Спосіб моделювання протекторної дії антибіотиків при гнійно-запальних процесах ротової порожнини експериментальних тварин на фоні впливу опіоїдного анальгетика
Номер патенту: 85762
Опубліковано: 25.11.2013
Автори: Онисько Роман Михайлович, Фік Володимир Богуславович, Кривко Юрій Ярославович, Федечко Йосип Михайлович, Пальтов Євгеній Володимирович
Формула / Реферат
Спосіб моделювання протекторної дії антибіотиків при гнійно-запальних процесах на фоні впливу опіоїдного анальгетика, що включає мікробіологічне дослідження, який відрізняється тим, що експериментальним тваринам водять антибіотик і проводять динамічне дослідження мікрофлори зубної бляшки та м'яких тканин ротової порожнини, яке включає мікроскопічне та бактеріологічне дослідження із застосуванням дискометричного методу визначення чутливості мікрофлори до антибіотиків.
Текст
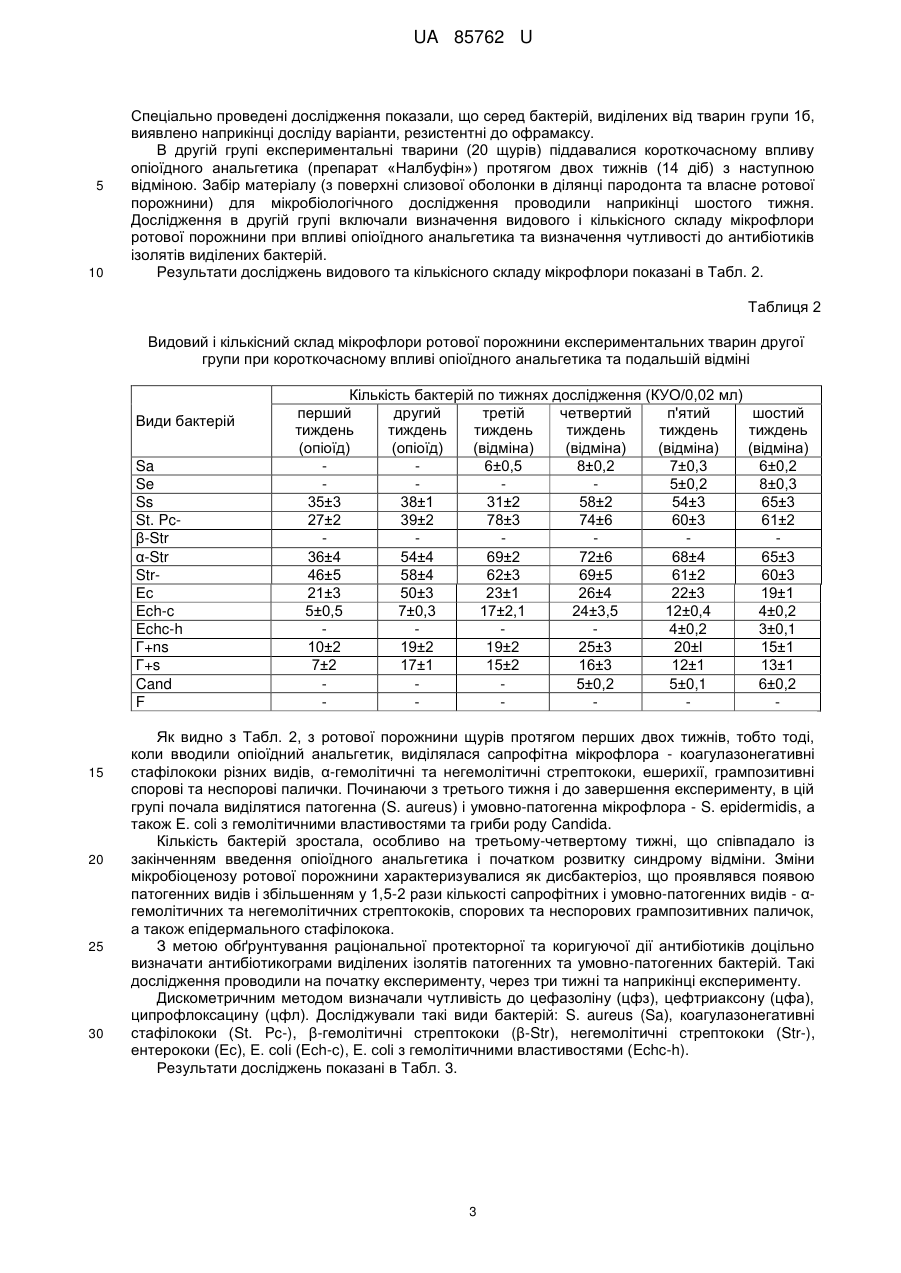
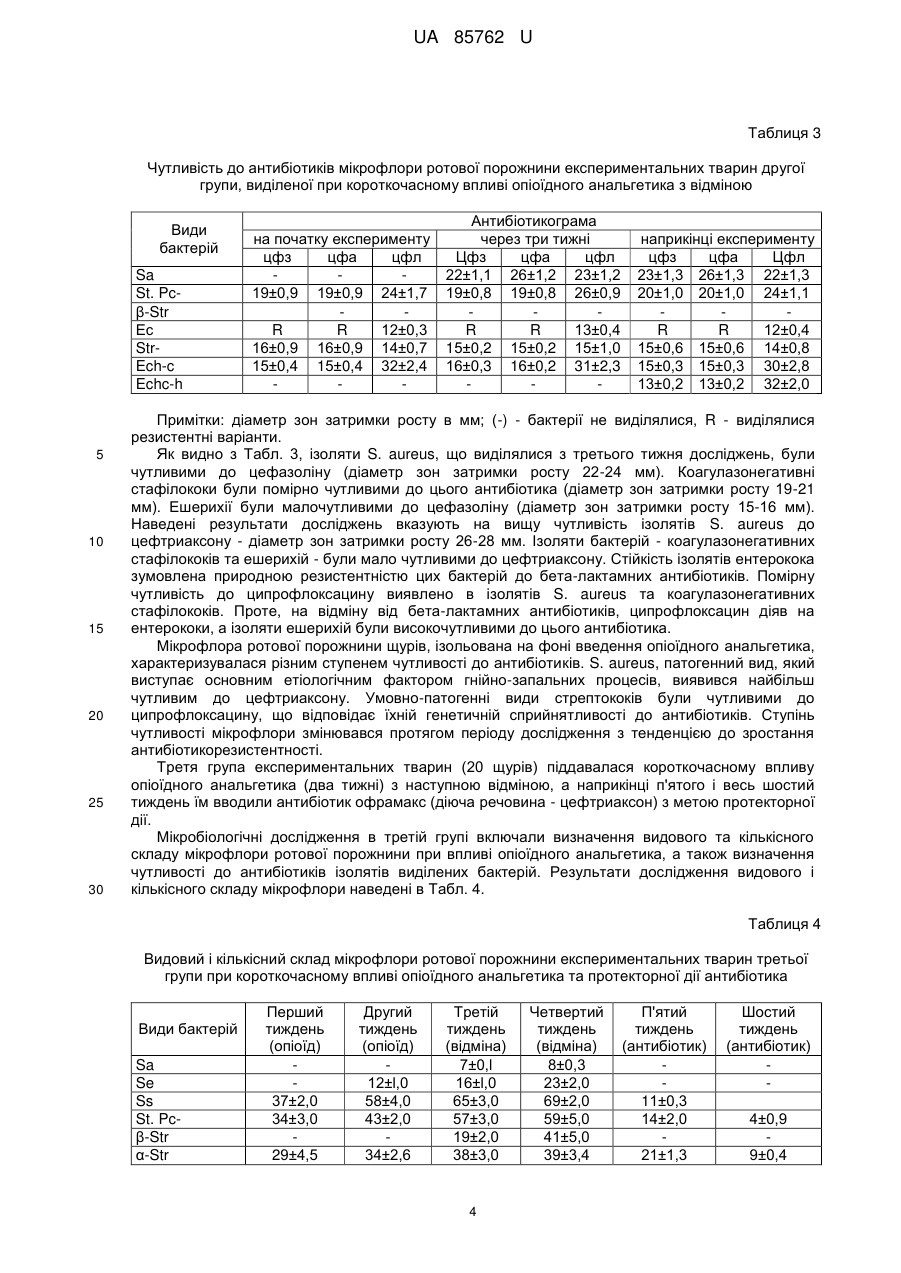
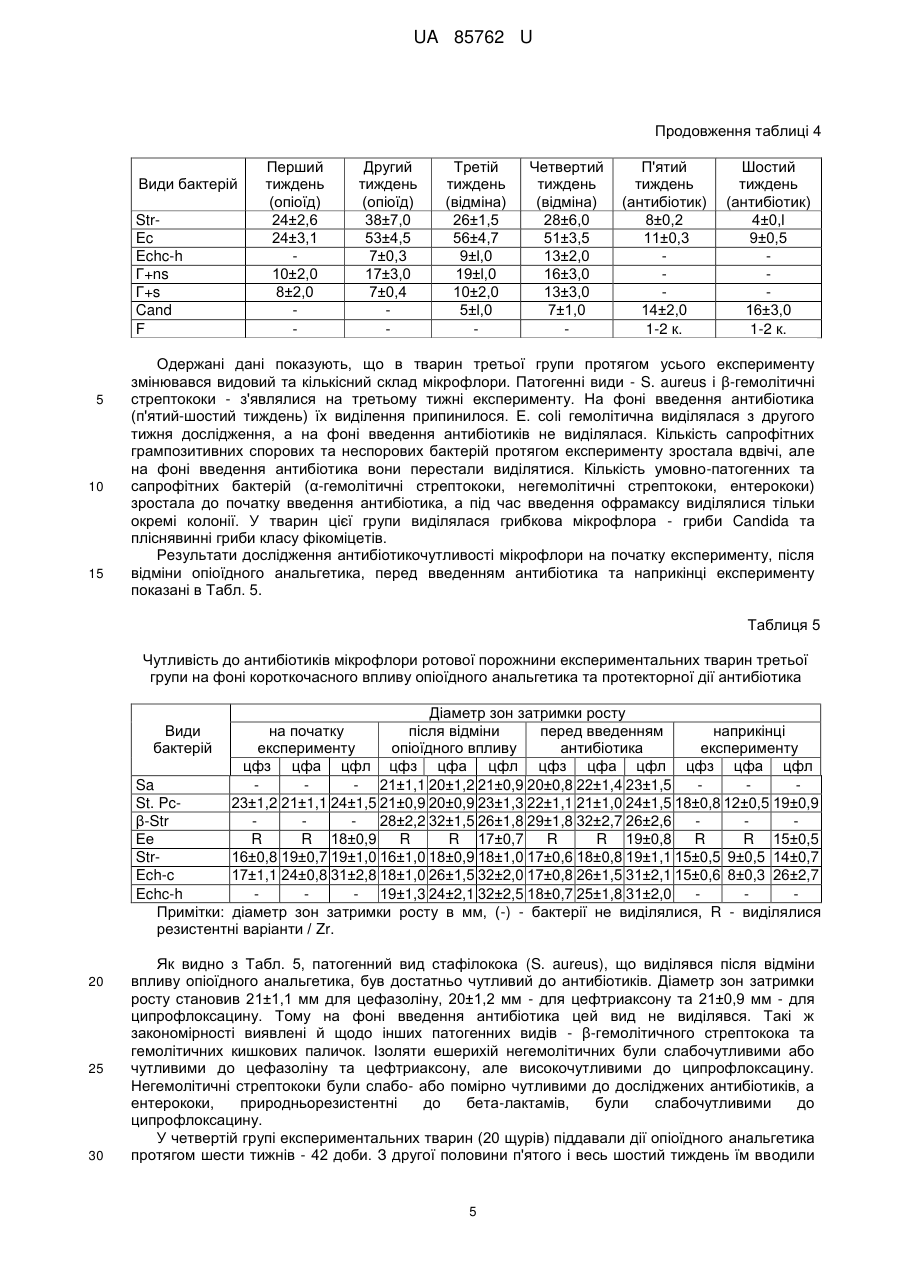
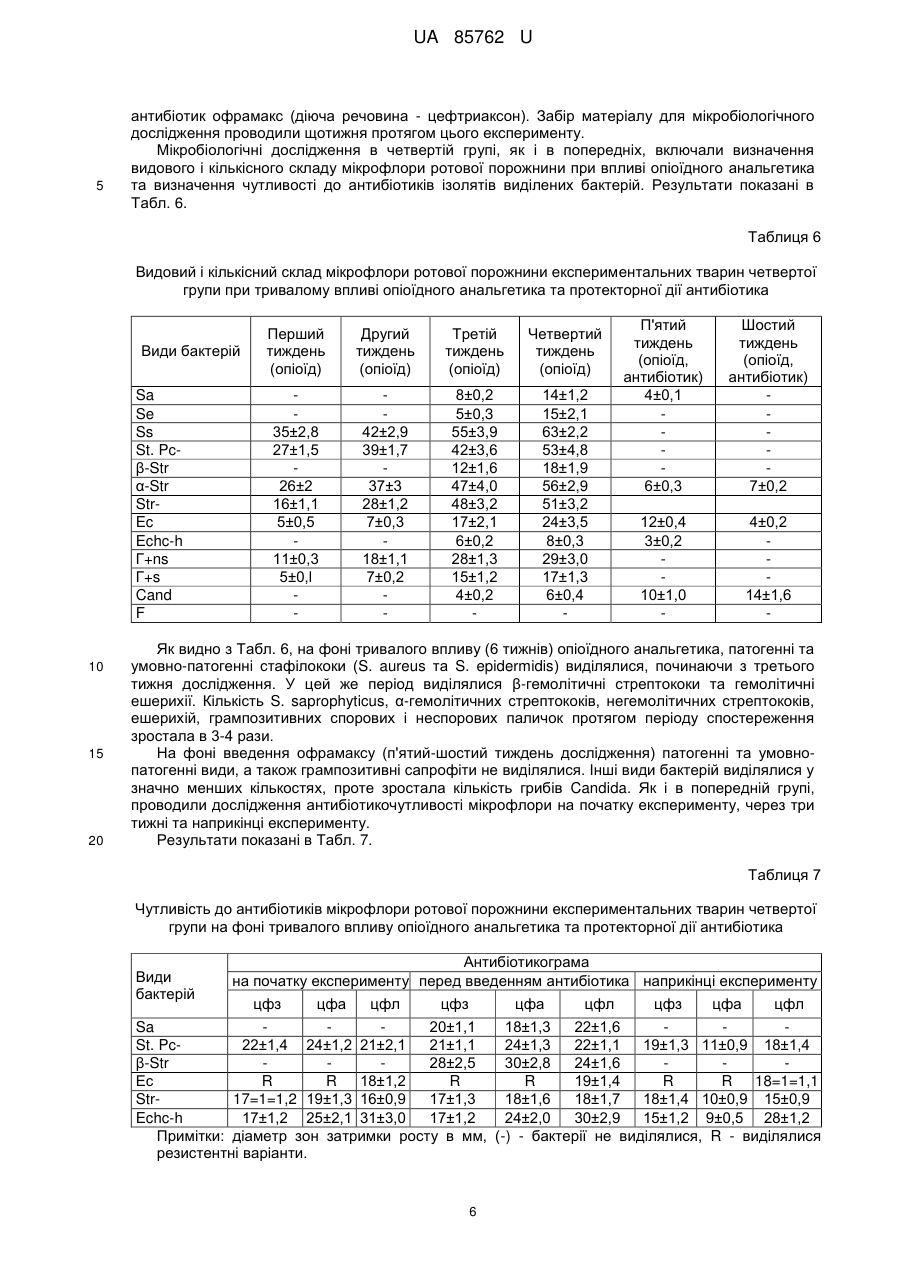
Реферат: Спосіб моделювання протекторної дії антибіотиків при гнійно-запальних процесах на фоні впливу опіоїдного анальгетика, що включає мікробіологічне дослідження, причому експериментальним тваринам водять антибіотик і проводять динамічне дослідження мікрофлори зубної бляшки та м'яких тканин ротової порожнини, яке включає мікроскопічне та бактеріологічне дослідження із застосуванням дискометричного методу визначення чутливості мікрофлори до антибіотиків. UA 85762 U (12) UA 85762 U UA 85762 U 5 10 15 20 25 30 35 40 45 50 55 Корисна модель стосується медицини, зокрема мікробіології та анатомії, і може бути використана при моделюванні коригуючого впливу антибіотикотерапії як протекторної дії при гнійно-запальних процесах, що розвинулися в результаті побічного впливу опіоїдного анальгетика. Відомий спосіб діагностики та лікування гострих гнійних захворювань м'яких тканин у хворих з дисоціальним типом поведінки, зокрема наркоманів, який полягає в комплексному підході дослідження інструментальними методами, мікробіологічного дослідження на фоні впливу опіоїдного анальгетика та визначення тактики лікування гнійно-запальних вогнищ м'яких тканин [Фурса А.А. Особенности диагностики и лечения острых гнойных заболеваний мягких тканей у больных с диссоциальным типом поведения: автореф. дис. канд. мед. наук: спец. 14.01.17 «Хирургия»/ А.А. Фурса. - Москва, 2011]. Таким способом досягається контроль за розвитком запальних процесів, гострих гнійних захворювань, зокрема у наркоманів, але він не дає можливості встановити особливості розвитку процесу в пародонті та ротовій порожнині в цілому, ідентифікувати мікрофлору в ротовій порожнині при дії опіоїдів у наркоманів, визначити оптимальну схему корекції за допомогою антибіотикотерапії та відповідно впливати на умовнопатогенну і патогенну мікрофлору, яка розвинулася в результаті дії опіоїдного анальгетика. В основу корисної моделі поставлено задачу створити спосіб моделювання протекторної дії антибіотиків, що буде базуватися на дослідженні мікрофлори ротової порожнини протягом дії опіоїдного анальгетика, який спричиняє розвиток гнійно-запальних процесів ротової порожнини, що дасть можливість коригувати мікробіоценоз і позитивно впливати на стан м'яких тканин пародонта. Поставлена задача вирішується тим, що у способі моделювання протекторної дії антибіотиків при гнійно-запальних процесах на фоні впливу опіоїдного анальгетика, що включає мікробіологічне дослідження, згідно з корисною моделлю, експериментальним тваринам вводять антибіотик і проводять динамічне дослідження мікрофлори зубної бляшки та м'яких тканин ротової порожнини, яке включає мікроскопічне та бактеріологічне дослідження із застосуванням дискометричного методу визначення чутливості мікрофлори до антибіотиків. Запропонований спосіб дає можливість виявити особливості видового та кількісного складу мікрофлори ротової порожнини при дії опіоїдного анальгетика і на основі визначення чутливості мікроорганізмів до антибіотиків здійснювати протекторно-коригуючий вплив на розвиток гнійнозапального процесу. Спосіб моделювання протекторної дії антибіотиків при гнійно-запальних процесах ротової порожнини експериментальних тварин на фоні впливу опіоїдного анальгетика здійснювали таким чином. Досліджували мікрофлору ротової порожнини експериментальних тварин (щурів) на фоні впливу опіоїдного анальгетика, наприклад препарату «Налбуфін», що супроводжувалося розвитком запальних процесів ротової порожнини, для корекції яких застосовували антибіотики, зокрема офрамакс (діюча речовина - цефтриаксон, виробник Ranbaxy, Індія). Дослідження проведено на білих статевозрілих щурах-самцях лінії "Wistar", масою 160 г, віком 3,5-7,5 місяців. Перед проведенням дослідів виконали огляд, зважування та маркування кожної тварини. Відібраних тварин утримували в окремій клітці на стандартному харчовому раціоні віварію. Проводили загальний огляд стану слизової оболонки в ділянці власне ротової порожнини та присінка рота. Слизова оболонка в цих ділянках та в ділянці ясен була помірно зволожена, блідо-рожевого забарвлення без явищ патологічного ураження. Експериментальні дослідження мікрофлори ротової порожнини щурів на антибіотикочутливість проводили до початку досліду та в динаміці протягом 6 тижнів, з взяттям матеріалу кожний тиждень на фоні впливу опіоїдного анальгетика (наприклад препарату «Налбуфін»). При цьому проводили мікробіологічні посіви на середовища та мікроскопічне дослідження мазків, забраних з поверхні ясен (на межі різців і вільної частини ясен) в ділянці пародонта верхньої та нижньої щелеп та слизової оболонки присінка рота і власне ротової порожнини. Матеріал забирали бактеріологічною петлею і поміщали в пробірки з цукровим бульйоном. Одночасно готували мазки для мікроскопічного дослідження. Посів матеріалу з пробірок проводили на ΜΠΑ, кров'яний агар, ЖСА, середовище Ендо та середовище Сабуро. Виділені ізоляти бактерій ідентифікували за комплексом морфо-тинкторіальних та біохімічних властивостей. Для кількісної характеристики мікрофлори проводили посів 0,02 мл матеріалу на диференціальні середовища (три проби одного матеріалу) і підраховували кількість колонієутворюючих одиниць (КУО) для кожного з виявлених видів. Антибіотикограми досліджували дискометричним методом із застосуванням стандартних середовищ. 1 UA 85762 U 5 10 15 20 25 При дослідженні видового складу виявлялися такі види: S. aureus (Sa), S. epidermidis (Se), S. saprophyticus (Ss), коагулазонегативні стафілококи інших видів (St. Pc-), β-гемолітичні стрептококи (β-Str), α-гемолітичні стрептококи (α-Str), негемолітичні стрептококи (Str-), ентерококи (Ес), Echerichia coli (Ech-c), Echerichia coli з гемолітичними властивостями (Echc-h), грампозитивні неспорові бактерії (Γ+ns), грампозитивні спорові бактерії (Γ+s), гриби Candida (Cand), фікоміцети (F). Мікробіологічні дослідження проводили щотижня в чотирьох групах тварин протягом 6-ти тижнів. Перша група тварин (контрольна) розділена на дві підгрупи: 1а - тварини не одержували опіоїдний анальгетик та антибіотики; 1б - тварини одержували антибіотик протягом перших двох тижнів. Друга група: опіоїдний анальгетик тварини одержували два тижні, далі - відміна, забір матеріалу - наприкінці шостого тижня. Третя група: опіоїдний анальгетик тварини одержували два тижні, далі - відміна, п'ятийшостий тиждень - тварини одержували антибіотик, забір матеріалу - наприкінці шостого тижня. Четверта група: опіоїдний анальгетик тварини одержували шість тижнів, п'ятий-шостий тиждень - тварини одержували антибіотик, забір матеріалу - наприкінці шостого тижня. У першій групі тварин (контрольній) експериментальні тварини (20 щурів) були розділені на дві підгрупи. Контрольну групу 1а становили піддослідні тварини, яких не піддавали дії опіоїдного анальгетика. Спостереження за цією групою вели протягом усього періоду експерименту - шість тижнів. Матеріал для мікробіологічного дослідження забирали перед початком досліду, через три тижні та в останній день спостереження. Контрольну групу 1б становили тварини, яким протягом перших двох тижнів вводили офрамакс. Мікробіологічні дослідження у цій групі проводили до введення офрамаксу, в останній день введення антибіотика та наприкінці періоду спостереження - шостий тиждень. Результати досліджень показані в Табл. 1. Таблиця 1 Видовий та кількісний склад мікрофлори ротової порожнини експериментальних тварин першої групи Види бактерій Sa Se Ss St. Pcβ-Str α-Str StrEc Ech-c Echc-h Г+ns Г+s Cand F 30 35 на початку досліду 27±2 34±3 36±24 49±5 21±2 21±3 12±0,9 7±0,5 Підгрупа 1a на третьому тижні 29±3 30±2 32±4 52±6 24±1,7 50±3 14±2 7±0,6 наприкінці досліду 32±3 33±4 35±3 48±4 23±1,8 23±1 12±1,0 9±0,8 на початку досліду 34±2 29±2 37±5 47±5 23±3 26±4 14±1,9 8±0,7 Підгрупа 1б через два тижні 12±0,9 21±2 22±3 4±0,2 наприкінці досліду 15±2 17±3 26±4 31±3 15±1 6±0,3 Як видно з даних, наведених у Табл. 1, у тварин контрольної групи 1а виділялася сапрофітна мікрофлора у помірних кількостях. Протягом періоду спостереження видовий та кількісний склад мікрофлори істотно не змінювався. У тварин контрольної групи 1б, які одержували офрамакс, перед введенням антибіотика видовий та кількісний склад мікрофлори ротової порожнини не відрізнявся від контрольної групи 1а. Після введення антибіотика відмічено виражені зміни видового та кількісного складу мікрофлори - не виділялися стафілококи, грампозитивні спорові та неспорові палички. Основний склад мікрофлори становили α-гемолітичні та негемолітичні стрептококи та гриби Candida, тобто мікроорганізми природнорезистентні до офрамаксу. Наприкінці експерименту видовий склад мікрофлори відновлювався, проте всі основні види виділялися у меншій кількості. 2 UA 85762 U 5 10 Спеціально проведені дослідження показали, що серед бактерій, виділених від тварин групи 1б, виявлено наприкінці досліду варіанти, резистентні до офрамаксу. В другій групі експериментальні тварини (20 щурів) піддавалися короткочасному впливу опіоїдного анальгетика (препарат «Налбуфін») протягом двох тижнів (14 діб) з наступною відміною. Забір матеріалу (з поверхні слизової оболонки в ділянці пародонта та власне ротової порожнини) для мікробіологічного дослідження проводили наприкінці шостого тижня. Дослідження в другій групі включали визначення видового і кількісного складу мікрофлори ротової порожнини при впливі опіоїдного анальгетика та визначення чутливості до антибіотиків ізолятів виділених бактерій. Результати досліджень видового та кількісного складу мікрофлори показані в Табл. 2. Таблиця 2 Видовий і кількісний склад мікрофлори ротової порожнини експериментальних тварин другої групи при короткочасному впливі опіоїдного анальгетика та подальшій відміні Види бактерій Sa Se Ss St. Pcβ-Str α-Str StrЕс Ech-c Echc-h Γ+ns Γ+s Cand F 15 20 25 30 Кількість бактерій по тижнях дослідження (КУО/0,02 мл) перший другий третій четвертий п'ятий шостий тиждень тиждень тиждень тиждень тиждень тиждень (опіоїд) (опіоїд) (відміна) (відміна) (відміна) (відміна) 6±0,5 8±0,2 7±0,3 6±0,2 5±0,2 8±0,3 35±3 38±1 31±2 58±2 54±3 65±3 27±2 39±2 78±3 74±6 60±3 61±2 36±4 54±4 69±2 72±6 68±4 65±3 46±5 58±4 62±3 69±5 61±2 60±3 21±3 50±3 23±1 26±4 22±3 19±1 5±0,5 7±0,3 17±2,1 24±3,5 12±0,4 4±0,2 4±0,2 3±0,1 10±2 19±2 19±2 25±3 20±l 15±1 7±2 17±1 15±2 16±3 12±1 13±1 5±0,2 5±0,1 6±0,2 Як видно з Табл. 2, з ротової порожнини щурів протягом перших двох тижнів, тобто тоді, коли вводили опіоїдний анальгетик, виділялася сапрофітна мікрофлора - коагулазонегативні стафілококи різних видів, α-гемолітичні та негемолітичні стрептококи, ешерихії, грампозитивні спорові та неспорові палички. Починаючи з третього тижня і до завершення експерименту, в цій групі почала виділятися патогенна (S. aureus) і умовно-патогенна мікрофлора - S. epidermidis, а також Е. соlі з гемолітичними властивостями та гриби роду Candida. Кількість бактерій зростала, особливо на третьому-четвертому тижні, що співпадало із закінченням введення опіоїдного анальгетика і початком розвитку синдрому відміни. Зміни мікробіоценозу ротової порожнини характеризувалися як дисбактеріоз, що проявлявся появою патогенних видів і збільшенням у 1,5-2 рази кількості сапрофітних і умовно-патогенних видів - αгемолітичних та негемолітичних стрептококів, спорових та неспорових грампозитивних паличок, а також епідермального стафілокока. З метою обґрунтування раціональної протекторної та коригуючої дії антибіотиків доцільно визначати антибіотикограми виділених ізолятів патогенних та умовно-патогенних бактерій. Такі дослідження проводили на початку експерименту, через три тижні та наприкінці експерименту. Дискометричним методом визначали чутливість до цефазоліну (цфз), цефтриаксону (цфа), ципрофлоксацину (цфл). Досліджували такі види бактерій: S. aureus (Sa), коагулазонегативні стафілококи (St. Pc-), β-гемолітичні стрептококи (β-Str), негемолітичні стрептококи (Str-), ентерококи (Ес), Е. соlі (Ech-c), Ε. соlі з гемолітичними властивостями (Echc-h). Результати досліджень показані в Табл. 3. 3 UA 85762 U Таблиця 3 Чутливість до антибіотиків мікрофлори ротової порожнини експериментальних тварин другої групи, виділеної при короткочасному впливі опіоїдного анальгетика з відміною Види бактерій Sa St. Pcβ-Str Ес StrEch-c Echc-h 5 10 15 20 25 30 на початку експерименту цфз цфа цфл 19±0,9 19±0,9 24±1,7 R R 12±0,3 16±0,9 16±0,9 14±0,7 15±0,4 15±0,4 32±2,4 Антибіотикограма через три тижні Цфз цфа цфл 22±1,1 26±1,2 23±1,2 19±0,8 19±0,8 26±0,9 R R 13±0,4 15±0,2 15±0,2 15±1,0 16±0,3 16±0,2 31±2,3 наприкінці експерименту цфз цфа Цфл 23±1,3 26±1,3 22±1,3 20±1,0 20±1,0 24±1,1 R R 12±0,4 15±0,6 15±0,6 14±0,8 15±0,3 15±0,3 30±2,8 13±0,2 13±0,2 32±2,0 Примітки: діаметр зон затримки росту в мм; (-) - бактерії не виділялися, R - виділялися резистентні варіанти. Як видно з Табл. 3, ізоляти S. aureus, що виділялися з третього тижня досліджень, були чутливими до цефазоліну (діаметр зон затримки росту 22-24 мм). Коагулазонегативні стафілококи були помірно чутливими до цього антибіотика (діаметр зон затримки росту 19-21 мм). Ешерихії були малочутливими до цефазоліну (діаметр зон затримки росту 15-16 мм). Наведені результати досліджень вказують на вищу чутливість ізолятів S. aureus до цефтриаксону - діаметр зон затримки росту 26-28 мм. Ізоляти бактерій - коагулазонегативних стафілококів та ешерихій - були мало чутливими до цефтриаксону. Стійкість ізолятів ентерокока зумовлена природною резистентністю цих бактерій до бета-лактамних антибіотиків. Помірну чутливість до ципрофлоксацину виявлено в ізолятів S. aureus та коагулазонегативних стафілококів. Проте, на відміну від бета-лактамних антибіотиків, ципрофлоксацин діяв на ентерококи, а ізоляти ешерихій були високочутливими до цього антибіотика. Мікрофлора ротової порожнини щурів, ізольована на фоні введення опіоїдного анальгетика, характеризувалася різним ступенем чутливості до антибіотиків. S. aureus, патогенний вид, який виступає основним етіологічним фактором гнійно-запальних процесів, виявився найбільш чутливим до цефтриаксону. Умовно-патогенні види стрептококів були чутливими до ципрофлоксацину, що відповідає їхній генетичній сприйнятливості до антибіотиків. Ступінь чутливості мікрофлори змінювався протягом періоду дослідження з тенденцією до зростання антибіотикорезистентності. Третя група експериментальних тварин (20 щурів) піддавалася короткочасному впливу опіоїдного анальгетика (два тижні) з наступною відміною, а наприкінці п'ятого і весь шостий тиждень їм вводили антибіотик офрамакс (діюча речовина - цефтриаксон) з метою протекторної дії. Мікробіологічні дослідження в третій групі включали визначення видового та кількісного складу мікрофлори ротової порожнини при впливі опіоїдного анальгетика, а також визначення чутливості до антибіотиків ізолятів виділених бактерій. Результати дослідження видового і кількісного складу мікрофлори наведені в Табл. 4. Таблиця 4 Видовий і кількісний склад мікрофлори ротової порожнини експериментальних тварин третьої групи при короткочасному впливі опіоїдного анальгетика та протекторної дії антибіотика Види бактерій Sa Se Ss St. Pcβ-Str α-Str Перший тиждень (опіоїд) 37±2,0 34±3,0 29±4,5 Другий тиждень (опіоїд) 12±l,0 58±4,0 43±2,0 34±2,6 Третій тиждень (відміна) 7±0,l 16±l,0 65±3,0 57±3,0 19±2,0 38±3,0 4 Четвертий тиждень (відміна) 8±0,3 23±2,0 69±2,0 59±5,0 41±5,0 39±3,4 П'ятий тиждень (антибіотик) 11±0,3 14±2,0 21±1,3 Шостий тиждень (антибіотик) 4±0,9 9±0,4 UA 85762 U Продовження таблиці 4 Види бактерій StrEc Echc-h Γ+ns Γ+s Cand F 5 10 15 Перший тиждень (опіоїд) 24±2,6 24±3,1 10±2,0 8±2,0 Другий тиждень (опіоїд) 38±7,0 53±4,5 7±0,3 17±3,0 7±0,4 Третій тиждень (відміна) 26±1,5 56±4,7 9±l,0 19±l,0 10±2,0 5±l,0 Четвертий тиждень (відміна) 28±6,0 51±3,5 13±2,0 16±3,0 13±3,0 7±1,0 П'ятий тиждень (антибіотик) 8±0,2 11±0,3 14±2,0 1-2 к. Шостий тиждень (антибіотик) 4±0,l 9±0,5 16±3,0 1-2 к. Одержані дані показують, що в тварин третьої групи протягом усього експерименту змінювався видовий та кількісний склад мікрофлори. Патогенні види - S. aureus і β-гемолітичні стрептококи - з'являлися на третьому тижні експерименту. На фоні введення антибіотика (п'ятий-шостий тиждень) їх виділення припинилося. Е. соlі гемолітична виділялася з другого тижня дослідження, а на фоні введення антибіотиків не виділялася. Кількість сапрофітних грампозитивних спорових та неспорових бактерій протягом експерименту зростала вдвічі, але на фоні введення антибіотика вони перестали виділятися. Кількість умовно-патогенних та сапрофітних бактерій (α-гемолітичні стрептококи, негемолітичні стрептококи, ентерококи) зростала до початку введення антибіотика, а під час введення офрамаксу виділялися тільки окремі колонії. У тварин цієї групи виділялася грибкова мікрофлора - гриби Candida та пліснявинні гриби класу фікоміцетів. Результати дослідження антибіотикочутливості мікрофлори на початку експерименту, після відміни опіоїдного анальгетика, перед введенням антибіотика та наприкінці експерименту показані в Табл. 5. Таблиця 5 Чутливість до антибіотиків мікрофлори ротової порожнини експериментальних тварин третьої групи на фоні короткочасного впливу опіоїдного анальгетика та протекторної дії антибіотика Діаметр зон затримки росту на початку після відміни перед введенням наприкінці експерименту опіоїдного впливу антибіотика експерименту цфз цфа цфл цфз цфа цфл цфз цфа цфл цфз цфа цфл Sa - 21±1,1 20±1,2 21±0,9 20±0,8 22±1,4 23±1,5 St. Pc23±1,2 21±1,1 24±1,5 21±0,9 20±0,9 23±1,3 22±1,1 21±1,0 24±1,5 18±0,8 12±0,5 19±0,9 β-Str 28±2,2 32±1,5 26±1,8 29±1,8 32±2,7 26±2,6 Ее R R 18±0,9 R R 17±0,7 R R 19±0,8 R R 15±0,5 Str16±0,8 19±0,7 19±1,0 16±1,0 18±0,9 18±1,0 17±0,6 18±0,8 19±1,1 15±0,5 9±0,5 14±0,7 Ech-c 17±1,1 24±0,8 31±2,8 18±1,0 26±1,5 32±2,0 17±0,8 26±1,5 31±2,1 15±0,6 8±0,3 26±2,7 Echc-h - 19±1,3 24±2,1 32±2,5 18±0,7 25±1,8 31±2,0 Примітки: діаметр зон затримки росту в мм, (-) - бактерії не виділялися, R - виділялися резистентні варіанти / Zr. Види бактерій 20 25 30 Як видно з Табл. 5, патогенний вид стафілокока (S. aureus), що виділявся після відміни впливу опіоїдного анальгетика, був достатньо чутливий до антибіотиків. Діаметр зон затримки росту становив 21±1,1 мм для цефазоліну, 20±1,2 мм - для цефтриаксону та 21±0,9 мм - для ципрофлоксацину. Тому на фоні введення антибіотика цей вид не виділявся. Такі ж закономірності виявлені й щодо інших патогенних видів - β-гемолітичного стрептокока та гемолітичних кишкових паличок. Ізоляти ешерихій негемолітичних були слабочутливими або чутливими до цефазоліну та цефтриаксону, але високочутливими до ципрофлоксацину. Негемолітичні стрептококи були слабо- або помірно чутливими до досліджених антибіотиків, а ентерококи, природньорезистентні до бета-лактамів, були слабочутливими до ципрофлоксацину. У четвертій групі експериментальних тварин (20 щурів) піддавали дії опіоїдного анальгетика протягом шести тижнів - 42 доби. З другої половини п'ятого і весь шостий тиждень їм вводили 5 UA 85762 U 5 антибіотик офрамакс (діюча речовина - цефтриаксон). Забір матеріалу для мікробіологічного дослідження проводили щотижня протягом цього експерименту. Мікробіологічні дослідження в четвертій групі, як і в попередніх, включали визначення видового і кількісного складу мікрофлори ротової порожнини при впливі опіоїдного анальгетика та визначення чутливості до антибіотиків ізолятів виділених бактерій. Результати показані в Табл. 6. Таблиця 6 Видовий і кількісний склад мікрофлори ротової порожнини експериментальних тварин четвертої групи при тривалому впливі опіоїдного анальгетика та протекторної дії антибіотика Sa Se Ss St. Pcβ-Str α-Str StrEc Echc-h Г+ns Г+s Cand F 10 15 20 Другий тиждень (опіоїд) Третій тиждень (опіоїд) Четвертий тиждень (опіоїд) 35±2,8 27±1,5 26±2 16±1,1 5±0,5 11±0,3 5±0,l Види бактерій Перший тиждень (опіоїд) 42±2,9 39±1,7 37±3 28±1,2 7±0,3 18±1,1 7±0,2 8±0,2 5±0,3 55±3,9 42±3,6 12±1,6 47±4,0 48±3,2 17±2,1 6±0,2 28±1,3 15±1,2 4±0,2 14±1,2 15±2,1 63±2,2 53±4,8 18±1,9 56±2,9 51±3,2 24±3,5 8±0,3 29±3,0 17±1,3 6±0,4 П'ятий тиждень (опіоїд, антибіотик) 4±0,1 6±0,3 Шостий тиждень (опіоїд, антибіотик) 7±0,2 12±0,4 3±0,2 10±1,0 4±0,2 14±1,6 Як видно з Табл. 6, на фоні тривалого впливу (6 тижнів) опіоїдного анальгетика, патогенні та умовно-патогенні стафілококи (S. aureus та S. epidermidis) виділялися, починаючи з третього тижня дослідження. У цей же період виділялися β-гемолітичні стрептококи та гемолітичні ешерихії. Кількість S. saprophyticus, α-гемолітичних стрептококів, негемолітичних стрептококів, ешерихій, грампозитивних спорових і неспорових паличок протягом періоду спостереження зростала в 3-4 рази. На фоні введення офрамаксу (п'ятий-шостий тиждень дослідження) патогенні та умовнопатогенні види, а також грампозитивні сапрофіти не виділялися. Інші види бактерій виділялися у значно менших кількостях, проте зростала кількість грибів Candida. Як і в попередній групі, проводили дослідження антибіотикочутливості мікрофлори на початку експерименту, через три тижні та наприкінці експерименту. Результати показані в Табл. 7. Таблиця 7 Чутливість до антибіотиків мікрофлори ротової порожнини експериментальних тварин четвертої групи на фоні тривалого впливу опіоїдного анальгетика та протекторної дії антибіотика Види бактерій Антибіотикограма на початку експерименту перед введенням антибіотика наприкінці експерименту цфз цфа цфл цфз цфа цфл цфз цфа цфл Sa 20±1,1 18±1,3 22±1,6 St. Pc22±1,4 24±1,2 21±2,1 21±1,1 24±1,3 22±1,1 19±1,3 11±0,9 18±1,4 β-Str 28±2,5 30±2,8 24±1,6 Ес R R 18±1,2 R R 19±1,4 R R 18=1=1,1 Str17=1=1,2 19±1,3 16±0,9 17±1,3 18±1,6 18±1,7 18±1,4 10±0,9 15±0,9 Echc-h 17±1,2 25±2,1 31±3,0 17±1,2 24±2,0 30±2,9 15±1,2 9±0,5 28±1,2 Примітки: діаметр зон затримки росту в мм, (-) - бактерії не виділялися, R - виділялися резистентні варіанти. 6 UA 85762 U 5 10 15 20 25 Як показують результати, наведені в Табл. 7, резистентна умовно-патогенна мікрофлора ротової порожнини щурів (ентерококи, негемолітичні стрептококи, ешерихії з гемолітичними властивостями), які виділялися на фоні введення антибіотика, були резистентні або слабочутливі до нього. Одночасно дещо знижувалася чутливість ізолятів бактерій до антибіотиків, які не вводилися тваринам (цефазолін, ципрофлоксацин). Це може вказувати на формування множинної резистентності до антибіотиків тих бактерій, що заселяють ротову порожнину щурів на фоні опіоїдного впливу. Патогенна мікрофлора, що з'являлася на фоні введення опіоїдного анальгетика, була чутлива до антибіотиків, включаючи офромакс (діюча речовина - цефтриаксон). Унаслідок дії цефтриаксону наприкінці досліду ця мікрофлора не виділялася. Умовно-патогенна мікрофлора, що виділялася протягом усього періоду експерименту, була чутлива до ципрофлоксацину. Одночасно підвищувалася стійкість мікрофлори до антибіотиків, які не вводилися тваринам, що може вказувати на формування множинної резистентності. Отже, корекція гнійно-запальних процесів, які розвиваються на фоні тривалого впливу опіоїдного анальгетика, повинна враховувати зміни видового складу та ступеня чутливості бактерій до антибіотиків, яка змінюється у процесі їхнього застосування. Результати дослідження мікрофлори ротової порожнини експериментальних тварин (щурів) показують, що на фоні введення опіоїдного анальгетика з'являються патогенні види бактерій, які можна вважати етіологічними факторами розвитку гнійно-запальних процесів. Одночасно зростає кількість умовно-патогенних та сапрофітних бактерій. Ці зміни особливо проявляються при тривалому введенні опіоїдного анальгетика. При введенні антибіотика офрамакс (діюча речовина - цефтриаксон) патогенні види перестають виділятися, а кількість інших бактерій істотно зменшується. Виділені види бактерій були чутливими до антибіотиків (цефтриаксон, цефазолін, ципрофлоксацин), за винятком природнорезистентних видів, але відмічена тенденція до наростання антибіотикорезистентності. ФОРМУЛА КОРИСНОЇ МОДЕЛІ 30 35 Спосіб моделювання протекторної дії антибіотиків при гнійно-запальних процесах на фоні впливу опіоїдного анальгетика, що включає мікробіологічне дослідження, який відрізняється тим, що експериментальним тваринам водять антибіотик і проводять динамічне дослідження мікрофлори зубної бляшки та м'яких тканин ротової порожнини, яке включає мікроскопічне та бактеріологічне дослідження із застосуванням дискометричного методу визначення чутливості мікрофлори до антибіотиків. Комп’ютерна верстка М. Мацело Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 7
ДивитисяДодаткова інформація
Автори англійськоюFIK VOLODYMYR BOHUSLAVOVYCH, Phedechko Yosyp Mykhailovych, Onysko Roman Mykhailovych
Автори російськоюФИК ВЛАДИМИР БОГУСЛАВОВИЧ, Федечко Йосип Михайлович, Онисько Роман Михайлович
МПК / Мітки
МПК: G09B 23/28, G01N 33/48
Мітки: експериментальних, анальгетика, спосіб, дії, гнійно-запальних, фоні, моделювання, опіоїдного, протекторної, тварин, порожнини, впливу, антибіотиків, процесах, ротової
Код посилання
<a href="https://ua.patents.su/9-85762-sposib-modelyuvannya-protektorno-di-antibiotikiv-pri-gnijjno-zapalnikh-procesakh-rotovo-porozhnini-eksperimentalnikh-tvarin-na-foni-vplivu-opiodnogo-analgetika.html" target="_blank" rel="follow" title="База патентів України">Спосіб моделювання протекторної дії антибіотиків при гнійно-запальних процесах ротової порожнини експериментальних тварин на фоні впливу опіоїдного анальгетика</a>
Попередній патент: Спосіб отримання органічного добрива
Наступний патент: Спосіб керування електродвигуном механізму підйому вантажу мостового крана
Випадковий патент: Композиція для підвищення вогнестійкості конструкцій