Тверда фармацевтична лікарська форма для перорального введення з швидким вивільненням інгібітора фактора ха згортання крові
Формула / Реферат
1. Тверда фармацевтична лікарська форма для перорального введення, що містить 5-хлор-N-({(5S)-2-оксо-3-[4-(3-оксо-4-морфолініл)феніл]-1,3-оксазолідин-5-іл}-метил)-2-тіофенкарбоксамід (І) та характеризується швидким вивільненням, яка відрізняється тим, що
(a) вона містить активну речовину (І) в аморфній формі або в термодинамічно метастабільній кристалічній модифікації та
(b) 80 % активної речовини (І) вивільнюються протягом менш ніж 2 годин відповідно до методу вивільнення згідно з Фармакопеєю США, що визначають пристроєм 2 (лопатка).
2. Фармацевтична лікарська форма за пунктом 1, яка відрізняється тим, що 80 % активної речовини (І) вивільнюються протягом максимум 1 години відповідно до методу вивільнення згідно з Фармакопеєю США, що визначають пристроєм 2 (лопатка).
3. Фармацевтична лікарська форма за пунктом 1, яка відрізняється тим, що при дослідженні вивільнення in vitro в умовах недостатнього розведення ця лікарська форма характеризується перенасиченням у порівнянні з мікронізованою активною речовиною (І) в термодинамічно стабільній кристалічній модифікації І.
4. Фармацевтична лікарська форма за пунктом 3, яка відрізняється тим, що при дослідженні вивільнення in vitro відповідно до методу вивільнення згідно з Фармакопеєю США за допомогою пристрою 2 (лопатка) в умовах недостатнього розведення ця лікарська форма в 900 мл ацетатного буферного розчину при значенні рН 4,5 без додавання поверхнево-активної речовини при швидкості обертання мішалки 75 об./хв. протягом однієї години при загальній кількості досліджуваної активної речовини (І) 20 мг вивільнює щонайменше в 1,5 рази більшу кількість активної речовини (І) у порівнянні з 20 мг мікронізованої активної речовини (І) в термодинамічно стабільній кристалічній модифікації І.
5. Фармацевтична лікарська форма за пунктом 1, яка відрізняється тим, що активну речовину (І) аморфізують методом розчинення або переводять у термодинамічно метастабільну кристалічну модифікацію.
6. Фармацевтична лікарська форма за пунктом 5, яка відрізняється тим, що як розчинник використовують оцтову кислоту, а також додають одну або кілька придатних допоміжних речовин, переважно полівінілпіролідон, причому активна речовина (І) входить до складу одержаної розчиненням суміші у концентрації від 0,1 до 30 %.
7. Фармацевтична лікарська форма за пунктом 1, яка відрізняється тим, що активну речовину (І) аморфізують розплавленням або переводять у термодинамічно метастабільну кристалічну модифікацію.
8. Фармацевтична лікарська форма за пунктом 7, яка відрізняється тим, що при здійсненні розплавлення використовують одну або кілька придатних допоміжних речовин, переважно поліетиленгліколь, причому активна речовина (І) входить до складу одержаної розплавленням суміші у концентрації від 0,1 до 30 %.
9. Фармацевтична лікарська форма за пунктом 1, яка відрізняється тим, що активну речовину (І) аморфізують екструдуванням розплаву або переводять у термодинамічно метастабільну кристалічну модифікацію.
10. Фармацевтична лікарська форма за пунктом 9, яка відрізняється тим, що як полімер при екструдуванні розплаву використовують гідроксипропілцелюлозу (ГПЦ) або полівінілпіролідон (ПВП), причому вміст полімеру в екструдаті становить щонайменше 40 %, а активна речовина (І) входить до складу екструдату у концентрації від 0,1 до 20 %.
11. Фармацевтична лікарська форма за одним із пунктів 9 або 10, яка відрізняється тим, що як пластифікатор для полімеру та/або з метою зниження температури плавлення активної речовини (І) додають щонайменше одну фармацевтично прийнятну речовину у концентрації від 0,2 до 40 %.
12. Фармацевтична лікарська форма за пунктом 11, яка відрізняється тим, що фармацевтично прийнятною добавкою є цукровий спирт.
13. Фармацевтична лікарська форма за одним із пунктів 1-12, що існує у багаточастинковій формі.
14. Фармацевтична лікарська форма за пунктом 13, яка відрізняється тим, що діаметр частинок становить від 0,5 до 3,0 мм.
Текст
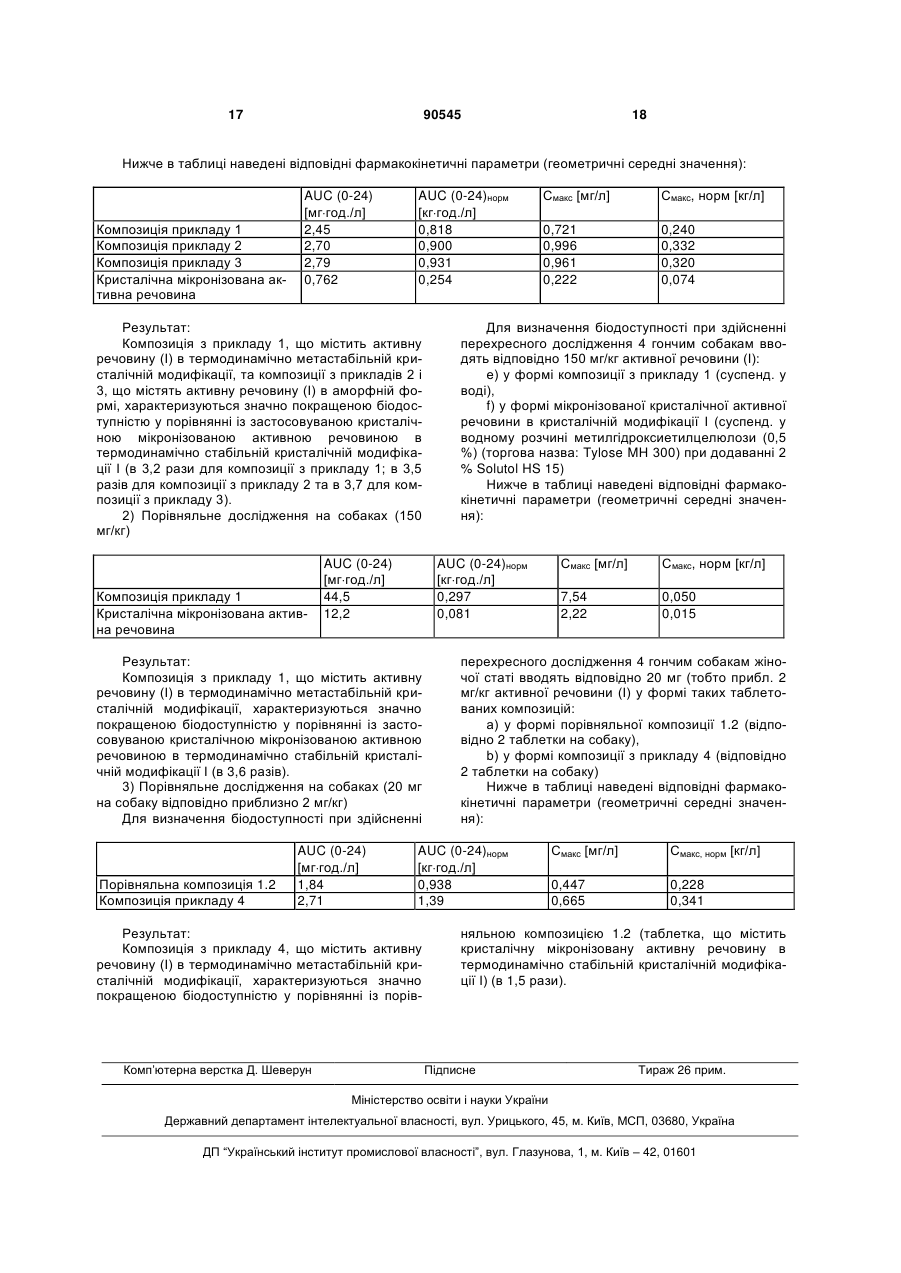
1. Тверда фармацевтична лікарська форма для перорального введення, що містить 5-хлор-N({(5S)-2-оксо-3-[4-(3-оксо-4-морфолініл)феніл]-1,3оксазолідин-5-іл}-метил)-2-тіофенкарбоксамід (І) та характеризується швидким вивільненням, яка відрізняється тим, що (a) вона містить активну речовину (І) в аморфній формі або в термодинамічно метастабільній кристалічній модифікації та (b) 80 % активної речовини (І) вивільнюються протягом менш ніж 2 годин відповідно до методу вивільнення згідно з Фармакопеєю США, що визначають пристроєм 2 (лопатка). 2. Фармацевтична лікарська форма за пунктом 1, яка відрізняється тим, що 80 % активної речовини (І) вивільнюються протягом максимум 1 години відповідно до методу вивільнення згідно з Фармакопеєю США, що визначають пристроєм 2 (лопатка). 3. Фармацевтична лікарська форма за пунктом 1, яка відрізняється тим, що при дослідженні вивільнення in vitro в умовах недостатнього розведення ця лікарська форма характеризується перенасиченням у порівнянні з мікронізованою активною речовиною (І) в термодинамічно стабільній кристалічній модифікації І. 4. Фармацевтична лікарська форма за пунктом 3, яка відрізняється тим, що при дослідженні вивільнення in vitro відповідно до методу вивільнення згідно з Фармакопеєю США за допомогою при 2 (19) 1 3 90545 4 целюлозу (ГПЦ) або полівінілпіролідон (ПВП), причому вміст полімеру в екструдаті становить щонайменше 40 %, а активна речовина (І) входить до складу екструдату у концентрації від 0,1 до 20 %. 11. Фармацевтична лікарська форма за одним із пунктів 9 або 10, яка відрізняється тим, що як пластифікатор для полімеру та/або з метою зниження температури плавлення активної речовини (І) додають щонайменше одну фармацевтично прийнятну речовину у концентрації від 0,2 до 40 %. 12. Фармацевтична лікарська форма за пунктом 11, яка відрізняється тим, що фармацевтично прийнятною добавкою є цукровий спирт. 13. Фармацевтична лікарська форма за одним із пунктів 1-12, що існує у багаточастинковій формі. 14. Фармацевтична лікарська форма за пунктом 13, яка відрізняється тим, що діаметр частинок становить від 0,5 до 3,0 мм. Даний винахід стосується твердих фармацевтичних лікарських форм для перорального введення, що містять 5-хлор-N-({(5S)-2-оксо-3-[4-(3оксо-4-морфолініл)-феніл]-1,3-оксазолідин-5іл}метил)-2-тіофенкарбоксамід в аморфній формі та/або термодинамічно метастабільній кристалічній модифікації та характеризується швидким вивільненням активної речовини, а також способу їх одержання, їх застосування як лікарського засобу, їх застосування для профілактики, вторинної профілактики та/або лікування захворювань, а також їх застосування для одержання лікарського засобу для профілактики, вторинної профілактики та/або лікування захворювань. 5-хлор-N-({(5S)-2-оксо-3-[4-(3-оксо-4морфолініл)феніл]-1,3-оксазолідин-5-іл}-метил)-2тіофенкарбоксамід (І) є низькомолекулярним перорально застосовуваним інгібітором фактора Xa згортання крові, який може бути застосований для профілактики, вторинної профілактики та/або лікування різних тромбоемболічних захворювань (див. WO-A 01/47919, зміст якого через посилання включений обсяг охорони винаходу). Якщо надалі мова йтиме про активну речовину (І), то при цьому мають на увазі всі кристалічні модифікації та аморфну форму 5-хлор-N-({(5S)-2-оксо-3-[4-(3-оксо-4морфолініл)феніл]-1,3-оксазолідин-5-іл}метил)-2тіофенкарбоксаміду (І), а також відповідні гідрати, сольвати та супутні продукти кристалізації. При приготуванні композиції слід враховувати фізико-хімічні та біологічні властивості активної речовини (І), наприклад, відносно низьку розчинність у воді (прибл. 7 мг/л; 25°С) та відносно високу температуру плавлення прибл. 230C активної речовини (І) у такій кристалічній модифікації, в якій одержують активна речовина (І) описаним у прикладі 44 WO 01/47919 (Chem. Abstr. 2001, 135, 92625) способом, таку модифікацію надалі позначають кристалічною модифікацією І. У WO 2005/060940 описані фармацевтичні лікарські форми, що містять активну речовину (І) в гідрофілізованій формі. При цьому перевагу надають таблеткам із швидким вивільненням активної речовини, значення Q яких (30 хвилин) відповідно до методу вивільнення згідно з Фармакопеєю США, визначене пристроєм 2 (лопаткою) становить 75%. Нещодавно несподівано з'ясували, що лікарські форми, які містять активну речовину (І) в аморфній формі та/або у формі термодинамічно метастабільних кристалічних модифікацій, характеризуються покращеною біодоступністю. Предметом даного винаходу є тверді фармацевтичні лікарські форми для перорального застосування з швидким вивільненням активної речовини, що містять 5-хлор-N-({(5S)-2-оксо-3-[4-(3-оксо4-морфолініл)феніл]-1,3-оксазолідин-5-іл}-метил)2-тіофен-карбоксамід (І), які відрізняються тим, що вони містять активну речовину (І) у аморфній формі та/або у формі термодинамічно метастабільної кристалічної модифікації, а також тим, що 80 % активної речовини (І) відповідно до методу вивільнення згідно з Фармакопеєю США, вивільнюються через максимум 2 години, що визначається пристроєм 2 (лопаткою; 75 об./хв.). Інші умови цих досліджень вивільнення in vitro відповідно до методу вивільнення згідно з Фармакопеєю США описані в експериментальній частині („sink"-yмови). Кількість вивільненої активної речовини (І), що становить 80 %, відноситься до загальної кількості активної речовини (І) у лікарській формі. Перевагу надають твердим фармацевтичним лікарським формам для перорального введення з швидким вивільненням активної речовини, що містять 5-хлор-N-({(5S)-2-оксо-3-[4-(3-оксо-4морфолініл)феніл]-1,3-оксазолідин-5-іл}-метил)-2тіофен-карбоксамід (І), які відрізняються тим, що вони містять активну речовину (І) в аморфній формі та що 80 % активної речовини (І) відповідно до методу вивільнення згідно з Фармакопеєю США, вивільнюються через максимум 2 години, що визначається пристроєм 2 (лопаткою; 75 об./хв.). Відповідно до переважної форми виконання даного винаходу 80 % активної речовини (І) відповідно до методу вивільнення згідно з Фармакопеєю США вивільнюються через максимум 1 годину, що визначається пристроєм 2 (лопаткою; 75 об./хв.). Активна речовина (І) може входити до складу лікарських форм згідно з винаходом частково або повністю в аморфній формі та/або у формі термодинамічно метастабільної кристалічної модифікації. Переважно лікарські форми згідно з винаходом містять активну речовину (І) в аморфній формі та/або у формі метастабільних кристалічних модифікацій в кількості, у перерахунку на загальну кількість активної речовини (І), щонайменше 50 %, особливо переважно понад 50 %, зокрема щонайменше 90 %. Переважна активна речовина (І) може входити до складу лікарських форм згідно з винаходом частково або повністю в аморфній формі. Переважно лікарські форми згідно з винаходом містять активну речовину (І) в аморфній формі в кількості, 5 у перерахунку на загальну кількість активної речовини (І), щонайменше 50 %, особливо переважно понад 50 %, зокрема щонайменше 90 %. Відповідно до переважної форми виконання даного винаходу завдяки частковому або повному існуванню активної речовини (І) в аморфній формі та/або у формі однієї або кількох термодинамічно метастабільних кристалічних модифікацій поряд зі збільшенням швидкості вивільнення спостерігається також підвищення розчинності активної речовини. Відповідно до цієї форми виконання лікарські форми згідно з винаходом містять активну речовину (І) в аморфній формі та/або у формі метастабільних кристалічних модифікацій переважно в кількості, у перерахунку на загальну кількість активної речовини (І), щонайменше 50 %, особливо переважно понад 50 %, зокрема щонайменше 90 %. Підвищення розчинності активної речовини або „перенасичення" показують здійснювані in vitro дослідження вивільнення: під поняттям „перенасичення" в даному контексті мається на увазі, що ступінь вивільнення активної речовини композицій згідно з винаходом через одну годину щонайменше в 1,5 рази вища у порівнянні зі ступенем вивільнення кристалічної мікронізованої активної речовини (І) у кристалічній модифікації І в описаних в експериментальній частині "non-sink"-умовах вивільнення in vitro при дозі 20 мг активної речовини (І). Відповідно до цієї форми виконання лікарські форми згідно з винаходом містять активну речовину (І) в загальній кількості 20 мг та вивільнюють цю активну речовину (І) щонайменше в 1,5 рази швидше у порівнянні з 20 мг мікронізованої кристалічної активної речовини (І) у кристалічній модифікації І протягом однієї години відповідно до методу вивільнення згідно з Фармакопеєю США, що визначається пристроєм 2 (лопатка). Якщо, наприклад, мікронізована активна речовина (І) в цих умовах через годину характеризується вивільненням 40 % (8 мг), то швидкість вивільнення активної речовини з композицій згідно з винаходом становить щонайменше 60 % (12 мг). При цьому середній розмір частинок мікронізованої активної речовини (І) - показник X50 (вміст 50%) становить від 1 до 8 мкм, а показник X90 (вміст 90%) становить менше 20 мкм. Відповідно до особливо переважної форми виконання даного винаходу завдяки частковому або повному існуванню активної речовини (І) в аморфній формі поряд зі збільшенням швидкості вивільнення спостерігається також підвищення розчинності активної речовини. Відповідно до цієї форми виконання лікарські форми згідно з винаходом містять активну речовину (І) в аморфній формі переважно в кількості, у перерахунку на загальну кількість активної речовини (І), щонайменше 50 %, особливо переважно понад 50 %, зокрема щонайменше 90 %. Підвищення розчинності активної речовини або „перенасичення" демонструють здійснювані in vitro дослідження вивільнення: під терміном „перенасичення" в даному контексті мається на увазі, що швидкість вивільнення активної речовини композицій згідно з винаходом через одну годину щонайменше в 1,5 рази вища у порівнянні зі швидкістю вивільнення кристалічної мікро 90545 6 нізованої активної речовини (І) у кристалічній модифікації І в описаних в експериментальній частині “non-sink” - умовах вивільнення in vitro при дозуванні 20 мг активної речовини (І). Відповідно до цієї форми виконання лікарські форми згідно з винаходом містять активну речовину (І) в загальній кількості 20 мг та вивільнюють цю активну речовину (І) в щонайменше в 1,5 рази більшій кількості у порівнянні з 20 мг мікронізованої кристалічної активної речовини (І) у кристалічній модифікації І протягом однієї години відповідно до методу вивільнення згідно з Фармакопеєю США, що визначається пристроєм 2 (лопатка). Якщо, наприклад, мікронізована активна речовина (І) в цих умовах через годину характеризується вивільненням 40 % (8 мг), то швидкість вивільнення активної речовини з композицій згідно з винаходом становить щонайменше 60 % (12 мг). При цьому середній розмір частинок мікронізованої активної речовини (І) показник X50 (вміст 50%) становить від 1 до 8 мкм, а показник X90 (вміст 90%) становить менше 20 мкм. Для одержання фармацевтичних лікарських форм згідно з винаходом можуть бути використані всі кристалічні модифікації та аморфна форма 5хлор-N-({(5S)-2-оксо-3-[4-(3-оксо-4морфолініл)феніл]-1,3-оксазолідин-5-іл}метил)-2тіофенкарбоксаміду (І), а також відповідні гідрати, сольвати та супутні продукти кристалізації. Для аморфізації активних речовин та з метою одержання термодинамічно метастабільних кристалічних модифікацій або з метою стабілізації цих форм активної речовини у композиціях можливими є різні фармацевтично прийнятні методи одержання. Часто використовують метод розчинення, спосіб розплавлення або комбінацію цих двох способів [Chiou, W.L.; - Riegelman, S., ,,Pharmaceutical Applications of Solid Dispersion Systems", Journal of Pharmaceutical Sciences 60 (1971), 1281-1302; Ford, J. L., ,,The Current Status of Solid Dispersions", Pharm. Acta HeIv. 61 (1986), 69-88; Rasenack, N., ,,Poorly Water-soluble Drugs for Oral Delivery - A Challenge for Pharmaceutical Development, Part III: Drug delivery Systems containing the drug molecularly dispersed / Aspects on in vitro and in vivo characterization", Pharmazeutische Industrie 67, Nr. 5 (2005), 583-591]. У випадку кристалічної активної речовини (І) в термодинамічно стабільній кристалічній модифікації І метод розчинення, при якому активну речовину та, в разі потреби, використовувану(і) допоміжну(і) речовину(и), наприклад, полівінілпіролідон, розчиняють та після цього піддають подальшій обробці, є менш придатним, оскільки ця активна речовина характеризується лише обмеженою розчинністю у фармацевтично прийнятних органічних розчинниках, таких як, наприклад, ацетон або етанол, і тому потребує використання несумірно великих кількостей розчинника. Виняток становить чиста оцтова кислота як придатний розчинник для кристалічної активної речовини (І) - придатний спосіб одержання описаний в експериментальній частині. Активна речовина (І) входить до складу одержаної способом розчинення суміші згідно з вина 7 ходом переважно у концентрації від 0,1 до 30 %, особливо переважно від 0,1 до 20 %, зокрема від 5 до 15 %, у перерахунку на загальну масу розчинених компонентів. Переважним згідно з винаходом методом аморфізації активної речовини (І) та одержання термодинамічно метастабільних кристалічних модифікацій або стабілізації аморфного стану активної речовини (І) у фармацевтичних композиціях є спосіб розплавлення, при якому активну речовину розплавляють разом з або в одній або кількох придатних допоміжних речовинах. Придатними для здійснення способу розплавлення допоміжними речовинами є, наприклад, сечовина, лимонна кислота, стеаринова кислота, цукор, цукрові спирти, такі як, наприклад, маніт або ксиліт, та гідрофільні полімери, такі як, наприклад, поліетиленгліколі (ПЕГ), поліетиленоксиди, блокспівполімери поліоксиетилену та поліоксипропілену та співполімери вінілпіролідону та вінілацетату, гідроксипропілцелюлоза (ГПЦ), насичені полігліколізовані гліцериди (Gelucire, Gattefosse) або суміші допоміжних речовин. Переважними допоміжними активними речовинами є поліетиленгліколі, суміші поліетиленгліколів та суміші одного або кількох поліетиленгліколів і однієї або кількох інших придатних допоміжних речовин, особливу перевагу надають поліетиленгліколям та сумішам поліетиленгліколів, зокрема поліетиленгліколям. Активну речовину (І) поміщають у розплавлену допоміжну речовину або суміш допоміжних речовин та температуру підвищують доти, доки не утвориться прозорий розплав, або активну речовину (І) та допоміжну(і) активну(і) речовину(і) спочатку змішують, а потім розплавляють. Після розплавлення суміш охолоджують та подрібнюють, так що переважно утворюється порошок або гранулят, який називають також „твердим розчином". Альтернативно розплав після подрібнення можна, наприклад, дозувати у капсули або використовувати як саше, в разі потреби, після примішування придатних фармацевтичних допоміжних речовин. Шляхом вибору відповідної рецептури та придатних параметрів одержання при здійсненні такого способу розплавлення можна гарантувати, що розкладання активної речовини в ході процесу розплавлення не вийде за фармацевтично прийнятні межі. Це виявляється складним завданням, якщо температура плавлення активної речовини (І) у кристалічній модифікації І становить приблизно 230°С, оскільки у цьому високому температурному діапазоні, як правило, спостерігається значне збільшення швидкості розкладання активної речовина та/або допоміжних речовин. Активна речовина (І) входить до складу одержаної способом розплавлення суміші згідно з винаходом переважно у концентрації від 0,1 до 30%, особливо переважно від 0,1 до 20 %, зокрема від 5 до 15 %, у перерахунку на загальну масу розплаву. Особливо переважним для одержання фармацевтичних лікарських форм, що містять активну речовину (І) в аморфній формі або у формі метастабільних кристалічних модифікацій, є спосіб екструдування розплаву [Breitenbach, J., ,,Melt extru 90545 8 sion: From process to drug delivery technology", European Journal of Pharmaceutics and Biopharmaceutics 54 (2002), 107-117; Breitenbach, J., „Feste Losungen durch Schmelzextrusion - ein integriertes Herstellkonzept", Pharmazie in unsererZeit 29 (2000), 46-49]. Крім того шляхом вибору відповідної рецептури та придатних параметрів одержання при здійсненні такого способу одержання можна гарантувати, що розкладання активної речовини не вийде за фармацевтично прийнятні межі. Спосіб екструдування розплаву для одержання активної речовини (І) в аморфній формі або у формі метастабільних кристалічних модифікацій переважно здійснюють в присутності полімеру, такого як, наприклад, полівінілпіролідон (ПВП), поліетиленгліколь, поліметакрилат, поліметилметакрилат, поліетиленоксид, блокспівполімери поліоксиетилену та поліоксипропілену, співполімери вінілпіролідону та вінілацетату, або в присутності етеру целюлози, такого як, наприклад, гідроксипропілцелюлоза (ГПЦ), або сумішей різних полімерів. Переважно при цьому як полімер використовують гідроксипропілцелюлозу (ГПЦ), полівінілпіролідон (ПВП) або суміш ГПЦ та ПВП. Особливу перевагу надають гідроксипропілцелюлозі (ГПЦ) або полівінілпіролідону (ПВП). Вміст полімеру в екструдаті становить згідно з винаходом переважно щонайменше 40 % від загальної маси екструдату. Активна речовина (І) входить до складу екструдату згідно з винаходом переважно у концентрації від 0,1 до 20 %, зокрема від 5 до 15 %, у перерахунку на загальну масу екструдату. При здійсненні способу екструдування розплаву для одержання та/або стабілізації активної речовини (І) в аморфній формі вигідним виявилося додавання однієї або кількох фармацевтично прийнятних речовин для зниження температури плавлення активної речовини або як пластифікатора полімеру з метою полегшення переробки та зменшення розкладання активної речовини в процесі екструзії. Переважно ці фармацевтично прийнятні речовини згідно з винаходом використовують у концентрації від 0,2 до 40 %, у перерахунку на загальну масу екструдату. Придатними для цього є, наприклад, сечовина, полімери, такі як поліетиленгліколь, поліметакрилати, поліметилметакрилати, поліетиленоксид, блокспівполімери поліоксиетилену та поліоксипропілену, співполімери вінілпіролідону та вінілацетату, насичені полігліколізовані гліцериди (Gelucire, Gattefosse) або цукрові спирти, такі як, наприклад, еритрит, мальтит, маніт, сорбіт та ксиліт. Переважно використовують цукрові спирти. При цьому шляхом вибору придатних параметрів одержання можна гарантувати якомога більш повний перехід активної речовини (І) в аморфний або термодинамічно метастабільний стан з метою підвищення її розчинності. Продукт, що містить активну речовину (І) в аморфній формі або у формі метастабільної(них)кристалічної(них) модифікації(цій), одержаний, наприклад, методом розчинення, розплавлення 9 або екструдування розплаву, може бути оброблений різними способами: Він може бути, наприклад, подрібнений та використовуваний як порошок або гранулят, в разу потребі після дозування у капсули або як саше. При цьому можна додавати звичайні фармацевтичні допоміжні речовини, такі як, наприклад, наповнювачі, засобу, що регулюють текучість, адсорбенти, змочувальні агенти, ароматизатори та барвники. Крім того продукт, що містить активну речовину (І) в аморфній формі або у формі метастабільних кристалічних модифікацій, може бути перетворений на таблетку. З цією метою його ріжуть, подрібнюють та змішують зі звичайними допоміжними речовинами для формування таблеток, такими як наповнювачі та сухі зв'язувальні агенти (наприклад, порошкова целюлоза, мікрокристалічна целюлоза, оброблена кремнієм мікрокристалічна целюлоза, фосфат дикальцію, фосфат трикальцію, трисилікат магнію, маніт, мальтит, сорбіт, ксиліт, лактоза, декстроза, мальтоза, сахароза, глюкоза, фруктоза або мальтодекстрини), засоби, що сприяють розкладанню/дезінтеграції (наприклад, карбоксиметилцелюлоза, кроскармелоза (поперечно-зшита карбоксиметилцелюлоза), кросповідон (поперечно-зшитий полівінілпіролідон), НГПЦ (низькозаміщена гідроксипропілцелюлоза), натрійкарбокси-метилкрохмаль, гліколят натрію картопляного крохмалю, частково гідролізований крохмаль, пшеничний крохмаль, кукурудзяний крохмаль, рисовий крохмаль або картопляний крохмаль, „внутрішні" змазки, „зовнішні" змазки та засоби, що регулюють текучість, такі як фумарова кислота, стеаринова кислота, стеарат магнію, стеарат кальцію, стеарилфумарат натрію, низькомолекулярні жирні спирти, поліетиленгліколі, крохмалі (пшеничний, рисовий, кукурудзяний або картопляний крохмаль), тальк, високодисперсний (колоїдний) діоксид кремнію, оксид магнію, карбонат магнію або силікат кальцію, адсорбенти, ароматизатори та барвники, пресують до одержання таблеток та, в разі потреби, наносять лакове покриття. Придатними матеріалами для захисту від світла та/або фарбувальними лаками є, наприклад, полімери, такі як полівініловий спирт, гідроксипропілцелюлоза та/або гідроксипропілметилцелюлоза, в разі потреби, у комбінації з придатними пластифікаторами, такими як, наприклад, поліетиленгліколь або поліпропіленгліколь, та пігментами, такими як, наприклад, діоксид титану або оксиди заліза. Під таблетками мають на увазі переважно таблетки, час розпаду яких становить максимум 30 хвилин. Іншим предметом даного винаходу є спосіб одержання таблетованої композиції згідно з винаходом, причому за допомогою методу розчинення, переважно за допомогою способу розплавлення, найбільш переважно за допомогою екструдування розплаву одержують твердий розчин або екструдат, що містить активну речовину (І) в аморфній формі або в метастабільній розкладання, який після цього подрібнюють, змішують з іншими відомими фахівцям фармацевтичними допоміжними речовинами та дозують у капсули або у вигляді 90545 10 саше або змішують з відомими фахівцям допоміжними речовинами для таблетування (див. вище) та після цього переважно шляхом прямого таблетування пресують до одержання таблеток, на які потім можна наносити лакове покриття. Особливо переважно активна речовина (І) існує в аморфній формі. Крім того одержаний розплавленням продукт, що містить активну речовину (І) в аморфній формі та/або в метастабільній кристалічній модифікації, може бути представлений у вигляді багаточастинкових лікарських форм. Під поняттям „багаточастинкові лікарські форми" згідно з винаходом розуміють такі композиції, що складаються із кількох маленьких частинок, таких як, наприклад, сферичні грануляти (гранули) або мінітаблетки. Діаметр таких частинок становить, як правило, від 0,5 до 3,0 мм. На розрізані та закруглені екструдати або малоформатні таблетки (мінітаблетки, максимальний діаметр яких становить 3 мм), в разі потреби, можна наносити лакове покриття та дозувати у капсули або готувати у вигляді саше. Інша можливість полягає у подальшій переробці до великих таблеток, які після контакту з водою/шлунковим соком в результаті швидкого розпаду вивільнюють первинні грануляти/гранули. Особливо переважно активна речовина (І) існує в аморфній формі. Ще одним предметом даного винаходу є фармацевтичні лікарські форми, переважно капсули, саше або таблетки, що включають описані вище багаточастинкові лікарські форми. Ще одним предметом даного винаходу є спосіб одержання багаточастинкових фармацевтичних лікарських форм згідно з винаходом, причому переважно шляхом екструдування розплаву одержують екструдат, що містить активну речовину (І) в аморфній формі та/або в термодинамічно метастабільній кристалічній модифікації. Відповідно до переважної форми виконання даного винаходу шляхом розрізання цього штрангу та, в разі потреби, подальшого закруглення безпосередньо одержують гранульовану багаточастинкову лікарську форму. Після цього на одержані таким чином гранули можна наносити лакове покриття та дозувати у капсули або у вигляді саше. Особливо переважно активна речовина (І) існує в аморфній формі. Ще одним предметом даного винаходу є лікарські засоби, які включають тверду фармацевтичну лікарську форму згідно з винаходом для перорального введення, що містить активну речовину (І) в аморфній формі та/або в термодинамічно метастабільній(них) кристалічній(них) модифікації(ціях) та характеризується швидким вивільненням активної речовини. Особливо переважно активна речовина (І) існує в аморфній формі. Ще одним предметом даного винаходу є застосування твердої фармацевтичної лікарської форми згідно з винаходом для перорального введення, що містить аморфну та/або термодинамічно метастабільну активну речовину (І) та характеризується швидким вивільненням активної речовини, для профілактики, вторинної профілактики та/або лікування захворювань, зокрема артеріальних та/або венозних тромбоемболічних за 11 хворювань, таких як інфаркт міокарда, стенокардія (включаючи нестабільну стенокардію), реоклюзії та рестенози після ангіопластики або аортокоронарного шунтування, апоплексичний напад, транзиторні ішемічні напади, периферійні артеріальні облітерувальні захворювання, емболія легеневої артерії або глибокі венозні тромбози. Особливо переважно активна речовина (І) існує в аморфній формі. Ще одним предметом даного винаходу є застосування твердої фармацевтичної лікарської форми згідно з винаходом для перорального введення, що містить аморфну та/або термодинамічно метастабільну активну речовину (І) та характеризується швидким вивільненням активної речовини, для одержання лікарського засобу для профілактики, вторинної профілактики та/або лікування захворювань, зокрема артеріальних та/або венозних тромбоемболічних захворювань, таких як інфаркт міокарда, стенокардія (включаючи нестабільну стенокардію), реоклюзії та ре стенози після ангіопластики або аортокоронарного шунтування, апоплексичний напад, транзиторні ішемічні напади, периферійні артеріальні облітерувальні захворювання, емболія легеневої артерії або глибокі венозні тромбози. Особливо переважно активна речовина (І) існує в аморфній формі. Ще одним предметом даного винаходу є застосування 5-хлор-N-({(5S)-2-оксо-3-[4-(3-оксо-4морфолініл)феніл]-1,3-оксазолідин-5-іл}метил)-2тіофенкарбоксаміду (І) для одержання твердої фармацевтичної лікарської форми згідно з винаходом для перорального введення, що характеризується швидким вивільненням активної речовини. Ще одним предметом даного винаходу є спосіб профілактики, вторинної профілактики та/або лікування артеріальних та/або венозних тромбоемболічних захворювань шляхом перорального введення твердої фармацевтичної лікарської форми згідно з винаходом, що містить активну речовину (І) в аморфній формі та/або в термодинамічно метастабільній кристалічній модифікації та характеризується швидким вивільненням активної речовини. Особливо переважно активна речовина (І) існує в аморфній формі. Наведені нижче переважні приклади виконання більш детально пояснюють винахід, не обмежуючи обсяг його охорони. Якщо не зазначено нічого іншого, то всі кількісні показники відносяться до ваг. %. Експериментальна частина Дослідження вивільнення in vitro здійснюють відповідно до методу вивільнення згідно з Фармакопеєю США за допомогою пристрою 2 (лопатка) при температурі 37 °С. Швидкість обертання мішалки становить 75 об./хв. (обертів га хвилину) в 900 мл ацетатного буферного розчину, значення рН якого становить 4,5, одержаного із 29,9 г тригідрату ацетату натрію та 16,6 мл крижаної оцтової кислоти в 10 л води. При цьому дослідження здійснюють в "sink"або „non-sink”-умовах. „Sink"-умови (умови достатнього розведення): показник вивільнення активної речовини визначають в "sink"-умовах. Залежно від дози досліджува 90545 12 ної речовини для встановлення "sink"-yмов можна використовувати поверхнево-активну речовину, переважно лаурилсульфат натрію. Розчинність середовища для активної речовини (І), в разі потреби, при додаванні поверхнево-активної речовини, переважно лаурилсульфату натрію, встановлюють такою, щоб вона в 3-10 разів перевищувала розчинність досліджуваної дози активної речовини. „Non-sink"-умови (умови недостатнього розведення): дослідження для визначення перенасичення (підвищення розчинності) здійснюють без додавання поверхнево-активної речовини, причому здатна до вивільнення доза активної речовини (І) становить 20 мг. Описані нижче дослідження вивільнення in vitro здійснюють в "non-sink''-умовах, щоб продемонструвати перенасичення композицій з прикладів. Порівняльні композиції: Для унаочнення процесу перенасичення композицій з прикладів 1-6 (див. нижче.) для порівняння визначають вивільнення in vitro (в "non-sink"умовах) мікронізованої кристалічної активної речовини (І) в термодинамічно стабільній кристалічній модифікації І, а також вивільнення активної речовини з одержаної грануляцією у псевдозрідженому шарі таблетованої композиції, що характеризується швидким вивільненням та містить подрібнену кристалічну активну речовину (І) в кристалічній модифікації І. Порівняльна композиція 1.1 Вивільненні in vitro („nоn-sink"'-умови) мікронізованої (X50 = 4 мкм; X90 =10 мкм) кристалічної активної речовини (І) в кристалічній модифікації І; доза активної речовини 20 мг: Час [хв.] 15 Вивільнення 23 [%] 30 34 60 41 90 44 (лопатка згідно з Фармакопеєю США, 75 об./хв., 900 мл ацетатного буферного розчину, значення рН =4,5) Порівняльна композиція 1.2 Вивільнення in vitro („non-sink"-умови) активної речовини з таблетованої композиції, що містить 10 мг мікронізованої кристалічної активної речовини (І) у кристалічній модифікації І; доза активної речовини 20 мг при введенні 2 таблеток на посудину: Час [хв.] 15 Вивільнення 46 [%] 30 50 60 52 90 52 (лопатка згідно з Фармакопеєю США, 75 об./хв., 900 мл ацетатного буферного розчину, значення рН =4,5) Під таблетованою композицією мають на увазі таблетку В, описану в експериментальній частині WO 2005/060940 під цифрою 5.1 стосовно складу та одержання, на яку наносять лакове покриття, причому лак має такий склад (в мг/табл.): 13 90545 гідроксипропілметилцелюлоза 15 ср 1,5 мг поліетиленгліколь 3.350 0,5 мг діоксид титану 0,485 мг оксид заліза червон. 0,015 мг Приклад 1 композиції: Розплав активної речовини в ПЕГ 6000, що містить активну речовину (І) в термодинамічно метастабільній кристалічній модифікації: Активна речовина (І), мікронізована (MOD 1) 200 г поліетиленгліколь 6000 1800 г 2000 г Одержання: Поліетиленгліколь розплавляють у здатній до нагрівання реакційні посудині (з мішалкою та датчиком температури). Після досягнення температури прибл. 210C додають мікронізовану активну речовину (І) та знову нагрівають. Після досягнення температури 220-230°С прозорий розплав поміщають на металевий піддон та охолоджують за допомогою сухої криги. Після розтирання розплав подрібнюють у шаровому млині, в результаті чого одержують порошковий продукт. Вивільнення in vitro („nоn-sink"-умови) активної речовини з композиції прикладу 1 (доза активної речовини 20 мг): Час [хв.] 15 Вивільнення 48 [%] 30 71 60 82 90 87 (лопатка згідно з Фармакопеєю США, 75 об./хв., 900 мл ацетатного буферного розчину, значення рН =4,5) Результати показують, що композиція з прикладу 1 характеризується значно підвищеною розчинністю (перенасиченням) у порівнянні з мікронізованою активною речовиною (І) (порівняльний приклад 1.1). Через 1 годину спостерігають збільшення розчинності в 2 рази. Приклад 2 композиції: Екструдат гідроксипропілцелюлози, що містить аморфну активну речовину (І): активна речовина (І), мікронізована (MOD 1) 450 г гідроксипропілцелюлоза (тип ГПЦ-М, Nisso) 3900 г ксиліт 900 г 5250 г Одержання: Мікронізовану активну речовину (І), гідроксипропілцелюлозу і ксиліт змішують та обробляють у двошнековому екструдері (Leistritz Micro 18 PH) , діаметр вихідного сопла якого становить 2 мм. Суміш піддають екструзії при пропускній здатності приблизно 1 кг/год. та такій температурі зон нагріву: 20 °С (зона 1), 100 °С (зона 2), 174 °С (зона 3) та 194 °С (зони 4-8, а також вихід сопла). Одержаний штранг ріжуть шматочки довжиною приблизно 1 мм та потім подрібнюють у шаровому млині. Вивільнення in vitro („non-sink''-умови) активної речовини з композиції прикладу 2 (доза активної речовини 20 мг; фракція сита < 315 мкм): Час [хв.] 15 Вивільнення 36 [%] 14 30 66 60 85 90 90 (лопатка згідно з Фармакопеєю США, 75 об./хв., 900 мл ацетатного буферного розчину, значення рН = 4,5) Результати показують, що композиція з прикладу 2 характеризується значно підвищеною розчинністю (перенасиченням) у порівнянні з мікронізованою активною речовиною (І) (порівняльний приклад 1.1). Через 1 годину спостерігають збільшення розчинності в 2,1 рази. Приклад 3 композиції: Екструдат полівінілпіролідону, що містить аморфну активну речовину (І): активна речовина (І), мікронізована (MOD 1) 220 г полівінілпіролідон (Kollidon 25, BASF) 1985 г ксиліт 245 г 2450г Одержання: Мікронізовану активну речовину (І), полівінілпіролідон і ксиліт змішують та обробляють у двошнековому екструдері (Leistritz Micro 18 PH) , діаметр вихідного сопла якого становить 2 мм. Суміш піддають екструзії при пропускній здатності приблизно 1 кг/год. та такій температурі зон нагріву: 20 °С (зона 1), 100 °C (зона 2), 180 °C (зона 3) та 200 °С (зони 4-8, а також вихід сопла). Одержаний штранг ріжуть шматочки довжиною приблизно 1 мм та потім подрібнюють у шаровому млині. Вивільнення in vitro активної речовини з композиції прикладу 3 (доза активної речовини 20 мг; фракція сита < 315 мкм): Час [хв.] 15 Вивільнення 66 [%] 30 93 60 97 90 97 (лопатка згідно з Фармакопеєю США, 75 об./хв., 900 мл ацетатного буферного розчину, значення рН = 4,5) 100 мг* Результати показують, що композиція з прикладу 3 характеризується значно підвищеною розчинністю (перенасиченням) у порівнянні з мікронізованою активною речовиною (І) (порівняльний приклад 1.1). Через 1 годину спостерігають збільшення розчинності в 2,4 рази. Приклад 4 композиції: Таблетки, що містять активну речовину (І) в метастабільній розкладання у формі ПЕГрозплаву Склад таблеток, що містять 10 мг активної речовини (І) (мг/табл): активна речовина (І)-ПЕГ 6000розплав (див. приклад 1) 100 мг* мікрокристалічна целюлоза 270 мг маніт (Pearlitol SD 200, Roquette) 200 мг кроскармелоза (Ac-Di-Sol, FMC) 20 мг високодисперсний діоксид кремнію (Aerosil 200, Degussa) 4 мг 15 90545 стеарат магнію 16 6 мг 600 мг об./хв., 900 мл ацетатного буферного розчину, значення рН = 4,5) (* кількість залежить від актуального вмісту активної речовини; зрівнювальною речовиною є мікрокристалічна целюлоза) Одержання: ПЕГ-розплав активної речовини (І) одержують, як описано в прикладі 1. Після просіювання (0,63 мм) примішують інші допоміжні речовини (див. таблицю вище), і цю суміш пресують на таблетувальному пресі до одержання продовгуватих таблеток розміром 17x7 мм, межа міцності при згині яких становить приблизно 40 Н. Вивільнення in vitro („non-sink''-умови) активної речовини з композиції прикладу 4 (доза активної речовини 20 мг; 2 таблетки на посудину): Результати показують, що композиція з прикладу 5 характеризується значно підвищеною розчинністю (перенасиченням) у порівнянні з мікронізованою активною речовиною (І) (порівняльний приклад 1.1). Через 1 годину спостерігають збільшення розчинності в 2,5 рази. Приклад 6 композиції: Одержаний розчиненням гранулят полівінілпіролідону, що містить активну речовину (І) в аморфній формі: активна речовина (І), мікронізована (MOD 1) 4,0 г полівінілпіролідон 25 28,0 г крижана оцтова кислота (чиста оцтова кислота) 140,0 г 172,0 г Одержання: В ротаційному випарнику активну речовину (І) розчиняють в крижаній оцтовій кислоті при температурі від прибл. 90 до 100°С, після чого розчинник відганяють у вакуумі. Кількість продукту, що залишилась, піддають грубому подрібненню та поміщають у вакуумну сушильну шафу. У вакуумі здійснюють сушку протягом приблизно 48 годин при температурі від 100 до 120 °С. Гранулят розтирають та просіюють (< 1 мм). Вивільнення in vitro ("non-sinк"-умови) активної речовини з композиції прикладу 6 (доза активної речовини 20 мг): Час [хв.] 15 Вивільнення 65 [%] 30 78 60 88 90 93 (лопатка згідно з Фармакопеєю США, 75 об./хв., 900 мл ацетатного буферного розчину, значення рН = 4,5) Результати показують, що композиція з прикладу 4 характеризується значно підвищеною розчинністю (перенасиченням) у порівнянні з мікронізованою активною речовиною (І) (порівняльний приклад 1.1). Через 1 годину спостерігають збільшення розчинності в 2,1 рази. Приклад 5 композиції: Таблетки, що містять аморфну активну речовину (І) у формі ГПЦ-екструдату Склад таблеток, що містять 10 мг активної речовини (І) (мг/табл.): активна речовина (І)-ГПЦ-екструдат (див. приклад 2) 117 мг * мікрокристалічна целюлоза 253 мг лактоза (таблетоза, Меgglе) 200 мг кроскармелоза (Ac-Di-SoI, FMC) 20 мг високодисперсний діоксид кремнію (Aerosil 200, Degussa) 4 мг стеарат магнію 6 мг 600 мг (* кількість залежить від актуального вмісту активної речовини; зрівнювальною речовиною є мікрокристалічна целюлоза) Одержання: ГПЦ-екструдат активної речовини (І) одержують, як описано в прикладі 2. Після просіювання (0,4 мм) примішують інші допоміжні речовини (див. таблицю вище), і цю суміш пресують на таблетувальному пресі до одержання продовгуватих таблеток розміром 17x7 мм, межа міцності при згині яких становить приблизно 40 Н. Вивільнення in vitro („nоn-sinк"-умови) активної речовини з композиції прикладу 5 (доза активної речовини20 мг; 2 таблетки на посудину): Час [хв.] 15 Вивільнення 100 [%] 30 101 60 101 90 101 (лопатка згідно з Фармакопеєю США, 75 Час [хв.] 15 Вивільнення 79 [%] 30 82 60 83 90 83 (лопатка згідно з Фармакопеєю США, 75 об./хв., 900 мл ацетатного буферного розчину, значення рН = 4,5) Результати показують, що композиція з прикладу 6 характеризується значно підвищеною розчинністю (перенасиченням) у порівнянні з мікронізованою активною речовиною (І) (порівняльний приклад 1.1). Через 1 годину спостерігають збільшення розчинності в 2 рази. Біодоступність 1) Порівняльне дослідження на пацюках (3 мг/кг) Для визначення біодоступності пацюкам Wistar чоловічої статі вводять відповідно З мг/кг активної речовини (І): a) у формі композиції з прикладу 1 (суспенд. у воді), b) у формі композиції з прикладу 2 (суспенд. у воді), c) у формі композиції з прикладу 3 (суспенд. у воді), d) у формі мікронізованої кристалічної активної речовини в термодинамічно стабільній кристалічній модифікації І (суспенд. в 0,5 %-ному водному розчині метилгідроксиетилцелюлози (торгова назва: Tylose MH 300)) 17 90545 18 Нижче в таблиці наведені відповідні фармакокінетичні параметри (геометричні середні значення): Композиція прикладу 1 Композиція прикладу 2 Композиція прикладу 3 Кристалічна мікронізована активна речовина AUC (0-24) [мггод./л] 2,45 2,70 2,79 0,762 AUC (0-24)норм [кггод./л] 0,818 0,900 0,931 0,254 Результат: Композиція з прикладу 1, що містить активну речовину (І) в термодинамічно метастабільній кристалічній модифікації, та композиції з прикладів 2 і 3, що містять активну речовину (І) в аморфній формі, характеризуються значно покращеною біодоступністю у порівнянні із застосовуваною кристалічною мікронізованою активною речовиною в термодинамічно стабільній кристалічній модифікації І (в 3,2 рази для композиції з прикладу 1; в 3,5 разів для композиції з прикладу 2 та в 3,7 для композиції з прикладу 3). 2) Порівняльне дослідження на собаках (150 мг/кг) Композиція прикладу 1 Кристалічна мікронізована активна речовина AUC (0-24) [мггод./л] 44,5 12,2 Порівняльна композиція 1.2 Композиція прикладу 4 0,721 0,996 0,961 0,222 0,240 0,332 0,320 0,074 Для визначення біодоступності при здійсненні перехресного дослідження 4 гончим собакам вводять відповідно 150 мг/кг активної речовини (І): e) у формі композиції з прикладу 1 (суспенд. у воді), f) у формі мікронізованої кристалічної активної речовини в кристалічній модифікації І (суспенд. у водному розчині метилгідроксиетилцелюлози (0,5 %) (торгова назва: Tylose MH 300) при додаванні 2 % Solutol HS 15) Нижче в таблиці наведені відповідні фармакокінетичні параметри (геометричні середні значення): Смакс [мг/л] Смакс, норм [кг/л] 7,54 2,22 0,050 0,015 перехресного дослідження 4 гончим собакам жіночої статі вводять відповідно 20 мг (тобто прибл. 2 мг/кг активної речовини (І) у формі таких таблетованих композицій: a) у формі порівняльної композиції 1.2 (відповідно 2 таблетки на собаку), b) у формі композиції з прикладу 4 (відповідно 2 таблетки на собаку) Нижче в таблиці наведені відповідні фармакокінетичні параметри (геометричні середні значення): AUC (0-24)норм [кггод./л] 0,938 1,39 Результат: Композиція з прикладу 4, що містить активну речовину (І) в термодинамічно метастабільній кристалічній модифікації, характеризуються значно покращеною біодоступністю у порівнянні із порів Комп’ютерна верстка Д. Шеверун Смакс, норм [кг/л] AUC (0-24)норм [кггод./л] 0,297 0,081 Результат: Композиція з прикладу 1, що містить активну речовину (І) в термодинамічно метастабільній кристалічній модифікації, характеризуються значно покращеною біодоступністю у порівнянні із застосовуваною кристалічною мікронізованою активною речовиною в термодинамічно стабільній кристалічній модифікації І (в 3,6 разів). 3) Порівняльне дослідження на собаках (20 мг на собаку відповідно приблизно 2 мг/кг) Для визначення біодоступності при здійсненні AUC (0-24) [мггод./л] 1,84 2,71 Смакс [мг/л] Смакс [мг/л] Смакс, норм [кг/л] 0,447 0,665 0,228 0,341 няльною композицією 1.2 (таблетка, що містить кристалічну мікронізовану активну речовину в термодинамічно стабільній кристалічній модифікації І) (в 1,5 рази). Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюSolid orally administerable pharmaceutical dosage forms with rapid release of inhibitor of coagulation factor xa
Автори англійськоюBenke Klaus
Назва патенту російськоюТвердая фармацевтическая лекарственная форма для перорального введения с быстрым высвобождением ингибитора фактора ха свертывания крови
Автори російськоюБенке Клаус
МПК / Мітки
МПК: A61K 31/5377, A61P 7/02, A61K 9/20, A61K 9/16
Мітки: фактора, введення, перорального, фармацевтична, вивільненням, згортання, швидким, крові, інгібітора, тверда, лікарська, форма
Код посилання
<a href="https://ua.patents.su/9-90545-tverda-farmacevtichna-likarska-forma-dlya-peroralnogo-vvedennya-z-shvidkim-vivilnennyam-ingibitora-faktora-kha-zgortannya-krovi.html" target="_blank" rel="follow" title="База патентів України">Тверда фармацевтична лікарська форма для перорального введення з швидким вивільненням інгібітора фактора ха згортання крові</a>
Попередній патент: Спосіб видобування корисних копалин
Наступний патент: Роторно-пульсаційний апарат
Випадковий патент: Радіоізотопний щільномір