Нанокомпозитний матеріал для біомедичного застосування
Номер патенту: 97613
Опубліковано: 25.03.2015
Автори: Геращенко Ігор Іванович, Карабанова Людмила Василівна, Носач Людмила Вікторівна, Воронін Євгеній Пилипович, Бондарук Оксана Миколаївна
Формула / Реферат
Нанокомпозитний матеріал для біомедичного застосування, що містить поліуретан та гідрофільний полімер метакрилового ряду, які формують взаємопроникні полімерні сітки з нанодоменною структурою, який відрізняється тим, що додатково містить модифікований нанорозмірний наповнювач пірогенний високодисперсний кремнезем з іммобілізованими на його поверхні антимікробними речовинами, вибраними з ряду метронідазол, декаметоксин, нанорозмірне срібло та їх суміші, і сполуками з біостимулюючими властивостями, вибраними з ряду амінокислот гліцин, лізин, гістидин, триптофан, або солями цинку, або солями срібла та їхніми сумішами при такому співвідношенні компонентів, мас. ч.:
поліуретан
10-95
полі(2-гідроксіетилметакрилат)
5-90
модифікований нанорозмірний наповнювач
1-20.
Текст
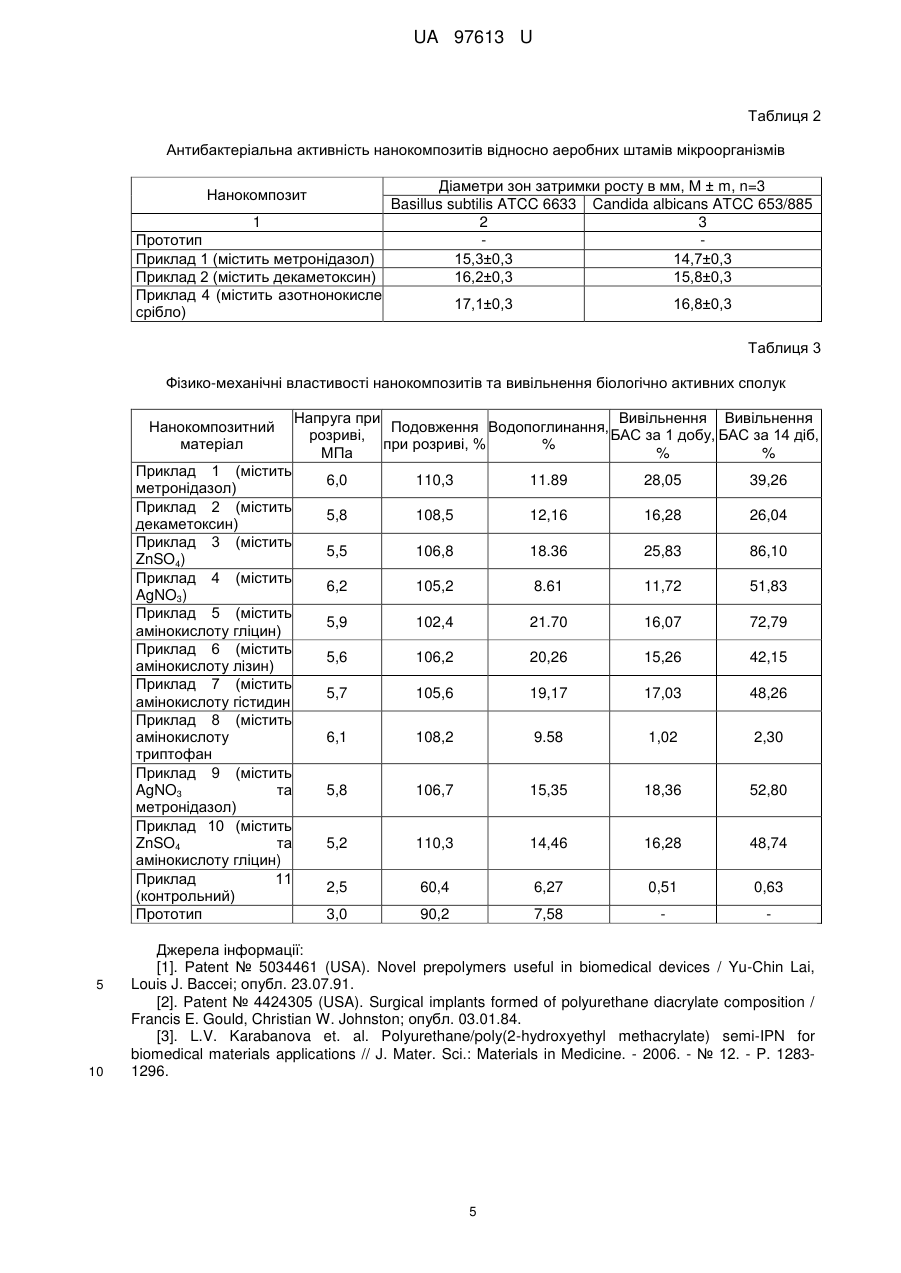
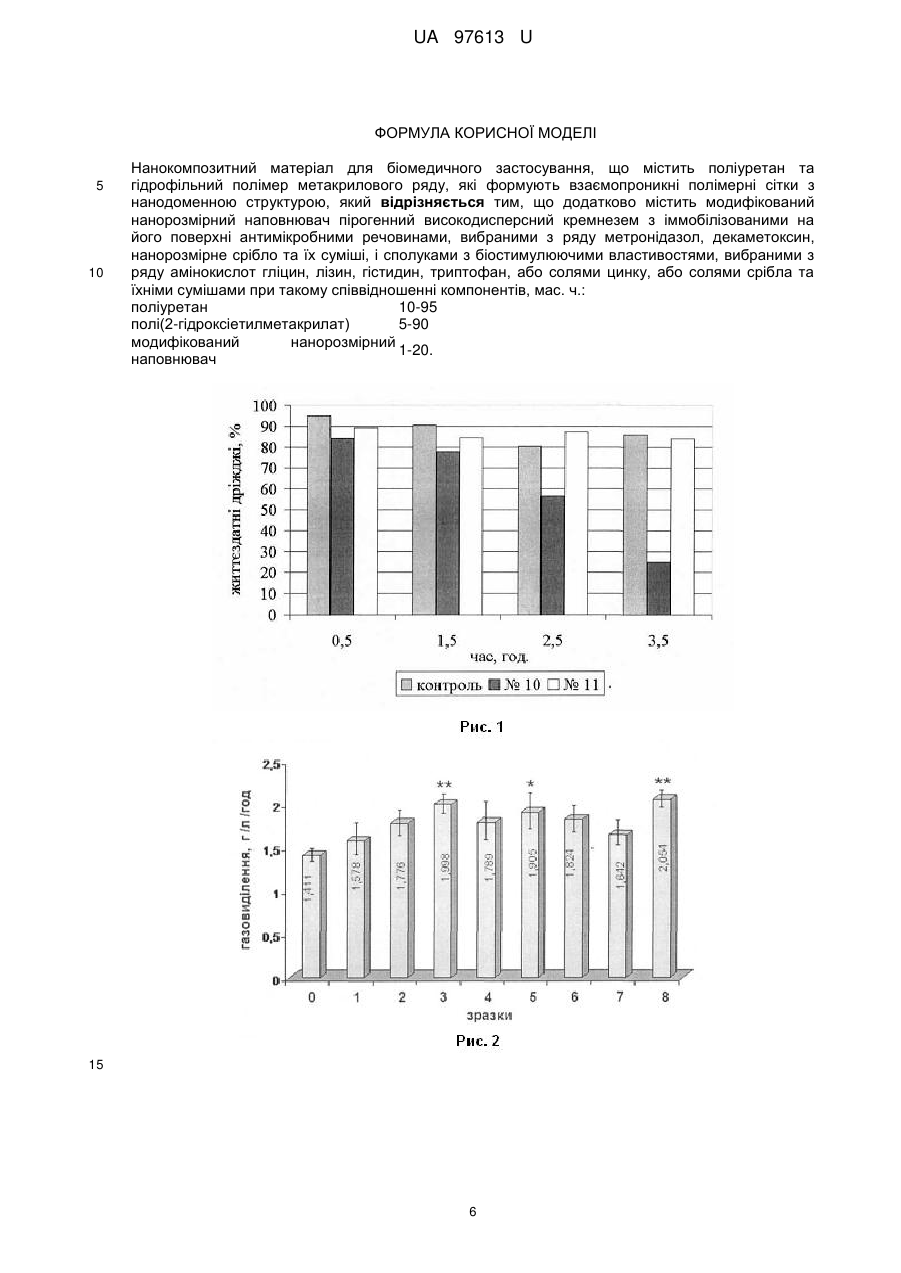
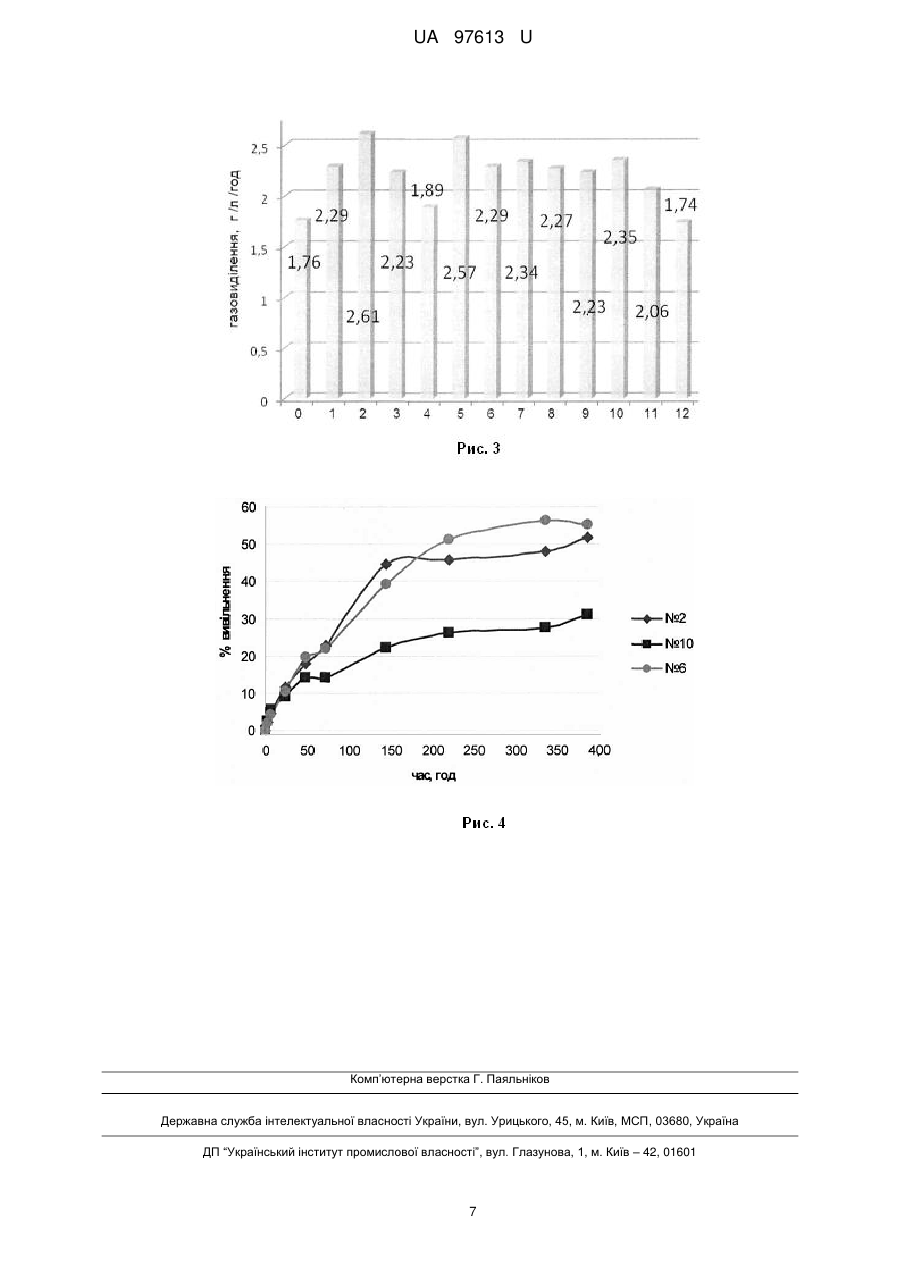
Реферат: Нанокомпозитний матеріал для біомедичного застосування містить поліуретан та гідрофільний полімер метакрилового ряду, які формують взаємопроникні полімерні сітки з нанодоменною структурою. Він додатково містить модифікований нанорозмірний наповнювач пірогенний високодисперсний кремнезем з іммобілізованими на його поверхні антимікробними речовинами, вибраними з ряду метронідазол, декаметоксин, нанорозмірне срібло та їх суміші, і сполуками з біостимулюючими властивостями, вибраними з ряду амінокислот гліцин, лізин, гістидин, триптофан, або солями цинку, або солями срібла та їхніми сумішами. UA 97613 U (12) UA 97613 U UA 97613 U 5 10 15 20 25 30 35 40 45 50 55 Корисна модель належить до композицій на основі поліуретанів та акрилатів, з використанням неорганічних та органічних сполук, та призначається для використання в медицині, а саме в хірургічній практиці для закриття та лікування ран, опіків, трофічних виразок, для виготовлення виробів медичного призначення, як то катетерів, імплантів. В медичній практиці є актуальною задача створення матеріалів для заміни, реконструкції та відновлення тканин організму. Основною проблемою існуючих синтетичних матеріалів, що використовуються для відновлення тканин організму та реконструкції, є їх недостатня біосумісність, недостатні антимікробні властивості, недостатня біологічна активність. Відомі матеріали на основі поліуретанового преполімеру, співполімерів гідроксіетилметакрилату [1], що розроблені для біомедичного застосування. Вони мають хороші фізико-механічні властивості та газопроникність. Але вони не мають антимікробних властивостей та не є біологічно активними матеріалами. Відомий матеріал на основі гідрофільної поліуретан-діакрилатної композиції, з якого виробляються хірургічні імплантати, наприклад контактні лінзи [2]. Вони мають високу біосумісність, але мають вузький сегмент використання, оскільки при контакті з водою утворюють гідрогелі, що мають низькі фізико-механічні властивості. Найбільш близьким за складом до корисної моделі є матеріал, що складається з поліуретану та полі(2-гідроксіетилметакрилату), які утворюють напіввзаємопроникні полімерні сітки з нанодоменною структурою [3]. При цьому один з компонентів напіввзаємопроникних полімерних сіток - поліуретан надає матеріалу оптимальних фізико-механічних властивостей, а другий - полі(2-гідроксіетилметакрилат, забезпечує матеріалу необхідну гідрофільність. Описаний матеріал є достатньо біосумісним, але він не має біологічної активності, не має антисептичних властивостей та є недостатньо бактерицидним матеріалом. Задачею запропонованої корисної моделі є створення нанокомпозитного матеріалу з біологічною активністю, антисептичними та бактерицидними властивостями, з регульованою швидкістю вивільнення біологічно активних сполук. Поставлена задача вирішується тим, що нанокомпозитний матеріал, що містить поліуретан та гідрофільний полімер метакрилового ряду, які формують взаємопроникні полімерні сітки з нанодоменною структурою, згідно із запропонованою корисною моделлю, додатково містить модифікований нанорозмірний наповнювач пірогенний високодисперсний кремнезем з іммобілізованими на його поверхні антимікробними речовинами, вибраними з ряду метронідазол, декаметоксин, нанорозмірне срібло та їх суміші, і сполуками з біостимулюючими властивостями, вибраними з ряду амінокислот гліцин, лізин, гістидин, триптофан, або солями цинку, або солями срібла та їхніми сумішами при такому співвідношенні компонентів, мас. ч.: поліуретан 10-95 полі(2-гідроксіетилметакрилат) 5-90 модифікований нанорозмірний наповнювач 1-20. Нанокомпозитний матеріал як біологічно активні сполуки містить щонайменше один компонент, що вибраний з групи антимікробних та антисептичних речовин, речовин, що прискорюють регенерацію клітин або суміш цих речовин. Як антимікробні субстанції нанокомпозитний матеріал містить, наприклад, декаметоксин, метронідазол або солі срібла. Як речовини, що прискорюють регенерацію клітин, нанокомпозитний матеріал містить амінокислоти, наприклад гліцин, лізин, гістидин, триптофан або сполуки цинку. Суть корисної моделі пояснюється наступними прикладами. Приклад 1. До 6,9 г поліоксипропіленгліколю з MM 2000 додавали 1 г наповнювача солденсилу з депонованим на поверхні метронідазолом, суміш перемішували до гомогенного стану, додавали 3,04 г поліізоціанату, 1,8 г етилацетату, перемішували до формування гомогенного розчину, виливали в плоскопаралельну форму із скла та отверджували при температурі 80 °C протягом 24 годин. До одержаного продукту додавали 90 г мономеру 2гідроксіетилметакрилату, що містив ініціатор фотополімеризації, після чого проводили фотополімеризацію мономеру із застосуванням ультрафіолетової лампи з утворенням гідрофільного полімеру полі(2-гідроксіетилметакрилату). Кінцевий продукт мав вигляд еластичної прозорої плівки або еластичної плівки з білим опалесцентним забарвленням. Плівка характеризувалась наступними фізико-механічними параметрами: подовження при розриві 110 %, напруга при розриві 6 Мпа. Водопоглинання плівки складало 11,89 %. Дослідження антимікробних властивостей нанокомпозитного матеріалу проводили методом дифузії в агар (метод колодязів). Для оцінки активности матеріалу використовували тест-штами 1 UA 97613 U 5 10 15 20 25 30 35 40 45 50 55 60 аеробних мікрооорганізмів Staphylococcus aureus ATCC 25923, Escherichia coli ATCC 25922, Basillus subtilis ATCC 6633, Candida albicans ATCC 885/653 та анаеробних мікроорганізмів Clostridium perfringens 28, Bacteroides fragilis ATCC 13/83, Peptostreptococcus anaerobius 13, Fusobacteriun necrophorum 22. Мікробне навантаження складало 10-10 мікробних клітин на 1 мл середовища і встановлювалось за стандартом Mcfarland. Для досліджень використовували агар Мюллера-Хінтона. Визначення антибактеріальної активності нанокомпозитного матеріалу проводили на двох шарах щільного живильного середовища, розлитого в чашки Петрі. У нижньому шарі використовували "голодні", не засіяні середовища (агар-агар, вода, солі). Нижній шар служив підкладкою заввишки 10 мм, на яку строго горизонтально встановлювали 3-6 тонкостінних циліндрів з нержавіючої сталі діаметром 8 мм і заввишки 10 мм. Довкола циліндрів заливали верхній шар, що складався з живильного середовища, що містило агар, розплавленого і охолодженого до 40 °C, в яке вносили відповідний стандарт добової культури тест-мікроба. Після застигання середовища циліндри витягували стерильним пінцетом і в лунки, що утворилися, поміщали досліджуваний нанокомпозит. Чашки підсушували 30-40 хв при кімнатній температурі і ставили в термостат на 18-24 год. Під час роботи з анаеробними мікроорганізмами для кожного з них брали індивідуальне живильне середовище. Після застигання середовища чашки Петрі підсушували при кімнатній температурі, ставили в анаеростат, заповнений газовою сумішшю: 80,0 % азоту, 10,0 % кисню, 10,0 % вуглекислого газу. Посіви культивували 48-72 год. Антибактеріальну активність нанокомпозитного матеріалу оцінювали за зоною затримки росту мікроорганізмів навколо лунки. Результати представлені в таблицях 1 та 2 та рисунку 1, де зображена мікроскопічна оцінка пригнічуючої дії нанокомпозитів на ріст бактерій залежно від часу інкубації: -контроль (перший стовбчик); № 10 - нанокомпозит містить срібло азотнокисле (другий стовбчик); № 11 - нанокомпозит містить триптофан (третій стовбчик). Біологічну активність нанокомпозитного матеріалу досліджували як вплив даного матеріалу на бродильну енергію дріжджових клітин Saccharomyces cerevisiae. Ці клітини досить чутливі до дії факторів, що впливають на їх ріст та розмноження, яке оцінювали методом реєстрації виділення вуглекислого газу. Результати наведені на рисунках 2 та 3. На рисунку 2 зображена біостимулююча активність нанокомпозитів, що містять сполуки цинку. Показник інтенсивності газовиділення в експерименті впливу нанокомпозитів на бродильну енергію дріжджів за проміжок часу 0-10 годин: 0 - контроль; 1-8 нанокомпозити, що містять різну кількість сульфату цинку. На рисунку 3 зображена біостимулююча активність нанокомпозитів, що містять амінокислоти. Показник інтенсивності газовиділення в експерименті впливу нанокомпозитів на бродильну енергію дріжджів за проміжок часу 0-10 годин: 0 - контроль; 1-2, 11 - нанокомпозити, що містять різну кількість амінокислоти гліцин; 3-4 - нанокомпозити, що містять різну кількість амінокислоти лізин; 5-6, 12 - нанокомпозити, що містять різну кількість амінокислоти триптофан; 7-10 - нанокомпозити, що містять різну кількість амінокислоти гістидин. Кінетику вивільнення сполук срібла, цинку, амінокислот гліцину, лізину, гістидину, триптофану, антимікробних препаратів декаметоксину, метронідазолу з нанокомпозитного матеріалу досліджували аналітичними методами (дитизоновим - для іонів важких металів, нінгідриновим - для амінокислот). Результати наведені в таблиці 3 та рисунку 4, де зображена кінетика вивільнення нітрату срібла у водне середовище з нанокомпозитів з матрицями складу 83ПУ/17ПГЭМА (№ 2), 63ПУ/37ПГЭМА (№6) і ПУ (№ 10). Проведено дослідження цитотоксичності та гістосумісності створених нанокомпозитних матеріалів в дослідах на щурах. Аналіз крові та біопсію тканин для гістологічних досліджень проводили через 1; 3; 5; 7; 10 та 18 добу після імплантації. У тварин, яким підшкірно був імплантований нанокомпозит, виражених ознак запалення в оточуючих тканинах та порушень показників крові протягом терміну спостереження не виявлено. У всіх досліджуваних тварин рана заживала без ускладнень первинним натяжінням. Приклад 2. До 13,92 г поліоксипропіленгліколю з MM 2000 додавали 2 г наповнювача солденсилу з депонованим на поверхні антибіотиком декаметоксином, суміш перемішували до гомогенного стану, дадавали 6,08 г поліізоціанату, 3,6 г етилацетату, перемішували до формування гомогенного розчину, виливали в плоскопаралельну форму із скла та отверджували при температурі 80 °C протягом 24 годин. До одержаного продукту додавали 80 г мономеру 2-гідроксіетилметакрилату, що містив ініціатор фотополімеризації, після чого проводили фотополімеризацію мономеру із застосуванням ультрафіолетової лампи з утворенням гідрофільного полімеру полі(2-гідроксіетилметакрилату). Кінцевий продукт мав вигляд еластичної прозорої плівки або еластичної плівки з білим опалесцентним забарвленням. Дослідження проводили, як описано в прикладі 1. Результати наведені в таблицях 1-3. 2 UA 97613 U 5 10 15 20 25 30 35 40 45 50 55 Приклад 3. До 20,87 г поліоксипропіленгліколю з MM 2000 додавали 3 г наповнювача солденсилу з депонованим на поверхні сульфатом цинку, суміш перемішували до гомогенного стану, додавали 9,13 г поліізоціанату, 5,4 г етилацетату, перемішували до формування гомогенного розчину, виливали в плоскопаралельну форму із скла та отверджували при температурі 80 °C протягом 24 годин. До одержаного продукту додавали 70 г мономеру 2гідроксіетилметакрилату, що містив ініціатор фотополімеризації, після чого проводили фотополімеризацію мономеру із застосуванням ультрафіолетової лампи з утворенням гідрофільного полімеру полі(2-гідроксіетилметакрилату). Кінцевий продукт мав вигляд прозорої еластичної плівки з білим опалесцентним забарвленням. Дослідження проводили, як описано в прикладі 1. Результати наведені на рисунку 2, де зображена біостимулююча активность нанокомпозитів, що містять сполуки цинку. Показник інтенсивності газовиділення в експерименті впливу нанокомпозитів на бродильну енергію дріжджів за проміжок часу 0-10 годин: 0 контроль; 1-8 нанокомпозити, що містять різну кількість сульфату цинку. Приклад 4. До 27,83 г поліоксипропіленгліколю з MM 2000 додавали 4 г наповнювача солденсилу з депонованим на поверхні азотнокислим сріблом, суміш перемішували до гомогенного стану, додавали 12,17 г поліізоціанату, 7,2 г етилацетату, перемішували до формування гомогенного розчину, виливали в плоскопаралельну форму із скла та отверджували при температурі 80 °C протягом 24 годин. До одержаного продукту додавали 60 г мономеру 2гідроксіетилметакрилату, що містив ініціатор фотополімеризації, після чого проводили фотополімеризацію мономеру із застосуванням ультрафіолетової лампи з утворенням гідрофільного полімеру полі(2-гідроксіетилметакрилату). Кінцевий продукт мав вигляд прозорої еластичної плівки з темно-жовтим забарвленням. Дослідження проводили, як описано в прикладі 1. Результати наведені в таблицях 1-3 та рисунку 1, де зображена мікроскопічна оцінка пригнічуючої дії нанокомпозитів на ріст бактерій залежно від часу інкубації: -контроль (перший стовбчик); № 10 - нанокомпозит містить срібло азотнокисле (другий стовбчик); № 11 нанокомпозит містить триптофан (третій стовбчик). Приклад 5. До 34,79 г поліоксипропіленгліколю з MM 2000 додавали 5 г наповнювача солденсилу з депонованою на поверхні амінокислотою гліцин, суміш перемішували до гомогенного стану, додавали 15,21 г поліізоціанату, 9 г етилацетату, перемішували до формування гомогенного розчину, виливали в плоскопаралельну форму із скла та отверджували при температурі 80 °C протягом 24 годин. До одержаного продукту додавали 50 г мономеру 2гідроксіетилметакрилату, що містив ініціатор фотополімеризації, після чого проводили фотополімеризацію мономеру із застосуванням ультрафіолетової лампи з утворенням гідрофільного полімеру полі(2-гідроксіетилметакрилату). Кінцевий продукт мав вигляд прозорої еластичної плівки з білим опалесцентним забарвленням. Дослідження проводили, як описано в прикладі 1. Результати наведені в таблиці 3 та на рисунку 3, де зображена біостимулююча активность нанокомпозитів, що містять амінокислоти. Приклад 6. До 41,75 г поліоксипропіленгліколю з MM 2000 додавали 10 г наповнювача солденсилу з депонованою на поверхні амінокислотою лізин, суміш перемішували до гомогенного стану, додавали 18,25 г поліізоціанату, 10,8 г етилацетату, перемішували до формування гомогенного розчину, виливали в плоскопаралельну форму із скла та отверджували при температурі 80 °C протягом 24 годин. До одержаного продукту додавали 40 г мономеру 2гідроксіетилметакрилату, що містив ініціатор фотополімеризації, після чого проводили фотополімеризацію мономеру із застосуванням ультрафіолетової лампи з утворенням гідрофільного полімеру полі(2-гідроксіетилметакрилату). Кінцевий продукт мав вигляд прозорої еластичної плівки з білим опалесцентним забарвленням. Дослідження проводили, як описано в прикладі 1. Результати наведені в таблиці 3 та рисунку 3, де зображена біостимулююча активность нанокомпозитів, що містять амінокислоти. Приклад 7. До 57,75 г поліоксипропіленгліколю з MM 2000 додавали 15 г наповнювача солденсилу з депонованою на поверхні амінокислотою гістидин, суміш перемішували до гомогенного стану, додавали 25,25 г поліізоціанату, 14,94 г етилацетату, перемішували до формування гомогенного розчину, виливали в плоскопаралельну форму із скла та отверджували при температурі 80 °C протягом 24 годин. До одержаного продукту додавали 17 г мономеру 2-гідроксіетилметакрилату, що містив ініціатор фотополімеризації, після чого проводили фотополімеризацію мономеру із застосуванням ультрафіолетової лампи з утворенням гідрофільного полімеру полі(2-гідроксіетилметакрилату). Кінцевий продукт мав вигляд прозорої еластичної плівки з білим опалесцентним забарвленням. Дослідження проводили, як описано в прикладі 1. Результати наведені в таблиці 3 та рисунку 3, де зображена біостимулююча активність нанокомпозитів, що містять амінокислоти. 3 UA 97613 U 5 10 15 20 25 30 35 40 Приклад 8. До 66,10 г поліоксипропіленгліколю з MM 2000 додавали 20 г наповнювача солденсилу з депонованою на поверхні амінокислотою триптофан, суміш перемішували до гомогенного стану, додавали 28,90 г поліізоціанату, 17,1 г етилацетату, перемішували до формування гомогенного розчину, виливали в плоскопаралельну форму із скла та отверджували при температурі 80 °C протягом 24 годин. До одержаного продукту додавали 5 г мономеру 2-гідроксіетилметакрилату, що містив ініціатор фотополімеризації, після чого проводили фотополімеризацію мономеру із застосуванням ультрафіолетової лампи з утворенням гідрофільного полімеру полі(2-гідроксіетилметакрилату). Кінцевий продукт мав вигляд прозорої еластичної плівки з білим опалесцентним забарвленням. Дослідження проводили, як описано в прикладі 1. Результати наведені в таблиці 3 та рисунку 3, де зображена біостимулююча активность нанокомпозитів, що містять амінокислоти. Приклад 9. До 66,10 г поліоксипропіленгліколю з MM 2000 додавали 10 г наповнювача солденсилу з депонованим на поверхні азотнокислим сріблом, 10 г наповнювача сол-денсилу з депонованим на поверхні метронідазолом, суміш перемішували до гомогенного стану, додавали 28,90 г поліізоціанату, 17,1 г етилацетату, перемішували до формування гомогенного розчину, виливали в плоскопаралельну форму із скла та отверджували при температурі 80° С протягом 24 годин. До одержаного продукту додавали 5 г мономеру 2-гідроксіетилметакрилату, що містив ініціатор фотополімеризації, після чого проводили фотополімеризацію мономеру із застосуванням ультрафіолетової лампи з утворенням гідрофільного полімеру полі(2гідроксіетилметакрилату). Кінцевий продукт мав вигляд прозорої еластичної плівки з білим опалесцентним забарвленням. Дослідження проводили, як описано в прикладі 1. Результати наведені в в таблиці 3. Приклад 10. До 57,75 г поліоксипропіленгліколю з MM 2000 додавали 7,5 г наповнювача солденсилу з депонованим на поверхні сульфатом цинку, 7,5 г наповнювача сол-денсилу з депонованою на поверхні амінокислотою гліцин, суміш перемішували до гомогенного стану, додавали 25,25 г поліізоціанату, 14,94 г етилацетату, перемішували до формування гомогенного розчину, виливали в плоскопаралельну форму із скла та отверджували при температурі 80° С протягом 24 годин. До одержаного продукту додавали 17 г мономеру 2гідроксіетилметакрилату, що містив ініціатор фотополімеризації, після чого проводили фотополімеризацію мономеру із застосуванням ультрафіолетової лампи з утворенням гідрофільного полімеру полі(2-гідроксіетилметакрилату). Кінцевий продукт мав вигляд прозорої еластичної плівки з білим опалесцентним забарвленням. Дослідження проводили, як описано в прикладі 1. Результати наведені в таблиці 3. Приклад 11 (контрольний) До 6,96 г поліоксипропіленгліколю з MM 2000 додавали 22 г наповнювача сол-денсилу з депонованою на поверхні амінокислотою триптофан, суміш перемішували до гомогенного стану, додавали 3,04 г поліізоціанату, 1,8 г етилацетату, перемішували до формування гомогенного розчину, виливали в плоскопаралельну форму із скла та отверджували при температурі 80 °C протягом 24 годин. До одержаного продукту додавали 90 г мономеру 2-гідроксіетилметакрилату, що містив ініціатор фотополімеризації, після чого проводили фотополімеризацію мономеру із застосуванням ультрафіолетової лампи з утворенням гідрофільного полімеру полі(2-гідроксіетилметакрилату). Кінцевий продукт мав вигляд прозорої еластичної плівки з білим опалесцентним забарвленням. Дослідження проводили, як описано в прикладі 1. Результати наведені в таблиці 3. Таблиця 1 Антибактеріальна активність нанокомпозитів відносно анаеробних штамів мікроорганізмів Нанокомпозит 1 Прототип Приклад 1 (містить метронідазол) Приклад 2 (містить декаметоксин) Приклад 4 (містить азотнонокисле срібло) Діаметри зон затримки росту в мм, М ± т, n=3 Clostridium Bacteroides fragilis Peptostreptococcus Fusobacteriun perfringens 28 ATCC 13/83 anaerobius 13 necrophorum 22 2 3 4 5 17,3±0,3 18,7±0,3 19,3±0,7 19,3±0,3 18,4±0,3 19,1±0,3 18,7±0,3 19,4±0,3 19,8±0,3 19,6±0,3 20,1±0,3 20,5±0,3 45 4 UA 97613 U Таблиця 2 Антибактеріальна активність нанокомпозитів відносно аеробних штамів мікроорганізмів Діаметри зон затримки росту в мм, М ± m, n=3 Basillus subtilis ATCC 6633 Candida albicans ATCC 653/885 1 2 3 Прототип Приклад 1 (містить метронідазол) 15,3±0,3 14,7±0,3 Приклад 2 (містить декаметоксин) 16,2±0,3 15,8±0,3 Приклад 4 (містить азотнонокисле 17,1±0,3 16,8±0,3 срібло) Нанокомпозит Таблиця 3 Фізико-механічні властивості нанокомпозитів та вивільнення біологічно активних сполук Нанокомпозитний матеріал Приклад 1 (містить метронідазол) Приклад 2 (містить декаметоксин) Приклад 3 (містить ZnSO4) Приклад 4 (містить AgNO3) Приклад 5 (містить амінокислоту гліцин) Приклад 6 (містить амінокислоту лізин) Приклад 7 (містить амінокислоту гістидин Приклад 8 (містить амінокислоту триптофан Приклад 9 (містить AgNO3 та метронідазол) Приклад 10 (містить ZnSO4 та амінокислоту гліцин) Приклад 11 (контрольний) Прототип 5 10 Напруга при Вивільнення Вивільнення Подовження Водопоглинання, розриві, БАС за 1 добу, БАС за 14 діб, при розриві, % % МПа % % 6,0 110,3 11.89 28,05 39,26 5,8 108,5 12,16 16,28 26,04 5,5 106,8 18.36 25,83 86,10 6,2 105,2 8.61 11,72 51,83 5,9 102,4 21.70 16,07 72,79 5,6 106,2 20,26 15,26 42,15 5,7 105,6 19,17 17,03 48,26 6,1 108,2 9.58 1,02 2,30 5,8 106,7 15,35 18,36 52,80 5,2 110,3 14,46 16,28 48,74 2,5 60,4 6,27 0,51 0,63 3,0 90,2 7,58 Джерела інформації: [1]. Patent № 5034461 (USA). Novel prepolymers useful in biomedical devices / Yu-Chin Lai, Louis J. Baccei; опубл. 23.07.91. [2]. Patent № 4424305 (USA). Surgical implants formed of polyurethane diacrylate composition / Francis E. Gould, Christian W. Johnston; опубл. 03.01.84. [3]. L.V. Karabanova et. al. Polyurethane/poly(2-hydroxyethyl methacrylate) semi-IPN for biomedical materials applications // J. Mater. Sci.: Materials in Medicine. - 2006. - № 12. - P. 12831296. 5 UA 97613 U ФОРМУЛА КОРИСНОЇ МОДЕЛІ 5 10 Нанокомпозитний матеріал для біомедичного застосування, що містить поліуретан та гідрофільний полімер метакрилового ряду, які формують взаємопроникні полімерні сітки з нанодоменною структурою, який відрізняється тим, що додатково містить модифікований нанорозмірний наповнювач пірогенний високодисперсний кремнезем з іммобілізованими на його поверхні антимікробними речовинами, вибраними з ряду метронідазол, декаметоксин, нанорозмірне срібло та їх суміші, і сполуками з біостимулюючими властивостями, вибраними з ряду амінокислот гліцин, лізин, гістидин, триптофан, або солями цинку, або солями срібла та їхніми сумішами при такому співвідношенні компонентів, мас. ч.: поліуретан 10-95 полі(2-гідроксіетилметакрилат) 5-90 модифікований нанорозмірний 1-20. наповнювач 15 6 UA 97613 U Комп’ютерна верстка Г. Паяльніков Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 7
ДивитисяДодаткова інформація
Автори англійськоюKarabanova Liudmyla Vasylivna, Herashchenko Ihor Ivanovych, Voronin Yevhen Pylypovich, Nosach Luidmyla Viktorivna
Автори російськоюКарабанова Людмила Васильевна, Геращенко Игорь Иванович, Воронин Евгений Филиппович, Носач Людмила Викторовна
МПК / Мітки
МПК: C08L 33/12, C08K 5/16, C08K 3/36
Мітки: нанокомпозитний, матеріал, біомедичного, застосування
Код посилання
<a href="https://ua.patents.su/9-97613-nanokompozitnijj-material-dlya-biomedichnogo-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Нанокомпозитний матеріал для біомедичного застосування</a>
Попередній патент: Спосіб одержання плівок цинк сульфіду
Наступний патент: Комбінована засипна забійка свердловини
Випадковий патент: Троакар-лапароліфт