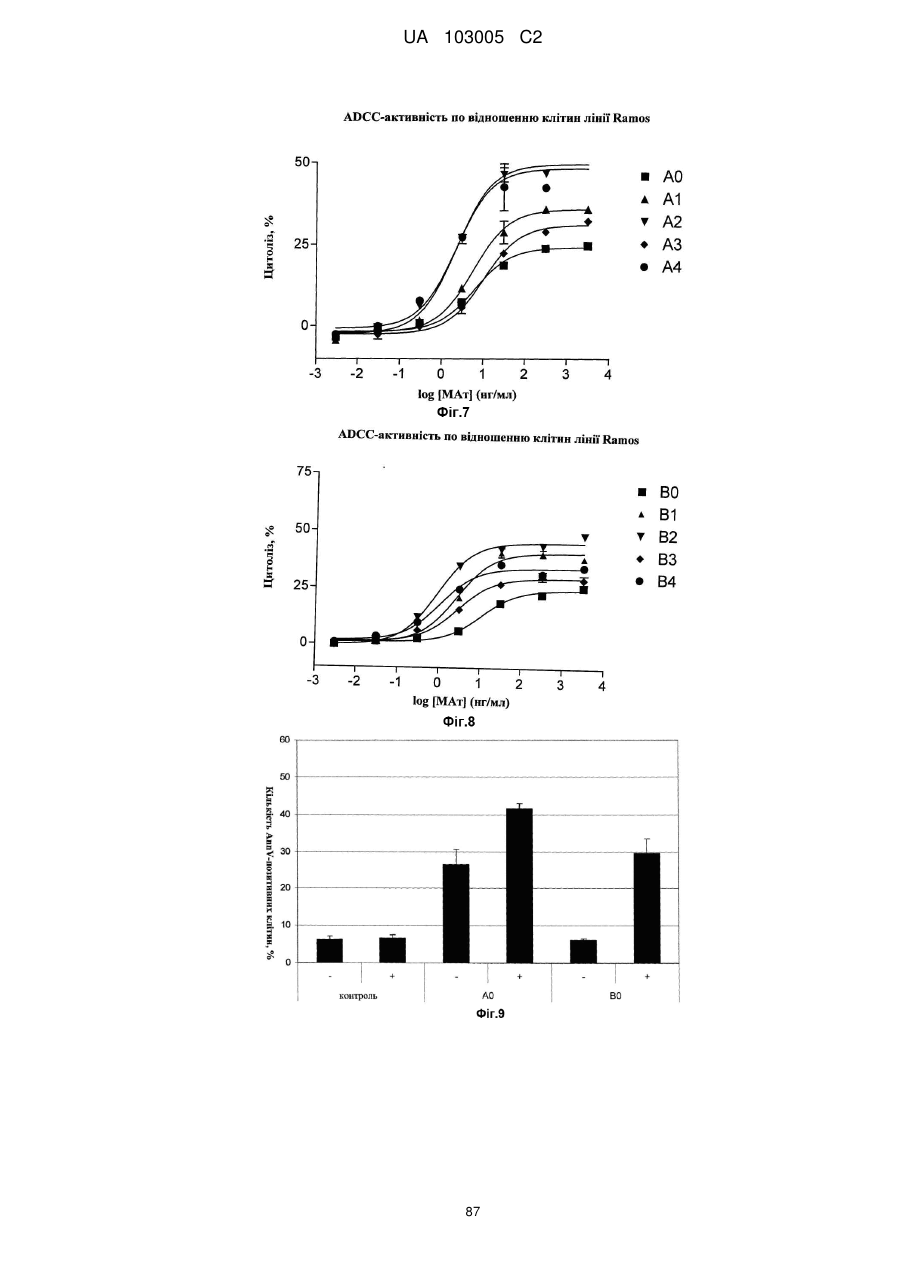
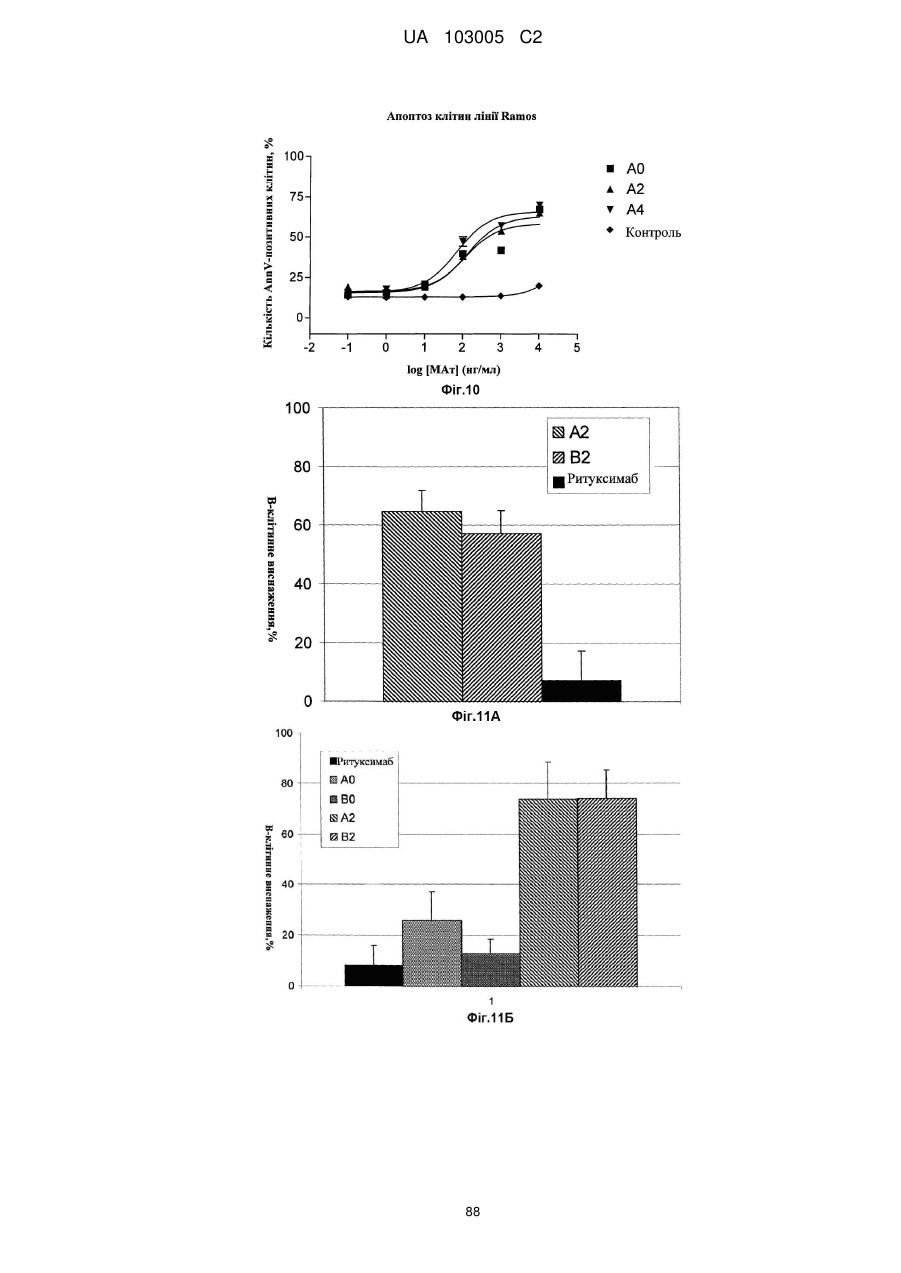
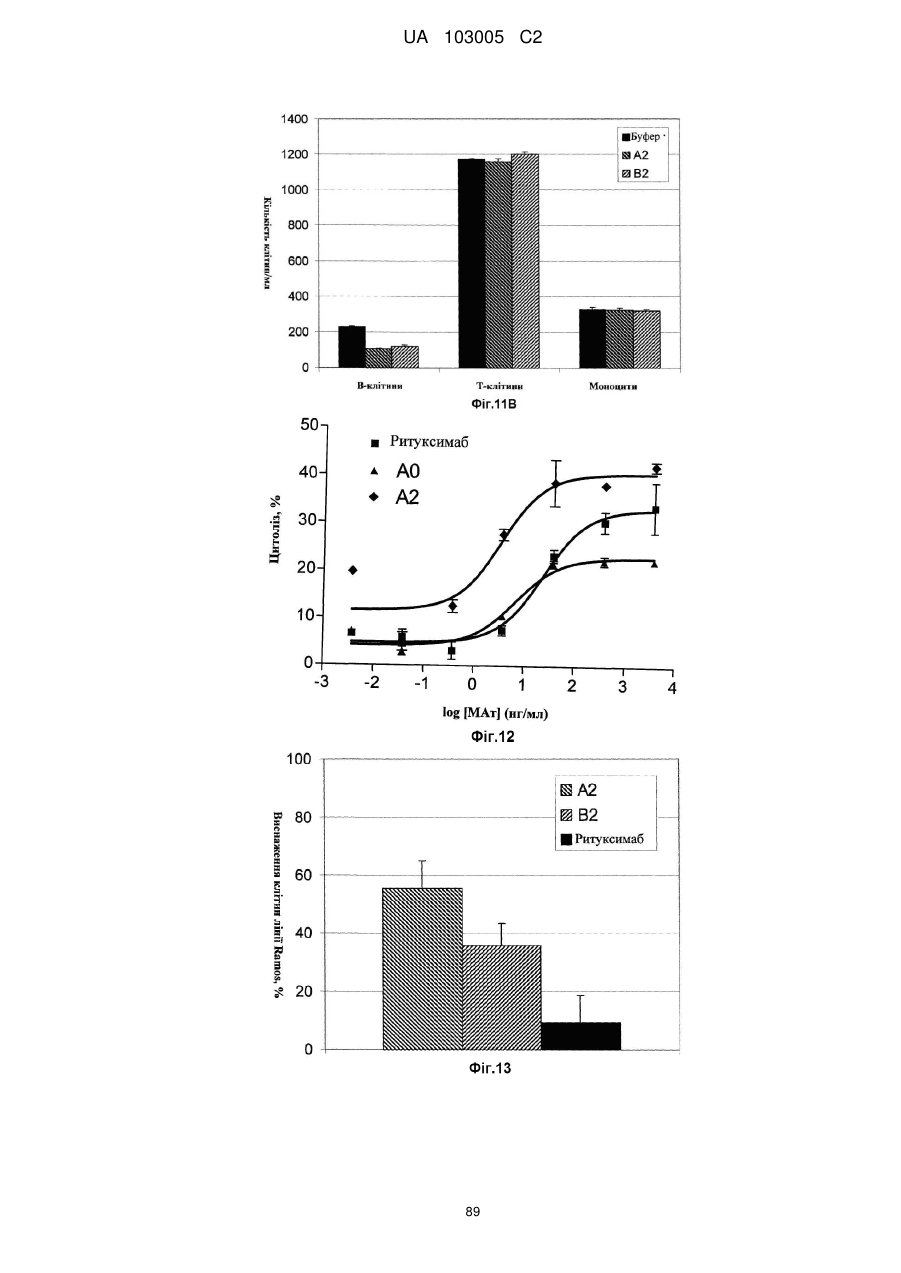
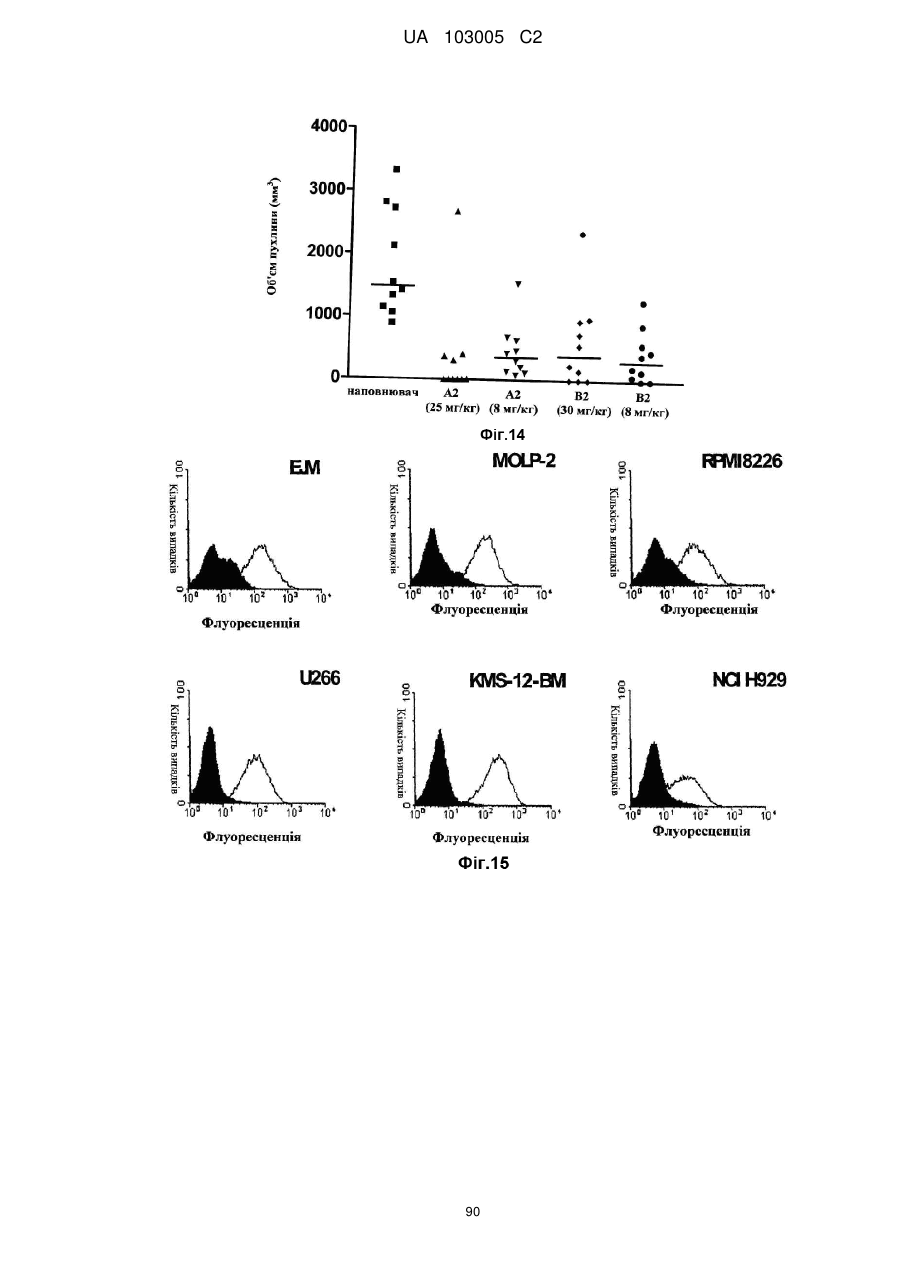
Антитіло до cd37
Номер патенту: 103005
Опубліковано: 10.09.2013
Автори: Хайдер Карл-Хайнц, Остерманн Елінборг, Боргес Ерік
Формула / Реферат
1. Молекула химерного антитіла, яка зв'язується з людським CD37 і яка характеризується тим, що вона містить:
I) варіабельну область важкого ланцюга, який містить амінокислотну послідовність, представлену в SEQ ID NO: 2;
II) варіабельну область легкого ланцюга, який містить амінокислотну послідовність, представлену в SEQ ID NO: 4;
ІІІ) константну область важкого та легкого ланцюгів людського походження.
2. Антитіло за п. 1, в якому
I) константна область важкого ланцюга є ланцюгом IgG1, a
II) константна область легкого ланцюга є каппа-ланцюгом.
3. Антитіло за п. 2, в якому зазначена константна область важкого ланцюга а) містить амінокислотну послідовність, представлену в SEQ ID NO: 24, і в якому константна область легкого ланцюга b) містить амінокислотну послідовність, представлену в SEQ ID NO: 26.
4. Антитіло за будь-яким з пп. 1-3, де зазначене антитіло має одну або декілька мутацій в Fc-фрагменті, які модулюють одну або декілька ефекторних функції.
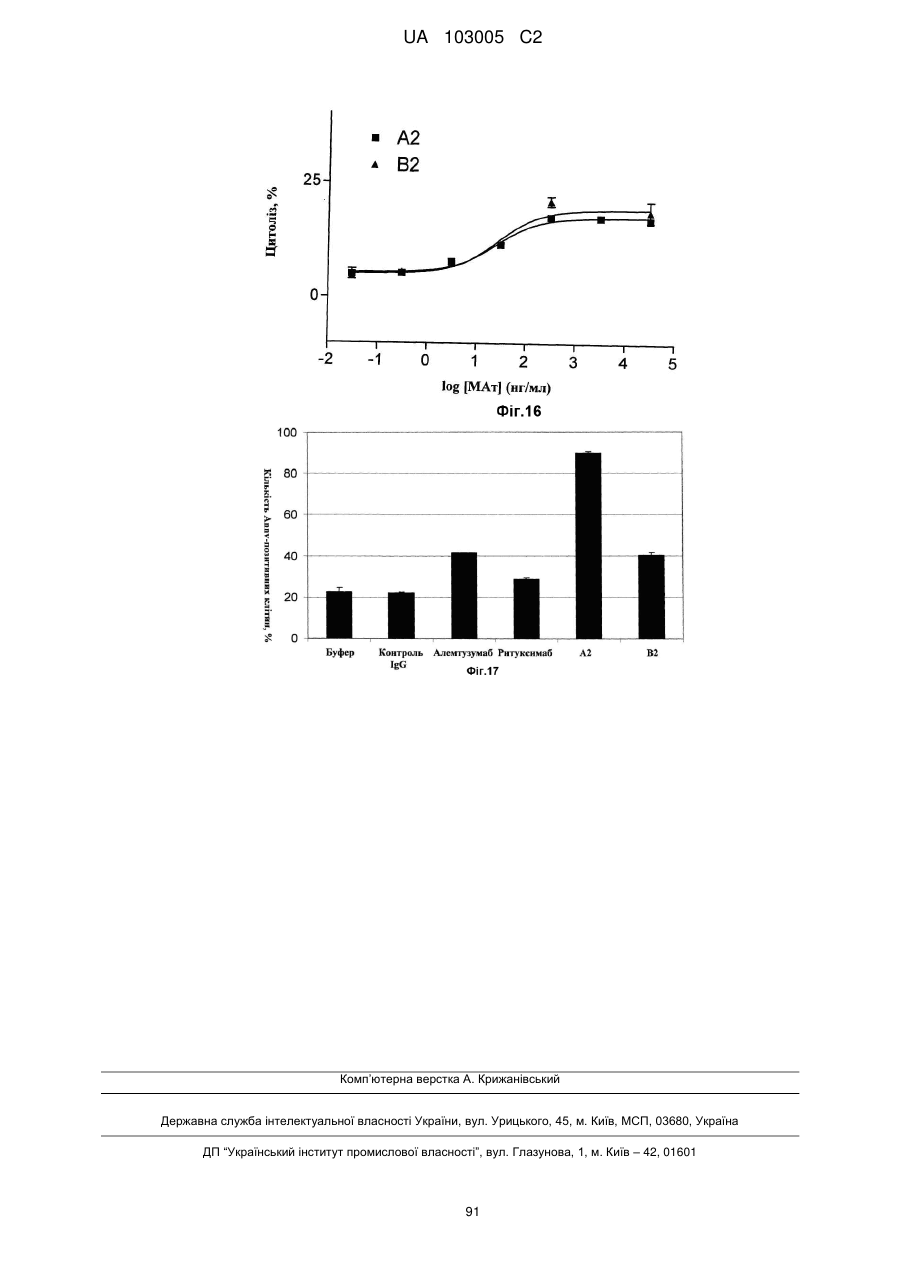
5. Антитіло за п. 4, в якому вказана модуляція ефекторної функції є підвищенням антитіло-обумовленої клітинозалежної цитотоксичності.
6. Антитіло за п. 4 або 5, в якому зазначена одна або декілька мутацій в Fc-фрагменті є одиночною заміною в положенні 332 згідно з індексом нумерації EU за Кеботом.
7. Антитіло за п. 4 або 5, в якому одна або декілька мутацій в Fc-фрагменті є комбінацією замін в положеннях 239 і 332 згідно з індексом нумерації EU за Кеботом.
8. Антитіло за п. 4 або 5, в якому зазначена одна або декілька мутацій в Fc-фрагменті є комбінацією замін в положеннях 236 і 332 згідно з індексом нумерації EU за Кеботом.
9. Антитіло за п. 4 або 5, в якому одна або декілька мутацій в Fc-фрагменті є комбінацією замін в положеннях 236, 239 і 332 згідно з індексом нумерації EU за Кеботом.
10. Антитіло за будь-яким з пп. 6-9, в якому зазначеними замінами є І332Е, S239D і G236А.
11. Антитіло, яке зв'язується з людським CD37 і має важкий ланцюг, що містить амінокислотну послідовність, представлену в SEQ ID NO: 28, та яке має легкий ланцюг, що містить амінокислотну послідовність, яка представлена в SEQ ID NO: 30.
12. Антитіло, яке зв'язується з людським CD37 і має важкий ланцюг, який містить амінокислотну послідовність, представлену в SEQ ID NO: 32, та яке має легкий ланцюг, що містить амінокислотну послідовність, яка представлена в SEQ ID NO: 34.
13. Молекула ДНК, що містить область, яка кодує варіабельну область важкого ланцюга антитіла за будь-яким з пп. 1-12.
14. Молекула ДНК за п. 13, в якій зазначена область, що кодує варіабельну область важкого ланцюга, злита з областю, що кодує константну область важкого ланцюга людського походження.
15. Молекула ДНК за п. 14, в якій людська константна область важкого ланцюга є областю IgG1.
16. Молекула ДНК за п. 15, в якій IgG1 кодується послідовністю, представленою в SEQ ID NO: 23, SEQ ID NO: 27 або SEQ ID NO: 31.
17. Молекула ДНК за будь-яким з пп. 14-16, в якій людська константна область важкого ланцюга має одну або декілька замін в Fc-фрагменті за будь-яким з пп. 6-9.
18. Молекула ДНК, що містить область, яка кодує варіабельну область легкого ланцюга антитіла за будь-яким з пп. 1-12.
19. Молекула ДНК за п. 18, в якій зазначена область, що кодує варіабельну область легкого ланцюга, злита з областю, що кодує константну область легкого ланцюга людського походження.
20. Молекула ДНК за п. 19, в якій константна область легкого ланцюга є областю каппа-ланцюга.
21. Молекула ДНК за п. 20, в якій легкий каппа-ланцюг кодується послідовністю, представленою в SEQ ID NO: 25, SEQ ID NO: 29 або SEQ ID NO: 33.
22. Експресійний вектор, що містить молекулу ДНК за будь-яким з пп. 13-17 і/або молекулу ДНК за будь-яким з пп. 18-21.
23. Клітина-хазяїн, що несе один або декілька векторів за п. 22.
24. Клітина-хазяїн за п. 23, що несе експресійний вектор, який містить молекулу ДНК за будь-яким з пп. 13-17, і другий експресійний вектор, який містить молекулу ДНК за будь-яким з пп. 18-21.
25. Клітина-хазяїн за п. 24, що є клітиною ссавця.
26. Спосіб одержання антитіла за будь-яким з пп. 1-12, що полягає в тому, що трансфектують клітину-хазяїн ссавця одним або декількома векторами за п. 22, культивують клітину-хазяїн і виділяють і очищають молекулу антитіла.
27. Фармацевтична композиція, що містить як діючу речовину одну або декілька молекул антитіл до CD37 за будь-яким з пп. 1-12 і фармацевтично прийнятний носій.
28. Фармацевтична композиція за п. 27, що містить також один або декілька додаткових терапевтичних засобів.
29. Фармацевтична композиція за п. 28, в якій один або декілька додаткових терапевтичних засобів вибрані з агентів, мішенню яких є В-клітинний антиген, відмінний від CD37.
30. Фармацевтична композиція за п. 29, в якій В-клітинний антиген є CD20.
31. Фармацевтична композиція за п. 28 або 29, в якій один або декілька додаткових терапевтичних засобів вибрані з агентів, які індукують апоптоз.
32. Фармацевтична композиція за п. 31, в якій вказаний агент є модулятором TRAIL-рецептора.
33. Фармацевтична композиція за будь-яким з пп. 27-32, призначена для виснаження В-клітин, на поверхні яких експресується CD37.
34. Фармацевтична композиція за п. 33, призначена для лікування В-клітинних злоякісних захворювань.
35. Фармацевтична композиція за п. 34, де В-клітинне злоякісне захворювання вибране з групи, що включає В-клітинну неходжкінську лімфому, В-клітинний хронічний лімфолейкоз і множинну мієлому.
36. Фармацевтична композиція за п. 33, призначена для лікування аутоімунних або запальних захворювань, в патології яких беруть участь В-клітини.
37. Спосіб виснаження експресуючих CD37 В-клітин в популяції клітин, що полягає в тому, що обробляють популяцію клітин молекулою антитіла за будь-яким з пп. 1-12 або фармацевтичною композицією, яка містить вказану молекулу антитіла.
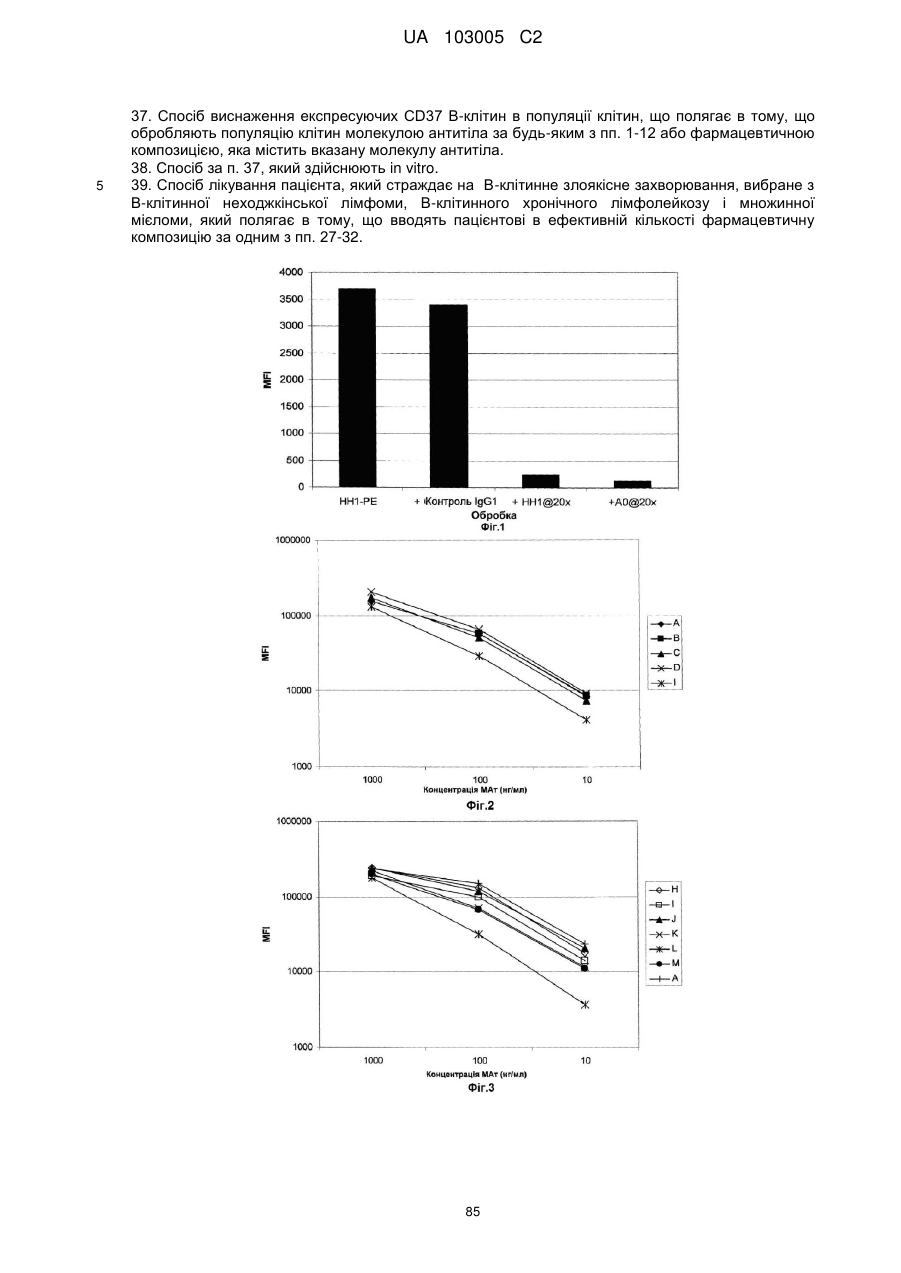
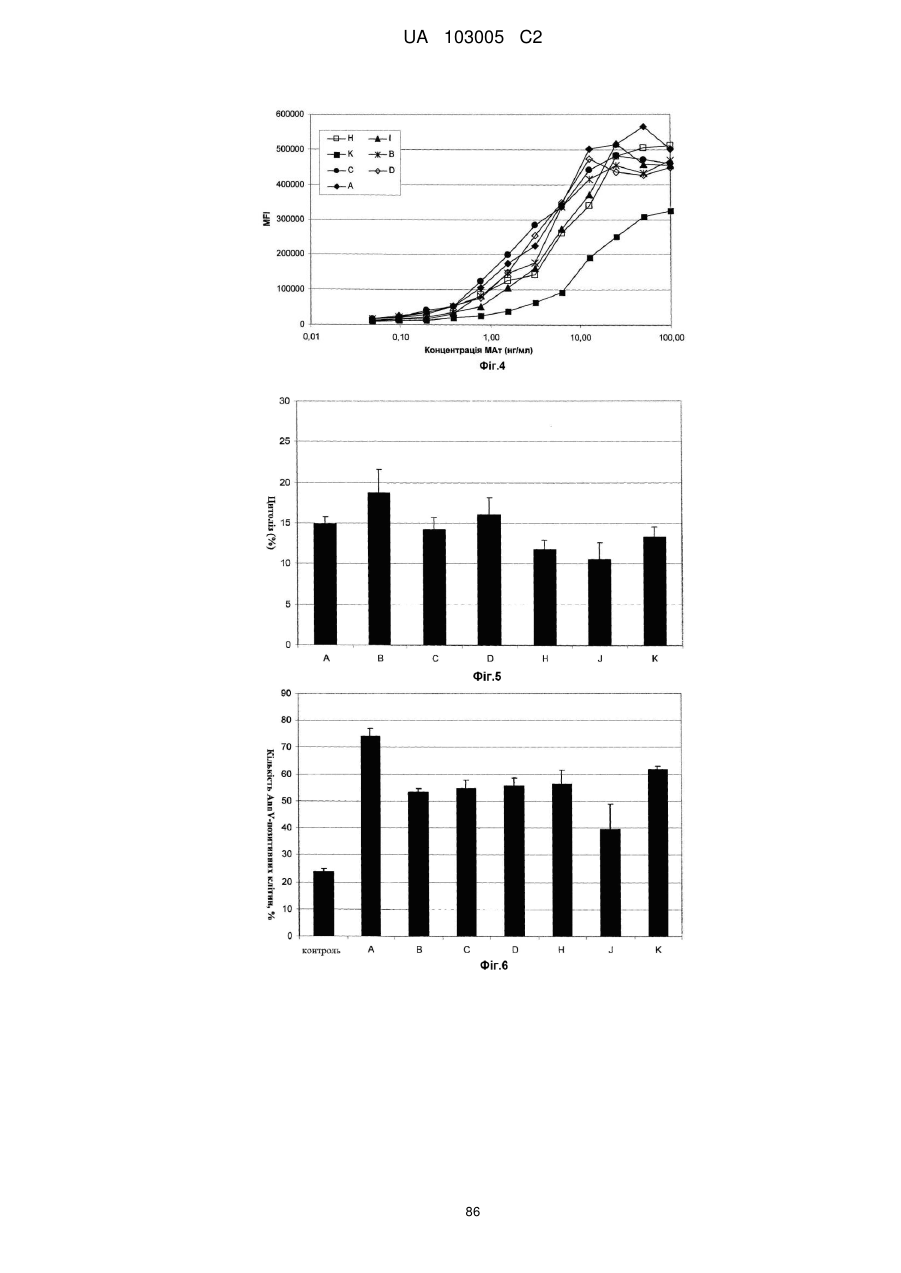
38. Спосіб за п. 37, який здійснюють in vitro.
39. Спосіб лікування пацієнта, який страждає на В-клітинне злоякісне захворювання, вибране з В-клітинної неходжкінської лімфоми, В-клітинного хронічного лімфолейкозу і множинної мієломи, який полягає в тому, що вводять пацієнтові в ефективній кількості фармацевтичну композицію за одним з пп. 27-32.
Текст
Реферат: Винахід належить до молекули химерного антитіла до CD37, молекул ДНК, що кодують варіабельні області важкого та легкого ланцюгів антитіла до CD37, фармацевтичної композиції, що містить антитіло до CD37, способу виснаження експресуючих CD37 В-клітин та способу лікування пацієнта, що страждає В-клітинним злоякісним захворюванням за допомогою антитіла до CD37. UA 103005 C2 (12) UA 103005 C2 UA 103005 C2 5 10 15 20 25 30 35 40 45 50 55 60 Введення Дійсний винахід належить до імунотерапії, основаної на B-клітинному виснаженні. Зокрема, дійсний винахід належить до молекул антитіл до CD37, призначеним для застосування у вказаній терапії, наприклад, для лікування В-клітинних злоякісних і аутоіммунних станів. Імунотерапія на основі моноклональних антитіл (МАт) є безпечним і вибірковим методом лікування раку і інших захворювань. Зокрема, роль моноклональних антитіл в різних терапіях, спрямованих на B-клітинне виснаження, які призначені, наприклад, для лікування B-клітинних злоякісних захворювань, підвищилась з появою ритуксимаба (Rituxan®), антитіла до антигена CD20, присутньому на B-клітинній поверхні. У багаточисельних дослідженнях підтверджена ефективність ритуксимаба при його застосуванні як індивідуальний агент і як компонент комбінованої терапії при неходжкинській лімфомі (NHL) низької міри злоякісності (Hiddemann та ін., 2005а; Hiddemann та ін., 2005б; Hainsworth, 2004; McLaughlin та ін., 1998), лімфоми з клітин зони мантії (Forstpointner та ін., 2004; Kahl та ін., 2006; Foran та ін., 2000; Howard та ін., 2002; Romaguera та ін., 2005), дифузної великоклітинної лімфоми (DLCL) (Coiffier та ін., 1998; Feugier та ін., 2005), і лейкозу/лімфоми Беркитта (Thomas та ін., 2006). Проте відповідь на терапію була виявлена лише у підпопуляції пацієнтів і у більшості з них виявлений рецидив після лікування ритуксимабом. Таким чином, розглядається можливість застосування нових терапевтичних засобів, мішенню яких є B-клітини, потенційно ефективніших, ніж терапія, спрямована на CD20, які призначені для лікування B-клітинних злоякісних захворювань (Zhao та ін., 2007). Антиген CD37 є антигеном клітинної поверхні, який, до теперішнього часу не розглядався як мішень при B-клітинних злоякісних захворюваннях в такій же мірі, як і антиген CD20. CD37, який є представником суперсімейства тетраспанинов, є високоглікозілірованною молекулою клітинної поверхні, що характеризується наявністю 4 трансмембранних доменів і 2 позаклітинних петель. CD37 eкспресується практично виключно на зрілих B-клітинах, при цьому встановлено, що найбільш високий рівень експресії має місце на В-клітинах периферичної крові, нижчі рівні характерні для плазматичних клітин і рівні, що не виявляються, для CD10+-Вклітин-попередників в кістковому мозку. Виявлений також низький рівень експресії CD37 на Тклітинах, що покояться і активованих, гранулоцитах і моноцитах. При B-клітинному неоплазмі експресія CD37 виявлена в основному при агресивній неходжкинськой лімфомі (NHL) і хронічному лімфолейкозе (CLL). Високий рівень експресії CD37 виявлений також при лімфомі з клітин зони мантії (MCL). Вказана схема експресії робить CD37 привабливою мішенню для опосередковуваної антитілом терапії раку. CD37 вперше описаний в 1986 р. і охарактеризований з використанням мишачого моноклонального антитіла MB-1 (Link та ін., 1986). Фізіологічна роль CD37 залишається невідомою. У мишей з дефіцитом CD37 не виявлено змін в розвитку і складі клітин лімфоїдних органів, але вони мають знижені рівні IgG1 і ослаблені -/опосередковані Т-клітинами імунні відповіді (Knobeloch та ін., 2000). Дослідження CD37 -Tклітин дозволяє передбачити участь CD37 в проліферації T-клітин (van Spriel та ін., 2004). Описано, що CD37 eкспресується на злоякісних B-клітинах при різних захворюваннях. CD37 eкспресується при більшості пов'язаних із зрілими В-клітинами злоякісних захворювань типа лімфоми Беркитта, фолікулярної лімфоми і лімфоцитарної лімфоми (Link та ін., 1986). Високі рівні експресії CD37 виявлені при волосковоклітинному лейкозі і в зразках, отриманих з організму пацієнтів, страждаючих хронічним лімфолейкозом (CLL) і різними підтипами неходжкинської лімфоми (NHL), включаючи лімфому з клітин зони мантії (MCL) (Schwartz-Albiez та ін., 1988; Barrena та ін., 2005). У одному з досліджень описано застосування мікромасиву антитіл для іммунофенотипування CD37, при цьому було встановлено, що CD37 є хорошим засобом дискримінації злоякісних CLL-клітин (високий рівень експресії CD37) і здорових лімфоцитів периферичної крові (PB) (низький рівень експресії CD37) (Belov та ін., 2001). Скріплення специфічного у відношенні CD37 МАт з раковими клітинами може "запускати" різні механізми дії: по-перше, після зв'язування антитіла з позаклітинним доменом антигена CD37 воно може активувати каскад комплементу, що наводить до лізису клітини-мішені. Подруге, антитіло до CD37 може наводити до антитіло-обумовленої клітиннозалежної цитотоксичності (ADCC) відносно клітини-мішені, що має місце після того, як Fc-фрагмент зв'язаного антитіла розпізнається відповідними рецепторами на цитотоксичних клітинах імунної системи. По-третє, антитіло може змінювати здатність B-клітин реагувати на антиген або інші стимули. І, нарешті, антитіло до CD37 може ініціювати запрограмовану загибель клітин (апоптоз). МАт до CD37 MB-1 оцінювали в двох дослідах з використанням радіоімунотерапії на страждаючих B-NHL пацієнтах (B-клітинна неходжкинська лімфома; Press та ін., 1989; Kaminski 1 UA 103005 C2 131 5 10 15 20 25 30 35 40 45 50 55 60 та ін., 1992). У одному досвіді вводили в терапевтичних дозах I-MB-1 6 пацієнтами з рецидивом NHL і при цьому у всіх 6 пацієнтів виявлена клінічна повна ремісія (CR), медіанна тривалість якої складала 7 місяців. Слід зазначити, що у двох з шести пацієнтів клінічний регрес виявлений вже при введенні MB-1 із застосуванням лише слідів радіоактивного ізотопу (як мітки), що дозволяє передбачити наявність безпосередньої протипухлинної дії самого антитіла. У другому досвіді мічене радіоактивним ізотопом MB-1 застосовували для лікування пацієнтів, страждаючих рефрактором NHL, і у 3 з 9 пацієнтів, що вивчаються виявлено об'єктивні відповіді обмеженої тривалості (Kaminski та ін., 1992). У обох дослідах виявлено швидке і короткочасне виснаження периферичних B-клітин після ін'єкції міченого слідовими кількостями радіоактивної мітки антитіла MB-1. Ці дані дозволяють зробити висновок про цитотоксичну активність, властиву самому антитілу MB-1. В цілому, ці клінічні досліди підкреслюють можливість цілеспрямованої дії на CD37 з метою лікування B-клітинних злоякісних захворювань і свідчать про потенційну клінічну придатність терапії на основі антитіл до CD37. Отримано експериментальний доказ з використанням CD37-специфічних нагадуючих антитіло одноланцюжкових молекул ("Small Modular ImmunoPharmaceutical", SMIP) того, що лікування за допомогою цих молекул індукує апоптоз in vivo і уповільнює зростання лімфоми Беркитта на моделі ксенотрансплантату in vivo. В даний час описана антиапоптозная активність рекомбінантної анти-CD37 SMIP Tru16.4 фірми Trubiony (Zhao та ін., 2004). Tru 16.4 індукує незалежний від каспаз апоптоз первинних CLL-клітин, отриманих з організму страждаючих пухлиною пацієнтів. Індукція апоптозу цих клітин виявилася вищою, ніж при застосуванні ритуксимаба, і порівнянна з індукцією апоптозу, що викликається антагоністом CD52 алемтузумабом. Міра індукції апоптозу була прямо пропорційна рівню експресії CD37 на клітинній поверхні, і її можна було підвищувати зшиванням з антитілом до людського IgG. Кореляція експресії CD37 і ADCC продемонстрована на клітинних лініях in vivo. При оцінці на мишачій моделі лімфоми Беркитта (Raji) обробка scFv до CD37 володіла прийнятною терапевтичною ефективністю (Zhao та ін., 2007). Ці дані є першим доказом того, що спрямована дія на CD37 є перспективним підходом для цілеспрямованої протипухлинної терапії, пов'язаної з індукцією апоптозу і ADCC. Таким чином, було встановлено, що антиген CD37 часто eкспресується на пухлинних клітинах при деяких людських B-клітинних злоякісних станах і на зрілих здорових B-лімфоцитах і що терапія, основана на застосуванні антитіл до CD37, може бути перспективним підходом до лікування B-клітинних злоякісних станів. Виснаження CD37-позитивних здорових B-клітин не розглядається як маюче вирішальне значення, оскільки клінічні дані, отримані для багаточисельних пацієнтів, свідчать про те, що навіть пролонговане B-клітинне виснаження аж до 6 місяців при застосуванні МАт до CD20 не призводило до істотного зниження рівнів IgG у сироватці або до підвищення риску виникнення інфекцій (Van der Kolk та ін., 2002). Хоча встановлено, що антитіла до CD37 і описані вище антитіла, що нагадують молекули (MB-1 і SMIP Tru16.4) володіють протипухлинною ефективністю у відношенні B-клітинних злоякісних захворювань і можуть надавати цілеспрямовану дію на CD37, все ще існує потреба в альтернативних інгібіторах CD37 з метою підвищення ефективності терапії, основаної на Bклітинному виснаженні. Короткий виклад суті винаходу Об'єктом винаходу є нові антагоністи CD37, призначені для лікування B-клітинних злоякісних захворювань і інших порушень, які реагують на виснаження CD37-позитивних В-клітин. Крім того, об'єктом винаходу є антитіла до CD37 з покращуваними ефекторними функціями. Зокрема, винахід належить до МАт до CD37, що володіє обумовленою для антитіла клітиннозалежною цитотоксичністю (ADCC). Для вирішення завдання, лежачого в основі винаходу, застосовували мишаче моноклональне антитіло до CD37 як вихідне антитіло для створення химерних і гуманізованих антитіл до CD37, які можна застосовувати для лікування людини. Першим об'єктом дійсного винаходу є молекула антитіла, яка зв'язується з людським CD37 і яка виведена з а) мишачого моноклонального антитіла, що характеризується тим, що воно містить I) варіабельну область важкого ланцюга, який містить амінокислотну послідовність, представлену в SEQ ID NO: 2; і II) варіабельну область легкого ланцюга, який містить амінокислотну послідовність, представлену в SEQ ID NO: 4; або яка виведена з б) нелюдського антитіла, яке розпізнає такий же епітоп людського CD37, що і антитіло, вказане в підпункті a), або розпізнає епітоп, який розташований поблизу (примикає) або перекриває вказаний епітоп; 2 UA 103005 C2 5 10 15 20 25 30 35 40 45 50 55 де молекула антитіла є химерним або гуманізованим антитілом. Як буде зрозуміле з викладеного нижче, антитіло "виведене" з іншого антитіла, тобто вихідне антитіло, означає, що антитіло створене за допомогою модифікації вихідного антитіла згідно з описаним нижче методом. У переважному варіанті здійснення винаходу молекула антитіла є молекулою химерного або гуманізованого антитіла, виведеною з вихідного антитіла, вказаного в підпункті a). Антитіло, що має родинну послідовність, позначене як G28.1, і воно описане в WO 2005/017148. Вихідне антитіло категорії, описаної в підпункті б), можна, наприклад, вибирати з CD37специфічних антитіл, типа антитіла G28.1, антигеном якого є CD37, характеристики яких описані в працях третьої робочої групи по HLDA (людські лейкоцитарні диференційні антигени); ці антитіла позначені як HD28, HH1, BI14, F97-3G6 (Ling і MacLennan, 1987). Інші описані CD37специфічні антитіла включають RFB-7, Y29/55, MB-1, M-B371, M-B372 і IPO-24. Згідно даним Moldenhauer, 2000 і Schwartz-Albiez та ін., 1988, всі ці антитіла (включаючи G28.1) розпізнають однаковий або близький, або такий, що перекривається епітоп CD37. Schwartz-Albiez та ін., 1988, встановили, що цей епітоп розташований у вуглеводному фрагменті CD37. Деякі з вищезгаданих антитіл надходять у продаж, наприклад, HH1 (фірма SantaCruz), RFB-7 (фірма Biodesign), Y29/55 (фірма Biogenesis), M-B371 (фірма BD Biosciences), M-B372 (фірма SantaCruz) і IPO-24 (фірма AbCam). До інших CD37-специфічних антитіл відносяться S-B3 (фірма Biosys), NMN46 (фірма Chemicon) і ICO-66 (фірма Bioprobe). Чи розпізнає антитіло такий же епітоп, що і G28.1, можна визначати за допомогою конкурентних аналізів скріплення або радіоіммуноаналізів перехресного інгібірування, описаних у Moldenhauer та ін., 1987 і Moldenhauer, 2000. Конкурентне скріплення можна визначати, наприклад, з допомогою ELISA, з використанням планшетів, сенсибілізованих білком CD37 або пептидами CD37 або CD37-позитивними клітинами (клітинний ELISA), і оцінки скріплення біотінилированого антитіла у присутності конкурентного антитіла-кандидата. У присутності конкурентного антитіла або отриманого з антитіла фрагмента скріплення біотінилированого G28.1 (або іншого антитіла, для якого відомо, що воно розпізнає такий же епітоп) зменшується у разі, коли антитіла розпізнають загальний епітоп. Для ідентифікації пептидного епітопа G28.1 фрагментів або короткі поліпептиди або рекомбінантні білки, отримані з послідовності CD37, можна синтезувати або отримувати і оцінювати скріплення G28.1 з вказаними пептидами/поліпептидами з допомогою ELISA. Конкурентне скріплення можна оцінювати також з допомогою FACS-аналізів, описаних в прикладах. Антитіло, вказане в підпункті б), можна застосовувати аналогічно G28.1 як вихідне антитіло з метою створення химерних або гуманізованих молекул антитіл. Вихідне антитіло категорії, вказаної в підпункті б), можна створювати також de novo з використанням пептидів або білкових фрагментів, що містять відповідний епітоп, або молекул ДНК, кодуючих вказані пептиди/фрагменти відповідно, для імунізації із одержанням антитіл, що володіють реактивністю відносно того ж епітопа, що і G28.1. Вихідне антитіло, вказане в підпункті б), можна отримувати також шляхом імунізації цілими клітинами, що несуть відповідний епітоп; отримані для цієї мети клітини гібридоми потім можна піддавати скринінгу відносно конкурентного скріплення антитіл, що секретуються. Поняття "молекула антитіла до CD37" належить до антитіл до CD37 і фрагментів антитіл до CD37, а також до кон'югатів, включаючих молекули антитіл. Згідно із справжнім винаходом антитіла включають химерні моноклональні і гуманізовані моноклональні антитіла. Поняття "антитіло", яке використовують з взаємозамінним поняттям "молекула антитіла", включає повнорозмірні імуноглобуліни (у тому вигляді, в якому вони продукуються лімфоцитами і, наприклад, присутні в сироватці крові), моноклональні антитіла, що секретуються клітинними лініями гібридом, поліпептиди, що продукуються шляхом рекомбинантної експресії в клітинахгосподарях, які характеризуються специфічністю скріплення імуноглобулінів або моноклональних антитіл, і молекули, які виведені з антитіл шляхом модифікації або додаткового процесингу із збереженням їх специфічності скріплення. У одному з варіантів здійснення винаходу молекула антитіла до CD37 є химерним антитілом, що характеризується тим, що воно містить I) варіабельну область важкого ланцюга, який містить амінокислотну послідовність, представлену в SEQ ID NO: 2; і II) варіабельну область легкого ланцюга, який містить амінокислотну послідовність, представлену в SEQ ID NO: 4; III) константні області важкого і легкого ланцюгів людського походження. 3 UA 103005 C2 5 10 15 20 25 30 35 40 45 50 55 60 Конструювання і одержання химерних мишастих/людських антитіл добре відомо в даній галузі (Boulianne та ін., 1984). Як правило, варіабельні області нелюдського антитіла пов'язують щонайменше з частиною (FC) константної області людського імуноглобуліну. Послідовності ДНК людських константних областей можна виділяти згідно з методами, добре відомими в даній галузі, з різних людських клітин, переважно з іморталізованих B-клітин (див. Kabat та ін., 1991; і WO 87/02671). Молекули антитіла можуть містити всю константну область або її частину, якщо вони володіють специфічністю зв'язування з антигеном CD37 і Fc-рецепторами. Вибір типа і довжини константної області залежить від того, чи потрібні ефекторні функції типа фіксації комплементу або обумовленої для антитіла клітиннозалежної токсичності, і від необхідних фармакологічних властивостей молекули антитіла. У деяких варіантах здійснення винаходу молекула антитіла, пропонована у винаході, є химерним CD37-специфічним антитілом, яке містить варіабельну область важкого ланцюга нелюдського антитіла, вказаного в підпункті a) або б), злиту з константною областю важкого ланцюга людського IgG1, і варіабельну область легкого ланцюга нелюдського антитіла, вказаного в підпункті a) або б), злиту з людською константною областю легкого капа-ланцюга. Згідно з іншим варіантом здійснення винаходу молекула антитіла є химерним CD37специфічним антитілом, яке містить варіабельну область важкого ланцюга, представлену в SEQ ID NO: 2, злиту з константною областю важкого ланцюга людського IgG1, яка є молекулою IgG1, послідовність якої представлена в SEQ ID NO: 24 (кодуюча послідовність ДНК: SEQ ID NO: 23), або виведену з неї молекулу мутанта IgG1, і яка містить варіабельну область легкого ланцюга, представлену в SEQ ID NO: 4, злиту з людською константною областю легкого капа-ланцюга, послідовність якого представлена в SEQ ID NO: 26 (кодуюча послідовність ДНК: SEQ ID NO: 25). Інші людські константні області, вживані для створення химерного нелюдського вихідного антитіла, вказаного в підпункті a) або б), відомі фахівцям в даній галузі, наприклад, можна використовувати IgG2, IgG3, IgG4, IgA, IgE або IgM (замість IgG1) або лямбда-ланцюг (замість капа-ланцюга). Константні області можуть бути химерними, наприклад, бути химерою важкого ланцюга IgG1/IgG2 або IgG1/IgG3. У деяких варіантах здійснення винаходу молекула антитіла до CD37 є гуманізованим антитілом, для якого є характерним наступне: I) CDR, що входять у варіабельну область важкого ланцюга, мають послідовність, представлену в SEQ ID NO: 2, і II) CDR, що входять у варіабельну область легкого ланцюга, мають послідовність, представлену в SEQ ID NO: 4, III) каркасні ділянки, що підтримують вказані CDR, виведені з людського антитіла IV) константні області важкого і легкого ланцюгів отримані з людського антитіла. Гуманізовані форми нелюдських (наприклад, мишастих, щурячих або кролячих) антитіл є імуноглобулінами, імуноглобуліновими ланцюгами або їх фрагментами (такими як Fv, Fab, Fab', F(ab')2 або іншими антигензв'язуючими молекулами, що несуть підпослідовності антитіл), які містять мінімальні послідовності, виведені з нелюдського імуноглобуліну. Гуманізовані антитіла включають імуноглобуліни (з антитіла-реципієнта), в яких залишки з гіперваріабельних ділянок (CDR) антитіла-реципієнта замінені залишками з CDR антитіл з видів окрім людини (антитіло-донор), таких як мишаче, щуряче або кроляче антитіло, що володіє необхідною специфічністю, афінністю і потенціалом. В деяких випадках залишки каркасної ділянки Fv людського імуноглобуліну замінюють на відповідні нелюдські залишки. У гуманізованих антитілах, пропонованих у винаході, послідовності, що кодують CDR нелюдського початкового антитіла, вказаного в підпункті a) або б), трансплантують у відповідні гени важких і легких ланцюгів людського імуноглобуліну. Під "гіперваріабельними ділянками" (CDR) моноклонального антитіла мають на увазі амінокислотні послідовності, що беруть участь в специфічному скріпленні антигена згідно з номенклатурою Кеботу (Kabat та ін., 1991), які узгоджуються з номенклатурою Chothia і Lesk, 1987. З послідовностей варіабельних областей, представлених в SEQ ID NO: 2 і SEQ ID NO: 4, послідовність CDR визначають загальноприйнятими методами на основі пошуку на основі особливостей послідовностей з використанням бази даних послідовностей Кеботу. Методи одержання гуманізованих антитіл добре відомі фахівцям в даній галузі, у тому числі описані в US 5225539; US 6548640 і US 6982321. Відповідні залишки каркасної ділянки антитіла з трансплантованим CDR можна перетворювати на мишачі залишки з метою підвищення афінності до скріплення. Як описано вище, на основі відомих в даній галузі методів експертові має бути очевидне, як отримувати CDR з конкретного нелюдського антитіла, як вибирати і отримувати відповідні гени людських імуноглобулінів, трансплантувати CDR у ці гени, модифікувати відібрані каркасні ділянки, 4 UA 103005 C2 5 10 15 20 25 30 35 40 45 50 55 експресувати антитіло з трансплантованим CDR у відповідних клітинах-господарях, наприклад, клітинах яєчника китайського хом'яка (CHO), і як оцінювати отримані рекомбінантні антитіла відносно афінності до скріплення і специфічності. Для одержання гуманізованого антитіла вирізують антигензв'язуючі сайти, які утворені з CDR важкого ланцюгу і CDR легкого ланцюгу, з ДНК клітин, що секретують моноклональне антитіло гризуна (миші) і трансплантують в ДНК, що кодує каркасну ділянку людського антитіла. Альтернативно методу трансплантації CDR нелюдські, зокрема мишачі, антитіла до CD37 можна гуманізувати за допомогою так званої технології "шліфовки", при якій каркасні ділянки гризунів залишають в незміненому вигляді за винятком виставлених на поверхні залишків, як описано в US 5639641. Наступним об'єктом винаходу є гуманізовані антитіла, послідовність варіабельної області важкого ланцюга яких представлена в SEQ ID NO: 6, послідовність варіабельної області легкого ланцюга вибрана з групи послідовностей, представлених в SEQ ID NO: 12, SEQ ID NO: 14, SEQ ID NO: 16, SEQ ID NO: 18, SEQ ID NO: 20 і SEQ ID NO: 22. Наступним об'єктом винаходу є гуманізовані антитіла, послідовність варіабельної області важкого ланцюга яких представлена в SEQ ID NO: 8, послідовність варіабельної області легкого ланцюга вибрана з групи послідовностей, представлених в SEQ ID NO: 12, SEQ ID NO: 14, SEQ ID NO: 16, SEQ ID NO: 18, SEQ ID NO: 20 і SEQ ID NO: 22. Наступним об'єктом винаходу є гуманізовані антитіла, послідовність варіабельної області важкого ланцюга яких представлена в SEQ ID NO: 10, послідовність варіабельної області легкого ланцюга вибрана з групи послідовностей, представлених в SEQ ID NO: 12, SEQ ID NO: 14, SEQ ID NO: 16, SEQ ID NO: 18, SEQ ID NO: 20 і SEQ ID NO: 22. Описані вище гуманізовані антитіла представлені в таблиці 1. У певних варіантах здійснення винаходу гуманізоване антитіло несе константну область важкого ланцюга людського IgG1 і константну область людського легкого капа-ланцюга. Як описано вище для химерних антитіл, константні області можна вибирати з інших класів і підкласів антитіл. У певних варіантах здійснення винаходу в гуманізованих антитілах, пропонованих у винаході, константна область важкого ланцюга людського IgG1 є молекулою IgG1, послідовність якої представлена в SEQ ID NO: 24, або виведену з неї молекулу мутанта IgG1, а константна область людського легкого капа-ланцюга має послідовність, представлену в SEQ ID NO: 26. Молекули антитіл до CD37, пропоновані у винаході, можуть бути також варіантами антитіл, які мають амінокислотні послідовності, представлені в переліку послідовностей. За допомогою доступних загальноприйнятих методів фахівець в даній галузі може отримувати, оцінювати і використовувати функціональні варіанти вказаних вище антитіл. Прикладами є варіанти антитіл, у яких змінено щонайменше одне положення в CDR і/або каркасній ділянці, варіанти антитіл із замінами однієї амінокислоти в каркасній ділянці, що є відхиленням від послідовності зародкової лінії, антитіла з консервативними амінокислотними замінами, антитіла, які кодуються молекулами ДНК, що гібридизуються в строгих умовах з молекулами ДНК, представленими в переліку послідовностей, які кодують варіабельні області ланцюгів антитіла. З врахуванням властивостей індивідуальних амінокислот можна здійснювати раціональні заміни із одержанням варіантів антитіл, які зберігають загальну молекулярну структуру вихідного антитіла. Амінокислотні заміни, тобто "консервативні заміни", можна здійснювати, наприклад, на основі схожості полярності, заряду, розчинності, гідрофобної, гідрофільної і/або амфіпатичної природи відповідної амінокислоти. Фахівцеві в даній галузі відомі загальноприйняті амінокислотні заміни, що описані, наприклад, в WO 2007/042309, і методи одержання вказаних модифікованих антитіл. На основі генетичного коду і методів рекомбінації і синтезу ДНК можна з використанням загальноприйнятих методів створювати молекули ДНК, що кодують варіанти антитіл з однією або декількома консервативними амінокислотними замінами, і легко отримувати відповідні антитіла. В порівнянні з антитілом, яке має варіабельні області ланцюгів, послідовність яких представлена в переліку послідовностей, варіанти антитіл, пропонованих у винаході, можуть мати послідовності, які ідентичні послідовностям CDR-ділянок щонайменше на 60 %, переважніше щонайменше на 70 % або 80 %, ще переважніше щонайменше на 90 % і найпереважніше щонайменше на 95 %. У переважних антитілах послідовність CDR-ділянок характеризується схожістю щонайменше на рівні 80 %, переважніше 90 % і найпереважніше 95 %. У переважних варіантів антитіл послідовності варіабельних областей ідентичні щонайменше на 60 %, переважніше щонайменше на 70 % або 80 %, ще переважніше щонайменше на 90 % і найпереважніше щонайменше на 95 %. У переважних антитіл 5 UA 103005 C2 5 10 15 20 25 30 35 40 45 50 55 послідовності варіабельних областей характеризуються схожістю щонайменше на рівні 80 %, переважніше 90 % і найпереважніше 95 %. "Ідентичність послідовностей" двох поліпептидних послідовностей характеризують відсотком амінокислот, які є ідентичними в послідовностях. "Схожість послідовностей" характеризують відсотком амінокислот, які або є ідентичними, або є консервативними амінокислотними замінами. Варіант можна отримувати також, використовуючи антитіло, яке має конкретну послідовність, представлену в переліку послідовностей, як вихідна точка для оптимізації і диверсифікації одного або декількох амінокислотних залишків, переважно амінокислотних залишків в одному або декількох CDR, і подальшого скринінгу бібліотеки варіантів антитіл, що утворилася, відносно варіантів з покращуваними властивостями. Встановлено, що можна використовувати диверсифікацію одного або декількох амінокислотних залишків CDR3 варіабельної області легкого ланцюга CDR3 варіабельної області важкого ланцюга CDR1 варіабельної області легкого ланцюга і/або CDR2 варіабельної області важкого ланцюга. Для здійснення диверсифікації можна застосовувати методи, відомі в даній галузі, наприклад, так звану TRIM-технологію, описану в WO 2007/042309. У іншому варіанті здійснення винаходу молекула антитіла до CD37 є антитілом з "доспілою афінністю". Антитіла до CD37 з "доспілою афінністю" є антитілом до CD37, виведене з антитіла, яке має послідовність, представлену в переліку послідовностей, яке має одну або декілька змін в одному або декількох CDR, яка(і) наводить(ять) до поліпшення афінності до антигенів в порівнянні з відповідним вихідним антитілом з не доспілою афінністю (не доспілим антитілом). Одна з методик створення вказаних мутантів антитіл включає метод фагового дисплея (Hawkins та ін., 1992; і Lowman та ін., 1991). В цілому, метод полягає в наступному: декілька сайтів гіперваріабельних ділянок (наприклад, 6-7 сайтів) піддають мутації із одержанням всіх можливих амінокислотних замін в кожному сайті. Отримані таким чином мутанти антитіл презентують в одновалентній формі на частках нитчастого фага таким чином, що продукт гена III фага M13 виявляється упакованим в кожній частці. Мутанти, що потім презентуються фагом, піддають скринінгу відносно їх біологічної активності (наприклад, афінності до скріплення) з використанням методів, представлених в дійсному описі. Антитіла з доспілою афінністю можна отримувати також методами, описаними, наприклад, у Marks та ін., 1992 (дозрівання афінності шляхом перестановки варіабельних областей важкого ланцюга (VH) і варіабельних областей легкого ланцюга (VL)) або у Barbas, та ін., 1994; Shier та ін., 1995; Yelton та ін., 1995; Jackson та ін., 1995 і Hawkins та ін., 1992 (випадковий мутагенез залишків CDR і/або каркасної ділянки). Афінність переважних антитіл з доспілою афінністю відносно антигена-мішені повинна характеризуватися значеннями, що знаходяться на наномолярному або навіть пикомолярному рівні. У іншому варіанті здійснення винаходу молекула антитіла до CD37, пропонована у винаході, є "деімунизированим" (неімунним) антитілом. "Деімунізоване" антитіло до CD37 є антитілом, що виведене з гуманізованого або химерного антитіла, послідовність якого представлена в переліку послідовностей, має одне або декілька змін в амінокислотній послідовності, яка(і) призводить(ять) до зниження імуногенності антитіла в порівнянні з відповідним вихідним недегуманізированим антитілом. Один з методів створення вказаних мутантів антитіл передбачає ідентифікацію і видалення T-клітинних епітопів молекули антитіла (Baker і Jones, 2007). На першій стадії можна визначати імуногенність молекули антитіла різними методами, наприклад, шляхом виявлення in vitro T-клітинних епітопів або передбачення вказаних епітопів аналізом in silico (молекулярне моделювання), які відомі з літератури (Jones та ін., 2004; Jones та ін., 2005; Reche та ін., 2004; Hertz та ін., 2006). Після ідентифікації тих, що мають вирішальне значення для функціональної активності залишків Tклітинних епітопів, можна здійснювати мутації з метою усунення імуногенності і збереження активності антитіла (Jones та ін., 2005; Tangri та ін., 2005). Методи інтродукції мутацій в білки добре відомі в даній галузі, наприклад, включають методику перекриваючої ПЦР. Оскільки Fc-фрагмент антитіла взаємодіє з декількома Fc- рецепторами, що наводить до декількох важливих функціональних властивостей (які називають "ефекторними функціями"), в деяких варіантах здійснення винаходу антитіло є повнорозмірним антитілом або антитілом, яке містить частину Fc-фрагмента, останнє має місце у випадку, якщо антитіло володіє здатністю до специфічного скріплення і з відповідною областю антигена, і з Fc-рецепторами. Вибір типа і довжини константної області залежить від того, яка з наступних ефекторних функцій є бажаною: або ефекторна функція типа фіксації комплементу, або обумовлена для антитіла 6 UA 103005 C2 5 10 15 20 25 30 35 40 45 50 55 60 клітиннозалежна цитотоксичность, і від необхідних фармакологічних властивостей білка антитіла. У одному з варіантів здійснення винаходу антитіло до CD37 є химерним або гуманізованим антитілом, яке містить Fc-фрагмент або його відповідну частину, створені для модуляції ефекторних функцій, перш за все для підвищення здібності до зв'язування антитіла з одним або декількома Fc-рецепторами, що підсилює ефекторну функцію типа ADDC. Створення Fcфрагмента наводить до того, що ефекторна функція антитіла у присутності ефекторних клітин є ефективнішою у порівнянні з батьківським антитілом, що не має створений Fc-фрагмент. У одному з варіантів здійснення винаходу вказаний варіант антитіла опосередкує вищу ADCC в порівнянні з ADCC, опосередковуваної батьківським антитілом. (Нижче, якщо спеціально не вказане інше, поняття "батьківське" у контексті молекули антитіла або в контексті IgG або Fcфрагмента належить до несконструйованої молекули антитіла Fc-фрагмента або IgG відповідно, з якої виводять мутантну (сконструйовану) молекулу). Різні модифікації Fc-області відомі в даній галузі, і вони описані як в науковій літературі, так і в патентних документах, наприклад, в EP 0307434, WO 93/04173, WO 97/34631, WO 97/44362, WO 98/05787, WO 99/43713, WO 99/51642, WO 99/58572, WO 02/060919, WO 03/074679, WO 2004/016750, WO 2004/029207, WO 2004/063351, WO 2004/074455, WO 2004/035752, WO 2004/099249, WO 2005/077981, WO 2005/092925, WO 2006/019447, WO 2006/031994, WO 2006/047350, WO 2006/053301, WO 2006/088494 і WO 2007/041635. У переважних варіантах здійснення винаходу антитіла, пропоновані у винаході, є Fcваріанти з амінокислотними замінами в положеннях 332 і/або 239, і/або 236. У переважних варіантах здійснення винаходу антитіла, пропоновані у винаході, мають мутації в Fc-фрагменті, вибрані з групи, що включає I) одну заміну в положенні 332, переважно I332E; II) комбінацію замін в положеннях 239 і 332, переважно S239D/I332E; III) комбінацію замін в положеннях 236 і 332, переважно G236A/I332E; IV) комбінацію замін в положеннях 236, 239 і 332, переважно G236A/S239D/I332E. Вказані вище заміни описані, наприклад, у Lazar та ін., 2006, в WO 2004/029207 і WO 2007/041635. Fc-варіанти антитіл, пропонованих в дійсному винаході, позначають по амінокислотних модифікаціях, які входять в них. Так, наприклад, I332E є Fc-варіант із заміною I332E відносно батьківського Fc-поліпептиду. Аналогічно цьому S239D/I332E позначає Fc-варіант із замінами S239D і I332E, а S239D/I332E/G236A позначає Fc-варіант із замінами S239D, I332E і G236A відносно батьківського Fc-поліпептиду. Нумерація дана згідно з схемою нумерації EU (Kabat та ін., 1991), яка відповідає нумерації антитіла EU (Edelman та ін., 1969). Фахівцеві в даній галузі має бути очевидне, що ці погоджені позначення передбачають непослідовну нумерацію в конкретних областях послідовності імуноглобуліну, що дозволяє здійснювати стандартизоване посилання на консервативні положення в сімействах імуноглобулінів. У вказаних вище антитілах положення 236, 239 і 332, в яких є заміни, відповідають положенням 119, 122 і 215 відповідно важкому ланцюгу IgG1, представленою в SEQ ID NO: 24. (У повнорозмірних послідовностях важких ланцюгів антитіл A2, A4, B2 і B4, представлених в SEQ ID NO: 28, 32, 36 і 40, замінені амінокислоти знаходяться в положеннях 235, 238 і 331). У деяких варіантах здійснення винаходу основою Fc-варіантів, пропонованих у винаході, є послідовність людського IgG, і тому послідовності людського IgG використовують в якості "основних" послідовностей, з якими порівнюють інші послідовності. У антитілах, пропонованих в дійсному винаході, сконструйований Fc-фрагмент переважно є IgG, зокрема IgG1, але може бути також IgG2 або варіанти послідовностей з інших класів імуноглобулінів, таких як IgA, IgE, IgGD, IgM або химерних версій два або більшої кількості класів імуноглобулінів (наприклад IgG2/IgG1) і тому подібне. Хоча Fc-варіанти, пропоновані в дійсному винаході, конструюють в контексті одного батьківського IgG, ці варіанти можна конструювати в контексті іншого вторинного батьківського IgG або "переносити" у нього. Для цієї мети визначають "еквівалентні" або "відповідні" залишки і заміни між першим і другим IgG, як правило, на основі гомології послідовностей або структур для послідовностей першого і другого IgG. Для визначення міри гомології амінокислотну послідовність першого IgG, представлену в дійсному описі, безпосередньо порівнюють з послідовністю другого IgG. Після вирівнювання послідовностей за допомогою однієї або декількох програм визначення гомології, відомих в даній галузі, які дозволяють визначати інсерції і делеції, необхідні для здійснення порівняльного аналізу первинної структури (тобто дозволяють уникати елімінації консервативних залишків в результаті довільної делеції і інсерції), визначають залишки, еквівалентні конкретним амінокислотам в 7 UA 103005 C2 5 10 15 20 25 30 35 40 45 50 55 60 первинній послідовності першого Fc-варіанту. Відсутність залежності від того, чи визначені еквівалентні або відповідні залишки, і відсутність залежності від ідентичності батьківського IgG, з якого створені IgG, означає, що Fc-варіанти, пропоновані в дійсному винаході, можна конструювати в будь-якому другому батьківському IgG, для якого характерна істотна гомологія послідовності або структури з Fc-варіантом. Так, наприклад, якщо створюють варіант антитіла, для якого батьківським антитілом є людський IgG1, за допомогою описаних вище методів або інших методів визначення еквівалентних залишків, то варіант антитіла можна конструювати, наприклад, в людському lgG2, використовуючи його як батьківське антитіло, людському IgA, використовуючи його як батьківське антитіло (див. WO 2007/041635). Мішенню антитіл, пропонованих у винаході, є антиген CD37, що може мати перевагу з точки зору цілеспрямованої дії на CD20, при захворюваннях, при яких рівень експресії CD37 вище, ніж CD20, наприклад, при хронічному лімфолейкозі, якщо в зразках виявлений високий рівень експресії мРНК CD37 в порівнянні з низьким рівнем експресії мРНК CD20. Встановлено, що антитіла, пропоновані у винаході, перевершують ритуксимаб, зареєстроване антитіло до CD20, з точки зору ADCC-активності при оцінці на клітинах лінії Ramos, В-клітинного виснаження при оцінці в цілісній крові і виснаження клітин лінії Ramos при лімфомі Беркитта. У експериментах, проведених при створенні винаходу, встановлено, що антитіла, пропоновані у винаході (як з несконструйованим Fc, так і із сконструйованим Fc) володіють активністю у відношенні B-клітинного виснаження, що перевищує активність ритуксимаба. Антитіла з мутантом Fc-фрагментом володіють приблизно в 10 разів вищою здатністю викликати B-клітинне виснаження в порівнянні з ритуксимабом (фіг. 11Б). Репрезентативні антитіла до CD37, пропоновані у винаході, володіють вираженою проапоптозною активністю без введення перехресних зшивань; у цьому плані антитіла перевищують по цьому вигляду активності антитіло до CD37 SMIP Tru16.4, яке не викликає апоптоз без введення перехресних зшивань (Zhao та ін., 2007). Індукція апоптозу без введення перехресних зшивань, що є характерним як для антитіл, пропонованих у винаході, які мають як сконструйований, так і для антитіл, що не мають його, є їх перевагою в разі відсутності перехреснозшиваючего агента in vivo (наприклад, в разі ефекторних клітин, що несуть Fcγрецептори) або в разі низької щільності антигена-мішені CD37 (наприклад, у разі пухлинних клітин, для яких характерний низький рівень експресії CD37). Антитіло, яке індукує апоптоз без введення перехресних зшивань, все ще може викликати клітинну загибель, тоді як антитіло, залежне від введення перехресних зшивань, не володіє вказаною здатністю. Згідно з іншим об'єктом винаходу молекула антитіла до CD37, пропонована у винаході, є фрагмент антитіла, виведеного з гуманізованого або химерного CD37-специфічного антитіла, пропонованого в дійсному винаході. Для одержання фрагментів антитіла, наприклад Fabфрагментів, можна здійснювати розщеплювання за допомогою загальноприйнятих методів, наприклад, з використанням папаіна. Приклади продуктів розщеплювання папаіном описані в WO 94/29348 і US 4342566. При розщеплюванні папаіном антитіл, як правило, утворюються два ідентичних антигензв'язуючих фрагмента, так званих Fab-фрагменти, кожен з яких містить один антигензв'язуючий сайт, при цьому зберігається Fc-фрагмент. Обробка пепсином наводить до одержання F(ab')2-фрагмента, який несе два антигензв'язуючий сайта і все ще володіє здатністю до перехресного зшивання з антигеном. Fab-фрагменти, отримані розщеплюванням антитіла, містять також константні області легкого ланцюга і перший домен константної області (CH1) важкого ланцюга. Fab'-фрагменти відрізняються від Fab-фрагментів тим, що вони містять додаткові залишки на карбоксильному кінці CH1-домена важкого ланцюга, включаючи один або декілька залишків цистеїну з шарнірної області антитіла. У контексті дійсного опису Fab'-SH позначає Fab', у якому залишок(и) цистеїну константних областей несе(уть) вільну тіольну групу. F(ab') 2-фрагменти антитіл початково отримували у вигляді пар Fab'-фрагментов, між якими знаходяться цистеїна шарнірної області. Фрагменти антитіл можна створювати також методами молекулярної біології, за допомогою яких отримують відповідні кодуючі ДНК-фрагменти. Молекула антитіла, як правило, є тетрамером, що складається з двох пар легких ланцюгів/важких ланцюгів, але вона також може бути диміром, тобто складатися з пари легкий ланцюг/важкий ланцюг, наприклад, бути Fab- або Fv-фрагментом, або вона може бути мономірним одноланцюжковим антитілом (scFv; Johnson і Bird, 1991), мініантитілом або подвійним антитілом. Молекула антитіла до CD37 може також мати форму кон'югата, тобто молекула антитіла може бути хімічно пов'язана з цитотоксичним агентом, зокрема цитотоксичним агентом, який індукує цитотоксичність (наприклад, апоптоз або припинення митоза) відносно пухлинних клітин. В результаті механізмів нормального кліренсу фармакологічних засобів антитіло, 8 UA 103005 C2 5 10 15 20 25 30 35 40 45 50 55 60 вживане у вигляді кон'югата з лікарським засобом ("іммунокон'югат"), приходить в контакт і зв'язується з клітинами-мішенями лише в обмежених кількостях. Тому цитотоксичний агент, що входить до складу кон'югата, повинен володіти високою цитотоксичною активністю, достатньою для того, щоб знищення клітин мало терапевтичну дію. Як описано в US 2004/0241174, прикладами вказаних цитотоксичних агентів є таксани (див., наприклад WO 01/38318 і WO 03/097625), ДНК-алкілуючі агенти (наприклад, аналоги CC 1065), антрациклини, аналоги тубулизина, аналоги дуокармицина, доксорубицин, ауристатин E, токсин рицини A і цитотоксичні агенти, що містять реактивний поліетиленглікольний залишок (див., наприклад Sasse та ін., 2000; Suzawa та ін., 2000; Ichimura та ін., 1991; Francisco та ін., 2003; US 5475092; US 6340701; US 6372738 і US 6436931; US 2001/0036923; US 2004/0001838; US 2003/0199519 і WO 01/49698). У переважному варіанті здійснення винаходу цитотоксичний агент є майтанзиноідом, тобто похідним майтанзина (CAS 35846538), майтанзиноіди, відомі в даній галузі, включають майтанзин, майтанзинол, складні C 3-ефіри майтанзинола і інші аналоги, і похідні майтанзинола (див., наприклад US 5208020 і US 6441163). Іммунокон'югати, що містять антитіло до CD37 можна створювати і синтезувати згідно з методом, описаним в WO 2007/077173 для іммунокон'югатів антитіл до FAP. У іншому варіанті здійснення винаходу молекулу антитіла до CD37, пропоновану у винаході, можна мітити радіоактивним ізотопом з утворенням радіоіммунокон'югата, цей підхід запропонований для антитіла до CD37 MB-1 (Buchsbaum та ін., 1992, див. вищий). Радіонукліди, що володіють найбільш переважною активністю випромінювання, відомі в даній галузі, і до них відносяться, наприклад, фосфор-32, стронцій-89, ітрій-90, йод-131, самарій-153, ербій 169, ітербій-175, реній-188, які можна успішно і стабільно зшивати з МАт. Молекули антитіл до CD37, пропоновані у винаході, можна мітити різними радіонуклідами, використовуючи методи прямого мічення або непрямого мічення, описані в US 6241961. Огляд технологій створення і застосування нових радіоактивномічених кон'югатов антитіл, які можна застосовувати згідно із справжнім винаходом, представлений у Goldenberg і Sharkey, 2007. Молекула антитіла, пропонованого у винаході, або із сконструйованим Fc, або з несконструйованим Fc, може також бути біспецифічною, тобто бути молекулою антитіла, яка зв'язується з двома різними мішеням, однією з яких є CD37, а інша є однією з мішеней, вибраних, наприклад, з поверхневих антигенів, експресуємих T-клітинами, наприклад CD3, CD16 і CD56. Дійсний винахід відноситься також до молекул ДНК, яка кодує химерні або гуманізовані молекули антитіл до CD37, пропоновані у винаході. Послідовності, які кодують варіабельні області важких ланцюгів молекул антитіл, пропонованих у винаході, представлені в SEQ ID NO: 1, SEQ ID NO: 5, SEQ ID NO: 7 і SEQ ID NO: 9. Послідовності, які кодують варіабельні області легких ланцюгів молекул антитіл, пропонованих у винаході, представлені в SEQ ID NO: 3, SEQ ID NO: 11, SEQ ID NO: 13, SEQ ID NO: 15, SEQ ID NO: 17, SEQ ID NO: 19, SEQ ID NO: 21. Молекули нуклеїнових кислот, які кодують легкий ланцюг і важкий ланцюг, можна синтезувати хімічно і ферментативно (ПЦР-амплифікація) стандартними методами. По-перше, можна синтезувати прийнятні олигонуклеотіди за допомогою методів, відомих в даній галузі (див., наприклад Gait, 1984), які можна застосовувати для одержання синтетичного гена. Методи створення синтетичних генів на основі олигонуклеотідов відомі в даній галузі (див., наприклад Stemmer та ін., 1995; Ye та ін., 1992; Hayden і Mandecki, 1988; Frank та ін., 1987). Молекули ДНК, пропоновані у винаході, включають, але, не обмежуючись лише ними, молекули ДНК, послідовності яких представлені в переліку послідовностей. Таким чином, дійсний винахід відноситься також до молекул нуклеїнових кислот, які гібридизуються з молекулами ДНК, послідовності яких представлені в переліку послідовностей, в строгих умовах скріплення і відмивання, які описані в WO 2007/042309, де вказані молекули нуклеїнових кислот кодують антитіло або його функціональний фрагмент, яке/який володіють властивостями, еквівалентними або перевищучими активність антитіла, що кодується послідовністю, представленою в переліку послідовностей. Переважними молекулами (відносно перспективності мРНК) є молекули, послідовності яких щонайменше на 75 % або 80 % (переважно щонайменше на 85 %, переважніше щонайменше на 90 % і найпереважніше щонайменше на 95 %) гомологічні або ідентичні послідовностям молекул ДНК, представлених у дійсному описі. Ще один клас варіантів ДНК, які підпадають під об'єм винаходу, може визначатися кодованим ним поліпептидом. Ці молекули ДНК розрізняються по їх послідовності від представлених в переліку послідовностей, але кодують в результаті вироджуваності генетичного коду, антитіла, що мають ідентичні амінокислотні послідовності. Наприклад, з 9 UA 103005 C2 5 10 15 20 25 30 35 40 45 50 55 60 позицій експресії антитіл в еукаріотичних клітинах послідовності ДНК, представлені в переліку послідовностей, створені так, щоб відповідати по частоті зустрічальності кодонов еукаріотичним клітинам. Якщо потрібно експресувати антитіла в E. coli, то ці послідовності можна змінювати, так аби вони відповідали по частоті зустрічальності кодонів E. coli. Варіанти молекул ДНК, пропонованих у винаході, можна конструювати декількома різними шляхами, наприклад, описаними в WO 2007/042309. Для одержання рекомбінантних молекул антитіл до CD37, пропонованих у винаході, молекули ДНК, що кодують повнорозмірні легкі і важкі ланцюги або їх фрагменти, вбудовують в експресійний вектор так, щоб функціонально пов'язувати послідовності з контролюючими транскрипцію і трансляцію послідовностями. Для створення антитіл, пропонованих у винаході, фахівець в даній галузі може будь-яку систему експресії з великої різноманітності відомих в даній галузі систем експресії, наприклад, перерахованих в огляді Kipriyanow і Le Gall, 2004. Експресіонні вектори є плазмідами, ретровірусами, космидами, виведеними з EBV епісомами і тому подібне. Експресіонні вектори і контролюючі експресію послідовності вибирають так, щоб вони були сумісні з клітиною-господарем. Ген легкого ланцюга антитіла і ген важкого ланцюга антитіла можна вбудовувати в різні вектори. У деяких варіантах здійснення винаходу обидві послідовності ДНК вбудовують в один і той же експресійний вектор. Прийнятними є вектори, які кодують володіючу повною функціональною активністю послідовність CH або CL людського імуноглобуліну, з відповідними сконструйованими сайтами рестрикції, що дозволяє легко вбудовувати і експресувати будь-яку описану вище послідовність VH або VL. Константна область ланцюга, як правило, відноситься в разі легкого ланцюга антитіла до капа- або лямбда-типу, а в разі важкого ланцюга антитіла може відноситися, але, не обмежуючись лише ними, до будь-якого IgG-ізотипу (IgG1, IgG2, IgG3, IgG4) абодо інших імуноглобулінів, включаючи алельні варіанти. Рекомбінантний експресійний вектор може кодувати також сигнальний пептид, який полегшує секрецію ланцюга антитіла з клітини-господаря. ДНК, що кодує ланцюг антитіла, можна клонувати у векторі так, щоб сигнальний пептид був зв'язаний в рамці прочитування з амінокінцем ДНК ланцюга зрілого антитіла. Сигнальний пептид може бути сигнальним пептидом імуноглобуліну або гетерологичним пептидом з білка, що не належить до імуноглобулінів. У альтернативному варіанті послідовність ДНК, що кодує ланцюг антитіла, може вже включати послідовність сигнального пептиду. Окрім послідовностей ДНК, що кодують ланцюги антитіла, рекомбінантні експресіонні вектори несуть регуляторні послідовності, такі як промотори, енхансери, сигнали термінації і поліаденилирування і інші контролюючі експресію елементи, які контролюють експресію ланцюгів антитіла в клітині-господарі. Прикладами промоторних послідовностей (наприклад, призначених для експресії в клітинах ссавців) є промотори і/або енхансери, виведені з цитомегаловірусів (CMV) (таких як CMV, що є мавпячим вірусом 40 (SV40) (наприклад, промотор/енхансер SV40), аденовірусів (наприклад, головний пізній промотор аденовірусів (AdMLP)), промотори поліоми і сильні промотори ссавців, такі як нативні промотори імуноглобулінів і промотори актина. Прикладами сигналів поліаденілирування є полиА BGH, пізній або ранній полиА SV40; у альтернативному варіанті можна використовувати 3’UTR генів імуноглобулінів. Рекомбінантні експресіонні вектори можуть нести також послідовності, які регулюють реплікацію вектора в клітинах-господарях (наприклад, сайти ініціації реплікації) і гени селектуємих маркерів. Молекули нуклеїнових кислот, що кодують важкий ланцюг або її антигензв'язуючий фрагмент і/або легкий ланцюг або її антигензв'язуючий фрагмент антитіла до CD37, і вектори, що містять вказані молекули ДНК, можна інтродуціювати в клітини-господарі, наприклад, клітини бактерій або клітини вищих еукаріотичних організмів, наприклад, клітини ссавців, за допомогою методів трансфекції, які добре відомі в даній галузі, включаючи опосередковувану ліпосомами трансфекцію, опосередковувану полікатионами трансфекцію, злиття протопластів, мікроін'єкції, осадження фосфатом кальцію, електропорацію або перенесення за допомогою вірусних векторів. Переважно молекули ДНК, що кодують важкий ланцюг і легкий ланцюг, присутні в двох векторах, якими спільно трансфектують клітину-господарь, переважно клітину ссавця. Придатні як господарі для експресії лінії клітин ссавців добре відомі в даній галузі і серед іншого є клітинами яєчника китайського хом'яка (CHO, CHO-DG44), клітинами NSO, клітинами SP2/0, клітинами HeLa, клітинами нирки дитинчати хом'яка (BHK), клітини нирки мавпи (COS), клітини людської карциноми (наприклад Hep G2), клітини A549, клітини 3T3 або похідні/потомство будь-якої з вказаних ліній клітин. До інших клітин ссавців відносяться, але, не 10 UA 103005 C2 5 10 15 20 25 30 35 40 45 50 55 60 обмежуючись лише ними, людські, мишачі, щурячі, мавпячі і отримані з організму гризунів клітинні лінії або інші еукаріотичні клітини, включаючи, але, не обмежуючись лише ними, клітини дріжджів, комах і рослин, або можна застосовувати прокаріотичні клітини, такі як бактерійні клітини. Молекули антитіл до CD37, пропоновані у винаході, отримують шляхом культивування клітин-господарів протягом періоду часу, достатнього для того, щоб сталася експресія молекули антитіла в клітинах-господарях. Молекули антитіл переважно виділяються з культурального середовища у вигляді поліпептиду, що секретується, або їх можна виділяти з лизатів клітин-господарів, якщо, наприклад, вони експресуються без секреторного сигналу. Необхідно очищати молекули антитіл за допомогою стандартних методів очищення білків, вживаних для очищення рекомбінантних білків і білків клітин-господарів, з метою одержання практично гомогенних препаратів антитіл. Наприклад, прийняті в даній галузі методи очищення, які можна застосовувати для одержання молекули антитіл до CD37, пропонованих у винаході, включають в якості першої стадії видалення клітин і/або часток клітинного дебриса з культурального середовища або лизату. Потім антитіло очищають від розчинних забрудників, таких як білки, поліпептиди і нуклеїнові кислоти, наприклад, фракціонуванням на іммуноафіних або іонообмінних колонках, осадженням етанолом, ЖВХР з оберненою фазою, хроматографією на сефадексі, хроматографією на силикагелі або на катіонообмінній смолі. На кінцевій стадії процесу одержання препаратів молекул антитіл до CD37 очищену молекулу антитіла можна сушити, наприклад, ліофилизувати, згідно з описаним вище методом з метою застосування в терапії. Наступним об'єктом дійсного винаходу є фармацевтична композиція, що містить в якості діючої речовини молекулу антитіла до CD37, пропоновану у винаході. Для застосування в терапії антитіло до CD37 включають у фармацевтичні композиції, призначені для полегшення введення тваринам або людині. Типові лікарські форми молекул антитіл до CD37 можна отримувати змішенням молекули антитіла до CD37 з фізіологічно прийнятними носіями, ексципиентами або стабілізаторами у вигляді ліофілізованих або висушених іншим чином форм або водних розчинів або водних або неводних суспензій. Носії, ексципиенти, модифікатори або стабілізатори є нетоксичними у вживаних дозах і концентраціях. Вони включають буферні системи, такі як фосфат, цитрат, ацетат і інші неорганічні або органічні кислоти і їх солі; антиоксиданти, включаючи аскорбінову кислоту і метіонін; консерванти (такі як хлорид октадецилдиметилбензиламмонія; гексаметонийхлорид; бензалконийхлорид, бензетонийхлорид; фенол, бутил або бензиловий спирт; алкілпарабени, такі як метил або пропілпарабен; катехол; резорцинол; циклогексанол; 3-пентанол і мета-крезол); білки, такі як сироватковий альбумін, желатин або імуноглобуліни; гідрофільні полімери, такі як полівінілпіролідон або поліетиленгліколь (ПЕГ); амінокислоти, такі як гліцин, глутамін, аспарагин, гістидин, аргінін або лізин; моносахариди, дисахариди, олігосахариди або полісахариди або інші вуглеводи, включаючи глюкозу, манозу, сахарозу, трегалозу, декстрин або декстрани; хелатуючі агенти, такі як ЕДТК; цукрові спирти, такі як Маніт або сорбіт; солетворні противоіони, такі як натрій; комплекси з металами (наприклад, комплекси Zn-білок); і/або іоногенні або неіоногенні поверхнево-активні речовини, такі як TWEEN™ (полісорбати), PLURONICS™ або ефіри жирних кислот, прості ефіри жирних кислот або складні ефіри цукрів. У лікарську форму антитіла можуть входити також органічні розчинники, такі як етанол або ізопропанол. Ексципиенти можуть володіти також модифікуючою вивільнення або модифікуючою абсорбцію функцією. Молекули антитіл до CD37 можна також сушити (сушка виморожуванням, сушка розпилюванням, спрей-сублімаціонна сушка, сушка за допомогою близьких до суперкритичних або суперкритичних газів, вакуумна сушка, сушка на повітрі), осаджувати або кристалізувати або укладати в мікрокапсули, які отримують, наприклад, методами коацервації або за допомогою міжфазної полімеризації, використовуючи, наприклад, гідроксиметилцеллюлозу або желатин і полі(метилметакрилат) відповідно, в колоїдні системи для введення лікарських засобів (наприклад, ліпосоми, альбумінові мікросфери, мікроемульсії, наночастки і нанокапсули), в мікроемульсії або їх можна осаджувати або іммобилизовувати на носіях або поверхнях, наприклад, з допомогою pcmc-технології (нанесення білкового покриття на мікрокристали). Вказані методики описані в Remington: The Science and Practice of Pharmacy, 21ое видав., під ред. Hendrickson R. Природно, лікарські форми, які можна застосовувати для введення in vivo, мають бути стерильними; для стерилізації можна використовувати загальноприйняті методики, наприклад, фільтрацію через стерильні фільтраційні мембрани. Для підвищення вживаної концентрації антитіла до CD37, його можна включати в так звані висококонцентровані рідкі форми (HCLF); відомі різні шляхи одержання вказаних HCLF. 11 UA 103005 C2 5 10 15 20 25 30 35 40 45 50 55 Молекули антитіл до CD37 можна застосовувати також у вигляді препарату з пролонгованим вивільненням. Вказані препарати включають тверді, напівтверді і рідкі матриці з гідрофобних або гідрофільних полімерів, і вони можуть бути виробами певної форми, наприклад, плівки, стики або мікрокапсули, і їх можна застосовувати за допомогою призначеного для введення пристрою. Прикладами матриць з пролонгованим вивільненням є складні поліефіри, гідрогелі (наприклад, полі(2-гідроксиетилметакрилат) або ацетатбутірат сахарози) або полі(вініловий спирт)), полілактіди (US 3773919), сополімери L глутамінової кислоти і γ-етил-L-глутамата, нерозкладний етиленвінілацетат, розкладні сополімери молочної кислоти - гліколевої кислоти, такі як LUPRON DEPOT™ (мікросфери, що ін'єктуються, складаються з сополімера молочної кислоти - гліколевої кислоти і ацетату леупроліда) і полі-D-(-)-3-гідроксимасляна кислота. Такі полімери, як етилен-вінілацетат і сополімери молочної кислоти - гліколевої кислоти володіють здатністю вивільняти молекули протягом 100 днів, тоді як деякі гідрогелі володіють здатністю вивільняти білки протягом коротших періодів часу. При тривалому збереженні капсульованих антитіл в організмі може відбуватися їх денатурація або агрегація в результаті дії вологості при 37 °C, що призводить до зниження біологічної активності і можливо змін імуногенності. Для стабілізації залежно від механізму, що бере участь, можна застосовувати різні раціональні стратегії. Наприклад, якщо відомо, що механізм агрегації призводить до утворення міжмолекулярної S-S-зв'язки за допомогою взаємних тіо-дисульфідних обмінів, то для досягнення стабілізації можна застосовувати модифікацію сульфгідрильних залишків, ліофілізацію (наприклад, як описано в WO 89/011297) з кислих розчинів, контроль вмісту вологи, використання відповідних добавок і створення специфічної композиції полімерної матриці. Для молекул антитіл до CD37, пропонованих у винаході, можна застосовувати також лікарські форми, які описані в US 7060268 і US 6991790. Молекулу антитіла до CD37 можна включати також в інші форми застосування, такі як дисперсії, суспензії або ліпосоми, пігулки, капсули, порошки, спреї, трансдермальні або інтрадермальні пластири або креми, у поєднанні з пристроями, що підвищують проникнення, або без них, облатки, лікарські форми для назального, трансбуккального або легеневого введення, або їх можна отримувати за допомогою імплантованих клітин або - після генної терапии - за допомогою власних клітин пацієнта. Молекулу антитіла до CD37 можна також дериватизувати за допомогою хімічної групи, такої як поліетиленгліколь (ПЕГ), метильна або етильна група або вуглеводна група. Ці групи можна застосовувати також для поліпшення біологічних характеристик антитіла, наприклад, для подовження часу напівжиття в сироватці або для підвищення афінності до зв'язування з тканиною. Переважним шляхом введення є парентеральний, шляхом інфузії або ін'єкції (внутрішньовенний, внутрішньом'язовий, підшкірний, внутрішньо-очеревинний, інтрадермальний), але можна застосовувати також інші шляхи введення, такі як введення шляхом інгаляції, трансдермально, введення в ніс, трансбуккально, оральний. Відповідна доза антитіла, призначена для попередження або лікування захворювання, повинна залежати від типа захворювання, що підлягає лікуванню, серйозності і перебігу захворювання, від того, чи вводять антитіло з метою профілактики або лікування, попередньої терапії, історії хвороби пацієнта і відповіді на антитіло, і від розпорядження лікаря, що лікує. Антитіло можна вводити пацієнтові однократно або у вигляді серії обробок. Залежно від типа і серйозності захворювання початкова можлива доза, в якій застосовують антитіла для введення пацієнтові, може складати від приблизно 0,01 мкг/кг до 40 мга/кг (наприклад, 0,1-20 мк/кг) з використанням, наприклад, або однократного, або декількох окремих введень, або безперервної інфузії. При застосуванні повторних введень протягом декількох днів або більш, залежно від стану, лікування продовжують до досягнення необхідного придушення симптомів захворювання. Проте можна використовувати інші схеми лікування. Прогрес при застосуванні вказаної терапії легко відстежувати за допомогою загальноприйнятих методик і аналізів, наприклад, визначаючи рівень B-клітинного виснаження (наприклад, за допомогою проточної цитометрії). "Терапевтично ефективна кількість", у яку слід вводити антитіло, є мінімальна кількість, необхідна для попередження, полегшення симптомів або лікування захворювання або порушення. Молекулу антитіла до CD37, пропоновану у винаході, і що містять її фармацевтичні композиції застосовують для виснаження B-клітин, на поверхні яких eкспресується CD37, і які викликають ракове або аутоіммунне/запальне захворювання. 12 UA 103005 C2 5 10 15 20 25 30 35 40 45 50 55 60 Згідно з одним з об'єктів винаходу фармацевтичну композицію, пропоновану у винаході, можна застосовувати для лікування різних видів раку, зокрема будь-яких CD37-позитивних злоякісних захворювань. В-клітинні злоякісні захворювання включають, але, не обмежуючись лише ними B-клітинні лімфоми (наприклад, різні форми хвороби Ходжкина, В-клітинна неходжкинська лімфома (NHL) і родинні лімфоми (наприклад, Вальденстрема макроглобулінемія (яку називають лімфоплазмоцитарною лімфомою або іммуноцитомою) або лімфоми центральної нервової системи), лейкоз (наприклад, гострий лімфолейкоз (ALL), хронічний лімфолейкозa (CLL; який називають також B-клітинним хронічним лімфолейкозом BCLL), волосковоклітинний лейкоз і хронічний міобластний лейкоз) і мієломи (наприклад, множинна мієлома). Інші В-клітинні злоякісні захворювання включають дрібноклітинну лімфоцитарную лімфому, B-клітинний пролімфоцитарний лейкоз, лімфоплазмоцитарну лімфому, лімфому з клітин маргінальної зони селезінки, мієлому з плазматичних клітин, солітарну плазмацитому кісті, екстраосальну плазмацитому, екстранодальну В-клітинну лімфому з клітин маргінальної зони лімфоїдної тканини слизистих оболонок (MALT), нодальну В-клітинну лімфому з клітин маргінальної зони, фолікулярну лімфому, лімфому з клітин мантії, дифузну великоклітинну В-клітинну лімфому, медіастинальну (тимусну) великоклітинну В-клітинну лімфому, інтраваскулярну великоклітинну В-клітинну лімфому, первинну лімфому серозних оболонок, лімфому/лейкоз Беркитта, лімфому "сірої" зони, B-клітинні проліферативні захворювання з неясним злоякісним потенціалом, лімфоматоидний грануломатоз і лімфопроліферативне порушення після трансплантації. Згідно з іншим об'єктом винаходу фармацевтичну композицію, пропоновану у винаході, яка містить антитіла до CD37, можна застосовувати для лікування аутоіммунних і запальних захворювань, в патології яких беруть участь В-клітини. Такі захворювання включають, але, не обмежуючись лише ними: артрит, ревматоїдний артрит, юнацький ревматоїдний артрит, остеоартрит, полихондрит, псоріатичний артрит, псоріаз, дерматит, поліміозит/дерматомиозит, міозит тілець включень, запальний міозит, токсичний епідермальний некроліз, системну склеродермію і склероз CREST-синдром, відповіді, асоційовані із запальним захворюванням кишечника, хвороба Крону, неспецифічний виразковий коліт, респіраторний дистресс-синдром, респіраторний дистресс-синдром дорослих (ARDS), менінгіт, енцефаліт, увеїт, коліт, гломерулонефрит, алергічні стани, екзему, астму, стани, що включають інфільтрацію Т-клеток, і хронічні запальні відповіді, атеросклероз, аутоіммунний міокардит, синдром недостатньої адгезії лейкоцитів, системну червону волчанку (SLE), підгостру шкіряну червону волчанку, дискоїдну червону волчанку, волчаночний мієліт, волчаночний церебрит, юнацький діабет, розсіяний склероз, алергічний енцефаломієліт, оптичний нейромієліт, ревматичну лихоманку, хорею Сиденгама, імунні відповіді, що асоціюються з гострою гіперчутливістю і гіперчутливістю сповільненого типа, опосередковані цитокінами і T-лімфоцитами, туберкульоз, саркоїдоз, грануломатоз, включаючи грануломатоз Вегенера і хвороба Черджа-Стросса, агранулоцитоз, васкуліт (включаючи гіперчутливий васкуліт/ангиит ANCA (антинейтрофільні цитоплазматичні антитіла)-асоційований васкуліт і ревматоїдний васкуліт), апластичнку анемію, анемію Даймонда-Блекфена, імунну гемолітичну анемію, включаючи аутоіммунну гемолітичну анемію (AIHA), перниціозну анемію, есенціальну апластичну анемію (PRCA), дефіцит фактора VIII, гемофілію A, аутоіммунну нейтропенію, панцитопенію, лейкопенію, хвороби, що включають діапедез лейкоцитів, запальні порушення центральної нервової системи (ЦНС), синдром пошкодження декількох органів, важку псевдопаралітичну міастенію, хвороби, опосередковані комплексом антиген-антитіло, хворобу, пов'язану з антигломерулярними антитілами до базальної мембрани, синдром, пов'язаний з антитілом до фосфоліпідів, алергічний нейрит, хворобу Бехчета, синдром Кастлемана, синдром Гудпасчера, міастенічний синдром Лемберта-Итона, синдром Рейно, синдром Шегрена, синдром Стивенса-Джонсона, відторгнення трансплантата щільних органів, реакцію "трансплантат проти господаря" (GVHD), бульозний пемфигоїд, пухирчатку, аутоіммунні поліендокринопатії, сіронегативні спондилоартропатіїи, хвороба Рейтера, синдром "людини, що не гнеться", артерит гігантських клітин, нефрит, пов'язаний з імунними комплексами, пов'язану з IgA нефропатію, пов'язані з IgM полінейропатії або опосередковувану IgM нейропатію, ідіопатичну тромбоцитопенічну пурпуру (ITP), тромботичну тромбоцитопенічну пурпуру (TTP), пурпуру Геноха-Шенлейна, аутоіммунну тромбоцитопенію, аутоіммунне захворювання яєчок і яєчника, включаючи аутоіммунний орхіт і оофорит, первинний гіпотиреоз; аутоіммунні ендокринні захворювання, включаючи аутоіммунний тиреоїдит, хронічний тиреоїдит (тиреоїдит Хасимото), підгострий тиреоїдит, ідіопатичний гипотериоз, хвороба Аддисона, хвороба Грейвса, аутоіммунні полігландулярні синдроми (або синдроми полігладулярної ендокринопатії), діабет типа I, який називають також інсулинзалежним цукровим діабетом (IDDM) і синдром Шихена; 13 UA 103005 C2 5 10 15 20 25 30 35 40 45 50 55 аутоіммунний гепатит, лімфоїдний інтерстиціальний пневмоніт (асоційований з ВІЛ), облітеруючий бронхіоліт (незв'язаний з трансплантацією) по NSIP, синдром Гийена-Барре, васкуліт крупних судин (включаючи ревматичну поліміалгію і гигантоклітинний артеріїт (хвороба Такаясу), васкуліт середніх судин (включаючи хворобу Кавасакі і нодозний поліартеріїт), нодозний поліартеріїт (PAN), анкилозируючий спондиліт, хворобу Берже (пов'язана з IgA нефропатія), швидко прогресуючий гломерулонефрит, первинний біліарний цироз, спру черевної порожнини (глютенова ентеропатія), криоглобулінемію, криоглобулинемию, асоційовану з гепатитом, аміотрофічний бічний склероз (ALS), хворобу коронарної артерії, родинну середземноморську лихоманку, мікроскопічний поліангіїт, синдром Когана, синдром Вискотта-Олдрича і облітеруючі тромбоангіїти (див.WO 2007/014278). Залежно від порушення, що підлягає лікуванню молекулу антитіла до CD37, пропоновану у винаході, можна застосовувати індивідуально або у поєднанні з одним або декількома додатковими терапевтичними засобами, зокрема вибраними з числа викликаючих пошкодження ДНК або тубулинзв'язуючих агентів, або терапевтичними речовинами, що діють, які інгібірують ангіогенез, шляхи трансдукції сигналів або чекпойнти мітоза в ракових клітинах. Додаткові терапевтичні засоби можна вводити одночасно, необов'язково у вигляді компонента одного і того ж фармацевтичного препарату, або до або після введення молекули антитіла до CD37. У деяких варіантах здійснення винаходу додатковий терапевтичний агент може бути, але, не обмежуючись лише ними, один або декілька інгібіторів, вибраних з групи, що включає інгібітори сімейства EGFR, сімейства VEGFR, IGF-1R, рецепторів інсуліну, киназ AuroraA, AuroraB, PLK і PI3, FGFR, PDGFR, Raf, KSP або PDK1. Іншими прикладами додаткових терапевтичних агентів є інгібітори CDK, Akt, Src, Bcr Abl, cKit, cMet/HGF, c-Myc, Flt3, HSP90, антагоністи білка hedgehog, інгібітори JAK/STAT, Mek, mTor, NFkappaB, інгібітори протеосоми Rho, інгібітор шляху передачі сигналу Wnt або шляху передачі сигналу Notch або інгібітор шляху убіквитинізації. Прикладами інгібіторів Aurora-кінази є, але, не обмежуючись лише ними PHA-739358, AZD 1152, AT 9283, CYC-116, R-763, VX-667, MLN-8045, PF-3814735, SNS 314, VX 689, GSK 1070916, TTP-607, PHA-680626, MLN-8237 і ENMD-2076. Прикладом інгібіторів PLK є GSK-461364. Прикладами інгібіторів raf-кінази є BAY-73-4506 (є також інгібітором VEGFR), PLX 4032, RAF265 (є також інгібітором VEGFR), сорафениб (є також інгібітором VEGFR) XL 281 і невавар (Nevavar) (є також інгібітором VEGFR). Прикладами інгібіторів KSP є іспинесиб ARRY-520, AZD-4877, CK 1122697, GSK 246053A, GSK-923295, MK-0731, SB-743921, LY 2523355 і EMD 534085. Прикладами інгібіторів src і/або bcr-abl є дасатиниб AZD-0530, босутиниб XL 228 (є також інгібітором IGF-1R), нилотиниб (є також інгібітором PDGFR і cKit), іматиниб (є також інгібітором cKit) NS-187, KX2-391, AP-24534 (є також інгібітором EGFR, FGFR, Tie2, Flt3), KM-80 і LS-104 (є також інгібітором Flt3, Jak2). Прикладом інгібітору PDK1 є AR-12. Прикладом інгібітору Rho є BA-210. Прикладами інгібіторів PI3-кінази є PX-866, PX-867, BEZ-235 (є також інгібітором mTor), XL147 і XL 765 (є також інгібітором mTor), BGT-226, CDC-0941. Прикладами інгібіторів cMet або HGF є XL-184 (є також інгібітором VEGFR, cKit, Flt3), PF2341066, MK-2461, XL-880 (є також інгібітором VEGFR), MGCD-265 (є також інгібітором VEGFR, Ron, Tie2), SU-11274, PHA-665752, AMG-102, AV-299, ARQ-197, MetMAb, CGEN-241, BMS777607, JNJ 38877605, PF-4217903, SGX-126, CEP-17940, AMG-458, INCB 028060 і E 7050. Прикладом інгібітору c-Myc є CX-3543. Прикладами інгібіторів Flt3 є AC-220 (є також інгібітором cKit і PDGFR), KW 2449, LS-104 (є також інгібітором bcr-abl і Jak2), MC-2002, SB-1317, лестауртиниб (є також інгібітором VEGFR, PDGFR, PKC) TG-101348 (є також інгібітором JAK2), XL 999 (є також інгібітором cKit, FGFR, PDGFR і VEGFR), сунитиниб (є також інгібітором PDGFR, VEGFR і cKit) і тандутиниб (є також інгібітором PDGFR і cKit). Прикладами інгібіторів HSP90 є танеспимицин, алвеспимицин IPI 504, STA 9090, MEDI-561, AUY-922, CNF 2024 і SNX-5422. Прикладами інгібіторів JAK/STAT є CYT-997 (взаємодіє також з тубуліном), TG 101348 (є також інгібітором Flt3) і XL-019. Прикладами інгібіторів Mek є ARRY-142886, AS-703026, PD-325901, AZD 8330, ARRY-704, RDEA-119 і XL 518. 14 UA 103005 C2 5 10 15 20 25 30 35 40 45 50 55 Прикладами інгібіторів mTor є темсиролимус, дефоролимус (є також інгібітором VEGFr), еверолімус (є також інгібітором VEGF) XL-765 (є також інгібітором PI3-кінази) і BEZ-235 (є також інгібітором PI3-кінази). Прикладами інгібіторів Akt є перифозин GSK-690693, RX-0201 і трицирибин. Прикладами інгібіторів cKit є маситиниб OSI-930 (є також інгібітором VEGFR), AC-220 (є також інгібітором Flt3 і PDGFR), тандутиниб (є також інгібітором Flt3 і PDGFR), акситиниб (є також інгібітором VEGFR і PDGFR), сунитиниб (є також інгібітором Flt3, PDGFR, VEGFR) і XL820 (є також інгібітором VEGFR і PDGFR), іматиниб (є також інгібітором bcr-abl), нилотиниб (є також інгібітором bcr-abl і PDGFR). Прикладами антагоністів білка hedgehog є IPI-609, CUR-61414, GDC-0449, IPI 926 і XL-139. Прикладами інгібіторів CDK є селициклиб AT-7519, P-276, ZK-CDK (є також інгібітором VEGFR2 і PDGFR), PD-332991, R-547, SNS-032, PHA-690509, PHA-848125 і SCH-727965. Прикладами інгібіторів протеосоми є бортезомиб, карфилзомиб і NPI-0052 (є також інгібітором NFkappaB). Прикладами інгібіторів протеосоми /інгібіторів шляхи NFkappaB є бортезомиб, карфилзомиб NPI-0052, CEP-18770, MLN 2238, PR-047, PR-957, AVE-8680 і SPC-839. Прикладом інгібітору шляху убіквитинизації є HBX-41108. Прикладами антиангіогенних засобів є інгібітори FGFR, PDGFR і VEGF(R) і талидомиди, вказані засоби вибирають з групи, що включає, але, не обмежуючись лише ними, бевацизумаб, мотесаниб CDP-791, SU-14813, телатиниб KRN-951, ZK-CDK (є також інгібітором CDK), ABT869, BMS-690514, RAF-265, IMC-KDR, IMC-18F1, IMiD, талидомид CC-4047, леналидомид ENMD 0995, IMC-D11, Ki 23057, бриваниб, цедираниб, 1B3, CP 868596, IMC 3G3, R-1530 (є також інгібітором Flt3), сунитиниб (є також інгібітором cKit і Flt3), акситиниб (є також інгібітором cKit), лестауртиниб (є також інгібітором Flt3 і PKC), ваталаниб, тандутиниб (є також інгібітором Flt3 і cKit), пазопаниб PF-337210, афлиберцепт E-7080, CHIR 258, сорафениба тозилат (є також інгібітором Raf), вандетаниб CP-547632, OSI-930, AEE-788 (є також інгібітором EGFR і Her2), BAY-57-9352 (є також інгібітором Raf), BAY-73-4506 (є також інгібітором Raf), XL 880 (є також інгібітором cMet), XL 647 (є також інгібітором EGFR і EphB4), XL 820 (є також інгібітором cKit), нилотиниб (є також інгібітором cKit і brc-abl) CYT-116, PTC-299, BMS 584622, CEP-11981, довитиниб CY-2401401 і ENMD-2976. Додатковий терапевтичний агент можна вибирати також з інгібіторів EGFR, він може бути низькомолекулярним інгібітором EGFR або антитіло до EGFR. Прикладами антитіл до EGFR є, але, не обмежуючись лише ними, цетуксимаб, панитумумаб, нимотузумаб, залутумумаб; прикладами низькомолекулярних інгібіторів EGFR є гефитиниб, ерлотиниб і вандетаниб (є також інгібітором VEGFR). Іншим прикладом модулятора EGFR є злитий з токсином EGF. Іншими інгібіторами EGFR і/або Her2, які можна застосовувати у поєднанні з молекулою антитіла до CD37, пропонованою у винаході, є лапатиниб, трастузумаб, пертузумаб XL 647, нератиниб BMS-599626 ARRY-334543, AV-412, mAB-806, BMS 690514, JNJ-26483327, AEE-788 (є також інгібітором VEGFR), AZD-8931, ARRY-380 ARRY-333786, IMC-11F8, земаб TAK-285, AZD-4769. Додатковий лікарський засіб можна вибирати також з агентів, мішенню яких є IGF 1R і шляхи інсулінового рецептора. До таких агентів відносяться антитіла, які зв'язуються з IGF 1R (наприклад CP-751871, AMG-479, IMC-A12, MK 0646, AVE 1642, R 1507, BIIB 022, SCH 717454, rhu Mab IGFR і нові хімічні субстанції, мішенню яких є кіназний домен IGF1-R (наприклад, OSI906 або BMS-554417, XL-228, BMS-754807). Інші агенти, які доцільно об'єднувати з молекулою антитіла до CD37, пропонованою у винаході, є молекули, мішенню яких є CD20, у тому числі такі специфічні для CD20 антитіл, як ритуксимаб LY-2469298, окрелизумаб MEDI-552, IMMU-106, GA-101 (= R7159), XmAb-0367, офатумумаб, що мітяться радіоактивним ізотопом антитіла до CD20 типа тоситумумаба і ібритумомаба тиуксетана або інші білки, мішенню яких є CD20, типа SMIP Tru015, PRO-131921, FBT A05, велтузумаба, R-7159. Антитіла до CD37 можна об'єднувати з інгібіторами інших розташованих на поверхні антигенів, які експресуються на лейкоцитах, зокрема антитілами або молекулами, що нагадують антитіла, наприклад, з антитілом до CD2 (сиплізумаб), антитілом до CD4 (занолімумаб), антитілом до CD19 (MT-103, MDX-1342, SAR-3419, XmAb-5574), антитілом до CD22 (епратузумаб), антитілом до CD23 (луміліксимаб), антитілом до CD30 (іратумумаб), антитілом до CD32B (MGA-321), антитілом до CD38 (HuMax-CD38), антитілом до CD40 (SGN40), антитілом до CD52 (алемтузумаб), антитілом до CD80 (галіксимаб). Антитіло, пропоноване у винаході, можна об'єднувати також з іншим антагоністом CD37, наприклад, з TRU-016. 15 UA 103005 C2 5 10 15 20 25 30 35 40 45 50 55 60 Інші агенти, яких можна об'єднувати з антитілами до CD37, є іммунотоксини, такі як BL-22 (іммунотоксин до CD22), інотузумаба озогаміцин (кон'югат антитіло до CD23 - каліхеаміцин), RFT5.dgA (кон'югат А ланцюг токсину рицини - антитіло до CD25), SGN-35 (кон'югат антитіло до CD30 - аурістатін E) і гемтузумаба озогаміцин (кон'югат антитіло до CD33 - каліхеаміцин), MDX90 1411 (кон'югат антитіла до CD70) або мічені радіоактивним ізотопом антитіла типу Yепратузумаб (радіоїммунокон'югат антитіла до CD22). Крім того, антитіла до CD37 можна об'єднувати з імуномодуляторами, агентами, наприклад, антитілами, які індукують апоптоз або модифікують шляхи трансдукції сигналів, такими як модулятори TRAIL-рецептора, наприклад, мапатумумаб (агоніст TRAIL-1-рецептора), лексатумумаб (агоніст TRAIL-2-рецептора), тігатузумаб, апомаб, AMG-951 і AMG-655; антитіло до HLA-DR (типу 1D09C3), антитіло до CD74, інгібітор ліганда фактора диференціювання остеокластов (типу деносумаба), антагоніст BAFF (типа AMG-623a) або агоніст Toll-подібного рецептора (наприклад, TLR 4 або TLR-9). Інші лікарські засоби, які можна застосовувати у поєднанні з молекулами антитіл, пропонованими в дійсному винаході, вибирають з групи, що включає, але, не обмежуючись лише ними, гормони, аналоги гормонів і антигормональні засоби (наприклад, тамоксифен, торемифен, ралоксифен, фулвестрант, мегестрола ацетат, флутамід, нілутамід, бікалутамід, ципротерону ацетат, фінастерид, бусереліна ацетат, флудрокортизон, флуоксиместерон, медроксипрогестерон, гідроксипрогестерона капроат, діетилстилбестрол, тестостерона пропіонат, флуоксиместерон/його еквіваленти, остреотид, арзоксифен, пасиреотид, вапреотид, адренокортикостероїди/їх антагоністи, преднізон, дексаметазон, аминоглутетимид), інгібітори ароматази (наприклад, анастрозол, летрозол, лиарозол, ексеместан, атаместан, форместан), агоністи і антагоністи LHRH (наприклад, госерелина ацетат, леупролід, абарелікс, церторелікс, деслорелін, гістрелін, трипторелін), антиметаболіти (наприклад, антифолати типа метотрексату, триметрексата, пеметрекседа, аналоги піримідину типа 5 фторурацила, флуородезоксиуридіна, капецітабіна, децитабіна, неларабіна, 5-азацитидіна і гемцитабіна, аналоги пурину і аденозина, такі як меркаптопурин, тіогуанін, азатіоприн, кладрибин і пентостатин, цитарабін, флударабін, клофарабін); протипухлинні антибіотики (наприклад, антрациклини, такі як доксорубіцин, даунорубіцин, епірубіцин і ідарубіцин, мітоміцин-C, блеоміцина дактиноміцин, плікаміцин, актиноміцин D, мітоксантрон, мітоксантронідарубіцин, піксантрон, стрептозоцин, афідиколін); похідні платини (наприклад, цисплатин, оксалиплатин, карбоплатин, лобаплатин, сатраплатин); алкілуючі засоби (наприклад, естрамустин, семустин, мехлоретамин, мелфалан, хлорамбуцил, бусульфан, дакарбазин, циклофосфамід, іфосфамід, гідроксимочевина, темозоломид, нитрозомочевини, такі як кармустин і ломустин, тіотепа); антимітотичні засоби (наприклад, алкалоїди барвінку типа винбластина, виндесина, винорелбина, винфлунина і винкристина; і таксани, такі як паклитаксел, доцетаксел і їх препаративні форми, ларотаксел; симотаксел і епотилони типа іксабепилона, патупилона ZK-EPO); інгібітори топоизомерази (наприклад, епиподофиллотоксини, такі як етопосид і етопофос, тенипосид, амсакрин, топотекан, іринотекан, баноксантрон, камптотецин) і хіміотерапевтичні агенти різного типа, такі як похідні ретиноївої кислоти, амифостин, анагрелид, інтерферон альфа, інтерферон бета, інтерферон гамма, інтерлейкин-2, прокарбазин N-метилгідразин, митотан і порфимер, бексаротен, целекоксиб, етиленимін/метилмеламін, триетиленмеламин, триетилентиофосфорамід, гексаметилмеламин, і ферменти, такі як L-аспарагиназа L-аргіназа, і метронидазол, мисонидазол, десметилмисонидазол, пимонидазол, етанидазол, ниморазол RSU 1069, EO9, RB 6145, SR4233, нікотинамід, 5-бромдезоксиуридин, 5-йоддезоксиуридин, бромдезоксицитидин, еритрогідроксинониладенин, антраценедион GRN 163L (конкурентний антагоніст матриці теломерази), SDX-101 (агоніст PPAR), талабостат (інгібітор DPP), фородезин (інгібітор PNP), атацицепт (розчинний рецептор представників сімейства TNF BLyS і APRIL), агенти, нейтралізуючі TNF-альфа (енбрел, хуміра, ремикад) XL-844 (інгібітор CHK1/2), VNP-40101M (ДНК-алкилирующий агент), SPC-2996 (антисмисловий інгібітор bcl2), обатоклакс (інгібітор bcl2), ензастаурин (модулятор PKC-бета), воринистат (інгібітор HDAC), ромидепсин (інгібітор HDAC) AT-101 (інгібітор Bcl-2/Bcl-xL), плитидепсин (багатофункціональний депсипептид) SL-11047 (модулятори метаболізму поліаминів). У деяких варіантах здійснення винаходу молекулу антитіла до CD37 застосовують у поєднанні з "CHOP" (комбінація циклофосфаміду, доксорубицину, винкристину і преднізону). Молекулу антитіла до CD37, пропоновану у винаході, можна застосовувати також у поєднанні з іншими шляхами лікування, включаючи хірургію, променеву терапію, ендокринну терапію, лікування за допомогою біологічних модифікаторів відповіді, гіпертермію і кріотерапію, і лікування за допомогою засобів, призначених для зниження яких-небудь побічних дій (наприклад, протиблювотні засоби) G-CSF, GM-CSF, фотосенсибілізуючі засоби, такі як похідні 16 UA 103005 C2 5 10 15 20 25 30 35 40 45 50 55 гематопорфірину Photofrin®, похідні бензопорфірину Npe6, етиопорфирин олова, феоборид-a, бактеріохлорофил-a, нафталоцианини, фталоцианини, фталоцианини цинку. Моноклональні антитіла характеризуються високою специфічністю відносно антигена і часто взаємодіють лише з людським антигеном-мішенню, але не взаємодіють з гомологічними білками з різних видів тварин. Для розробки терапевтичних антитіл потрібні відповідні створені на тваринах моделі для оцінки in vivo токсичності і фармакодинамічної поведінки. Як одну з моделей in vivo можна застосовувати трансгенних мишей, в організмі яких ендогенний антигенмішень замінений на людський гомолог (миша типа "knock-out/knock-in"). Зокрема для розробки терапевтичних антитіл до CD37 мишачий ген CD37 можна замінювати, на людський ген CD37. Для цієї мети можна конструювати забезпечуюче спрямоване перенесення вектор, який містить кодуючу послідовність генома людського гена CD37, фланкірованну нетрансльованими послідовностями. Це забезпечуюче спрямоване перенесення вектор можна застосовувати для гомологічної рекомбінації, використовуючи мишачі ES-клітини. Трансгенних тварин, гомозиготних відносно експресії людського CD37, можна застосовувати для оцінки фармакодинамічної дії антитіл відносно людського CD37, наприклад, шляхом моніторингу кількості периферичних В-клітин після обробки антитілами. У альтернативному варіанті вказаних мишей можна застосовувати для вивчення можливих токсичних дій специфічних для людського CD37 антитіл після внутрішньовенного (i.v.) введення. Іншим варіантом в разі відсутності перехресної реакції моноклональних антитіл в організмі тварин є створення так званих сурогатних антитіл. Сурогатне антитіло є антитілом, яке взаємодіє з гомологічним білком різних видів тварин, яке є доречним і яке можна застосовувати для вивчення фармакодінамичних дій, наприклад, на мишах або макаках-крабоїдах (яванський макак). У випадку CD37 створюють моноклональні антитіла, які є специфічними для CD37 макака або CD37 миші відповідно. У ідеальному варіанті сурогатне антитіло повинне володіти аналогічною здатністю до скріплення і функціональними властивостями, що і створене антитіло. Це можна досліджувати, застосовуючи системи аналізу, в яких використовують експресуючі CD37 клітини макака або миші в якості клітин-мішеней, наприклад, для оцінки скріплення, FACS з використанням аналізу Скетчарда, аналізу ADCC і апоптозу. Врешті-решт сурогатне антитіло можна вибирати на основі його здатності викликати B-клітинне виснаження в крові макак або мишей in vitro. Короткий опис креслень: На кресленнях показано: на фіг. 1 - дані, отримані за допомогою конкурентного FACS-аналізу, які свідчать про те, що химерне антитіло A0 специфічно розпізнає антиген CD37; на фіг. 2 - дані про скріплення гуманізованих версій A0 з клітинним антигеном CD37, отримані з допомогою FACS-аналізу; на фіг. 3 - дані про скріплення гуманізованих версій A0 з клітинним антигеном CD37, отримані з допомогою FACS-аналізу; на фіг. 4 - дані про афінності гуманізованих версій A0 до клітинного антигена CD37, отримані з допомогою FACS з використанням аналізу Скетчарда; на фіг. 5 - дані про ADCC-активності гуманізованих версій A0 у відношенні Ramos-клітин; на фіг. 6- дані про проапоптозну активність гуманізованих версій A0 у відношенні Ramosклітин; на фіг. 7 - дані про ADCC-активності версій МАт A0 із сконструйованим Fc у відношенні Ramos-клітин; на фіг.8 - дані про ADCC-активності версій МАт В0 со сконструйованим Fc у відношенні Ramos-клітин; на фіг. 9 - дані про проапоптозну активність МАт A0 і B0; на фіг. 10 - дані про проапоптозну активність версій МАт A0 із сконструйованим Fc; на фіг. 11 А - дані про виснаження здорових людських В-клітин при аналізі цілісної крові з використанням версій антитіл A2 і B2 із сконструйованим Fc порівняно з ритуксимабом; фіг. 11 Б - дані, що свідчать про підвищену в порівнянні з ритуксимабом здатність версій антитіл із сконструйованим Fc викликати B-клітинне виснаження; на фіг. 11 В - дані, що свідчать про те, що антитіла A2 і B2 не володіють здатністю виснажувати T-клітини і моноцити при аналізі цілісної крові; на фіг. 12 - дані, що свідчать про підвищену в порівнянні з ритуксимабом ADCC-активність антитіл із сконструйованим Fc; на фіг. 13 - дані про виснаження Ramos-клітин з лімфоми Беркитта за допомогою версій антитіл А2 і В2 із сконструйованим Fc при аналізі цілісної крові порівняно з ритуксимабом; 17 UA 103005 C2 5 10 15 20 25 30 35 40 45 на фіг. 14 - дані про інгібірування in vivo зростання пухлин у бестимусних мишей при оцінці на моделі ксенотрансплантату пухлинних Ramos-клітин за допомогою версій антитіл А2 і В2 із сконструйованим Fc; на фіг. 15 - дані про експресію CD37 на клітинах множинної мієломи; на фіг. 16 - дані про ADCC-активність антитіл A2 і B2 відносно клітин множинної мієломи; на фіг. 17 - дані про проапоптозну активність антитіл A2 і B2 відносно отриманих з організму пацієнта CLL-клітин. Приклад 1 Створення химерних і гуманізованих антитіл до CD37 а) Створення химерного антитіла A0 На основі амінокислотних послідовностей варіабельних областей важкого і легкого ланцюга, представлених в SEQ ID NO: 2 і SEQ ID NO:4, синтезували відповідні послідовності ДНК, застосовуючи частоту зустрічальності кодонів, оптимальну для клітин ссавців (фірма GeneArt, Регенсбург, Німеччина), додаючи на 5'-кінець сайт клонування HindIII і на 3'-кінець сайт клонування BamH1. Синтезовані молекули ДНК розщеплювали HindIII і BamHI і ДНК-фрагменти, що утворилися (SEQ ID NO: 1 і SEQ ID NO: 3 плюс сайти рестрикції), клонували в експресійних векторах, основою яких є pcDNA3.1, що кодують константну область людського IgG1 і константну область людського легкого капа-ланцюга відповідно (SEQ ID NO: 24 і SEQ ID NO: 26). Отримували плазмидні препарати EndoFree (фірма Qiagen) і плазмидами важкого і легкого ланцюга спільно трансфектували HEK293-клітини лінії FreeStyle (фірма Invitrogen), використовуючи кожну плазмиду в концентрації 1 мг/л, згідно з протоколом постачальника. Через 72 г супернатант збирали і визначали концентрацію IgG з допомогою ELISA. Химерне антитіло, що утворилося, до CD37 (позначене A0) очищали на колонці з модифікованим білком А, елюювали цитратним буфером, після чого піддавали діалізу в протитечії ЗФР. б) Створення гуманізованих версій химерного антитіла A0 Гуманізацію химерного МАт A0, отриманого згідно з методом, описаним в розділі a), здійснювали на основі підходу трансплантації CDR, який описаний, наприклад, в US 5225539; US 6548640; US 6982321. Для створення структурної моделі VL-області МАт А0 вибирали структурну матрицю з бази даних банку білків (Protein Data Bank (PDB)) національної лабораторії Брукхевена (Brookhaven National Laboratory). Вибирали VL-область мишачого моноклонального антитіла, позначеного як "1KB5", послідовність якої характеризувалася ідентичністю на рівні 88 % і схожістю на рівні 81 % при дозволі 2,5 Å. Для створення VH-області МАт А0 як основну модель матриці вибирали структуру того ж мишачого моноклонального антитіла "1KB5", послідовність якої характеризувалася ідентичністю на рівні 90 % і схожістю на рівні 91 %. Встановлено, що "найкращим підбором" для людської консенсусної каркасної ділянки є людська Vкаппа1 (hVK1) і людська VH1 (hVH1). Як альтернативний шлях конструювання вибирали трансплантацію в найбільш стабільні людські консенсусні області hVK3 і hVH3. Для трансплантації моделі МАт A0_VL і МАт A0_VH об'єднували з моделями людської консенсусної області hVK1, hVK3, hVH1A і hVH3 із одержанням Fv-моделей. Трансплантацію в петлю здійснювали шляхом занурення CDR-ділянок мишастого МАт A0 в каркасні ділянки людського антитіла і синтезували молекули ДНК-конструкцій гуманізованих ланцюгів. Відповідні гуманізовані варіабельні області синтезували і клонували в тих, що кодують імуноглобулін експресійних векторах і здійснювали короткочасну експресію в системі експресії HEK293 FreeStyle (фірма Invitrogen), що описана в розділі а), використовуючи поєднання послідовностей важких і легкий ланцюгів, які представлені в таблиці 1, і очищали на колонках з білком А. Таблиця 1 Послідовності варіабельних областей важких і легких ланцюгів химерних і гуманізованих антитіл до CD37, які використовували в прикладах Антитіло A (=A0) B C D H Важкий ланцюг SEQ ID NO: ак/ДНК seq 2/1 seq 6/5 seq 6/5 seq 6/5 seq 8/7 18 Легкий ланцюг SEQ ID NO: ак/ДНК seq 4/3 seq 12/11 seq 14/13 seq 16/15 seq 18/17 UA 103005 C2 Таблиця 1 Послідовності варіабельних областей важких і легких ланцюгів химерних і гуманізованих антитіл до CD37, які використовували в прикладах Антитіло I J K L M 5 10 15 20 Важкий ланцюг SEQ ID NO: ак/ДНК seq 8/7 seq 8/7 seq 10/9 seq 10/9 seq 10/9 Легкий ланцюг SEQ ID NO: ак/ДНК seq 20/19 seq 22/21 seq 18/17 seq 20/19 seq 22/21 в) Створення химерних і гуманізованих антитіл до CD37 із сконструйованим Fc Для створення Fc-мутантів використовували метод, описаний у Lazar та ін., 2006. Отриману послідовність важкого ланцюга із сконструйованим Fc інтродуціювали в експресійний вектор pAD-CMV1 (описаний в EP 393438) і здійснювали з використанням цього вектору спільно з плазмидой, що містить кодуючу послідовність, трансфекцію клітин CHO-DG44. Антитіло виділяли з культуральних середовищ через 5-7 днів після трансфекції і очищали за допомогою хроматографії на білці А, елюювали цитратним буфером, після чого піддавали діалізу в протитечії ЗФР. Вміст білка в зразках визначали за допомогою ЖХВР на білці А, вміст ендотоксину визначали за допомогою хромогенного аналізу з використанням набору KineticQCL (фірма Lonza). Вміст мономерів в зразку визначали з допомогою HP-SEC (гель фільтрація високого дозволу), у всіх вживаних для оцінки функціональної активності зразках вміст мономерів > 95 %. Таблиця 2 Послідовності варіабельних областей важких і легких ланцюгів (колонки III і IV) і Fc-мутантів (колонка II) химерних і гуманізованих антитіл до CD37 (антитіло A0, B0, C0 і так далі ідентичні антитілам A і B, C і так далі в таблиці 1) Повнорозмірні послідовності важких і легких ланцюгів представлені в колонках V і VI. (Послідовності в колонці V, помічені *, позначають послідовність IgG1, представлену в SEQ ID NO: 24 і 23 (послідовності дикого типа), які модифіковані таким чином, що включають заміну(и), відповідну(і) вказаним в колонці II, і відповідну(і) мутацію(ї) в кодуючій ДНК) I II Aт Заміна(и) в Fc(нумерація за Кеботом) A0 A1 A2 A3 A4 I332E S239D/I332E I332E/G236A S239D/I332E/G236A B0 III SEQ ID NO: v важкого ланцюга ак/ДНК seq 2/1 seq 2/1 seq 2/1 seq 2/1 seq 2/1 IV V SEQ ID NO: v SEQ ID NO: легкого Повний важкий ланцюга ланцюг ак/ДНК ак/ДНК seq 4/3 2/1 злита з 24/23 seq 4/3 2/1 злита з 24*/23* seq 4/3 28/27 seq 4/3 2/1 злита з 24*/23* seq 4/3 32/31 seq 6/5 seq 12/11 6/5 злита з 24/23 B1 I332E seq 6/5 seq 12/11 6/5 злита з 24*/23* B2 S239D/I332E seq 6/5 seq 12/11 36/35 B3 I332E/G236A seq 6/5 seq 12/11 6/5 злита з 24*/23* B4 S239D/I332E/G236A seq 6/5 seq 12/11 40/39 seq 6/5 seq 14/13 6/5 злита з 24/23 C0 C1 I332E seq 6/5 seq 14/13 6/5 злита з 24*/23* C2 S239D/I332E seq 6/5 seq 14/13 6/5 злита з 24*/23* 19 VI SEQ ID NO: Повний легкий ланцюг ак/ДНК 4/3 злита з 26/25 4/3 злита з 26/25 30/29 4/3 злита з 26/25 34/33 12/11 злита з 26/25 12/11 злита з 26/25 38/37 12/11 злита з 26/25 42/41 14/13 злита з 26/25 14/13 злита з 26/25 14/13 злита з 26/25 UA 103005 C2 I II Aт Заміна(и) в Fc(нумерація за Кеботом) III IV SEQ ID NO: SEQ ID NO: v v важкого легкого ланцюга ланцюга ак/ДНК ак/ДНК V VI SEQ ID NO: Повний важкий ланцюг ак/ДНК SEQ ID NO: Повний легкий ланцюг ак/ДНК C3 I332E/G236A seq 6/5 seq 14/13 6/5 злита з 24*/23* C4 S239D/I332E/G236A seq 6/5 seq 14/13 6/5 злита з 24*/23* seq 6/5 seq 16/15 6/5 злита з 24/23 D0 D1 I332E seq 6/5 seq 16/15 6/5 злита з 24*/23* D2 S239D/I332E seq 6/5 seq 16/15 6/5 злита з 24*/23* D3 I332E/G236A seq 6/5 seq 16/15 6/5 злита з 24/*23* D4 S239D/I332E/G236A seq 6/5 seq 16/15 6/5 злита з 24/*23* seq 8/7 seq 18/17 8/7 злита з 24/23 H0 H1 I332E seq 8/7 seq 18/17 8/7 злита з 24*/23* H2 S239D/I332E seq 8/7 seq 18/17 8/7 злита з 24*/23* H3 I332E/G236A seq 8/7 seq 18/17 8/7 злита з 24*/23* H4 S239D/I332E/G236A seq 8/7 seq 18/17 8/7 злита з 24*/23* seq 8/7 seq 20/19 8/7 злита з 24/23 I-0 I-1 I332E seq 8/7 seq 20/19 8/7 злита з 24*/23* I-2 S239D/I332E seq 8/7 seq 20/19 8/7 злита з 24*/23* I-3 I332E/G236A seq 8/7 seq 20/19 8/7 злита з 24*/23* I-4 S239D/I332E/G236A seq 8/7 seq 20/19 8/7 злита з 24*/23* seq 8/7 seq 22/21 8/7 злита з 24/23 J0 J1 I332E seq 8/7 seq 22/21 8/7 злита з 24*/23* J2 S239D/I332E seq 8/7 seq 22/21 8/7 злита з 24*/23* J3 I332E/G236A seq 8/7 seq 22/21 8/7 злита з 24*/23* J4 S239D/I332E/G236A seq 8/7 seq 22/21 8/7 злита з 24*/23* seq 10/9 seq 18/17 10/9 злита з 24/23 K0 K1 I332E seq 10/9 seq 18/17 K2 S239D/I332E seq 10/9 seq 18/17 K3 I332E/G236A seq 10/9 seq 18/17 K4 S239D/I332E/G236A seq 10/9 seq 18/17 20 10/9 злита з 24*/23* 10/9 злита з 24*/23* 10/9 злита з 24*/23* 10/9 злита з 24*/23* 14/13 злита з 26/25 14/13 злита з 26/25 16/15 злита з 26/25 16/15 злита з 26/25 16/15 злита з 26/25 16/15 злита з 26/25 16/15 злита з 26/25 18/17 злита з 26/25 18/17 злита з 26/25 18/17 злита з 26/25 18/17 злита з 26/25 18/17 злита з 26/25 20/19 злита з 26/25 20/19 злита з 26/25 20/19 злита з 26/25 20/19 злита з 26/25 20/19 злита з 26/25 22/21 злита з 26/25 22/21 злита з 26/25 22/21 злита з 26/25 22/21 злита з 26/25 22/21 злита з 26/25 18/17 злита з 26/25 18/17 злита з 26/25 18/17 злита з 26/25 18/17 злита з 26/25 18/17 злита з 26/25 UA 103005 C2 I II Aт Заміна(и) в Fc(нумерація за Кеботом) L0 III IV SEQ ID NO: SEQ ID NO: v v важкого легкого ланцюга ланцюга ак/ДНК ак/ДНК seq 10/9 seq 20/19 L1 I332E seq 10/9 seq 20/19 L2 S239D/I332E seq 10/9 seq 20/19 L3 I332E/G236A seq 10/9 seq 20/19 L4 S239D/I332E/G236A seq 10/9 seq 20/19 seq 10/9 seq 22/21 M0 M1 20 25 30 35 S239D/I332E seq 10/9 seq 22/21 I332E/G236A seq 10/9 seq 22/21 M4 15 seq 22/21 M3 10 seq 10/9 M2 5 I332E S239D/I332E/G236A seq 10/9 seq 22/21 V VI SEQ ID NO: Повний важкий ланцюг ак/ДНК SEQ ID NO: Повний легкий ланцюг ак/ДНК 10/9 злита з 24/23 10/9 злита з 24*/23* 10/9 злита з 24*/23* 10/9 злита з 24*/23* 10/9 злита з 24*/23* 10/9 злита з 24/23 10/9 злита з 24*/23* 10/9 злита з 24*/23* 10/9 злита з 24*/23* 10/9 злита з 24*/23* 20/19 злита з 26/25 20/19 злита з 26/25 20/19 злита з 26/25 20/19 злита з 26/25 20/19 злита з 26/25 22/21 злита з 26/25 22/21 злита з 26/25 22/21 злита з 26/25 22/21 злита з 26/25 22/21 злита з 26/25 Приклад 2 Химерне МАт A0 специфічно розпізнає антиген CD37 Специфічність МАт A0 відносно клітинного CD37 оцінювали за допомогою конкурентного FACS-аналізу з використанням клітин Ramos з лімфоми Беркитта (ATCC №CRL-1596). Клітини 2 вирощували в колбах для культури тканини (175 см ) з використанням як культуральне середовище RPMI-1640+GlutaMAX, доповненою 10 % інактивованою тепловою обробкою фетальної бичачої сироватки, 12,5мМ HEPES, 1 мМ піруватом натрію, 1 % середовища MEM, 5 що містить замінимі амінокислоти. Клітини культивували з початковою щільністю 3×10 клітин/мл при 37 °C і 5 % CO2 в зволоженій атмосфері протягом 3 днів. У культурах 5 6 підтримували концентрацію клітин на рівні від 3×10 до 1,8×10 /мл шляхом пересівання в співвідношенні 1:6 в свіже середовище 2-3 рази на тиждень. Для конкурентних FACS-аналізів CD37-специфічне МАт HH1 (фірма Santa Cruz), безпосередньо мічене фікоеритрином (ФЕ), використовували в концентрації 1 мкг/мл. Антитіло заздалегідь інкубували з неміченим конкурентним антитілом A0 протягом 10 мін при 4 °C у вказаному молярному співвідношенні. 5 Потім інкубували 1×10 клітин Ramos з сумішшю антитіл протягом 30 мін на льоду. Після цього клітини відмивали двічі забуференим фосфатом фізіологічним розчином (ЗФР), ре суспендували в FACS-буфері і оцінювали за допомогою пристрою типа BD FACS Canto. Результати вказаного аналізу представлені на фіг. 1. Додавання контрольного людського антитіла у вигляді IgG1 (фірма Sigma, IgG1-каппа) в 20-кратному молярному надлишку не знижувало істотно середню інтенсивність флуоресценції (MFI)клітин Ramos. Додавання або неміченого антитіла HH1, або антитіла А0 в 20 кратному молярному надлишку майже повністю анулювало скріплення безпосередньо міченого антитіла НН1. Цей результат свідчить про те, що антитіла A0 і HH1 розпізнають ідентичні або схожі епітопи на клітинах Ramos і конкурують за зв'язування з клітинним антигеном CD37. Приклад 3 Скріплення гуманізованих версій МАт A0 з клітинним антигеном CD37 Гуманізованих версій A0 оцінювали відносно їх зв'язування з клітинним антигеном CD37 з допомогою FACS-аналізу. Антитіла додавали до клітин Ramos у вказаних концентраціях і давали їм зв'язуватися протягом 30 мін при 4 °C. Потім зв'язане антитіло виявляли за допомогою міченого ФЕ козиного антилюдського антитіла у вигляді IgG (фірма Sigma), клітини відмивали двічі ЗФР, і після цього ресуспендували в FACS-буфері і аналізували FACS-методом з використанням пристрою типа BD FACS Canto. Приклади представлені на фіг. 2 і 3 (антитіла A, B, C, D, I або A, H, I, J, K, L і M відповідно; див. таблицю 1). Декілька гуманізованих версій A0 характеризувалися зв'язуванням з клітинами Ramos, аналогічним скріпленню батьківського 21 UA 103005 C2 5 10 15 20 25 30 35 40 45 50 55 антитіла A0, цей результат свідчить про те, що гуманізація не знижує зв'язування з клітинним антигеном CD37. Приклад 4 FACS з використанням аналізу Скетчарда гуманізованих версій химерного МАт A0 Афінність гуманізованих версій антитіла A0 (позначених як B, C, D, H, I і K; див. таблицю 1) до клітинного антигена CD37 визначали описаним раніше методом FACS з використанням аналізу Скетчарда (Brockhoff та ін., 1994). В цілому метод полягав в наступному: готували розведення антитіл в 96-лучночному планшеті, починаючи з 100-400 нМ в першій лунці (80 мкл), потім здійснювали 11 стадій розведення (1:2, 40+40 мл). Додавали по 50 мкл МАт в пробірки для здійснення FACS, у кожну пробірку для здійснення FACS додавали по 150 мкл клітин 6 5 (0,8×10 /мл=1,2×10 клітин/пробірку). Клітини обережно змішували і інкубували протягом 1 г на льоду. Потім додавали 50 мкл кон'югірованого з ФИТЦ вторинного антитіла (концентрація 15 мкг/мл; мишасте МАт до людського IgG всіх підкласів, фірма Zymed, № 05-4211), змішували і інкубували протягом 30 мін на льоду. Потім додавали 4 мл ЗФР, рН 7,2, що містить 0,02 % кислоти, клітини пелетирували і ресуспендували в 300 мкл ЗФР pH 7,2 і піддавали FACSаналізу за допомогою пристрою типа BD FACS Canto. Всі стадії експерименту здійснювали на вологому льоду, всі розведення антитіл здійснювали в ЗФР/0,5 % БСА + 0,02 % кислоти. Калібрування для FACS-аналізу здійснювали за допомогою тих, що входять в набір Quantum FITC MESF (Premix) гранул у високій концентрації (High Level Bead) (фірма Bangs Laboratories). У всіх зразках оцінювали одні і ті ж FACS-параметри. Співвідношення зв'язаного IgG і вільного IgG розраховували на основі значень MFI при різних концентраціях антитіл і представляли у вигляді Скетчард-блота. На фіг. 4 показаний взаємозв'язок MFI/концентрацією антитіла декількох гуманізованих варіантів A0. Результати демонструють, що зв'язування з клітинами Ramos деяких гуманізованих версій було схожим із скріпленням вихідного антитіла, при цьому значення констант дисоціації (Kd) складали від 2,15 до 4,90 наномілі/л. Приклад 5 ADCC-активність гуманізованих версій химерного МАт A0 Здатність гуманізованих версій A0 (які позначені як B, C, D, H, J, K; див. таблицю 1) опосередкувати обумовлену для антитіла клітиннозалежну цитотоксичність (ADCC) оцінювали, використовуючи клітини лінії Ramos в якості клітин-мішеней і що стимулюючі IL2 людські PBMC як ефекторні клітини. Клітини лінії Ramos (з лімфоми Беркитта; ATCC №CRL-1596) отримували від ATCC. Клітини вирощували в колбах для культури тканини (175 см2) з використанням в якості культурального середовища RPMI-1640+GlutaMAX, доповненого 10 % інактивованою тепловою обробкою фетальної бичачої сироватки, 12,5 мМ HEPES, 1 мМ піруватом натрію, 1 % середовища MEM, що містить замінимі амінокислоти. Клітини культивували з початковою 5 щільністю 3×10 клітин/мл при 37 °C і 5 % CO2 в зволоженій атмосфері протягом 3 днів. У 5 6 культурах підтримували концентрацію клітин на рівні від 3×10 до 1,8×10 /мл шляхом пересівання в співвідношенні 1:6 в свіже середовище 2-3 рази на тиждень. Аліквоти клітинної 6 6 культури з щільністю клітин від 1,5×10 /мл до 1,8×10 /мл і що знаходяться на логарифмічній фазі зростання центрифугували (200×g, тобто 1000 об/мін) протягом 10 мін. Клітини відмивали однократно середовищем для відмивання (RPMI 1640 без L-глутаміну) і пелетирували (200×g, тобто 1000 об/мін; 10 мін). Клітинний дебрис ресуспендували в середовищі для аналізу [1 % БСА в RPMI без L-глутаміну] і визначали кількість клітин. Концентрацію клітин доводили до 5 2×10 /мл. Приблизно 50-80 мл цілісної крові здорових донорів використовували для виділення PBMC. 10 мл цілісної крові розводили в співвідношенні 1:3,6 26 мл HBSS (збалансований сольовий розчин Хенкса без кальцію і магнію) у 50- мілілітровій пробірці. 18 мл розведеної цілісної крові настилали зверху на 12 мл реагенту Lymphoprep (фірма Nycomed Pharma) у 50-мілілітровій пробірці і центрифугували при 370×g (1400 об/мін) протягом 35 мін. Мононуклеарні клітини з поверхні відбирали аспірацією і відмивали спочатку однократно HBSS (750×g, тобто 1900 об/мін; 10 мін), а потім двічі HBSS (300×g, тобто 1200 об/мін; 10 мін) і останній раз HBSS (160×g, тобто 900 об/мін; 10 мін). Пелетируванні клітини обережно ресуспендували за допомогою піпетки в культуральному середовищі/середовищу для аналізу (10 % інактивованою тепловою обробкою людської AB-сироватки в RPMI 1640 без L-глутаміну) визначали кількість клітин за 7 допомогою лічильника клітин. Концентрацію PBMC доводили до 1×10 /мл. Свіжовиділені PBMC 5 (5×10 /мл) підтримували в культуральному середовищі (RPMI 1640 без L-глутаміну, доповнена 10 % інактивованою тепловою обробкою людської AB-сироватки) в колбах для культури тканини 2 (75 см ) при 37 °C у CO2-інкубаторі протягом ночі. Наступного дня клітини стимулювали hIL-2 в кінцевій концентрації 1 од./мл на протязі ще 3 днів. Стимульовані IL-2 PBMC відділяли від 22 UA 103005 C2 5 10 15 20 25 30 35 40 45 50 55 60 клітинного дебриса в градієнті Lymphoprep. Очищені стимульовані IL-2 PBMC суспендували в 7 культуральному середовищі/середовищу для аналізу в концентрації 1×10 /мл. Спільне культивування ефекторних клітин з клітинами-мішенями у присутності специфічного або неспецефічного антитіла здійснювали в двох або трьох повторюваннях в 96-лункових круглодонних титраційних планшетах в кінцевому об'ємі 200 мкл середовища для аналізу на лунку, що містить 10 % людською AB-сироватки і 1 % БСА в RPMI у співвідношенні 1:1. Спочатку вносили ефекторні клітини (свіжовиділені PBMC-клітини в 100 мкл 10 % людської ABсироватки в RPMI на лунку), потім клітини-мішені і розчин антитіла, розведений в 50 мкл 1 % БСА в RPMI. Як контроль ефекторні клітини культивували лише в середовищі для аналізу (контроль ефекторних клітин), а клітини-мішені культивували або лише в середовищі для аналізу (спонтанний лізис), або в середовищі для аналізу, доповненому 1 % Triton X-100 (максимальний лізис). Отримані спільним культивуванням культури інкубували при 37 °C у зволожуючому CO2-інкубаторі протягом 3 г. Після періоду інкубації клітини видаляли з культурального середовища центрифугуванням (200×g, тобто 1000 об/мін; 10 мін) при кімнатній температурі. Що не містять клітин супернатанти (100 мкл/лунку) переносили у відповідні лунки 96-лункового круглодонного планшета. Для визначення активності лактатдегідрогенази (LDH) в цих супернатантах 100 мкл реакційної суміші (що змішали безпосередньо перед використанням 250 мкл каталізатора з 11,25 мл розчину фарбника) додавали в кожну лунку і інкубували протягом 30 мін при кімнатній температурі в темноті. Потім оцінювали абсорбцію згідно з описаним нижче методом. Для оцінки ADCC-активності застосовували набір для оцінки цитотоксичності (LDH; фірма Roche). Виявлення цитотоксичності основане на визначенні ферментативної активності LDH, що вивільняється з клітин з пошкодженою плазматичною мембраною. LDH, що вивільняється в супернатанти культур, відновлює сіль тетразолію, присутню в наборі, до формазана. Максимальну абсорбцію формазанового фарбника оцінюють при 490 нм порівняно з довжиною хвилі 650 нм за допомогою вживаного для ELISA планшет-ридера. Для розрахунку відсотка клітинно-опосередковуваної цитотоксичності для кожної серії експериментів використовували по 5 контролів. Контроль основного рівня I (1): активність LDH у середовищі для аналізу, яке віднімають із значень, вказаних в (3) і (5). Контроль основного рівня II (2): активність LDH у середовищі для аналізу, доповненому 1 % Triton-X100, яку віднімають з максимальних значень вивільнення LDH, вказаних в (4). Спонтанне вивільнення LDH (3): активність LDH, що вивільняється лише з клітин-мішеней. Максимальне вивільнення LDH (4): Максимальна активність LDH, яка може вивільнятися з клітин-мішеней. Контроль ефекторних клітин (5): активність LDH, що вивільняється лише з ефекторних клітин. Для визначення відсотка клітинно-опосередковуваної цитотоксичності розраховували середню абсорбцію по трьох або двом повторюванням і віднімали основний рівень згідно з інструкціями виробника. На фіг. 5 представлені результати оцінки ADCC при застосуванні ефекторних клітин: клітин-мішеней (E:T) в співвідношенні 25:1 і клітин лінії Ramos в якості клітин-мішеней. Антитіла додавали в концентрації 30 нг/мл. Як початкове МАт, так і його гуманізовані версії характеризувалися близькою ADCC-активністю відносно клітин Ramos. В цілому, гуманізація МАт до CD37 не змінювала істотно здатність індукувати ADCC. Приклад 6 Проапоптозна активність гуманізованих версій химерного МАт A0 Проапоптозну активність МАт A0 (=A) і його гуманізованих версій (B, C, D і I; див. таблицю 1) оцінювали, вимірюючи рівень аннексин V/PI (йодид пропідія)-позитивних клітин після інкубації клітин лінії Ramos з МАт. Клітини лінії Ramos (з лімфоми Беркитта; ATCC №CRL-1596) 2 отримували від ATCC. Клітини вирощували в колбах для культури тканини (175 см ) з використанням в якості культурального середовища RPMI-1640+GlutaMAX, доповненого 10 % інактивованою тепловою обробкою фетальної бичачої сироватки, 12,5 мМ HEPES, 1 мМ піруватом натрію, 1 % середовища MEM, що містить замінимі амінокислоти. Клітини 5 культивували з початковою щільністю 3×10 клітин/мл при 37 °C і 5 % CO2 в зволоженій 5 атмосфері протягом 3 днів. У культурах підтримували концентрацію клітин на рівні від 3×10 до 6 1,8×10 /мл шляхом пересівання в співвідношенні 1:6 в свіже середовище 2-3 рази на тиждень. 6 6 Аліквоти клітинної культури з щільністю клітин від 1,5×10 /мл до 1,8×10 /мл і що знаходяться на логарифмічній фазі зростання центрифугували (200×g, тобто 1000 об/мін) протягом 10 мін. Клітини відмивали однократно середовищем для відмивання (RPMI 1640 без L-глутаміну) і пелетирували (200×g, тобто 1000 об/мін; 10 мін). Клітинний дебрис ресуспендували в 23 UA 103005 C2 5 10 15 20 25 30 35 40 45 50 55 60 культуральному середовищі і визначали кількість клітин. Концентрацію клітин доводили до 6 1×10 //мл Висівали по 100 мкл клітинної суспензії на лунку 96-лункових круглодонних тітраціоних планшетів. Антитіла розводили в середовищі для культури клітин, що містить 10 % FBS, і додавали в кожну лунку по 100 мкл розчину антитіла. Клітини інкубували протягом 20-24 г при 37 °C у CO2-інкубаторі і потім забарвлювали за допомогою набору №2 для оцінки апоптозу типа Vybrant. У клітини додавали мічений за допомогою фарбника Alexa Fluor 488 аннексин V і розчин йодиду пропідія і інкубували протягом 15 мін в темноті. Потім клітини ресуспендували в 400 мкл буфера для скріплення аннексина V і піддавали FACS-аналізу за допомогою пристрою типа BD FACS Canto. Відсоток аннексин V-позитивних/PI-негативних клітин і аннексин V/PIпозитивних клітин визначали за допомогою двомірного дот-блоттинга, використовуючи FL1/FL2канали. Як негативний контроль використовували антитіло відповідного ізотипу, що не зв'язується (фірма Sigma, людський IgG1). На фіг. 6 представлені дані про проапоптозну дію різних гуманізованих версій МАт A відносно клітин лінії Ramos. Клітини інкубували з антитілом в концентрації 10 мкг/мл протягом 24 г, представлені дані про загальний процентний вміст аннексин V-позитивних клітин (PIпозитивних і PI-негативних). Для батьківського МАт A характерна сильна проапоптозна активність. При створенні винаходу несподівано було встановлено, що при використанні гуманізованих версій кількість аннексин V-позитивних клітин істотно знижувалося в порівнянні з батьківським МАт A, що свідчить про змінену проапоптозну активність гуманізованих антитіл. В цілому, в цій серії експериментів встановлено, що гуманізація МАт призводила до зниження проапоптозної активності. Приклад 7 ADCC-активність версій химерного МАт А0 із сконструйованими Fc ADCC-активність версій химерного МАт А0 із сконструйованими Fc (які позначені як A1, A2, A3, A4; див. таблицю 2) оцінювали з використанням в якості клітин-мішеней клітин лінії Ramos. ADCC оцінювали згідно з описаним вище методом (приклад 5). Результати експерименту представлені на фіг. 7. Для версій А0 із сконструйованими Fc виявлена в значній мірі підвищена активність і ефективність в порівнянні з батьківським МАт A0. При використанні деяких Fcваріантів підвищення максимального лізису досягало аж до 100 % в порівнянні з батьківським МАт, і величини EC50 підвищувалися аж до 10 разів в порівнянні з батьківським МАт. В цілому, інтродукція специфічних Fc-мутантів сильно підвищувала ADCC-активність химерного МАт A0. Приклад 8 ADCC-активність версій химерного МАт В0 із сконструйованими Fc ADCC-активність версій химерного МАт В0 із сконструйованими Fc (які позначені як В1, В2, В3, В4; див. таблицю 2) оцінювали з використанням в якості клітин-мішеней клітин лінії Ramos. ADCC оцінювали згідно з описаним вище методом (приклад 5). Для В0 із сконструйованими Fc виявлена в значній мірі підвищена активність і ефективність в порівнянні з батьківським МАт В0. При використанні деяких Fc-варіантів підвищення максимального лізису досягало аж до 80 % в порівнянні з батьківським МАт, і величини EC50 підвищувалися аж до 20 разів в порівнянні з батьківським МАт. В цілому,інтродукція специфічних Fc-мутантів значно підвищувала ADCCактивність гуманізованого МАт В0. Результати експерименту представлені на фіг. 8. Приклад 9 Проапоптозна активність МАт A0 і B0 Дані про проапоптозну активність МАт A0 і B0 відносно клітин лінії Ramos до і після перехресного зшивання з МАт до IgG представлені на фіг. 9. Аналіз апоптозної активності здійснювали згідно з методом, описаним в прикладі 6, для перехресного зшивання антитіл додавали до антитіл антитіло до людського IgG (специфічне для -ланцюгу; фірма Sigma) у співвідношенні 1:1 і інкубували протягом 15 мін при 37 °C перед додаванням клітин-мішеней. На фіг. 9 представлені дані експерименту, при здійсненні якого CD37-специфічні перехресно зшиті і незшиті МАт додавали в концентрації 1 мкг/мл. Встановлено, що химерне МАт A0 є сильним індуктором апоптозу навіть без перехресного зшивання, ця дія істотно підвищувалася після перехресного зшивання МАт. При створенні винаходу несподівано було встановлено, що без перехресного зшивання у гуманізованого МАт B0 повністю була відсутня проапоптозна активність, проте у нього виявлена виражена проапоптозна активність після перехресного зшивання з Ат до IgG. В цілому, в цьому експерименті встановлено, що проапоптозна активність гуманізованої версії МАт A0 може відновлюватися після перехресного зшивання антитіла. Приклад 10 Проапоптозна активність версій МАт А0 із сконструйованими Fc Проапоптозну активність версій химерного МАт А0 із сконструйованими Fc відносно клітин Ramos оцінювали за допомогою фарбування аннексином V/PI згідно з методом, описаним в 24 UA 103005 C2 5 10 15 20 25 30 35 40 45 50 55 60 прикладі 6. Батьківське антитіло A0 і варіанти із сконструйованими Fc A2 і A4 титрували з використанням концентрацій від 0,1 до 10000 нг/мл Як видно з даних, представлених на фіг. 10, для всіх трьох антитіл характерна близька проапоптозна активність. В цілому, результати, отримані в цьому експерименті, свідчать про те, що у МАт А0 із сконструйованим Fc проапоптозна активність не змінювалася. Приклад 11 а) Аналіз здатності антитіл А2 і В2 із сконструйованими Fc викликати В-клітинне виснаження в цілісній крові Ефективність і здатність відносно виснаження здорових B-клітин з людської крові оцінювали за допомогою аналізу цілісної крові. У цьому форматі аналізу тестоване антитіло додавали в оброблені ЕДТК зразки людськоїй крові здорових індивідуумів і потім після інкубації протягом 34 г при 37 °C визначали кількість B-клітин за допомогою 4-кольорового FACS-аналізу. Шляхом порівняння з буфером або IgG-контролями розраховували міру B-клітинного виснаження, що викликається тестованим агентом. Завдяки присутності певних рівнів людського IgG і ефекторних клітин, що аналогічно ситуації, яка має місце в організмі людини in vivo, цей тип аналізу можна розглядати як надійний інструмент прогнозування дії тестованих антитіл in vivo. Кількісний FACS-аналіз використовували для визначення кількості B-клітин і/або зібраних Ramos-клітин в зразках крові здорових індивідуумів. Для здійснення кількісного аналізу застосовували пробірки фірми BD Trucount, що містять відому кількість флуоресцентних гранул, які служили як внутрішній стандарт при кількісному визначенні популяції клітин, що представляє інтерес. B-клітини ідентифікували за допомогою 4-кольорового аналізу з використанням 4 різних CD-маркерів (CD3/ CD14/ CD19/ CD45) у поєднанні з FSC/SSC-аналізом. По 270 мкл свіжої крові на лунку інкубували в 48-лунковому планшеті разом з 30 мкл розведення антитіла (у ЗФР) або із ЗФР (контроль, що є буфером), досвід здійснювали з дублюванням. Зразки інкубували протягом 4 г при 37 °C і після цього негайно поміщали на лід. У пробірки фірми Trucount додавали по 33 мкл майстер-суміші CD-маркерів і 50 мкл суміші кровантитіло. Зразки інтенсивно перемішували і інкубували протягом 15 мін при кімнатній температурі. Потім додавали 450 мкл буфера для лізису, інтенсивно перемішували і інкубували на протязі ще 15 мін при кімнатній температурі. Зразки поміщали на лід і негайно піддавали FACS-аналізу за допомогою проточного цитометра типа BD FACS Canto™. Для оцінки даних використовували програму BD FACSDiva (версія 5.0.2). Химерні і гуманізовані МАт A2 і B2 із сконструйованими Fc характеризувалися дуже високою активністю відносно виснаження здорових B-клітин, і при цьому значення EC50 складали від 0,15 до 0,35 нМ. Міра виснаження здорових B-клітин складала від 57 % до 65 %. Паралельно оцінювали ритуксимаб, зареєстроване антитіло, яке застосовують для лікування B-NHL, і для нього в цьому форматі аналізу встановлена істотно нижча здатність викликати B-клітинне виснаження (фіг. 11 A). б) Конструювання Fc наводить до підвищення здатності антитіл A0 і B0 викликати В-клітинне виснаження ритуксимабом Дія МАт на B-клітинне виснаження в зразках людської крові, отриманих із здорових індивідуумів, оцінювали згідно з методом, описаним в розділі a). МАт А0 і В0, в яких не здійснювали конструювання Fc, характеризувалися здатністю викликати B-клітинне виснаження на рівні 13 %-26 %, що відповідає активності ритуксимаба. Конструювання Fc наводило до різкого підвищення здатності обоє МАт викликати B-клітинне виснаження, при цьому середній відсоток виснаження складав 75 %. Ці дані чітко демонструють підвищену активність A2 і B2 в порівнянні з ритуксимабом (фіг. 11 Б). в) Антитіла A2 і B2 не викликають виснаження T-клітин і моноцитів при аналізі цілісної крові Дія A2 і B2 на T-лімфоцити (CD3-позитивні) і моноцити (CD14-позитивні) оцінювали паралельно з оцінкою дії на B- лімфоцити. Не виявлено істотної зміни ні кількості T-клітин, ні кількості моноцитів, тоді як виявлено різке зниження кількості B-клітин (фіг. 11В). Ці дані свідчать про те, що A2 і B2 викликають специфічне виснаження B-клітин в людській крові. Приклад 12 Конструювання Fc наводить до підвищення ADCC-активності в порівнянні з ритуксимабом ADCC-активність версії МАт А2 із сконструйованим Fc оцінювали з використанням клітин лінії Ramos в якості клітин-мішеней. ADCC оцінювали згідно з описаним вище методом (приклад 5). При використанні А0 з несконструйованим Fc виявлено, що обумовлений їм максимальний лізис клітин-мішеней лінії Ramos, нижче в порівнянні з лізисом, ритуксимабом, що викликається, специфічним для CD20 антитілом, яке дозволено застосовувати для лікування пацієнтів, страждаючих B-клітинними лімфомами. При створенні винаходу несподівано було встановлено, що А0 із сконструйованим Fc (тобто А2) володіє істотно покращуваною активністю і 25 UA 103005 C2 5 10 15 20 25 30 35 40 45 50 55 60 ефективністю в порівнянні з ритуксимабом. Ці результати чітко демонструють, що при аналогічній щільності антигенів CD20 і CD37 на поверхні клітин лінії Ramos МАт до CD37 A2 із сконструйованим Fc володіє вищою ADCC-активністю в порівнянні з ритуксимабом (фіг. 12). Приклад 13 Здатність антитіл А2 і В2 із сконструйованими Fc викликати виснаження клітин лімфоми при аналізі цілісної крові Ефективність і здатність викликати виснаження клітин лінії Ramos, клітинній лінії, виведеній з крові людини, страждаючої лімфомою Беркитта, оцінювали за допомогою аналізу цілісної крові, описаного в прикладі 11. Модифікацією аналізу є те, що пухлинні клітини лінії Ramos відбирали приблизно в 10-кратному надлишку відносно ендогенних B-клітин у вживаній як матриця цілісній крові, а їх виснаження оцінювали також з допомогою FACS-аналізу. Для химерних і гуманізованих МАт A2 і B2 із сконструйованим Fc виявлена висока активність відносно виснаження клітин Ramos, що характеризувалося значеннями EC 50 від 0,35 до 0,54 нМ. Міра виснаження клітин Ramos складала від 36 % до 55 %. Паралельно оцінювали активність ритуксимаба, зареєстрованого антитіла, яке застосовують для лікування B-NHL, і при цьому встановлено, що при використанні вказаного формату аналізу ритуксимаб володів істотно нижчою здатністю викликати виснаження клітин Ramos (фіг. 13). Приклад 14 In vivo ефективність антитіл A2 і B2 із сконструйованими Fc при оцінці на моделі відповідного захворювання Протипухлинну ефективність in vivo МАт A2 і B2 оцінювали на моделі лімфоми Беркитта, для створення якої використовували клітини лінії Ramos і бестимусних мишей. CD37-позитивні клітини Ramos ін'єктували підшкірно в бік тварин і після розвитку пухлин починали i.v.-обработку тварин. Була вибрана схема введення, що передбачає застосування двічі в тиждень (q3/4d) двох різних доз (8 мг/кг і 25 мг/кг), які оцінювали паралельно. Обоє МАт володіли вираженою протипухлинною ефективністю, при цьому значення T/C складали від 0,2 % до 26 %. Не виявлено істотної відмінності між двома вживаними дозами і між двома антитілами. Проте виявлена тенденція до прояву вищої ефективності при обробці тварин високою дозою A2, при цьому значення T/C складало 0,2 % і у 5 з 10 тварин виявлений повний регрес пухлин. Всі варіанти обробки добре переносилися, при цьому не виявлено помітної втрати ваги. В цілому, встановлено, що МАт A2 і B2 володіли вираженою протипухлинною ефективністю на моделі лімфоми Беркитта, створеної з використанням клітин лінії Ramos, при цьому максимальна активність досягалася вже при застосуванні дози 8 мг/кг Активність виявилася порівнянною з активністю ритуксимаба, яку оцінювали паралельно. Слід зауважити, що активність in vivo, виявлена при застосуванні антитіл A2 і B2 із сконструйованими Fc, може бути недооціненою, оскільки ці МАт оптимізовані для взаємодії з людськими, але не мишачими ефекторними клітинами. Вказана оптимізована взаємодія, яка наводить до значно підвищеної ADCCактивності in vitro при застосуванні людських ефекторних клітин (приклад 8), не знайшло свого віддзеркалення на вживаній мишачій моделі. Проте, отримані в цьому експерименті дані (представлені на фіг. 14), є доказом in vivo концепції спрямованої дії на CD37, і тому їх можна використовувати для оцінки терапевтичної дози, яку можна рекомендувати для застосування на людині. Приклад 15 Оцінка кореляції фармакокінетичного (ФК) і фармакодінамичного (ФД) дії A2 і B2 на мишах з метою визначення призначеної для людини терапевтичної дози Оцінювали кореляцію між концентраціями A2 і B2 в сироватці і їх фармакодінамичною дією на мишах з використанням моделі ксенотрансплантату пухлини з клітин Ramos. Ці дослідження продемонстрували, що при використанні антитіл А2 і В2 в дозі 8 мг/кг (приготовані в цитратному буфері: 25 мМ Na-цитрат, 115 мМ NaCl, 0,04 % Твін 80, pH 6,0) відбувалося істотне уповільнення зростання пухлин при оцінці на вказаній моделі агресивної пухлини, отриманої шляхом підшкірного введення (s.c.), при використанні схем введення антитіл мишам q3 або 4d, що свідчить про прояв активності протягом всього періоду застосування доз антитіл. Крім того, з використанням вказаної дози проводили фармакокінетичну оцінку. На основі поєднання результатів ФК/ФД-досліджень на мишах можна розраховувати призначену для людини дозу за допомогою опублікованих даних для визначення кліренсу (CL) гуманізованих антитіл в організмі людини (Lobo та ін., 2004). Повний розрахунок для A2: - Середнє значення AUC(0-∞) після введення однієї дози 8 мг/кг = 6099 мкг·ч/мл - Приймаючи, що значення AUC(0-∞) для мишей = AUC(ss, τ) для мишей і AUC(ss, τ)/ τ = C(ave, ss). 26 UA 103005 C2 5 10 15 20 25 30 35 40 45 50 55 60 - C(ave, ss) для мишей (у випадку τ = 84 г) = 73 мкг/мл, що, ймовірно еквівалентно C(ave, ss) для людини (у випадку τ = 168 г). - Оскільки AUC(ss, τ) для людини = D/CL і з врахуванням кліренсу гуманізованих антитіл (CL) в організмі людини за даними Lobo і др, 2004 складає: CL = від 7 мл/ч/70 кг до 15 мл/ч/70 кг Для варіанту 7 мл/ч/70 кг: 168 г × 7=1176 мл× 73 мкг= 86 мг. Для варіанту 15 мл/ч/70 кг: 168 г × 15=2520 мл × 73 мкг = 184 мг. Таким чином, для A2 встановлено, що призначена для щотижневого введення людині вагою 70 кг доза повинна складати 86-184 мг. За допомогою вказаних вище положень розрахункова доза В2, призначена для щотижневого введення людині вагою 70 кг, повинна складати від 189 до 404 мг. Приклад 16 Антитіла A2 і B2 володіють ADCC-активністю відносно клітин множинної мієломи Оцінювали експресію CD37 з використанням панелі клітинних ліній множинної мієломи, застосовуючи FACS-аналіз і антитіла, специфічні для CD37. Клітини або інкубували з антитілом CD37, безпосередньо міченим флуоресцентною міткою, або з неміченим специфічним у відношенні CD37 антитілом, а потім з вторинним флуоресцентноміченим антитілом до первинного антитіла. Флуоресцентну активність мічених клітин оцінювали за допомогою проточного цитометра для FACS типа Canto (фірма BD Biosciences) і інтенсивність флуоресценції підраховували у вигляді MFI з використанням програми FACS Diva. Експресія CD37 на клітинній поверхні виявлена в 6 з 11 вивчених зразків клітин множинної мієломи (фіг. 15). Для однієї з клітинних ліній (RPMI 8226) потім визначали ADCC-активність за допомогою методу, описаного в прикладі 5, використовуючи специфічні для CD37 антитіла A2 і B2. Для обох антитіл продемонстрована виражена ADCC-активність відносно клітин лінії RPMI 8226, що характеризувалася значеннями EC50 в межах 25 нг/мл і максимальним клітинним лізисом приблизно 20 % (фіг. 16). Ці результати свідчать про те, що CD37-позитивні клітини множинної мієломи володіють чутливістю до опосередковуваного ADCC клітинного лізису при застосуванні специфічних для CD37 МАт A2 і B2. На фіг. 15 продемонстровані результати FACS-аналізу експресії CD37 в шести виведених з множинної мієломи клітинних лініях. Незафарбовані області під кривою відповідають даним, що свідчить про реактивність із специфічним для CD37 антитілом, зафарбовані області під кривою відповідають даним, отриманим для вживаного в якості негативного контролю антитіла. Приклад 17 Проапоптозна активність антитіл A2 і B2 відносно отриманих з організму пацієнта CLL-клітин Проапоптозну активність A2 і B2 оцінювали з використанням клітин, отриманих з організму пацієнта, страждаючого хронічним лімфолейкозом (CLL). Виділяли мононуклеарні клітини периферичної крові (PBMC) з організму пацієнта з діагностованим CLL після одержання його інформованої згоди згідно декларації Хельсінкі. Первинні CLL-клітини очищали зі свіжозібраної крові за допомогою процедури Ficoll-Paque® plus (фірма StemCell Technologies, Мьелан, Франція) і зберігали до застосування при 4 °C у культуральному середовищі RPMI 1640, що містить 10 % інактивованою тепловою обробкою людської AB-сироватки (фірма Sigma, Франція). Культуральне середовище для первинних CLL-клітин була RPMI 1640, доповнену 2мМ L глутаміном і 10 % інактивованою тепловою обробкою людської AB-сироватки. Для експериментального застосування кількість первинних CLL-клітин підраховували за допомогою гемоцитометра і їх життєздатність оцінювали шляхом виключення 0,25 % трипанового синього. Життєздатність зразків CLL-клітин складала більше 90 %. Клітини інкубували при 37 °C протягом 24 г з антитілами в концентрації 30 мкг/мл і потім визначали відсоток аннексин Vпозитивних клітин згідно з методом, описаним в прикладі 6. Як видно з фіг. 17, для антитіл A2 і B2 із сконструйованими Fc виявлена виражена проапоптозна активність відносно первинних CLL-клітин, про що свідчила кількість аннексин V-позитивних клітин на рівні зразковий 90 % (A2) і 40 % (B2). Чітко продемонстровано, що обоє МАт перевищували по активності ритуксимаб, специфічне для B-клітин антитіло, дозволене для лікування B-NHL. Для МАт A2 також чітко продемонстрована вища активність в порівнянні з алемтузумабом, антитілом, дозволеним для лікування B-CLL. Приклад 18 Створення трансгенної мишачої моделі, в якій ендогенний ген CD37 замінений його людським гомологом Конструювали призначений для спрямованого перенесення вектор, який містив кодуючу послідовність людського CD37 (BAC (бактерійна штучна хромосома) ID: RP11-433N13, RP11 50I11), фланкировану нетрансльованими послідовностями. Цей призначений для спрямованого перенесення вектор (який містив також сайти loxP, фланкируючі екзони 3-4, і маркер для 27 UA 103005 C2 5 10 15 20 25 30 35 40 45 50 55 селекції neo, фланкирований сайтами frt) потім застосовували для гомологічної рекомбінації, використовуючи мишачі ES-клітини і стандартну технологію заміни екзонов 1-8 мишачій послідовності генома на людські послідовності-копії. Для цієї мети клітинну лінію C57BL/6N ES вирощували на шарі клітин фідерів з інактивованим митозом, який складався з мишачих зародкових фібробластів (MEF), в середовищі DMEM з високим вмістом глюкози, яка містила 20 % FBS (фірма PAN) і 1200 од./мл що інгібірує лейкоз фактора (фірма Millipore, ESG 1107). 7 Піддавали електропораціїи 1×10 клітин і 30 г лінеаризованого ДНК-вектора (пристрій Biorad Gene Pulser) при 240 В і 500 Ф. Селекцію з допомогою G418 (200 г/мл) починали в день 2 (d2). Противоселекцію ганцикловіром (2M) починали в d5 після електропорації. Клони ES виділяли в d8 і аналізували за допомогою Саузерн-блоттинга згідно із стандартними процедурами, наприклад, використовуючи радіо-активномічені ДНК-зонди, специфічні для генів-мішеней, після розмноження і заморожування клонів в рідкому азоті. Потім створювали трансгенних тварин за допомогою стандартних процедур, відомих в даній галузі, наприклад, шляхом ін'єкції бластоциста і подальшого створення химерних тварин. Отримували тварин гетерозиготних і гомозиготних по людському CD37 шляхом загальноприйнятої селекції химерних і гетерозиготних тварин відповідно. Здійснювали моніторинг успішних випадків "виключення (knock-out)" мишачого гена CD37 і "включення (knock-in)" людського гена CD37 на основі рівня білків за допомогою стандартних процедур, наприклад FACS-аналізу лімфоцитів периферичної крові або іммуногистохімичного аналізу зрізів тканин. Приклад 19 Створення сурогатних антитіл Отримували моноклональні антитіла, специфічні у відношенні CD37 макака, шляхом генетичної імунізації мишей і кроликів повною кодуючою послідовністю антигена CD37 макака (реєстраційний №. ENSMMUT00000020744). Специфічні антитіла відбирали, використовуючи рекомбінантні клітини HEK293 або CHO, експресуючі антигени CD37 макака, наприклад, за допомогою стандартних методів ELISA або FACS. Кодуючі послідовності варіабельних областей важких і легких ланцюгів цих антитіл відновлювали за допомогою ПЦР-клонування і застосовували для створення химерних антитіл (згідно з методом, описаним в прикладі 1), які несли VH- і VL-область, виведену з мишачого або кролячого вихідного антитіла, і Fc-фрагмент, ідентичний вказаному фрагменту антитіла, пропонованого у винаході, наприклад A2 або B2. Здатність до скріплення і функціональні властивості можна досліджувати за допомогою систем аналізів, в яких використовують клітини, експресуючі CD37 макака, в якості клітин-мішеней, призначені, наприклад, для аналізу скріплення FACS, аналізу Скетчарда ADCC і апоптозу. І, нарешті, сурогатне антитіло відбирали на основі його активності відносно виснаження B-клітин в крові макака-крабоїда in vitro. Приклад 20 Одержання продукуючих антитіла клонів Для одержання клонів, продукуючих антитіла, пропоновані у винаході, наприклад, антитіла A2, A4, B2 або B4, молекулу ДНК, яка кодує повний важкий ланцюг, наприклад, що має послідовність, яка представлена в SEQ ID NO: 27, 31, 35 або 39, відповідно вбудовували в еукаріотичний експресійний вектор, позначений як pBI-26, який кодує також маркер для селекції, що представляє дигидрофолатредуктазу з хом'яка. Молекулу ДНК, яка кодує повний легкий ланцюг, наприклад, що має послідовність, яка представлена в SEQ ID NO: 29, 33, 37 і 41 відповідно, вбудовували в еукаріотичний експресійний вектор, позначений як pBI-49, який кодує також маркер для селекції, що є неомицинфосфотрансферазою. Послідовності ДНК повних важких і легких ланцюгів повністю секвенували. Клітинну лінію китайського хом'яка CHO-DG44, вирощену у вигляді суспензійної культури в середовищах певного хімічного складу, трансфектували спільно еукаріотичними експресійними векторами важких і легких ланцюгів антитіл згідно з описаним вище методом. Трансфектовані клітини відбирали в середовищі, доповненому гіпоксантином і тимідином, і у присутності антибіотика G418. Потім клітини піддавали стадіям селекції і ампліфікації з використанням зростаючих концентрацій Метотрексату (MTX). Відбирали на стадії ампліфікації у присутності 800 нМ MTX клон індивідуальної клітини на основі характеристик зростання і отримували антитіло в колбах, що оберталися, і зберігали після консервації заморожуванням в банці для зберігання клітин (Safety Cell Bank, SCB). 28
ДивитисяДодаткова інформація
Назва патенту англійськоюAnti cd37 antibodies
Автори російськоюHeider, Karl-Heinz, Borges, Eric, Ostermann, Elinborg
МПК / Мітки
МПК: C12P 21/08, C12N 5/10, C12N 15/13, A61P 35/02, A61K 39/395, C07K 16/28, C12N 15/63
Мітки: антитіло
Код посилання
<a href="https://ua.patents.su/93-103005-antitilo-do-cd37.html" target="_blank" rel="follow" title="База патентів України">Антитіло до cd37</a>
Попередній патент: Гуманізоване антитіло проти cd79b і імунокон’югати й способи застосування
Наступний патент: Піразольні сполуки для боротьби з безхребетними шкідниками
Випадковий патент: Паштет "особливий"