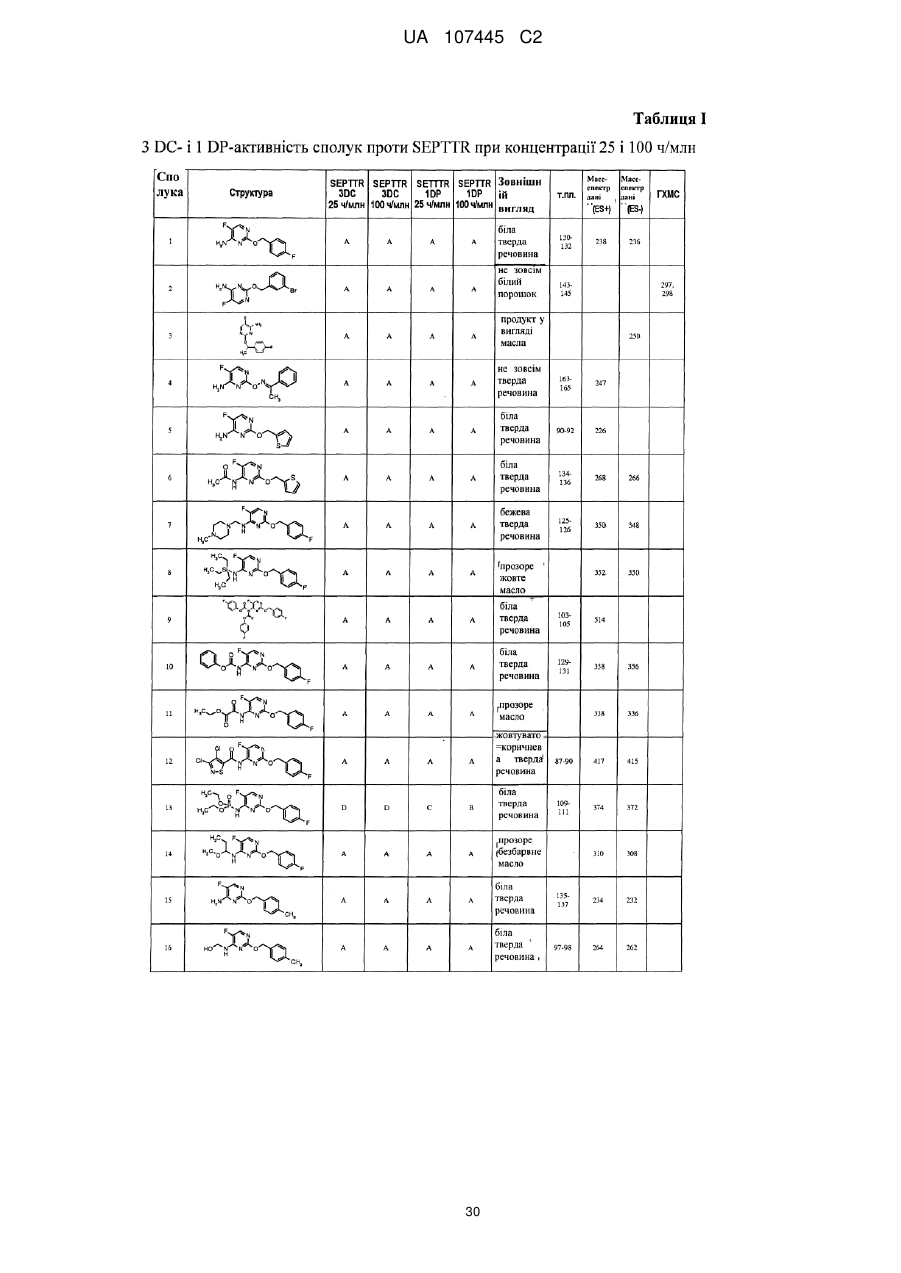
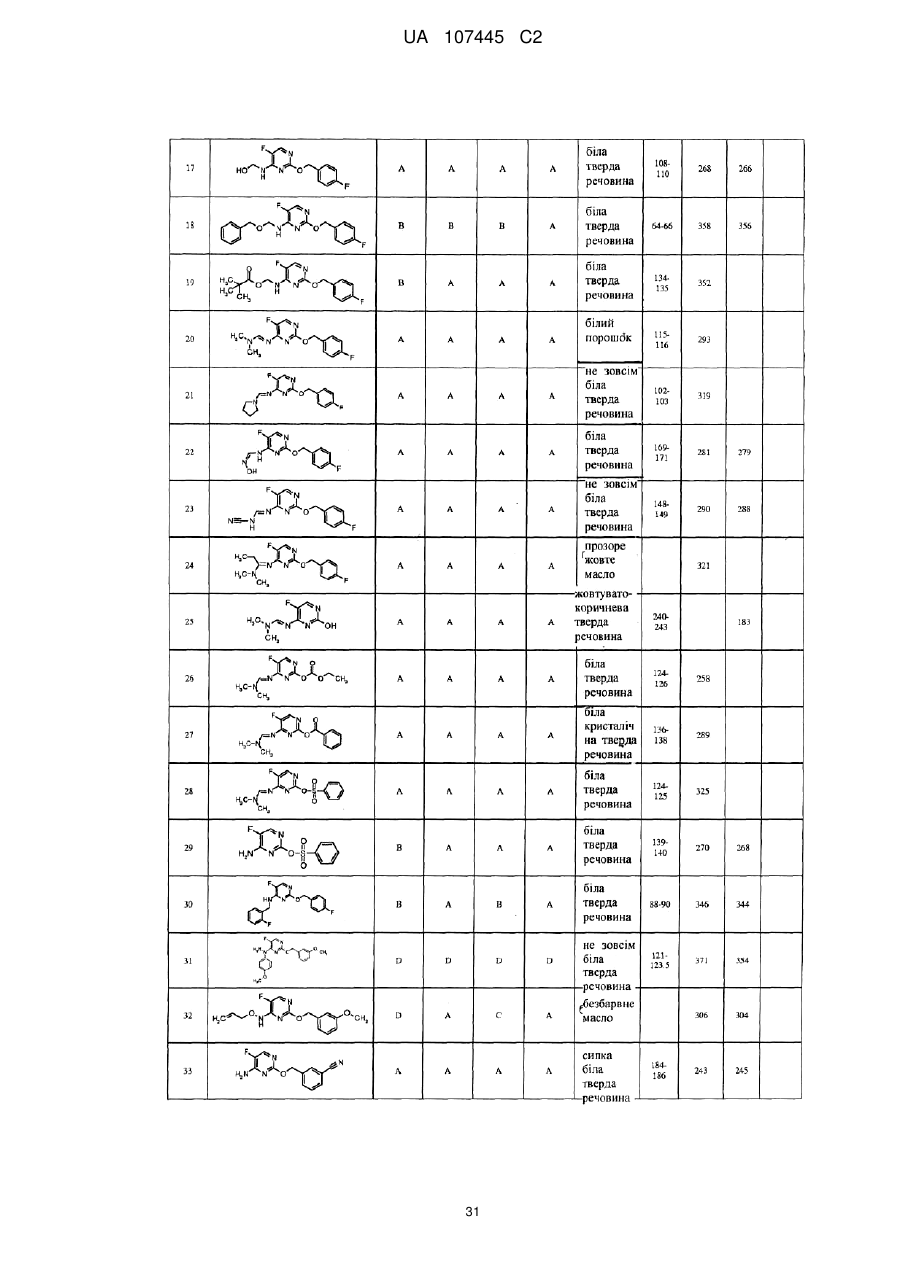
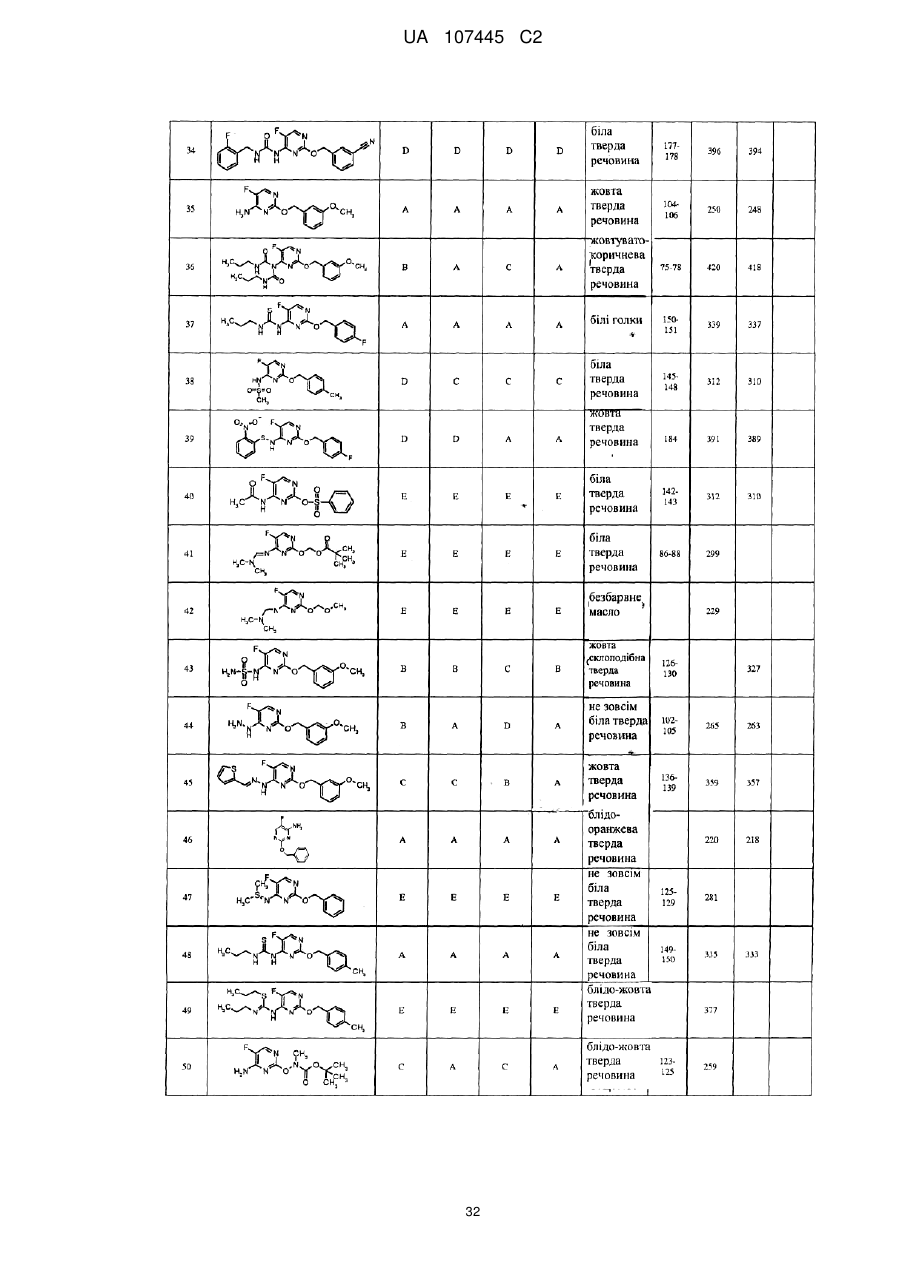
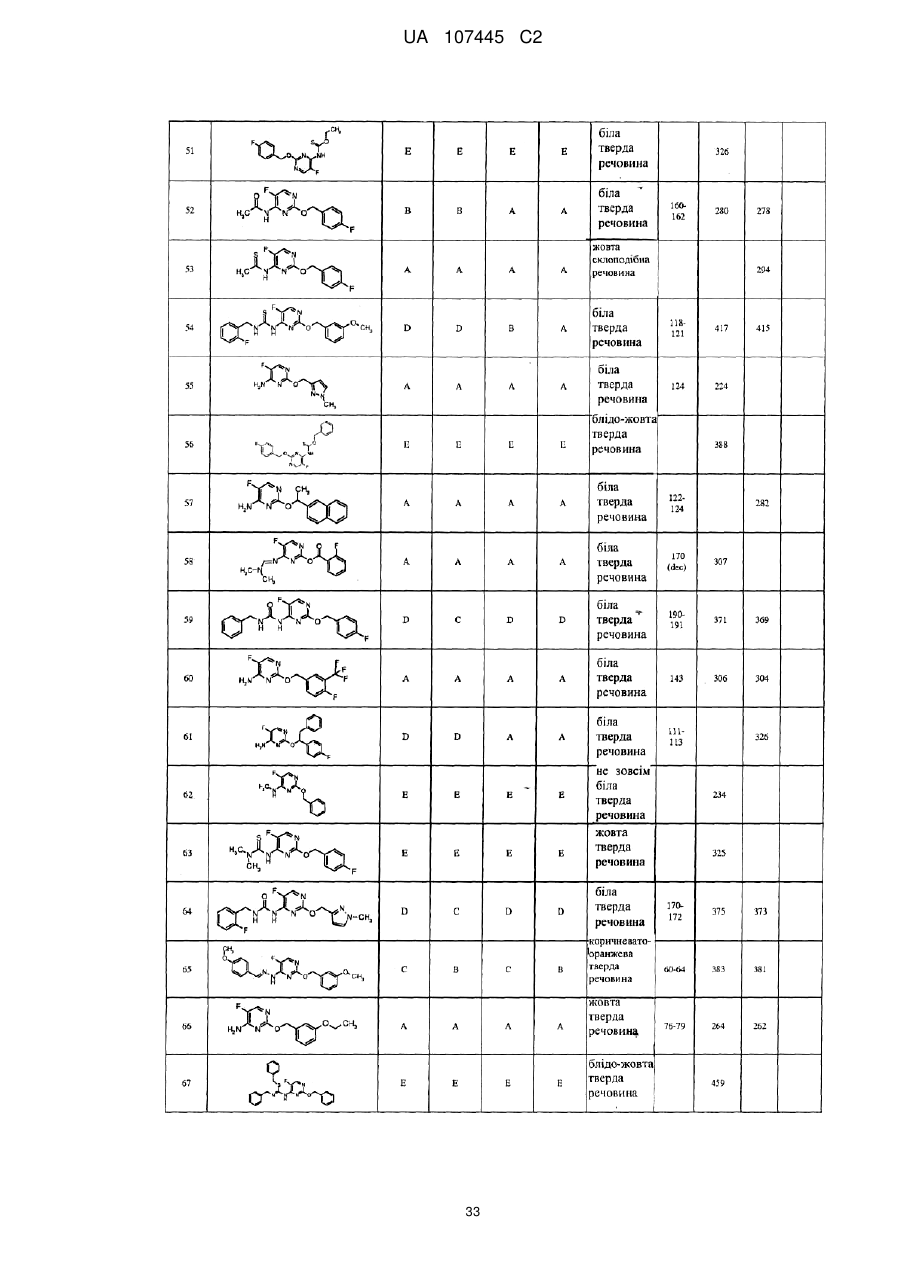
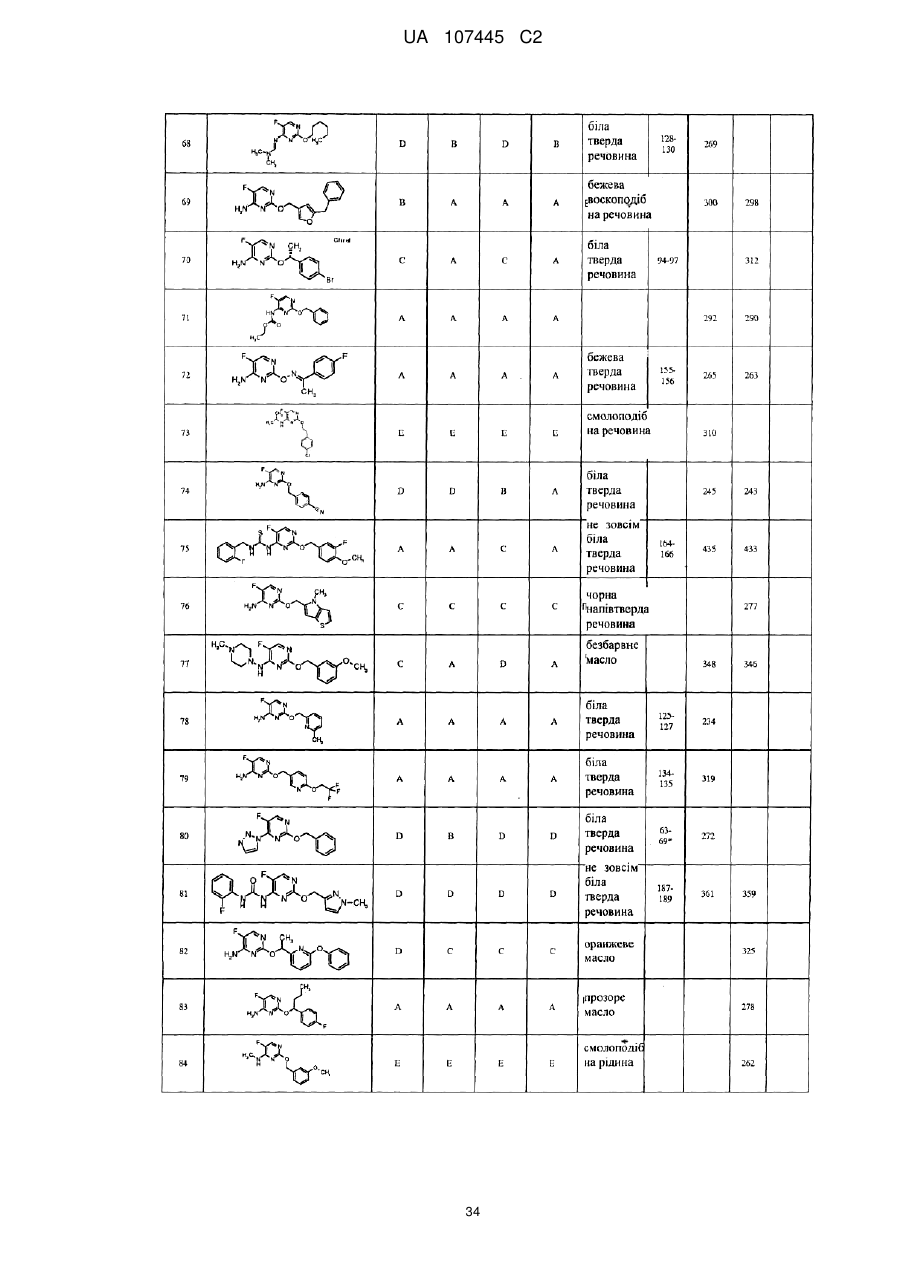
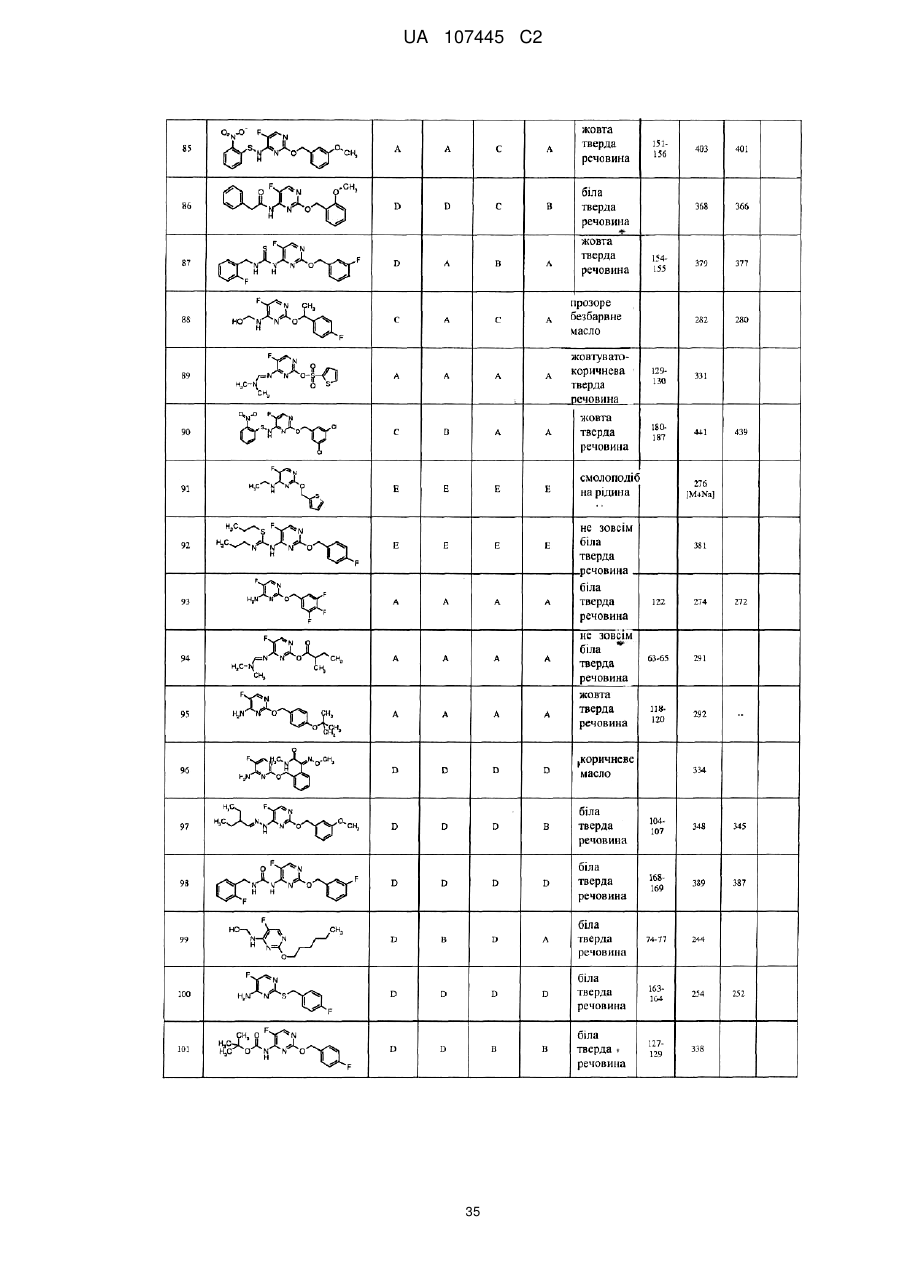
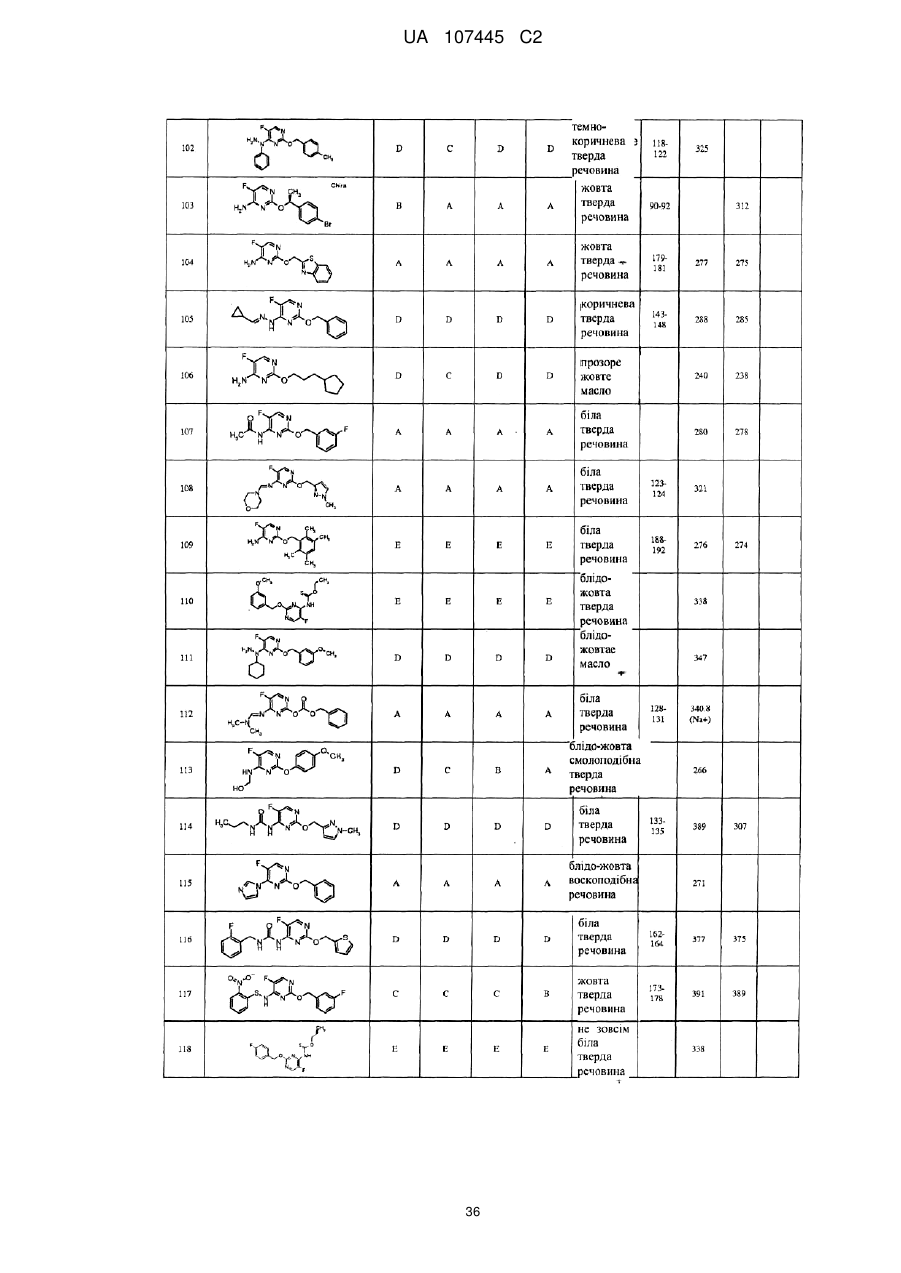
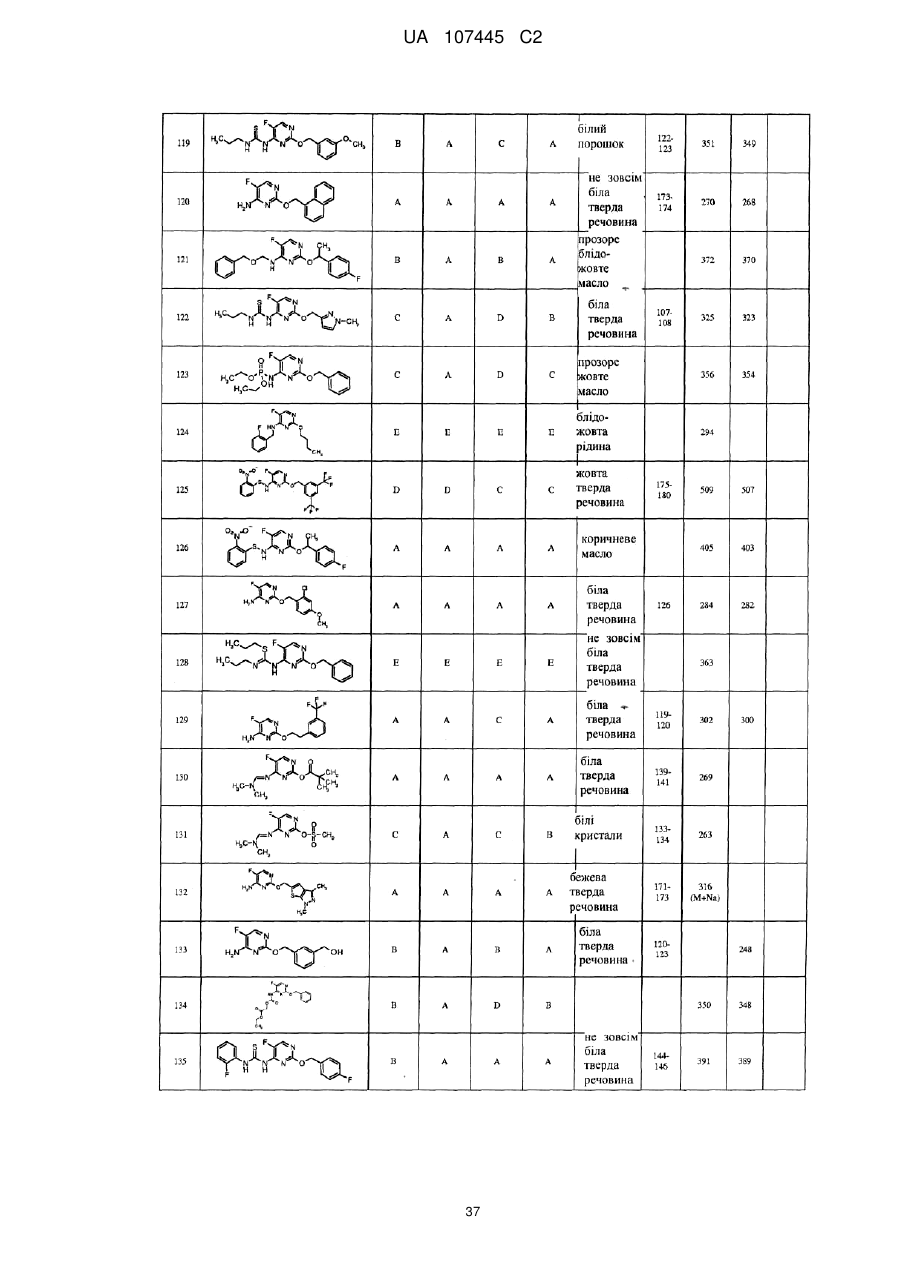
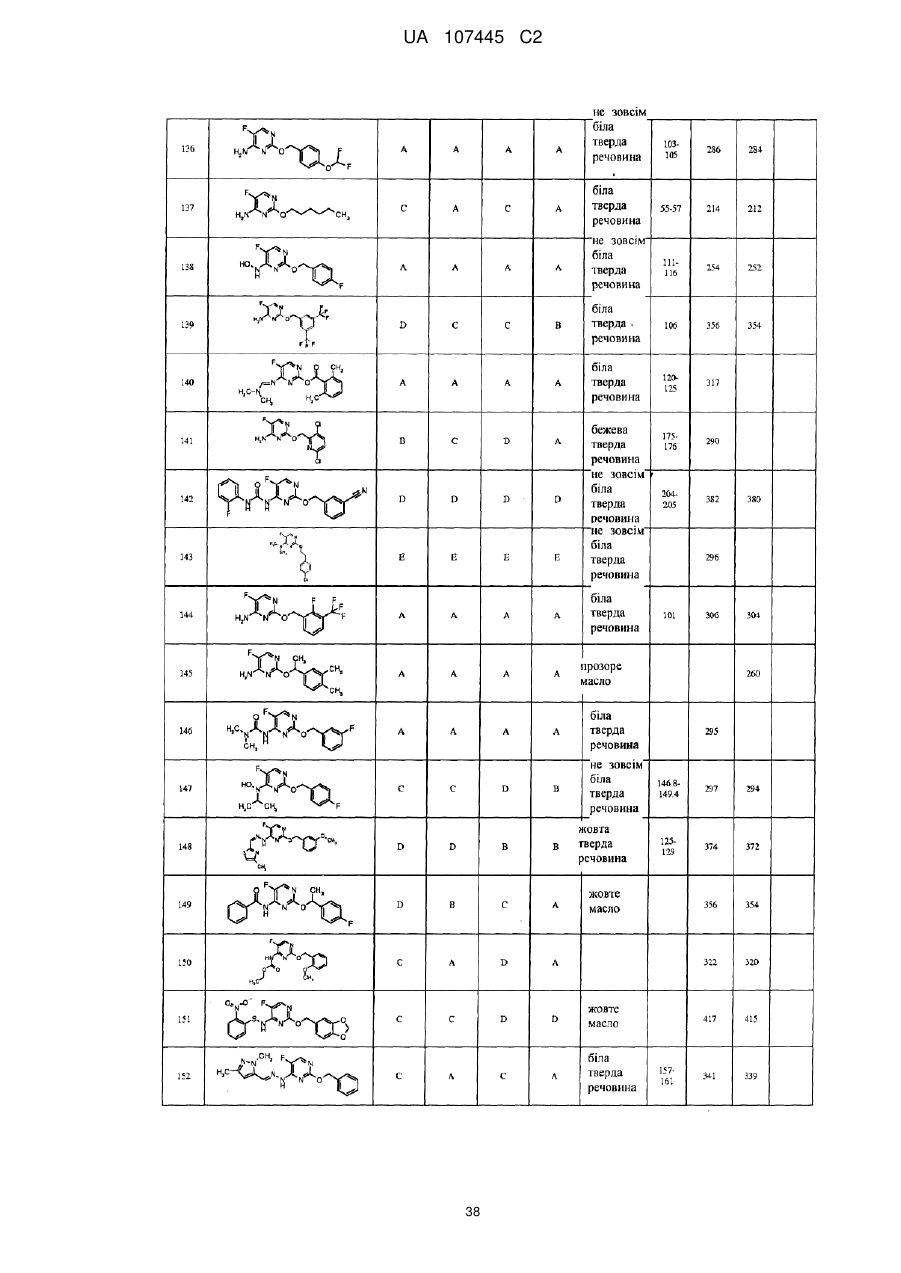
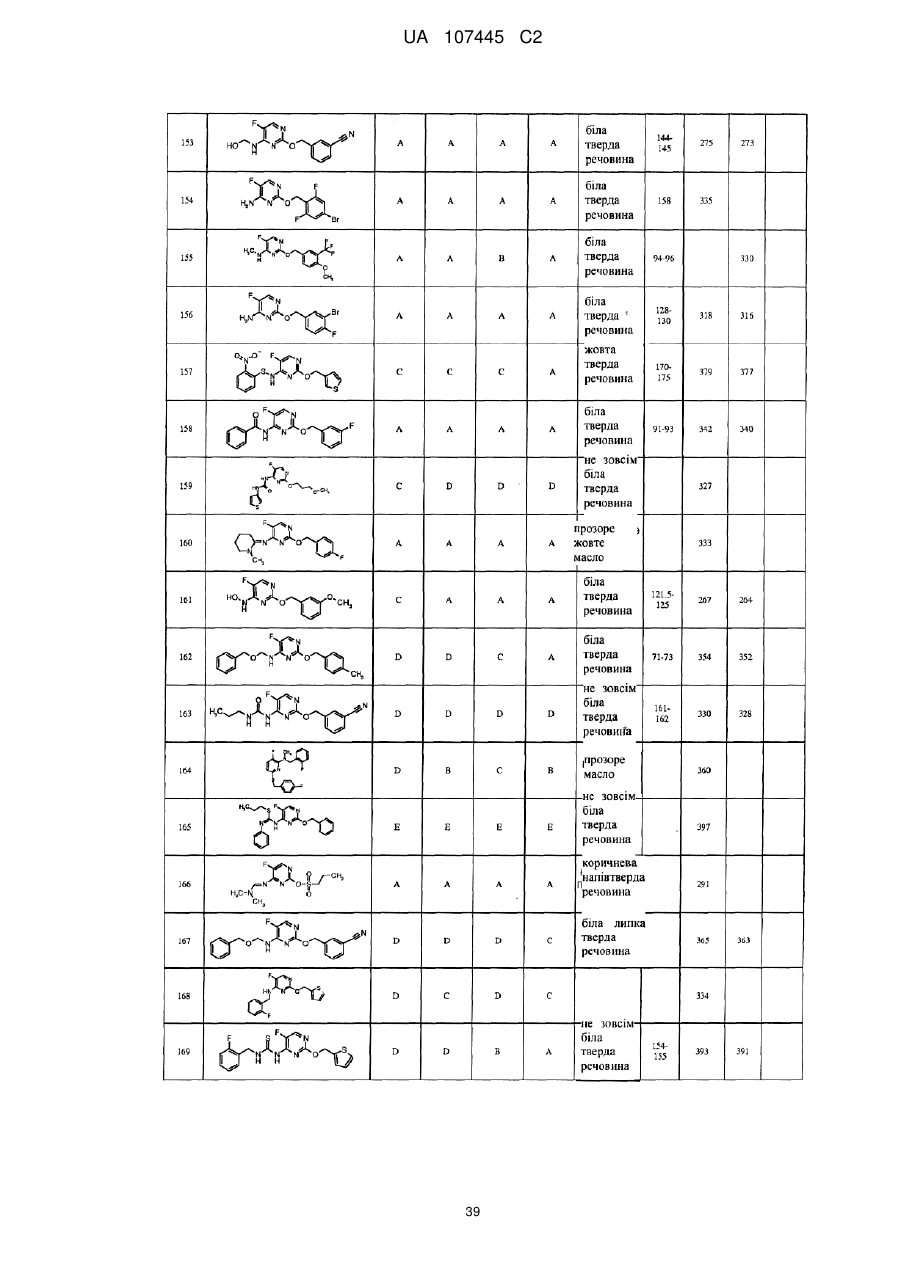
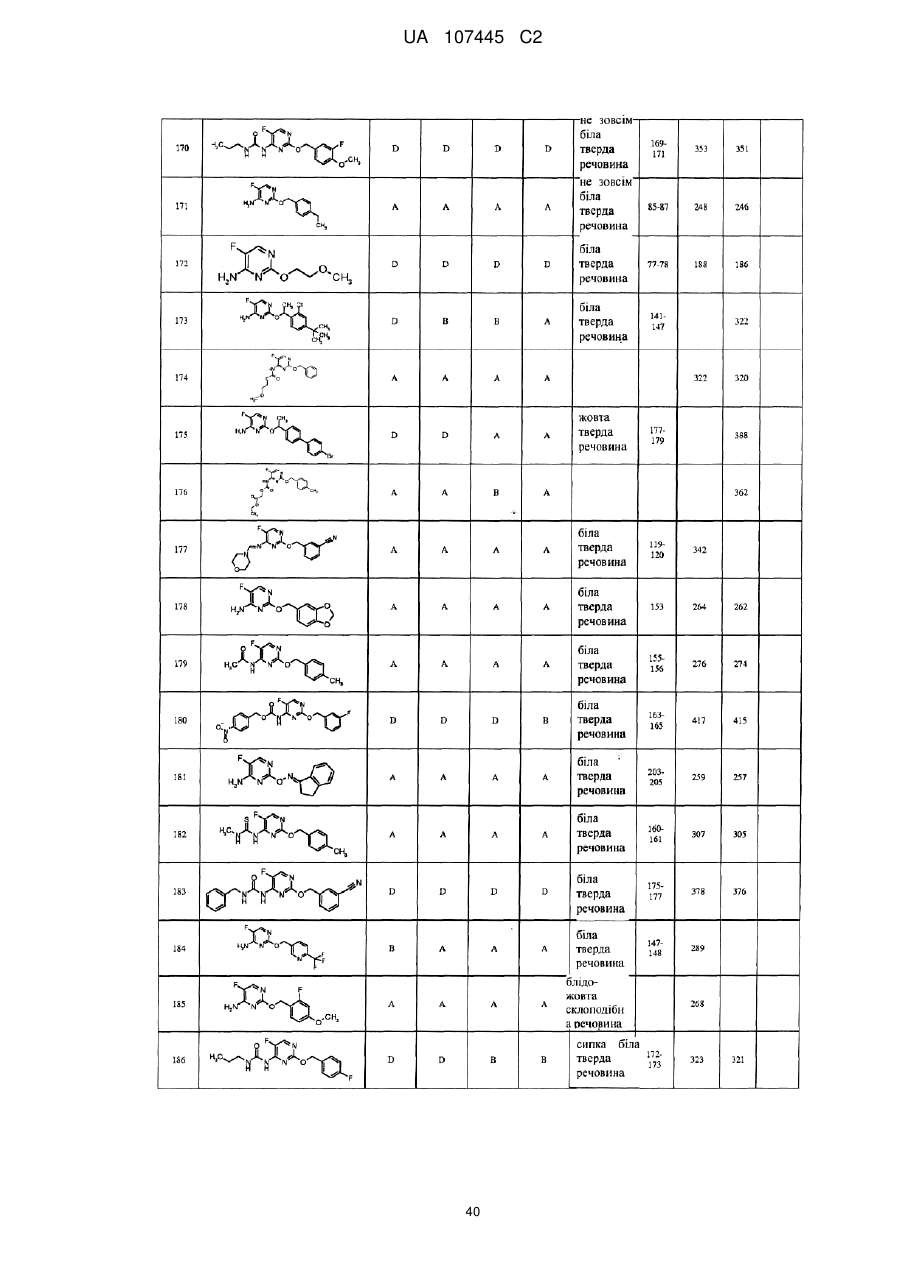
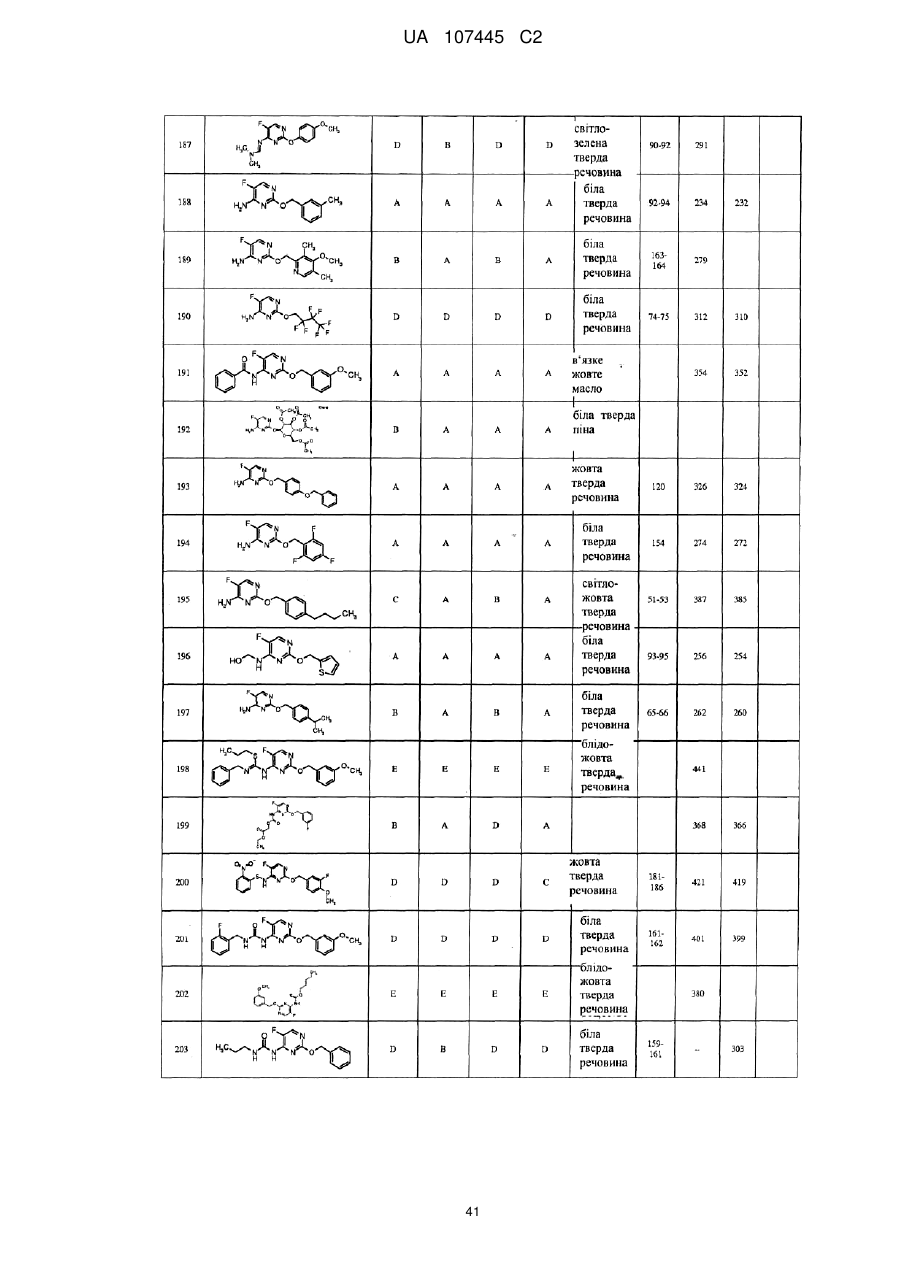
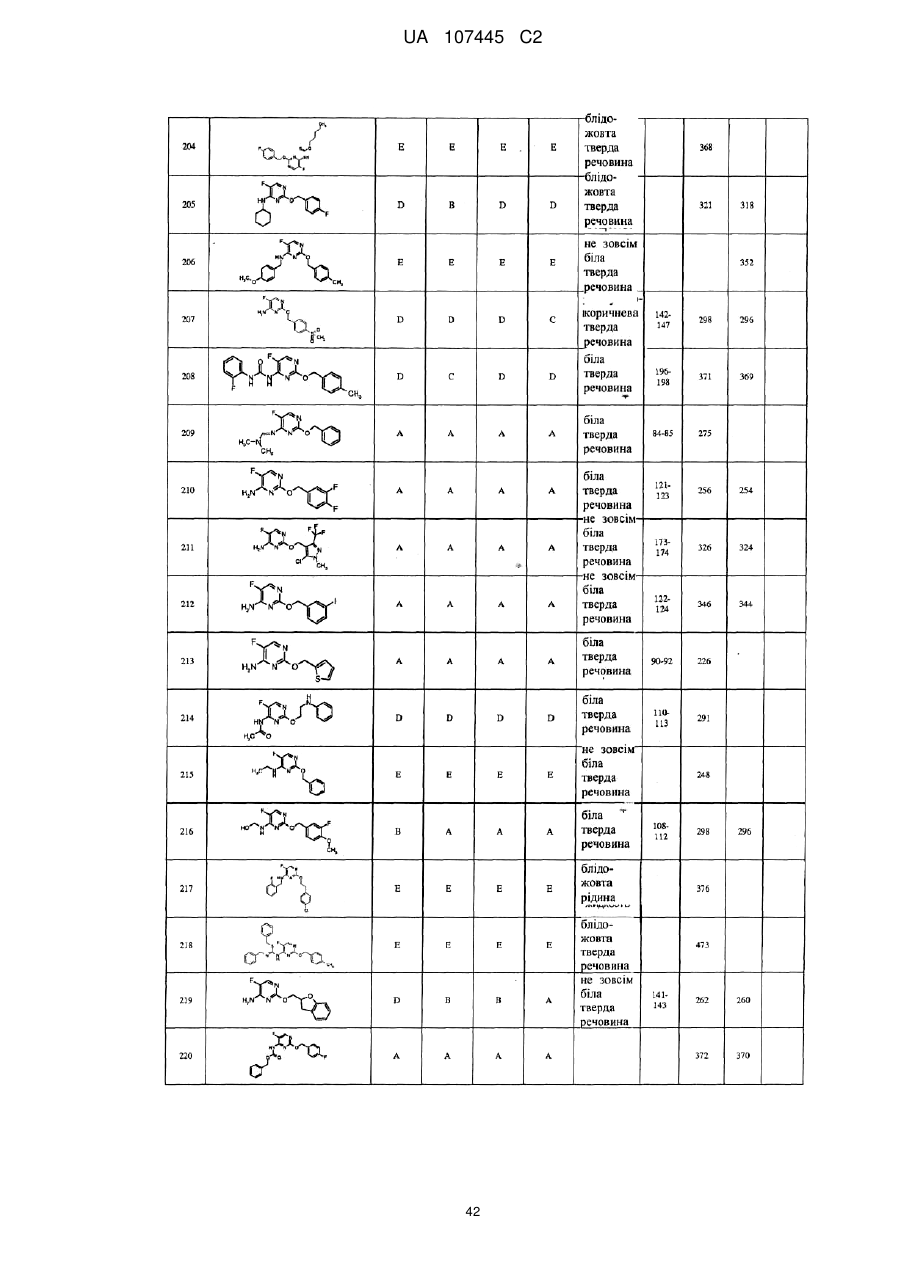
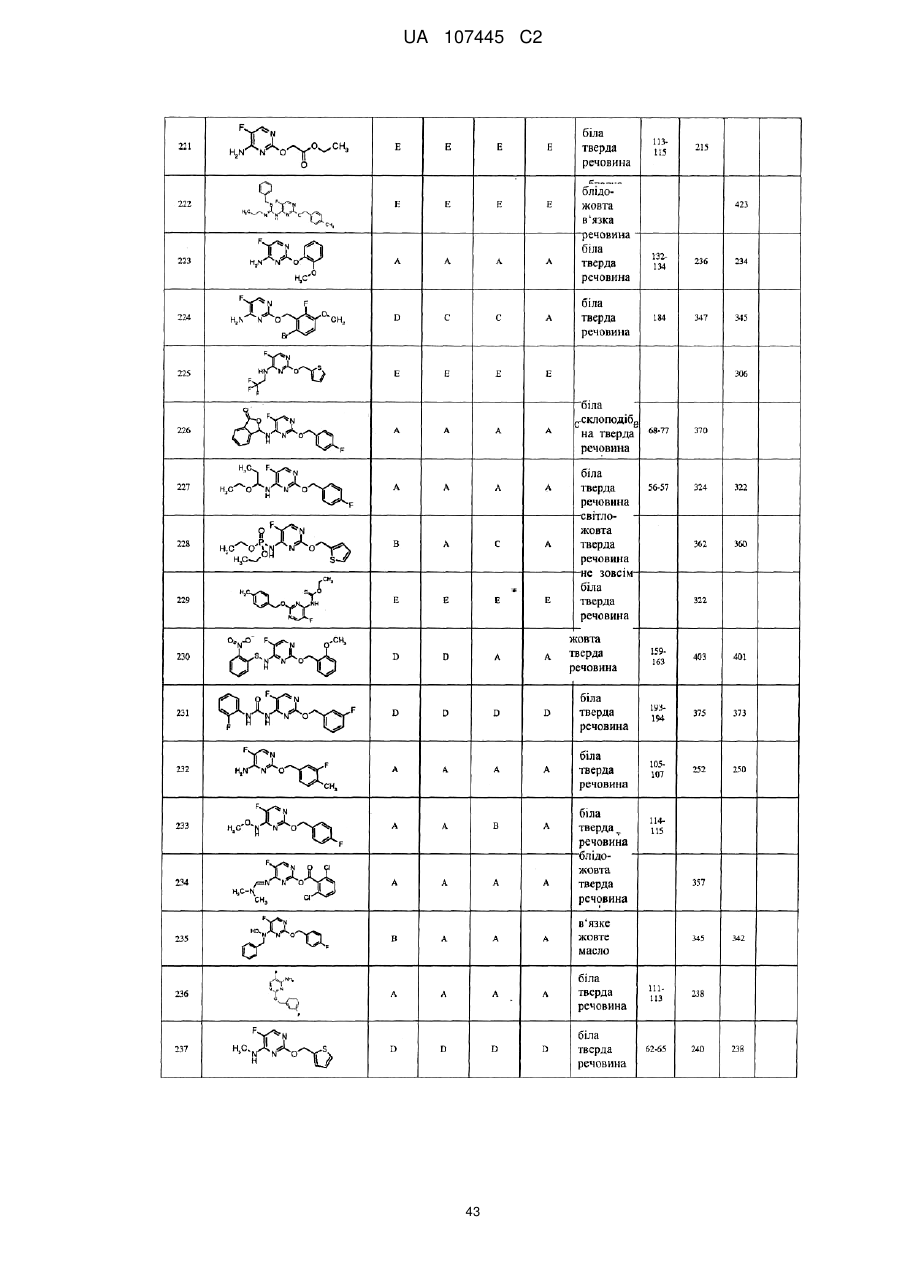
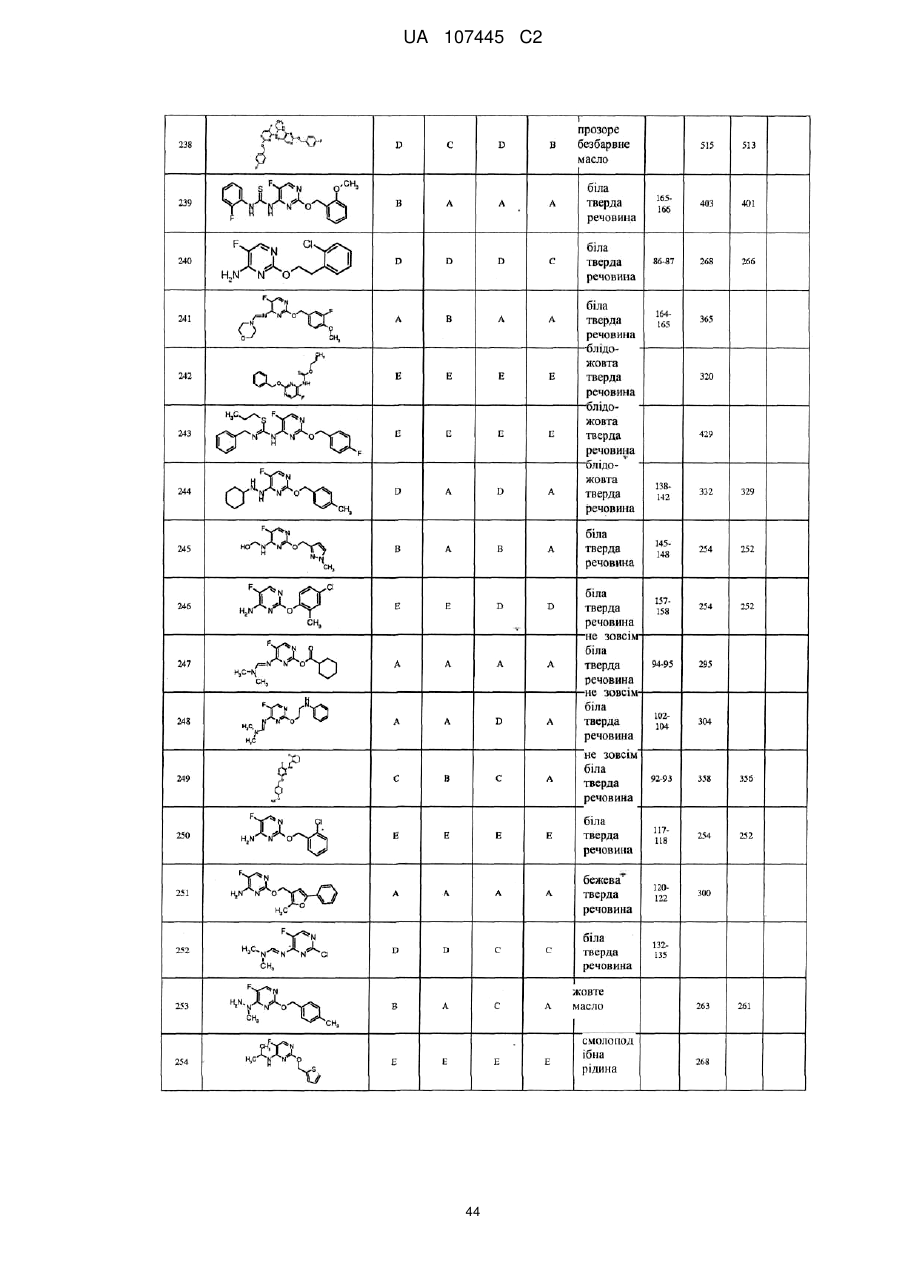
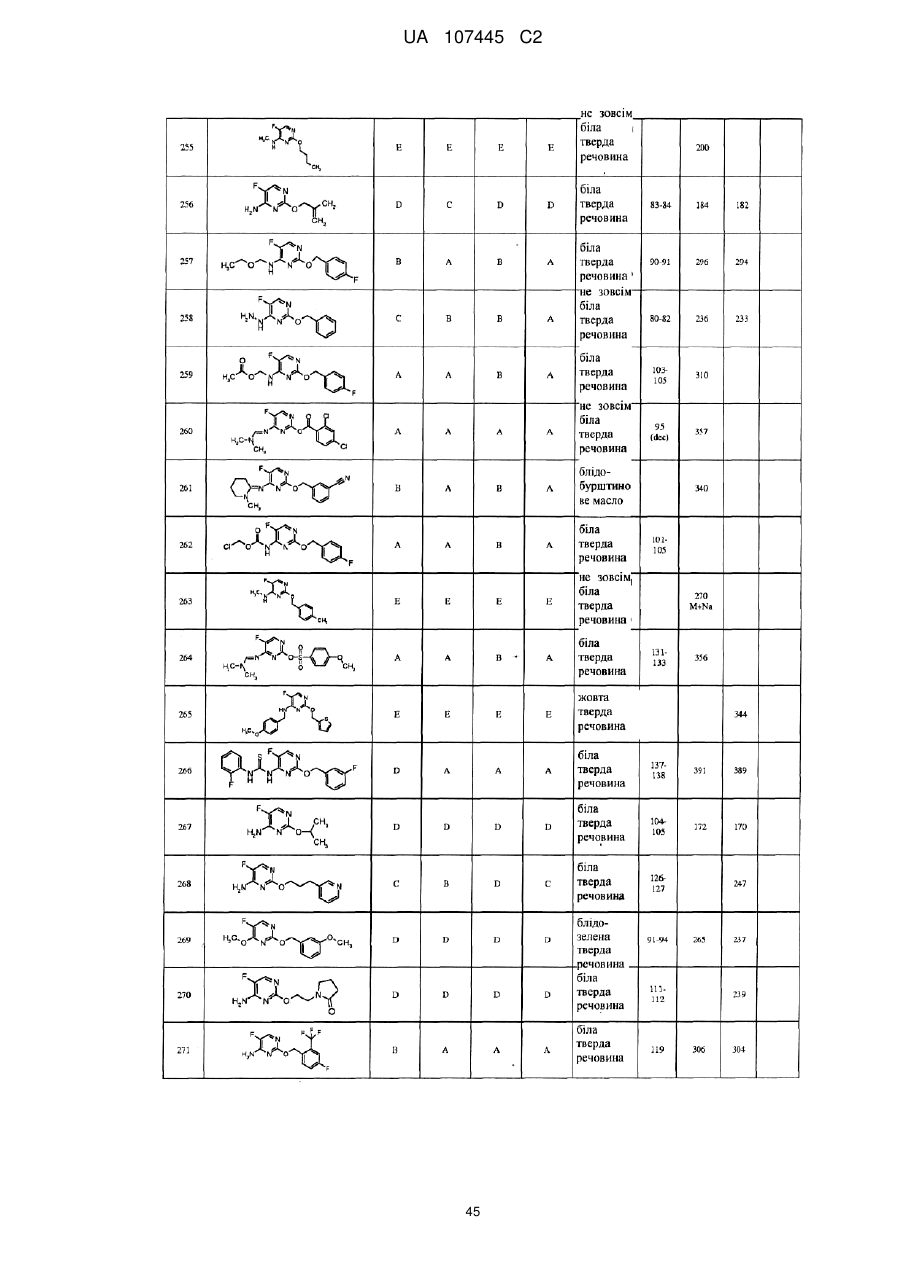
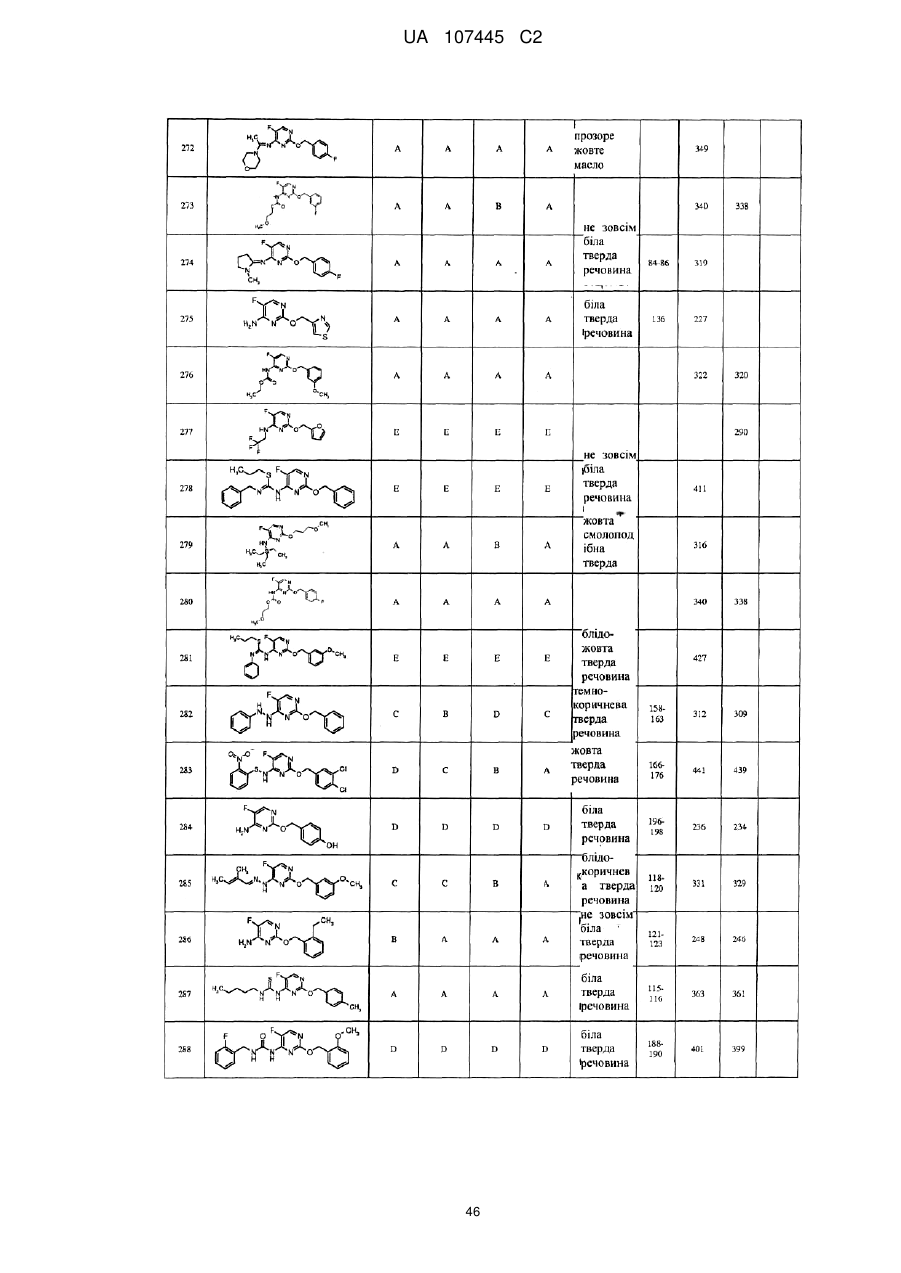
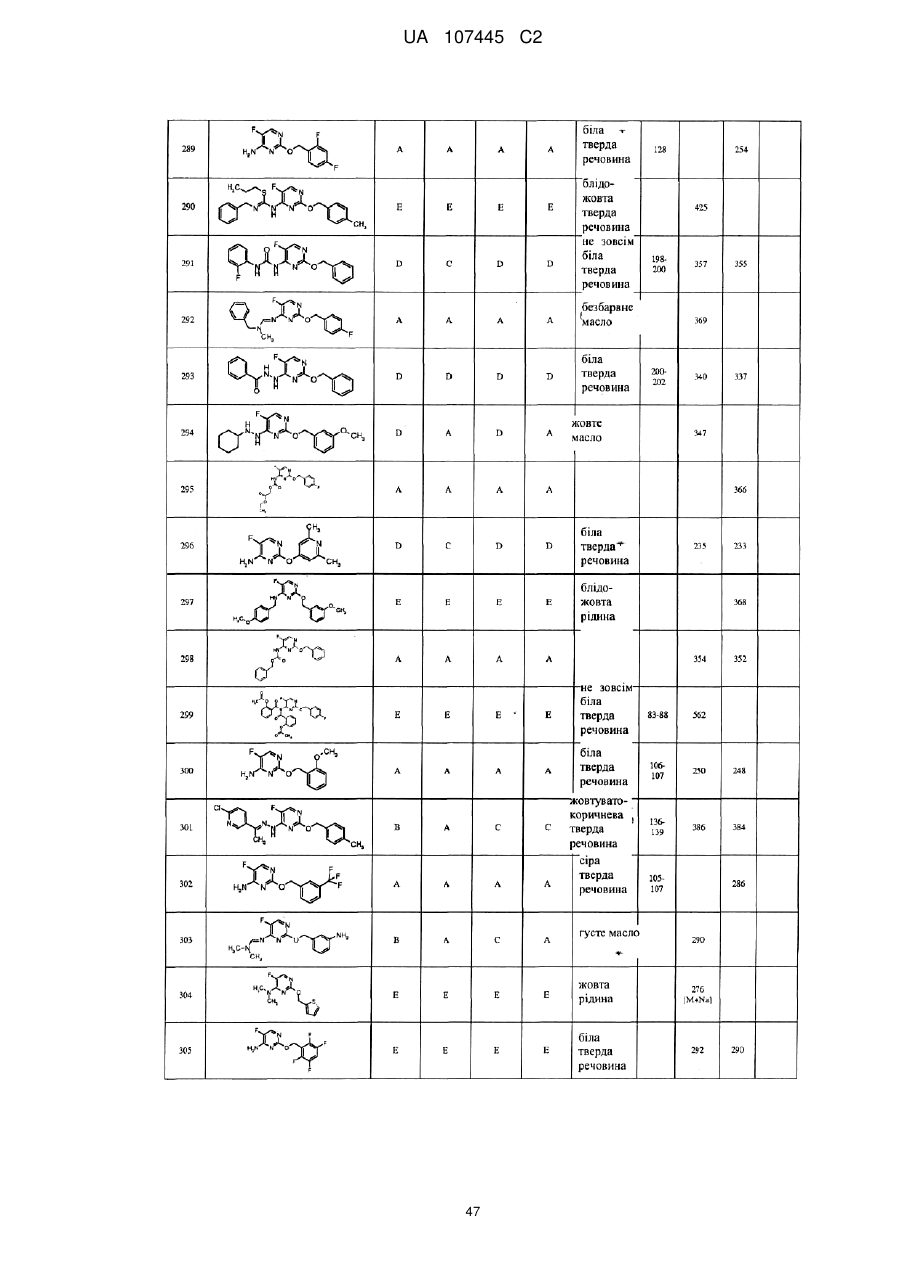
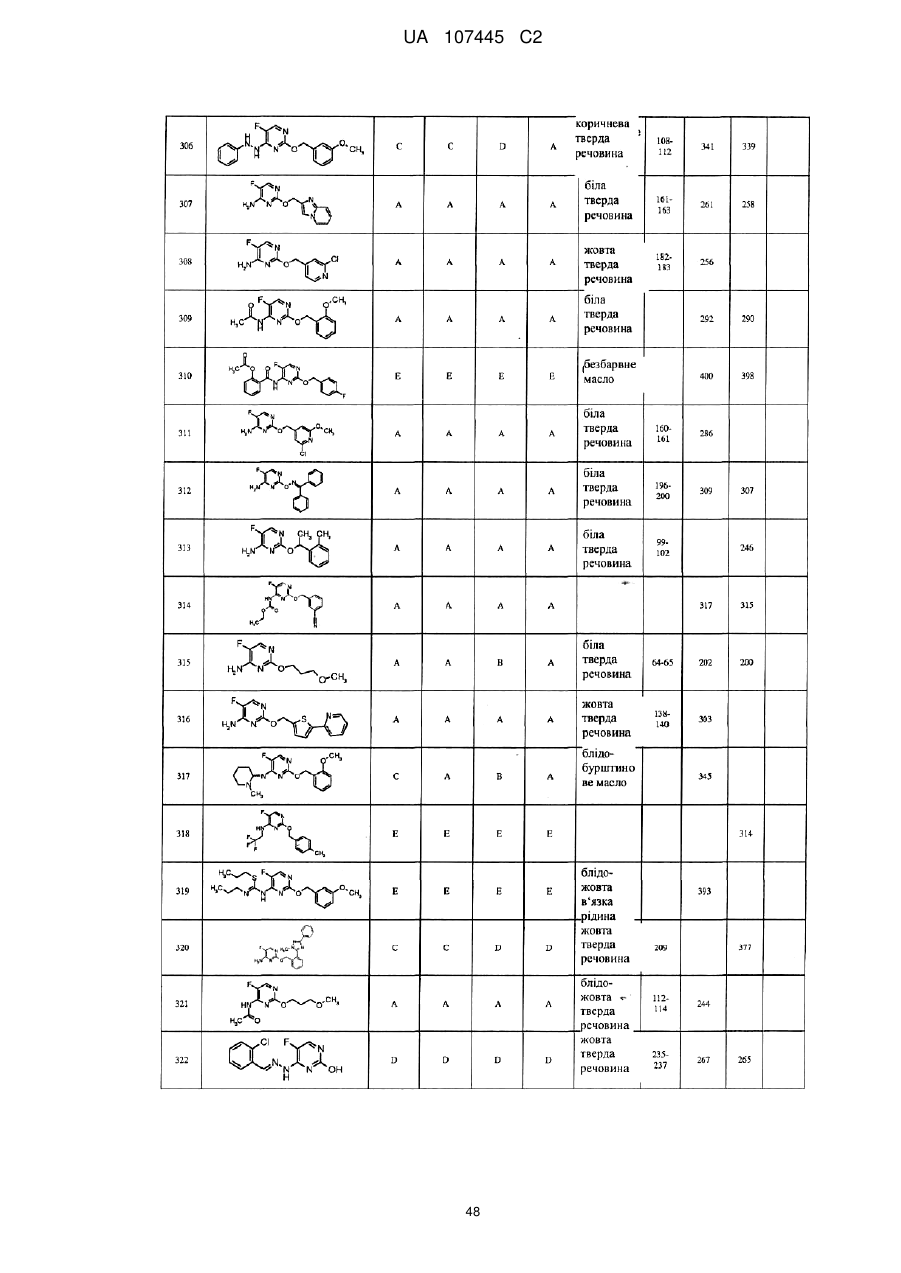
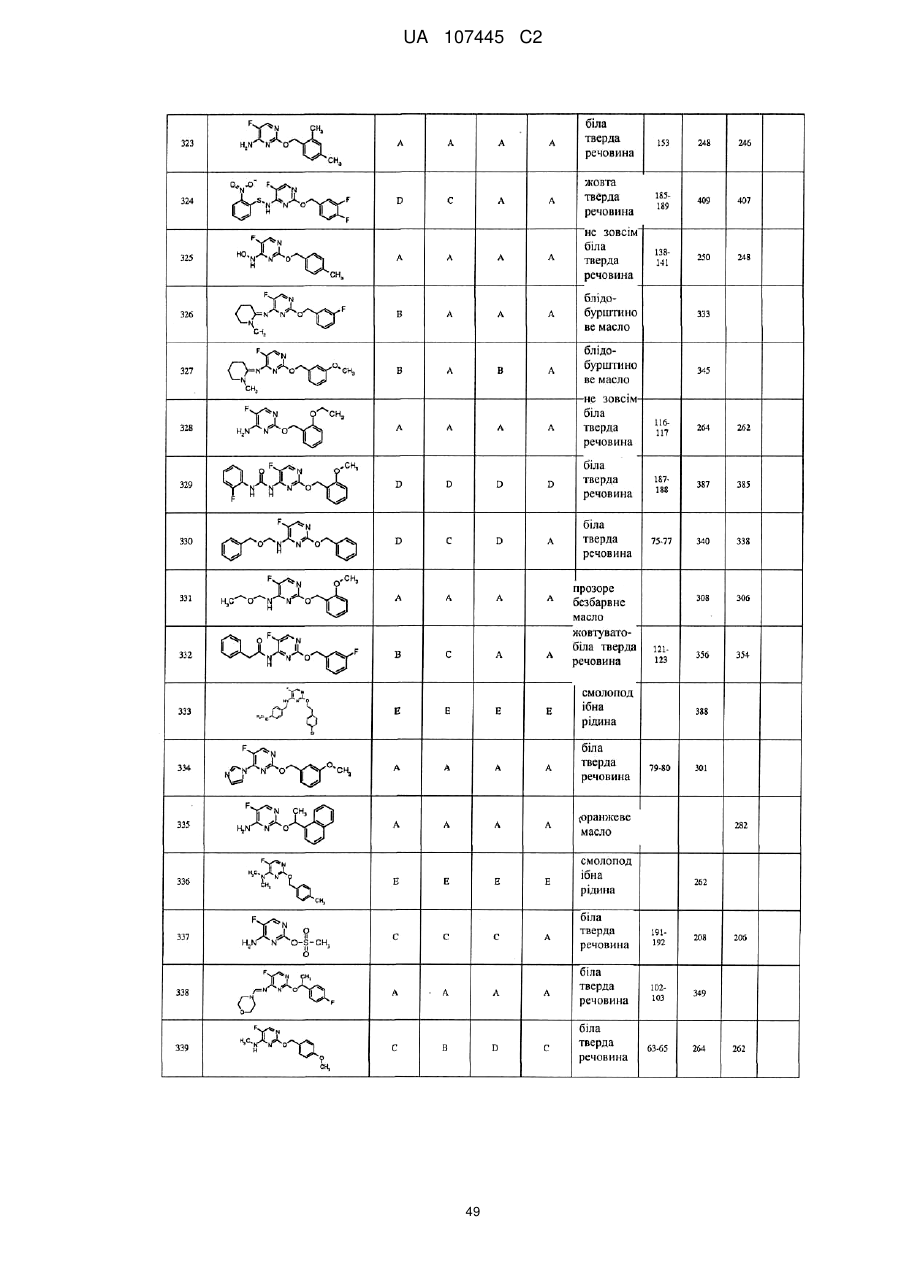
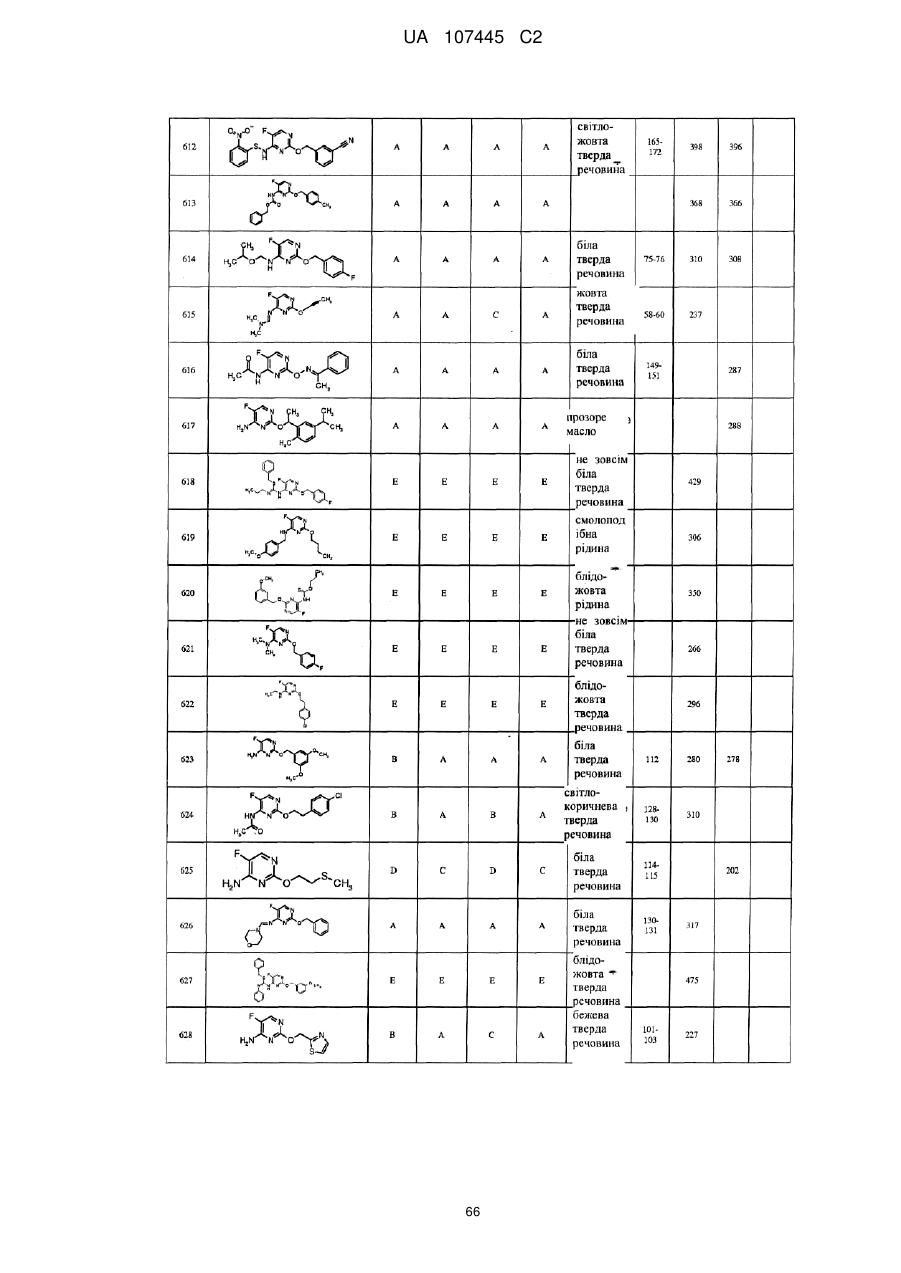
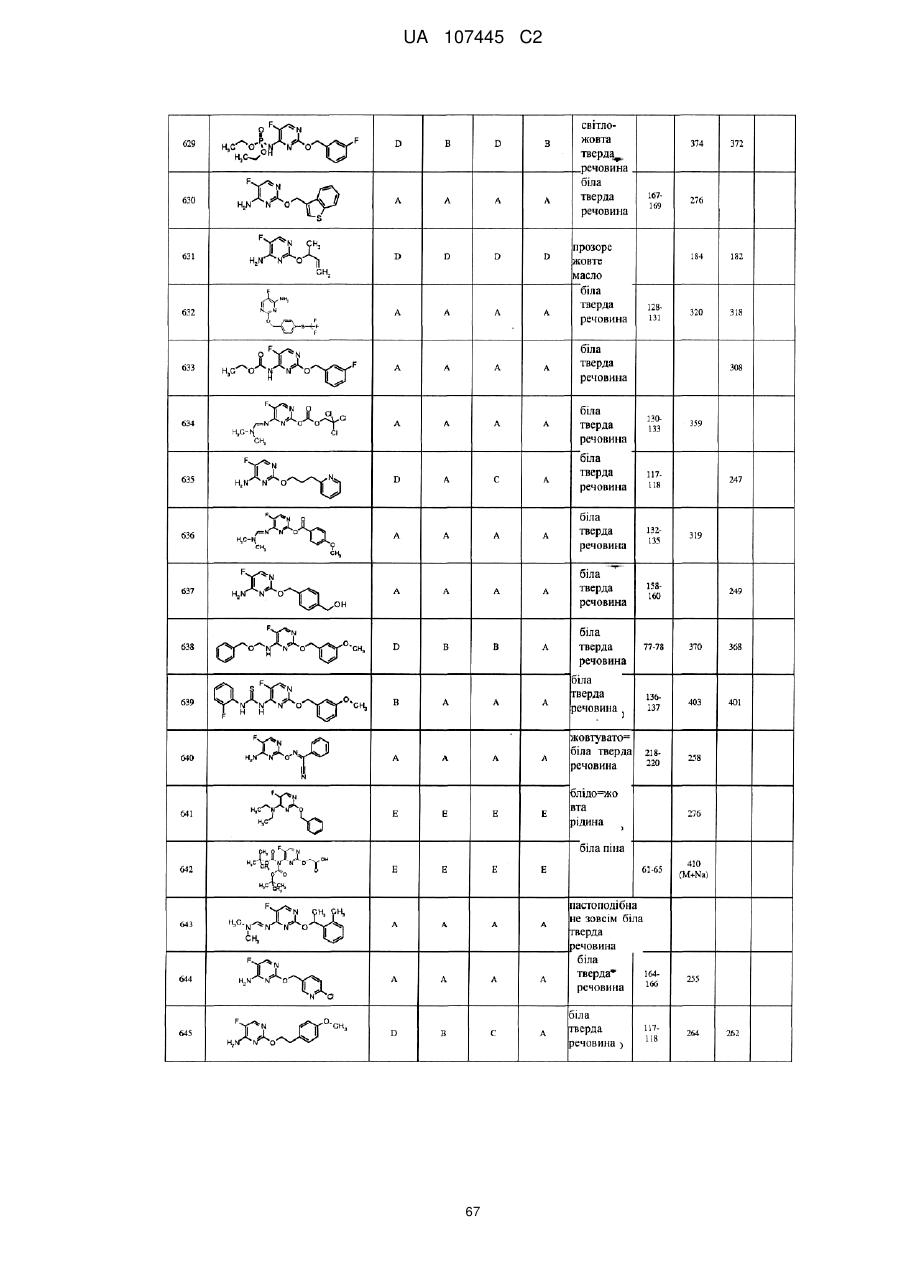
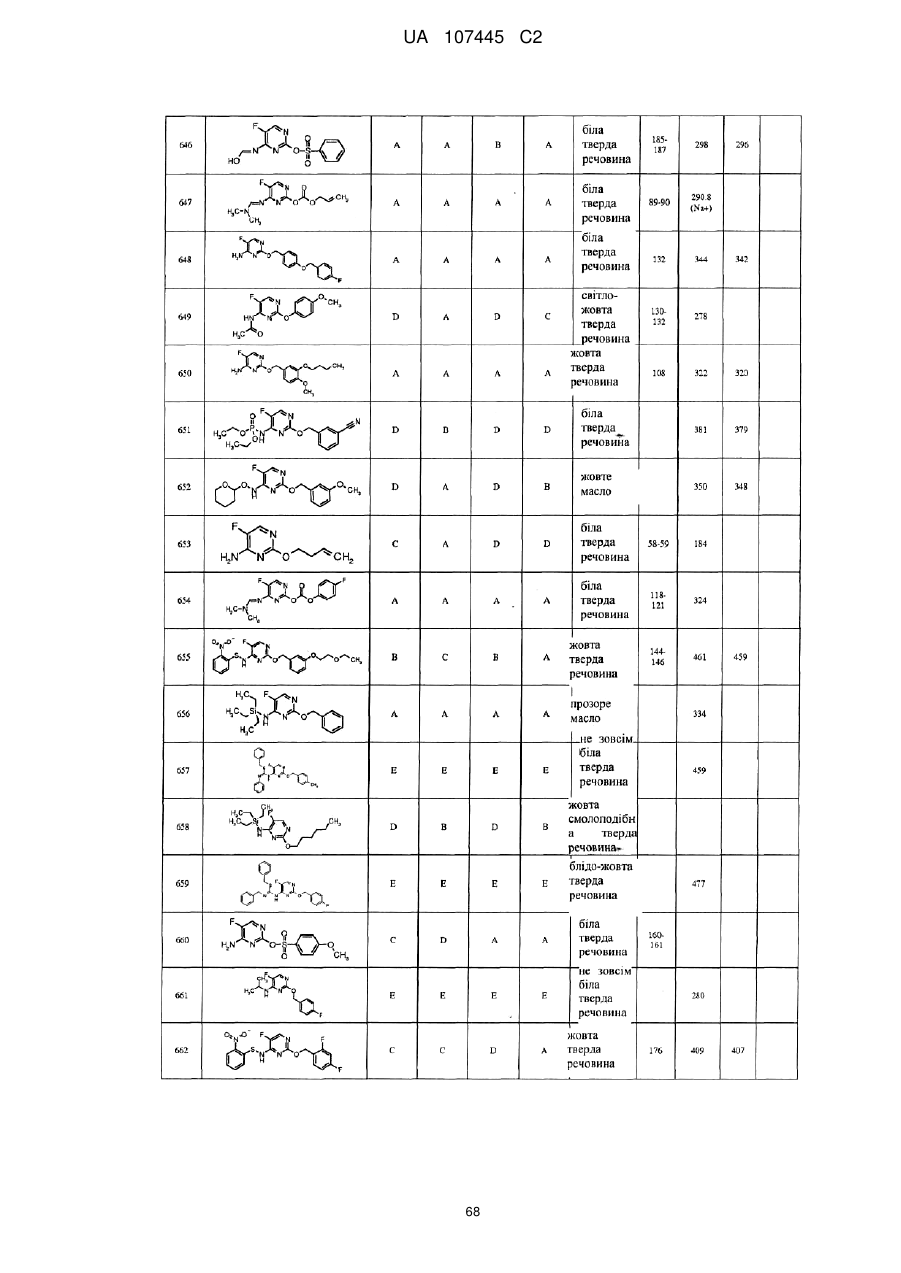
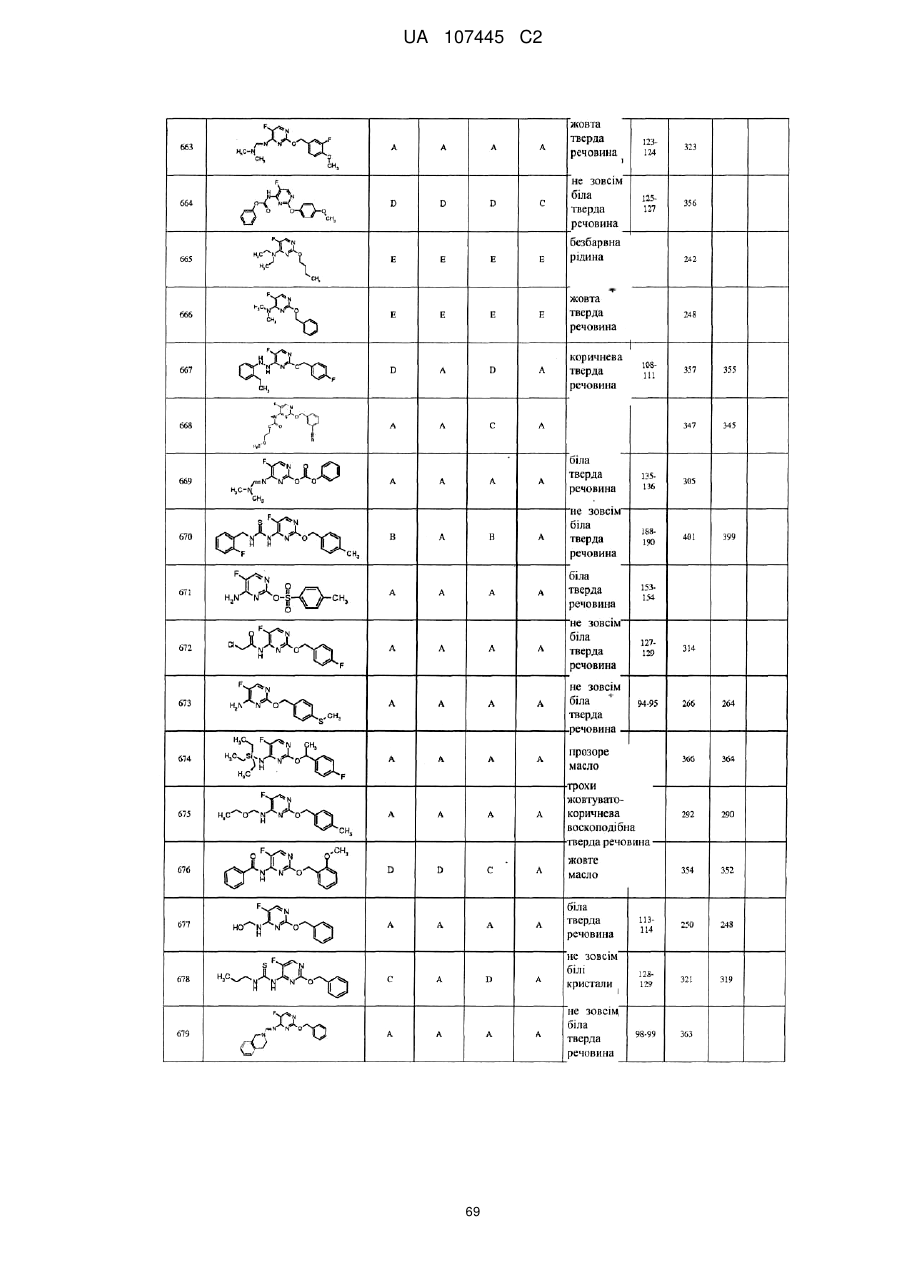
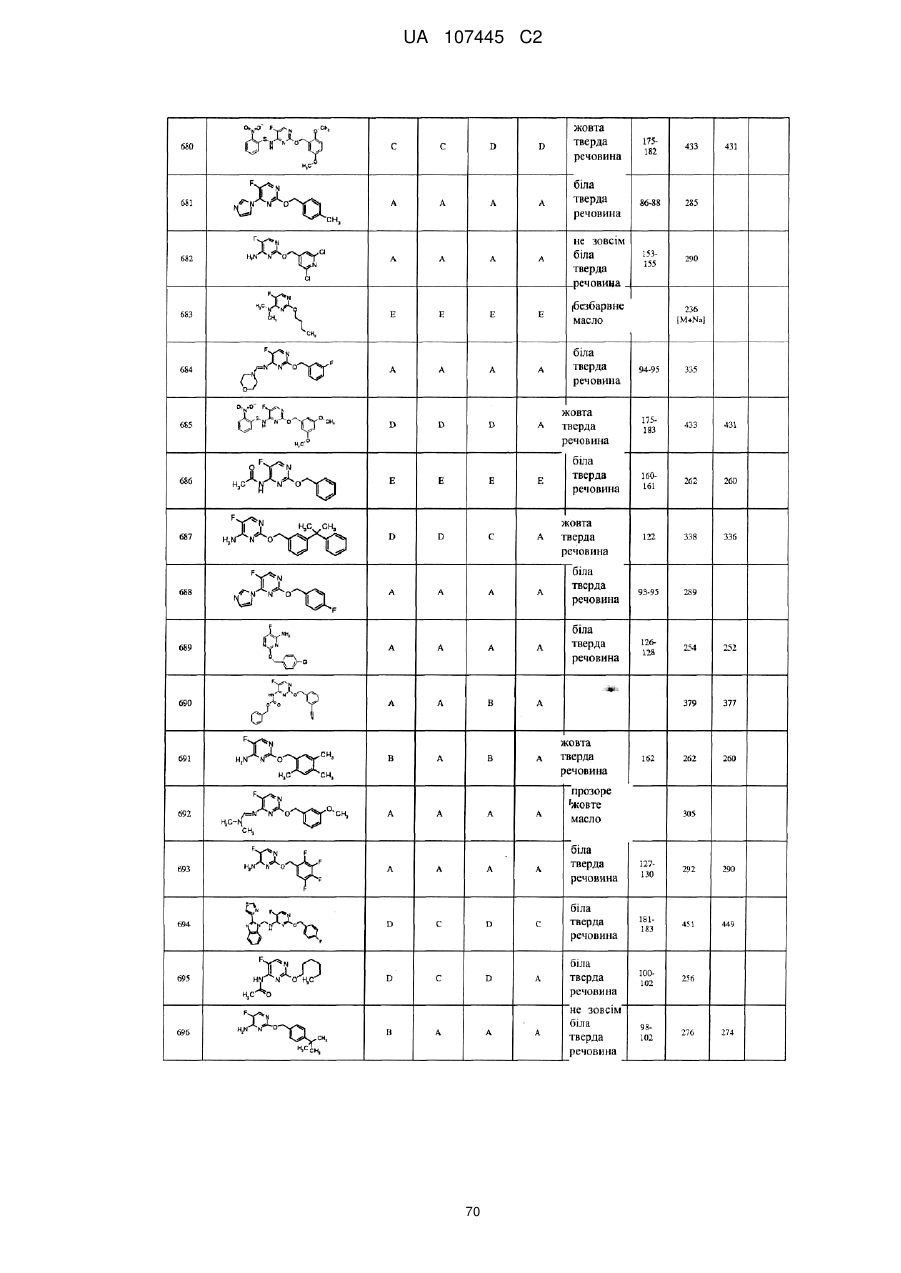
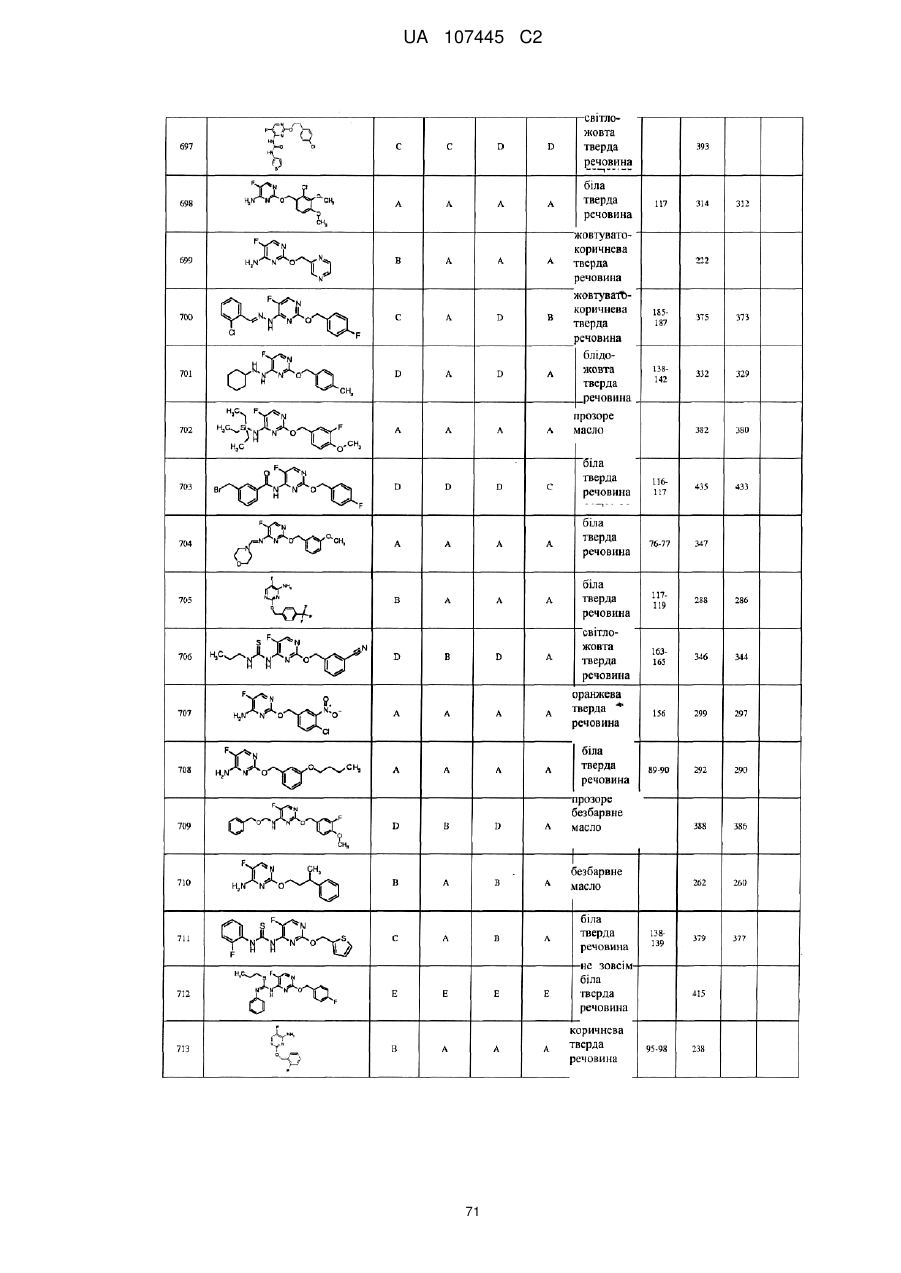
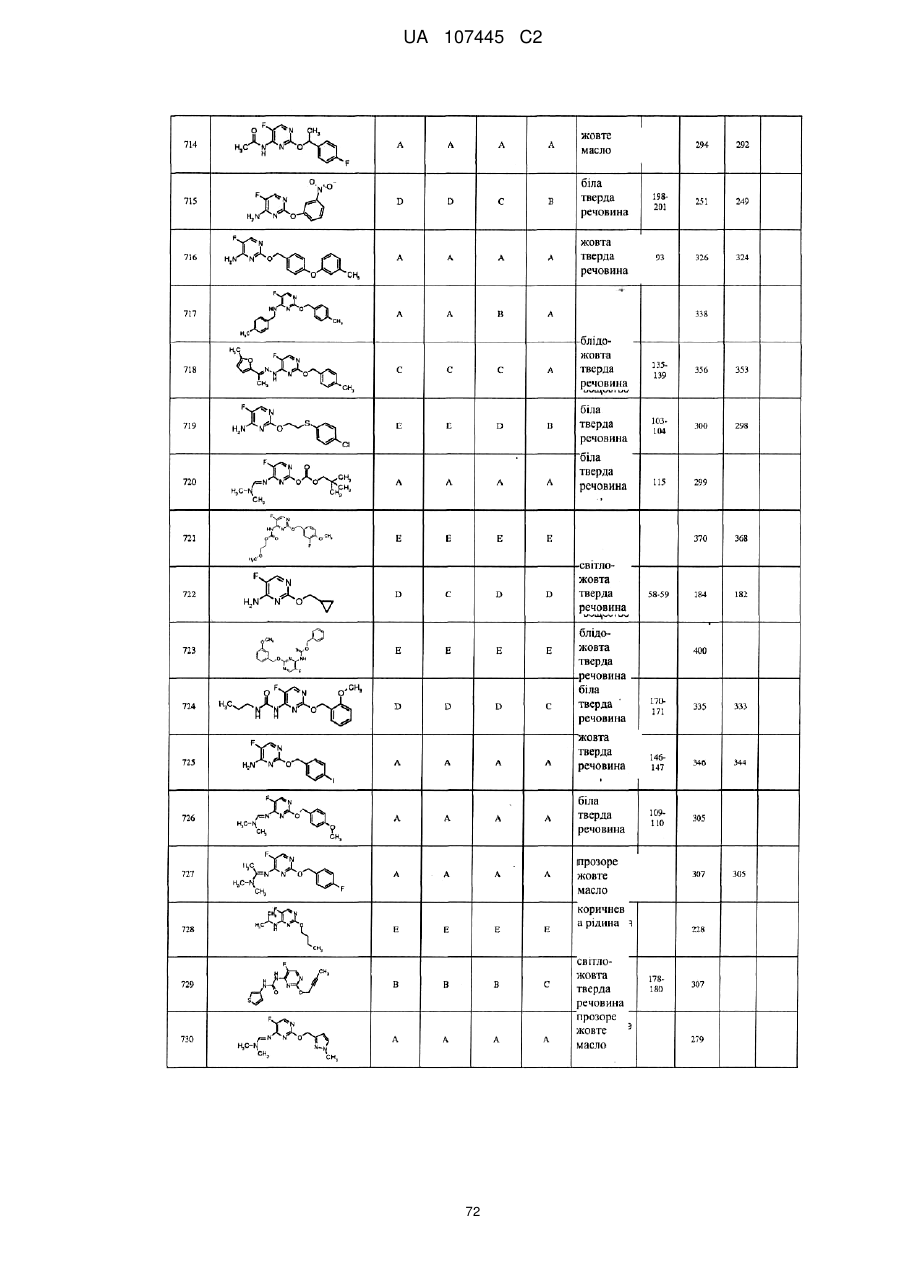
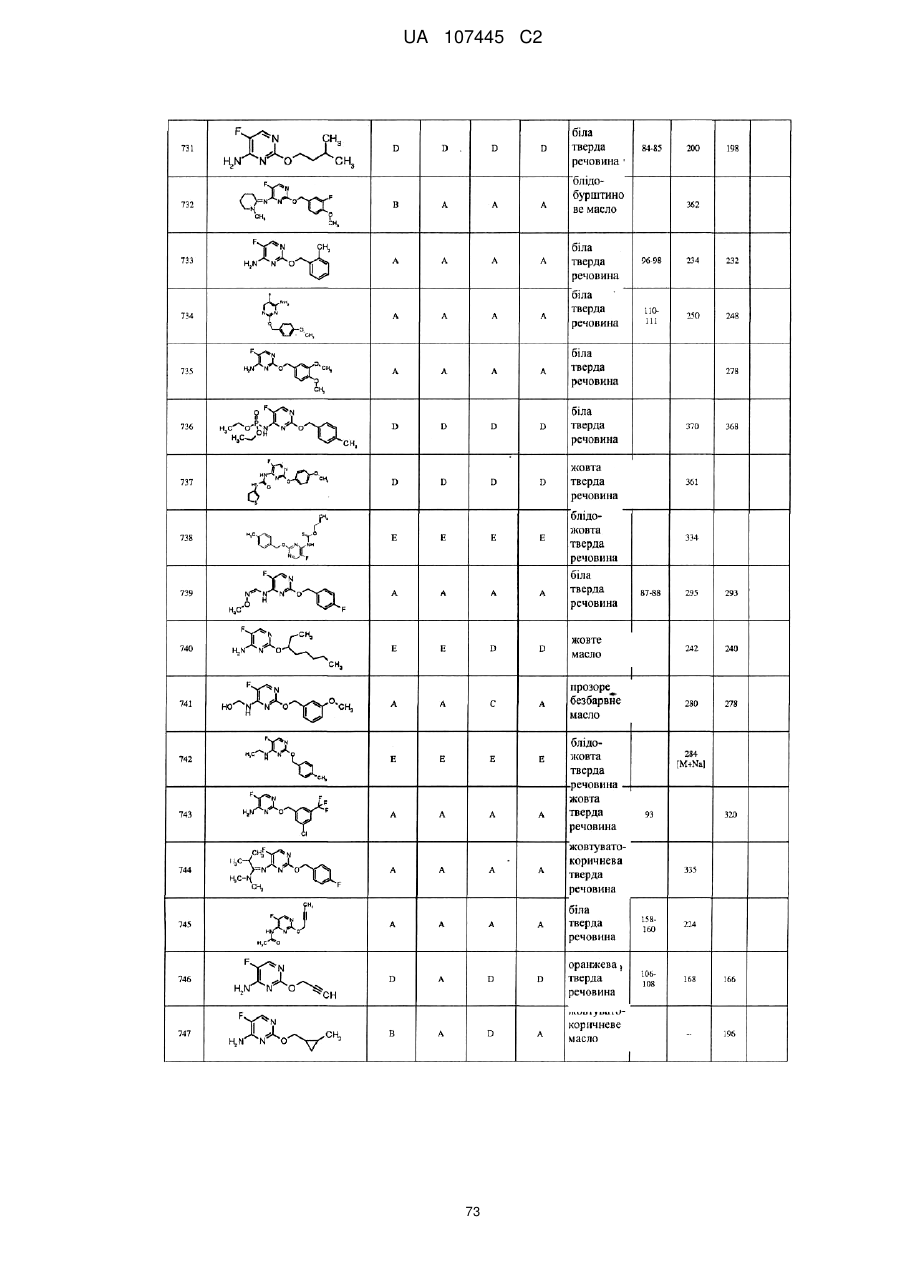
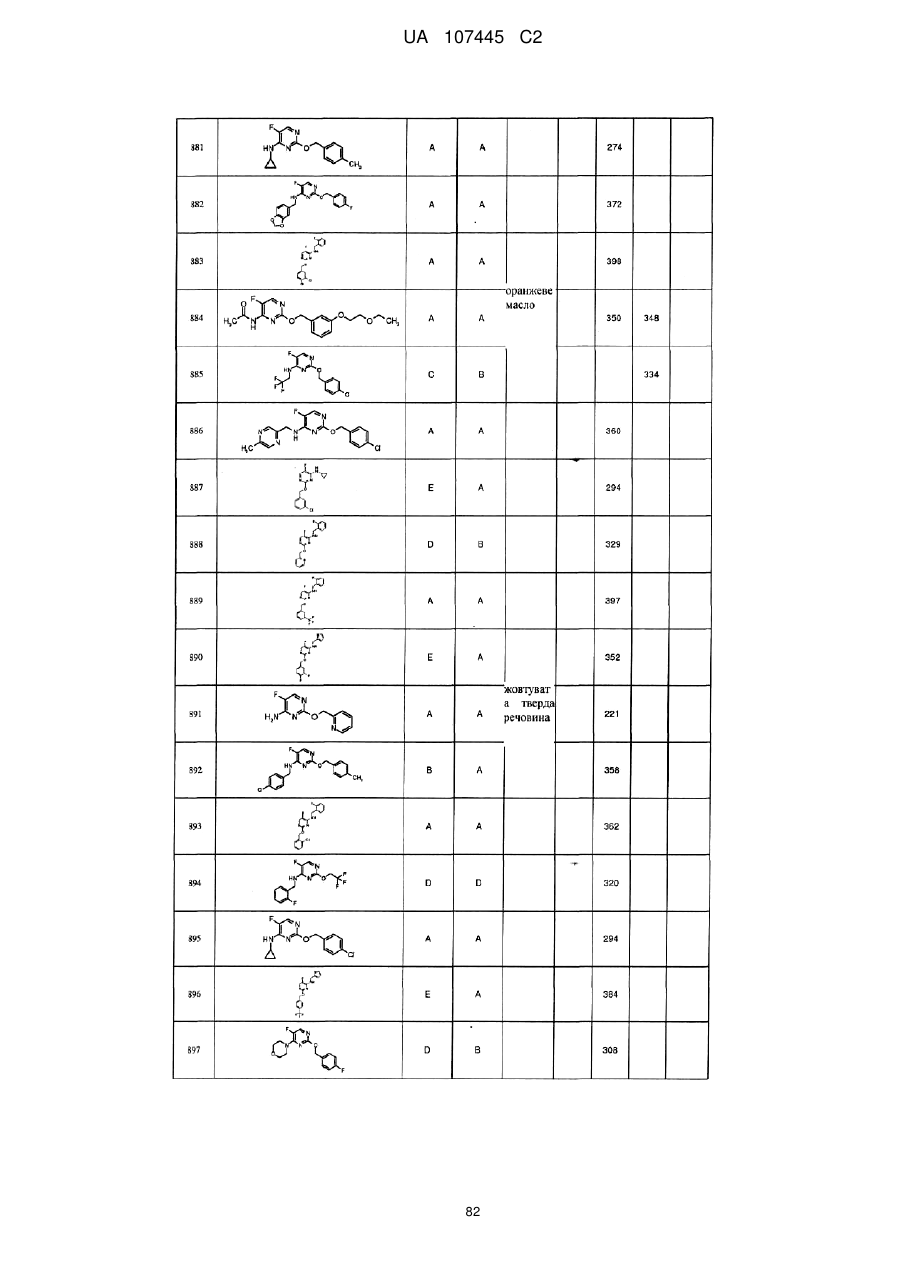
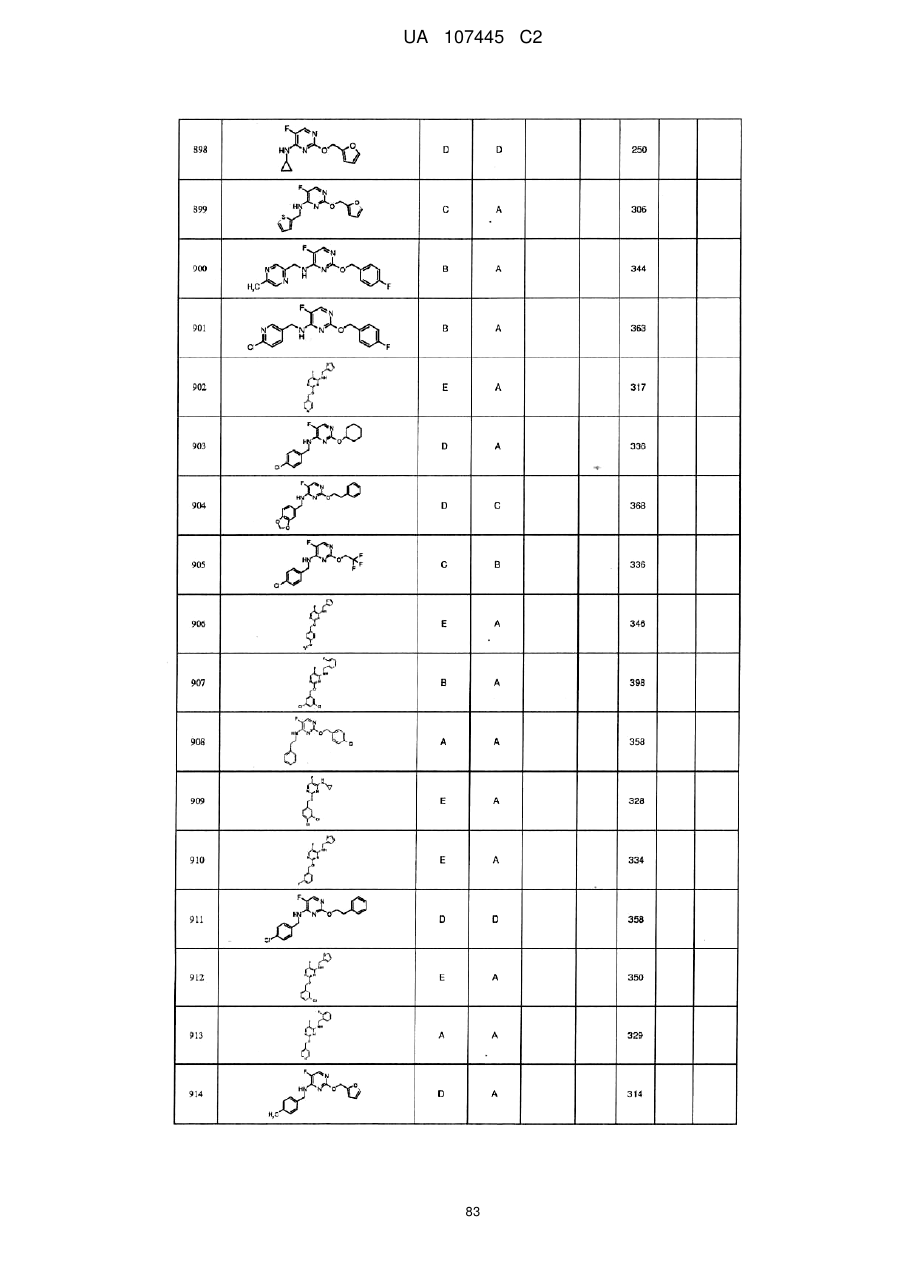
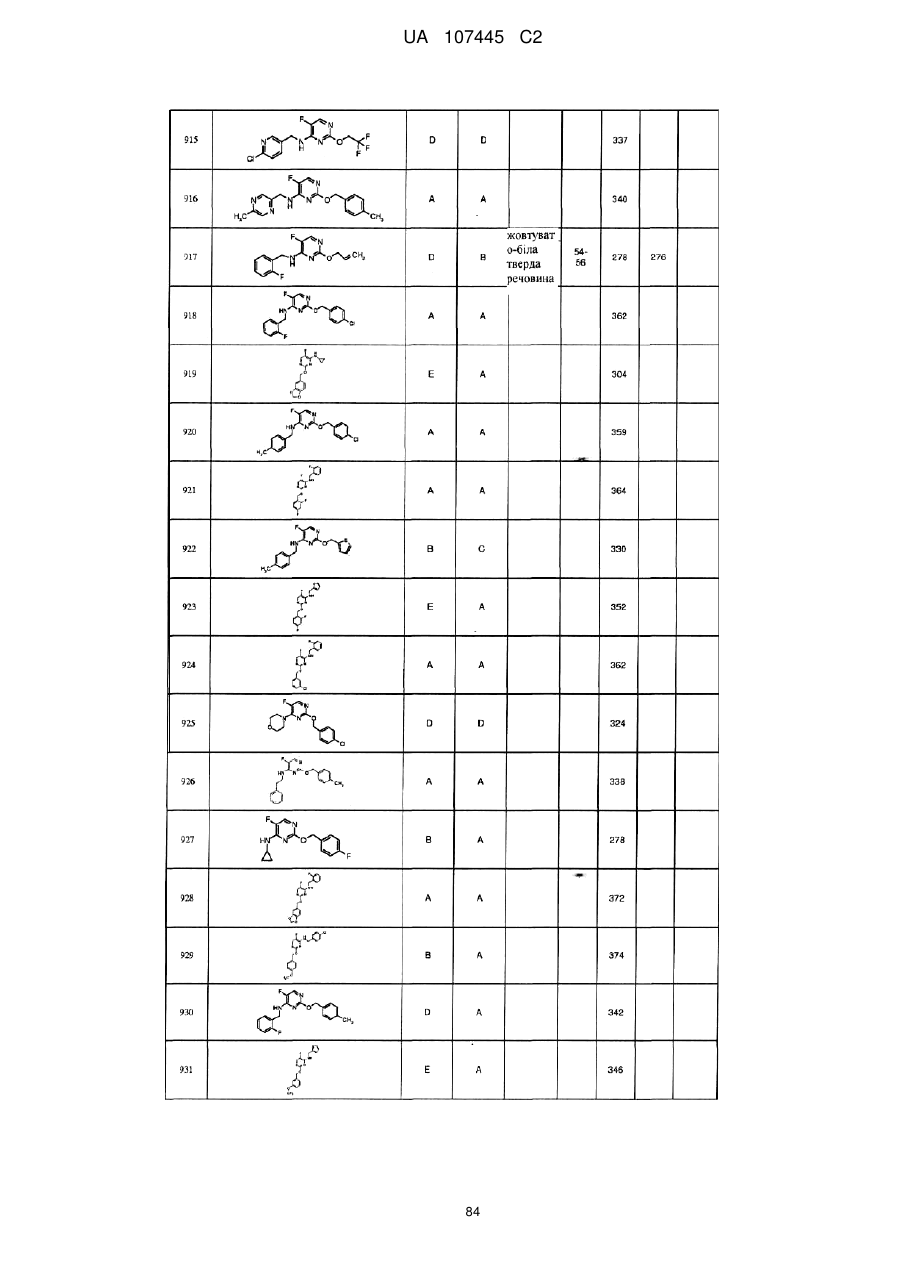
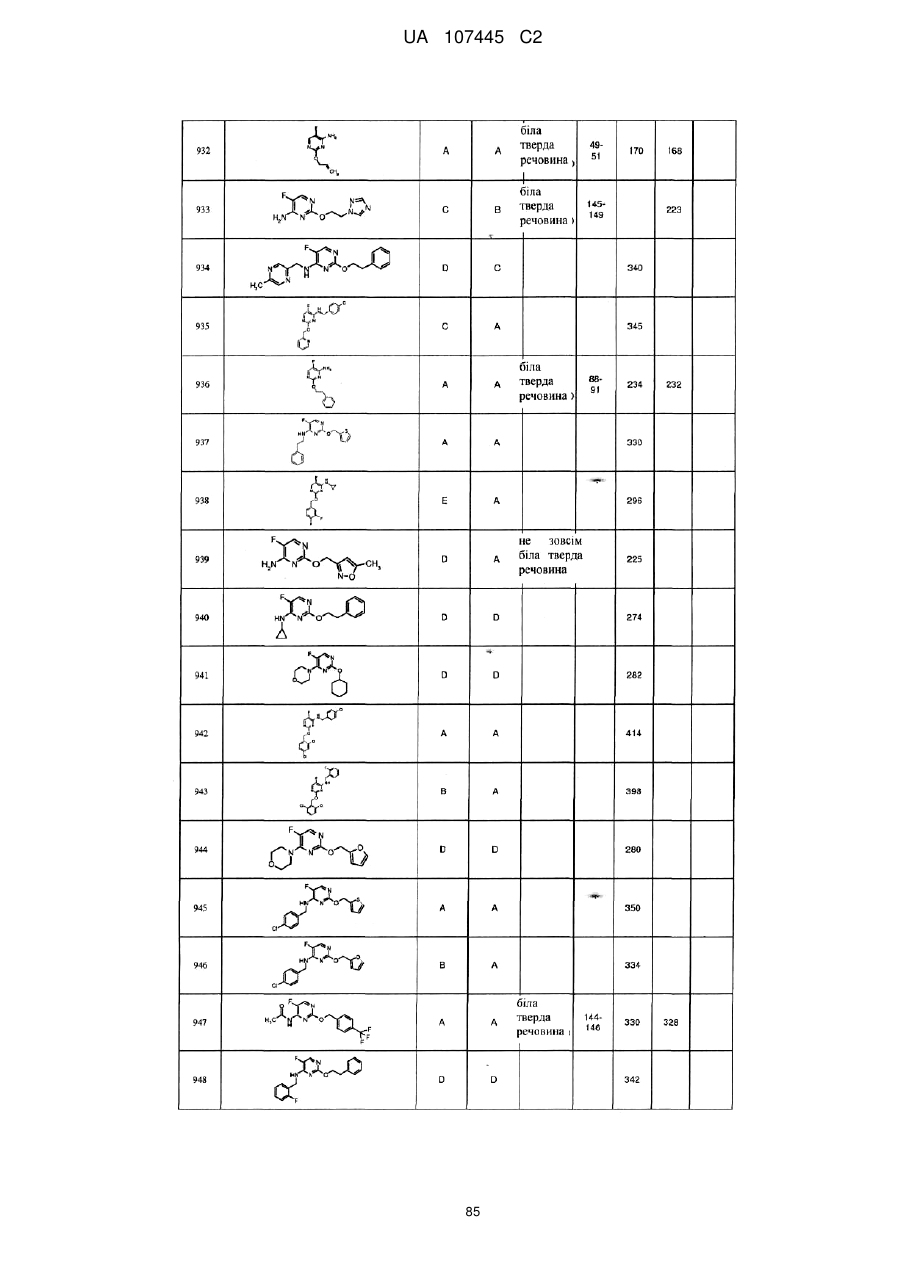
5-фторпіримідинові похідні як фунгіциди
Номер патенту: 107445
Опубліковано: 12.01.2015
Автори: Руіс Джеймс, Вебстер Джеффрі, Побанс Марк, Надер Бассам, Оуен В., Лорсбах Бет, Мартін Тімоті, Бенко Золтан, Сміт Фрісбі, Яо Ченьлінь, Епп Джеффрі, Салленбергер Майкл, Мейєр Кевін, Бро Ннека, Девіс Джордж, Янг Девід, Бебель Тімоті, Брайан Крісті
Формула / Реферат
1. Сполука формули І
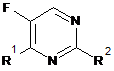 , І
, І
де R1 являє собою -N(R3)R4;
R2 являє собою -OR21;
R3 являє собою:
Н;
С1-С6-алкіл, необов'язково заміщений 1-3 групами R5;
С2-С6-алкеніл, необов'язково заміщений 1-3 групами R5;
5- або 6-членний гетероароматичний цикл, вибраний з групи, яка складається з фуранілу, піридинілу, піридиніл-N-оксиду, піримідинілу, піридазинілу, піразинілу, тіазолілу, триазинілу, тіадіазолілу, оксазолілу, ізоксазолілу, триазолілу; при цьому кожний гетероароматичний цикл необов'язково заміщений 1-3 групами R29;
імідазол, конденсований з ароматичним або гетероароматичним циклом, вибраним з групи, яка складається з бензолу, оксазолу, ізоксазолу, фурану, тіазолу, піримідину, піридину, піролу, піразину, тіофену; при цьому кожний ароматичний або гетероароматичний цикл необов'язково заміщений 1-3 групами R29;
бензо[1,3]діоксоліл;
3Н-ізобензофуран-1-оніл;
ціано;
С3-С6-алкініл, необов'язково заміщений 1-3 групами R5;
-C(=O)R6;
-C(=O)OCH2C(=O)R8;
-C(=S)R6;
-C(=S)NHR8;
-C(=O)N(R8)R10;
-OR7;
-P(O)(OR15)2;
-S(O)2R8;
-SR8;
-Si(R8)3;
-N(R9)R10;
-N=C(Rl5)R16;
-(CHR24)mR29;
-(CHR24)OR29 або
-C(=NR16)SR16;
де m дорівнює цілому числу від 1 до 3;
R4 являє собою:
Н;
C1-С6-алкіл, необов'язково заміщений 1-3 групами R5;
-C(=O)R6 або
-C(=O)N(R8)R10;
як альтернатива R3 і R4, взяті разом, можуть утворювати:
5- або 6-членний насичений або ненасичений цикл, що містить 1-3 гетероатоми, де кожний цикл необов'язково може бути заміщений 1-3 групами R11;
=C(R12)N(R13)R14;
=C(R15)OR15
або
=NR31;
R5 незалежно являє собою галоген, С1-С6-алкіл, С1-С4-галогеналкіл, С1-С4-алкокси, С1-С4-галогеналкокси, С1-С4-алкілтіо, С1-С4-галогеналкілтіо, аміно, C1-С3-алкіламіно, С2-С6-алкоксикарбоніл, С2-С6-алкілкарбоніл, С2-С6-алкіламінокарбоніл, -ОН, N-метилпіперазин або С3-С6-триалкілсиліл;
R6 незалежно являє собою Н, С1-С6-алкіл, С1-С5-галогеналкіл, С1-С5-алкокси, С1-С5-галогеналкокси, С2-С6-алкоксикарбоніл, С1-С4-алкоксіалкокси, С2-С6-алкіламінокарбоніл; 1-бензо[1,2,3]тіадіазол-7-іл, тіазоліл, бензил, феніл, фенокси або бензилокси, де тіазоліл, бензил, феніл, фенокси або бензилокси необов'язково можуть бути заміщені 1-3 групами R20, 5-членний насичений або ненасичений цикл, що містить 1-3 гетероатоми, де кожний цикл необов'язково може бути заміщений 1-3 групами R11;
R7 являє собою Н, С1-С6-алкіл, С2-С6-алкеніл, С1-С5-галогеналкіл, бензил, який необов'язково може бути заміщений 1-5 групами R20, CHR18C(O)OR19 або 5- або 6-членний насичений або ненасичений цикл, що містить 1-3 гетероатоми, де кожний цикл необов'язково може бути заміщений 1-3 групами R11;
R8 незалежно являє собою С1-С6-алкіл, С1-С6-галогеналкіл, аміно, С1-С6-алкіламіно, С2-С6-діалкіламіно, феніл, необов'язково заміщений 1-3 групами R29, або 5- або 6-членний насичений або ненасичений цикл, що містить 1-3 гетероатоми, де кожний цикл необов'язково може бути заміщений 1-3 групами R11;
де R8 не є С1-С6-алкілом, коли R21 являє собою -Si(R8)3;
R9 являє собою Н, С1-С6-алкіл, С1-С6-галогеналкіл, -C(=O)R17 або феніл, необов'язково заміщений 1-3 групами R20,
R10 являє собою Н або С1-С6-алкіл, С1-С6-галогеналкіл або феніл, необов'язково заміщений 1-3 групами R20;
R11 незалежно являє собою галоген, С1-С6-алкіл, С1-С6-галогеналкіл, С1-С6-алкокси, С1-С6-галогеналкокси, С1-С6-алкілтіо, С1-С6-галогеналкілтіо, аміно, С1-С6-алкіламіно, С2-С6-діалкіламіно, С2-С6-алкоксикарбоніл або С2-С6-алкілкарбоніл;
R12 являє собою Н або С1-С4-алкіл;
R13 і R14 незалежно являють собою Н, ціано, -ОН, С1-С4-алкіл, С1-С6-алкокси, С2-С6-алкілкарбоніл, феніл або бензил, де феніл або бензил необов'язково можуть бути заміщені 1-3 групами R20;
як альтернатива R13 і R14, взяті разом, можуть утворювати:
5- або 6-членний насичений або ненасичений цикл, що містить 1-3 гетероатоми, де кожний цикл необов'язково може бути заміщений 1-3 групами R11;
як альтернатива R12 і R13, взяті разом, можуть утворювати:
5- або 6-членний насичений або ненасичений цикл, що містить 1-3 гетероатоми, де кожний цикл необов'язково може бути заміщений 1-3 групами R11;
R15 являє собою Н або С1-С6-алкіл;
R16 являє собою Н, С1-С6-алкіл або феніл, необов'язково заміщений 1-3 групами R20;
як альтернатива R15 і R16 можуть бути взяті разом у вигляді -(СН2)4- або -(СН2)5-;
R17 являє собою Н, С1-С6-алкіл, С1-С6-галогеналкіл, С1-С6-алкокси, феніл, фенокси або бензилокси, де кожний цикл необов'язково може бути заміщений 1-3 групами R20;
R18 являє собою Н, С1-С6-алкіл або С1-С6-галогеналкіл;
R19 являє собою Н, С1-С6-алкіл, С1-С6-галогеналкіл або бензил;
R20 незалежно являє собою галоген, ціано, нітро, аміно, С1-С6-алкоксіалкокси, С1-С6-алкіл, С1-С6-галогеналкіл, С1-С6-гідроксіалкіл, С2-С6-алкоксіалкіл, С2-С6-галогеналкоксіалкіл, С2-С6-алкеніл, С2-С6-галогеналкеніл, С3-С6-алкініл, С3-С6-галогеналкініл, гідроксил, С1-С6-алкокси, С1-С6-галогеналкокси, С2-С6-алкенілокси, С2-С6-галогеналкенілокси, С3-С6-алкінілокси, С3-С6-галогеналкінілокси, С1-С6-алкілтіо, С1-С6-галогеналкілтіо, С1-С6-алкілсульфоніл, С1-С6-галогеналкілсульфоніл, С2-С6-алкенілтіо, С2-С6-галогеналкенілтіо, С2-С6-галогеналкенілсульфоніл, С3-С6-алкінілтіо, С3-С6-алкінілсульфоніл, С3-С6-галогеналкінілсульфоніл, С1-С6-алкіламіно, С2-С8-діалкіламіно, С3-С8-діалкіламінокарбоніл, С2-С6-алкоксикарбоніл, С2-С6-алкілкарбоніл, С3-С6-триалкілсиліл, 2-[(Е)-метоксііміно]-N-метилацетамідил, феніл, бензил, бензилокси, фенокси або 5- або 6-членний гетероароматичний цикл, де кожний феніл, бензил, бензилокси, фенокси або 5- або 6-членний гетероароматичний цикл необов'язково може бути заміщений 1-3 замісниками, незалежно вибраними з груп R29;
R21 являє собою:
С5-С14-алкіл;
С1-С6-галогеналкіл;
С2-С4-алкеніл;
С2-С4-галогеналкеніл;
С3-С4-алкініл;
С3-С4-галогеналкініл;
феніл, нафтил або тетрагідрохінолініл, кожний з яких необов'язково заміщений 1-3 групами R20;
-(CHR22)mR23;
-(CHR22)mC(O)OR24;
-(CHR22)mC(O)R25;
-(CHR22)mC(O)N(R26)R27;
-(CHR22)mOR28;
-(CHR22)mSR28;
-(CHR22)mN(R26)R27;
-C(=O)R25;
-N=C(R30)(R32);
-NR24C(=O)OR24;
-Si(R8)3;
-SO2R27;
С2-С6-алкоксикарбоніл;
цукри, вибрані з групи, яка складається з бета-О-глюкозатетраацетату, рамнози, фруктози і пентози; або
5- або 6-членний гетероароматичний цикл, вибраний з групи, яка складається з фуранілу, піридинілу, піридиніл-N-оксиду, піримідинілу, піридазинілу, піразинілу, піразолілу, тіазолілу, триазинілу, тіадіазолілу, оксазолілу, триазолілу або ізоксазолілу, де кожний 5- або 6-членний гетероароматичний цикл необов'язково може бути заміщений 1-5 групами R20;
R22 являє собою Н, С1-С6-алкіл, С1-С6-алкокси, бензил або феніл, де кожний з бензилу або фенілу необов'язково може бути заміщений 1-3 групами R20;
R23 являє собою:
С4-С6-алкіл;
С1-С6-галогеналкіл;
феніл, необов'язково заміщений 1-5 групами R20;
гетероароматичні цикли з конденсованими кільцями, вибрані з групи, яка складається з бензотіофенілу, хінолінілу, ізохінолінілу, тієно[2,3-b]піридилу, 1-метил-1Н-тієно[2,3-с]піразолілу, бензофуранілу і бензоімідазолілу, 2,3-дигідробензофуран-2-ілу, 4-метил-4Н-тієно[3,2-b]пірол-5-ілу, 1-метил-1H-індол-5-ілу, імідазо[1,2-а]піридин-2-ілу, імідазо[2,1-b]тіазол-6-ілу, бензотіазол-2-ілу, бензо[b]тіофен-7-ілу і 1-метил-1Н-індазол-3-ілу, де кожний з циклів може бути додатково заміщений 1-3 групами R20;
нафтил;
бензо[1,3]діоксоліл;
піролідиноніл;
оксетаніл;
5- або 6-членний насичений або ненасичений цикл, що містить 1-3 гетероатоми, де кожний цикл необов'язково може бути заміщений 1-3 групами R11; або
5- або 6-членний гетероароматичний цикл, вибраний з групи, яка складається з фуранілу, піридинілу, піридиніл-N-оксиду, піримідинілу, піридазинілу, піразинілу, піразолілу, тіазолілу, триазинілу, тіадіазолілу, оксазолілу, ізоксазолілу, триазолілу, імідазолілу, тіофен-2-ілу і тіофен-3-ілу, де кожний гетероароматичний цикл необов'язково може бути заміщений 1-3 групами R20;
R24 являє собою Н, С1-С6-алкіл, феніл або бензил, необов'язково заміщений 1-3 групами R20;
R25 являє собою:
Н;
С1-С6-алкіл;
феніл, необов'язково заміщений 1-3 групами R20; або
5- або 6-членний гетероароматичний цикл, вибраний з групи, яка складається з фуранілу, піридинілу, піридиніл-N-оксиду, піримідинілу, піридазинілу, піразинілу, тіазолілу, триазинілу, тіадіазолілу, оксазолілу, триазолілу і ізоксазолілу;
R26 і R27 незалежно являють собою:
Н;
С1-С6-алкіл;
бензил або феніл, де кожний з бензилу або фенілу необов'язково може бути заміщений 1-3 групами R20; або
5- або 6-членний насичений або ненасичений цикл, що містить 1-3 гетероатоми, де кожний цикл необов'язково може бути заміщений 1-3 групами R11;
R28 являє собою:
Н;
С1-С6-алкіл;
С1-С6-галогеналкіл;
С1-С6-алкоксіалкіл;
С2-С6-алкілкарбоніл;
бензил або феніл, де кожний з бензилу або фенілу необов'язково може бути заміщений 1-3 групами R20; або
5- або 6-членний насичений або ненасичений цикл, що містить 1-3 гетероатоми, де кожний цикл необов'язково може бути заміщений 1-3 групами R11;
R29 незалежно являє собою галоген, ціано, нітро, С1-С6-алкіл, C1-C6-галогеналкіл, C1-С6-гідроксіалкіл, С2-С6-алкоксіалкіл, С1-С6-галогеналкоксіалкіл, С2-С6-алкеніл, С2-С6-галогеналкеніл, С3-С6-алкініл, С3-С6-галогеналкініл, гідроксил, С1-С6-алкокси, С1-С6-галогеналкокси, С2-С6-алкенілокси, С2-С6-галогеналкенілокси, С3-С6-алкінілокси, С3-С6-галогеналкінілокси, С1-С6-алкілтіо, С1-С6-алкілсульфоніл, С1-С6-галогеналкілсульфоніл, С2-С6-алкенілтіо, С2-С6-галогеналкенілтіо, С2-С6-галогеналкенілсульфоніл, С3-С6-алкінілтіо, С3-С6-алкінілсульфоніл, С3-С6-галогеналкінілсульфоніл, С1-С6-алкіламіно, С2-С8-діалкіламіно, С3-С8-діалкіламінокарбоніл, С3-С6-триалкілсиліл, тіазоліл, феніл, піримідиніл або піридил, де тіазоліл, феніл, піридил або піримідиніл необов'язково можуть бути заміщені 1-3 групами R20;
R30 незалежно являє собою:
С1-С6-алкіл, С1-С6-галогеналкіл, С1-С6-алкокси, С1-С6-галогеналкокси, С2-С6-алкенілокси, С2-С6-галогеналкенілокси, С1-С6-алкіламіно, С2-С8-діалкіламіно, С3-С8-діалкіламінокарбоніл, С2-С6-алкіламінокарбоніл;
феніл, де фенільний цикл необов'язково може бути заміщений 1-3 групами R20; або
5- або 6-членний насичений або ненасичений цикл, що містить 1-3 гетероатоми, де кожний цикл необов'язково може бути заміщений 1-3 групами R11;
R31 являє собою:
С1-С6-алкіл,
феніл, де фенільний цикл необов'язково може бути заміщений 1-3 групами R20; або
5- або 6-членний насичений або ненасичений цикл, що містить 1-3 гетероатоми, де кожний цикл необов'язково може бути заміщений 1-3 групами R11;
R32 являє собою:
С1-С6-алкіл, С1-С6-алкокси, бензил або феніл, де кожний з бензилу або фенілу необов'язково може бути заміщений 1-3 групами R20;
як альтернатива R31 і R32, взяті разом, можуть утворювати:
5- або 6-членний насичений або ненасичений цикл, що містить 1-3 гетероатоми, де кожний цикл необов'язково може бути заміщений 1-3 групами R11.
2. Сполука за п. 1, в якій:
R1 являє собою -N(R3)R4;
R2 являє собою -OR21;
R3 являє собою Н; і
R4 являє собою Н.
3. Сполука за п. 1, де сполука представлена формулою
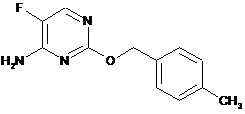 .
.
Текст
Реферат: (74) Представник: Мошинська Ніна Миколаївна, реєстр. №115 (56) Перелік документів, взятих до уваги експертизою: EP 0 139 613, A, 02.05.1985 ЕР 0 332 579, А, 13.09.1989 US 3 868 373, A, 25.02.1975 GB 1 461 184, A, 13.02.1977 WO 03059916, A, 24.07.2003 ЕР 0 602 478, А, 22.06.1994 US 3 309 359, А, 14.03.1967 US 5 480 991, А, 02.01.1996 US 3 354 160, А, 21.11.1967 Jaworski Andrzej et al. JOURNAL OF MOLECULAR STRUCTURE, 1990, no. 223, pp. 63-92 BIRESSI M GABRIELLA et al. GAZZETTA CHIMICA ITALIANA, vol. 93, no. 10, 01.01.1963, pp. 12681278 IRIS WEMPEN et al. JOURNAL OF THE AMERICAN CHEMICAL SOCIETY, vol. 83, no. 23, 1961, pp. 4755-4766 LAK S. JEONG et al. JOURNAL OF MEDICINAL CHEMISTRY, vol. 36, no. 18, 01.09.1993, pp. 26272638 KLOETZER WILHELM et al. MONATSHEFTE FUR CHEMIE, SPRINGER VERLAG WIEN, AT, vol. 99, no. 2, 01.01.1968, pp. 847-860 ATKINS PAUL J. et al. JOURNAL OF THE CHEMICAL SOCIETY, PERKIN TRANSACTIONS 2: PHYSICAL ORGANIC CHEMISTRY, ROYAL SOCIETY OF CHEMISTRY, GB, no. 2, 01.01.1972, pp. 155-160 Проценко Л. Д. и др. Журнал общей химии, Том 33, Вып. 2, 1963, стр. 537-542 Ивин Б. А. и др. Журнал общей химии, Том 35, Вып. 7, 1965, стр. 1303-1307 Кузьменко И. И. и др. Физиологически активне вещества, Вып. 20, 1988, стр. 7-10 SANEYOSHI M. et al. CHEMICAL AND PHARMACEUTICAL BULLETIN, 01.11.1995, vol. 43, no. 11, pp. 2005-2009 SANEYOSHI M. et al. CHEMICAL & PHARMACEUTICAL BULLETIN, vol. 29, no. 10, 01.01.1981, pp. 2769-2775 GELIJKENS C.F. et al. JOURNAL OF CHROMATOGRAPHY B: BIOMEDICAL SCIENCES AND APPLICATIONS, 01.10.1981, vol. 225, no. 2, pp. 291-299 UA 107445 C2 (12) UA 107445 C2 Даній винахід належить до галузі 5-фторпіримідинів і їх похідних і до застосування таких сполук як фунгіцидів. UA 107445 C2 5 10 15 20 25 30 35 40 45 50 55 Перехресне посилання на споріднені заявки У даній заявці заявляється перевага пріоритету попередньої патентної заявки США, серійний № 61/011799, поданої 22 січня 2008 р., і попередньої патентної заявки США, серійний № 61/115297, поданої 17 листопада 2008 р. Галузь техніки, до якої належить винахід Даній винахід належить до галузі 5-фторпіримідинів і їх похідних і до застосування таких сполук як фунгіцидів. Рівень техніки і суть винаходу Фунгіциди являють собою сполуки природного або синтетичного походження, які використовують для догляду за рослинами і захисту рослин проти пошкодження, викликаного відповідними сільськогосподарськими грибками. Зазвичай один фунгіцид не може застосовуватися у всіх ситуаціях. Отже, дослідження продовжується з метою одержання фунгіцидів, які можуть мати кращу ефективність, більш зручні для застосування і є більш дешевими. Даній винахід належить до 5-фторпіримідинових сполук і їх застосування як фунгіцидів. Сполуки згідно з даним винаходом можуть забезпечувати захист проти аскоміцетів, базидіоміцетів, дейцероміцетів і ооміцетів. Один з варіантів здійснення даного винаходу може включати в себе сполуки формули I: , 1 3 4 де R являє собою -N(R )R ; 2 21 R являє собою -OR ; 3 R являє собою: Н; 5 C1-C6-алкіл, необов'язково заміщений 1-3 групами R ; 5 C2-C6-алкеніл, необов'язково заміщений 1-3 групами R ; 5- або 6-членний гетероароматичний цикл, вибраний з групи, яка складається з фуранілу, піридинілу, піридиніл-N-оксиду, піримідинілу, піридазинілу, піразинілу, тіазолілу, триазинілу, тіадіазолілу, оксазолілу, ізоксазолілу, триазолілу; при цьому кожний гетероароматичний цикл 30 необов'язково заміщений 1-3 групами R ; імідазол, конденсований з ароматичним або гетероароматичним циклом, вибраним з групи, яка складається з бензолу, оксазолу, ізоксазолу, фурану, тіазолу, піримідину, піридину, піролу, піразину, тіофену; при цьому кожний ароматичний або гетероароматичний цикл необов'язково 30 заміщений 1-3 групами R ; бензо[1,3]діоксоліл; 3H-ізобензофуран-1-оніл; ціано; 5 C3-C6-алкініл, необов'язково заміщений 1-3 групами R ; 6 -С(=О)R ; 8 -С(=О)OCH2C(=О)R ; 6 -С(=S)R ; 8 -С(=S)nHR ; 8 10 -С(=О)n(R )R ; 7 -OR ; 15 -Р(О)(OR )2; 8 -S(О)2R ; 8 -SR ; 8 -Si(R )3; 9 10 -N(R )R ; 15 16 -N=С(R )R ; 22 37 -(CHR )mR ; 24 29 -(CHR )OR ; або 16 16 -С(=NR )SR ; де m дорівнює цілому числу від 1 до 3; 4 R являє собою: Н; 1 UA 107445 C2 5 5 10 15 20 25 30 35 40 45 50 55 60 C1-C6-алкіл, необов'язково заміщений 1-3 групами R ; 6 -С(=О)R ; або 8 10 -С(=О)n(R )R ; 3 4 як альтернатива R і R , взяті разом, можуть утворювати: 5- або 6-членний насичений або ненасичений цикл, що містить 1-3 гетероатоми, де кожний 11 цикл необов'язково може бути заміщений 1-3 групами R ; 12 13 14 =С(R )n(R )R ; 13 14 =С(R )(R ); 15 15 =С(R )OR ; 34 =S(R )2; або 35 =NR ; 5 R незалежно являє собою галоген, C1-C6-алкіл, C1-C4-галогеналкіл, C1-C4-алкокси, C1-C4галогеналкокси, C1-C4-алкілтіо, C1-C4-галогеналкілтіо, аміно, C1-C3-алкіламіно, C2-C6алкоксикарбоніл, C2-C6-алкілкарбоніл, C2-C6-алкіламінокарбоніл, -ОH, N-метилпіперазин або C3C6-триалкілсиліл; 6 R незалежно являє собою Н, C1-C6-алкіл, C1-C5-галогеналкіл, C1-C5-алкокси, C1-C5галогеналкокси, C2-C6-алкоксикарбоніл, C1-C4-алкоксіалкокси, C2-C6-алкіламінокарбоніл; 1бензо[1,2,3]тіадіазол-7-іл, тіазоліл, бензил, феніл, фенокси або бензилокси, де тіазоліл, бензил, 20 феніл, фенокси або бензилокси необов'язково можуть бути заміщені 1-3 групами R , 5- або 6членний насичений або ненасичений цикл, що містить 1-3 гетероатоми, де кожний цикл 11 необов'язково може бути заміщений 1-3 групами R ; 7 R являє собою Н, C1-C6-алкіл, C2-C6-алкеніл, C1-C5-галогеналкіл, бензил, який 20 18 19 необов'язково може бути заміщений 1-5 групами R , CHR C(O)OR або 5- або 6-членний насичений або ненасичений цикл, що містить 1-3 гетероатоми, де кожний цикл необов'язково 11 може бути заміщений 1-3 групами R ; 8 R незалежно являє собою C1-C6-алкіл, C1-C6-галогеналкіл, аміно, C1-C6-алкіламіно, C2-C630 діалкіламіно, феніл, необов'язково заміщений 1-3 групами R , або 5- або 6-членний насичений або ненасичений цикл, що містить 1-3 гетероатоми, де кожний цикл необов'язково може бути 11 заміщений 1-3 групами R ; 9 17 R являє собою Н, C1-C6-алкіл, C1-C6-галогеналкіл, -C(=О)R або феніл, необов'язково 20 заміщений 1-3 групами R ; 10 R являє собою Н або C1-C6-алкіл, C1-C6-галогеналкіл або феніл, необов'язково заміщений 20 1-3 групами R ; 11 R незалежно являє собою галоген, C1-C6-алкіл, C1-C6-галогеналкіл, C1-C6-алкокси, C1-C6галогеналкокси, C1-C6-алкілтіо, C1-C6-галогеналкілтіо, аміно, C1-C6-алкіламіно, C2-C6діалкіламіно, C2-C6-алкоксикарбоніл або C2-C6-алкілкарбоніл; 12 R являє собою Н або C1-C4-алкіл; 13 14 R і R незалежно являють собою Н, ціано, -OH, C1-C4-алкіл, C1-C6-алкокси, C2-C6алкілкарбоніл, феніл або бензил, де феніл або бензил необов'язково можуть бути заміщені 1-3 20 групами R ; 13 14 як альтернатива R і R , взяті разом, можуть утворювати: 5- або 6-членний насичений або ненасичений цикл, що містить 1-3 гетероатоми, де кожний 11 цикл необов'язково може бути заміщений 1-3 групами R , або 3,4-дигідро-1H-ізохінолін-2-іл; 12 13 як альтернатива R і R , взяті разом, можуть утворювати: 5- або 6-членний насичений або ненасичений цикл, що містить 1-3 гетероатоми, де кожний 11 цикл необов'язково може бути заміщений 1-3 групами R ; 15 R являє собою Н або C1-C6-алкіл; 16 20 R являє собою Н, C1-C6-алкіл або феніл, необов'язково заміщений 1-3 групами R ; 15 16 як альтернатива R і R можуть бути взяті разом у вигляді -(CH2)4- або -(CH2)5-; 17 R являє собою Н, C1-C6-алкіл, C1-C6-галогеналкіл, C1-C6-алкокси, феніл, фенокси або 20 бензилокси, де кожний цикл необов'язково може бути заміщений 1-3 групами R ; 18 R являє собою Н, C1-C6-алкіл або C1-C6-галогеналкіл; 19 R являє собою Н, C1-C6-алкіл, C1-C6-галогеналкіл або бензил; 20 R незалежно являє собою галоген, ціано, нітро, аміно, C1-C6-алкоксіалкокси, C1-C6-алкіл, C1-C6-галогеналкіл, C1-C6-гідроксіалкіл, C2-C6-алкоксіалкіл, C2-C6-галогеналкоксіалкіл, C2-C6алкеніл, C2-C6-галогеналкеніл, C3-C6-алкініл, C3-C6-галогеналкініл, гідроксил, C1-C6-алкокси, C1C6-галогеналкокси, C2-C6-алкенілокси, C2-C6-галогеналкенілокси, C3-C6-алкінілокси, C3-C6галогеналкінілокси, C1-C6-алкілтіо, C1-C6-галогеналкілтіо, C1-C6-алкілсульфоніл, C1-C6галогеналкілсульфоніл, C2-C6-алкенілтіо, C2-C6-галогеналкенілтіо, C2-C6галогеналкенілсульфоніл, C3-C6-алкінілтіо, C3-C6-алкінілсульфоніл, C3-C6 2 UA 107445 C2 5 10 15 20 25 30 35 40 45 50 55 60 галогеналкінілсульфоніл, C1-C6-алкіламіно, C2-C8-діалкіламіно, C3-C8-діалкіламінокарбоніл, C2C6-алкоксикарбоніл, C2-C6-алкілкарбоніл, C3-C6-триалкілсиліл, 2-[(Е)-метоксііміно]-Nметилацетамідил, феніл, бензил, бензилокси, фенокси або 5- або 6-членний гетероароматичний цикл, де кожний феніл, бензил, бензилокси, фенокси або 5- або 6-членний гетероароматичний цикл необов'язково може бути заміщений 1-3 замісниками, незалежно 31 вибраними з груп R ; 21 R являє собою: Н; C1-C14-алкіл; C1-C6-галогеналкіл; C2-C4-алкеніл; C2-C4-галогеналкеніл; C3-C4-алкініл; C3-C4-галогеналкініл; феніл, нафтил або тетрагідрохінолініл, кожний з яких необов'язково заміщений 1-3 групами 20 R ; 22 23 -(CHR )mR ; 24 25 -(CHR )mC(O)OR ; 24 26 -(CHR )mC(O)R ; 24 27 28 -(CHR )mC(O)n(R )R ; 24 29 -(CHR )mOR ; 24 29 -(CHR )mSR 24 27 28 -(CHR )mN(R )R ; 32 -С(=О)R ; 32 36 -N=С(R )(R ); 5 25 -NR2 C(=О)OR ; 8 -Si(R )3; 33 -SO2R ; C2-C6-алкоксикарбоніл; C2-C6-алкіламінокарбоніл; C2-C6-алкілкарбоніл; цукри, вибрані з групи, яка складається з бета-D-глюкозатетраацетату, рамнози, фруктози і пентози; або 5- або 6-членний гетероароматичний цикл, вибраний з групи, яка складається з фуранілу, піридинілу, піридиніл-N-оксиду, піримідинілу, піридазинілу, піразинілу, піразолілу, тіазолілу, триазинілу, тіадіазолілу, оксазолілу, триазолілу або ізоксазолілу, де кожний 5- або 6-членний 20 гетероароматичний цикл необов'язково може бути заміщений 1-5 групами R ; 22 R незалежно являє собою: Н; галоген; ціано; нітро; C1-C6-алкіл; C1-C6-галогеналкіл; 20 феніл або бензил, необов'язково заміщений 1-3 групами R ; C1-C6-гідроксіалкіл; C2-C6-алкоксіалкіл; C3-C6-галогеналкініл; C2-C6-алкеніл; C2-C6-галогеналкеніл; C3-C6-алкініл; C1-C6-алкокси; C1-C6-галогеналкокси; C1-C6-алкілтіо; C1-C6-алкіламіно; C2-C8-діалкіламіно; C3-C6-циклоалкіламіно; C4-C6-(алкіл)циклоалкіламіно; C2-C6-алкілкарбоніл; C2-C6-алкоксикарбоніл; 3 UA 107445 C2 5 10 15 20 25 30 35 40 45 50 55 C2-C6-алкіламінокарбоніл; C3-C8-діалкіламінокарбоніл; C3-C6-триалкілсиліл; гетероароматичні цикли з конденсованими кільцями, вибрані з групи, яка складається з бензотіофенілу, хінолінілу, ізохінолінілу, тієно[2,3-b]піридилу, 1-метил-1H-тієно[2,3-c]піразолілу і 20 бензоімідазолілу, де кожний з циклів може бути додатково заміщений 1-3 групами R ; або 5- або 6-членний гетероароматичний цикл, вибраний з групи, яка складається з фуранілу, піридинілу, піридиніл-N-оксиду, піримідинілу, піридазинілу, піразинілу, тіазолілу, триазинілу, тіадіазолілу, оксазолілу, ізоксазолілу, триазолілу і тієнілу; 23 R являє собою Н; галоген; C1-C6-алкіл; C1-C6-галогеналкіл; C2-C6-діалкіламіно; 20 феніл, необов'язково заміщений 1-5 групами R ; гетероароматичні цикли з конденсованими кільцями, вибрані з групи, яка складається з бензотіофенілу, хінолінілу, ізохінолінілу, тієно[2,3-b]піридилу, 1-метил-1H-тієно[2,3-c]піразолілу, бензофуранілу і бензоімідазолілу, 2,3-дигідробензофуран-2-ілу, 4-метил-4H тієно[3,2-b]пірол-5ілу, 1-метил-1H-індол-5-ілу, імідазо[1,2-a]піридин-2-ілу, імідазо[2,1-b]тіазол-6-ілу, бензотіазол-2ілу, бензо[b]тіофен-7-ілу і 1-метил-1H-індазол-3-ілу, де кожний з циклів може бути додатково 20 заміщений 1-3 групами R ; нафтил; бензо[1,3]діоксоліл; піролідиноніл; оксетаніл; 20 C1-C6-алкілтіо, необов'язково заміщений 1-5 групами R ; 5- або 6-членний насичений або ненасичений цикл, що містить 1-3 гетероатоми, де кожний 11 цикл необов'язково може бути заміщений 1-3 групами R ; або 5- або 6-членний гетероароматичний цикл, вибраний з групи, яка складається з фуранілу, піридинілу, піридиніл-N-оксиду, піримідинілу, піридазинілу, піразинілу, піразолілу, тіазолілу, триазинілу, тіадіазолілу, оксазолілу, ізоксазолілу, триазолілу, імідазолілу, тіофен-2-ілу і тіофен20 3-ілу, де кожний гетероароматичний цикл необов'язково може бути заміщений 1-3 групами R ; 24 R являє собою Н, C1-C6-алкіл, C1-C6-алкокси, бензил або феніл, де кожний з бензилу або 20 фенілу необов'язково може бути заміщений 1-3 групами R ; 25 20 R являє собою Н, C1-C6-алкіл, феніл або бензил, необов'язково заміщений 1-3 групами R ; 26 R являє собою: Н; C1-C6-алкіл; C1-C6-алкокси; 20 феніл, необов'язково заміщений 1-3 групами R ; або 5- або 6-членний гетероароматичний цикл, вибраний з групи, яка складається з фуранілу, піридинілу, піридиніл-N-оксиду, піримідинілу, піридазинілу, піразинілу, тіазолілу, триазинілу, тіадіазолілу, оксазолілу, триазолілу і ізоксазолілу; 27 28 R і R незалежно являють собою: Н; C1-C6-алкіл; бензил або феніл, де кожний з бензилу або фенілу необов'язково може бути заміщений 1-3 20 групами R ; або 5- або 6-членний насичений або ненасичений цикл, що містить 1-3 гетероатоми, де кожний 11 цикл необов'язково може бути заміщений 1-3 групами R ; 29 R являє собою: Н; C1-C6-алкіл; C1-C6-галогеналкіл; C1-C6-алкоксіалкіл; C2-C6-алкілкарбоніл; бензил або феніл, де кожний з бензилу або фенілу необов'язково може бути заміщений 1-3 20 групами R ; або 4 UA 107445 C2 5 10 15 20 25 30 35 40 45 50 55 60 5- або 6-членний насичений або ненасичений цикл, що містить 1-3 гетероатоми, де кожний 11 цикл необов'язково може бути заміщений 1-3 групами R ; 30 R незалежно являє собою галоген, ціано, нітро, C1-C6-алкіл, C1-C6-галогеналкіл, C1-C6гідроксіалкіл, C2-C6-алкоксіалкіл, C2-C6-галогеналкоксіалкіл, C2-C6-алкеніл, C2-C6-галогеналкеніл, C3-C6-алкініл, C3-C6-галогеналкініл, гідроксил, C1-C6-алкокси, C1-C6-галогеналкокси, C2-C6алкенілокси, C2-C6-галогеналкенілокси, C3-C6-алкінілокси, C3-C6-галогеналкінілокси, C1-C6алкілтіо, C1-C6-алкілсульфоніл, C1-C6-галогеналкілсульфоніл, C2-C6-алкенілтіо, C2-C6галогеналкенілтіо, C2-C6-галогеналкенілсульфоніл, C3-C6-алкінілтіо, C3-C6-алкінілсульфоніл, C3C6-галогеналкінілсульфоніл, C1-C6-алкіламіно, C2-C8-діалкіламіно, C3-C8-діалкіламінокарбоніл, C3-C6-триалкілсиліл, тіазоліл, феніл, піримідиніл або піридил, де тіазоліл, феніл, піридил або 20 піримідиніл необов'язково можуть бути заміщені 1-3 групами R ; 31 R незалежно являє собою галоген, ціано, нітро, C1-C6-алкіл, C1-C6-галогеналкіл, C1-C6гідроксіалкіл, C2-C6-алкоксіалкіл, C2-C6-галогеналкоксіалкіл, C2-C6-алкеніл, C2-C6-галогеналкеніл, C3-C6-алкініл, C3-C6-галогеналкініл, гідроксил, C1-C6-алкокси, C1-C6-галогеналкокси, C2-C6алкенілокси, C2-C6-галогеналкенілокси, C3-C6-алкінілокси, C3-C6-галогеналкінілокси, C1-C6алкілтіо, C1-C6-алкілсульфоніл, C1-C6-галогеналкілсульфоніл, C2-C6-алкенілтіо, C2-C6галогеналкенілтіо, C2-C6-галогеналкенілсульфоніл, C3-C6-алкінілтіо, C3-C6-алкінілсульфоніл, C3C6-галогеналкінілсульфоніл, C1-C6-алкіламіно, C2-C8-діалкіламіно, C3-C8-діалкіламінокарбоніл або C3-C6-триалкілсиліл; 32 R незалежно являє собою: C1-C6-алкіл, C1-C6-галогеналкіл, C1-C6-гідроксіалкіл, C2-C6-алкоксіалкіл, C2-C6галогеналкоксіалкіл, C2-C6-алкеніл, C2-C6-галогеналкеніл, C3-C6-алкініл, C3-C6-галогеналкініл, гідроксил, C1-C6-алкокси, C1-C6-галогеналкокси, C2-C6-алкенілокси, C2-C6-галогеналкенілокси, C3-C6-алкінілокси, C3-C6-галогеналкінілокси, C1-C6-алкілтіо, C1-C6-алкілсульфоніл, C1-C6галогеналкілсульфоніл, C2-C6-алкенілтіо, C2-C6-галогеналкенілтіо, C2-C6галогеналкенілсульфоніл, C3-C6-алкінілтіо, C3-C6-алкінілсульфоніл, C3-C6галогеналкінілсульфоніл, C1-C6-алкіламіно, C2-C8-діалкіламіно, C3-C8-діалкіламінокарбоніл, C3C6-триалкілсиліл; 20 феніл, де фенільний цикл необов'язково може бути заміщений 1-3 групами R ; або 5- або 6-членний насичений або ненасичений цикл, що містить 1-3 гетероатоми, де кожний 11 цикл необов'язково може бути заміщений 1-3 групами R ; 33 R незалежно являє собою: 20 C1-C6-алкіл, C1-C6-галогеналкіл, феніл або тієніл, необов'язково заміщений 1-3 групами R ; або 5- або 6-членний насичений або ненасичений цикл, що містить 1-3 гетероатоми, де кожний 11 цикл необов'язково може бути заміщений 1-3 групами R ; 34 R являє собою: C1-C6-алкіл, C1-C6-галогеналкіл, C2-C6-алкоксіалкіл, C1-C6-алкіламіно; або 5- або 6-членний насичений або ненасичений цикл, що містить 1-3 гетероатоми, де кожний 11 цикл необов'язково може бути заміщений 1-3 групами R ; 35 R являє собою: C1-C6-алкіл, C2-C6-алкілкарбоніл; або 5- або 6-членний насичений або ненасичений цикл, що містить 1-3 гетероатоми, де кожний 11 цикл необов'язково може бути заміщений 1-3 групами R ; 36 R являє собою Н, ціано, C1-C6-алкіл, C1-C6-алкокси, бензил або феніл, де кожний з бензилу 20 або фенілу необов'язково може бути заміщений 1-3 групами R ; 32 36 як альтернатива R і R , взяті разом, можуть утворювати: 5- або 6-членний насичений або ненасичений цикл, що містить 1-3 гетероатоми, де кожний 11 цикл необов'язково може бути заміщений 1-3 групами R ; і 37 R незалежно являє собою: 20 Н, галоген або феніл, необов'язково заміщений 1-5 групами R ; C1-C6-алкіл, C1-C6-галогеналкіл, гідроксил, C1-C6-алкокси або C1-C6-галогеналкокси; або 5- або 6-членний насичений або ненасичений цикл, що містить 1-3 гетероатоми, де кожний 11 цикл необов'язково може бути заміщений 1-3 групами R . Ще один варіант здійснення даного винаходу може включати в себе фунгіцидну композицію для боротьби з грибками або запобігання ураженню грибками, що містить описані нижче сполуки і ботанічно прийнятну речовину-носій. Ще один варіант здійснення даного винаходу може включати в себе спосіб боротьби з грибками або запобігання ураженню рослини грибками, спосіб, що включає в себе стадії нанесення фунгіцидно ефективної кількості однієї або більше описаних нижче сполук 5 UA 107445 C2 5 10 15 20 25 30 35 40 45 50 55 щонайменше на один з грибків, одну з рослин, область, прилеглу до рослини, і насіння, адаптоване до відтворювання рослини. Термін "алкіл" належить до нерозгалуженого, розгалуженого, або циклічного ланцюга з атомів вуглецю, включаючи метил, етил, пропіл, бутил, ізопропіл, ізобутил, трет-бутил, пентил, гексил, циклопропіл, циклобутил, циклопентил, циклогексил і т.п. Термін "алкеніл" належить до розгалуженого, нерозгалуженого або циклічного ланцюга з атомів вуглецю, що містить один або більше подвійних зв'язків, включаючи етеніл, пропеніл, бутеніл, ізопропеніл, ізобутеніл, циклогексеніл і т.п. Термін "алкініл" належить до розгалуженого або нерозгалуженого ланцюга з атомів вуглецю, що містить один або більше потрійних зв'язків, включаючи пропініл, бутиніл і т.п. Термін 'R', що застосовується в даному описі, належить до групи, яка складається з C 2-8алкілу, C3-8-алкенілу або C3-8-алкінілу, якщо не вказано інакше. Термін "алкокси" належить до замісника -OR. Термін "алкоксикарбоніл" належить до замісника -C(O)-OR. Термін "алкілкарбоніл" належить до замісника -C(O)-R. Термін "алкілсульфоніл" належить до замісника -SO2-R. Термін "галогеналкілсульфоніл" належить до сульфонільного заміщення на алкілі, який частково заміщений атомами галогенів. Термін "алкілтіо" належить до замісника -S-R. Термін "алкіламінокарбоніл" належить до замісника -C(O)-N(Н)-R. Термін "діалкіламінокарбоніл" належить до замісника -C(O)-NR2. Термін "алкілциклоалкіламіно" належить до циклоалкіламіно-замісника, який заміщений алкільною групою. Термін "триалкілсиліл" належить до -SiR3. Термін "ціано" належить до замісника -C≡N. Термін "гідроксил" належить до замісника OH. Термін "аміно" належить до замісника -NH2. Термін "алкіламіно" належить до замісника -N(Н)-R. Термін "діалкіламіно" належить до замісника -NR2. Термін "алкоксіалкокси" належить до -O(CH2)nO(CH2)n, де n дорівнює цілому числу від 1 до 3. Термін "алкоксіалкіл" належить до алкокси-заміщення на алкілі. Термін "галогеналкоксіалкіл" належить до алкокси-заміщення на алкілі, який може бути частково заміщений атомами галогенів. Термін "гідроксіалкіл" належить до алкілу, який заміщений гідроксильною групою. Термін "галогеналкокси" належить до замісника -OR-X, в якому X являє собою Cl, F, Br або I, або будь-яку їх комбінацію. Термін "галогеналкіл" належить до алкілу, який заміщений Cl, F, I або Br, або будь-якою їх комбінацією. Термін "галогеналкеніл" належить до алкенілу, який заміщений Cl, F, I або Br, абобудь-якою їх комбінацією. Термін "галогеналкініл" належить до алкінілу, який заміщений Cl, F, I або Br, або будь-якою їх комбінацією. Термін "галоген" або "гало" належить до одного або декількох атомів галогенів, що визначаються як F, Cl, Br і I. Термін "гідроксикарбоніл" належить до замісника -C(O)-OH. Термін "нітро" належить до замісника -NO2. Термін "тієніл" належить до 5-членного ароматичного циклу з одним атомом сірки. По всьому опису винаходу посилання на сполуки формули I також включає в себе оптичні ізомери і солі формули I, і їх гідрати. Зокрема, коли формула I містить алкільну групу з розгалуженим ланцюгом, зрозуміло, що такі сполуки включають в себе оптичні ізомери і їх рацемати. Типові солі включають в себе: гідрохлорид, гідробромід, гідройодид і т.п. Фахівцям в даній галузі також зрозуміло, що якщо не вказано інакше, допустиме додаткове заміщення, за умови, що воно задовольняє правила хімічного зв'язування і енергії деформації, і продукт все ще має фунгіцидну активність. Ще один варіант здійснення даного винаходу належить до застосування сполуки формули I для захисту рослини від пошкодження, що викликається фітопатогенним мікроорганізмом, або до обробки рослини зараженого фітопатогенним мікроорганізмом, що включає в себе нанесення сполуки формули I або композиції, що містить сполуку, на грунт, рослину, частину рослини, листя і/або насіння. 6 UA 107445 C2 5 10 15 20 25 30 35 40 45 50 55 Додатково ще один варіант здійснення даного винаходу належить до композиції, застосовної для захисту рослини від пошкодження фітопатогенним мікроорганізмом і/або для обробки рослини, зараженої фітопатогенним мікроорганізмом, що містить сполуку формули I і ботанічно прийнятну речовину-носій. Докладний опис даного винаходу Сполуку згідно з даним винаходом можна наносити будь-яким з ряду відомих способів, або у вигляді сполук, або у вигляді складів, що містять сполуки. Наприклад, сполуки можна наносити на коріння, насіння або листя рослин для боротьби з різними грибками без збитку для ринкової вартості рослин. Речовини можна наносити в формі будь-якого з типів складів, що зазвичай застосовуються, наприклад, у вигляді розчинів, обпилювачів, здатних вбирати вологу порошків, сипких концентратів, або концентратів емульсії. Сполуки згідно з даним винаходом переважно застосовуються в формі складу, що містить одну або декілька сполук формули I з ботанічно прийнятним носієм. Концентровані склади для нанесення можна диспергувати у воді або інших рідинах, або склади можуть являти собою пилоподібні або гранульовані склади, які можна наносити без додаткової обробки. Склади можна одержувати згідно з процедурами, які є загальноприйнятими в галузі сільськогосподарських хімічних препаратів. У даному винаході передбачається застосування всіх носіїв, за допомогою яких одну або декілька сполук можна одержувати у вигляді складу для доставки і застосування як фунгіциду. Зазвичай склади наносять у вигляді водних суспензій або емульсій. Такі суспензії або емульсії можна одержувати з розчинних у воді складів, суспендованих у воді складів або емульгованих складів, які являють собою тверді речовини, зазвичай відомі як порошки, здатні вбирати вологу; або рідини, зазвичай відомі як концентрати емульсій, водні суспензії або концентрати суспензій. Як легко можна зрозуміти, можна використовувати будь-яку речовину, до якої можна додавати дані сполуку, за умови, що вона забезпечує необхідну застосовність (корисність) без суттєвого впливу на активність таких сполук як протигрибкових засобів. Здатні вбирати вологу порошки, які можна пресувати з утворенням диспергованих у воді гранул, містять однорідну суміш однієї або більше сполук формули I, інертний носій і поверхнево-активні речовини. Концентрація сполуки в здатному вбирати вологу порошку може складати приблизно від 10 мас. процентів до приблизно 90 мас. процентів з розрахунку на загальну масу здатного вбирати вологу порошку, більш переважно - приблизно від 25 мас. процентів до приблизно 75 мас. процентів. При одержанні здатних вбирати вологу порошкоподібних складів сполук можна об'єднувати з будь-якою тонкоподрібненою твердою речовиною, такою як профіліт, тальк, крейда, гіпс, фулерова земля, бентоніт, атапульгіт, крохмаль, казеїн, глютен, монтморилонітові глини, діатомові землі, очищені силікати або т.п. При таких операціях тонкоподрібнений носій і поверхнево-активні речовини зазвичай змішують із сполукою (сполуками) і перемелюють. Концентрати емульсій сполук формули I можуть містити відповідну концентрацію сполуки, таку як приблизно від 10 мас. процентів до приблизно 50 мас. процентів сполуки, у відповідній рідині з розрахунку на загальну масу концентрату. Сполуки можна розчиняти в інертному носії, який являє собою або розчинник, що змішується з водою, або суміш незмішуваних з водою органічних розчинників і емульгаторів. Концентрати можна розбавляти водою і маслом з утворенням сумішей для розпилення в формі емульсій "масло-в-воді". Застосовні органічні розчинники включають в себе ароматичні вуглеводні, зокрема, висококиплячі нафталінові і олефінові фракції нафти, такі як важкий лігроїн, збагачений ароматичними сполуками. Також можна застосовувати інші органічні розчинники, наприклад, терпенові розчинники, включаючи похідні каніфолі, аліфатичні кетони, такі як циклогексанон, і складні спирти, такі як 2етоксіетанол. Емульгатори, які можна тут переважно використовувати, можуть бути легко вказані фахівцями в даній галузі і включають в себе різні неіоногенні, аніоногенні, катіоногенні і амфотерні емульгатори або суміш двох або більше емульгаторів. Приклади неіоногенних емульгаторів, застосовних при одержанні концентратів емульсій, включають в себе простий ефір поліалкіленгліколів і продукти конденсації алкіл- і арилфенолів, аліфатичних спиртів, аліфатичних амінів або жирних кислот з етиленоксидом, пропіленоксидами, такі як етоксильовані алкілфеноли і карбоксильовані складні ефіри, солюбілізовані поліолом або поліоксіалкіленом. Катіоногенні емульгатори включають в себе четвертинні сполуки амонію і солі амінів жирного ряду. Аніоногенні емульгатори включають в себе маслорозчинні солі (наприклад, кальцію) алкіларилсульфонових кислот, маслорозчинні солі або прості сульфатовані ефіри полігліколю і відповідні солі простого фосфатованого ефіру полігліколю. 7 UA 107445 C2 5 10 15 20 25 30 35 40 45 50 55 60 Типові органічні рідини, які можна використовувати при одержанні концентратів емульсій сполук згідно з даним винаходом являють собою ароматичні рідини, такі як ксилольні, пропілбензольні фракції; або змішані нафталінові фракції, мінеральні масла, заміщені ароматичні органічні рідини, такі як діоктилфталат; гас; діалкіламіди різних жирних кислот, зокрема, диметиламіди гліколів жирного ряду і похідні гліколів, такі як простий н-бутиловий ефір, простий етиловий ефір, або простий метиловий ефір діетиленгліколю і простий метиловий ефір метиленгліколю і т.п. Суміші двох або більше органічних рідин також можна використовувати при одержанні концентрату емульсії. Органічні рідини включають в себе ксилольні і пропілбензольні фракції з ксилолом, найбільш переважним в деяких випадках. Поверхнево-активні диспергуючі засоби зазвичай використовуються в рідких складах в кількості від 0,1 до 20 мас. процентів з розрахунку на загальну масу диспергуючого засобу і одного або декількох сполук. Склади також можуть містити інші сумісні добавки, наприклад, регулятори росту рослин і інші біологічно активні сполуки, що застосовуються в сільському господарстві. Водні суспензії містять суспензії однієї або більше водонерозчинних сполук формули I, диспергованих у водному носії, при концентрації в діапазоні приблизно від 5 до приблизно 50 мас. процентів, з розрахунку на загальну масу водної суспензії. Суспензії одержують шляхом тонкого розмелювання однієї або більше сполук і енергійного змішування розмеленої речовини і поверхнево-активних речовин, вибраних з тих самих типів, які обговорювалися вище, з носієм, що містить воду. Для збільшення густини і в'язкості водного носія можна додавати інші компоненти, такі як неорганічні солі і синтетичні або природні камеді. Сполуки формули I також можна застосовувати у вигляді гранульованих складів, які, зокрема, застосовні для нанесення на грунт. Гранульовані склади зазвичай містять приблизно від 0,5 до приблизно 10 мас. процентів, з розрахунку на загальну масу гранульованого складу, сполуки (сполук), диспергованої в інертному носії, який цілком або здебільшого складається з грубодисперсної інертної речовини, такої як атапульгіт, бентоніт, діатоміт, глина або тому подібної дешевої речовини. Такі склади зазвичай одержують шляхом розчинення сполук у відповідному розчиннику і нанесення їх на гранульований носій, який заздалегідь відформований до відповідного розміру частинок в діапазоні приблизно від 0,5 до приблизно 3 мм. Відповідною розчинник являє собою розчинник, в якому сполука значно або повністю розчинна. Такі склади також можна одержувати шляхом виготовлення густої маси або пасти з носія і сполуки і розчинника, і подрібнення і сушіння з одержанням необхідних гранульованих частинок. Обпилювачі, що містять сполуки формули I, можна одержувати шляхом ретельного змішування однієї або більше сполук в порошкоподібній формі з відповідним пилоподібним сільськогосподарським носієм, наприклад, таким як каолінова глина, розмелена вулканічна порода і т.п. Обпилювачі можуть відповідно містити приблизно від 1 до приблизно 10 мас. процентів сполук з розрахунку на загальну масу обпилювача. Склади можуть додатково містити допоміжні поверхнево-активні речовини для посилення осадження, змочування і проникнення сполук в цільову сільськогосподарську культуру і мікроорганізм. Такі допоміжні поверхнево-активні речовини необов'язково можна використовувати у вигляді компонента складу або у вигляді суміші з резервуара. Кількість допоміжної поверхнево-активної речовини зазвичай буде змінюватися від 0,01 до 1,0 об'ємного процента з розрахунку на об'єм води, що розпилюється, переважно від 0,05 до 0,5 об'ємних процентів. Відповідні допоміжні поверхнево-активні речовини включають в себе, але не обмежуються перерахованим, етоксильовані нонілфеноли, етоксильовані синтетичні або природні спирти, солі складного ефіру або сульфобурштинових кислот, етоксильовані органосилікони, етоксильовані аміни жирного ряду і суміші поверхнево-активних речовин з мінеральними або рослинними маслами. Склади також можуть включати в себе емульсії "масло-в-воді", такі як емульсії, описані в патентній заявці США, серійний № 11/495228, опис якої в явній формі включений в даний документ шляхом посилання. Склади необов'язково можуть включати в себе комбінації, які містять інші пестицидні сполуки. Такі додаткові пестицидні сполуки можуть являти собою фунгіциди, інсектициди, гербіциди, нематоциди, майтициди, артроподициди, бактерициди або їх комбінації, які сумісні із сполуками згідно з даним винаходом в середовищі, вибраному для нанесення, і не надають протидії активності даних сполук. Відповідно в таких варіантах здійснення винаходу інша пестицидна сполука використовується як додатковий токсикант для того ж самого або для іншого застосування пестициду. Сполуки формули I і пестицидна сполука зазвичай можуть бути присутніми в комбінації у ваговому відношенні від 1:100 до 100:1. Сполуки згідно з даним винаходом також можна об'єднувати з іншими фунгіцидами з утворенням фунгіцидних сумішей і їх синергічних сумішей. Фунгіцидні сполуки згідно з даним 8 UA 107445 C2 5 10 15 20 25 30 35 40 45 50 55 60 винаходом часто наносять разом з одним або декількома іншими фунгіцидами для боротьби з більш широким спектром небажаних хвороб. Коли сполуки застосовуються разом з іншим фунгіцидом (фунгіцидами), заявлені тут сполуки можна одержувати у вигляді Складу з іншим фунгіцидом (фунгіцидами), змішувати в резервуарі з іншим фунгіцидом (фунгіцидами) або наносити послідовно з іншим фунгіцидом (фунгіцидами). Інші такі фунгіциди можуть включати в себе 2-(тіоціанатометилтіо)бензотіазол, 2-фенілфенол, сульфат 8-гідроксихіноліну, антиміцин, ампеломіцес, квіскваліс, азаконазол, азоксистробін, бактерії Bacillus subtilis, беналаксил, беноміл, бентіавалікарб-ізопропіл, бензиламінобензолсульфонатна сіль (BABS), бікарбонати, біфеніл, бісмертіазол, бітертанол, бластицидин-S, боракс, бордоська суміш (суміш Bordeaux), боскалід, бромуконазол, бупіримат, полісульфід кальцію, каптафол, каптан, карбендазим, карбоксин, карпропамід, карвон, хлоронеб, хлороталоніл, хлозолінат, штам Coniothyrium minitans, гідроксид міді, октаноат міді, оксихлорид міді, сульфат міді, сульфат міді (триосновний), оксид міді (I), ціазофамід, цифлуфенамід, цимоксаніл, ципроконазол, ципродиніл, дазомет, дебакарб, етиленбіс(дитіокарбамат) діамонію, дихлофлуанід, дихлорофен, диклоцимет, дикломецин, дихлоран, діетофенкарб, дифеноконазол, дифензокватіон, дифлуметорим, диметоморф, димоксистробін, диніконазол, диніконазол-M, динобутон, динокап, дифеніламін, дитіанон, додеморф, додеморф-ацетат, додин, додин в формі вільної основи, едифенфос, енестробін, епоксиконазол, етабоксам, етоксиквін, етридіазол, фамоксадон, фенамідон, фенаримол, фенбуконазол, фенфурам, фенгексамід, феноксаніл, фенпіклоніл, фенпропідин, фенпропіморф, фентин, фентину ацетат, фентину гідроксид, фербам, феримзон, флуазинам, флудіоксоніл, флуморф, флуопіколід, фторімід, флуоксастробін, флуквінконазол, флусилазол, флусульфамід, флутоланіл, флутриафол, фолпет, формальдегід, фозетил, фозетил-алюміній, фуберидазол, фуралаксил, фураметпір, гуазатин, гуазатину ацетати, GY-81, гексахлорбензол, гексаконазол, гімексазол, імазаліл, імазалілу сульфат, імібенконазол, іміноктадин, іміноктадин-триацетат, іміноктадинтрис(албезилат), іпконазол, іпробенфос, іпродіон, іпровалікарб, ізопротіолан, казугаміцин, гідрат гідрохлориду казугаміцину, крезоксим-метил, манкопер, манкозеб, мандипропамід, манеб, мепаніпірим, мепроніл, хлорид ртуті, оксид ртуті, хлорид ртуті (I), металаксил, мефеноксам, металаксил-M, метам, метам-амоній, метам-калій, метам-натрій, метконазол, метасульфокарб, метилйодид, метилізотіоціанат, метирам, метоміностробін, метрафенон, мілдіоміцин, міклобутаніл, набам, нітротал-ізопропіл, нуаримол, октилінон, офурак, олеїнова кислота (жирні кислоти), оризастробін, оксадиксил, оксин-мідь, окспоконазолу фумарат, оксикарбоксин, пефуразоат, пенконазол, пенцикурон, пентахлорфенол, лаурат пентахлорфенілу, пентіопірад, ацетат фенілртуті, фосфонова кислота, фталід, пікоксистробін, поліоксин В, поліоксини, поліоксорим, бікарбонат калію, сульфат калійгідроксихіноліну, пробеназол, прохлораз, процімідон, пропамокарб, пропамокарбу гідрохлорид, пропіконазол, пропінеб, проквіназид, протіоконазол, піраклостробін, піразофос, пірибутикарб, пірифенокс, піриметаніл, піроквілон, квінокламін, квіноксифен, квінтозен, екстракт Reynoutria sachalinensis, силтіофам, симеконазол, 2-фенілфеноксид натрію, бікарбонат натрію, пентахлорфеноксид натрію, спіроксамін, сірка, SYP-Z071, SYP-048, дьогтярні масла, тебуконазол, текназен, тетраконазол, тіабендазол, тифлузамід, тіофанат-метил, тирам, тіадиніл, толклофос-метил, толілфлуанід, триадимефон, триадименол, триазоксид, трициклазол, тридеморф, трифлоксистробін, трифлумізол, трифорин, тритиконазол, валідаміцин, вінклозолін, зинеб, зирам, зоксамід, штам грибів Candida oleophila, штам грибів Fusarium oxysporum, Gliocladium spp., Phlebiopsis gigantean, штам Streptomyces griseoviridis, Trichoderma spp., (RS)-N-(3,5-дихлорфеніл)-2(метоксиметил)сукцинімід, 1,2-дихлорпропан, гідрат 1,3-дихлор-1,1,3,3-тетрафторацетону, 1хлор-2,4-динітронафталін, 1-хлор-2-нітропропан, 2-(2-гептадецил-2-імідазолін-1-іл)етанол, 2,3дигідро-5-феніл-1,4-дитіїн-1,1,4,4-тетраоксид, ацетат 2-метоксіетилртуті, хлорид 2метоксіетилртуті, силікат 2-метоксіетилртуті, 3-(4-хлорфеніл)-5-метилроданін, 4-(2-нітропроп-1еніл)фенілтіоціанат: ампропілфос, анілазин, азитирам, полісульфід барію, Bayer 32394, беноданіл, бенквінокс, бенталурон, бензамакрил; бензамакрил-ізобутил, бензаморф, бінапакрил, сульфат біс(метилртуті), оксид біс(трибутилолова), бутіобат, хромат/сульфат кадмію-кальцію-міді-цинку, карбаморф, CECA, хлобентіазон, хлораніформетан, хлорфеназол, хлорквінокс, клімбазол, біс(3-фенілсаліцилат) міді, хромат міді і цинку, куфранеб, сульфат мідь(II)гідразинію, цупробам, циклафурамід, ципендазол, ципрофурам, декафентин, дихлон, дихлозолін, диклобутразол, диметиримол, диноктон, диносульфон, динотербон, дипіритіон, диталімфос, додицин, дразоксолон, EBP, ESBP, етаконазол, етем, етирим, фенаміносульф, фенапаніл, фенітропан, флуодержазол, фуркарбаніл, фурконазол, фурконазол-цис, фурмециклокс, фурофанат, гліодин, гризеофульвін, галакринат, Hercules 3944, гексилтіофос, ICIA0858, ізопамфос, ізоваледіон, мебеніл, мекарбінзид, метазоксолон, метфуроксам, 9 UA 107445 C2 5 10 15 20 25 30 35 40 45 50 55 60 диціандіамід метилртуті, метсульфовакс, мілнеб, мукохлористий ангідрид, міклозолін, N-3,5дихлорфенілсукцинімід, N-3-нітрофенілітаконімід, натаміцин, N-етилмеркуріо-4толуолсульфонанілід, біс(диметилдитіокарбамат) нікелю, OCH, диметилдитіокарбамат фенілртуті, нітрат фенілртуті, фосдифен, протіокарб; протіокарбу гідрохлорид, піракарболід, піридинітрил, піроксихлор, піроксифур, квінацетол; квінацетол-сульфат, квіназамід, квінконазол, рабензазол, саліциланілид, SSF-109, сультропен, тецорам, тіадифлуор, тиціофен, тіохлорфенфім, тіофанат, тіоквінокс, тіоксімід, триаміфос, триаримол, триазбутил, трихламід, урбацид, XRD-563 і зариламід, IK-1140, NC-224 і будь-які їх комбінації. Додатково сполуки згідно з даним винаходом можна об'єднувати з іншими пестицидами, включаючи інсектициди, нематоциди, майтициди, артроподициди, бактерициди або їх комбінації, які сумісні із сполуками згідно з даним винаходом в середовищі, вибраному для нанесення, і не надають протидії активності даних сполук, з утворенням їх пестицидних сумішей і синергічних сумішей. Фунгіцидні сполукм згідно з даним винаходом можна наносити разом з одним або декількома іншими пестицидами для боротьби з широким спектром небажаних сільськогосподарських шкідників. Коли сполуки застосовуються разом з іншими пестицидами, сполуки, що заявляються тут можна одержувати у вигляді складу з іншим пестицидом (пестицидами), змішувати в резервуарі з іншим пестицидом (пестицидами) або наносити послідовно з іншим пестицидом (пестицидами). Типові інсектициди включають в себе, але не обмежуються перерахованим: антибіотичні інсектициди, такі як алозамідин і турингієнзин; макроциклічні лактонові інсектициди, такі як спінозад; авермектинові інсектициди, такі як абамектин, дорамектин, емамектин, еприномектин, івермектин і селамектин; милбеміцинові інсектициди, такі як лепімектин, мілбемектин, мілбеміциноксим і моксидектин; арсеновмісні інсектициди, такі як арсенат кальцію, ацетоарсеніт міді, арсенат міді, арсенат свинцю, арсеніт калію і арсеніт натрію; рослинні інсектициди, такі як анабазин, азадирахтин, d-лимонен, нікотин, піретрини, цинерини, цинерин I, цинерин II, жасмолін I, жасмолін II, піретрин I, піретрин II, квасію, ротенон, рианію і сабадила; карбаматні інсектициди, такі як бендіокарб і карбарил; бензофуранілметилкарбаматні інсектициди, такі як бенфуракарб, карбофуран, карбосульфан, декарбофуран і фуратіокарб; диметилкарбаматні інсектициди димітан, диметилан, гиквінкарб і піримікарб; оксимкарбаматні інсектициди, такі як аланікарб, алдикарб, алдоксикарб, бутокарбоксим, бутоксикарбоксим, метоміл, нітрилакарб, оксаміл, тазимкарб, тіокарбоксим, тіодикарб і тіофанокс; фенілметилкарбаматні інсектициди, такі як аліксикарб, амінокарб, буфенкарб, бутакарб, карбанолат, клоетокарб, дикрезил, діоксакарб, EMPC, етіофенкарб, фенетакарб, фенобукарб, ізопрокарб, метіокарб, метолкарб, мексакарбат, промацил, промекарб, пропоксур, триметакарб, XMC і ксилілкарб; динітрофенольні інсектициди, такі як динекс, динопроп, динозам і DNOC; фторовмісні інсектициди, такі як гексафторсилікат барію, кріоліт, фторид натрію, гексафторсилікат натрію і сульфлурамід; формамідинові інсектициди, такі як амітраз, хлордимеформ, форметанат і формпаранат; інсектициди-фуміганти, такі як акрилонітрил, дисульфід вуглецю, тетрахлорид вуглецю, хлороформ, хлорпікрин, парадихлорбензол, 1,2-дихлорпропан, етилформіат, етилендибромід, етилендихлорид, етиленоксид, ціанід водню, йодметан, метилбромід, метилхлороформ, метиленхлорид, нафталін, фосфин, сульфурилфторид і тетрахлоретан; неорганічні інсектициди, такі як боракс, полісульфід кальцію, олеат міді, хлорид ртуті (I), тіоціанат калію і тіоціанат натрію; інгібітори синтезу хітину, такі як бістрифлурон, бупрофезин, хлорфлуазурон, циромазин, дифлубензурон, флуциклоксурон, флуфеноксурон, гексафлумурон, луфенурон, новалурон, новіфлумурон, пенфлурон, тефлубензурон і трифлумурон; імітатори ювенільних гормонів, такі як епофенонан, феноксикарб, гідропрен, кінопрен, метопрен, пірипроксифен і трипрен; ювенільні гормони, такі як ювенільний гормон I, ювенільний гормон II і ювенільний гормон III; агоністи гормонів линяння, такі як хромафенозид, галофенозид, метоксифенозид і тебуфенозид; гормони линяння, такі як α-екдізон і екдистерон; інгібітори линяння, такі як діофенолан; прекоцени, такі як прекоцен I, прекоцен II і прекоцен III; не віднесені до певної категорії регулятори росту комах, такі як дицикланіл; інсектициди-аналоги нереїзтоксину, такі як бенсультап, картап, тіоциклам і тіосультап; нікотиноїдні інсектициди, такі як флонікамід; нітрогуанідинові інсектициди, такі як клотіанідин, динотефуран, імідаклоприд і тіаметоксам; нітрометиленові інсектициди, такі як нітенпірам і нітіазин; піридилметиламінові інсектициди, такі як ацетаміприд, імідаклоприд, нітенпірам і тіаклоприд; хлорорганічні інсектициди, такі як бром-ДДТ, камфехлор, ДДТ, pp'-DDT, етил-DDD, HCH, гамма-НСН, ліндан, метоксихлор, пентахлорфенол і TDE; циклодієнові інсектициди, такі як алдрин, бромциклен, хлорбіциклен, хлордан, хлордекон, дієлдрин, дилор, ендосульфан, ендрин, HEOD, гептахлор, HHDN, ізобензан, ізодрин, келеван і мірекс; фосфаторганічні інсектициди, такі як бромфенвінфос, хлорфенвінфос, кротоксифос, дихлорвос, дикротофос, диметилвінфос, фоспірат, гептенофос, метокротофос, мевінфос, монокротофос, 10 UA 107445 C2 5 10 15 20 25 30 35 40 45 50 55 60 налед, нафталофос, фосфамідон, пропафос, TEPP і тетрахлорвінфос; тіофосфаторганічні інсектициди, такі як діоксабензофос, фосметилан і фентоат; аліфатичні тіофосфаторганічні інсектициди, такі як ацетіон, амітон, кадузафос, хлоретоксифос, хлормефос, демефіон, демефіон-О, демефіон-S, деметон, деметон-0, деметон-S, деметон-метил, деметон-О-метил, деметон-S-метил, деметон-S-метилсульфон, дисульфотон, етіон, етопрофос, IPSP, ізотіоат, малатіон, метакрифос, оксидеметонметил, оксидепрофос, оксидисульфотон, форат, сульфотеп, тербуфос і тіометон; аліфатичні амідні тіофосфаторганічні інсектициди, такі як амідитіон, ціантоат, диметоат, етоатметил, формотіон, мекарбам, ометоат, протоат, софамід і вамідотіон; оксимні тіофосфаторганічні інсектициди, такі як хлорфоксим, фоксим і фоксимметил; гетероциклічні тіофосфаторганічні інсектициди, такі як азаметифос, коумафос, коумітоат, діоксатіон, ендотіон, меназон, морфотіон, фозалон, піраклофос, піридафентіон і хінотіон; бензотіопіранові тіофосфаторганічні інсектициди, такі як дитикрофос і тикрофос; бензотриазинові тіофосфаторганічні інсектициди, такі як азинфос-етил і азинфос-метил; ізоіндольні тіофосфаторганічні інсектициди, такі як діаліфос і фосмет; ізоксазольні тіофосфаторганічні інсектициди, такі як ізоксатіон і золапрофос; піразолопіримідинові тіофосфаторганічні інсектициди, такі як хлорпразофос і піразофос; піридинові тіофосфаторганічні інсектициди, такі як хлорпірифос і хлорпірифос-метил; піримідинові тіофосфаторганічні інсектициди, такі як бутатіофос, діазинон, етримфос, ліримфос, піриміфосетил, піриміфос-метил, примідофос, піримітат і тебупіримфос; хіноксалінові тіофосфаторганічні інсектициди, такі як хіналфос і хіналфос-метил; тіадіазольні тіофосфаторганічні інсектициди, такі як атидатіон, літидатіон, метидатіон і протидатіон; триазольні тіофосфаторганічні інсектициди, такі як ізазофос і триазофос; фенільні тіофосфаторганічні інсектициди, такі як азотоат, бромофос, бромофос-етил, карбофенотіон, хлортіофос, ціанофос, цитіоат, дикаптон, дихлофентіон, етафос, фамфур, фенхлорфос, фенітротіон, фенсульфотіон, фентіон, фентіонетил, гетерофос, йодфенфос, мезулфенфос, паратіон, паратіон-метил, фенкаптон, фосніхлор, профенофос, протіофос, сульпрофос, темефос, трихлорметафос-3 і трифенофос; фосфонатні інсектициди, такі як бутонат і трихлорфон; фосфонотіоатні інсектициди, такі як мекарфон; фенілетилфосфонотіоатні інсектициди, такі як фонофос і трихлоронат; фенілфенілфосфонотіоатні інсектициди, такі як ціанофенфос, EPN і лептофос; фосфорамідатні інсектициди, такі як круфомат, фенаміфос, фостієтан, мефосфолан, фосфолан і піриметафос; фосфорамідотіоатні інсектициди, такі як ацефат, ізокарбофос, ізофенфос, метамідофос і пропетамфос; фосфородіамідні інсектициди, такі як димефокс, мазидокс, міпафокс і шрадан; оксадіазинові інсектициди, такі як індоксакарб; фталімідні інсектициди, такі як діаліфос, фосмет і тетраметрин; піразольні інсектициди, такі як ацетопрол, етипрол, фіпроніл, пірафлупрол, пірипрол, тебуфенпірад, толфенпірад і ваніліпрол; інсектициди на основі піретроїдних складних ефірів, такі як акринатрин, алетрин, біоалетрин, бартрин, біфентрин, біоетанометрин, циклетрин, циклопротрин, цифлутрин, бета-цифлутрин, цигалотрин, гамма-цигалотрин, лямбдацигалотрин, циперметрин, альфа-циперметрин, бета-циперметрин, тета-циперметрин, зетациперметрин, цифенотрин, дельтаметрин, димефлутрин, диметрин, емпентрин, фенфлутрин, фенпіритрин, фенпропатрин, фенвалерат, есфенвалерат, флуцитринат, флувалінат, тауфлувалінат, фуретрин, іміпротрин, метофлутрин, перметрин, біоперметрин, трансперметрин, фенотрин, пралетрин, профлутрин, піресметрин, ресметрин, біоресметрин, цисметрин, тефлутрин, тералетрин, тетраметрин, тралометрин і трансфлутрин; інсектициди на основі піретроїдних простих ефірів, такі як етофенпрокс, флуфенпрокс, галфенпрокс, протрифенбут і силафлуофен; піримідинамінові інсектициди, такі як флуфенерим і піримідифен; пірольні інсектициди, такі як хлорфенапір; інсектициди на основі тетронових кислот, такі як спіромезифен; інсектициди на основі тіосечовини, такі як діафентіурон; інсектициди на основі сечовини, такі як флукофурон і сулкофурон; і інсектициди, не віднесені до певної категорії, такі як клозантел, кротамітон, EXD, феназафлор, феноксакрим, флубендіамід, гідраметилнон, ізопротіолан, малонобен, метафлумізон, метоксадіазон, ніфлуридид, піридабен, піридаліл, рафоксанід, триаратен і триазамат, і будь-які їх комбінації. Додатково сполуки згідно з даним винаходом можна об'єднувати з гербіцидами, які сумісні із сполуками згідно з даним винаходом в середовищі, вибраному для нанесення, і не є антагоністичними по відношенню до активності даних сполук при утворенні пестицидних сумішей і їх синергічних сумішей. Для боротьби з широким спектром небажаних рослин фунгіцидні сполуки згідно з даним винаходом можна наносити разом з одним або декількома гербіцидами. Коли сполуки застосовують разом з гербіцидами, сполуки, що заявляються тут, можна одержувати у вигляді складу з гербіцидом (гербіцидами), змішувати в резервуарі з гербіцидом (гербіцидами) або наносити послідовно з гербіцидом (гербіцидами). Типові гербіциди включають в себе, але не обмежуються перерахованим: амідні гербіциди, такі як 11 UA 107445 C2 5 10 15 20 25 30 35 40 45 50 55 60 алідохлор, бефлубутамід, бензадокс, бензипрам, бромобутид, кафенстрол, CDEA, хлортіамід, ципразол, диметенамід, диметенамід-Р, дифенамід, епроназ, етніпромід, фентразамід, флупоксам, фомесафен, галосафен, ізокарбамід, ізоксабен, напропамід, напталам, петоксамід, пропізамід, хінонамід і тебутам; анілідні гербіциди, такі як хлоранокрил, цисанілід, кломепроп, ципромід, дифлуфенікан, етобензанід, фенасулам, флуфенацет, флуфенікан, мефенацет, мефлуїдід, метаміфоп, моналід, напроанілід, пентанохлор, піколінафен і пропаніл; арилаланінові гербіциди, такі як бензоїлпроп, флампроп і флампроп-M; хлорацетанілидні гербіциди, такі як ацетохлор, алахлор, бутахлор, бутенахлор, делахлор, діетатил, диметахлор, метазахлор, метолахлор, S-метoлахлор, претилахлор, пропахлор, пропісохлор, принахлор, тербухлор, тенілхлор і ксилахлор; сульфонанілідні гербіциди, такі як бензофлуор, перфлуїдон, піримісульфан і профлуазол; сульфонамідні гербіциди, такі як асулам, карбасулам, фенасулам і оризалін; антибіотичні гербіциди, такі як біланафос; гербіциди на основі бензойної кислоти, такі як хлорамбен, дикамба, 2,3,6-TBA і трикамба; гербіциди на основі піримідинілоксибензойної кислоти, такі як біспірибак і піримінобак; гербіциди на основі піримідинілтіобензойної кислоти, такі як піритіобак; гербіциди на основі фталевої кислоти, такі як хлортал; гербіциди на основі піколінової кислоти, такі як амінопіралід, клопіралід і піклорам; гербіциди на основі хінолінкарбонової кислоти, такі як хінклорак і хінмерак; арсеновмісні гербіциди, такі як какодилова кислота, CMA, DSMA, гексафлурат, MAA, MAMA, МSMA, арсеніт калію і арсеніт натрію; бензоїлциклогександіонові гербіциди, такі як мезотрион, сулкотрион, тефурилтрион і темботрион; бензофуранілалкілсульфонатні гербіциди, такі як бенфуресат і етофумесат; карбаматні гербіциди, такі як асулам, карбоксазол, хлорпрокарб, дихлормат, фенасулам, карбутилат і тербукарб; карбанілатні гербіциди, такі як барбан, BCPC, карбасулам, карбетамід, CEPC, хлорбуфам, хлорпрофам, CPPC, десмедифам, фенисофам, фенмедифам, фенмедифам-етил, профам і свеп; циклогексеноксимні гербіциди, такі як аллоксидим, бутроксидим, клетодим, клопроксидим, циклоксидим, профоксидим, сетоксидим, тепралоксидим і тралкоксидим; циклопропілізоксазольні гербіциди, такі як ізоксахлортол і ізоксафлутол; дикарбоксімідні гербіциди, такі як бензфендізон, цинідон-етил, флумезин, флуміклорак, флуміоксазин і флуміпропін; динітроанілінові гербіциди, такі як бенфлуралін, бутралін, динітрамін, еталфлуралін, флухлоралін, ізопропалін, металпропалін, нітралін, оризалін, пендиметалін, продіамін, профлуралін і трифлуралін; динітрофенольні гербіциди, такі як динофенат, динопроп, диносам, диносеб, динотерб, DNOC, етинофен і мединотерб; гербіциди на основі простого дифенілового ефіру, такі як етоксифен; гербіциди на основі простого нітрофенілового ефіру, такі як ацифлуорфен, аклоніфен, біфенокс, хлометоксифен, хлорнітрофен, етнипромід, фтордифен, фторглікофен, фторнітрофен, фомесафен, фурилоксифен, галосафен, лактофен, нітрофен, нітрофлуорфен і оксифлуорфен; дитіокарбаматні гербіциди, такі як дазомет і метам; галогеновані аліфатичні гербіциди, такі як алорак, хлоропон, далапон, флупропанат, гексахлорацетон, йодметан, метилбромід, монохлороцтова кислота, SMA і TCA; імідазолінонові гербіциди, такі як імазаметабенз, імазамокс, імазапік, імазапір, імазаквін і імазетапІр; неорганічні гербіциди, такі як сульфамат амонію, боракс, хлорат кальцію, сульфат міді, сульфат заліза (II), азид калію, ціанат калію, азид натрію, хлорат натрію і сірчана кислота; нітрильні гербіциди, такі як бромобоніл, бромоксиніл, хлороксиніл, дихлобеніл, йодобоніл, іоксиніл і піраклоніл; фосфорорганічні гербіциди, такі як аміпрофос-метил, анілофос, бенсулід, біланафос, бутаміфос, 2,4-DEP, DMPA, EBEP, фосамін, глуфосинат, гліфосат і піперофос; фенокси-гербіциди, такі як бромофеноксим, кломепроп, 2,4DEB, 2,4-DEP, дифенопентен, дисул, ербон, етнипромід, фентерацол і трифопсим; феноксіоцтові гербіциди, такі як 4-CPA, 2,4-D, 3,4-DA, MCPA, MCPA-тіоетил і 2,4,5-T; феноксимасляні гербіциди, такі як 4-CPB, 2,4-DB, 3,4-DB, MCPB і 2,4,5-TB; феноксипропіонові гербіциди, такі як клопроп, 4-CPP, дихлорпроп, дихлорпроп-Р, 3,4-DP, фенопроп, мекопроп і мекопроп-Р; арилоксифеноксипропіонові гербіциди, такі як хлоразифоп, клодинафоп, клофоп, цигалофоп, диклофоп, феноксапроп, феноксапроп-Р, фентіапроп, флуазифоп, флуазифоп-Р, галоксифоп, галоксіоп-Р, ізоксапірифоп, метаміфоп, пропаквізафоп, хізалофоп, хізалофоп-Р і трифоп; фенілендіамінові гербіциди, такі як динітрамін і продіамін; піразолільні гербіциди, такі як бензофенап, піразолінат, пірасульфотол, піразоксифен, піроксасульфон і топрамезон; піразолілфенільні гербіциди, такі як флуазолат і пірафлуфен; піридазинові гербіциди, такі як кредазин, піридафол і піридат; піридазинонові гербіциди, такі як бромпіразон, хлоридазон, дімідазон, флуфенпір, метфлуразон, норфлуразон, оксапіразон і піданон; піридинові гербіциди, такі як амінопіралід, кліодинат, клопіралід, дитіопір, флуроксипір, галоксидин, піклорам, піколінафен, піриклор, тіазопір і триклопір; піримідиндіамінові гербіциди, такі як іпримідам і тіоклорим; гербіциди на основі сполук четвертинного амонію, такі як циперкват, діетамкват, дифензокват, дикват, морфамкват і паракват; тіокарбаматні гербіциди, такі як бутилат, циклоат, 12 UA 107445 C2 5 10 15 20 25 30 35 40 45 50 55 60 діалат, EPTC, еспрокарб, етіолат, ізополінат, метіобенкарб, молінат, орбенкарб, пебулат, просульфокарб, пірибутикарб, сульфалат, тіобенкарб, тіокарбазил, триалат і вернолат; тіокарбонатні гербіциди, такі як димексано, EXD і проксан; гербіциди на основі тіосечовини, такі як метіурон; триазинові гербіциди, такі як дипропетрин, триазифлам і тригідрокситриазин; хлортриазинові гербіциди, такі як атразин, хлоразин, ціаназин, ципразин, егліназин, іпазин, мезопразин, проціазин, прогліназин, пропазин, себутилазин, симазин, тербутилазин і триетазин; метокситриазинові гербіциди, такі як атратон, метометон, прометон, секбуметон, симетон і тербуметон; метилтіотриазинові гербіциди, такі як аметрин, азипротрин, ціанатрин, десметрин, диметаметрин, метопротрин, прометрин, симетрин і тербутрин; триазинонові гербіциди, такі як аметридіон, амибузин, гексазинон, ізометіозин, метамітрон і метрибузин; триазольні гербіциди, такі як амітрол, кафенстрол, епроназ і флупоксам; триазолонові гербіциди, такі як амікарбазон, бенкарбазон, карфентразон, флукарбазон, пропоксикарбазон, сульфентразон і тієнкарбазонметил; триазолопіримідинові гербіциди, такі як клорансулам, диклосулам, флорасулам, флуметсулам, метосулам, пеноксулам і піроксулам; урацильні гербіциди, такі як бутафенацил, бромацил, флупропацил, ізоцил, ленацил і тербацил; 3-фенілурацили; гербіциди на основі сечовини, такі як бензтіазурон, кумілурон, циклурон, дихлоралсечовина, дифлуфензопір, ізонорурон, ізоурон, метабензтіазурон, монісоурон і норурон; гербіциди на основі фенілсечовини, такі як анізурон, бутурон, хлорбромурон, хлоретурон, хлортолурон, хлороксурон, даїмурон, дифеноксурон, димефурон, діурон, фенурон, флуометурон, флуотіурон, ізопротурон, лінурон, метіурон, метилдимрон, метобензурон, метобромурон, метоксурон, монолінурон, монурон, небурон, парафлурон, фенобензурон, сидурон, тетрафлурон і тидіазурон; гербіциди на основі піримідинілсульфонілсечовини, такі як амідосульфурон, азимсульфурон, бенсульфурон, хлоримурон, циклосульфамурон, етоксисульфурон, флазасульфурон, флуцетосульфурон, флупірсульфурон, форамсульфурон, галосульфурон, імазосульфурон, мезосульфурон, нікосульфурон, ортосульфамурон, оксасульфурон, примісульфурон, піразосульфурон, римсульфурон, сульфометурон, сульфосульфурон і трифлоксисульфурон; гербіциди на основі триазинілсульфонілсечовини, такі як хлорсульфурон, циносульфурон, етаметсульфурон, йодосульфурон, метсульфурон, просульфурон, тіфенсульфурон, триасульфурон, трибенурон, трифлусульфурон і тритосульфурон; гербіциди на основі тіадіазолілсечовини, такі як бутиурон, етидимурон, тебутіурон, тіазафлурон і тидіазурон; і гербіциди, не віднесені до певної категорії, такі як акролеїн, аліловий спирт, азафенідин, беназолін, бентазон, бензобіциклон, бутидазол, ціанамід кальцію, камбендихлор, хлорфенак, хлорфенпроп, хлорфлуразол, хлорфлуренол, цинметилін, кломазон, CPMF, крезол, орто-дихлорбензол, димепіперат, ендотал, флуоромідин, флуридон, флурохлоридон, флуртамон, флутіацет, інданофан, метазол, метилізотіоціанат, нипіраклофен, OCH, оксадіаргіл, оксадіазон, оксазикломефон, пентахлорфенол, пентоксазон, ацетат фенілртуті, піноксаден, просулфалін, пірибензоксим, пірифталід, хінокламін, родетаніл, сулглікапін, тидіазимін, тридифан, триметурон, трипропіндан і тритак. Ще один варіант здійснення даного винаходу являє собою спосіб боротьби з грибками або спосіб запобігання ураженню грибками. Такий спосіб включає в себе нанесення на грунт, рослину, коріння, листя, насіння або місцерозташування грибків, або місцерозташування, в якому потрібно попереджувати ураження грибком (наприклад, нанесення на злакові рослини або виноградну лозу), фунгіцидно ефективної кількості однієї або більше сполук формули I. Сполуки придатні для обробки різних рослин при фунгіцидно прийнятних рівнях, і в той самий час вони виявляють низьку фітотоксичність. Сполуки можна застосовувати як захисний засіб, так і/або як ерадикант. Встановлено, що сполуки мають значну фунгіцидну дію, особливо для сільськогосподарського застосування. Більшість сполук особливо ефективні для застосування відносно сільськогосподарських зернових культур і садових рослин. Фахівцям в даній галузі буде зрозуміло, що ефективність сполуки відносно згаданих вище грибків визначає загальну застосовність сполук як фунгіцидів. Сполуки мають широкий спектр активності проти патогенних грибків. Типові патогени можуть включати в себе, але не обмежуються перерахованим, збудників плямистості листя пшениці (Septoria tritici, також відомий як Mycosphaerella graminicola), парші яблунь (Venturia inaequalis) і церкоспороза листя цукрового буряка (Cercospora beticola), арахісу (Cercospora arachidicola і Cercosporidium personatum) і інших сільськогосподарських культур, і чорної сигатоки бананів (Mycosphaerella fujiensis). Точна кількість активної речовини для нанесення залежить не тільки від конкретної активної речовини, що підлягає нанесенню, але також від бажаної специфічної дії, видів грибків, з якими має бути боротьба, і стадії їх росту, а також від частини рослини або іншого продукту, який зазнає контакту зі сполукою. Таким чином, всі сполуки і склади, що їх 13 UA 107445 C2 5 10 15 20 25 30 35 40 45 50 містять, не можуть бути в рівній мірі ефективними при однакових концентраціях або проти одних і тих самих видів грибків. Сполуки ефективні при застосуванні до рослин для заборони хвороби і в ботанічно прийнятній кількості. Термін "заборона хвороби і ботанічно прийнятна кількість" належить до кількості сполуки, яка знищує або стримує хворобу рослин, відносно яких потрібна боротьба з грибками, але не є суттєво токсичною для рослини. Така кількість зазвичай буде складати приблизно від 0,1 до приблизно 1000 ч/млн (частин на мільйон), переважно - від 1 до 500 ч/млн. Точна концентрація необхідної сполуки варіюється залежно від грибкового ураження, з яким ведеться боротьба, типу складу, що використовується, способу нанесення, конкретних видів рослин, кліматичних умов і т.п. Відповідна норма внесення зазвичай знаходиться в діапазоні приблизно від 0,10 до приблизно 4 фунти/акр (приблизно від 0,01 до 0,45 грама на квадратний 2 метр, г/м ). Будь-який заданий тут діапазон або необхідне значення може бути розширене або змінене без втрати необхідних ефектів, як очевидно фахівцеві в даній галузі для розуміння опису, що наводиться тут. Сполуку формули I можна одержувати, застосовуючи добре відомі хімічні процедури. Проміжні продукти, що конкретно не згадуються в даному описі, або є в продажу і можуть бути одержані за допомогою описаних в хімічній літературі способів, або можуть бути легко синтезовані з вихідних речовин, що є в продажу з використанням стандартних процедур. Наступні приклади представлені для ілюстрації різних аспектів сполук згідно з даним винаходом і не повинні тлумачитися як обмеження формули винаходу. Приклади Одержання 5-фтор-2-(4-фторбензилокси)піримідин-4-аміну (1): До розчину 4-фторбензилового спирту (2,56 г, 20,3 ммоль) в 1,4-діоксані (20 мл) протягом 10 хв декількома порціями додавали 60 % NaH (0,813 г, 20,3 ммоль). До одержаного розчину при перемішуванні магнітною мішалкою додавали 2-хлор-5-фторпіримідин-4-амін* (2,00 г, 13,6 ммоль), і перемішували суміш при кімнатній температурі доти, поки не припиниться виділення газу. Потім реакційну суміш нагрівали в мікрохвильовому реакторі CEM Discover при 120 °C протягом 90 хв. Охолоджену реакційну суміш розподіляли між етилацетатом і водою, органічну фазу концентрували і продукт очищували за допомогою колонкової хроматографії (градієнт гексан/етилацетат), одержуючи при цьому 5-фтор-2-(4-фторбензилокси)піримідин-4-амін (1,66 г, вихід 52 %) у вигляді твердої речовини білого кольору: т.пл. (температура плавлення) 1291 131 °C; H ЯМР (300 МГц, CDCl3) δ 7,91 (д, J=2,6 Гц, 1H), 7,42 (м, 2H), 7,03 (м, 2H), 5,27 (с, 2H), + 5,05 (шир.с, 2H); МС (ESI) m/z 238 (M+H) . *4-аміно-2-хлор-5-фторпіримідин можна придбати комерційним шляхом або одержати за допомогою відомих в літературі способів. 1. Hayashi Т.; Kawakami Т., японський патент JP 2005126389. 2. Durr G.J. J. Med. Chem. 1965, 8(2), 253. 2-(3-Бромбензілокси)-5-фторпіримідин-4-іламін (2): До суміші KO-т-Bu (1,0 M в т-BuOH, 1,36 мл, 1,36 ммоль) при перемішуванні магнітною мішалкою додавали (3-бромфеніл)метанол (0,25 г, 1,36 ммоль). До одержаного розчину додавали 2-хлор-5-фторпіримідин-4-іламін (0,10 г, 0,68 ммоль), суміш закривали пробкою і перемішували при 90 °C протягом 4 годин. Реакційну суміш охолоджували до кімнатної температури, розбавляли водою, і одержаний осад збирали фільтруванням. Тверду речовину промивали водою, промивали циклогексаном і сушили у вакуумній сушильній шафі. Розчин сполуки в CH2Cl2 завантажували в колонку Biotage SCX і елюювали CH 2Cl2 з подальшим додаванням 2,0 M розчину NH3 в MeOH. Розчинник випарювали при зниженому тиску, одержуючи при цьому вказану в заголовку сполуку (0,100 г, 49 %) у вигляді твердої речовини не 1 зовсім білого кольору: т.пл. 143-145 °C; H ЯМР (400 МГц, ДМСО-d6) δ 7,90 (д, J=2,5 Гц, 1H), 14 UA 107445 C2 7,61 (с, 1H), 7,43 (д, J=8,0 Гц, 1H), 7,36 (д, J=7,7 Гц, 1H), 7,22 (т, J=7,7 Гц, 1H), 5,28 (с, 2H), 5,20 + (шир.с, 2H); ГХ-МС (EI) m/z 297, 299 (M) . Одержання 5-фтор-2-[1-(4-фторфеніл)етокси]піримідин-4-іламіну (3): 5 10 15 20 25 30 35 40 45 До суміші 4-аміно-2-хлор-5-фторпіримідину (11,10 г, 75,2 ммоль) в 1-(4-фторфеніл)етанолі (11,70 г, 82,8 ммоль) при перемішуванні магнітною мішалкою однією порцією додавали 1,0 M розчин KO-т-Bu в т-BuOH (82,8 мл, 82,8 ммоль), і одержану жовтувато-коричневу суміш нагрівали із зворотним холодильником і перемішували протягом 24 годин. Розчинник видаляли у вакуумі, і одержане червоно-оранжеве масло очищували флеш-хроматографією (SiO2, 010 % MeOH/CH2Cl2), одержуючи при цьому 5,5 г червоно-оранжевого масла. Одержане масло суспендували в суміші гексанів (100 мл) і перемішували протягом 16 годин. До суміші, що не змінилася, додавали воду (100 мл) і енергійно перемішували двофазну систему протягом 1 години. Одержану тверду речовину кремового кольору збирали вакуумним фільтруванням, промивали теплою водою (55 °C, 2100 мл) і сушили у вакуумі при 55 °C протягом 16 годин, одержуючи при цьому 5-фтор-2-[1-(4-фторфеніл)етокси]піримідин-4-іламін (3,30 г, вихід 17,2 %) 1 у вигляді твердої речовини білого кольору: т.пл. 96-98 °C; H ЯМР (300 МГц, CDCl3) δ 7,84 (д, J=2,6 Гц, 1H), 7,42-7,38 (м, 2H), 7,03-6,97 (м, 2H), 5,99 (кв, J=6,6 Гц, 1H), 5,09 (шир.с, 2H), 1,61 (д, + J=6,6 Гц, 3H); МС (ESI) m/z 252 (M+H) , m/z 250 (M-H) . Одержання 1-фенілетанон-O-(4-аміно-5-фторпіримідин-2-іл)оксиму (4): До суміші 4-аміно-2-хлор-5-фторпіримідину (0,10 г, 0,68 ммоль) і ацетофеноноксиму (0,092 г, 0,68 ммоль) в сухому ДМФА (3 мл) при перемішуванні магнітною мішалкою в 5 мл посудині мікрохвильового реактора Biotage Iniator додавали NaH (0,027 г 60 мас. % суспензії, 0,68 ммоль) в атмосфері N2. Після припинення газовиділення одержану суміш герметично закривали кришкою з діафрагмою мікрохвильового реактора Biotage Initiator і нагрівали в мікрохвильовому реакторі Biotage Initiator до 100 °C протягом 60 хвилин. Вміст посудини виливали в пробірку з водою (5 мл) і CH2Cl2 (5 мл) і нейтралізували декількома краплями 2N розчину HCl. Фази розділяли, і органічний екстракт сушили над MgSO 4, фільтрували і упарювали в потоці азоту. Сирий (неочищений) вміст очищували на діоксиді кремнію (градієнт EtOAc/гексани), і упарювали одержані фракції, одержуючи при цьому 0,057 г (34 %) 1-фенілетанон-O-(4-аміно-5фторпіримідин-2-іл)оксим у вигляді твердої речовини не зовсім білого кольору: т.пл. 163-165 °C; 1 H ЯМР (300 МГц, CDCl3) δ 8,04 (д, J=2,6 Гц, 1H), 7,75 (м, 2H), 7,42 (м, 3H), 5,25 (шир.с, 2H), 2,51 + (с, 3H); ВЕРХ-МС (ESI) m/z 247 (M+H) . Одержання 5-фтор-2-(тіофен-2-ілметокси)піримідин-4-іламіну (5): До суміші 2-хлор-5-фторпіримідин-4-іламіну (2,00 г, 13,5 ммоль) і тіофен-2-ілметанолу (1,92 г, 16,9 ммоль) з якорем для магнітної мішалки в 20 мл реакційній посудині мікрохвильового реактора Biotage Initiator додавали KO-т-Bu (17,0 мл 1M розчину в т-BuOH, 17,0 ммоль). Одержану суміш герметично закривали кришкою з діафрагмою мікрохвильового реактора Biotage Initiator і нагрівали в мікрохвильовому реакторі Biotage Initiator до 100 °C протягом 30 хв. Цикл нагрівання повторювали (2), щоб сумарний час реакції становив 90 хв. Вміст посудини виливали в льодяну воду, і за допомогою 2N розчину HCl доводили pH до нейтрального значення. Одержану тверду речовину відфільтровувати і промивали водою (2) і потім 20 %ною сумішшю простий ефір/гексани (100 мл). Тверду речовину, що залишилася, сушили протягом ночі при 50 °C у вакуумі, одержуючи при цьому 4,17 г (68 %) 5-фтор-2-(тіофен-21 ілметокси)піримідин-4-іламіну у вигляді порошку світло-жовтого кольору: т.пл. 92-94 °C; H ЯМР (300 МГц, CDCl3) δ 7,92 (д, J=2,7 Гц, 1H), 7,29 (м, 1H), 7,13 (д, J=3,6 Гц, 1H), 6,97 (м, 1H), 5,46 (с, + 2H), 5,17 (шир.с, 2H); МС (ESI) m/z 226 (M+H) . Одержання N-[5-фтор-2-(тіофен-2-ілметокси)піримідин-4-іл]ацетаміду (6): 15 UA 107445 C2 5 10 15 20 25 30 35 40 У пробірці з нагвинчуваною кришкою об'ємом 2 драхми обробляли розчин 5-фтор-2-(тіофен2-ілметокси)піримідин-4-іламіну (0,10 г, 0,4 ммоль) в CH2Cl2 ацетилхлоридом (0,032 г, 0,4 ммоль) і PS-NMM (0,42 г, 0,8 ммоль), полімерзв'язаним еквівалентом N-метилморфоліну (NMM). Суміш перемішували при кімнатній температурі протягом 12 годин. Реакційну суміш фільтрували, і випарювали розчинник, одержуючи при цьому 0,084 г (75 %) вказаної в заголовку 1 сполуки у вигляді білої твердої речовини: т.пл. 134-136 °C; H ЯМР (300 МГц, CDCl3) δ 8,24 (д, J=2,6 Гц, 1H), 7,86 (шир.с, 1H), 7,31 (м, 1H), 7,23 (м, 1H), 7,00 (м, 1H), 5,54 (с, 2H), 2,58 (с, 3H); + МС (ESI) m/z 268 (M+H) . Одержання [5-фтор-2-(4-фторбензилокси)піримідин-4-іл]-(4- метилпіперазин-1-ілметил)аміну (7): До суміші параформальдегіду (0,24 г, 8 ммоль) в CH2Cl2 (20 мл) при перемішуванні магнітною мішалкою додавали N-метилпіперазин (0,80 г, 8,0 ммоль). Суспензію перемішували на орбітальному струшувачі протягом ночі при температурі навколишнього середовища, і потім додавали 5-фтор-2-(4-фторбензилокси)піримідин-4-іламін (0,47 г, 2,0 ммоль). Одержану суміш перемішували з п'ятниці по понеділок при кімнатній температурі. Розчинник випарювали, і сирий (неочищений) залишок двічі промивали 50 %-ною сумішшю простий ефір/петролейний ефір і сушили в потоці N2, одержуючи при цьому 0,21 г (30 %) [5-фтор-2-(4-фторбензилокси)піримідин4-іл](4-метилпіперазин-1-ілметил)аміну у вигляді твердої речовини бежового кольору: т.пл. 1251 126 °C; H ЯМР (300 МГц, CDCl3) δ 7,83 (д, J=2,3 Гц, 1H), 7,43 (м, 2H), 7,03 (т, J=8,5 Гц, 2H), 5,40 (шир.с, 1H), 5,27 (с, 2H), 4,41 (д, J=6,8 Гц, 2H), 2,63 (шир.с, 4H), 2,47 (шир.с, 4H), 2,30 (с, 3H); + ВЕРХ-МС (ESI) m/z 350 (M+H) . Одержання [5-фтор-2-(4-фторбензилокси)піримідин-4-іл]триетилсиланіламіну (8): До суміші 5-фтор-2-(4-фторбензилокси)піримідин-4-іламіну (0,25 г, 1,05 ммоль) в сухому ТГФ (5 мл) при перемішуванні магнітною мішалкою при 0 °C додавали NaH (0,042 г 60 мас. % суспензія в мінеральному маслі, 1,05 ммоль). Коли виділення пухирців газу припинялося, за допомогою шприца по краплях (акуратно) додавали триетилсилілхлорид (0,158 г, 1,05 ммоль). Після перемішування протягом ночі при температурі навколишнього середовища реакційну суміш виливали в простий ефір і промивали сумішшю водного насиченого розчину бікарбонату натрію і насиченого розчину солі. Органічний шар відділяли, сушили над Na 2SO4, фільтрували і упарювали, одержуючи при цьому тверду речовину білого кольору. Одержану сиру (неочищену) речовину очищували на діоксиді кремнію за допомогою колонкової хроматографії (градієнт EtOAc/гексани), одержуючи при цьому 0,121 г (33 %) [5-фтор-2-(4-фторбензилокси)піримідин-41 іл]триетилсиланіламіну у вигляді прозорого масла жовтого кольору: H ЯМР (300 МГц, CDCl3) δ 7,89 (д, J=2,5 Гц, 1H), 7,39 (м, 2H), 7,03 (т, J=8,6 Гц, 2H), 5,27 (с, 2H), 4,53 (с, 1H), 0,99 (м, 9H), + 0,83 (м, 6H); ВЕРХ-МС (ESI) m/z 352 (M+H) . Одержання складного 4-фторфенілового ефіру [5-фтор-2-(4-фторбензилокси)піримідин-4іл]біскарбамінової кислоти (9): До охолоджуваної льодом суміші 5-фтор-2-(4-фторбензилокси)піримідин-4-іламіну (0,25 г, 1,05 ммоль) в сухому ТГФ (5 мл) при перемішуванні магнітною мішалкою додавали NaH (0,042 г 16 UA 107445 C2 5 10 15 20 25 30 35 40 45 60 мас. % суспензії в мінеральному маслі, 1,05 ммоль). Після того, як виділення пухирців газу припинялося, по краплях додавали 4-фторфенілхлорформіат (0,184 г, 1,05 ммоль) у вигляді розчину в сухому ТГФ. Після перемішування протягом однієї години реакційну суміш розподіляли між EtOAc і насиченим розчином солі. Органічний екстракт сушили над Na 2SO4, фільтрували і упарювали. Сиру (неочищену) речовину очищували на діоксиді кремнію, застосовуючи градієнт EtOAc/Hex і потім MeOH/EtOAc, одержуючи при цьому 0,054 г (14 %) складного 4-фторфенілового ефіру [5-фтор-2-(4-фторбензилокси)піримідин-4-іл]біскарбамінової 1 кислоти у вигляді твердої речовини білого кольору: т.пл. 103-105 °C; H ЯМР (300 МГц, CDCl3) δ + 8,58 (д, J=2,2 Гц, 1H), 7,43 (м, 2H), 7,08 (м, 10H), 5,40 (с, 2H); ВЕРХ-МС (ESI) m/z 514 (M+H) . Одержання складного фенілового ефіру [5-фтор-2-(4-фторбензилокси)піримідин-4іл]карбамінової кислоти (10): При перемішуванні до суміші 5-фтор-2-(4-фторбензилокси)піримідин-4-іламіну (0,20 г, 0,84 ммоль) в сухому ТГФ (3 мл) при температурах льодяної бані додавали NaH (0,034 г 60 мас. % суспензії в мінеральному маслі, 0,84 ммоль). Коли виділення пухирців газу припинялося, одержану суміш за допомогою канюлі переносили (по краплях) при перемішуванні в охолоджувану льодом суміш дифенілкарбонату (1,8 г, 8,4 ммоль) в сухому ТГФ (5 мл). Суміш перемішували протягом ночі, виливали в EtOAc і промивали насиченим водним розчином NH 4Cl з подальшим проміванням насиченим розчином солі. EtOAc-шар відділяли, сушили над Na2SO4, фільтрували і упарювали. Сиру (неочищену) речовину очищували на силікагелі, застосовуючи градієнт EtOAc і суміші гексанів і одержуючи при цьому 0,063 г (21 %) складного фенілового ефіру [5-фтор-2-(4-фторбензилокси)піримідин-4-іл]карбамінової кислоти у вигляді твердої 1 речовини білого кольору: т.пл. 129-131 °C; H ЯМР (300 МГц, CDCl3) δ 8,28 (д, J=2,3 Гц, 1H), 7,43 + (м, 5H), 7,30-7,20 (м, 2H), 7,02 (т, J=8,6 Гц, 2H), 5,38 (с, 2H); ВЕРХ-МС (ESI) m/z 358 (M+H) . Одержання складного етилового ефіру N-[5-фтор-2-(4-фторбензилокси)піримідин-4іл]оксаламової кислоти(11): До суміші 5-фтор-2-(4-фторбензилокси)піримідин-4-іламіну (0,235 г, 0,99 ммоль), Nметилморфоліну на полістиролі (0,538 г, 1,24 ммоль) і CH 2Cl2 (5 мл) додавали складний етиловий ефір хлороксооцтової кислоти (0,135 г, 0,99 ммоль) і перемішували одержану суміш на орбітальному струшувачі протягом 16 годин. Реакційний вміст фільтрували на кислотному SPE-картріджі і елюювали CH2Cl2. CH2Cl2-фільтрат упарювали, одержуючи при цьому 0,165 г (50 %) складного етилового ефіру N-[5-фтор-2-(4-фторбензилокси)піримідин-4-іл]оксаламової 1 кислоти у вигляді прозорого масла: H ЯМР (300 МГц, CDCl3) δ 9,21 (шир.с, 1H), 8,38 (д, 7=2,3 Гц, 1H), 7,48 (м, 2H), 7,03 (т, J=8,5 Гц, 2H), 5,40 (с, 2H), 4,48 (кв, J=7,1 Гц, 2H), 1,45 (т, J=7,1 Гц, + 3H); ВЕРХ-МС (ESI) m/z 338 (M+H) . Одержання [5-фтор-2-(4-фторбензилокси)піримідин-4-іл]аміду 3,4-дихлорізотіазол-5карбонової кислоти (12): До суспензії 3,4-дихлорізотіазол-5-карбонової кислоти (0,15 г, 0,76 ммоль) в оксалилхлориді (2 мл) додавали каталітичну кількість диметилформаміду (2 краплі), і нагрівали суміш до 80 °C і перемішували протягом 2 годин. Надлишок оксалилхлориду видаляли на роторному випарнику. Тим часом 5-фтор-2-(4-фторбензилокси)піримідин-4-іламін (0,17 г, 0,68 ммоль) розчиняли в ТГФ (1 мл), обробляли LiHMDS (1 M розчин в ТГФ, 0,76 мл, 0,76 ммоль) і перемішували протягом 10 хвилин. Додавали свіжоприготований 3,4-дихлортіазол-5-карбонілхлорид*, розчинений в ТГФ (1 мл), реакційну суміш закривали пробкою і перемішували протягом 12 годин. Реакційну суміш розбавляли водою, і необхідну сполуку екстрагували CH 2Cl2 (35 мл). Об'єднані екстракти сушили над MgSO4 і потім упарювали при зниженому тиску. Суміш елюювали CH 2Cl2 через 17 UA 107445 C2 5 10 15 20 25 30 35 40 аніонообмінну колонку для твердофазної екстракції і потім додатково очищували хроматографією із зворотною фазою, одержуючи при цьому [5-фтор-2-(4фторбензилокси)піримідин-4-іл]амід 3,4-дихлорізотіазол-5-карбонової кислоти (0,035 г, 12 %) у 1 вигляді твердої речовини жовтувато-коричневого кольору: т.пл. 87-90 °C; H ЯМР (400 МГц, ДМСО-d6) δ 11,78 (с, 1H), 8,67 (с, 1H), 7,51-7,48 (м, 2H), 7,24-7,19 (м, 2H), 5,25 (с, 2H); МС (ESI) + m/z 417 (M+H) , 415 (M-H) . *Nagata Т.; Kogure А.; Yonekura N.; Hanai R.; Kaneko L; Nakano Y., японський патент JP 2007211002 А Одержання складного діетилового ефіру [5-фтор-2-(4-фторбензилокси)піримідин-4іл]фосфорамідинової кислоти (13): До розчину 5-фтор-2-(4-фторбензилокси)піримідин-4-іламіну (0,10 г, 0,42 ммоль) в сухому ТГФ (5 мл) при перемішуванні магнітною мішалкою в атмосфері азоту додавали NaH (0,017 г 60 мас. % суспензії, 0,42 ммоль), і перемішували суміш доти, поки не припинялося виділення пухирців газу. По краплях додавали діетилхлорфосфат (0,073 г, 0,42 ммоль), і перемішували суміш при температурі навколишнього середовища протягом 1 години. Реакційну суміш упарювали досуха, залишок розчиняли в EtOAc і промивали насиченим водним розчином NH4Cl. Органічний шар відділяли, сушили над Na2SO4, фільтрували і упарювали. Сиру (неочищену) речовину очищували на діоксиді кремнію (градієнт ацетон/CH 2Cl2), одержуючи при цьому 0,017 г (11 %) складного діетилового ефіру [5-фтор-2-(4-фторбензилокси)піримідин-41 іл]фосфорамідинової кислоти у вигляді твердої речовини білого кольору: т.пл. 109-111 °C; H ЯМР (300 МГц, CDCl3) δ 8,10 (т, J=1,8 Гц, 1H), 7,43 (м, 2H), 7,03 (т, J=8,5 Гц, 2H), 6,18 (шир.с, + 1H), 5,35 (с, 2H), 4,25 (м, 4H), 1,38 (т, J=7,1 Гц, 6H); ВЕРХ-МС (ESI) m/z 374 (M+H) . Одержання [5-фтор-2-(4-фторбензилокси)піримідин-4-іл]-(1- метоксипропіл)аміну (14): До розчину 5-фтор-2-(4-фторбензилокси)піримідин-4-іламіну (0,10 г, 0,42 ммоль) в пропіональдегіді (2 мл) додавали каталітичну кількість камфорсульфонової кислоти. Суміш перемішували на орбітальному струшувачі при кімнатній температурі протягом 4 годин і потім упарювали досуха. Додавали метанол (2 мл), і одержаний розчин нагрівали до 60 °C протягом 1 години. Після упарювання сирий продукт очищували хроматографією із зворотною фазою, одержуючи при цьому вказану в заголовку сполуку (0,030 г, вихід 24 %) у вигляді прозорого 1 безбарвного масла: H ЯМР (300 МГц, CDCl3) δ 7,91 (д, J=2,5 Гц, 1H), 7,47-7,41 (м, 2H), 7,09-7,01 (м, 2H), 5,41 (дт, J=9,9 і 6,0 Гц, 1H), 5,30 (с, 2H), 5,2 (шир.д, J=10 Гц, 1H), 3,12 (с, 3H), 1,88-1,60 + (м, 2H), 0,98 (т, J=7,1 Гц, 3H), ВЕРХ-МС 308 (ES ), 310 (ES ). Одержання [5-фтор-2-(4-метилбензилокси)піримідин-4-іламіно]метанолу (16): До розчину 5-фтор-2-(4-метилбензилокси)піримідин-4-іламіну (0,10 г, 0,43 ммоль) в діоксані (2 мл) додавали параформальдегід (0,060 г, 2 ммоль), і перемішували суміш на орбітальному струшувачі при 90 °C протягом 16 годин, охолоджували і випарювали досуха. При очищенні хроматографією із зворотною фазою одержували 0,070 г (63 %) вказаної в заголовку сполуки у 1 вигляді твердої речовини білого кольору: т.пл. 97-98 °C; H ЯМР (CDCl3) δ 7,94 (д, J=2,5 Гц, 1H), 7,36 (д, J=7,9 Гц, 2H), 7,19 (д, J=7,9 Гц, 2H), 5,97 (шир.с, 1H), 5,33 (с, 2H), 5,04-4,99 (м, 2H), 3,39 + (т, J=8,0 Гц, 1H), 2,37 (с, 3H); МС (ESI) m/z 264 (M+H) . Одержання бензилоксиметил-[5-фтор-2-(4-фторбензилокси)піримідин-4-іл]аміну (18): 45 18 UA 107445 C2 5 10 15 20 25 30 35 40 До суміші [5-фтор-2-(4-фторбензилокси)піримідин-4-іламіно]метанолу (0,10 г, 3,7 ммоль) в бензиловому спирті (1 мл) додавали каталітичну кількість п-толуолсульфонової кислоти. Через 30 хвилин реакційну суміш охолоджували до кімнатної температури і розподіляли між етилацетатом і насиченим розчином бікарбонату натрію. Фази розділяли, і органічну частину сушили над безводним Na2SO4, фільтрували і упарювали, одержуючи при цьому сирий (неочищений) продукт. При очищенні хроматографією із зворотною фазою одержували 0,094 г (70 %) вказаної в заголовку сполуки у вигляді твердої речовини білого кольору: т.пл. 64-66 °C; 1 H ЯМР (CDCl3) δ 7,93 (д, J=2,7 Гц, 1H), 7,47-7,40 (м, 2H), 7,37-7,29 (м, 5H), 7,08-7,00 (м, 2H), + 5,81-5,70 (шир.м, 1H), 5,29 (с, 2H), 5,12 (д, J=6,9 Гц, 2H), 4,63 (с, 2H); МС (ESI) m/z 358 (M+H) . Одержання складного [5-фтор-2-(4-фторбензилокси)піримідин-4- іламіно]метилового ефіру 2,2-диметилпропіонової кислоти (19): До суміші [5-фтор-2-(4-фторбензилокси)піримідин-4-іламіно]метанолу (0,10 г, 0,37 ммоль) в піридин (2 мл) додавали триметилацетилхлорид (0,048 г, 0,40 ммоль), і перемішували суміш на орбітальному струшувачі при 60 °C протягом 4 годин. Реакційну суміш охолоджували, упарювали досуха і розподіляли між EtOAc і водою. Органічний шар сушили над Na 2SO4, фільтрували і упарювали, одержуючи при цьому вказану в заголовку сполуку (0,078 г, вихід 1 60 %) у вигляді твердої речовини білого кольору: т.пл. 134-135 °C; H ЯМР (300 МГц, CDCl3) δ 7,97 (д, J=2,5 Гц, 1H), 7,49-7,44 (м, 2H), 7,11-7,03 (м, 2H), 6,17 (шир.т, J=7 Гц, 1H), 6,17 (д, J=7,4 + Гц, 2H), 5,33 (с, 2H), 1,20 (с, 9H); ВЕРХ-МС m/z 352 (M+H) . Одержання N′-[5-фтор-2-(4-фторбензилокси)піримідин-4-іл]-N, N-диметилформамідину (20): До розчину 5-фтор-2-(4-фторбензилокси)піримідин-4-іламіну (1,00 г, 4,2 ммоль) в N, Nдиметилформаміді (ДМФА, 20 мл) при перемішуванні магнітною мішалкою додавали N, Nдиметилформаміддиметилацеталь (0,55 г, 4,6 ммоль) і продовжували перемішування 16 годин при кімнатній температурі. Розчин виливали в 100 мл льодяної води, після чого одержували білий осад. Суміш охолоджували при 0 °C протягом 1 години, і потім фільтрували, одержуючи при цьому вказану в заголовку сполуку (1,10 г, 89 %) у вигляді твердої речовини білого кольору: 1 т.пл. 113-115 °C; H ЯМР (CDCl3) δ 8,65 (с, 1H), 8,04 (д, J=2,6 Гц, 1H), 7,46-7,40 (м, 2H), 7,07-6,98 + (м, 2H), 5,30 (с, 2H), 3,17 (с, 3H), 3,16 (с, 3H); МС (ESI) m/z 292 (M+H) . Розраховано теоретично для C14H14F2N4O: С - 57,53; Н - 4,83; N-19,17. Знайдено: С - 57,67; Н - 4,84; N-19,09. Одержання [5-фтор-2-(4-фторбензилокси)піримідин-4-іл]-[1-піролідин-1-ілметилиден]аміну (21): До розчину N'-[5-фтор-2-(4-фторбензилокси)піримідин-4-іл]-N, N-диметилформамідину (0,10 г, 0,36 ммоль) в толуолі (2 мл) додавали піролідин (0,051 г, 0,72 ммоль) і каталітична кількість камфорсульфонової кислоти. Пробірку з газовідвідною трубкою поміщували на орбітальний струшувач, перемішували при 90 °C протягом 16 годин, охолоджували і упарювали вміст досуха. При очищенні хроматографією із зворотною фазою одержували вказану в заголовку 1 сполуку (0,060 г, вихід 53 %) у вигляді твердої речовини білого кольору: т.пл. 102-103 °C; H ЯМР (300 МГц, CDCl3) δ 8,87 (с, 1H), 8,06 (д, J=2,7 Гц, 1H), 7,49-7,42 (м, 2H), 7,09-7,01 (м, 2H), + 5,32 (с, 2H), 3,73-3,62 (м, 4H), 2,07-1,96 (м, 4H); ВЕРХ-МС (ESI) m/z 319 (M+H) . Одержання N-[5-фтор-2-(4-фторбензилокси)піримідин-4-іл]-N'-гідроксиформамідину (22): 19 UA 107445 C2 5 10 15 20 25 30 35 40 45 До розчину N'-[5-фтор-2-(4-фторбензилокси)піримідин-4-іл]-N, N-диметилформамідину (0,10 г, 0,34 ммоль) в EtOH (2 мл) додавали гідрохлорид гідроксиламіну (0,047 г, 0,68 ммоль), і перемішували суміш на орбітальному струшувачі протягом 1,5 годин при 50 °C. Реакційну суміш охолоджували і упарювали досуха. Додавали воду до одержання суспензії, яку фільтрували, виділяючи при цьому вказану в заголовку сполуку (0,090 г, вихід 94 %) у вигляді твердої 1 речовини білого кольору: т.пл. 169-171 °C; H ЯМР (300 МГц, CDCl3) δ 8,15 (д, J=2,2 Гц, 1H), 8,02 + (шир.с, 2H), 7,49-7,43 (м, 2H), 7,11-7,02 (м, 3H), 5,35 (с, 2H); ВЕРХ-МС (ESI) m/z 281 (M+H) , 279 (M-H) . Одержання N-[5-фтор-2-(4-фторбензилокси)піримідин-4-іл]-N'-ціаноформамідину (23): Ціанамід (8,00 г, 190,0 ммоль) перемішували при кип'ятінні із зворотним холодильником в триетилортоформіаті (60 мл) протягом 2 годин. Реакційну суміш охолоджували до кімнатної температури і переганяли, одержуючи при цьому етил-N-ціаноімідат (12,5 г, т. кипіння = 110112 °C/45 мм Hg).* До одержаного імідату (1 мл) додавали 5-фтор-2-(4фторбензилокси)піримідин-4-іламін (0,05 г, 0,2 ммоль), нагрівали суміш при 90 °C протягом 4 годин, охолоджували, розбавляли хлороформом, фільтрували і упарювали. Сирий (неочищений) продукт очищували хроматографією із зворотною фазою, одержуючи при цьому 0,053 г (17 %) вказаної в заголовку сполуки у вигляді твердої речовини не зовсім білого кольору: 1 т.пл. 148-149 °C; H ЯМР (300 МГц, CDCl3) δ 9,45 і 9,33 (шир.д, шир.с, J=10 Гц, 1H), 8,33 і 8,25 (2д, J=2 Гц, 1H), 7,46-7,38 (м, 2H), 7,11-7,01 (м, 2H), 5,35 і 5,33 (2с, 2H); ВЕРХ-МС (ESI) m/z 290 + (M+H) , 288 (M-H) . * Bridsen Peter K. і Wang Xiaodong, Synthesis, 1995, 855-8. Одержання N'-[5-фтор-2-(4-фторбензилокси)піримідин-4-іл]-N, N-диметилпропіонамідину (24): До розчину N, N-диметилпропіонаміду (0,202 г, 2,0 ммоль) в CHCl3 (2 мл) додавали оксихлорид фосфору (POCl3; 0,066 г, 0,43 ммоль) і перемішували суміш на орбітальному струшувачі при кімнатній температурі протягом 1 години. Додавали триетиламін (0,22 г, 2,2 ммоль) і 5-фтор-2-(4-фторбензилокси)піримідин-4-іламін (0,10 г, 0,40 ммоль), і перемішували суміш при 50 °C протягом 3 годин, охолоджували до кімнатної температури, розподіляли між хлороформом і водою, фази розділяли, і органічну частину упарювали при зниженому тиску. При очищенні хроматографією із зворотною фазою одержували вказану в заголовку сполуку 1 (0,042 г, вихід 31 %) у вигляді масла жовтого кольору: H ЯМР (300 МГц, CDCl3) δ 8,87 (с, 1H), 8,04 (д, J=2,5 Гц, 1H), 7,46-7,40 (м, 2H), 7,07-6,99 (м, 2H), 5,30 (с, 2H), 3,13 (с, 6H), 2,55 (кв, J=7,7 + Гц, 2H), 1,15 (т, J=7,7 Гц, 3H); ВЕРХ-МС (ESI) m/z 321 (M+H) . Одержання N'-(5-фтор-2-гідроксипіримідин-4-іл)-N, N-диметилформамідину (25): До розчину 4-аміно-5-фторпіримідин-2-олу* (4,00 г, 31,0 ммоль) в ДМФА (100 мл) при перемішуванні магнітною мішалкою додавали N, N-диметилформаміддиметилацеталь (4,00 г, 34,0 ммоль). Суміш перемішували при кімнатній температурі протягом 72 годин, розбавляли простим діетиловим ефіром (200 мл) і фільтрували. Твердий продукт промивали гептаном, одержуючи при цьому вказану в заголовку сполуку (5,23 г, вихід 92 %) у вигляді твердої 1 речовини білого кольору: т.пл. 240-243 °C; H ЯМР (300 МГц, ДМСО-d6) δ 10,7 (шир.с, 1H), 8,59 + (с, 1H), 7,7 (д, J=5,6 Гц, 1H), 3,18 (с, 3H), 3,06 (с, 3H); ВЕРХ-МС (ESI) m/z 185 (M+H) , 183 (M-H) . 20 UA 107445 C2 *4-аміно-5-фторпіримідин-2-ол можна придбати в продажу. Одержання складного 4-(диметиламінометиленаміно)-5-фторпіримідин-2-ілетилового ефіру вугільної кислоти (26): 5 10 15 20 25 30 35 40 До розчину N'-(5-фтор-2-гідроксипіримідин-4-іл)-N, N-диметилформамідину (0,10, 0,54 ммоль) в CH2Cl2 (2 мл) додавали триетиламін (0,20 г, 2,0 ммоль) і етилхлорформіат (0,065 г, 0,60 ммоль), і перемішували суміш на орбітальному струшувачі при кімнатній температурі протягом ночі. Реакційну суміш розбавляли CH2Cl2, і розчин промивали водою, сушили над MgSO4, фільтрували і упарювали. Сирий (неочищений) продукт очищували колонковою хроматографією на силікагелі (градієнт EtOAc/петролейний ефір) одержуючи при цьому 0,031 г (22 %) вказаної в заголовку сполуки у вигляді твердої речовини білого кольору: т.пл. 124-126 °C; 1 H ЯМР (300 МГц, CDCl3) δ 8,67 (с, 1H), 8,19 (д, J=2,2 Гц, 1H), 4,35 (кв, J=7,14 Гц, 2H), 3,21 (с, + 6H), 1,40 (т, J=7,14 Гц, 3H); ВЕРХ-МС (ESI) m/z 258 (M+H) . Одержання складного 4-(диметиламінометиленаміно)-5-фторпіримідин-2-ілового ефіру бензойної кислоти (27): До суспензії N'-(5-фтор-2-гідроксипіримідин-4-іл)-N, N-диметилформамідину (0,10 г, 0,54 ммоль) в піридин (2 мл) додавали бензоїлхлорид (0,084 г, 0,60 ммоль), і перемішували суміш на орбітальному струшувачі протягом 16 годин при кімнатній температурі. Реакційну суміш розподіляли між EtOAc і насиченим водним розчином NaHCO 3, органічну фазу сушили над твердим MgSO4, фільтрували і упарювали, одержуючи при цьому вказану в заголовку сполуку 1 (0,147 г, 94 %) у вигляді твердої речовини білого кольору: т.пл. 136-138 °C; H ЯМР (300 МГц, CDCl3) δ 8,69 (с, 1H), 8,27 (д, J=2,4 Гц, 2H), 8,25-8,20 (м, 2H), 7,69-7,63 (м, 1H), 7,56-7,49 (м, 2H), + 3,23 (с, 3H), 3,20 (с, 3H); ВЕРХ-МС (ESI) m/z 289 (M+H) . Одержання складного 4-(диметиламінометиленаміно)-5-фторпіримідин-2-ілового ефіру бензолсульфонової кислоти (28): До суспензії N'-(5-фтор-2-гідроксипіримідин-4-іл)-N, N-диметилформамідину (0,10 г, 0,54 ммоль) в піридині (2 мл) додавали бензолсульфонілхлорид (0,106 г, 0,60 ммоль), і перемішували суміш на орбітальному струшувачі протягом 16 годин при кімнатній температурі. Реакційну суміш розподіляли між EtOAc і насиченим водним розчином NaHCO3, і органічну фазу сушили над твердим MgSO4, фільтрували і концентрували при зниженому тиску. При очищенні хроматографією із зворотною фазою (градієнт H 2O/MeCN) одержували вказану в заголовку 1 сполуку (0,089 г, вихід 46 %) у вигляді твердої речовини білого кольору: т.пл. 124-125 °C; H ЯМР (300 МГц, CDCl3) δ 8,54 (с, 1H), 8,12-8,07 (м, 3H), 7,73-7,66 (м, 1H), 7,62-7,56 (м, 2H), 3,21 + (с, 6H); ВЕРХ-МС (ESI) m/z 325 (M+H) . Одержання складного 4-аміно-5-фторпіримідин-2-ілового ефіру бензолсульфонової кислоти (29): До розчину HCl в діоксані (3 мл 10 %-ного розчини) додавали складний 4(диметиламінометиленаміно)-5-фторпіримідин-2-іловий ефір бензолсульфонової кислоти (0,090, 0,3 ммоль), і перемішували суміш на орбітальному струшувачі при кімнатній температурі протягом 1,5 годин. Розчинник видаляли випарюванням, залишок розчиняли в розчині діоксану і води (2,5 мл, 1:1) і обробляли насиченим водним розчином NaHCO 3 (0,5 мл). Через 16 годин 21 UA 107445 C2 5 10 15 20 25 30 35 40 реакційну суміш розподіляли між EtOAc і водою, органічну фазу сушили над Na2SO4, фільтрували і випарювали розчинник, одержуючи при цьому вказану в заголовку сполуку (0,059 1 г, вихід79 %) у вигляді твердої речовини білого кольору: т.пл. 139-141 °C; H ЯМР (300 МГц, ДМСО-d6) δ 8,05-8,00 (м, 3H), 7,90-7,75 (м, 3H), 7,70-7,63 (м, 2H); ВЕРХ-МС (ESI) m/z 268 (M-H) , + 270 (M+H) . Одержання складного 4-аміно-5-фторпіримідин-2-ілового ефіру бензолсульфонової кислоти (29): До суспензії 5-фторцитозину (0,177 г, 1,4 ммоль) в піридині (5 мл) додавали бензолсульфонілхлорид (0,284 г, 1,6 ммоль), і перемішували суміш при кімнатній температурі протягом 2 годин. Реакційну суміш упарювали досуха, і сиру (неочищену) речовину очищували хроматографією із зворотною фазою, одержуючи при цьому вказану в заголовку сполуку (0,106 1 г, вихід 29 %) у вигляді твердої речовини білого кольору: т.пл. 145-146 °C; H ЯМР (300 МГц, + ДМСО-d6) δ 8,05-8,00 (м, 3H), 7,9-7,75 (м, 3H), 7,70-7,63 (м, 2H); ВЕРХ-МС (ESI) m/z 270 (M+H) , 268 (M-H) . Одержання (2-фторбензил)-[5-фтор-2-(4-фторбензилокси)піримідин-4-іл]аміну (30): A) розчин 2,4-дихлор-5-фторпіримідину* (0,105 г, 0,63 ммоль) в 5 мл сухого ТГФ обробляли при перемішуванні магнітною мішалкою 2-фторбензиламіном (0,085 г, 0,68 ммоль) і надлишком триетиламіну, і нагрівали одержану суміш при 80 °C протягом 5 годин. Реакційну суміш розподіляли між CH2Cl2 і розбавленою HCl, органічну фазу промивали насиченим розчином солі, сушили над Na2SO4 і фільтрували. Розчинник видаляли при зниженому тиску, одержуючи при цьому 0,157 г (97 %) вказаної в заголовку сполуки у вигляді твердої речовини жовтого 1 кольору: т.пл. 117-118 °C; H ЯМР (300 МГц, CDCl3) δ 7,90 (д, J=2,6, 1H), 7,47-7,27 (м, 2H), 7,21+ 7,01 (м, 2H), 5,54 (с, 1H), 4,76 (д, J=5,9, 2H); МС (ESI) m/z 256 (M+H) . *2,4-дихлор-5-фторпіримідин можна придбати в продажу. B) Розчин (2-хлор-5-фторпіримідин-4-іл)-(2-фторбензил)аміну* (0,103 г, 0,40 ммоль) в 5 мл сухого ТГФ обробляли 4-фторбензиловим спиртом (0,062 г, 0,49 ммоль) і 1,0 M розчином KO-тBu в т-BuOH (0,4 мл, 0,4 ммоль). Суміш нагрівали при 80 °C в герметично закритій пробірці протягом 18 годин, розподіляли між CH2Cl2 і водою; органічну фазу промивали насиченим розчином солі, сушили над Na2SO4 і фільтрували. Розчинник видаляли при зниженому тиску, залишок очищували колонковою флеш-хроматографією (SiO2, 10>20 % EtOAc/петролейний ефір), одержуючи при цьому вказану в заголовку сполуку (0,157 г, 42 %) у вигляді твердої 1 речовини білого кольору: т.пл. 83-84 °C; H ЯМР (300 МГц, CDCl3) δ 7,83 (д, J=2,8, 1H), 7,45-7,27 (м, 5H), 7,15-6,96 (м, 5H), 5,37 (шир.с, 1H), 5,29 (с, 3H), 4,74 (д, J=5,9, 3H); МС (ESI) m/z 346 + (M+H) . *Singh R.; Argade А.; Payan D.G.; Clough J.; Keim Н.; Sylvain С; Li, Н.; Bhаmidipati S., патентна заявка WO 2004014382 A1 20040219 Одержання 5-фтор-2-(3-метоксибензилокси)-4-(1-(4- метоксифеніл)гідразиніл)піримідину (31): 22 UA 107445 C2 5 10 15 20 25 30 35 40 45 50 55 A) До суміші 2,4-дихлор-5-фторпіримідину (5,04 г, 30,1 ммоль) і 3-метоксибензилового спирту (7,8 мл, 62,8 ммоль) в 250 мл круглодонній колбі додавали 1,0 M розчин KO-т-Bu в KO-тBu (66 мл, 66 ммоль). Спостерігалося значне екзотермічне виділення тепла, одержану суміш перемішували при кімнатній температурі протягом 2 годин. Реакційну суміш розбавляли EtOAc (100 мл) і промивали насиченим розчином солі (50 мл 2). Органічний шар сушили над MgSO4, фільтрували і концентрували при зниженому тиску. При кристалізації з гарячого EtOH одержували речовину, яку збирали на лійці з пористим фільтром і промивали EtOH, охолодженим льодом, одержуючи при цьому вказану в заголовку сполуку (7,94 г, 71 %) у вигляді 1 твердої речовини білого кольору: т.пл. 81-83 °C; H ЯМР (300 МГц, CDCl3) δ 8,10 (д, J=2,3 Гц, 1H), 7,29 (м, 2H), 7,02 (м, 4H), 6,87 (дт, J=2,2, 7,8 Гц, 2H), 5,44 (с, 2H), 5,35 (с, 2H), 3,82 (с, 3H), + 3,82 (с, 3H); МС (ESI) m/z 371 (M+H) . B) До суміші 5-фтор-2,4-біс-(3-метоксибензилокси)піримідину (7,9 г, 21,3 ммоль) і EtOH (21 мл) в 500 мл круглодонній колбі додавали 2,0 N розчин KOH у воді (85 мл, 170 ммоль). Приєднували зворотний холодильник і нагрівали реакційну суміш при 95 °C протягом 16 годин. Після охолоджування до кімнатної температури реакційну суміш промивали Et2O (250 мл) і потім підкислювали 1 N розчином HCl до pH 3. Одержану тверду речовину збирали на лійці з пористим фільтром. За допомогою подальшої екстракції надлишком EtOAC і концентрації при зниженому тиску одержували вказану в заголовку сполуку (3,63 г, 68 %) у вигляді твердої 1 речовини білого кольору: т.пл. 136-139; H ЯМР (300 МГц, ДМСО-d6) δ 12,97 (шир.с, 1H), 7,87 (д, J=3,7 Гц, 1H), 7,30 (т, J=7,9 Гц, 1H), 7,00 (м, 2H), 6,91 (дд, J=1,8, 8,0 Гц, 1H), 5,29 (с, 2H), 3,74 (с, + 3H); МС (ESI) m/z 251 (M+H) . C) В висушену в сушильному шафі 100 мл колбу Шленка завантажували 5-фтор-2-(3метоксибензилокси)піримідин-4-ол (3,63 г, 14,5 ммоль) і N, N-диметиланілін (3,7 мл, 29,2 мл). Додавали оксихлорид фосфору (POCl3, 40 мл, 429 ммоль), і нагрівали одержаний розчин до 95 °C в атмосфері азоту. Через 2 години реакційну суміш охолоджували до кімнатної температури і концентрували до постійного об'єму при зниженому тиску і 50 °C. Залишок, що залишився, розбавляли в Et2O (50 мл) і промивали 1N розчином HCl (250 мл). Шляхом концентрації при зниженому тиску одержували тверду речовину, яку промивали водою і збирали шляхом фільтрування у вакуумі. Вказану в заголовку сполуку (4,09 г, 105 %) виділяли у 1 вигляді твердої речовини білого кольору: т.пл. 96-100 °C; H ЯМР (300 МГц, ДМСО-d6) δ 8,81 (д, J=0,8 Гц, 1H), 7,30 (т, J=8,1 Гц, 1H), 7,02 (м, 2H), 6,91 (дд, J=2,3, 8,3 Гц, 1H), 5,34 (с, 2H), 3,75 (с, + 3H); МС (ESI) m/z 269 (M+H) . D) До суміші 4-хлор-2-(3-метоксибензил)-5-фторпіримідину (0,153 г, 0,568 ммоль) і гідрохлориду 4-метоксифенілгідразину (0,324 г, 1,85 ммоль) в етанолі (5 мл) додавали триетиламін (0,272, 2,69 ммоль), і нагрівали суміш до 50 °C протягом 16 годин. Реакційну суміш охолоджували до кімнатної температури і розбавляли Et2O (50 мл). Et2O-розчин промивали водою (250 мл), сушили над MgSO4, фільтрували і концентрували. Залишок розтирали в Et 2O, одержуючи при цьому 5-фтор-2-(3-метоксибензилокси)-4-(1-(4метоксифеніл)гідразиніл)піримідин (0,113 г, вихід 54 %) у вигляді твердої речовини білого 1 кольору: т.пл. 121-123,5 °C; H ЯМР (300 МГц, ДМСО-d6) δ 8,02 (д, J=5,4 Гц, 1H), 7,28 (т, J=8,1 Гц, 1H), 7,22 (д, J=8,5 Гц, 2H), 6,99-6,93 (м, 2H), 6,93-6,85 (м, 3H), 5,25 (с, 2H), 3,75 (с, 3H), 3,74 + (с, 3H); МС (ESI) m/z 371 (M+H) , 354 (M-NH2) . Одержання О-аліл-N-(5-фтор-2-(3-метоксибензилокси)піримідин-4-іл)гідроксиламіну (32): До суміші 4-хлор-2-(3-метоксибензил)-5-фторпіримідину (0,151 г, 0,558 ммоль) і гідрохлориду О-алілгідроксиламіну (0,201 г, 1,83 ммоль) в суміші 5:1 MeOH:CH 3CN (5 мл) додавали триетиламін (0,273 г, 2,70 ммоль), і нагрівали суміш при 50 °C протягом 18 годин. Реакційну суміш охолоджували до кімнатної температури і розбавляли Et 2O (50 мл). Органічний розчин промивали водою (250 мл), сушили над MgSO4, фільтрували і концентрували. При очищенні флеш-хроматографією (SiO2, 17 %50 % EtOAc/гексан) одержували О-аліл-N-(5фтор-2-(3-метоксибензилокси)піримідин-4-іл)гідроксиламін (0,113 г, вихід 66 %) у вигляді 1 безбарвного масла: H ЯМР (300 МГц, ДМСО-d6) δ 10,94 (широкий синглет, 1H), 7,94 (широкий синглет, 1H), 7,28 (т, J=8,0 Гц, 1H), 6,95-7,03 (м, 2H), 6,88 (дд, J=2,5, 7,9 Гц, 1H), 5,97 (тдд, J=5,8, 10,6, 17,0 Гц, 1H), 5,32 (дд, J=1,5, 17,4 Гц, 1H), 5,24 (с, 2H), 5,22 (дд, J=1,2, 10,6 Гц, 1H), 4,39 (д, + J=6,0 Гц, 2H), 3,74 (с, 3H); МС (ESI) m/z 306 (M+H) , 304 (M-H) . 23 UA 107445 C2 Одержання 1-[2-(3-ціанобензилокси)-5-фторпіримідин-4-іл]-3-(2- фторбензил)сечовини (34): 5 10 15 20 25 30 35 40 До суміші 3-(4-аміно-5-фторпіримідин-2-ілоксиметил)бензонітрилу (0,075 г, 0,31 ммоль) і 2фторбензилізоціанату (0,59 мл, 0,46 ммоль) в сухому ДМФА (1,5 мл) при перемішуванні магнітною мішалкою додавали LiHMDS (1,0 M розчин в ТГФ, 0,31 мл, 0,30 ммоль). Пробірку закривали пробкою, і перемішували суміш при кімнатній температурі протягом 8 годин. Додавали насичений водний розчин NH 4Cl (3 мл), і перемішували суміш протягом 4 годин. Гетерогенну суміш фільтрували, тверду речовину промивали гарячою водою, промивали E 2O і потім сушили у вакуумі, одержуючи при цьому вказану в заголовку сполуку (0,075 г, 62 %) у 1 вигляді твердої речовини білого кольору: т.пл. 177-178 °C; H ЯМР (400 MГц, ДМСО-d6) δ 10,04 (с, 1H), 8,90 (т, J=5,7 Гц, 1H), 8,37 (д, J=2,8 Гц, 1H), 7,85 (шир.с, 1H), 7,80 (д, J=7,5 Гц, 1H), 7,74 (д, J=8,0 Гц, 1H), 7,60 (т, J=7,8 Гц, 1H), 7,42-7,38 (м, 1H), 7,35-7,29 (м, 1H), 7,20-7,14 (м, 2H), 5,33 + (с, 2H), 4,49 (д, J=5,8 Гц, 2H); ВЕРХ-МС (ESI) m/z 396,3 (M+H) , 394,3 (M-H) . Одержання 1-[5-фтор-2-(3-метоксибензилокси)піримідин-4-іл]-(3'пропілкарбамоил)-3пропілсечовини (36): До суміші 5-фтор-2-(3-метоксибензилокси)піримідин-4-іламіну (0,075 г, 0,30 ммоль) і пропілізоціанату (0,057 мл, 0,60 ммоль) в сухому ДМФА (1,5 мл) при перемішуванні магнітною мішалкою додавали LiHMDS (1,0 M розчин в ТГФ, 0,60 мл, 0,60 ммоль). Пробірку закривали пробкою, і перемішували реакційну суміш при кімнатній температурі протягом 8 годин. Розчинник випарювали при зниженому тиску, і сиру (неочищену) речовину очищували хроматографією із зворотною фазою, одержуючи при цьому вказану в заголовку сполуку (0,043 1 г, 10 %) у вигляді твердої речовини жовтувато-коричневого кольору: т.пл. 75-78 °C; H ЯМР (400 MГц, ДМСО-d6) δ 12,34 (с, 1H), 8,49 (с, 1H), 7,89 (с, 1H), 7,29 (т, J=7,8 Гц, 1H), 7,05-7,01 (м, 2H), 6,90 (дд, J=6,9 Гц, J=2,5 Гц, 1H), 5,30 (с, 2H), 3,75 (с, 3H), 3,74-3,68 (м, 2H), 3,15-3,10 (м, 2H), + 1,58-1,44 (м, 4H), 0,89-0,85 (м, 6H); ВЕРХ-МС (ESI) m/z 420,4 (M+H) , 418,4 (M-H) . Одержання 1-[2-(3-ціанобензилокси)-5-фторпіримідин-4-іл]-3- пропілтіосечовини (37): До суміші 3-(4-аміно-5-фторпіримідин-2-ілоксиметил)бензонітрилу (0,075 г, 0,31 ммоль) і пропілізотіоціанату (0,047 мл, 0,46 ммоль) в сухому ДМФА (1,5 мл) при перемішуванні магнітною мішалкою додавали LiHMDS (1,0 M розчин в ТГФ, 0,31 мл, 0,31 ммоль). Пробірку закривали пробкою, і перемішували реакційну суміш протягом 8 годин. У пробірку додавали насичений водний розчин NH4Cl (3 мл), і перемішували суміш протягом 4 годин. Гетерогенну суміш фільтрували, тверду речовину промивали гарячою водою, промивали сумішшю гексанів і сушили у вакуумі, одержуючи при цьому вказану в заголовку сполуку (0,055 г, 52 %) у вигляді 1 твердої речовини світло-жовтого кольору: т.пл. 163-165 °C; H ЯМР (400 MГц, ДМСО-d6) δ 10,77 (с, 1H), 10,38 (с, 1H), 8,47 (д, J=2,7 Гц, 1H), 7,90 (с, 1H), 7,82 (д, J=7,5 Гц, 1H), 7,78 (д, J=8,1 Гц, 1H), 7,62 (т, J=7,7 Гц, 1H), 5,42 (с, 2H), 3,55 (дд, J=12,4, 6,8 Гц, 2H), 1,65-1,59 (м, 2H), 0,95 (т, + J=7,5 Гц, 3H); ВЕРХ-МС (ESI) m/z 346,3 (M+H) , 344,2 (M-H) . Одержання N-[5-фтор-2-(4-метилбензилокси)піримідин-4-іл]метансульфонаміду (38): До розчину 5-фтор-2-(4-метилбензилокси)піримідин-4-іламіну (0,100 г, 0,43 ммоль) в безводному ТГФ (4 мл) при кімнатній температурі по краплях додавали LiHMDS (1,07 мл 1,0 M 24 UA 107445 C2 5 10 15 20 25 30 35 40 45 розчин, 1,07 ммоль), і перемішували одержаний оранжевий розчин протягом 20 хвилин. Додавали метансульфонілхлорид (0,108 г, 0,94 ммоль) у вигляді однієї порції, і перемішували каламутний, ясно-оранжевий розчин протягом 60 хвилин. Реакцію гасили насиченим розчином солі (5 мл) і відділяли ТГФ-фазу. Водну фазу екстрагували EtOAc (5 мл), і об'єднували органічні частини, сушили над Na2SO4, фільтрували і концентрували до оранжевого смолоподібного залишку. Залишок очищували флеш-хроматографією (SiO2, 0100 % EtOАc/гексани), одержуючи при цьому 0,034 г (26 %) вказаної в заголовку сполуки у вигляді твердої речовини 1 білого кольору: т.пл. 145-148 °C; H ЯМР (400 MГц, CDCl3) δ 8,19 (с, 1H), 7,33 (д, J=7,9 Гц, 2H), + 7,17 (д, J=7,9 Гц, 2H), 5,35 (с, 2H), 3,37 (с, 3H), 2,35 (с, 3H); ВЕРХ-МС (ESI) m/z 312 (M+H) , 310 (M-H) . Одержання N-[5-фтор-2-(4-фторбензилокси)піримідин-4-іл]-S-(2нітрофеніл)тіогідроксиламіну (39): До розчину 5-фтор-2-(4-фторбензилокси)піримідин-4-іламіну (0,05 г, 0,2 ммоль) і 1,0 M розчину KO-т-Bu в т-BuOH (1,0 мл, 1,0 ммоль) додавали нітробензолсульфенілхлорид (0,044 г, 0,23 ммоль) у вигляді однієї порції, і перемішували одержаний коричневий розчин протягом 60 хвилин. Реакційну суміш розбавляли водою (2 мл) і нейтралізували до pH 7 1N розчином HCl. Водну фазу екстрагували EtOAc (5 мл), органічні фази об'єднували, сушили над Na 2SO4, фільтрували і концентрували. Сиру (неочищену) речовину очищували хроматографією із зворотною фазою, одержуючи при цьому вказану в заголовку сполуку (0,020 г, 26 %) у вигляді 1 твердої речовини жовтого кольору: т.пл. 184 °C; H ЯМР (300 МГц, CDCl3) δ 8,36 (д, J=7,25 Гц, 1H), 8,09 (д, J=2,3 Гц, 1H), 7,59 (м, 1H), 7,36 (м, 2H), 7,29 (м, 2H), 6,88 (м, 2H), 6,23 (шир.с, 1H), + 5,19 (с, 2H); ВЕРХ-МС (ESI) m/z 391 (M+H) , 389 (M-H) . Одержання складного 4-ацетиламіно-5-фторпіримідин-2-ілового ефіру бензолсульфонової кислоти (40): N-(5-фтор-2-гідроксипіримідин-4-іл)ацетамід* (200 мг, 1,17 ммоль) суспендували в піридині (5 мл) і перемішували при температурі навколишнього середовища. До суспензії при перемішуванні додавали бензолсульфонілхлорид (226 мг, 1,29 ммоль) і продовжували перемішування протягом 16 годин. Розчинник випарювали в потоці азоту, і залишок суспендували в дихлорметані (2-3 мл), поміщували безпосередньо в колонку з силікагелім і елюювали етилацетатом в петролейному ефірі (градієнт 0-50 %), виділяючи при цьому 180 мг, 0,58 ммоль (49 %) вказаної в заголовку сполуки у вигляді твердої речовини білого кольору: т.пл. 1 142-143 °C; H ЯМР (ДМСО-d6) δ 10,96 (с, 1H), 8,67 (д, J=2,6 Гц, 1H), 8,12-8,06 (м, 2H), 7,86-7,79 + (м, 1H), 7,73-7,65 (м, 2H), 2,98 (с, 3H); ВЕРХ-МС (ESI) m/z 312 (M+H) , 310 (M-H) . *N-(5-фтор-2-гідроксипіримідин-4-іл)ацетамід можна приготувати відомими в літературі способами. 1. Duschinsky R., Fells Е., Hoffer M. патент США 3309359 Одержання складного 4-(диметиламінометиленаміно)-5-фторпіримідин-2-ілоксиметилового ефіру 2,2-диметилпропіонової кислоти (41): N'-(5-фтор-2-гідроксипіримідин-4-іл)-N, N-диметилформамідин (100 мг, 0,54 ммоль), карбонат цезію (196 мг, 0,60 ммоль) і хлорметилпівалат (90 мг, 0,6 ммоль) перемішували (струшували) разом в ДМФА (3 мл) при температурі навколишнього середовища протягом 16 годин. Реакційну суміш розподіляли між етилацетатом і водою, сушили над сульфатом магнію, фільтрували і упарювали, одержуючи при цьому безбарвне масло, яке обробляли простим діетиловим ефіром (3-4 мл), одержуючи при цьому тверду речовину. Тверду речовину видаляли, ефірний розчин поміщували в колонку з силікагелім і елюювали етилацетатом в петролейному ефірі (градієнт 0-50 %), виділяючи при цьому 14 мг, 0,05 ммоль (9 %) вказаної в 25 UA 107445 C2 1 заголовку сполуки у вигляді твердої речовини білого кольору: т.пл. 86-88 °C; H ЯМР (CDCl3) δ 8,73 (с, 1H), 8,06 (д, J=2,6 Гц, 1H), 6,04 (с, 2H), 3,20 (с, 3H), 3,18 (с, 3H), 1,16 (с, 9H); ВЕРХ-МС + (ESI) m/z 299 (M+H) . Одержання N'-(5-фтор-2-метоксиметоксипіримідин-4-іл)-N, N-диметилформамідину (42): 5 10 15 20 25 30 35 40 45 N'-(5-фтор-2-гідроксипіримідин-4-іл)-N, N-диметилформамідин (100 мг, 0,54 ммоль), карбонат цезію (196 мг, 0,60 ммоль) і простий бромметилметиловий ефір (75 мг, 0,6 ммоль) перемішували (струшували) разом в ДМФА (3 мл) при температурі навколишнього середовища протягом 4 годин. Реакційну суміш розподіляли між етилацетатом і водою, сушили над сульфатом магнію, фільтрували і упарювали, одержуючи при цьому безбарвне масло, яке поміщували безпосередньо в колонку з силікагелім і елюювали етилацетатом в петролейному ефірі (градієнт 0-80 %), виділяючи при цьому 23 мг, 0,1 ммоль (19 %) вказаної в заголовку 1 сполуки у вигляді безбарвного масла: H ЯМР (CDCl3) δ 8,66 (с, 1H), 8,05 (д, J=2,6 Гц, 1H), 5,46 + (с, 2H), 3,53 (с, 3H), 3,17 (с, 3H), 3,16 (с, 3H); ВЕРХ-МС (ESI) m/z 229 (M+H) . Одержання [5-фтор-2-(3-метоксибензилокси)піримідин-4-іл]сульфаміду (43): До розчину 4-хлор-5-фтор-2-(3-метоксибензилокси)піримідину* (1,3 г, 4,84 ммоль) в сухому ДМФА (5 мл) при перемішуванні магнітною мішалкою додавали заздалегідь змішану суспензію з 60 % NaH (0,45 г, 10,65 ммоль) і сульфаміду (0,93 г, 9,68 ммоль) в сухому ДМФА (5 мл). Одержану суспензію не зовсім білого кольору перемішували при кімнатній температурі протягом 72 годин. Потім одержану оранжеву суспензію нагрівали до 50 °C протягом 48 годин і охолоджували до кімнатної температури. Реакційну суміш розподіляли між етилацетатом і насиченим розчином солі. Органічний екстракт сушили над Na 2SO4, фільтрували і упарювали. Сиру (неочищену) речовину очищували колонковою хроматографією з нормальною фазою діоксиду кремнію із застосуванням градієнта EtOAc/Hex і хроматографією із зворотною фазою із застосуванням градієнта H2O/ACN, одержуючи при цьому [5-фтор-2-(3метоксибензилокси)піримідин-4-іл]сульфамід (115 мг, вихід 7,2 %) у вигляді твердої речовини 1 білого кольору: т.пл. 126-130 °C; H ЯМР (300 МГц, CD3OD) δ 8,01 (д, J=3,63 Гц, 1H), 7,25 (м, 1H), 7,01 (м, 2H), 6,88 (м, 1H), 5,37 (с, 2H), 3,78 (с, 3H); МС (ESI) m/z 326,9 (M-H) . *проміжний продукт 4-хлор-5-фтор-2-(3-метоксибензилокси)піримідин одержували, як описано в синтезі 31. Одержання 5-фтор-4-гідразиніл-2-(3-метоксибензилокси)піримідину (44): У 125 мл колбу Ерленмейера завантажували 4-хлор-5-фтор-2-(3метоксибензилокси)піримідин (1,50 г, 5,58 ммоль) і EtOH (50 мл). Додавали моногідрат гідразину (900 мкл, 18,5 ммоль), і залишали одержану суміш перемішуватися при кімнатній температурі. Через 22 години реакційну суміш переносили в 500 мл колбу Ерленмейера і розбавляли водою (200 мл), після чого з розчину в осад починала випадати тверда речовина білого кольору. Після перемішування протягом 7 годин твердий продукт збирали на лійці з пористим фільтром і промивали надлишком води. Після сушіння на пористому фільтрі одержували вказану в заголовку сполуку (1,23 г, 83 %) у вигляді твердої речовини білого 1 кольору: т.пл. 103-106 °C; H ЯМР (300 МГц, ДМСО-d6) δ 8,92 (шир.с, 1H), 7,86 (д, J=3,6 Гц, 1H), 7,27 (т, J=8,1 Гц, 1H), 6,94-7,01 (м, 2H), 6,87 (дд, J=2,4, 7,9 Гц, 1H), 5,24 (с, 2H), 4,46 (шир.с, 2H), + 3,74 (с, 3H); МС (ESI) m/z 265,2 (M+H) , 263,2(M-H) . Одержання (Е)-5-фтор-2-(3-метоксибензилокси)-4-(2-(тіофен-2ілметилен)гідразиніл)піримідину (45): 26 UA 107445 C2 5 10 15 20 25 30 35 40 У 20 мл пробірку завантажували 5-фтор-4-гідразиніл-2-(3-метоксибензилокси)піримідин (74,7 мг, 0,283 ммоль), EtOH (2 мл), тіофен-2-карбальдегід (26 мкл, 0,284 ммоль) і 1 M розчин HCl в Et2O (14 мкл, 0,014 ммоль) і нагрівали при 50 °C на струшувачі. Через 90 хвилин реакційну суміш охолоджували до кімнатної температури, концентрували у високому вакуумі, одержуючи при цьому вказану в заголовку сполуку (77,8 мг, 77 %) у вигляді твердої речовини жовтого 1 кольору: т.пл. 136-139 °C; H ЯМР (300 МГц, ДМСО-d6) δ 11,46 (шир.с, 1H), 8,50 (шир.с, 1H), 8,16 (д, J=3,6 Гц, 1H), 7,64 (д, J=5,0 Гц, 1H), 7,41 (д, J=3,4 Гц, 1H), 7,28 (т, J=8,0 Гц, 1H), 7,12 (дд, J=3,8, 4,8 Гц, 1H), 7,04 (м, 2H), 6,88 (дд, J=2,4, 8,3 Гц, 1H), 5,27 (с, 2H), 3,73 (с, 3H); МС (ESI) m/z + 359,2 (M+H) , 357,2 (M-H) . 4 Одержання 2-(бензилокси)-4-[(диметил-λ -сульфаніліден)аміно]-5- фторпіримідину (47): У висушену в сушильному шафі 10 мл колбу Шленка завантажували 2-(бензилокси)-5фторпіримідин-4-амін (101 мг, 0,462 ммоль), CH2Cl2 (2 мл) і диметилсульфід (75,0 мкл, 1,02 ммоль) і охолоджували до 0 °C на льодяній бані. Додавали N-хлорсукцинімід (122 мг, 0,914 ммоль), і залишали одержану суміш перемішуватися при 0 °C протягом 45 хвилин і потім при кімнатній температурі протягом 30 хвилин. Додавали розчин NaOMe в MeOH (25 %-ний розчин, 360 мкл, 1,35 ммоль). Через 20 хвилин реакцію гасили водою (3 мл) і залишали перемішуватися протягом 1 години. Потім сиру (неочищену) реакційну суміш розбавляли CH 2Cl2, промивали водою (50 мл 2), сушили в над безводним Na 2SO4, фільтрували і концентрували шляхом роторного випарювання, потім сушили у високому вакуумі, одержуючи при цьому вказану в заголовку сполуку (120 мг, 93 %) у вигляді твердої речовини не зовсім білого кольору: т.пл. 1251 129 °C; H ЯМР (300 МГц, ДМСО-d6): δ 7,70 (д, J=3,9 Гц, 1H), 7,25-7,44 (м, 5H), 5,21 (с, 2H), 2,75 + (с, 6H); МС (ESI) m/z 281,1 (M+H) . *Yamamoto Y.; Yamamoto Н., J. Am. Chem. Soc. 2004, 126, 4128-4129. Одержання 1-[5-фтор-2-(4-метилбензилокси)піримідин-4-іл]-2,3- дипропілізотіосечовини (49): До розчину 1-[5-фтор-2-(4-метилбензилокси)піримідин-4-іл]-3- пропілтіосечовини (0,50 г, 1,40 ммоль) в CH3CN (4 мл) додавали карбонат калію (0,20 г, 1,40 ммоль) при кімнатній температурі і при перемішуванні магнітною мішалкою, і перемішували суміш протягом 20 хвилин. При кімнатній температурі додавали N-пропілбромід (0,19 г, 1,40 ммоль), і перемішували одержану суміш протягом 15 годин. Реакційну суміш розбавляли H 2O і екстрагували CH2Cl2 (320 мл). Об'єднані органічні шари сушили над Na2SO4, фільтрували і випарювали розчинник. Сиру (неочищену) суміш очищували на діоксиді кремнію (градієнт EtOAc/гексани), і упарювали одержані фракції, одержуючи при цьому 0,335 г (63 %) 1-[5-фтор-2-(4метилбензилокси)піримідин-4-іл]-2,3- дипропілізотіосечовини у вигляді в'язкої рідини блідо1 жовтого кольору: H ЯМР (300 МГц, CDCl3) δ 10,56 (шир.с, 1H), 8,09 (д, J=2,6 Гц, 1H), 7,31 (м, 2H), 7,24 (м, 2H), 5,28 (с, 2H), 3,28 (дд, J=13,6, 6,5 Гц, 4H), 2,36 (с, 3H), 1,62 (м, 4H), 1,0 (т, J=7,4 + Гц, 4H); ВЕРХ-МС (ESI) m/z 377(M+H) . Одержання О-(4-аміно-5-фторпіримідин-2-іл)-трет-бутил-N-метил-N-гідроксикарбамату (50): У пробірці з нагвинчуваною кришкою об'ємом 2 драхми розчин 4-аміно-2-хлор-5фторпіримідину (0,1 г, 0,68 ммоль) і трет-бутил-N-метил-N-гідроксикарбамату* (0,11 г, 0,75 27 UA 107445 C2 5 10 15 20 25 30 35 40 45 50 ммоль) обробляли 1,0 M розчином KO-т-Bu в т-BuOH (1,0 мл, 1,0 ммоль) у вигляді однієї порції, одержаний розчин жовтого кольору нагрівали при 100 °C і перемішували протягом 24 годин. Реакційну суміш охолоджували, екстрагували EtOAC (35 мл) і випарювали розчинник. Сиру (неочищену) суміш очищували хроматографією із зворотною фазою, одержуючи при цьому 0,10 г (56,9 %) вказаної в заголовку сполуки у вигляді твердої речовини жовтого кольору: т.пл. 1231 125 °C; H ЯМР (300 МГц, CDCl3) δ 7,96 (д, J=2,3 Гц, 1H), 5,26 (шир.с, 2H), 3,32 (с, 3H), 1,43 (с, + 9H); МС (ESI) m/z 259 (M+H) . *трет-бутил-N-метил-N-гідроксикарбамат можна одержувати відомими в літературі способами: 1. Carrasco MR; Braun R. T.; Serafimova I, M; Silva О, J. Org. Chem., 2003, 68 (1), 195. Одержання О-етил-5-фтор-2-(4-фторбензилокси)піримідин-4-ілкарбaмотіоату (51): 5-Фтор-2-(4-фторбензилокси)піримідин-4-амін (300 мг, 1,26 ммоль) перемішували з хлороформом (25 мл) і водою (12 мл). Додавали бікарбонат натрію (870 мг, 10,12 ммоль) з подальшим додаванням по краплях тіофосгену (218 мг, 1,9 ммоль). Реакційну суміш перемішували при кімнатній температурі протягом 16 годин, потім розбавляли хлороформом (20 мл) і розділяли фази. Органічний екстракт сушили над сульфатом натрію, фільтрували і концентрували на роторному випарнику до 1/3 об'єму. До одержаного розчину сирого ізотіоціанату в хлороформі додавали абсолютний етанол (10 мл), і нагрівали суміш в герметично закритій пробірці протягом 1 години. Реакційну суміш охолоджували до кімнатної температури, концентрували і очищували флеш-хроматографією на діоксиді кремнію, одержуючи при цьому 45 мг (11 %) О-етил-5-фтор-2-(4-фторбензилокси)піримідин-41 ілкарбaмотіоату у вигляді твердої речовини блідо-жовтого кольору: т.пл. 109-119 °C; H ЯМР (CDCl3) δ 8,30 (шир.с, 2H), 7,44 (м, 2H), 7,06 (м, 2H), 5,36 (с, 2H), 4,66 (кв, J=6 Гц, 2H), 1,45 (т, + J=6 Гц, 3H); ВЕРХ-МС (ESI): m/z 326 (ES ). Одержання N-(5-фтор-2-(4-фторбензилокси)піримідин-4-іл)етантіоаміду (53): N-(5-фтор-2-(4-фторбензилокси)піримідин-4-іл)ацетамід (50 мг, 0,42 ммоль) перемішували з 1,2-дихлоретаном (3 мл) і реагентом Лавессона (170 мг, 0,42 ммоль) в посудині для ® мікрохвильового реактора Biotage Initiator . Посудину нагрівали в мікрохвильовому реакторі ® Biotage Initiator до 100 °C протягом 5 хвилин, потім охолоджували до кімнатної температури, вміст посудини фільтрували і розбавляли CH 2Cl2. Потім реакційну суміш промивали насиченим розчином солі, і розділяли шари. Органічний екстракт сушили на діоксиді кремнію і очищували флеш- хроматографією. Фракції, що містять продукт, потім упарювали досуха і знову очищували за допомогою ВЕРХ із зворотною фазою, одержуючи при цьому 4 мг N-(5-фтор-2-(4фторбензилокси)піримідин-4-іл)етантіоаміду (4 %) у вигляді склоподібної речовини жовтого 1 кольору: H ЯМР (CDCl3) δ 9,34 (шир., 1H), 8,29 (д, J=3 Гц, 1H), 7,41 (м, 2H), 7,06 (м, 2H), 5,33 (с, 2H), 3,13 (с, 3H); ВЕРХ-МС (ESI): m/z 294 (ES ).) Протоколи біологічних випробувань 1. Оцінка фунгіцидної активності: плямистість листя (мікосферельоз) пшениці (Mycosphaerella graminicola; анаморф: Septoria tritici; Байєрівський код SEPTTR): Рослини пшениці (сорт Юма) вирощували з насіння в теплиці, в грунтосуміші, що складається з 50 % мінералізованого грунту Metro mix/50 % грунту без Metro mix доти, поки повністю не з'являвся перший лист при 7-10 паростків на горщичок. Такі рослини інокулювали водною суспензією спор грибка Septoria tritici або перед обробкою фунгіцидами, або після неї. Після інокуляції рослини витримували при 100 % відносній вологості (один день в темряві в зрошуваній камері з подальшими двома-трьома днями в освітленій зрошуваній камері), даючи можливість спорам прорости і інфікувати листя. Потім рослини переносили в теплицю для розвитку хвороби. 2. Оцінка фунгіцидної активності: плямистість (церкоспороз) листя цукрового буряка (Cercospora beticola: Байєрівський код CERCBE): 28
ДивитисяДодаткова інформація
Назва патенту англійською5-fluoro pyrimidine derivatives
Автори російськоюBenko, Zoltan, Boebel, Timothy, Breaux, Nneka, Bryan, Kristy, Davis, George, Epp, Jeffrey, Lorsbach, Beth, Martin, Timothy, Meyer, Kevin, Nader, Bassam, Owen, W., Pobanz, Mark, Ruiz, James, Smith, Frisby, Sullenberger, Michael, Webster, Jeffery, Yao, Chenglin, Young, David
МПК / Мітки
МПК: C07D 403/12, C07D 239/47, C07D 409/12, A01P 3/00
Мітки: похідні, фунгіциди, 5-фторпіримідинові
Код посилання
<a href="https://ua.patents.su/96-107445-5-ftorpirimidinovi-pokhidni-yak-fungicidi.html" target="_blank" rel="follow" title="База патентів України">5-фторпіримідинові похідні як фунгіциди</a>
Попередній патент: Інгібітори seh та їх застосування
Наступний патент: Спосіб одержання поліморфної форми 5-хлор-n-({(5s)-2-okco-3-[4-(3-okco-4-морфолініл)феніл]-1,3-оксазолідин-5-іл}метил)-2-тіофенкарбоксаміду у модифікації іі
Випадковий патент: Система для дистанційного визначення стану здоров'я пацієнта