Інгібітори seh та їх застосування
Номер патенту: 107444
Опубліковано: 12.01.2015
Автори: Дінг Йун, Маріно Джозеф Пол Дж., Телджі Ріма К.
Формула / Реферат
1. Сполука вибрана з групи, що включає:
цис-4-{[4-(метиламіно)-6-(3-піридиніл)-1,3,5-триазин-2-іл]аміно}-N-{[2-(трифторметил)феніл]метил}циклогексанкарбоксамід;
цис-4-{[4-(метиламіно)-6-феніл-1,3,5-триазин-2-іл]аміно}-N-{[2-(трифторметил)феніл]метил}циклогексанкарбоксамід;
цис-4-{[4-(метиламіно)-6-(3-тієніл)-1,3,5-триазин-2-іл]аміно}-N-{[2-(трифторметил)феніл]метил}циклогексанкарбоксамід;
цис-4-{[4-(2-фторфеніл)-6-(метиламіно)-1,3,5-триазин-2-іл]аміно}-N-{[2-(трифторметил)феніл]метил}циклогексанкарбоксамід;
цис-4-{[4-(4-ціанофеніл)-6-(метиламіно)-1,3,5-триазин-2-іл]аміно}-N-{[2-(трифторметил)феніл]метил}циклогексанкарбоксамід;
цис-4-({4-(метиламіно)-6-[4-(метилсульфоніл)феніл]-1,3,5-триазин-2-іл}аміно)-N-({2-[(трифторметил)окси]феніл}метил)циклогексанкарбоксамід;
цис-4-{[4-(метиламіно)-6-(3-піридиніл)-1,3,5-триазин-2-іл]аміно}-N-({2-[(трифторметил)окси]феніл}метил)циклогексанкарбоксамід;
цис-4-({4-(метиламіно)-6-[4-(трифторметил)феніл]-1,3,5-триазин-2-іл}аміно)-N-({2-[(трифторметил)окси]феніл}метил)циклогексанкарбоксамід;
3-{4-(метиламіно)-6-[(цис-4-{[({2-[(трифторметил)окси]феніл}метил)аміно]карбоніл}циклогексил)аміно]-1,3,5-триазин-2-іл}бензойну кислоту;
3-[4-(метиламіно)-6-({цис-4-[({[4-(метилокси)-2-(трифторметил)феніл]метил}аміно)карбоніл]циклогексил}аміно)-1,3,5-триазин-2-іл]бензойну кислоту;
цис-4-({4-(метиламіно)-6-[4-(трифторметил)феніл]-1,3,5-триазин-2-іл}аміно)-N-{[4-(метилокси)-2-(трифторметил)феніл]метил}циклогексанкарбоксамід;
цис-4-{[4-(метиламіно)-6-(3-піридиніл)-1,3,5-триазин-2-іл]аміно}-N-{[4-(метилокси)-2-(трифторметил)феніл]метил}циклогексанкарбоксамід;
цис-4-({4-(метиламіно)-6-[4-(метилсульфоніл)феніл]-1,3,5-триазин-2-іл}аміно)-N-{[4-(метилокси)-2-(трифторметил)феніл]метил}циклогексанкарбоксамід;
3-[4-(метиламіно)-6-({цис-4-[({[4-(трифторметил)-3-піридиніл]метил}аміно)карбоніл]циклогексил}аміно)-1,3,5-триазин-2-іл]бензойну кислоту;
цис-4-({4-(метиламіно)-6-[4-(трифторметил)феніл]-1,3,5-триазин-2-іл}аміно)-N-{[4-(трифторметил)-3-піридиніл]метил}циклогексанкарбоксамід;
цис-4-{[4-(метиламіно)-6-(3-піридиніл)-1,3,5-триазин-2-іл]аміно}-N-{[4-(трифторметил)-3-піридиніл]метил}циклогексанкарбоксамід;
цис-4-({4-(метиламіно)-6-[4-(метилсульфоніл)феніл]-1,3,5-триазин-2-іл}аміно)-N-{[4-(трифторметил)-3-піридиніл]метил}циклогексанкарбоксамід;
3-[4-{[цис-4-({[(2-хлор-4-ціанофеніл)метил]аміно}карбоніл)циклогексил]аміно}-6-(метиламіно)-1,3,5-триазин-2-іл]бензойну кислоту;
цис-N-[(2-хлор-4-ціанофеніл)метил]4-{[4-(метиламіно)-6-(3-піридиніл)-1,3,5-триазин-2-іл]аміно}циклогексанкарбоксамід;
цис-4-{[4-(диметиламіно)-6-метил-1,3,5-триазин-2-іл]аміно}-N-{[2-(трифторметил)феніл]метил}циклогексанкарбоксамід;
цис-4-[(4-аміно-6-метил-1,3,5-триазин-2-іл)аміно]-N-{[2-(трифторметил)феніл]метил}циклогексанкарбоксамід;
N-[(2,4-дихлорфеніл)метил]-3-{[4-метил-6-(метиламіно)-1,3,5-триазин-2-іл]аміно}циклогексанкарбоксамід;
цис-3-{[4-метил-6-(метиламіно)-1,3,5-триазин-2-іл]аміно}-N-{[2-(трифторметил)феніл]метил}циклогексанкарбоксамід;
цис-3-{[4-метил-6-(метиламіно)-1,3,5-триазин-2-іл]аміно}-N-({2-[(трифторметил)окси]феніл}метил)циклогексанкарбоксамід;
цис-N-{[4-хлор-2-(трифторметил)феніл]метил}-3-{[4-метил-6-(метиламіно)-1,3,5-триазин-2-іл]аміно}циклогексанкарбоксамід;
(цис)-N-{[2-хлор-4-(диметиламіно)феніл]метил}-3-{[4-метил-6-(метиламіно)-1,3,5-триазин-2-іл]аміно}циклогексанкарбоксамід;
(цис)-N-[(2-хлор-4-ціанофеніл)метил]-3-{[4-метил-6-(метиламіно)-1,3,5-триазин-2-іл]аміно}циклогексанкарбоксамід;
(цис)-3-{[4-метил-6-(метиламіно)-1,3,5-триазин-2-іл]аміно}-N-{[3-(трифторметил)-4-піридиніл]метил}циклогексанкарбоксамід;
(цис)-3-{[4-(2-фторфеніл)-6-(метиламіно)-1,3,5-триазин-2-іл]аміно}-N-{[2-(трифторметил)феніл]метил}циклогексанкарбоксамід;
(цис)-3-{[4-(4-фторфеніл)-6-(метиламіно)-1,3,5-триазин-2-іл]аміно}-N-{[2-(трифторметил)феніл]метил}циклогексанкарбоксамід;
(цис)-3-{[4-(4-ціанофеніл)-6-(метиламіно)-1,3,5-триазин-2-іл]аміно}-N-{[2-(трифторметил)феніл]метил}циклогексанкарбоксамід;
(цис)-4-{[4-метил-6-(метиламіно)-1,3,5-триазин-2-іл]аміно}-N-{[2-(трифторметил)феніл]метил}циклогексанкарбоксамід;
цис-4-{[4-метил-6-(метиламіно)-1,3,5-триазин-2-іл]аміно}-N-({2-[(трифторметил)окси]феніл}метил)циклогексанкарбоксамід;
цис-N-[(2,4-дихлорфеніл)метил]-4-{[4-метил-6-(метиламіно)-1,3,5-триазин-2-іл]аміно}циклогексанкарбоксамід;
цис-N-{[4-хлор-2-(трифторметил)феніл]метил}-4-{[4-метил-6-(метиламіно)-1,3,5-триазин-2-іл]аміно}циклогексанкарбоксамід;
транс-4-{[4-метил-6-(метиламіно)-1,3,5-триазин-2-іл]аміно}-N-{[2-(трифторметил)феніл]метил}циклогексанкарбоксамід;
транс-4-{[4-метил-6-(метиламіно)-1,3,5-триазин-2-іл]аміно}-N-({2-[(трифторметил)окси]феніл}метил)циклогексанкарбоксамід;
транс-N-[(2,4-дихлорфеніл)метил]-4-{метил[4-метил-6-(метиламіно)-1,3,5-триазин-2-іл]аміно}циклогексанкарбоксамід;
транс-N-{[4-хлор-2-(трифторметил)феніл]метил}-4-{метил[4-метил-6-(метиламіно)-1,3,5-триазин-2-іл]аміно}циклогексанкарбоксамід;
транс-4-{[4-(метиламіно)-6-феніл-1,3,5-триазин-2-іл]аміно}-N-{[2-(трифторметил)феніл]метил}циклогексанкарбоксамід;
транс-4-{[4-(метиламіно)-6-феніл-1,3,5-триазин-2-іл]аміно}-N-({2-[(трифторметил)окси]феніл}метил)циклогексанкарбоксамід;
транс-N-[(2,4-дихлорфеніл)метил]-4-{[4-(метиламіно)-6-феніл-1,3,5-триазин-2-іл]аміно}циклогексанкарбоксамід;
транс-N-{[4-хлор-2-(трифторметил)феніл]метил}-4-{[4-(метиламіно)-6-феніл-1,3,5-триазин-2-іл]аміно}циклогексанкарбоксамід;
3-{[4-(метиламіно)-6-феніл-1,3,5-триазин-2-іл]аміно}-N-{[2-(трифторметил)феніл]метил}циклогексанкарбоксамід;
3-{[4-(метиламіно)-6-феніл-1,3,5-триазин-2-іл]аміно}-N-({2-[(трифторметил)окси]феніл}метил)циклогексанкарбоксамід;
N-[(2,4-дихлорфеніл)метил]-3-{[4-(метиламіно)-6-феніл-1,3,5-триазин-2-іл]аміно}циклогексанкарбоксамід;
N-{[4-хлор-2-(трифторметил)феніл]метил}-3-{[4-метил-6-(метиламіно)-1,3,5-триазин-2-іл]аміно}циклогексанкарбоксамід;
цис-N-[(2,4-дихлорфеніл)метил]-4-{[4-(метиламіно)-6-феніл-1,3,5-триазин-2-іл]аміно}циклогексанкарбоксамід;
цис-N-({4-бром-2-[(трифторметил)окси]феніл}метил)-3-{[4-метил-6-(метиламіно)-1,3,5-триазин-2-іл]аміно}циклогексанкарбоксамід;
цис-3-{[4-метил-6-(метиламіно)-1,3,5-триазин-2-іл]аміно}-N-({4-(4-морфолініл)-2-[(трифторметил)окси]феніл}метил)циклогексанкарбоксамід;
(цис)-3-{[4-метил-6-(метиламіно)-1,3,5-триазин-2-іл]аміно}-N-{[4-(метилокси)-2-(трифторметил)феніл]метил}циклогексанкарбоксамід;
(цис)-N-{[4-фтор-2-(трифторметил)феніл]метил}-3-{[4-метил-6-(метиламіно)-1,3,5-триазин-2-іл]аміно}циклогексанкарбоксамід;
(цис)-N-{[4-ціано-2-(трифторметил)феніл]метил}-3-{[4-метил-6-(метиламіно)-1,3,5-триазин-2-іл]аміно}циклогексанкарбоксамід;
або її фармацевтично прийнятна сіль.
2. Сполука за п. 1, що являє собою
(цис)-N-{[4-ціано-2-(трифторметил)феніл]метил}-3-{[4-метил-6-(метиламіно)-1,3,5-триазин-2-іл]аміно}циклогексанкарбоксамід,
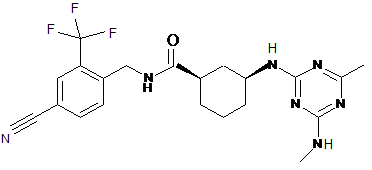 ,
,
або її фармацевтично прийнятна сіль.
3. Сполука за п. 1, що являє собою
(цис)-N-{[4-ціано-2-(трифторметил)феніл]метил}-3-{[4-метил-6-(метиламіно)-1,3,5-триазин-2-іл]аміно}циклогексанкарбоксамід
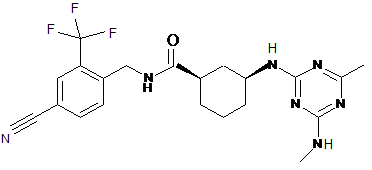 .
.
4. Сполука за п. 3, представлена у вигляді енантіомерно чистого окремого стереоізомера.
5. Спосіб лікування COPD і астми, за яким вводять безпечну та ефективну кількість сполуки або солі за будь-яким з попередніх пунктів людині, що потребує цього.
6. Фармацевтична композиція, що містить сполуку або сіль за будь-яким з пп. 1-4 і один або декілька фармацевтично прийнятних наповнювачів.
Текст
Реферат: Винахід стосується нових інгібіторів sEH та їх застосування для лікування хвороб, опосередкованих ферментом sEH. Конкретно, винахід стосується сполук, що відповідають формулі І: у якій R1, R2, R4, R5, R6, А, В, Υ, Ζ, n і m мають вказані в описі значення, і їхніх фармацевтично прийнятних солей. Сполуки за винаходом є інгібіторами sEH і можуть бути застосовані для лікування хвороб, опосередкованих ферментом sEH, таких як гіпертензія. Відповідно, винахід додатково стосується фармацевтичних композицій, що містять сполуку за винаходом. Винахід ще додатково стосується способів інгібування sEH і лікування станів, пов'язаних з цим, з використанням сполуки за винаходом або фармацевтичної композиції, що містить сполуки за винаходом. UA 107444 C2 (12) UA 107444 C2 UA 107444 C2 5 10 15 20 25 30 35 40 Галузь техніки, до якої належить винахід Винахід стосується нових інгібіторів sEH та їх застосування при лікуванні хвороб, опосередкованих ферментом sEH. Рівень техніки Епоксидні функціональні групи можуть бути виявлені в ліках, ксенобіотичних матеріалах і ендогенних біомолекулах. Епоксид-гідролази, знайдені і в рослинах, і у тварин, є ферментами, які перетворюють епоксиди на діоли шляхом гідролізу. У ссавців розчинна епоксид-гідролаза ("sEH") є, головним чином, відповідальною за метаболізм похідних арахідонової кислоти, відомих як епоксіейкозатрієнові кислоти ("EET"). sEH перетворює EET на дигідроксіейкозатрієнові кислоти ("DHET"). У декількох публікаціях повідомляється про корисні судинорозширювальні, протизапальні й антитромботичні ефекти EET. Див., наприклад, Spector et al., Prog. Lipid Res., 43, 55-90, 2004; Imig, Cardiovasc. Drug Rev., 24, 169-188, 2006. DHET, як правило, неактивні й тому не виявляють корисних ефектів EET. Навпаки, мікросомальна епоксид-гідролаза ("mEH") каталізує гідроліз широкого діапазону епоксид-субстратів, включаючи канцерогенні поліциклічні ароматичні вуглеводні й реакційноздатні епоксиди, таким чином вона забезпечує важливий шлях детоксифікації. Поліморфізми в mEH можуть приводити до відмінностей у біоактивації прокарциногенів, і окремі епідеміологічні дослідження людей підтверджують, що генотип mEH асоціюється зі зміненим ризиком раку. Fretland & Omiecinski, Chemico-Biol. Int., 129, 41-59, 2000. Фармакологічні дослідження фенотипу мишей з вибитим геном і генетичного поліморфізму підтверджують, що підвищені рівні EET є захисними в багатьох серцево-судинних розладах, включаючи гіпертензію [Sinal et al., J Biol Chem., 275, 40504-40510, 2000; Imig et at., Hypertension, 39, 690-694, 2002, Jung et al., Hypertension, 45, 759-765, 2005, Loch et al., Cell Biochem Biophys., 47, 87-98, 2007], серцеву недостатність [Xu et al., Proc. Natl. Acad. Sci. U.S.A. 103, 18733-18738, 2006], ниркову дисфункцію/ураження кінцевих органів [Zhao et al. J., Am. Soc. Nephrol., 15; 1244-1253, 2004; Imig et al., Hypertension, 46; 975-981, 2005], удар [Dorrance et al., J. Cardiovasc. Pharmacol., 46; 842-848, 2005; Fomage et al., Hum. Mol. Genet., 14; 2829-2837, 2005; Koerner et al., J. Neurosci., 27, 4642-4649, 2007], атеросклероз і тромбоз [Sato et al., J. Hum. Genet., 49; 29-34, 2004; Lee et al., Hum. Mol. Genet., 15, 1640-1649, 2006; Wei et al, Atherosclerosis, 190; 26-34, 2007; Krotz et al., Arterioscler. Thromb. Vasc. Biol., 24, 595-600, 2004] і запалення [Inceoglu et al., Life Sci., 79; 2311-2319, 2006]. Один з підходів до лікування таких станів передбачає використання переваги й корисного ефекту EET для інгібування дії sEH, тим самим запобігання деградації EET. У світлі ролі, яку sEH грає в деградації EET, бажано одержати сполуки, які інгібують його активність. Таким чином, існує потреба в ідентифікації сполук, які інгібують sEH, які можуть бути застосовані для лікування всіляких станів, опосередкованих ферментом sEH. Суть винаходу Винахід стосується нових інгібіторів sEH та їх застосування при лікуванні хвороб, опосередкованих ферментом sEH. Конкретно, винахід стосується сполук, що відповідають формулі I: Формула I 45 50 де R1, R2, R4, R5, R6, A, B, Y, n і m мають вказані нижче значення, та їхніх фармацевтично прийнятних солей. Сполуки за винаходом є інгібіторами sEH і можуть бути застосовні при лікуванні хвороб, опосередкованих ферментом sEH, таких як гіпертензія. Відповідно, винахід додатково стосується фармацевтичних композицій, що містять сполуки за винаходом. Винахід додатково відноситься ще до способів інгібування sEH і лікування станів, пов'язаних з ним, із застосуванням сполуки за винаходом або фармацевтичної композиції, що містить сполуки за винаходом. 1 UA 107444 C2 5 10 15 20 25 30 35 40 45 50 55 Детальний опис винаходу У описі винаходу хімічні елементи ідентифіковані відповідно до Періодичної системи елементів. Використовувані тут скорочення й символи знаходяться відповідно до загального вживання таких скорочень і символів фахівцями в галузі хімії й біології. Наприклад, наступні скорочення використані тут: "aq" є скороченням для слова водний, "BOP" є скороченням для гексафторфосфату (бензотриазол-1-ілокси)трис (диметиламіно)фосфонію, "°C" є скороченням для градусів Цельсія, "DIEA" є скороченням для діізопропілетиламіну, "DMAP" є скороченням для диметиламінопіридину, "DMF" є скороченням для диметилформаміду, "ДМСО" є скороченням для диметилсульфоксиду, "EDCl" є скороченням для гідрохлориду N-(3-диметиламінопропіл)-N'-етилкарбодиіміду, "екв." є скороченням для еквіваленту, "HPLC" є скороченням для рідинної хроматографії високого тиску, "г" є скороченням для грама або грамів, "л" є скороченням для літра або літрів, "LC-MS" є скороченням для терміну рідинна хроматографія - мас-спектрометрія, "мл" є скороченням для мілілітру або мілілітрів, "хвил" є скороченням для хвилини або хвилин, "ммоль" є скороченням для мілімолю або мілімолярного, "н." є скороченням для нормальності й належить до еквівалентів реагенту на літр розчину, "Ph" є скороченням для фенілу, "sat" є скороченням для насиченого, "TFA" є скороченням для трифтороцтової кислоти, "THF" є скороченням для тетрагідрофурану, Терміни й визначення "Алкіл" стосується одновалентного насиченого вуглеводневого ланцюга, що має обумовлене число членів-атомів. Наприклад, C1-8 алкіл відноситься до алкільної групи, що має від 1 до 8 членів-атомів. Алкільні групи можуть бути необов'язково заміщеними одним або декількома замісниками, які обумовлені тут. Алкільні групи можуть бути прямими або розгалуженими. Типові розгалужені алкільні групи мають одне, два або три відгалуження. Алкіл включає метил, етил, пропіл (н-пропіл та ізопропіл), бутил (н-бутил, ізобутил і трет-бутил), пентил (н-пентил, ізопентил і неопентил) і гексил. "Циклоалкіл" стосується одновалентного насиченого або ненасиченого вуглеводневого кільця, що має вказане число членів-атомів. Наприклад, C3-6 циклоалкіл стосується циклоалкільної групи, що має від 3 до 6 членів-атомів. Ненасичені циклоалкільні групи мають один або декілька вуглець-вуглецевих подвійних зв'язків у кільці. Циклоалкільні групи не є ароматичними. Циклоалкільні групи, що мають від 3 до 7 членів-атомів або менше, є моноциклічними кільцевими системами. Циклоалкільні групи, що мають щонайменше 7 членіватомів, можуть бути моноциклічними, зв'язаними містками або конденсованими біциклічними кільцевими системами. Циклоалкільні групи можуть бути необов'язково заміщеними одним або декількома замісниками, які обумовлені тут. Циклоалкіл включає циклопропіл, циклопропеніл, циклобутил, циклобутеніл, циклопентил, циклопентеніл, циклогексил, циклогексеніл, циклогептаніл і циклогептеніл. "Енантіомерно збагачений" відноситься до продуктів, енантіомерний надлишок яких більший за нуль. Наприклад, енантіомерно збагачений відноситься до продуктів, енантіомерний надлишок яких більш ніж 50 % її, більш ніж 75 % її і більш ніж 90 % ее. "Енантіомерний надлишок" або "ее" означає надлишок одного енантіомера в порівнянні з іншим, виражений у відсотках. Як результат, коли обидва енантіомери присутні в рівних кількостях у рацемічній суміші, енантіомерний надлишок дорівнює нулю (0 % ее). Проте, якщо один енантіомер збагачений так, що складає 95 % продукту, тоді енантіомерний надлишок буде 90 % ее (кількість збагаченого енантіомеру, 95 %, мінус кількість іншого енантіомеру, 5 %). "Енантіомерно чистий" відноситься до продуктів, енантіомерний надлишок яких дорівнює 99 % ее або більше. "Напівперіод виведення" відноситься до часу, необхідного для перетворення половини кількості речовини на інший хімічно відмітний різновид in vitro або in vivo. "Галоген" відноситься до галогену-радикала, як-от фтор, хлор, бром або йод. 2 UA 107444 C2 5 10 15 20 25 30 35 40 45 50 55 "Галогеналкіл" відноситься до алкільної групи, яка є заміщеною одним або декількома галоген-замісниками. Галогеналкіл включає трифторметил. "Гетероарил" відноситься до одновалентного ароматичного кільця, що містить від 1 до 4 гетероатомів як членів-атомів у кільці. Гетероарильні групи, що містять більш ніж один гетероатом, можуть містити різні гетероатоми. Гетероарильні групи можуть бути необов'язково заміщеними одним або декількома замісниками, які обумовлені тут. Якщо не обумовлене інше, гетероарильні групи є моноциклічними кільцевими системами або конденсованими, спіро або зв'язаними містками біциклічними кільцевими системами. Моноциклічні гетероарильні кільця мають 5 або 6 членів-атомів. Біциклічні гетероарильні кільця мають від 7 до 11 члени-атомів. Біциклічні гетероарильні кільця включають такі кільця, де феніл і моноциклічне гетероциклоалкільне кільце приєднані, утворюючи конденсовану, спіро або зв'язану містком біциклічну кільцеву систему, й такі кільця, де моноциклічне гетероарильне кільце й моноциклічне циклоалкільне, циклоалкенільне, гетероциклоалкільне або гетероарильне кільце зв'язані, утворюючи конденсовану, спіро або зв'язану містком біциклічну кільцеву систему. Гетероарил включає піроліл, піразоліл, імідазоліл, оксазоліл, ізоксазоліл, оксадіазоліл, тіазоліл, ізотіазоліл, тіадіазоліл, фураніл, фуразаніл, тієніл, триазоліл, піридиніл, піримідиніл, піридазиніл, піразиніл, тіазиніл, тетразиніл, тетразоліл, індоліл, ізоіндоліл, індолізиніл, індазоліл, пуриніл, хінолініл, ізохінолініл, хіноксалініл, хіназолініл, птеридиніл, цинолініл, бензимідазоліл, бензопіраніл, бензоксазоліл, бензизоксазоліл, бензофураніл, ізобензoфураніл, бензотіазоліл, бензизотіазоліл, бензoтієніл, фуропіридиніл і нафтиридиніл. "Гетероатом" відноситься до атома азоту, сірки або кисню. "Гетероциклоалкіл" відноситься до насиченого або ненасиченого кільця, що містить від 1 до 4 гетероатомів як членів-атомів у кільці. Проте гетероциклоалкільні кільця не є ароматичними. Гетероциклоалкільні групи, що містять більш ніж один гетероатом, можуть містити різні гетероатоми. Гетероциклоалкільні групи можуть бути необов'язково заміщеними одним або декількома замісниками, які обумовлені тут. Якщо не обумовлене інше, гетероциклоалкільні групи є моноциклічними, зв'язаними містками або кільцевими конденсуючими системами. Моноциклічні гетероциклоалкільні кільця мають від 4 до 7 членів-атомів. Зв'язані містками або біциклічні гетероциклоалкільні кільця мають від 7 до 11 членів-атомів. У деяких варіантах здійснення гетероциклоалкіл є насиченим. У інших варіантах здійснення гетероциклоалкіл є ненасиченим, але не ароматичним. Гетероциклоалкіл включає піролідиніл, тетрагідрофураніл, дигідрофураніл, піраніл, тетрагідропіраніл, дигідропіраніл, тетрагідротієніл, піразолідиніл, оксазолідиніл, тіазолідиніл, піперидиніл, гомопіперидиніл, піперазиніл, морфолініл, тіаморфолініл, азепініл, 1,3-діоксоланіл, 1,3-діоксаніл, 1,4-діоксаніл, 1,3-оксатіоланіл, 1,3оксатіаніліл, 1,3-дитіаніл, азетидиніл, азабіцикло[3,2,1]октил, азабіцикло[3,3,1]ноніл, азабіцикло[4,3,0]ноніл, оксабіцикло[2,2,1]гептил і фталімідил. "Члени-атоми" відносяться до атома або атомів, які утворюють ланцюг або кільце. Коли наявний більш ніж один член-атом у ланцюзі й у кільці, кожен член-атом ковалентний пов'язаний з сусіднім членом-атомом у ланцюзі або кільці. Атоми, які утворюють заміщаючу групу на ланцюзі або кільці, не є членами-атомами в ланцюзі або кільці. "Необов'язково заміщена" вказує не те, що група, така як алкіл, алкеніл, алкініл, арил, циклоалкіл, циклоалкеніл, гетероциклоалкіл або гетероарил, може бути незаміщеною або заміщеною одним або декількома замісниками, які обумовлені тут. "Заміщена" по відношенню до групи вказує на те, що атом водню, приєднаний до члена-атома в групі, заміщений. Має бути зрозуміло, що термін "заміщена" включає саму собою зрозумілу умову, що таке заміщення відбувається відповідно до допустимої валентності заміщеного атома й замісника і що заміщення має результатом стабільну сполуку (тобто сполуку, яка спонтанно не піддається трансформації, як-от перегрупування, циклізація або елімінування). В деяких варіантах здійснення один атом може бути заміщений більш ніж одним замісником, оскільки таке заміщення знаходиться відповідно до дозволеної валентності атома. Відповідні замісники вказані тут для кожної заміщеної або необов'язково заміщеної групи. "Фармацевтично прийнятний" відноситься до тих сполук, матеріалів, композицій і дозованих форм, які, відповідно до офіційного медичного висновку, є придатними для застосування в контакті з тканинами людини й тварин без зайвої токсичності, подразнення або інших проблем або ускладнень відповідно до раціонального відношення користь/ризик. Сполуки Винахід стосується сполук, що відповідають формулі I: 3 UA 107444 C2 Формула I 5 10 15 20 25 30 35 40 45 50 де: A представляє феніл або моноциклічний гетероарил; R1 незалежно вибраний з групи, що складається з таких членів, як: галоген, CN, Ra, ORb, C(О)ORc, C(O)NRcRc, NRcRc, NRcC(O)Rb, NRcS(O 2)Ra, SRb, S(O2)Ra і S(O2)NRcRc; n означає ціле число від 0 до 5; R2 означає H або C1-3 алкіл; m дорівнює 1 або 2; Z означає O або S; B означає C3-10 циклоалкіл; R4 означає H або C1-6 алкіл; Y означає R7, R8, R9, R10, R11 або R12; R5 означає H, R51, R52, R53, R54, R55, -C(О)Rb, -C(О)NRcRc, -S(О2)Ra або -S(O2)NRcRc; кожен R51 означає C1-6 алкіл, необов'язково заміщений одним або декількома замісниками, вибраними з групи, що складається з галогену, ORd, SRk, C(O) ORc, C(O) NReRe, NReRe, Rg, Rh, Ri, Rj; кожен R52 означає C3-6 циклоалкіл, необов'язково заміщений одним або декількома замісниками, вибраними з групи, що складається з галогену, ORd, SRd, C(O) ORc, C(O) NReRe, NReRe, C1-3 алкілу й C1-3 галогеналкілу; R53 означає моноциклічний гетероциклоалкіл, необов'язково заміщений одним або декількома C1-3 алкілами; R54 означає феніл, необов'язково заміщений одним або декількома замісниками, вибраними з групи, що складається з галогену, CN, Ra, ORb, C(О)ORc, C(О)NRcRc, NRcRc, NRcC(O)Rb, NRcS(O2)Ra, SRb, S(О2)Ra і S(O2)NReRe; R55 означає моноциклічний гетероарил, необов'язково заміщений одним або декількома замісниками, вибраними з групи, що складається з галогену, -CN, C1-3 алкілу, C1-3 галогеналкілу, ORd і NReRe; R6 означає H, R51 або R52; або R5 і R6, узяті разом з атомом азоту, до якого вони приєднані, утворюють насичене моноциклічне кільце, що має від 5 до 7 членів-атомів, де вказане кільце необов'язково містить один додатковий гетероатом як член-атом і де вказане кільце є необов'язково заміщеним одним або декількома замісниками, вибраними з групи, що складається з C1-3 алкілу, ORd і NRfRf; R7 означає C1-8 алкіл, необов'язково заміщений одним або декількома замісниками, вибраними з групи, що складається з галогену, ORd, SRd, NReRe, C 3-6 циклоалкілу, Ri і Rj; R8 означає C3-6 циклоалкіл, необов'язково заміщений одним або декількома замісниками, вибраними з групи, що складається з галогену, ORd, SRd, NReRe, C 1-3 алкілу й C1-3 галогеналкілу; R9 - моноциклічний гетероциклоалкіл, необов'язково заміщений одним або декількома C 1-3 алкілами; R10 означає феніл, необов'язково заміщений одним або декількома замісниками, вибраними з групи, що складається з галогену, CN, Ra, ORb, C(О)ORc, C(O)NReRe, NReRe, NRcC(O)Rb, NRcS(O2)Ra, SRb, S(O2)Ra і S(O2)NRcRc; R11 означає гетероарил, необов'язково заміщений одним або декількома замісниками, вибраними з групи, що складається з галогену, CN, Ra, ORb, C(О)ORc, C(О)NReRe, NReRe, NRcC(О)Rb, NRcS(O2)Ra, SRb, S(O2)Ra і S(O2)NRcRc; R12 означає -OR8, -OR9, -OR10, -OR11, -SR7, -SR8, -SR9, -SR10 або SR11; кожен Ra незалежно представляє C1-6 алкіл або C1-6 галогеналкіл; кожен Rb незалежно представляє H, C1-6 алкіл або C1-6 галогеналкіл; кожен Rс незалежно представляє H або C1-6 алкіл; де дві групи Rс приєднано до атома азоту; 4 UA 107444 C2 5 10 15 20 25 30 35 40 45 50 55 обидві групи Rс, незалежно в кожному випадку, узяті разом з атомом азоту, до якого вони приєднані, утворюють насичене моноциклічне кільце, що має від 5 до 7 члени-атомів, де вказане кільце необов'язково містить один додатковий гетероатом як член-атом і де вказане кільце є необов'язково заміщеним одним або декількома замісниками, вибраними з групи, що складається з C1-3 алкілу, ORd, і NRfRf; кожен Rd незалежно представляє H, C1-3 алкіл або C1-3 галогеналкіл; кожен Re незалежно представляє H, C1-3 алкіл, CH2-CF3; або обидві групи Re, незалежно в кожному випадку, узяті разом з атомом азоту, до якого вони приєднані, утворюють насичене моноциклічне кільце, що має від 5 до 7 члени-атомів, де вказане кільце необов'язково містить один додатковий гетероатом як член-атом і де вказане кільце є необов'язково заміщеним одним або декількома замісниками, вибраними з групи, що складається з C1-3 алкілу, ORd і NRfRf; кожен Rf незалежно представляє H або C1-3 алкіл; кожен Rg означає C3-6 циклоалкіл, необов'язково заміщений одним або декількома замісниками, вибраними з групи, що складається з галогену, ORd, SRd, C(O)ORc, C(O)NReRe, NReRe і C1-3 алкілу; кожен Rh означає моноциклічний гетероциклоалкіл, необов'язково заміщений одним або декількома C1-3 алкілами; кожен Ri означає феніл, необов'язково заміщений одним або декількома замісниками, вибраними з групи, що складається з галогену, -CN, C1-3 алкілу, C1-3 галогеналкілу, ORd і NReRe; кожен Rj означає моноциклічний гетероарил, необов'язково заміщений одним або декількома замісниками, вибраними з групи, що складається з галогену, -CN, C1-3 алкілу, C1-3 галогеналкілу, ORd і NReRe; і кожен Rk незалежно представляє H, C1-3 алкіл, C1-3 галогеналкіл або бензил, необов'язково заміщений одним або декількома замісниками, вибраними з групи, що складається з галогену, CN, C1-3 алкілу, C1-3 галогеналкілу, ORd і NReRe; або їхніх фармацевтично прийнятних солей. Значення будь-якої функціональної групи або замісника на ній у будь-якому випадку у Формулі I або будь-якій її субформулі є незалежним від їх значення або значення будь-якої іншої функціональної групи або замісника в будь-якому іншому випадку, якщо не обумовлене інше. Сполуки, що відповідають формулі I, можуть містити один або декілька асиметричних центрів (згадуваних також як хіральні центри) і тому можуть існувати як окремі енантіомери, діастереомери або інші стереоізомерні форми або як їх суміші. Хіральні центри, такі як хіральні атоми вуглеці, можуть бути також наявними в заміснику, такому як алкільна група. Коли стереохімія хірального центру, наявного у Формулі I або в якій-небудь хімічній структурі, що ілюструється тут, точно не визначена, структура призначена для того, щоб охоплювати будьякий стереоізомер і всі їх суміші. Так, сполуки, що відповідають формулі I, містять один або декілька хіральних центрів, можуть бути використані як рацемічні суміші, енантіомерно збагачені суміші або як енантіомерно чисті окремі стереоізомери. Окремі стереоізомери сполуки, що відповідає формулі I, які містять один або декілька асиметричних центрів, можуть бути розділені способами, відомими фахівцям у цій галузі. Наприклад, таке розділення може бути здійснене (1) шляхом утворення діастереоізомерних солей, комплексів або інших похідних; (2) шляхом селективної реакції із специфічним для стереоізомера реагентом, наприклад ферментативним окисленням або відновленням, або (3) газо-рідинною або рідинною хроматографією в хіральному середовищі, наприклад, на хіральном носієві, такому як діоксид кремнію із зв'язаним хіральним лігандом, або у присутності хірального розчинника. Досвідчений фахівець враховуватиме, що, коли бажаний стереоізомер перетворюють на інший хіральний різновид шляхом однієї з указаних процедур розділення, потрібна додаткова стадія для вивільнення бажаної форми. Як варіант, конкретні стереоізомери можуть бути синтезовані шляхом асиметричного синтезу з використанням оптично активних реагентів, субстратів, каталізаторів або розчинників або шляхом перетворення одного енантіомера на іншій шляхом асиметричного перетворення. Сполуки, що відповідають формулі I, можуть також містити подвійні зв'язки або інші центри геометричної асиметрії. Коли стереохімія центру геометричної асиметрії, присутнього у Формулі I або в якій-небудь хімічній структурі, що ілюструється тут, точно не визначена, структура призначена для того, щоб охоплювати транс (Е) геометричний ізомер, цис (Z) геометричний ізомер і всі їх суміші. Так само, всі таутомерні форми також включені у Формулу I, чи то існують такі таутомери в рівновазі, чи то переважно в одній формі. 5 UA 107444 C2 5 10 15 20 25 30 35 40 45 50 55 60 У деяких варіантах здійснення сполуки, що відповідають формулі I, можуть містити кислотну функціональну групу й тому бути здатними до утворення фармацевтично прийнятних адитивних солей з основами шляхом обробки відповідною основою. В деяких інших варіантах здійснення сполуки, що відповідають формулі I, можуть містити функціональну групу основного характеру й тому бути здатними до утворення фармацевтично прийнятних адитивних солей з кислотами шляхом обробки відповідною кислотою. Таким чином, досвідчений фахівець матиме на увазі, що можуть бути одержані фармацевтично прийнятні солі сполук, що відповідають формулі I. Дійсно, в деяких варіантах здійснення винаходу фармацевтично прийнятні солі сполук, що відповідають формулі I, можуть бути переважніше відповідної вільної основи або вільної кислоти, тому що такі солі додають вищу стабільність або розчинність молекулі, тим самим полегшуючи введення до складу дозованої форми. Відповідно, винахід додатково стосується фармацевтично прийнятних солей сполук, що відповідають формулі. Використовуваний тут термін "фармацевтично прийнятні солі" відноситься до солей, які зберігають бажану біологічну активність відповідної сполуки і виявляють мінімальні небажані токсикологічні ефекти. Такі фармацевтично прийнятні солі можуть бути одержані in situ під час остаточної ізоляції й очищення сполуки або шляхом окремої взаємодії очищеної сполуки у формі її вільної кислоти або вільної основи з відповідною основою або кислотою, відповідно. Унаслідок їх потенційного застосування в медицині солі сполук формули (I) є переважно фармацевтично прийнятними. Придатні фармацевтично прийнятні солі включають адитивні солі з кислотами або основами. Фармацевтично прийнятна адитивна сіль з кислотою може бути утворена при взаємодії сполуки формули (I) з відповідною неорганічною або органічною кислотою (як-от бромоводнева, хлороводнева, сірчана, азотна, фосфорна, янтарна, малеїнова, мурашина, оцетова, пропіонова, фумарова, лимонна, виннокам'яна, молочна, бензойна, саліцилова, глутамінова, аспарагінова, п-толуолсульфонова, бензолсульфонова, метансульфонова, етансульфонова, нафталінсульфонова, як-от 2-нафталінсульфонова, або гексанова кислота) необов'язково в придатному розчиннику, такому як органічний розчинник, щоб одержати сіль, яку зазвичай ізолюють, наприклад кристалізацією й фільтруванням. Фармацевтично прийнятна адитивна сіль з кислотою сполуки формули (I) може містити або бути, наприклад, такою як гідробромід, гідрохлорид, сульфат, нітрат, фосфат, сукцинат, малеат, форміат, ацетат, пропіонат, фумарат, цитрат, тартрат, лактат, бензоат, саліцилат, глутамат, аспартат, п-толуолсульфонат, бензолсульфонат, метансульфонат, етансульфонат, нафталінсульфонат (наприклад, 2нафталінсульфонат) або гексаноат. Фармацевтично прийнятна адитивна сіль з основою може бути утворена при взаємодії сполуки формули (I) з відповідною неорганічною або органічною основою (наприклад, як-от триетиламін, етаноламін, триетаноламін, холін, аргінін, лізин або гістидин) необов'язково у відповідному розчиннику, такому як органічний розчинник, щоб одержати адитивну сіль з основою, яку зазвичай ізолюють, наприклад, кристалізацією й фільтруванням. Інші придатні фармацевтично прийнятні солі включають фармацевтично прийнятні солі металів, наприклад фармацевтично прийнятні солі лужних або лужноземельних металів, такі як солі натрію, калію, кальцію або магнію, особливо, фармацевтично прийнятні солі металів з частинами молекул однієї або декількох карбонових кислот, які можуть бути присутніми у сполуці формули (I). Інші фармацевтично неприйнятні солі, наприклад оксалати, можуть бути використані, наприклад, при ізоляції сполуки за винаходом, і вони включені у сферу дії винаходу. Винахід включає у сферу своєї дії всі можливі стехіометричні й нестехіометричні форми солей сполуки формули (I). Використовуваний тут термін "сполуки за винаходом" означає як сполуки, що відповідають формулі I, так і їхні фармацевтично прийнятні солі. Термін "сполуки за винаходом" також зустрічається тут і відноситься як до сполуки, що відповідає формулі I, так і до її фармацевтично прийнятних солей. У твердому стані сполуки за винаходом можуть існувати в кристалічній, напівкристалічній і аморфній формах, а також як їх суміші. Фахівець враховуватиме, що можуть бути одержані фармацевтично прийнятні сольвати сполуки за винаходом, коли молекули розчинника об'єднуються із структурою твердого стану під час кристалізації. Сольвати можуть залучати воду або неводні розчинники або їх суміші. На додаток, уміст розчинника в таких сольватах може змінюватися у відповідь на довкілля і при зберіганні. Наприклад, вода може витісняти інший розчинник з часом залежно від відносної вологості й температури. Сольвати, в яких вода є розчинником, який об'єднаний із структурою твердого стану, зазвичай називають "гідратами". Сольвати, в яких більш ніж один розчинник об'єднаний зі 6 UA 107444 C2 5 10 15 20 25 30 35 40 45 50 55 60 структурою твердого стану, зазвичай називають як "змішані сольвати". Сольвати включають "стехіометричні сольвати", а також композиції, що містять змінні кількості розчинника (так звані "нестехіометричні сольвати"). Стехіометричні сольвати, в яких вода є розчинником, який об'єднаний із структурою твердого стану, зазвичай називають "стехіометричними гідратами". Винахід включає і стехіометричні, й нестехіометричні сольвати. На додаток, кристалічні форми сполуки за винаходом, включаючи їх сольвати, можуть містити молекули розчинника, які не об'єднані із структурою твердого стану. Наприклад, молекули розчинника можуть бути захоплені кристалами при ізоляції. На додаток, молекули розчинника можуть стримуватися на поверхні кристалів. Винахід включає такі форми. Фахівець додатково має брати до уваги, що сполуки за винаходом, включаючи їхні сольвати, можуть виявляти поліморфізм (тобто здатність зустрічатися в різних формах порядку кристалічної упаковки). Ці різні кристалічні форми зазвичай відомі як "поліморфи". Винахід включає всі такі поліморфи. Поліморфи мають той самий хімічний склад, але відрізняються за упаковкою, геометричним порядком й іншими наочними властивостями кристалічного твердого стану. Полімори, отже, можуть мати відмітні фізичні властивості, як-от щільність, твердість, деформованість, стабільність і властивості розчинення. Поліморфи зазвичай виявляють різні ІЧ спектри й діаграми, які можуть бути використані для ідентифікації. Поліморфи також виявляють різні температури плавлення, які можуть бути використані для ідентифікації. Фахівець враховуватиме, що різні поліморфи можуть бути одержані, наприклад, шляхом зміни або пристосування умов реакції або реагентів, використовуваних при одержанні сполуки. Наприклад, зміни температури, тиску або розчинника можуть приводити до одержання різних поліморфів. На додаток, один поліморф може спонтанно перетворитися на інший поліморф за конкретних умов. Типові варіанти здійснення У одному варіанті здійснення: A означає феніл, тіофеніл або піридил; R1 означає CF3, галоген, OCF3, CN, OC1-6 алкіл, морфолінo, CO2H або N(CH3)2; n дорівнює 1, 2 або 3; B означає циклогексил; R4 означає водень; Z означає О; Y означає C1-3 алкіл, феніл, тіофеніл або піридил; де феніл, тіофеніл або піридил може бути заміщеними групами -CO2H, SO2Me, CF3, галоген або CN; R5 означає водень або C1-6 алкіл; і R6 означає водень або C1-6 алкіл. У іншому варіанті здійснення: A означає феніл; R1 означає CF3, галоген, OCF3, CN, OC1-6 алкіл або морфолінo; n дорівнює 1 або 2; B означає циклогексил; R4 означає водень; Z означає О; Y означає метил; R5 означає водень і R6 означає метил. Конкретні приклади сполук за даним винаходом включають наступні: цис-4-{[4-(метиламіно)-6-(3-піридиніл)-1,3,5-триазин-2-іл]аміно}-N-{[2(трифторметил)феніл]метил}циклогексанкарбоксамід; цис-4-{[4-(метиламіно)-6-феніл-1,3,5-триазин-2-іл]аміно}-N-{[2(трифторметил)феніл]метил}циклогексанкарбоксамід; цис-4-{[4-(метиламіно)-6-(3-тієніл)-1,3,5-триазин-2-іл]аміно}-N-{[2(трифторметил)феніл]метил}циклогексанкарбоксамід; цис-4-{[4-[4-(1,1-диметилетил)феніл]-6-(метиламіно)-1,3,5-триазин-2-іл]аміно}-N-{[2(трифторметил)феніл]метил}циклогексанкарбоксамід; цис-4-{[4-(2-фторфеніл)-6-(метиламіно)-1,3,5-триазин-2-іл]аміно}-N-{[2(трифторметил)феніл]метил}циклогексанкарбоксамід; цис-4-{[4-(4-ціанофеніл)-6-(метиламіно)-1,3,5-триазин-2-іл]аміно}-N-{[2(трифторметил)феніл]метил}циклогексанкарбоксамід; цис-4-({4-(метиламіно)-6-[4-(метилсульфоніл)феніл]-1,3,5-триазин-2-іл}аміно)-N-({2[(трифторметил)окси]феніл}метил)циклогексанкарбоксамід; 7 UA 107444 C2 5 10 15 20 25 30 35 40 45 50 55 60 цис-4-{[4-(метиламіно)-6-(3-піридиніл)-1,3,5-триазин-2-іл]аміно}-N-({2[(трифторметил)окси]феніл}метил)циклогексанкарбоксамід; цис-4-({4-(метиламіно)-6-[4-(трифторметил)феніл]-1,3,5-триазин-2-іл}аміно)-N-({2[(трифторметил)окси]феніл}метил)циклогексанкарбоксамід; 3-{4-(метиламіно)-6-[(цис-4-{[({2[(трифторметил)окси]феніл}метил)аміно]карбоніл}циклогексил)аміно]-1,3,5-триазин-2іл}бензойна кислота; 3-[4-(метиламіно)-6-({цис-4-[({[4-(метилокси)-2(трифторметил)феніл]метил}аміно)карбоніл]циклогексил}аміно)-1,3,5-триазин-2-іл]бензойна кислота; цис-4-({4-(метиламіно)-6-[4-(трифторметил)феніл]-1,3,5-триазин-2-іл}аміно)-N-{[4(метилокси)-2-(трифторметил)феніл]метил}циклогексанкарбоксамід; цис-4-{[4-(метиламіно)-6-(3-піридиніл)-1,3,5-триазин-2-іл]аміно}-N-{[4-(метилокси)-2(трифторметил)феніл]метил}циклогексанкарбоксамід; цис-4-({4-(метиламіно)-6-[4-(метилсульфоніл)феніл]-1,3,5-триазин-2-іл}аміно)-N-{[4(метилокси)-2-(трифторметил)феніл]метил}циклогексанкарбоксамід; 3-[4-(метиламіно)-6-({цис-4-[({[4-(трифторметил)-3піридиніл]метил}аміно)карбоніл]циклогексил}аміно)-1,3,5-триазин-2-іл]бензойна кислота; цис-4-({4-(метиламіно)-6-[4-(трифторметил)феніл]-1,3,5-триазин-2-іл}аміно)-N-{[4(трифторметил)-3-піридиніл]метил}циклогексанкарбоксамід; цис-4-{[4-(метиламіно)-6-(3-піридиніл)-1,3,5-триазин-2-іл]аміно}-N-{[4-(трифторметил)-3піридиніл]метил}циклогексанкарбоксамід; цис-4-({4-(метиламіно)-6-[4-(метилсульфоніл)феніл]-1,3,5-триазин-2-іл}аміно)-N-{[4(трифторметил)-3-піридиніл]метил}циклогексанкарбоксамід; 3-[4-{[цис-4-({[(2-хлор-4-ціанофеніл)метил]аміно}карбоніл)циклогексил]аміно}-6(метиламіно)-1,3,5-триазин-2-іл]бензойна кислота; цис-N-[(2-хлор-4-ціанофеніл)метил]-4-{[4-(метиламіно)-6-(3-піридиніл)-1,3,5-триазин-2іл]аміно}циклогексанкарбоксамід; цис-4-({4-[(2-гідроксіетил)аміно]-6-метил-1,3,5-триазин-2-іл}аміно)-N-{[2(трифторметил)феніл]метил}циклогексанкарбоксамід; цис-4-{[4-метил-6-(4-метил-1-пиперазиніл)-1,3,5-триазин-2-іл]аміно}-N-{[2(трифторметил)феніл]метил}циклогексанкарбоксамід; цис-4-({4-метил-6-[(фенілметил)аміно]-1,3,5-триазин-2-іл}аміно)-N-{[2(трифторметил)феніл]метил}циклогексанкарбоксамід; цис-4-[(4-метил-6-{[2-(метилокси)етил]аміно}-1,3,5-триазин-2-іл)аміно]-N-{[2(трифторметил)феніл]метил}циклогексанкарбоксамід; цис-4-{[4-(диметиламіно)-6-метил-1,3,5-триазин-2-іл]аміно}-N-{[2(трифторметил)феніл]метил}циклогексанкарбоксамід; цис-4-{[4-метил-6-(1-піперидиніл)-1,3,5-триазин-2-іл]аміно}-N-{[2(трифторметил)феніл]метил}циклогексанкарбоксамід; цис-4-[(4-аміно-6-метил-1,3,5-триазин-2-іл)аміно]-N-{[2(трифторметил)феніл]метил}циклогексанкарбоксамід; N-[(2,4-дихлорфеніл)метил]-3-{[4-метил-6-(метиламіно)-1,3,5-триазин-2іл]аміно}циклогексанкарбоксамід; цис-3-{[4-метил-6-(метиламіно)-1,3,5-триазин-2-іл]аміно}-N-{[2(трифторметил)феніл]метил}циклогексанкарбоксамід; цис-3-{[4-метил-6-(метиламіно)-1,3,5-триазин-2-іл]аміно}-N-({2[(трифторметил)окси]феніл}метил)циклогексанкарбоксамід; цис-N-{[4-хлор-2-(трифторметил)феніл]метил}-3-{[4-метил-6-(метиламіно)-1,3,5-триазин-2іл]аміно}циклогексанкарбоксамід; (цис)-N-({2-хлор-4-[(метилсульфоніл)аміно]феніл}метил)-3-{[4-метил-6-(метиламіно)-1,3,5триазин-2-іл]аміно}циклогексанкарбоксамід; (цис)-N-{[2-хлор-4-(диметиламіно)феніл]метил}-3-{[4-метил-6-(метиламіно)-1,3,5-триазин-2іл]аміно}циклогексанкарбоксамід; (цис)-N-[(2-хлор-4-ціанофеніл)метил]-3-{[4-метил-6-(метиламіно)-1,3,5-триазин-2іл]аміно}циклогексанкарбоксамід; (цис)-N-{[2-хлор-4-(1H-тетразол-5-іл)феніл]метил}-3-{[4-метил-6-(метиламіно)-1,3,5-триазин2-іл]аміно}циклогексанкарбоксамід; (цис)-3-{[4-метил-6-(метиламіно)-1,3,5-триазин-2-іл]аміно}-N-{[3-(трифторметил)-4піридиніл]метил}циклогексанкарбоксамід; 8 UA 107444 C2 5 10 15 20 25 30 35 40 45 50 55 60 (цис)-3-{[4-(2-фторфеніл)-6-(метиламіно)-1,3,5-триазин-2-іл]аміно}-N-{[2(трифторметил)феніл]метил}циклогексанкарбоксамід; (цис)-3-{[4-(4-фторфеніл)-6-(метиламіно)-1,3,5-триазин-2-іл]аміно}-N-{[2(трифторметил)феніл]метил}циклогексанкарбоксамід; (цис)-3-{[4-(4-ціанофеніл)-6-(метиламіно)-1,3,5-триазин-2-іл]аміно}-N-{[2(трифторметил)феніл]метил}циклогексанкарбоксамід; (цис)-4-{[4-метил-6-(метиламіно)-1,3,5-триазин-2-іл]аміно}-N-{[2(трифторметил)феніл]метил}циклогексанкарбоксамід; цис-4-{[4-метил-6-(метиламіно)-1,3,5-триазин-2-іл]аміно}-N-({2[(трифторметил)окси]феніл}метил)циклогексанкарбоксамід; цис-N-[(2,4-дихлорфеніл)метил]-4-{[4-метил-6-(метиламіно)-1,3,5-триазин-2іл]аміно}циклогексанкарбоксамід; цис-N-{[4-хлор-2-(трифторметил)феніл]метил}-4-{[4-метил-6-(метиламіно)-1,3,5-триазин-2іл]аміно}циклогексанкарбоксамід; цис-4-{[4-метил-6-(метиламіно)-1,3,5-триазин-2-іл]аміно}-N-({2[(трифторметил)тіо]феніл}метил)циклогексанкарбоксамід; транс-4-{[4-метил-6-(метиламіно)-1,3,5-триазин-2-іл]аміно}-N-{[2(трифторметил)феніл]метил}циклогексанкарбоксамід; транс-4-{[4-метил-6-(метиламіно)-1,3,5-триазин-2-іл]аміно}-N-({2[(трифторметил)окси]феніл}метил)циклогексанкарбоксамід; цис-4-{метил[4-метил-6-(метиламіно)-1,3,5-триазин-2-іл]аміно}-N-{[2(трифторметил)феніл]метил}циклогексанкарбоксамід; цис-4-{метил[4-метил-6-(метиламіно)-1,3,5-триазин-2-іл]аміно}-N-({2[(трифторметил)окси]феніл}метил)циклогексанкарбоксамід; цис-N-[(2,4-дихлорфеніл)метил]-4-{метил[4-метил-6-(метиламіно)-1,3,5-триазин-2іл]аміно}циклогексанкарбоксамід; цис-N-{[4-хлор-2-(трифторметил)феніл]метил}-4-{метил[4-метил-6-(метиламіно)-1,3,5триазин-2-іл]аміно}циклогексанкарбоксамід; транс-4-{[4-(метиламіно)-6-феніл-1,3,5-триазин-2-іл]аміно}-N-{[2(трифторметил)феніл]метил}циклогексанкарбоксамід; транс-4-{[4-(метиламіно)-6-феніл-1,3,5-триазин-2-іл]аміно}-N-({2[(трифторметил)окси]феніл}метил)циклогексанкарбоксамід; транс-N-[(2,4-дихлорфеніл)метил]-4-{[4-(метиламіно)-6-феніл-1,3,5-триазин-2іл]аміно}циклогексанкарбоксамід; транс-N-{[4-хлор-2-(трифторметил)феніл]метил}-4-{[4-(метиламіно)-6-феніл-1,3,5-триазин-2іл]аміно}циклогексанкарбоксамід; цис-4-{метил[4-(метиламіно)-6-феніл-1,3,5-триазин-2-іл]аміно}-N-{[2(трифторметил)феніл]метил}циклогексанкарбоксамід; цис-4-{метил[4-(метиламіно)-6-феніл-1,3,5-триазин-2-іл]аміно}-N-({2[(трифторметил)окси]феніл}метил)циклогексанкарбоксамід; цис-N-[(2,4-дихлорфеніл)метил]-4-{метил[4-(метиламіно)-6-феніл-1,3,5-триазин-2іл]аміно}циклогексанкарбоксамід; цис-N-{[4-хлор-2-(трифторметил)феніл]метил}-4-{метил[4-(метиламіно)-6-феніл-1,3,5триазин-2-іл]аміно}циклогексанкарбоксамід; 3-{[4-(метиламіно)-6-феніл-1,3,5-триазин-2-іл]аміно}-N-{[2(трифторметил)феніл]метил}циклогексанкарбоксамід; 3-{[4-(метиламіно)-6-феніл-1,3,5-триазин-2-іл]аміно}-N-({2[(трифторметил)окси]феніл}метил)циклогексанкарбоксамід; N-[(2,4-дихлорфеніл)метил]-3-{[4-(метиламіно)-6-феніл-1,3,5-триазин-2іл]аміно}циклогексанкарбоксамід; N-{[4-хлор-2-(трифторметил)феніл]метил}-3-{[4-метил-6-(метиламіно)-1,3,5-триазин-2іл]аміно}циклогексанкарбоксамід; цис-N-[(2,4-дихлорфеніл)метил]-4-{[4-(метиламіно)-6-феніл-1,3,5-триазин-2іл]аміно}циклогексанкарбоксамід; 4-{[({цис-4-[(4-(метилтіо)-6-{[(2R)-2-фенілпропіл]аміно}-1,3,5-триазин-2-іл)аміно]циклогексил}карбоніл)аміно]метил}бензойна кислота; цис-N-({4-бром-2-[(трифторметил)окси]феніл}метил)-3-{[4-метил-6-(метиламіно)-1,3,5триазин-2-іл]аміно}циклогексанкарбоксамід; цис-3-{[4-метил-6-(метиламіно)-1,3,5-триазин-2-іл]аміно}-N-({4-(4-морфолініл)-2[(трифторметил)окси]феніл}метил)циклогексанкарбоксамід; 9 UA 107444 C2 5 10 15 20 25 цис-3-{[4-метил-6-(метиламіно)-1,3,5-триазин-2-іл]аміно}-N-({4-(1-піперидиніл)-2[(трифторметил)окси]феніл}метил)циклогексанкарбоксамід; цис-3-{[4-метил-6-(метиламіно)-1,3,5-триазин-2-іл]аміно}-N-({4-(1-піролідиніл)-2[(трифторметил)окси]феніл}метил)циклогексанкарбоксамід; цис-N-{[2-хлор-4-(1-піперидиніл)феніл]метил}-3-{[4-метил-6-(метиламіно)-1,3,5-триазин-2іл]аміно}циклогексанкарбоксамід; (цис)-3-{[4-метил-6-(метиламіно)-1,3,5-триазин-2-іл]аміно}-N-{[4-(метилокси)-2(трифторметил)феніл]метил}циклогексанкарбоксамід; (цис)-N-{[4-фтор-2-(трифторметил)феніл]метил}-3-{[4-метил-6-(метиламіно)-1,3,5-триазин-2іл]аміно}циклогексанкарбоксамід; і (цис)-N-{[4-ціано-2-(трифторметил)феніл]метил}-3-{[4-метил-6-(метиламіно)-1,3,5-триазин-2іл]аміно}циклогексанкарбоксамід. Одержання сполуки Сполуки, що відповідають формулі I, одержують шляхом традиційних органічних синтезів. Відповідні шляхи синтезу описані нижче на наступних загальних схемах реакції. Всі функціональні групи мають значення, вказані у формулі I, якщо не обумовлено інакше. Вихідні матеріали й реагенти, вказані нижче, комерційно доступні або можуть бути отримані з комерційно доступних вихідних матеріалів із застосуванням відомих фахівцям способів. Фахівець має враховувати, що, якщо вказаний тут замісник несумісний з описаними тут способами синтезу, замісник може бути захищений відповідною захисною групою, яка є стабільною в умовах реакції. Захисна група може бути видалена у відповідний момент у реакційній послідовності, щоб забезпечити бажану проміжну сполуку або цільову сполуку. Придатні захисні групи й способи захисту й усунення захисту різних замісників, для захисту яких використані відповідні захисні групи, добре відомі фахівцям, приклади груп можна знайти в T. Greene and P. Wuts, Protecting Groups in Chemical Synthesis (3rd ed.) John Wiley & Sons, NY (1999). В деяких випадках замісник може бути специфічно вибраний, щоб він був реакційноздатний у використовуваних умовах реакції. За таких обставин умови реакції перетворюють вибраний замісник на інший замісник, який або застосовний як проміжна сполука, або є бажаним замісником у цільовій сполуці. 30 35 40 Схема 1 представляє загальну схему реакції одержання проміжної сполуки 1.7. Bocзахищена амінокислота 1.1 може бути одержана обробкою відповідної амінокислоти (комерційно доступної або отриманої з комерційно доступних вихідних матеріалів із застосуванням способів, відомих фахівцям) Boc2О і основою (як-от NаOH) у розчиннику (такому як 1,4-діоксан і вода) при температурах між 0 і 50 °C. Коли потрібно, щоб R4 був R41 або R42, алкілування boc-захищеної амінокислоти 1.1 з використанням R4-галогеніду (комерційно доступного або отриманого з комерційно доступних вихідних матеріалів із застосуванням способів, відомих фахівцям у цій галузі) й основ (як-от NаH) у розчиннику (такому як DMF) при температурах між 0 і 50 °C забезпечує boc-захищену амінокислоту 1.2. Амідна проміжна сполука 10 UA 107444 C2 5 10 1.4 може бути одержана обробкою проміжних сполук 1.1 або 1.2 аміном 1.3 (комерційно доступним або отриманим з комерційно доступних вихідних матеріалів із застосуванням способів, відомих фахівцям у цій галузі) й амідним реагентом сполучення (таким як EDCl або BOP) у розчиннику (як-от DMF) при кімнатній температурі. Гідроліз boc-захисної групи проміжної сполуки 1.4 може бути здійснений із застосуванням TFA, щоб забезпечити проміжну сполуку 1.5. Дихлортриазинова проміжна сполука 1.6 може бути синтезована шляхом обробки ціанурхлориду (комерційно доступний) 1 еквівалентом проміжної сполуки 1.5 і основою (як-от NаOH або основа Хюніга) в розчиннику (як-от MеCN і вода) при 0 °C. Подальше додавання 1 еквіваленту HNR5R6 (комерційно доступного або отриманого з комерційно доступних вихідних матеріалів із застосуванням способів, відомих фахівцям у цій галузі) й основи (як-от NаOH або основа Хюніга) в розчиннику (такому як MеCN і вода) при температурах між 25 і 50 °C забезпечує моно-хлортриазин 1.7. 15 20 Схема 2 представляє загальну схему реакції одержання деяких сполук, що відповідають формулі I. Моно-хлортриазин 2.1 (вказаний вище як проміжна сполука 1.7) може бути оброблений YB(ОН)2 (комерційно доступним або отриманим з комерційно доступних вихідних матеріалів із застосуванням способів, відомих фахівцям у цій галузі), джерелом паладію (таким як PdCl2(dppf)2) і основою (як-от K2CO3) в розчиннику (такому як THF) при температурах між 80 і 170 °C (термічне або мікрохвильове нагрівання), щоб забезпечити сполуку, що відповідають формулі I, де Y означає R7, R8, R9, R10 або R11. 25 11 UA 107444 C2 5 10 15 20 Схема 3 представляє загальну схему реакції одержання деяких сполук, що відповідають формулі I. Boc-захищена амінокислота 3.1 може бути одержана обробкою відповідної амінокислоти (комерційно доступної або отриманої з комерційно доступних вихідних матеріалів із застосуванням способів, відомих фахівцям у цій галузі) Boc 2O і основою (як-от NаOH) у розчиннику (такому як 1,4-діоксан і вода) при температурах між 0 і 50 °C. Коли потрібно, щоб R4 був R41 або R42, алкілування boc-захищеної амінокислоти 3.1 із застосуванням R4-галогеніду (комерційно доступного або отриманого з комерційно доступних вихідних матеріалів із застосуванням способів, відомих фахівцям у цій галузі) й основ (як-от NаH) у розчиннику (як-от DMF) при температурах між 0 і 50 °C забезпечує boc-захищену амінокислоту 3.2. Подальший гідроліз boc-захищеної групи проміжної сполуки 3.2 може бути здійснений із застосуванням TFA з утворенням амінокислоти 3.3. 2,4-Дихлортриазин 3.4 може бути синтезований при додаванні 1 еквіваленту відповідного реагенту Гриньяра (комерційно доступного або отриманого з комерційно доступних вихідних матеріалів із застосуванням способів, відомих фахівцям у цій галузі) до ціанурхлориду (комерційно доступний) у розчиннику (такому як THF) при 0 °C. Проміжну сполуку 3.4 може бути оброблено 1 еквівалентом HNR5R6 (комерційно доступним або отриманим з комерційно доступних вихідних матеріалів із застосуванням способів, відомих фахівцям у цій галузі) й основою (як-от NаOH або основа Хюніга) в розчиннику (як-от MеCN і вода) при температурах між 25 і 50 °C. Одержану проміжну сполуку 3.5 може бути піддано взаємодії з надлишком амінокислоти 3.3 при підвищеній температурі (60-90 °C) в розчиннику (такому як MеCN і вода) до одержання карбонової кислоти 3.6. Проміжну сполуку 3.6 може бути оброблено аміном 3.7 (комерційно доступним або отриманим з комерційно доступних вихідних матеріалів із застосуванням способів, відомих фахівцям у цій галузі) й реагентом сполучення (таким як EDCl або BOP) в розчиннику (такому як DMF) при кімнатній температурі до одержання сполук, що відповідають формулі I, де Y означає R7, R8, R9, R10 або R11. 25 30 35 Схема 4 представляє загальну схему реакції одержання деяких сполук, що відповідають формулі I. 2,4-Дихлортриазин 4.1 може бути синтезований при додаванні 1 еквіваленту відповідного реагенту Гриньяра (комерційно доступного або отриманого з комерційно доступних вихідних матеріалів із застосуванням способів, відомих фахівцям у цій галузі) до ціанурхлориду (комерційно доступний) при 0 °C в розчиннику (такому як THF). Проміжні сполуки 4.1 можуть бути оброблені 1 еквівалентом аміду 4.3 (вказаного вище як проміжна сполука 1.5) і основою (як-от NаOH або основа Хюніга) в розчиннику (такому як MеCN і вода) при температурах між 25 і 50 °C, щоб одержати моно-хлортриазин 4.4. Проміжна сполука 4.4 може бути оброблена надлишком HNR5R6 (комерційно доступний або отриманий з комерційно доступних вихідних матеріалів із застосуванням способів, відомих фахівцям у цій галузі) й основою (як-от NаOH або основа Хюніга) в розчиннику (такому як MеCN і вода) при підвищеній температурі (60-80 °C), щоб забезпечити сполуки, що відповідають формулі I, де Y означає R7, R8, R9, R10 або R11. 12 UA 107444 C2 5 Як варіант, проміжна сполука 4.1 може бути оброблена 1 еквівалентом HNR5R6 (комерційно доступний або отриманий з комерційно доступних вихідних матеріалів із застосуванням способів, відомих фахівцям у цій галузі) й основою (як-от NаOH або основа Хюніга) в розчиннику (як-от MеCN і вода) при температурах між 25 і 50 °C, до одержання монохлортриазину 4.2. Проміжна сполука 4.2 може бути оброблена надлишком аміду 4.3 і основою (як-от NаOH або основа Хюніга) в розчиннику (як-от MеCN і вода) при підвищеній температурі (60-80 °C), щоб забезпечити сполуку, що відповідають формулі I, де Y означає R7, R8, R9, R10 або R11. 10 15 20 25 30 Схема 5 представляє загальну схему реакції одержання деяких сполук, що відповідають формулі I. Дихлортриазин 5.1 може бути синтезований обробкою ціанурхлориду (комерційно доступний) 1 еквівалентом HNR5R6 (комерційно доступний або отриманий з комерційно доступних вихідних матеріалів із застосуванням способів, відомих фахівцям у цій галузі) й основою (як-от NаOH або основа Хюніга) в розчиннику (такому як MеCN і вода) при 0 °C. Подальше додавання 1 еквіваленту аміду 5.2 (вказаного вище як проміжна сполука 1.5) і основи (як-от NаOH або основа Хюніга) в розчиннику (такому як MеCN і вода) при температурах між 25 і 50 °C дає моно-хлортриазин 5.3. Проміжна сполука 5.3 може бути потім оброблена надлишком NаY (комерційно доступний або отриманий з комерційно доступних вихідних матеріалів із застосуванням способів, відомих фахівцям у цій галузі), щоб забезпечити сполуки, що відповідають формулі I, де Y означає R12. Приклади Наступні приклади пояснюють винахід. Ці приклади призначені не для того, щоб обмежувати сферу дії даного винаходу, але швидше щоб забезпечити керівництво для фахівця для одержання й застосування сполук, композицій і способів за даним винаходом Хоча й описані конкретні варіанти здійснення даного винаходу, фахівець повинен мати на увазі, що різні зміни й модифікації можуть бути зроблені, не виходячи за межі суті і сфери дії винаходу. Проміжна сполука 1 цис-4-аміно-N{[2-(трифторметил)феніл]метил}циклогексанкарбоксамід Стадія 1: цис-4-({[(1,1-диметилетил)окси]карбоніл}аміно)циклогексанкарбонова кислота 35 13 UA 107444 C2 5 10 У колбу з цис-4-аміноциклогексанкарбоновою кислотою (4,3 г, 30 ммоль, 1,0 екв.) додавали 1,4-діоксан (36 мл). Суспензію охолоджували до 0 °C і 1,0 н. гідроксид натрію (72 мл, 72 ммоль, 2,4 екв.) додавали протягом 5 хвил. Розчин перемішували протягом 20 хвил при 0 °C. Розчин біс(1,1-диметилетил)дикарбонату (7,87 г, 36,0 ммоль,1,1 екв.) в 1,4-діоксані (36 мл) додавали протягом 5 хвил. Реакційній суміші давали можливість нагрітися до кімнатної температури й перемішування продовжували протягом ночі. Реакційну суміш охолоджували до 0 °C і підкисляли (до ~ pH 4) 1,5 M гідросульфатом калію. Бажаний продукт екстрагували етилацетатом (3х), сушили з сульфатом натрію, фільтрували й концентрували при зниженому тиску, одержуючи 6,55 г (90 %) вказаної в заголовку сполуки. MS (ES+): m/e 265,9 [M+Na]. Стадія 2: 1,1-диметилетил{цис-4-[({[2(трифторметил)феніл]метил}аміно)карбоніл]циклогексил}карбамат 15 20 25 30 35 До розчину цис-4-({[(1,1-диметилетил)окси]карбоніл}аміно)-циклогексанкарбонової кислоти (3,0 г, 12 ммоль, 1,0 екв.) і 1-[2-(трифторметил)феніл]метанаміну (1,9 мл, 14 ммоль, 1,0 екв.) в CH2Cl2 (82 мл) при кімнатній температурі додавали DMAP (301 мг, 2,47 ммоль, 0,2 екв.). Додавали EDC (2,95 г, 15,4 ммоль, 1,25 екв.) і діізопропілетиламін (DIEA, 2,7 мл, 15 ммоль, 1,25 екв.). Перемішування продовжували протягом ночі при кімнатній температурі. Розчин розбавляли CH2Cl2 (100 мл), промивали насиченим бікарбонатом натрію (200 мл), водою (200 мл) і насиченим розчином солі (200 мл). Екстракти в CH 2Cl2 сушили з MgSO4, фільтрували й концентрували при зниженому тиску, одержуючи вказану в заголовку сполуку. MS (ES+): m/e + 400,8 [M+Na] . Стадія 3: цис-4-аміно-N-{[2-(трифторметил)феніл]метил}циклогексанкарбоксамід До розчину 1,1-диметилетил {цис-4-[({[2-(трифторметил)феніл]метил}аміно)карбоніл]циклогексил}карбамату в CH2Cl2 (40 мл) при 0 °C додавали заздалегідь змішаний розчин CH2Cl2 (10 мл) і TFA (10 мл). Реакційну суміш перемішували при 0 °C протягом 10 хвил. Реакційну суміш нагрівали до кімнатної температури й перемішування продовжували протягом 2 год. Розчинник потім видаляли при зниженому тиску, одержуючи 2,83 г (69 % за 2 стадії) вказаної в + заголовку сполуки. MS ES+): m/e 301,1 [М+h] . Як варіант, проміжна сполука 1 може бути синтезована із застосуванням наступної процедури: Стадія 1: цис-4-({[(1,1-диметилетил)окси]карбоніл}аміно)циклогексанкарбонова кислота 40 14 UA 107444 C2 5 10 250 мл круглодонну колбу, заповнену аргоном, забезпечували магнітною стрижньовою мішалкою. В колбу додавали цис-4-аміноциклогексанкарбонову кислоту (9,27 г, 64,7 ммоль), ізопропанол (83 мл) і 1 н. NаOH (70,6 мл, 70,6 ммоль) при кімнатній температурі. Після розчинення всієї твердої речовини додавали біс(трет-бутил)дикарбонат (15,54 г, 71,2 ммоль), суміш витримували при кімнатній температурі протягом 21 год. Сиру суміш промивали гексанами (3×100 мл). Після цього 100 мл 1 н. HCl додавали до водного шару й суміш екстрагували етилацетатом (300 мл). Органічну фазу сушили над Na 2SO4, фільтрували й концентрували, одержуючи 12,85 г цис-4-({[(1,1-диметилетил)окси]карбоніл}аміно)циклогексанкарбонової кислоти (82 %) у вигляді не зовсім білої твердої речовини. Стадія 2: 1,1-диметилетил{цис-4[({[2(трифторметил)феніл]метил}аміно)карбоніл]циклогексил}карбамат 15 20 25 30 35 40 У 250 мл круглодонну колбу, заповнену аргоном, додавали цис-4-({[(1,1диметилетил)окси]карбоніл}аміно)циклогексанкарбонову кислоту (15,54 г, 63,9 ммоль), 2(трифторметил)бензиламін (8,95 мл, 63,9 ммоль) і 100 мл DMF. Триетиламін (26,7 мл, 192 ммоль) додавали й розчину давали можливість перемішуватися протягом декількох хвилин. Потім окремий розчин гексафторфосфату 1H-1,2,3-бензoтриазол-1-ілокситрис(диметиламіно)фосфонію (BOP реагент, 28,3 г, 63,9 ммоль), розчиненого в 60 мл DMF, додавали до суміші при кімнатній температурі. Реакційну суміш перемішували протягом 2 год. і потім виливали в енергійно перемішувану суміш насиченого бікарбонату натрію й води (1:1, 1,6 л). У результаті цього відбувалося осадження бажаного продукту у вигляді не зовсім білої твердої речовини. Тверду речовину витягували вакуумним фільтруванням й сушили протягом 24 год. у вакуумі, одержуючи 24,88 г 1,1-диметилетил{цис-4[({[2(трифторметил)феніл]метил}аміно)карбоніл]циклогексил} карбамату (62,1 ммоль, 97 %). MS + (ES) m/e 401 [M+H] . Стадія 3: цис-4-аміно-N-{[2-(трифторметил)феніл]метил}циклогексанкарбоксамід У 500 мл круглодонну колбу, забезпечену магнітною стрижньовою мішалкою, завантажували 1,1-диметилетил{цис-4-[({[2(трифторметил)феніл]метил}аміно)карбоніл]циклогексил}карбамат (24,88 г, 62,1 ммоль) і дихлорметан (100 мл). Трифтороцтову кислоту (100 мл) додавали повільно й реакційну суміш перемішували при кімнатній температурі протягом 1 год. Летючі компоненти видаляли в роторному випарнику й сире масло розчиняли в етилацетаті й промивали насиченим розчином бікарбонату натрію (3×200 мл). Органічну фазу сушили над Na2SO4, фільтрували й концентрували, одержуючи 18,3 г вказаної в заголовку сполуки (98 %) у + вигляді не зовсім білої твердої речовини. MS (ES) m/e 301 [M+H] . Проміжна сполука 2 цис-4-аміно-N-({2-[(трифторметил)окси]феніл}метил)циклогексанкарбоксамід 15 UA 107444 C2 5 Проміжну сполуку 2 одержували, використовуючи загальну процедуру, описану вище в синтезі проміжної сполуки 1, замінюючи 2-[(трифторметил)окси]бензиламіном 2+ (трифторметил)бензиламін. MS (ES+): [M+H] . Проміжна сполука 3 N-[4-(амінометил)-3-хлорфеніл]метансульфонамід 10 Стадія 1: N-(3-хлор-4-ціанофеніл)метансульфонамід 15 20 До розчину 4-аміно-2-хлорбензoнітрилу (5 г, 32,8 ммоль) і піридину (3,18 мл, 39,3 ммоль) в дихлорметані (DCM) (75 мл) додавали метансульфонилхлорид (4,50 г, 39,3 ммоль) повільно при 0 °C в атмосфері N2. Після додавання суміш нагрівали до кімнатної температури й перемішували протягом ночі. Реакційну суміш обробляли 50 мл 2 н. NаOH. Шари розділяли. Водний шар підкисляли конц. HCl до pH=2, що мало результатом осадження продукту. Тверді речовини фільтрували, промивали водою й сушили, одержуючи бажаний продукт у вигляді білої + твердої речовини (7,0 г, 93 %). MS (ES+): m/e 230,8 [M+H] . Стадія 2: N-[4-(амінометил)-3-хлорфеніл]метансульфонамід 25 30 35 У тригорлу круглодонну колбу, що містить при 0 °C розчин LiAlH4 (2M у THF) (26,0 мл, 52,0 ммоль) додавали йод (6,60 г, 26,0 ммоль) у THF (20 мл) по краплях в атмосфері N 2. Після додавання суміш перемішували протягом 30 хвил при 0 °C. Потім N-(3-хлор-4ціанофеніл)метансульфонамід (4 г, 17,34 ммоль) у THF (20 мл) додавали по краплях. Після додавання реакційну суміш нагрівали до кімнатної температури й перемішували протягом 1 год., у цей час осад випадав з розчину. Реакційну суміш фільтрували й осад промивали холодним THF. Осад обережно переносили у склянку, яка містила 60 мл THF. Суміш підкисляли до pH=2 6 н. HCl при постійному перемішування при 0 °C. Шари розділяли й водний шар промивали DCM (30 мл). Водний шар концентрували в роторному випарнику. Одержані тверді речовини промивали холодним MеOH, одержуючи жовту тверду речовину. Маткову рідину піддавали такій же переробці (2х). Об'єднані перероблені фракції збирали й сушили, одержуючи + вказану в заголовку сполуку у вигляді солі з HCl (4,2 г, 89 %). MS (ES+): m/e 234,7 [M+H] . Проміжна сполука 4 [4-(амінометил)-3-хлорфеніл]диметиламін 40 16 UA 107444 C2 Стадія 1: 2-хлор-4-(диметиламіно)бензонітрил 5 10 Суміш 4-аміно-2-хлорбензoнітрилу (1 г, 6,55 ммоль), йодметану (7,44 г, 52,4 ммоль) і карбонату цезію (4,27 г, 13,11 ммоль) в ацетонітрилі (10 мл) нагрівали до 100 °C в герметичній пробірці. Після перемішування протягом ночі до суміші додавали воду (15 мл), потім EtOAc (25 мл). Органічний шар розділяли і водний повторно екстрагували EtOAc (25 мл). Органічні речовини сушили над Na2SО4 і видаляли. Колонкова хроматографія (EtOAc/гексани=0-40 %) давала бажаний продукт у вигляді білої твердої речовини (0,76 г, 64 %). MS (ES+): m/e 180,8 + [M+H] . Стадія 2: [4-(амінометил)-3-хлорфеніл]диметиламін 15 20 25 До розчину 2-хлор-4-(диметиламіно)бензонітрилу (0,76 г, 4,21 ммоль) у THF (5 мл) додавали 1M LiAlH4/I2 в THF (8,41 мл, 8,41 ммоль, який готували на стадії 2 одержання проміжної сполуки 3). Суміш перемішували протягом 10 хвил, у цей час LCMS показувала утворення бажаного продукту. До суміші додавали воду (15 мл) і підкисляли до pH=2 6 н. HCl. Водний шар розділяли і промивали Et2О (2×25 мл). Водний шар потім підлужували 6 н. NаOH і екстрагували Et 2О (3×30 мл). Органічні речовини сушили над Na2SO4. Шар простого ефіру видаляли до 1/3 об'єму, в цей час 8 мл 1M HCl додавали в розчин простого ефіру. Після перемішування протягом 10 хвилин тверді речовини осідали з розчину. Тверді речовини фільтрували, промивали простим ефіром і сушили, одержуючи вказану в заголовку сполуку (1,0 г, 92 %) у вигляді світло-жовтої твердої + речовини. MS (ES+): m/e 185,0 [M+H] . Проміжна сполука 5 {[4-(метилокси)-2-(трифторметил)феніл]метил}амін 30 35 40 До суміші 4-(метилокси)-2-(трифторметил)бензальдегіду (14 г, 65 ммоль, 1,0 екв.), водних NH3 (25-28 %, 370 мл, 5,20 моль, 80 екв.) і MеOH (300 мл) додавали Ni Ренея (3,8 г, 65 ммоль, 1,0 екв.). Колбу під'єднували до водневого балона й суміш перемішували протягом 7 діб при кімнатній температурі. Реакційну суміш фільтрували через шар целіту й фільтрат концентрували. Залишок очищали HPLC, одержуючи 9 г (64 %) вказаної в заголовку сполуки у + 1 вигляді трифторацетатної солі. MS (ES+): m/e 206 [M+H] . H ЯМР (400 МГц, Дмсо-d6) δ 7,6 (д, 1H), 7,3 (д, 1H), 7,2 (с, 1H), 4,1 (с, 2H), 3,8 (с, 3H). Проміжна сполука 6 4-(амінометил)-3-хлорбензoнітрил 17 UA 107444 C2 Стадія 1: 4-(бромметил)-3-хлорбензoнітрил 5 10 Суміш 3-хлор-4-метилбензoнітрилу (7,5 г, 50 ммоль, 1,0 екв.), N-бромсукциніміду (9,14 г, 52 ммоль, 1,1 екв.) і азобісизобутиронітрилу (AIBN, 0,82 г, 5 ммоль, 0,1 екв.) у тетрахлориді вуглецю нагрівали до температури кипіння з поверненням флегми протягом 25 год. Додавали воду (50 мл) і продукт екстрагували CH2Cl2. Органічні шари промивали водою, сушили з MgSО 4 і випаровували, одержуючи 11,3 г вказаної в заголовку сполуки. Цей матеріал використовували на наступній стадії без очищення. Стадія 2: 4-(амінометил)-3-хлорбензoнітрил 15 20 До суміші 4-(бромметил)-3-хлорбензoнітрилу (11 г, 49 ммоль, 1,0 екв.) і 6 M NH 3 в метанолі (200 мл) перемішували при 18 °C протягом 17 год. Водну HCl (1 M, 200 мл) додавали й водний шар промивали етилацетатом. Водну фазу доводили до pH 9-10 1 M NаOH і екстрагували етилацетатом. Органічний шар промивали водою, сушили з сульфатом магнію й концентрували. Залишок очищали на силікагелі, одержуючи 2,71 г вказаної в заголовку сполуки. + MS (ES+): m/e 167,0 [M+H] . Проміжна сполука 7 {[4-(трифторметил)-3-піридиніл]метил}амін 25 30 До суміші 4-(трифторметил)-3-піридинкарбонітрилу (9,5 г, 55 ммоль, 1,0 екв.) і 5 M NH 3 в метанолі (600 мл, 3,0 моль, 54 екв.) додавали Ni Ренея (3,0 г, 52 ммоль, 0,95 екв.). Колбу під'єднували до водневого балону й суміш перемішували протягом 16 год. Реакційну суміш фільтрували й фільтрат концентрували. Залишок очищали HPLC, одержуючи 10,5 г (47 %) + вказаної в заголовку сполуки у вигляді біс-трифторацетатної солі. MS (ES+): m/e 177,1 [M+H] . Проміжна сполука 8 цис-4-аміно-N-({2-хлор-4-[(метилсульфоніл)аміно]феніл}метил)циклогексанкарбоксамід 35 40 Проміжну сполуку 8 одержували, використовуючи загальну процедуру, описану вище в синтезі проміжної сполуки 1, замінюючи N-[4-(амінометил)-3-хлорфеніл]метансульфонамідом 2+ (трифторметил) бензиламіну. MS (ES+): m/e 359,9 [M+H] . Проміжна сполука 9 цис-4-аміно-N-{[4-(метилокси)-2-(трифторметил)феніл]метил}циклогексанкарбоксамід 18 UA 107444 C2 5 Проміжну сполуку 9 одержували, використовуючи загальну процедуру, описану вище в синтезі проміжної сполуки 1, замінюючи 1-[4-(метилокси)-2-(трифторметил)феніл]метанаміном + 2-(трифторметил)бензиламіну. MS (ES+): m/e 331,0 [M+H] . Проміжна сполука 10 цис-4-аміно-N-{[4-ціано-2-(трифторметил)феніл]метил}циклогексанкарбоксамід 10 15 20 Проміжну сполуку 10 одержували, використовуючи загальну процедуру, описану вище в синтезі проміжної сполуки 1, замінюючи 4-(амінометил)-3-хлорбензoнітрилом 2+ (трифторметил)бензиламін. MS (ES+): m/e 292,0 [M+H] . Проміжна сполука 11 цис-4-аміно-N-{[4-(трифторметил)-3-піридиніл]метил}циклогексанкарбоксамід Проміжну сполуку 11 одержували, використовуючи загальну процедуру, описану вище в синтезі проміжної сполуки 1, замінюючи 1-[4-(трифторметил)-3-піридиніл]метанаміном 2+ (трифторметил)-бензиламін. MS (ES+): 302,0 [M+H] . Проміжна сполука 12 цис-4-{[4-хлор-6-(метиламіно)-1,3,5-триазин-2-іл]аміно}-N-{[2(трифторметил)феніл]метил}циклогексанкарбоксамід 25 Стадія 1: цис-4-[(4,6-дихлор-1,3,5-триазин-2-іл)аміно]-N-{[2(трифторметил)феніл]метил}циклогексанкарбоксамід 30 35 До розчину 2,4,6-хлор-1,3,5-триазину (307 мг, 1,66 ммоль, 1,00 екв.) в CH2Cl2 (6 мл) при 50 °C додавали заздалегідь змішаний розчин діізопропілетиламіну (DIEA, 1,45 мл, 8,30 ммоль, 5,00 екв.) і проміжної сполуки 1 (500 мг, 1,66 ммоль, 1,00 екв.) в CH 2Cl2 (3 мл). Реакційній суміші давали можливість нагрітися до кімнатної температури й перемішували протягом 3 год. Вказану в заголовку сполуку одержували й переносили далі по ходу процесу без додаткової переробки + або очищення. MS (ES+): m/e 449,7 [M+H] . 19 UA 107444 C2 Стадія 2: цис-4-{[4-({2-[(фенілметил)тіо]етил}аміно)-1,3,5-триазин-2-іл]аміно}-N-{[2(трифторметил)феніл]метил}циклогексанкарбоксамід 5 10 Заздалегідь змішаний розчин діізопропілетиламіну (DIEA, 0,872 мл, 4,98 ммоль, 3 екв.) і метиламіну (0,830 мл, 1,66 ммоль, 1 екв.) в CH2Cl2 (3 мл) додавали по краплях до сирої реакційної суміші, одержаної на стадії 1. Суміш перемішували протягом 3 год. Летючі компоненти видаляли при зниженому тиску, одержуючи 695 мг (94 %) вказаної в заголовку сполуки. Частину цього матеріалу піддавали очищенню шляхом HPLC із зворотною фазою й + останнє використовували без очищення. MS (ES+): m/e 443,9 [M+H] . Проміжна сполука 13 2,4-дихлор-6-метил-1,3,5-триазин 15 20 25 30 35 40 До розчину 2,4,6-трихлор-1,3,5-триазину (20 г, 108 ммоль, 1,0 екв.) в THF (8 мл) при -10 °C додавали по краплях бромід метилмагнію (45 мл, 135 ммоль, 1,25 екв.). Реакційній суміші давали можливість нагрітися до кімнатної температури й перемішували протягом 2 год. Суміш виливали у воду з льодом і перемішували протягом додаткової години. Продукт екстрагували етилацетатом, промивали насиченим розчином солі, сушили з сульфатом натрію, фільтрували й концентрували при зниженому тиску, одержуючи 14 г вказаної в заголовку сполуки. Сирий продукт переносили на наступну стадію. MS (ES+): m/e 186,1 [M+Na]+. Проміжна сполука 14 {[2-хлор-4-(1H-тетразол-5-іл)феніл]метил}амін До розчину проміжної сполуки 6 (0,1 г, 0,600 ммоль) і триметилсилілазиду (0,159 мл, 1,200 ммоль) в толуолі (5 мл) додавали оксид дибутилолова (0,015 г, 0,060 ммоль). Суміш перемішували протягом ночі при 100 °C, в цей час LCMS показувала, що реакція завершена. Реакційну суміш піддавали вакуумному фільтруванню. Осад на фільтрі промивали холодними MеOH і сушили, одержуючи вказану в заголовку сполуку у вигляді світло-коричневоїтвердої + речовини (0,08 г, 63,6 %). MS(ES+): m/e 210,0 [M+H] . Проміжна сполука 15 3-аміно-N-{[2-(трифторметил)феніл]метил}циклогексанкарбоксамід Проміжна сполука 15 одержували, використовуючи загальну процедуру, описану вище в синтезі прикладу 28 (стадія 2), замінюючи 2-(трифторметил)бензиламіном 2,4+ дихлорбензиламін. MS (ES+): m/e 301,1 [M+H] . 20 UA 107444 C2 Проміжна сполука 16 цис-4-(метиламіно)циклогексанкарбонова кислота 5 Стадія кислота 1: цис-4-[{[(1,1-диметилетил)окси]карбоніл}(метил)аміно]циклогексанкарбонова 10 15 20 25 30 35 До суспензії NаH (1,0 г, 41 ммоль, 2,5 екв.) в DMF (30 мл) при -10 °C додавали цис-4-({[(1,1диметилетил)окси]карбоніл}аміно)циклогексанкарбонову кислоту (4,0 г, 16 ммоль, 1,0 екв.). Реакційній суміші давали можливість нагрітися до кімнатної температури й потім перемішували протягом 1 год. Суміш знову охолоджували до -10 °C і додавали по краплях MеI (25 г, 260 ммоль, 16 екв.). Холодну баню видаляли й реакційну суміш перемішували протягом 3 год. при кімнатній температурі. Суміш виливали на лід і потім додавали NаOH (1,5 г), щоб гідролізувати небажаний метиловий складний ефір, який утворився. Цей розчин перемішували протягом ще 4 годин. Водний шар промивали етилацетатом і концентрували при зниженому тиску, щоб видалити DMF. Одержаний залишок розбавляли водою і pH доводили до ~3-4. Бажаний продукт, осаджений у вигляді білої твердої речовини, збирали фільтруванням (2,5 г). Стадія 3: цис-4-(метиламіно)циклогексанкарбонова кислота Розчин цис-4-[{[(1,1-диметилетил)окси]карбоніл}(метил)аміно]циклогексанкарбонової кислоти (2,5 г, 16 ммоль, 1,0 екв.) і 1 M HCl у діоксані (15 мл) нагрівали до кипіння з поверненням флегми протягом 4 год. Розчинник видаляли при зниженому тиску, одержуючи 1,3 г вказаної в заголовку сполуки. Цей матеріал використовували без очищення. Проміжна сполука 17 цис-4-аміно-N-[(2,4-дихлорфеніл)метил]циклогексанкарбоксамід Проміжну сполуку 17 одержували, використовуючи загальну процедуру, описану вище в синтезі проміжної сполуки 1, замінюючи [(2,4-дихлорфеніл)метил]аміном 2+ (трифторметил)бензиламін. MS (ES+): m/e 303,0 [M+H] . Проміжна сполука 18 3-аміно-N-({2-[(трифторметил)окси]феніл}метил)циклогексанкарбоксамід 21 UA 107444 C2 5 Проміжну сполуку 18 одержували, використовуючи загальну процедуру, описану вище в синтезі проміжної сполуки 15, замінюючи 2-[(трифторметил)окси]бензиламіном 2+ (трифторметил)бензиламін. MS (ES+): m/e 317,1 [M+H] . Проміжна сполука 19 Одержання 3-{[4-метил-6-(метиламіно)-1,3,5-триазин-2-іл]аміно}циклогексанкарбонової кислоти 10 15 20 25 30 35 До суміші 2,4-дихлор-6-метил-1,3,5-триазину (2,291 г, 13,97 ммоль) і метиламіну (6,98 мл, 13,97 ммоль) додавали 1 н. NаOH по краплях, щоб підтримувати pH 10. Реакційну суміш перемішували протягом 30 хвилин. Потім 3-аміноциклогексанкарбонову кислоту (2,0 г, 13,97 ммоль) додавали однією порцією і 1 н. NаOH додавали по краплях, щоб підтримувати pH 10. Реакційну суміш нагрівали до 70 °C протягом ночі. Реакційну суміш охолоджували й очищали + 1 безпосередньо препаративною HPLC. MS (ES+) m/e 266,2 [M+H] . H ЯМР (400 МГц, Дмсо-d6) δ 9,0-8,5 (уш.м, 2H), 3,9 (уш.м, 1H), 2,9 (м, 2H), 2,3 (с, 3H), 2,2 (с, 3H), 1,9-1,7 (уш.м, 4H), 1,4-1,1 (уш.м, 4H). Проміжна сполука 20 1-{4-бром-2-[(трифторметил)окси]феніл}метанамін Стадія 1: 4-бром-2-[(трифторметил)окси]бензальдегід 5-бром-2-йодфеніл трифторметиловий простий ефір (500 мг, 1,37 ммоль) розчиняли в 10 мл безводного THF і охолоджували до -70 °C. Потім н-бутиллітій (0,55 мл 2,5 M розчину, 1,37 ммоль) додавали по краплях протягом 30 хвилин. DMF (0,19 мл, 2,74 ммоль) додавали й реакційну суміш перемішували протягом 30 хвилин при -70 °C і потім давали можливість їй нагрітися до 0 °C і перемішували протягом трьох годин. Реакцію гасили 5 мл насиченого розчину хлориду амонію й екстрагували етилацетатом. Органічний шар промивали водою, сушили над сульфатом магнію, фільтрували й концентрували, одержуючи 4-бром-2[(трифторметил)окси]бензальдегід (100 мг, 0,37 ммоль, 27 %) у вигляді жовтої твердої 1 речовини. H ЯМР (400 МГц, Дмсо-d6) δ 10,1 (с, 1H), 7,9 (с, 3H). Стадія 2: 1-{4-бром-2-[(трифторметил)окси]феніл}метанамін 22 UA 107444 C2 5 10 4-бром-2-[(трифторметил)окси]бензальдегід (3 г, 11,2 ммоль) розчиняли в 100 мл 5M розчину аміаку в метанолі й перемішували протягом ночі, після чого реакційну суміш обробляли боргідридом натрію (858 мг, 22,5 ммоль) і перемішували при кімнатній температурі протягом чотирьох діб. Реакцію гасили додаванням 20 мл води і перемішували протягом 30 хвилин. Летючі речовини видаляли й залишок екстрагували метиленхлоридом (3×20 мл). Метиленхлорид випаровували, одержуючи жовте масло, яке очищали препаративною HPLC, одержуючи сіль TFA 1-{4-бром-2-[(трифторметил)окси]феніл}метанаміну (900 мг, 3,3 ммоль, + 1 29 %) у вигляді білої твердої речовини. MS (ES) m/e 270,272 [M+H] . H ЯМР (400 МГц, Дмсо-d6) δ 8,5 (уш.с, 2H), 7,8 (д, 1H), 7,7 (с, 1H), 7,6 (д, 1H), 4,1 (уш.с, 2H). Проміжна сполука 21 4-(амінометил)-3-(трифторметил)бензонітрил 15 Стадія 1: 4-(бромметил)-3-(трифторметил)бензонітрил 20 25 4-метил-3-(трифторметил)бензонітрил (10 г, 54 ммоль) розчиняли в 200 мл тетрахлориду вуглецю й обробляли N-бромсукцинімідом (10,5 г, 59 ммоль) і бензоїлпероксидом (1,3 г, 0,54 ммоль). Реакційну суміш нагрівали до температури кипіння з поверненням флегми й перемішували протягом одного тижня. Потім 80 мл води додавали й шари розділяли. Водний шар екстрагували метиленхлоридом (2×50 мл). Об'єднані органічні шари промивали водою (2×50 мл), сушили над сульфатом магнію й концентрували, одержуючи 4-(бромметил)-3(трифторметил)бензонітрил (14 г, 53 ммоль) у вигляді жовтого масла, яке використовували на наступній стадії без додаткового очищення. Стадія 2: 4-(амінометил)-3-(трифторметил)бензонітрил 30 35 40 4-(бромметил)-3-(трифторметил)бензонітрил (14 г) розчиняли в 500 мл 5 M розчину аміаку в метанолі й перемішували протягом 24 годин при кімнатній температурі. Розчинник видаляли у вакуумі, одержуючи жовту тверду речовину, яку розчиняли в 1 M HCl і екстрагували діетиловим простим ефіром (3×30 мл). Водний шар потім доводили до pH 9-10 1 M NаOH і екстрагували дихлорметаном (3×80 мл). Це давало 4-(амінометил)-3-(трифторметил)бензонітрил (4,7 г, 23 1 ммоль, 43 %) у вигляді жовтої твердої речовини. MS (ES) m/e 201 [M+H]+. H ЯМР (400 МГц, Дмсо-d6) δ 8,2 (с, 1H), 8,15 (д, 1H), 8,0(д, 1H), 3,9 (с, 2H). Приклад 1 цис-4-{[4-(метиламіно)-6-(3-піридиніл)-1,3,5-триазин-2-іл]аміно}-N-{[2(трифторметил)феніл]метил}циклогексанкарбоксамід 23 UA 107444 C2 5 10 У судину для мікрохвильової обробки завантажували PdCl2(dppf)2 (27,7 мг, 0,0339 ммоль, 0,2 екв.) і 3-піридинілборонову кислоту (52,0 мг, 0,423 ммоль, 2,5 екв.). Додавали заздалегідь змішаний розчин THF (2,1 мл) і проміжної сполуки 13 (75 мг, 0,17 ммоль, 1,0 екв.) з подальшим додаванням 0,6 M водного карбонату калію (2,8 мл, 1,7 ммоль, 10 екв.). Реакційну суміш нагрівали за допомогою мікрохвильового реактора протягом 20 хвил при 150 °C. Реакційну суміш розбавляли водою (5 мл) і екстрагували тричі етилацетатом (5 мл). Екстракти в етилацетаті об'єднували, сушили з Na2SO4, фільтрували й концентрували при зниженому тиску. Залишок очищали HPLC із зворотною фазою, одержуючи 7,2 мг (8,8 %) вказаної в заголовку + сполуки. MS (ES+): m/e 486,1 [M+H] . Приклад 2 цис-4-{[4-(метиламіно)-6-феніл-1,3,5-триазин-2-іл]аміно}-N-{[2(трифторметил)феніл]метил}циклогексанкарбоксамід 15 20 25 30 35 У судину для мікрохвильової обробки завантажували ацетат паладію (II) (0,38 мг, 0,0017 ммоль, 0,01 екв.), трициклогексилфосфін (0,95 мг, 0,0034 ммоль, 0,02 екв.) і фенілборонову кислоту (30,9 мг, 0,253 ммоль, 1,5 екв.). Розчин 1,4-діоксану (0,86 мл) і проміжної сполуки 1 (75 мг, 0,17 ммоль, 1 екв.) додавали з подальшим додаванням розчину води (0,13 мл) і триосновного фосфату калію (71,7 мг, 0,338 ммоль, 2 екв.). Реакційну суміш нагрівали за допомогою мікрохвильового реактора протягом 20 хвил при 150 °C. Реакційну суміш розбавляли водою (5 мл) і екстрагували тричі етилацетатом (5 мл). Екстракти в етилацетаті об'єднували, сушили з Na2SО4, фільтрували й концентрували при зниженому тиску. Залишок очищали HPLC із зворотною фазою, одержуючи 4,3 мг (5,3 %) вказаної в заголовку сполуки. MS + (ES+): m/e 485,1 [M+H] . Як варіант, приклад 2 може бути одержаний згідно з процедурою нижче: Приклад 2 цис-4-{[4-(метиламіно)-6-феніл-1,3,5-триазин-2-іл]аміно}-N-{[2(трифторметил)феніл]метил}циклогексанкарбоксамід Стадія 1: 2,4-дихлор-6-феніл-1,3,5-триазин 24 UA 107444 C2 5 Бромід фенілмагнію (97,6 мл 1,0 M розчину в THF, 97,6 ммоль, 1,0 екв.) додавали по краплях до розчину в THF (8 мл) ціанурхлориду (18,0 г, 97,6 ммоль, 1,0 екв.) при 0 °C. Реакційну суміш перемішували при кімнатній температурі протягом 1 год. і виливали на лід і перемішували протягом 30 хвил. Продукт екстрагували етилацетатом і об'єднані органічні шари промивали (насич.) хлоридом натрію, сушили (Na2SO4), фільтрували й концентрували при зниженому тиску, одержуючи 16 г вказаної в заголовку сполуки. Сирий продукт переносили вперед за процесом без очищення. Стадія 2: 4-хлор-N-метил-6-феніл-1,3,5-триазин-2-амін 10 15 До охолодженого (0 °C) розчину 2,4-дихлор-6-феніл-1,3,5-триазину (16,0 г, 70,8 ммоль, 1,00 екв.), розчиненого в суміші 1:1 CH3CN:H2О (80 мл), додавали NH2Me (8,00 г, 27,5 % розчин у H2O, 70,8 ммоль, 1,00 екв.). Розчин обробляли 1 н. NаOH для підтримки pH 9-10 і перемішували протягом 15 хвил. Одержану суспензію розбавляли водою й фільтрували, одержуючи 12 г сирого продукту. Частину цього матеріалу (8 г) очищали HPLC із зворотною фазою, одержуючи + 3,6 г вказаної в заголовку сполуки. MS (ES+): m/e 221,1 [M+H] . Стадія 3: цис-4-{[4-(метиламіно)-6-феніл-1,3,5-триазин-2-іл]аміно}-N-{[2(трифторметил)феніл]метил}циклогексанкарбоксамід 20 25 30 До суміші проміжної сполуки 1 (2,04 г, 6,80 ммоль) і діізопропілетиламіну (3,55 мл, 20,4 ммоль) в ацетонітрилі (100 мл) додавали 4-хлор-N-метил-6-феніл-1,3,5-триазин-2-амін (1,5 г, 6,8 ммоль). Суміш нагрівали при температурі кипіння з поверненням флегми протягом 18 год. Розчинник випаровували й залишок розчиняли в DMF, підкисляли TFA і очищали HPLC із зворотною фазою (Phenomenex, 90 мл/хвил, 20 %-85 % MeCN/вода з 0,1 % TFA, 20 хвил, УФ виявлення при 214 нм), одержуючи вказану в заголовку сполуку (2,05 г, чистота 99,7 %, вихід + 50,2 %) у вигляді солі з TFA. MS(ES+): m/e 485,1 [M+H] . Забруднені фракції HPLC об'єднували й повторно очищали HPLC, одержуючи додатковий продукт (0,6 г, чистота >99 %, вихід 14,8 %). + MS (ES+): m/e 485,1 [M+H] . Приклад 3 цис-4-[[4-(метиламіно)-6-(3-тієніл)-1,3,5-триазин-2-іл]аміно}-N-{[2(трифторметил)феніл]метил}циклогексанкарбоксамід 35 40 Приклад 3 одержували, використовуючи загальну процедуру, описану вище в прикладі 2, + замінюючи 3-тієнілбороновою кислотою фенілборонову кислоту. MS (ES+): m/e 491,0 [M+H] . Приклад 4 цис-4-{[4-[4-(1,1-диметилетил)феніл]-6-(метиламіно)-1,3,5-триазин-2-іл]аміно}-N-{[2(трифторметил)феніл]метил}циклогексанкарбоксамід 25 UA 107444 C2 5 Приклад 4 одержували, використовуючи загальну процедуру, описану вище в прикладі 2, замінюючи [4-(1,1-диметилетил)феніл]бороновою кислотою фенілборонову кислоту. MS (ES+): + m/e 541,1 [M+H] . Приклад 5 цис-4-{[4-(2-фторфеніл)-6-(метиламіно)-1,3,5-триазин-2-іл]аміно}-N-{[2(трифторметил)феніл]метил}циклогексанкарбоксамід 10 15 Приклад 5 одержували, використовуючи загальну процедуру, описану вище в прикладі 2, замінюючи 2-фторфенілбороновою кислотою фенілборонову кислоту. MS (ES+): m/e 503,0 + [M+H] . Приклад 6 цис-4-{[4-(4-ціанофеніл)-6-(метиламіно)-1,3,5-триазин-2-іл]аміно}-N-([2(трифторметил)феніл]метил}циклогексанкарбоксамід 20 25 30 35 Приклад 6 одержували, використовуючи загальну процедуру, описану вище в прикладі 2, замінюючи 4-ціанофенілбороновою кислотою фенілборонову кислоту. MS (ES+): m/e 510,0 [M+H]. Приклад 7 цис-4-({4-(метиламіно)-6-[4-(метилсульфоніл)феніл]-1,3,5-триазин-2-іл}аміно)-N-({2[(трифторметил)окси]феніл}метил)циклогексанкарбоксамід Приклад 7 одержували, використовуючи загальну процедуру, описану вище в прикладі 2, замінюючи проміжною сполукою 2 проміжну сполуку 1 і [4-(метилсульфоніл)феніл]бороновою + кислотою фенілборонову кислоту. MS (ES+): m/e 579,0 [M+Н] . Приклад 8 цис-4-{[4-(метиламіно)-6-(3-піридиніл)-1,3,5-триазин-2-іл]аміно}-N-({2[(трифторметил)окси]феніл}метил)циклогексанкарбоксамід 26 UA 107444 C2 5 Приклад 8 одержували, використовуючи загальну процедуру, описану вище в прикладі 1, + замінюючи проміжною сполукою 2 проміжну сполуку 1. MS (ES+): m/e 502,0 [M+H] . Приклад 9 цис-4-({4-(метиламіно)-6-[4-(трифторметил)феніл]-1,3,5-триазин-2-іл}аміно)-N-({2[(трифторметил)окси]феніл}метил)циклогексанкарбоксамід 10 15 Приклад 9 одержували, використовуючи загальну процедуру, описану вище в прикладі 2, замінюючи проміжною сполукою 2 проміжну сполуку 1 і [4-(трифторметил)феніл]бороновою + кислотою фенілборонову кислоту. MS (ES+): m/e 569,0 [M+Н] . Приклад 10 3-{4-(метиламіно)-6-[(цис-4-{[({2[(трифторметил)окси]феніл}метил)аміно]карбоніл}циклогексил)аміно]-1,3,5-триазин-2іл}бензойна кислота 20 25 Приклад 10 одержували, використовуючи загальну процедуру, описану вище в прикладі 2, замінюючи проміжною сполукою 2 проміжну сполуку 1 і 3-(дигідроксибораніл)бензойною + кислотою фенілборонову кислоту. MS (ES+): m/e 545,0 [M+H] . Приклад 11 3-[4-(метиламіно)-6-({цис-4-[({[4-(метилокси)-2(трифторметил)феніл]метил}аміно)карбоніл]циклогексил}аміно)-1,3,5-триазин-2-іл]бензойна кислота 30 35 Приклад 11 одержували, використовуючи загальну процедуру, описану вище в прикладі 2, замінюючи проміжною сполукою 9 проміжну сполуку 1 і 3-(дигідроксибораніл)бензойною + кислотою фенілборонову кислоту. MS (ES+): m/e 559,0 [M+H] . Приклад 12 цис-4-({4-(метиламіно)-6-[4-(трифторметил)феніл]-1,3,5-триазин-2-іл}аміно)-N-{[4(метилокси)-2-(трифторметил)феніл]метил}циклогексанкарбоксамід 27 UA 107444 C2 5 Приклад 12 одержували, використовуючи загальну процедуру, описану вище в прикладі 2, замінюючи проміжною сполукою 9 проміжну сполуку 1 і [4-(трифторметил)феніл]бороновою + кислотою фенілборонову кислоту. MS (ES+): m/e 583,0 [M+H] . Приклад 13 цис-4-{[4-(метиламіно)-6-(3-піридиніл)-1,3,5-триазин-2-іл]аміно}-N-{[4-(метилокси)-2(трифторметил)феніл]метил}циклогексанкарбоксамід 10 15 20 25 30 Приклад 13 одержували, використовуючи загальну процедуру, описану вище в прикладі 1, + замінюючи проміжною сполукою 9 проміжну сполуку 1. MS (ES+): m/e 516,0 [M+H] . Приклад 14 цис-4-({4-(метиламіно)-6-[4-(метилсульфоніл)феніл]-1,3,5-триазин-2-іл}аміно)-N-{[4(метилокси)-2-(трифторметил)феніл]метил}циклогексанкарбоксамід Приклад 14 одержували, використовуючи загальну процедуру, описану вище в прикладі 2, замінюючи проміжною сполукою 9 проміжну сполуку 1 і [4-(метилсульфоніл)феніл]бороновою + кислотою фенілборонову кислоту. MS (ES+): m/e 593,0 [M+Н] . Приклад 15 3-[4-(метиламіно)-6-({цис-4-[({[4-(трифторметил)-3піридиніл]метил}аміно)карбоніл]циклогексил}аміно)-1,3,5-триазин-2-іл]бензойна кислота Приклад 15 одержували, використовуючи загальну процедуру, описану вище в прикладі 2, замінюючи проміжною сполукою 11 проміжну сполуку 1 і 3-(дигідроксибораніл)бензойною + кислотою фенілборонову кислоту. MS(ES+): m/e 530,1 [M+H] . Приклад 16 цис-4-({4-(метиламіно)-6-[4-(трифторметил)феніл]-1,3,5-триазин-2-іл}аміно)-N-{[4(трифторметил)-3-піридиніл]метил}циклогексанкарбоксамід 35 28
ДивитисяДодаткова інформація
Назва патенту англійськоюNovel seh inhibitors and their use
Автори російськоюDing, Yun, Thalji, Reema, K., Marino, Joseph, Paul, Jr.
МПК / Мітки
МПК: C07D 251/18, A61K 31/53
Мітки: застосування, інгібітори
Код посилання
<a href="https://ua.patents.su/56-107444-ingibitori-seh-ta-kh-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Інгібітори seh та їх застосування</a>
Попередній патент: Хімічний спосіб
Наступний патент: 5-фторпіримідинові похідні як фунгіциди
Випадковий патент: Розподільник












