Експериментальна модель неалкогольної жирової хвороби печінки у щурів
Номер патенту: 109085
Опубліковано: 10.08.2016
Автори: Яковлєва Ольга Олександрівна, Некрут Дар'я Олександрівна, Луцюк Микола Борисович, Остренюк Роман Сергійович, Заічко Наталя Валентинівна
Формула / Реферат
Експериментальна модель неалкогольної жирової хвороби печінки у щурів, що включає годування щурів напівсинтетичним гепатопатогенним раціоном, що містить білок, вуглеводи, жири, целюлозу, суміш життєво необхідних солей, суміш вітамінів у фізіологічних дозах, яка відрізняється тим, що для скорочення термінів досягнення та розвитку неалкогольної жирової хвороби печінки щурам щодня протягом 60 діб вводять гомоцистеїну тіолактон у дозі 100 мг/кг ваги.
Текст
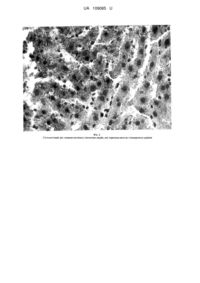
Реферат: Експериментальна модель неалкогольної жирової хвороби печінки у щурів включає годування щурів напівсинтетичним гепатопатогенним раціоном, що містить білок, вуглеводи, жири, целюлозу, суміш життєво необхідних солей, суміш вітамінів у фізіологічних дозах. Щурам щодня протягом 60 діб вводять гомоцистеїну тіолактон у дозі 100 мг/кг ваги. UA 109085 U (54) ЕКСПЕРИМЕНТАЛЬНА МОДЕЛЬ НЕАЛКОГОЛЬНОЇ ЖИРОВОЇ ХВОРОБИ ПЕЧІНКИ У ЩУРІВ UA 109085 U UA 109085 U 5 10 15 20 25 30 35 40 45 50 55 60 Корисна модель належить до галузі експериментальної медицини, а саме до експериментальної гепатології та експериментальних моделей дієт, які дозволяють на лабораторних тваринах моделювати патологічний синдром неалкогольної жирової хвороби печінки (НАЖХП) з метою дослідження її патогенетичних механізмів або з метою скринінгу препаратів, що знижують важкість стану НАЖХП або препаратів, що можуть бути використані для корекції наслідків НАЖХП, також для дослідження механізмів формування, прогресування та терапії захворювань печінки неінфекційного ґенезу. Відомими аналогами є способи моделювання експериментального захворювання печінки, зокрема моделей стеатозу печінки, гепатиту, цирозу печінки та ін., описані в багатьох патентах, в яких як пошкоджуючий агент автори використовують токсичний фактор [Клиникоморфологические изменения печени при атерогенной дислипидемии и при лечении статинами/ Л.Б. Лазебник, Л.А. Зеленогородская, И.А. Морозов и др.// Терапевт. Арх. - 2003. - № 5. - С. 812]. Відомим аналогом є спосіб моделювання токсичного гепатиту та цирозу печінки у статевозрілих щурів шляхом введення 20 % розчину ССl4 в дозі 0,1 мл/100 г маси тіла тварини двічі на тиждень протягом 3 місяців, паралельно замість пиття тваринам давали 5 % розчин етанолу [Пат. 43704 Україна, МПК: G09B 23/00. Спосіб моделювання хронічного токсичного гепатиту та цирозу печінки у нестатевозрілих щурів/ І.І. Незгода, В.А. Рауцкіс, Н.А. Рикало. U200903490; заявл. 10.04.2009; опубл. 25.08.2009, Бюл. № 16. - 2 с.]. Відомим аналогом є спосіб моделювання токсичного гепатиту шляхом інтрагастрального одноразового введення 50 % розчину совтолу-1 на оливковій олії із розрахунку 150 мг на 100 г ваги тіла тварини [Пат. 2188457 Росія, МКИ G09B 23/28, Способ моделирования токсической гепатопатии/ В.А. Мышкин, Р.Б. Ибатуллина, Е.С. Волкова и др. - 2000103102/14; заявл. 08.02.2000; опубл. 27.08.2002.]. Відомий метод моделювання цирозу печінки шляхом введення лабораторній тварині 2 рази на тиждень протягом місяця інтрагастрально 50 % розчину совтолу-1 на оливковій олії із розрахунку 0,25 мл на 100 г ваги тіла тварини і 10 % розчин етанолу замість води для пиття [Пат. 2197018 Росія, МКИ G09В 23/28, Способ моделирования цирроза печени/ В.А. Мышкин, Р.Б. Ибатуллина, А.И. Савлуков и др. - 2000103880/14; заявл. 16.02.2000; опубл. 20.01.2003]. Відомим аналогом є спосіб моделювання гепатиту, що полягає в ініціації токсичного ураження печінки шляхом перорального введення 40 % етанолу в дозі 14 мл/кг протягом 60 днів [Доркина, Е.Г. Гепатопротекторные свойства флавоноидов: автореферат диссертации на соискание уч. зв. док. биол. наук: 14.03.06/ Доркина Елена Григорьевна. - Волгоград, 2010. - 45 с.]. Перераховані аналоги - способи моделювання жирової дистрофії, токсичного гепатиту, цирозу печінки та інших захворювань печінки сприяють органічному ураженню печінки та базуються на токсичному факторі ініціації пошкодження печінки. Недоліком аналогів є те, що механізми розвитку даних захворювань відрізняються від реальних причин виникнення цих захворювань у людей, у яких, як правило, причиною виникнення неінфекційних захворювань печінки є неправильний спосіб життя та нераціональне харчування. Саме тому для вивчення патогенетичних механізмів розвитку цих захворювань та розробки правильного лікування та профілактики необхідно створення моделі, що найбільш наближена до реальних клінічних умов. Найближчим аналогом до корисної моделі є спосіб моделювання стеатозу печінки [Пат. 2394281 Росія, МПК G09B 23/28 (2006.01), Способ моделирования неалкогольного стеатогепатита у крыс/ Ю.К. Караман, Т.П. Новгородцева, Н.В. Бивалькевич, Е.Г. Лобанова. 2009120376/14; заявл. 28.05.2009; опубл. 10.07.2010], у відповідності до якої щурам протягом 6 місяців щодоби з їжею вводять 42,5 г топленого яловичого жиру и 4,3 г порошкового холестерину із розрахунку на 1 кг ваги тіла. Недоліком найближчого аналога є те, що для досягнення необхідного результату час утримування тварин занадто великий, що приводить до надмірного зростання витрат при проведенні таких експериментів. В основу корисної моделі поставлена задача створення простої у виконанні з високим наближенням до клінічного перебігу дієтичної моделі створення неалкогольної жирової хвороби печінки із мінімальною летальністю тварин. Поставлена задача вирішується тим, що неалкогольну жирову хворобу печінки викликають на фоні високожирової дієти додатковим введенням гомоцистеїну (метаболіту, який утворюється в організмі з метіоніну в ході багатостадійного процесу), згодовують піддослідним тваринам високожирову дієту, готують щурів напівсинтетичним гепатопатогенним раціоном, що містить білок, вуглеводи, жири, целюлозу, суміш життєво необхідних солей, суміш вітамінів у 1 UA 109085 U 5 10 15 20 25 30 35 40 45 50 55 фізіологічних дозах, згідно з корисною моделлю, замість надлишкових кількостей холестерину протягом 60 діб щодоби тваринам вводять гомоцистеїну тіолактон у дозі 100 мг/кг ваги тіла. Корисна модель є простою модифікацією аналогів, вона дозволяє значно, в декілька раз, скоротити час, необхідний для розвитку неалкогольної жирової хвороби печінки у лабораторних тварин. Моделювання НАЖХП не є складним у відтворенні і дає можливість для проведення оригінальних та практично значущих для медицини та біології робіт по з'ясуванню патогенетичних механізмів формування жирової хвороби печінки, причин, які її викликають, пускових механізмів процесів фіброгенезу і розвитку цирозу. При вирішенні поставленої задачі нелінійних щурів-самців, отриманих у науковоекспериментальній клініці (віварії) Вінницького національного медичного університету ім. М.І. Пирогова, утримували протягом 60 діб на високожировій дієті, що включає 200 г казеїну, 300 г крохмалю та 250 г жиру (125 г лярду та 125 г соняшникової олії). Фактично у високожировій дієті збільшено квоту жирів до 50 % загального калоражу за рахунок зменшення квоти вуглеводів до 26 %. Також до складу дієти входили вітаміни в таких кількостях: піридоксин - 1,0; фолієва кислота - 0,2; кобаламін - 0,03; тіамін - 4,0; рибофлавін - 5,0; пантотенат - 15,0; нікотинат - 15,0; біотин 0,2; холін - 50,0; токоферол 150,0; вітамін К (філохінон) - 2,0; ретинол - 1,0; кальциферол - 0,03 мг на 1 кг сухого корму. Суміш вітамінів була складена, відповідно до фізіологічних потреб [Экспериментальная витаминология (справочное руководство). Под редакцией Ю.М. Островского. - Минск: "Наука и Техника", 1979. - 551 с.]. Водорозчинні вітаміни вносили в дієту у вигляді їхньої суміші, виготовленої на глюкозі. Жиророзчинні вітаміни додавали в соняшникову олію. До дієти додавали сольову суміш, яку виготовляли за затвердженою методикою [Инструкция для приготовления основной диеты для крыс. Утверждена Институтом Питания АМН СССР 27.12.1952 г. - М., 1952. - 8 с.] ,в склад якої входили: натрію хлорид - 58,5 г, калій фосфорнокислий однозаміщений - 163,3 г, магнію сульфат - 24,1 г, кальцій вуглекислий -160,2 г, залізо сірчанокисле - 11,1 г, калію йодид - 0,322 г, сірчанокислий марганець - 1,87 г, сірчанокислий цинк - 0,23 г, сірчанокисла мідь - 0,2 г, хлористий кобальт - 0,01 г, фтористий натрій - 0,21 г, каплун - 0,047 г, калій-хром-сульфат - 0,55 г, натрію селеніт - 0,01 г. Гіпергомоцистеїнемію моделювали шляхом введення гомоцистеїну тіолактону із розрахунку 100 мг/кг ваги тварини інтрагастрально на 1 % розчині крохмалю 1 раз на добу. Контрольну групу тварин утримували на стандартній дієті, яка відрізнялась співвідношенням кількостей вуглеводного та жирового компонентів, а саме - замість 300 г крохмалю та 250 г жиру (125 г лярду та 125 г соняшникової олії) до складу стандартної дієти входило 620 г крохмалю та 100 г жиру (50 г лярду та 50 г соняшникової олії). Як і в високожировій дієті, до раціону додавали целюлозу, суміші вітамінів і солей. Стандартна дієта і високожирова дієта були ізокалорійними, містили однакову кількість білку, вітамінів та мінеральних солей. Корисна модель пояснюється кресленнями, де на фіг. 1. зображені гістологічний зріз тканини печінки у інтактних щурів, які утримувалися на стандартному раціоні; на фіг. 2. гістологічний зріз тканини печінки у щурів, які утримувалися на стандартному раціоні із інтрагастральним введенням гомоцистеїну тіолактону у дозі 100 мг/кг; фіг. 3. - гістологічний зріз тканини печінки у щурів, що утримувались на високожировому раціоні; фіг. 4. - гістологічний зріз тканини печінки у щурів, які утримувались на високожировому раціоні із інтрагастральним введенням гомоцистеїну тіолактону у дозі 100 мг/кг. В науково-дослідній клініко-діагностичній лабораторії ВНМУ ім. М.І. Пирогова було проведено експериментальні дослідження на щурах. Для відтворення експериментальної моделі було використано дорослих щурів-самців, середньої вагою 262,7±21,5 г. Для дослідження було створено 4 групи щурів Група 1 - контрольна - інтактні щури, яких утримували на стандартному раціоні (10 шт); Група 2 - дослідна - щури, яких утримували на стандартному раціоні при щодобовому введенні гомоцистеїну тіолактону в дозі 100 мг/кг ваги (10 шт); Група 3 - дослідна - щури, яких утримували на експериментальному високожировому раціоні, але без додаткового введення гомоцистеїну тіолактону (10 шт); Група 4 - дослідна - щури, яких утримували на експериментальному високожировому раціоні при щодобовому введенні гомоцистеїну тіолактону в дозі 100 мг/кг ваги (10 шт). Тварин щодня оглядали, враховували кількість їжі, яку вживали тварини. Щотижня проводили зважування тварин з метою поточного контролю зміни ваги тіла. 2 UA 109085 U 5 10 15 20 25 30 35 40 По закінченню терміну досліду виведення тварин з експерименту здійснювали шляхом декапітації під тіопенталовим наркозом, у відповідності до вимог Європейської конвенції по захисту експериментальних тварин 86/609 EEC та Закону України № 3447-IV від 21.02.2006 "Про захист тварин від жорстокого поводження". При цьому визначали біометричні показники, а саме вагу тварин, довжину тіла, відносну та абсолютну вагу печінки. Функціональний стан печінки щурів оцінювали за активністю АЛТ, ACT, рівнем загального холестерину (ЗХС), тригліцеридів (ТГ), ліпопротеїнів високої щільності (ЛПВЩ), ліпопротеїдів низької щільності (ЛПНЩ), ліпопротеїдів дуже низької щільності (ЛПДНЩ) в сироватці крові. Всі ці показники визначали на аналізаторі Beckman Coulter AU 480 OLYMPUS. Для оцінки інтенсивності процесів оксидативного стресу визначали активність ферментів NADPH-оксидази, тіоредоксинредуктази, вміст карбонільних груп білків, глутатіонпероксидази та відновленого глутатіону, а також малонового діальдегіду (МДА) та супероксиддисмутази (СОД) в гомогенаті печінки. Як маркери печінкового стеатогенезу визначали вміст триглі-церидів та холестерину в печінці. В ліпідному екстракті печінки визначали загальний вміст фосфоліпідів. Для визначення розвитку печінкового фіброгенезу вимірювали вміст TNF- та гіалуронату в сироватці крові, а також вміст гідроксипроліну в печінці. Рівень загального ГЦ в сироватці крові визначали імуноферментним методом набором AXIS®. Для проведення гістологічного дослідження тканини печінки невеликі фрагменти центральної частини правої частки органу фіксували 10 % розчином нейтрального формаліну протягом не менше 48 годин, потім його промивали, зневоднювали за допомогою систем багатоатомних спиртів і заливали в парафінові блоки за стандартною схемою. В подальшому за допомогою санного мікротома "Мікромед МС-2М" готувалися напівтонкі зрізи завтовшки 5-7 мкм. Зрізи забарвлювали гематоксилін-еозином (основний метод забарвлення) та Суданом III (для виявлення крапель жиру). Мікроскопію гістологічних препаратів проводили за допомогою світлового мікроскопа "Olimpus BX-41" при збільшеннях в 40, 100, 200 та 400 разів. Отримані результати наведено в таблицях та графічному матеріалі. Статистичну значимість розбіжностей між групами розраховували за непараметричним методом Уайта, оскільки розподіл величин в групах переважно не відповідав нормальному закону. Вагові показники піддослідних тварин наведено в таблиці 1 у вигляді М±m, де М - середнє арифметичне, m середнє відхилення від середнього. У щурів 4 групи, які отримували високожирову дієту у поєднанні із додатковим введенням гомоцистеїну тіолактону, виявили достовірне збільшення ваги тіла у порівнянні з контрольною групою. Статистично достовірної різниці між вагою тіла щурів групи 2, які отримували стандартну дієту та контрольною групою, а також між щурами групи 3, які отримували високожирову дієту, та контрольною групою, за час експерименту не виявили. Відмічено достовірне збільшення абсолютної ваги печінки в усіх дослідних групах по відношенню до абсолютної ваги печінки у інтактних тварин, а також між вагою печінки тварин групи 4 по відношенню до абсолютної ваги печінки тварин груп 2 та 3. Таблиця 1 Вагові показники піддослідних тварин Показники Вага щурів до експерименту, г Вага щурів після експерименту, г Приріст маси тіла, г Абсолютна вага печінки, г Відносна вага печінки, % 1 261±15 360,5±22,6 99,5±15,5 9,40±0,61 2,90±0,25 Групи тварин (пояснення в тексті) 2 3 4 263±19 262±20 265±32 374,0+28,8 380,2±34,8 400,5±33,5* 111,0±18,8 118,2±21,8 135,5±21,4* 11,37±1,49* 11,76±1,51* 13,83±1,27*#& 3,05±0,30 3,10±0,26 3,46±0,26*#& Примітка тут і далі: (*) - статистична значимість розбіжності відносно групи 1 (контрольної) перевищує 95 %. (#) - статистична значимість розбіжності відносно групи 2 (дослідної) перевищує 95 %. (&) - статистична значимість розбіжності відносно групи 3 (дослідної) перевищує 95 % 3 UA 109085 U 5 10 В зв'язку із збільшенням ваги тіла дослідних тварин у порівнянні з вагою тіла інтактних тварин відносна вага печінки (доля ваги печінки у загальній вазі тіла тварини виражена у відсотках) достовірно відрізняється лише у тварин групи 4 у порівнянні до тварин групи 1 (інтактних). Вивчення показників ліпідного обміну було показало, що у щурів під впливом запропонованого раціону за час досліду було сформовано аліментарну дисліпідемію, що було проявлено достовірним підвищенням рівнів загального холестерину, тригліцеридів, холестерину ліпопротеїнів низької щільності (ХС ЛПНЩ) в сироватці крові (табл. 2). Цікаво, що при цьому концентрація холестерину ліпопротеїнів високої щільності (ХС ЛПВЩ) також достовірно збільшилася, а індекс атерогенності практично не змінився. Таблиця 2 Біохімічні показники сироватки крові піддослідних тварин Показники ЗХС, ммоль/л ТГ, ммоль/л ХС/ЛПВЩ, ммоль/л ХС ЛПНЩ, ммоль/л ХС ЛПДНЩ, ммоль/л ИА, у.о. АЛТ, од/л ACT, од/л АСТ/АЛТ 1 1,24±0,22 0,69±0,40 0,67±0,08 0,20±0,08 Групи тварин (пояснення в тексті) 2 3 1,59±0,16* 1,35±0,18 0,56±0,15 0,83±0,29# 0,75±0,12 0,76±0,12 0,58±0,17* 0,23±0,09 4 1,76±0,28* 1,03±0,30*# 0,85±0Д5* 0,45±0,21*& 0,39±0,11 0,26±0,07* 0,35±0,10 0,42±0,07# 0,85±0ДЗ 46,14±10,18 185,65±48,79 4,08±0,65 1,20±0,38 53,28±12,86 238,44±46,42 4,78±1,18 0,81±0,14 48,09±8,37 189,18±22,22 4,15±0,87 1Д1±0,29& 77,06±22,92*#& 333,48±105,6*& 4,33±1,10 Примітка: показники наведено у вигляді М ± т, де М - середнє арифметичне, m - середнє відхилення від середнього 15 20 25 30 Морфофункціональний стан печінки щурів оцінювали за активністю ферментів сироватки крові - АЛТ, ACT (табл. 2). У тварин, які утримувалися на високожировому раціоні з додатковим введенням гомоцистеїну (група 4), достовірно, майже вдвічі, підвищилася активність цих ферментів, що свідчить про пошкодження цілісності клітин печінки, розвиток цитолітичного синдрому. Але співвідношення активностей АСТ/АЛТ (коефіцієнт де Рітіса) залишилося практично незмінним в усіх групах, що можна трактувати як відсутність переходу патологічного процесу в хронічну форму. Загальна інтерпретація виявлених змін свідчить про формування певних печінкових захворювань. Формування моделі НАЖХП супроводжувалось прогресуванням явища оксидативного стресу в тканинах печінки. Виявлено збільшення рівнів малонового діальдегіду (МДА) в сироватці крові та гомогенаті печінки, який у дослідній 4 групі зріс більш ніж у 2 рази у порівнянні із контрольною групою (табл. 3). Достовірно збільшились рівні NADPH-оксидази в піддослідних групах у порівнянні із контрольною групою та карбонільних груп білка в гомогенаті печінки у 2 та 4 групах експериментальних групах щурів. При цьому відмічалось суттєве зниження активності антиоксидантних ферментів. Так при дослідженні рівнів антиоксидантного захисту було виявлено достовірне зниження активності тіоредоксинредуктази, глутатіонпероксидази та супероксиддисмутази (СОД) в сироватці крові. Фактором, що обумовив дезактивацію цих ферментів було зниження вмісту відновленого глутатіону в печінці щурів в експериментальній 4 групі в порівнянні із контролем майже у 4 рази. Наведені результати вказують на виснаження функціональної здібності антиоксидантної системи при активації перекисного окислення ліпідів. 35 4 UA 109085 U Таблиця 3 Показники системи перекисного окислення ліпідів та антиоксидантного захисту в гомогенаті печінки та сироватці крові щурів Показники Групи тварин (пояснення в тексті) 2 3 Гомогенат печінки 0,46±0,03 0,63±0,03* 0,59±0,05*# 1 МДА, мкмоль/г Тіоредоксинредуктаза, нмоль/хв*мг білка NADPH-оксидаза, нмоль/хв на 1 мг білка Глутатіон відновлений, мкмоль/г білка Карбонільні групи, нмоль/мг білка Глутатіонпероксидаза, нмоль/хв*мг белка СОД, од/мг білка МДА, мкмоль/л 4 0,91±0,08*#& 5,85±0,43 5.02±0,62 4,55±0,62* 4.23±0.39* 1,25±0,14 1.47±0,09* 1,52±0,15* 1.59±0.18* 76,2±11,2 55,4±6,4* 68,5±3,8*# 38,4±4,3*#& 2,15±0,34 2,82±0,32* 2.45±0.22 3.25±0.33*& 12,3±2,6 10,5±1,5 11,2±2,2 8,5±1,0* 1,05±0,12* 0,96±0,18* 3,62±0,41 4,59±0,42* 1,40±0,18 1,18±0,19 Сироватка крові 3,24±0,30 4,07±0,36* Примітка: показники наведено у вигляді М±m, де М - середнє арифметичне, m - середнє відхилення від середнього 5 10 Порівняння показників стеатозу та фіброзу печінки у тварин дослідних груп та контрольної групи продемонструвало, що у щурів 4 групи суттєво підвищився рівень ГЦ в порівнянні із тваринами груп 1, 2, та 3, що свідчить про потенціюючу дію ГЦ у щурів із високожировим раціоном (табл.4). Також було відмічено достовірне збільшення рівнів фосфоліпідів, тригліцеридів та холестерину в гомогенаті печінки, що свідчить про формування стеатозу печінки у щурів. Ця модель також спричиняла розвиток початкових стадій фіброзу, про що свідчить підвищення рівнів TNF- в сироватці крові щурів, зростання гідроксипроліну в печінці в піддослідних групах тварин та гіалуронату в сироватці крові у тварин 3 та 4 груп. Через те, що значення концентрацій С-реактивного білка в сироватці крові знаходилися практично на межі чутливості методу, не вдалося підтвердити достовірність розбіжностей між 3 та 4 групами та контрольною групою. Таблиця 4 Маркери стеатозу та фіброзу печінки в гомогенаті щурів та сироватці крові печінки Показники Гомоцистеїн, мкмоль/л Гідроксипролін, мкг/г Фосфоліпіди, од.опт.г. Григліцериди, мкмоль/г Холестерин, мкмоль/г Гіалуронат, мг/л TNF-, мкг/л С-реактивний мг/л Групи тварин (пояснення в тексті) 2 3 Гомогенат печінки 5,8±0,43 9,6±1,11* 7,4±1,22 389±41,6 510±68,3* 472±51,5* 0,117±0,019 0,146±0,025 0,160±0,020* 18,2±2,1 17,5±1,9 21,6±2,2* 7,14±0,64 8,66±0,93* 8,31±0,82* Сироватка крові 54,1±8,2 60,2±8,8 72,4±9,2* 7,2±1,8 30,2±6,2* 18,6±2,4*# 11,3±0,96*#& 615±58,6*& 0,176±0,008* 26,2±2,1*#& 9,45±0,94* 0,036±0,013 0.068±0,046 1 білок, 0,088±0,039* 0,079±0,041 4 96,6±11,4*#& 32,1±8,8*& Примітка: показники наведено у вигляді М±m, де М - середнє арифметичне, m - середнє відхилення від середнього 5 UA 109085 U 5 10 15 20 25 30 35 Для підтвердження достовірності змін біохімічних показників було проведено гістологічне дослідження. Для цього були детально вивчені гістологічні зрізи тканин печінки, які були забарвлені гематоксилін-еозином та cуданом III з метою виявлення включень жиру. У щурів контрольної групи мікроскопічна структура печінки без патології. Структура печінкових пластинок не порушена, частка сполучної тканини складала 0,5 % (фіг. 1). В поодиноких гепатоцитах проміжної зони класичних печінкових часточок виявляли жирові включення. Частка гепатоцитів з дрібнокрапельною жировою дистрофією цитоплазми на зрізах печінки в класичних печінкових часточках складала менше 5 % від їх загальної кількості. У тварин, яким вводили ГЦ в дозі 100 мг/кг ваги тіла при гістологічному дослідженні печінки було виявлено повнокров'я міжчасточкових вен в портальних зонах, а також синусоїдів та центральних вен в класичних печінкових часточках (фіг. 2). Також було відмічена помірна лейкоцитарна інфільтрація в портальних зонах. Частка гепатоцитів на зрізах печінки в класичних печінкових часточках з дрібнокрапельною жировою дистрофією цитоплазми складала від 35 % до 50 % від їх загальної кількості. При цьому в центральній зоні класичної печінкової часточки було виявлено некрози гепатоцитів, їх кількість складала 2 % від загальної кількості гепатоцитів на зрізах. У щурів, що утримувались на високожировій дієті виявлена лейкоцитарна інфільтрація, однак вона була менш виражена ніж в 2 групі (фіг. 3). Частка гепатоцитів на зрізах печінки в класичних печінкових часточках з дрібнокрапельною жировою дистрофією цитоплазми складала від 50 до 70 % і більше. У тварин групи 4 виявили наступні морфологічні зміни в структурі печінки (фіг. 4): - цитоплазма гепатоцитів прозора, що вказує на набряк; - ядра більшої частини гепатоцитів овальні і містять добре виражені ядерця; - цитоплазма гепатоцитів на зрізах печінки в класичних печінкових часточках містить включення жиру; - частина гепатоцитів містить значну кількість жирових включень; - в наявності розширення центральних вен в класичних печінкових часточках та міжчасточкових вен в портальних зонах. Отже, проведені дослідження дозволили отримати нову експериментальну модель НАЖХП. Ця модель проста у виконанні, дозволяє скоротити час проведення експерименту, а також максимально наближена до клінічного перебігу зазначеного захворювання печінки. Це пояснюється тим, що при використанні запропонованої моделі не застосовуються токсичні агенти, а ефект досягається введенням до складу високожирової дієти надлишкової кількості нормального метаболіту (гомоцистеїну). ФОРМУЛА КОРИСНОЇ МОДЕЛІ 40 Експериментальна модель неалкогольної жирової хвороби печінки у щурів, що включає годування щурів напівсинтетичним гепатопатогенним раціоном, що містить білок, вуглеводи, жири, целюлозу, суміш життєво необхідних солей, суміш вітамінів у фізіологічних дозах, яка відрізняється тим, що для скорочення термінів досягнення та розвитку неалкогольної жирової хвороби печінки щурам щодня протягом 60 діб вводять гомоцистеїну тіолактон у дозі 100 мг/кг ваги. 6 UA 109085 U 7 UA 109085 U Комп’ютерна верстка М. Мацело Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 8
ДивитисяДодаткова інформація
МПК / Мітки
МПК: G01N 33/50, G09B 23/28
Мітки: печінки, експериментальна, неалкогольної, модель, жирової, хвороби, щурів
Код посилання
<a href="https://ua.patents.su/10-109085-eksperimentalna-model-nealkogolno-zhirovo-khvorobi-pechinki-u-shhuriv.html" target="_blank" rel="follow" title="База патентів України">Експериментальна модель неалкогольної жирової хвороби печінки у щурів</a>
Попередній патент: Пристрій для електронно-променевого полірування виробів
Наступний патент: Спосіб діагностики дисбіозу репродуктивного тракту жінок
Випадковий патент: Фармацевтична композиція, яка містить омега-карбоксіарилзаміщену дифенілсечовину, для лікування раку