Спосіб одержання целюлаз з використанням міцеліального гриба, придатного для біореактора, що має низький об’ємний коефіціент перенесення кисню kla
Номер патенту: 112783
Опубліковано: 25.10.2016
Автори: Шосспьє Бернар, Бен Шаабан Фадель, Журдьє Етьєнн, Коен Селін
Формула / Реферат
1. Спосіб одержання целюлаз з використанням штаму, що належить до міцеліального гриба у біореакторі з перемішуванням і аерацією, який включає щонайменше два етапи:
перший етап росту в присутності щонайменше одного вуглецевого ростового субстрату в періодичній фазі, який проводять з концентрацією вуглецевого ростового субстрату в діапазоні від 10 до 60 г/л,
другий етап росту і ферментного вироблення в присутності щонайменше одного вуглецевого субстрату-індуктора в підживлюваній періодичній фазі у присутності обмеженої подачі джерела вуглецю в межах від 50 до 140 мг на грам клітинної біомаси на годину,
і біореактор має коефіцієнт об'ємного перенесення кисню, kLа, в діапазоні від 40 до 180 год-1.
2. Спосіб за п. 1, в якому концентрація вуглецевого ростового субстрату знаходиться в діапазоні від 10 до 20 г/л.
3. Спосіб за п. 2, в якому концентрація вуглецевого субстрату знаходиться в діапазоні від 12 до 17 г/л.
4. Спосіб за одним з попередніх пунктів, в якому подача джерела вуглецю знаходиться в діапазоні від 70 до 100 мг на грам клітинної біомаси на годину.
5. Спосіб за п. 4, в якому подача джерела вуглецю знаходиться в діапазоні від 80 до 90 мг на грам клітинної біомаси на годину.
6. Спосіб за одним з попередніх пунктів, в якому біореактор має коефіцієнт об'ємного перенесення кисню, kLа, в діапазоні від 40 до 150 год-1.
7. Спосіб за одним з попередніх пунктів, в якому вуглецевий ростовий субстрат вибраний з лактози, глюкози, ксилози, залишків, отриманих після етанольної ферментації мономерних цукрів з ферментативних гідролізатів целюлозної біомаси і/або неочищеного екстракту водорозчинних пентоз, що походить з попередньої обробки целюлозної біомаси.
8. Спосіб за одним з попередніх пунктів, в якому вуглецевий субстрат-індуктор є лактозою, целобіозою, сефарозою, залишками, отриманими після етанольної ферментації мономерних цукрів з ферментативних гідролізатів целюлозної біомаси і/або неочищеного екстракту водорозчинних пентоз, що походить з попередньої обробки целюлозної біомаси.
9. Спосіб за одним з попередніх пунктів, в якому вуглецевий ростовий субстрат, вибраний для виробництва біомаси, вносять до біореактора перед стерилізацією.
10. Спосіб за одним з пп. 1-9, в якому вуглецевий ростовий субстрат, вибраний для виробництва біомаси, стерилізують окремо і вводять до біореактора після стерилізації.
11. Спосіб за одним з попередніх пунктів, в якому вуглецевий субстрат-індуктор, який вводять під час підживлюваної періодичної фази, стерилізують незалежно перед введенням в біореактор.
12. Спосіб за одним з попередніх пунктів, в якому використовуваний штам являє собою штам Trichoderma reesei.
13. Спосіб за одним з попередніх пунктів, в якому використовуваний штам являє собою штам Trichoderma reesei, модифікований генетичною мутацією, селекцією або рекомбінацією.
Текст
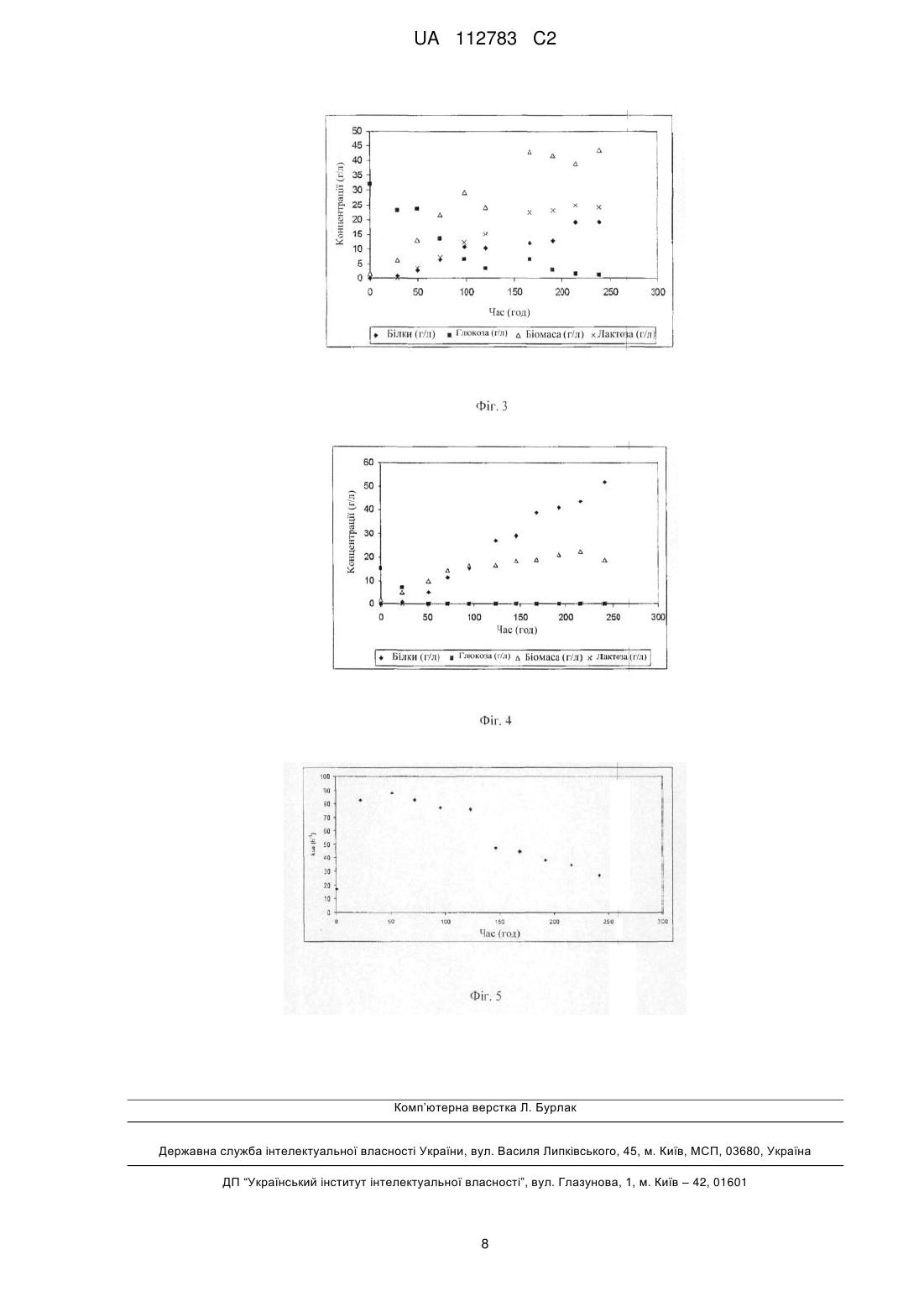
Реферат: Даний винахід належить до способу одержання целюлаз з використанням штаму міцеліального гриба у біореакторі з перемішуванням, аерацією, що включає щонайменше два етапи росту: перший етап росту в присутності щонайменше одного вуглецевого ростового субстрату в періодичній фазі з концентрацією вуглецевого ростового субстрату в діапазоні від 10 до 60 г/л, другий етап росту і вироблення в присутності щонайменше одного вуглецевого субстратуіндуктора в підживлюваній періодичній фазі у присутності обмеженої подачі джерела вуглецю в межах від 50 до 140 мг на грам клітин на годину, і біореактор має коефіцієнт об′много -1 перенесення кисню, KLa, в діапазоні від 40 до 180 год. UA 112783 C2 (12) UA 112783 C2 UA 112783 C2 5 10 15 20 25 30 35 40 45 50 55 Галузь винаходу Винахід стосується способу вироблення целюлаз з використанням міцеліального грибу, необхідного для ферментативного гідролізу лігноцелюлозної біомаси, яку використовують, наприклад, у способах вироблення біопалива, відомих як способи другого покоління або в інших процесах в хімічній, паперовій або текстильній промисловості. Попередній рівень техніки Розвиток економічно життєздатних процесів для вироблення біопалива другого покоління є в даний час "гарячою темою". Ці види палива виробляються з лігноцелюлозної біомаси і породжують менше проблем, що стосується конкуренції з використання земель сільськогосподарського призначення для виробництва продуктів харчування в порівнянні з видами біопалива "першого покоління", які виробляються з цукрової тростини, кукурудзи, пшениці або буряка. Лігноцелюлозна біомаса характеризується складною структурою, утвореною з трьох основних фракцій: целюлози, геміцелюлози і лігнінів. Звичайний спосіб перетворення її в етанол включає ряд етапів. Попередня обробка може зробити целюлозу доступною для ферментів, а саме - целюлаз. Етап ферментативного гідролізу може бути використаний для перетворення целюлози на глюкозу, яку потім перетворюють на етанол під час етапу ферментації, як правило, з використанням дріжджів Saccharomyces cerevisiae. Нарешті, етап дистиляції може відокремити і виділити етанол з бродильного сусла. Різні техніко-економічні дослідження показали, що зниження вартості целюлаз є одним з ключових моментів в біологічних способах вироблення етанолу, починаючи з лігноцелюлозних речовин. В даний час промислові целюлази, як правило, виробляються міцеліальним грибом Trichoderma reesei, через його високу здатність до секреції целюлаз. Стратегія, яка застосовується в промисловості, полягає в тому, щоб викликати швидкий ріст грибку до заданої концентрації, потім індукувати вироблення целюлази, щоб максимізувати продуктивність і вихід. Trichoderma reesei є суворим аеробом і її ріст призводить до значного збільшення в'язкості середовища, що ускладнює перенесення необхідного для її виживання кисню. Перенесення кисню пов'язане з KLa, відомим як коефіцієнт об'ємного перенесення кисню на одиницю об'єму середовища. Це добуток коефіцієнта KL (загальний коефіцієнт обміну O2 в м/с або м/год.) і коефіцієнта "а" (питома площа обміну на одиницю об'єму рідкої фази культурального середовища в м на м культурального середовища). KLa є пропорційним до перемішування і аерації. Для того щоб задовольнити біологічну потребу в кисні, яка підвищується протягом фази росту гриба, необхідно підвищити перенесення кисню, що, як правило, досягається збільшенням перемішування або проточної швидкості аерації. Це призводить до підвищення споживання енергії даним процесом (струм до двигуна для перемішування і компресора для аерації) із збільшенням, як наслідок, експлуатаційних витрат. Витрати, пов'язані з перемішуванням і аерацією можуть становити до 50 % від експлуатаційних витрат способу вироблення целюлаз. Одним із шляхів зниження вартості вироблення ферментів, таким чином, є зменшення експлуатаційних витрат через модифікацію виконання способу, з тим, щоб мінімізувати необхідний KLa при збереженні целюлозної продуктивності. Це також означає, що збільшення масштабу може бути спрощене, що стосується розмірів промислового ферментера (зазвичай 3 -1 від 100 до 1000 м ), яке стає складним для значень KLa більше 200 год. . Ферменти ферментативного комплексу Trichoderma reesei містять три основних типи активності: ендоглюканази, екзоглюканази та целобіази або β-глюкозидази. Інші білки з функціями або активностями, які є життєво важливими для гідролізу лігноцелюлозних матеріалів, також виробляються Trichoderma reesei, наприклад ксиланази. Наявність субстратуіндуктору є життєво важливим для експресії целюлолітичних і/або геміцелюлолітичних ферментів. Регуляція генів целюлаз різними джерелами вуглецю була докладно вивчена. Вони індукувалися в присутності целюлози, продуктів її гідролізу (наприклад, целобіози) або певних олігосахаридів, таких як лактоза або софороза (Ilmen et al., 1997; Appl Environ Microbiol 63: 12981306). Звичайні методи генетичних мутацій уможливили селекцію штамів Trichoderma reesei, які надпотужно виробляють целюлази, таких як штами MCG77 (Gallo - патент США № 4275167), MCG 80 (Allen, AL & Andreotti, RE, Biotechnol-Bioengi 1982, 12, 451-459 1982), RUT C30 (Montenecourt, B.S. & Eveleigh, DE, Appl Environ Microbiol 1977, 34, 777-782) і CL847 (Durand et al., 1984, Proc Colloque SFM "Génétique des microorganismes industriels" [Генетика промислових мікроорганізмів], Париж. H. HESLOT Ed, pp. 39-50). 1 UA 112783 C2 5 10 15 20 25 30 35 40 45 50 55 Для того щоб отримати хорошу продуктивність ферменту, промислові способи для вироблення целюлаз, такі як описані в патенті Франції №2881753, наприклад, здійснюються в два етапи: • етап росту у "періодичному" режимі, де необхідно надати джерело вуглецю, яке може швидко засвоюватись для росту Trichoderma reesei, потім • "періодичний підживлюваний" етап вироблення, з використанням субстрату-індуктора, такого, наприклад, як лактоза, який дозволяє експресію і секрецію в культуральне середовище целюлаз. Безперервна подача таких розчинних вуглецевих субстратів, тим самим обмежуючи залишкову концентрацію в культурах і, таким чином, оптимізуючи кількість цукру, означає, що можуть бути досягнуті високі ферментативні продуктивності. Оптимальна подача вуглецевого джерела, використаного у цитованому патенті, знаходиться в діапазоні від 35 до 45 мг (цукру) г -1 -1 (сухої маси клітин) , год. . Цей протокол має недолік - необхідність високого виходу енергії, щоб задовольнити потребу мікроорганізму в кисні. Наприкінці фази росту потреба в кисні дуже висока. Насправді, коли всі субстрати доступні в надлишку, ріст відбувається зі швидкістю росту, близькою до максимальної швидкості росту для даного штаму. Біологічна потреба в кисні, яка є функцією швидкості росту і концентрації біомаси, буде зростати. Оскільки культури регулюють концентрацію розчиненого кисню до постійного значення, швидкість перенесення кисню ШПК повинна дорівнювати швидкості споживання кисню ШСК (або біологічній потребі в кисні). kLa *(О2*-О2L)= (μ*X)/RX/О2 де: О2*: концентрація насиченого кисню O2L: концентрація кисню в рідкій фазі -1 μ: швидкість росту мікроорганізму (год. ) RX/О2: вихід клітинної біомаси по відношенню до спожитого кисню X = концентрація клітинної біомаси (суха маса) Цей тип процесу, таким чином, потребує kLa, що є дуже високим, для того, щоб задовольнити цю потребу. Це зазвичай здійснюється шляхом збільшення перемішування (або аерації), споживаючи електричну енергію. Якщо kLa зменшується наполовину, максимальна біомаса, яку можна отримати з тією ж самою швидкістю росту, зменшується вдвічі. Можливо отримати таку ж кількість біомаси з більш низькою швидкістю росту, але це вимагає більше часу і, таким чином, викликає падіння кінцевої продуктивності для секретованих ферментів. Даний винахід може бути використаний для кращого керування біологічною потребою в кисні без зниження продуктивності ферменту. Це стало можливим за рахунок використання фізіологічних характеристик міцеліальних грибів, таких як Trichoderma reesei, в обмежуючих умовах по відношенню до вуглецевого субстрату. Суть винаходу Даний винахід стосується виробництва целюлаз міцеліальним грибом, який можна використовувати для підтримання ефективності ферментного вироблення, за допомогою біореактора з низьким об'ємним коефіцієнтом перенесення кисню kLa. Опис креслень Фігура 1 представляє порівняння значень, змодельованих на моделі з використанням експериментальних значень, наведених в статті Tolan & Foody (1999), отриманих з іншим штамом Trichoderma reesei. Фігура 2 представляє зміну концентрації біомаси, білків і kLa відповідно до Прикладу 1. Фігура 3 представляє зміну змінних стану з часом, відповідно до Прикладу 2. Фігура 4 представляє зміну змінних стану з часом, відповідно до Прикладу 3. Фігура 5 представляє зміну k La з часом, відповідно до Прикладу 3. Докладний опис винаходу Даний винахід стосується способу вироблення целюлаз з використанням штаму міцеліального гриба в біореакторі з перемішуванням та аерацією, що включає щонайменше два етапи: • перший етап росту в присутності щонайменше одного вуглецевого ростового субстрату в періодичній фазі з концентрацією вуглецевого ростового субстрату в діапазоні від 10 до 80; • другий етап росту і вироблення в присутності щонайменше одного вуглецевого субстратуіндуктора в періодичній підживлюваній фазі у присутності обмеженої подачі джерела вуглецю в діапазоні від 50 до 140 мг на грам клітин на годину. Переважно, концентрація вуглецевого ростового субстрату знаходиться в діапазоні від 10 до 20 г/л. Більш переважно, вона знаходиться в діапазоні від 12 до 17 г/л. 2 UA 112783 C2 5 10 15 20 25 30 35 40 45 50 55 60 Протягом фази росту концентрація вуглецевого субстрат є такою, що ріст відбувається з максимальною швидкістю росту. Переважно, концентрація вуглецевого субстрату-індуктора, використаного в періодичній підживлюваній фазі, знаходиться в діапазоні від 70 до 100 мг на грам клітин на годину. Ще більш переважно вона знаходиться в діапазоні від 80 до 90 мг на грам клітин на годину. Біореактор, використаний в даному винаході, може, таким чином, мати об'ємний коефіцієнт -1 перенесення кисню kLa в діапазоні від 40 до 180 год. , переважно в діапазоні від 40 до 150 год. 1 . Другий етап здійснюється в умовах обмеження вуглецевого субстрату-індуктора подачею, яка є нижче максимальної здатності штаму до споживання. Вуглецевий ростовий субстрат переважно вибирають з лактози, глюкози, ксилози, залишків, отриманих після етанольної ферментації мономерних цукрів з ферментативних гідролізатів целюлозної біомаси і/або неочищеного екстракту водорозчинних пентоз, що походить від попередньої обробки целюлозної біомаси. Вуглецевий субстрат-індуктор переважно вибирають з лактози, целобіози, софорози, залишків, отриманих після етанольної ферментації мономерних цукрів з ферментативних гідролізатів целюлозної біомаси і/або неочищеного екстракту водорозчинних пентоз, що походить від попередньої обробки целюлозної біомаси. Ростові субстрати-індуктори, наведені вище, можуть бути використані окремо або у вигляді суміші. Залежно від своєї природи, вуглецевий ростовий субстрат, вибраний для виробництва біомаси, вводять до ферментеру перед стерилізацією або його стерилізують окремо і вводять до біореактору після стерилізації. Вуглецевий субстрат-індуктор, введений під час періодичної підживлюваної фази, перед введенням до реактору стерилізують незалежно. Переважно, коли індукуючим джерелом вуглецю є лактоза, водний розчин готують у концентрації 200-250 г/л. Спосіб за даним винаходом можна використовувати для отримання аналогічної целюлазної продуктивності, використовуючи біореактор із здатністю до перенесення кисню в два з -1 -1 половиною рази менше, тобто KLa від 100 год. замість 250 год. . Кореляція, яка поєднує KLa з потужністю, що розсіюється в біореакторах, які аеруються і перемішуються, як, наприклад, вказано у доповіді NREL "Lignocellulosic biomass to ethanol process design and economics utilizing co-current dilute acid prehydrolysis and enzymatic hydrolysis, current and futuristic scenarios", R Wooley et al. NREL/TP-580-26157 (1999), розділ вироблення ферменту, виглядає наступним чином: 0,4 0,5 KLa=0,026*(P/V) *VG в якому: 3 P/V: розсіяна потужність, in W/m VG: поверхнева швидкість газу (м/с). -1 Таким чином, відповідно до цієї кореляції, розсіяна потужність (P/V) для K La 100 год. -1 приблизно в 10 разів менше, ніж необхідно, коли K La становить 250 год. . Перевагою процесу за даним винаходом є можливість спрощення в масштабуванні способу 3 до промислового масштабу (зазвичай від 100 до 1000 м ) і скорочення експлуатаційних витрат. Процес є дуже простим, надійним і використовує фізіологічні властивості гриба в умовах обмеження вуглецевого субстрату. У порівнянні із звичайним способом, робочий режим був адаптований з одного боку за рахунок зменшення початкової концентрації ростового субстрату протягом першої фази "періодичного" режиму способу, з тим щоб зменшити максимальну біологічну потребу в кисні в кінці цієї фази, і з іншого боку, за рахунок збільшення подачі вуглецевого субстрату під час "періодичної підживлюваної" фази, щоб продовжити виробництво клітинної біомаси під час початку цієї фази при зниженій швидкості росту, одночасно з ферментами. Фізіологічні властивості гриба використані, щоб визначити швидкість подачі підживлення періодики і бажану концентрацію біомаси. Це означає, що остаточна ефективність вироблення може бути підтримана, вимагаючи при цьому меншої здатності до перенесення кисню для біореактора. Штам, використаний в способі, являє собою штам міцеліального гриба, що належить до родів Trichoderma, Aspergillus, Penicillium або Schizophyllum. Переважно, використані штами є штамами, що належать до виду Trichoderma reesei. Використані промислові штами відносяться до виду Trichoderma reesei, можливо модифіковані для поліпшення целюлолітичних і/або геміцелюлолітичних ферментів за 3 UA 112783 C2 5 10 15 20 25 30 35 40 45 50 55 допомогою процесів мутації-селекції, такі як, наприклад, штам IFP CL847; штами, поліпшені методами генетичної рекомбінації також можуть використовуватись. Ці штами культивують в ферментерах з перемішуванням і аерацією за умов, які сумісні з їх ростом і з виробленням ферменту. Можуть бути використані інші штами мікроорганізмів, які виробляють ферменти з використанням процесів, аналогічних тим, які використовуються для Trichoderma. Переважно, використовуваний штам є штамом Trichoderma reesei, модифікованим генетичною мутацією, селекцією або рекомбінацією. Як приклад, штам є штамом CL847, RutC30, MCG77 або MCG80. Подача вуглецевого субстрату-індуктора, qs, з більш ніж приблизно 140 мг цукру на г біомаси на год. викликає накопичення цукру в середовищі і змінює фізіологічну поведінку Trichoderma reesei, в результаті чого відбувається падіння питомої швидкості виробництва білка, qp (явище катаболічної репресії). Шляхом обмеження цієї подачі до значень в діапазоні від 50 до 140 мг цукру на грам біомаси на годину, в умовах обмеження, штам одночасно виробляє біомасу і ферменти, і прагне до стану рівноваги, де він виробляє тільки ферменти. На підставі цих спостережень була створена модель, яку застосували для моделювання -1 безперервного виробництва біомаси та ферментів при ступені розведення 0,018 год. для різних початкових концентрацій вуглецевого субстрату. Умови відповідають дослідженням, описаним у статті Tolan & Foody ("Cellulase from submerged fermentation", (1999), Adv in biochemical engineering biotechnology, Vol 65, p. 42-67), яка цитує роботу Nicholson et al. (1989) (Proceedings of the 7th Canadian bioenergy seminar, Energy Mines, and Resources) і надає експериментальні результати для концентрацій біомаси і білків. Ми взяли визначені кінетичні параметри для штаму CL847, навіть якщо ці автори використали інший штам. Результати представлені на Фігурі 1 і показують дуже гарну відповідність між моделлю і експериментом. Це також показує, що ця модель є дійсною для інших штамів Trichoderma reesei, які мають таку саму фізіологічну поведінку як штам CL847. Концентрація вуглецевого ростового субстрату протягом періодичної фази була нижчою в порівнянні з попереднім рівнем техніки (FR № 2881753) з метою зниження максимальної -1 біологічної потреби в кисні в кінці цієї фази (при μmax) для біореактора з k La 100 год. . Згодом подачу вуглецевого субстрату під час "періодичної підживлюваної" фази підвищили в порівнянні з патентом Франції № 2881753, який рекомендував подачу в діапазоні від 35 до 45 мг вуглецевого субстрату-індуктора на грам біомаси на годину. Це означало, що на початку цієї фази вироблення біомаси може бути продовжене одночасно з виробленням ферментів, але при зниженій швидкості росту, що означає, що біологічною потребою в кисні можна керувати. Подачу джерела вуглецю протягом підживлювальної періодичної фази, таким чином, було збільшено до величини більше 50 мг цукру на грам біомаси на годину на початку підживлюваної періодичної фази. Ріст тривав одночасно з виробленням ферментів і стабілізувався, коли подача вуглецевого джерела була близькою до оптимальної для даного штаму. Приклади У наведених нижче прикладах, Приклад 1 представляє культуру, використовуючи стандартні -1 умови патенту FR № 2 881753 в біореакторі, з k La, що дорівнює 250 год. . Приклад 2 представляє експеримент, проведений у тих самих умовах, як і у Прикладі 1, у ферментері з -1 kLa, що дорівнює 100 год. . Цей приклад призвів до накопичення вуглецевого субстрату з високим виробленням біомаси та низьким виробленням ферменту. Приклад 3 був здійсненням способу за даним винаходом. Його було використано для отримання продуктивності, аналогічної до Прикладу 1 в -1 біореакторі з kLa, що дорівнює 100 год. . Приклад 1: Вироблення ферментів на глюкозі Виробництво целюлази проводили в механічно перемішуваному ферментері. Мінеральне середовище мало наступний склад: КОН 1,66 г/л, 85 % H3PO4 2 мл/л, (NH4)2SО4 2,8 г/л, MgSО4*7H2О 0,6 г/л, CaCl2 0,6 г/л, MnSО 4 3,2 мг/л, ZnSО4*7 H2О 2,8 мг/л, CoCl2 104,0 мг/л, FeSО4*7H2O 10 мг/л, кукурудзяний екстракт 1,2 г/л, піногасник 0,5 мл/л Ферментер, що містить мінеральне середовище, стерилізували при 120 °C протягом 20 хвилин, вуглецевим джерелом був розчин глюкози, стерилізований при 120 °C протягом 20 хв., який потім додавали до ферментеру стерильним способом для отримання кінцевої концентрації 30 г/л. Ферментер засівали 10 % (об'єм/об'єм) рідкої попередньої культури Trichoderma reesei штаму CL847. Мінеральне середовище для попередньої культури було ідентичне такому з ферментера, окрім додавання 5 г/л фталату калію для буферизації рН. Ріст грибка протягом попередньої культури проводили з використанням глюкози як вуглецевого субстрату в концентрації 30 г/л. Ріст інокуляту тривав від 2 до 3 днів при 28 °C в інкубаторі при 4 UA 112783 C2 5 10 15 20 25 30 35 4045 50 55 60 перемішуванні при атмосферному тиску. Перенесення до ферментеру проводили, якщо залишкова концентрація глюкози становила менше 15 г/л. Експеримент, який проводили в біореакторі, включав дві фази: • фаза росту на глюкозному вуглецевому субстраті (початкова концентрація = 30 г/л) при температурі 27 °C і рН 4,8 (встановленим за допомогою 5,5 М аміачного розчину). Аерація була 0,5 л/л/хв і перемішування було збільшено до між 200 і 800 обертів на хвилину в залежності від тиску O2 (тиск розчиненого кисню), який було встановлено на 30 %. • фаза вироблення ферменту. Через 30 год. розчин 250 г/л лактози безперервно вводили зі швидкістю протоку 35 мг на грам клітин на годину протягом 250 годин. Температуру знизили до 25 °C і рН до 4, доки культивування не скінчилося. Значення рН було встановлено додаванням 5,5 М аміачного розчину, який надавав азот, необхідний для синтезу білків, які виділяються у культуральне середовище. Кількість розчиненого кисню О2 підтримували вище 30 % за рахунок перемішування. За виробленням ферменту йшов аналіз позаклітинних білків методом Лоурі, на основі калібрування, проведеного з BSA ("бичачий сироватковий альбумін"), після відділення міцелію за допомогою фільтрації або центрифугування. Визначали наступні целюлолітичні активності: - активність фільтрувального паперу або FP, виражена в FPU (одиниці фільтрувального паперу), яку можна використовувати для аналізу загальної активності ферментативного пулу ендоглюканаз і екзоглюканаз; - β-глюкозидазна і ксиланазна активності для специфічних активностей. Активність FP вимірювали на папері Whatman N°1 (методика, рекомендована біотехнологічною комісією IUPAC) при початковій концентрації 50 г/л; було визначено випробуваний зразок ферментативного розчину для аналізу, який вивільняв еквівалент 2 г/л глюкози (колориметричний аналіз) протягом 60 хвилин. Принцип активності фільтрувального паперу у визначенні, за допомогою аналізу DNS (динітросаліцилової кислоти), кількість відновлюючих цукрів, отриманих з паперу Whatman N°1. Для визначення β-глюкозидазної активності було використано p-нітрофеніл-бета-Dглюкопіранозид (PNPG) як субстрат. Він розщеплюється β-глюкозидазою, яка вивільняє pнітрофенол. Одна β-глюкозидазна одиниця визначається як кількість ферменту, необхідного для отримання 1 мкМоль р-нітрофенолу з PNPG на хвилину і виражається в МО/мл. Принцип аналізу ксиланазної активності знаходиться у визначенні, шляхом DNS аналізу, кількості відновлених цукрів, отриманих з гідролізованого розчину ксилану. Цей метод аналізу використовує відновлювальні властивості цукрів, головним чином ксилози. Ксиланазна активність виражається в МО/мл і відповідає кількості ферменту, необхідного для отримання 1 мкМоль ксилози на хвилину. Специфічні активності отримують діленням активностей, виражених в МО/мл, на концентрацію білків. Вони виражаються в МО/мг. Значення KLa були визначені з газових балансів після перевірки вуглецевого і окиснювально-відновного балансів. Аналітичні визначення на остаточному суслі Прикладу 1 дали наступні результати: Клітинна біомаса, г/л = 15,5 Білки, г/л = 50,2 Продуктивність = 0,20 г/л/год. FPU=29,1 МО/мл Специфічна ксиланаза = 8,2 МО/мг Специфічна β-глюкозидаза = 1,0 МО/мг Фігура 2 повторює зміну в концентрації біомаси, білків і KLa з плином часу. Очевидно, що -1 клітинна біомаса підвищилася до 15 г/л в перші 50 годин експерименту і що K La було 240 год. . Концентрація білків підвищилася несильно протягом перших 50 годин, потім різко з того моменту, з якого концентрація біомаси була стабільною. Вона досягла 50 г/л, коли культивування було завершене. Приклад 2: Приклад 2 було здійснено при тих самих умовах, що і Приклад 1, за винятком того, що -1 використаний ферментер мав максимальну KLa 100 год. і його первинний об'єм був 750 мл. Ферментація призвела до високого вироблення клітинної біомаси (45 г/л) і низького вироблення білка (19 г/л) (див. Фігуру 3). Це було обумовлено наявністю великих залишкових концентрацій вуглецевого субстрату (лактози, глюкози) протягом усього експерименту. Це перезапустило вироблення целюлази, яке було індуковане в умовах обмеження за вуглецевим субстратом-індуктором. Глюкоза не була 5 UA 112783 C2 5 10 15 20 25 30 35 спожита, коли здатність до перенесення кисню даного біореактора була в 2,5 рази менше, що знизило швидкість споживання вуглецевого субстрату, яка була пропорційна швидкості споживання О2. Фактично, швидкість перенесення кисню виражається наступним чином: ШПК = KLa (О2*-О2L) в якій: O2*: концентрація насиченого кисню, O2L - концентрація кисню в рідкій фазі. Швидкість споживання кисню, таким чином, була обмежена ШПК, який був в 2,5 рази менше. Аналітичні визначення у остаточному суслі надали наступні результати: Клітинна біомаса, г/л - 45, Білки, г/л = 19 FPU=10,1 МО/мл, Специфічна ксиланаза = 8,5 МО/мг, Специфічна β-глюкозидаза = 1,2 МО/мг Приклад 3 (за винаходом): -1 Використовували біореактор з KLa 100 год. , але процес вироблення був змінений, щоб бути у відповідності з цим винаходом. Початкову концентрацію глюкози, таким чином, було знижено до 15 г/л так, щоб максимальна біологічна швидкість споживання молекулярного кисню була сумісною з використаним ферментером. Вихід вироблення клітинної біомаси по відношенню до глюкози був 0,5 г/г, коли вона була в надлишку. Це означає, що максимальна швидкість споживання молекулярного кисню для цієї кількості глюкози була 0,5 г/л/год. (при максимальній швидкості -1 росту 0,08 год. і виході перетворення молекулярного кисню на біомасу 1,2 г/г). Підживлювана періодична фаза була розпочата після 24 годин з подачею 89 мг субстрату на грам біомаси на годину (розчин 250 г/л лактози). Фаза росту відбувалася одночасно з виробленням білку. Останній досяг 51,7 г/л після 240 годин експерименту (Фігура 4). Остаточна продуктивність білка, таким чином, зберігалася, незважаючи на використання ферментеру із зниженою здатністю до перенесення. Вона становила 0,21 г/л/год. (це було 0,20 г/л/год. у випадку Прикладу 1). -1 Фігура 5 ілюструє зміну у k La в ході експерименту; він залишився нижче 100 год. . Аналітичні визначення на остаточному суслі дали наступні результати: Клітинна біомаса, г/л = 18,9 Білки, г/л = 51,7 Продуктивність = 0,21 г/л/год. FPU=30,1 МО/мл Специфічна ксиланаза = 9,5 МО/мг Специфічна β-глюкозидаза = 1,12 МО/мг. ФОРМУЛА ВИНАХОДУ 40 45 50 55 60 1. Спосіб одержання целюлаз з використанням штаму, що належить до міцеліального гриба у біореакторі з перемішуванням і аерацією, який включає щонайменше два етапи: перший етап росту в присутності щонайменше одного вуглецевого ростового субстрату в періодичній фазі, який проводять з концентрацією вуглецевого ростового субстрату в діапазоні від 10 до 60 г/л, другий етап росту і ферментного вироблення в присутності щонайменше одного вуглецевого субстрату-індуктора в підживлюваній періодичній фазі у присутності обмеженої подачі джерела вуглецю в межах від 50 до 140 мг на грам клітинної біомаси на годину, -1 і біореактор має коефіцієнт об'ємного перенесення кисню, kLа, в діапазоні від 40 до 180 год . 2. Спосіб за п. 1, в якому концентрація вуглецевого ростового субстрату знаходиться в діапазоні від 10 до 20 г/л. 3. Спосіб за п. 2, в якому концентрація вуглецевого субстрату знаходиться в діапазоні від 12 до 17 г/л. 4. Спосіб за одним з попередніх пунктів, в якому подача джерела вуглецю знаходиться в діапазоні від 70 до 100 мг на грам клітинної біомаси на годину. 5. Спосіб за п. 4, в якому подача джерела вуглецю знаходиться в діапазоні від 80 до 90 мг на грам клітинної біомаси на годину. 6. Спосіб за одним з попередніх пунктів, в якому біореактор має коефіцієнт об'ємного -1 перенесення кисню, kLа, в діапазоні від 40 до 150 год . 7. Спосіб за одним з попередніх пунктів, в якому вуглецевий ростовий субстрат вибраний з лактози, глюкози, ксилози, залишків, отриманих після етанольної ферментації мономерних 6 UA 112783 C2 5 10 15 цукрів з ферментативних гідролізатів целюлозної біомаси і/або неочищеного екстракту водорозчинних пентоз, що походить з попередньої обробки целюлозної біомаси. 8. Спосіб за одним з попередніх пунктів, в якому вуглецевий субстрат-індуктор є лактозою, целобіозою, сефарозою, залишками, отриманими після етанольної ферментації мономерних цукрів з ферментативних гідролізатів целюлозної біомаси і/або неочищеного екстракту водорозчинних пентоз, що походить з попередньої обробки целюлозної біомаси. 9. Спосіб за одним з попередніх пунктів, в якому вуглецевий ростовий субстрат, вибраний для виробництва біомаси, вносять до біореактора перед стерилізацією. 10. Спосіб за одним з пп. 1-9, в якому вуглецевий ростовий субстрат, вибраний для виробництва біомаси, стерилізують окремо і вводять до біореактора після стерилізації. 11. Спосіб за одним з попередніх пунктів, в якому вуглецевий субстрат-індуктор, який вводять під час підживлюваної періодичної фази, стерилізують незалежно перед введенням в біореактор. 12. Спосіб за одним з попередніх пунктів, в якому використовуваний штам являє собою штам Trichoderma reesei. 13. Спосіб за одним з попередніх пунктів, в якому використовуваний штам являє собою штам Trichoderma reesei, модифікований генетичною мутацією, селекцією або рекомбінацією. 7 UA 112783 C2 Комп’ютерна верстка Л. Бурлак Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 8
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for the production of cellulases by a filamentous fungus adapted to a fermenter having a low volumetric oxygen transfer coefficient kla
Автори англійськоюBen Chaabane, Fadhel, Jourdiet, Etienne, Cohen, Celine, Chaussepied, Bernard
Автори російськоюБэн Шаабан Фадель, Журдье Этьенн, Коэн Сэлин, Шосспье Бэрнар
МПК / Мітки
МПК: C12N 9/42
Мітки: біореактора, целюлаз, міцеліального, об'ємний, низькій, кисню, використанням, одержання, коефіціент, придатного, має, гриба, перенесення, спосіб
Код посилання
<a href="https://ua.patents.su/10-112783-sposib-oderzhannya-celyulaz-z-vikoristannyam-micelialnogo-griba-pridatnogo-dlya-bioreaktora-shho-maeh-nizkijj-obehmnijj-koeficient-perenesennya-kisnyu-kla.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання целюлаз з використанням міцеліального гриба, придатного для біореактора, що має низький об’ємний коефіціент перенесення кисню kla</a>
Попередній патент: Гофрувальна суміш та її застосування
Наступний патент: Спосіб лікування та/або профілактики нейродегенеративних розладів
Випадковий патент: Спосіб спостереження низькоорбітальних супутників землі і опорних зірок