Спосіб одержання стероїдних напівпродуктів або їх 22r/s стереоізомерів
Номер патенту: 19288
Опубліковано: 25.12.1997
Автори: Пер Тур Андерсон, Віл'ям Трофаст, Брор Арне Тален, Пол Хекан Андерсон, Бенгт Ігемар Аксельсон
Формула / Реферат
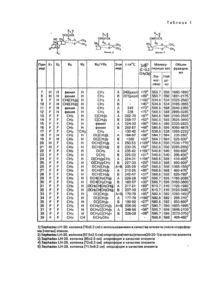
Способ получения стероидных полупродуктов общей формулы I
или их 22 R/S стереоизомеров, где
одинарная или двойная углерод-углеродная связь;
Х1 - водород или фтор;
Х2 - водород или фтор;
R1 - линейный или разветвленный С1-С10-алкил;
R2 - атом водорода или линейный С1-С10-ацил,
отличающийся тем, что соединения общей формулы II
где Х1, Х2 и R2 имеют указанные значения,
подвергают взаимодействию с альдегидом общей формулы III
где R1 имеет указанные значения, в присутствии кислотного катализатора такого, как хлорная кислота с последующим выделением целевых продуктов или разделением на отдельные 22 R/S стереоизомеры.
Текст
Изобретение относится к способу получения новых стероидных промежуточных продуктов общей формулы 1 или их 22 R/S стереоизомеров, где символ означает одинарную или двойную углерод-углеродную связь: Х1 - атом водорода или фтора; Х2 - атом водорода или фтора; R1 - линейный или разветвленный С1-С10 алкил; R2 - атом водорода или линейный C1-С10 ацил, пригодных для получения новых фармакологически активных стероидных сложных эфиров, обладающи х высоким связующим средством относительно глюкокортикостероидного рецептора, что обуславливает противовоспалительные свойства. Цель изобретения - создание промежуточных продуктов для синтеза новых стероидных соединений, а обладающих преимуществами в фармакологическом отношении перед известными аналогами. В нижеприведенных примерах, при проведении опытов препаративной хроматографии применяют объемную скорость движения потока 2,5 мл/см 2 · ч-1. Во всех примерах молекулярные веса определены посредством электронной ударной масс-спектрометрии. Точки плавления измерены на микроскопе с обогреваемым столиком, фирмы "Lettz", Ветцлар, ФРГ. Все анализы HPLC (HPLC = высокоаффективная жидкостная хроматография) проведены с колонкой Waters μ Bondapak C18 (300 х 3,9мм внутренний диаметр) при объемной скорости потока 1,0 мл/мин и смесью этанола с водой в соотношении от 50:50 до 60:40 в качестве подвижной фазы. Пример 1. Получение (22RS)-, {22R> и (22RS)-11b-16a-17a -21-тетраоксипрегна-1,4-диен-3,20-дион-16 a, 17 a ацеталей. Приготовление (22RS)-, (22R)- и (22S)-16 a, 17 a-бутилидендиокси-6a, 9a-дифтор-11 β, 21-диоксипрегна1,4-диен-3,20-диона. А. К суспензии 1,0 г 6a, 9a-дифтор-11 β, 16a, 17a, 21-тетраоксипрегна-1,4-диен-3,20-диона в 500 мл метиленхлориде добавляют 0,32 мл свежеперегнанного н-бутанола и 2 мл 72%-ной хлорной кислоты. Реакционную смесь оставляют стоять при комнатной температуре и при перемешивании на 24 ч. Реакционную смесь промывают 10%-ным водным раствором карбоната калия и водой, высушивают над сульфатом натрия и выпаривают. Остаток растворяют в этилацетате и осаждают петролейным эфиром. Остается 883 мг (22RS)-16a, 17 a-бутилидендиокси-6a, 9a-дифтор-11 β, 21-диоксипрегна-1,4-диен-3,20диона. HPLC-анализ показал 99%-ную частоту и соотношение 16:84 у 22S и 22R-эпимеров. Молекулярный вес: 466. (Вычислено 466,5) (22R/S) эпимерную смесь хроматографируют на колонке "Сефадекс LH-20" (76 х 6,3 см) с применением гептан: хлороформ: этанол, 20:20; 1 в качестве подвижной фазы. Фракции 1231513425мл(А) и 13740-15690 мл (В) собирают, выпаривают, остаток растворяют в метиленхлориде и осаждают петролейным эфиром. Фракция (А) дает 62 мг (22S)- и фракция В 687 мг (22R)-16a, 17 a-бутилидендиокси6 a, 9a-дифтор-11 β, 21-диоксипрегна-1,4-диен-3,20-диона (22S)-эпимер:молекулярный вес 466 (вычислено 466,5) т.пл. 196-200°С (22R)-эпимер:молекулярный вес 466 (вычислено 466,5), т.пл.: 169-172°С. В. К раствору 1,0 г 6о, 9a-дифтор-11b, 21-диокси-16 a, 17 a-/(1 метилэтилиден)бис-окси)/прегна -1,4диен-3,20-диона в 500 мл метиленхлорида добавляют 0,30 мл свежеперегнанного н-бутанала и 2 мл 72%-ной хлорной кислоты. Реакционную смесь оставляют стоять 24 ч при 33°С и перемешивании экстрагируют водным раствором карбоната калия и водой, высушивают над сульфа том натрия и выпаривают. Остаток растворяют в метиленхлориде и осаждают петролейным эфиром. Выход 848 мг (22RS) 16 а, 17a-бутилидендиокси-6a, 9a-дифтор-11b, диоксипрегна-1,4-диен-3,20-диона. HPLC-анализ показал 93 %-ную ступень чистоты и отношение 12/88 между 22S- и 22R-эпимерами. В1. К суспензии 4,0 г 6a, 9a-дифтор-11 β, 21-диокси-16a, 17a-/(1-метилэтилиден) бис(окси)/прегна-1,4диен-3,20-диона в 100 мл гептана добавляют 1,2 мл свежеперегнанного н-бутакала и 3,8 мл 72%-ной хлорной кислоты. Реакционную смесь оставляют стоять при комнатной температуре на 5 ч при интенсивном перемешивании, экстрагируют водным карбонатом калия и водой, высушивают над сульфатом натрия и выпаривают. Выход: 4,0 г (22RS)-16 a, 17 a-бутилидендиокси-6a, 9a-дифтор-11 β, 21-диокси-прегна-1,4-диен3,20-диона. HPLC-анализ показал 98,5%-ную чистоту и отношение между 22S и 22R-эпимерами 3/97. После 2 перекристаллизации из хлороформа с петролейным эфиром получено 3,1 г 22R-эпимера, содержащего всего лишь 1,1% 22S-эпимера и 1,3% других загрязняющих примесей. С. Подобным же образом, следуя процедуре изложенной в примере 1В, замещением 6a, 9a -дифтор-11b 16a, 17a, 21 -тетра-оксипрегна-1,4-диен-3,20-диона-11β, 16a, 17a, 21-тетраоксипрегна-1,4-диен-3,20-ди-он получают 9a-фтор- и 6a-фтор-11b, 16a, 17a, 21-тетраокси-прегна-1,4-диен-3,20-дион или соответствующие 16a, 17a-ацетониды нефторированных и фторированных несимметричных (22RS)- (22R)- и (22S)-11b, 16a, 17a, 21-тетраоксипрегна-1,4-диен-3,20-дион 16a, 17a-ацетали из ацетальдегида, пропанала, бутанала, изобутанала, пентанала, 3-метилбутанала, 2,2-диметил-пропанала, гексанала, гептанала, октанала, нонанала и додеканала. Пример 2. А. Преднизолон 16α, 17α -ацетонид (250 мг; 0,6 ммоля) растворяют в 75 метиленхлорида. Добавляют н-бутанал (130 мг 1,8 ммоля) и 70%-ную хлорную кислоту (0,025 мл). Раствор перемешивают при 33°С 15 ч. Желтый раствор промывают 2 х 10 мл 10%-ного раствора карбоната калия и 4 х 10 мл воды, высушивают и выпаривают. Выход, (22RS)-16 α, 17 α-бутилидендиокси-11b, 21-дигидрокси-прегна-1,4-диен3,20-диона 257 мг (97,7%), HPLC показал 91,1%-ную чистоту. Содержание непрореагировавшего ацетонида составило 7,4% загрязнений. Соотношение для S/R эпимера 14,6/85,4. B. Триамцинолон 16 a, 17a-ацетонид (0,5 г, 1,1 ммоль) растворяют в 150 мл метиленхлорида. Добавляют н-бутанал (260 мг, 3,6 ммоля) и 70%-ную хлорную кислоту (0,22 мл). Смесь перемешивают при 33°С 16 ч. В делительную воронку наслаивают поверх метиленхлорид. Колбу, в которой проводили реакцию, промывают несколько раз 10 мл карбоната калия и метиленхлоридом соответственно. Затем раствор промывают 2 х 10 мл 10%-ного К2СО3 и 4 х 10 мл воды, высушивают и выпаривают. Выход: (22RS)-16 α, 17a-бутилидендиокси9a-фтор-11b, 21-дигидроксипрегна-1,4-диен-3,20-диона 438 мл (84,9%). HPLC показала 80,2%-ную степень чистоты. Соотношение для S/R эпимера 19/81. C. Флюоцинолон 16a, 17a-ацетонид (0,5 г, 1 ммоль) растворяют в 150 мл метиленхлорида, Добавляют нбутанал (260 мг, 3,6 ммоля) и 70%-ную хлорную кислоту (0,22 мл). Смесь перемешивают при 33°С 24 ч. Метиленхлоридную фазу переносят в делительную воронку. Колбу для проведения реакции промывают несколько раз 15 мл 10%-ного К2СО3 и метиленхлорида, соответственно. Раствор промывают 2 х 15 мл 10%ного К2СО3 и 4 х 15 мл воды, высушивают и выпаривают. Выход: (22RS)-16a, 17a-бутилидендиокси-6a, 9a-дифтор-11b, 21-дигидрокси- прегна-1,4-диен-3,2-диона 513 мг (100%) HPLC показала 97,4%-ную степень чистоты. Соотношение для S/R эпимера: 8,6/91,4. Пример 3. Получение 11b-окси-16a, 17a-/(метилэтилиден)бис(окси)/- и (20RS), (20R)- и (20S)-11b-окси-16 a, 17a -алкилметилен-диоксинандроста-1,4-диен-3-он-17b-карбоновой и -4-окси-3-он-17b карбоновой кислот. Получение 6a, 9a-дифтор-11b-окси-16a, 17a-/(1-метилэтилиден)-бис(окси)андроста-1,4-диен-3-он-17bкарбоновой кислоты. A. К раствору 1,99 г флюоцинолон 16a, 17a-ацетонида в 120 мл метанола добавляют 40 мл 20%-ного водного раствора карбоната калия. Через этот раствор барботируют стр ую воздуха примерно 20 ч при перемешивании при комнатной температуре. Метанол выпаривают и к остатку добавляют 200 мл воды. Раствор экстрагируют метиленхлоридом. Водную фазу подкисляют разбавленной хлористоводородной кислотой. Образовавшийся осадок собирают фильтрованием и высушивают, что дает 1,34 г 6a, 9a-дифтор11b-окси-16a, 17a-/(1-метилэтилиден)-бис(окси)/андроста-1,4-диен-3-он-17b-карбоновой кислоты, точка плавления 264-268°С, молекулярный вес 438. Степень чистоты, определенная посредством HPLC, составляет 94,0%. Водную фазу экстрагируют этилацетатом. После высушивания растворитель выпаривают, что оставляет дополнительно 0,26 г порцию кислоты. Чистота: 93,7%. B. Йодную кислоту (15,1 г) в 16,5 мл воды добавляют к раствору флюоцинолон 16a, 17a-ацетонида (5,0 г) в 55 мл диоксана. Реакционную смесь перемешивают при комнатной температуре 20 ч, нейтралируют насыщенным водным раствором бикарбоната натрия и выпаривают. Остаток растворяют в 200 мл метиленхлорида и промывают 8 х 100 мл 10%-ного карбоната калия. Водную фазу подкисляют конц.хлористоводородной кислотой и экстрагируют 6 х 100 мл этилацетата. После высушивания растворитель выпаривают. Остаток растворяют в 400 мл этилацетата и осаждают петролейным эфиром, что дает 3,96 г 6a, 9a-дифтор-11b-окси-16a, 17a-/(1-метилэтилиден)бис(окси)/андростата-1,4-диен-3-он-17bкарбоновой кислоты. Степень чистоты, определенная HPLC, составила 99,5%. С. Аналогичным образом, путем замещения флюоцинолон 16a, 17a-ацетонида посредством 11b, 16α, 17α, 21-тетраоксипрегна- 1,4-диен-3,20-диона, 6a-фтор-11b, 16a, 17a, 21-тетраоксипрегна-1,4-диен-3,20диона и получают триамцинолон 16a, 17a-ацетонид 11 β -окси-16a, 17a-/(-метилиден) бис(окси)/андроста1,4-диен-3-он-17b-карбоновые кислоты. В результате замещения 16a, 17a-ацетонидной группы на 16a, 17aацетали, между 16a-оксипреднизолоном, триамциклоном и флюоцинолоном и ацетальдегидом, пропанолом, бутанолом, изо-бутаналом, пентаналом, 3-метилбутанолом, 2,2-диметилпропаналом, гексаналом, гептаналом, октаналом, нонаналом и додеканалом получают их 21-сложные эфиры (20RS)-(20R) и (20S)-11bокси-16a, 17a-алкил-метилендиоксандроста-1,4-диен- и 4-ен-3-он-17b-карбоновые кислоты. Пример 4. Осуществляют тщательное перемешивание 21-ацетокси-6a, 9a-дифтор-11b-окси-16a, 17a [/1метилэтилиден/ бис/окси}-прегна-1,4-диен-3,20-диона (500 мг), 10 граммов тонкого песка (SiO2) и 20 мл бутанала. Добавляют бутанал (0,15 мл) и 70%-ную хлорную кислоту (0,15 мл) и смесь перемешивают при комнатной температуре в течение 5 ч. Каждый час вводят дополнительные 0,05 миллилитровые порции 70%ной хлорной кислоты, Реакционную смесь фильтруют и твердый продукт промывают смесью 10 мл хлористого метилена и 20 мл насыщенного водного раствора NaHCO3 четыре раза. Органическую фазу отделяют от соединенных промывок, высушивают над сульфатом натрия и выпаривают. Остаточный продукт очищают методом хроматографии в колонке с Sephadex LH-20 (71 х 6,3 см) хлороформом, служащим в качестве подвижной фазы. Фракцию 1965-2280 мл собирают, выпаривают и остаток растворяют в хлористом метилене и осаждают петролейным эфиром, так что остается 163 мг (22RS)-21-ацетокси-16a, 17 a-бутилиденди-окси-6a, 9a-дифтор-11b-оксипрегна-1,4-диен-3,20-диона. Анализ методом жидкостной хроматографии высокого разрешения показал степень чистоты 95,7% и отношение между эпимерами (22S)- и (22R) 18:22, Молекулярный вес: 508 (рассчитанный молекулярный вес 508,6). Эпимерную смесь (22RS) разделяют в колонке с Sephadex Н-20 (76 х 6,3 см) с использованием в качестве подвижной фазы смеси гептан:хлороформ:этанол в соотношении 20:20:1. Фракции 2100-2475 мл (А) и 24752910 мл (В) собирают и выпаривают и остаток растворяют в хлористом метилене и осаждают петролейным эфиром. Фракция А дает 22 мг (22S) и фракция В дает 119 мг (22Р)-21-ацетокси-16a. 17a-бутилиденди-окси-6 a, 9a-дифтор-11b-оксипрегна-1,4-диен-3,20-диона. (22S)-Эпимер: Молекулярный вес 508 (рассчитано 508,6), температура плавления 185-189°С. (22R)-Эпимер: Молекулярный вес 508 (рассчитано 508,6), температура плавления 280-284°С (a)D25 = +88,4° (с = 0,2; CH 2CI2). Аналогично этому, осуществляя процедуру, изложенную в примере 4, получали соединения 2а-14а, перечисленные в табл. 7. Пример 5. 1'-Этоксикарбонилоксиэтил 6a, aдифтор-11b-окси-16a, 17a-/{1метилэтилиден)бис(окси)/андроста-1,4-диен-3-он-17a-карбоксилат. Α. 6a, 9a-Дифтор-11b-окси-16a, 17a (1-метилэтилиден)бис(окси)/-андроста-1.4-ди-ен-3-он-17b-карбоновую кислоту (600 мг) и бикарбонат калия (684 мг) растворяют в 45 мл диметилформамида. Добавляют 1-бромэтил этилкарбонат (2 мл) и реакционную смесь перемешивают при комнатной температуре всю ночь. Добавляют воду (200 мл) и смесь зкстрагируют метиленхлоридом. Обьединённые экстракты промывают 5%-ным водным бикарбонатом и водой. Остаток очищают хроматографией на колонке "Сефадекс LH-20" (72 x 6,3 см) используя хлороформ в качестве подвижной фазы. Собирают фракцию 1515-2250 мл и выпаривают, что дает 480 мг 1'-этоксикарбонилокси-этил-6a, 9a-дифтор-11b-окса 16а, 17а-/(1-метилэтилиден)бис (окси)/-андроста1,4-диен-3-он-17-карбоксилат. Степень чистоты, определенная посредством HPLC, составляет 98,1 %, а отношение эпимера А/В, 48/52. Точка плавления: 218-27°С (a)D25 + 63,2 (с = 0,214; CH2CI2). Молекулярный вес 554. 1'-Этоксикарбонилоксиэтил 6a, 9a дифтор-11b-окси-16a, 17a-/(1-метилэтилиден)бис (окси)/андроста-1,4диен-3-он-17-карбоксилат (480 мг) хроматографируют на колонке "Сефадекс LH-20" (76 х 6,3 см) с применением гептан:хлороформ:этанол, 20:20:1 как подвижной фазы. Собирают фракцию 2325-2715 мл, выпаривают и остаток растворяют в метиленхлориде, осаждают петролейным эфиром, что дает 200 мг соединения (А), имеющего степень чистоты 97,3% (определено HPLC-анализом). Точка плавления: 246250°С. (a)D25 = +100,5° (00,214; CH2CI2). Молекулярный вес: 554. Фракция 4140 - 5100 мл дала 250 мл соединения (В), степень чистоты на 99,0%. Точка плавления 250255°С (a)D25= +28,5°C - 0,246. СН2Сl2). Молекулярный вес: 554. Β. 6a, 9a-Дифтор-11b-окси-16 α, 17α /(1-метилэтилиден)бис(окси)/андроста-1,4-диен-3-он-17b-карбоновую кислоту (200 мг) растворяют в 25 мл диметилформамида. Добавляют 1-хлорэтилэтилкарбонат (100 мг), бикарбонат калия (70 мг) и 18-краун-6-простой эфир. Реакционную смесь перемешивают при 80°С 3 ч., охлаждают, после добавления 150 мл воды экстрагируют метиленхлоридом, высушивают и выпаривают. Неочищенный продукт очищают, как указано в процедуре А, причем остается 207 мг 1'этоксикарбонилоксиэтил 6a, 9a-дифтор-11b-окси-16a, 17a/(1-метилэтилиден)бис(окси) /андроста-1,4-диен-3он-17-карбоксилат. Чистота (HPLC) составляет 98,4% и отношение эпимера А/В = 54/46. С. 6a, 9a-Дифтор-11b-окси-16a, 17a-/(1-метилэтилиден)бис(окси)/андроста-1,4-диен-3-он-17bкарбоновую кислоту (200 мг) и 1,5-диазабицикло (5.4.0) ундекан-5 (140 мг) суспендируют в 25 мл бензола и нагревают до действия обратного холодильника. Добавляют раствор 1-бромэтил-этил-карбоната (175 мг) и 5 мл бензола и смесь нагревают 2,5 ч. После охлаждения добавляют 50 мл метиленхлорида и раствор промывают водой, высушивают и упаривают. Неочищенный продукт очищают таким же образом, как в процедуре А. Вы ход 207 мг 1'-этоксикарбонилоксиэтил 6a, 9a-дифтор-11b-окси-16a, 17a-/(1метилэтилиден)бис(окси) /андроста-1,4-диен-3-он-17b-карбоксилата. Чистота (HPLC) 96,4%. Отношение эпимера А/В - 44/56. Д. К раствору 6a, 9a-дифтор-11b-окси-16a, 17a -/(1-метилиден)бис(окси)/андроста-1,4-диен-3-он-17bкарбоновой кислоты (100 мг) в 25 мл ацетона добавляют 175 мг α-бромдиэтилкарбоната и 45 мг безводного карбоната калия.Смесь нагревают 6 ч с обратным холодильником. Охлажденную реакционную смесь выливают в 150 мл воды и экстрагируют метиленхлоридом. Экстракт промывают водой, высушивают над сульфатом натрия и выпаривают. Выход 65 мг твердого 1'-этоксикарбонилоксиэтил 6a, 9a-ди-фтор-11b-окси16a, 17a -/(1-метилиден)бис (окси)/андроста-1,4-диен-3-он-17b-карбоксилата. Чистота, определенная HPLC, составила 97,6% и отношение эпимера А/В=49/51. Е. 6a, 9a-Дифтор-11b-окси-16a, 17a-/(1-метилэтилиден)бис(окси)/андроста-1,4-диен-3-он-17bкарбоновую кислоту (500 мг) и кислый тетрабутиламмонийсульфат (577 мг) добавляют к 3 мл 1-м гидроокиси натрия. Добавляют также раствор 435 мг 1-бром-этилкарбоната в 50 мл метиленхлорида. Смесь нагревают с обратным холодильником. Происходит разделение на 2 слоя. Органический слой промывают 2 х 10 мл воды, высушивают и выпаривают, "сырой" продукт очищают хроматографией на колонке "Сефадекс LH-20" (72 х 6,3 см) с применением хлороформа, как подвижной фазы. Собирают фракцию 1545-1950 мл, выпаривают и остаток осаждают из смеси метиленхлорида с петролейным эфиром. Остается 341 мг 1’этоксикарбонилоксиэтил 6a, 9a-дифтор -11b-окси-16a, 17a-/(1-метилэтилиден)бис (окси)/андроста-1,4-диен3-он-17b-карбоксилат. Степень чистоты, определенная посредством HPLC; 99,2%. Отношение эпимера А/В = 56/44. F. 6a, 9a-Дифтор-11b-окси-16a, 17a-/(1-метилиден)-бис-(окси)/андроста-1,4-ди-ен-3-он-17b-карбоновую кислоту (200 мг) и трикаприлметиламмоний хлорид (200 мг) добавляют к 5 мл насыщенного водного бикарбоната натрия. Добавляют 100 мг 1-бромметилэтилкарбоната в 10 мл метиленхлорида. Смесь перемешивают при 45°С 20 ч разбавляют 10 мл метиленхлорида, выделяют и очищают, как указано в процедуре "Е". Выход 254 мг 1’-этоксикарбонилоксиэтил 6α, 9α-дифтор-11b-окси-16a, 17a -/(1метилэтилиден)бис(окcи)/андроста-1,4-диен-3-он-17b-карбоксилата. Чистота (HPLC): 97,4. Отношение эпимера А/В = 60/40. G. 6a, 9a-Дифтор-11b-окси-16a, 17a-/(1-метилэтилиден)бис(окси)/андроста-1,4-диен-3-он-17b-карбоновую кислоту (200 мг) 1-бромэтилэтилкарбонат (135 мг) в триэтиламин) (275 мг) растворяют в 200 мл диметилформамида. Смесь перемешивают при 8°С 3 ч., разбавляют 200 мл метиленхлорида, промывают водой, высуши вают и выпаривают. "Сырой" продукт очищают, как указано в процедуре А. Получают 69 мг 1'этоксикарбонилоксиэтил 6a, 9a-дифтор-11b-окси 16a, 17a-/(1-метилэтилиден)бис(окси)-андроста-1,4-диен-3он-17b-карбоксилат. Чистота (HPLC) 97,8% и отношение эпимера А/В =48/52. Пример 6. 1'-Ацетоксиэтил 6a, 9a-дифтор-11b-окси-16a, 17a-/(1-метилиден)бис(окси)/андроста-1,4-диен 3-он-17b-карбоксилат. 6a, 9a-Дифтор-11b-окси-16a, 17a-/(1-метилэтилиден)бис(окси)/андроста-1,4-ди-ен-3-он-17b-карбоновую кислоту (500 мг) и бикарбонат калия (575 мг) растворяют в 40 мл диметилформамида. Добавляют 1хлорэтилацетат (1 мл) и реакционную смесь перемешивают при комнатной температуре 40 ч. Реакционную смесь выливают в 50 мл воды и экстрагируют метиленхлоридом. Экстракт промывают водным бикарбонатом натрия и водой, высушивают и выпаривают. Остаток хроматографируют на колонке "Сефадекс LH-20" (72x6,3 см), применяя хлороформ как подвижную фазу. Фракции 1755-2025 и 2026-2325 мл собирают и выпаривают. Твердый продукт после фракции 1755-2025 мл дополнительно очищают хроматографией на колонке "Сефадекс LH-20" (76x6,3см - внутренний диаметр), используя смесь гептан-хлороформ-этанол, 20:20:1 в качестве подвижной фазы. Фракцию 2505-2880 мл собирают и выпаривают. Остаток растворяют в метиленхлориде и осаждают петролейным эфиром, причем остается 167 мг твердого продукта (А). Чистота, определенная HPLC = 99,1 %. Точка плавления 238 -259°С. |a|D25=+94°(C=0,192; СН2СІ2). Молекулярный вес = 254. Твердый продукт из указанной выше фракции 2026-2325 мл дополнительно очищают хроматографией так же, как указано выше. Фракцию 5100-5670 мл собирают и выпаривают. Остаток растворяют в метиленхлориде и осаждают посредством петролейного эфира, что дает 165 мг твердого продукта "В". Чистота, определенная путем: HPLC, составляет 99,4%. Точка плавления 261-265°С |alD25=34° (00,262, СН2СІ2), Молекулярный вес = 524. Н-ЯМР спектры А и В являются почти тождественными, за исключением того, что метиновый квартет от сложноэфирной группы, который сдвинут на 0,16 в нижнюю область соединения В в сравнении с соединением А. Характеристики диспергирования А и В в масс-спектре соударения электронов являются идентичными, исключая интенсивности масс-пиков. Такие спектроскопические характеристики А и В показывают, что они являются эпимерами вследствие хирального центра в сложно-эфирной группе. Примеры 7-8. Вещества, приведенные в табл. 1-3, приготовлены, выделены и очищены по способу, аналогичному описанному в примерах 4 и 5. Фармакология. Средство новых сложных эфиров андростан-17b-карбоновой кислоты по отношению к рецептору глюкокортикоида. Все стероиды, приведенные в табл. 1-3 являются физиологически-активными соединениями. Средство новых сложных эфиров андростан-17b-карбоновой кислоты к глюкокортикоидному рецептору использовано в качестве модели для определения способности к противовоспалительному действию. Их средства к рецептору сравнивают по отношению к буденозид (/22R/S/-16a, 17a-бутилидендиокси-11b,21-диокси-прегна1,4-диен-3,20-диону), глюкокортикоиду повышенной активности, с благоприятным соотношением между локальным действием, и действием, относящимся к организму в целом. Во время всех исследований используют крыс-самцов "Sprague Dawley": в возрасте 1-2 мес. Зобную железу удаляют и помещают в физиологический раствор поваренной соли, охлаждаемый льдом. Ткань гомогенизируют в гомогенизаторе "Potter Elvehjem" в 10 мл буферного раствора, содержащего 20 ммоль Трис. рН 7,4 10% (вес/объем) глицерина, 1 ммоль этилен-диаминтетрауксусной кислоты (ЭДТА). 20 ммоль NаМоО4 10 моль меркаптоэтанола. Гомогенат концентрируют 15 мин при 20000 x 1 g. Доли слоя, всплывшего при 2000 x 1 g (230 мкл) инкубируют около 24 ч при 0°С с 100 мкл фенилметилсульфонилфторида (ингибитор эстеразы, конечная концентрация 0,5 ммоль), 20 мкл намеченного-соперника" и 50 мкл 3Н-меченого дексаметазона (конечная концентрация 3 нмоль). Связанный и свободный стероиды разделяют инкубированием смеси с 60 мкл 2,5% (вес/объем) активированного угля и 0,25% (вес/объем) суспензии декстрана 170 в 20 ммоль Трис, рН 7,4.1 моль ЭДТА и 20 ммоль NaMoO4 10 мин при 0QC. После этого центрифугируют при 500 x 1 g 10 мин и 230 мкл всплывшего слоя сосчитывают в 10 мл Insta-Gel в сцинтилляционном спектрофотометре Packard". Всплывшие соли инкубируют с а) /3Н/ с одним дексаметазоном, б) /3Н/дексаметазоном вместе с 1000кратным избытком намеченного дексаметазона и в) /3Н/ дексаметазона вместе с 0,03-300-кратным избытком соперника. Неспецифическую связь определяют, когда 1000-кратный избыток намеченного дексаметазона добавляют к /3Н/-меченому дексаметазону. Радиоактивность, связанная с рецептором в присутствии "соперника", разделенная на радиоактивность, связанную с рецептором в отсутствии "соперника" и умноженная на 100 дает выраженную в % специфическую связь для меченого дексаметазона. Для каждой концентрации "соперника", специфически связанная с радиоактивностью, выраженная в %, наносится на график, по отношению к логарифму концентрации "соперника". Кривые сравнивают при 50%-ном уровне специфической связи; в сравнении с будезонидом, который относят как единицу относительно средства связуемости (RBA) (см. табл.4-7).
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for preparation of steroid semiproducts or 22r/s stereoisomers thereof
Назва патенту російськоюСпособ получения стероидных полупродуктов или их 22r/s стереоизомеров
МПК / Мітки
МПК: C07J 75/00, C07J 5/00
Мітки: одержання, напівпродуктів, спосіб, стероїдних, стереоізомерів
Код посилання
<a href="https://ua.patents.su/10-19288-sposib-oderzhannya-sterodnikh-napivproduktiv-abo-kh-22r-s-stereoizomeriv.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання стероїдних напівпродуктів або їх 22r/s стереоізомерів</a>
Попередній патент: Спосіб вибухового дроблення
Наступний патент: Очисний біологічний контактор для отримання питної води та спосіб управління очисним біологічним контактором
Випадковий патент: Інформаційно-діагностична система