Спосіб відновного алкілування глікопептидного антибіотика, комплекси міді та спосіб одержання глікопептидного антибіотика із мідного комплексу
Номер патенту: 58526
Опубліковано: 15.08.2003
Автори: Женг Хуа, БЕРГЛУНД Ричард Алан, Локвуд Ненсі, Магаданз Говард Ю.
Формула / Реферат
1. Спосіб відновного алкілування глікопептидного антибіотика, що містить сахаридний фрагмент з аміногрупою в положенні N4 і одну чи кілька інших аміногруп, який включає проведення реакції розчинного мідного комплексу глікопептидного антибіотика з кетоном або альдегідом в присутності відновного агента, яким є ціаноборгідрид натрію або піридино-борводневий комплекс.
2. Спосіб за п. 1, який здійснюють у метанолі.
3. Спосіб за п. 2, який відрізняється тим, що розчинний мідний комплекс глікопептидного антибіотика готують in situ із глікопептидного антибіотика і розчинної сполуки міді.
4. Спосіб за п. 3, який відрізняється тим, що глікопептидним антибіотиком є глікопептидний антибіотик типу ванкоміцину.
5. Спосіб за п. 4, який відрізняється тим, що глікопептидним антибіотиком є А82846В.
6. Спосіб за п. 5, який відрізняється тим, що альдегідом є 4'-хлор-4-біфенілкарбоксальдегід.
7. Спосіб за п. 1, який додатково включає виділення мідного комплексу алкілованого глікопептидного антибіотика.
8. Спосіб за будь-яким з пп. 1-7, який додатково включає виділення алкілованого глікопептидного антибіотика.
9. Комплекс міді з А82846А або А82846В.
10. Комплекс за п. 9, який відрізняється тим, що являє собою комплекс міді з А82846В у співвідношенні 1:1.
11. Комплекс міді з відновно алкілованим глікопептидним антибіотиком, який одержано способом за будь-яким з пп. 1-7.
12. Комплекс за п. 11 з відновно алкілованим А82846В.
13. Комплекс за п. 12, в якому відновно алкілований А82846В являє собою N4-(4-(4-xлopфeнiл)бeнзил)-A82846B.
14. Спосіб одержання глікопептидного антибіотика, алкілованого по сахаридному фрагменту з аміногрупою в положенні N4, який включає обробку водою мідного комплексу згаданого глікопептидного антибіотика при значенні рН, рівному або меншому 4.
Текст
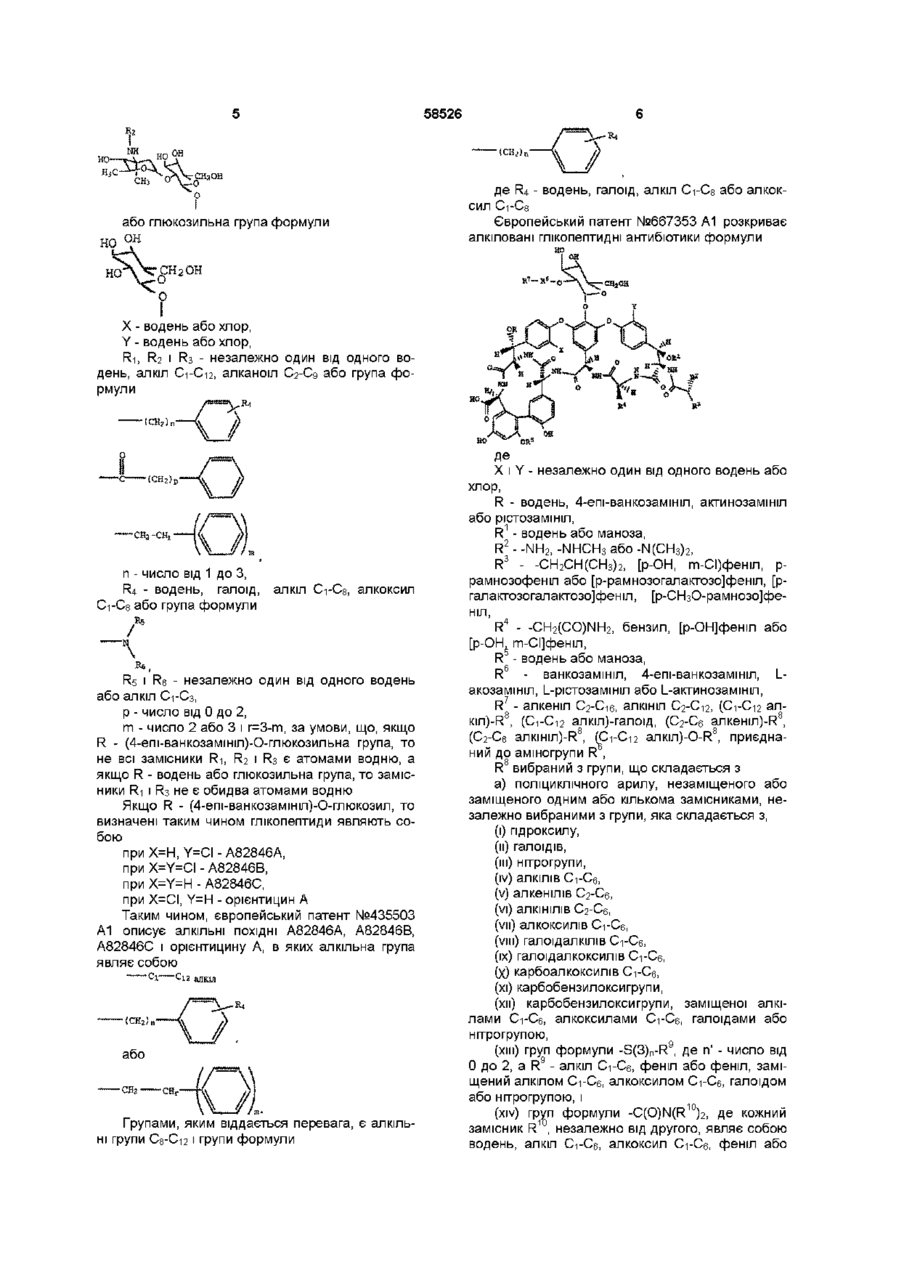
1 Спосіб відновного алкілування глікопептидного антибіотика, що містить сахаридний фрагмент з аміногрупою в положенні N4 і одну чи кілька інших аміногруп, який включає проведення реакції розчинного мідного комплексу глікопептидного антибіотика з кетоном або альдегідом в присутності відновного агента, яким є ціаноборпдрид натрію або піридино-борводневий комплекс 4 Спосіб за п 3, який відрізняється тим, що глікопептидним антибіотиком є глікопептидний антибютиктипу ванкоміцину 5 Спосіб за п 4, який відрізняється тим, що глікопептидним антибіотиком є А82846В 6 Спосіб за п 5, який відрізняється тим, що альдегідом є 4'-хлор-4-біфенілкарбоксальдепд 7 Спосіб за п 1, який додатково включає виділення мідного комплексу алкілованого глікопептидного антибіотика 8 Спосіб за будь-яким з пп 1-7, який додатково включає виділення алкілованого глікопептидного антибіотика 9 Комплекс МІДІ з А82846А або А82846В 10 Комплекс за п 9, який відрізняється тим, що являє собою комплекс МІДІ з А82846В у співвідношенні 1 1 11 Комплекс МІДІ з відновно алкілованим глікопептидним антибіотиком, який одержано способом за будь-яким з пп 1-7 12 Комплекс за п 11 з відновно алкілованим А82846В 13 Комплекс за п 12, в якому відновно алкілований А82846В являє собою N4-(4-(4хлорфеніл)бензил)-А82846В 14 Спосіб одержання глікопептидного антибіотика, алкілованого по сахаридному фрагменту з аміногрупою в положенні N4, який включає обробку водою мідного комплексу згаданого глікопептидного антибіотика при значенні рН, рівному або меншому 4 Цей винахід спрямований на вдосконалення методів відновного алкілування глікопептидних антибіотиків Винахід передбачає підвищену репоселективність реакції між кількома положеннями і тим самим забезпечує підвищений вихід бажа ного продукту Більш ТОЧНО, цей винахід стосується методів проведення реакції відновного алкілування переважно за участю однієї аміногрупи сахариду глікопептидного антибіотика, який містить одну або кілька додаткових аміногруп (73) Елі ЛІЛЛІ енд Компані, US О (О ю 00 ю 58526 Суть винаходу полягає у виявленому факті, що проведення реакції за присутності розчинної сполуки МІДІ сприяє переважній реакції з аміногрупою, яка зв'язана з сахаридним фрагментом, і, таким чином, підвищує вихід по відновному алкілуванню в цю позицію Початковою стадією є утворення мідного комплексу глікопептидного антибіотика, який потім піддають відновному алкілуванню Цей винахід стосується також таких мідних комплексів вихідних глікопептидних антибілотиків Продукти алкілування глікопептидних антибіотиків одержують у вигляді мідних комплексів, які являють собою інший варіант цього винаходу Цей винахід стосується відновного алкілування глікопептидних антибіотиків Глікопептидні антибіотики являють собою широкий клас речовин, які або продукуються мікроорганізмами, або продукуються мікроорганізмами і потім піддаються частковому модифікуванню У продаж надходять як антибактеріальні продукти дві таких речовини - ванкоміцин і тейкопланін, проте відкрито багато інших, які розглядаються як основи для подальшого розвитку, зокрема, в зв'язку з тим, що в КІНЦІ 80-Х років виникла СТІЙКІСТЬ мікроорганізмів до різноманітних антибіотиків, в тому числі до глікопептидних Увесь клас глікопептидних антибіотиків вичерпно описаний у монографії "Глікопептидні антибіотики" під редакцією Рамакрішнана Нагараджана (Glycopeptide Antibiotics, edited by Ramakrishnan Nagarajan, Marcel Dekker, Inc , New York, 1994) Серед глікопептидів, відкритих останнім часом, можна назвати речовини, ВІДОМІ ПІД позначеннями А82846А (відомий також як ереомоміцин), А82846В (відомий також під назвою хлороорієнтицин А), А82846С (відомий також як орієнтицин С) і орієнтицин А Цьому винаходу віддається перевага в застосуванні до глікопептидних антибіотиків типу ванкоміцину, в тому числі до ванкоміцину, А82846А, А82846В, А82846С і орієнтицину А, особлива перевага віддається використанню винаходу до А82846В ВІДОМІ численні способи модифікації природних глікопептидів Серед таких способів ВІДОМІ способи відновного алкілування реакційноздатних аміногруп у глікопептидах Див , напр , патент США №4,698,327, де описано відновне алкілування ванкоміцину, і європейські патенти №435503 А1 і 667353 А1, які стосуються відновного алкілування різноманітних глікопептидів, в тому числі ванкоміцину, А82846А, А82846В, А82846С і орієнтицину А У цих джерелах описано способи відновного алкілування, які забезпечують введення в ВИХІДНІ глікопептиди великої різноманітності алкільних груп У патенті США №4,698,327 описано алкіловані сполуки ванкоміцину формули Де R - водень або метил, п=1 або 2, Ri - водень або метил, R2 і R3 незалежно один від одного являють собою водень або групу формули R6R7CH-, R6 і R7 незалежно один від одного являють собою R5, R5-(anKin C1-C5) або Rs-(anKeHin C2-C5), R5 - водень, алкіл С-і-С-ю, алкеніл Сг-С-ю, алкоксил С1-С4, циклоалкіл Сз-С-ю, циклоалкеніл CsС12, феніл, нафтил, інденіл, тетралініл, декалініл, адамантил, моноциклічна гетероциклічна система, що включає від 3 атомів до 8 атомів вуглецю в циклі, або біциклічна гетероциклічна система, що включає від 6 атомів до 11 атомів, за умови, що принаймні один атом циклу є атомом вуглецю і принаймні один атом циклу є гетероатомом, вибраним з групи, що включає О, N і S, і Rs може бути заміщений однією або кількома гідроксильними, нітро-, алкокси С-і-С-ю, алкільними С-і-С-ю, фенільними, тюалкільними С-і-Сє, нітрильними, галоїдними, С2-С4 ациламшо-, аміно-, С1-С4 діалкіламшогрупами, a R4 - водень, за умови, що (1) принаймні один з замісників R2 і R3 має бути іншим, ніж водень, (2) якщо п=2, то R має бути воднем, (3) якщо R - метил, a R3 - водень, то R2 не може бути метилом і (4) якщо обидва замісники R і Ri - метальні групи, то R2 - водень або метил і п=1 Європейський патент №435503 А1 стосується алкілованих та ацильованих глікопептидів формули Де но ^ ~он R - водень або (4-епі-ванкозамшіл)-Оглюкозильна група формули 58526 t дп ' ссш Ш wi v* ~.\ _ НО ОН де R4 - водень, галоїд, алкіл C-i-Cs або алкок або глюкозильна група формули сил Європейський патент №667353 А1 розкриває алкіловані глікопептидні антибіотики формули X - водень або хлор, Y - водень або хлор, R-i, F 2 і R3 - незалежно один від одного во? день, алкіл С-і-С-12, алканоїл С2-С9 або група формули П - ЧИСЛО ВІД 1 ДО З, R4 - водень, галоїд, Сз або група формули алкіл Сі-Ся, алкоксил Rs і R6 - незалежно один від одного водень або алкіл С-і-Сз, р - число від 0 до 2, m - число 2 або 3 і r=3-m, за умови, що, якщо R - (4-епі-ванкозамшіл)-О-глюкозильна група, то не всі замісники Ri, R2 і R3 є атомами водню, а якщо R - водень або глюкозильна група, то замісники Ri і R3 не є обидва атомами водню Якщо R - (4-епі-ванкозамшіл)-О-глюкозил, то визначені таким чином глікопептиди являють собою при Х=Н, Y=CI - А82846А, при X=Y=CI - А82846В, при X=Y=H - А82846С, при Х=СІ, Y=H - орієнтицин А Таким чином, європейський патент №435503 А1 описує алкільні ПОХІДНІ А82846А, А82846В, А82846С і орієнтицину А, в яких алкільна група являє собою Сі С Групами, яким віддається перевага, є алкільні групи Cs-Ci21 групи формули X і Y - незалежно один від одного водень або хлор, R - водень, 4-епі-ванкозамшіл, актинозамініл або рістозамініл, R1 - водень або маноза, R2 - -NH 2 , -NHCH3 або -N(CH 3 ) 2 , R3 - -СН 2 СН(СНз) 2 , [р-ОН, т-СІ)феніл, ррамнозофеніл або [р-рамнозогалактозо]феніл, [ргалактозогалактозо]феніл, [р-СНзО-рамнозо]феніл, R4 - -CH 2 (CO)NH 2 , бензил, [р-ОН]феніл або [р-ОН т-СІ]феніл, R - водень або маноза, R6 - ванкозамініл, 4-епі-ванкозамшіл, Lакозамініл, L-рістозамшіл або L-актинозамшіл, R7 - алкеніл Сг-С-іб, алкініл С2-С12, (C1-C12 алKin)-R8, (C1-C12 алкіл)-галоід, (Сг-Сє anKeHin)-R8, (С2-С6 anKiHin)-R8, (C1-C12 anKin)-O-R8, приєднаний до аміногрупи R , R8 вибраний з групи, що складається з а) поліциклічного арилу, незаміщеного або заміщеного одним або кількома замісниками, незалежно вибраними з групи, яка складається з, (і) гідроксилу, (м) галоїдів, (їм) нітрогрупи, (iv) алкілів Сі-Сє, (v) алкенілів Сг-Сє, (vi) алкінілів Сг-Сє, (VII) а л к о к с и л і в С-і-Сє, (VIM) г а л о і д а л к і л і в С-і-Сє, (їх) галоідалкоксилів С-і-Сє, (Х) карбоалкоксилів С-і-Сє, (хі) карбобензилоксигрупи, (хм) карбобензилоксигрупи, заміщеної алкілами Сі-Сє, алкоксилами С-і-С І, галоїдами або нітрогрупою, (хні) груп формули -S(3) n -R 9 , де п' - число від 0 до 2, a R9 - алкіл Сі-Сє, феніл або феніл, заміщений алкілом Сі-Сє, алкоксилом С-і-Сє, галоїдом або нітрогрупою, і (xiv) груп формули -C(O)N(R 10 )2, де кожний замісник R10, незалежно від другого, являє собою водень, алкіл С-і-Сє, алкоксил Сі-Сє, феніл або 58526 феніл, заміщений алкілом С-і-Сє, алкоксилом d Сб, галоїдом або нітрогрупою, b) гетероарилу, незаміщеного або заміщеного одним або кількома замісниками, незалежно вибраними з групи, яка складається з (і) галоїдів, (м) алкілів Сі-Сє, (їм) алкоксилів С-і-Сє, (iv) галоідалкілів С-і-Сє, (v) галоідалкоксилів С-і-Сє, (vi) фенілу, (VM) тюфенілу, (VIM) фенілу, заміщеного галоїдом, алкілами Сі-Сє, алкенілами Сг-Сє, алкінілами Сг-Сє, алкоксилами Сі-Сє або нітрогрупою, (їх) карбоалкоксилу Сі-Сє, (х) карбобензилоксигрупи, (хі) карбобензилоксигрупи, заміщеної алкілами Сі-Сє, алкоксилами С-і-Сє, галоїдами або нітрогрупою, (хм) груп формули -S(O) n -R 9 , визначених вище, 10 (хмі) груп формули -C(O)N(R )г, визначених вище, і (xiv) ТІЄНІЛЬНОІ групи, c) груп формули д е А 1 - -ОС(А 2 ) 2 -С(А 2 ) 2 -О-О-С(А 2 ) 2 -О-, С(А 2 ) 2 -О- або -С(А 2 ) 2 -С(А 2 )2-С(А 2 )2-С(А 2 ) 2 - 1 а кожний замісник А 2 вибраний незалежно від інших із групи, що складається з водню, алкілів С-і-Сє, алкоксилів С-і-Сб або циклоалкілів С4-С10, d) груп формули де р - число від 1 до 5, а R 11 вибраний незалежно від інших із групи, що складається з (і) ВОДНЮ, (м) нітрогрупи, (їм) гідроксилу, (iv) галоїдів, (v) алкілів С-і-Сз, (vi) алкоксилів Ci-Cs, (VM) а л к і л і в С9-С12, (VIM) а л к і н і л і в С2-С9, (їх) алкоксилів С9-С12, (х) алкоксилів Сі-Сз, заміщених алкоксилами Сі-Сз, гідроксилами, галоідалкоксилами Сі-Сз аботюалкілами С1-С4, (хі) оксиалкенілів С2-С5, (хм) оксиалкінілів С2-С13, (хні) галоідалкілів С-і-Сє, (xiv) гадоідалкоксилів С-і-Сє, (xv) тюалкілів Сг-Сє, (xvi) оксиалканоілів Сг-С-ю, (xviі) карбоксиалкенілів С2-С4, (xvi 1 ) оксиалкілсульфонілів С-і-Сз, 1 (хіх) карбоксиалкілів Сі-Сз, (хх) ІЧ-[діалкіл Сі-Сзіаміноалкоксилів Сі-Сз, (ххі) ціаноалкоксилів С-і-Сє і (ххм) дифенілалкілів С-і-Сє, 8 11 за умови, що, якщо R - алкіл С-i-Cs, алкоксил С-і-Сз або галоїд, то р має бути рівним 2 або 8 11 більше, або якщо R є (алкіл Ci-C3)-R , то R не є воднем, алкілом С-i-Cs, алкоксилом Ci-Cs або галоїдом, є) груп формули де q - число від 0 до 4, 12 R вибраний незалежно від інших із групи, що складається з (і) галоїдів, (м) нітрогрупи, (їм) алкілів Сі-Сє, (iv) алкоксилів С-і-Сє, (v) галоідалкілів С-і-Сє, (vi) галоідалкоксилів С-і-Сє, (VM) г і д р о к с и л у і (VIM) т ю а л к і л і в С-і-Сє, г - число від 1 до 5, за умови, що сума q і г не перевищує 5, Z вибраний із групи, що складається з (і) одинарного зв'язку, (м) двовалентного алкілу С-і-Сє, незаміщеного або заміщеного гідроксилом, алкілом С-і-Сє або алкоксилом С-і-Сє, (їм) двовалентного алкенілу Сг-Сє, (iv) двовалентного алкінілу Сг-Сє або (v) груп формули -(C(R ) 2 ) S -R 1 5 - або -R 15 (C(R 1 )2)s-, де s - число від 0 до 6, а кожний з замісників R вибраний незалежно від іншого з групи, що включає водень, алкіли С-і-Сз або циклоалкіли С4-С10, і R 15 вибраний з групи, що включає -О-, -S-, -SO-, -SO2-, SO2-O-, -С(О)-, -ОС(О)-, -С(О)О-, -NH-, -N(anKin C r C 6 ) - , -C(O)NH-, NHC(O>, N=N, R1 незалежно вибраний з групи, що складається з (і) гетероциклілів С4-С10, (м) гетероарилів, (їм) циклоалкілів С4-С10, незаміщених або заміщених алкілами Сі-Сє, або (iv) фенілу, незаміщеного або заміщеного замісниками числом від 1 до 5, вибраними незалежно один від одного з групи, що включає галоїди, гідроксил, нітрогрупу, алкіли С-і-С-ю, алкоксили С-і-С-ю, галоідалкоксили С-і-Сз, галоідалкіли С і Сз, (Сі-Сз)-алкоксифеніли, феніл, феніл-(Сг Сз)алкіли, (Сі-Сб)-алкоксифеніли, феніл-(С2Сз)алкшіли і (Сі-Сб)-алкілфеніли, f) циклоалкілів С4-С10, незаміщених або заміщених одним або кількома замісниками, вибраними незалежно один від одного з групи, що складається з (і) алкілів Сі-Сє, (м) алкоксилів Сі-Сє, (їм) алкенілів Сг-Сє, (iv) алкінілів Сг-Сє, (v) циклоалкілів С4-С10, (vi) фенілу, (viі) тюфенілу, (VIM) фенілу, заміщеного нітрогрупою, галоїдами, оксиалканоілами С-і-Сє або карбоциклоалкоксилами, і 58526 13 13 (їх) груп загальної формули -Z-R , де Z і R визначені вище, і д) груп формули де А і А вибрані незалежно один від одного з групи, що включає (і) ЗВ'ЯЗОК, (и) -О-, (їм) -S(O)t-, де t - число від 0 до 2, 7 17 (iv) -C(R )2, де кожний з замісників R незалежно від іншого вибраний з групи, що включає водень, алкіли С-і-Сє, гідроксил, алкіли С-і-Сє, ал17 коксили Сі-Сє, або обидва замісники R , взяті в сукупності, є атомами кисню, 18 18 (v) -N(R )2, де кожний з замісників R незалежно від іншого вибраний з групи, що включає водень, алкіли С-і-Сє, алкеніли Сг-Сє, алкініли C-zСб, циклоалкіли С4-С10, феніл, феніл, заміщений нітрогрупою, галоїдами, оксиалканоілами С-і-Сє, або обидва замісники R18, взяті в сукупності, є циклоалкілом C4-C1Q, R16 є R12 або R , визначені вище, і u - число від 0 до 4 У цих посиланнях глікопептидними антибіотиками, яким віддається перевага, є А82846А, А82846В, А82846С та орієнтицин А, алкілами, яким віддається перевага, є такі, в яких R7 є СНгR8, і фрагментами R8, яким віддається перевага, є такі, що визначені вище як групи (d) і (є) Цей винахід може бути використаний для виготовлення алкілованих глікопептидів, описаних у цих посиланнях Алкіловані глікопептиди, яким віддається перевага, що можуть бути виготовлені цим способом, включають нижчеперелічені сполуки |\|4-п-октил-А82846В ІЧ4-п-децил-А82846В Ы4-бензил-А82846В |\|4-(р-хлорбензил)-А82846В |\|4-(р-бромбензил)-А82846В |\|4-(р-пропілбензил)-А82846В І\І4-(р-ізопропілбензил)-А82846В |\|4-(р-бутилбензил)-А82846В І\І4-(р-ізобутилбензил)-А82846В І\І4-(р-пентилбензил)-А82846В І\І4-(р-ізогексилбензил)-А82846В 4 |\| -(р-октилбензил)-А82846В 4 І\І -(р-пропоксибензил)-А82846В І\І4-(р-ізопропоксибензил)-А82846В |\|4-(р-бутоксибензил)-А82846В І\І4-(р-пентилоксибензил)-А82846В І\І4-(р-гексилоксибензил)-А82846В І\І4-(о-гексилоксибензил)-А82846В І\І4-(р-гептилокеибензил)-А82846В М4-(р-октилоксибензил)-А82846В |\|4-фенетил-А82846В М4-(4-фенілбензил)-А82846В Ы4-(4-(4-хлорфен1л) бензил)-А82846В [\|4.(4-(4-метилбензилокси)бензил)-А82846В г\І4-(4-(4-етилбензилокси)бензил)-А82846В М4-(4-(4-хлорфенетил)бензил)-А82846В М4-(4-(2-(4-метоксифеніл)етиніл) бензил)А82846В У вищенаведених посиланнях відновне алкілування описане як спосіб, що включає першу 10 стадію, на якій глікопептид реагує з ВІДПОВІДНИМ альдегідом або кетоном з утворенням Шиффової основи, яку на другій стадії відновлюють з утворенням бажаного алкілованого продукту Як один з варіантів цього способу в європейському патенті №667353 А1 описано процес, в якому відновний агент додають одночасно з глікопептидом і альдегідом або кетоном У посиланні стверджується, що може бути використаний будь-який ХІМІЧНИЙ відновний агент, однак перевага віддається ціаноборпдриду натрію Практично у всіх глікопептидах є кілька реакційноздатних груп Модифікація цих кількох груп не є однозначно корисною Іноді бажано провести реакцію з глікопептидом репоселективно, щоб вона пройшла тільки з одною з кількох груп Це стосується й відновного алкілування глікопептидів Як приклад можна навести А82846В Хоча його ПОХІДНІ, алкіловані по аміногрупах лейцину (N1) та/або моносахариду (N6) виявляють антибактеріальну активність, перевагу слід віддавати алкілуванню по групі N4 (аміногрупі дисахариду) Фармацевтична практика вимагає використання відносно чистої форми, тому для одержання алкілованого по N4 продукту високої чистоти бажано, щоб реакція йшла переважно по групі N4 Цей винахід забезпечує спосіб проведення реакції переважно по сахарид ній аміногрупі в положення N4 глікопептид ного антибіотика У випадку ванкоміцину, А82846А, А82846В, А82846С та орієнтицину А цей спосіб знижує реакційну здатність аміногруп у положеннях N1 і N 6 і, таким чином, підвищує селективність реакції по групі N4 (аміногрупі дисахариду) Цей винахід вимагає попереднього приготування розчинного мідного комплексу глікопептиду, який потім піддають відновному алкілуванню Розчинний мідний комплекс одержують шляхом реакції глікопептидного антибіотика з міддю, звичайно шляхом додавання джерела розчинної МІДІ ДО реакційної суміші, що містить глікопептид ний антибіотик Конкретна форма сполуки, що є джерелом МІДІ, не має суттєвого значення, якщо тільки вона, принаймні, частково розчинна і не впливає негативно на рН Така сіль МІДІ може бути використана в безводній або в гідратній формі Слолукоюджерелом МІДІ, якій віддається перевага, є ацетат МІДІ (II), який найчастіше використовують у вигляді гідрату Введення МІДІ в реакційну суміш призводить спочатку до утворення комплексу МІДІ з вихідним глікопептидним антибіотиком, як правило, у співвідношенні 1 1 Цей комплекс МІДІ з вихідним глікопептидним антибіотиком є однією з ознак цього винаходу Відновним агентом, який слід використовувати в цьому винаході, є ціанборпдрид натрію або піридино-бороводневий комплекс Важливе значення має добір розчинника Чистий метанол давав високі виходи, і можна очікувати, що метанол, розбавлений до певної міри, наприклад, диметилформамідом або диметилсульфоксидом, може забезпечити прийнятні виходи Інші розчинники не призводять до задовільних результатів Тому розчинником для реакції є принаймні переважно, метанол 58526 12 11 Реакцію слід проводити при рН 6-8, перевага ню як відновного агента ідеальними умовами є віддається рН 6,3-7,0 також використання чистого метанолу як розчинника, але при температурах приблизно 58-63°С Використовувані КІЛЬКОСТІ реагентів не мають суттєвого значення, КІЛЬКОСТІ, ЯКІ СЛІД використоДеяка КІЛЬКІСТЬ продукту утворюється навіть вувати для досягнення максимального виходу, при короткочасній реакції Перевага віддається дещо міняються залежно від природи конкретних більшим тривалостям реакції, напр , від 6 годин реагуючих речовин Глікопептидний антибіотик і до 48 годин Однак виявлено, що ідеальний час альдегід або кетон витрачаються при реакції в реакції лежить у межах від приблизно 20 годин до еквімолярних кількостях Перевага віддається 25 годин При більш тривалих процесах може незначному надлишку альдегіду або кетону, напідвищитися вихід продуктів, алкілованих по непр , від 1,3 1 до 1,7 1 Використовувана КІЛЬКІСТЬ бажаних групах глікопептидного антибіотика глікопептидного антибіотика має бути скореговаУ варіанті здійснення процесу за цим винахона з урахуванням його чистоти В реакції витрадом, якому віддається перевага, глікопептидний чається еквімолярнпа КІЛЬКІСТЬ ВІДНОВНОГО агента антибіотик і сполуку МІДІ змішують у розчиннику, Слід використовувати, принаймні, таку КІЛЬКІСТЬ, одержуючи розчинний мідний комплекс глікопепперевага віддаєтьсянезначному надлишку КІЛЬтидного антибіотика, а потім додають альдегід і КІСТЬ розчинної сполуки МІДІ не має суттєвого відновний агент Проте точна ПОСЛІДОВНІСТЬ дозначення у випадку використання ціанборпдриду давання не має суттєвого значення Перевага натрію як відновного агента Коли як відновний віддається додаванню відновного агента порціяагент використовуюється піридин-бороводневий ми, у випадку ж використання піридино - боровокомплекс, КІЛЬКІСТЬ використовуваної розчинної дневого комплексу як відновного агента такий сполуки МІДІ має більше значення, оскільки надспосіб додавання є обов'язковою умовою одерлишок МІДІ вступає в реакцію з піридинжання позитивних результатів Реакцію продовбороводневим комплексом Незалежно від прижують протягом деякого часу, після чого утворюроди відновного агента, цей процес призводить ється продукт, що може бути виділений із реакспочатку до утворення комплексу з глікопептидційної суміші ним антибіотиком складу 1 1, тому перевага відУ варіанті, якому віддається перевага, після дається наявності МІДІ в КІЛЬКОСТІ, приблизно екзбігання часу реакції її припиняють, напр , додавімолярній у відношенні до глікопептидного антиючи до реакційної суміші борпдрид натрію Ця біотика КІЛЬКОСТІ, ЩО перевищують один молярречовина реагує з альдегідом або кетоном і тому ний еквівалент (у випадку піридин-бороводневого запобігає подальшим небажаним реакціям комплексу) або два молярні еквіваленти (у випаПродукт виділяють із реакційної суміші у видку ціаноборпдриду натрію) є небажаними гляді мідного комплексу алкілованого глікопептиду Виділення здійснюють концентруванням реаПідсумовуючи вищезазначене, ідеальні викокційної суміші й осадженням комплексу шляхом ристовувані КІЛЬКОСТІ реагентів знаходяться у додавання антирозчинника, напр , етилацетату, співвідношенні ацетону, 1-пропанолу, ізопропілового спирту, глікопептидний антибіотик альдегід або кеперевага віддається ацетонітрилу Комплекс мотон відновний агент сіль МІДІ жна розкласти шляхом обробки водою при рН 21 1,3-1,5 1,3 1 4, що призводить до вивільнення алкілованого з тим винятком, що при використанні піридиглікопептиду, який при бажанні можна очистити но-бороводневого комплексу як відновного агенвідомим способом та співвідношення, якому віддається перевага, складає Нижченаведені приклади ілюструють цей ви1 1,3-1,71,50,9-1,0 нахід і дозволять досвідченим фахівцям здійснити його Концентрація реагентів у розчиннику має деякий вплив на процес Об'єм метанолу у відноПорівняльний приклад А (без МІДІ) шенні до маси глікопептидного антибіотика може А82846В (6,0г, ефективність 76,5%, 4,59г варіювати від 50 1 до 500 1, виявлено, що розве100%-ноі речовини, 2,88ммоль), 4'-хлор-4дення 100 1 є практично прийнятним, корисним біфенілкарбоксальдепд (0,86г, 3,97ммоль) та співвідношенням, хоча більш сильні розведення ціаноборпдрид натрію (84мг, 1,34ммоль) додаваможуть привести до незначного підвищення вили до 600мл метанолу і розчин нагрівали зі звоходу ротним холодильником протягом 3 годин Додавали додаткову порцію ціаноборпдриду натрію Температура проведення процесу не має (84мг, 1,34ммоль) і суміш нагрівали зі зворотним суттєвого значення Реакційні суміші в метанолі холодильником ще протягом 3 годин Додавали киплять приблизно при 67°С, цим і визначається заключну порцію ціаноборпдриду натрію (84мг, максимальна температура при використанні чис1,34ммоль) і продовжували нагрівання зі звороттого метанолу як розчинника Звичайно, можливо ним холодильником ще протягом 17 годин Провести реакцію й при більш високих температурах, зорий безбарвний розчин охолоджували до кімякщо використовувати метанолвмісні суміші або натної температури й концентрували до об'єму вести процес під тиском Припустимими є більш 130мл у роторному випарнику Продукт осаджунизки температури, однак доцільно не нижче вали шляхом додавання 200мл ізопропілового 45°С Ідеальними умовами використання ціаноспирту протягом 2 годин Після охолодження до борпдриду натрію як відновного агента є викори0°С і перемішування протягом 1 години фільтрустання чистого метанолу як розчинника і провеванням відділено І\І4-(4-(4-хлорфеніл) бензил)дення реакції за кипіння зі зворотним холодильА82846В у вигляді твердої речовини білого коником, у випадку використання піридин-боровод 58526 14 13 льору (5,61г, ефективність 49,3%, 2,77г 100%-ноі натрію в 14М водному розчині гідроксиду натрію речовини, 53,7%) (тут і далі останнє число озна(0,13мл, О.бммоль) і кілька крапель оцтової кисчає вихід продукту порівняно з теоретичним) лоти для доведення рН розчину до 8,1 Після перемішування протягом 2 годин при кімнатній Приклад 1 температурі реакційну суміш концентрували до А82846В (0,50г, ефективність 76,3%, 0,38г об'єму 60мл у роторному випарнику Додавали по 100%-ноі речовини, 0,24ммоль), 4'-хлор-4краплях ізопропіловии спирт (175мл) на протязі 1 біфенілкарбоксальдепд (70мг, 0,32ммоль) та мо4 години для осадження мідного комплексу N -(4ногідрат ацетату МІДІ (51 МГ, 0,26ММОЛЬ) розмішу(4-хлорфеніл)бензил)-А82846В Фільтруванням вали в 50мл метанолу Додавали ціаноборпдрид відділено комплекс у вигляді твердої речовини натрію (20мг, 0,32ммоль) і суміш нагрівали зі звопурпурового кольору (6,50г, ефективність 26,9% у ротним холодильником протягом 23 годин Провигляді вологого осаду на фільтрі, 1,75г 100%-ноі зорий розчин пурпурового кольору охолоджували речовини, 79,1%) до кімнатної температури й додавали 12%-ний розчин боргідриду натрію в 14М водному розчині Приклад 4 гідроксиду натрію (0,03мл, 0,14ммоль) Додавали А82846В (2,5г, ефективність 78,5%, 1,96г одну краплю оцтової кислоти для доведення рН 100%-ноі речовини, 1,23ммоль) розмішували в розчину до 7,3 Додавали другу порцію 12%-ного 250мл метанолу і додавали моногідрат ацетату розчину боргідриду натрію в 14М водному розчиМІДІ (0,26г, 1,32ммоль) Після перемішування при ні гідроксиду натрію (0,23мл, О.Юммоль) і потім кімнатній температурі протягом 10 хвилин додаодну краплю оцтової кислоти для підтримання рН вали 4'-хлор-4-біфенілкарбоксальдепд (0,35г, розчину 7,3 Суміш перемішували протягом 1 1,6ммоль) та ціаноборпдрид натрію (34мг, години при кімнатній температурі й концентрува0,54ммоль) і суміш нагрівали зі зворотним хололи до об'єму 12мл у роторному випарнику Продильником протягом 3 годин Додавали додаткодукт виділяли шляхом додавання 25мл ацетонітву порцію ціаноборпдриду натрію (34мг, рилу на протязі 20 хвилин Після перемішування 0,54ммоль) і суміш нагрівали зі зворотним холопротягом 20 хвилин при кімнатній температурі дильником ще протягом 3 годин Додавали заВІДДІЛЯЛИ фільтруванням мідний комплекс N4-(4ключну порцію ціаноборпдриду натрію (34мг, (4-хлорфеніл)бензил)-А82846В у вигляді твердої 0,54ммоль) і продовжували нагрівання зі зворотречовини пурпурового кольору (0,58г, ефективним холодильником ще протягом 17 годин Охоність 59,5%, 0,35г 100%-ноі речовини, 80,3%) лоджували суміш до кімнатної температури і додавали 12%-ний розчин боргідриду натрію в 14М Приклад 2 водному розчині гідроксиду натрію (0,14мл, А82846В (6,0г, ефективність 78,4%, 4,7г О.бЗммоль) Додавали кілька крапель оцтової 100%-ноі речовини, 2,95ммоль) розмішували в кислоти для доведення рН розчину до 7,3 Дода600мл метанолу і додавали ацетат МІДІ (0,66Г, вали другу порцію 12%-ного розчину боргідриду З.бммоль) Після 15-ХВИЛИННОГО розмішування натрію в 14М водному розчині гідроксиду натрію при кімнатній температурі додавали 4'-хлор-4(0,13мл, О.бммоль) і кілька крапель оцтової кисбіфенілкарбоксальдепд (0,95г, 4,4ммоль) та ціалоти для доведення рН розчину до 8,2 Після ноборпдрид натрію (0,27г, 4,3ммоль) і суміш наперемішування протягом 1,5 годин при кімнатній грівали зі зворотним холодильником протягом 24 температурі реакційну суміш концентрували до годин Після охолодження до кімнатної темпераоб'єму 60мл у роторному випарнику Додавали по тури аналіз аліквотної частки реакційної маси краплях ізопропіловии спирт (175мл) на протязі 1 методом високоефективної рідинної хроматог4 години для осадження продукту Останній відфірафії засвідчив вихід 4,52г ІЧ -(4-(4-хлорфельтрували й висушили у вакуумі Одержано мідніл)бензил)-А82846В(85,4%) ний комплекс І\І4-(4-(4-хлорфеніл) бензил)Приклад З А82846В Фільтруванням відділено комплекс у А82846В (2,5г, ефективність 78,5%, 1,96г вигляді твердої речовини пурпурового кольору 100%-ноі речовини, 1,23ммоль) розмішували в (2,56г, ефективність 62,9%, 1,61г 100%-ноі речо250мл метанолу і додавали моногідрат ацетату вини, 72,9%) МІДІ (0,26г, 1,32ммоль) Після перемішування при кімнатній температурі протягом 10 хвилин додаПриклад 5 вали 4'-хлор-4-біфенілкарбоксальдепд (0,35г, А82846В (6,0г, ефективність 76,1%, 4,56г 1,6ммоль) та ціаноборпдрид натрію (34мг, 100%-ноі речовини, 2,9ммоль) розмішували в 0,54ммоль) і суміш нагрівали зі зворотним холо600мл метанолу і додавали моногідрат ацетату дильником протягом 3 годин Додавали додаткоМІДІ (0,63г, 3,15ммоль) Після перемішування при ву порцію ціаноборпдриду натрію (34мг, кімнатній температурі протягом 15 хвилин дода0,54ммоль) і суміш нагрівали зі зворотним холовали 4'-хлор-4-біфенілкарбоксальдепд (0,85г, дильником ще протягом 3 годин Додавали за3,9ммоль) та ціаноборпдрид натрію (84мг, ключну порцію ціаноборпдриду натрію (34мг, 1,3ммоль) і суміш нагрівали зі зворотним холоди0,54ммоль) і продовжували нагрівання зі зворотльником протягом 3 годин Додавали додаткову ним холодильником ще протягом 17 годин Охопорцію ціаноборпдриду натрію (84мг, 1,3ммоль) і лоджували суміш до кімнатної температури і досуміш нагрівали зі зворотним холодильником ще давали 12%-ний розчин боргідриду натрію в 14М протягом 3 годин Додавали заключну порцію водному розчині гідроксиду натрію (0,14мл, ціаноборпдриду натрію (84мг, 1,3ммоль) і продоО.бЗммоль) Додавали кілька крапель оцтової вжували нагрівання зі зворотним холодильником кислоти для доведення рН розчину до 7,3 Додаще протягом 16 годин Охолоджували суміш до вали другу порцію 12%-ного розчину боргідриду кімнатної температури і додавали 50%-ний вод 58526 15 ний розчин гідроксиду натрію для доведення рН реакційної суміші до 7,6 Додавали борпдрид натрію (0,11г, 2,9ммоль) і перемішували протягом 3,5 годин при кімнатній температурі Реакційну суміш концентрували до об'єму 110мл у роторному випарнику і додавали по краплях ізопропіловий спирт (250мл) на протязі 4 годин для осадження продукту Після охолодження суспензії пурпурового кольору до 0°С протягом 1 години фільтруванням відділено мідний комплекс N -(4(4-хлорфеніл)бензил)-А82846В (11,03г, ефективність 36,2% у вигляді вологого осаду на фільтрі, 3,99г 100%-ноі речовини, 77,6%) Порівняльний приклад В (без МІДІ) А82846В (0,50г, ефективність 84,3%, 0,42г 100%-ноі речовини, 0,26ммоль) розмішували в 50мл метанолу і додавали 4'-хлор-4біфенілкарбоксальдепд (72мг, О.ЗЗммоль) та піридино-бороводневий комплекс (0,033мл, О.ЗЗммоль) Суміш нагрівали зі зворотним холодильником протягом 6 годин, а потім охолоджували до кімнатної температури Аналіз аліквотної частки реакційної маси методом високоефективної рідинної хроматографії засвідчив вихід 0,25г М4-(4-(4-хлорфеніл)бензил)-А82846В(53,2%) Приклад 6 А82846В (0,50г, ефективність 84,3%, 0,42г 100%-ноі речовини, 0,26ммоль) розмішували в 50мл метанолу і додавали ацетат МІДІ (45МГ, 0,25ммоль) Після 10-ХВИЛИННОГО розмішування при кімнатній температурі додавали 4'-хлор-4біфенілкарбоксальдепд (84мг, 0,39ммоль) та піридино-бороводневий комплекс (0,039мл, 0,39ммоль) Суміш нагрівали при 57°С протягом 24 годин, а потім охолоджували до кімнатної температури Аналіз аліквотної частки реакційної маси методом високоефективної рідинної хроматографії засвідчив вихід 0,34г N4-(4-(4хлорфеніл)бензил)-А82846В(72,3%) Приклад 7 А82846В (0,50г, ефективність 76,3%, 0,38г 100%-ноі речовини, 0,24ммоль) і моногідрат ацетату МІДІ (43мг, 0,216ммоль) розмішували в 50мл метанолу і додавали 4'-хлор-4біфенілкарбоксальдепд (84,5мг, 0,39ммоль) та піридино-бороводневий комплекс (0,011 мл, 0,11ммоль) Суміш нагрівали при 63°С протягом 2 годин і додавали другу порцію піридинобороводневого комплексу (0,01мл, 0,1ммоль) Після витримування при 63°С протягом ще 2 годин додавали третю порцію піридинобороводневого комплексу (0,005мл, 0,05ммоль) Ще через 2 години додавали четверту порцію піридино-бороводневого комплексу (0,005мл, 0,05ммоль), а потім, через 5 годин при 63 С, п'яту порцію піридино-бороводневого комплексу (0,005мл, 0,05ммоль) Суміш витримували при 63°С протягом подальших 11 годин, а потім охолоджували до кімнатної температури Аналіз аліквотної частки реакційної маси методом високоефективної рідинної хроматографії засвідчив вихід 0,34г І\І4-(4-(4-хлорфеніл)бензил)-А82846В (79,2%) Реакції, описані у порівняльних прикладах А і В і в прикладах 1-7, оцінено також з точки зору (1) КІЛЬКОСТІ залишкового вихідного глікопептиду, (2) 16 КІЛЬКОСТІ продуктів, алкілованих по інших аміногрупах, крім N4, і (3) КІЛЬКОСТІ поліалкілованих продуктів Ці результати представлено у поданій нижче таблиці, де їх виражено у процентах відносно цільового продукту, алкілованого по аміногрупі N4, виходи цільового продукту є реальними значеннями, вказаними у вищенаведених прикладах ТАБЛИЦЯ ї продукту, задишко продукту, продукту, продукту, Номер чонлшіаного моноадкі- моноалкі- дшлкшоприкладу вованого •Ш846В лованого ловзного ваного іга no N ' noN6 по№ N41N6 Порівея льний приклад А 53,7 І4,І 3,5 2,4 24,4 1 80,3 7,6 1,0 0,4 9,7 2 85,4 13,0 2,4 0,7 8,2 ї 79 1 9,8 1,1 0,5 8,1 4 72,9 10,1 1,0 0,4 5,8 5 77,6 9,3 1,0 0,4 7,1 Порівняльний приклад В 53,2 47,6 9,9 1,3 21,7 6 72,3 17,8 2,1 0,7 6,2 7 79,2 9,2 1,4 03 7,4 щюд^кту , тризлкідіалкшо-• лоеанога ваного по продукту №:№ 15,9 5,6 5,9 64 4,7 5,4 3,4 0,7 0,9 0,6 0,3 0,5 7,8 2,5 34 1,8 0,4 0,3 Наведені дані показують, що цей винахід забезпечує кілька переваг По-перше, підвищується вихід продукту, алкілованого по N4 По-друге знижуються виходи продуктів, алкілованих по N та/або по N6 По-третє, цей винахід забезпечує значне підвищення репоселективності реакції Приклад 8 Мідний комплекс І\І4-(4-(4-хлорфеніл)бензил)А82846В А82846В (0,50г, ефективність 75,6-78,8%, 0,24-0,25ммоль) розмішували в 50мл метанолу і додавали ацетат МІДІ (53-56МГ, 0,29-0,31 ММОЛЬ), а потім 4'-хлор-4-біфенілкарбоксальдепд (7073мг, 0,32-0,34ммоль) та ціаноборпдрид натрію (20-22мг, 0,32-0,35ммоль) Реакційну суміш нагрівали зі зворотним холодильником протягом 24 годин і охолоджували до кімнатної температури Доводили рН до 9,0-9,3 за допомогою 1М розчину гідроксиду натрію Реакційну суміш концентрували до об'єму 10-20мл у роторному випарнику і по краплях додавали ізопропіловий спирт (13-20мл) для осадження мідного комплексу глікопептиду пурпурового кольору, який ВІДДІЛЯЛИ фільтруванням з відсмоктуванням Після висушування у вакуумі при 65°С одержано мідний комплекс глікопептиду у вигляді порошку пурпурового кольору Після проведення чотирьох операцій синтезу об'єднані порції комплексу глікопептиду проаналізовано для визначення вмісту МІДІ, знайдений вміст МІДІ 3,0%, що підтверджує ідентификацію продукту як комплексу МІДІ з N4-(4-(4хлорфеніл)бензил)-А82846В у співвідношенні 1 1 Порівняльний приклад С і приклади 9-19 РІЗНІ СОЛІ МІДІ порівнювали за допомогою стандартизованої процедури А82846В (1 еквівалент в розрахунку на вільну основу з урахуванням ефективності) розмішували в 50мл метанолу і додавали сіль двовалентного металу (МХ2, 0,63 еквіваленту) або одновалентного металу (MX, 1,25 еквіваленту), а потім 4'хлор-4-біфенілкарбоксальдепд (1,25 еквіваленту) та ціаноборпдрид натрію (1,25 еквіваленту) Суміш нагрівали зі зворотним холодильником про 58526 18 17 тягом 24 годин Після охолодження до кімнатної рН Додавали глікопептид у вигляді основи (0,55г, температури відбирали аліквотну частку для ефективність 74,7%, 0,41г 100%-ноі речовини, аналізу методом високоефективної рідинної хро0,26ммоль) і перемішували протягом 15 хвилин матографії (ВРХ) Реєстрували характеристики розчинності й рН Для контролю проходження реакції та визначення виходу використовували систему ВРХтипу ТАБЛИЦЯ Ш 600Е фірми "Уотерс" (Waters 600E) з інтегратоСіль Розчхштсіь сот в рН Розчинність рН ром НР3395 і детектором типу 757 фірми "Епметанолі гажшівптицу за присутності солі ___ лайд Байосистемз" (Applied Biosystems 757), що f^——-— Низька Низька працював на довжині хвилі 230нм, чутливість 0,1 розчинність, роячинщоть, мутний білий мутний рожевий одиниці поглинання, періодичність спрацьовурОЗЧИіі розчии Cu(OH)j Низька 6,2 Низька 7,0 вання фільтру 1 секунда Колонка 4,6мм х 25см, ртіЧИВНІІЛЬ, розчинність. сорбент "Зорбакс СБ феніл" (Zorbax SB-Phenyl) мугиий мугаий свгоюблакиший світяоблакитняй фірми "Дюпон" (DuPont) Елюент А 10% ацетонірозчин розчин трилу, 90% буферного розчину (0,2% триетилаQi(OAc| Розчинна, 6,5 Розчинна, 6,7 прозорий прожірий міну, 0,25% ортофосфорної кислоти) Елюент В синьозелений пурпуровий розчин 60% ацетонітрилу, 40% буферного розчину (0,2% розчин Cu(O CCF ) Розчинна, 4,4 Розчинна, 6,2 триетиламшу, 0,25% ортофосфорної кислоти) прозорий прозорий ештлобяакитяий пурпуровий розчин Програма градієнтного елюювання зі швидкістю розчин потоку 1мл/хв початковий момент - 100% А, грацикяогекеанбутират Слабка мутність, 6,0 Розчинна, 6,7 МІДІ (II) СВІТЛИЙ прозорий дієнт до 80% А, 20% В на протязі 5хв , постійний блакитншеланнй пурпуровий розчин склад протягом 5хв , градієнт до 100% В протярозчин етшгексаноат м ш Розчинна, 6,5 Розчинна, 6,7 гом 20хв , градієнт до 100% А на протязі 5хв , прозорий (П) прозорий синьозелений пурпуровий розчин постійний склад 20хв Підготовка проби 0,5-1,0г розчин реакційної суміші розбавляли до 25мл сумішшю СиСіз Розчинна, 3,2 Низька 6,6 прозорий розчинність, ацетонітрилу з буферним розчином Витримувабезбарвний розчин мутний пурпуровий ли при кімнатній температурі приблизно ЗО хвирозчин CuBrj Розчинна, 2,8 Розчинна, 5,9 лин до знебарвлення пурпурового кольору міднопрозорий жовтий прозорий го комплексу Час елюювання цільового продукту розчин пурпуровий розчин CuSO 5H O Розчинна 3,7 Низька 6,2 алкілування глікопептиду 16-18 хвилин, вихідного прозорий РОЗЧИННІСТЬ, безбарвний розчин МУТНІЙ пурпуровий глікопептиду 3-4 хвилини, продукту алкілування розчин по аміногрупі N6 (моносахаридній) 18-19 хвилин, 1 продукту алкілування по аміногрупі N (метиллейцину) 19-21 хвилина, діалкілованих домішок Вищенаведені приклади ілюструють деякі ха24-26 хвилин і альдегіду 35-36 хвилин Вихід вирактерні особливості цього винаходу По-перше, значали шляхом порівняння зі стандартами, примідь має бути введена в реакційну суміш у приготованими з використанням стандартного зразка наймні частково розчинній формі Такі сполуки продукту МІДІ, як CuF2 або Си(ОН)2, майже нерозчинні в метанолі, є неефективними Крім того, перевага Результати подано в нижченаведеній табливіддається солям МІДІ, ЯКІ забезпечують повну ці Результати для алкілованих побічних продукрозчинність вихідного глікопептидного антибіотитів подано в процентах відносно цільового продука, в ідеальному випадку - при значеннях рН, 4 кту алкілування по N яким віддається перевага Солі, які мають найвищу ефективність (Си(ОАс)2, циклогексанбутиCo 3 3 4 У% відносно продукт моноалкілованої» по N 4 ]Виш Сіль % у рН Вихідний Продукт, Продукт, И1КОмономи- МОНОЗІШ т в ш и6й ЛОВ8ВИЙ noN noN 1 ПорівияЧЬНИЙ приклад С 9 10 п 1 2 U 14 Ь 16 17 18 19 2 рат МІДІ (II) і етилгексаноат МІДІ (II)) забезпечують ТАБЛИПЯ II Нотіер 3 2 63,5 57,8 62,0 71,7 64,0 никяогек«шбто!ра.т мда (11) 69,0 етщд-ексаноат міді (II) 69fi CuClj 66,9 CuBr? 67,5 OiCl 67,4 CuSO 5H O 33,9 CuSO 52,1 відсутність CuF ; Cu100 32,2 7,8 6,2 4,1 3,6 4,0 2,3 ЗД 4,7 Ї.9 4,1 4,6 7,1 6,1 1.6 1,8 2,1 1,2 повну розчинність основи глікопептиду і рН розчину глікопептиду приблизно 6,7 Солі, ЯКІ забезпечують підвищення ефективності у порівнянні зі способом без використання МІДІ, але не є оптимальними (CufC^CCFsh, CuCb, СиВгг), або забезпечують розчинність глікопептиду, проте з рН нижче оптимального (СиВгг, CufC^CCFsh), або створюють оптимальне значення рН, але при цьому не забезпечують повної розчинності глікопептиду (СиСіг) 1,4 3,3 2,4 2,4 1,9 s s Було проведено подальше співставлення тих же самих солей МІДІ З ТОЧКИ зору їх розчинності в метанолі й розчинності вихідного глікопептидного антибіотика за їх присутності Для цього використано таку процедуру мідну сіль (0,165ммоль) додавали до 50мл метанолу і розмішували протягом 15 хвилин при кімнатній температурі Реєстрували характеристики розчинності, а також Коротко кажучи, мідь має бути у формі, яка, принаймні, частково розчинна і забезпечує або підтримує повну розчинність вихідного глікопептидного антибіотика при прийнятному значенні рН, як правило, від 6,3 до 7 Крім того, ці експерименти було проведено при КІЛЬКОСТІ МІДІ, меншій за оптимальну, додаткові переваги цього винаходу досягаються при вищих концентраціях МІДІ Порівняльний приклад D (за відсутності МІДІ) І приклад 20 20 19 58526 Було проведено два досліди з глікопептиднатній температурі суміш пурпурового кольору ним антибіотиком А82846А один без МІДІ (порівнагрівали до 35-40°С і розмішували ще ЗО хвиняльний приклад D), а другий з моногідратом лин Розчин концентрували до об'єму 45мл у роацетату МІДІ ЯК альдегід був використаний 4'торному випарнику і по краплях додавали 100мл хлор-4-біфенілкарбоксальдепд Реакції було проізопропілового спирту протягом 2 годин Суспенведено за процедурами, описаними у вищенавезію охолоджували до 0°С і фільтрували Після дених прикладах Результати ДОСЛІДІВ подано у висушування у вакуумі при 35°С, одержали 2,6г таблиці IV мідного комплексу А82846В у вигляді твердої речовини пурпурового кольору Мас-спектроскоТАБЛИЦЯ IV пічний аналіз показав наявність ІОНІВ, очікуваних для комплексу, в тому числі серію ПІКІВ з масою Дослід Вихід у %, % продукту, % продукіу, % продукту % проявну, , розрахований моиоалкшо- моноалкіло- дияюлова дшшоваприблизно 1653, які не були виявлені при аналізі 4 за площею ваного по ваногопо ного по N і ного по N і 1 6 порівняльного зразка А82846В і є характерними N4 шка на N N N хроматогрші для мідного комплексу А82846В Порівняльний 52,4 9,0 Інший зразок мідного комплексу А82846В був 4,7 приклад D 2,6 15,8 Приклад 20 71,4 1 ] 6,0 0,9 6,6 приготований аналогічним способом і проаналізований методом спектроскопії в УФ і видимому Приклад 21 Мідний комплекс А82846В діапазонах, який показав максимум поглинання А82846В (3,0г, ефективність 78,7%, 2,4г на довжині хвилі приблизно 540нм, цей максимум 100%-ноі речовини, 1,5ммоль) розмішували в не виявлений у спектрах порівняльного зразка ЗООмл метанолу при кімнатній температурі й доА82846В і ацетату МІДІ І Є характерним для міднодавали моногідрат ацетату МІДІ (0,31Г, 1,6ММОЛЬ) го комплексу А82846В ПІСЛЯ розмішування протягом 20 хвилин при кім1 6 Комп'ютерна верстка Е Гапоненко Підписано до друку 05 09 2003 Тираж39 прим Міністерство освіти і науки України Державний департамент інтелектуальної власності, Львівська площа, 8, м Київ, МСП, 04655, Україна ТОВ "Міжнародний науковий комітет", вул Артема, 77, м Київ, 04050, Україна
ДивитисяДодаткова інформація
Назва патенту англійськоюProcesses for reductive alkylation of glycopeptide antibiotics
Автори англійськоюBergkund Richard Alan
Назва патенту російськоюСпособ восстановительного алкилирования гликопептидных антибиотиков
Автори російськоюБерглунд Ричард Алан
МПК / Мітки
МПК: A61K 38/00, A61K 38/14
Мітки: мідного, спосіб, антибіотика, глікопептидного, відновного, комплекси, міді, алкілування, комплексу, одержання
Код посилання
<a href="https://ua.patents.su/10-58526-sposib-vidnovnogo-alkiluvannya-glikopeptidnogo-antibiotika-kompleksi-midi-ta-sposib-oderzhannya-glikopeptidnogo-antibiotika-iz-midnogo-kompleksu.html" target="_blank" rel="follow" title="База патентів України">Спосіб відновного алкілування глікопептидного антибіотика, комплекси міді та спосіб одержання глікопептидного антибіотика із мідного комплексу</a>
Попередній патент: Висувна опора стрілового крана
Наступний патент: Спосіб визначення гранул клітин крові, які містять цинк
Випадковий патент: Спосіб отримання мезопористого магеміту