Кондуктометричний біосенсор для визначення афлатоксинів у водних розчинах
Номер патенту: 75156
Опубліковано: 26.11.2012
Автори: Сергеєва Тетяна Анатолівна, Шкотова Людмила Василівна, Дзядевич Сергій Вікторович, Бурдак Олександр Степанович, Солдаткін Олександр Олексійович, Солдаткін Олексій Петрович
Формула / Реферат
Кондуктометричний біосенсор для визначення концентрації афлатоксинів у водних розчинах, що містить дві пари кондуктометричних електродів, на одну з яких нанесена робоча ферментна мембрана, на другу нанесена референтна мембрана, а вказаний біосенсор виконаний з можливістю підключення до кондуктометричної установки, який відрізняється тим, що робоча мембрана містить ацетилхолінестеразу чутливу до афлатоксинів.
Текст
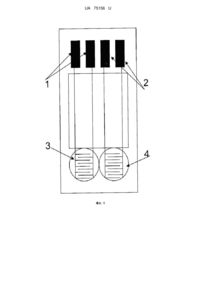
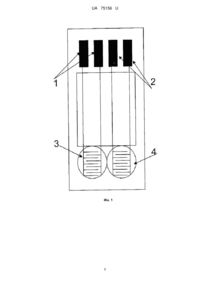
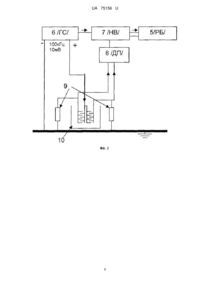
Реферат: Кондуктометричний біосенсор для визначення концентрації афлатоксинів у водних розчинах містить дві пари кондуктометричних електродів, на одну з яких нанесена робоча ферментна мембрана, на другу нанесена референтна мембрана. Вказаний біосенсор виконаний з можливістю підключення до кондуктометричної установки. Робоча мембрана містить ацетилхолінестеразу чутливу до афлатоксинів. UA 75156 U (12) UA 75156 U UA 75156 U 5 10 15 20 25 30 35 40 45 50 55 Корисна модель належить до екології і може бути використана, зокрема для експресаналізів водних проб (змивів зернових), для оцінки наявності та визначення концентрації афлатоксинів, а більш конкретно, до конструкції аналітичних систем для моніторингу токсичних речовин у водних розчинах, а саме, до кондуктометричного біосенсора на основі ацетилхолінестерази для аналізу афлатоксинів у водних розчинах. Афлатоксини - являють собою одну з найбільш небезпечних груп мікотоксинів, що мають сильні канцерогенні властивості. Афлатоксини виявляють в різних продуктах харчового призначення - в зерні злакових культур, в різних горіхах, спеціях, какао, кава, деяких овочах і фруктах, в насінні олійних рослин, в молоці, м'ясі, яйцях. Одним з найбільш небезпечних та поширених афлатоксинів, це афлатоксин В1 - продукт життєдіяльності цвілевих грибів Aspergillus flavus, який розмножується на зерні при високій вологості і теплих умовах. Цю речовину вважають найтоксичнішим природним гепатоканцерогеном з усіх сполук, які охарактеризовані на сьогодні. Вона спричиняє гепатоцелюлярну карціному людини - пухлину, що з'являється з великою частотою в деяких регіонах земної кулі. Потрапляючи до організму афлатоксини спричиняють афлатоксикози специфічні захворювання, що розвиваються в результаті дії на організм людини і тварин токсичних метаболітів мікроскопічних патогенних грибів [1]. У печінці афлатоксин В1 та інші токсини цієї групи не зворотно зв'язуються з молекулами білків і ДНК та утворюють аддукти (наприклад, афлатоксин В1-лізин у молекулі альбуміну). Руйнування білків і азотистих основ ДНК у гепатоцитах зумовлює токсичність афлатоксинів щодо печінки. У гепатоцитах афлатоксин В1 перетворюється до більш токсичних і канцерогенних метаболітів за участю цитохром Р450монооксигенази [2, 3]. Серед афлатоксинів, як відомо афлатоксин В1 вважається одним із самих шкідливих та поширених. Навіть дуже низькі концентрації негативно впливають на здоров'я людини. Цю речовину вважають найтоксичнішим природним гепатоканцерогеном з усіх сполук, які охарактеризовані на сьогодні. У зв'язку з вищевикладеним, постійний ефективний контроль наявності цих токсинів (перевищення допустимих концентрацій) в кормі тварин і продуктах харчування людей є обов'язковим для запобігання отруєнь. Сучасні стандартні методи високоточного визначення токсичних речовин, а саме рідинна хроматографія, спектрофотометрія, колориметрія, різноманітні хімічні та фізичні методи потребують наявності кваліфікованого персоналу та складного і дорогого обладнання. Ще одним недоліком наведених методів аналізу є необхідність в складній попередній підготовці проб, що виливається у великі затрати часу та коштів. Тому сьогодні постає дуже актуальне питання створення більш зручного, точного, селективного, швидкого та дешевого методу визначення афлатоксинів. Розробка та створення кондуктометричних біосенсорів для визначення афлатоксинів може сьогодні найкраще вирішити проблеми, пов'язані з перерахованими вище недоліками, та задовольнити усім вищезгаданим вимогам. На даний момент існує кілька варіантів біосенсорів для визначення афлатокинів [4-10]. Робота низки цих біосенсорів основана на використанні імунного або імунно-ферментного методів аналізу. Біосенсори на основі цих методів характеризуються складністю та тривалістю процедури аналізу, дороговизною матеріалів при виготовленні самих біосенсорів [4-6]. Інші варіанти біосенсорів для визначення афлатоксинів, що існують на даний момент у світі, це амперметричні [7-10]. В основі біоселективних елементів даних біосенсорів використовують або афлатоксиноксидазу [7, 8] або, як і в запропонованій корисній моделі, ацетилхолінестеразу [9, 10]. Але, порівняно з кондуктометричними біосенсорами на основі тих самих ферментних систем, описані амперометричні біосенсори мають ряд недоліків, таких як потреба у наявності допоміжних речовин - медіаторів в складі біоселективного елементу або/та недостатня чутливість та селективність за рахунок чутливості амперометричних перетворювачів до інтерферуючих електроактивних речовин. Крім того, кондуктометричні методи аналізу на відміну від амперометричних є достатньо простими, зручними, точними та дозволяють вирішити ряд важливих науково-дослідних та виробничих задач [11]. Найбільш близьким до пропонованого за технічною суттю є амперометричний біосенсор для визначення концентрації афлатоксину у водних розчинах, який має один амперометричний електрод, на який нанесена робоча мембрана на основі ацетилхолінестерази, а сам біосенсор призначений для підключення до амперометричної установки [9]. Недоліками описаного пристрою є те, він є менш чутливим, селективним та значно складнішим під час його приготування. 1 UA 75156 U 5 10 15 20 25 30 35 40 45 50 55 В основу корисної моделі поставлена задача створення такого кондуктометричного біосенсора для визначення афлатоксинів у водних розчинах, який би був більш чутливим, селективним та простим при виготовлені. Поставлена задача вирішується пропонованим кондуктометричним біосенсором для визначення концентрації афлатоксинів у водних розчинах, який має дві пари кондуктометричних електродів, на одну з яких нанесена робоча ферментна мембрана, на другу нанесена референтна мембрана, а вказаний біосенсор призначений для підключення до кондуктометричної установки, згідно з корисною моделлю робоча мембрана має просту безмедіаторну архітектуру та складається з ацетилхолінестерази чутливої до афлатоксинів. Поставлена задача вирішується за рахунок застосування кондуктометричного методу вимірювання, ефекту інгібування іммобілізованого ферменту ацетилхолінестерази і створення умов для селективної оцінки вмісту афлатоксину у досліджуваному зразку. Необхідну селективність та чутливість було отримано завдяки використанню кондуктометричного біосенсора на основі простої безмедіаторної архітектури біомембрани з ацетилхолінестеразою, яка є чутливою до афлатоксинів. Щоб отримати селективний біосенсор, який можна використовувати для роботи з реальними зразками було застосовано кондуктометричний метод вимірювання. В основі роботи кондуктометричного біосенсора для визначення афлатоксинів лежить ефект інгібування ацетилхолінестерази з наступною ферментативною реакцією: AXE Ацетилхолін H2O Холін CH 3COO H В процесі проходження ферментативної реакції ацетилхолінестераза розщеплює ацетилхолін, при цьому змінюється концентрація заряджених іонів в робочій мембрані, яку і можна реєструвати за допомогою кондуктометричного перетворювача [12]. Далі перевіряли реакцію біосенсора на досліджуваний розчин з можливим вмістом в ньому афлатоксинів. В ході цього впливу афлатоксини, що присутні в аналізованому зразку, інгібують роботу ферменту. Відповідно, по ходу ферментативної реакції, при наявності інгібіторів, генерується вже менше заряджених іонів, що призводить теж до зміни провідності розчину, але у меншій мірі ніж спочатку. В залежності від цієї різниці і визначали наявність афлатоксинів в досліджувальному зразку. Ферментативну систему вибирали експериментально за умов отримання покращених аналітичних характеристик біосенсору таких як чутливість, селективність, простота конструкції, а також мінімальної собівартості. Суть пропонованої корисної моделі пояснюється графічними матеріалами, де на фіг. 1 схематично показано кондуктометричний біосенсор для визначення концентрації афлатоксинів у водних розчинах; на фіг. 2 показана блок-схема кондуктометричної установки [13]; на фіг. 3 продемонстровано принцип роботи кондуктометричного біосенсора на основі ацетилхолінестерази для визначення афлатоксинів на реальному прикладі проведення експерименту; на фіг. 4 наведено калібрувальний графік залежності залишкової активності біосенсора від концентрації афлатоксину В1. Кондуктометричний біосенсор для визначення концентрації афлатоксинів у водних розчинах складається з двох пар електродів 1 та 2 (фіг. 1). На одну пару електродів 1 нанесена робоча мембрана 3. На другу пару електродів 2 нанесена референтна мембрана 4. Згаданий біосенсор підключений до кондуктометричної установки (фіг. 2). Робоча мембрана 3 містить фермент ацетилхолінестеразу, селективну до впливу афлатоксинів. Кондуктометрична установка містить блок 5 для реєстрації сигналів біосенсора /РБ/, низькочастотний генератор сигналів 6 /ГС/ (типу Г3-118 /Україна/), входи якого підключені до відповідних електродів кондуктометричного біосенсора. Виходи генератора сигналів 6 /ГС/ підключені до входу фазочутливого нановольтметра 7 /НВ/. Виходи нановольтметра 7 /НВ/ підключені до реєстраційного блока 5 /РБ/, призначеного для реєстрації сигналів з біосенсора. Окрім того, установка оснащена опорами навантаження 9 /ОН/, призначеними для відображення сигналів з відповідних пар електродів. При цьому входи нановольтметра 7 /НВ/ через диференційний підсилювач 8 /ДП/ підключені до відповідних пар електродів біосенсора, які розташовані у вимірювальній комірці 10 /ВК/. Пропонований кондуктометричний біосенсор для визначення концентрації афлатоксинів у водних розчинах працює наступним чином: На робочу поверхню однієї пари електродів 1 кондуктометричного біосенсора наносили вихідну суміш для створення робочої мембрани 3 (об'єм 50 нл), яку вносили в пари глутарового 2 UA 75156 U 5 10 15 20 25 30 35 40 45 50 альдегіду (ГА) на 15-25 хвилин, Цю робочу мембрану готували із 25 мМ фосфатного буфера, рН 6,2, і наступних інгредієнтів у такому їх співвідношенні (у мас. %): ацетилхолінестерази (АцХЕ) 0,25-1,25 сироватковий альбумін бика (БСА) 3-6 гліцерин 8-18. На другу пару електродів 2 наносили вихідну суміш для створення референтної мембрани 4 (50 нл), яку вносили в ГА на 15-25 хвилин, цю мембрану формували з 25 мМ фосфатного буфера, рН 6,2, і наступних інгредієнтів у такому їх співвідношенні (у мас. %): БСА 3,25-6,25 гліцерин 8-18 З генератора 6 /ГС/ на електроди біосенсора 1 та 2, що утворюють диференційну пару і знаходяться в комірці 10 /К/ з розчином, що досліджується, подавали змінну напругу з частотою 100 кГц та амплітудою 10 мВ. При цьому із згаданих електродів 1 та 2 отримували сигнали, які знімалися з опорів навантаження 9 /ОН/ (RH=1 кОм) та надходили через диференційний підсилювач /типу Unipan-233-6 (Польща)/ 8 /ДП/ до селективного нановольтметра /типу Unipan233 (Польща)/ 7 /НВ/. Після нановольтметра 7/НВ/ сигнал подавали до реєстраційного блока 5 /РБ/ для реєстрації сигналу біосенсора кондуктометричної вимірювальної установки, в якій відбувалося перерахування даних та отримання сигналу, який відповідає концентрації афлатоксинів у досліджуваному водному розчині. Пропоновану систему використовували так. Попередньо виготовляли біоселективні мембрани. Створення біосенсора: виготовляли робочу мембрану 3. Для цього готували розчин з вмістом 1 % Ацетилхолінестерази (АцХЕ), 5 % БСА та 10 % гліцерину у 25мМ фосфатному буфері, рН 6,2. Референтну мембрану 4 виготовляли таким же чином, але замість наважки фермента брали лише 6 % БСА. Гліцерин у складі мембран 3, 4 використовувався для стабілізації ферменту при іммобілізації та запобігання передчасного підсихання розчину, нанесеного на поверхню перетворювача. В свою чергу, БСА в складі робочої мембрани 3 відігравав роль стабілізуючого агенту для ферменту. Для створення мембран біосенсора, відповідно, 3 та 4, краплю суміші АцХЕ-БСА (50 нл) наносили на одну частину чутливої поверхні перетворювача 1, а на іншу 2 - розчин БСА без ферменту (це був датчик порівняння). Для іммобілізації мембран датчики розміщували в атмосфері насичених парів глутарового альдегіду (ГА) на 15-25 хв. і потім підсушували на повітрі й відмивали від надлишку ГА та незв'язаного ферменту в буферному розчині протягом 10-20 хв. Протокол аналізу афлатоксинів на прикладі афлатоксину В1 в модельних розчинах. Спочатку отримували залежності величин відгуків кондуктометричного біосенсора на ацетилхолінхлорид до і після інгібування біосенсора різними концентраціями афлатоксину В1 одержували калібрувальний графік (Фіг.4). Мінімальна границя визначення афлатоксину В1 була 0,05 мкг/мл, що в 20 разів краще ніж, у найбільш близького до пропонованого за технічною суттю амперометричного біосенсора - 1 мкг/мл [9]. Для перевірки роботи пропонованого кондуктометричного біосенсора з реальними зразками, готували розчин з умовно невідомою концентрацією афлатоксину В1. За допомогою біосенсора отримували сигнал (X) на внесення до комірки 1 мМ ацетилхолін хлориду (див. Фіг. 3.). Величину цього сигналу приймали за 100 %. Потім до вимірювальної комірки додавали розчин з умовно невідомою концентрацією афлатоксину В1. Починав зменшуватись відгук біосенсора на субстрат. В залежності від концентрації афлатоксину В1 в аналізованій пробі, зменшується величина відгуку на субстрат (Y). В залежності від величини сигналу по формулі Z=Y*100/X (Х, Y-величини сигналів біосенсора до і після, інгібування афлатоксином В1) отримували залишкову активність (Z). Оскільки залишкова активність відома, по калібрувальному графіку отримували концентрацію афлатоксину, яка на сто відсотків співпадала з умовно невідомою концентрацію афлатоксину у розчині. З прикладу роботи біосенсора та за допомогою калібрувального графіка (Фіг. 4) видно, що пропонований кондуктометричний біосенсор на основі ацетилхолін естерази є функціонально придатним і дозволяє отримувати результати з більш високим ступенем достовірності, порівняно із прототипом, проводити аналіз афлатоксинів в реальних розчинах. Джерела інформації:. 1. Нечаев А.П. Харчова хімія. СПб.: ГИОРД, 2003 - 640 с. 3 UA 75156 U 5 10 15 20 25 30 2. Yu J., Cleveland Т.Е., Nierman W.C., Bennett J.W. Aspergillus flavus genomics: gateway to human and animal health, food safety, and crop resistance to diseases // Rev. Iberoam. Micol.-2005. Vol. 22. - P. 194-202. 3. E. Azziz-Baumgartner, K. Lindblade, K. Gieseker et al. Case-control study of an acute aflatoxicosis outbreak // Environ. Health Perspect.-2005. - Vol. 113 (12). - P. 1779-1783. 4. Kim E. Sapsford, Chris R. Taitt, Stephanie Fertig, Martin H. Moore, Michael E. Lassman, Chris M. Maragos, Lisa C. Shriver-Lake Indirect competitive immunoassay for detection ofaflatoxin B1 in corn and nut products using the array biosensor // Biosensors and Bioelectronics, -2006. - Vol. 21. P. 2298-2305. 5. Yan Liu, Zonghui Qin, Xingfa Wu, Hong Jiang Immune-biosensor for aflatoxin В1 based bioelectrocatalytic reaction on micro-comb electrode // Biochemical Engineering Journal, -2006. -Vol. 32. -P. 211-217. 6. M.A. Carlson, СВ. Bargeron, R.C. Benson, A.B. Fraser, Т.Е. Phillips, J.T. Velky, J.D. Groopman, P.T. Strickland, H.W. Ко An automated, handheld biosensor for aflatoxin // Biosensors and Bioelectronics, -2000. - Vol. 14. - P. 841-848. 7. Junhua Chen, Daling Liu, Shichuan Li, Dongsheng Yao Development of an amperometric enzyme electrode biosensor for sterigmatocystin detection // Enzyme and Microbial Technology, 2010. - Vol. 47. - P. 119-126. 8. Shi chuan Li, Jun hua Chen, Hong Cao, Dong sheng Yao, Da ling Liu Amperometric biosensor for aflatoxin B1 based on aflatoxin-oxidase immobilized on multiwalled carbon nanotubes // Food Control, -2011. - Vol. 22. - P. 43-49. 9. Tamara Hansmann, Benoit Sanson, Jure Stojan, Martin Weik, Jean-Louis Marty, Didier Fournier Kinetic insight into the mechanism of cholinesterasterase inhibition by aflatoxin В1 to develop biosensors // Biosensors and Bioelectronics, -2009. - Vol. 24. - P. 2119-2124. 10. Miroslav Pohanka, Daniel Jun, Kamil Kuca Aflatoxin assay using an acetylcholinesterase based biosensor // Toxicology Letters, -2008. - Vol. 180. - P. S73. 11. Дзядевич С.В. Кондуктометричні ферментні біосенсори: теорія, технологія, застосування. // Біополімери і клітина-2005,-21, - С. 91-106. 12. Дзядевич С.В., Шульга А.А., Пацковский С.В., Архипова В.Н., Солдаткин А.П., Стриха В.И. Тонкопленочные кондуктометрические датчики для ферментативных биосенсоров. // Электрохимия - 1994,-30, - С. 982-987. 13. Солдаткін О.О., Дзядевич С.В., Солдаткін О.П., Єльська Г.В., Патент України № 25456, Кондуктометричний біосенсор для визначення концентрації іонів важких металів у водних розчинах // Заявл. 28.03.2007; Опубл. 10.08.2007, Бюл. № 12. - 8 с. 35 ФОРМУЛА КОРИСНОЇ МОДЕЛІ 40 Кондуктометричний біосенсор для визначення концентрації афлатоксинів у водних розчинах, що містить дві пари кондуктометричних електродів, на одну з яких нанесена робоча ферментна мембрана, на другу нанесена референтна мембрана, а вказаний біосенсор виконаний з можливістю підключення до кондуктометричної установки, який відрізняється тим, що робоча мембрана містить ацетилхолінестеразу чутливу до афлатоксинів. 4 UA 75156 U 5 UA 75156 U 6 UA 75156 U 7 UA 75156 U Комп’ютерна верстка Л. Ціхановська Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 8
ДивитисяДодаткова інформація
Назва патенту англійськоюConductometric bio-sensor for determination of aflatoxins in water solutions
Автори англійськоюSoldatkin Oleksandr Oleksiiovych, Budrak Oleksandr Stepanovych, Shkotova Liudmyla Vasylivna, Serhieieva Tetiana Anatoliivna, Dziadevych Serhii Viktorovych, Soldatkin Oleksii Petrovych
Назва патенту російськоюКондуктометрический биосенсор для определения афлатоксинов в водных растворах
Автори російськоюСолдаткин Александр Алексеевич, Бурдак Александр Степанович, Шкотова Людмила Васильевна, Сергеева Татьяна Анатольевна, Дзядевич Сергей Викторович, Солдаткин Алексей Петрович
МПК / Мітки
МПК: G01N 33/18, G01N 33/02
Мітки: розчинах, водних, визначення, афлатоксинів, біосенсор, кондуктометричний
Код посилання
<a href="https://ua.patents.su/10-75156-konduktometrichnijj-biosensor-dlya-viznachennya-aflatoksiniv-u-vodnikh-rozchinakh.html" target="_blank" rel="follow" title="База патентів України">Кондуктометричний біосенсор для визначення афлатоксинів у водних розчинах</a>
Попередній патент: Спосіб переробки кислих гудронів
Наступний патент: Спосіб видалення діоксиду сульфуру з димових газів вугільних казанів