Спосіб визначення наявності у ссавця ало-антитіл до факторa viii, що спроможні розщеплювати фактор viii, амінокислотна послідовність, що інгібує будь-який сайт у молекулі факторa viii, що чутливий до розщепленн
Номер патенту: 75867
Опубліковано: 15.06.2006
Автори: Кавері Срініва, Казачкін Мішель, Лакруа-Десмазе Себастьєн
Формула / Реферат
1. Спосіб визначення наявності у ссавця ало-антитіл до фактора VIII, що спроможні розщеплювати фактор VIII, який відрізняється тим, що включає:
і) виділення плазми із зразка крові, взятого в зазначеного ссавця;
іі) виділення зі вказаної плазми ало-антитіл до фактора VIII;
ііі) приведення зазначених ало-антитіл до фактора VIII у контакт з фактором VIII на період часу, достатній для забезпечення розщеплення вказаного фактора VIII зазначеними ало-антитілами до фактора VIII; і
iv) визначення, після вказаного періоду часу, чи ефективно зазначені ало-антитіла до фактора VIII розщепили вказаний фактор VIII.
2. Спосіб за п. 1, який відрізняється тим, що на етапі (іі) зазначені ало-антитіла до фактора VIII виділяють із вказаної плазми, об'єднуючи їх із зазначеним фактором VIII, причому зазначений фактор VIII переважно пов'язаний із матриксом.
3. Спосіб за п. 1 або 2, який відрізняється тим, що на етапі (іі) зазначені ало-антитіла до фактора VIII виділяють за допомогою афінної хроматографії.
4. Спосіб за п. 3, який відрізняється тим, що на етапі (іі) зазначена афінна хроматографія включає застосування фактора VIII, який ковалентно пов'язаний з матриксом сефарози, що переважно активований ціаноген-бромідом.
5. Спосіб за будь-яким з пп. 1-4, який відрізняється тим, що на етапі (ііі) вказаний фактор VIII мітять міткою, переважно радіактивною міткою, зокрема, такою як 125І.
6. Спосіб за будь-яким з пп. 1-5, який відрізняється тим, що на етапі (ііі) зазначений фактор VIII приводять до контакту з ало-антитілами до фактора VIII на період часу від приблизно 0,5 години до приблизно 30 годин, переважно близько 10 годин, при температурі від приблизно 15°С до приблизно 40°С, переважно 38°С.
7. Спосіб за будь-яким з пп. 1-6, який відрізняється тим, що етап (iv) проводять шляхом визначення, що включає метод поділу, такий як електрофорез у гелі, зокрема електрофорез у поліакриламідному гелі у присутності додецилсульфату натрію (SDS-PAGE), або гель-фільтрацію, зокрема, таку як швидка рідинна гель-фільтраційна хроматографія білків, та техніку візуалізації, зокрема, таку як авторадіографія.
8. Спосіб за будь-яким з пп. 1-7, який відрізняється тим, що додатково включає:
v) одержання характеристик сайту (сайтів) молекули зазначеного фактора VIII, у якому (яких) відбувається розщеплення зазначеними ало-антитілами до фактора VIII.
9. Спосіб за п. 8, який відрізняється тим, що зазначене одержання характеристик здійснюють, приводячи вказаний фактор VIII у контакт із зазначеними ало-антитілами до фактора VIII, які спроможні розщеплювати фактор VIII, розділяючи та потім секвенуючи отримані внаслідок такої процедури фрагменти фактора VIII.
10. Спосіб за п. 8 або 9, який відрізняється тим, що зазначений поділ проводять, використовуючи таку техніку, як електрофорез у гелі, зокрема, таку як SDS-PAGE.
11. Спосіб за будь-яким з пп. 8-10, який відрізняється тим, що зазначене секвенування здійснюють, використовуючи таку техніку, як N-кінцеве секвенування, зокрема, із використанням автоматичного білкового мікросеквенатора.
12. Спосіб за будь-яким з пп. 8-11, який відрізняється тим, що зазначене секвенування в такий спосіб локалізує спроможні до розщеплення зв'язки: Аrg372-Ser373, що знаходиться між доменами А1 і А2, Tyr1680-Asp1681, що знаходиться на N-кінці домену A3, і Glu1794-Asp1795, що знаходиться всередині домену A3 молекули фактора VIII.
13. Амінокислотна послідовність:
Ser Val Ala Lys Lys His Pro,
що інгібує будь-який сайт у молекулі фактора VIII, що чутливий до розщеплення ало-антитілами до фактора VIII.
14. Амінокислотна послідовність:
Asp Glu Asp Glu Asn Gln Ser,
що інгібує будь-який сайт у молекулі фактора VIII, що чутливий до розщеплення ало-антитілами до фактора VIII:
15. Амінокислотна послідовність:
Asp Gln Arg Gln Gly Ala Glu,
що інгібує будь-який сайт у молекулі фактора VIII, що чутливий до розщеплення ало-антитілами до фактора VIII.
16. Застосування інгібітору розщеплення фактора VIII для нейтралізування каталітичної активності ало-антитіл до фактора VIII.
17. Застосування за п. 16, яке відрізняється тим, що інгібітор являє собою інгібітор протеаз, зокрема, такий як 4-(2-аміноетил)бензил-сульфонілфторид-гідрохлорид.
18. Застосування за п. 16 або 17, яке відрізняється тим, що згаданий інгібітор інгібує розщеплення спроможних до розщеплення зв'язків: Arg372-Ser373, що знаходиться між доменами А1 і А2, Tyr1680-Asp1681, що знаходиться на N-кінці домену A3, і Glu1794-Asp1795, що знаходиться всередині домену A3 молекули фактора VIII.
19. Інгібітор розщеплення фактора VIII, що каталізується ало-антитілами до фактора VIII, який відрізняється тим, що включає амінокислотну послідовність:
Ser Val Ala Lys Lys His Pro.
20. Інгібітор розщеплення фактора VIII, що каталізується ало-антитілами до фактора VIII, який відрізняється тим, що включає амінокислотну послідовність:
Asp Glu Asp Glu Asn Gln Ser.
21. Інгібітор розщеплення фактора VIII, що каталізується ало-антитілами до фактора VIII, який відрізняється тим, що включає амінокислотну послідовність:
Asp Gln Arg Gln Gly Ala Glu.
22. Фармацевтична композиція, яка відрізняється тим, що містить фармацевтично ефективну кількість ало-антитіл до фактора VIII, що спроможні розщеплювати фактор VIII, особливо таких, які можливо ідентифікувати згідно із будь-яким із пп. 1-6.
23. Фармацевтична композиція за п. 22, яка відрізняється тим, що містить фармацевтичнo ефективну кількість ало-антитіл до фактора VIII, що спроможні розщеплювати фактор VIII, яку використовують для лікування ссавця, який страждає на патологію, що є результатом аномального рівня вмісту фактора VIII у його крові.
24. Фармацевтична композиція за п. 23, яка відрізняється тим, що її застосовують, коли вказана патологія є результатом наявності надлишку фактора VIII у його крові.
25. Фармацевтична композиція за п. 23 або 24, яка відрізняється тим, що її застосовують, коли вказана патологія має тромбозну природу, зокрема являє собою тромбоз.
26. Застосування фармацевтично ефективної кількості інгібітору розщеплення фактора VIII за п. 16 для створення фармацевтичної композиції для нейтралізування каталітичної активності ало-антитіл до фактора VIII.
27. Застосування за п. 26, яке відрізняється тим, що згадана композиція містить інгібітор розщеплення фактора VIII і її використовують, зокрема, для лікування ссавця, який страждає на патологію, що є результатом субфізіологічного рівня вмісту фактора VIII у його крові.
28. Застосування за будь-яким з пп. 26 або 27, яке відрізняється тим, що згаданий інгібітор являє собою інгібітор протеаз, зокрема, такий як 4-(2-аміноетил)бензил-сульфонілфторид-гідрохлорид.
29. Застосування за будь-яким з пп. 26-28, яке відрізняється тим, що згаданий інгібітор інгібує розщеплення спроможних до розщеплення зв'язків: Аrg372-Ser373, що знаходиться між доменами А1 і А2, Tyr1680-Asp1681, що знаходиться на N-кінці домену A3, і Glu1794-Asp1795, що знаходиться всередині домену A3 молекули фактора VIII.
30. Застосування за будь-яким з пп. 26-29, яке відрізняється тим, що згаданий інгібітор включає амінокислотну послідовність:
Ser Val Ala Lys Lys His Pro.
31. Застосування за будь-яким з пп. 26-29, яке відрізняється тим, що згаданий інгібітор включає амінокислотну послідовність:
Asp Glu Asp Glu Asn Gln Ser.
32. Застосування за будь-яким з пп. 26-29, яке відрізняється тим, що згаданий інгібітор включає амінокислотну послідовність:
Asp Gln Arg Gln Gly Ala Glu.
33. Застосування за будь-яким з пп. 26-32, яке відрізняється тим, що вказана патологія має гемофілічну природу, зокрема являє собою захворювання, що включає коагуляційні порушення, що виникають через недостатність фактора VIII, таке як гемофілія А.
34. Застосування за п. 26, яке відрізняється тим, що містить фармацевтично ефективну кількість інгібітору розщеплення фактора VIII, що каталізується ало-антитілами до фактора VIII.
35. Ало-антитіло до фактора VIII, що спроможне розщеплювати фактор VIII та яке можливо ідентифікувати згідно зі способом за пп. 1-12.
36. Ало-антитіло до фактора VIII за п. 35, яке відрізняється тим, що розщеплює наступні спроможні до розщеплення зв'язки в молекулі фактора VIII: Arg372-Ser373, що знаходиться між доменами А1 і А2, Tyr1680-Asp1681, що знаходиться на N-кінці домену A3, і Glu1794-Asp1795, що знаходиться всередині домену A3 молекули фактора VIII.
Текст
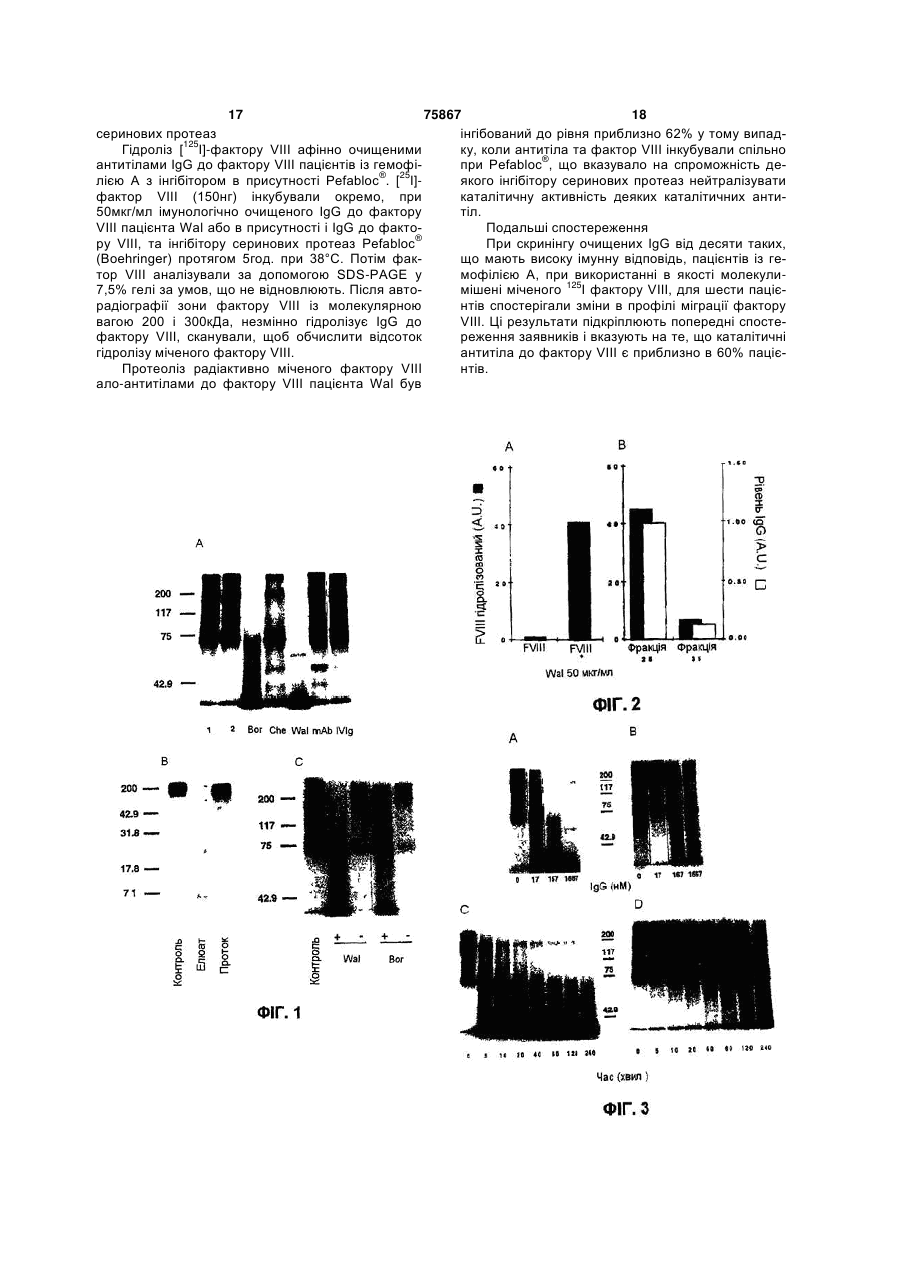
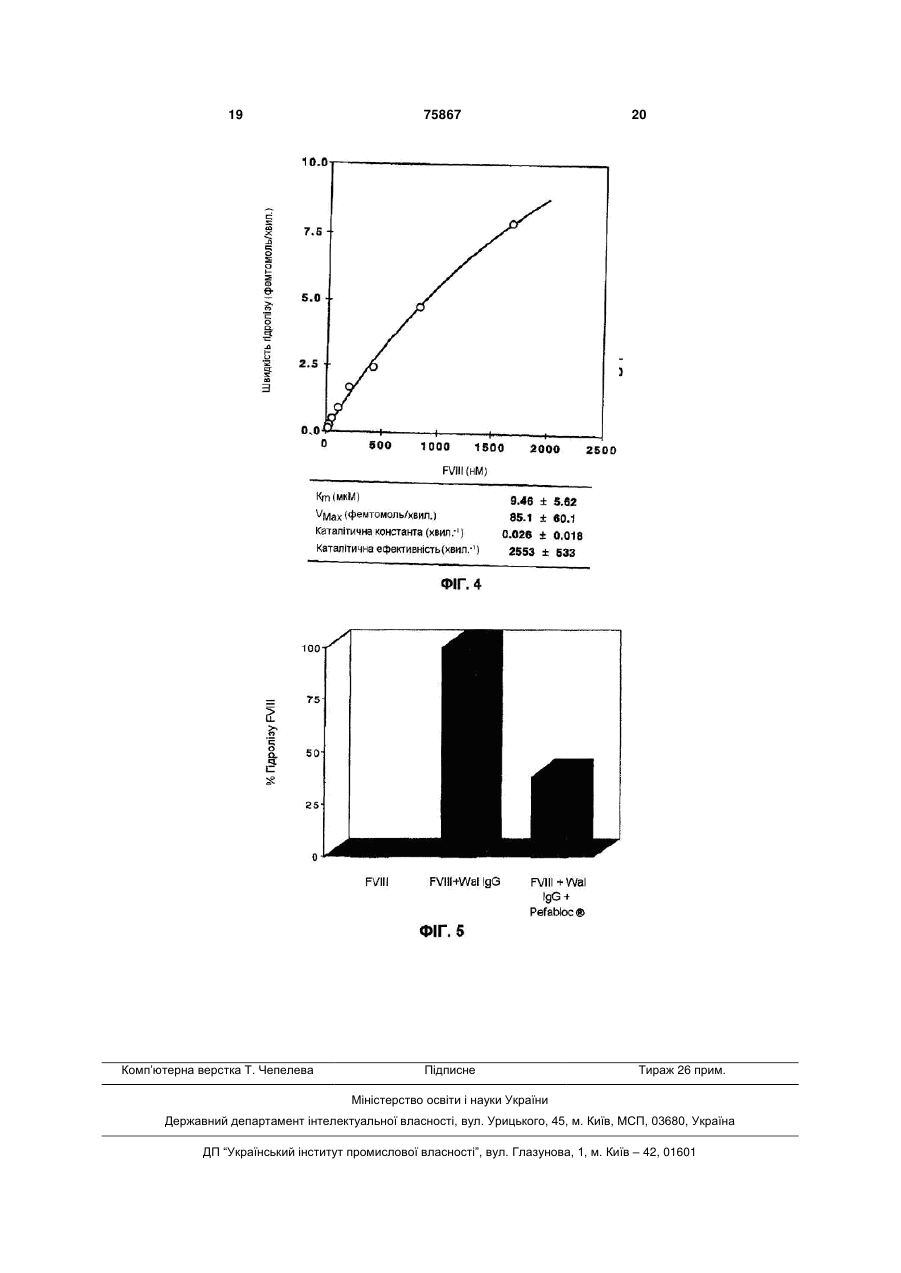
1. Спосіб визначення наявності у ссавця алоантитіл до фактора VIII, що спроможні розщеплювати фактор VIII, який відрізняється тим, що включає: і) виділення плазми із зразка крові, взятого в зазначеного ссавця; іі) виділення зі вказаної плазми ало-антитіл до фактора VIII; ііі) приведення зазначених ало-антитіл до фактора VIII у контакт з фактором VIII на період часу, достатній для забезпечення розщеплення вказаного фактора VIII зазначеними ало-антитілами до фактора VIII; і iv) визначення, після вказаного періоду часу, чи ефективно зазначені ало-антитіла до фактора VIII розщепили вказаний фактор VIII. 2. Спосіб за п.1, який відрізняється тим, що на етапі (іі) зазначені ало-антитіла до фактора VIII виділяють із вказаної плазми, об'єднуючи їх із зазначеним фактором VIII, причому зазначений фактор VIII переважно пов'язаний із матриксом. 3. Спосіб за п.1 або 2, який відрізняється тим, що на етапі (іі) зазначені ало-антитіла до фактора VIII виділяють за допомогою афінної хроматографії. 4. Спосіб за п.3, який відрізняється тим, що на етапі (іі) зазначена афінна хроматографія включає UA (21) 2002010487 (22) 18.07.2000 (24) 15.06.2006 (86) PCT/EP00/06870, 18.07.2000 (31) 99401841.4 (32) 21.07.1999 (33) EP (46) 15.06.2006, Бюл. № 6, 2006 р. (72) Кавері Срініва, FR, Лакруа-Десмазе Себастьєн, FR, Казачкін Мішель, FR (73) ЕНСТІТЮ НАСЬЙОНАЛЬ ДЕ ЛЯ САНТЕ Е ДЕ ЛЯ РЕШЕРШ МЕДІКАЛЬ (ІНСЕРМ), FR, БЕЄ ФАРМА, FR (56) Fulcher C. A. et al.: "Localization of human factor FVIII inhibitor epitopes to two polipeptide fragments", PROCEEDINGS OF THE NATIONAL ACADEMY OF SCIENCES OF USA, vol. 82, November 1985 (198511), pages 7728-7732, XP002125713. Fijnvandraat K. et al.:"A human alloantibody interferes with binding of factor IXa to the factor VIII light chain", BLOOD, vol. 91, no. 7, 1 April 1998 (1998-04-01), pages 2347-2352, XP 002118155. Ehrenforth S. et al.:" Incidence of development of factor VIII and factor IX inhibitors in haemophiliacs", LANCET THE, vol. 339, 7 March 1992 (1992-03-07), pages 594-598, XP002125714. Gilles J.G.G. et al.:"Anti-factor VIII antibodies of hemophiliac patients are frequently directed towards nonfunctional determinants and do not exhibit isotypic restriction", BLOOD, vol. 82, no. 8, 15 October 1993 (1993-10-15), pages 2452-2461, XP002096815. Saenko E.L. et al.:"A role for the C2 domain of factor VIII in binding to von Willebrand factor", JOURNAL OF BIOLOGICAL CHEMISTRY, vol. 269, no. 15, 15 2 (19) 1 3 75867 4 застосування фактора VIII, який ковалентно пов'ящо інгібує будь-який сайт у молекулі фактора VIII, заний з матриксом сефарози, що переважно актищо чутливий до розщеплення ало-антитілами до вований ціаноген-бромідом. фактора VIII. 5. Спосіб за будь-яким з пп.1-4, який відрізняєть16. Застосування інгібітору розщеплення фактора ся тим, що на етапі (ііі) вказаний фактор VIII мітять VIII для нейтралізування каталітичної активності міткою, переважно радіактивною міткою, зокрема, ало-антитіл до фактора VIII. 17. Застосування за п.16, яке відрізняється тим, такою як 125І. 6. Спосіб за будь-яким з пп.1-5, який відрізняєтьщо інгібітор являє собою інгібітор протеаз, зокреся тим, що на етапі (ііі) зазначений фактор VIII ма, такий як 4-(2-аміноетил)бензилприводять до контакту з ало-антитілами до фактосульфонілфторид-гідрохлорид. 18. Застосування за п.16 або 17, яке відрізняєтьра VIII на період часу від приблизно 0,5 години до ся тим, що згаданий інгібітор інгібує розщеплення приблизно 30 годин, переважно близько 10 годин, при температурі від приблизно 15°С до приблизно спроможних до розщеплення зв'язків: Arg372-Ser373, 40°С, переважно 38°С. що знаходиться між доменами А1 і А2, Tyr16807. Спосіб за будь-яким з пп.1-6, який відрізняєтьAsp1681, що знаходиться на N-кінці домену A3, і ся тим, що етап (iv) проводять шляхом визначенGlu1794-Asp1795, що знаходиться всередині домену ня, що включає метод поділу, такий як електрофоA3 молекули фактора VIII. рез у гелі, зокрема електрофорез у 19. Інгібітор розщеплення фактора VIII, що каталізується ало-антитілами до фактора VIII, який відполіакриламідному гелі у присутності додецилсурізняється тим, що включає амінокислотну послільфату натрію (SDS-PAGE), або гель-фільтрацію, зокрема, таку як швидка рідинна гельдовність: фільтраційна хроматографія білків, та техніку візуSer Val Ala Lys Lys His Pro. алізації, зокрема, таку як авторадіографія. 20. Інгібітор розщеплення фактора VIII, що каталі8. Спосіб за будь-яким з пп.1-7, який відрізняєтьзується ало-антитілами до фактора VIII, який відся тим, що додатково включає: різняється тим, що включає амінокислотну посліv) одержання характеристик сайту (сайтів) моледовність: кули зазначеного фактора VIII, у якому (яких) відAsp Glu Asp Glu Asn Gln Ser. бувається розщеплення зазначеними ало21. Інгібітор розщеплення фактора VIII, що каталізується ало-антитілами до фактора VIII, який відантитілами до фактора VIII. 9. Спосіб за п.8, який відрізняється тим, що зарізняється тим, що включає амінокислотну послізначене одержання характеристик здійснюють, довність: приводячи вказаний фактор VIII у контакт із зазнаAsp Gln Arg Gln Gly Ala Glu. 22. Фармацевтична композиція, яка відрізняється ченими ало-антитілами до фактора VIII, які спроможні розщеплювати фактор VIII, розділяючи та тим, що містить фармацевтично ефективну кільпотім секвенуючи отримані внаслідок такої процекість ало-антитіл до фактора VIII, що спроможні дури фрагменти фактора VIII. розщеплювати фактор VIII, особливо таких, які 10. Спосіб за п.8 або 9, який відрізняється тим, можливо ідентифікувати згідно із будь-яким із що зазначений поділ проводять, використовуючи пп.1-6. 23. Фармацевтична композиція за п.22, яка відрізтаку техніку, як електрофорез у гелі, зокрема, таку няється тим, що містить фармацевтичнo ефектияк SDS-PAGE. 11. Спосіб за будь-яким з пп.8-10, який відрізнявну кількість ало-антитіл до фактора VIII, що спроється тим, що зазначене секвенування здійснюможні розщеплювати фактор VIII, яку ють, використовуючи таку техніку, як N-кінцеве використовують для лікування ссавця, який страсеквенування, зокрема, із використанням автомаждає на патологію, що є результатом аномального тичного білкового мікросеквенатора. рівня вмісту фактора VIII у його крові. 12. Спосіб за будь-яким з пп.8-11, який відрізня24. Фармацевтична композиція за п.23, яка відрізється тим, що зазначене секвенування в такий няється тим, що її застосовують, коли вказана спосіб локалізує спроможні до розщеплення зв'язпатологія є результатом наявності надлишку факки: Аrg372-Ser373, що знаходиться між доменами А1 тора VIII у його крові. і А2, Tyr1680-Asp1681, що знаходиться на N-кінці до25. Фармацевтична композиція за п.23 або 24, яка відрізняється тим, що її застосовують, коли вкамену A3, і Glu1794-Asp1795, що знаходиться всередині домену A3 молекули фактора VIII. зана патологія має тромбозну природу, зокрема 13. Амінокислотна послідовність: являє собою тромбоз. Ser Val Ala Lys Lys His Pro, 26. Застосування фармацевтично ефективної кільщо інгібує будь-який сайт у молекулі фактора VIII, кості інгібітору розщеплення фактора VIII за п.16 що чутливий до розщеплення ало-антитілами до для створення фармацевтичної композиції для фактора VIII. нейтралізування каталітичної активності ало14. Амінокислотна послідовність: антитіл до фактора VIII. 27. Застосування за п.26, яке відрізняється тим, Asp Glu Asp Glu Asn Gln Ser, що інгібує будь-який сайт у молекулі фактора VIII, що згадана композиція містить інгібітор розщепщо чутливий до розщеплення ало-антитілами до лення фактора VIII і її використовують, зокрема, фактора VIII: для лікування ссавця, який страждає на патологію, 15. Амінокислотна послідовність: що є результатом субфізіологічного рівня вмісту Asp Gln Arg Gln Gly Ala Glu, фактора VIII у його крові. 28. Застосування за будь-яким з пп.26 або 27, яке відрізняється тим, що згаданий інгібітор являє 5 75867 6 33. Застосування за будь-яким з пп.26-32, яке відсобою інгібітор протеаз, зокрема, такий як 4-(2різняється тим, що вказана патологія має гемоаміноетил)бензил-сульфонілфторид-гідрохлорид. 29. Застосування за будь-яким з пп.26-28, яке відфілічну природу, зокрема являє собою захворюрізняється тим, що згаданий інгібітор інгібує розвання, що включає коагуляційні порушення, що щеплення спроможних до розщеплення зв'язків: виникають через недостатність фактора VIII, таке 372 373 Аrg -Ser , що знаходиться між доменами А1 і як гемофілія А. 34. Застосування за п.26, яке відрізняється тим, А2, Tyr1680-Asp1681, що знаходиться на N-кінці домену A3, і Glu1794-Asp1795, що знаходиться всерещо містить фармацевтично ефективну кількість дині домену A3 молекули фактора VIII. інгібітору розщеплення фактора VIII, що каталізу30. Застосування за будь-яким з пп.26-29, яке відється ало-антитілами до фактора VIII. різняється тим, що згаданий інгібітор включає 35. Ало-антитіло до фактора VIII, що спроможне амінокислотну послідовність: розщеплювати фактор VIII та яке можливо ідентиSer Val Ala Lys Lys His Pro. фікувати згідно зі способом за пп.1-12. 31. Застосування за будь-яким з пп.26-29, яке від36. Ало-антитіло до фактора VIII за п.35, яке відрізняється тим, що згаданий інгібітор включає різняється тим, що розщеплює наступні спромоамінокислотну послідовність: жні до розщеплення зв'язки в молекулі фактора Asp Glu Asp Glu Asn Gln Ser. VIII: Arg372-Ser373, що знаходиться між доменами 32. Застосування за будь-яким з пп.26-29, яке відА1 і А2, Tyr1680-Asp1681, що знаходиться на N-кінці різняється тим, що згаданий інгібітор включає домену A3, і Glu1794-Asp1795, що знаходиться всеамінокислотну послідовність: редині домену A3 молекули фактора VIII. Asp Gln Arg Gln Gly Ala Glu. Даний винахід відноситься до способу визначення наявності у ссавця каталітичних ало-антивїл до фактору VIII, які спроможні розщеплювати фактор VIII, та отримання характеристик сайтів розщеплення молекули зазначеного фактору VIII зазначеними каталітичними антитілами до фактору VIII. Даний винахід відноситься також до інгібітору розщеплення (деградації) фактору VIII, каталізує ало-антитіла до фактору VIII. Далі даний винахід відноситься до фармацевтичного складу, що містить зазначені каталітичні ало-антитіла до фактору VIII, що здатні розщеплювати фактор VIII і які отримані в процесі здійснення зазначеного способу визначення, і до фармацевтичної композиції, що містить вказаний інгібітор розщеплення фактору VIII, каталізує алоантитіла до фактору VIII. Нарешті, даний винахід відноситься до терапевтичного застосування вказаного інгібітору розщеплення фактору VIII, каталізує ало-антитіла до фактору VIII, фармацевтичної композиції, що містить зазначені каталітичні ало-антитіла до фактору VIII, що здатні розщеплювати фактор VIII і які отримані в процесі здійснення зазначеного способу визначення, і фармацевтичної композиції, що містить вказаний інгібітор розщеплення фактору VIII, каталізує ало-антитіла до фактору VIII. Гемофілія А – це пов'язане з Х-хромосомою рецесивне порушення, що призводить до дефектності або дефіциту молекул фактору VIII, що у гострій формі є небезпечним для життя і геморагічним захворюванням, що позбавляє працездатності. Вливання пацієнтам із гострою гемофілією А гомологічного фактору VIII у 25% випадків призводить до появи ало-антитіл до фактору VIII (Ehrenforth S., Kreuz W., Scharrer L., Linde R., Funk M., Gungor T., Krackhardt В and Kornhuber B. "Incidence of development of factor VIII and factor IX inhibitors in haemophiliacs". // Lancet. 1992. Т. 339. С.594-598), що інгібують про-коагулянтну активність фактору VIII, створюючи стеричні перешкоди взаємодії фактору VIII із молекулами, що стабілізують, (Saenko Ε.L., Shima Μ., Rajalakshmi Κ. J. and Scandella D. "A role for the C2 domain of factor VIII in binding to von Willebrand factor". // J. Biol. Chem. 1994. Т. 269.С. 11601-11605; і Saenko E. L, Shima M., Gilbert G. E. and Scandella D. "Slowed release of thrombin-cleaved factor VIII from von Willebrand factor by a monoclonal and a human antibody is a novel mechanism for factor VIII inhibition". // J. Biol. Chem. 1996. T. 271.C. 2742427431), із необхідними для його активності молекулами (Агаі М., Scandella D. and Hoyer L. W. "Molecular basis of factor VIII inhibition by human antibodies: Antibodies that bind to the factor VIII light chain prevent the interaction of factor VIII with phospholipids". // J. Clin. Invest. 1989. Т. 83.С. 19781984; і Zhong D., Saenko E. L., Shima M., Felch M. and Scandella D. "Some human inhibitor antibodies interfere with factor VIII binding to factor IXя. // Blood. 1998. T. 92.C. 136-142) або з молекулами, що активують, (Lubahn В С., Ware J., Stafford D. W. and Reiser Η. Μ. "Identification of a FVIII epitope recognized by a human hemophilic inhibitor". // Blood. 1989. Т. 73.С. 497-499; і Neuenschwander P. F. and Jesty J. "Thrombin-activated and factor Xa-activated human factor VIII: differences in cofactor activity and decay rate". // Arch. Biochem. Biophys. 1992. Т. 296.С. 426-434). Заявниками було зроблене відкриття, що не випливало з попереднього досвіду, про розщеплення фактору VIII ало-антитілами двох пацієнтів із високою імунною відповіддю, що мають гостру гемофілію А, що виявило невідомий досі механізм, за яким інгібітори фактору VIII можуть перешкоджати про-коагулянтній функції фактору VIII. Відкриття заявниками каталітичних алоантитіл до фактору VIII є, наскільки відомо, пер 7 75867 8 шим описом появи каталітичних антитіл, що індупроводиться способом визначення, що включає куються при введенні пацієнтам фактору VIII. Тому метод розділення - такий, як електрофорез у гелі, вважалось несподіваним, навіть абсурдним або як, зокрема, електрофорез у поліакриламідному неймовірним, що в присутності фактору VIII утвогелі в присутності додецилсульфату натрію (SDSрюються антитіла, що дійсно роблять молекулу PAGE), або гель-фільтраційна хроматографія фактору VIII неактивною шляхом каталітичного така, як, зокрема, швидка рідинна гельгідролізу ("протеолізу"). Проте відомі дотепер кафільтраційна хроматографія білків, та техніку візуталітичні антитіла всі є ауто-антитілами, що виявалізації - таку, як, зокрема, авторадіографію. ляються в процесі захворювання або при фізіолоУ відповідності з таким варіантом здійснення гічних умовах. Тому всі антитіла, що індукуються способу за даним винаходом, для цього способу названі АЛО-антитілами, походження котрих явно характерно те, що він додатково включає: відрізняється від походження АУТО-антитіл у ν) одержання характеристик сайта (сайтів) мобудь-якому аутоімунному захворюванні. лекули зазначеного фактору VIII, у котрому (який) Розраховані значення середньої Km і що здавідбувається розщеплення зазначеними алоється Vmax для реакції антитіл до фактору VIII антитілами до зазначеного фактору VIII. одного з пацієнтів складали відповідно Відповідно до варіанта здійснення етапу (ν) 9,46±5,62мкМ і 85±60 фемтомоль хв.-1. Кінетичні способу за даним винаходом, вказане одержання параметри гідролізу фактору VIII змушують припухарактеристик здійснюють, приводячи зазначений стити наявність функціональної ролі каталітичної фактор VIII у контакт із зазначеними алоімунної відповіді в інактивації фактору VIM in vivo. антитілами до фактору VIII, які спроможні розщепТому отримання характеристики ало-антитіл лювати фактор VIII, розділяючи та потім секвенудо фактору VIII як сайт-специфічних протеаз заючи отримані внаслідок такої процедури фрагменбезпечує нові підходи до лікування захворювань у ти фактору VIII. Зручно здійснювати таке пацієнтів, що мають ало-антитіла до фактору VIII. розподілення, використовуючи таку техніку, як Таким чином, відповідно до першого аспекту, електрофорез у гелі - такий, як, зокрема, SDSданий винахід передбачає спосіб визначення наяPAGE, або гель-фільтрацію. Зазначене секвенувності у ссавця каталітичних ало-антитіл до факвання зручно здійснювати, використовуючи таку тору VIII, які здатні розщеплювати фактор VIII, техніку, як N-кінцеве секвенування, зокрема, із який відрізняється тим, що він включає: використанням автоматичного білкового мікросекі) виділення плазми зі зразка крові, взятого в венатора. З використанням зазначеного секвенузазначеного ссавця; вання локалізовані такі спроможні до розщеплення іі) виділення із зазначеної плазми ало-антитіл зв'язку: Arg372-Ser373, що знаходиться між домена1680 1681 до фактору VIII; ми А1 і А2, Tyr -Asp , що знаходиться на N1794 ііі) приведення зазначених ало-антитіл до факкінці домену A3, і Glu -Asp1795, що знаходиться тору VIII у контакт із фактором VIII на період часу, всередині домену A3 молекули фактору VIII. що достатній для забезпечення розщеплення заТаким чином, відповідно до другого аспекту, значеного фактору VIII зазначеними алоданий винахід пропонує амінокислотну послідовантитілами до фактору VIII; і ність: Ser Val Ala Lys Lys His Pro; амінокислотну iv) визначення, після зазначеного періоду чапослідовність: су, чи ефективно зазначені ало-антитіла до факAsp Glu Asp Glu Asn Gin Ser; і тору VIII розщепили зазначений фактор VIII. амінокислотну послідовність: Відповідно до варіанта здійснення етапу (іі) Asp Gin Arg Gin Gly Ala Glu. способу за даним винаходом, ало-антитіла до фаДаний винахід поширюється також на варіанти ктору VIII виділяють із плазми, об'єднуючи їх із або аналоги такої або будь-якої іншої послідовносфактором VIII, причому зазначений фактор VIII ті фактору VIII, що спроможні інгібувати будь-який переважно пов'язаний із носієм (матриксом). Зручсайт у молекулі фактору VIII, що чутливий до лізино, щоб на етапі (іі) ало-антитіла до фактору VIII су ало-антитілом до фактору VIII. У контексті данобули виділені за допомогою афінної хроматограго винаходу таким варіантом може бути, наприфії. Переважно, щоб на етапі (іі) зазначена афінна клад, пептидний або непептидний аналог хроматографія включала використання в якості амінокислотної послідовності, яка описана вище, носія сефарози, переважно активованої ціаногенщо інгібує будь-який сайт у молекулі фактору VIII, бромідом. який чутливий до лізису ало-антитілом до фактору Відповідно до варіанта здійснення етапу (ііі) VIII. Таким варіантом може бути, наприклад, варіспособу за даним винаходом, зазначений фактор ант послідовності, що коротше на декілька аміноVIII позначений мітячим агентом, що переважно кислот, наприклад, на N-кінці, на С-кінці або на радіактивно-мітячим агентом - таким, зокрема, як обох кінцях, або довше на декілька амінокислот 125 І. Переважно, щоб на етапі (ііі) зазначений фак(такі варіанти можна одержати хімічним синтезом тор VIII був приведений у контакт з ало-антитілами або ферментативним розщепленням існуючої в до фактору VIII на період часу від приблизно 0,5 природі молекули), за умови, що цей варіант інгігодини до приблизно 30 годин, переважно близько бує будь-який сайт у молекулі фактору VIII, чутли10 годин, при температурі від приблизно 15°С до вий до лізису ало-антитілами до фактору VIII. приблизно 40°С, переважно 38°С. Тому, відповідно до третього аспекту, даний Відповідно до варіанта здійснення етапу (iv) винахід передбачає інгібітор розщеплення фактоспособу за даним винаходом, визначення того, чи ру VIII, який каталізується ало-антитілами до факефективно зазначений фактор VIII був розщеплетору VIII. Переважно цей інгібітор відрізняється ний зазначеними ало-антитілами до фактору VIII, тим, що він містить у собі інгібітор протеази. Прик 9 75867 10 ладами інгібіторів протеази, що можуть бути викокомпозицію, яка відрізняється тим, що вона місристані в контексті даного винаходу як інгібітори тить фармацевтично ефективну кількість щонайрозщеплення фактору VIII, що каталізується аломенше одного інгібітору розщеплення фактору VIII, антитілами до фактору VIII, але не обмежуючись як він визначений вище, або однієї з його фарманими, є інгібітори типу фторидів - такі, як, наприцевтично прийнятних солей заміщення, яка вклюклад, PMSF (фенілметилсульфоніл-фторид) або чена у фармацевтично прийнятний наповнювач, AEBSF (4-(2-аміноетил)бензилсульфонілфторид розчинник або носій. гідрохлорид (що особливо продається фірмою Ці фармацевтичні композиції можуть вводиRoche Diagnostics Gmb, Mannheim, Germany, під тись, наприклад, трансбукальним, ректальним, товарним знаком Pefabloc®). Більш конкретно, для парентеральним, трансдермальним, окулярним, цього інгібітору характерно, що зазначений інгібіназальним або вушним шляхом. тор інгібує (пригнічує) розщеплення чутливих до Ці фармацевтичні композиції можуть бути тверозщеплення зв'язків: Arg372-Ser373, що знаходитьрдою речовиною або рідиною і можуть бути подані ся між доменами А1 і А2, Tyr1680-Asp1681, що знахоу фармацевтичних формах, що використовуються диться на N-кінці домену A3, і Glu1794-Asp1795, що звичайно в медицині людини, - таких, як, напризнаходиться всередині домену A3 молекули факклад, прості таблетки або таблетки з покриттям, тору VIII. Ще більш переважно, для цього інгібітору желатинові капсули, гранули, свічки, препарати характерно те, що він являє собою пептидний або для ін'єкції, трансдермальні системи (для введеннепептидний аналог амінокислотної послідовності: ня через шкіру), краплі для очей, аерозолі та розSer Val Ala Lys Lys His Pro; чини, які розпорошуються, а також вушні краплі. їх пептидний або непептидний аналог амінокисготують звичайним шляхом. Активний початок, що лотної послідовності: складається з фармацевтично ефективної кількосAsp Glu Asp Glu Asn Gin Ser; або ті щонайменше одного з інгібіторів розщеплення пептидний або непептидний аналог амінокисфактору VIII, як вони визначені вище, або однієї з лотної послідовності: його фармацевтично прийнятних солей заміщенAsp Gin Arg Gin Gly Ala Glu. ня, може бути включений сюди разом із наповнюІнгібітори розщеплення фактору VIII, як вони вачами, які використовуються звичайно у фармабули визначені вище, так само як і їхні солі заміцевтичних композиціях - такими, як тальк, щення, особливо їхні фармацевтично прийнятні гуміарабік, лактоза, крохмаль, стеарат магнію, солі заміщення, мають цінні фармакологічні показполівідон, похідні целюлози, кокосова олія, напівники, тому що вони виявляють нейтралізуючу аксинтетичні гліцериди, водні або неводні носії, жири тивність стосовно ало-антитіл до фактору VIII. тварини або рослинного походження, гліколі, різЦі властивості обґрунтовують їхнє застосуванноманітні зволожуючі агенти, диспергатори або ня в терапії, та даний винахід додатково відноемульгатори, силіконові гелі, деякі полімери або ситься до зазначених вище інгібіторів розщепленспівполімери, консерванти, ароматизатори та барня фактору VIII, а також до їхніх солей заміщення, вники. Кращою фармацевтичною формою є форособливо до їхніх фармацевтично прийнятних сома для ін'єкції. лей заміщення, у якості ліків. Даний винахід поширюється також на фармаТаким чином, вони особливо показані для ліцевтичну композицію з активністю, що нейтралізує, кування захворювань, зокрема, гемофілічного пощо може використовуватися головним чином як ходження, більш конкретно - захворювань, які поприйнятні ліки для лікування таких захворювань, в'язані із дефектами згортання крові внаслідок як гемофілія А з продукцією ало-антитіл до фактонедостатності фактору VIII. ру VIII; аутоіммунні захворювання з алоМожна згадати як приклад застосування заантитілами до фактору VIII (у випадку, коли в цих значених речовин для лікування, з одного боку, пацієнтів виявлені каталітичні антитіла), причому пацієнтів із високою імунною відповіддю, що мадля зазначеної фармацевтичної композиції харакють такі захворювання, як, наприклад, слабка або терно, що вона містить фармацевтично ефективну гостра гемофілія А (у випадках, коли в цих пацієнкількість щонайменше одного зазначеного вище тів виявлені каталітичні антитіла), і/або з іншого інгібітору розщеплення фактору VIII або однієї з боку, пацієнтів, що страждають, наприклад, аутоійого фармацевтично прийнятних солей заміщенмунними захворюваннями (у випадках, коли в цих ня, які включені у фармацевтично прийнятний напацієнтів виявлені каталітичні антитіла). повнювач, розчинник або носій. Таким чином, відповідно до четвертого принВинахід поширюється також на спосіб терапеципового аспекту, даний винахід забезпечує рівтичного впливу на ссавця, що страждає патологішення проблеми створення фармацевтичної комєю, яка є результатом рівня утримання в його крові позиції, яка існувала тривалий час, що фактору VIII, що відрізняється тим, що зазначеновідрізняється тим, що вона містить фармацевтичму ссавцю вводиться терапевтично ефективна но ефективну кількість щонайменше одного типу кількість щонайменше одного інгібітору розщепало-антитіл до фактору VIII, які спроможні розщелення фактору VIII, як він визначений вище, або плювати фактор VIII, як визначено вище, особливо однієї з його фармацевтично прийнятних солей таких, які можна одержати в процесі описаного заміщення. вище способу, або однієї з їхніх фармацевтично Цей спосіб забезпечує головним чином успішприйнятних солей, які включені у фармацевтично не лікування захворювань гемофілічної природи, прийнятний наповнювач, розчинник або носій. особливо патологій, які викликані нестачею факДалі, відповідно до п'ятого принципового аспетору VIII у крові хворого. кту, даний винахід передбачає фармацевтичну Винахід поширюється також на фармацевтич 11 75867 12 ну композицію з протитромбозною активністю, що Bor, Che і Wal інгібували про-коагулянтну активможе бути використана головним чином як корисні ність фактору VIII до рівня відповідно 57,0, 64,0 і ліки при таких захворюваннях як, особливо, тром43,0 BU/мг (одиниць Bethesda на мг) IgG. боз, причому для зазначеної фармацевтичної комСпільна інкубація міченого фактору VIII з алопозиції характерно, що вона містить фармацевтиантитілами до фактору VIII призводила, у двох чно ефективну кількість щонайменше одного типу пацієнтів з трьох, до протеолізу молекули. Була ало-антитіл до фактору VIII, які здатні розщеплюпродемонстрована специфічність гідролізу в сайвати фактор VIII, особливо такий, який може бути тах об'єднання антитіл для ало-антитіл ізотипу IgG отриманий у процесі описаного вище способу, або до фактору VIII. Спільна інкубація [125І]-фактору однієї з його фармацевтично прийнятних солей VIII з афінно очищеним IgG до фактору VIII пацієнзаміщення, яка включена у фармацевтично прийнтів Воr і Wal в присутності інгібіторів протеази апятний наповнювач, розчинник або носій. ротиніну (0,15мкМ), Е-64 (28мкМ), EDTA (1,3мкМ), Винахід поширюється також на спосіб терапелейпептину (10мкМ) і пепстатину (10мкМ) не призвтичного впливу на ссавців, для яких характерно водила до інгібування протеолітичної активності. те, що зазначеному ссавцю вводять терапевтично Заявники охарактеризували головні сайти роефективну кількість щонайменше одного типу алозщеплення каталітичним IgG в молекулі фактору антитіл до фактору VIII, як вони визначені вище, VIII як такі: Arg372-Ser373, що знаходиться між доабо однієї з його фармацевтично прийнятних соменами А1 і А2 фактору VIII, Tyr1680-Asp1681, що лей заміщення. знаходиться на N-кінці домену A3, і Glu1794-Asp1795, Цей спосіб забезпечує головним чином успішщо знаходиться всередині домену A3. не лікування захворювань тромбозної природи, Була продемонстрована залежність гідролізу особливо патологій, які викликані наявністю надфактору VIII ало-анитілами до фактору VIII від лишку фактору VIII у крові хворого. часу і дози. Зокрема, гідроліз спостерігався в умоУ терапії людини і тварин ало-антитіла до фавах, коли Іg до фактору VIII і фактор VIII інкубувактору VIII або інгібітори розщеплення фактору VIII, ли спільно при молярних співвідношеннях, що буяк вони визначені вище, можуть вводитись самі по ли в 80-9500 разів нижче, ніж ті, що очікувалися в собі або у сполученні з фізіологічно активним наплазмі пацієнтів, що призводить до припущення, повнювачем, у будь-якій формі, зокрема, орально що гідроліз є механізмом інактивації фактору VIII у формі желатинових капсул або таблеток або ало-антитілами пацієнтів in vivo. парентерально у формі розчинів для ін'єкцій. МожДалі заявники досліджували кінетику опосерена розглядати інші форми введення - такі, як предкованого антитілами гідролізу фактору VIII, інкупарати у вигляді свічок, мазей, кремів, гелів або буючи IgG до фактору VIII пацієнта Wal із зростааерозолів. ючими концентраціями неміченого фактору VIII У контексті даного винаходу використані такі при фіксованій концентрації [125І]-фактору VIII. терміни: Криві залежності розміру, зворотної швидкості, від "каталітичні ало-антитіла до фактору VIII", що розміру, зворотної концентрації субстрату, були розуміється як такий, що позначає антитіла, які лінійними (r=0,99), що дозволяє припустити, що націлені на фактор VIII, наділені каталітичною акреакція має просту кінетику Міхаеліса-Ментен, як тивністю, які індукуються у пацієнтів з гемофілією вже спостерігалося для поліклональних каталітичА при трансфузії терапевтичних препаратів факних антитіл. Для пацієнта Wal були розраховані тору VIII; каталітична ефективність, що здається, Vmax і "фактор VIII", що розуміється як такий, що позшвидкість гідролізу ало-антитілами до фактору начає кофермент фактору IX у ферментативному VIII. На підставі розрахованих кінетичних параметрозщепленні фактору X у процесі згортання крові; рів гідролізу in vitro було зроблене припущення, "розщеплення фактору VIII", що розуміється як що механізмом інактивації фактору VIII алотакий, що позначає створення фрагментів фактору антитілами пацієнтів in vivo може бути протеоліз. VIII, які не з'являються внаслідок спонтанного гідАсоціація фактору VIII із фактором фон Вілебролізу або гідролізу ферментами, що фізіологічно ранда (vWF) підвищує каталітичну швидкість тророзщеплюють - наприклад, тромбіном, який актимбіну стосовно фактору VIII, оскільки він захищає вований фактором IX, активований фактором X і фактор VIII від гідролізу активованим білком С активованою білком С; (АРС). Додавання vWF до фактору VIII призводило "інгібітор розщеплення фактору VIII, каталізує до часткового інгібування (тобто на 36,9%) гідроліало-антитілами до фактору VIII", що розуміється як зу фактору VIII імуноглобуліном G (IgG) до фактобудь-який пептид, що позначає, що належить або ру VIII, якщо очищений vWF і фактор VIII змішуване належить до амінокислотної послідовності факли у ваговому співвідношенні, що близьке до тору VIII, або інгібітор протеази, що здатний спеїхнього співвідношення в нормальній плазмі, тобто цифічно нейтралізувати гідролізуючу активність 30мкг/мл vWF і 300нг/мл фактору VIII. каталітичних антитіл до фактору VIII. Ідентифікація ало-антитіл до фактору VIII як У рекомбінантний фактор VIII людини була каталітичних антитіл, на додаток до описаних ра125 введена радіоактивна мітка І. Ало-антитіла до ніше антитіл, що гідролізують, до вазоактивного фактору VIII були виділені й очищені з плазми кишкового пептиду (VIР) у пацієнтів з астмою, антрьох пацієнтів із гемофілією та інгібуванням за титіл, що гідролізують ДНК у пацієнтів із системдопомогою афінної хроматографії на сефарозі ним червоним вовчком та тироглобулін(Sepharose), до матриксу якої був пришитий очиспецифічних каталітичних антитіл у пацієнтів з щений імунологічним методом фактор VIII людини. аутоімунним тиреоідітом, розширює спектр каталіАфінно очищені антитіла до фактору VIII пацієнтів тичних імунних відповідей. Наскільки відомо заяв 13 75867 14 никам, це перше свідчення індукції в людини катадо фактору VIII пацієнта Wal опрацьовували 8Μ літичних антитіл у відповідь на екзогенне введення сечовиною та піддавали гель-проникаючій хромабілкового антигену. Кінетичні параметри гідролізу тографії. Основний пік утримувався у фракції 25, фактору VIII, що проявляють каталітичні властивощо відповідає IgG за тестом ELISA. Активність, що сті IgG до фактору VIII і оцінка кількостей цих ангідролізує, елюювалася у фракції IgG, і така активтитіл у плазмі дозволяють припустити наявність у ність не виявлялася у фракціях, у яких був відсуткаталітичної імунної відповіді функціональної ролі ній IgG (наприклад, фракція 35). в інактивації фактору VIII in vivo. У поліклональній Фіг.2 (В): суміші ало-антитіл до фактору VIII, що різняться за Основний пік, що був виділений у фракції 25, їхніми функціональними властивостями, каталітивідповідав IgG, як свідчить SDS-PAGE, що несе чні антитіла можуть інгібувати про-коагулянтну радіоактивну мітку вмісту фракції. активність фактору VIII із більшою швидкістю, ніж Фіг.3: Залежність протеолізу [125I]-фактору VIII ті антитіла до фактору VIII, що не каталізують. Таафінно очищеними антитілами до фактору VIII ким чином, ідентифікація пептидних епітопів, що є пацієнтів із гемофілією А з інгібітором від дози і від мішенями для протеолітичних антитіл до фактору часу VIII, може бути вирішальною для розуміння патоКінетика гідролізу фактору VIII ало-антитілами фізіології відповіді з наявністю інгібітору фактору до фактору VIII пацієнтів Воr і Wal. Швидкість гідVIII. Крім того, одержання характеристик інгібіторів ролізу міченого 125І фактору VIII імуноглобуліном G фактору VIII як сайт-специфічних протеаз забездо фактору VIII пацієнта Wal була вище, ніж швидпечує нові підходи до лікування пацієнтів, що макість гідролізу, що виявляється імуноглобуліном G ють ало-антитіла до фактору VIII. до фактору VIII пацієнта Воr; це дозволяє припусДля кращого розуміння даного винаходу та тити, що каталітичні антитіла пацієнтів мають різбільш ясного уявлення про його цілі, характерні номанітні кінетичні властивості, або, альтернативриси та переваги наведено нижчевикладений поно, що частка каталітичних антитіл серед антитіл яснювальний опис із посиланнями на додані фігудо фактору VIII у пацієнтів різниться. ри, які подані винятково як приклади, що не обмеФіг.4: Гідроліз [125І]-фактору VIII антитілами до жують, а ілюструють специфічність розщеплення Фактору VIII в присутності зростаючих кількостей фактору VIII ало-антитілами до фактору VIII. неопрацьованого (неміченого) Фактору VIII. Фіг.1: Гідроліз [126I]-фактору VIII афінно очиКінетика опосередкованого антитілами гідроліщеними антитілами IgG до Фактору VIII пацієнтів із зу фактору VIII при інкубуванні IgG до фактору VIII гемофілією А с інгібітором у пацієнта Wal із зростанням концентрації немічеФіг.1 (А): Мічений 125І фактор VIII інкубували з ного фактору VIII в присутності фіксованої концен125 афінно очищеним IgG до фактору VIII пацієнтів Воr трації [ І]-фактору VIII. Додавання зростаючих (смуга Bor), Che (смуга Che) і Wal (смуга Wal) або концентрацій кількостей неміченого фактору VIII тільки з буфером (смуга 1) протягом 10год. при призводило до залежного від дози інгібування гід38°C, потім проводили SDS-PAGE та авторадіоролізу [125І]-фактору VIII імуноглобуліном G (Іg) до графію. Для двох з трьох пацієнтів (Воr і Wal) інкуфактору VIII. Насичення гідролізу фактору VIII не бація фактору VIII з афінно очищеним IgG до факбуло досягнуто при максимальній концентрації, що тору VIII призводила до гідролізу молекули була використана (тобто при 1,7мкМ). Графік зафактору VIII. Навпаки, профіль міграції в гелі факлежності величини, що зворотна до швидкості, від тору VIII не змінювався, якщо мічений 125І фактор величини, що зворотна до концентрації субстрату, VIII інкубували з IgG до фактору VIII, який був був лінійним (r=0,99), що свідчить про те, що реакочищеним із плазми пацієнта Che (смуга Che). ція має просту кінетику Міхаеліса-Ментен, як уже Профіль міграції фактору VIII не змінювався також спостерігалося для поліклональних каталітичних і при інкубації з моноклональним IgG M061 людини антитіл. до дигоксину (mAb) або з нормальним нефракціоФіг.5: Інгібування каталітичної активності IqG нованим поліклональним IgG людини до фактору VIII пацієнта Wal (Sandoglobulin, IVIg), що не виявляє інгібуючої акПротеоліз фактору VIII, що несе радіоактивну тивності стосовно фактору VIII мітку, ало-антитілами до фактору VIII пацієнта Wal Фіг.1 (В): пригнічувався до приблизно 62%, якщо антитіла та Фракції протоку через афінні колонки не містифактор VIII спільно інкубували в присутності ли антитіл до фактору VII, що визначаються метоPefabloc® (продукт фірми Roche Diagnostics Gmb, дом твердофазного імуноферментного аналізу Mannheim, Germany); це вказує на активність певELISA, та не гідролізували мічений 125І фактор VIII. ного інгібітору протеази в нейтралізації каталітичФіг.1 (С): ної активності деяких із каталітичних антитіл. Видалення IgG з кислотних елюатів, що місПРИКЛАДИ тять афінно очищені антитіла до фактору VIII від Приклад 1: Афінне очищення антитіл до факпацієнтів Wal і Воr, хроматографією на білку G тору VIII призводило до втрати їхньої гідролітичної активАнтитіла виділяли з плазми осадженням суності стосовно фактору VIII. льфату амонію. Потім антитіла, що реагують із Фіг.2: Гель-проникаюча хроматографія каталіфактором VIII, очищали афінною хроматографією тичної активності антитіл до Фактору VIII на матриці активованої CNBr сефарози 4В, до якої Фіг.2 (А): був пришитий фактор VIII, що промислово випусЩоб додатково виключити можливість того, кається та який очищений імунологічним методом, що протеолітична активність антитіл обумовлена отримуваний із плазми людини (25000од./3г гелю). примісними протеазами, афінно очищені антитіла Збирали фракції протоку через колонку. Після ре 15 75867 16 тельного промивання фосфатно-буферним сольогідролізуються IgG до фактору VIII, щоб мати можвим розчином (PBS) рН7,4 антитіла до фактору ливість розрахувати швидкість гідролізу міченого VIII елюювали розчином 0,2М гліцину рН2,8, діаліфактору VIII. зували проти PBS та концентрували за допомогою Приклад 4: Швидка гель-фільтраційна рідинна Centripep. Відбирали проби з фракцій протоку та хроматографія білка елюатів і берегли їх до використання при -20°С. Аліквоту 100мкл IgG до фактору VIII пацієнта Фрагменти F(ab')2 антитіл до фактору VIII одержуWal (740мкг), що оброблена 8Μ сечовиною, піддавали, як описано раніше. вали гель-фільтрації на колонці із суперозою-12, Вміст IgG до фактору VIII у 10мг IgG, що нанеяка урівноважена PBS із 0,01% азиду, при швидкосений на колонку, для пацієнтів Bor, Che і Wal дості протоку 0,2мл/хв. Збирали фракції об'ємом рівнювало відповідно 130, 20 та 280мкг (тобто 500мкл та після 10-кратного розведення аналізу143±130мкг/мл нефракціонованої плазми), що узвали їх на наявність IgG методом ELISA-сендвіч і годжується з попередніми спостереженнями. на протеолітичну активність стосовно фактору VIII. Приклад 2: Нейтралізуюча активність по відБілки у фракції 25 мітили 125І і піддавали SDSношенню до фактору VIII PAGE при умовах, що не відновлюють, паралельАктивність, що нейтралізує, по відношенню до но з нормальним поліклональним IgG людини. фактору VIII антитіл до фактору VIII визначали Гель забарвлювали барвником кумасі блакитним, методом Kasper та ін. та виражали в одиницях а також авторадіографували; потім обидва зобраBethesda (BU) (посилання). BU визначали як велиження сполучали. Основний пік, виділений у фракчину, що зворотна до концентрації IgG, що дає ції 25, відповідав IgG, відповідно до ELISA і SDS50% інгібування про-коагулянтної активності факPAGE міченого вмісту фракції. Активність, що гідтору VII. Залишкову активність фактору VIII виміролізує, елюювалася разом із фракцією IgG і не рювали в одноступінчатому аналізі шляхом вимівиявлялася у фракціях, у яких був відсутнім IgG рювання часу активованого часткового (наприклад, фракція 35). тромбопластину, використовуючи в якості субПриклад 5: Аналіз послідовностей NH2-кінця страту людську плазму, яка не містить фактору Сахарозний склад із неміченим рекомбінантVIM (Behring), а в якості активатора - pathromptin® ним фактором VIII (rDNA-BHK) (300мкг, octocog плаценти людини (Behring). Випробувані прогріту alfa, Bayer Corporation, Berkeley, CA, США) опраплазму або імунологічно очищений IgG до фактору цьовували IgG до фактору VIII пацієнта Wal VIII інкубували з об'єднаної, обробленої цитратом (74мкг) у 1500мкл буфера 50м тріс-НСІ рН7,7, людської плазми протягом 2год. при 37°С. Час 100мМ гліцин, 0,025% твін-20 і 0,02% NaN3 протязгортання для чотирьох послідовних розведень гом 24год. при 38°С. Отримані фрагменти фактору референсного зразка плазми (Immuno AG, Wien) VIII піддавали SDS-PAGE у 10% гелі при 50мА в порівнювали з часом згортання трьох розведень умовах, що не відновлюють, та переносили протякожного випробуваного зразка. Розведення робигом 2год. при 100мА на мембрану Hybond-P PVDF ли в буфері Owren-Koller (Diagnostiga Stago). Роз(Amersham, Little Chalfont, Англія) у 10мМ CAPS та біжності між повторами складали від 1 до 2,5%. 10% етанолі при рН11,0. Після фарбування кумасі Афінно очищені антитіла до фактору VIII паціблакитним видимі зони вирізали та проводили Nєнтів Bor, Che і Wal інгібували прокоагулянтну аккінцеве секвенування за допомогою автоматичнотивність фактору VIII відповідно до 57,0, 64,0 і 43,0 го білкового мікросеквенатора Prosize 492 cLC BU/мг IgG. (PE-Applied Biosystems, Foster City, CA, USA). КільПриклад 3: Оцінка гідролізу фактору VIII кість секвенованого білку, в залежності від фрагРекомбінантний фактор VIII людини, що випумента, варіювала від 0,5 до 2 пікомолей. скається в промисловості, мітили 125І іодогенним Основними доступними для розщеплення методом до питомої активності 11,6нКюрі/мкг. [25І]зв'язками були такі: Arg372-Ser373 (R372-S373), що фактор VIII (від 1,5 до 150нг) інкубували в 50мкл знаходиться між доменами А1 і А2 фактору VIII, буфера 50м трис-НСІ рН7,7, 100мМ гліцин, 0,025% Tyr1680-Asp1681 (Y1680-D1681), що знаходиться на Nтвін-20 та 0,02% NaN3 без або з додаванням від 17 кінці домену A3, і Glu1794-Asp1795 (E1794-D1795), що до 1667нМ імунологічно очищеного IgG до фактознаходиться всередині домену A3. Декілька сайтів ру VIII протягом від 5хв. до 10год. при 38°С. Монорозщеплення фактору VIII антитілами до фактору клональний IgG M061 людини до дигоксину (mAb) VIII можуть мати походження від індивідуальних та нормальний нефракціонований людський полікантитіл із поліспецифічною каталітичною активніслональний IgG (IVIg, Sandoglobulin®) використовутю або ж поліклональних популяцій антитіл, кожвали в якості негативних контролів. Проби змішуний тип із яких має унікальну специфічність у змісвали у відношенні 1:1 із буфером Лемлі без ті сайта розщеплення. меркаптоетанолу та після нанесення в осередки 20мкл кожної проби піддавали їх без кип'ятіння Амінокислотна послідовність Сайт розщеплення електрофорезу при SDS. Електрофорез проводиSer Val Ala Lys Lys His Pro Arg372-Ser373 ли паралельно в 7,5% і 15% гелях із SDS при умо(CVAKKHP) (R372-S373) 1794 1795 вах, що не відновлюють. Електрофорез проводили Asp Gin Arg Gin Gly Ala Glu Glu -Asp 1794 1795 при кімнатній температурі за допомогою системи (DQRQGAE) (E -D ) mini-PROTEAN II при 25мА/гель до досягнення Asp Glu Asp Glu Asn Gin Ser Tyr1680-Asp1681 фронтом барвника низу гелю. Потім гелі сушили (DEDENQS) (Y1680-D1681) та зони білка виявляли за допомогою Х-ОМАТ AR. Після авторадіографії сканували зони фактору VIII Приклад 6: Дослідження інгібування проведеіз молекулярною вагою 200 і 300кДа, що завжди но за допомогою Pefabloc - загального інгібітору 17 75867 18 серинових протеаз інгібований до рівня приблизно 62% у тому випадГідроліз [125І]-фактору VIII афінно очищеними ку, коли антитіла та фактор VIII інкубували спільно антитілами IgG до фактору VIII пацієнтів із гемофіпри Pefabloc®, що вказувало на спроможність де® 25 лією А з інгібітором в присутності Pefabloc . [ І]якого інгібітору серинових протеаз нейтралізувати фактор VIII (150нг) інкубували окремо, при каталітичну активність деяких каталітичних анти50мкг/мл імунологічно очищеного IgG до фактору тіл. VIII пацієнта Wal або в присутності і IgG до фактоПодальші спостереження ру VIII, та інгібітору серинових протеаз Pefabloc® При скринінгу очищених IgG від десяти таких, (Boehringer) протягом 5год. при 38°С. Потім факщо мають високу імунну відповідь, пацієнтів із гетор VIII аналізували за допомогою SDS-PAGE у мофілією А, при використанні в якості молекули7,5% гелі за умов, що не відновлюють. Після автомішені міченого 125І фактору VIII, для шести пацієрадіографії зони фактору VIII із молекулярною нтів спостерігали зміни в профілі міграції фактору вагою 200 і 300кДа, незмінно гідролізує IgG до VIII. Ці результати підкріплюють попередні спостефактору VIII, сканували, щоб обчислити відсоток реження заявників і вказують на те, що каталітичні гідролізу міченого фактору VIII. антитіла до фактору VIII є приблизно в 60% пацієПротеоліз радіактивно міченого фактору VIII нтів. ало-антитілами до фактору VIII пацієнта Wal був 19 Комп’ютерна верстка Т. Чепелева 75867 Підписне 20 Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюA method of determining the presence of catalytic factor viii allo-antibodies capable of degrading factor viii in a mammal, amino acid sequence inhibiting any site in factor viii molecule being sensible to cleavage by allo-antibodies in factor viii (variants), use of inhibitor of cleavage of factor viii to neutralize a catalytic activity of allo-antibodies to factor viii and pharmaceutical composition containing allo-antibodies being capable of degrading factor viii
МПК / Мітки
МПК: G01N 33/86, A61K 38/08, A61P 7/04, G01N 33/68, C07K 7/06, A61K 39/395, C07K 14/755
Мітки: спосіб, інгібує, розщепленн, послідовність, viii, сайт, ало-антитіл, амінокислотна, спроможні, визначення, розщеплювати, чутливий, наявності, будь-який, фактор, молекули, фактора, ссавця
Код посилання
<a href="https://ua.patents.su/10-75867-sposib-viznachennya-nayavnosti-u-ssavcya-alo-antitil-do-faktora-viii-shho-spromozhni-rozshheplyuvati-faktor-viii-aminokislotna-poslidovnist-shho-ingibueh-bud-yakijj-sajjt-u-molekul.html" target="_blank" rel="follow" title="База патентів України">Спосіб визначення наявності у ссавця ало-антитіл до факторa viii, що спроможні розщеплювати фактор viii, амінокислотна послідовність, що інгібує будь-який сайт у молекулі факторa viii, що чутливий до розщепленн</a>
Попередній патент: Інгібітори реплікації респіраторно-синцитіального вірусу
Наступний патент: Пристрій для виявлення буксування колісних пар локомотива
Випадковий патент: Спосіб регулювання потужності машинних агрегатів компресорних станцій магістральних газонафтопроводів та електростанцій з парогазотурбінним приводом