Біологічний спосіб виявлення збудників трансмісивних бактеріальних інфекцій: анаплазмозу, бартонельозу, ерліхіозу
Номер патенту: 81049
Опубліковано: 25.06.2013
Автори: Костиря Ірина Анатоліївна, Похіл Сергій Іванович, Козько Володимир Миколайович, Бондаренко Андрій Володимирович, Тимченко Олена Миколаївна, Чигиринська Ніла Анатоліївна, Юрко Катерина Володимирівна, Семеренська Євгенія Іванівна, Килипко Людмила Віталіївна, Круглова Тетяна Анатоліївна, Торянік Інна Іванівна
Формула / Реферат
Біологічний спосіб виявлення збудників трансмісивних бактеріальних інфекцій: анаплазмозу (АІ), бартонельозу (БІ), ерліхіозу (ЕІ), який характеризується тим, що як лабораторні тварини із підвищеною чутливістю до зараження і накопичення вказаних патогенів застосовуються білі нелінійні миші з штучно сформованим (шляхом підшкірного уведення імунодепресивного лікарського препарату "Циклофосфан®" у дозі 250 мкг/кг) імунокомпрометованим станом із подальшою верифікацією у них методом полімеразної ланцюгової реакції (ПЛР) етіології інфекції, яка виникає у тварин після інтраперитонеального уведення їм (в об'ємі 0,3 мл) зразків біологічного матеріалу, якщо останні містять збудники АІ, БІ, ЕІ.
Текст
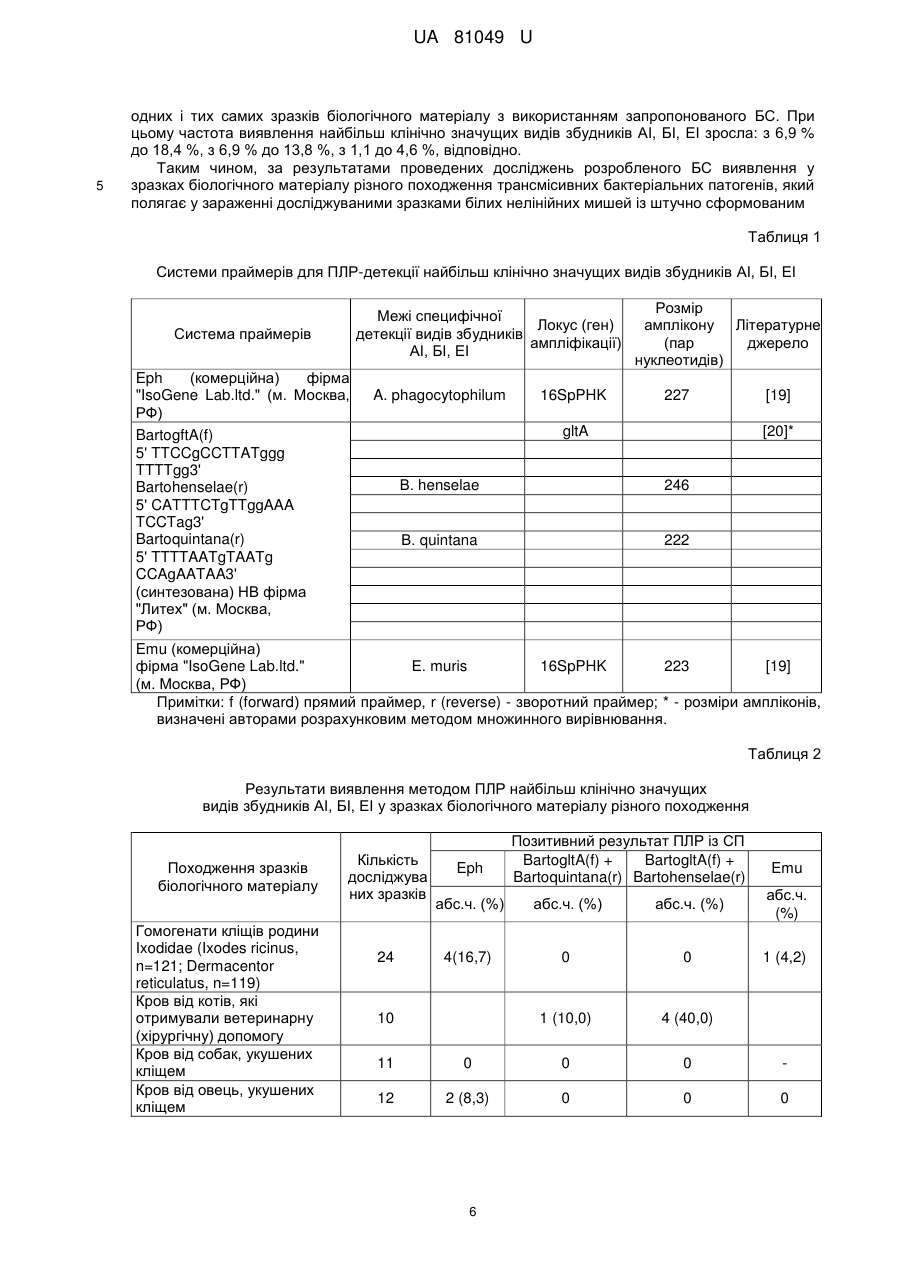
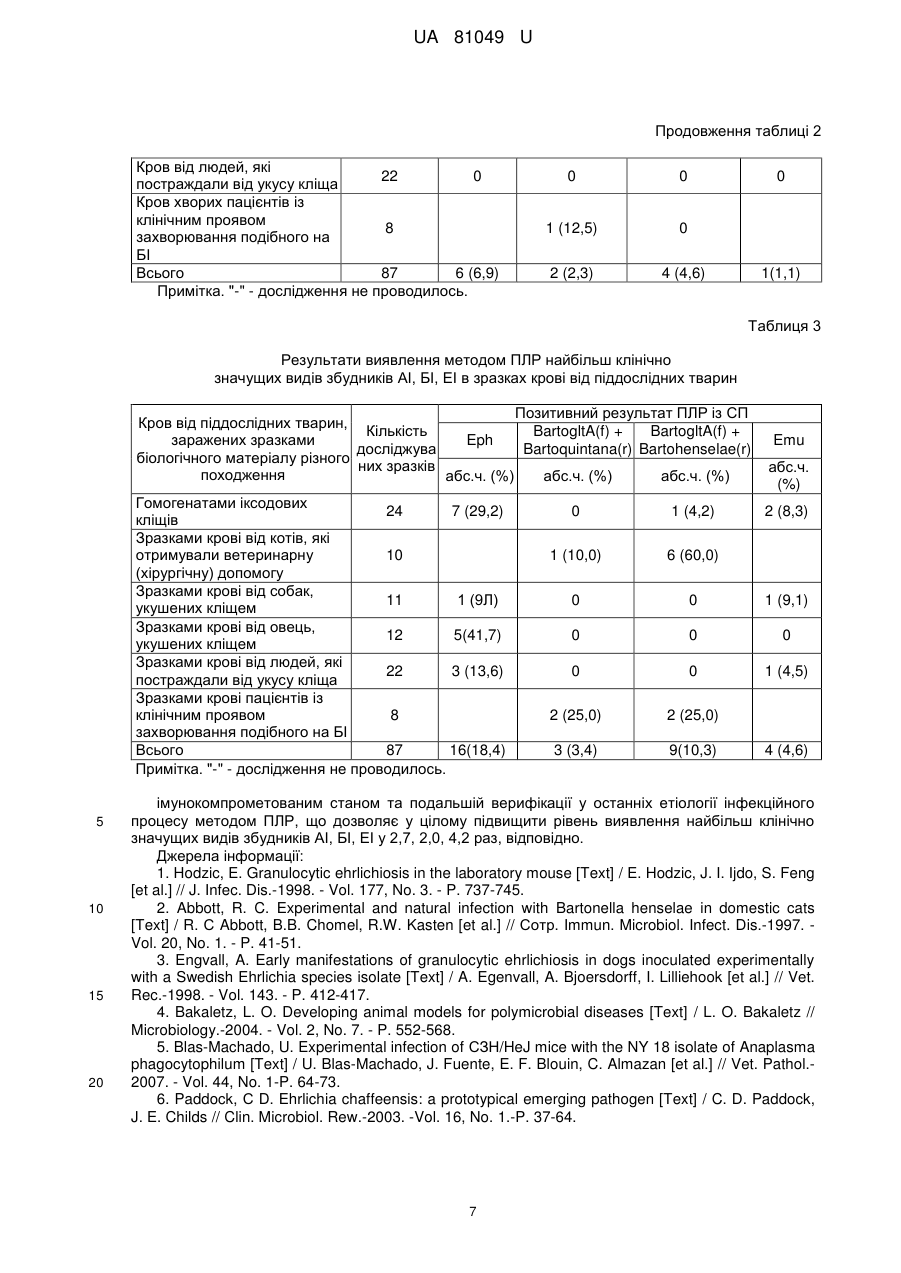
Реферат: Біологічний спосіб виявлення збудників трансмісивних бактеріальних інфекцій: анаплазмозу (АІ), бартонельозу (БІ), ерліхіозу (ЕІ) характеризується тим, що як лабораторні тварини із підвищеною чутливістю до зараження і накопичення вказаних патогенів застосовуються білі UA 81049 U (12) UA 81049 U нелінійні миші з штучно сформованим (шляхом підшкірного уведення імунодепресивного лікарського препарату "Циклофосфан®" у дозі 250 мкг/кг) імунокомпрометованим станом із подальшою верифікацією у них методом полімеразної ланцюгової реакції (ПЛР) етіології інфекції, яка виникає у тварин після інтраперитонеального уведення їм (в об'ємі 0,3 мл) зразків біологічного матеріалу, якщо останні містять збудники АІ, БІ, ЕІ. UA 81049 U 5 10 15 20 25 30 35 40 45 50 55 60 Корисна модель належить до медицини та ветеринарії, а саме до медичної і ветеринарної мікробіології, зокрема до способів лабораторної діагностики трансмісивних (кліщових) інфекційних захворювань: анаплазмозу (анаплазмозної інфекції - АІ), бартонельозу (бартонельозної інфекції - БІ), ерліхіозу (ерліхіозної інфекції - EI). Ця корисна модель може бути використана для діагностики у людей і тварин АІ, БІ, EI шляхом виявлення їх збудників у зразках досліджуваного біологічного матеріалу (кров, біоптат лімфовузлів, селезінки, кісткового мозку, печінки та ін.) завдяки накопиченню вказаних патогенів у організмі високочутливих до них лабораторних тварин після уведення останнім потенційно інфікованих зразків матеріалу з подальшою верифікацією у піддослідних тварин етіології викликаного інфекційного процесу за допомогою полімеразної ланцюгової реакції (ПЛР). Крім того, дана корисна модель може бути використана для встановлення інфікованості збудниками АІ, БІ, ЕІ кліщів - переносників (векторів) цих патогенів при вивченні географічного ареалу циркуляції останніх та епідемічних і епізоотологічних особливостей їх поширення. У теперішній час біологічний спосіб (БС), який ґрунтується на експериментальному відтворенні інфекційного захворювання у лабораторних тварин, застосовується у медичній та ветеринарній практиці для діагностики різних інфекцій: туляремії, сибірської виразки, лептоспірозу, лістеріозу та інших. Після встановлення у кінці ХХ-го століття етіологічного значення у захворюваності людей та тварин групи нових збудників трансмісивних бактеріальних інфекцій (АІ, БІ, EI) науковці різних країн світу активно розпочали розроблювати лабораторні моделі для штучного відтворення у піддослідних тварин цих захворювань [1, 2, 3]. Кінцевою метою таких досліджень є: вивчення особливостей патогенезу АІ, БІ, EI; встановлення закономірностей перебігу імунологічних реакцій та формування специфічного і неспецифічного імунітету проти їх збудників; визначення в умовах in vivo результативності (специфічності, чутливості, відтворюваності) методів лабораторної діагностики АІ, БІ, EI; ефективності етіотропної терапії та засобів специфічної імунопрофілактики цих захворювань; встановлення видів тварин, які відіграють роль природного джерела ("хазяїна") інфекції та механізмів передачі патогенів, а також розробка способів щеплення останніх і дослідження їх біологічних властивостей. Збудники АІ, БІ, EI є високоспеціалізованими внутрішньоклітинними паразитами із вираженим тропізмом до враження певних тканих і органів-мішеней та характеризуються високою вибагливістю до умов життєдіяльності, що не дозволяє їх виростити на поживних середовищах і в культурах евукаріотичних клітин, які широко застосовуються в сучасній лабораторній практиці [1, 4, 5, 6, 7]. В Європі (у тому числі й в Україні) домінуючими видами збудників захворювань людей на АІ, БІ, ЕІ, відповідно, є: Anaplasma phagocytophilum (викликає гранулоцитарний анаплазмоз людини - ГАЛ); Bartonella henselae (викликає хворобу від котячих подряпин - ХКП, бацилярний ангіоматоз - БА, пеліозний гепатит, ендокардит, гостру або хронічну бактеремію, нейроретиніт, енцефаліт, менінгіт, менінгоенцефаліт, енцефаломієліт) та В. quintana (викликає БА, окопну гарячку, ендокардит, хронічну бактеремію); Ehrlichia muris (викликає моноцитарний ерліхіоз людини - МЕЛ). Тому переважна більшість розроблюваних у світі лабораторних моделей спрямована на дослідження саме цих - клінічно найбільш значимих патогенів. При цьому закордонні науковці, в першу чергу, використовують ті види тварин, які є природним хазяїном вказаних збудників. Як такі тварини для досліджень АІ були використані коні, велика рогата худоба, вівці, білохвості олені, собаки, деревинні щури та білоногі миші [7, 8, 9]; для вивчення БІ - домашні коти, собаки, койоти, примати та бавовняні щури [2, 10, 11], а для ЕІ - собаки та білохвості олені [6, 12]. Використання вказаних тварин хоча і дозволяє в експерименті досить подібно відтворювати природний перебіг АІ, БІ, ЕІ у ссавців та людей, але має ряд суттєвих недоліків, пов'язаних із їх недоступністю для широкого застосування в діагностичній практиці, високою вартістю таких тварин, труднощами утримання останніх в умовах лабораторії та технічною складністю проведення на них експериментів, а також обмеженнями щодо можливості створення уніфікованої лабораторної моделі для усієї групи трансмісивних бактеріальних інфекцій, що обумовлено із здатністю кожного виду патогенів розмножуватись і накопичуватись лише у певному виді чутливих до них тварин, тощо. Тому, в останні роки відмічена тенденція зростання кількості досліджень, які спрямовані на розробку технічно більш зручних моделей експериментального відтворення АІ, БІ, ЕІ, які ґрунтуються на використанні найбільш поширених лабораторних тварин - найчастіше мишей, значно рідше щурів, мурчаків, кролів [1, 4, 5, 7, 11]. Слід зазначити, що у звичайних білих нелінійних лабораторних мишей перебіг експериментальної АІ, БІ, ЕІ характеризується повною відсутністю або надзвичайно слабко вираженими симптомами захворювання (яке майже ніколи не закінчується загибеллю піддослідних тварин) без суттєвого розмноження та накопичення у їх організмі збудників та швидкою елімінацією останніх навіть за умов наявності бактеремії у 1 UA 81049 U 5 10 15 20 25 30 35 40 45 50 55 60 піддослідних тварин на початковому етапі після їх зараження [1, 4, 5, 6]. Вказані обставини спонукають дослідників застосовувати спеціальні (генетично клоновані) сингенні лінії мишей із вродженим імунокомпрометованим станом, що характеризуються високим рівнем чутливості до збудників різних інфекційних захворювань [4, 5, 7]. Однак, такі лінійні імунокомпрометовані лабораторні тварини є відносно дорогими, досить дефіцитними, потребують спеціально створених умов для їх ізольованого утримання та розмноження, що запобігало б загибелі тварин при випадковому зараженні будь якою інфекцією. Це суттєво ускладнює стабільне (безперервне) забезпечення лінійними імунокомпрометованими тваринами бактеріологічних лабораторій і широке практичне їх використання для БС діагностики АІ, БІ, ЕІ [5, 7, 12]. Тому потенційно найбільш перспективним для широкого практичного застосування може бути БС, який ґрунтується на використанні білих нелінійних лабораторних мишей із штучно створеним (індукованим) імунокомпрометованим станом. Останній вдається сформувати шляхом уведення піддослідним тваринам хімічних сполук, що мають необхідний спектр імунодепресивної дії. Сьогодні вже існує великий перелік лікарських препаратів, які характеризуються різнотипними механізмами імунодепресії без прояву протибактерійної активності [13, 14]. Це дозволяє здійснювати обґрунтований вибір для застосовування саме тих препаратів, які забезпечують найбільш адекватне відтворення потрібного імунокомпрометованого стану у піддослідних тварин з уникненням при цьому небажаної бактерицидної (або пригнічуючої) дії на збудники АІ, БІ, ЕІ. Наш вибір вітчизняного лікарського препарату "Циклофосфан®" (виробник ВАТ "Київмедпрепарат") саме й обґрунтовується детально вивченими механізмами його імуносупресивної дії, відсутністю протибактерійної активності, дешевизною і загальною доступністю цього препарату [14]. При розробці БС виявлення збудників трансмісивних бактеріальних інфекцій із використанням імунокомпрометованих лабораторних тварин було враховано і такі важливі факти, як зростання чутливості вказаних тварин не лише до збудників АІ, БІ, ЕІ, а й до патогенів інших інфекційних захворювань, що можуть міститись у зразках досліджуваного матеріалу, що уводяться піддослідним тваринам. Крім того, науковими дослідженнями вже доведено, що кліщові інфекції, як правило, є змішаними (мікстними) інфекціями, а не моноінфекціями [2, 4, 6, 8]. Тобто, унаслідок укусу кліща в організм потерпілого (людини, тварини) одночасно можуть потрапляти декілька видів збудників із подальшим розвитком мікстного інфекційного захворювання: АІ з БІ, АІ з ЕІ, БІ з ЕІ. Тому, цілком необхідним є уточнення (верифікація) етіології інфекційного процесу у заражених піддослідних тварин. У теперішній час серед великої кількості методів верифікації етіології АІ, БІ, ЕІ (мікроскопічних, культуральних, імунологічних, молекулярно-генетичних та інших) перевага віддається методу ПЛР (який може бути відтворений у різному форматі), що забезпечує відносно високий рівень чутливості, специфічності та відтворюваності результатів досліджень [1, 2, 4, 5, 7]. При цьому для відтворення ПЛР широко застосовуються праймерні системи (ПС) як комерційного виробництва, так і синтезовані на замовлення дослідників. Аналог 1: Способ моделирования имунодефицитного состояния по системе нейтрофильных гранулоцитов (Патент РФ №2118850 від 10.09.1998 р.) [15]. Для проведення досліджень з метою підбору оптимальних препаратів імунокоректорів імунодефіцитних станів запропоновано використовувати циклофосфамід, уведення якого лабораторним тваринам призводить до зменшення у периферійній крові останніх кількості циркулюючих нейтрофільних гранулоцитів і їх рецепторної фагоцитарної функції. Спільними ознаками цього аналога із корисною моделлю, яка заявляється, є здатність циклофосфаміду (після його уведення) формувати імунокомпрометований стан у піддослідних тварин. Суттєвими недоліками, які заважають досягти бажаного технологічного результату при використанні аналога є: відсутність експериментальних даних про можливість застосування циклофосфаміду для відтворення лабораторної моделі інфекційних захворювань (у тому числі АІ, БІ, ЕІ); уведення надмірної дози препарату (0,5 і 150 мг/кг), що призводить до надто глибокої імуносупресії у піддослідних тварин і непередбачуваної загибелі котрих із них; не оптимальний (інтрабрюшинний) спосіб уведення циклофосфаміду, що обумовлює швидке (через 15 хвилин), але відносно короткочасне існування (до 3-х діб) імунокомпрометованого стану, тривалість якого недостатня для розмноження і накопичення в організмі тварин збудників АІ, БІ, ЕІ. Аналог 2: Method for the detection of bacterial species of the genera Anaplasma/Ehrlichia and Bartonella (Патент США №7989170 від 02.08.2011 p.) [16]. Для виявлення та ідентифікації широкого спектра збудників АІ, БІ, ЕІ у зразках різного біологічного матеріалу запропоновано використовувати ПЛР для ампліфікації (накопичення на першому етапі) специфічних локусів їх генів (16S rRNA, msp2, та повторів міжгенного регіону 16S-23S rRNA) з подальшою (на другому етапі) гібридизацією утворених ампліконів із синтезованими видоспецифічними нуклеотидними 2 UA 81049 U 5 10 15 20 25 30 35 40 45 50 55 зондами, що дозволяє чітко визначити вид патогену. Спільними ознаками даного аналога із корисною моделлю, яка заявляється, є використання методу ПЛР для виявлення збудників АІ, БІ, ЕІ. Суттєвими недоліками, які заважають досягти бажаного технологічного результату є: відсутність етапу розмноження і накопичення патогенів шляхом їх вирощування в умовах in vivo (в спеціальних культурах чутливих евукаріотичних клітин або в організмі лабораторних тварин), 4 що значно знижує рівень чутливості досліджень (до >10 клітин збудника/мл); технічна складність та висока вартість проведення досліджень, які обумовлені потребою у додатковому спеціальному обладнанні і багатьох різноманітних тест-систем для здійснення гібридизації та детекції гібридних комплексів ДНК-ДНК при ідентифікації більш ніж 10-ти видів бактерій родів Anaplasma, Bartonella і Ehrlichia без урахування клінічної значущості останніх у захворюваності людей. Найближчим аналогом (прототипом) корисної моделі, що пропонується є [7]: Borjesson D.L. The mouse as a model for investigation of human granulocytic ehrlichiosis: current knowledge and future directions [Text] / D.L. Borjesson, S.W. Barthold // Compar. Medic.-2002. - Vol. 52, No 5. - P. 403-413. З метою вивчення патогенезу ГАЛ і біологічних властивостей його збудника - A. phagocytophilum у прототипі представлено результати досягнень і визначено напрямки та перспективи подальших досліджень щодо відтворення експериментальної моделі ГАЛ із використанням лабораторних мишей. Ознаками прототипу, які збігаються із ознаками способу, що заявляється, є: використання при проведенні цілеспрямованих досліджень тварин із імунокомпрометованим станом, здатних накопичувати збудники АІ після їх інтраперитонеального зараження зразками біологічного матеріалу, які містять ці патогени; використання методу ПЛР для виявлення вказаних патогенів у тканинах і органах піддослідних тварин для підтвердження розвитку специфічного інфекційного процесу та для встановлення тканинного тропізму збудників АІ. Причинами, що перешкоджають одержанню очікуваного технічного результату за допомогою прототипу є: висока вартість і недоступність для широкого практичного використання спеціальних сингенних ліній мишей (SCID-severe combined immunodeficiency) із вродженим важким комбінаторним імунодефіцитним станом, а також необхідність створення спеціальних умов для ізольованого утримання і проведення експериментів із такими тваринами; недостатній рівень уніфікованості прототипної лабораторної моделі ГАЛ, що обумовлено відсутністю експериментальних даних стосовно можливості використання вказаних лабораторних тварин для одночасного виявлення не лише збудників АІ, а й збудників інших трансмісивних бактеріальних інфекцій (БІ та ЕІ), які потенційно теж можуть бути присутніми у зразках досліджуваного біологічного матеріалу різного походження. В основу корисної моделі поставлено задачу розробити ефективний БС виявлення у зразках різного біологічного матеріалу групи таксономічно-відмінних збудників трансмісивних бактеріальних інфекційних захворювань (АІ, БІ, ЕІ), який би характеризувався уніфікованою і простою технологією відтворення, був більш дешевим і доступним для широкого практичного використання та дозволяв би виявляти найбільш клінічнозначущі види патогенів. Поставлена задача вирішується тим, що в розробленому способі досліджувані зразки різного біологічного матеріалу, які потенційно можуть містити збудники АІ, БІ, ЕІ, запропоновано уводити нелінійним білим мишам (Mm musculus L.) із штучно сформованим імунокомпрометованим станом, завдяки чому в організмі останніх створюються сприятливі умови для розмноження і накопичування вказаних патогенів, найбільш клінічнозначущі види яких у подальшому виявляються у біоптатному і секційному матеріалі від піддослідних тварин методом ПЛР, відтворюваним у стандартному форматі із використанням комерційних та/або синтезованих СП. Схема-алгоритм технології відтворення БС виявлення збудників АІ, БІ, ЕІ складається із таких послідовних етапів: підготовка зразків досліджуваного біологічного матеріалу; зараження підготовленими зразками лабораторних тварин із штучно сформованим імунокомпрометованим станом; відбір від передчасно сконалих і морталізованих піддослідних тварин зразків секційного матеріалу - тканин і органів, які потенційно найбільш інтенсивно уражаються вказаною групою патогенів; верифікація етіології АІ, БІ, ЕІ шляхом експресної детекції методом ПЛР у відібраних зразках секційного матеріалу найбільш клінічнозначущих видів збудників. БС виявлення збудників АІ, БІ, ЕІ є придатним для проведення цілеспрямованих (діагностичних, епідеміологічних, епізоотичних, екологобіологічних та інших) досліджень зразків біологічного матеріалу різного походження, які потенційно можуть містити вказані патогени, у тому числі зразків матеріалу твердої і рідкої консистенції, із відсутністю та із наявністю у них контамінації сторонньою (природного походження чи випадково внесеною) мікрофлорою. 3 UA 81049 U 5 10 15 20 25 30 35 40 45 50 55 60 У теперішній час найбільш актуальним завданням є виявлення збудників АІ, БІ, ЕІ при діагностиці трансмісивних інфекційних захворювань у людей і тварин, які виникають у них після укусу кліща. При цьому найчастіше досліджуваним матеріалом від постраждалих слугують зразки крові і досить рідко - біоптат лімфовузлів, селезінки, кісткового мозку, печінки та інше. Великого наукового і практичного значення набули дослідження з встановлення рівня інфікованості збудниками АІ, БІ, ЕІ кліщів, які відіграють роль векторів передачі цих патогенів і тому слугують зразками матеріалу для таких досліджень. Основні особливості підготовки зразків біологічного матеріалу для БС виявлення збудників АІ, БІ, ЕІ полягають у наступному. Відібрані зразки крові необхідно внести у стерильні ємкості із антикоагулянтом (який не має антимікробної активності) для запобігання згортанню крові. При проведенні своїх досліджень ми використовували вакуумні системи забору крові VENOSAFE™, Terumo Europe N.V. (Бельгія) і пробірки VF-052SDK (робочий об'єм 2 мл) із антикоагулянтом К2 EDTA. Зразки крові доцільно однократно заморозити (при температурі близько -20 °C) і розморозити (при кімнатній температурі), що забезпечує руйнування клітин крові та вивільнення із них клітин і мікроколоній патогенів. Зразки біологічного матеріалу твердої консистенції підлягають ретельній гомогенізації (шляхом подрібнення або розтирання) і розведенню стерильною дистильованою водою у співвідношенні близько 1:9 (об'єм/об'єм, відповідно) з подальшим перемішуванням до утворення рівномірної суспензії. Перед гомогенізацією поверхня кліщів дезінфікується шляхом занурення останніх на 10 хвилин у 70 % етиловий спирт. Доцільно гомогенізувати все тіло кліща так як збудники АІ, БІ, ЕІ можуть знаходитись у різних його тканинах і органах (слинних залозах, лімфі, кишечнику тощо). З урахуванням мети досліджень для приготування одного гомогенату можна використовувати декілька кліщів одного виду, зібраних в одній місцевості (ми готували гомогенати із 10 дорослих кліщів). Для уведення лабораторним тваринам відбирається супернатант (після відстоювання і самовільного осадження в осад великорозмірних частинок) суспензії гомогенізованих зразків. Усі маніпуляції при відборі та підготовці для дослідження зразків біологічного матеріалу слід здійснювати з дотриманням правил асептики щоб запобігти додатковій їх контамінації сторонньою мікрофлорою. Штучний імунокомпрометований стан у білих нелінійних лабораторних тварин створюється шляхом одноразової підшкірної ін'єкції їм 250 мкг/кг лікарського препарату "Циклофосфан®" (виробництва ВАТ "Київмедпрепарат", м. Київ, Україна) за 3-4 години перед уведенням тваринам зразків досліджуваного біологічного матеріалу. Підшкірний спосіб уведення указаного препарату (на відміну від інтрабрюшинного) забезпечує більш рівномірне надходження препарату у систему кровообігу та кровотворні органи, знижує швидкість елімінації препарату із організму тварини, що забезпечує формування більш тривалого у часі (до 7-10 діб) імунокомпрометованого стану - достатнього для розмноження і накопичення збудників АІ, БІ, ЕІ. Оптимальною є і емпірично визначена нами доза препарату 250 мкг/кг. Вказана доза, з одного боку, забезпечує формування досить вираженого і стійкого імунокомпрометованого стану, а з іншого боку - ін'єкція цієї дози препарату (на відміну від уведення 500 мкг/кг і більше) не призводить до непередбачуваної загибелі частини (близько 12 % і більше) піддослідних тварин. Уведення лабораторним тваринам зразків досліджуваного біологічного матеріалу (в об'ємі 0,3 мл) здійснюється шляхом інтраперитонеальної ін'єкції, що забезпечує велику площу для аплікації збудників АІ, БІ, ЕІ з високою вірогідністю контакту останніх із клітинами-мішенями (макрофагами, лейкоцитами, еритроцитами та іншими), у яких вказані патогени здатні розмножуватись. Термін спостереження за зараженими піддослідними тваринами становить 810 діб так як, у цей часовий період досягає максимального значення концентрація збудників у тканинах і органах тварин [1, 5, 10, 11, 12]. При спостереженні за тваринами виявляється їх передчасна загибель та виникнення у них клінічних ознак захворювання: зниження рухливості та апетиту, інертність при тактильному та звуковому подразненні, згорблена посадка, кульгавість, метеоризм, втрата близько 30 % маси тіла. Нами проведено визначення і порівняння рівня морбідності (передчасної загибелі і захворюваності) у трьох відмінних груп лабораторних тварин: група № 1 - контрольні інтактні тварини (n=7); група № 2 - контрольні тварини із штучно сформованим імунокомпрометованим станом (n=7); група № 3 - піддослідні тварини з імунокомпрометованим станом, які були заражені зразками досліджуваного біологічного матеріалу (n=87). Результати цих досліджень засвідчили, що на відміну від контрольних тварин груп № 1 і № 2, у піддослідних тварин групи № 3 виникає клінічно виражене захворювання у 67,8 % випадків, яке може призводити у 39,0 % випадків до передчасної загибелі тварин на 3-10 добу після їх зараження. При цьому у подальшому із використанням методу ПЛР було встановлено, що безпосередньо перебіг АІ, БІ, ЕІ може бути причиною передчасної загибелі піддослідних тварин (у 17,4 %, 13,0 %, 8,7 % випадків, відповідно), супроводжуватись виникненням у них клінічних ознак захворювання без загибелі тварин 4 UA 81049 U 5 10 15 20 25 30 35 40 45 50 55 60 упродовж терміну спостереження (у 43,8 %, 33,3 %, 25,0 % випадків, відповідно), або перебігати при відсутності виражених симптомів інфекції (у 31,3 %, 41,6 %, 25,0 % випадків, відповідно). Для підтвердження розмноження і накопичення збудників АІ, БІ, ЕІ у піддослідних тварин групи № 3 вибірково (з урахуванням позитивного результату ПЛР) було проведено порівняльне визначення методом реакції непрямої імунофлюоресценції [17, 18] кількості корпускулярного антигену (клітин і мікроколоній) бактерій родів Anaplasma, Bartonella, Ehrlichia у зразках досліджуваного біологічного матеріалу, якими заражались піддослідні тварини, та у зразках секційного матеріалу від останніх - тканин і органів, що потенційно можуть містити найбільшу кількість клітин збудників АІ, БІ, ЕІ (кров, селезінка, кістковий мозок, печінка, лімфовузли). Результати цих досліджень продемонстрували накопичення до високих концентрацій (від 9,7 × 10 до 1,3 × 10 корпускул антигенів/мл, г) родів бактерій Anaplasma, Bartonella, Ehrlichia у тканинах і органах-мішенях заражених тварин, які перевищували вихідні концентрації цих 23 мікроорганізмів у відповідних зразках досліджуваного біологічного матеріалу більш ніж у 10 10 раз. Для точної верифікації етіології інфекційного процесу від загиблих та морталізованих (методом гіпернаркозування хлороформом) тварин запропоновано застосовувати найпоширеніший (найбільш доступний і технологічно дешевий) стандартний варіант відтворення ПЛР. При цьому верифікація етіології АІ, БІ, ЕІ ґрунтується на виявленні методом ПЛР основних клінічно значущих видів патогенів (A. phagocytophilum, В. henselae і В. quintana, Е. muris, відповідно) у зразках крові (відібраної шляхом пункції серця із дотриманням правил асептики) у піддослідних тварин заражених зразками досліджуваного біологічного матеріалу. Доцільність відбору саме зразків крові обґрунтовується простотою виконуваних для цього експериментальних маніпуляцій, а також повним співпаданням отриманих нами (позитивних і негативних) результатів ПРЛ при паралельному дослідженні зразків крові та інших тканин і органів (селезінки, кісткового мозку, печінки, лімфовузлів), відібраних від одних і тих самих піддослідних тварин. Для відтворення стандартного формату ПЛР запропоновано застосовувати доступні на території України, відносно дешеві і вже підготовлені для безпосереднього використання комерційні набори реагентів фірми "IsoGene Lab. ltd." (м. Москва, РФ) [19]: "Комплект реактивов для универсальной пробоподготовки" - Diatom®DNA Prep 100 (включає реактиви для виділення та очищення із зразків біологічного матеріалу ДНК з метою подальшої ампліфікації визначеного її фрагменту); "Наборы реагентов для амплификации ДНК" - Gene Pak®PCR test: E2136 (включає реакційні суміші із СП Eph для ампліфікації специфічного фрагменту геному А. phagocytophilum) і Е 2138 (включає реакційні суміші із СП Emu для ампліфікації специфічного фрагменту геному Е. muris); "Набор реагентов для амплификации ДНК" - Gene Pak®DNA PCR Core (включає універсальні реакційні суміші, які не містять будь-яких СП, а можуть бути використаними для ампліфікації специфічних фрагментів геному В. henselae і В. quintana при додаванні спеціально синтезованих СП); "Маркер молекулярной массы ДНК, М50, Ml00" - GenePak™ DNA Ladder M50, Ml00 (включає суміші фрагментів ДНК різної молекулярної маси, які відрізняються на 50 або 100 пар нуклеотидів, відповідно, і використовується для порівняльного встановлення розміру утворюваних ампліконів при відтворенні ПЛР із синтезованими СП); "Универсальний внутренний контроль УВК-90" (включає набори реактивів для моніторингу можливих втрат ДНК при її виділенні із досліджуваних зразків біологічного матеріалу і для визначення можливого інгібування ПЛР у процесі її відтворення; використовується разом із іншими наборами реагентів для ампліфікації ДНК фірми "IsoGene Lab. ltd."). При використанні усіх вказаних наборів слід дотримуватись правил, викладених в інструкціях їх виробника. У табл. 1 представлено відомості щодо походження СП, межі специфічної детекції (виявлення) найбільш клінічно значущих видів збудників АІ, БІ, ЕІ, локуси (гени) ампліфікації фрагменту їх геному, розміри утворюваних ампліконів, посилання на літературне джерело, у якому наведено протокол технології відтворення ПЛР із кожною СП. Запропонований БС виявлення збудників трансмісивних бактеріальних інфекцій (АІ, БІ, ЕІ) пройшов випробування в лабораторії нових та маловивчених інфекційних захворювань ДУ "Інститут мікробіології та імунології ім. І.І. Мечникова Національної академії медичних наук" і ТОВ "БіоАналітичні технології" (м. Харків) шляхом дослідження 87 зразків біологічного матеріалу різного походження, які потенційно могли містити збудники АІ, БІ, ЕІ. Результати виявлення методом ПЛР найбільш клінічно значущих видів указаних патогенів у вихідних зразках досліджуваного біологічного матеріалу і у крові піддослідних тварин, заражених цими ж зразками представлено в табл. 2 і 3, відповідно. Порівняльний аналіз вказаних результатів демонструє суттєве (р
ДивитисяДодаткова інформація
Назва патенту англійськоюBiological method for determination of germs of vector-borne bacterial infections: anaplasmosis , bartonellosis, erlikhiosis
Автори англійськоюPohil S I, Timchenko O M, Chigirinsky N A, Kylypko Liudmyla Vitaliivna, Semerenska Yevheniia Ivanivna, Kostyria Iryna Anatoliivna, Torianyk Inna Ivanivna, Kruhlova Tetiana Anatoliivna, Kozko V M, Yurko Kateryna Volodymyrivna, Bondarenko A V
Назва патенту російськоюБиологический способ обнаружения возбудителей трансмиссивных бактериальных инфекций: анаплазмоза, бартонеллеза , эрлихиоза
Автори російськоюПохил Сергей Иванович, Тимченко Елена Николаевна, Чигиринская Нила Анатолиевна, Килипко Людмила Витальевна, Семеренская Евгения Ивановна, Костыря Ирина Анатольевна, Торяник Инна Ивановна, Круглова Татьяна Анатольевна, Козько Владимир Николаевич, Юрко Екатерина Владимировна, Бондаренко Андрей Владимирович
МПК / Мітки
МПК: C12N 1/20
Мітки: збудникiв, трансмісивних, бартонельозу, анаплазмозу, біологічний, бактеріальних, виявлення, ерліхіозу, спосіб, інфекцій
Код посилання
<a href="https://ua.patents.su/10-81049-biologichnijj-sposib-viyavlennya-zbudnikiv-transmisivnikh-bakterialnikh-infekcijj-anaplazmozu-bartonelozu-erlikhiozu.html" target="_blank" rel="follow" title="База патентів України">Біологічний спосіб виявлення збудників трансмісивних бактеріальних інфекцій: анаплазмозу, бартонельозу, ерліхіозу</a>
Попередній патент: Суміш для ливарних форм та стрижнів
Наступний патент: Спосіб аналізу естетичних властивостей текстильних матеріалів
Випадковий патент: Пристрій фільтрації параметрів траєкторії цілі