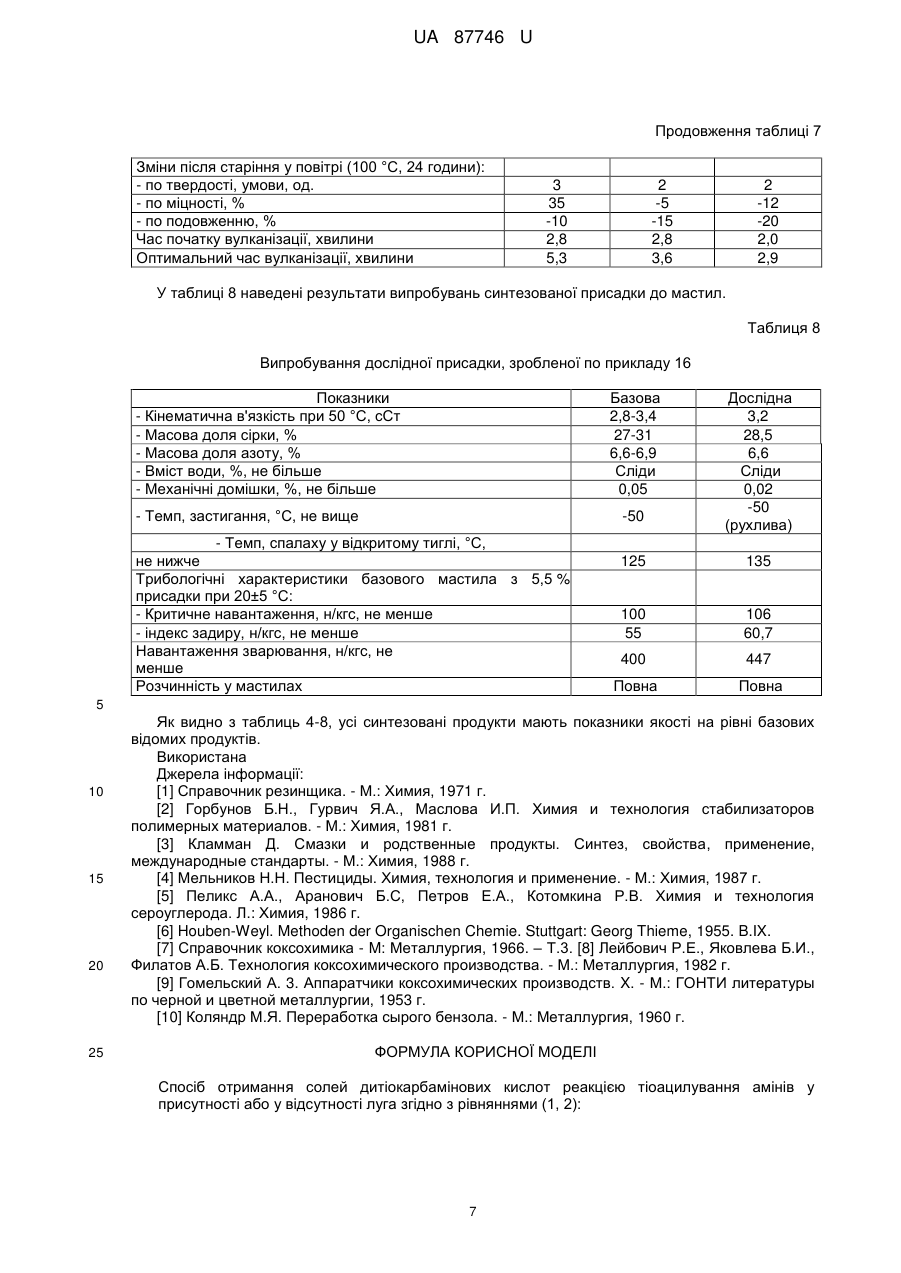
Спосіб отримання солей дитіокарбамінових кислот
Формула / Реферат
1. Спосіб отримання солей дитіокарбамінових кислот реакцією тіоацилування амінів у присутності або у відсутності луга згідно з рівняннями (1, 2):
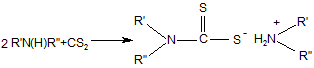 , (1)
, (1)
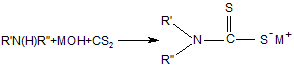 , (2)
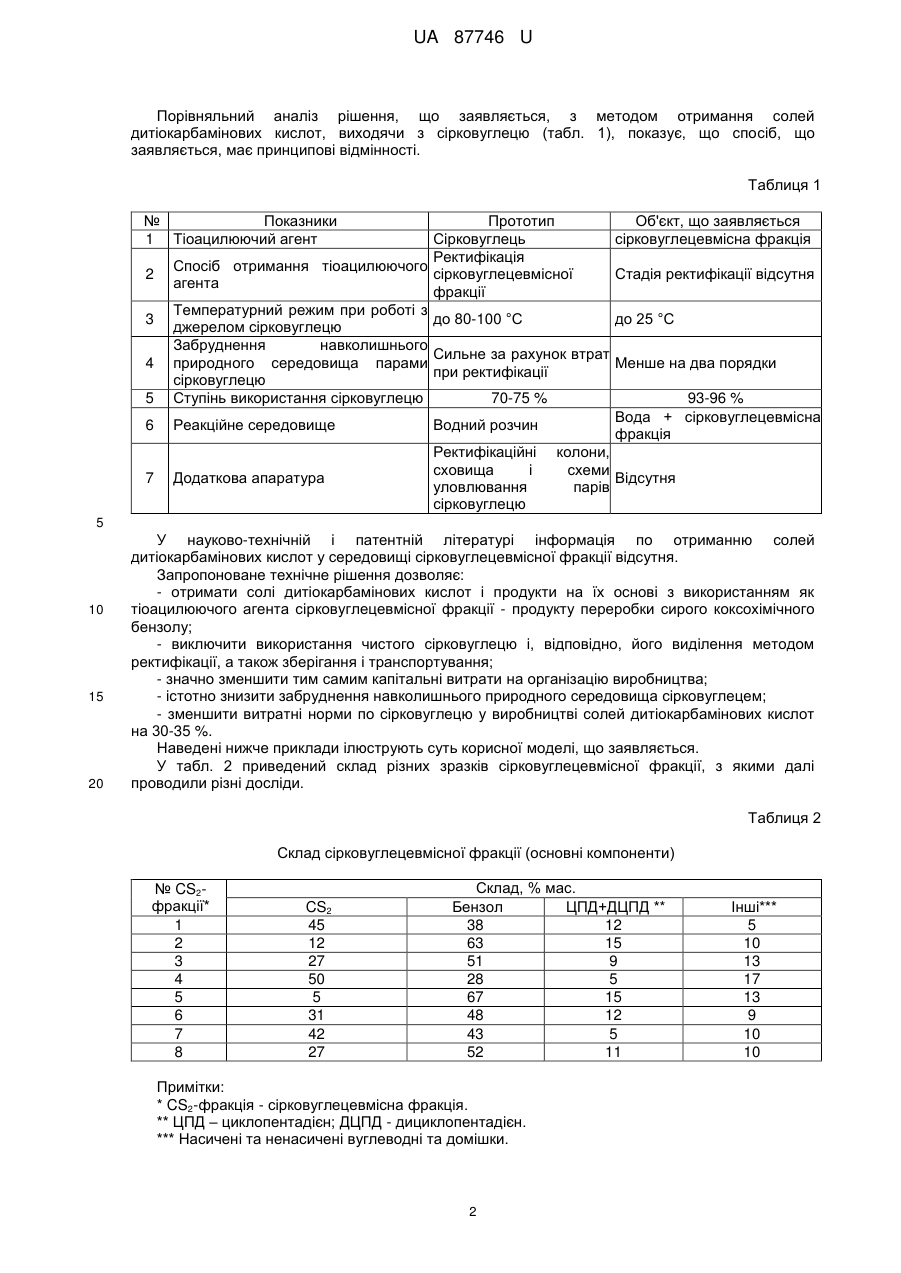
, (2)
де M=Na, K;
R', R''=H, -CH3, -CH2CH3, цикло-(CH2)5,
який відрізняється тим, що як тіоацилюючий агент використовують сірковуглецевмісну фракцію, отриману при переробці сирого коксохімічного бензолу, яка має склад, мас. %:
сірковуглець
5-50
бензол
28-67
насичені та ненасичені вуглеводні та домішки
10-50
цикло- і дициклопентадієн
5-30,
з подальшим відділенням бензольного шару, який не містить сірковуглецю, та виділенням солей дитіокарбамінових кислот звичними методами.
2. Спосіб за п. 1, який відрізняється тим, що при тіоацилуванні використовують аміни, які мають таку основність, що достатня для отримання стійких солей дитіокарбамінових кислот, у тому числі, діетиламін, диметиламін, піперидин.
3. Спосіб за п. 1, який відрізняється тим, що тіоацилування проводять у присутності лужних агентів, у тому числі, їдкого натру, їдкого калію, отримуючи відповідні солі дитіокарбамінових кислот.
Текст
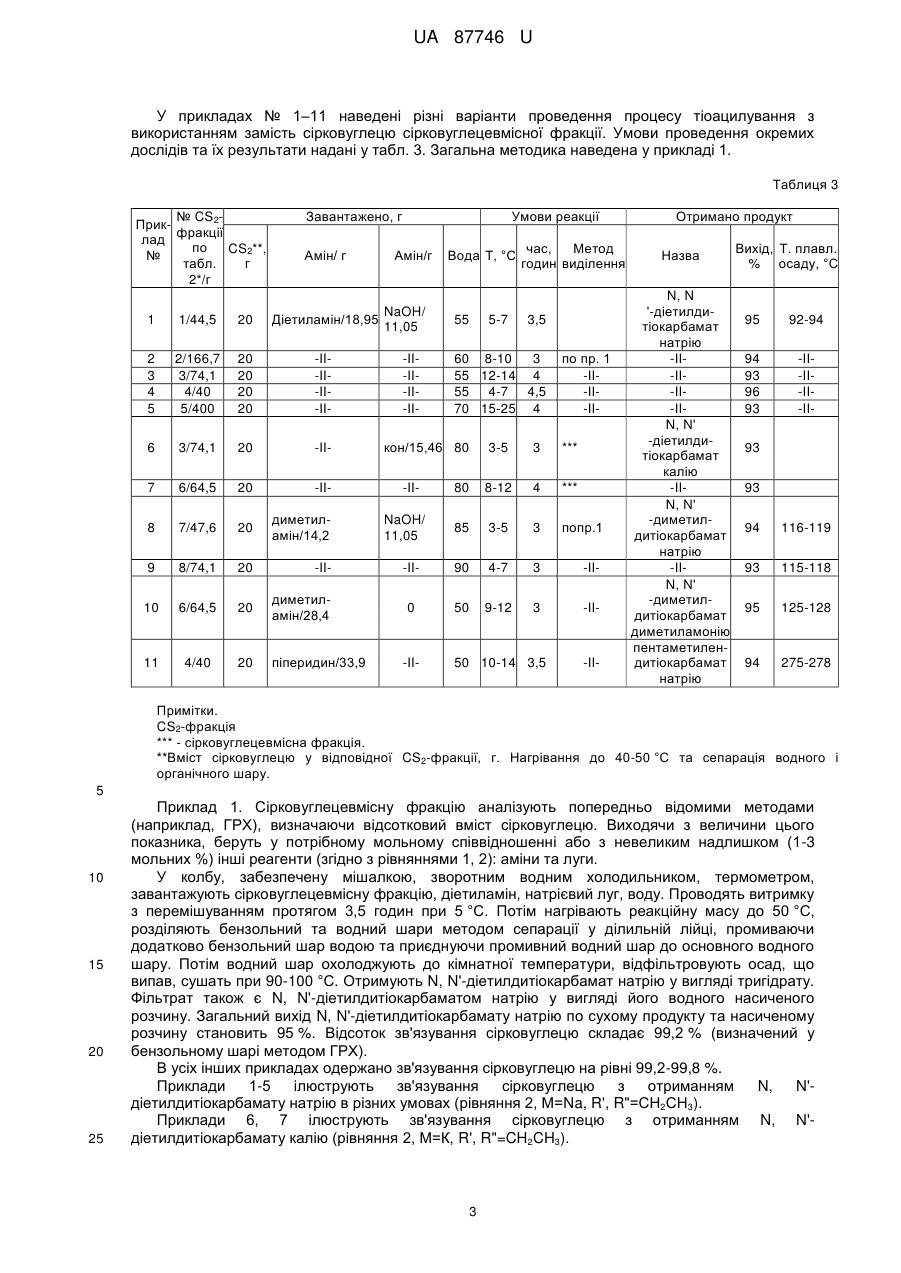
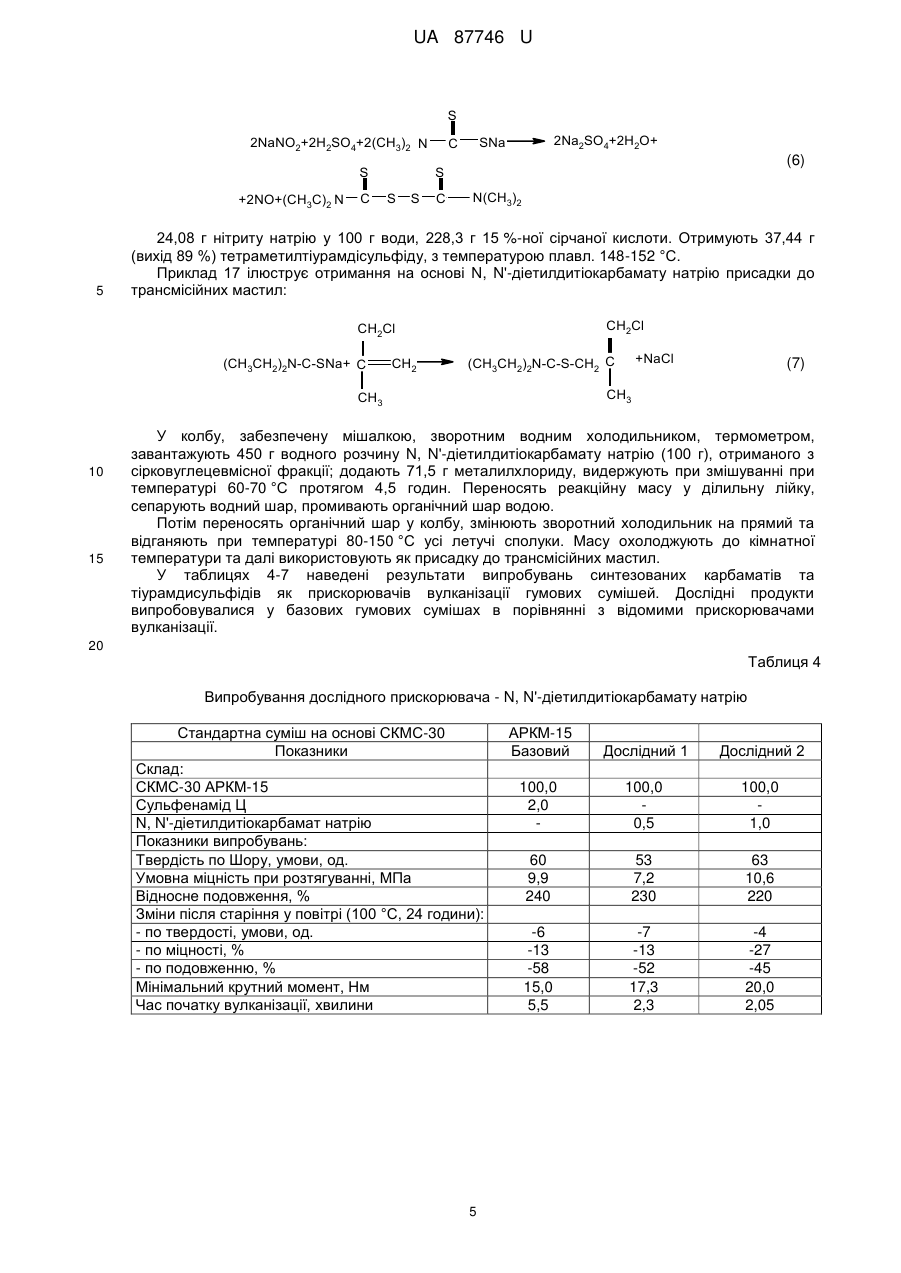
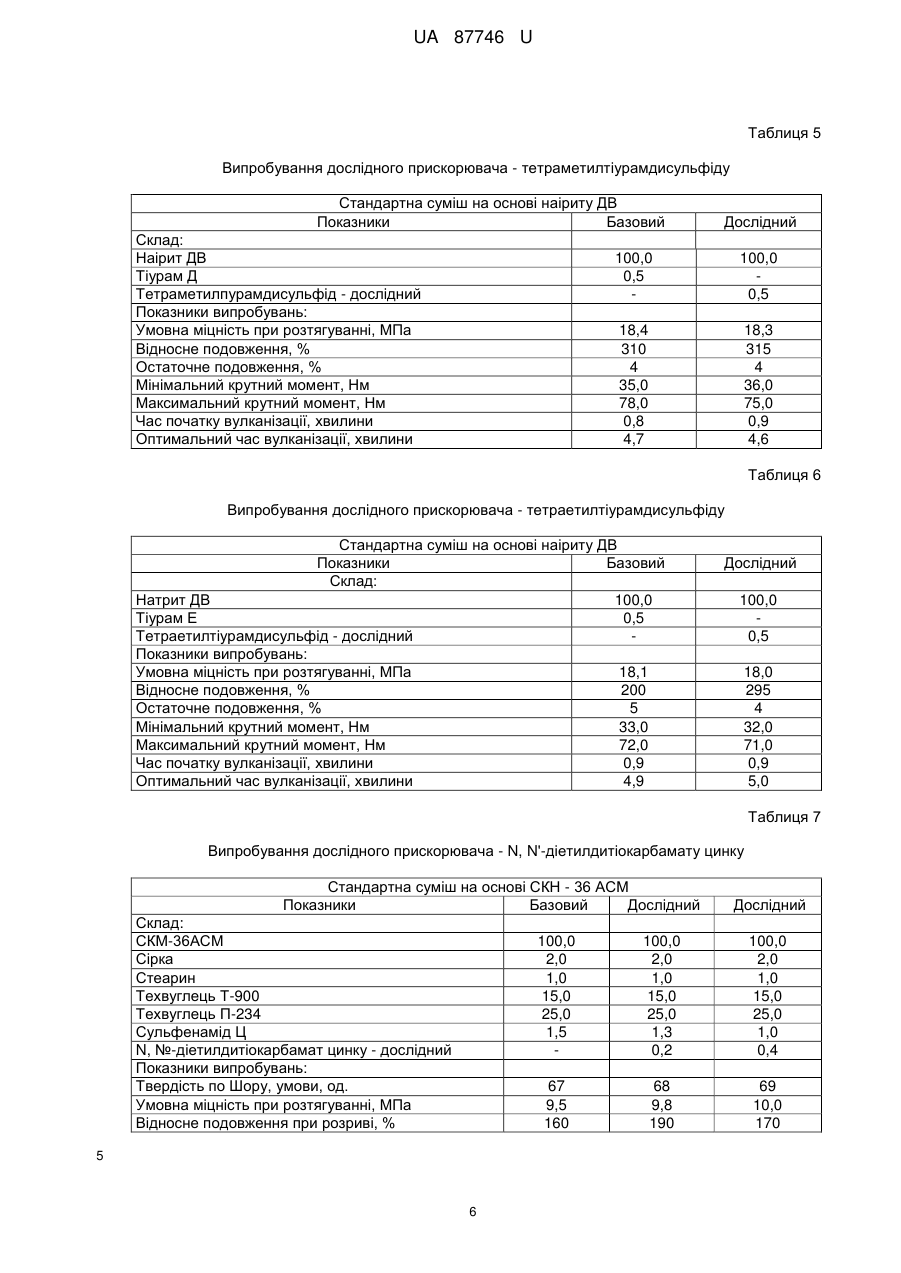
Реферат: UA 87746 U UA 87746 U 5 Корисна модель належить до способів отримання солей дитіокарбамінових кислот. Відомо, що вони широко використовуються у різних галузях промисловості для отримання прискорювачів вулканізації гумових сумішей, пестицидів, інгібіторів корозії, присадок для мастил, аналітичних реагентів, флотагентів [1-4]. Традиційний спосіб їх синтезу, прийнятий за найближчий аналог (прототип), включає взаємодію амінів з сірковуглецем (реакція тіоацилування) у водному середовищі у відсутності (рівняння 1) або у присутності (рівняння 2) лужних сполук [2, 5, 6]: S R' N 2 R'N(H)R''+CS2 C + - HN S 2 R' (1) R'' R'' S R' N R'N(H)R''+MOH+CS2 C S M+ (2) R'' 10 15 20 25 30 35 40 45 де M=Na, K; R', R''=H, алкіл. Сірковуглець отримують при переробці сирого бензолу коксохімічних виробництв [7-10]. Спочатку з сирого бензолу виділяють сірковуглецевмісну фракцію (яка також має назву сірковуглецевої), склад якої може вагатися у широких межах, мас. %: сірковуглець 5-50 бензол 28-67 насичені та ненасичені 10-50 вуглеводні та домішки цикло- і дициклопентадієн 5-30. Виділення сірковуглецю з сірковуглецевмісної фракції, зважаючи на складність її складу, має багато труднощів: - вимагає наявність ректифікаційних колон з великою кількістю теоретичних тарілок; - ненасичені сполуки, які входять до складу сірковуглецевмісної фракції, полімеризуються та окислюються як у процесі ректифікації, так і при зберіганні отриманого сірковуглецю; - останнє призводить до зниження якості сірковуглецю і потребує використання інгібіторів полімеризації та окислення при його зберіганні; - у ряді випадків додатково полімеризують при підвищеній температурі циклопентадієн, який також входить до складу сірковуглецевмісної фракції, тому що через близькість його температури кипіння до температури кипіння сірковуглецю їх дуже нелегко розділити навіть ректифікацією; - ректифікація і виділення сірковуглецю у вигляді легкокиплячої фракції призводять до його великих витрат, значного забруднення навколишнього природного середовища сірковуглецем, що, в сукупності з його високою токсичністю, пожежо- і вибухонебезпечністю, є вкрай небажаним; - при відносно низьких концентраціях сірковуглецю у сірковуглецевмісній фракції (менше ніж 15 %) його виділення ректифікацією взагалі стає невигідним. З метою виключення вказаних недоліків пропонується інший спосіб отримання солей дитіокарбамінових кислот. Його відмінними особливостями є: - виключення використовування у синтезі чистого сірковуглецю; використовування як джерела сірковуглецю та реакційного середовища сірковуглецевмісної фракції – продукту переробки сирого коксохімічного бензолу, і, відповідно, виключення стадії ректифікації з виділенням сірковуглецю; - проведення реакції тіоацилування при відносно низьких температурах (0-25 °C), що виключає забруднення навколишнього природного середовища парами сірковуглецю; - практично повне зв'язування сірковуглецю у солі дитіокарбамінових кислот з їх використанням як цільових та проміжних продуктів у подальших синтезах; - відділення після проведення реакції тіоацилування бензольного шару, який вже не має у своєму складі сірковуглецю, і виділення солей дитіокарбамінових кислот відомими методами; - використання амінів, які дозволяють отримати відносно стабільні солі дитіокарбамінових кислот у присутності або у відсутності сильних лужних сполук, у приведених вище умовах; - використання амінів, дозволяючих отримати солі дитіокарбамінових кислот, які легко розчиняються у воді і погано у бензолі при підвищеній температурі, що дозволяє розділити бензольний і водний шари методом сепарації після проведення синтезу. 1 UA 87746 U Порівняльний аналіз рішення, що заявляється, з методом отримання солей дитіокарбамінових кислот, виходячи з сірковуглецю (табл. 1), показує, що спосіб, що заявляється, має принципові відмінності. Таблиця 1 № Показники 1 Тіоацилюючий агент 5 Прототип Сірковуглець Ректифікація Спосіб отримання тіоацилюючого сірковуглецевмісної агента фракції Температурний режим при роботі з до 80-100 °C джерелом сірковуглецю Забруднення навколишнього Сильне за рахунок втрат природного середовища парами при ректифікації сірковуглецю Ступінь використання сірковуглецю 70-75 % Об'єкт, що заявляється сірковуглецевмісна фракція 2 Стадія ректифікації відсутня 6 Реакційне середовище Водний розчин Додаткова апаратура Ректифікаційні сховища і уловлювання сірковуглецю 3 4 7 до 25 °C Менше на два порядки 93-96 % Вода + сірковуглецевмісна фракція колони, схеми Відсутня парів 5 10 15 20 У науково-технічній і патентній літературі інформація по отриманню солей дитіокарбамінових кислот у середовищі сірковуглецевмісної фракції відсутня. Запропоноване технічне рішення дозволяє: - отримати солі дитіокарбамінових кислот і продукти на їх основі з використанням як тіоацилюючого агента сірковуглецевмісної фракції - продукту переробки сирого коксохімічного бензолу; - виключити використання чистого сірковуглецю і, відповідно, його виділення методом ректифікації, а також зберігання і транспортування; - значно зменшити тим самим капітальні витрати на організацію виробництва; - істотно знизити забруднення навколишнього природного середовища сірковуглецем; - зменшити витратні норми по сірковуглецю у виробництві солей дитіокарбамінових кислот на 30-35 %. Наведені нижче приклади ілюструють суть корисної моделі, що заявляється. У табл. 2 приведений склад різних зразків сірковуглецевмісної фракції, з якими далі проводили різні досліди. Таблиця 2 Склад сірковуглецевмісної фракції (основні компоненти) № CS2фракції* 1 2 3 4 5 6 7 8 CS2 45 12 27 50 5 31 42 27 Склад, % мас. Бензол ЦПД+ДЦПД ** 38 12 63 15 51 9 28 5 67 15 48 12 43 5 52 11 Примітки: * CS2-фракція - сірковуглецевмісна фракція. ** ЦПД – циклопентадієн; ДЦПД - дициклопентадієн. *** Насичені та ненасичені вуглеводні та домішки. 2 Інші*** 5 10 13 17 13 9 10 10 UA 87746 U У прикладах № 1–11 наведені різні варіанти проведення процесу тіоацилування з використанням замість сірковуглецю сірковуглецевмісної фракції. Умови проведення окремих дослідів та їх результати надані у табл. 3. Загальна методика наведена у прикладі 1. Таблиця 3 № CS2Прикфракції лад по CS2**, № табл. г 2*/г Завантажено, г Амін/ г Умови реакції Амін/г NaOH/ Діетиламін/18,95 11,05 1 1/44,5 20 2 3 4 5 2/166,7 3/74,1 4/40 5/400 20 20 20 20 -II-II-II-II 6 3/74,1 20 -II 7 6/64,5 20 -II 8 7/47,6 20 диметиламін/14,2 9 8/74,1 20 -II 10 6/64,5 20 диметиламін/28,4 11 4/40 20 піперидин/33,9 -II-II-II-II Вода Т, °C 55 5-7 час, Метод годин виділення 3,5 60 8-10 3 55 12-14 4 55 4-7 4,5 70 15-25 4 кон/15,46 80 по пр. 1 -II-II-II 3-5 3 *** 80 8-12 4 *** 85 3-5 3 попр.1 -II 90 4-7 3 -II 0 50 9-12 3 -II -IINaOH/ 11,05 -II 50 10-14 3,5 -II Отримано продукт Назва N, N '-діетилдитіокарбамат натрію -II-II-II-IIN, N' -діетилдитіокарбамат калію -IIN, N' -диметилдитіокарбамат натрію -IIN, N' -диметилдитіокарбамат диметиламонію пентаметилендитіокарбамат натрію Вихід, Т. плавл. % осаду, °C 95 92-94 94 93 96 93 -II-II-II-II 93 93 94 116-119 93 115-118 95 125-128 94 275-278 Примітки. CS2-фракція *** - сірковуглецевмісна фракція. **Вміст сірковуглецю у відповідної CS2-фракції, г. Нагрівання до 40-50 °C та сепарація водного і органічного шару. 5 10 15 20 25 Приклад 1. Сірковуглецевмісну фракцію аналізують попередньо відомими методами (наприклад, ГРХ), визначаючи відсотковий вміст сірковуглецю. Виходячи з величини цього показника, беруть у потрібному мольному співвідношенні або з невеликим надлишком (1-3 мольних %) інші реагенти (згідно з рівняннями 1, 2): аміни та луги. У колбу, забезпечену мішалкою, зворотним водним холодильником, термометром, завантажують сірковуглецевмісну фракцію, діетиламін, натрієвий луг, воду. Проводять витримку з перемішуванням протягом 3,5 годин при 5 °C. Потім нагрівають реакційну масу до 50 °C, розділяють бензольний та водний шари методом сепарації у ділильній лійці, промиваючи додатково бензольний шар водою та приєднуючи промивний водний шар до основного водного шару. Потім водний шар охолоджують до кімнатної температури, відфільтровують осад, що випав, сушать при 90-100 °C. Отримують N, N'-діетилдитіокарбамат натрію у вигляді тригідрату. Фільтрат також є N, N'-діетилдитіокарбаматом натрію у вигляді його водного насиченого розчину. Загальний вихід N, N'-діетилдитіокарбамату натрію по сухому продукту та насиченому розчину становить 95 %. Відсоток зв'язування сірковуглецю складає 99,2 % (визначений у бензольному шарі методом ГРХ). В усіх інших прикладах одержано зв'язування сірковуглецю на рівні 99,2-99,8 %. Приклади 1-5 ілюструють зв'язування сірковуглецю з отриманням N, N'діетилдитіокарбамату натрію в різних умовах (рівняння 2, М=Na, R', R"=СН2СН3). Приклади 6, 7 ілюструють зв'язування сірковуглецю з отриманням N, N'діетилдитіокарбамату калію (рівняння 2, М=К, R', R"=CH2CH3). 3 UA 87746 U 5 Приклади 8, 9 ілюструють зв'язування сірковуглецю з отриманням N, N'диметилдитіокарбамату натрію (рівняння 2, М=Na, R', R"=СН3). Приклад 10 ілюструє зв'язування сірковуглецю з отриманням N, N'-диметилдитіокарбамату діметиламонію (рівняння 1, R', R"=СН2СН3). Приклад 11 ілюструє зв'язування сірковуглецю з отриманням пентаметилендитіокарбамату натрію (рівняння 2, М=Na, R', R"=цикло-(СН2)5). Приклад 12 ілюструє отримання на основі N, N'-діетилдитіокарбамату натрію N, N'діетилдитіокарбамату цинку (рівняння 3, М=Na). S S ZnCl2+2(CH3CH2)2 N C [(CH3CH2)2 N SM C S]2Zn+2MCl (3) 10 15 20 де M=Na, K. У колбу, забезпечену мішалкою, зворотним водним холодильником, термометром, завантажують 26,15 г тригідрату N, N'-діетилдитіокарбамату натрію, отриманого з сірковуглецевмісної фракції, 180 г води, 7,9 г хлориду цинку, перемішують дві години при 3540 °C, відфільтровують осад, промивають водою, сушать. Отримують 20,6 г N, N'діетилдитіокарбамату цинку (вихід 98 %) з температурою плавл. 175-176 °C. Приклад 13 ілюструє отримання на основі N, N'-діетилдитіокарбамату калію N, N'діетилдитіокарбамату цинку (рівняння 3, М=К). Він виконується по способу, наведеному у прикладі 12, але замість N, N'-діетилдитіокарбамату натрію в масу додається 16,75 г N, N'діетилдитіокарбамату калію у вигляді водного розчину. Отримують 17,16 г N, N'діетилдитіокарбамату цинку (вихід 97 %) з температурою плавл. 174-176 °C. Приклад 14 ілюструє отримання на основі N, N'-діметилдитіокарбамату натрію N, N'диметилдитіокарбамату цинку. S S ZnCl2+2(CH3)2 N [(CH3)2 N SNa C C S]2Zn+2NaCl (4) 25 30 Він виконується по способу, наведеному у прикладі 12, але замість N, N'діетилдитіокарбамату натрію в масу додається 16,75 г N, N'-диметилдитіокарбамату натрію. Отримують 17,16 г N, N'-диметилдитіокарбамату цинку (вихід 97 %) з температурою плавл. 249253 °C. Приклад 15 ілюструє отримання на основі N, N'- діетилдитіокарбамату натрію тетраетилтіурамдисульфіду. S C 2NaNO2+2H2SO4+2(CH3CH2)2 N S +2NO+(CH3CH2)2 N 35 40 C SNa (5) S S S 2Na2SO4+2H2O+ N(CH2CH3)2 C У колбу, забезпечену мішалкою, зворотним водним холодильником, термометром, завантажують 130 г водного розчину N, N'-діетилдитіокарбамату натрію (50 г), отриманого з сірковуглецевмісної фракції; додають 20,14 г нітриту натрію у 100 г води, масу охолоджують до 2-4 °C і поступово по краплях додають 191 г 15 %-ної сірчаної кислоти. Реакційну масу перемішують протягом 2,5 годин, відфільтровують осад, промивають водою, сушать. Отримують 38,7 г (вихід 90 %) тетраетилтіурамдисульфіду, з температурою плавл. 68-71 °C. Приклад 16 ілюструє отримання на основі N, N'-диметилдитіокарбамату натрію тетраметилтіурамдисульфіду. Він виконується по способу, наведеному у прикладі 14, але замість N, N'діетилдитіокарбамату натрію в колбу додається така ж кількість N, N'-диметилдитіокарбамату натрію, 45 4 UA 87746 U S 2NaNO2+2H2SO4+2(CH3)2 N S +2NO+(CH3C)2 N 5 C 2Na2SO4+2H2O+ SNa C (6) S S S C N(CH3)2 24,08 г нітриту натрію у 100 г води, 228,3 г 15 %-ної сірчаної кислоти. Отримують 37,44 г (вихід 89 %) тетраметилтіурамдісульфіду, з температурою плавл. 148-152 °C. Приклад 17 ілюструє отримання на основі N, N'-діетилдитіокарбамату натрію присадки до трансмісійних мастил: CH2Cl CH2Cl (CH3CH2)2N-C-SNa+ C CH2 15 (7) CH3 CH3 10 +NaCl (CH3CH2)2N-C-S-CH2 C У колбу, забезпечену мішалкою, зворотним водним холодильником, термометром, завантажують 450 г водного розчину N, N'-діетилдитіокарбамату натрію (100 г), отриманого з сірковуглецевмісної фракції; додають 71,5 г металилхлориду, видержують при змішуванні при температурі 60-70 °C протягом 4,5 годин. Переносять реакційну масу у ділильну лійку, сепарують водний шар, промивають органічний шар водою. Потім переносять органічний шар у колбу, змінюють зворотний холодильник на прямий та відганяють при температурі 80-150 °C усі летучі сполуки. Масу охолоджують до кімнатної температури та далі використовують як присадку до трансмісійних мастил. У таблицях 4-7 наведені результати випробувань синтезованих карбаматів та тіурамдисульфідів як прискорювачів вулканізації гумових сумішей. Дослідні продукти випробовувалися у базових гумових сумішах в порівнянні з відомими прискорювачами вулканізації. 20 Таблиця 4 Випробування дослідного прискорювача - N, N'-діетилдитіокарбамату натрію Стандартна суміш на основі СКМС-30 Показники Склад: СКМС-30 АРКМ-15 Сульфенамід Ц N, N'-діетилдитіокарбамат натрію Показники випробувань: Твердість по Шору, умови, од. Умовна міцність при розтягуванні, МПа Відносне подовження, % Зміни після старіння у повітрі (100 °C, 24 години): - по твердості, умови, од. - по міцності, % - по подовженню, % Мінімальний крутний момент, Нм Час початку вулканізації, хвилини 5 АРКМ-15 Базовий Дослідний 1 Дослідний 2 100,0 2,0 100,0 0,5 100,0 1,0 60 9,9 240 53 7,2 230 63 10,6 220 -6 -13 -58 15,0 5,5 -7 -13 -52 17,3 2,3 -4 -27 -45 20,0 2,05 UA 87746 U Таблиця 5 Випробування дослідного прискорювача - тетраметилтіурамдисульфіду Стандартна суміш на основі наіриту ДВ Показники Базовий Склад: Наірит ДВ Тіурам Д Тетраметилпурамдисульфід - дослідний Показники випробувань: Умовна міцність при розтягуванні, МПа Відносне подовження, % Остаточне подовження, % Мінімальний крутний момент, Нм Максимальний крутний момент, Нм Час початку вулканізації, хвилини Оптимальний час вулканізації, хвилини Дослідний 100,0 0,5 100,0 0,5 18,4 310 4 35,0 78,0 0,8 4,7 18,3 315 4 36,0 75,0 0,9 4,6 Таблиця 6 Випробування дослідного прискорювача - тетраетилтіурамдисульфіду Стандартна суміш на основі наіриту ДВ Показники Базовий Склад: Натрит ДВ 100,0 Тіурам Е 0,5 Тетраетилтіурамдисульфід - дослідний Показники випробувань: Умовна міцність при розтягуванні, МПа 18,1 Відносне подовження, % 200 Остаточне подовження, % 5 Мінімальний крутний момент, Нм 33,0 Максимальний крутний момент, Нм 72,0 Час початку вулканізації, хвилини 0,9 Оптимальний час вулканізації, хвилини 4,9 Дослідний 100,0 0,5 18,0 295 4 32,0 71,0 0,9 5,0 Таблиця 7 Випробування дослідного прискорювача - N, N'-діетилдитіокарбамату цинку Стандартна суміш на основі СКН - 36 АСМ Показники Базовий Дослідний Склад: СКМ-36АСМ Сірка Стеарин Техвуглець Т-900 Техвуглець П-234 Сульфенамід Ц N, №-діетилдитіокарбамат цинку - дослідний Показники випробувань: Твердість по Шору, умови, од. Умовна міцність при розтягуванні, МПа Відносне подовження при розриві, % Дослідний 100,0 2,0 1,0 15,0 25,0 1,5 6 100,0 2,0 1,0 15,0 25,0 1,0 0,4 67 9,5 160 5 100,0 2,0 1,0 15,0 25,0 1,3 0,2 68 9,8 190 69 10,0 170 UA 87746 U Продовження таблиці 7 Зміни після старіння у повітрі (100 °C, 24 години): - по твердості, умови, од. - по міцності, % - по подовженню, % Час початку вулканізації, хвилини Оптимальний час вулканізації, хвилини 3 35 -10 2,8 5,3 2 -5 -15 2,8 3,6 2 -12 -20 2,0 2,9 У таблиці 8 наведені результати випробувань синтезованої присадки до мастил. Таблиця 8 Випробування дослідної присадки, зробленої по прикладу 16 Показники - Кінематична в'язкість при 50 °C, сСт - Масова доля сірки, % - Масова доля азоту, % - Вміст води, %, не більше - Механічні домішки, %, не більше Базова 2,8-3,4 27-31 6,6-6,9 Сліди 0,05 - Темп, застигання, °C, не вище -50 - Темп, спалаху у відкритому тиглі, °C, не нижче Трибологічні характеристики базового мастила з 5,5 % присадки при 20±5 °C: - Критичне навантаження, н/кгс, не менше - індекс задиру, н/кгс, не менше Навантаження зварювання, н/кгс, не менше Розчинність у мастилах Дослідна 3,2 28,5 6,6 Сліди 0,02 -50 (рухлива) 125 135 100 55 106 60,7 400 447 Повна Повна 5 10 15 20 25 Як видно з таблиць 4-8, усі синтезовані продукти мають показники якості на рівні базових відомих продуктів. Використана Джерела інформації: [1] Справочник резинщика. - М.: Химия, 1971 г. [2] Горбунов Б.Н., Гурвич Я.А., Маслова И.П. Химия и технология стабилизаторов полимерных материалов. - М.: Химия, 1981 г. [3] Кламман Д. Смазки и родственные продукты. Синтез, свойства, применение, международные стандарты. - М.: Химия, 1988 г. [4] Мельников Н.Н. Пестициды. Химия, технология и применение. - М.: Химия, 1987 г. [5] Пеликс А.А., Аранович Б.С, Петров Е.А., Котомкина Р.В. Химия и технология сероуглерода. Л.: Химия, 1986 г. [6] Houben-Weyl. Methoden der Organischen Chemie. Stuttgart: Georg Thieme, 1955. B.IX. [7] Справочник коксохимика - M: Металлургия, 1966. – Т.3. [8] Лейбович Р.Е., Яковлева Б.И., Филатов А.Б. Технология коксохимического производства. - М.: Металлургия, 1982 г. [9] Гомельский А. 3. Аппаратчики коксохимических производств. X. - М.: ГОНТИ литературы по черной и цветной металлургии, 1953 г. [10] Коляндр М.Я. Переработка сырого бензола. - М.: Металлургия, 1960 г. ФОРМУЛА КОРИСНОЇ МОДЕЛІ Спосіб отримання солей дитіокарбамінових кислот реакцією тіоацилування амінів у присутності або у відсутності луга згідно з рівняннями (1, 2): 7 UA 87746 U S R' N 2 R'N(H)R''+CS2 C + - HN S 2 R' (1) R'' R'' S R' N R'N(H)R''+MOH+CS2 C S M+ (2) R'' де M=Na, K; R', R''=H, -CH3, -CH2CH3, цикло-(CH2)5, 5 10 який відрізняється тим, що як тіоацилюючий агент використовують сірковуглецевмісну фракцію, отриману при переробці сирого коксохімічного бензолу, яка має склад, мас. %: сірковуглець 5-50 бензол 28-67 насичені та ненасичені вуглеводні та домішки 10-50 цикло- і дициклопентадієн 5-30, з подальшим відділенням бензольного шару, який не містить сірковуглецю, та виділенням солей дитіокарбамінових кислот звичними методами. 2. Спосіб за п. 1, який відрізняється тим, що при тіоацилуванні використовують аміни, які мають таку основність, що достатня для отримання стійких солей дитіокарбамінових кислот, у тому числі, діетиламін, диметиламін, піперидин. 3. Спосіб за п. 1, який відрізняється тим, що тіоацилування проводять у присутності лужних агентів, у тому числі, їдкого натру, їдкого калію, отримуючи відповідні солі дитіокарбамінових кислот. 15 Комп’ютерна верстка І. Мироненко Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 8
ДивитисяДодаткова інформація
Автори англійськоюSHTEINBERH LEON YAKOVYCH
Автори російськоюШТЕЙНБЕРГ ЛЕОН ЯКОВЛЕВИЧ
МПК / Мітки
МПК: C07C 333/00
Мітки: кислот, отримання, дитіокарбамінових, спосіб, солей
Код посилання
<a href="https://ua.patents.su/10-87746-sposib-otrimannya-solejj-ditiokarbaminovikh-kislot.html" target="_blank" rel="follow" title="База патентів України">Спосіб отримання солей дитіокарбамінових кислот</a>
Попередній патент: Плазмовий реактор з магнітною системою
Наступний патент: Плазмовий пристрій нанесення багатошарових плівкових покриттів
Випадковий патент: Вантова система