Таблетка леветирацетаму тривалого вивільнення
Номер патенту: 89216
Опубліковано: 11.01.2010
Автори: Раічандані Йогеш, Джоші Маянк, Кширсагар Раджеш
Формула / Реферат
1. Таблетка тривалого вивільнення леветирацетаму з ядром, що складається з близько 30 % вага/вага до близько 85 % вага/вага леветирацетаму і від близько 1 % вага/вага до близько 55 % вага/вага гідрофільного полімеру, що регулює швидкість, і необов'язково від близько 1 % до близько 5 % за вагою повідону, причому гідрофільний полімер, що регулює швидкість, має в'язкість більш ніж 15 cps у 2 % вага/вага розчині та вибраний з гідроксіетилцелюлози, гідроксипропілцелюлози, ксантанової камеді, гуарової камеді, камеді ріжкового дерева, полівінілового спирту, гідроксипропілметилцелюлози або їх сумішей, причому ядро таблетки факультативно покрито функціональним покриттям від близько 1 % вага/вага до 15 % вага/вага ядра, що включає комбінацію гідрофобного та/або гідрофільного полімеру.
2. Таблетка тривалого вивільнення леветирацетаму з ядром, що складається з близько 30 % вага/вага до близько 85 % вага/вага леветирацетаму і від близько 1 % вага/вага до близько 50 % вага/вага гідрофільного полімеру, що регулює швидкість, і необов'язково від близько 1 % до близько 5 % за вагою повідону, причому гідрофільний полімер, що регулює швидкість, має в'язкість більш ніж 15 cps у 2 % вага/вага розчині та вибраний з гідроксіетилцелюлози, гідроксипропілцелюлози, ксантанової камеді, гуарової камеді, камеді ріжкового дерева, полівінілового спирту, гідроксипропілметилцелюлози або їх сумішей, причому ядро таблетки має функціональне покриття від близько 1 % вага/вага до 15 % вага/вага ядра з зазначеним функціональним покриттям, що включає комбінацію гідрофобного та/або гідрофільного полімеру.
3. Таблетка тривалого вивільнення леветирацетаму за п. 1 або 2, яка забезпечує піковий рівень в сироватці крові леветирацетаму протягом від близько восьми до близько шістнадцяти годин, коли пацієнт, що цього потребує, приймає її орально, і забезпечує тривалі терапевтично ефективні рівні в сироватці за період більше двадцяти чотирьох годин зі зменшеними проявами психоневрологічних побічних ефектів шляхом видалення мінімумів і піків концентрації лікарського засобу в сироватці крові у пацієнтів.
4. Таблетка тривалого вивільнення за п. 1 або 2, де таблетка включає від близько 50 % до 80 % леветирацетаму за вагою, від близько 20 % до близько 40 % гідроксипропілметилцелюлози за вагою і факультативно від близько 1 % до близько 5 % за вагою повідону.
5. Таблетка тривалого вивільнення за п. 1 або 2, де ядро таблетки включає від близько 50 % до 80 % леветирацетаму за вагою, від близько 20 % до близько 40 % гідроксипропілметилцелюлози за вагою і факультативно від близько 1 % до близько 5 % за вагою повідону, а ядро покрите функціональним покритгям, що містить етилцелюлозу і гідроксипропілметилцелюлозу.
6. Таблетка тривалого вивільнення за п. 5, де ядро покрите функціональним покриттям від близько 1 % до близько 12 % загальної ваги таблетки, що містить від близько 70 % до близько 80 % ваги функціонального покриття етилцелюлози і від близько 20 % до близько 30 % ваги функціонального покриття гідроксипропілметилцелюлози.
7. Таблетка тривалого вивільнення за п. 5, де ядро покрите функціональним покриттям від близько 1 % до близько 12 % загальної ваги таблетки, що містить етилцелюлози від близько 70 % до близько 80 % ваги функціонального покриття і лактози від близько 20 % до близько 30 % за вагою функціонального покриття лактози.
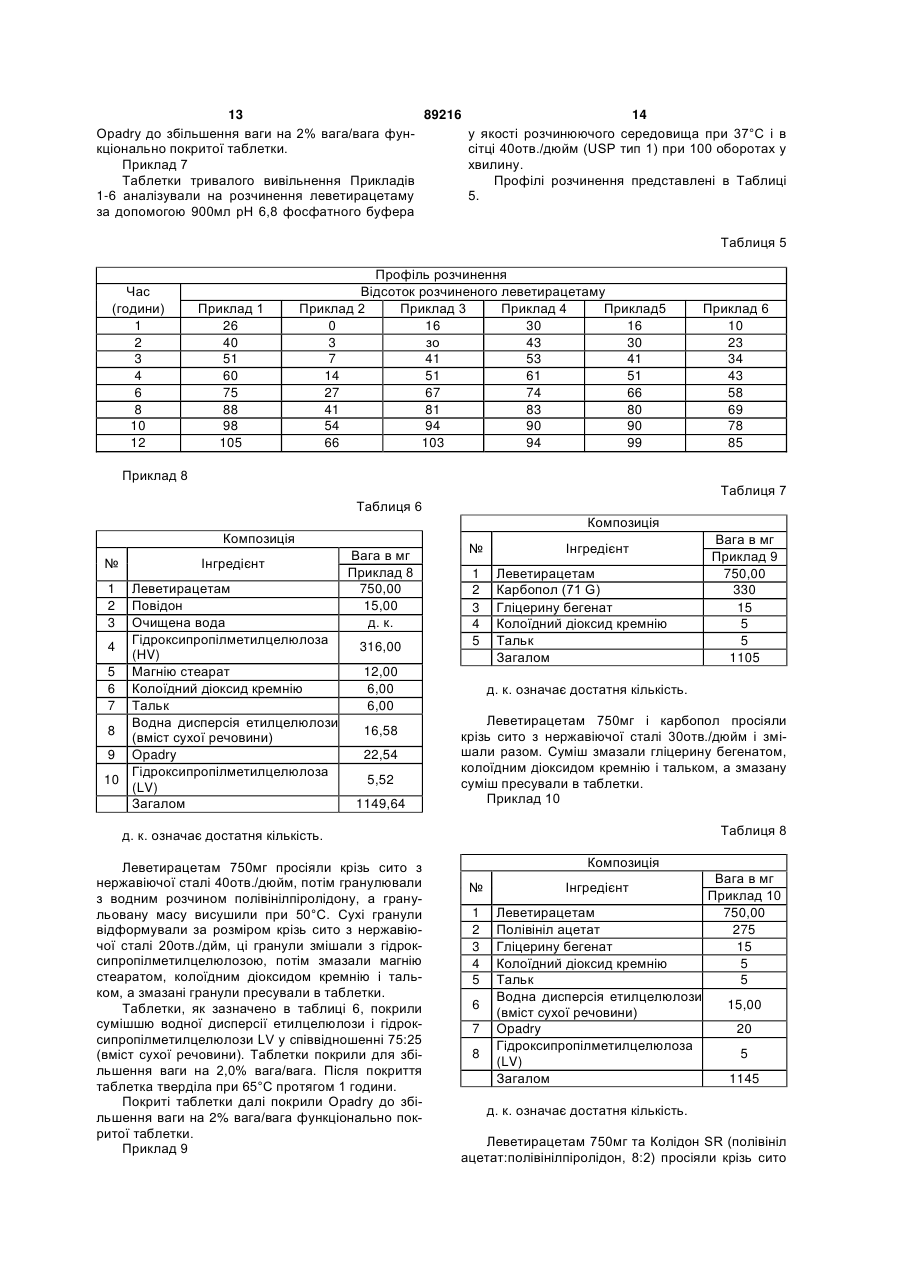
8. Таблетка тривалого вивільнення леветирацетаму за п. 1 або 2, що має наступний профіль розчинення в апараті 1 USP (кошик) при 100 оборотах у хвилину в очищеній воді при 37 °С:
Час (години) Середній % вивільнення леветирацетаму
2 ≤44
4 35-75
12 >75.
9. Таблетка тривалого вивільнення за п. 1 або 2, де таблетка включає леветирацетаму від близько 61 % до 73 % ваги, гідроксипропілметилцелюлози від близько 25 % до близько 35 % ваги, причому факультативно повідону від близько 1,1 % до близько 1,5 % ваги.
10. Таблетка тривалого вивільнення за п. 1 або 2, де ядро таблетки включає леветирацетаму від близько 61 % до 73 % ваги, гідроксипропілметилцелюлози від близько 25 % до близько 35 % ваги і факультативно повідону від близько 1,1 % до близько 1,5 % ваги, причому ядро покрите функціональним покриттям, що містить етилцелюлозу і гідроксипропілметилцелюлозу.
11. Таблетка тривалого вивільнення за п. 10, де ядро покрите функціональним покриттям від близько 1,5 % до близько 4,8 % загальної ваги таблетки, що містить етилцелюлози близько 75 % ваги функціонального покриття і гідроксипропілметилцелюлози близько 25 % ваги функціонального покриття.
12. Таблетка тривалого вивільнення за п. 1 або 2, де функціональне покриття складає 1-6 % загальної ваги таблетки.
13. Таблетка тривалого вивільнення за п. 5, де функціональне покриття включає етилцелюлозу, що містить 44,0-51,0 % етоксигруп і гідроксипропілметилцелюлозу, що має в'язкість 2-6 cps у 2 % водному розчині, і що містить 28,0-30,0 % метоксигруп та 7,0-12,0 % гідроксипропоксигруп.
14. Таблетка тривалого вивільнення за п. 1 або 2, де ядро отримують вологою грануляцією, сухою грануляцією або прямим пресуванням, і факультативно ядро таблетки покривають або у ванні для нанесення покриття, або в системі із шаром, що рухається.
15. Таблетка тривалого вивільнення за п. 1 або 2, що має наступний профіль розчинення в апараті 1 USP (кошик) при 100 оборотах у хвилину в очищеній воді при 37 °С:
Час (години) Середній % вивільнення леветирацетаму
2 10-44
4 35-75
12 >80.
16. Таблетка тривалого вивільнення за п. 1 або 2, що додатково покрита гідрофільним полімером для поліпшення її зовнішнього вигляду, причому зазначений полімер знаходиться в готовій суміші, наприклад, OpadryTM.
Текст
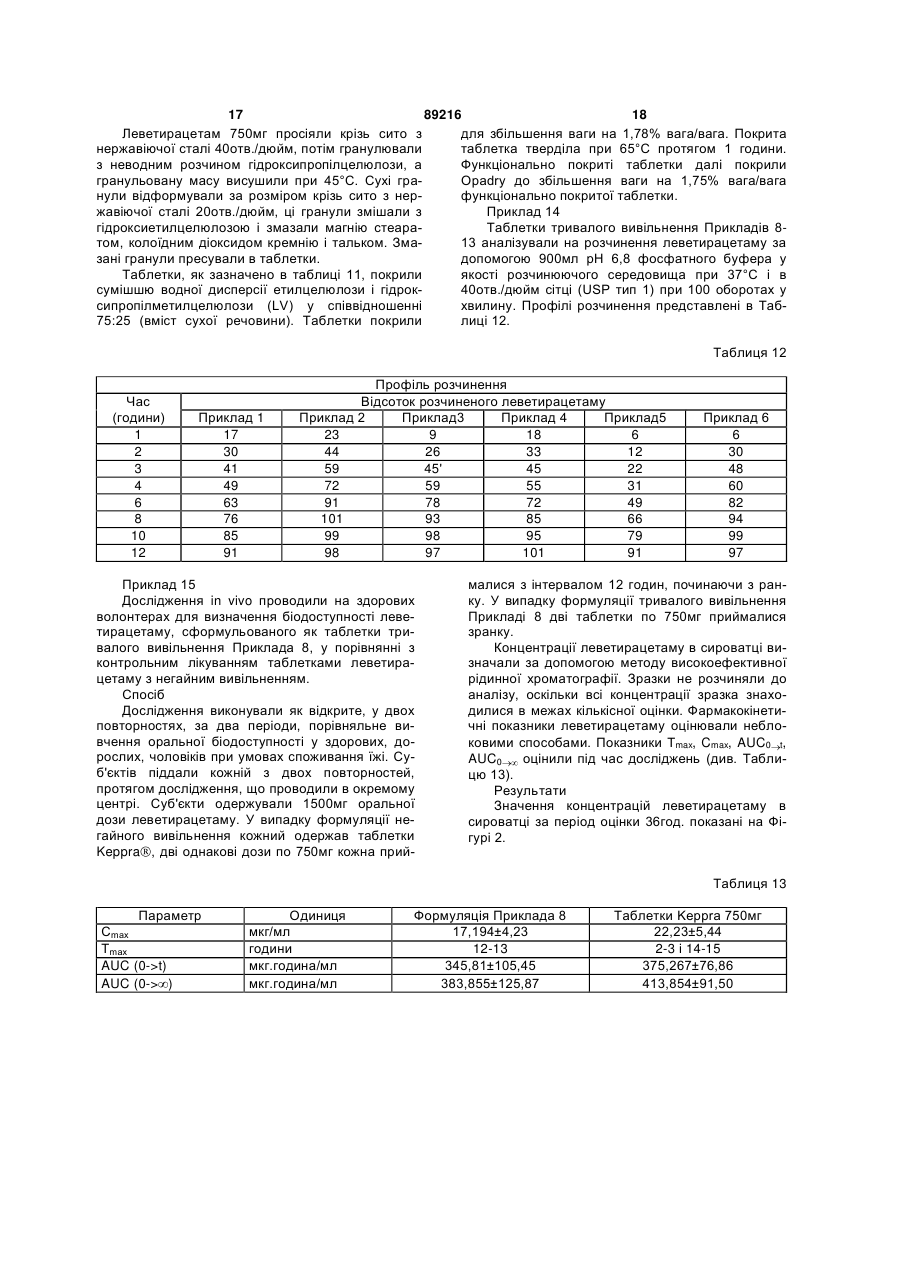
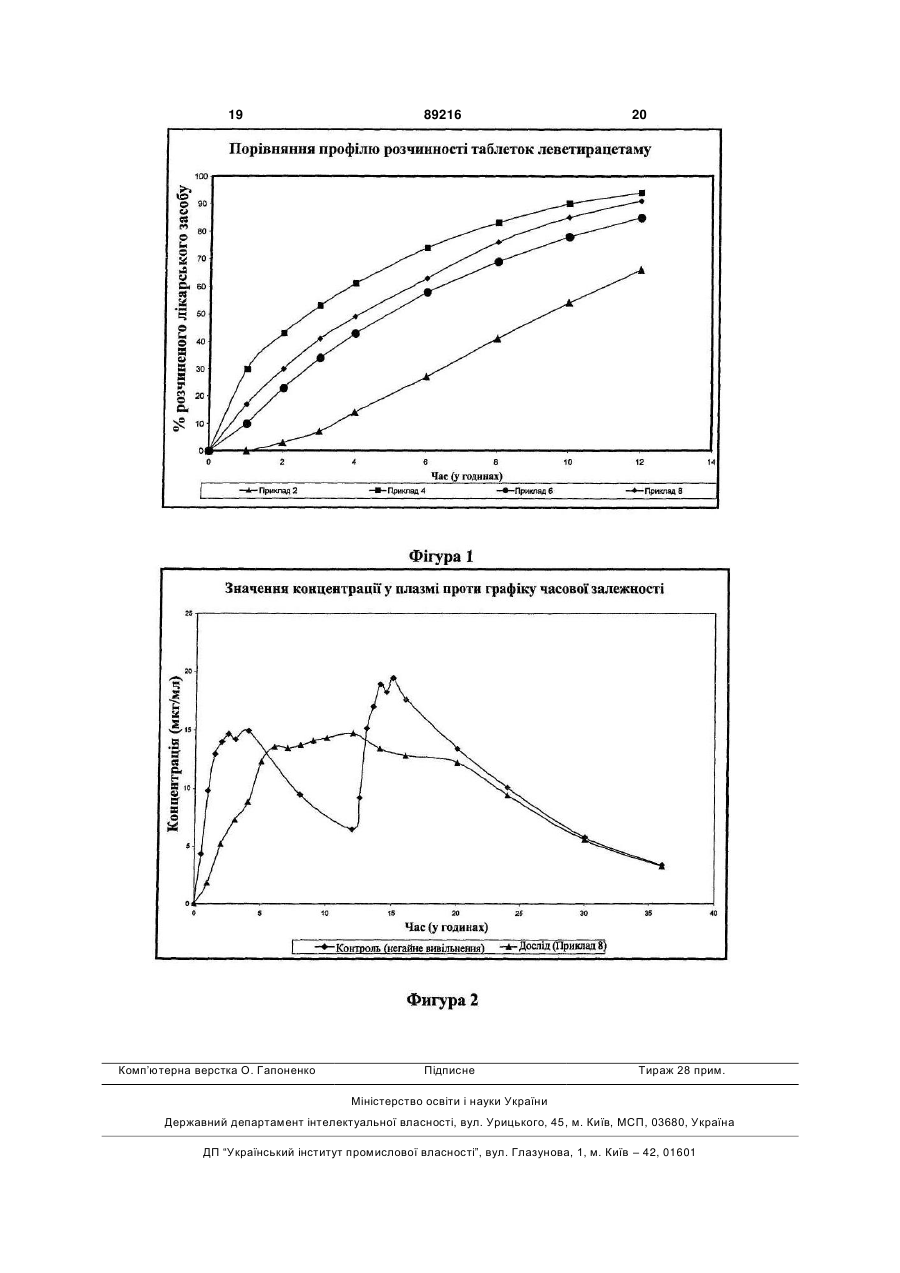
1. Таблетка тривалого вивільнення леветирацетаму з ядром, що складається з близько 30 % вага/вага до близько 85 % вага/вага леветирацетаму і від близько 1 % вага/вага до близько 55 % вага/вага гідрофільного полімеру, що регулює швидкість, і необов'язково від близько 1 % до близько 5 % за вагою повідону, причому гідрофільний полімер, що регулює швидкість, має в'язкість більш ніж 15 cps у 2 % вага/вага розчині та вибраний з гідроксіетилцелюлози, гідроксипропілцелюлози, ксантанової камеді, гуарової камеді, камеді ріжкового дерева, полівінілового спирту, гідроксипропілметилцелюлози або їх сумішей, причому ядро таблетки факультативно покрито функціональним покриттям від близько 1 % вага/вага до 15% вага/вага ядра, що включає комбінацію гідрофобного та/або гідрофільного полімеру. 2. Таблетка тривалого вивільнення леветирацетаму з ядром, що складається з близько 30 % вага/вага до близько 85 % вага/вага леветирацетаму і від близько 1 % вага/вага до близько 50 % вага/вага гідрофільного полімеру, що регулює швидкість, і необов'язково від близько 1 % до близько 5% за вагою повідону, причому гідрофільний полімер, що регулює швидкість, має в'язкість більш ніж 15 cps у 2 % вага/вага розчині та вибраний з гідроксіетилцелюлози, гідроксипропілцелюлози, ксантанової камеді, гуарової камеді, камеді ріжкового дерева, полівінілового спирту, гідроксипропілметилцелюлози або їх сумішей, причому ядро таблетки має функціональне покриття від близько 1 % 2 (19) 1 3 89216 4 Час (години) Середній % вивільнення леве13. Таблетка тривалого вивільнення за п. 5, де тирацетаму функціональне покриття включає етилцелюлозу, 2 ≤44 що містить 44,0-51,0 % етоксигруп і гідроксипропі4 35-75 лметилцелюлозу, що має в'язкість 2-6 cps у 2 % 12 >75. водному розчині, і що містить 28,0-30,0 % метокси9. Таблетка тривалого вивільнення за п. 1 або 2, груп та 7,0-12,0 % гідроксипропоксигруп. де таблетка включає леветирацетаму від близько 14. Таблетка тривалого вивільнення за п. 1 або 2, 61 % до 73 % ваги, гідроксипропілметилцелюлози де ядро отримують вологою грануляцією, сухою від близько 25 % до близько 35 % ваги, причому грануляцією або прямим пресуванням, і факультафакультативно повідону від близько 1,1 % до блитивно ядро таблетки покривають або у ванні для зько 1,5 % ваги. нанесення покриття, або в системі із шаром, що 10. Таблетка тривалого вивільнення за п. 1 або 2, рухається. де ядро таблетки включає леветирацетаму від 15. Таблетка тривалого вивільнення за п. 1 або 2, близько 61 % до 73 % ваги, гідроксипропілметилщо має наступний профіль розчинення в апараті 1 целюлози від близько 25 % до близько 35 % ваги і USP (кошик) при 100 оборотах у хвилину в очищефакультативно повідону від близько 1,1 % до блиній воді при 37 °С: зько 1,5 % ваги, причому ядро покрите функціонаЧас (години) Середній % вивільнення левельним покриттям, що містить етилцелюлозу і гідтирацетаму роксипропілметилцелюлозу. 2 10-44 11. Таблетка тривалого вивільнення за п. 10, де 4 35-75 ядро покрите функціональним покриттям від бли12 >80. зько 1,5 % до близько 4,8 % загальної ваги таблет16. Таблетка тривалого вивільнення за п. 1 або 2, ки, що містить етилцелюлози близько 75 % ваги що додатково покрита гідрофільним полімером функціонального покриття і гідроксипропілметилдля поліпшення її зовнішнього вигляду, причому целюлози близько 25 % ваги функціонального позазначений полімер знаходиться в готовій суміші, криття. наприклад, OpadryTM. 12. Таблетка тривалого вивільнення за п. 1 або 2, де функціональне покриття складає 1-6 % загальної ваги таблетки. Даний винахід стосується фармацевтичної композиції тривалого вивільнення леветирацетаму з режимом прийому один раз на день і способу її одержання. У даній галузі відоме застосування гідрофільних і гідрофобних полімерів з високим коефіцієнтом в'язкості для створення фармацевтичної композиції тривалого або контрольованого вивільнення. Для продовження вивільнення таблетка, що містить лікарський засіб, також включає гідрофільний полімер з високим коефіцієнтом в'язкості. Якщо необхідно, таблетки покривають гідрофобним полімером і агентом, що утворює пори. Як тільки тверда дозована форма входить у контакт із навколишнім середовищем, утворюються пори, і лікарський засіб дифундує через ці пори. Середовище досягає ядра таблетки і викликає гідратацію полімеру, що також регулює вивільнення лікарського засобу. Регулювання швидкості вивільнення сприяє лікуванню, утворюючи постійні рівні в сироватці крові активного інгредієнта і знижуючи частоту введення, що поліпшує дотримання пацієнтом режиму лікування. Даний винахід представляє фармацевтичну композицію таблеток тривалого вивільнення леветирацетаму, придатних для введення людям один раз на день. Леветирацетам являє собою (-)-(S)- -етил-2оксо-1-піролідин ацетамід з молекулярною формулою C8Η14Ν2O2 і молекулярною масою 170,21. Леветирацетам являє собою білий або грязнобілий кристалічний порошок та має розчинність у воді 104г/мл. Він добре розчиняється в хлорофор мі (65,3г/100мл) і в метанолі (53,6г/100мл), розчиняється в етанолі (16,5г/100мл), слабко розчиняється в ацетонітрилі (5,7г/100мл) і практично не розчиняється в n-гексані. Леветирацетам описаний у патентах США 4,837,223, 4,943,639 і 6,107,492. Леветирацетам призначають як додаткову терапію при лікуванні припадків, що часто виявляються, у дорослих з епілепсією. Точний механізм(и) дії протиепілептичного ефекту леветирацетаму не відомий і, здається, не є причиною будь-якої взаємодії з відомими механізмами, включеними в інгібіторну і збудливу нейротрансмісію. Леветирацетам швидко абсорбується із 100% оральною біодоступністю. Їжа не впливає на тривалість абсорбції леветирацетаму, але знижує Сmах на 20% і затримує Тmах на 1,5 години. Фармакокінетичні показники леветирацетаму є лінійними при діапазоні дози 500-5000мг зі стійкими кінетичними показниками, що досягаються через 2 дні після багаторазового прийому двічі на день. Він зв'язаний не менш чим на 10% із сироватковими білками. Період напіввиведення леветирацетаму з сироватки складає 7±1 годин зі значенням розподілу 0,6л/кг. Загальний кліренс організму складає 0,9мл/хвилина/кг, а нирковий кліренс 0,6мл/хвилина/кг. Його виведення корелює з кліренсом креатиніну. Не спостерігають залежність від віку, статі, раси або часу доби. В даний час леветирацетам призначають дорослим як традиційні таблетки з негайним вивільненням. Сучасний режим прийому включає введення двічі на день. Леветирацетам прийнятний у 5 89216 6 якості препарату негайного вивільнення і схвалелеветирацетаму, яка включає леветирацетам, ний для продажу в різних країнах, включаючи факультативно агент, що зв'язує, гідрофільний Сполучені Штати Америки, під торговою маркою полімер, що регулює швидкість, і традиційні фармацевтично прийнятні наповнювачі; суміш пресуKEPPRA (UCB Pharma). KEPPRA доступний з ють у таблетку, а сформовану таблетку додатково вмістом 250, 500 і 750мг у вигляді таблетованої покривають функціональним покриттям, що місформуляції негайного вивільнення. тить гідрофобний полімер, що регулює швидкість. У біофармацевтичній класифікаційній системі Функціональне покриття факультативно включає він відноситься до Класу І, оскільки добре розчиагент, що утворює канали, яким може бути гідроняється (1,04г/мл), є високо водопроникним фільний полімер або розчинна у воді речовина. (F>90%), і >85% кількості таблетки вивільняється Крім того, композиція може бути покрита функціоза 15 хвилин у трьох середовищах з різною рН. нальним покриттям на основі полімеру. КомпоненКлінічно, він не належить ні до якого конкретного ти вибрані таким чином, щоб забезпечувати тритерапевтичного класу, оскільки має відносно низьвале вивільнення леветирацетаму певним кий показник токсичності і відносно високий тераспособом. певтичний індекс. Переважно даний винахід стосується формуРежим прийому двічі на день для таблеток леляції тривалого вивільнення, що включає від бливетирацетаму негайного вивільнення добре перезько 30% вага/вага до близько 85% вага/вага леноситься з незначними проявами психоневрологіветирацетаму, від близько 1% вага/вага до чних побічних ефектів, таких як сонливість, утома, близько 50% вага/вага гідрофільного полімеру і труднощі координації і відхилення у поведінці. Пофакультативно від близько 1% вага/вага до близьбічний ефект пропорційний рівню лікарського зако 10% вага/вага агента, що зв'язує. Згадана вага собу в сироватці, і тому даний винахід розглядає стосується ваги ядер таблеток. Таблетка, крім тополіпшення терапевтичної ефективності, зниження го, функціонально покрита гідрофобним полімепроявів побічних ефектів і поліпшення дотримуром, що включає від близько 2% вага/вага до бливання пацієнтом режиму один раз на день із тризько 15% вага/вага ваги ядра таблетки. Покриття валим вивільненням. факультативно включає агент, що утворить канаWO01/51033 стосується твердої фармацевтили, від близько 10% вага/вага до близько 60% вачної сполуки, яку можна вводити орально, що дога/вага загальної ваги шару покриття. Крім того, зволяє регулювати вивільнення, щонайменше, покрита таблетка має нефункціональне покриття, однієї активної речовини, яка може бути леветищо складає від близько 1% вага/вага до 3% варацетамом, що містить гомогенну суміш, яка га/вага загальної ваги композиції. включає активну речовину, щонайменше, одного Більш переважно даний винахід стосується матричного наповнювача від 5 до 95% загальної формуляції тривалого вивільнення, що включає ваги сполуки, вибраного з інертних матриць, гідвід близько 50% вага/вага до близько 75% варофільних або ліпідних матриць, сумішей інертних га/вага леветирацетаму, від близько 0,5% до блиі ліпідних матриць, сумішей гідрофільних і інертних зько 5% полівінілпіролідону, від близько 20% ваматриць; щонайменше, одного ентеро-розчинного га/вага до близько 45% вага/вага полімеру від 2 до 50% загальної ваги сполуки і, гідроксипропілметилцелюлози. Функціональне щонайменше, одного агента, що його підлужили покриття на таблетках включає від близько 2% розчинного у водній фазі в умовах фізіологічної вага/вага до близько 5% вага/вага загальної ваги рН, щонайменше, 0,5-50% загальної ваги сполуки. композиції. Покриття включає від близько 50% WO/03/101428 представляє спосіб одержання вага/вага до близько 80% вага/вага етилцелюлози, фармацевтичної сполуки з уповільненим вивільяк функціональний полімер, і від близько 15% ваненням активного компонента, який може бути га/вага до близько 35% вага/вага гідроксипропіллеветирацетамом. Суміш активної речовини і пометилцелюлози, як агента, що утворює канали. лімеру, що забезпечує уповільнене вивільнення, За даним винаходом формуляцію тривалого пресують, пропускаючи її через два валки з темвивільнення готують пресуванням матричної табпературою більш ніж 40°С, а прикладена на неї летки, з наступним нанесенням функціонального сила пресування складає більш ніж 15-40кН/см покриття, зазначений спосіб включає етапи, при ширини валка. Пресовану суміш опудрюють до яких: бажаного розміру часток і, якщо необхідно, процес і. змішують леветирацетам або його гранули, повторюють. приготовлені сухою або вологою грануляцією з Ціль даного винаходу полягає в забезпеченні полімером, що регулює швидкість; фармацевтичної композиції тривалого вивільнення іі. змазують змішану суміш і пресують у таблелеветирацетаму, що при прийомі приводить до тки прийнятної форми; рівнів у сироватці крові, які виявляють ефект плаііі. покривають таблетки водною дисперсією то, протягом тривалого періоду часу. нерозчинного у воді і розчинного у воді полімеру; Інша мета даного винаходу полягає в одерiv. покривають таблетки водною дисперсією жанні фармацевтичної композиції, що вивільняє нефункционального покриваючого полімеру. леветирацетам установленим способом. Фігура 1 являє собою графік, на якому показаЩе одна мета даного винаходу полягає в заний профіль вивільнення лікарського засобу левебезпеченні фармацевтичної композиції тривалого тирацетаму з чотирьох різних композицій лікарсьвивільнення леветирацетаму з режимом прийому кого засобу в матрицях з використанням апарата один раз на день. типу 1 USP (Фармакопея Сполучених Штатів АмеДаний винахід стосується способу одержання рики), 100 оборотів у хвилину і при 37°С. фармацевтичної композиції тривалого вивільнення 7 89216 8 Фігура 2 являє собою графік порівняльного За варіантом здійснення даного винаходу акпрофілю рівня в сироватці леветирацетаму при тивні гранули змішують з гідрофільним полімером, прийомі з їжею у здорових волонтерів. що регулює швидкість, з високим ступенем в'язкоЗа варіантом здійснення даного винаходу табсті, як частиною матричної системи. Високий стулетка тривалого вивільнення включає активний пінь в'язкості означає в'язкість більш ніж 15 cps у інгредієнт і розчинний у воді полімер, що регулює 2% вага/вага розчині. Гідрофільний полімер, що швидкість, і факультативно традиційні наповнюварегулює швидкість, у матричній системі включає чі, включаючи агент, що зв'язує. Ці таблетки покгідроксиетилцелюлозу, гідроксипропілцелюлозу, риті комбінацією нерозчинного у воді полімеру. альгінат натрію, карбомер (Карбопол ), натрію Покриття факультативно включає розчинний у воді карбоксиметилцелюлозу, ксантанову камедь, гуаполімер або таку речовину як агент, що утворює рову камедь, камедь ріжкового дерева, полівінілаканали. Функціонально покриті таблетки, крім того, цетат, полівініловий спирт і гідроксипропілметилпокриті розчинними у воді полімером у якості нецелюлозу (з високим ступенем в'язкості). Полімер, функціонального покриття. що утворює матрицю, включає від близько 1% до За варіантом здійснення даного винаходу заблизько 50%, переважно від близько 20% до блистосовується активний інгредієнт, що включає або зько 40% за вагою покритої композиції тривалого не включає агент, що зв'язує, якщо морфологія вивільнення. кристалів сприяє прямому пресуванню. Однак, На додаток до згаданих вище інгредієнтів табякщо частки не сприяють прямому пресуванню, і летки тривалого вивільнення, як описано тут, танеобхідна грануляція, тоді виконують або "суху кож містять речовину, що змазує, антиадгезив та грануляцію", або "вологу грануляцію". Спосіб сухої речовину, що сприяє плинності. Антиадгезиви грануляції включає змішування лікарського засобу включають, магнію стеарат, тальк, кальцію стеаз агентом, що зв'язує, або безпосередньо з гідрорат, гліцерину бегенат, поліетиленгліколі, гідрогефільним полімером, що регулює швидкість вивільнізовану рослинну олію, мінеральну олію, стеаринення, або з обома, з наступним формуванням нову кислоту та інші матеріали, відомі фахівцю в заготовки на таблетковому пресі або за допомогою даній галузі. Речовини, що сприяють плинності, валкових ущільнювачів. Спосіб вологої грануляції включають кукурудзяний крохмаль, тальк, кальцію включає водну або неводну грануляцію. Спосіб силікат, магнію силікат, колоїдний діоксид кремнію, вологої грануляції включає змішування активного кремнію гідрогель та інші матеріали, відомі фахівінгредієнта з "розріджувачем" або сумішшю "розріцю в даній галузі. Речовини, що змазують, вклюджувача" і гідрофільного полімеру, що регулює чають кальцію стеарат, магнію стеарат, натрію швидкість, і грануляцію суміші з масою агента, що стеарил фумарат, гліцерил пальмітостеарат, глізв'язує, для утворення вологої маси з наступним церил стеарат, мінеральну олію, стеаринову киссушінням і обробкою за розміром. Агент, що зв'ялоту, цинку стеарат та інші матеріали, відомі фахізує, можна факультативно змішувати із сухою сувцю в даній галузі. Речовини, що сприяють мішшю, а грануляцію виконувати з водним або плинності, речовини, що змащують, та антиадгеневодним розчинником. Розчинник для неводної зиви окремо присутні в діапазоні від близько 0,01% грануляції вибирають з етанолу, ізопропілового до близько 5% вага/вага покритих таблеток. Переспирту і дихлорметану. важно речовини, що сприяють плинності, антиадЗа даним винаходом фармацевтична компогезиви і речовини, що змащують, присутні в діапазиція містить леветирацетам як активний інгредізоні від близько 0,5% до близько 4% ваги покритих єнт. Леветирацетам може бути присутнім у кількотаблеток, або по одному, або в комбінації. сті від близько 40% до близько 80%, більш Сформовані таблетки тривалого вивільнення переважно від близько 50% до близько 75% за покриті покриттям гідрофобного полімеру, що ревагою композиції тривалого вивільнення. гулює швидкість, а покриття полімеру, що регулює За переважним варіантом здійснення даного швидкість, складається з гідрофобного полімеру, винаходу леветирацетам гранулюють за допомогідрофобного або гідрофільного пластифікатора і гою водної грануляції з розчином агента, що зв'ягідрофільного полімеру, що утворює пори (агента, зує. Застосовуваний агент, що зв'язує, надзвичайщо утворює канали). Гідрофобний полімер, що но важливий для додання стискальності, утворює плівку, вибирають із групи, що включає властивостей плинності і щільності/твердості. ефір целюлози, такий як етилцелюлоза, ацетат Агент, що зв'язує, можна вибирати з полівінілпіроцелюлози, полівінілацетат, нейтральний полімер лідону, гідроксипропілцелюлози, гідроксипропілефірів метакрилової кислоти, сополімер полівініметилцелюлози (з низьким ступенем в'язкості), ловогоспирт-малеїнового ангідриду і подібне. Для метилцелюлози, крохмалю, пептизованого крохпокриття, що регулює швидкість, можна застосомалю, модифікованого кукурудзяного крохмалю, вувати комерційно доступну дисперсію плівкоутполіакриламіду, полі-N-вініламіду, натрію карбокворювачів, а саме, Eudragit L-30D, Eudragit NE симетилцелюлози, поліетиленгліколю, желатину, 30D, Aquacoat ECD-30, Surelease E-7, Eudragit RS поліетиленоксиду, поліпропіленгліколю, трагакан30D, Eudragit RL 30D і т. д. Гідрофільний полімер, та, альгінової кислоти, комбінацій цих та інших що утворює пори, у покритті, що регулює швидматеріалів, відомих фахівцю в даній галузі. Агент, кість, вибирають з кополівідону, полівінілпіролідощо зв'язує, може бути присутнім у кількості від ну, поліетиленгліколей, гідроксиетилцелюлози, близько 0,01% до близько 10%, переважно від гідроксипропілметилцелюлози (з низьким ступеблизько 0,5% до близько 5% за вагою композиції нем в'язкості). За актуальним варіантом здійснентривалого вивільнення. ня нерозчинний у воді полімер присутній в кількості від 40% до близько 90%, переважно від близько 9 89216 10 50% до близько 80% за вагою шару функціональза вагою покритих таблеток; факультативно до 5% ного покриття композиції тривалого вивільнення. за вагою гідрофільного полімеру, що утворює поРозчинний у воді полімер, що утворює пори, є ри, покритих таблеток, і факультативно до 2% присутнім у кількості від близько 10% до близько пластифікатора за вагою покритих таблеток. 60%, переважно від близько 15% до близько 35% За даним винаходом нефункціональне покритза вагою шару покриття. Додатково покриваюча тя вибирають із групи готових для формування дисперсія може також включати пластифікатор дисперсії, таких як OPADRY. OPADRY включає для модифікації властивостей і характеристик погідрофільний (з низьким ступенем в'язкості) полілімерів, використовуваних у покритті пресованих мер, що утворює плівку, прийнятний барвник і світаблеток. Пластифікатори за даним винаходом тлонепроникний агент. Світлонепроникний агент можуть включати полімери з низькою молекулярвключає діоксид титана та інші матеріали, відомі ною масою, олігомери, сополімери, олії, невеликі фахівцю в даній галузі. Барвник включає FD&C органічні молекули, поліоли з низькою молекулярЧервоний №3, FD&C Червоний №20, FD&C Жовною масою, що мають аліфатичні гідроксили, платий №6, FD&C Блакитний №2, D&C Зелений №5, стифікатори складноефірного типу, гліколеві ефіD&C Жовтогарячий №5, D&C Червоний №8, карари, поліпропіленгліколь, багатоблочні полімери, мель та оксид заліза, червоний, інші барвні речоодноблочні полімери, поліетиленгліколь з низькою вини F.D. & С. і натуральні барвні агенти, такі як молекулярною масою, цитратні пластифікатори екстракт виноградної шкірочки, порошок червоного складноефірного типу, триацетин, пропіленгліколь буряка, бетакаротин, анато, кармін, куркума, папі гліцерин. Такі пластифікатори можуть також рика та інші матеріали, відомі фахівцю в даній гавключати етиленгліколь, 1,2-бутиленгліколь, 2,3лузі. бутиленгліколь, стиролгліколь, діетиленгліколь, Зрозуміло, що сполуки, застосовувані при триетиленгліколь, тетраетиленгліколь та інші полістворенні фармацевтичної формуляції, звичайно етиленглікольні сполуки, монопропіленгліколь мовідповідають розмаїтості функцій або цілей. Таким ноізопропіловий ефір, пропіленгліколь моноетилочином, якщо сполука, згадана в даному описі, згавий ефір, етиленгліколь моноетиловий ефір, дується тільки один раз або застосовується для діетиленгліколь моноетиловий ефір, сорбітол лакпозначення більш ніж одного терміна в даному тат, етил лактат, бутил лактат, етил гліколят, диописі, то його мету або функцію не слід розглядати бутилсебацинат, ацетилтрибутил цитрат, триетил як обмежену винятково згаданою ціллю(ями) або цитрат, ацетилтриетил цитрат, трибутил цитрат та функцією(ями). аліл гліколят. Також в даній формуляції можна Наступні приклади не слід розглядати як вичевикористовувати комбінацію пластифікаторів. рпні, вони служать ілюстрацією тільки декількох з Композиція за даним варіантом здійснення перебезлічі варіантів здійснення за даним винаходом. важно включає 1,0-10,0% гідрофобного полімеру Приклади 1-2 Таблиця 1 Композиція № 1 2 3 4 5 6 7 Вага в мг Інгредієнт Леветирацетам Повідон Очищена вода Гідроксипропілметилцелюлоза (HV) Магнію стеарат Колоїдний діоксид кремнію Водна дисперсія етилцелюлози (вміст сухої речовини) Загалом Приклад 1 500,00 05,00 д. к. 300,00 10,00 5,00 820 Приклад 2 500,00 05,00 д. к. 300,00 10,00 5,00 24,30 844,30 д. к. означає достатня кількість. Леветирацетам 500мг просіяли крізь сито з нержавіючої сталі 40отв./дюйм, а потім гранулювали з водним розчином полівінілпіролідону і гранульовану масу висушили при 50°С. Сухі гранули відформували за розміром крізь сито з нержавіючої сталі 20отв./дюйм, гранули змішали з гідроксипропілметилцелюлозою, змазали магнію стеара том і колоїдним діоксидом кремнію, а змазані гранули пресували в таблетки. Як зазначено в Таблиці 1, таблетки приклада 2 додатково покриті водною дисперсією гідрофобної етилцелюлози, що регулює швидкість, до збільшення ваги на 2,96% вага/вага пресованої таблетки. Після нанесення функціонального покриття таблетки тверділи при 55°С протягом 1 години. 11 89216 12 льного покриття таблетки тверділи при 55°С протягом 1 години. Приклад 4 Приклад 3 Таблиця 2 Таблиця 3 Композиція № 1 2 3 4 5 6 7 8 Вага в мг Приклад 3 Леветирацетам 500,00 Повідон 05,00 Очищена вода д. к. Гідроксипропілметилцелюлоза (HV) 300,00 Магнію стеарат 10,00 Колоїдний діоксид кремнію 5,00 Водна дисперсія етилцелюлози 35,82 (вміст сухої речовини) Opadry 42,98 Загалом 898,80 Композиція Інгредієнт № Інгредієнт 1 2 3 Леветирацетам Повідон Очищена вода Гідроксипропілметилцелюлоза (HV) Магнію стеарат Колоїдний діоксид кремнію Opadry Тальк Загалом 4 5 6 7 8 Вага в мг Приклад 4 500,00 10,00 д. к. 285,00 10,00 5,00 16,30 5,00 831,30 д. к. означає достатня кількість. д. к. означає достатня кількість. Леветирацетам 500мг просіяли крізь сито з нержавіючої сталі 40отв./дюйм, потім гранулювали з водним розчином полівінілпіролідону, а гранульовану масу висушили при 50°С. Сухі гранули відформували за розміром крізь сито з нержавіючої сталі 20отв./дюйм, гранули змішали з гідроксипропілметилцелюлозою, змазали магнію стеаратом і колоїдним діоксидом кремнію, а змазані гранули пресували в таблетки. Пресовані таблетки покрили сумішшю водної дисперсії етилцелюлози і Opadry до збільшення ваги на 9,60% вага/вага пресованих таблеток. Після нанесення функціона Леветирацетам 500мг просіяли крізь сито з нержавіючої сталі 40отв./дюйм, потім гранулювали з водним розчином полівінілпіролідону, а гранульовану масу висушили при 50°С. Сухі гранули відформували за розміром крізь сито з нержавіючої сталі 20отв./дюйм, гранули змішали з гідроксипропілметилцелюлозою, змазали магнію стеаратом, тальком і колоїдним діоксидом кремнію, та змазані гранули пресували в таблетки. Пресовані таблетки покрили Opadry до збільшення ваги на 2% вага/вага пресованих таблеток. Приклади 5-6 Таблиця 4 Композиція № 1 2 3 4 5 6 7 8 9 10 Вага в мг Інгредієнт Леветирацетам Повідон Очищена вода Гідроксипропілметилцелюлоза (HV) Магнію стеарат Колоїдний діоксид кремнію Водна дисперсія етилцелюлози (вміст сухої речовини) Opadry Тальк Гідроксипропілметилцелюлоза (LV) Загалом Приклад 5 500,00 10,00 д. к. 285,00 10,00 5,00 15,28 16,71 5,00 5,10 852,09 Приклад 6 500,00 10,00 д. к. 285,00 10,00 5,00 30,56 17,12 5,00 10,19 872,87 д. к. означає достатня кількість. Леветирацетам 500мг просіяли крізь сито з нержавіючої сталі 40отв./дюйм, потім гранулювали з водним розчином полівінілпіролідону, а гранульовану масу висушили при 50°С. Сухі гранули відформували за розміром крізь сито з нержавіючої сталі 20отв./дюйм, ці гранули змішали з гідроксипропілметилцелюлозою, змазали магнію стеаратом, тальком і колоїдним діоксидом кремнію, а змазані гранули пресували в таблетки. Таблетки прикладів 5 і 6, як зазначено в таблиці 4, покрили сумішшю водної дисперсії етилцелюлози і гідроксипропілметилцелюлози (LV; низька в'язкість) у співвідношенні 75:25 (вміст сухої речовини). Таблетки покрили для збільшення ваги на 2,5% вага/вага і 5,0% вага/вага пресованих таблеток прикладу 5 і прикладу 6, відповідно. Після покриття таблетка тверділа при 65°С протягом 1 години. Покриті таблетки далі покрили 13 89216 14 Opadry до збільшення ваги на 2% вага/вага фуну якості розчинюючого середовища при 37°С і в кціонально покритої таблетки. сітці 40отв./дюйм (USP тип 1) при 100 оборотах у Приклад 7 хвилину. Таблетки тривалого вивільнення Прикладів Профілі розчинення представлені в Таблиці 1-6 аналізували на розчинення леветирацетаму 5. за допомогою 900мл рН 6,8 фосфатного буфера Таблиця 5 Час (години) 1 2 3 4 6 8 10 12 Приклад 1 26 40 51 60 75 88 98 105 Профіль розчинення Відсоток розчиненого леветирацетаму Приклад 2 Приклад 3 Приклад 4 Приклад5 0 16 30 16 3 зо 43 30 7 41 53 41 14 51 61 51 27 67 74 66 41 81 83 80 54 94 90 90 66 103 94 99 Приклад 6 10 23 34 43 58 69 78 85 Приклад 8 Таблиця 7 Таблиця 6 Композиція Композиція № Інгредієнт Леветирацетам Повідон Очищена вода Гідроксипропілметилцелюлоза 4 (HV) 5 Магнію стеарат 6 Колоїдний діоксид кремнію 7 Тальк Водна дисперсія етилцелюлози 8 (вміст сухої речовини) 9 Opadry Гідроксипропілметилцелюлоза 10 (LV) Загалом 1 2 3 Вага в мг Приклад 8 750,00 15,00 д. к. 316,00 12,00 6,00 6,00 16,58 22,54 5,52 1149,64 № 1 2 3 4 5 Інгредієнт Леветирацетам Карбопол (71 G) Гліцерину бегенат Колоїдний діоксид кремнію Тальк Загалом д. к. означає достатня кількість. Леветирацетам 750мг і карбопол просіяли крізь сито з нержавіючої сталі 30отв./дюйм і змішали разом. Суміш змазали гліцерину бегенатом, колоїдним діоксидом кремнію і тальком, а змазану суміш пресували в таблетки. Приклад 10 Таблиця 8 д. к. означає достатня кількість. Леветирацетам 750мг просіяли крізь сито з нержавіючої сталі 40отв./дюйм, потім гранулювали з водним розчином полівінілпіролідону, а гранульовану масу висушили при 50°С. Сухі гранули відформували за розміром крізь сито з нержавіючої сталі 20отв./дйм, ці гранули змішали з гідроксипропілметилцелюлозою, потім змазали магнію стеаратом, колоїдним діоксидом кремнію і тальком, а змазані гранули пресували в таблетки. Таблетки, як зазначено в таблиці 6, покрили сумішшю водної дисперсії етилцелюлози і гідроксипропілметилцелюлози LV у співвідношенні 75:25 (вміст сухої речовини). Таблетки покрили для збільшення ваги на 2,0% вага/вага. Після покриття таблеткатверділа при 65°С протягом 1 години. Покриті таблетки далі покрили Opadry до збільшення ваги на 2% вага/вага функціонально покритої таблетки. Приклад 9 Вага в мг Приклад 9 750,00 330 15 5 5 1105 Композиція № Інгредієнт 1 2 3 4 5 Леветирацетам Полівініл ацетат Гліцерину бегенат Колоїдний діоксид кремнію Тальк Водна дисперсія етилцелюлози (вміст сухої речовини) Opadry Гідроксипропілметилцелюлоза (LV) Загалом 6 7 8 Вага в мг Приклад 10 750,00 275 15 5 5 15,00 20 5 1145 д. к. означає достатня кількість. Леветирацетам 750мг та Колідон SR (полівініл ацетат:полівінілпіролідон, 8:2) просіяли крізь сито 15 89216 з нержавіючої сталі 30отв./дюйм і змішали разом. Суміш змазали гліцерину бегенатом, колоїдним діоксидом кремнію і тальком, а змазану суміш пресували в таблетки. Таблетки, як зазначено в таблиці 8, покрили сумішшю водної дисперсії етилцелюлози і гідроксипропілметилцелюлози (LV) у співвідношенні 75:25 (вміст сухої речовини). Таблетки покрили для збільшення ваги на 1,90% вага/вага непокритих таблеток. Після покриття таблетка тверділа при 65°С протягом 1 години. Функціонально покриті таблетки далі покрили Opadry до збільшення ваги на 1,87% вага/вага функціонально покритої таблетки. Приклад 11 Таблиця 9 Інгредієнт 1 Леветирацетам Гідроксипропілметилцелюлоза (HV) Магнію стеарат Колоїдний діоксид кремнію Тальк Водна дисперсія етилцелюлози (вміст сухої речовини) Opadry Гідроксипропілметилцелюлоза (LV) Загалом 2 3 4 5 6 7 8 Таблиця 10 Композиція № Інгредієнт 1 Леветирацетам Гідроксипропілметилцелюлоза (HV) Гідроксипропілцелюлози Магнію стеарат Колоїдний діоксид кремнію Тальк Водна дисперсія етилцелюлози (вміст сухої речовини) Opadry Гідроксипропілметилцелюлоза (LV) Загалом 2 3 4 5 6 7 8 9 Композиція № 16 Вага в мг Приклад 11 750,00 350 12,00 6,00 6,00 15,00 20 5 1164 д. к. означає достатня кількість. Леветирацетам 750мг і гідроксилпропілметилцелюлозу (HV) просіяли крізь сито з нержавіючої сталі 40отв./дюйм і змішали разом. Суміш ущільнили за допомогою валкового ущільнювача (Chilsonator) для утворення заготовок. Заготовки відформували за розміром у вібраційному грануляторі за допомогою сита з нержавіючої сталі 20отв./дюйм. Отримані гранули змазали магнію стеаратом, колоїдним діоксидом кремнію і тальком. Змазану суміш пресували в таблетки. Таблетки, як зазначено в таблиці 9, покрили сумішшю водної дисперсії етилцелюлози і гідроксипропілметилцелюлози (LV) у співвідношенні 75:25 (вміст сухої речовини). Таблетки покрили для збільшення ваги на 1,78% вага/вага непокритих таблеток. Після покриття таблетка тверділа при 65°С протягом 1 години. Функціонально покриті таблетки далі покрили Opadry до збільшення ваги на 1,75% вага/вага функціонально покритої таблетки. Приклад 12 Вага в мг Приклад 12 750,00 271 45,00 12,00 6,00 6,00 15,00 20 5 1164 д. к. означає достатня кількість. Леветирацетам 750мг і гідроксилпропілметилцелюлозу (HV) просіяли крізь сито з нержавіючої сталі 40отв./дюйм і змішали разом. Суміш гранулювали неводною грануляцією за допомогою гідроксипропілцелюлози як агента, що зв'язує. Гранульовану масу висушили при 45°С. Сухі гранули відформували за розміром крізь сито з нержавіючої сталі 20отв./дюйм, а гранули змазали магнію стеаратом, тальком і колоїдним діоксидом кремнію. Змазану суміш пресували в таблетки. Таблетки, як зазначено в таблиці 10, покрили сумішшю водної дисперсії етилцелюлози і гідроксипропілметилцелюлози LV у співвідношенні 75:25 (вміст сухої речовини). Таблетки покрили для збільшення ваги на 1,78% вага/вага непокритих таблеток. Після покриття таблетка тверділа при 65°С протягом 1 години. Покриті таблетки далі покрили Opadry до збільшення ваги на 1,75% вага/вага функціонально покритої таблетки. Приклад 13 Таблиця 11 Композиція № Інгредієнт 1 2 3 4 5 6 Леветирацетам Гідроксипропілцелюлози Гідроксиетилцелюлоза Магнію стеарат Колоїдний діоксид кремнію Тальк Водна дисперсія етилцелюлози (вміст сухої речовини) Opadry Гідроксипропілметилцелюлоза (LV) Загалом 7 8 9 д. к. означає достатня кількість. Вага в мг Приклад 13 750,00 45,00 271 12,00 6,00 6,00 15,00 20 5 1164 17 89216 18 Леветирацетам 750мг просіяли крізь сито з для збільшення ваги на 1,78% вага/вага. Покрита нержавіючої сталі 40отв./дюйм, потім гранулювали таблетка тверділа при 65°С протягом 1 години. з неводним розчином гідроксипропілцелюлози, а Функціонально покриті таблетки далі покрили гранульовану масу висушили при 45°С. Сухі граOpadry до збільшення ваги на 1,75% вага/вага нули відформували за розміром крізь сито з нерфункціонально покритої таблетки. жавіючої сталі 20отв./дюйм, ці гранули змішали з Приклад 14 гідроксиетилцелюлозою і змазали магнію стеараТаблетки тривалого вивільнення Прикладів 8том, колоїдним діоксидом кремнію і тальком. Зма13 аналізували на розчинення леветирацетаму за зані гранули пресували в таблетки. допомогою 900мл рН 6,8 фосфатного буфера у Таблетки, як зазначено в таблиці 11, покрили якості розчинюючого середовища при 37°С і в сумішшю водної дисперсії етилцелюлози і гідрок40отв./дюйм сітці (USP тип 1) при 100 оборотах у сипропілметилцелюлози (LV) у співвідношенні хвилину. Профілі розчинення представлені в Таб75:25 (вміст сухої речовини). Таблетки покрили лиці 12. Таблиця 12 Час (години) 1 2 3 4 6 8 10 12 Приклад 1 17 30 41 49 63 76 85 91 Профіль розчинення Відсоток розчиненого леветирацетаму Приклад 2 Приклад3 Приклад 4 Приклад5 23 9 18 6 44 26 33 12 59 45' 45 22 72 59 55 31 91 78 72 49 101 93 85 66 99 98 95 79 98 97 101 91 Приклад 15 Дослідження in vivo проводили на здорових волонтерах для визначення біодоступності леветирацетаму, сформульованого як таблетки тривалого вивільнення Приклада 8, у порівнянні з контрольним лікуванням таблетками леветирацетаму з негайним вивільненням. Спосіб Дослідження виконували як відкрите, у двох повторностях, за два періоди, порівняльне вивчення оральної біодоступності у здорових, дорослих, чоловіків при умовах споживання їжі. Суб'єктів піддали кожній з двох повторностей, протягом дослідження, що проводили в окремому центрі. Суб'єкти одержували 1500мг оральної дози леветирацетаму. У випадку формуляції негайного вивільнення кожний одержав таблетки Keppra , дві однакові дози по 750мг кожна прий Приклад 6 6 30 48 60 82 94 99 97 малися з інтервалом 12 годин, починаючи з ранку. У випадку формуляції тривалого вивільнення Прикладі 8 дві таблетки по 750мг приймалися зранку. Концентрації леветирацетаму в сироватці визначали за допомогою методу високоефективної рідинної хроматографії. Зразки не розчиняли до аналізу, оскільки всі концентрації зразка знаходилися в межах кількісної оцінки. Фармакокінетичні показники леветирацетаму оцінювали неблоковими способами. Показники Tmax, Cmax, AUC0 t, AUC0 оцінили під час досліджень (див. Таблицю 13). Результати Значення концентрацій леветирацетаму в сироватці за період оцінки 36год. показані на Фігурі 2. Таблиця 13 Параметр Сmах Тmах AUC (0->t) AUC (0-> ) Одиниця мкг/мл години мкг.година/мл мкг.година/мл Формуляція Приклада 8 17,194±4,23 12-13 345,81±105,45 383,855±125,87 Таблетки Keppra 750мг 22,23±5,44 2-3 і 14-15 375,267±76,86 413,854±91,50 19 Комп’ютерна верстка О. Гапоненко 89216 Підписне 20 Тираж 28 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюExtended release formulation of levetiracetam
Автори англійськоюKshirsagar Rajesh, Joshi Mayank, Raichandani Yogesh
Назва патенту російськоюТаблетка леветирацетама продолжительного высвобождения
Автори російськоюКширсагар Раджеш, Джоши Маянк, Раичандани Йогеш
МПК / Мітки
МПК: A61K 9/30, A61P 25/08, A61K 31/4015
Мітки: вивільнення, леветирацетаму, таблетка, тривалого
Код посилання
<a href="https://ua.patents.su/10-89216-tabletka-levetiracetamu-trivalogo-vivilnennya.html" target="_blank" rel="follow" title="База патентів України">Таблетка леветирацетаму тривалого вивільнення</a>
Попередній патент: Спосіб підвищення продуктивності сільськогосподарських культур
Наступний патент: Аналізатор для множини потоків даних в системі зв’язку
Випадковий патент: Спосіб хірургічного лікування низькорозміщених кровоточивих виразок дванадцятипалої кишки