Виділене антитіло до cxcr5
Номер патенту: 104715
Опубліковано: 11.03.2014
Автори: Аллен Елізабет, Камерон Беатріс, Рюч Норман, Міколь Венсан, Борен Ніколя, Лі Рената, Оліджино Томас
Формула / Реферат
1. Виділене антитіло або його фрагмент, які специфічно зв'язуються з позаклітинним доменом CXCR5 людини, де антитіло або його фрагмент включають:
(a) варіабельну область легкого ланцюга, що включає амінокислотну послідовність SEQ ID NO: 11, і варіабельну область важкого ланцюга, що включає амінокислотну послідовність SEQ ID NO: 12;
(b) амінокислотні послідовності RSSKSLLHSSGKTYLY, RMSNLAS, MQHLEYPYT, GFSLIDYGVN, VIWGDGTTY і IVY;
(c) варіабельну область легкого ланцюга, що включає амінокислотну послідовність SEQ ID NO: 13, SEQ ID NO: 14 або SEQ ID NO: 15, і варіабельну область важкого ланцюга, що включає амінокислотну послідовність SEQ ID NO: 16;
(d) амінокислотні послідовності:
(i) RSSKSLLHSSGKTYLY, RLSNLAS, MQHLEYPYT, GFSLIDYGVN, VIWGDGTTY і IVY; або
(ii) RSSKSLLHSSGKTYLY, RLSSNLAS, MQHLEYPYT, GFSLIDYGVN, VIWGDGTTY і IVY;
(e) варіабельну область легкого ланцюга, що включає амінокислотну послідовність SEQ ID NO: 17, SEQ ID NO: 19 або SEQ ID NO: 21, і варіабельну область важкого ланцюга, що включає амінокислотну послідовність SEQ ID NO: 23;
(f) варіабельну область легкого ланцюга, що включає амінокислотну послідовність SEQ ID NO: 28, і варіабельну область важкого ланцюга, що включає амінокислотну послідовність SEQ ID NO: 29;
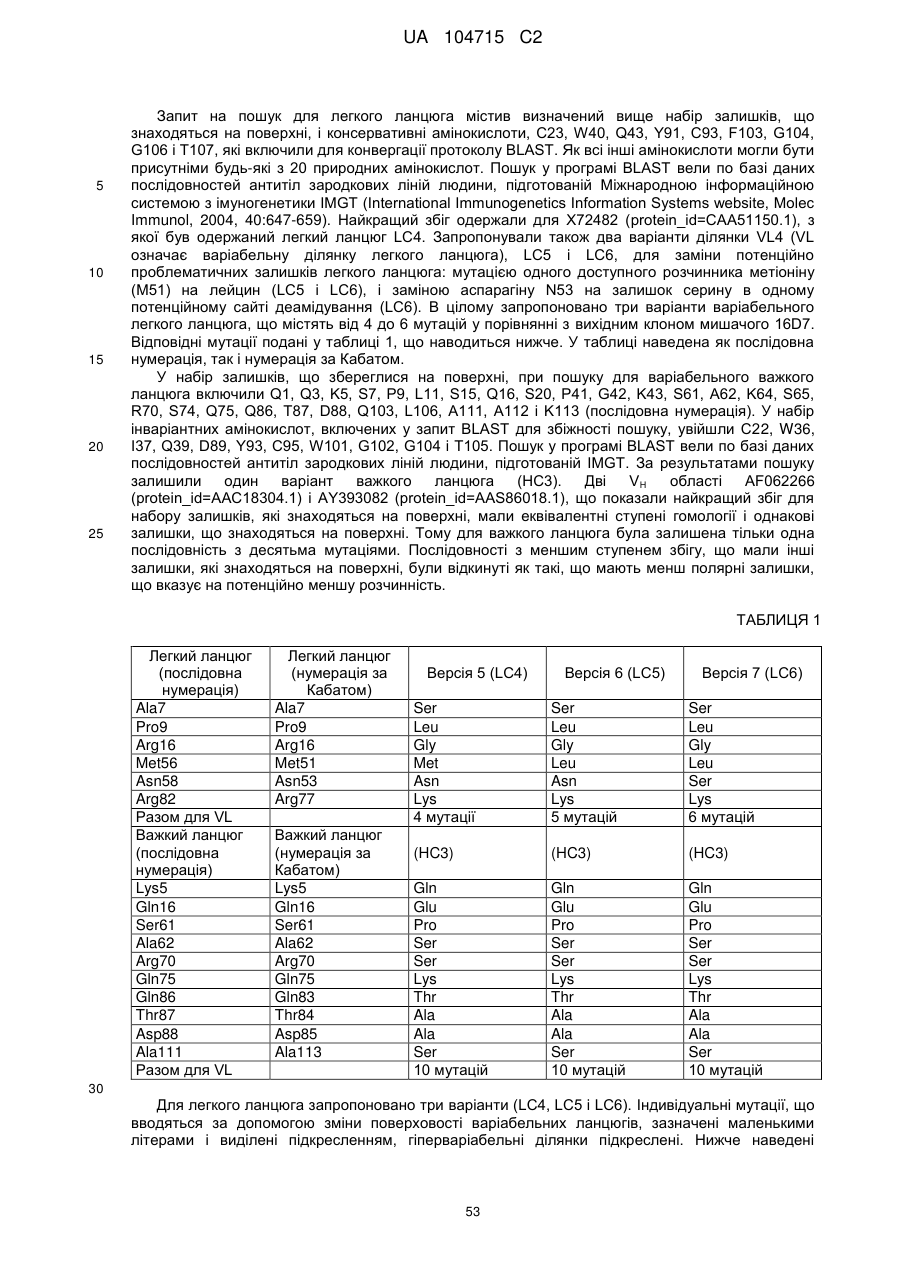
(g) варіабельну область легкого ланцюга, що включає амінокислотну послідовність SEQ ID NO: 30, SEQ ID NO: 31 або SEQ ID NO: 32, і варіабельну область важкого ланцюга, що включає амінокислотну послідовність SEQ ID NO: 33 або SEQ ID NO: 34;
(h) амінокислотні послідовності:
(і) RSSKSLLHSSGKTYLY, RMSNLA, MQHLEYPYT, GFSLIDYGVN, VIWGDGTTY і IVY;
(іі) RSSKSLLHSSGKTYLY, RLSNLA, MQHLEYPYT, GFSLIDYGVN, VIWGDGTTY і IVY; або
(ііі) RSSKSLLHSSGKTYLY, RLSSLA, MQHLEYPYT, GFSLIDYGVN, VIWGDGTTY і IVY;
(i) варіабельну область легкого ланцюга, що включає амінокислотну послідовність SEQ ID NO: 35, і варіабельну область важкого ланцюга, що включає амінокислотну послідовність SEQ ID NO: 37;
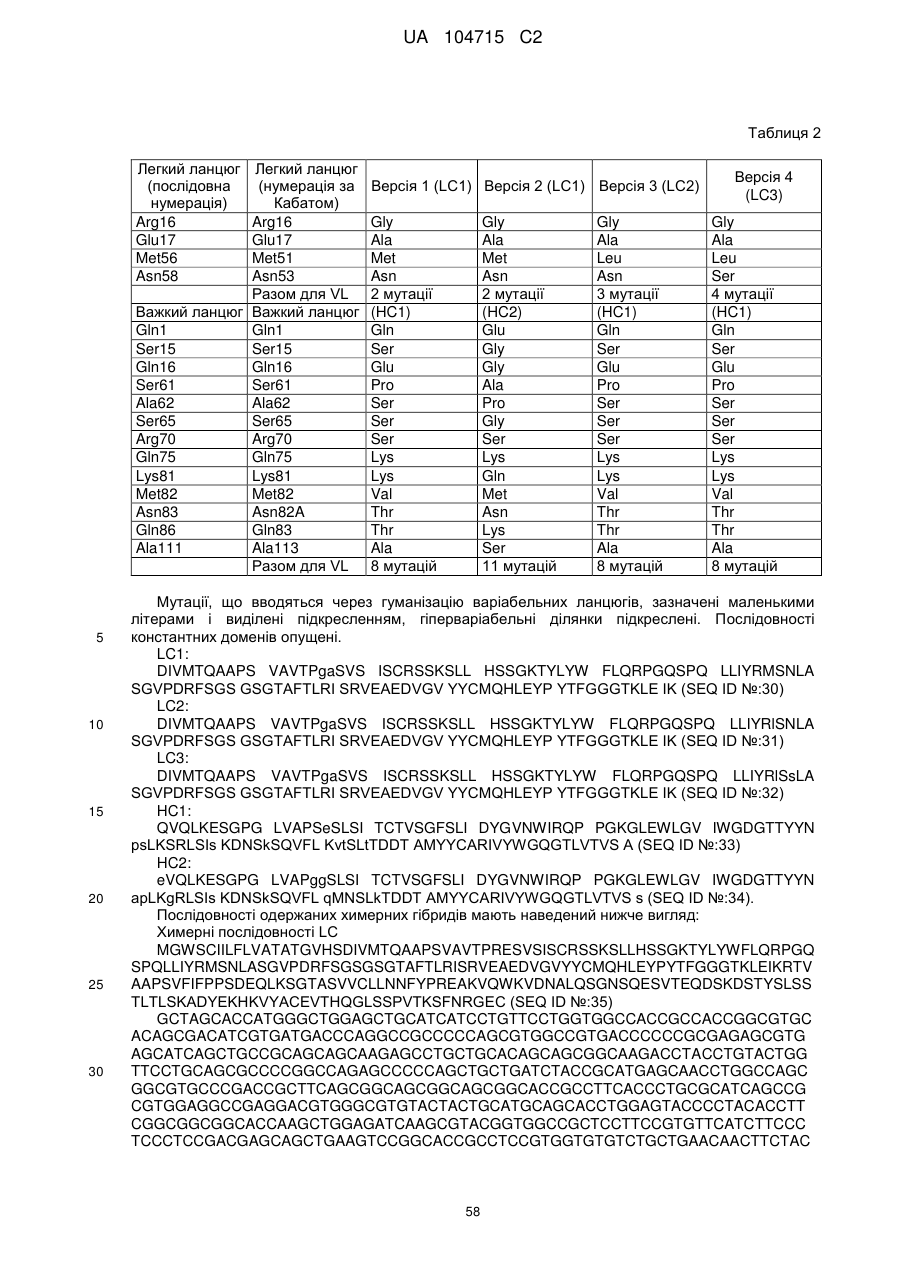
(j) варіабельну область легкого ланцюга, що включає амінокислотну послідовність SEQ ID NO: 39, SEQ ID NO: 41 або SEQ ID NO: 43, і варіабельну область важкого ланцюга, що включає амінокислотну послідовність SEQ ID NO: 45 або SEQ ID NO: 47;
(k) варіабельну область легкого ланцюга, що включає амінокислотну послідовність SEQ ID NO: 55, і варіабельну область важкого ланцюга, що включає амінокислотну послідовність SEQ ID NO: 56 або SEQ ID NO: 57; або
(l) амінокислотні послідовності RSSKSLLHSSGKTYLYW, RMSNLA, MQHLEYPYT, GFSLIDYGVN, VIWGDGTTY і IVY.
2. Антитіло або його фрагмент за п. 1, де антитіло або його фрагмент містять один або більше доменів константної ділянки.
3. Антитіло або його фрагмент за п. 1, де антитіло або його фрагмент містять СH1, СH2, CH3, CL або їх комбінації.
4. Антитіло або його фрагмент за п. 2, в якому один або більше доменів константної області взяті з антитіла IgG.
5. Антитіло або його фрагмент за п. 4, де антитіло IgG являє собою антитіло IgG4.
6. Антитіло або його фрагмент за п. 1, де антитіло або його фрагмент містять варіабельну область легкого ланцюга.
7. Антитіло або його фрагмент за п. 1, де антитіло або його фрагмент містять варіабельну область важкого ланцюга.
8. Антитіло або його фрагмент за п. 1, де антитіло або його фрагмент являють собою одноланцюжкове антитіло Fv.
9. Фармацевтична композиція, що включає терапевтично ефективну кількість антитіла або його фрагмента за п. 1 або 2 і фармацевтично прийнятий носій.
10. Виділена молекула нуклеїнової кислоти, що кодує антитіло або його фрагмент за п. 1.
11. Вектор, що містить молекулу нуклеїнової кислоти за п. 10.
12. Виділена клітина-хазяїн, що містить вектор за п. 11.
13. Спосіб лікування пацієнта, який має порушення, пов'язане з CXCR5-позитивними клітинами, що включає введення зазначеному пацієнту терапевтично ефективної кількості антитіла або його фрагмента за п. 1 або 2.
14. Спосіб за п. 13, де порушення, пов'язане з CXCR5-позитивними клітинами, являє собою рак підшлункової залози, рак товстої кишки, рак сечового міхура, Т-клітинний лейкоз, В-клітинний лейкоз, вовчак, синдром Шегрена, міастенію гравіс, розсіяний склероз, виразковий коліт, ревматоїдний артрит, псоріатичний артрит, хронічне запальне захворювання або відторгнення трансплантата.
15. Спосіб за п. 14, де вказане порушення, пов'язане з CXCR5-позитивними клітинами, являє собою ревматоїдний артрит.
16. Спосіб за п. 13, де щонайменше одна з CXCR5-позитивних клітин являє собою В-клітину.
17. Спосіб за п. 13, де щонайменше одна з XCXR5-позитивних клітин активується CXCL13.
18. Спосіб за п. 13, де щонайменше одна з CXCR5-позитивних клітин являє собою Т-клітину.
19. Спосіб лікування пацієнта, який страждає на захворювання або стан, пов'язані з CXCR5, що включає введення вказаному пацієнту терапевтично ефективної кількості антитіла або його фрагмента за п. 1 або 2.
20. Спосіб за п. 19, де захворювання або стан, пов'язані з CXCR5, являють собою рак підшлункової залози, рак товстої кишки, рак сечового міхура, Т-клітинний лейкоз, В-клітинний лейкоз, вовчак, синдром Шегрена, міастенію гравіс, розсіяний склероз, виразковий коліт, ревматоїдний артрит, псоріатичний артрит, хронічне запальне захворювання або відторгнення трансплантата.
21. Спосіб за п. 20, де захворювання або стан, пов'язані з CXCR5, являють собою ревматоїдний артрит.
22. Спосіб приготування антитіла або його фрагмента за п. 1, що включає:
(а) ідентифікацію варіабельної області антитіла людини, гомологічної варіабельній області нелюдського антитіла CXCR5;
(b) ідентифікацію за молекулярними конформаціями зазначеної варіабельної області зазначеного нелюдського антитіла CXCR5 амінокислотних залишків, які є гнучкими, і амінокислотних залишків, що фланкують зазначені гнучкі залишки і які зберігають молекулярну конформацію зазначеної варіабельної області;
(c) ідентифікацію у зазначеній варіабельній області антитіла людини амінокислотних залишків, гомологічних до зазначених ідентифікованих амінокислотних залишків зі стадії (b);
(d) заміну зазначених ідентифікованих амінокислотних залишків зі стадії (b) на зазначені ідентифіковані амінокислотні залишки зі стадії (с) з одержанням гуманізованої варіабельної області; і
(e) об'єднання зазначеної гуманізованої варіабельної області зі стадії (d) з послідовністю людини з одержанням гуманізованого антитіла або його фрагмента проти позаклітинного домену CXCR5 людини.
23. Спосіб за п. 22, в якому зазначена стадія (b) включає молекулярно-динамічне моделювання.
24. Спосіб за п. 22, в якому зазначений пункт (d) включає відсутність замін амінокислот на відстані більше 5Å від області, яка визначає комплементарність.
25. Спосіб за п. 22, який додатково включає підтвердження, що зазначена гуманізована варіабельна область стадії (d) подібна до людського антитіла, шляхом порівняння послідовності зазначеної гуманізованої варіабельної області з послідовностями набору послідовностей антитіл людини.
26. Спосіб за п. 22, який додатково включає підтвердження, що зазначена гуманізована варіабельна область стадії (d) подібна до людського антитіла, шляхом порівняння траєкторії зазначеної гуманізованої варіабельної області з траєкторіями набору послідовностей антитіл людини.
27. Спосіб за п. 22, в якому гуманізована варіабельна область стадії (d) не містить епітопу для В-клітини або епітопу для Т-клітини.
Текст
Реферат: Винахід належить до виділеного антитіла, яке специфічно зв'язується з CXCR5 для лікування або профілактики хвороб і порушень, пов'язаних з CXCR5. Також винахід належить до фармацевтичної композиції, що містить антитіло проти CXCR5, молекули нуклеїнової кислоти, що кодує антитіло проти CXCR5, вектора, що містить нуклеїнову кислоту та клітини-хазяїна, що містить вектор. UA 104715 C2 (12) UA 104715 C2 UA 104715 C2 5 10 15 20 25 30 35 40 45 50 55 ГАЛУЗЬ ТЕХНІКИ, ДО ЯКОЇ НАЛЕЖИТЬ ВИНАХІД Даний винахід стосується антитіл до CXCR5 і їх застосування для полегшення стану, лікування або профілактики захворювань або розладів у ссавців, включаючи людину, викликаних аномальною активністю або метаболізмом CXCR5, або аномальним або випадковим їхнім зв’язуванням, наприклад з патогеном. Розглянуте антитіло може блокувати зв’язування ліганду, наприклад CXCL13, зі своїм рецептором, наприклад, CXCR5. Також розкривається інформація про профілактичні, імунотерапевтичні і діагностичні препарати, що містять розглянуті антитіла і їх похідні, і їх застосування в рамках методів профілактики або лікування захворювань ссавців, включаючи людину, які викликані аномальним метаболізмом + і/або активністю кліток CXCR5 , наприклад В-лімфоцитів. До таких захворювань належать аутоімунні хвороби, а також хвороби, викликані або, що характеризуються запальними процесами, наприклад ревматоїдний артрит (РА), при якому спостерігається підвищена активність CXCR5. РІВЕНЬ ТЕХНІКИ CXCR5, також відомий як рецептор лімфоми Беркіта (BLR1), CD185, MDR15 і MGC117347, є рецептором, пов’язаним з G-білком, який входить у сімейство рецепторів хемокіну CXC. Як ліганд виступає BLC, інша назва - CXCL13, який є хемоатрактантом B-клітин. Непроцесований попередник CXCR5 складається з 372 амінокислот і має молекулярну вагу 42 KD. CXCR5 бере участь у міграції й локалізації В-клітин у певних анатомічних відділах. У нокаутних мишей з відсутніми периферичними лімфатичними вузлами менше пейерових бляшок і більш низький рівень В-клітин. КОРОТКИЙ ОПИС ВИНАХОДУ У даному винаході пропонуються нові гуманізовані й людські антитіла, а також їх фрагменти й похідні, які специфічним чином зв’язуються з CXCR5. Деякі з антитіл і їх CXCR5-з’єднувальні фрагменти можуть бути змінені, для того, щоб перешкодити утворенню внутрішньоланцюгового дисульфідного зв’язку, що приводить до утворенню молекули, яка зберігає стабільність у процесі одержання й використання in vivo. Інші розглянуті антитіла можуть бути також змінені, для того, щоб звести до мінімуму зв’язування з FCR. Деякі розглянуті антитіла CXCR5 конкурують із CXCL13 за зв’язування з CXCR5. Інші антитіла знижують активність CXCR5. Винахід включає амінокислотні послідовності варіабельного важкого й легкого ланцюга антитіл і відповідні ним послідовності нуклеїнових кислот. Інший приклад здійснення винаходу включає послідовності гіперваріабельних ділянок (CDR) антитіл, для того, щоб одержати з’єднувальні молекули, які містять одну або кілька ділянок CDR або похідних від ділянок CDR, що зберігають здатність зв’язування CXCR5 вихідної молекули, з якої був одержаний CDR. Розглянутим антитілом може бути таке, яке не дозволяє CXCL13 або іншому ліганду + зв’язуватися із клітинами CXCR5 , наприклад В-клітинами. Інший приклад здійснення даного винаходу включає клітинні лінії й вектори, що містять послідовності антитіл згідно з даним винаходом. Ще один приклад здійснення даного винаходу припускає використання антитіл для виготовлення медикаменту або лікарського препарату для лікування захворювань і порушень, пов’язаних з функцією й метаболізмом CXCR5. В іншому прикладі здійснення даного винаходу пропонується використовувати зазначені антитіла при лікуванні порушень, пов’язаних з атипічною або аномальною біологічною природою й функціонуванням CXCR5. Додаткові особливості й переваги описані в даному документі й будуть очевидні з наведеного нижче повного опису винаходу. ДОКЛАДНИЙ ОПИС ВИНАХОДУ Даний винахід не обмежується конкретною методологією, протоколами, клітинними лініями, векторами або реагентами, описаними в даному документі, оскільки їх можна міняти, не зачіпаючи при цьому основної ідеї й об’єму винаходу. Далі, використовувана в даному документі термінологія призначена винятково для опису конкретних здійснень і не має на увазі обмеження об’єму даного винаходу. Якщо не зазначене інше, усі технічні й наукові терміни й скорочення, використовувані в даному документі, мають таке ж значення, яке загальновідомо рядовим фахівцям в галузі, до якої належить даний винахід. Будь-які способи й матеріали, аналогічні або ідентичні описаним у даному документі, можуть використовуватися в практичному застосуванні даного винаходу, і нижче приводяться тільки приклади способів, обладнань і матеріалів. 1 UA 104715 C2 5 10 15 20 25 30 35 40 45 50 55 60 Усі публікації й патенти, зазначені в даному документі, включаються в даний документ як посилання на них для цілей опису й розкриття, що приводяться в ньому білків, ферментів, векторів, клітин-хазяїв і методологій, які можуть використовуватися в даному винаході й у комбінації з ним. Разом з тим, ніякі положення даного документа не слід розглядати як визнання того, що даний винахід не має права на більш ранній пріоритет такого розкриття через попередній винахід. Перед описом формулювання й застосування способів, пов’язаних з CXCR5, і розглянутих продуктів для відомості фахівців нижче приводяться визначення деяких термінів і словосполучень. «CXCR5» означає відому молекулу, що зустрічається в природі, яка присутня в лімфоцитах, зокрема В-клітинах, і особливо, в інтактних В-клітинах; таку молекулу, виділену з таких клітин; таку молекулу, одержану за допомогою рекомбінантних технологій з використанням відомих матеріалів і методів і з використанням нуклеїнової кислоти, що кодує CXCR5; а також частини CXCR5, наприклад позаклітинний домен (EC), який зберігає характеристики й властивості, важливі для практичного застосування даного винаходу, такого як зв’язування CXCL13. Розчинна молекула CXCR5 може, по суті, включати EC домен CXCR5, який звичайно складається з перших шістдесяти амінокислот молекули, тобто амінотермінальної частини CXCR5. CXCR5 не є проміскуїтетним рецептором. CXCL13 виступає як ліганд CXCR5 і конститутивно експресується на стромальних клітинах, наприклад фолікулярних дендритних клітинах і в лімфоїдних тканинах. CXCL13 специфічно залучає В-клітини й невелику субпопуляцію Т-клітин, які називаються В-хелперними фолікулярними Т-клітинами, TFH. Таку поведінку не можна назвати несподіваною, беручи до уваги множину взаємодій між популяціями Т-клітин і В-клітин в імунній системі. Більше того, активовані Т-клітини індукують або підсилюють експресію CXCR5. Було встановлено, що інфільтрація лімфоцитів у третинні ектопічні гермінативні центри (GC) добре корелює з гостротою, що підсилюється, захворювання й падінням переносимості у випадку певних розладів, які характерні для подібних атипічеих лімфовузлових структур. У моделях мишей in vivo, наприклад миші CXCR5-/- і CXCL13-/-, відсутність рецептора або ліганду приводить до зміненої тонкої структури GC через зміну локалізації Т- і В-клітин, а, можливо, і взаємодії. Ці миші також захищені від розвитку гострого колаген-індукованого артриту (КІА). Оскільки CXCR5 селективно експресується на зрілих Вклітинах, які пов’язані з патогенезом РА, блокування цього рецептора буде модулювати артритогенну відповідь у страждаючих захворюванням пацієнтів. Була продемонстрована клінічна ефективність лікування ревматоїдного артриту біологічними молекулами (такими як анти-TNFα і антитіла до CD20, ритуксимаб); зокрема, у пацієнтів, що одержували орієнтоване на В-клітини лікування, відзначалися стійкі поліпшення клінічних ознак і симптомів. Селективна спрямована дія проти CXCR5, який експресується тільки в зрілих В-клітинах і В-хелперних Тклітинах, не буде впливати на розвиток В-клітин, і не буде викликати імунну недостатність у пацієнта. На відміну від ритуксимабу розглянуте антитіло належить до нейтралізуючих антитіл, які не опосередковують цитотоксичність клітин. Під «хворобою CXCR5» розуміють розлад, порушення, захворювання, патологічний стан, відхилення та ін., яке характеризується або викликається надекспресією або підвищеними рівнями CXCL13 або іншого ліганду CXCR5, підвищеними рівнями В-клітин, підвищеними рівнями активності В-клітин, підвищеними рівнями CXCR5 або аномальним метаболізмом і активністю CXCR5. Під «активністю В-клітин» маються на увазі більш високі в порівнянні з нормою рівні Вклітин, які можуть бути локальними, або ознаки біологічного прояву або функціонування Вклітин, наприклад експресія антитіла, присутність або активність тирозинкінази Брутона, експресія або присутність CD19, експресія або присутність фактора, що активує В-клітини й інш. Термін «по суті ідентичні» стосовно послідовності поліпептидного ланцюга антитіла може бути витлумачений як ідентичність послідовності ланцюга антитіла, і поліпептидної послідовності, що зіставляється, щонайменше на 70%, 80%, 90%, 95% або більше. Той же термін відносно послідовності нуклеїнової кислоти може бути витлумачений як ідентичність послідовності нуклеотидів і послідовності нуклеїнової кислоти, що зіставляється, щонайменше на 85%, 90%, 95%, 97% або більше. Терміни «ідентичність» або «гомологія» можуть означати відсоток основ нуклеотидів або амінокислотних залишків у послідовності кандидата, які ідентичні залишку відповідної послідовності, з якої вона порівнюється, після зіставлення послідовностей і введення пропусків, якщо необхідно, для забезпечення максимального відсотка ідентичності по всій послідовності й без урахування яких-небудь консервативних заміщень у рамках ідентичності послідовності. Ні 2 UA 104715 C2 5 10 15 20 25 30 35 40 45 50 55 60 N-термінальні або C-термінальні подовжуючи сегменти, ні вставки не слід розглядати як такі, що зменшують ідентичність або гомологію. Методи й комп’ютерні програми для зіставлення доступні й відомі фахівцям в галузі. Ідентичність послідовності може оцінюватися за допомогою програмного забезпечення для зіставлення послідовностей. Словосполучення й терміни «функціональний фрагмент, варіант, похідне або аналог» і їм подібні, а також їх форми, застосовувані у відношенні антитіла або антигену, описують сполуку або молекулу, що володіє якісною біологічною активністю, властивою розглянутому антитілу або антигену повної довжини. Наприклад, функціональний фрагмент або аналог антитіла до CXCR5 може зв’язуватися з молекулою CXCR5 або може перешкоджати або суттєво знижувати здатність ліганду, наприклад CXCL13, або агоністу або антагоністичного антитіла зв’язуватися з CXCR5. Прикладом є молекула scFV. Що стосується CXCR5, її варіантом або похідним є молекула, яка неідентична CXCR5, що зустрічається в природі, але, проте, може використовуватися для цілей даного винаходу, наприклад, незважаючи на відсутність ідентичності з немутантною CXCR5, проте може використовуватися як імуноген для підвищення рівня антитіл, які селективно зв’язуються з немутантною CXCR5. «Субституційними» варіантами називають такі, де щонайменше один амінокислотний залишок у нативній послідовності вилучений і замінений іншою амінокислотою, введеною на його місце в тому ж положенні. Заміщення можуть бути одиночними, при яких заміняється тільки одна амінокислота в молекулі, або множинними, якщо в одній і тій же молекулі заміщаються дві або більше амінокислоти. Множинні заміщення можуть проводитися в послідовних сайтах. Крім того, одна амінокислота може заміщуватися декількома залишками, такий варіант містить як заміщення, так і вставки. «Інсерційними» варіантами називають такі, де одна або кілька амінокислот були введені безпосередньо по сусідству з тією або іншою амінокислотою в конкретному положенні нативної послідовності. Під, безпосередньо сусідньою із тієї або іншою амінокислотою розуміється амінокислота, пов’язана з α-карбоксильною або αамінною функціональною групою амінокислоти. «Делеційними» варіантами називають такі, де вилучена одна або кілька амінокислот з нативної амінокислотної послідовності. Звичайно в делеційних варіантах видаляють одну або дві амінокислоти в конкретній області молекули. Термін «антитіло» використовується в найбільш широкому сенсі й, зокрема, включає моноклональні антитіла (включаючи моноклональні антитіла повної довжини), поліклональні антитіла, мультиспецифічні антитіла (наприклад, біспецифічні антитіла), фрагменти антитіл або синтетичні поліпептиди, що містять одну або більше послідовностей CDR або похідних CDR, за умови, що поліпептиди проявляють бажану біологічну активність. Антитіла (Abs) і імуноглобуліни (Igs) належать до глікопротеїнів, що володіють однаковими структурними особливостями. Як правило, антитіла розглядають як Igs з визначеною або розпізнаваною специфічністю. Таким чином, антитіла проявляють специфічність зв’язування з конкретною мішенню, тоді як до імуноглобулінів належать й антитіла, і інші подібні антитіл молекули, які не мають специфічності до мішені. Антитіла згідно з даним винаходом можуть належати до будьякого класу (наприклад, IgG, IgE, IgM, IgD, IgA та ін.) або підкласу (наприклад, IgG 1, IgG2, IgG2a, IgG3, IgG4, IgA1, IgA2 та ін.) (терміни «тип» і «клас», а також «підтип» і «підклас» рівнозначно використовуються в даному документі). Нативні або немутантні, тобто одержані від представника популяції без штучних маніпуляцій, антитіла й імуноглобуліни звичайно являють собою гетеротетрамерні глікопротеїни з молекулярною вагою приблизно 150000 дальтон, що складаються із двох однакових легких ланцюгів (L) і двох однакових важких ланцюгів (H). Кожний важкий ланцюг має на кінці варіабельний домен (VH), за яким іде декілька константних доменів. Кожний легкий ланцюг має на кінці варіабельний домен (V L), а на іншому кінці константний домен. Під виразом «без штучних маніпуляцій» розуміють відсутність обробки, після якої елементи містять або експресують чужорідну антигензв’язувальну молекулу. Визначення «нативний» може належати до найбільш переважної алелі або видів, що реєструються у популяції, або до антитіла, одержаного від тварини без маніпуляцій, у зіставленні з алеллю або поліморфізмом, або варіантів, або похідних, одержаних за рахунок тієї або іншої форми маніпуляцій, наприклад мутагенезу, застосування рекомбінантних методик та ін. для зміни амінокислоти антигензв’язувальної молекули. Використовуваний у даному документі термін «антитіло до CXCR5» означає антитіло або одержаний з нього поліпептид (похідне), які специфічно зв’язуються з людським CXCR5 відповідно до даного документа, у тому числі, серед інших, молекули, які інгібують або суттєво знижують рівень зв’язування CXCR5 з його лігандами або інгібують активність CXCR5. Термін «варіабельний» у контексті варіабельного домену антитіл стосується певних частин відповідної молекули, які значною мірою відрізняються своєю послідовністю від одного до іншого антитіла й використовуються для специфічного розпізнавання й зв’язування конкретного 3 UA 104715 C2 5 10 15 20 25 30 35 40 45 50 55 антитіла з його певною мішенню. При цьому варіабельність нерівномірно розподіляється по варіабельним доменам антитіл. Варіабельність зосереджується в трьох сегментах, які називаються визначальними комплементарність областями (CDR; тобто CDR1, CDR2 і CDR3), також відомими як гіперваріабельні ділянки, які знаходяться у варіабельних доменах як легкого, так і важкого ланцюга. Області варіабельних доменів з більш високими рівнями консервативності називають каркасними ділянками (FR) або послідовностями. Варіабельні домени нативних важких і легенів ланцюгів містять по чотири області FR, значною мірою мають конформацію β-аркуша й зв’язані трьома CDR, які утворюють з’єднувальні петлі, а в деяких випадках і утворюють частину структури β-аркуша. CDR у кожному ланцюзі часто сусідять із областями FR і разом з CDR іншого ланцюга сприяють формуванню шуканого (епітопа або детермінанта) сайту зв’язування антитіл (див., Kabat et al. Sequences of Proteins of Immunological Interest, National Institute of Health, Bethesda, MD (1987)). Якщо не зазначене інакше, використовувана в даному документі нумерація амінокислотних залишків імуноглобуліну проводиться відповідно до системи нумерації амінокислотних залишків імуноглобуліну в роботі Kabat et al. Один CDR може мати здатність специфічно зв’язувати когнатний епітоп. Визначення «фрагмент антитіла» стосується частини інтактного або повного ланцюга або антитіла, як правило області зв’язування мішені або варіабельної області. До прикладів фрагментів антитіла, серед інших, належать фрагменти Fab, Fab’, F(ab’)2 і FV. «Функціональним фрагментом» або «аналогом антитіла до CXCR5» називають такий фрагмент, який може перешкоджати здатності рецептора, або суттєво знижувати таку здатність, зв’язуватися з лігандом або ініціювати сигнал. Використовуваний у даному документі термін «функціональний фрагмент» є синонімом терміна «фрагмент антитіла» і при вживанні відносно антитіл може стосуватися таких фрагментів, як FV, Fab, F(ab’)2 та ін., які в стані перешкоджати здатності рецептора, або суттєво знижувати таку здатність, зв’язуватися з лігандом або ініціювати сигнал. Фрагмент «FV» складається з димера варіабельного домену з одним важким й одним легким ланцюгом, утвореного за допомогою нековалентної асоціації (димер VH-VL). У такій конфігурації три CDR кожного варіабельного домену взаємодіють, формуючи шуканий сайт зв’язування на поверхні димеру VH-VL, так само як в інтактному антитілі. У сукупності такі шість CDR забезпечують специфічність зв’язування мішені на інтактному антитілі. При цьому навіть одиничний варіабельний домен (або половина FV, що містить усього три CDR, специфічних до мішені) може мати здатність розпізнавати й зв’язувати мішень. «Одноланцюжкові FV», фрагменти антитіл «sFV» або «scAb» включають домени антитіла VH і VL, де ці домени присутні в єдиному поліпептидному ланцюзі. Як правило, поліпептид F V додатково містить поліпептидний лінкер, часто гнучку молекулу, між доменами V H і VL, що дозволяє sFv утворювати потрібну структуру для зв’язування мішені. Термін «діатіла» стосується фрагментів антитіл із двома антигензв’язувальними сайтами, такі фрагменти можуть включати варіабельний домен важкого ланцюга (V H), пов’язаний з варіабельним доменом легкого ланцюга (VL) у тому ж поліпептидному ланцюзі. За рахунок використання лінкера, який занадто короткий, щоб забезпечувати об’єднання двох варіабельні доменів одного й того самого ланцюга, домени діатіл змушені поєднуватися з доменами зв’язування іншого ланцюга для формування двох антигензв’язувальних сайтів. Фрагмент Fab містить варіабельні й константні домени легкого ланцюга й варіабельний і перший константний домен (CH1) важкого ланцюга. Фрагменти Fab’ відрізняються від фрагментів Fab додаванням декількох залишків у карбоксильному термінальному кінці домену C H1, так щоб він містив один або декілька цистеїнів із шарнірної області антитіла. Фрагменти F ab’ можуть бути одержані розщепленням дисульфідного зв’язку в цистеїнах шарнірної області продукту руйнування пепсином F(ab’)2. Додаткова ферментативна й хімічна обробка антитіл може приводити до утворення інших функціональних фрагментів, що представляють інтерес. Використовуваний у даному документі термін «моноклональне антитіло» стосується антитіла, одержаного з популяції значною мірою однорідних антитіл, тобто окремі антитіла, що утворюють популяцію, ідентичні, якщо не враховувати можливі природні мутації, які можуть бути присутніми у незначних кількостях. У цьому випадку до моноклональних антитіл, зокрема, належать «химерні» антитіла, у яких частина важкого і/або легкого ланцюга ідентична або гомологічна відповідним послідовностям в антитілах, одержаних від конкретних видів або приналежних до певного класу або підкласу (типу або підтипу) антитіл, при цьому інший ланцюг (ланцюги) ідентичний або гомологічний відповідним послідовностям в антитілах, одержаних від інших видів або приналежних іншому класу або підкласу антитіл, а також фрагменти таких антитіл, за умови що вони проявляють бажану біологічну активність при зв’язуванні з CXCR5 або впливі на активність або метаболізм 4 UA 104715 C2 5 10 15 20 25 30 35 40 45 50 55 CXCR5 (патент США № 4816567; і Morrison et al., Proc Natl Acad Sci USA 81:6851 (1984)). Тому CDR одного класу антитіл можуть бути щеплені в FR антитіла іншого класу або підкласу. Моноклональні антитіла мають високу специфічність, вони орієнтовані на єдиний сайтмішень, епітоп або детермінант. Крім того, на відміну від звичайних (поліклональних) препаратів антитіл, які, як правило, містять різні антитіла, спрямовані проти різних детермінантів (епітопів) антигену, кожне моноклональне антитіло спрямоване проти єдиного детермінанта в мішені. На додаток до специфічності, перевага моноклональних антитіл полягає в тому, що вони продукуються клітиною-хазяїном без домішок інших імуноглобулінів, що забезпечує клонування відповідного гена й мРНК, що кодує антитіло його ланцюгів. Модифікатор «моноклональне» вказує на характеристику антитіла, яке було одержано зі значною мірою однорідної популяції антитіл, і не повинен бути витлумачений як потребуючий продукції антитіла будь-яким конкретним методом. Наприклад, моноклональні антитіла для використання в даному винаході можуть бути виділені з фагової бібліотеки антитіл за допомогою добре відомих методик або ж можуть бути виділені з поліклонального препарату. Вихідні моноклональні антитіла для використання відповідно до даного винаходу можуть бути виготовлені за допомогою гібридомного методу, описаного в Kohler et al., Nature 256:495 (1975), або можуть бути одержані рекомбінантними методами, які добре відомі фахівцям в галузі. У порівнянні з людським антитілом «гуманізовані» форми нелюдських (наприклад, мишачих) антитіл являють собою химерні імуноглобуліни, ланцюги імуноглобулінів або їх фрагменти (наприклад FV, Fab, Fab’, F(ab’)2 або інших зв’язуючих мішень підпослідовностей антитіл), які містять послідовності, похідні від нелюдського імуноглобуліну. Як правило, гуманізоване антитіло буде включати по суті всю послідовність одного, а звичайно двох варіабельних доменів, в яких усі або по суті всі ділянки CDR відповідають ділянкам CDR нелюдського імуноглобуліну, і всі або по суті всі області FR являють собою матричну послідовність людського імуноглобуліну. Гуманізоване антитіло може також включати щонайменше частину константної області імуноглобуліну (Fc), як правило, вибраної матричної послідовності людського імуноглобуліну. Як правило, основною метою є одержання молекули антитіла, яка мінімально імуногенна для людини. Тому існує можливість також замінити одну або кілька амінокислот в одній або декількох CDR на такі, які будуть менш імуногенними для організмухазяїна людини, суттєво не знижуючи специфічну функцію зв’язування однієї або декількох CDR з CXCR5 або з CXCL13. Як альтернатива можна використовувати нелюдську FR, але в ній найбільш імуногенні амінокислоти заміняються на менш імуногенні. Проте, що обговорювалося вище CDR-прищеплювання не є єдиним методом одержання гуманізованого антитіла. Наприклад, модифікації одних тільки областей CDR може бути недостатньо, оскільки досить часто каркасні залишки можуть відігравати важливу роль у визначенні тривимірної структури петель CDR і загальної афінності антитіла до свого ліганду. Тому можуть застосовуватися будьякі способи модифікації молекули нелюдського вихідного антитіла, так щоб бути менш імуногенними для людини, і повна ідентичність із людським антитілом не завжди є обов’язковою. Отже, гуманізація може також досягатися, наприклад, простим заміщенням усього лише декількох залишків, зокрема, тих, які знаходяться на поверхні молекули антитіла й не сховані усередині її структури, а тому недоступні для імунної системи хазяїна. Подібний спосіб запропонований у даному документі відносно заміщення «мобільних» або «гнучких» залишків молекули антитіла, при цьому мета полягає в тому, щоб зменшити або придушити імуногенність молекули, що виходить, не порушуючи специфічність антитіла у відношенні епітопу або детермінанту. Див., наприклад, Studnicka et al., Prot Eng 7(6)805-814, 1994; Mol Imm 44:1986-1988, 2007; Sims et al., J Immunol 151:2296 (1993); Chothia et al., J Mol Biol 196:901 (1987); Carter et al., Proc Natl Acad Sci USA 89:4285 (1992); Presta et al., J Immunol 151:2623 (1993), WO 2006/042333 і патент США № 5869619. Адаптивна імунна відповідь має два основні аспекти: клітинна імунна відповідь Т-лімфоцитів і гуморальна імунна відповідь антитіла, що продукує В-лімфоцити. Епітопи В-клітин можуть бути лінійними, утвореними безперервною послідовністю амінокислот, або можуть бути конформаційними (Protein Science (2005) 14, 246). Напроти, епітопи Т-клітин являють собою короткі лінійні пептиди, які відщеплюються від антигенних білків, що існують у формі білків основного комплексу гістосумісності (MHC) або, у випадку людини, молекул лейкоцитарного антигену людину (HLA) класу I або класу II. Форма епітопу залежить як від зв’язування MHCпептиду, так і від взаємодії з рецептором Т-клітин (TCR). Білки MHC мають високий поліморфізм, і кожний з них зв’язується з обмеженим набором пептидів. Тому конкретна комбінація алелей МНС, присутніх в організмі хазяїна, обмежує набір потенційних епітопів, розпізнаваних у випадку інфекції. 5 UA 104715 C2 5 10 15 20 25 30 35 40 45 50 55 Два основні типи Т-клітин різняться по експресії білків CD8 і CD4, які визначають, чи буде Тклітина розпізнавати епітопи, представлені молекулами класу I або класу II, відповідно. + Процесінг CD4 T-епітопів відбувається після інкапсуляції антигенутримуючих клітин у пов’язаних з мембраною везикулах, де антиген розщеплюється протеазами на пептидні + фрагменти, які зв’язуються з білками MHC класу II. Напроти, CD8 T-клітини звичайно розпізнають вірусні або власні антигени, експресовані всередині клітини, білки, які розщеплюються на більш короткі пептиди імунопротеасомами в цитозолі. Після розщеплення пептиди переміщаються переносником, пов’язаним із процесінгом антигену, (TAP) в + ендоплазматичний ретикулум для зв’язування з антигенами HLA I. Епітопи CD4 T (хелперних) клітин мають велике значення для імунних відповідей, залежних від Т-клітин, на білкові антигени. Пропонований спосіб гуманізації заснований на впливі гнучкості молекули антитіла в процесі й у момент імунного розпізнавання. Гнучкість білка пов’язана з молекулярним рухом його молекули. Під гнучкістю білка мають на увазі здатність усього білка, частини білка або окремо взятого амінокислотного залишку формувати ансамбль конформацій, які значною мірою відрізняються один від одного. Дані про гнучкість білка можна одержати за результатами експериментів рентгенівської кристалографії (див., наприклад, Kundu et al. 2002, Biophys J 83:723-732.), ядерного магнітного резонансу (див., наприклад, Freedberg et al., J Am Chem Soc 1998, 120(31):7916-7923) або за результатами моделювання молекулярної динаміки (MD). Моделювання MD білка проводиться на комп’ютері й дозволяє виявити рухи всіх атомів білка за певний період часу за допомогою розрахунку фізичних взаємодій атомів один з одним. Результатом моделювання MD є траєкторія для досліджуваного білка за період часу моделювання. Траєкторія являє собою ансамбль конформацій білка, який також називається статичними конфігураціями, які періодично реєструються за час моделювання, наприклад кожну пікосекунду (псек). Саме за допомогою аналізу ансамблю статичних конфігурацій можна визначити гнучкість амінокислотних залишків білка. Тому гнучким залишком вважається такий, який може мати ансамбль різних конформацій у структурі поліпептиду, де такий залишок знаходиться. Методи MD відомі фахівцям в галузі, див., наприклад,, Brooks et al. “Proteins: A Theoretical Perspective of Dynamics, Structure and Thermodynamics” (Wiley, New York, 1988). Several software enable MD simulations, such as Amber (див., Case et al. (2005) J Comp Chem 26:1668-1688), Charmm (див., Brooks et al. (1983) J Comp Chem 4:187-217; and Mackerell et al. (1998) in “The Encyclopedia of Computational Chemistry” vol. 1:271-177, Schleyer et al., eds. Chichester: John Wiley & Sons) or Impact (див. Rizzo et al. J Am Chem Soc; 2000; 122(51):1289812900.) Більшість комплексів білків об’єднані порівняно великою і планарною схованою поверхнею, і, було показано, що гнучкість зв’язуючих партнерів забезпечує основу для їхньої пластичності, що дозволяє їм конформаційно адаптуватися один до одного (Structure (2000) 8, R137-R142). Відповідно, було показано, що приклади «індукованої відповідності» відіграють домінуючу роль в областях контакту білок-білок. Крім того, існує сукупність даних, що постійно поповнюється, які показують, що білки насправді зв’язують ліганди різних форм, розмірів і структур (Protein Science (2002) 11:184-187) і що конформаційна різноманітність, мабуть, є істотною рисою здатності розпізнавати різних партнерів (Science (2003) 299, 1362-1367). Гнучкі залишки беруть участь у зв’язуванні партнерів у парі білок-білок (Structure (2006) 14, 683-693). Гнучкі залишки можуть приймати самі різні конформації, що формують ансамбль областей взаємодії, які, швидше за все, будуть розпізнаватися В-клітинами пам’яті й викликати імуногенну відповідь. Таким чином, антитіла можуть бути гуманізовані за допомогою модифікації ряду залишків каркасної ділянки, так щоб ансамбль конформацій і експонованих областей розпізнавання в модифікованому антитілі якомога більше походив на існуючі в антитілі людини. Цього можна домогтися модифікацією обмеженого числа залишків за допомогою: (1) побудови моделі гомології вихідного моноклонального антитіла (mAb) і проведення молекулярно-динамічного моделювання (MD); (2) аналізу гнучких залишків і ідентифікації найбільш гнучких залишків у молекулі нелюдського антитіла, а також виявлення залишків або мотивів, які, швидше за все, будуть джерелом гетерогенності або реакції розпаду; (3) ідентифікації людського антитіла, яке демонструє наявність найбільш схожого ансамблю зон розпізнавання, як вихідного антитіла; (4) виявлення гнучких залишків для мутації, залишків або мотивів, які, швидше за все, будуть джерелом гетерогенності й розпаду й також будуть зазнавати мутації; і (5) перевірки на наявність відомих епітопів Т або В- клітин. Гнучкі залишки можна виявляти на основі розрахунків MD, які пропонуються в даному документі, з 6 UA 104715 C2 5 10 15 20 25 30 35 40 45 50 55 60 використанням моделі передбачуваного розчинника, яка враховує взаємодію водного розчинника з атомами білка за період часу моделювання. Після виявлення набору гнучких залишків у варіабельних легких і важких ланцюгах визначають набір каркасних ділянок важких і легких ланцюгів варіабельних областей людини, які мають близьку подібність із існуючим у розглянутому антитілі набором. Для цього, наприклад, можна скористатися пошуком BLAST для набору гнучких залишків по базі даних для послідовностей антитіл людської зародкової лінії. Цього також можна домогтися за допомогою зіставлення динаміки вихідного mAb з динамікою бібліотеки канонічних структур зародкової лінії. Залишки й сусідні залишки CDR виключаються з пошуку, для того, щоб забезпечити збереження високої афінності для антигену. Таким чином, проводили зіставлення траєкторії молекулярної динаміки для розглянутого антитіла із траєкторіями бібліотеки структур антитіл зародкової лінії. 16D7 зіставляли з бібліотекою 49 структур зародкової лінії. Траєкторія молекулярної динаміки, зафіксована для кожного антитіла, являє собою ансамбль розрахунків молекулярної динаміки, одержаний у ході комп’ютерного моделювання молекулярної динаміки, де, наприклад, використовували 10 різних конформацій як різні точки відліку, і для кожної точки відліку проводили приблизно 10 розрахунків моделей молекулярної динаміки. 49 тривимірних гомологічних моделей антитіл зародкової лінії людину будували за допомогою систематичної комбінації 7 легких ланцюгів людини, що найбільш часто зустрічаються (vκ1, vκ2, vκ3, vκ4, v1, vl2 і v3) і 7 важких ланцюгів, що найбільш часто зустрічаються (vh1a, vh1b, vh2, vh3, vh4, vh5 і vh6) (Nucleic Acids Research, 2005, Vol. 33, Database issue D593-D597). Гнучкі залишки 16D7 потім заміняли на відповідні залишки структури зародкової лінії із траєкторією, найбільш близькою до траєкторії розглянутого антитіла. Потім робили заміну гнучких залишків. Коли кілька людських залишків проявляли подібну гомологію, вибір визначався також природою залишків, які найбільш здатні вплинути на поведінку гуманізованого антитіла в розчині. Наприклад, перевага віддавалася полярним залишкам в експонованих гнучких петлях, а не гідрофобним залишкам. Залишки, які є потенційним джерелом нестабільності й гетерогенності, також піддавали мутації, навіть якщо їх виявляли в CDR. Сюди включаються експоновані метіоніни, оскільки утворення сульфоксиду може бути наслідком взаємодії з кисневими радикалами, протеолітичне розщеплення кислотнонестійких зв’язків, наприклад, у дипептиді Asp-Pro (Drug Dev Res (2004) 61:137-154), сайти деамідування, присутні в експонованому залишку аспарагіну, за яким іде невелика по розмірах амінокислота, наприклад Gly, Ser, Ala, His, Asn або Cys (J Chromatog (2006) 837:35-43), а також сайти N-глікозилування, наприклад сайт Asn-X-Ser/Thr. Як правило, експоновані метіоніни будуть заміщатися лейцинами, експоновані аспарагіни будуть заміщатися глутаміном або аспартатом, або ж буде заміщатися наступний за ними залишок. У випадку сайту глікозилування (Asn-X-Ser/Thr) буде замінятися або Asn, або залишок Ser/Thr. Результуюча композитна послідовність перевіряється на предмет присутності відомих епітопів В-клітин або лінійних епітопів Т-клітин. Пошук проводиться, наприклад, по загальнодоступній базі даних імунних епітопів (IEDB) (Plos Biol (2005) 3(3)e91). Якщо усередині композитної послідовності виявляється відомий епітоп, шукається інший набір людських послідовностей, усередині яких проводиться заміщення. На відміну від запропонованого в патенті США № 5639641 способу зміни поверхні, у пропонованому способі враховуються також імуногенні відповіді, опосередковані В- і Тклітинами. Даний спосіб також дозволяє обійти проблему втрати активності, яка іноді спостерігається при CDR-прищеплюванні (патент США № 5530101). Крім того, у процесі інженерії й селекції також враховуються аспекти стабільності й розчинності, що дозволяє створити антитіло, оптимізоване в плані низької імуногенності, високої афінності до антигену й більш прийнятних біофізичних характеристик. Стратегії й способи зміни поверхні антитіл, а також інші способи зниження імуногенності антитіл у різних організмах хазяїна викладені, наприклад, у патенті США № 5639641. У цілому, у рамках переважного способу: (1) проводиться зіставлення положень набору варіабельних областей важких і легких ланцюгів антитіла, для того, щоб визначити експоновані поверхневі положення важкого й легкого ланцюга варіабельної області каркасної ділянки, при цьому зіставлені положення для всіх варіабельних областей повинні бути щонайменше приблизно на 98% ідентичні; (2) визначається набір нелюдських експонованих поверхневих амінокислотних залишків важких і легких ланцюгів варіабельної області каркасної ділянки, наприклад, для антитіла гризунів (або його фрагмента); (3) визначається набір експонованих поверхневих амінокислотних залишків важких і легких ланцюгів варіабельної області каркасної ділянки, який найбільш близький набору експонованих поверхневих амінокислотних залишків гризунів; і (4) 7 UA 104715 C2 5 10 15 20 25 30 35 40 45 50 55 60 набір експонованих поверхневих амінокислотних залишків важких і легких ланцюгів варіабельної області каркасної ділянки, ідентифікований на етапі (2), заміняється набором експонованих поверхневих амінокислотних залишків важких і легких ланцюгів варіабельної області каркасної ділянки, ідентифікованим на етапі (3), за винятком тих амінокислотних залишків, які розміщаються в межах 5Å від будь-якого атома будь-якого залишку CDR антитіла гризунів, для того, щоб одержати гуманізоване антитіло, наприклад антитіло гризунів, що зберігає специфічність зв’язування. Антитіла можуть гуманізуватися множиною інших методик, у тому числі CDRприщеплюванням (EPO 0 239 400; WO 91/09967; а також патенти США №№ 5530101 і 5585089), зміни поверхні антитіл (EPO 0592106; EPO 0519596; Padlan, 1991, Molec Imm 28(4/5):489-498; Studnicka et al., 1994, Prot Eng 7(6):805-814; і Roguska et al., 1994, PNAS 91:969-973) і перестановки в ланцюзі (патент США № 5565332). Людські антитіла можуть виготовлятися із застосуванням різних методів, відомих фахівцям в галузі, у тому числі, серед інших, методів фаг-дисплея, див. патенти США №№ 4444887, 4716111, 5545806 і 5814318; і WO 98/46645, WO 98/50433, WO 98/24893, WO 98/16654, WO 96/34096, WO 96/33735 і WO 91/10741, з використанням трансгенних тварин, наприклад гризунів, з використанням химерних клітин та ін. Терміни «гомолог антитіла» або «гомолог» стосуються будь-якої молекули, яка специфічним чином зв’язує CXCR5 відповідно до змісту даного документа. Таким чином, до гомологів антитіла належать нативне або рекомбінантне антитіло, модифіковане або немодифіковане; частини антитіла, які зберігають біологічні властивості, що представляють інтерес; наприклад зв’язування CXCR5; наприклад молекули Fab або FV; одноланцюжкове антитіло; поліпептид, що містить одну або кілька областей CDR та ін. Амінокислотна послідовність гомолога необов’язково повинна бути ідентична послідовності існуючого в природі антитіла, але може бути змінена або модифікована включенням амінокислот, що заміщають, введених амінокислот, вилучених амінокислот, амінокислот, що не входять у число двадцяти, які звичайно зустрічаються в білках, та ін., для того, щоб одержати поліпептид з поліпшеними або іншими корисними властивостями. Антитілами з гомологічними послідовностями називають антитіла з амінокислотними послідовностями, які мають гомологію послідовності з амінокислотними послідовностями антитіла CXCR5 згідно з даним винаходом. Переважно, гомологія існує з амінокислотною послідовністю варіабельних областей антитіла згідно з даним винаходом. «Гомологія послідовності», стосовно послідовності амінокислот даного документа, визначається як послідовність із гомологією щонайменше приблизно 90%, 91%, 92%, 93%, 94% або вище й, більш переважно, з гомологією щонайменше близько 95%, 96%, 97%, 98% або 99% стосовно іншої послідовності амінокислот, яка визначається, наприклад, по методу пошуку FASTA відповідно до Pearson & Lipman, Proc Natl Acad Sci USA 85, 2444-2448 (1988). Химерним антитілом називають антитіло, що містить різні частини антитіла, одержані з різних джерел, таких як різні антитіла, різні класи антитіл, різні види тварин, наприклад антитіла, що мають варіабельну область, одержану з мишачого моноклонального антитіла, з’єднані з константною областю людського імуноглобуліну та ін. Таким чином, гуманізоване антитіло являє собою вид химерного антитіла. Методи виготовлення химерних антитіл відомі фахівцям в галузі, див, напр., Morrison, 1985, Science 229:1202; Oi et al., 1986, Biotechniques 4:214; Gillies et al., 1989, J Immunol Methods 125:191-202; і патенти США №№ 5807715, 4816567 і 4816397. До штучних антитіл належать одноланцюжкові антитіла, фрагменти scFv, химерні антитіла, діатіла, триатіла, тетратіла й mru (див. рецензії Winter & Milstein, 1991, Nature 349:293-299; і Hudson, 1999, Curr Opin Imm 11:548-557), кожне з них має здатність зв’язувати антиген або епітоп. В одноланцюжковому фрагменті FV (scFv), домени VH і VL антитіла зв’язані гнучким пептидом. Звичайно лінкер являє собою пептид довжиною близько 15 амінокислот. Якщо лінкер суттєво менше, наприклад довжиною в 5 амінокислот, утворюються діатіла, які являють собою бівалентні димери scFv. Якщо лінкер скорочується до менше трьох амінокислотних залишків, формуються тримерні й тетрамерні структури, які називають триатілами й тетратілами, відповідно. Найменшою з’єднувальною одиницею антитіла може бути окремий CDR, як правило, CDR2 або 3 важкого ланцюга, який має достатню здатність до розпізнавання й зв’язуванню, але може бути також будь-яка комбінація послідовностей CDR, яка може визначатися з використанням практичних методів, викладених у даному документі. Такий фрагмент називають молекулярною областю розпізнавання, або mru. Трохи таких mru можуть бути зв’язані разом з короткими лінкерними пептидами, тим самим, утворюючи штучний з’єднувальний білок з більш високою авідністю в порівнянні з окремою mru. В об’єм даного винаходу також включаються функціональні еквіваленти розглянутого антитіла. Термін «функціональні еквіваленти» включає, наприклад, антитіла з гомологічними 8 UA 104715 C2 5 10 15 20 25 30 35 40 45 50 55 60 послідовностями, гомологи антитіл, химерні антитіла, штучні антитіла й модифіковані антитіла, наприклад ті, в яких кожний функціональний еквівалент визначається здатністю зв’язуватися з CXCR5, інгібувати здатність або функцію CXCR5 передавати сигнал, або інгібувати зв’язування CXCL13 і інших лігандів з CXCR5. Досвідченому фахівцеві в галузі буде очевидно часткове накладення термінів, що означають групи молекул, «фрагменти антитіл» і «функціональні еквіваленти». Методи одержання функціональних еквівалентів, які зберігають здатність до зв’язування CXCR5, відомі кваліфікованим фахівцям в галузі й викладені, наприклад, в WO 93/21319, EPO Серійний номер 239,400, WO 89/09622, EPO Серійний номер 338745 і EPO Серійний номер 332424. До функціональних еквівалентів даної заявки також належать модифіковані антитіла, наприклад антитіла, модифіковані за рахунок ковалентного зв’язку молекули будь-якого типу з антитілом. Наприклад, до модифікованих антитіл належать антитіла, які були модифіковані, наприклад глікозилуванням, ацетилуванням, зв’язуванням з поліетиленгліколем, деамідуванням, фосфорилуванням, амідуванням, введенням відомих захисних/блокувальних груп, протеолітичним розщепленням, зв’язком із клітинним лігандом, зв’язком з токсином або цитотоксичною групою або іншим білком та ін. Ковалентне зв’язування необов’язково приводить до антитіла, яке захищено від формування анти-ідіотипічної відповіді. Модифікація може проводитися з використанням відомих методик, у тому числі, серед інших, специфічного хімічного розщеплення, ацетилизування, формілування, метаболічного синтезу та ін. Крім того, модифіковані антитіла можуть містити одну або кілька некласичних амінокислот. Рядовим фахівцям в галузі відома множина методик, які дозволяють проводити оптимізацію афінності зв’язування. Як правило, такі методики включають заміщення різних амінокислотних залишків у розглянутому сайті з наступним скринінговим аналізом афінності зв’язування мутантного поліпептиду з когнатним антигеном або епітопом. Після ідентифікації й виділення антитіла часто буває корисно одержати варіант або мутант антитіла, або мутеїн, де змінено один або кілька амінокислотних залишків, наприклад, в одній або декількох гіперваріабельних областях антитіла. В альтернативному варіанті або додатково в структуру антитіла може бути внесено одна або кілька змін (наприклад, заміщень) у залишках каркасної ділянки, що приводить до підвищення афінності зв’язування мутанта антитіла з CXCR5. Прикладами залишків каркасної ділянки, які можуть бути модифіковані, є такі залишки, які прямо нековалентно зв’язують антиген (Amit et al., Science 233:747-753 (1986)); взаємодіють із конформацією CDR або впливають на неї (Chothia et al., J Mol Biol 196:901-917 (1987)); і/або знаходяться в області контакту VL-VH (EP 239400). У деяких прикладах здійснення модифікація одного або декількох таких залишків каркасної ділянки приводить до підвищення афінності зв’язування антитіла з когнатним антигеном. Наприклад, у даному прикладі здійснення винаходу можна міняти від одного до приблизно п’яти залишків каркасної ділянки. Іноді цього може бути досить, щоб одержати мутант антитіла, придатний для використання в доклінічних випробуваннях, навіть якщо в жодин із залишків гіперваріабельної області не вносили зміни. Однак, як правило, мутант антитіла може включати одну або кілька змін гіперваріабельної області. Константні області також можна міняти, для того, щоб домогтися бажаних або більш бажаних ефекторних властивостей. Залишки гіперваріабельної області, які зазнають заміщення, можна змінювати довільно, особливо, якщо вихідна афінність зв’язування вихідного антитіла така, що довільно одержані мутанти антитіл можуть легко аналізуватися в процесі скринінга на зміну зв’язування за методикою аналізу, наведеною в даному документі. Одним з методів одержання мутантів антитіл, наприклад мутантів CDR, є «мутагенез сканування аланіну» (Cunningham & Wells, Science 244:1081-1085 (1989); і Cunningham & Wells, Proc Nat Acad Sci USA 84:6434-6437 (1991)). Один або кілька залишків гіперваріабельної області заміняються аланіном або поліаланіновими залишками. Такий залишок (залишки) гіперваріабельної області, який проявляє функціональну чутливість до заміщень, потім модифікують, вводячи подальші або інші мутації в сайтах заміни. Таким чином, незважаючи на те, що сайт для введення варіації послідовності амінокислоти визначений, сам по собі характер мутації необов’язково заздалегідь заданий. Можна спробувати ввести аналогічні заміщення з іншими амінокислотами, залежно від бажаних властивостей сканованих залишків. Більш систематичний метод ідентифікації амінокислотних залишків для модифікації включає ідентифікацію залишків гіперваріабельної області, задіяних у зв’язуванні CXCR5, а також тих залишків гіперваріабельної області, які незначно або зовсім не задіяні у зв’язуванні CXCR5. Проводиться аланінове сканування залишків незв’язувальної гіперваріабельної області, причому кожний Ala мутант проходить тестування на поліпшення зв’язування з CXCR5. В іншому прикладі здійснення для модифікації вибирається той залишок (залишки), які істотно 9 UA 104715 C2 5 10 15 20 25 30 35 40 45 50 55 задіяні у зв’язуванні CXCR5. Модифікація може передбачати делецію залишку або введення одного або декількох залишків у безпосередній близькості від розглянутого залишку. Однак, як правило, модифікація передбачає заміну залишку іншою амінокислотою. Перша заміна може бути консервативною. Якщо така заміна приводить до зміни біологічної активності (наприклад афінності зв’язування), тоді можна провести наступну консервативну заміну, щоб довідатися, чи вдалося домогтися більш істотних змін. Ще більш значима зміна в лінії антитіл і прояві біологічних властивостей може бути досягнута при виборі амінокислоти, яка більш помітно відрізняється по властивостях від тієї, яка звичайно є присутньою на цьому сайті. Тому таке заміщення може проводитися при одночасному збереженні: (a) структури поліпептидного кістяка в зоні заміни, наприклад, у вигляді аркуша або спіральної конформації; (б) заряду або гідрофобності молекули в цільовому сайті, або (в) об’єму бічного ланцюга. Наприклад амінокислоти, що зустрічаються в природі, можуть бути підрозділені на групи на основі загальних властивостей бічного ланцюга: (1) гідрофобні: метіонін (M або Met), аланін (A або Ala), валін (V або Val), лейцин (L або Leu) і ізолейцин (I або Ile); (2) нейтральні, гідрофільні: цистеїн (C або Сys), серин (S або Ser), треонін (T або Thr), аспарагін (N або Аsn) і глутамін (Q або Gln); (3) кислі: аспарагінова кислота (D або Аsp) і глутамінова кислота (E або Glu); (4) основні: гістидин (H або Нis), лізин (K або Lys) і аргінін (R або Аrg); (5) залишки, які впливають на орієнтацію ланцюга: гліцин (G або Gly) і пролін (P або Рro); (6) ароматичні: триптофан (W або Тrp), тирозин (Y або Тyr) і фенілаланін (F або Рhe). Під неконсервативними заміщеннями може матися на увазі заміна однієї з амінокислот на амінокислоту з іншої групи. Під консервативними заміщеннями може розумітися заміна однієї амінокислоти на іншу усередині однієї групи. До переважних заміщень амінокислот належать такі, які: (1) знижують підданість протеолізу, (2) зменшують схильність до окиснення, (3) змінюють афінність зв’язування й (4) забезпечують або змінюють інші фізико-хімічні або функціональні властивості таких аналогів. Серед аналогів можуть бути присутнім різні мутеїни з послідовністю, що відрізняється від існуючої в природі пептидної послідовності. Наприклад, одиничні або множинні заміни амінокислот (переважно консервативні заміни амінокислот) можуть проводитися в існуючій у природі послідовності (переважно в частині поліпептиду за межами домену (доменів), відповідального за міжмолекулярні контакти). Консервативна заміна амінокислот не повинна суттєво змінювати структурні характеристики вихідної послідовності (наприклад, заміна амінокислоти звичайно не повинна приводити до порушення спіральної конформації, яка була присутня у вихідній послідовності, або ж порушувати інші елементи вторинної структури, які характеризують вихідну послідовність), виключенням є зміни загального об’єму або зміни конформації R-групи або бічного ланцюга, Proteins, Structures and Molecular Principles (Creighton, ed., W. H. Freeman and Company, New York (1984)); Introduction to Protein Structure (Branden & Tooze, eds., Garland Publishing, New York, N. Y. (1991)); і Thornton et al. Nature 354:105 (1991). Звичайно мутант антитіла з поліпшеними біологічними властивостями буде мати амінокислотну послідовність, яка щонайменше на 75% ідентична або подібна амінокислотній послідовності важкого або легкого ланцюга варіабельного домену вихідного антилюдського антитіла CXCR5, або має щонайменше 80%-ну, щонайменше 85%-ну, щонайменше 90%-ну і часто щонайменше 95%-ну ідентичність. Ідентичність або подоба відносно послідовності вихідного антитіла визначається в даному документі як відсоток амінокислотних залишків у послідовності кандидата, які ідентичні (тобто той же залишок) або подібні (тобто амінокислотний залишок з тієї ж групи, основаних на близьких властивостях бічного ланцюга, див. вище) залишкам вихідного антитіла після зіставлення послідовностей і введення пропусків, якщо необхідно, для забезпечення максимального відсотка ідентичності послідовності. В альтернативному варіанті мутанти антитіла можуть бути одержані систематичною мутацією ділянок FR і CDR важкого і легкого ланцюгів або ж ділянки Fc антитіла да CXCR5. Інший метод одержання мутантів антитіла включає використання дозрівання афінності за допомгою фаг-дисплею (Hawkins et al., J Mol Biol 254:889-896 (1992) і Lowman et al., Biochemistry 30(45):10832-10838(1991)). Злиті білки оболонки бактеріофага (Smith, Science 228:1315 (1985); Scott & Smith, Science 249:386 (1990); Cwirla et al. Proc Natl Acad Sci USA 8:309 (1990); Devlin et al. Science 249:404 (1990); Wells & Lowman, Curr Opin Struct Biol 2:597 (1992); і патент США № 5223409) відомі як зручні об’екти для зв’язування фенотипу білків і пептидів дисплею з генотипом частинок бактеріофага, які їх кодують. При використанні фаг-дисплею також 10 UA 104715 C2 5 10 15 20 25 30 35 40 45 50 55 відображаються домени Fab антитіл (McCafferty et al., Nature 348: 552 (1990); Barbas et al. Proc Natl Acad Sci USA 88:7978 (1991); і Garrard et al. Biotechnol 9:1373 (1991)). Моновалентний фаг-дисплей відображає набір варіантів білка злитих з білком оболонки бактеріофага на частинках фага (Bass et al., Proteins 8:309 (1990). Дозрівання афінності, або поліпшення рівноважної афінності зв’язування різних білків, раніше досягалося за допомогою послідовного застосування мутагенезу, моновалентного фаг-дисплею й функціонального аналізу (Lowman & Wells, J Mol Biol 234:564 578 (1993); і патент США № 5534617), наприклад, особлива увага приділялася ділянкам CDR антитіл (Barbas et al., Proc Natl Acad Sci USA 91:3809 (1994); і Yang et al., J Mol Biol 254:392 (1995)). 6 Бібліотеки множини (наприклад, 10 або більше) варіантів білків, які відрізняються в певних положеннях послідовності, можна побудувати на частинках бактеріофагів, кожна з яких містить ДНК, що кодує певний варіант білка. Після циклів афінного очищення з використанням імобілізованого антигену, ізолюють окремі клони бактеріофагів і на підставі ДНК визначають амінокислотну послідовність відображуваного білка. Після одержання мутанта антитіла можна визначити біологічну активність даної молекули в порівнянні з вихідним антитілом, згідно з відомостями, викладеними в даному документі. Як відзначалося вище, для цього може знадобитися визначити афінність зв’язування й/або іншу біологічну активність або фізичні властивості антитіла. У переважному здійсненні даного винаходу готується набір мутантів антитіла з наступним скринінгом афінності зв’язування для антигену. Один або декілька мутантів антитіла, що вибираються за результатами скринінга, можуть додатково перевірятися з використанням одного або декількох інших методів аналізу біологічної активності, для того, щоб підтвердити, що мутант (мутанти) антитіла має нові або поліпшені властивості. У переважних прикладах здійснення мутант антитіла зберігає здатність зв’язування CXCR5 з афінністю зв’язування, близькою або переважною/більш високою в порівнянні з характеристиками вихідного антитіла. Відібраний у такий спосіб мутант (мутанти) антитіла може піддаватися подальшим модифікаціям, які часто залежать від передбачуваного використання антитіла. Такі модифікації можуть включати подальша зміну амінокислотної послідовності, злиття з гетерологічним поліпептидом (поліпептидами) і/або ковалентні модифікації. Наприклад, залишок цистеїну, який не задіяний у збереженні належної конформації мутанта антитіла, можна заміщати, як правило, на серин, для того, щоб поліпшити стабільність молекули до окиснення й попередити утворення аберантних зшивок. Напроти, цистеїн можна вводити в структуру антитіла, для того, щоб поліпшити його стабільність (особливо якщо як антитіло вибирається фрагмент антитіла, наприклад фрагмент FV). Інший тип мутанта антитіла має змінену структуру глікозилування. Із цією метою можна видаляти одну або кілька вуглеводних груп, що присутні в антитілі, і/або додавати один або кілька сайтів глікозилування, яких немає в молекулі антитіла. Глікозилування антитіл, як правило, або N-пов’язане з Asn, або O-пов’язане з Ser або Thr. Трипептидні послідовності аспарагін-X-серин і аспарагін-X-треонін, де X - будь-яка амінокислота, крім проліну, є розповсюдженими послідовностями розпізнавання для ферментативного зв’язування вуглеводної групи з бічним ланцюгом аспарагіну. N-ацетилгалактозамін, галактоза, фукоза або ксилоза, наприклад, зв’язуються з гідроксіамінокислотою, як правило, із серином або треоніном, хоча може використовуватися й 5-гідроксипролін або 5-гідроксилізин. Додавання одного або декількох залишків серину або треоніну до послідовності вихідного антитіла або заміщення цими залишками може підвищити ймовірність O-зв’язаного глікозилування. Можливо, буде бажане модифікувати антитіло згідно з даним винаходом в плані ефекторної функції, для того, щоб підвищити ефективність антитіла. Наприклад, в область Fc може вводитися залишок (залишки) цистеїну, що забезпечує можливість утворення міжланцюжкового дисульфідного зв’язку в цій області. Одержане в такий спосіб гомодимерне антитіло може характеризуватися більш високою здатністю до інтерналізації й/або комплемент-залежному лізису й антитілозалежної клітинної цитотоксичності (ADCC), див. Caron et al., J Exp Med 176:1191-1195 (1992) і Shopes, Immunol 148:2918-2922 (1993). В альтернативному варіанті може бути сконструйоване антитіло, яке має подвійні області Fc і тому може забезпечувати підвищені комплемент-залежний лізис і здатність до ADCC, див. Stevenson et al., Anti-Cancer Drug Design 3: 219 230 (1989). Ковалентні модифікації антитіла включаються в об’єм даного винаходу. Вони можуть проводитися за допомогою хімічного синтезу або, якщо можливо, ферментативного або хімічного розщеплення антитіла. Інші форми ковалентних модифікацій антитіла вводяться в молекулу за допомогою взаємодії вибраних амінокислотних залишків антитіла з органічним 11 UA 104715 C2 5 10 15 20 25 30 35 40 45 50 55 60 агентом, використовуваним для одержання похідних, які у стані реагувати з вибраними бічними ланцюгами або з N-термінальним або C-термінальним залишком. Цистеїнові залишки можуть реагувати з α-галоацетатами (і відповідними амінами), наприклад хлороцтовою кислотою або хлорацетамідом, з утворенням карбоксиметильних або карбоксіамідометильних похідних. Похідні цистеїнових залишків також можна одержувати, наприклад, шляхом реакції із бромтрифторацетоном, α-бром-β-(5-імідозоїл)пропіоновою кислотою, хлорацетилфосфатом, N-алкіламалеімідами, 3-нітро-2-піридилдисульфідом, метил-2піридилдисульфідом, п-хлормеркурбензоатом, 2-хлормеркур-4-нітрофенолом або 2оксадіазолом-1,3. Похідні гістидинових залишків можуть бути одержані реакцією з діетилпірокарбонатом при pH 5,5-7,0. П-бромофенацилбромід може також використовуватися, реакцію переважно проводити в 0,1 M розчині какодилату натрію при pH 6,0. Лізинові залишки й α-термінальні залишки можуть реагувати з бурштиновим ангідридом або з ангідридами інших карбонових кислот, для того, щоб змінити заряд залишків. До інших зручних реагентів для одержання похідних α-аміновмісних залишків належать імідоефіри, наприклад метилпіколінімідат, піридоксальфосфат, піридоксаль, хлорборогідрид, тринітробензолсульфонова кислота, O-метилізосечовина й 2,4-пентандіон, і амінокислота може каталізуватися трансаміназою у присутності гліоксилату. Залишки аргініну можуть модифікуватися реакцією з одним або декількома стандартними реагентами, наприклад фенілгліоксалем, 2,3-бутандіоном, 1,2-циклогександіоном і нінгідрином. Для одержання похідних у випадку залишків аргініну часто потрібно проводити реакцію в лужному середовищі. Крім того, реагенти можуть взаємодіяти з лізином, а також з εаміногрупою аргініну. Специфічна модифікація залишків тирозину може проводитися за допомогою ароматичних діазонієвих сполук або тетранітрометану. Наприклад, N-ацетилімідазол і тетранітрометан використовуються для утворення O-ацетилтирозильних сполук і 3-нітропохідних, відповідно. 125 131 Залишки тирозину можуть йодуватися з використанням I або I, щоб одержати мічені білки для застосування в радіоімунологічному аналізі. Карбоксильні бічні групи (аспартил або глутаміл) можуть бути модифіковані реакцією з карбодіімідами (R-N=C=C-R’), де R і R’ можуть бути різними алкільними групами, наприклад 1циклогексил-3-(2-морфолініл-4-етил)карбодіімід або 1-етил-3-(4-азоній-4,4диметилпентил)карбодіімід. Крім того, залишки аспартил і глутамил можуть бути трансформовані в аспарагінові й глутамінові залишки реакцією з іонами амонію. Глутамінові й аспарагінові залишки часто деамідують до відповідних глутамільних і аспартильних залишків, відповідно, у нейтральному або основному середовищі. Деамідована форма таких залишків входить в об’єм даного винаходу. До інших модифікацій належить гідроксилування проліну й лізину, фосфорилування гідроксильних груп залишків серину або треоніну, метилування α-аміногруп бічних ланцюгів лізину, аргініну й гістидину (Creighton, Proteins: Structure and Molecular Properties, W.H. Freeman & Co., San Francisco, pp. 79-86 (1983)), ацетилування N-термінального аміну й амідування будьякої C-термінальної карбоксильної групи. Інша форма ковалентної модифікації являє собою хімічне або ферментативне зв’язування глікозидів з антитілом. Такі методи не вимагають продукції антитіл у клітині-хазяїні, яка проявляє глікозилуючі властивості в N-зв’язаному або O-зв’язаному глікозилуванні. Залежно від використаного методу комбінації цукор (цукри) можуть зв’язуватися з: (a) аргініном і гістидином; (б) вільними карбоксильними групами; (в) вільними сульфгідрильними групами, наприклад у цистеїні; (г) вільними гідроксильними групами, наприклад у серині, треоніні або гідроксипроліні; (д) ароматичними залишками, наприклад у фенілаланіні, тирозині або триптофані; або (е) амідною групою глутаміну. Подібні методи описані в WO 87/05330 і в Aplin & Wriston, CRC Crit Rev Biochem, pp. 259-306 (1981). Видалення будь-якої вуглеводної групи, що присутня у структурі антитіла, може здійснюватися хімічним або ферментативним способом. Наприклад, для хімічного деглікозилування може знадобитися подіяти на антитіло таким реагентом, як трифторметансульфонова кислота або рівноцінною сполукою, що приводить до розщеплення більшості або всіх цукрів, крім з’єднувального цукру (N-ацетилглюкозамін або Nацетилгалактозамін), при цьому антитіло залишається інтактним. Хімічне деглікозилування описане, наприклад, в Hakimuddin et al. Arch Biochem Biophys 259:52 (1987) і в Edge et al., Anal Biochem 118:131 (1981). Ферментативне розщеплення вуглеводних груп на антитілах може здійснюватися за допомогою кожної з множини ендоглікозидаз і екзоглікозидаз, як це описано, наприклад, в Thotakura et al., Meth Enzymol 138:350 (1987). 12 UA 104715 C2 5 10 15 20 25 30 35 40 45 50 55 Інша форма ковалентної модифікації антитіла включає зв’язування антитіла з одним з множини небілкових полімерів, наприклад поліетиленгліколем, поліпропіленгліколем або поліоксіалкіленами, на основі методу, наведеного в патентах США №№ 4640835; 4496689; 4301144; 4670417; 4791192 або 4179337. Інша переважна методика одержання мутантів або мутеїнів являє собою дозрівання афінності за допомогою фаг-дисплею (Hawkins et al., J Mol Biol 254:889-896 (1992) і Lowman et al., Biochemistry 30(45):10832-10838(1991)). Коротко, проводиться мутація декількох сайтів гіперваріабельної області (наприклад, 6-7 сайтів), щоб одержати всі можливі амінокислотні заміщення на кожному сайті. Одержані в такий спосіб мутанти антитіла моновалентно проявляються на частинках фага як злиті з білком, що знаходиться на частинках. Фаг, що експресує різні мутанти, може проходити цикл процедур селекції зв’язування з наступним виділенням і секвенуванням тих мутантів, які демонструють високу афінність. Метод селекції нових зв’язуючих поліпептидів може спиратися на використання бібліотеки структурно зв’язаних поліпептидів. Бібліотека структурно зв’язаних поліпептидів, наприклад, злитих з білком оболонки фага, виходить за допомогою мутагенезу й проявляється на поверхні частинки. Потім частинки вступають у контакт із молекулою-мішенню, і частинки з найвищої афінністю до мішені відділяються від частинок, що володіють більш низькою афінністю. Частинки, що зв’язуються з високою афінністю, потім ампліфікують за допомогою інфікування підходящого бактеріального хазяїна, і стадію конкурентного зв’язування повторюють. Процес повторюють, доти поки не будуть одержані поліпептиди з бажаною афінністю. В альтернативному варіанті мультивалентний фаг (Mccafferty et al. (1990) Nature 348:552554; і Clackson et al. (1991) Nature 352:624-628) може також використовуватися для експресії випадкових точкових мутацій (наприклад, мутацій, одержаних у результаті використання ДНКполімерази, що допускає помилки) для одержання фагової бібліотеки фрагментів антитіл, які потім можуть бути піддані скринінгу для перевірки афінності до CXCR5, Hawkins et al., (1992) J Mol Biol 254:889-896. Переважно, щоб у процесі дозрівання афінності реплікований вектор експресії залишався під строгим контролем регуляторного елемента транскрипції, а умови культивування коректувалися таким чином, щоб кількість або число частинок, що несуть більше однієї копії злитого білка, було менше приблизно 1%. Крім того, переважно, щоб кількість частинок, що несуть більше однієї копії злитого білка, було менше 10% від кількості частинок, що несуть єдину копію злитого білка. Переважно, щоб така кількість була меншою 20%. Функціональні еквіваленти можна одержувати заміною різних CDR у різних ланцюгах антитіл у каркасній або композитної FR, одержаній від багатьох антитіл. Так, наприклад, можна одержати різні класи антитіл для заданого набору CDR за допомогою заміщення різних важких ланцюгів, наприклад IgG1-4, IgM, IgA1-2 або IgD, для того, щоб одержати типи й ізотипи антитіл CXCR5, що відрізняються. Аналогічним чином, штучні антитіла, що входять в об’єм даного винаходу, можуть бути одержані за допомогою вміщення заданого набору CDR у повністю синтетичну каркасну ділянку. Наприклад, з молекули IgG4, що володіє зниженою функцією, ефектора, одержують підходящу каркасну область і частину Fc для включення варіабельної області або однієї або декількох, що представляють інтерес CDR. В інших прикладах здійснення для посилення властивостей з’єднувальної CXCR5 молекули, яка становить інтерес, можуть вноситися певні модифікації в каркасну частину й/або Fc частину молекули, що несе антигензв’язувальну ділянку розглянутої молекули. Наприклад, можуть проводитися амінокислотні заміни для посилення або ослаблення розглянутих властивостей. Таким чином, для проведення модифікації в молекулі IgG4 підходять заміщення на сайтах, відомих своїм впливом на функцію, наприклад у шарнірній області, в області, яка впливає на ефекторну функцію або яка впливає на зв’язування Fc. Для досягнення бажаних властивостей у молекулі IgG4 можуть проводитися заміщення наступних амінокислот по нумерації Кабата: 225, 226, 227, 228, 229, 230, 231, 232, 233, 234, 235, 236, 237, 238, 239, 240, 241, 242, 243, 244, 245, 246, 247, 248, 249, 250, 251, 252, 253, 254, 255 і ін., або ж їхні комбінації. Наприклад, заміщення проліном серину 241 може стабілізувати третинну й четвертинну структури молекули (Mol Imm 30(1)105-108, 1993), а заміщення глутаміновою кислотою лейцину 248 може пригнічувати ефекторну функцію (функції) (J Imm 164(4)1925-1033, 2000; і Clin Imm 98(2)164-174, 2001). Іншою корисною властивістю є можливість одержання похідного антитіла, яке зв’язується з CXCR5, але, наприклад, не приводить до виснаження B-клітин. За рахунок цього можуть досягатися певні переваги, оскільки не відбувається порушення продукції антитіл в організмі пацієнта. Лікування таким реагентом також спрощує проведення комбінованих схем терапії із 13 UA 104715 C2 5 10 15 20 25 30 35 40 45 50 55 60 другим препаратом з конкретними показаннями дії на рівні, що не зачіпає В-клітин. Це може бути, наприклад, рівень Т-клітин. Тому, наприклад, 16D7-HC1-LC3 оброблявся таким чином, щоб містити два заміщення, S241P і L248E. Залишки проліну й глутамінової кислоти надають бажані властивості розглянутої CXCR5-з’єднувальній молекулі, яка містить каркасну ділянку IgG4, наприклад стабільність і знижену функцію ефектора. До фрагментів антитіл і функціональних еквівалентів даного винаходу належать такі молекули, які мають реєстрований рівень специфічного зв’язування з CXCR5. Реєстрований рівень зв’язування включає всі значення в діапазоні щонайменше 10-100%, переважно щонайменше 50%, 60% або 70%, більш переважно щонайменше 75%, 80%, 85%, 90%, 95% або 99% здатності зв’язування антитіла, що представляє інтерес. В об’єм даного винаходу також включаються еквіваленти з афінністю більше 100% у порівнянні з розглянутим антитілом. CDR звичайно мають велике значення для розпізнавання епітопів і зв’язування антитіла. При цьому, однак, можуть вноситися зміни в залишки, які входять до складу CDR, з одночасною відсутністю впливу на здатність антитіла розпізнавати когнатний епітоп і зв’язуватися з ним. Наприклад, можуть вноситися зміни, які не виявляють впливу на розпізнавання епітопів, але, проте, підвищують афінність зв’язування антитіла з епітопом. У ряді досліджень приводиться огляд ефектів впливу проведення замін однієї або декількох амінокислот у різних положеннях послідовності антитіла, виходячи зі знань про первинну послідовність антитіла, на їхні властивості, наприклад зв’язування й рівень експресії (Yang et al., 1995, J Mol Biol 254:392-403; Rader et al., 1998, Proc Natl Acad Sci USA 95:8910-8915; і Vaughan et al., 1998, Nature Biotechnology 16, 535-539). Таким чином, еквіваленти розглянутого антитіла можуть бути одержані зміною послідовностей генів важкого й легкого ланцюгів в CDR1, CDR2 або CDR3, або в каркасних областях за допомогою таких методів, як олігонуклеотид-опосередкований сайт-спрямований мутагенез, касетний мутагенез, ПЛР зниженої точності, перестановка в ДНК або штами мутатора E. coli (Vaughan et al., 1998, Nat Biotech 16:535-539; і Adey et al., 1996, Chap. 16, pp. 277-291, в Phage Display of Peptides and Proteins, eds. Kay et al., Academic Press). Методи зміни послідовності нуклеїнової кислоти первинного антитіла можуть приводити до утворення антитіл з підвищеною афінністю (Gram et al., 1992, Proc Natl Acad Sci USA 89:3576-3580; Boder et al., 2000, Proc Natl Acad Sci USA 97:10701-10705; Davies & Riechmann, 1996, Immunotech 2:169-179; Thompson et al., 1996, J Mol Biol 256:77-88; Short et al., 2002, J Biol Chem 277:16365-16370; і Furukawa et al., 2001, J Biol Chem 276:27622-27628). Повторювані цикли «поліпептидної селекції» можуть застосовуватися для відбору систем з усе більш високою афінністю зв’язування, наприклад, за допомогою селекції змін декількох амінокислот, які відбираються в ході множини циклів селекції. Після першого циклу селекції, що включає першу область селекції амінокислот у ліганді або поліпептиді антитіла, проводяться додаткові цикли селекції в інших областях або амінокислотах ліганду. Цикли селекції повторюються до досягнення бажаних характеристик афінності. До вдосконалених антитіл також належать антитіла, що володіють удосконаленими характеристиками, одержані з використанням стандартних методик імунізації тварин, утворенням гібридом і селекції антитіл з певними характеристиками. Термін «антагоніст» стосується молекули, здатної інгібувати один або кілька проявів біологічної активності молекули-мішені, наприклад, передачу сигналу CXCR5. Антагоніст може перешкоджати зв’язуванню рецептора з лігандом і навпаки, виводячи з ладу або знищуючи клітини, активовані лігандом, і/або блокуючи активацію рецептора або ліганду (наприклад активацію тирозинкінази), або передачу сигналу після зв’язування ліганду з рецептором. Антагоніст у стані повністю блокувати взаємодія рецептор-ліганд або може суттєво пригнічувати такі взаємодії. Для цілей даного винаходу всі подібні аспекти впливу антагоніста вважаються еквівалентними. Тому в об’єм даного винаходу включаються антагоністи (наприклад нейтралізуючі антитіла), які зв’язуються з CXCR5, CXCL13 або іншими лігандами CXCR5, або комплексом CXCR5 і його лігандом, наприклад CXCL13; варіанти амінокислотних послідовностей або похідні CXCR5 або CXCL13, які є антагоністами взаємодії між CXCR5 і лігандом, наприклад CXCL13; розчинний CXCR5, в одному з варіантів злитий з гетерологічною молекулою, наприклад областю імуноглобуліну (наприклад, імуноадгезин); комплекс, що включає CXCR5, пов’язаний з іншим рецептором або біологічною молекулою, пептиди із синтетичною або нативною послідовністю, які зв’язуються з CXCR5; та ін. Термін «агоніст» стосується сполуки, що включає білок, поліпептид, пептид, антитіло, фрагмент антитіла, кон’югат, більшу молекулу, малу молекулу, яка активує один або кілька проявів біологічної активності CXCR5. Агоністи можуть втручатися у зв’язування рецептора з 14 UA 104715 C2 5 10 15 20 25 30 35 40 45 50 55 лігандом і навпаки, діяти як мітоген клітин, активованих лігандом, і/або перешкоджати інактивації клітин або інгібуванню сигналу після зв’язування ліганду з рецептором. Для цілей даного винаходу всі подібні аспекти впливу агоніста вважаються еквівалентними. Тому в об’єм даного винаходу включаються агоністи, які зв’язуються з CXCR5, CXCL13 або іншими лігандами CXCR5, або комплексом CXCR5 і його лігандом, наприклад CXCL13; варіанти амінокислотних послідовностей або похідні CXCR5 або CXCL13, які стимулюють взаємодію між CXCR5 і лігандом, наприклад CXCL13; розчинний CXCR5, в одному з варіантів злитий з гетерологічною молекулою, наприклад областю імуноглобуліну (наприклад, імуноадгезин); комплекс, що включає CXCR5, пов’язаний з іншим рецептором або біологічною молекулою, пептиди із синтетичною або нативною послідовністю, які зв’язуються з CXCR5; та ін. Агоністом звичайно є сполука, яка прямо активує CXCR5, наприклад, для передачі сигналу. Використовувані в даному документі терміни «клітина», «лінія клітин» і «клітинна культура» включають їхнє потомство. Також мається на увазі, що все потомство не може бути в точності ідентичним, наприклад, по вмісту ДНК, внаслідок навмисних або випадкових мутацій. Сюди входить варіант потомства, який має такі ж функції або біологічну характеристику, що представляє інтерес, для яких проводиться скринінг у вихідних клітинах. «Клітина-хазяїн», використовувана в даному винаході, як правило, є прокаріотичною або еукаріотичною клітиною, що відбирається залежно від поставленої мети. «Трансформація» клітинного організму, клітини або клітинної лінії за допомогою нуклеїнової кислоти означає введення нуклеїнової кислоти в клітину-мішень, для того, щоб забезпечити можливість реплікації нуклеїнової кислоти як у якості позахромосомного елемента, так і за допомогою хромосомної інтеграції, а також, можливо, її експресію. «Трансфекцією» клітини або організму нуклеїновою кислотою називається поглинання нуклеїнової кислоти, наприклад вектора експресії, клітиною або організмом незалежно від того, чи буде фактично проходити експресія яких-небудь кодуючих послідовностей. Терміни «трансфікована клітина-хазяїн» і «трансформована» стосуються клітини, у яку була введена нуклеїнова кислота. Характерною прокаріотичною клітиною-хазяїном є різні штами E. coli. Характерними еукаріотичними клітинами-хазяями є клітини ссавців, наприклад клітини яєчників китайського хом’ячка або клітини людського походження. Послідовність нуклеїнової кислоти, що вводиться, може бути взята від того ж виду, що й вид клітини-хазяїна, або від виду, що відрізняється від виду клітинихазяїна, або ж може являти собою вихідну послідовність нуклеїнової кислоти, що містить певні чужорідні й певні гомологічні нуклеїнові кислоти. Трансформація може також відбуватися за допомогою трансдукції або інфекції елементами вірусного походження. Термін «вектор» означає конструкцію нуклеїнової кислоти, носій, що містить нуклеїнову кислоту, трансген, чужорідний ген або розглянутий ген, який може бути функціонально пов’язаний з підходящими контрольними послідовностями для експресії трансгену в організмі підходящого хазяїна. До таких контрольних послідовностей, наприклад, належать промотор для проведення транскрипції, додаткова операторна послідовність для контролю такої транскрипції, послідовність, що кодує придатні сайти зв’язування мРНК на рибосомі, а також послідовності, які контролюють зупинку транскрипції й трансляції. Вектором може бути плазміа, частка фага або просто потенційна геномна вставка. Після трансформації в підходящого хазяїна вектор може реплікуватися й функціонувати незалежно від геному хазяїна, або може в деяких випадках інтегруватися в геном клітини-хазяїна. У наведеному описі терміни «плазміда» і «вектор» використовуються рівнозначно, оскільки плазміда є широко застосовуваною формою вектора. Разом з тим передбачається, що винахід включає такі інші форми векторів, які виконують еквівалентні функції носіїв, які відомі або стають відомі фахівцям в галузі, наприклад віруси, синтетичні молекули, які містять нуклеїнові кислоти, ліпосоми та ін. Під «ссавцем» для цілей лікування розуміється будь-яка тварина, що класифікується як ссавець, у тому числі люди, домашні й сільськогосподарські тварини, нелюдиноподібні примати, а також тварини із зоопарків, спортивні або свійські тварина, наприклад собаки, коні, кішки, корови та ін. Розглянуті антитіла можуть піддаватися скринінгу або можуть використовуватися в методах аналізу, які описані в даному документі або відомі фахівцям в галузі. Часто для таких аналізів потрібен реагент, який можна виявити доступними методами, що наприклад містить мітку. Використовуваний у даному документі термін «мітка» стосується детектованої сполуки або складу, який прямо або побічно може кон’югуватися з молекулою або білком, наприклад антитілом. Мітка може бути сама по собі детектованою (наприклад радіоізотопні мітки або флуоресцентні мітки) або, у випадку ферментативної мітки, може каталізувати хімічні зміни субстрату або складу, які піддаються детектуванню. 15 UA 104715 C2 5 10 15 20 25 30 35 40 45 50 55 60 Використовуваний у даному документі термін «тверда фаза» означає неводну матрицю, до якої може прикріплюватися частинка або молекула, наприклад антитіло згідно з даним винаходом. Прикладами твердих фаз, що входять в об’єм даного винаходу, є повністю або частково утворені зі скла (наприклад скла з контрольованою пористістю), полісахариди (наприклад агароза), поліакриламіди, полістирол, полівініловий спирт і силікони. У деяких прикладах здійснення, залежно від контексту, тверда фаза може являти собою ямку в аналітичному планшеті; в інших випадках вона може використовуватися в колонці для очищення (наприклад, у колонці для афінної хроматографії). Таким чином, твердою фазою може бути папір, гранули, полімерна поверхня, чип та ін., вона може бути виготовлена із всіляких матеріалів, наприклад нітроцелюлози, агарози, полістиролу, поліпропілену, силікону та ін., а також може мати всілякі конфігурації. Розчинний CXCR5 або його фрагменти, наприклад позаклітинний домен (EC), можуть використовуватися як імуногени для одержання розглянутих антитіл. Імуноген може виходити або виділятися із природних джерел, або може бути одержаний за допомогою рекомбінантних + технологій. Цільні клітини, наприклад клітини CXCR5 , клітини, одержані із природних джерел (наприклад, В-клітини, лінії В-клітин або лінії ракових клітин), або трансформовані (або трансфіковані) клітини, одержані за допомогою рекомбінантних методик для експресії або, можливо, надекспресії CXCR5, можуть використовуватися як імуноген для виготовлення антитіл, що представляють інтерес. Крім того, можуть використовуватися мембранні препарати, що переносять CXCR5 або синтетичні пептиди, або процесовані поліпептиди, відповідні областям EC CXCR5, які відомі фахівцям в галузі. Як імуноген може використовуватися EC CXCR5, довжиною приблизно 60 амінокислот, або його частина. Фахівцям в галузі будуть очевидні й інші форми імуногена, придатні для одержання антитіл, наприклад кон’югати. Таким чином, CXCR5 або його частини можуть зв’язуватися з молекулою носія, наприклад з альбуміном або KLH, для того, щоб використовуватися як імуноген. Звичайно, у випадку клітин, що експресують CXCR5, саме домен EC є переважним імуногеном або частиною імуногена. Як відомо фахівцям в галузі, ген або кДНК, що кодують CXCR5, можуть клонуватися в плазміду або інший вектор експресії й експресуватися в рамках кожної з декількох систем експресії відповідно до методів, добре відомих кваліфікованим фахівцям в галузі, див., наприклад, нижче. Через виродження генетичного коду для експресії рекомбінантного CXCR5 або його функціональних продуктів на практиці може використовуватися множина нуклеотидних послідовностей, що кодують білок CXCR5 або поліпептиди. Нуклеотидну послідовність можна змінювати за допомогою селекції комбінацій на підставі можливого вибору кодонів, наприклад тих, які переважні для клітини-хазяїна. Комбінації становлять у відповідності до стандартного триплетного генетичного коду у застосуванні до нуклеотидної послідовності, яка кодує існуючий у природі CXCR5, і можуть розглядатися всі подібні варіації. Тому кодуюча CXCR5 послідовність може бути змінена, так щоб містити кодони, які експресують розглянуті амінокислоти, при цьому триплетний кодон є переважним для механізму експресії генів у клітині-хазяїні, наприклад людській клітині. Кожний з таких поліпептидів може використовуватися для імунізації тварини, наприклад верблюдів, або в іншій системі для генерації антитіл, які зв’язуються з CXCR5. Як відзначалося вище, при сприятливих обставинах імуноген CXCR5 може експресуватися у формі злитого білка, що містить CXCR5, пов’язаний із сегментом злиття, який звичайно являє собою поліпептид з однією або декількома корисними функціями. Сегмент злиття часто допомагає проводити очищення білка, наприклад, дає можливість виділити й очистити злитої білок за допомогою афінної хроматографії, але може також використовуватися для підвищення імуногенності. Злиті білки можна продукувати за допомогою культивування рекомбінантних клітин, трансформованих за допомогою злитої послідовності нуклеїнової кислоти, яка кодує білок, пов’язаний з карбоксильним і/або амінотермінальним закінченням поліпептиду CXCR5. Сегменти злиття можуть, серед інших, включати області F c імуноглобуліну, глутатіон-Sтрансферазу, β-галактозидазу, полігістидиновий сегмент, який у стані зв’язуватися із двовалентним іоном металу, і білок, що зв’язує мальтозу. Молекули нуклеїнових кислот, що кодують амінокислотну послідовність мутантів, можуть бути одержані за допомогою різних методів, відомих фахівцям в галузі. До таких методів, серед інших, належать олігонуклеотидний (або сайт-спрямований) мутагенез, ПЛР-мутагенез і касетний мутагенез раніше виготовленого мутованого або немутованого варіанта розглянутої молекули (див., наприклад, Kunkel, Proc Natl Acad Sci USA 82:488 (1985)). Рекомбінантна експресія антитіла згідно з даним винаходом або його фрагмента, похідного або аналога (наприклад, важкого або легкого ланцюга антитіла згідно з даним винаходом, одноланцюжкового антитіла згідно з даним винаходом або антитіла мутеїну згідно з даним 16 UA 104715 C2 5 10 15 20 25 30 35 40 45 50 55 60 винаходом) має на увазі конструювання вектора експресії, що містить полінуклеотид, який кодує антитіло або фрагмент антитіла, як описано в даному документі. Після одержання полінуклеотиду, що кодує молекулу антитіла, можна приготувати вектор для продукції антитіла, використовуючи технологію рекомбінантної ДНК, відому фахівцям в галузі. Конструюється вектор експресії, що містить послідовності, що кодують антитіло, а також відповідні маркери контролю транскрипції й трансляції. До таких методів належать, наприклад, методики рекомбінантної ДНК in vitro, синтетичні методики й генетична рекомбінація in vivo. Вектор експресії переноситься в клітину-хазяїна за допомогою стандартних методик, і трансфіковані клітини потім культивують за допомогою стандартних методик з метою одержати антитіло згідно з даним винаходом або його фрагмент. В одному з аспектів винаходу в клітиніхазяїні може проводитися спільна експресія векторів, що кодують важкий і легкий ланцюги, для того, щоб забезпечити експресію всієї молекули імуноглобуліну, як це докладно описано в даному документі. При експресії молекул антитіла, представлених у даному винаході, можуть використовуватися найрізноманітніші системи хазяїна/вектора експресії. Такі системи експресії являють собою носії для одержання й наступного очищення розглянутих кодуючих послідовностей, але також являють собою клітини, які при трансформації або трансфекції відповідними, кодуючими нуклеотидними послідовностями в стані експресувати молекулу антитіла згідно з даним винаходом in situ. Бактеріальні клітини, наприклад, E. coli, а також еукаріотичні клітини широко використовуються для експресії молекули рекомбінантного антитіла, особливо для експресії всієї молекули рекомбінантного антитіла. Наприклад, клітини ссавців, такі як клітини CHO, у комбінації з вектором, що наприклад несуть основний елемент проміжного раннього гена-промотора цитомегаловірусу людини, є ефективною системою експресії антитіл (Foecking et al., Gene 45:101 (1986); і Cockett et al., Bio/Technology 8:2 (1990)). Як відомо фахівцям в галузі, для виготовлення білків, що представляють інтерес, можуть також використовуватися рослини й культури рослинних клітин, клітини комах та ін. Крім того, може вибиратися клітина-хазяїн, яка модулює експресію введених послідовностей або модифікує й забезпечує процесінг генного продукту конкретним заданим чином. Подібні модифікації (наприклад, глікозилування) і процесінг (наприклад, розщеплення) білкових продуктів можуть мати важливе значення для функціонування білка. Різні клітини-реципієнти мають характерні й специфічні механізми пост-трансляційного процесінга й модифікації білків і генних продуктів. Відповідні лінії клітин або системи реципієнтів можуть вибиратися для забезпечення необхідної модифікації й процесінга розглянутого експресованого антитіла. Отже, може використовуватися еукаріотична клітина-хазяїн, яка має клітинний апарат для належного процесінга первинного транскрипта, глікозилування й фосфорилування генного продукту. До таких клітин-реципієнтів ссавців, серед інших, належать CHO, COS, 293, 3T3 або клітини мієломи. Стабільна експресія є переважною для довгострокової високопродуктивної продукції рекомбінантних білків. Наприклад, можуть бути сконструйовані лінії клітин, які стабільно експресують молекулу антитіла. Замість використання векторів експресії, які містять вірусні джерела реплікації, клітина-хазяїн може бути трансформована за допомогою ДНК в умовах регулювання, яке забезпечується відповідними елементами контролю експресії (наприклад, промотором, енхансером, послідовностями, термінаторами транскрипції, сайтами поліаденілування та ін.) і селектованим маркером. Після інтродукції чужорідної ДНК сконструйованим клітинам протягом одного або двох днів дають рости в збагаченім середовищі, потім їх переносять в селективне середовище. Селектований маркер у рекомбінантній плазміді надає стабільність стосовно селекції й дозволяє клітинами стабільно інтегрувати плазміду в хромосому з наступним розвитком у лінію клітин. Такі сконструйовані лінії клітин зручні не тільки для продукції антитіл, але також придатні для скринінга й оцінки сполук, які прямо або побічно взаємодіють із молекулою антитіла. Може використовуватися ряд систем селекції, у тому числі, серед інших, тимідинкіназа вірусу Herpes simplex (Wigler et al., Cell 11:223 (1977)), гіпоксантингуанінфосфорибозилтрансфераза (Szybalska et al., Proc Natl Acad Sci USA 48:202 (1992)), селекція глутаматсинтази в присутності метіонінсульфоксиміду (Adv Drug Del Rev 58, 671, 2006, див. також веб-сайт або добірку літератури Lonza Group Ltd.), а також гени аденінфосфорибозилтрансферази (Lowy et al., Cell 22:817 (1980)) у клітинах tk, hgprt або aprt, відповідно. Також стійкість до антиметаболітів може використовуватися як основа для селекції наступних генів: dhfr, який забезпечує стійкість до метатрексату (Wigler et al., Proc Natl Acad Sci USA 77:357 (1980); O’hare et al., Proc Natl Acad Sci USA 78:1527 (1981)); gpt, який визначає стійкість до мікофенолової кислоти (Mulligan et al., Proc Natl Acad Sci USA 78:2072 (1981)); neo, 17 UA 104715 C2 5 10 15 20 25 30 35 40 45 50 55 60 який забезпечує стійкість до аміноглікозиду, G-418 (Wu et al., Biotherapy 3:87 (1991)); hygro, який визначає стійкість до гігроміцину (Santerre et al., Gene 30:147 (1984)). Методи, відомі фахівцям в галузі технології рекомбінантної ДНК, можуть стандартним чином застосовуватися для селекції бажаного рекомбінантного клону, і такі методи описані, наприклад, в Ausubel et al., eds., Current Protocols in Molecular Biology, John Wiley & Sons (1993); Kriegler, Gene Transfer and Expression, A Laboratory Manual, Stockton Press (1990); Dracopoli et al., eds., Current Protocols in Human Genetics, John Wiley & Sons (1994); і Colberre-Garapin et al., J Mol Biol 150:1 (1981). Рівні експресії молекули антитіла можуть бути підвищені за допомогою векторної ампліфікації (наприклад, див. Bebbington et al., в DNA Cloning, Vol. 3. Academic Press (1987)). У випадку можливості ампліфікації маркера у векторній системі, експресуючій антитіло, збільшення рівня інгібітору, присутнього в культурі, буде приводити до росту числа копій маркерного гена. Оскільки ампліфікована область асоційована з геном антитіла, продукція антитіла буде також зростати (Crouse et al., Mol Cell Biol 3:257 (1983)). Клітина-хазяїн може спільно трансфікуватися двома або більше векторами експресії згідно з даним винаходом, наприклад першим вектором, що кодує похідний від важкого ланцюга поліпептид, і другим вектором, що кодує похідний від легкого ланцюга поліпептид. Ці два вектори можуть містити ідентичні селектовані маркери, які забезпечують рівну експресію поліпептидів важкого й легкого ланцюгів. Як альтернатива може використовуватися одиничний вектор, який кодує й у стані експресувати поліпептиди як важкого, так і легкого ланцюгів. У подібних випадках легкий ланцюг повинний розташовуватися до важкого, щоб уникнути появи надлишку токсичного вільного важкого ланцюга (Proudfoot, Nature 322:52 (1986); і Kohler, Proc Natl Acad Sci USA 77:2197 (1980)). Послідовності, що кодують, для важкого й легкого ланцюгів можуть включати кДНК або геномну ДНК. Після того як молекула антитіла згідно з даним винаходом була одержана в організмі тварини, синтезована хімічним шляхом або за допомогою рекомбінантної експресії, її можна очистити за допомогою будь-якого методу, відомого фахівцям в галузі, застосовуваного для очищення молекули імуноглобуліну, наприклад хроматографії (наприклад іонообмінної, афінної, зокрема, що спирається на афінність CXCR5 для білка A, а також гель-фільтрацією та ін.), центрифугування, диференціальної розчинності або за допомогою будь-якої іншої стандартної методики для очищення білків. Крім того, для спрощення процесу очищення антитіла згідно з даним винаходом або їх фрагменти можуть бути злиті в гетерологічні поліпептидні послідовності, описані в даному документі або ж відомі фахівцям в галузі. Рекомбінантний білок CXCR5, який розглядається в наведених нижче прикладах, використовувався для імунізації мишей, для того, щоб одержати гібридоми, які продукують моноклональні антитіла згідно з даним винаходом. З одержаних моноклональних антитіл відбиралися ті, які мали корисні терапевтичні властивості, наприклад, перешкоджали зв’язуванню ліганда CXCR5 із цим білком. Відібрані антитіла потім модифікувалися з метою додання їм корисних властивостей, наприклад, підвищеної стабільності in vivo. Антитіла згідно з даним винаходом можуть бути одержані будь-яким зручним методом, відомим фахівцям в галузі. До антитіл згідно з даним винаходом можуть належати поліклональні антитіла, хоча через модифікацію антитіл для оптимізації застосування на людині, а також для оптимізації застосування антитіл самих по собі, моноклональні антитіла є переважними через простоту одержання й обробки конкретних білків. Методи виготовлення поліклональних антитіл відомі кваліфікованим фахівцям в галузі (Harlow et al., Antibodies: a Laboratory Manual, Cold Spring Harbor Laboratory Press, 2nd ed. (1988)). Наприклад, розглянутий у даному документі імуноген може вводитися різним тваринамреципієнтам, у тому числі, серед інших, кроликам, мишам, верблюдам, щурам та ін., для того, щоб індукувати продукцію сироватки, що містить поліклональні антитіла, специфічні стосовно CXCR5. Введення імуногену може припускати одну або кілька ін’єкцій імунізуючого агента й, якщо бажане, ад’юванта. Для посилення імунної відповіді можуть використовуватися різні ад’юванти, що залежать від виду хазяїна, і до них, серед іншого, належать ад’юванти Фройнда (повні й неповні), мінеральні масла, гелі, гідроксид алюмінію, поверхнево-активні речовини, наприклад лізолецитин, плюронілові поліоли, поліаніони, пептиди, масляні емульсії, гемоціанін лімфи равлика (KLH), динітрофенол, а також потенційно застосовні людські ад’юванти, наприклад БКГ (Bacille Calmette-Guerin) або Corynebacterium parvum. Додаткові приклади ад’ювантів, які можуть застосовуватися, включають ад’ювант MPL-TDM (монофосфорилліпід А, синтетичний дикориноміколат трегалози). Протоколи імунізації добре відомі фахівцям в галузі, і вона може проводитися відповідно до будь-якого методу, який забезпечує імунну відповідь у вибраному організмі тварини-реципієнта. Таким чином, залежно від поставленої мети в різні періоди часу можуть використовуватися найрізноманітніші методи введення. 18 UA 104715 C2 5 10 15 20 25 30 35 40 45 50 55 60 Як правило, імуноген (з ад’ювантом або без нього) вводиться ссавцеві за допомогою декількох підшкірних або внутрішньочеревинних ін’єкцій, або внутрішньом’язово, або внутрішньовенно. Імуноген може включати поліпептид CXCR5, злитий білок або їх варіанти, які можуть виходити в клітині, що продукує або надпродукує CXCR5, такою клітиною може бути існуюча в природі клітина, існуюча в природі клітина-мутант або клітина, сконструйована за допомогою генної інженерії. У певних обставинах можуть використовуватися цільні клітини, експресуючі CXCR5. Залежно від природи поліпептидів (тобто відсотка гідрофобності, гідрофільності, стабільності, сумарного заряду, ізоелектричної точки та ін.) CXCR5 або його частина можуть модифікуватися або кон’югуватися, щоб забезпечити імуногенність або більш високу імуногенність в організмі тварини, наприклад ссавця, який піддається імунізації. Наприклад, CXCR5 або його частина може кон’югуватися з носієм. Під кон’югацією розуміється хімічна кон’югація за допомогою одержання похідних активних хімічних функціональних груп імуногену й кон’югованого імуногенного білка, для того, щоб утворювати ковалентний зв’язок, або ж кон’югація з використанням методології злитих білків, або ж інших методів, відомих кваліфікованим фахівцям в галузі. Прикладами таких носіїв або імуногенних білків, серед інших, є KLH, овальбумін, сироватковий альбумін, бичачий тироглобулін, соєвий інгібітор трипсину й проміскуітетні Т-хелперні пептиди. Як описувалося вище, для посилення імунної відповіді можуть використовуватися різні ад’юванти. Після одержання придатного препарату з’являється можливість виділити конкретні антитіла з множини антитіл з використанням відомих методик розділення, наприклад афінної хроматографії, пенінга, абсорбції та ін. Таким способом можуть бути одержані індивідуальні види антитіл для подальшого дослідження, наприклад секвенування із встановленням амінокислотних послідовностей однієї або декількох CDR. Антитіла згідно з даним винаходом переважно включають моноклональні антитіла. Моноклональні антитіла можуть бути виготовлені за допомогою гібридомних методик, наприклад описаних в Kohler et al., Nature 256:495 (1975); патент США № 4376110; Harlow et al., Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, 2nd ed. (1988) і Hammerling et al., Monoclonal Antibodies and T-Cell Hybridomas, Elsevier (1981), методик рекомбінантної ДНК, наприклад виготовлення й використання трансфектом, або інших методів, відомих фахівцям в галузі. Інші приклади методів, які можуть використовуватися для продукції моноклональних антитіл, серед інших, включають, гібридомние методики В- клітин людини (Kosbor et al., Immunology Today 4:72 (1983); і Cole et al., Proc Natl Acad Sci USA 80:2026 (1983)), і EBVгібридомну методику (Cole et al., Monoclonal Antibodies and Cancer Therapy, pp. 77-96, Alan R. Liss (1985)). Такі антитіла можуть належати до будь-якого класу імуноглобулінів, у тому числі IgG, IgM, IgE, IgA і IgD, а також до будь-якого їхнього підкласу. Гібридоми, продукуючі mAb згідно з даним винаходом, можуть культивуватися in vitro або in vivo. У рамках гібридомної моделі організм хазяїна, наприклад миші, гуманізованої миші, трансгенної миші з генами імунної системи людини, хом’ячка, кролика, щура, верблюда або будь-якої іншої підходящої тварини-хазяїна, імунізується з метою активувати лімфоцити, які продукують або в стані продукувати антитіла, що специфічно зв’язуються з CXCR5. В альтернативному варіанті лімфоцити можуть бути імунізовані in vitro. Потім лімфоцити зливають із клітинами мієломи за допомогою підходящого реагенту для злиття, наприклад поліетиленгліколю, для того, щоб утворювати клітини гібридоми (Goding, Monoclonal Antibodies: Principles and Practice, Academic Press, pp. 59-103 (1986)). Як правило, при виготовленні продукуючих антитіла гібридом використовуються лімфоцити периферичної крові (PBL), якщо бажано одержати клітини людського походження, або ж клітини селезінки або лімфатичних вузлів, якщо потрібні клітини, що походять від ссавців, крім людини. Іморталізовані лінії клітин звичайно являють собою трансформовані клітини ссавців, зокрема, клітини мієломи, одержані від гризунів, великої рогатої худоби або людини. Звичайно використовують лінію клітин мієломи щурів або мишей. Клітини гібридоми можуть культивуватися в придатному культуральному середовищі, яке переважно містить одну або кілька сполук, інгібуючих ріст або виживання незлитих, іморталізованих клітин. Наприклад, якщо в батьківських клітинах був відсутній фермент гіпоксантин-гуанінфосфорибозилтрансферази (HGPRT або HPRT), культуральне середовище для гібридом, як правило, буде містити гіпоксантин, аміноптерин і тимідин («середовище НАТ»)-речовини, які перешкоджають росту HGPRT-дефіцитних клітин. До переважних ліній іморталізованих клітин належать такі, які ефективно беруть участь у злитті, підтримують стабільно високий рівень продукції антитіла відібраними антитілопродукуючими клітинами й чутливі до середовища, наприклад до середовища НАТ. До таких ліній клітин мієломи належать лінії мієломи миші, наприклад одержані з мишачих пухлин MOPC 19 UA 104715 C2 5 10 15 20 25 30 35 40 45 50 55 60 21 і MPC-11, що поставляються Salk Institute Cell Distribution Center, San Diego, Calif. а також клітини SP2/0, FO або X63-Ag8-653, що поставляються American Type Culture Collection, Manassas, VA. Описувалася також продукція людських моноклональних антитіл з ліній клітин мієломи людини й мишачо-людських клітин гетеромієломи (Kozbor, J Immunol 133:3001 (1984); і Brodeur et al., Monoclonal Antibody Production Techniques and Applications, Marcel Dekker, Inc, pp. 51-63 (1987)). Може також використовуватися лінія клітин мієломи миші NSO (European Collection of Cell Cultures, Salisbury, Wilshire, UK). В альтернативному варіанті для одержання гібридом пропонується використовувати електричне злиття замість хімічного. В місці злиття В-клітини можуть бути іморталізовані з використанням, наприклад, вірусу Епштейна-Барр або іншого гена, що трансформує, див., наприклад, Zurawaki et al., в Monoclonal Antibodies, ed., Kennett et al., Plenum Press, pp. 19-33. (1980). Можуть також використовуватися трансгенні миші й миші з важким комбінованим імунодефіцитом (SCID), яким трансплантовані В-лімфоцити людини. Культуральне середовище, в якому вирощують клітини гібридоми, аналізується на предмет продукції моноклональних антитіл, спрямованих проти CXCR5. Специфічність зв’язування моноклональних антитіл, продукованих клітинами гібридоми, може визначатися за імунопреципітацією або аналізом зв’язування in vitro, наприклад радіоімунологічним аналізом (RIA), флуороцитометричним аналізом (FACS) або твердофазним імуноферментним аналізом (ELISA). Перераховані методики відомі в галузі, і ними володіє будь-який фахівець в галузі. Афінність зв’язування моноклонального антитіла з CXCR5 може, наприклад, визначатися аналізом по Скетчарду (Munson et al., Anal Biochem 107:220 (1980)). Після ідентифікації клітин гібридоми, продукуючих антитіла з бажаною специфічністю, афінністю й/або активністю, клони можуть бути субклоновані з використанням процедур серійних розведень і культивуватися за допомогою стандартних методів (Goding, Monoclonal Antibodies: Principles and Practice, Academic Press, pp. 59-103 (1986)). До придатних культуральних середовищ, наприклад, належать модифіковане середовище Дульбеко-Ігла (DMEM) або середовище RPMI-1640. Крім того, клітини гібридоми можуть вирощуватися in vivo у формі асцитних пухлин в організмі тварини. Моноклональні антитіла, продуковані субклонами, належним чином відділяються або ізолюються з культурального середовища, асцитної рідини або сироватки із застосуванням стандартних процедур очищення імуноглобуліну, наприклад білка А-сефароза, білка Gсефароза, хроматографії на гідроксіапатиті, гель-фільтраційної хроматографії, гельелектрофорезу, діалізу або афінної хроматографії. В галузі існує широка різноманітність методик продукції моноклональних антитіл, а тому винахід не обмежується тільки їх продукцією в гібридомах. Наприклад, моноклональні антитіла можуть бути одержані на основі методик рекомбінантної ДНК, наприклад методик, подібних описаним у патенті США № 4816567. У даному контексті термін «моноклональне антитіло» стосується антитіла, одержаного від єдиного еукаріотичного, фагового або прокаріотичного клону. ДНК, що кодує моноклональні антитіла згідно з даним винаходом, легко виділяється й секвенується з використанням стандартних процедур (наприклад, із застосуванням олігонуклеотидних зондів, які в стані специфічно зв’язуватися з генами, що кодують важкий і легкий ланцюги мишачих антитіл або ці ж ланцюги людини, гуманізовані або з інших джерел) (Innis et al. в PCR Protocols. A Guide to Methods and Applications, Academic (1990), і Sanger et al., Proc Natl Acad Sci 74:5463 (1977)). Клітини гібридом служать як джерело таких ДНК. Після виділення ДНК може вводитися у вектори експресії, які потім трансфікуються в клітиниреципієнти, наприклад клітини E. coli, клітини NS0, клітини COS, клітини яєчників китайського хом’ячка (CHO) або клітини мієломи, які в інших ситуаціях не продукують імуноглобуліновий білок, для того, щоб добитися синтезу моноклональних антитіл у рекомбінантних клітинахреципієнтах. ДНК може також модифікуватися, наприклад, за допомогою підстановки константних доменів, що кодує послідовності важких і легких ланцюгів людини замість гомологічних послідовностей миші (патент США № 4816567; і Morrison et al., Proc Natl Acad Sci USA 81:6851 (1984)) або ж ковалентного зв’язування кодуючої послідовності імуноглобуліну з усією або частиною кодуючої послідовності неімуноглобулінового поліпептиду. Такий неімуноглобуліновий поліпептид може бути використаний замість константних доменів антитіла згідно з даним винаходом або замість варіабельних доменів одного із сайтів комбінування CXCR5 антитіла згідно з даним винаходом, так щоб утворювати химерне бівалентне антитіло. Антитіла можуть бути моновалентними. Методи одержання моновалентних антитіл добре відомі фахівцям в галузі. Наприклад, один з методів передбачає рекомбінантну експресію 20 UA 104715 C2 5 10 15 20 25 30 35 40 45 50 55 60 легкого ланцюга імуноглобуліну й модифікованого важкого ланцюга. Важкий ланцюг звичайно обрізається в будь-якій точці області Fc, для того, щоб попередити утворення перехресних зшивок у важкому ланцюзі. В альтернативному варіанті відповідні цистеїнові залишки заміняються іншим амінокислотним залишком або видаляються, для того, щоб перешкодити перехресним зшивкам. Фрагменти антитіла, які розпізнають специфічні епітопи, можуть бути одержані з використанням відомих методик. Такі фрагменти традиційно одержують методом протеолітичного руйнування інтактних антитіл (див., наприклад, Morimoto et al., J Biochem Biophys Methods 24:107 (1992); і Brennan et al., Science 229:81 (1985)). Наприклад, фрагменти Fab і F(ab’)2 згідно з даним винаходом можуть бути одержані протеолітичним розщепленням молекул імуноглобуліну під дією таких ферментів, як папаїн (для одержання фрагментів Fab) або пепсин (для одержання фрагментів F(ab’)2). Фрагменти F(ab’)2 містять варіабельну область, константний домен легкого ланцюга й константну область CH1 важкого ланцюга. Разом з тим ці фрагменти можуть бути одержані прямо з рекомбінантних клітин-реципієнтів. Наприклад, фрагменти антитіла можуть бути виділені з фагової бібліотеки антитіла. В альтернативному варіанті фрагмени F(ab’)2-SH можуть бути прямо виділені з E. coli і хімічно пов’язані з утворенням фрагментів F(ab’)2 (Carter et al., Bio/Technology 10:163 (1992). Відповідно до іншого підходу фрагменти F(ab’)2 можуть бути прямо виділені з культури рекомбінантних клітин-реципієнтів. Досвідченому експериментаторові будуть очевидні й інші методики одержання фрагментів антитіл. В інших прикладах здійснення переважним антитілом є одноланцюжковий фрагмент FV (FV) (WO 93/16185). Для деяких додатків, у тому числі застосування антитіл в організмі людини in vivo і аналітичних методах детектування in vitro, може виявитися кращим використовувати химерні, гуманізовані або людські антитіла. Методи одержання химерних антитіл відомі фахівцям в галузі, див., наприклад, Morrison, Science 229:1202 (1985); Oi et al., Biotechniques 4:214 (1986); Gillies et al., J Immunol Methods 125:191 (1989); і патенти США №№ 5807715; 4816567 і 4816397. Гуманізовані антитіла одержують із молекул антитіл, які продукуються організмами, крім людини, і зв’язуються з CXCR5, причому одна або декілька їх CDR введена в області FR молекули людського імуноглобуліну. Антитіла можуть гуманізуватися на основі безлічі методик, відомих фахівцям в галузі, у тому числі, наприклад, вставки в CDR (EPO 239,400; WO 91/09967; і патенти США №№ 5225539; 5530101 і 5585089), зміни поверхні антитіл (EPO 592,106; EPO 519,596; Padlan, Molecular Immunology 28:489 (1991); Studnicka et al., Protein Engineering 7:805 (1994); і Roguska et al., Proc Natl Acad Sci USA 91:969 (1994)), і перестановки в ланцюзі (патент США № 5565332). Гуманізоване антитіло містить один або кілька амінокислотних залишків, джерелом яких є будь-який організм, крім людського. Не присутні в людини амінокислотні залишки часто називають «імпортованими» залишками, які звичайно беруть із «імпортованого» варіабельного домену. Гуманізація може в основному проводитися з використанням методів Вінтера зі співробітниками (Jones et al., Nature 321:522 (1986); Riechmann et al., Nature 332:323 (1988); і Verhoeyen et al., Science 239:1534 (1988)), за допомогою заміщення нелюдськими CDR або ділянками послідовностей CDR відповідні послідовності людського антитіла. Відповідно, такі «гуманізовані» антитіла є химерними (патент США № 4816567), у яких значно менша ділянка в порівнянні з інтактним людським варіабельним доменом заміщена на відповідну послідовність організму, що не є людським. На практиці гуманізовані антитіла звичайно являють собою людські антитіла, у яких певні залишки CDR і, можливо, деякі залишки FR заміщені аналогічними сайтами антитіл гризунів. Константна область важкого ланцюга, який може включати один або декілька доменів важкого ланцюга, а також шарнірна область можуть бути взяті від будь-якого класу або підкласу, для того, щоб добитися бажаного ефекту, наприклад конкретної ефекторної функції. Часто остовні залишки каркасних ділянок людини можуть бути замінені відповідним залишком CDR донорного антитіла, для того, щоб змінити й, по можливості, поліпшити зв’язування антигену. Остовні заміщення визначають по методах, відомих фахівцям в галузі, наприклад за допомогою моделювання взаємодій CDR і остовних залишків, для того, щоб визначити остовні залишки, що мають важливе значення для зв’язування антигену, а також шляхом зіставлення послідовності для ідентифікації незвичайних остовних залишків у конкретних положеннях, див., наприклад, патент США № 5585089; і Riechmann et al., Nature 332:323 (1988). Крім того, переважно, щоб гуманізовані антитіла зберігали високу афінність до CXCR5, а також зберігали або здобували інші сприятливі біологічні властивості. Таким чином, гуманізовані антитіла готуються в рамках процесу аналізу вихідних послідовностей і різних концептуальних 21 UA 104715 C2 5 10 15 20 25 30 35 40 45 50 55 60 гуманізованих продуктів за допомогою тривимірних моделей вихідних і гуманізованих послідовностей. Тривимірні моделі імуноглобулінів широко доступні й відомі фахівцям в галузі. Існують комп’ютерні програми, які візуально представляють і відображають можливі тривимірні конформаційні структури вибраних кандидатів імуноглобулінових послідовностей. Вивчення зображень дозволяє проводити аналіз імовірної ролі різних залишків у функціонуванні імуноглобулінової послідовності-кандидата, тобто аналіз залишків, які впливають на здатність імуноглобуліну-кандидата зв’язувати CXCR5. Таким чином, можуть відбиратися й комбінуватися залишки FR з реципієнтної і імпортованої послідовностей, для того, щоб максимізувати бажану характеристику антитіла, наприклад, зростаючої афінності до антигену-мішені, хоча саме залишки CDR прямо й найбільш істотним чином впливають на зв’язування CXCR5. Області CDR також можуть модифікуватися, так щоб містити одну або кілька амінокислот, що відрізняються від одержаних від вихідного антитіла, від якого була взята CDR, для того, щоб забезпечити посилення або появу інших властивостей, що представляють інтерес, наприклад зв’язування з більшою афінністю або більшою авідністю. Можна проводити маніпуляції й вносити зміни в певні частини константних областей антитіла, для того, щоб додати гомологам, похідним, фрагментам і іншим елементам антитіла властивості, що відрізняються від тих, що спостерігалися у вихідному антитілі або кращі в порівнянні з ним. Так, наприклад, багато антитіл IgG4 утворюють внутрішньоланцюгові дисульфідні зв’язки на околицях шарнірної області. Внутрішньоланцюговий зв’язок у стані дестабілізувати вихідну бівалентну молекулу з утворенням моновалентних молекул, що містять важкий ланцюг з асоційованим легким ланцюгом. Такі молекули можуть знову асоціюватися, але вже випадковим чином. Відзначалося, що модифікація амінокислот у шарнірній області молекул IgG4 може знизити ймовірність утворення внутрішньоланцюгового зв’язку, тим самим стабілізуючи молекулу IgG4, що зведе до мінімуму ймовірність утворення біспецифічних молекул. Подібна модифікація може виявитися корисною, якщо використовуваним для лікування антитілом є молекула IgG4, оскільки зросла стабільність буде зводити до мінімуму ймовірності дисоціації молекули в процесі одержання й виробництва, а також і in vivo. Моновалентне антитіло може не мати такої ж ефективності, що й бівалентна вихідна молекула. Наприклад, якщо пацієнтові вводиться бівалентний IgG4, відсоток бівалентного IgG4 спадає до приблизно 30% за двотижневий період. Заміщення амінокислоти в положенні 228 збільшує стабільність IgG4. Серин, який знаходиться в положенні 228, може бути заміщений на іншу амінокислоту, наприклад, на одну з інших 19 амінокислот. Така зміна може бути зроблена, зокрема, у випадку рекомбінантних антитіл де кодуючи послідовність нуклеїнової кислоти може бути мутована, для того, щоб одержати, заміняючу амінокислоту в положенні 228. Наприклад, компонент S може бути замінений на пролін. Інший набір амінокислот, придатний для модифікації, включає амінокислоти в шарнірній області, які впливають на зв’язування молекули, що містить важкий ланцюг з рецептором, що зв’язуються з Fc, і інтерналізацію зв’язаного антитіла. У молекулах IGG1 до таких амінокислот належать залишки із приблизно 233 по приблизно 237 (Glu-Leu-Leu-Gly-Gly); (SEQ ID №:49) із приблизно 252 по приблизно 256 (Met-Ile-Ser-Arg-Thr) (SEQ ID №:50) і із приблизно 318 (Glu) по приблизно 331 (Pro), включаючи, наприклад, Lys320, Lys322 і Pro329. Використання повністю людських антитіл особливо бажане при терапевтичному впливі на людей-пацієнтів. Людські антитіла можуть виготовлятися із застосуванням різних методів, відомих фахівцям в галузі, у тому числі фаг-дисплея, описаних вище, з використанням бібліотеки антитіл людини, одержаних з імуноглобулінових послідовностей людини, див. патенти США №№ 4444887 і 4716111; і WO 98/46645, WO 98/50433, WO 98/24893, WO 98/16654, WO 96/34096, WO 96/33735 і WO 91/10741. Методики з робіт Cole et al. і Boerder et al. також можуть застосовуватися для виготовлення людських моноклональних антитіл (Cole et al., Monoclonal Antibodies and Cancer Therapy, Alan R. Liss (1985); і Boerner et al., J Immunol 147:86 (1991)). Людські антитіла можуть бути також одержані з використанням трансгенних мишей, які нездатні до експресії функціональних ендогенних імуноглобулінів, але які також експресують певні гени людського імуноглобуліну. Наприклад, генні комплекси людського важкого й легкого ланцюгів імуноглобуліну можуть вводитися в мишачі ембріональні стовбурні клітини випадковим чином або за допомогою гомологічної рекомбінації. В альтернативному варіанті людська варіабельна область, константна область і D-область можуть вводитися в мишачі ембріональні стовбурні клітини на додаток до генів важкого й легкого ланцюга людини. Мишачі гени важкого й легкого ланцюга імуноглобуліну можуть перевести в нефункціональний стан окремо або одночасно із введенням локусів людського імуноглобуліну за допомогою гомологічної 22 UA 104715 C2 5 10 15 20 25 30 35 40 45 50 55 60 рекомбінації. Зокрема, гомозиготна делеція в області JH перешкоджає ендогенній продукції антитіла. Модифіковані ембріональні стовбурні клітини розмножують і проводять їхню мікроін’єкцію в бластоциcти для одержання химерних мишей. Химерних мишей потім вирощують для одержання гомозиготного потомства, яке експресує людські антитіла, див., наприклад, Jakobovitis et al., Proc Natl Acad Sci USA 90:2551 (1993); Jakobovitis et al., Nature 362:255 (1993); Bruggermann et al., Year in Immunol 7:33 (1993); і Duchosal et al., Nature 355:258 (1992)). Трансгенні миші звичайним чином зазнають імунізації CXCR5, наприклад повною послідовністю CXCR5 або її частиною, такою як її домен EC. Моноклональні антитіла, орієнтовані проти CXCR5, можуть бути одержані від імунізованих трансгенних мишей за допомогою стандартної гібридомної технології. Трансгени людського імуноглобуліну, накопичені трансгенними мишами, реорганізуються під час диференціації В-клітин і потім піддаються класовому перемиканню й соматичній мутації. Таким чином, за допомогою даної методики є можливість продукувати терапевтично застосовні антитіла IgG, IgA, IgM і IgE. Огляд див. у роботі Lonberg et al., Int Rev Immunol 13:65-93 (1995). Обговорення продукції людських антитіл і людських моноклональних антитіл і протоколів одержання таких антитіл: див., наприклад, WO 98/24893; WO 92/01047; WO 96/34096 і WO 96/33735; EPO No. 0 598 877; і патенти США №№ 5413923; 5625126; 5633425; 5569825; 5661016; 5545806; 5814318; 5885793; 5916771 і 5939598. Крім того, такі компанії, як Amgen (Fremont, CA), Genpharm (San Jose, CA) і Medarex, Inc. (Princeton, NJ) можуть залучатися для поставки людських антитіл, націлених проти CXCR5, з використанням технології, яка аналогічна наведеній вище. Крім того, людські mAbs можуть бути одержані імунізацією мишей, яким трансплантовані людські лейкоцити периферичної крові, спленоцити або кістковий мозок (наприклад методика триом XTL Biopharmaceuticals, Israel). Повністю людські антитіла, які розпізнають вибраний епітоп, можуть бути одержані з використанням методики, яка називається «спрямованою селекцією». У рамках цього підходу відібране нелюдське моноклональне антитіло, наприклад мишаче антитіло, використовується для спрямованої селекції повністю людського антитіла, що розпізнає той же епітоп (Jespers et al., Bio/technology 12:899 (1988)). При використанні рекомбінантних методик варіант антитіла може продукуватися внутрішньоклітинно, у периплазматичному просторі, або прямо секретуватися в середовище. Якщо варіант антитіла продукується внутрішньоклітинно, на першому етапі можна відокремити залишки частинок, клітини-реципієнти або фрагменти після лізису, наприклад, за допомогою центрифугування або ультрафільтрації. У роботі Carter et al., Bio/Technology 10:163 (1992) описана процедура ізолювання антитіл, які секретуються в періплазматичний простір E. coli. Коротко говорячи, клітинну пасту обробляють ацетатом натрію (pH 3,5) і EDTA. Залишки клітин можна вилучити центрифугуванням. Якщо варіант антитіла секретується в середовище, супернатант від такої системи експресії звичайно спочатку концентрують за допомогою комерційно доступних фільтрів для концентрації білків, наприклад, системи ультрафільтрації Amicon або Millipore Pellicon. Для інгібування протеолізу може додаватися інгібітор протеази, наприклад, PMSF, а також можна включити антибіотики, щоб перешкодити росту випадкових забруднювачів. Препарат антитіл, виготовлений із клітин, може очищатися з використанням, наприклад, хроматографії на гідроксіапатиті, гель-електрофорезу, діалізу й афінної хроматографії. Придатність білка А або білка G як афінного ліганда залежить від виду й ізотипу будь-якого домену Fc імуноглобуліну, який утримується у варіанті антитіла. Білок А може застосовуватися для очищення антитіл, в основі яких лежать людські важкі ланцюги IgG1, IgG2 або IgG4 (Lindmark et al., J Immunol Meth 62:1 (1983)). Білок G може використовуватися для ізотипів мишей і людського IgG3 (Guss et al., EMBO J 5:1567 (1986)). Як матриця, з якою зв’язується афінний ліганд, найчастіше використовується агароза, але існують і інші матриці. Механічно міцні матриці, наприклад стекло з регульованою пористістю або полі(стирол-дивініл)бензол, допускають використання більш високих швидкостей потоку й дозволяють домагатися більш коротких часів обробки в порівнянні з агарозою. Якщо у варіант антитіла включений домен CH 3, для очищення зручно використовувати смолу Bakerbond ABXTM (JT Baker; Phillipsburg, NJ). Залежно від виділюваного антитіла і його варіанта можуть також застосовуватися інші методики очищення білка, наприклад фракціонування на іонообмінній колонці, осадження етанолом, зворотнофазова ВЕРХ, хроматографія на силікагелі, хроматографія на гепарин-агарозі, хроматографія на аніонообмінній або катіонообмінній смолі (наприклад, на колонці з поліаспарагіновою кислотою), хроматофокусування, SDS-PAGE і осадження сульфатом амонію. Після будь-якої стадії (стадій) попереднього очищення можна провести хроматографію з гідрофобною взаємодією при низьких рН для суміші, що містить розглянуте антитіло або його 23 UA 104715 C2 5 10 15 20 25 30 35 40 45 50 55 60 варіант і домішки, в умовах елюювання буфером при pН в інтервалі приблизно 2,5-4,5, переважно проведеного при низьких концентраціях солей (наприклад, в інтервалі приблизно 00,25 M солі). Крім того, антитіла згідно з даним винаходом можуть, у свою чергу, використовуватися для одержання антиідіотипічних антитіл, які «імітують» CXCR5, застосовуючи методики, добре відомі фахівцям в галузі (див., наприклад, Greenspan et al., FASEB J 7:437 (1989); і Nissinoff, J Immunol 147:2429 (1991)). Наприклад, антитіла, які зв’язуються з CXCR5 і конкурентно інгібують мультимеризацію й/або зв’язування ліганда з CXCR5, можуть використовуватися для одержання антиідіотипів, які «імітують» CXCR5 і домен зв’язування, і в результаті зв’язуються з CXCR5 і нейтралізують CXCR5 і/або його ліганд. Подібні нейтралізуючі антиідіотипи або фрагменти Fab таких антиідіотипів можуть використовуватися в терапевтичних схемах лікування, наприклад, для нейтралізації CXCL13. Антитіла згідно з даним винаходом можуть бути біспецифічними. Біспецифічні антитіла можуть бути моноклональними, переважно людськими або гуманізованими антитілами, які мають специфічність зв’язування щонайменше до двох різних антигенів. У даному винаході один з напрямків специфічності зв’язування стосується CXCR5, а другий може стосуватися будь-якого іншого антигену, наприклад білка клітинної поверхні, рецептора, субодиниці рецептора, ліганда, тканиноспецифічного антигена, білка вірусного походження, кодованого вірусом оболонкового білка, білка бактеріального походження, білка бактеріальної поверхні та ін. При цьому друга специфічність може бути до CXCL13. Методи виготовлення біспецифічних антитіл добре відомі фахівцям в галузі. Звичайно рекомбінантна продукція біспецифічних антитіл основана на спільній експресії пар важкий ланцюг/легкий ланцюг двох імуноглобулінів, причому два важкі ланцюги мають різні специфічності (Milstein et al., Nature 305:537 (1983)). Внаслідок випадкового розподілу важких і легких ланцюгів імуноглобуліну гібридоми (квадроми) продукують імовірну суміш десяти різних молекул антитіл, з яких лише одна має правильну біспецифічну структуру. Виділення потрібної молекули звичайно проводиться за допомогою декількох стадій афінної хроматографії. Аналогічні процедури описані в заявці WO 93/08829 і в роботі Traunecker et al., EMBO J 10:3655 (1991). Інші методи виготовлення біспецифічних антитіл приводяться, наприклад, в Kufer et al., Trends Biotech 22:238-244, 2004. Варіабельні домени антитіла з бажаними специфічностями зв’язування можна зливати з послідовностями константних доменів імуноглобулінів. Злиття краще проводиться з константним доменом важкого ланцюга імуноглобуліну, що включає щонайменше частину шарнірних областей CH2 і CH3. Щонайменше в одному із продуктів злиття може втримуватися константна область першого важкого ланцюга (CH1), що включає сайт, необхідний для зв’язування легкого ланцюга. ДНК що кодують продукти злиття важкого ланцюга імуноглобуліну, і, якщо бажане, легкий ланцюг імуноглобуліну вводяться в різні вектори експресії й спільно трансформуються в підходящому організмі хазяїна. Більш докладно про одержання біспецифічних антитіл можна довідатися, наприклад, у роботі Suresh et al., Meth Enzym 121:210 (1986). Гетерокон’югати антитіл також становлять частину даного винаходу. Гетерокон’югати антитіл складаються із двох ковалентно зв’язаних антитіл. Такі антитіла, наприклад, були запропоновані для орієнтування клітин імунної системи на небажані клітини (патент США № 4676980). Передбачається, що антитіла можуть бути виготовлені in vitro за допомогою відомих методів синтетичної хімії білків, у тому числі із застосуванням агентів для перехресних зшивок. Наприклад, імунотоксини можуть конструюватися за допомогою реакції дисульфідного обміну або за рахунок утворення тіоефірного зв’язку. Прикладами придатних для цього реагентів є імінотіолат і метил-4-меркаптобутирімідат, а також запропоновані, наприклад, у патенті США № 4676980. Крім того, можна одержати однодоменні антитіла до CXCR5. Приклади подібної технології були описані в заявці WO9425591 для випадку антитіл, одержаних з важкого ланцюга Ig верблюда, а також в US 20030130496, де обговорюється виділення однодоменних повністю людських антитіл з фагових бібліотек. В альтернативному варіанті методики, описані при одержанні одноланцюжкових антитіл (патент США № 4946778; Bird, Science 242:423 (1988); Huston et al., Proc Natl Acad Sci USA 85:5879 (1988); і Ward, et al., Nature 334:544 (1989)), можуть бути адаптовані для одержання одноланцюжкових антитіл. Одноланцюжкові антитіла утворюються за допомогою зв’язування фрагментів важкого й легкого ланцюгів області FV через амінокислотний місток з утворенням одноланцюжкового поліпептиду. Можна також використовувати методики складання функціональних фрагментів FV в E. coli (Skerra et al., Science 242:1038 (1988)). 24 UA 104715 C2 5 10 15 20 25 30 35 40 45 50 55 60 Даний винахід включає антитіла, рекомбінантно злиті або хімічно кон’юговані (у тому числі ковалентно й нековалентно кон’юговані) з поліпептидом. Злиті або кон’юговані антитіла згідно з даним винаходом можуть використовуватися для простоти очищення, див., наприклад, WO 93/21232; EP 439,095; Naramura et al., Immunol Lett 39:91 (1994); патент США № 5474981; Gillies et al., Proc Natl Acad Sci USA 89:1428 (1992); і Fell et al., J Immunol 146:2446 (1991). Амінокислотна послідовність маркера може являти собою гексагістидиновий пептид (SEQ ID №:51), наприклад пепетид, подібний маркеру у векторі pQE (QIAGEN, Inc., Chatsworth, CA), серед інших, багато з яких комерційно доступні, Gentz et al., Proc Natl Acad Sci USA 86:821 (1989). До інших пептидних маркерів, зручних для очищення, серед інших, належать маркер «НА», який відповідає епітопу, одержаному з гемагглютинуючого білка грипу (Wilson et al., Cell 37:767 (1984)) і маркер «flag». Можна також створити одноланцюжкові пептидні з’єднувальні молекули, в яких області важкого й легкого ланцюга FV з’єднані одна з одною. Одноланцюжкові антитіла («scF v») і метод їх конструювання описані, наприклад, у патенті США № 4946778. В альтернативному варіанті аналогічними способами можна сконструювати й експресувати Fab. Усі повністю або частково людські антитіла можуть бути менш імуногенними, ніж повністю мишачі mAbs, фрагменти й одноланцюжкові антитіла також можуть бути менш імуногенними. Антитіла або фрагменти антитіл можуть виділятися з фагових бібліотек антитіл, одержаних за допомогою методик, описаних в Mccafferty et al., Nature 348:552 (1990). Clarkson et al., Nature 352:624 (1991) і Marks et al., J Mol Biol 222:581 (1991) розглядають виділення мишачих і людських антитіл, відповідно, з використанням фагових бібліотек. У наступних публікаціях описана продукція високоафінних (в інтервалі нM) людських антитіл за допомогою перестановки в ланцюзі (Marks et al., Bio/Technology 10:779 (1992)), а також метод комбінаторної інфекції й рекомбінація in vivo як стратегії побудови дуже великих фагових бібліотек (Waterhouse et al., Nucl Acids Res 21:2265 (1993)). Таким чином, подібні методики є практичною альтернативою традиційним гібридомним методикам в одержанні моноклональних антитіл. Антитіла до CXCR5 аналізувалися методами твердофазного імуноферментного аналізу (ELISA), FACS, вестерн-блотингом або іншими імунохімічними методами, відомими фахівцям в галузі. Так, В-клітини або клітини, експресуючі CXCR5, можуть використовуватися для детектування зв’язування з ним антитіла за допомогою тієї або іншої відомої методики, або ж рекомбінантно експресований CXCR5 або його частина, наприклад домен EC, можуть закріплювати на твердій фазі й використовувати як елемент захоплення при аналізі, побудованому залежно від поставленої мети. Щоб визначити, чи зв’язується той або інший конкретний гомолог антитіла з людським CXCR5, можна використовувати будь-який стандартний метод аналізу зв’язування. До зручних методів аналізу зв’язування CXCR5 належать аналіз FACS, аналіз ELISA, радіоімунологічні методи аналізу і їм подібні, які детектують зв’язування антитіла з CXCR5 людини й виникаючі в результаті функції. Для таких аналізів зручні розглянуті в даному описі, що мають повну довжину й розчинні форми людського CXCR5. Зв’язування антитіла або гомолога з CXCR5, або з його розчинними фрагментами, можна легко реєструвати за рахунок використання другого антитіла, специфічного до імуноглобулінів виду, від якого одержані антитіло або гомолог. Щоб встановити, блокує чи в помітній мірі те або інше антитіло або гомолог зв’язування CXCL13 або іншого ліганда з людським CXCR5, можна скористатися будь-яким зручним методом конкурентного аналізу. До придатних методів аналізу, наприклад, належать методи ELISA, методи FACS, радіоімунологічні методи аналізу і їм подібні, які дозволяють кількісно визначити здатність антитіла або гомолога конкурувати з CXCL13 або іншим лігандом за зв’язування з людським CXCR5. Переважно, оцінюється здатність ліганда блокувати зв’язування міченого людського CXCR5 з імобілізованим антитілом або гомологом. Здатність антитіла або гомолога зв’язуватися з людським CXCR5 можна оцінити перевіркою + + його здатності зв’язуватися з людськими клітинами CXCR5 . Придатними клітинами CXCR5 для використання при визначенні того, чи може те або інше конкретне антитіло або гомолог зв’язуватися з людським CXCR5, є клітини культур тканин ссавців, трансформовані за допомогою ДНК, яка кодує людський CXCR5 повної довжини, і експресує CXCR5 на поверхні клітин або в лініях В-клітин. + Зв’язування антитіла або гомолога із клітиною CXCR5 може реєструватися за допомогою фарбування клітин флуоресцентно-міченим другим антитілом, специфічним до імуноглобулінів того ж виду, від якого одержаний аналізований гомолог антитіла. Клітинний сортер з активацією флуоресценції («FACS») може використовуватися для реєстрації й кількісного опису будь-якого зв’язування, див., у загальному випадку, Shapiro, Practical Flow Cytometry, Alan R. Liss, Inc., New York, N.Y. (1985). 25 UA 104715 C2 5 10 15 20 25 30 35 40 45 50 55 Крім того, здатність гомолога антитіла блокувати зв’язування ліганда, наприклад, CXCL13, з людським CXCR5 може визначатися за допомогою преінкубування надлишку ліганда із + клітинами CXCR5 і кількісної реєстрації міри блокування зв’язування антитіла або гомолога із клітинами за рахунок присутності зв’язаного ліганда. Зв’язування гомолога антитіла із клітинами + CXCR5 може реєструватися за допомогою FACS, з використанням флуоресцентно-міченого другого антитіла, специфічного до імуноглобулінів того ж виду, від якого одержаний аналізований гомолог антитіла. В альтернативному варіанті можлива постановка конкурентного аналізу, відомого фахівцям в галузі, за допомогою міченого ліганда або антитіла. Ліганд, наприклад, CXCL13, який використовувався в описаних вище процедурах аналізу, може продукуватися клітинами, трансформованими геном для синтезу ліганда, або ж може застосовуватися виділений CXCL13, одержуваний із застосуванням викладених у даному документі практичних методів, або ж може здобуватися ліганд, що серійно випускається. Щоб визначити, чи не приводить те або інше конкретне антитіло або гомолог до помітного + зниження кількості циркулюючих клітин CXCR5 in vivo, визначалася кількість циркулюючих + клітин CXCR5 , взятих у ссавця протягом 24 годин після введення антитіла або гомолога ссавцеві з нормальною імунною функцією, і ця величина зіставлялася з кількістю до введення або кількістю в контрольного ссавця, якому вводили антитіло або гомолог відповідного ізотипу без певної специфічності замість антитіла або гомолога згідно з даним винаходом. Кількісне + визначення клітин CXCR5 у тварин, що одержали дозу антитіла CXCR5 або його функціональної частини, або його похідного, може проводитися, наприклад, за допомогою фарбування одержаних клітин флуоресцентно-міченими антитілами, які зв’язують антитіла до CXCR5, а також міченими антитілами, специфічними до Т-клітин і В-клітин, з наступним аналізом FACS. Антитіла згідно з даним винаходом можуть описуватися або характеризуватися з погляду епітопа (епітопів) або частини (частин) CXCR5, які антитіло розпізнає або з якими воно специфічно зв’язується. Епітоп (епітопи) або частина (частини) поліпептидів, як описано в даному документі, можуть характеризуватися, наприклад, по N-термінальним і C-термінальним положенням, по довжині безперервного ланцюга амінокислотних залишків, конформаційним епітопам та ін. Антитіла згідно з даним винаходом можуть також описуватися або характеризуватися по перехресній реакційній здатності. В об’єм даного винаходу також включаються антитіла, які зв’язують поліпептиди CXCR5, що характеризуються щонайменше 95%, щонайменше 90%, щонайменше 85%, щонайменше 80%, щонайменше 75%, щонайменше 70%, щонайменше 65%, щонайменше 60%, щонайменше 55% і щонайменше 50% ідентичністю (яка розраховується за допомогою методів, відомих фахівцям в галузі й описаних у даному документі) до CXCR5. Антитіла згідно з даним винаходом можуть також описуватися або характеризуватися по афінності зв’язування з розглянутим CXCR5. Антитіла до CXCR5 можуть зв’язуватися з KD -7 -6 -5 менше приблизно10 M, менше приблизно 10 M або менше приблизно 10 M. Більш висока афінність зв’язування розглянутого антитіла може бути більш бажана, наприклад, з -8 -15 рівноважною константою дисоціації або KD від приблизно 10 до приблизно 10 M, від -8 -12 -9 -11 приблизно 10 до приблизно 10 M, від приблизно 10 до приблизно 10 M або від приблизно -8 -10 10 до приблизно 10 M. У даному винаході також пропонуються антитіла, які конкурентно інгібують зв’язування антитіла з епітопом згідно з даним винаходом, що визначається будь-яким методом, відомим фахівцям в галузі, для реєстрації конкурентного зв’язування, наприклад, описаними в даному документі методами імунологічного аналізу. У переважних прикладах здійснення антитіло конкурентно інгібує зв’язування з епітопом щонайменше на 95%, щонайменше на 90%, щонайменше на 85%, щонайменше на 80%, щонайменше на 75%, щонайменше на 70%, щонайменше на 60% або щонайменше на 50%. В об’єм даного винаходу також включаються кон’югати, що містять розглянуте антитіло. Кон’югати складаються із двох основних компонентів: розглянутого антитіла й другого компонента, яким може бути з’єднуючий клітини агент, цитотоксичний агент та ін. Використовуваний у даному документі термін «з’єднуючий клітини агент» стосується речовини, яка специфічно розпізнає й зв’язує молекулу на поверхні клітини. Так, як зв’язуючий клітини агент може виступати антиген CD, патогенний антиген, наприклад вірусний антиген, диференціюючий антиген, раковий антиген, клітинноспецифічний антиген, тканиноспецифічний антиген, Ig або подібна Ig молекула та ін. В одному із прикладів здійснення з’єднуючий клітини агент специфічно розпізнає CXCL13 або комплекс CXCR5 з його лігандом, наприклад з CXCL13. Кон’югат може знаходитися в контакті із клітиною-мішенню протягом тривалого періоду часу, для того, щоб дати можливість 26 UA 104715 C2 5 10 15 20 25 30 35 40 45 50 55 60 ефекторній функції кон’югата вплинути на клітину й/або забезпечити достатній час, протягом якого відбудеться інтерналізація кон’югата клітиною. З’єднуючі клітини агенти можуть бути будь-якого типу, який відомий у цей час або стане відомим у майбутньому, до них належать пептиди, непептидні сполуки, сахариди, нуклеїнові кислоти, ліганди, рецептори та ін. або їх комбінації. З’єднуючим клітини агентом може бути будь-яка сполука, яка зв’язує клітину як специфічним, так і неспецифічним чином. Як правило, як агент може виступати антитіло (зокрема моноклональне антитіло), лімфокіни, гормони, фактори росту, вітаміни, молекули-переносники живильних речовин (наприклад, трансферин) або будь-яка інша зв’язуюча клітину молекула або речовина. До інших прикладів зв’язуючих клітку агентів, які можуть використовуватися в даному винаході, належать: поліклональні антитіла, моноклональні антитіла й фрагменти антитіл, наприклад, Fab, Fab’, F(ab’)2 і FV (Parham, J. Immunol. 131:2895-2902 (1983); Spring et al., J. Immunol. 113:470-478 (1974); і Nisonoff et al., Arch. Biochem. Biophys. 89: 230-244 (1960)). Другим компонентом також може бути цитотоксичний агент. Використовуваний у даному документі термін «цитотоксичний агент» стосується речовини, яка пригнічує або блокує функціонування або ріст клітин і/або викликає деструкцію клітин. Так, як цитотоксичний агент може виступати таксол, майтансиноїд, наприклад DM1 або DM4, CC-1065 або CC-1065 аналог, рицин, мітоміцин C та ін. У деяких прикладах здійснення цитотоксичний агент, подібно будьякому зв’язуючому агенту кон’югата за даним винаходом, ковалентно пов’язаний з антитілом, що розглядається, прямо або через розщеплюваний або нерозщеплюваний лінкер. Прикладами придатних майтансиноїдів є майтансинол і аналоги майтансинолу. Майтансиноїди пригнічують утворення мікроканальців і найвищою мірою токсичні для клітин ссавців. До прикладів придатних аналогів майтансинолу належать аналоги, що мають модифіковане ароматичне кільце, а також аналоги з модифікаціями в інших положеннях. Такі придатні для використання майтансиноїди пропонуються в патентах США №№ 4424219; 4256746; 4294757; 4307016; 4313946; 4315929; 4331598; 4361650; 4362663; 4364866; 4450254; 4322348; 4371533; 6333410; 5475092; 5585499 і 5846545. Приклади придатних аналогів майтансинолу з модифікованим ароматичним кільцем включають: (1) C-19-дехлор (патент США № 4256746) (одержуваний, наприклад, LAHвідновленням ансамітоцину P2); (2) C-20-гідрокси (або C-20-деметил) +/- C-19-Дехлор (патенти США № 4361650 і 4,307,016) (одержуваний, наприклад, деметилуванням з використанням стрептоміцетів або актиноміцетів або дехлоруванням із застосуванням літійалюмінійгідриду (LAH)); і (3) C-20-деметокси, C-20-ацилокси (-OCOR), +/-дехлор (патент США № 4294757) (одержуваний ацилуванням під дією ацилхлоридів). Приклади придатних аналогів майтансинолу з модифікаціями в інших положеннях включають: (1) C-9-SH (патент США № 4424219) (одержуваний реакцією майтансинолу з H 2S або P2S5); (2) C-14-алкоксиметил (деметокси/CH2OR) (патент США № 4,331,598); (3) C-14гідроксиметил або ацилоксиметил (CH2OH або CH2OAc) (патент США № 4450254) (одержуваний з нокардій); (4) C-15-гідрокси/ацилокси (патент США № 4364866) (одержуваний конверсією майтансинолу стрептоміцетами); (5) C-15-метокси (патенти США № 4313946 і 4315929) (виділюваний з Trewia nudiflora); (6) 18-N-деметил (патенти США № 4362663 і 4322348) (одержуваний деметилуванням майтансинолу стрептоміцетами); і (7) 4,5-деокси (патент США № 4371533) (одержуваний відновленням майтансинолу під дією трихлористого титану/LAH). Цитотоксичні кон’югати можуть бути одержані методами in vitro. Для зв’язування цитотоксичного агента, ліків або проліків з антитілом, як правило, використовується лінкерна група. Придатні лінкерні групи відомі фахівцям в галузі, до них належать дисульфідні групи, тіоефірні групи, кислотонестійки групи, фотолабільні групи, групи, нестійкі до впливу пептидази, а також групи, нестійкі до впливу естерази. Наприклад, кон’югати можуть конструюватися за допомогою реакції дисульфідного обміну або за рахунок утворення тіоефірного зв’язку між розглянутим антитілом і ліками або проліками. Як обговорювалося вище, у даному винаході пропонуються послідовності виділених нуклеїнових кислот, що кодують описані в даному документі антитіло або його функціональний варіант, конструкції векторів, що включають нуклеотидну послідовність, що кодує з’єднуючі CXCR5 поліпептиди згідно з даним винаходом, клітини-реципієнти, що несуть такий вектор, а також рекомбінантні методики продукції такого поліпептиду. Вектор, як правило, складається з компонентів, відомих фахівцям в галузі, і звичайно, серед інших, включає один або декілька перерахованих нижче елементів: сигнальна послідовність, точка початку реплікації, один або кілька маркерів або генів селекції, послідовності, що 27 UA 104715 C2 5 10 15 20 25 30 35 40 45 50 55 60 сприяють і/або стимулють трансляцію, енхансер та ін. Таким чином, вектори експресії містять нуклеотидну послідовність, яка функціонально пов’язана з такими придатними транскрипційними або трансляційними регуляторними нуклеотидними послідовностями як, наприклад, похідними від генів ссавців, мікробів, вірусів або комах. До прикладів додаткових регуляторних послідовностей належать оператори, рибосомальні сайти зв’язування мРНК і/або інші відповідні послідовності, які контролюють транскрипцію й трансляцію, наприклад їх ініціювання й припинення. Нуклеотидні послідовності є «функціонально зв’язаними», якщо регуляторна послідовність має функціональне відношення до нуклеотидної послідовності відповідного поліпептиду. Так, нуклеотидна послідовність промотору функціонально зв’язана, наприклад, з послідовністю важкого ланцюга антитіла, якщо нуклеотидна послідовність промотору контролює транскрипцію такої нуклеотидної послідовності. Крім того, у вектори експресії можна вбудовувати послідовності, що кодують відповідні сигнальні пептиди, які звичайно не є природним чином пов’язаними з послідовностями важкого і/або легкого ланцюгів антитіла. Наприклад, нуклеотидна послідовність сигнального пептиду (секреторний лідер) може бути злита усередині рамки з поліпептидною послідовністю, так щоб антитіло секретувалося у періплазматичний простір або в середовище. Сигнальний пептид, який діє в передбачуваних клітинах-реципієнтах, підсилює позаклітинну секрецію відповідного антитіла або його частини. Сигнальний пептид може відщеплюватися від поліпептиду при виділенні антитіла із клітини. Приклади таких секреторних сигналів добре відомі й включають, наприклад, описані в патентах США № 5698435; 5698417 і 6204023. Як вектор може виступати плазміда, одноланцюжковий або дволанцюжковий вірусний вектор, фаговий вектор одноланцюжкової або дволанцюжкової РНК або ДНК, фагмід, косміда або будь-який інший носій трансгена, що представляє інтерес. Такі вектори можуть вводитися в клітини як полінуклеотиди, з використанням добре відомих методик введення ДНК і РНК у клітини. Вектори, у випадку фагових або вірусних векторів, також можуть вводитися в клітини у формі вірусу в оболонці або в капсулі з використанням добре відомих методик інфекції й трансдукції. Вірусні вектори можуть бути компетентними або дефективними стосовно реплікації. В останньому випадку розмноження вірусу буде, як правило, проходити тільки в комплементарних клітинах-реципієнтах і з використанням множинних векторів, що несуть різні вірусні компоненти, необхідні для продукції частинок. Безклітинні системи трансляції можуть також застосовуватися для продукції білка з використанням РНК, одержаних з існуючих конструкцій ДНК (див., наприклад, WO 86/05807 і WO 89/01036; і патент США № 5122464). Експресія антитіл згідно з даним винаходом може здійснюватися в будь-якій придатній клітині-хазяїні. До прикладів клітин-реципієнтів, придатних для використання в даному винаході, належать прокаріотичні, дріжджові або вищі еукаріотичні клітини, і сюди, серед інших, входять мікроорганізми, наприклад бактерії ( зокрема E. coli, B. subtilis, ентеробактер, ервінії, клебсіели, протеус, сальмонели, сератії й шигели, а також паличкоподібні бактерії, псевдомонади й стрептоміцети), трансформовані за допомогою векторів експресії рекомбінантної ДНК бактеріофага, плазмідної ДНК або космідної ДНК, що містять кодуючи послідовності розглянутого антитіла; дріжджі (наприклад, сахароміцети, пічіа, актиноміцети, клювероміцети, шизосахароміцети, кандиди, триходерма, нейроспора й гіфоміцети, такі як нейроспора, пеніцил, толіпокладіум і аспергіли), трансформовані за допомогою рекомбінантних векторів експресії дріжджів, що містять послідовності, що кодують антитіла; клітинні системи комах, інфіковані рекомбінантними векторами експресії вірусу (наприклад, бакуловірусу), що містять послідовності, що кодують антитіла; рослинні клітинні системи, інфіковані рекомбінантними векторами експресії вірусу (наприклад, вірус мозаїки кольорової капусти, CaMV; або вірус тютюнової мозаїки, TMV) або трансформовані векторами експресії рекомбінантної плазміди (наприклад, плазміди Ti), що містять послідовності, що кодують, антитіла; або ж клітинні системи ссавців (наприклад, клітини COS, CHO, BHK, 293 або 3T3), що несуть рекомбінантні конструкції експресії, що містять промотори, одержані з генома клітин ссавців (наприклад, промотор металотіонеїну) або з вірусів ссавців (наприклад, пізній промотор аденовірусу або 7.5K промотор вірусу осповакцини). Вектори експресії для використання в прокаріотичних клітинах-реципієнтах звичайно включають один або декілька фенотипічних селектованих маркерних генів. Фенотипічний селектований маркерний ген, наприклад, являє собою ген, що кодує білок, який забезпечує стійкість стосовно антибіотиків або задовольняє аутотрофним вимогам. До прикладів придатних для використання векторів експресії для прокаріотичних клітин-реципієнтів належать вектори, одержані на основі комерційно доступних плазмід, наприклад, серії векторів pKK223-3 (Pharmacia Fine Chemicals, Uppsala, Sweden), pGEM1 (Promega Biotec, Madison, WI), pet (Novagen, Madison, WI) і pET (Novagen, Madison, WI) і pRSET (Invitrogen, Carlsbad, CA) (Studier, J 28
ДивитисяДодаткова інформація
Автори російськоюLee, Renata, Mikol, Vincent, Allen, Elizabeth, Ruetsch, Norman, Cameron, Beatrice, Oligino, Thomas, Baurin, Nicolas
МПК / Мітки
МПК: A61K 39/395
Мітки: виділене, антитіло, cxcr5
Код посилання
<a href="https://ua.patents.su/101-104715-vidilene-antitilo-do-cxcr5.html" target="_blank" rel="follow" title="База патентів України">Виділене антитіло до cxcr5</a>