Фармацевтична композиція, що містить дротаверин
Номер патенту: 113517
Опубліковано: 10.02.2017
Автори: Кхуллар Правін, Бадабхагні Судхакара Рао, Прасад Кум, Джайсваль Нілеш
Формула / Реферат
1. Фармацевтична композиція в формі м'якої капсули для перорального введення, що включає:
- 5-30 % (мас./мас.) дротаверину гідрохлориду;
- не менше 60 % (мас./мас.) рідкої суміші щонайменше однієї неіонної гідрофільної поверхнево-активної речовини і щонайменше однієї неіонної гідрофобної поверхнево-активної речовини,
де неіонна гідрофобна поверхнево-активна речовина включає пропіленгліколю монокаприлат.
2. Фармацевтична композиція за п. 1, в якій загальна кількість поверхнево-активної речовини знаходиться в діапазоні від 75 до 90 %.
3. Фармацевтична композиція за п. 1, в якій гідрофобну поверхнево-активну речовину представлено в кількостях від 60 до 90 % від маси композиції.
4. Фармацевтична композиція за п. 1, в якій неіонна гідрофільна поверхнево-активна речовина має значення гідрофільно-ліпофільного балансу (HLB) від 11 до 16.
5. Фармацевтична композиція за п. 1, в якій неіонна гідрофільна поверхнево-активна речовина являє собою полісорбат 80.
6. Фармацевтична композиція за п. 1, в якій неіонна гідрофільна поверхнево-активна речовина представлена в кількостях від 3 до 7 % від маси композиції.
7. Фармацевтична композиція за п. 1, в якій масове співвідношення дротаверину гідрохлориду і рідкої суміші поверхнево-активних речовин становить від 1:3 до 1:7.
8. Фармацевтична композиція за будь-яким з пп. 1-7, в якій кінцеве значення рН композиції знаходиться між 4 і 6.
9. Спосіб одержання фармацевтичної композиції за будь-яким з пп. 1-8, який включає наступні послідовні стадії: розчинення дротаверину гідрохлориду в рідкій суміші щонайменше однієї неіонної гідрофільної поверхнево-активної речовини і щонайменше однієї неіонної гідрофобної поверхнево-активної речовини при перемішуванні для одержання гомогенної суміші; і потім встановлення рН між 4 і 6, використовуючи звичайний буфер.
10. Застосування композиції, заявленої в будь-якому з пп. 1-8, для лікування спазмів і гострих болів.
Текст
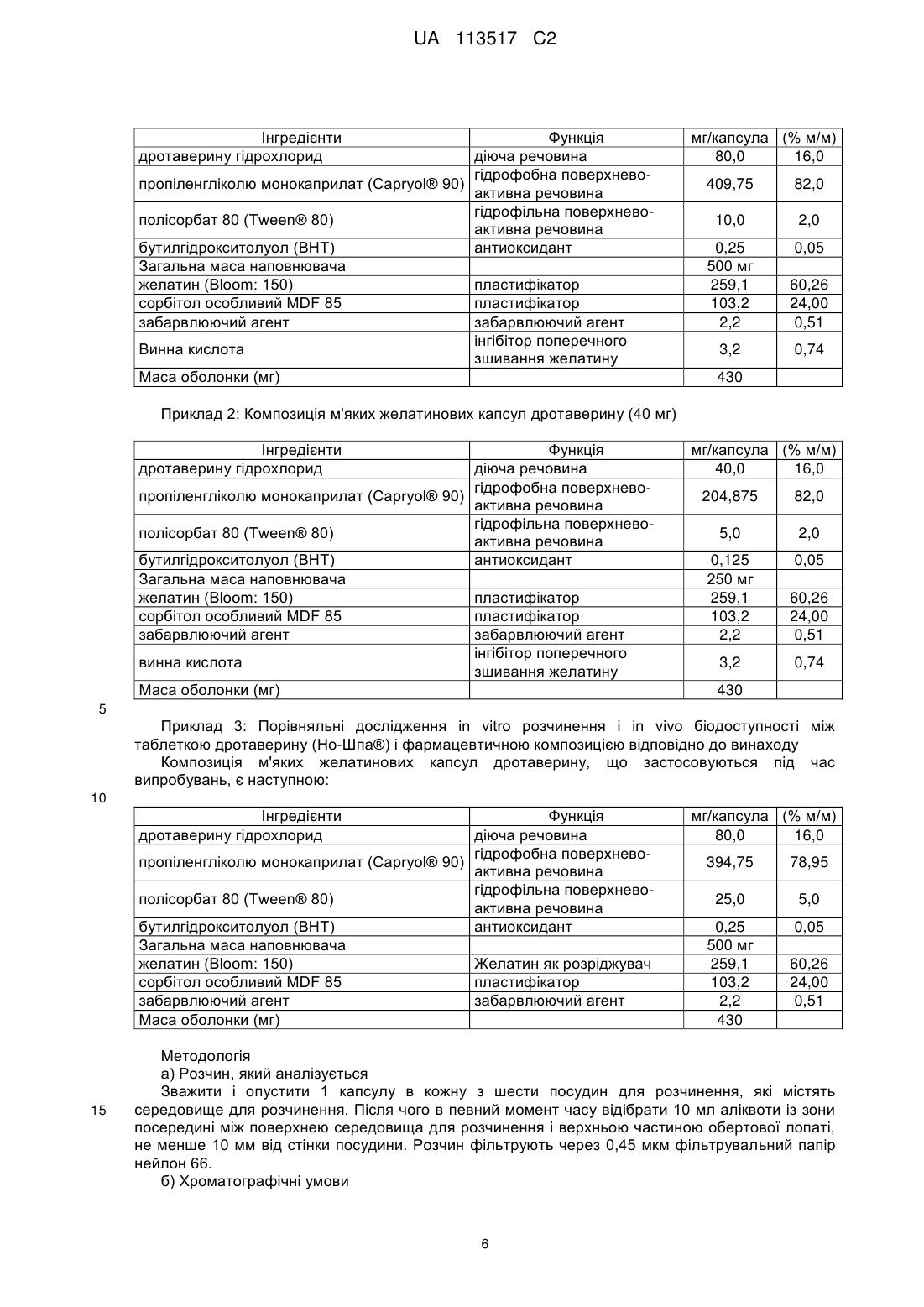
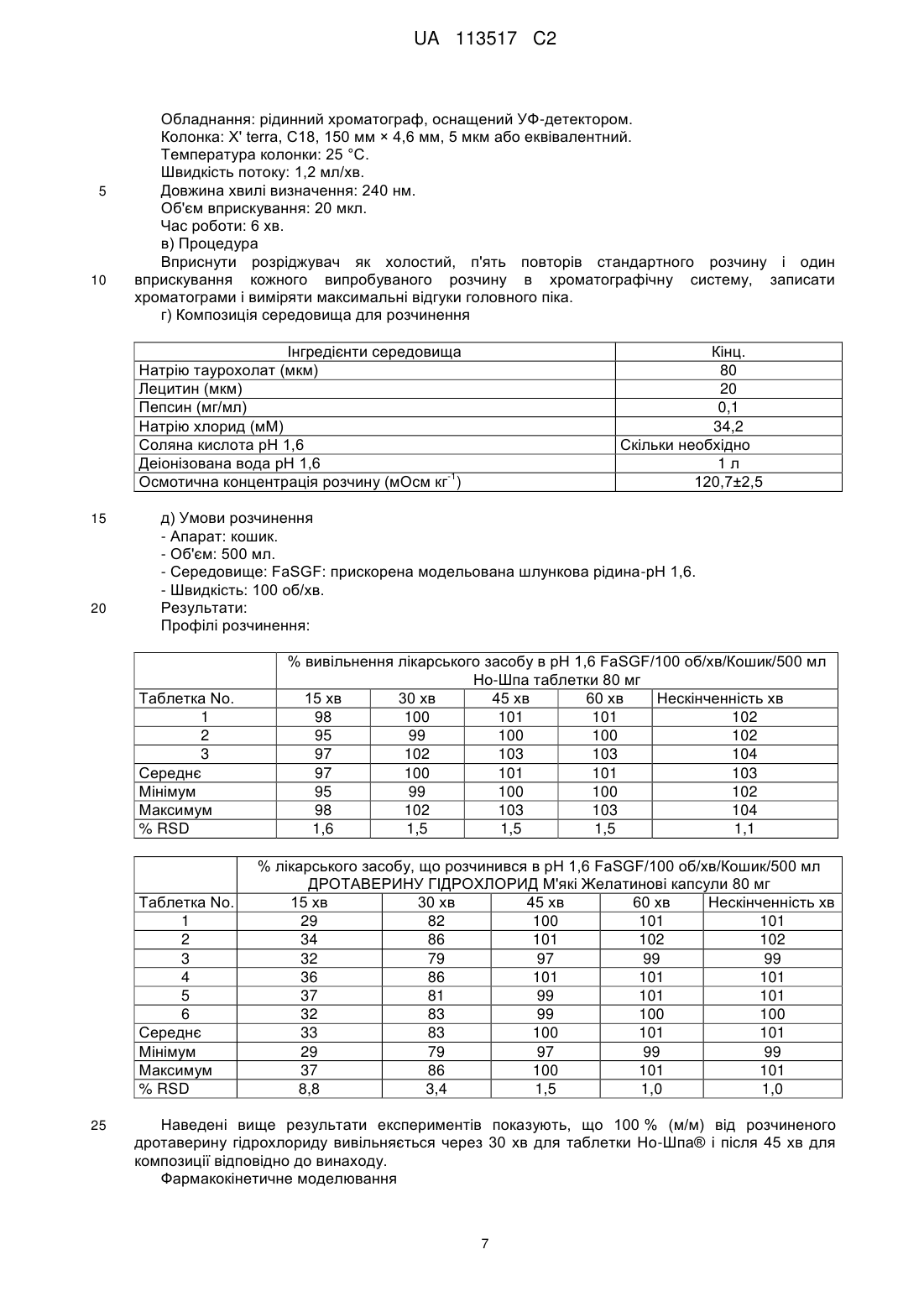
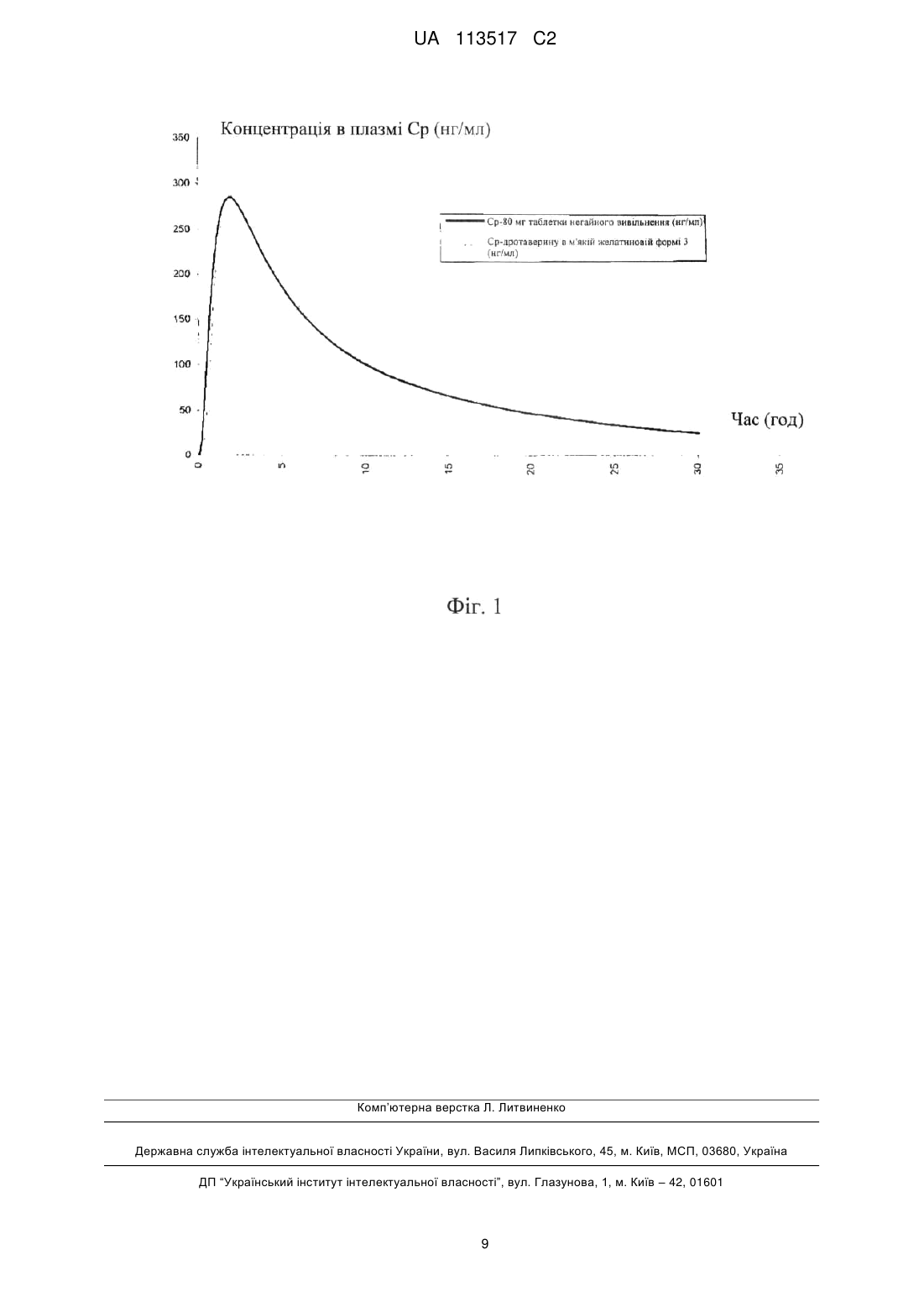
Реферат: Винахід належить до фармацевтичної композиції у формі м'якої капсули для перорального введення, що включає: - 5-30 % (мас./мас.) дротаверину гідрохлориду; не менше 60 % (мас./мас.) рідкої суміші щонайменше однієї неіонної гідрофільної поверхнево-активної речовини і щонайменше однієї неіонної гідрофобної поверхнево-активної речовини, де неіонна гідрофобна поверхнево-активна речовина включає пропіленгліколю монокаприлат, а також до способу одержання вказаної композиції та її застосування для лікування спазмів і гострих болів. UA 113517 C2 (12) UA 113517 C2 UA 113517 C2 5 10 15 20 25 30 35 40 45 ГАЛУЗЬ ТЕХНІКИ, ДО ЯКОЇ НАЛЕЖИТЬ ВИНАХІД Даний винахід стосується стабільної фармацевтичної композиції дротаверину гідрохлориду для перорального введення. Зокрема, винахід стосується композиції, що містить дротаверин гідрохлорид у придатній системі розчинника, необов'язково вміщеної в капсулі. Крім того, даний винахід також стосується способу одержання такої фармацевтичної композиції, і застосування вказаної композиції для виготовлення лікарського засобу для лікування спазмів і гострих болів. РІВЕНЬ ТЕХНІКИ ВИНАХОДУ Дротаверин (1-(3,4-дієтоксибензиліден)-6,7-дієтокси-1,2,3,4-тетрагідроізохінолін) належить до класу ліків, відомих як гідроізохінолони, з наступною формулою: . Він стосується фармакологічної групи холінергічних мускаринових антагоністів на основі механізму дії, і також класифікований в фармакологічній групі спазмолітичних агентів. Молекулярна маса дротаверину становить 397,50. Вважається, що дротаверин має властивості релаксанту гладких м'язів. Їх ефект залежить від застосованої концентрації. Це неантихолінергічний спазмолітик, який селективно інгібує фосфодієстеразу IV, і це супроводжується помірним ефектом блокування кальцієвих каналів. Він знаходиться в продажі в формі таблеток під товарним знаком Но-Шпа® переважно в деяких країнах Східної і Центральної Європи, і в Африці південніше Сахари. Дротаверин насамперед призначається при таких станах як холангіт, холецистит, холецистолітіаз, цистит, нефролітіаз, папіліт, спазмі гладких м'язів, утворенні каменів, уретеролітіазі, уролітіазі, тенезмах сечового міхура. Складністю в складі дротаверину в пероральних фармацевтичних композиціях є його неприємний, сильний і гіркий смак і післясмак, що привело до недостатності і навіть недодержання лікування, і, таким чином, мало негативний вплив на ефективність лікування. Крім того, дослідження фармакокінетики і біодоступності, проведені для пероральної дози дротаверину гідрохлориду на здорових людях, показали, що абсолютна біодоступність була непостійна і змінювалася в діапазоні від 24,5 % до 91 % з середнім значенням від 58,2 до 18,2 % (середнє SD) (European Journal of Drug Metabolism and Pharmacokinetics vol: 21, Issue: 3, Pages: 217-221). Передбачено, що висока мінливість в біодоступності дротаверину гідрохлориду після перорального введення може мати наслідком значні міжіндивідуальні відмінності в терапевтичній відповіді. Об'єктом даного винаходу є надання препаратів, таких як м'яка капсула, які дозволяють одержати фармакокінетичні параметри, біоеквівалентні одержаним для таблеток дротаверину гідрохлориду в істотно еквівалентній дозі, яка доступна під товарним знаком Но-Шпа®. Іншим аспектом винаходу є надання способу одержання пероральної фармацевтичної композиції за винаходом, що включає розчинення лікарського засобу у прийнятній кількості рідкого носія і приведення рН до прийнятного діапазону, за допомогою чого досягається стійкість при зберіганні і термін придатності складу. Іншим об'єктом винаходу є надання перорального складу дротаверину гідрохлориду зі зменшеним гірким смаком. Заявники виявили, що ці об'єкти можуть бути одержані шляхом надання рідкої композиції, яка містить дротаверин гідрохлорид в рідкій суміші щонайменше однієї неіонної гідрофільної поверхнево-активної речовини і щонайменше однієї неіонної гідрофобної поверхнево-активної речовини. СУТЬ ВИНАХОДУ Даний винахід надає фармацевтичну композицію дротаверину гідрохлориду для перорального введення, яка включає дротаверин гідрохлорид і рідку суміш щонайменше однієї неіонної гідрофільної поверхнево-активної речовини і щонайменше однієї неіонної гідрофобної 1 UA 113517 C2 5 10 15 20 25 30 35 40 45 50 55 поверхнево-активної речовини; фармацевтична композиція може необов'язково містити допустимі фармацевтично прийнятні ексципієнти. Ще одним об'єктом даного винаходу є надання фармацевтичної композиції, наприклад, м'якої капсули, твердої капсули, капсули з двох частин або таблетки, що включає композицію за даним винаходом. В іншому аспекті винаходу наданий спосіб одержання фармацевтичної композиції за винаходом, який включає розчинення ліків у прийнятній кількості системи розчинника. Винахід також стосується застосування пероральної фармацевтичної композиції винаходу для одержання лікарського засобу для лікування спазмів і гострих болів. Ці та інші аспекти, ознаки і переваги даного винаходу стануть зрозумілішими з посиланням на наступні опис і формулу винаходу. ОПИС Декілька експериментів було проведено даними авторами для того, щоб одержати рідку фармацевтичну композицію дротаверину, яка має біодоступність, порівнянну з одержаною для таблетки Но-Шпа®, де було несподівано виявлено, що дротаверин в системі розчинника виконував головну роль в пероральній біодоступності. Було виявлено, що дротаверин в рідкій суміші щонайменше однієї неіонної гідрофільної поверхнево-активної речовини і щонайменше однієї неіонної гідрофобної поверхнево-активної речовини дозволяє одержати біодоступність, еквівалентну одержаній для таблетки Но-Шпа®. "Біоеквівалентний" тут використовується в значенні, що якщо фармацевтична композиція відповідно до винаходу перевірена в дослідженні за допомогою порівняння з еталонним товарним продуктом, середня площа під кривою (AUC) і/або Cmax для кожного лікарського засобу становить не менше 80 % від (відповідної) середньої AUC, що спостерігаються і/або Cmax. Згідно з винаходом, стабільний склад означає склад, який, зокрема, виявляє високу стійкість до розкладання дротаверину гідрохлориду. Таким чином, при зберіганні протягом 1 місяця при 40 °C і вологості 75 % фармацевтична композиція відповідно до даного винаходу містить в собі щонайменше 99 % (м/м) вихідного дротаверину гідрохлориду і не виявляє будь-якої ознаки високого рівня розкладання, тобто рівень загальної кількості домішок становить менше 1 % від маси в перерахунку на дротаверин гідрохлорид (про що свідчить аналіз ВЕРХ). Дротаверин гідрохлорид взятий в терапевтично ефективних кількостях. "Терапевтично ефективна кількість" потрібно розуміти як значення дози лікарського засобу, ефективної у вияві терапевтичного ефекту. Для перорального введення винаходу термін "терапевтично ефективна кількість" означає дозу лікарського засобу, яка після всмоктування в тіло через стінки шлунковокишкового тракту дає концентрацію лікарського засобу в крові, ефективну у виявленні терапевтичного ефекту на орган-мішень. Фахівці в даній галузі техніки зрозуміють, що кількості лікарського засобу, представлені в композиції, змінюються залежно від конкретної ситуації, включаючи, але не обмежуючись, шляхом введення, розміром, віком і станом пацієнта і тому подібним. Крім того, ці ефективні кількості можуть бути легко визначені лікарем без додаткового експериментування. У композиції за даним винаходом дротаверин гідрохлорид представлений в кількостях від 5 % до 30 % від маси композиції. У переважному варіанті виконання дротаверин гідрохлорид представлений в кількостях від 10 % до 30 % від маси композиції. В одному варіанті здійснення фармацевтична композиція містить суміш щонайменше однієї неіонної гідрофільної поверхнево-активної речовини, яка стосується поверхнево-активних речовин, що мають значення гідрофільно-ліпофільного балансу (HLB) від 10 до 18, переважно від 11 до 16; і щонайменше однієї гідрофобної поверхнево-активної речовини, яка стосується поверхнево-активних речовин, що мають значення HLB від 4 до 10, переважно від 4 до 6. Система HLB (Fiedler, H.B., Encyclopedia of Excipients, 5th ed., Aulendorf: ECV-Editio-CantorVerlag (2002)) привласнює чисельні значення поверхнево-активним речовинам, причому ліпофільні речовини набувають менших значень HLB, а гідрофільні речовини набувають великих значень HLB. Загальна кількість поверхнево-активної речовини становить щонайменше 60 %, і переважно від 60 до 95 % від маси, основаної на загальній масі композиції. Більш переважно, щоб загальна кількість поверхнево-активної речовини становила від 75 до 90 % від маси композиції. Переважною поверхнево-активною речовиною, яка використовується в контексті даного винаходу, є пропіленгліколь монокаприлат (капріол-90), який має значення HLB, яке дорівнює 6. У композиції за даним винаходом є переважним, що гідрофобна поверхнево-активна речовина присутня в кількостях від 60 до 90 % від маси композиції. Більш переважно, коли 2 UA 113517 C2 5 10 15 20 25 30 35 40 45 50 55 60 гідрофобна поверхнево-активна речовина присутня в кількостях від 80 до 85 % від маси композиції. Найбільш переважною гідрофільною поверхнево-активною речовиною для включення в фармацевтичну композицію є полісорбат 80 (поліоксіетилен сорбітан моноолеат; Tween 80), який має значення HLB, яке дорівнює 15. У композиції за даним винаходом є переважним, що гідрофільна поверхнево-активна речовина присутня в кількостях від 1 до 10 % від маси композиції. Більш переважно, коли гідрофільна поверхнево-активна речовина присутня в кількостях від 3 до 7 % від маси композиції. У найбільш переважному варіанті здійснення за винаходом фармацевтична композиція є сумішшю пропіленгліколь монокаприлату (капріол-90) (неіонна гідрофобна поверхнево-активна речовина) і полісорбату 80 (неіонна гідрофільна поверхнево-активна речовина). У ще одному аспекті, даний винахід стосується перорально ввідного складу, що містить дротаверин гідрохлорид і рідку суміш щонайменше однієї неіонної гідрофільної поверхневоактивної речовини, і щонайменше однієї неіонної гідрофобної поверхнево-активної речовини, в якій масове співвідношення дротаверину гідрохлориду до рідкої суміші поверхнево-активної речовини становить від 1:2 до 1:10. У переважному варіанті здійснення за винаходом масове співвідношення дротаверину гідрохлориду до рідкої суміші становить від 1:3 до 1:7. Композиція дротаверину відповідно до даного винаходу може додатково містити модифікатор в'язкості і, необов'язково, консервант. Модифікатори в'язкості, які застосовуються в даному винаході, можуть бути будь-якими з відомих в даній галузі, такими як похідні целюлози, набухаючі полімери, смоли, співполімери поліоксіетилену і їм подібні. Консерванти, що застосовуються в даному винаході, можуть бути будь-якими з відомих в даній галузі, такими як: натрій метабісульфіт, натрій сульфіт, натрій бензоат, бензойна кислота, ЕДТА динатрієвий, альфа-токоферол, пропілгалат, бутильований гідроксіанізол і бутильований гідрокситолуол, аскорбінова кислота і їм подібні. У переважному варіанті здійснення рН системи розчинника підтримується від 4 до 6. Конкретніше, рН знаходиться в діапазоні 4,5-5,8. Найбільш переважно, щоб рН підтримувався на рівні 4,5. рН системи розчинника може бути відрегульований за допомогою будь-якого звичайного буфера. Переважним буфером для застосування є ацетатний буфер. Винахід також стосується способу одержання фармацевтичного препарату, що містить 530 % від маси композиції дротаверину гідрохлориду, і 60-95 % від маси композиції рідкої суміші щонайменше однієї неіонної гідрофільної поверхнево-активної речовини, і щонайменше однієї неіонної гідрофобної поверхнево-активної речовини. Цей метод містить наступні стадії: розчинення дротаверину гідрохлориду в рідкій суміші щонайменше однієї неіонної гідрофільної поверхнево-активної речовини і щонайменше однієї неіонної гідрофобної поверхнево-активної речовини при перемішуванні для одержання гомогенної суміші; і потім встановлення рН між 4 і 6, використовуючи звичайний буфер. Один аспект винаходу надає м'які желатинові капсули, які включають оболонку капсули, що містить желатин і/або пластифікатори і, при бажанні або необхідності, інші допоміжні матеріали. При розробці м'якої желатинової капсули для композиції дротаверину відповідно до даного винаходу, повинно бути очевидно, що капсула є системою, що містить композицію дротаверину і желатинову оболонку, яка застосовується для капсулювання композиції дротаверину. Таким чином, не тільки наповнена композиція дротаверину переважна для одержання бажаних характеристик пероральної біодоступності, але і склад желатинової оболонки також є переважним, оскільки він повинен бути сумісний з композицією дротаверину. Фахівець в даній галузі техніки знає про потенційні взаємодії наповнювача і оболонки, які можуть привести як до фізичної, так і до хімічної нестабільності капсули. Відповідно, композиція желатинової оболонки, що використовується для формування капсули для композиції дротаверину, також є переважною і значущою для даного винаходу. Загалом, композиція желатинової оболонки капсули для м'яких желатинових капсул складається з необробленого желатину і одного або декількох інгредієнтів, які додаються для пластифікації желатину з одержанням капсули прийнятної твердості відповідно до вимог проекту або переваг. Типові пластифікатори включають гліцерин і сорбітол. Також, ангідриди сорбітану і манітол також можуть бути використані. Крім того, інші нетрадиційні інгредієнти також можуть бути використані для пластифікації желатину. Головною проблемою в композиціях на основі желатину є видиме зниження розчинення при старінні, що пов'язано з поперечним зшиванням желатин-вмісних продуктів. Поперечне зшивання є причиною утворення набряклої, дуже тонкої, тугої, резиноподібної, нерозчинної у 3 UA 113517 C2 5 10 15 20 25 30 35 40 45 50 55 60 воді мембрани, також відомої як тонка плівка. Тонка плівка діє як бар'єр і обмежує вивільнення лікарського засобу. Лікарські засоби на зразок дротаверину або його фармацевтично прийнятних солей або гідратів, мають тенденцію реагувати з желатином та індукувати поперечне зшивання, через що можливість зниження розчинення протягом досліджень стабільності є високою. Автори даного винаходу виявили, що таке поперечне зшивання желатину несподівано долається шляхом додавання деяких слабких кислот в поєднанні з гліцином. У конкретному варіанті здійснення за винаходом, слабкою кислотою, що використовується в даному винаході, є винна кислота, лимонна кислота або їх комбінації. Слабка кислота може бути присутньою в кількості від приблизно 0,1 до 1,0 % на масу основи складу желатинової оболонки. Як такі, композиції желатину, придатні для застосування з композицією дротаверину за даним винаходом, забезпечують необхідну фізичну і хімічну стабільність. Переважна композиція желатину для застосування при створенні м'яких желатинових капсул для застосування з композицією дротаверину за даним винаходом включає в себе желатин і пластифікатор. Такий пластифікатор, який добре відомий в галузі техніки фармацевтичної композиції, включає, наприклад, пропіленгліколь і сорбітол. Придатні пластифікатори для застосування з переважною композицією капсули включають сорбітол, TM такий як Special MDF 85 від SPI Pharma. Композиції капсульні можуть також включати інші придатні добавки, такі як консерванти і/або забарвлюючі агенти, які використовуються щоб стабілізувати капсулу і/або надати певну характеристику, таку як колір або зовнішній вигляд капсули. Фармацевтично прийнятні консерванти можуть включати, наприклад, метил- і пропілпарабени. Колір може бути наданий желатиновій оболонці при застосуванні FD&С і/або D&С барвників. Зразкові барвники включають, але не обмежуються ними, тартразин жовтий, азура червоний і тому подібні. Замутнювачі, такі як діоксид титану і/або оксиди заліза, можуть бути використані для того, щоб забарвити і/або зробити капсулу непрозорою. Винахід передбачає використання покриваючих агентів, які можуть включати як нефункціональні, так і кишковорозчинні покриваючі агенти, наприклад, полімери на основі целюлози, плівкові покриваючі агенти або інші покриваючі агенти, відомі фахівцям в даній галузі техніки. Даний винахід також передбачає застосування інших фармацевтичних допоміжних речовин, таких як буферні агенти, підкислювачі, підлужнювачі, зв'язуючі речовини, розпушувачі, розріджувачі, мастильні речовини, пластифікатори, підсилювачі проникності і розчинники, відомих фахівцеві в даній галузі техніки. Інші добавки, що звичайно застосовуються в фармацевтичних композиціях, можуть бути включені, і ці добавки добре відомі в даній галузі техніки. Такі добавки включають антиоксиданти, такі як бутилгідрокситолуол (ВНТ), консерванти, хелатуючі агенти, комплексоутворювальні агенти, модифікатори в'язкості, тонізатори, ароматизатори, пігменти, віддушки, замутнювачі, суспендуючі агенти, зв'язуючі речовини і їх суміші. Кількості таких добавок можуть бути легко визначені фахівцем в даній галузі техніки, залежно від конкретних бажаних властивостей. Точна доза активного агента і конкретної композиції для введення залежать від ряду чинників, наприклад, від стану, що підлягає лікуванню, необхідної тривалості лікування і швидкості вивільнення активного агента. Наприклад, кількість необхідного активного агента і швидкість вивільнення внаслідок цього можуть бути визначені на основі відомих in vitro або in vivo методик, які визначають, як довго концентрація конкретної діючої речовини в плазмі крові залишається на прийнятному рівні для терапевтичного ефекту. Як тільки основні принципи реалізації фармацевтичних композицій відповідно до даного винаходу в формі м'яких желатинових капсул стають зрозумілі, експерту по фармацевтичних композиціях не складе ніякої складності в адаптації критеріїв способу під конкретні потреби. Ще одним аспектом даного винаходу є створення способу введення фармацевтично активного інгредієнта пацієнту з урахуванням мінливості в біодоступності фармацевтично активного агента дротаверину, який містить стадії: а) надання стабільної желатинової композиції за винаходом для перорального введення, і б) введення вказаної композиції у вказаний організм для прийому всередину. У додатковому варіанті здійснення активний агент містить приблизно 40-80 мг основної композиції. Основні інгредієнти типової композиції відповідно до даного винаходу можуть містити приблизно: - 5-30 % (м/м) активного агента, переважно сіль дротаверину або гідрати, 4 UA 113517 C2 5 10 15 20 25 30 35 40 45 50 - щонайменше 60 % (м/м) рідкої суміші щонайменше однієї неіонної гідрофільної поверхнево-активної речовини і щонайменше однієї неіонної гідрофобної поверхнево-активної речовини. Буферний агент, що застосовується в даному винаході, може бути будь-яким з відомих в даній галузі техніки, таким як оцтова кислота, фосфорна кислота, фосфат калію, щавлева кислота, вугільна кислота, натрій карбонат, натрій ацетат, натрій цитрат, літій оксалат, амоній гідроксид, амоній нітрат, лимонна кислота, натрій бікарбонат, гліцин і т. д., і/або їх комбінації. Підлужнювач, що застосовується в даному винаході, може бути вибраний з кальцію карбонату, магнію гідроксиду, аравійської камеді, дикальційфосфату, калію гідроксиду, аскорбінової кислоти, і т. д., і/або їх комбінацій. Підкислювач, що застосовується в даному винаході, може бути вибраний з молочної кислоти, аскорбінової кислоти, лимонної кислоти, фосфорної кислоти, кальцію хлориду і т. д., і/або їх комбінацій. Інгредієнти желатинової оболонки типової композиції відповідно до даного винаходу можуть містити: - 35-52 % (м/м), більш переважно 40-44 % желатину, - 15-35 % (м/м), більш переважно 15-25 % сорбітолу і/або гліцерину, - 0,1-10 % (м/м) забарвлюючих агентів, - 0,1-10 % (м/м) винної кислоти. В іншому переважному варіанті здійснення, активний наповнювач (основний склад) за винаходом вміщений в м'яку желатинову капсулу круглої/овальної форми. У ще одному аспекті даного винаходу запропонований спосіб одержання фармацевтичної композиції. Спосіб містить включення активного інгредієнта дротаверину або його фармацевтично прийнятної солі або їх гідратів в ліпофільний і/або гідрофільний носій. Додатково, при необхідності, придатні фармацевтичні ексципієнти додаються, щоб утворити емульсію лікарського засобу. У переважному варіанті здійснення, придатний носій безперервно перемішують з активним інгредієнтом. Ексципієнти потім змішують. М'які желатинові капсули одержані із застосуванням способу роторного штампування, використовуючи желатин в звичайному способі. Гранули сухого желатину з'єднують з водою і придатними пластифікаторами, і цю комбінацію потім змішують і нагрівають під вакуумом, щоб сформувати розплавлену масу желатину. Масу желатину підтримують в розплавленому стані, поки вона формується або відливається в плівки або стрічки на відливальних колесах або барабанах. Плівки або стрічки подають під клин і між роторними штампами для капсулювання. Всередині штампів для капсулювання капсули одночасно утворюються в заглибленнях штампів з плівок або стрічок. Композицією, що містить дротаверин, наповнюють м'які желатинові капсули, застосовуючи будь-який традиційний спосіб. Капсулу потім вирізають і запаюють. Запаювання формується за допомогою поєднання тиску і нагрівання, як тільки капсула заповнена і вирізана. Даний винахід додатково визначений в подальших Прикладах. Потрібно розуміти, що ці приклади, які показують переважні варіанти здійснення за винаходом, даються тільки як ілюстрація. З наведеного вище обговорення і цих прикладів фахівець в даній галузі техніки може з'ясувати основні характеристики даного винаходу, і без відхилення від суті і об'єму винаходу може робити різні зміни і модифікації винаходу, щоб адаптувати його до різних застосувань і умов. ПРИКЛАД Хоча винахід був описаний в зв'язку з конкретними варіантами здійснення, безсумнівно, що багато які альтернативи і варіанти будуть очевидні фахівцям в даній галузі техніки в світлі наведеного вище опису. Відповідно, даний винахід призначений, щоб охопити всі альтернативи і варіанти, які потрапляють в межі суті і об'єму винаходу. Приклад 1: Композиція м'яких желатинових капсул дротаверину (80 мг) 5 UA 113517 C2 Інгредієнти дротаверину гідрохлорид Функція діюча речовина гідрофобна поверхневопропіленгліколю монокаприлат (Capryol® 90) активна речовина гідрофільна поверхневополісорбат 80 (Tween® 80) активна речовина бутилгідрокситолуол (BHT) антиоксидант Загальна маса наповнювача желатин (Bloom: 150) пластифікатор сорбітол особливий MDF 85 пластифікатор забарвлюючий агент забарвлюючий агент інгібітор поперечного Винна кислота зшивання желатину Маса оболонки (мг) мг/капсула (% м/м) 80,0 16,0 409,75 82,0 10,0 2,0 0,25 500 мг 259,1 103,2 2,2 0,05 60,26 24,00 0,51 3,2 0,74 430 Приклад 2: Композиція м'яких желатинових капсул дротаверину (40 мг) Інгредієнти дротаверину гідрохлорид Функція діюча речовина гідрофобна поверхневопропіленгліколю монокаприлат (Capryol® 90) активна речовина гідрофільна поверхневополісорбат 80 (Tween® 80) активна речовина бутилгідрокситолуол (BHT) антиоксидант Загальна маса наповнювача желатин (Bloom: 150) пластифікатор сорбітол особливий MDF 85 пластифікатор забарвлюючий агент забарвлюючий агент інгібітор поперечного винна кислота зшивання желатину Маса оболонки (мг) мг/капсула (% м/м) 40,0 16,0 204,875 82,0 5,0 2,0 0,125 250 мг 259,1 103,2 2,2 0,05 60,26 24,00 0,51 3,2 0,74 430 5 Приклад 3: Порівняльні дослідження in vitro розчинення і in vivo біодоступності між таблеткою дротаверину (Но-Шпа®) і фармацевтичною композицією відповідно до винаходу Композиція м'яких желатинових капсул дротаверину, що застосовуються під час випробувань, є наступною: 10 Інгредієнти дротаверину гідрохлорид Функція діюча речовина гідрофобна поверхневопропіленгліколю монокаприлат (Capryol® 90) активна речовина гідрофільна поверхневополісорбат 80 (Tween® 80) активна речовина бутилгідрокситолуол (BHT) антиоксидант Загальна маса наповнювача желатин (Bloom: 150) Желатин як розріджувач сорбітол особливий MDF 85 пластифікатор забарвлюючий агент забарвлюючий агент Маса оболонки (мг) 15 мг/капсула (% м/м) 80,0 16,0 394,75 78,95 25,0 5,0 0,25 500 мг 259,1 103,2 2,2 430 0,05 60,26 24,00 0,51 Методологія а) Розчин, який аналізується Зважити і опустити 1 капсулу в кожну з шести посудин для розчинення, які містять середовище для розчинення. Після чого в певний момент часу відібрати 10 мл аліквоти із зони посередині між поверхнею середовища для розчинення і верхньою частиною обертової лопаті, не менше 10 мм від стінки посудини. Розчин фільтрують через 0,45 мкм фільтрувальний папір нейлон 66. б) Хроматографічні умови 6 UA 113517 C2 5 10 Обладнання: рідинний хроматограф, оснащений УФ-детектором. Колонка: X' terra, C18, 150 мм × 4,6 мм, 5 мкм або еквівалентний. Температура колонки: 25 °C. Швидкість потоку: 1,2 мл/хв. Довжина хвилі визначення: 240 нм. Об'єм вприскування: 20 мкл. Час роботи: 6 хв. в) Процедура Вприснути розріджувач як холостий, п'ять повторів стандартного розчину і один вприскування кожного випробуваного розчину в хроматографічну систему, записати хроматограми і виміряти максимальні відгуки головного піка. г) Композиція середовища для розчинення Інгредієнти середовища Натрію таурохолат (мкм) Лецитин (мкм) Пепсин (мг/мл) Натрію хлорид (мМ) Соляна кислота pH 1,6 Деіонізована вода pH 1,6 -1 Осмотична концентрація розчину (мОсм кг ) 15 20 д) Умови розчинення - Апарат: кошик. - Об'єм: 500 мл. - Середовище: FaSGF: прискорена модельована шлункова рідина-рН 1,6. - Швидкість: 100 об/хв. Результати: Профілі розчинення: Таблетка No. 1 2 3 Середнє Мінімум Максимум % RSD Таблетка No. 1 2 3 4 5 6 Середнє Мінімум Максимум % RSD 25 Кінц. 80 20 0,1 34,2 Скільки необхідно 1л 120,7±2,5 % вивільнення лікарського засобу в pH 1,6 FaSGF/100 об/хв/Кошик/500 мл Но-Шпа таблетки 80 мг 15 хв 30 хв 45 хв 60 хв Нескінченність хв 98 100 101 101 102 95 99 100 100 102 97 102 103 103 104 97 100 101 101 103 95 99 100 100 102 98 102 103 103 104 1,6 1,5 1,5 1,5 1,1 % лікарського засобу, що розчинився в pH 1,6 FaSGF/100 об/хв/Кошик/500 мл ДРОТАВЕРИНУ ГІДРОХЛОРИД М'які Желатинові капсули 80 мг 15 хв 30 хв 45 хв 60 хв Нескінченність хв 29 82 100 101 101 34 86 101 102 102 32 79 97 99 99 36 86 101 101 101 37 81 99 101 101 32 83 99 100 100 33 83 100 101 101 29 79 97 99 99 37 86 100 101 101 8,8 3,4 1,5 1,0 1,0 Наведені вище результати експериментів показують, що 100 % (м/м) від розчиненого дротаверину гідрохлориду вивільняється через 30 хв для таблетки Но-Шпа® і після 45 хв для композиції відповідно до винаходу. Фармакокінетичне моделювання 7 UA 113517 C2 5 10 15 20 25 Фармакокінетичні профілі крові для фармацевтичної композиції за даним винаходом були розраховані із застосуванням програми моделювання. Математична модель (GastroplusTM програмне забезпечення для моделювання, доступне від Simulations Plus, Incorporated) була розроблена для вивчення вихідних швидкостей для дозованих лікарських форм дротаверину, які відповідали б конкретним мішеням вивільнення in vivo. Gastroplus® являє собою комп'ютерну програму, яка моделює всмоктування і фармакокінетику для перорально дозованих лікарських засобів. Базовою моделлю є модель Покращеного Блокового Всмоктування і Передачі (АСАТ) - розширення роботи, спочатку зробленої Gordon Amidon і Lawrence Yu. ДИВ. L.X. Yu, "An Integrated Model for Determining Causes of Poor Oral Drug Absorption". Pharm. Res… 16:1883-7 (1999) і B. Agoram, W.S. Woltosz, and M.B. Bolger, "Predicting the impact of physiological and biochemical processes on oral drug bioavailability", Advanced Drug Delivery Reviews, 50:S41-S67 (2001). Gastroplus® був застосований для моделювання всмоктування і фармакокінетики еталонних і аналізованих складів. Профілі розчинення in vitro складів дротаверину гідрохлориду (описаних вище) були застосовані як вихідні функції для моделювання всмоктування і фармакокінетики еталонних (таблеток, що знаходяться в продажу Но-Шпа® 80 мг) і аналізованих складів. На фігурі 1 показані результати застосування моделі для моделювання біодоступності in vivo таблеток Но-Шпа® 80 мг і фармацевтичної композиції відповідно до винаходу, що містить 80 мг дротаверину гідрохлориду. Ця модель була застосована, щоб оцінити ступінь ефективності дозованих форм за винаходом. Ці дані показують, що дозовані форми за даним винаходом будуть ефективні. Було виявлено, що відношення AUC і Cmax порівнянні для складу м'якого гелю і таблетки дротаверину гідрохлориду на 80 мг, застосовуючи програмне забезпечення Gastro Plus. Попередні обговорення і опис є ілюстративними для деяких варіантів здійснення за даним винаходом, але не призначені, щоб бути обмеженнями на цій практиці. ФОРМУЛА ВИНАХОДУ 30 35 40 45 50 1. Фармацевтична композиція в формі м'якої капсули для перорального введення, що включає: - 5-30 % (мас./мас.) дротаверину гідрохлориду; - не менше 60 % (мас./мас.) рідкої суміші щонайменше однієї неіонної гідрофільної поверхневоактивної речовини і щонайменше однієї неіонної гідрофобної поверхнево-активної речовини, де неіонна гідрофобна поверхнево-активна речовина включає пропіленгліколю монокаприлат. 2. Фармацевтична композиція за п. 1, в якій загальна кількість поверхнево-активної речовини знаходиться в діапазоні від 75 до 90 %. 3. Фармацевтична композиція за п. 1, в якій гідрофобну поверхнево-активну речовину представлено в кількостях від 60 до 90 % від маси композиції. 4. Фармацевтична композиція за п. 1, в якій неіонна гідрофільна поверхнево-активна речовина має значення гідрофільно-ліпофільного балансу (HLB) від 11 до 16. 5. Фармацевтична композиція за п. 1, в якій неіонна гідрофільна поверхнево-активна речовина являє собою полісорбат 80. 6. Фармацевтична композиція за п. 1, в якій неіонна гідрофільна поверхнево-активна речовина представлена в кількостях від 3 до 7 % від маси композиції. 7. Фармацевтична композиція за п. 1, в якій масове співвідношення дротаверину гідрохлориду і рідкої суміші поверхнево-активних речовин становить від 1:3 до 1:7. 8. Фармацевтична композиція за будь-яким з пп. 1-7, в якій кінцеве значення рН композиції знаходиться між 4 і 6. 9. Спосіб одержання фармацевтичної композиції за будь-яким з пп. 1-8, який включає наступні послідовні стадії: розчинення дротаверину гідрохлориду в рідкій суміші щонайменше однієї неіонної гідрофільної поверхнево-активної речовини і щонайменше однієї неіонної гідрофобної поверхнево-активної речовини при перемішуванні для одержання гомогенної суміші; і потім встановлення рН між 4 і 6, використовуючи звичайний буфер. 10. Застосування композиції, заявленої в будь-якому з пп. 1-8, для лікування спазмів і гострих болів. 8 UA 113517 C2 Комп’ютерна верстка Л. Литвиненко Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 9
ДивитисяДодаткова інформація
Назва патенту англійськоюPharmaceutical composition comprising drotaverine
Автори англійськоюBadabhagni, Sudhakara Rao, Jaiswal, Nilesh, Khullar, Praveen, Prasad, Kum
Автори російськоюБадабхагни Судхакара Рао, Джайсваль Нилеш, Кхуллар Правин, Прасад Кум
МПК / Мітки
МПК: A61K 31/485, A61K 31/47, A61K 9/48
Мітки: містить, композиція, дротаверин, фармацевтична
Код посилання
<a href="https://ua.patents.su/11-113517-farmacevtichna-kompoziciya-shho-mistit-drotaverin.html" target="_blank" rel="follow" title="База патентів України">Фармацевтична композиція, що містить дротаверин</a>
Попередній патент: Спосіб створення зображення
Наступний патент: Спосіб керування насосом
Випадковий патент: Спосіб індивідуального підбору пар у м'ясному скотарстві