Фрагмент днк, що кодує поліпептид к2р з властивостями активатора плазміногена
Номер патенту: 27111
Опубліковано: 28.02.2000
Автори: РУДОЛЬФ Райнер, ФІШЕР Штефан, ШТЕРН Анне, КОНЕРТ Ульріх, МАРТІН Ульріх
Формула / Реферат
Фрагмент ДНК, кодирующий полипептид К2Р со свойствами активатора плазминогена, имеющий нуклеотидную последовательность:
содержащий стартовый кодон АТС.
Текст
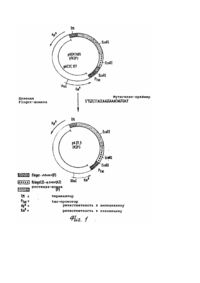
Изобретение относится к новому t-РА-производному, ДНК-последовательности, которая кодирует новое t-PAпроизводное, плазмидам экспрессии, которые обладают кодирующей t-PA-производное ДНК-последовательностью, а также к способу получения такого рода плазмид, способу получения t-PA-производного и средству растворения сгустков, содержащему t-PA-производное. Свернувшаяся кровь содержит в качестве основной компоненты протеиновой матрицы полимерный фибрин. Фибрин растворяется благодаря фибринолитической системе при физиологических условиях в последовательности реакций, которая подобна последовательности свертывания крови. Центральной реакцией при этом является активизирование плазминогена в плазмин, которое вызывается, например, активатором плазминогена ткани t-PA (ткань типа активатора плазминогена). Плазмин снова растворяет фибрин, который представляет собой основную компоненту протеиновой матрицы свернутой крови. Ферментативная активность природного или полученного гентехнологически из эукарионтов t-PA, а именно каталитическое активирование плазминогена в плазмин, в отсутствие фибрина или продуктов расщепления фибриногена очень незначительна, однако, в присутствии этих протеинов может отчетливо повышаться, а именно более, чем на фактор 10. t-PA расщепляется в крови благодаря имеющимся протеазам на А - и В -цепь. Обе образовавшиеся цепи остаются связанными через цестеиновый мостик. Сти-мулируемость активности t-PA представляет собой решающее преимущество по сравнению с другими известными активаторами плазминогенов, как, например, уро-киназа при стрептокиназа (см., например, M.Hoylaerts и др. J.Biol Chem 257/1982/, 2912-2919; W. Niewenhuizen и др., Biochem. Biophys Acta 755, /1983/531-533). Механизм действия t-PA ин виво описан, например Korniger u Collen, Ehroneb. Haneostasei 46, (1981), 561-565. Сфокусированная на поверхности фибрина активность фермента позволяет ему вести себя как пригодное средство для борьбы с патологическими закупорками вен (например, при инфаркте сердца), что большей частью может быть подтверждено клиническими испытаниями (Collen и др., Circulation 70 /1984/, 1012; Circulation 73 /1986/ 511). В качестве недостатка t-PA, однако, нужно рассматривать его быстрое уменьшение концентрации в плазме (клиренс). Следствием этого является то, что необходимо относительно большое количество t-РА, чтобы достичь ин виво эффективного лизирования тромбов. Высокие лечебные дозы опять же имеют следствием подобные действия, как, например, кровотечения. В европейском патенте 0196920 описан природный продукт разрушения t-PA, который содержит только еще домены протеазы и крингель-11 и N-конец которого начинается с аламина 160 (в расчете на указанную Pennica и др. в Nature 301/1983/214-221 последовательность аминокислот). Скорость клиренса этого продукта разрушения t-PA, однако, несущественно отличается от таковой природного tPA. Лишь благодаря химической модификации каталитической области за счет введения блокирующей группы можно здесь достичь улучшения. Поэтому задачей изобретения является изменение t-PA таким образом, чтобы образовавшееся производное обладало сильно сниженной скоростью клиренса и таким образом более длительным временем полураспада в плазме крови. При этом должны сохраняться лидирующее тромбы действие, а также стимулируемость фибрином. Предметом изобретения поэтому является активатор плазминогена ткани (t-PA-производное), который отличается тем, что он не гликозилирован и состоит из следующей последовательности аминокислот: которая на амино-конец, т.е. на аминокислоте №1=8, может быть еще продлена за счет М. Неожиданно установлено, что деления остальных, имеющихся в нативном t-РА областей не оказывает никакого влияния на тромболитическую эффективность протеина и зависящая от бирина стимулируемость мутеина сравнима с таковой нативного t-PA. Правда, установлено, что в предлагаемом согласно изобретению t-РА-производном отсутствует свойство связывания фибрина, однако, несмотря на это, неожиданно обнаружена ин виво эффективность тромболиза, которая даже существенно улучшена по сравнению с таковой нативного t-PA. Также неожиданным является тот факт, что при введении тромболитически достаточной эффективной дозы производного почти не оказывается влияния на системный фибрино-лиз. Следовательно, оказалось, что предлагаемое согласно изобретению t-PA-производное обладает типичным для нативного t-PA свойством специфичности к фибрину при физиологических условиях. Эти результаты получены из фармакологических исследований предлагаемого согласно изобретению t-PA-производного (см. примеры 6 и 7). Кроме того, предлагаемый в изобретении протеин обладает очень высокой удельной (специфической) активностью. При применении описанного ренатурирования уже определены активности 500 - 800 и U/мг. Следующим предметом изобретения является ДНК-последовательность, которая кодирует предлагаемое согласно изобретению t-PA-производное и содержит следующую последовательность: Предлагаемая в изобретении ДНК-последовательность служит для экспрессии предлагаемое в изобретении t-PAпроизводного, когда она имеется в плазмиде экспрессии. Такого рода плазмида экспрессии составляет следующий предмет изобретения, также, как и плазмида экспрессии, которая имеет отклоняющуюся от последней ДНКпоследовательность, которая, однако, также кодирует предлагаемое в изобретении t-PA-производное. На основании дегенерации генетического кода для этой цели пригодны отклоняющиеся от указанной ДНК-последовательности. Плазмида экспрессии содержит предпочтительно, наряду с кодирующей t-PA-производное последовательностью, дополнительно еще регулируемую структуру промотора (например, lac), эффективный терминатор (например, td), селекционный маркер (например, (3-лактамазаген) и область начала репликации. Следующим предметом изобретения является плазмадар А27.3. Получение этой плазмиды описано в примере 1, она содержит ДНК-последовательность, которая кодирует предлагаемое в изобретении t-РА-производное. Далее, следующим предметом изобретения является способ получения одной из предлагаемых в изобретении плазмид экспрессии, который отличается тем, что ДНК-последовательность, которая кодирует предлагаемый в изобретении t-PA-протеин или его производное, которое сверх доменов протеазы и крингеля-ІІ, обладает еще другими областями t-PA-протеина, внедряют в плазмиду и путем направленного мутагенеза удаляют те области, которые кодируют аминокислоты, отсутствующие в предлагаемом согласно изобретению t-PA-производном. Выбор плазмиды, в которую внедряется кодирующая предлагаемое в изобретении t-PA-производное ДНКпоследовательность зависит от используемых позднее для экспрессии производного клеток-хозяев. Пригодные плазмиды, а такжеминимальные требования, которые предъявляются к такого рода плазмиде (например, источник репликации, место рестрикционного разреза) известны специалисту. В рамках изобретения, однако, вместо плазмиды также можно применять космиду, репликативные, двунитевой формы фаги (X, М13) и другие, известные специалисту векторы. Методы направленного мутагенеза (определяемый сайтом мутагенез) описаны Morinaga и др., Bitechnology 21 (1984), 634, и осуществляется по существу как там описано. Далее, следующим предметом изобретения является способ получения предлагаемого в изобретении t-PAпроизводного, отличающийся тем, что одна из предлагаемых в изобретении плазмид экспри-мируется в пригодные клетки-хозяева и продукт получается из питательной среды, в случае необходимости после разрушения клетокхозяев. Предпочтительно для получения предлагаемого в изобретении t-PA-производного в качестве клеток-хозяев применяют прокарионтные клетки. При этом опять же особенно предпочтительно, чтобы образующиеся при этом так называемые "внутриклеточные тельца" (нерастворимые протеиновые агрегаты) сначала, отделялись от растворимых частиц клеток, содержащие t-PA внутриклеточные тельца солюбилизировались (растворялись) при восстанавливающих условиях путем обработки гуанидин-гидрохлоридом, затем их нужно дериватизировать с помощью GSSG и, наконец, ренатурировать t-PA-производное путем добавки L-аргинина и GSH. Точные методики активиро-вания t-PA из "внутриклеточных телец" описаны, например, в европейских патентах А - 0219874 и А 0241022. Однако согласно изобретению, также можно использовать любые другие способы получения активного протеина из "внутриклеточных телец". В случае предлагаемого в изобретении способа для очистки К2Р предпочтительно работают в присутствии Lаргинина, в особенности при концентрации 10 - 1000ммоль/л. Предлагаемое в изобретении отделение от чужеродного протеина путем аффинной хроматографии осуществляется в предпочтительном варианте осуществления изобретения через ЕТІ-адсорбирующую колонну (ETI эритрина-трипсин-ингибитор). При этом ETI фиксируется на материале носителя (абсорбер), как, например, сефароза. Очистка через ЕТІ-адсорбирующую колонну имеет то преимущество, что материал ЕТІ-адсорбирующей колонны может загружаться непосредственно из концентрированной смеси ренатурирования даже в присутствии таких высоких концентраций аргинина, как 0,8ммоль/л аргинина. Агрегации К2Р, которая имеет место при низких концентрациях аргинина ниже 10ммоль/л, благодаря этому избегают. Особенно предпочтительно поэтому осуществлять очистку К2Р через ETI-адсорбирующую колонну в присутствии 0,6 - 0,8ммоль/л аргинина. Содержащий К2Р раствор при этом предпочтительно имеет рН выше 7, особенно предпочтительно 7,5 - 8,6. Элюирование из ETI-колонны осуществляется путем снижения рН как в присутствии, так и также в отсутствие аргинина, при условиях, которые обеспечивают хорошую растворимость К2Р. Предпочтительно рН-значение при элюирова-нии лежит в кислой области, особенно предпочтительно в области 3 - 5,5. Полученный согласно изобретению К2Р обладает удельной t-PA-активностью 550,000±200,000IU/мг при чистоте свыше 95%, предпочтительно выше 99%. Согласно изобретению, следовательно получается t-PA-производное, которое обладает отчетливо более продолжительным временем полураспада плазмы на основании пониженной скорости клиренса. Предлагаемое согласно изобретению производное, однако, благодаря этому не теряет никаких своих свойств, делающих его пригодным в качестве лекарственного средства для тромболиза артериальных и венозных сгустков. Напротив, необходимые для тромболитической терапии с помощью К2Р дозы снижаются по крайней мере на четверть обычной в случае на-тивного t-PA дозы. В случае одинаковых доз К2Р и нативного t-PA система свертывания за счет К2Р затрагивается менее, чем благодаря нативному t-PA, и время кровотечения удлиняется незначительно в отличие от нативного t-PA, так что осложнения за счет кровотечения при терапии с помощью К2Р могут по возможности уменьшаться. Предлагаемое согласно изобретению t-PA-производное поэтому особенно пригодно для использования в лекарственном средстве, что опять же составляет следующий предмет изобретения. При применении предлагаемого в изобретении t-РА-производного в лекарственных средствах для достижения одинаковой эффективности, требуется только еще отчетливо сниженная доза введения, чем это имеет место в случае применения нативного, продуцированного СНО t-PA. Следующие примеры далее поясняют изобретение в сочетании с чертежами, на которых: фиг. 1 показывает схематически получение плазмиды рА27,3; фиг.2 показывает сравнение связи фибрина предлагаемого в изобретении t-PA-производного (кривая 1) с экспримированным в СНО-клетках нативным t-PA /двунитевой t-PA из СНО-клеток, расщепленных на физиологическом месте расщепления Агд 275-Ие276 (кривая 2) и однонитевой t-PA из СНО-клеток (кривая 3); фиг.3 и фиг.4 показывают диаграммы фармакокинетики t-PA-активности предлагаемого согласно изобретению t-PA-производного, по сравнению с выпускаемым в продажу t-PA-препаратом (Actilyse®); кривая I:K2P, доза 200000ед./кг=0,25мг/кг; внутривенное вливание через 30минут; число исследованных животных (кролики):4. Кривая 2: Actilyse® доза 200000ед./кг внутривенное вливание через 30минут, число исследованных животных/кролики/:6/; фиг.5 показывает кривые действия доз (для кроликов) на тромболиз предлагаемого согласно изобретению t-PA-производного, по сравнению с (показано среднее значение +SEM, IV-1000 IV; кривая 1:К2Р; кривая 2: Actilyse® фиг.6 показывает ход времени Simplali времени кровотечения (ВТ) до и после внутривенной инъекции пилюли (Bolus) (Actilyse®) плацебо или повышающихся доз находящимся под наркозом собакам; фиг.7 показывает ход во времени Simplali времени кровотечения (ВТ) до и после внутривенной инъекции пилюли плацебо или повышающихся доз К2Р находящимся под наркозом собакам. Пример 1. Конструкция плазмиды рА27,3. Исходная плазмида pREM7685, описанная в европейском патенте А-0242836, содержит следующие компоненты: tac-npoмотор, регион lac-оператора с АТС-стартовым кодоном, кодирующий регион для t-PA-производного ГК2Р, терминатор транскрипции из рКК223-3, ген β-лактамазы, ген резистентности к канамицину и область начала плазмиды рАСУС177, плазмиды, которая находится в клетке в низком числе копий. Последовательность t-РА-производного FK2P складывается вместе из нуклеотидов 180-336 (F-домены), 715-1809 [К2-домены, протеазы, меньшая доля 3'-VT] и ATG-стартового кодона. Положения нуклеотидов даны согласно последовательности, описанной Nature и др., 301 (1983) 214-221. Для делеции F-доменов из FK2P-конструкции в плазмид pREM7685 по существу используют метод Morinaga и сотр. Bitechnology, 21 (1984) 634. Для образования гетеродуплекса из pREM7685 изолируют два фрагмента. Фрагмент А: pREM7685 расщепляют с помощью рестрикционного фермента EcoRI. Продукты расщепления разделяют с помощью гель-электрофореза и больший фрагмент EcoRI элюируют из геля. Фрагмент В: плазмиду PREM7685 линеаризируют с помощью рестрикционного фермента Xhol. Линеаризированную плазмиду также получают препаративне гельэлектрофорезом. Для мутагенеза готовят синтетически следующий олигонуклеотид: 5 TG-TCT ТАС САА GGA ААС ACT GA 3' Для образования гетеродуплекса фрагмент А, фрагмент В (по 450f моль) и олигонуклеотид (75моль) смешивают и в присутствии 50ммоль/л NaCI, 10ммоль/л Трис/НСІ, рН 7,5 и 10ммоль/л MgSO4 инкубируют сначала триминуты при 100°С и тотчас переносят на лед. Ренатурация ДНК происходит за 30минут при 60°С. Для репаратурного синтеза к гетеродуплексу добавляют следующее: дезоксинук-леотидтрифосфаты (0,25ммоль/л, АТР (1ммоль/л), NaCI (100ммоль/л), Трис-НСІ, pH-7,5 (6,5ммоль/л), MgCI2 (8ммоль/л), (р-меркапотоэтанол 1ммоль/л), фрагмент Кленова ДНК-полимеразы из E.coli (0,125ед/мкл смеси) и Т4-лигазу (0,1ед/мкл смеси). Репаратурный синтез осуществляют в течение 4-х часов при 16°С. Затем эту смесь трансформируют в клетки E.coli (R M82, DSM 3689) с помощью lac Igплазмиды и трансформанты селекциони-руют путем добавки 25мкг/мл канамици-на и питательной среде. С помощью способа гибридизации колоний при применении вышеописанного олигонуклеотида мутагенеза в качестве зонда можно выбирать те клоны, которые несут плазмиду рА27,3, которая кодирует предлагаемое в изобретении t-PA-производное К2Р. Эта плазмида отличается от исходной плазмиды pREM7685, между прочим, отсутствием мест разреза Pstl, соответственно Sspl. Эти оба места разреза содержатся в любой области исходного плазмида, которая кодирует F-домены. Конструкция плазмиды рА27,3 схематически представлена на фиг.1. Пример 2. Получение активного t-PA-производного К2Р из E.coli Zellysi и получение внутриклеточных телец (IB). 1,6кг влажной клеточной массы (E.coli DSM 3689, трансформирована с помощью плазмида рА27,3) суспендируют в 10л 0,1моль/л Трис-НСІ, 20ммоль/л ЭДТК, рН-6,5, при 4°С. К этой смеси добавляют 2,5г лизоцима и инкубируют 30минут при 4°С; затем полное переведение клеток в удобную для переработки "форму осуществляют путем диспергирования при высоком давлении. К полученному раствору примешивают 5л 0,1ммоль/л Трис-НСІ, 20ммоль/л ЭДТК, 6% Тритона Х100 и 1,5ммоль/л NaCI, pH 6,5, и инкубируют следующие 30минут при 4°С. Затем осуществляют отделение нерастворимых составных частей (IB) путем центрифугирования с помощью центрифуги Padbery. Осадок после центрифугирования суспендируют в 10л 0,1ммоль/л Трис-НСІ, 20ммоль/л ЭДТК, рН 6,5, инкубируют 30минут при 4°С и IB-препарат выделяют путем последующего центрифугирования. Солюбилизация IB. 100г IB (мокрый вес) суспендируют в 450мл 0,1ммоль/л Трис-НСІ, бммоль/ л гуанидин-гидрохлорида, 0,2ммоль/л ДТЕ 1,4-дитиоэритрит 1ммоль/л ЭДТК, рН-8,6, и перемешивают при 25°С 2,5 часа. После установления рН-значения =3 с помощью НСІ (25%) осуществляют диализ против 10ммоль/л НСІ (X×50 л, 24 часа, 4°С), Дериватизация. Вводят гуанидин-гидрохлорид (твердый) так, чтобы после конечного разбавления вышеуказанного диализата с помощью 10ммоль/л НСІ концентрация гуанидин-гидрохлорида составляла 6ммоль/л. Реакционную смесь предварительно инкубируют при 25°С в течение 1,5 часов, затем вводят окисленный глютатион (GSSG) до 0,1ммоль/л и Трис-НСІ до 0,05ммоль/л и рН-значение доводят по титру до рН 9,3с помощью 5ммоль/л NaOH. Смесь перемешивают в течение 3,5 часов при 25°С. После установления рН-значения=3 с помощью HCI (25%) осуществляют диализ против 10ммоль/л НСТ (2x100 и 48 часов, 4°С). После диализа центрифугируют и прозрачную надосадочную жидкость обрабатывают далее. Натурирование. Реакционный сосуд емкостью 10л заполняют 0,1ммоль/л Трис-НСІ, 0,8ммоль/л L-аргинина, 2ммоль/л GSH (гентатион, восстановленная форма), 1ммоль/л ЭДТК, рН 8,5. Ренатурирование проводят при 20°С путем трехкратной добавки, смотря по обстоятельствам, 100мл производного (смешанный дисульфид, см. выше) в отрезок времени 24 часа. После ренатурирования получают материал с удельной активностью 1500 - 10000 Ш/мг (определение см. пример 46). Единица 111 - единица активности по определению WHO, Национального Института по биологическим стандартам и контролю. Концентрирование ренатурированной реакционной смеси. Ренатурированную смесь при необходимости можно концентрировать через ге-модиализатор. Пример 3. Очистка К2Р из E.Coli. 1. Очистка К2Р из E.Coli путем аффинной хроматографии на ЕТІ-сефарозе после предварительного концентрирова-ния. а) Элюирование с помощью лимонной кислоты. Смесь после ренатурирования концентрируют через Memo-диализатор (Asahi AM 300) 1:23 и дополняют с помощью 0,5ммоль/л NaCI. Уравнвношенную с помощью 0,1ммоль/л Трис-НСІ, рН 7,5, 0,8ммоль/л аргинина, 0,5ммоль/л NaCI колонну с ETI (эритрина-трипсин-ингибитор)-сефарозой (объем=50мл) нагружают 550мл концентрата подвергнутой повторному окислению смеси (10 колоночных объемов/час, 10 SV/час) и промывают уравновешивающим буфером до тех пор, пока абсорбция элюата при 280нм не достигнет холостого значения буфера. Элюирование связанного материала осуществляют с помощью 20ммоль/л лимонной кислоты, рН 3,2. б) Элюирование с помощью 0,3ммоль/л аргинина, рН 4,5. Ренатурированную реакционную смесь концентрируют как описано в примере 3.1.а. Уравновешенную с помощью 0,1ммоль/л Трис-НСІ, рН 7,5, 0,8ммоль/л аргинина, 0,5ммоль/л NaCI колонну с ЕТІ-сефарозой (25мл) нагружают 800мл концентрата (12SV/час). и промывают уравновешивающим буфером до тех пор, пока экстинкция элюата при 280нм не достигнет экстинкции буфера. Связанный материал элюируют с помощью 0,3ммоль/ л аргинина, рН 4,5. 2. Очистка К2Р из е.соlі путем аффинной хроматографии на ЕТІ-сефарозе без предварительного концентрирования. Уравновешенную с помощью 0,1ммоль/л Трис-НСІ, рН 7,5, 0,8ммоль/л аргинина, 0,5ммоль/л NaCI колонну с ЕТІсефарозой (объем 10 чил) загружают 12 л повторно окисленной смеси и промывают уравновешивающим буфером до тех пор, пока экстинкция элюата при 280нм не достигнет экстинкции буфера. Элюирование связанного материала осуществляют с помощью 0,8ммоль/л аргинина, рН 5. Пример 4. Характеристика очищенного К2Р из E.coli. а) Протеин-химическая характеристика. SDS-PAGE и обратная фаза жидкостной хроматографии высокого давления. Гомогенность очищенного с помощью аффинной хроматографии с ЕТІ-сефарозой материала показана благодаря SDS-PAGE и обратной фазы жидкостной хроматографии высокого давления (RP-HPLC). Из относительной длины пробега рассчитывается для К2Р из прокарионтов молекулярный вес 38,500+2,000Да. Денситометрическая оценка дает чистоту препарата выше 95%. RP-HPLC основана на различном взаимодействии протеинов с гидрофобной матрицей. Это свойство используется в качестве аналитического метода для квалификации степени чистоты. Анализ очищенного К2Р из E.coli осуществляют через разделительную колонку с Нуклеозилом 300 (Knauer) с помощью градиентов трифторуксусная кислота (ацетонитрил) буфер А: 1,2мл трифторуксус-ной кислоты в 1000мл воды; буфер В: 300мл воды, 700мл ацетонитрила, 1мл трифторуксусной кислоты; 0 - 100% (Интегрирование хроматографического анализа дает чистоту выше 95%). N-терминальная последовательность аминокислот. N-терминальная последовательность аминокислот определяется с помощью ABI 470 - секвенатора со стандартной программой и линейным РТН-детектированием. Найденная последовательность S1-Y2-Q3-G4-N5-S6-D7C8-Y9 совпадает с ожидаемой, происходящей из ДНК-последовательности, последовательностью. б) Определение активности. Ин витро активность К2Р из е.соіі определяется по описанию теста в "Leitschrift furolie gesaniti innve1 MoJizen" (ZGIMAL) 42 (17) 478-486 (1987). Удельная активность составляет 550,000 1/мг ±200,000IU/мг. Стимулируемость К2Р из E.coli благодаря BrCN-фрагментам фибриногена (активность в присутствии фибриногеновых фрагментов отдельно от активности без фибриногеновых фрагментов) в этой тест-системе составляет более 25. в) Ин витро-связывание с фибрином. Ин витро-связывание К2Р из E.coli с фибрином определяют по описанному Higgins и Vehar методу (Higgins D.Z., Vehar G.A., 1987, Biochem. 26, 7786-7791). На фиг.2 показано, что К2Р из E.coli в противоположность t-PA из СНО или tPA из E.coli не обладает никаким достойным внимания фибриновым связыванием. Пример 5. Для увеличения выхода экспрессии кодирующую К2Р-ген последовательность переклонируют в плазмид с более высоким числом копий. Для этой цели используют плазмиду реРа 126,1, описанную в патенте ФРГ 3838378.0. Эта плазмида составляется главным образом из вектора рКК223-3 и кодирующей последовательности для t-PA, как описано в европейском патенте А-О 242835. В эту плазмиду прежде всего интегрируют последовательность fd-терминато-ра. Для этой цели плазмиду реРа 126,1 линеаризируют с помощью рестрикцион-ного фермента Hind. Таким образом расщепленную плазмиду разделяют с помощью гель-электрофореза и получают пре-паративно. Плазмиду (pLBUL Bick и др., 1978, Nuel. Acids, Res, 5, 4495-4503; Gentz и др., 1981, PNAS 78(8) : 4963) подвергают- рестрикции с помощью Hind III и препаративно получают величиной примерно 360 вр Hind Ill-фрагмент, который содержит fd-терминатор, путем гель-электрофореза и гель-элюирования. Линеаризированный плазмид реРа 126,1 и длиной 360 вр Hind Ill-фрагмент из pL-BUL лигируют. Смесь после лигирования котранс-формируют с описанной в заявке на патент ФРГ 3838378.0 плазмидой pV-BP 500 в E.coli DSM 2102. Из клонов выбирают те, которые содержат желательную плазмиду реРа 126fd, которая отличается от исходной плазмиды реРа 126,1 тем, что она содержит второе место разреза Hind HI. Из плазмиды реРа 126fd получают два фрагмента: величиной 3,4kb Bam HI/Pvul-фрагмент и величиной примерно 1,3кв Pvul/Xmal-фрагмент. Оба указанных фрагмента лигируют с помощью величиной примерно 1,3кв BamHl/Xmalфрагмента из плазмиды рА27,3 и трансформируют в E.coli с помощью плазмиды pVBS 500. Результирующая плазмида получает название рА27fd и может отличаться от реРа 126, с тем, что у подвергнутой реструкции смеси с помощью EcoR I имеется второй очень маленький EcoR I-фрагмент из ре-Ра 126fd длиной примерно 610вр в рА27fd,, сокращенный примерно на 515вр. Пример 6. Фармакологические данные экспримированного в прокарионтах t-PA-производного К2Р. 1. Фармакокинетика К2Р на кроликах. К2Р на белых новозеландских кроликах сравнивают с Actilyse®по их фарма-кокинетическим свойствам. Оба фибринолитика настаивают в дозе 200000U/кг KG в течение 30минут. Пробы плазмы получают в определенные моменты времени до, во время и после вливания. t-PA-активность измеряется с помощью спектрофотометрического теста по J.H.Oviheyen и др. (Ehromb. Haemostas 48, 266, 1982) модифицированному no H.Zill (Z ges. Inn. Med 42, 478, 1987). Для расчета фармакокинетических параметров используют расчетную программу нелинейной регрессии, модифицированную по H.J.Hucing Alro-Astronautics-Report 64, Rics University 1-30, 1969. Параметры рассчитывают индивидуально с помощью биэкспоненциальной фармако-кинетической модели. К2Р показывает в пять раз более длительное время полураспада (t I/2L=10,3мин), уменьшение концентрации в плазме, чем Actilysi*, t-PA-препарат фирмы Ehomoe (табл.1, рис.5 и 6). По окончании вливания (спустя 30минут) в случае К2Р-Рго измеряют концентрации в плазме активности t-PA (Синф), равной 1986 IU/мл, которая таким образом в шесть раз выше, чем в случае Actilyse®. Распределительный объем центрального отделения (V,) составляет для К2Р 46,8мл/кг по сравнению с 73,7мл/кг для Actilyse. Клиренс всей плазмы (СІобщ) по сравнению с Actilyse®(СІобщ=22,2мл/мин/кг) в случае К2Р-Рго снижен на 1/7 (СІобщ=3,2мл/мин/кг). Для применения фибри-нолитика для инъекции пилюли особенно интересна "область под кривой" (AVC), так как она допускает сравнение концентрации, главенствующей по времени в плазме. К2Р показывает AVC в 8 раз выше (1064 1/мл час) чем Actilyse®(133,3 IU/мл час). В целом К2Р по сравнению с Actilyse®в настоящее время единственный продажный рекомбинантный t-PAпротеин, при равной дозе показывает улучшенный в 5-8 раз фармакокинетический профиль. 2. Фармакодинамика К2Р на кроликах. Для испытания тромболитической эффективности используют основанную D. Collen и др. Модель на кроликах по тромбозу яремной вены (J. Clin Incert 711, 68, 1983) К2Р и Actilyse®последуют в трех, смотря по обстоятельствам, дозах. Фиб-ринолитики вливают в течение 4-х часов и затем определяют скорость тромболиза (табл.2, фиг.5). Рассчитанная с помощью линейной степени регрессии доза для скорости тромболиза бСЩЗДэд) составляет для К2Р 124.000 IU/кг KG-и для Actilyse®520.000 І/кг. KG. K2P показывает, таким образом, в 4 раза более высокое тромболическое действие, "чем Actilyse®, K2P достигает, в зависимости от дозы, концентрации в плазме, активности t-PA, которая при четырехкратно сниженной дозе сравнима с Actilyse®. Сравнимая по тромболическому действию с 800 к U Actilyse®/KG-flO3a в 200 к U К2Р/кг KG приводит к незначительным воздействиям на параметры получения фибриногена, плазмогена и α-антиплазмина, которые однако не отличаются от воздействий дозы 800 к U Actilegfi/кг KG. К2Р представляет собой t-PA-Мутеин, который на модели тромбоза яремной вены кролика при четырехчасовом вливании фибринолитиков при понижении дозы на 1/44 дозы Actilyse®проявляет такое же тромболитическое действие, как м Actilyse®, К2Р не отличается при пониженной дозе от Actilyse®по воздействиям на систему свертывания и по концентрации в плазме t-PA-активности. Пример 7. Фармакологические свойства К2Р из E.coli на используемой в качестве модели собаке с тромбозом коронарной артерии. Для того, чтобы изучить тромболитические действия К2Р из E.coli на артериальных тромбах, в качестве примера выбрано экспериментальной моделью животное с острым инфарктом миокарда. В качестве вида животных исследовали собаку. Метод образования тромбона коронарной артерии представляет собой модификацию способа Roneson и др. (Ehromb.Res 17, 841, 1980). В открытой грудной клетке в случае находящихся под наркозом и при искусственном дыхании собак электрически раздражают поверхности интимы окружающей ветви A.Coronaria senistru/=left lircmuflen coronary artery = LCX/ (150 MA) и благодаря этому возникает тромбоз. Дис-тально тромбоз прежде был вызван спиралью, чтобы удалить путем экспериментального стеноза реактивную гиперемию. Проксимальне коронарный тромбоз прежде был вызван спиралью, чтобы удалить путем экспериментального стеноза реактивную гиперемию. Проксимальне коронарный тромбоз был инструментирован LCX с электромагнитной плавающей (Flow) измерительной головкой, чтобы можно было измерять реперное слияние. При изучении нахождения доз находящимся под действием гепарина собакам в течение 1минуты вводили путем инъекции ВМ 06.022 с эукаритным t-PA (Alteplase/Actilyse®и др. Kart Ehonam Гмбх, Biberach, ФРГ) в виде четырех различных доз, и с плацебо, смотря по обстоятельствам, 6-ти животным на дозу, в виде внутривенной одноразовой начальной пилюли. До и в определенные моменты времени после инъекции получали пробы плазмы, чтобы определить концентрацию в плазме t-PA-активности и фибриногена, плазми-ногена и аг-антиплазмина, а также, чтобы определить число тромбоцитов во всей крови. Фибриноген измеряют коагуломет-рически по Клаусу/Acta hoemat 17, 237, 1957), плазминоген и о-антиплазмин измеряют, как описано у Collen и др. (J. Clin Invest 71, 368, 1983), спектрометрически. Далее, "Sunplate время кровотечения" измеряли на задней ноге собаки с помощью стопора (защелки) Sunplate* 1, Organon belluka, Eppelluin, ФРГ, во время застоя 40 мм Нд (у Surg Res, 27, 244, 1979). Статическое сравнение измеренных величин после инъекции с контрольным значением до инъекции осуществляют с помощью теста Wilcoxon для разниц пар. Для того, чтобы можно было описать тромболитический успех, указывается число обоснованных репером на "доза-группа" животных (=скорость слияния реперов) а также время вплоть до слияния реперов (=время слияния реперов). Далее, определяют мокрый все еще имеющегося спустя 2 часа после инъекции остаточного тромба, и определяют количество животных с новой закупоркой после слияния реперов (=скорость повторной окклюзии). С помощью полулогарифмического регрессивного анализа действия доз (отношение скоростей слияния реперов) для каждого вещества рассчитывается эффективная доза для 50%-ной скорости реперного слияния (= ЭДэд). Статистическое сравнение веса остаточного тромба осуществляют с помощью теста Wilcoxon Mann-Whithey для несвязанных проб на выдержку. • Концентрация в плазме t-PA-активности измеряется с помощью спектрофото-метрического теста по Verheijen др. (Ehromb. Haemost48, 266, 1932), модифицированного по Lill (Z. gesanete Inn/Meof 42, 478, 1987). Для расчета фармакокине-тических параметров используется расчетная программа нелинейной регрессии, модифицированная по Н.У. Huang (Acro-Aitnnautios Report 64, Rice University США, 1-30, 1969). Параметры рассчитываются индивидуально после снижения свойственного организму базального уровня t-РА-активности нижеследующих измеренных значений с помощью би-экспонен-циальной фармакокинетической модели. Получаются следующие результаты. 1. Фармакодинамика на собаке. К2Р после внутривенной инъекции приводит к зависящей от дозы скорости слияния реперов. Максимальный эффект (скорость слияния реперов 100%) достигается после инъекции 200кК/кг КС, Доза со 100% успеха слияния реперов в случае Actilyse®составляет 1600 кК/кг·КС. Сравнение значений 3Дзд для К2Р (ЭД.^83 ки КС) дает сниженное в 11,5 раз значение, чем для Actilyse®ЭД50=961кК/кг КС. Введение плацебо не ведет ни к какому слиянию реперов. Вес остаточного тромба у животных с введенным плацебо составляет 9,6±1,6мг (среднее значение SEM); как К2Р, так и также Actilyse®приводят с увеличением доз к статистически значительному снижению веса остаточного тромба по сравнению с плацебо-контролем. Слияние реперов происходит в случае обоих фибринолитиков в среднем у всех животных спустя 25,9±3,5мин/К2Р, соответственно, спустя 24,2±6,2мин (Actilyse®). Большинство обработанных К2Р или Actilyse®собак повторно окклюдируют после слияния реперов (табл.3). 2. Фармакокинетика на собаке. После внутривенной инъекции 200 KU/кг К2Р или Actilyse®на наркотизированной собаке показано, что быстрая фаза уменьшения концентрации в плазме, выраженная в виде 11/2 а, в случае К2Р с 7,2±1,1мин. На фактор 4,5 длиннее, чем в случае Actilyse®с 1,6±0,2мин (табл.4). Найденная непосредственно после окончания инъекции концентрация в плазме К2Р примерно вдвое выше, чем в случае Actilyse®. Удаление К2Р из плазмы (клиренс плазмы= С1общ^) осуществляется в девять раз медленнее, чем в случае Actilyse®. Соответственно, площадь под кривой концентрации в плазме К2Р примерно в 9,5 раз больше, чем таковая в случае Actilyse®. 3. Специфичность фибрина на собаке. Спустя 2 часа.после инъекции К2Р находят зависящее от дозы в небольшой степени снижение остаточной концентрации фибриногена до 81±10% в случае самой высокой дозы (200ки/кгКС). В противоположность этому концентрация фибриногена после введения самой высокой дозы Actilyse®(1600ки/кгКС) почти полностью снижена до 3±0% (табл.5). Если осуществляют полулогарифмический регрессионный анализ доза-побочное действие (соотношение снижения фибрина) и определяют тромболитическое для ЭДэд действие в отношении остаточной концентрации фибриногена, то для эквипотентных доз в случае К2Р остаточное содержание фибриногена получается 92,5% по сравнению с 38,6% в случае Actilyse®. Также для плазминогена и otj-антиплазмина находят зависящее от дозы снижение остаточного содержания спустя 2 часа после инъекции, которое в случае Actilyse®более ярко выражено, чем в случае К2Р. Лишь концентрация тромбоцитов в случае обоих веществ почти не затрагивается. 4. Влияние на время кровотечения у собаки. Внутривенная инъекция К2Р не дает никакого статистически значительного удлинения времени кровотечения по сравнению с контрольным значением перед инъекцией во всех 4-х различных дозах. В противоположность этому Actilyse®в дозах 1130 и 1600ки/кг КС статистически значительно удлиняет время кровотечения (фиг.6 и 7). 5. Общая оценка. На описанной модели-собаке тромбоза коронарных артерий К2Р показывает себя как тромболитик, который после внутривенной инъекции пилюли (Bolus) может достигать 100%-ной скорости слияния реперов, не влияя сильно на концентрацию фибриногена и без заметного удлинения времени кровотечения. По сравнению с Actilyse®в качестве уровня техники К2Р в тромболитической потенции после внутривенной инъекции пилюли оказался отчетливо превосходящим (фактор 11,5). Исследование фармакокинетического профиля К2Р, далее, дает, что по сравнению с Actilyse®клиренс К2Р, как выражение для более продолжительного удаления из плазмы, в девять раз длительнее.
ДивитисяДодаткова інформація
Назва патенту англійськоюDna fragment, coding k2p polypeptides having plasminogen activator properties
Назва патенту російськоюФрагмент днк, кодирующий полипептид к2р со свойствами активатора плазминогена
МПК / Мітки
МПК: C12N 9/72, A61K 38/46, C07K 14/745, A61P 7/02, C12N 9/64, C12N 15/09, C07K 1/113, C12N 15/58
Мітки: днк, фрагмент, кодує, к2р, властивостями, активатора, поліпептид, плазміногена
Код посилання
<a href="https://ua.patents.su/11-27111-fragment-dnk-shho-kodueh-polipeptid-k2r-z-vlastivostyami-aktivatora-plazminogena.html" target="_blank" rel="follow" title="База патентів України">Фрагмент днк, що кодує поліпептид к2р з властивостями активатора плазміногена</a>
Попередній патент: Антрациклінові глікозиди та їх фармацевтично прийнятні кислотно-адитивні солі, спосіб їх одержання, похідні 1,6-дийод-3-оксапентану та спосіб їх одержання
Наступний патент: Веломобіль
Випадковий патент: Металеве рамне податливе кріплення