Спосіб одержання дипентаеритриту
Номер патенту: 69096
Опубліковано: 25.04.2012
Формула / Реферат
Спосіб отримання дипентаеритриту, що включає конденсацію ацетальдегіду і формальдегіду у присутності гідроксиду натрію і пентаеритриту, розділення, виділення і очищення продуктів, що надійшли в процес і утворилися в ньому відомими способами, який відрізняється тим, що, для підвищення виходу дипентаеритриту і забезпечення повного повернення у процес пентаеритриту, що був внесений і утворився, конденсацію альдегідів проводять в реакторі змішення, в який при температурі реакційної суміші 50-70 °C безперервно вводять ацетальдегід, формальдегід, гідроксид натрію і воду в мольному відношенні 1,0:3,8-4,5:1,0-1,3:20-50, та увесь пентаеритрит, видалений з реакційної суміші, з такою об'ємною швидкістю, щоб ступінь перетворення (конверсія) ацетальдегіду в кінцеві продукти за час перебування в реакторі складав 0,85-0,96.
Текст
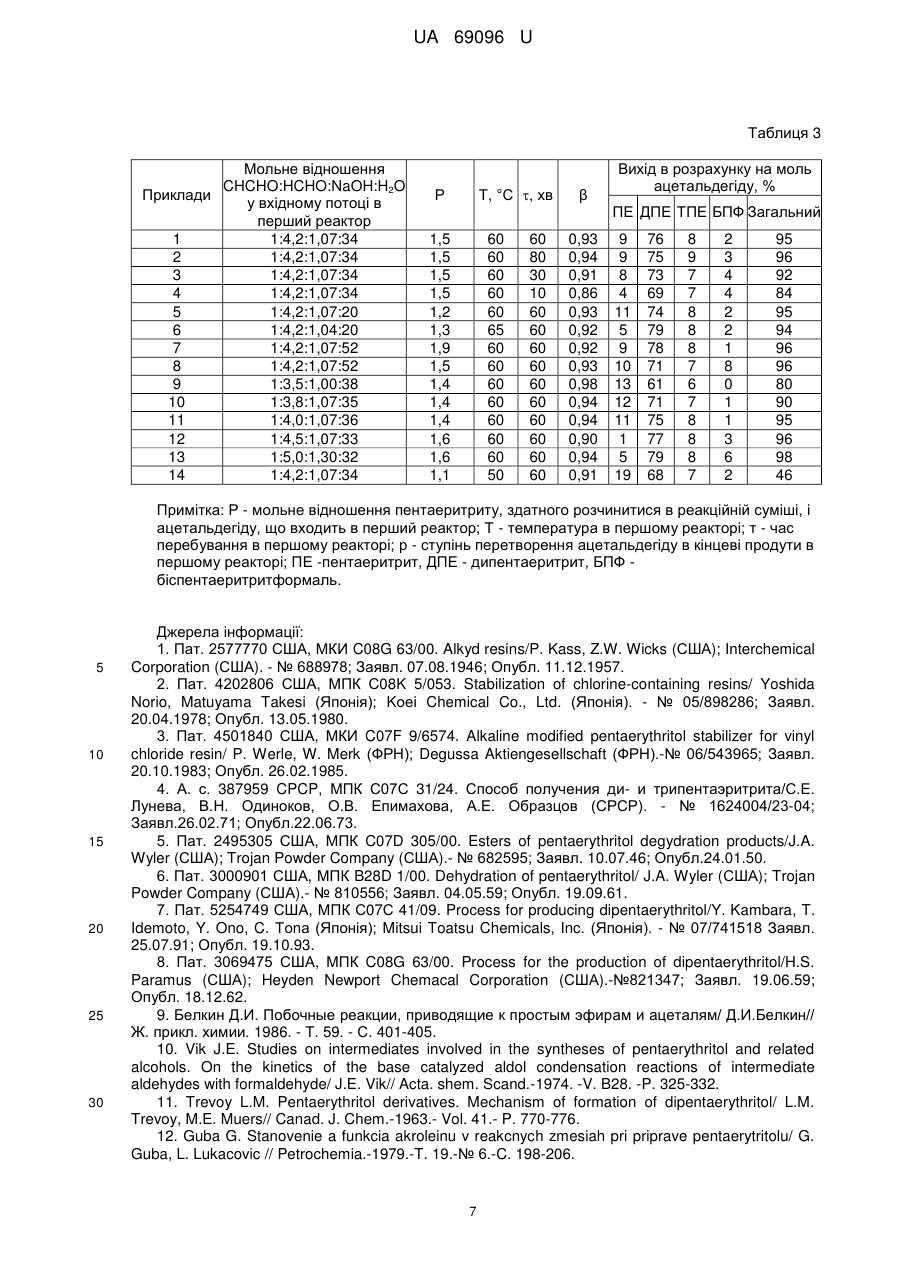
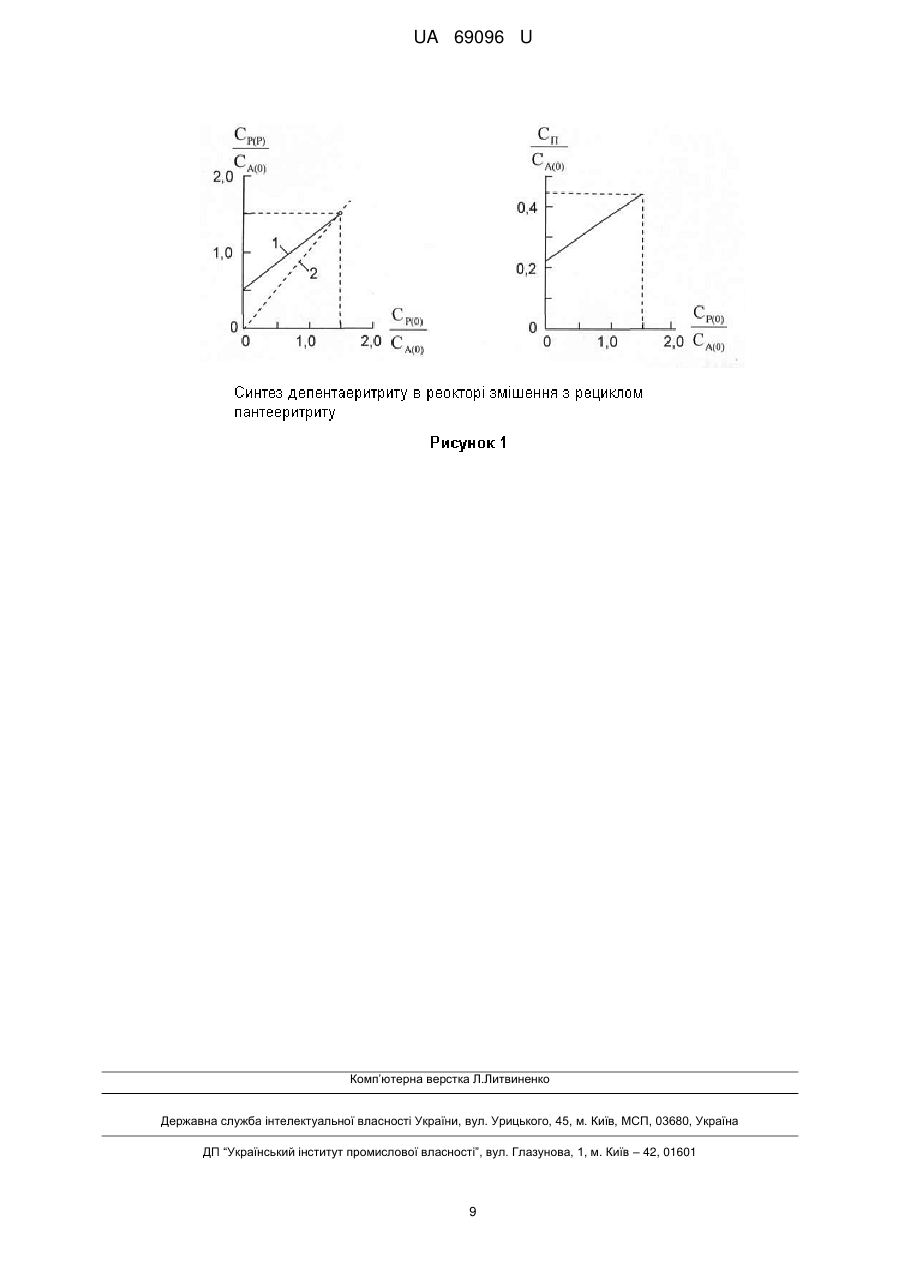
Реферат: Спосіб отримання дипентаеритриту включає конденсацію ацетальдегіду і формальдегіду у присутності гідроксиду натрію і пентаеритриту, розділення, виділення і очищення продуктів, що надійшли в процес і утворилися в ньому відомими способами. Для підвищення виходу дипентаеритриту і забезпечення повного повернення у процес пентаеритриту, що був внесений і утворився, конденсацію альдегідів проводять в реакторі змішення, в який безперервно вводять ацетальдегід, формальдегід, гідроксид натрію і воду та увесь пентаеритрит, видалений з реакційної суміші. UA 69096 U (54) СПОСІБ ОДЕРЖАННЯ ДИПЕНТАЕРИТРИТУ UA 69096 U UA 69096 U 5 10 15 20 25 30 35 40 45 Галуззю техніки, до якої належить корисна модель, є технологія отримання багатоатомних спиртів, конкретно - технологія отримання багатоатомного спирту дипентаеритриту, який є важливою сировиною для виробництва спеціальних смол і покриттів, що мають високу швидкість висихання, твердість і водостійкість, а також для виробництва полімерів, мастил, складних ефірів багатоосновних кислот, як антикоагулянтів полімерів, що містять хлор, і інших цінних продуктів [1-4]. Рівень техніки характеризують відомі способи отримання дипентаеритриту, що розглядаються далі. Відомий спосіб отримання дипентаеритриту [5, 6] нагріванням пентаеритриту у присутності кислотного каталізатора до температури 180-240 °C. Одним з недоліків цього способу є отримання суміші простих ефірів від дипентаеритриту до декапентаеритриту (поліпентаеритритриту), а також циклічних ефірів. Відомий спосіб отримання дипентаеритриту [7], згідно якому, для зменшення кількості поліпентаеритритів, дегідратація пентаеритриту проводиться у присутності кислотного каталізатора так, щоб ступінь перетворення пентаеритриту не перевищував 25 %. У атмосфері азоту при 240 °C суміш пентаеритриту і фосфорної кислоти в мольному відношенні 1:0,0035 протягом години збагачується дипентаеритритом. Склад отриманого продукту: масова частка пентаеритриту 79,7 %, дипентаеритриту 11,6 %, трипентаеритриту 1,6 %, а поліпентаеритрити відсутні. Для подальшого збагачення продукту дипентаеритритом використовується кристалізація у воді і фільтрування. Одним з недоліків цього способу є низький ступінь перетворення пентаеритриту в дипентаеритрит з отриманням суміші з низьким змістом дипентаеритриту, що ускладнює виділення цього продукту. Відомий спосіб отримання дипентаеритриту [8] дегідратацією неповних ефірів пентаеритриту і карбонових кислот, наприклад, оцтової, у присутності аліфатичної сульфокислоти, наприклад, етансульфокислоти, з подальшим алкоголізом складного ефіру дипентаеритриту у присутності мінеральної кислоти. Дегідратація проводиться при температурі 175-180 °C і залишковому тиску 25-30 мм рт. ст. до припинення відгонки води і карбонової кислоти. До залишку суміші ацетатів пентаеритриту і дипентаеритриту додається метанол і концентрована соляна кислота. З суміші відганяється метанол і метилацетат. Продукт з мольною часткою пентаеритриту 66,5 % і дипентаеритриту 33,5 % відділяється фільтруванням. Для відділення дипентаеритриту продукт змішується з водою в масовому відношенні 1:4,6, і нагрівається до температури 47 °C. При цій температурі дипентаеритрит відділяється фільтруванням. Одним з недоліків цього способу є необхідність використання органічних кислот і метанолу, а також складність процесів гідролізу складних ефірів і відгонки метилацетату. Загальним недоліком розглянутих способів [5-8] є необхідність проведення процесів при високій температурі і в твердій фазі, що значно ускладнює технологічний процес і вимагає використання спеціальних реакторів, а також необхідність використання продажного пентаеритриту, який є більш дорожчим, ніж сирий пентаеритрит, що використовується при синтезі дипентаеритриту з одночасним отриманням пентаеритриту шляхом конденсації ацетальдегіду або акролеїну з формальдегідом у присутності лужного конденсуючого агента. Реакції утворення дипентаеритриту в цьому процесі протікають паралельно реакціям утворення пентаеритриту згідно схемі 1 [9]. Загальні для двох напрямів реакцій проміжні альдегіди - метилолоцтовий і диметилолоцтовий, в лужному середовищі дегідратуються в оборотних реакціях з отриманням акролеїну і метилолакролеїну [10]. Іонізований пентаеритрит в оборотних реакціях приєднується до цих ненасичених альдегідів з отриманням проміжних продуктів, з яких виходить дипентаеритрит. 1 UA 69096 U 5 10 15 20 25 30 35 Як видно, вихід дипентаеритриту зростає при збільшенні концентрації пентаеритриту [11] і ненасичених альдегідів. Проте проста заміна ацетальдегіду на акролеїн не приводить до помітної зміни перебігу реакцій і підвищення виходу дипентаеритриту унаслідок оборотної реакції гідратації акролеїну з отриманням метилолоцтового альдегіду [12], і тільки при додаванні пентаеритриту до початку реакцій вихід дипентаеритриту зростає [13], що є, перш за все, наслідком підвищення концентрації пентаеритриту, а не використання акролеїну. Вихід дипентаеритриту знижується при збільшенні надлишку формальдегіду, що пов'язане, зокрема, з утворенням в оборотній реакції полуацеталю пентаеритриту і формальдегіду [14], з якого виходить біспентаеритритформаль. Є також дані про те, що вихід дипентаеритриту зростає при використанні гідроксиду калію [15]. Всі відмічені особливості так чи інакше використовуються в різних способах отримання дипентаеритриту. Відомий спосіб отримання дипентаеритриту [4] конденсацією акролеїну з формальдегідом у присутності гідроксиду лужного або лужноземельного металу, який відрізняється тим, що процес ведуть при мольному відношенні акролеїну, формальдегіду і гідроксиду металу 1:37:0,25-2,0 при температурі 50-90 °C у присутності пентаеритриту в кількості від 0,1 до 2,0 моль на 1 моль акролеїну. Спочатку готують розчин суміші формальдегіду і акролеїну, потім при вказаній температурі в суспензію пентаеритриту у воді при перемішуванні протягом 50 хвилин одночасно зливають розчин цієї суміші і водний розчин гідроксиду металу. При проведенні реакції без додаткового пентаеритриту вихід пентаеритриту 59 %, дипентаеритриту 15 %, трипентаеритриту і поліпентаеритритів 5,6 %, загальний вихід продуктів 80 % в розрахунку на акролеїн. При додаванні пентаеритриту в кількості 1 моль на 1 моль акролеїну вихід пентаеритриту 3 %, дипентаеритриту 42 %, трипентаеритриту і поліпентаеритритів 51 %, загальний вихід продуктів 96 % в розрахунку на акролеїн. Відомий спосіб отримання дипентаеритриту [16] в реакції пентаеритриту з акролеїном і формальдегідом при температурі 0-50 °C, мольному відношенні: пентаеритриту і акролеїну 0,23,0:1,0 (краще 0,8:2,0), формальдегіду і акролеїну 1,0-10,0:1 (краще 3,0-6,0) у присутності гідроксиду металу, узятого в кількості, що перевищує на 10-20 % стехіометрично необхідну. Згідно цьому способу акролеїн вводиться у водну суміш формальдегіду, гідроксиду металу і пентаеритриту протягом 15 хвилин при вказаній температурі. Вихід дипентаеритриту 77-82 %, трипентаеритриту 3,7-21 %, при загальному виході пентаеритриту, дипентаеритриту і трипентаеритриту 82-88 %. Вміст дипентаеритриту в суміші продуктів 43 %. Все ж таки, за даними патенту [13], в розглянутих умовах вихід пентаеритриту 47,5 %, дипентаеритриту 14,5 %, трипентаеритриту 2,5 %, біспентаеритритформалю 10,1 %, при загальному виході продукту 76,1 %. 2 UA 69096 U 5 Відомий спосіб отримання дипентаеритриту [13] реакцією пентаеритриту з акролеїном і формальдегідом при температурі 20-50 °C, і загальному мольному відношенні: акролеїну, формальдегіду, гідроксиду натрію і пентаеритриту 1,0:4,0-5,0:1,2:1,0-2,5. Згідно цьому способу у водну суміш формальдегіду, гідроксиду натрію і пентаеритриту вводиться протягом 15-60 хвилин при вказаній температурі водна суміш акролеїну і формальдегіду. Відповідно до таблиці 1 вихід продуктів в розрахунку на акролеїн залежить від умов процесу. Таблиця 1[13] Загальне мольне відношення: акролеїну, Температура о формальдегіду, C гідроксиду натрію і пентаеритриту 1:4:1,2:1 20 1:5:1,2:1 40 1:5:1,2:1 50 1:5:1,2:2 40 1:5:1,2:2,5 40 10 15 20 25 30 35 40 45 Вихід продуктів з розрахунку на акролеїн, % пентаеритриту дипентаеритриту трипентаеритриту 33,6 28,2 28,8 12,1 4,7 40,1 47,1 49,1 58,9 67,1 9,8 15,0 12,5 11,9 16,9 Сумарний з урахуванням поліпентаеритриту 90,6 95,3 95,0 89,9 95,9 Крім відмічених окремих недоліків, розглянутим способам за патентами [4, 13, 16] властиві також загальні недоліки. При використанні акролеїну збільшуються витрати і ускладнюється технологічний процес, тому що акролеїн дорожча сировина, ніж ацетальдегід, і його складно зберігати і використовувати унаслідок значної схильності до полімеризації. Дипентаеритрит можна отримати і в звичайному синтезі пентаеритриту з використанням ацетальдегіду, виключивши при цьому недоліки, пов'язані з використанням акролеїну. У звичайному синтезі пентаеритриту в періодичному реакторі або в реакторі витіснення вихід дипентаеритриту зростає із зменшенням мольного відношення ацетальдегіду і формальдегіду [17]. Відомий спосіб [18] отримання пентаеритриту і дипентаеритриту, згідно якому ацетальдегід, формальдегід, гідроксид кальцію і вода змішуються в мольному відношенні 1:3:0,5:14 при температурі 20 °C і перемішуються при цій температурі протягом 24 годин. Виходить суміш пентаеритриту і дипентаеритриту, що містить, за даними патенту, до 36 % дипентаеритриту. Недолік цього способу полягає в низькому виході суміші продуктів, який при вказаній кількості формальдегіду взагалі не може бути вище 75 % в розрахунку на ацетальдегід (для отримання одного моля пентаеритриту витрачається один моль ацетальдегіду і чотири моля формальдегіду). Відомий спосіб [15] отримання пентаеритриту і дипентаеритриту, що відрізняється від описаного вище способу [18] тим, що у водний розчин ацетальдегіду і формальдегіду, узятих в мольному відношенні 1:4, при температурі 30 °C поступово вноситься водний розчин гідроксиду калію. За даними патенту вихід поліпентаеритриту складає 26-33 %, а загальний вихід продуктів не вказується. Проте в цих умовах загальний вихід продуктів з розрахунку на ацетальдегід не перевищує 75 %. Недолік цього способу полягає у використанні дорогого лужного агента гідроксиду калію і в низькому виході суміші продуктів. Поступове введення ацетальдегіду в суміш формальдегіду і гідроксиду металу дозволяє проводити процес при зниженій поточній концентрації ацетальдегіду і відносно вищій концентрації пентаеритриту, що утворюється, а це сприяє збільшенню виходу і пентаеритриту і дипентаеритриту. Відомі способи отримання пентаеритриту [19, 20], згідно яким ацетальдегід вводиться у водний розчин формальдегіду і гідроксиду натрію (напівперіодичний реактор) протягом однієї години при температурі, що поступово зростає від 15-20 °C до 25-42 °C Мольне відношення ацетальдегіду і формальдегіду 1:4,5-5,0. Вихід суміші пентаеритриту і дипентаеритриту складає близько 90-95 % в розрахунку на ацетальдегід, але вихід дипентаеритриту не перевищує 1012 %. Недоліком цього способу є низький вихід дипентаеритриту і значна втрата формальдегіду і гідроксиду натрію у побічній реакції Канніццаро. В умовах напівперіодичного реактору вихід дипентаеритриту можна підвищити збільшуючи концентрацію пентаеритриту внесенням його в реакційну суміш до початку процесу, тобто 3 UA 69096 U 5 10 15 20 25 30 35 40 45 50 55 поверненням його у наступний процес після відділення від дипентаеритриту і виділення з реакційної суміші попереднього процесу. Відомий спосіб [21], згідно якому дипентаеритрит отримують у напівперіодичному реакторі конденсацією ацетальдегіду і формальдегіду у присутності гідроксиду натрію і пентаеритриту, узятих в мольному відношенні 1,0:4,5-5,0:1,4-2,0:1,0, при температурі від 15 до 45 °C, з поступовим введенням розчину ацетальдегіду в суміш інших реагентів протягом однієї години, або з поступовим введенням розчину ацетальдегіду і формальдегіду у розчин пентаеритриту, гідроксиду натрію і формальдегіду. За прикладами патенту при проведенні процесу шляхом поступового введення ацетальдегіду у суміш інших реагентів протягом години при температурі 22 °C і мольному відношенні ацетальдегіду, формальдегіду, гідроксиду натрію, пентаеритриту і води 1,0:5,0:1,4:1,0:40 вихід пентаеритриту 52 %, дипентаеритриту 13 % і трипентаеритриту 12 %, загальний вихід продуктів 77 %. Враховуючи, що розчинність пентаеритриту при температурі 22 °C складає 7,5 г на 100 г води [22-25], а реакційна суміш при вказаному мольному відношенні реагентів містить 720 г води в розрахунку на моль ацетальдегіду, в ній розчиняється тільки 54 г пентаеритриту (концентрація пентаеритриту в реакційному розчині 0,4 моль/л), а 82 г залишаються в твердій фазі, і мольне відношення ацетальдегіду і розчиненого пентаеритриту складає 1,0:0,4, а не 1,0:1,0, що й приводить до низького виходу дипентаеритриту. За прикладом патенту при поступовому введенні розчину ацетальдегіду і формальдегіду протягом години у розчин пентаеритриту, гідроксиду натрію і формальдегіду при температурі 43 °C, враховуючи розчинність пентаеритриту при цій температурі - 15 г на 100 г води [22-25], мольне відношенні ацетальдегіду, формальдегіду, гідроксиду натрію, пентаеритриту і води складає 1,0:4,5:1,7:1,0:68, концентрація пентаеритриту в реакційному розчині 0,62 моль/л, а вихід пентаеритриту 10 %, дипентаеритриту 39 % і трипентаеритриту 30 %, загальний вихід продуктів 79 %. Вихід дипентаеритриту зростає за рахунок підвищення концентрації розчиненого пентаеритриту і зниження концентрації формальдегіду. Недоліками цього способу є низький вихід дипентаеритриту, низький загальний вихід продуктів, значна витрата гідроксиду натрію і формальдегіду в побічній реакції Канніццаро. Крім цього, вихід продуктів у розглянутих прикладах патенту [21] розрахований по кількості продуктів, що вже розділені і виділені. Таким чином, 10 % пентаеритриту не можна повернути для використання у наступному процесі - відбувається послідовне накопичування синтезованого пентаеритриту, з чого витікає необхідність паралельного випуску пентаеритриту як товарного продукту, але в незначному обсязі. Це ускладнює виробництво і погіршує його технікоекономічні показники, порівняно з виробництвами, в яких пентаеритрит випускається у великому обсязі. За суттєвими ознаками патент [21] є найближчим аналогом. Суть корисної моделі. Задачею корисної моделі є усунення недоліків аналогу - підвищення виходу дипентаеритриту і забезбечення повного повернення у процес (рециклу) пентаеритриту, що був внесений і утворився. Ця задача вирішується наступним шляхом. Згідно з розглянутими і отриманими нами даними, загальний вихід дипентаеритриту, пентаеритриту і біспентаеритритформалю зростає тільки тоді, коли знижується вихід альдоксану - побічного продукту реакції ацетальдегіду. Знизити вихід альдоксану можна зменшуючи концентрацію ацетальдегіду і альдолю одним з наступних способів: розбавленням реакційної суміші водою; використанням великого надлишку формальдегіду; поступовим введенням ацетальдегіду в реакцію. Вихід дипентаеритриту зростає тільки тоді, коли в реакційній суміші збільшується рівноважна концентрація пентаеритриту, її можна збільшити: знижуючи розбавлення реакційної суміші водою; знижуючи концентрацію формальдегіду; вводячи ацетальдегід в реакцію при високому ступені перетворення альдегідів в продукти; вводячи в реакційну суміш пентаеритрит. Витрата гідроксиду натрію і формальдегіду в побічній реакції Канніццаро зменшується тільки тоді, коли знижується концентрація цих реагентів. Як видно, перелічені умови суперечливі. Оптимальне поєднання цих умов досягається тільки в реакторі змішення з одночасним безперервним введенням у нього ацетальдегіду, формальдегіду, гідроксиду натрію, пентаеритриту і води, де синтез проходить при низькій концентрації ацетальдегіду, що сприяє зниженню виходу альдоксану, як і в напівперіодичному реакторі, але на відміну від напівперіодичного реактору, синтез проходить також і при низькій концентрації формальдегіду, що сприяє зниженню виходу біспентаеритритформалю і значному зменшенню витрат формальдегіду і гідроксиду натрію в побічній реакції Канніццаро, а це 4 UA 69096 U 5 10 15 20 25 30 35 дозволяє проводити процес при підвищеній температурі, коли зростає розчинність пентаеритриту, яка і обмежує вихід дипентаеритриту. Проведені нами досліди показали, що всі відмічені вище недоліки усуваються і забезпечується повне повернення синтезованого пентаеритриту в процес - виробництво тільки дипентаеритриту, якщо процес проводиться у реакторі змішення в умовах, коли кількість синтезованого пентаеритриту з урахуванням його втрати при виділенні (приблизно 8-15 %) дорівнюється кількості пентаеритриту, витраченого на синтез дипентаеритриту. В технологічній системі, яка включає послідовно синтез в реакторі змішення, розділення пентаеритриту і дипентаеририту, виділення пентаеритриту і його повернення в реактор, в певних умовах автоматично встановлюється стаціонарний режим при зростанні виходу дипентаеритриту знижується кількість пентаеритриту, синтезованого і повертаного в реактор, що приводить до зменшення виходу дипентаеритриту і підвищенню виходу синтезованого пентаеритриту. В результаті встановлюється баланс (рисунок 1). 1 - залежність питомої концентрації пентаеритриту в реакторі від питомої концентрації пентаеритриту в потоці, що входить у реактор (без урахування втрат пентаеритриту при виділенні); 2 - баланс; СР(Р), СР(0), СП -концентрація відповідно пентаеритриту в реакторі, пентаеритриту у вхідному потоці, загальна концентрація дипентаеритриту, трипентаеритриту і біспентаеритритформалю в реакторі, моль/л; умови: мольне відношення ацетальдегіду, формальдегіду, гідроксиду натрію і води у вхідному потоці 1:4,2:1,04:35; температура в реакторі 65 °C; час перебування в реакторі 60 хв. Такі умови досягаються при мольному відношенні ацетальдегіду, формальдегіду, гідроксиду натрію і води у потоці, що входить в реактор змішення, 1,0:3,8-4,4:1,0-1,3:20-50, температурі в реакторі 50-70 °C, що забезпечує необхідну розчинність пентаеритриту і відповідно необхідну його концентрацію у реакційному розчині, і такому часі перебування реакційної суміші в реакторі, коли ступінь перетворення ацетальдегіду в кінцеві продукти досягає 90-96 %. У цих умовах мольне відношення ацетальдегіду і розчиненого пентаеритриту складає 1:1,51,7, що забезпечує вихід дипентаеритриту 70-79 %, трипентаеритриту 8-9 %, біспентаеритритформалю - 2-8 % в розрахунку на моль ацетальдегіду, загальний вихід продуктів 90-96 %, а кількість синтезованого пентаеритриту, з урахуванням його втрат при наступному виділенні, наближується до кількості витраченого на утворення дипентаеритриту, трипентаеритриту і біспентаеритритформалю. Таким чином, суттєві ознаки заявленої корисної моделі і аналогу істотно відрізняються (таблиця 2), а сукупність суттєвих ознак заявленої корисної моделі дозволяє досягти більш високого технічного результату, ніж сукупність суттєвих ознак аналогу: підвищити вихід дипентаеритриту, забезпечити повний рецикл пентаеритриту і виробництво тільки дипентаеритриту, чого не дозволяє досягнути сукупність суттєвих ознак аналогу. Таблиця 2 Суттєві ознаки Заявленої корисної моделі Аналогу [21] 1 Мольне відношення ацетальдегіду, формальдегіду, гідроксиду натрію і пентаеритриту 1,0:3,8-4,4:1,0-1,3:1,5-1,7 1,0:4,5-5,0:1,4-2,0:1,0 2 Температура 50-70 °C 15-45 °C 3 Спосіб введення реагентів в реакцію Реактор змішення безперервної дії з Напівперіодичний реактор з поступовим одночасним безперервним введенням введенням розчину ацетальдегіду в суміш реагентів з об'ємною швидкістю, коли ступінь інших реагентів, або поступовим введенням перетворення ацетальдегіду в кінцеві продукти розчину ацетальдегіду і формальдегіду у водну за час перебування в реакторі складає 0,85суміш пентаеритриту, гідроксиду натрію і 0,96. формальдегіду. 40 Ступінь перетворення ацетальдегіду в кінцеві продукти в реакторі змішення β від 0,85 до 0,98 може бути приблизно проконтрольований шляхом вимірювання концентрації гідроксиду натрію в початковому лужному розчині і в потоці, що виходить з реактора, і розрахунку: β=0,92(nNaOH-CNaOHVΣ), (1) де nNaOH - кількість молей гідроксиду натрію, що вводиться в реактор, в розрахунку на 1 моль ацетальдегіду, моль/моль; 5 UA 69096 U 5 10 15 20 25 30 35 40 45 CNaOH - концентрація гідроксиду натрію в реакторі, моль/л; VΣ - об'єм суміші всіх реагентів і води, що вводяться в реактор, в розрахунку на 1 моль ацетальдегіду, л/моль. Приклад 1. Синтез дипентаеритриту проводиться в реакторі зміщення і завершується у наступному реакторі любого типу в умовах: в потоці, що входить в перший реактор: мольне відношення ацетальдегіду, формальдегіду, гідроксиду натрію, води і пентаеритриту 1:4,2:1,07:34:1,5; в реакторі: температура 60 °C, ступінь перетворення ацетальдегіду в кінцеві продукти 0,93 (час перебування в реакторі 60 хв.); в потоці, що входить у наступний реактор: мольне відношення ацетальдегіду, що введений в перший реактор, і гідроксиду натрію, що вводится в другий реактор, 1: 0,23. В перший реактор місткістю 10 л (робочий об'єм до переливного штуцера 8,4 л) безперервно завантажуються 30,8 г/хв. водного розчину з масовим змістом ацетальдегіду 20 %, 47,6 г/хв. формаліну з масовим змістом формальдегіду 37 %, 30,5 г/хв. водного розчину з масовим змістом гідроксиду натрію 20 % і 39 г/хв. заздалегідь отриманого вологого пентаеритриту з масовим змістом: 18 % води і 74 % пентаеритриту. У реакторі підтримується постійна температура 60 °C, яка досягається практично тільки за рахунок тепла реакції. У наступному реакторі температура не регулюється. Зміст реакційної суміші, що безперервно виходить з цього реактору: пентаеритриту 1,51 моль/л, дипентаеритриту 0,36 моль/л, трипентаеритриту 0,04 моль/л, біспентаеритритформалю 0,02 моль/л, гідроксиду натрію 0,055 моль/л, альдегідів 0,76 моль/л, ступінь перетворення ацетальдегіду в кінцеві продукти близько 0, 93. Ця реакційна суміш безперервно пропускається при надбаної температурі через наступний реактор змішення або витиснення (змійовик, трубчастий), в який паралельно безперервно -1 вносится 7,6 г·хв. водного розчину з масовим змістом гідроксиду натрію 20 %. Зміст реакційної суміші, що безперервно виходить з цього реактора: пентаеритриту 1,59 моль/л, дипентаеритриту 0,38 моль/л, трипентаеритриту 0,04 моль/л, біспентаеритритформалю 0,02 моль/л, гідроксиду натрію 0,22 моль/л, альдегідів 0,44 моль/л. Вихід продуктів в розрахунку на ацетальдегід: пентаеритриту 9 %, дипентаеритриту 76 %, трипентаеритриту 8 %, біспентаеритритформалю 2 %, загальний вихід продуктів 95 %. Далі реакційна суміш переробляється відомими способами. Наприклад, у суміш вноситься 0,54 л води в розрахунку на моль ацетальдегіду і вона нагрівається до 80-95 °C до повного видалення залишкових альдегідів, після чого нейтралізується кислотою до рН 6. Нейтралізована суміш нагрівається до 100-105 °C до повного розчинення продуктів в неї, а потім охолоджується до температури 33 °C. Дипентаеритрит, що випав у осад, відділяється фільтруванням і очищається димінералізованою водою. Фільтрат випаровується і охолоджується до 20 С. Осад пентаеритриту відділяється фільтруванням. В результаті отримується на моль ацетальдегіду 90,2 г дипентаеритриту з масовим змістом основної речовини 89 %, трипентаеритриту 9 % і пентаеритриту 1 %, і 227 г пентаеритриту з масовим змістом основної речовини 90 %, дипентаеритриту і трипентаеритриту 10 %, який повертається у реактор. Втрати пентаеритриту при виділенні складають 9 %. З урахуванням дипентаеритриту, що повертається в реактор - 22 г на моль ацетальдегіду, загальна кількість дипентаеритриту, що виділяється, з масовим змістом основної речовини 89 %, трипентаеритриту 9 % і пентаеритриту 1 %, складає 112 г на моль ацетальдегіду, а його вихід 86 %. Приклади 2-12. Процес проводиться відповідно до прикладу 1 в умовах, наведених в таблиці 3 6 UA 69096 U Таблиця 3 Мольне відношення CHCHO:HCHO:NaOH:H2O Приклади у вхідному потоці в перший реактор 1 1:4,2:1,07:34 2 1:4,2:1,07:34 3 1:4,2:1,07:34 4 1:4,2:1,07:34 5 1:4,2:1,07:20 6 1:4,2:1,04:20 7 1:4,2:1,07:52 8 1:4,2:1,07:52 9 1:3,5:1,00:38 10 1:3,8:1,07:35 11 1:4,0:1,07:36 12 1:4,5:1,07:33 13 1:5,0:1,30:32 14 1:4,2:1,07:34 Т, °C , хв Р β Вихід в розрахунку на моль ацетальдегіду, % ПЕ ДПЕ ТПЕ БПФ Загальний 1,5 1,5 1,5 1,5 1,2 1,3 1,9 1,5 1,4 1,4 1,4 1,6 1,6 1,1 60 60 60 60 60 65 60 60 60 60 60 60 60 50 60 80 30 10 60 60 60 60 60 60 60 60 60 60 0,93 0,94 0,91 0,86 0,93 0,92 0,92 0,93 0,98 0,94 0,94 0,90 0,94 0,91 9 9 8 4 11 5 9 10 13 12 11 1 5 19 76 75 73 69 74 79 78 71 61 71 75 77 79 68 8 9 7 7 8 8 8 7 6 7 8 8 8 7 2 3 4 4 2 2 1 8 0 1 1 3 6 2 95 96 92 84 95 94 96 96 80 90 95 96 98 46 Примітка: Р - мольне відношення пентаеритриту, здатного розчинитися в реакційній суміші, і ацетальдегіду, що входить в перший реактор; Т - температура в першому реакторі; т - час перебування в першому реакторі; р - ступінь перетворення ацетальдегіду в кінцеві продути в першому реакторі; ПЕ -пентаеритрит, ДПЕ - дипентаеритрит, БПФ біспентаеритритформаль. 5 10 15 20 25 30 Джерела інформації: 1. Пат. 2577770 США, МКИ C08G 63/00. Alkyd resins/P. Kass, Z.W. Wicks (США); Interchemical Corporation (США). - № 688978; Заявл. 07.08.1946; Опубл. 11.12.1957. 2. Пат. 4202806 США, МПК С08K 5/053. Stabilization of chlorine-containing resins/ Yoshida Norio, Matuyama Takesi (Японія); Kоеі Chemical Co., Ltd. (Японія). - № 05/898286; Заявл. 20.04.1978; Опубл. 13.05.1980. 3. Пат. 4501840 США, МКИ C07F 9/6574. Alkaline modified pentaerythritol stabilizer for vinyl chloride resin/ P. Werle, W. Merk (ФРН); Degussa Aktiengesellschaft (ФРН).-№ 06/543965; Заявл. 20.10.1983; Опубл. 26.02.1985. 4. А. с. 387959 CPCP, МПК С07С 31/24. Способ получения ди- и трипентаэритрита/С.Е. Лунева, В.Н. Одиноков, О.В. Епимахова, А.Е. Образцов (СРСР). - № 1624004/23-04; Заявл.26.02.71; Опубл.22.06.73. 5. Пат. 2495305 США, МПК C07D 305/00. Esters of pentaerythritol degydration products/J.A. Wyler (США); Trojan Powder Company (США).- № 682595; Заявл. 10.07.46; Опубл.24.01.50. 6. Пат. 3000901 США, МПК B28D 1/00. Dehydration of pentaerythritol/ J.A. Wyler (США); Trojan Powder Company (США).- № 810556; Заявл. 04.05.59; Опубл. 19.09.61. 7. Пат. 5254749 США, МПК С07С 41/09. Process for producing dipentaerythritol/Y. Kambara, T. Idemoto, Y. Ono, C. Тоnа (Японія); Mitsui Toatsu Chemicals, Inc. (Японія). - № 07/741518 Заявл. 25.07.91; Опубл. 19.10.93. 8. Пат. 3069475 США, МПК C08G 63/00. Process for the production of dipentaerythritol/H.S. Paramus (США); Heyden Newport Chemacal Corporation (США).-№821347; Заявл. 19.06.59; Опубл. 18.12.62. 9. Белкин Д.И. Побочные реакции, приводящие к простым эфирам и ацеталям/ Д.И.Белкин// Ж. прикл. химии. 1986. - Т. 59. - С. 401-405. 10. Vik J.E. Studies on intermediates involved in the syntheses of pentaerythritol and related alcohols. On the kinetics of the base catalyzed aldol condensation reactions of intermediate aldehydes with formaldehyde/ J.E. Vik// Acta. shem. Scand.-1974. -V. B28. -P. 325-332. 11. Trevoy L.M. Pentaerythritol derivatives. Mechanism of formation of dipentaerythritol/ L.M. Trevoy, M.E. Muers// Canad. J. Chem.-1963.- Vol. 41.- P. 770-776. 12. Guba G. Stanovenie a funkcia akroleinu v reakcnych zmesiah pri priprave pentaerytritolu/ G. Guba, L. Lukacovic // Petrochemia.-1979.-T. 19.-№ 6.-C. 198-206. 7 UA 69096 U 5 10 15 20 25 30 35 13. Пат. 6121499 США, С07С 41/01. Process for producing polyhydroxy ethers and unsymmetrical polyhydroxy ethers obtainable with the process/ M. Morawietz, D. Arntz, M. Норр (ФРН); Degussa Aktiengesellschaft (ФРН). - № 09/033896; Заявл. 03.03.98; Опубл. 19.09.2000. 14. Пат. 2464430 США, МПК C07D 319/06. Production of formals pentaerythritol/R.H.Bart, J.E. Snow (США); Heyden Newport Chemacal Corporation (США). - № 621588; - Заявл. 10.10.45; Опубл. 15.03.49. 15. Пат. 2490567 США, МПК С07С 43/00. Preparation of polypentaerythritols/J.A. Wyler (США); Trojan Powder Company (США).-№ 753807; Заявл. 10.06.47; Опубл. 06.12.49. 16. А. с. 197741 ЧССР, МПК С07С 31/18. Spôsob výroby dipentaerytritolu z nizkym obsahom vyššich pentaerytritov/G. Guba, V. Macho, L. Koudelka, L. Komora (ЧССР).-№ PV-8517; Заявл.31.08.79; Опубл.28.02.83. 17. Белкин Д.И. Исследование зависимости выхода пентаэритрита и дипентаэритрита от начальных условий реакции конденсации формальдегида и ацетальдегида/ Д.И. Белкин// Ж. прикл. химии. 1979. -Т.52. - С. 237-239. 18. Пат. 2325589 США, МПК С07С 43/00. Acetaldehyde-formaldehyde condensation product/E.A. Bried (США); Hercules Powder Company (США). -№ 382341; Заявл. 08.03.41; Опубл. 03.08.43. 19. Пат. 2401749 США, МПК С07С 31/24. Pentaerythritol / R.E. Burghard, R.H. Bart (США); Heyden Newport Chemacal Corporation (США). -№ 442620; Заявл. 12.05.42; Опубл. 11.06.46. 20. А. с. 237838 ЧССР, МПК С07С, 29/14. Spôsob pripravy pentaerytritolu/M. Lichvár, L. Komora, V. Macho, J. Sabadoš (ЧССР).- № PV-5370; Заявл 18.07.1983; Опубл. 15.03.1987. 21. Пат. 2441597 США, МПК С07С 31/24. Manufacture of pentaerythritol/J.P. Remensnyder, P.I. Bowman, R.H. Bart (США); Heyden Newport Chemacal Corporation (США). - № 484478; Заявл. 24.04.1943; Опубл. 18.05.1948. 22. Cooke E.G. Solutions of pentaerythritol/ E.G. Cooke// Paint. Manuf.-1948.-V. 18, №4. -P.125. 23. Žiak J. Rozpustnost pentaerytritolu v zriedených vodných roztokoch formaldehydu/ J. Žiak // Petrochemia.-1976. - T. 16, № 1. - S. 5-9. 24. Белкин Д.И. Оборудование и условия выделения и очистки пентаэритрита/ Д.И. Белкин, В.Г. Шарыкин, В.В. Меньшико, A.M. Пеклер// Лакокрасчные материалы и их применение.-1990.No 4.- С.70-74. 25. Белкин Д.И. Экспериментальные данные для выбора оборудования и процессов синтеза, выделения и очистки петаэритрита/ Д.И. Белкин// Ж. прикладн. химии.-1990.-Т.63, № 11. - С. 2542-2548. 26. Белкин Д.И. Кинетика конденсации формальдегида и ацетальдегида/ Д.И. Белкин// Ж. прикл. химии.-1990. - Т. 63. - С. 2312-2320. ФОРМУЛА КОРИСНОЇ МОДЕЛІ 40 45 Спосіб отримання дипентаеритриту, що включає конденсацію ацетальдегіду і формальдегіду у присутності гідроксиду натрію і пентаеритриту, розділення, виділення і очищення продуктів, що надійшли в процес і утворилися в ньому відомими способами, який відрізняється тим, що, для підвищення виходу дипентаеритриту і забезпечення повного повернення у процес пентаеритриту, що був внесений і утворився, конденсацію альдегідів проводять в реакторі змішення, в який при температурі реакційної суміші 50-70 °C безперервно вводять ацетальдегід, формальдегід, гідроксид натрію і воду в мольному відношенні 1,0:3,8-4,5:1,0-1,3:20-50, та увесь пентаеритрит, видалений з реакційної суміші, з такою об'ємною швидкістю, щоб ступінь перетворення (конверсія) ацетальдегіду в кінцеві продукти за час перебування в реакторі складав 0,85-0,96. 8 UA 69096 U Комп’ютерна верстка Л.Литвиненко Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 9
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the preparation of dipentaerythritol
Автори англійськоюBielkin Davyd Illich, Demchenko Olha Oleksandrovna
Назва патенту російськоюСпособ получения дипентаэритрита
Автори російськоюБелкин Давид Ильич, Демченко Ольга Олександровна
МПК / Мітки
МПК: C07C 31/24
Мітки: спосіб, одержання, дипентаеритриту
Код посилання
<a href="https://ua.patents.su/11-69096-sposib-oderzhannya-dipentaeritritu.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання дипентаеритриту</a>
Попередній патент: Установка для візуалізації газових потоків при моделюванні процесів в приладах зниження рівня звуку пострілу
Наступний патент: Спосіб демонтажу секцій механізованого кріплення
Випадковий патент: Спосіб одержання електропровідних полімерних композитів