Спосіб стереоспецифічного одержання 3-гідрокси-5b-н стероїдного сапогеніну, спосіб перегрупування та способи одержання смілагеніну і епісмілагеніну
Формула / Реферат
1. Спосіб стереоспецифічного одержання 3-гідрокси-5β-Н стероїдного сапогеніну або його похідного, який включає відновлення 3-кето-5β-Н стероїдного сапогеніну з використанням відновника, що включає утруднений органоборан або алюмінійорганічний гідрид.
2. Спосіб за п. 1, який відрізняється тим, що відновником є утруднений органоборан, у якому органічні групи містять більш ніж два атоми вуглецю, і одержаний сапогенін є переважно 3β-гідрокси-5β-Н-сапогеніном.
3. Спосіб за п. 2, який відрізняється тим, що утруднений органоборан вибирають з відновників: триалкіл- або триарилборгідридів лужних металів.
4. Спосіб за будь-яким із попередніх пунктів, який відрізняється тим, що утруднений органоборан вибирають з літію три-втор-бутилборгідриду, калію три-втор-бутилборгідриду, натрію три-втор-бутилборгідриду, літію трисіамілборгідриду, калію трисіамілборгідриду, натрію трифенілборгідриду і літію трифенілборгідриду.
5. Спосіб за п. 4, який відрізняється тим, що утруднений органоборан є літію три-втор-бутилборгідридом.
6. Спосіб за п. 1, який відрізняється тим, що алюмінійорганічний гідрид є літію три-трет-бутоксиалюмогідридом.
7. Спосіб за будь-яким з попередніх пунктів, який відрізняється тим, що молярне співвідношення одержаного домінуючого сапогеніну до альтернативного 3-епімеру складає щонайменше близько 10:1.
8. Спосіб за п. 7, який відрізняється тим, що співвідношення складає щонайменше близько 15:1.
9. Спосіб за будь-яким з попередніх пунктів, який відрізняється тим, що органічний розчинник вибраний з тетрагідрофурану, толуолу, трет-бутил метилового ефіру, діетоксиметану, 1,4-діоксану, 2-метилтетрагідрофурану і будь-якої їх суміші.
10. Спосіб за п. 9, який відрізняється тим, що органічний розчинник містить в основному тетрагідрофуран.
11. Спосіб за п. 9, який відрізняється тим, що органічний розчинник містить в основному толуол.
12. Спосіб за п. 9, який відрізняється тим, що органічний розчинник містить в основному 1,4-діоксан.
13. Спосіб за п. 9, який відрізняється тим, що органічний розчинник містить в основному 2-метилтетрагідрофуран.
14. Спосіб за будь-яким з попередніх пунктів, який відрізняється тим, що бажаний сапогенін є сполукою загальної формули:
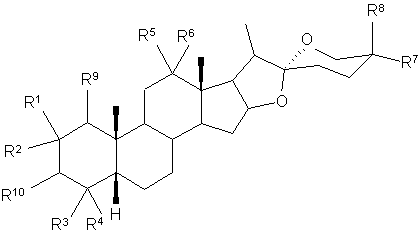 ,
,
де R1 R2, R3, R4, R5, R6, R7, R8 і R9 є незалежно один від одного Н, С1-4 алкілом, ОН або OR, де R є С6-12 арил або С1-4 алкіл, або R5 і R6 разом можуть бути =O (карбоніл) або захищеною карбонільною групою, стереохімія у атома вуглецю в положенні 3 може бути або R або S, і
R10 є ОН, О-зв'язаною вуглеводною групою або групою будь-якого органічного ефіру.
15. Спосіб за п. 14, який відрізняється тим, що сапогенін вибирають із сарсасапогеніну, смілагеніну та їх ефірів.
16. Спосіб за будь-яким з попередніх пунктів, який відрізняється тим, що 3-кето-5β-Н стероїдний сапогенін, який використовують як вихідну реагуючу речовину, одержують шляхом гетерогенної каталітичної гідрогенізації відповідного Δ4-3-кето стероїдного сапогеніну для перетворення Δ4-3-кето стероїдного сапогеніну переважно в згаданий 5β-Н-3-кетон.
17. Спосіб за п. 16, який відрізняється тим, що гетерогенну каталітичну гідрогенізацію виконують з використанням водню і паладієвого каталізатора в органічному розчиннику.
18. Спосіб за п. 17, який відрізняється тим, що використовують паладієвий каталізатор на основі.
19. Спосіб за будь-яким із пп. 16-18, який відрізняється тим, що Δ4-3-кето стероїдний сапогенін є діосгеноном.
20. Спосіб за п. 19, який відрізняється тим, що діосгенон одержують окисненням діосгеніну.
21. Спосіб за будь-яким з пп. 1-20, який відрізняється тим, що раніш одержаний сапогенін перетворюють у форму його проліків або в іншу фізіологічно прийнятну його форму.
22. Спосіб перегрупування 3α-гідрокси-5β-Н стероїдних сапогенінів і їх похідних у 3β-гідрокси-5β-Н стероїдні сапогеніни і їх похідні, що включає реагування 3-гідроксиактивованої похідної 3α-гідрокси-5β-Н стероїдного сапогеніну з нуклеофільним реагентом за умов, сприятливих для нуклеофільного заміщення з інверсією в положенні 3, з необов'язковим наступним розміщенням 3-замісника як необхідно.
23. Спосіб за п. 22, який відрізняється тим, що реакцію виконують відповідно до схеми реакції Міцунобу для одержання похідного ефіру і 3β-гідрокси-5β-Н стероїдного сапогеніну.
24. Спосіб за п. 22, який відрізняється тим, що активоване похідне сапогеніну є органічним сульфованим похідним.
25. Спосіб за будь-яким з пп. 22-24, який відрізняється тим, що 3-гідроксіактивовану похідну 3α-гідрокси-5β-Н стероїдного сапогеніну одержують шляхом відновлення 3-кето-5β-Н стероїдного сапогеніну з використанням відновника, що включає утруднений органоборан, включаючи органічні групи, що мають до двох атомів вуглецю чи алюмінійорганічний гідрид, з подальшим перетворенням одержаного 3α-гідрокси-5β-Н стероїдного сапогеніну в його 3-гідроксіактивовану похідну.
26. Спосіб за п. 25, який відрізняється тим, що алюмінійорганічний гідрид є літію три-трет-бутоксіалюминогідрид (ЛТБА).
27. Спосіб за п. 26, який відрізняється тим, що органобораном є триетилборогідрид.
28. Спосіб за одним з пп. 25-27, який відрізняється тим, що відновлення відбувається як вказано у пп. 7-14.
29. Спосіб за будь-яким з пп. 25-28, який відрізняється тим, що 3α-гідрокси-5β-Н стероїдний сапогенін та його похідні, одержані у відновленні, вибрані з епісарсасапогеніну, епісмілагеніну та їх ефірів.
30. Спосіб за будь-яким з пп. 22-29, який відрізняється тим, що 3β-гідрокси-5β-Н стероїдний сапогенін та його похідні, одержані у перетворенні, вибрані з сарсасапогеніну, смілагеніну та їх ефірів.
31. Спосіб за будь-яким із пп. 25-30, який відрізняється тим, що 3-кето-5β-Н стероїдний сапогенін, що використовують як вихідну реагуючу речовину, одержують шляхом гетерогенної каталітичної гідрогенізації відповідного Δ4-3-кето стероїдного сапогеніну для перетворення Δ4-3-кето стероїдного сапогеніну переважно в згаданий 5β-Н-3-кетон.
32. Спосіб за п. 31, який відрізняється тим, що гетерогенну каталітичну гідрогенізацію виконують як вказано в одному з пп. 17-19.
33. Спосіб за будь-яким із пп. 31 та 32, який відрізняється тим, що Δ4-3-кето стероїдний сапогенін є діосгеноном, який одержують окисненням діосгеніну.
34. Спосіб за будь-яким з пп. 22-33, який відрізняється тим, що раніш одержаний сапогенін перетворюють у форму його проліків або в іншу фізіологічно прийнятну його форму.
35. Спосіб одержання смілагеніну, що включає каталітичну гідрогенізацію діосгенону з наступним відновленням одержаного 3-кето-5β-Н стероїдного сапогеніну з використанням утрудненого органоборану.
36. Спосіб за п. 35, який відрізняється тим, що раніш одержаний сапогенін перетворюють у форму його проліків або в іншу фізіологічно прийнятну його форму.
37. Спосіб одержання епісмілагеніну, що включає каталітичну гідрогенізацію діосгенону з наступним відновленням одержаного 3-кето-5β-Н стероїдного сапогеніну з використанням алюмінійорганічного гідриду.
38. Спосіб за п. 37, який відрізняється тим, що раніш одержаний сапогенін перетворюють у форму його проліків або в іншу фізіологічно прийнятну його форму.
Текст
1. Спосіб стереоспецифічного одержання 3гідрокси-5β-Н стероїдного сапогеніну або його похідного, який включає відновлення 3-кето-5β-Н стероїдного сапогеніну з використанням відновника, що включає утр уднений органоборан або алюмінійорганічний гідрид. 2. Спосіб за п. 1, який відрізняється тим, що відновником є утруднений органоборан, у якому органічні групи містять більш ніж два атоми вуглецю, і одержаний сапогенін є переважно 3βгідрокси-5β-Н-сапогеніном. 3. Спосіб за п. 2, який відрізняється тим, що утруднений органоборан вибирають з відновників: триалкіл- або триарилборгідридів лужних металів. 4. Спосіб за будь-яким із попередніх пунктів, який відрізняє ться тим, що утр уднений органоборан вибирають з літію три-втор-бутилборгідриду, калію три-втор-бутилборгідриду, натрію три-вторбутилборгідриду, літію трисіамілборгідриду, калію трисіамілборгідриду, натрію трифенілборгідриду і літію трифенілборгідриду. 5. Спосіб за п. 4, який відрізняється тим, що утруднений органоборан є літію три-вторбутилборгідридом. 6. Спосіб за п. 1, який відрізняється тим, що алюмінійорганічний гідрид є літію три-третбутоксиалюмогідридом. 7. Спосіб за будь-яким з попередніх пунктів, який відрізняє ться тим, що молярне співвідношення одержаного домінуючого сапогеніну до альтернативного 3-епімеру складає щонайменше близько 10:1. 8. Спосіб за п. 7, який відрізняється тим, що співвідношення складає щонайменше близько 15:1. 9. Спосіб за будь-яким з попередніх пунктів, який відрізняє ться тим, що органічний розчинник вибраний з тетрагідрофурану, толуолу, трет-бутил метилового ефіру, діетоксиметану, 1,4-діоксану, 2метилтетрагідрофурану і будь-якої їх суміші. 10. Спосіб за п. 9, який відрізняється тим, що органічний розчинник містить в основному тетрагідрофуран. UA (21) a200504643 (22) 28.04.2003 (24) 10.12.2007 (86) PCT/GB2003/001780, 28.04.2003 (31) 0225106.4 (32) 28.10.2002 (33) GB (31) 0301505.4 (32) 22.01.2003 (33) GB (72) ГАННІНГ ФІЛІП ДЖЕЙМЗ, ТІФФІН ПІТЕР ДЕЙВІД (73) ФІТОФАРМ ПЛК (56) US 5 703 052, A, 30.12.1997 US 5 807 834, A, 15.09.1998 US 5 939 398, A, 17.08.1999 US 6 150 336, A, 21.11.2000 WO 02079221, A, 11.10.2002 LAJIS NORDIN H. et al. STEROIDS, vol. 58, no. 8, 1993, p. 387-389. MARKER R. E. et al. JOURNAL OF THE AMERIC AN CHEMICAL SOCIETY, AMERIC AN CHEMIC AL SOCIETY, WASHINGTON, DC, US, vol. 61, April 1939, p. 943-944. MORITA K. BULLETIN OF THE CHEMIC AL SOCIETY OF JAPAN, vol. 32, no. 8, 1959, p. 796799. MORITA K. BULLETIN OF THE CHEMIC AL SOCIETY OF JAPAN., vol. 32, no. 8, 1959, p. 791795. CHANG F. C. et al. JOURNAL OF THE AMERIC AN CHEMICAL SOCIETY. vol. 80, 1958, p. 2906. DROGEMULLER M. et al. PROCEEDINGS OF ECSOC-2. THE SECOND INTERNATION AL ELECTRONIC CONFERENCE ON SYNTHETIC ORGANIC CHEMISTR Y, SEPT. 1-30, 1998 (1999), 209-225. GOBBINI M. et al. BIOORGANIC & MEDICIN AL CHEMISTR Y LETTERS, OXFORD, GB, vol. 7, no. 4, 18 February 1997, p. 469-472. BABCOCK J. C. et al. JOURNAL OF THE AMERIC AN CHEMIC AL SOCIETY, vol. 74, 1952, p. 5472-5474. TOCHTROP GREGOR Y P. et al. THE JOURNAL OF ORGANIC CHEMISTR Y. UNITED STATES 20.09.2002, vol. 67, no. 19, p. 6764-6771. WEET J. F. et al. JOURNAL OF MEDICIN AL 2 (19) 1 3 81133 4 11. Спосіб за п. 9, який відрізняється тим, що положенні 3, з необов'язковим наступним органічний розчинник містить в основному толуол. розміщенням 3-замісника як необхідно. 12. Спосіб за п. 9, який відрізняється тим, що 23. Спосіб за п. 22, який відрізняється тим, що органічний розчинник містить в основному 1,4реакцію виконують відповідно до схеми реакції діоксан. Міцунобу для одержання похідного ефіру і 3β13. Спосіб за п. 9, який відрізняється тим, що гідрокси-5β-Н стероїдного сапогеніну. органічний розчинник містить в основному 224. Спосіб за п. 22, який відрізняється тим, що метилтетрагідрофуран. активоване похідне сапогеніну є органічним 14. Спосіб за будь-яким з попередніх пунктів, який сульфованим похідним. відрізняє ться тим, що бажаний сапогенін є 25. Спосіб за будь-яким з пп. 22-24, який сполукою загальної формули: відрізняє ться тим, що 3-гідроксіактивовану похідну 3α-гідрокси-5β-Н стероїдного сапогеніну R8 одержують шляхом відновлення 3-кето-5β-Н R5 R6 O стероїдного сапогеніну з використанням R7 відновника, що включає утруднений органоборан, 9 R включаючи органічні групи, що мають до двох O R1 атомів вуглецю чи алюмінійорганічний гідрид, з подальшим перетворенням одержаного 3αгідрокси-5β-Н стероїдного сапогеніну в його 3R2 гідроксіактивовану похідну. 10 26. Спосіб за п. 25, який відрізняється тим, що R алюмінійорганічний гідрид є літію три-третH R3 R4 бутоксіалюминогідрид (ЛТБА). , 27. Спосіб за п. 26, який відрізняється тим, що де R1 R2, R3, R4, R5, R6, R7, R8 і R9 є незалежно органобораном є триетилборогідрид. один від одного Н, С1-4 алкілом, ОН або OR, де R є 28. Спосіб за одним з пп. 25-27, який С6-12 арил або С 1-4 алкіл, або R5 і R6 разом можуть відрізняє ться тим, що відновлення відбувається бути =O (карбоніл) або захищеною карбонільною як вказано у пп. 7-14. групою, стереохімія у атома вуглецю в положенні 3 29. Спосіб за будь-яким з пп. 25-28, який може бути або R або S, і відрізняє ться тим, що 3α-гідрокси-5β-Н R10 є ОН, О-зв'язаною вуглеводною групою або стероїдний сапогенін та його похідні, одержані у групою будь-якого органічного ефіру. відновленні, вибрані з епісарсасапогеніну, 15. Спосіб за п. 14, який відрізняється тим, що епісмілагеніну та їх е фірів. сапогенін вибирають із сарсасапогеніну, 30. Спосіб за будь-яким з пп. 22-29, який смілагеніну та їх е фірів. відрізняє ться тим, що 3β-гідрокси-5β-Н 16. Спосіб за будь-яким з попередніх пунктів, який стероїдний сапогенін та його похідні, одержані у відрізняє ться тим, що 3-кето-5β-Н стероїдний перетворенні, вибрані з сарсасапогеніну, сапогенін, який використовують як вихідну смілагеніну та їх е фірів. реагуючу речовину, одержують шляхом 31. Спосіб за будь-яким із пп. 25-30, який гетерогенної каталітичної гідрогенізації відрізняє ться тим, що 3-кето-5β-Н стероїдний відповідного Δ4-3-кето стероїдного сапогеніну для сапогенін, що використовують як вихідну реагуючу 4 перетворення Δ -3-кето стероїдного сапогеніну речовину, одержують шляхом гетерогенної переважно в згаданий 5β-Н-3-кетон. каталітичної гідрогенізації відповідного Δ4-3-кето 17. Спосіб за п. 16, який відрізняється тим, що стероїдного сапогеніну для перетворення Δ4-3гетерогенну каталітичну гідрогенізацію виконують кето стероїдного сапогеніну переважно в згаданий з використанням водню і паладієвого каталізатора 5β-Н-3-кетон. в органічному розчиннику. 32. Спосіб за п. 31, який відрізняється тим, що 18. Спосіб за п. 17, який відрізняється тим, що гетерогенну каталітичну гідрогенізацію виконують використовують паладієвий каталізатор на основі. як вказано в одному з пп. 17-19. 19. Спосіб за будь-яким із пп. 16-18, який 33. Спосіб за будь-яким із пп. 31 та 32, який відрізняє ться тим, що Δ4-3-кето стероїдний відрізняє ться тим, що Δ4-3-кето стероїдний сапогенін є діосгеноном. сапогенін є діосгеноном, який одержують 20. Спосіб за п. 19, який відрізняється тим, що окисненням діосгеніну. діосгенон одержують окисненням діосгеніну. 34. Спосіб за будь-яким з пп. 22-33, який 21. Спосіб за будь-яким з пп. 1-20, який відрізняє ться тим, що раніш одержаний сапогенін відрізняє ться тим, що раніш одержаний сапогенін перетворюють у форму його проліків або в іншу перетворюють у форму його проліків або в іншу фізіологічно прийнятну його форму. фізіологічно прийнятну його форму. 35. Спосіб одержання смілагеніну, що включає 22. Спосіб перегрупування 3α-гідрокси-5β-Н каталітичну гідрогенізацію діосгенону з наступним стероїдних сапогенінів і їх похідних у 3β-гідроксивідновленням одержаного 3-кето-5β-Н стероїдного 5β-Н стероїдні сапогеніни і їх похідні, що включає сапогеніну з використанням утр удненого реагування 3-гідроксиактивованої похідної 3αорганоборану. гідрокси-5β-Н стероїдного сапогеніну з 36. Спосіб за п. 35, який відрізняється тим, що нуклеофільним реагентом за умов, сприятливих раніш одержаний сапогенін перетворюють у для нуклеофільного заміщення з інверсією в форму його проліків або в іншу фізіологічно прийнятну його форму. 5 81133 6 37. Спосіб одержання епісмілагеніну, що включає 38. Спосіб за п. 37, який відрізняється тим, що каталітичну гідрогенізацію діосгенону з наступним раніш одержаний сапогенін перетворюють у відновленням одержаного 3-кето-5β-Н стероїдного форму його проліків або в іншу фізіологічно сапогеніну з використанням алюмінійорганічного прийнятну його форму. гідриду. Даний винахід стосується стереоспецифічного синтезу 3-гідрокси-5b-Н стероїдних сапогенінів та їх похідних. Відомо, що визначені сапогеніни і їх похідні (конкретніше, сапогеніни, що мають 5b-Η атом, і більш конкретно, сполуки, що мають 3-ОН групу і 5b-Η атом, такі як сарсасапогенін, епісарсасапогенін, смілагенін і епісмілагенін) застосовуються в лікуванні когаітивної дисфункції та інших станів. Така їх активність описується, наприклад, у [патентах WO-99/48482, WO99/48507, WO-01/49703, WO-02/079221 і WO01/23406], описи яких включені тут у вигляді посилання. У даній публікації використовується така ж система найменувань циклів і позицій атомів вуглецю, як і в попередніх публікаціях. У літературі описуються методи синтезу 3гідроксистероїдних сапогенінів. Наприклад, синтез 3b-гідрокси-5a-Н стероїдів з відповідних 3-кето-5aН стероїдів, що здійснюється з боргідратом натрію в тетрагідрофурані (ТГФ) і метанолі або з використанням літію алюмогідриду в діетиловому ефірі [Helv. Chim. Acta, 66, 192-217 (1983)]. [Патент США №3875195 (1975)], що включений в цю заявку у вигляді посилання, описує каталітичне відновлення 3-кето-5b-Н стероїдів у 3b-гідрокси-5b-Η стероїди в більш низькій карбоновій кислоті з нікелевим каталізатором Ренея і воднем під тиском. Дослідники відзначають, що відновлення по Меєрвейну-Пондорфу-Верлею (МПВ) дає суміш 3a- і 3b-гідрокси стероїдів у рівних частинах. Зазначається, що розділити такі суміші складно. Після впровадження сімейства сильно утруднених триалкілборгідридних відновників, широко відомих як SelectridesÒ, що почалося на початку 70-х років [Brown et al., J. Am. Chem. Soc. 94, 7159-7161 (1972)], з'явився цілий ряд публікацій, які описували застосування цих відновників в конкретних методиках синтезу стеролів. Наприклад, в [Steroids, 36,299-303 (1980), Steroids, 45,39- 51 (1985), J. Chem. Soc. Commun. 1239-1240 (1982), Tetrahedron, 40,851854 (1984), Helv. Chim. Acta, 66,192-217 (1983), в патенті США №6150336 (2000) і Tetrahedron, 45,3717-3730 (1989)], що включені в цю заявку у вигляді посилання, описані стереоспецифічні перетворення за допомогою SelectrideÒ певних 3кето-5b і 3-кето-5а стероїдів у відповідні 3b-ΟΗ, 5bΗ і 3a-ОН, 5a-Н стероли. У відношенні стероїдних сапогенінів, описано синтез смілагеніну шля хом відновлення смілагенону з ізопропілатом алюмінію в ізопропіловому спирті, відновлення МПВ [Marker et al, J. Amer. Chem. Soc., 622525 (1940)]. Маркер повідомив, що відновлення МПВ сарсасапогенінів дає суміш сарсасапогеніну і епісарсасапогеніну [Marker and Rohrmann, J. Amer. Chem. Soc, 61,943 (1939)]. Описи цих публікацій включені в дану заявку посиланням. Дослідники також виявили специфічну каталітичну гідрогенізацію, наприклад, синтез епітігогеніну з тігогенону, що виконаний Блюнденом, з використанням гідрогенізації на каталізаторі Адамса (окис платини (IV)) у крижаній оцтовій кислоті, яка містить 2% хлороводневої кислоти [J. Nat. Prod. 42,478-482 (1979); Onderstepoort J. Vet. Res., 61,351-359 (1994)]. Маркер виявив, що гідрогенізація сарсасапогенону на каталізаторі Адамса в етанолі дає епісарсасапогенін [Marker and Rohrmann, J. Amer. Chem. Soc, 61,943 (1939)]. Також повідомляється про відновлення з використанням боргідриду натрію, наприклад, синтез епісарсасапогеніну із сарсасапогенону, що виконаний Майлсом, з використанням боргідриду натрію [J. Agric. Food Chem., 41,914-917 (1993)]. Також повідомляється про відновлення за допомогою літій алюмінію гідридом, наприклад, синтез епісмілагеніну зі смілагенону, що виконаний Джерасі [J. Am. Chem. Soc, 74,422-424, (1952)], і синтез епісарсасапогеніну із сарсасапогенону, що виконаний Льюїсом [Steroids, 58,387-389 (1993)]. Описи цих публікацій включені в дану заявку у вигляді посилання. [Патенти США №5703052 (1997), 5807834 (1998) і 5939398 (1999)], опис яких включено в дану заявку у вигляді посилання, приводять методики синтезу 3a-гідрокси-5a-Н сапогенінів з використанням K-SelectrideÒ при низьких температурах. У [патенті WO-02/079221, що опубл. 10.10.2002], у прикладі 6, описується синтез епісарсасапогеніну шляхом відновлення сарсасапогенону з використанням три-третбутоксиалюмогідрида літію. Хоча, ця публікація не у всіх країнах вважається відомим рівнем техніки. У даному винаході зроблена спроба удосконалити стереоспецифічний синтез 3гідрокси-5b-гідроген стероїдних сапогенінів, і, більш переважно, 3b-гідрокси-5b-Н-сапогенінів, що визначені і описані у [публікаціях WO-99/48482, WO-99/48507, WO-01/49703, WO-02/079221 і WO01/23406], так само, як і їх похідні, такі як, наприклад, відповідні сапоніни та інші фізіологічно прийнятні форми, такі як солі і ефіри, що можуть служити проліками. У найбільш переважному варіанті здійснення за даним винаходом, зроблена спроба забезпечити ефективний стереоспецифічний синтез сарсасапогеніну, смілагеніну, епісарсасапогеніну, епісмілагеніну, їх проліків і інших фізіологічно прийнятних форм. 7 81133 8 Даний винахід представляє, насамперед, похідні можуть легко взаємоперетворюватися шляхом реакцій, що добре відомі у цій галузі. спосіб одержання 3-гідрокси-5b-Н стероїдного сапогеніну або його похідного, який включає Похідні сапогенінів можуть нести похідні групи в будь-якому заданому, одному чи більш, положенні відновлення 3-кето-5b-Н стероїдного сапогеніну з в молекулі. Сапонін і його ефірні похідні можуть використанням відновника, такого як утруднений нести, наприклад, похідні групи в положенні 3 органоборан або алюмінійорганічний гідрид. кільця А. Вираз "сапогенін", що використовується 3-Гідрокси-5b-Н стероїдний сапогенін, який тут, буде включати всі похідні форми його, якщо попередньо утворений зазначеними зворотне не буде очевидним з контексту. стереоспецифічними відновниками, може потім У зв'язку з третім аспектом даного винаходу, перетворюватися в бажане похідне, наприклад, з що обговорюється нижче, вираз "похідне", який використанням технологій одержання похідних, які вживається тут, відноситься, крім того, до добре відомі у цій галузі. Зазначене перетворення активованих похідних сапогенінів, що може відбуватися в тій же чи в іншій реакційній використовуються у реакції. системі, і може протікати одночасно з Відповідним підбором відновника метод відновленням або після нього. дозволяє одержати ряд речовин -3a-гідрокси, 5b-Η Вираз "утруднений органоборан" тут відноситься, зокрема, до відновників -триалкілі 3b-гідрокси, 5b-Η і їх похідних - в основному або, принаймні, переважно як продукти реакції в або триарил-боргідридів лужних металів, таких як, стереоізомерно чистій формі (наприклад, близько наприклад, три-sec-бутилборгідрид літію, 80% перегрупування) з доступної комерційної або трисіамілборгідрид літію або трифенілборгідрид попередньо одержаної вихідної реагуючої літію, або до відповідних відновників, у яких літій замінений натрієм чи калієм. Алкільні групи речовини, звичайно для запобігання складного поділу сумішей ізомерів. переважно містять від 1 до 7 атомів вуглецю, Використання утрудненого органоборану чи найбільш переважно від 3 до 7 атомів вуглецю. алюмінійорганічного гідриду у якості відновника не Арильні групи переважно містять від 6 до 12 атомів вуглецю і можуть бути алкілзаміщеними. було попередньо застосоване до 3-кето-5b-Н Відновники, які згадані в даному описі, мають стероїдних сапогенінів. Синтез епісарсасапогеніну, загальну назву "Selectride", хоча, необхідно опис якого включено в дану заявку у вигляді розуміти, що використаний тут термін "Selectride" посилання, був виконаний Майлсом [J. Agric. Food не припускає обмеження винаходу у відношенні Chem., 41,914-917 (1993)] з використанням відновника, який отримано від визначеного боргідриду натрію у якості відновника, при тім, що виробника або з визначеного джерела, і такий більш селективний реактив ЛТБА вже був відомий відновник може використовуватися. Для більш у той час, коли про цю роботу повідомляли. детального обговорення відсилаємо до Якщо відновником є відносно високо ["Reductions by the Alumino-and Borohydrides in утруднений органоборан (органічні групи з більш Organic Synthesis", J. Seyden-Penne (VCH ніж двома атомами вуглецю), отриманий сапогенін Publishers, Inc.)]. Переважно утрудненими може бути, переважно, 3b-гідрокси-5b-Н органоборанами для використання за даним сапогеніном. винаходом є три-sес-бутилборгідрид літію (LЯкщо відновником є відносно менш Selectride), три-sес-бутилборгідрид калію (Kутруднений органоборан (органічні групи не більш, Selectride), три-sес-бутилборгідрид натрію (Nніж із двома атомами вуглецю), отриманий Selectride), трисіамілборгідрид літію (LSсапогенін може бути, переважно, 3a-гідрокси-5b-Н Selectride), трисіамілборгідрид калію (KSсапогеніном. Selectride), трифенілборгідрид натрію і Якщо відновником є алюмінійорганічний трифенілборгідрид літію. гідрид, то отриманий сапогенін може бути, Вираз "алюмінійорганічний гідрид" у даному переважно, 3a-гідрокси-5b-Н сапогеніном. описі відноситься зокрема до будь-якого Вираз "3-кето-5b-Н сапогенін", що відновника, що містить алюміній, гідридний використовується тут для зручності, означає компонент, і органічним групам (наприклад, алкіл вихідну речовину для відновлення і не обов'язково або алкокси, що відповідно містять від 1 до 7 має на увазі наявність або відсутність кето груп в атомів вуглецю), таким як натрій біс-(2інших частинах молекули, наприклад, поза кільцем метоксиетокси)алюмінію гідрид (Red-AlÒ), А, при умові, що, у разі потреби, будь-які небажані діїзобутил-алюмінію гідрид або літію три-третреактивні ділянки в інших частинах молекули бутоксиалюмогідрид (ЛТБА). Для більш відповідно захищені. Вихідна речовина 3-кето-5|3детального обговорення відсилаємо до Н сапогенін може мати відмінності в порівнянні з ["Reductions by the Alumino-and Borohydrides in бажаним продуктом реакції в частинах молекули, Organic Synthesis", J. Seyden-Penne (VCH крім положення 3 в кільці А, у цьому випадку Publishers, Inc.)]. Переважними органогідридами необхідне перетворення буде виконано способом, алюмінію для застосування за даним винаходом є що відомий фахівцю в цій галузі, як частина натрій біс(2-метоксиетокси)алюмінію гідрид (Redповного синтезу, що дає бажаний кінцевий Al), діїзобутилалюміній і ЛТБА. продукт. Вираз "похідне", що використовується тут у Вихідну речовину 3-кето-5b-Н сапогенін можна відношенні сапогенінів, відноситься, зокрема, до легко одержати окисненням відповідного 3-ОН відповідних сапонінів і інших фізіологічно сапогеніну. Наприклад, сарсасапогенон може бути прийнятних форм, таких як солі та ефіри, що отриманий окисненням з дихроматом піридину, як можуть служити проліками. Сапогеніни та інші 9 81133 10 описано Майлсом [J. Agric Food Chem., 41,914-917 містять від 6 до 12 атомів вуглецю, і такі арильні (1993)], окисненням Джонса, як описано групи можуть бути необов'язково алкілБлюнденом [J. Nat. Prod., 42,478-482 (1979)] і у заміщеними. [патенті WO-98/07741], описи яких включені в дану Альтернативна схема синтезу може включати заявку у вигляді посилань. Смілагенон отриманий початковий синтез активованого похідного з діосгенону (який безпосередньо утворений сапогенїну, що здатний брати участь у окисненням діосгеніну) з використанням нуклеофільному заміщенні, наприклад, органічне похідне, що сульфоване в 3-О положенні, таке як відновлення подвійного зв'язку a,b ненасиченого 3-мезилат або 3-тозилат похідне. кетона [Marker et al., J. Am. Chem. Soc. 2525 Якщо органічна кислота, яка використовується (1940), Irismetov & Goryaev, Izv. Akad. Nauk Kaz. в зазначеній реакції відповідно до другого аспекту SSR, Ser. Khim., 2,47-52 (1981)]. даного винаходу, включає груп у, таку як аміно У переважному варіанті здійснення даного група, що може брати участь у небажаній реакції, винаходу ви хідна речовина - 3-кето-5b-Н ця група буде відповідно захищена звичайним стероїдний сапогенін, отримано гетерогенною способом. каталітичною гідрогенізацією відповідного D4-3У цілому, даний винахід представляє методику кето стероїдного сапогеніну, наприклад, синтезу необхідних стероїдних сапогенінів, діосгенону. Гетерогенна каталітична гідрогенізація наприклад смілагеніну або епісмілагеніну, з перетворює D4-3-кето стероїдний сапогенін у доступних го тових вихідних речовин, наприклад, відповідний 5b-Η кетон, наприклад, смілагенон, діосгеніну, з використанням селективного який потім відновлюється відповідно до першого відновлення при стереохімічному контролі, як аспекту даного винаходу. показано для цих специфічних сполук на Схемі 1, Гетерогенна каталітична гідрогенізація може що представлена нижче: відповідно бути виконана з використанням водню і паладієвого каталізатора в органічному розчиннику. Паладієвий каталізатор знаходиться на носії, такому як, наприклад, сульфат барію, карбонат кальцію, графіт або вугілля. Паладієвий каталізатор переважно використовується в попередньо відновленій формі. Якщо діосгенон є реагуючою речовиною і каталітична гідрогенізація супроводжується відновленням смілагенону з використанням утрудненого органоборану в якості відновника, продуктом реакції є смілагенін. Якщо діосгенон є реагуючою речовиною і каталітична гідрогенізація супроводжується відновленням смілагенону з використанням алюмінійорганічного гідриду в якості відновника, продуктом реакції є епісмілагенін. Даний винахід представляє в другому своєму аспекті спосіб перетворення 3a-гідрокси-5b-Н стероїдних сапогенінів і їх похідних у 3b-гідрокси5b-Н стероїдні сапогеніни і їх похідні, що включає реакцію 3-гідрокси активованого похідного 3aгідрокси-5b-Н стероїдного сапогеніну з нуклеофільним реагентом при умовах, сприятливих для нуклеофільного заміщення з інверсією в положенні З з необов'язковим наступним розміщенням групи, що заміщує у положенні 3, при необхідності. Методики даного винаходу можуть бути Реакція буде протікати по SN2 механізму, що використані для одержання 3-гідрокси 5b-Η приведе до необхідного інверсованого продукту стероїдного сапогеніну, такого як сарсасапогенін, реакції. Схема синтезу, яка може бути докладно смілагенін, епісарсасапогенін, епісмілагенін і їх приведена, являється реакцією Міцунобу [Hughes, похідних. Проліки та інші фізіологічно прийнятні Organic Reactions, 42,337-400 (1992)]. Якщо таку форми сапогенінів можуть бути отримані з 3-ОН схему синтезу застосувати до сапогеніну, то 3-ОН сполук загальноприйнятим способом, що описаний сапогенін перетворюється через його 3-гідрокси більш детально нижче. активовану форму у відповідний 3-ефір з інверсією Сапогенінові продукти синтезу в положення 3. Реактивами, що використовуються, У способі одержання сапогенінових продуктів являються діалкілазодикарбоксилат, синтезу за даним винаходом переважно тріарилфосфін і відповідна органічна кислота або використовуються речовини загальної формули: її сіль відповідно до необхідного ефіру. Вираз "алкіл" переважно відноситься до алкільних груп, що містять від 1 до 7 атомів вуглецю. Вираз "арил" переважно відноситься до арильних груп, що 11 81133 е R1, R2, R3, R4, R5, R6, R7, R8 і R9, незалежно один від одного, являються Н, С1-4 алкілом, ОН або OR (де R - С6-12 арил чи С1-4 алкіл), або R5 і R6 разом можуть представляти =O (карбоніл) або захищену карбонільну груп у, стереохімія атому вуглецю в положенні 3 (а саме, вуглець кільця А, до якого приєднана група R10) може бути або R, або S, і R10 може бути ОН, О-зв'язаною вуглеводною групою або будь-якою групою органічного ефіру (який включає аліфатичні і амінокислотні ефіри). Крім випадку, описаного у вищенаведеній формулі, з використанням точково-штрихової моделі молекули, крім того, оскільки стереоспецифічність є ознакою даного винаходу, стереохімія формули не наводиться, і всі стереоізомери і суміші ізомерів включені. Вираз "фізіологічно прийнятні проліки" тут означає ті проліки сполук, що використовуються відповідно до даного винаходу, які, у рамках надійної клінічної оцінки, підходять для застосування в контакті з тканинами людини і тварин без зайвої токсичності, подразнення, алергійної реакції і тому подібного, відповідно до прийнятної пропорції користь/ризик, також як і цвітер-іонні форми, якщо можливо, сполук за винаходом. Вираз "проліки" означає сполуки, що швидко трансформуються in vivo у продукт реакції вихідної речовини формули, що згадана вище, наприклад, шляхом гідролізу в крові. Детальне обговорення проліків представлено у наступних джерелах: [Design of Prodrugs, H. Bundgaard, Ed., Elsevier, 1985; Methods in Enzymology, K. Widder et al, Ed., Academic Press, 42, p.309- 396,1985; A Textbook of Drug Design and Development, Krogsgaard-Larsen and H. Bundgaard, Ed. , Chapter 5; Design and Applications of Prodrugs, p.113-193, 1991; Advanced Drug Delivery Reviews, H. Bundgaard, 8, p.1-38 (1992); Journal of Pharmaceutical Sciences, 77, p.285 (1988); Chem. PHARM. BULL., N. Nakeya et al, 32, p.692 (1984); Pro-drugs as Novel Delivery Systems, T. Higuchi and V. Stella, Vol.14 of the A. C. S. Symposium Series, and Bioreversible Carriers in Drug Design, Edward B. Roche, Ed., American Pharmaceutical Association and Pergamon Press, 1978, які включені в дану заявку у вигляді посилання. Вираз "фізіологічно прийнятні солі" означає відносно нетоксичні, неорганічні і органічні кислотно-адитивні солі сполук за даним винаходом. Ці солі можуть бути отримані in situ у ході остаточного виділення та очищення сполук або шляхом реакції окремих очищених сполук. [Дивися, наприклад, статтю S. М. Berge et al, Pharmaceutical Salts, J. Pharm. Sci., 66: p.1-19 (1977), що включена тут шля хом посилання]. 12 Вираз "органічний ефір" тут означає будь-який ефір, що отриманий реакцією сполуки, де R10 являється ОН, з органічною кислотою, що утворює ефір, або її активованими похідними. Органічна кислота може бути, наприклад, аліфатичною карбоновою кислотою або амінокислотою. Без обмеження, група органічного ефіру може, наприклад, бути вибрана з: катилату (етоксикарбонілокси), ацетату, сукцинату, пропіонату, n-бутирату, і-бутирату, валеріату, ізовалеріату, n-капроату, ізокапроату, діетилацетату, октаноату, деканоату, ла урату, міристату, пальмітату, стеарату, бензоату, фенілацетату, фенілпропіонату, цинамату, фталілу, гліцинату, аланінату, валінату, фенілаланінату, ізолеуцинату, метіонінату, аргінінату, аспартату, цистеїнату, глютамінаїу, гістидинату, лізинату, пролінату, серинату, треонінату, триптофанату, тирозинату, фумерату, малеату, заміщеного аліфатичного, наприклад, хлорацетату, метоксиацетату, захищених гр уп амінокислотних ефірів, наприклад, Восаміногліцинату (Вос,t-бутоксикарбоніл), Восаміновалінату, CBZ-аміногліцинату (CBZбензилоксикарбоніл), CBZ-аміноалінату, і груп заміщених ароматичних ефірів, наприклад, рбромбензоїлокси, m-бромбензоїлокси, рметоксибензоїлокси, хлоробензоату, такого як рхлорбензоїлокси, дихлорбензоату, такого як, 2,4дихлорбензоїлокси, нітробензоату, такого як, рнітробензоїлокси або 3,5-динітробензоїлокси, і так далі. Вираз "цукор" тут використовується по відношенню, зокрема, до моно-, ди-або трисахаридів та їх ацилованих форм. Без обмеження, такі цукри можуть бути, наприклад, моно альдозою або кетозою, що мають 5 або 6 атомів вуглецю, переважно в циклічній фуранозній або піранозній формі, а також у формі a чи b аномеру, і мають D або L оптичні ізомери. Приклади прийнятних цукрів включають глюкозу, манозу, фр уктозу, галактозу, мальтозу, целобіозу, сахарозу, рамнозу, ксилозу, арабінозу, фукозу, хіновозу, апіозу, лактозу, галактозу-глюкозу, глюкозу-арабінозу, фукозу-глюкозу, рамнозу-глюкозу, глюкозуглюкозу-глюкозу, глюкозу-рамнозу, маннозуглюкозу, глюкозу-(рамнозу)-глюкозу, глюкозу(рамнозу)-рамнозу, глюкозу-(глюкозу)-глюкозу, галактозу-(рамнозу)-галактозу та їх ациловані (наприклад, ацетиловані) похідні. Перший аспект даного винаходу 3-Кето-5 b-Η стероїдний сапогенін, вихідна речовина для етану, який починається утворенням бажаного сапогеніну відповідно до першого аспекту даного винаходу, переважно відповідає сапогеніну з усіма точками молекули, крім групи в положенні 3. Однак, необхідні або бажані, придатні захисні групи можуть бути застосовані для відновлення і згодом вилучені для одержання бажаного сапогеніну. Вираз "захисні групи", що вживається тут, відноситься до груп, які використовуються для захисту активних функціональних груп, наприклад, гідрокси або карбоксигруп, де останні бажані в кінцевих продуктах реакції, щоб уникнути їх небажаної участі в реакції. Загальноприйняті 13 81133 14 захисні групи можуть бути використані у Було виявлено, що низькі температури відповідності зі стандартною методикою, (наприклад, біля -78°С) не є істотною умовою для наприклад, у [статті Т. W. Green і P. G. М. Wuts у способу за даним винаходом. Відновлення може "Protective Groups in Organic Chemistry" John Wiley звичайно проходити при температурах від -100°С і Sons, 1991; J. F. W McOmie у "Protective Groups in до 25°С, переважно від -40°С до 25°С, найбільше Organic Chemistry" Plenum Press, 1973]. переважно від біля -10°С до 10°С, і, відповідно, у Була виявлена певна кількість реагентів для розчиннику, що вибраний з ТТФ, 2селективного ефекту при одержанні смілагеніну метилтетрагідрофурану (МТГФ), толуолу, 1,4або епісмілагеніну, як показано нижче в Таблиці 1 діоксану, трет-бутилметил ефіру і суміші цих (відсоток селективності відноситься до розчинників, найбільш переважно - ТГФ. компонентів неочищеного продукту реакції). У переважному варіанті здійснення 3-кето-5bВиявлено, що використання K, L або N-SelectrideÒ Η стероїдний сапогенін, як вихідна реагуюча (калію, літію або натрію три-sec-бутилборгідриду) речовина, наприклад, смілагенон, що отриманий або відповідного трифенілборгідриду приводить гетерогенною каталітичною гідрогенізацією до утворення 3b-гідроксилу, наприклад відповідного D4-3-кето стероїдного сапогеніну, смілагеніну, високо стереоселективним способом. наприклад, діосгенону. Застосування менш утр удненого Такий D4-3-кето стероїдний сапогенін, триетилборгідриду літію, у якості відновника, наприклад, діосгенон, що, переважно, отриманий приводить до утворення 3a-гідроксилу, наприклад, окисненням відповідного А5-3-гідрокси стероїдного епісмілагеніну, високо стереоселективним сапогеніну, наприклад діосгеніну, для одержання способом. Також було виявлено, що застосування a,b-ненасиченого кетона. Буде відзначено, що алюмінійорганічного гідриду, такого як ЛТБА, пряме відновлення діосгеніну, при використанні також приводить до утворення 3a-гідроксилу, паладію або вугілля у якості каталізатора, дає наприклад, епісмілагеніну, високо переважаючий 5a-продукт - тігогенін. стереоселективним способом. При Маркер [Marker et al, J. Am. Chem. Soc, 62, 2525 (1940)] виявив, що відновлення діосгенону в стереоселективному відновленні 3-кето-5b-Н стероїдних сапогенінів відповідно за даним смілагенон може бути досягнуто на паладій-барій винаходом, виявили, що можливо одержати сульфатному каталізаторі в розчині ефіру в молярне співвідношення отриманих домінуючих 3атмосфері водню. Низька концентрація (500 гідрокси стероїдів до альтернативних 3-епімерів, об'ємів; нормальні технологічні об'єми принаймні, близько 10:1, із прикладами, знаходяться в межах 5-30 об'ємів) і високе принаймні, близько 15:1. завантаження каталізатора (1000%; нормальне завантаження каталізатора знаходиться в межах 1-20%) роблять описаний процес Таблиця 1 практично неможливим і економічно не раціональним для Селективність у відновленні смілагенону промислового застосування. На додаток, ефір не підходить для промислового використання через міркування безпеки. Епісмілагенін Смілагенон Смілагенін Реагент Температура (°С) Розчинник Інші вчені також досліджували відновлення (%) (%) (%) діосгенону в5,0смілагенон. Джерасі відновив LіАIН(ОtВu)3 Кімнатна температура ТГФ 95,0 діосгенон (10г) у етанолі (450мл) на попередньо LiBHEt3 -78 ТГФ 22,8 74,3 відновленому14,4 Pd-C (0,8г) при атмосферному 10% *АlН3 0 ТГФ 83,1 тиску. Неочищений смілагенон виділили *ВН3 0 ТГФ 11,8 83,9 осадженням 10,4водою і 51,4 з перекристалізували з *9-BBN -78 ТГФ 37,5 хлороформ/метанолом в кінцевий продукт реакції *NaBH4/CeCl 3 -78 ТГФ 4,4 89,5 чистий смілагенон (7,2г, 72%) із точкою плавлення -78 ТГФ 91,1 3,4не змінився, коли 4,7 L-SelectrideÒ 179-183°С. Продукт реакції -5 ТГФ 92,7 4,2 2,5 L-SelectrideÒ реакція протікала в присутності гідроксиду калію 20 ТГФ 92,7 4,8 2,2 L-SelectrideÒ (3г). Аналітично чистий зразок розплавився при -78 Толуол 5,5 2,5 L-SelectrideÒ температурі 90,8 186-188°С [Djerassi, Yashin and Rosenkranz, J. Am. Chem. Soc, 74,422 (1952)]. Цей -78 Діетилмалеанат 54,0 4,0 41,1 L-SelectrideÒ 20 Циклогексан процес утр уднений через низьку розчинність 74,9 13,9 8,5 L-SelectrideÒ діосгенону в е97,3 танолі. -78 ТГФ 1,6 0,2 N-SelectrideÒ Під час вивчення ряду прегнана Суворов -5 ТГФ 94,2 2,6 0,5 N-SelectrideÒ знайшов, що піридин впливає на результат -78 ТГФ 96,5 2,0 K-SelectrideÒ реакцій гідрогенізації. Звичайно, у цій0,3 роботі -10 ТГФ 93,6 4,0 0,6 K-SelectrideÒ каталізатором був обраний 10% паладіум на -78 Метилте трагідрофуран кальцію (Pd-CaCO3). У цих випадках 92,2 6,3 K-SelectrideÒ карбонаті селективність, як було 4,4 виявлено, 3,2 помітно -78 ТГФ 91,5 LS-SelectrideÒ перевершила95,5селективність реакцій, -78 ТГФ 2,4 0,3 що KS-SelectrideÒ протікають у91,0 спиртових розчинниках, навіть з KBH(Ph)3 -78 ТГФ 4,6 1,7 додаванням каустику [Su vorov and Yaroslavtseva, Steroids, 1270 (1961)]. Дослідження, що розглянуто * - порівняльні реакції. в цій роботі, включило гасіння розведеною соляною кислотою і екстрагування продукту реакції хлороформом. Органічний екстракт 15 81133 16 промили розведеною соляною кислотою, 8% 5% Pd/графіт (Johnson Matthey тип 450) і 10% водяним розчином бікарбонату натрію і водою до Pd/C (Johnson Matthey тип 39) також є нейтральної реакції лакмусу. Цей метод приводить прийнятними каталізаторами для цього процесу. до одержання великої кількості водних відходів, які Прийнятні розчинники можуть бути вибрані з містять піридин і галоїдовані розчини, що ТГФ, 2-метилтетрагідрофурану, толуолу, 1,4вимагають видалення, збільшуючи вартість діоксану, етил ацетату, метил ізобутилкетону, виробництва. найбільш переважний - ТГФ. Ці розчинники, як Ірисметов показав, що висока селективність виявлено, вигідніше піридину. З цими може бути досягнута у відновленні діосгенону до розчинниками, процес може протікати при смілагенону. У цій роботі діосгенон (1г) концентрації 1 об'єм до 50 об'ємів, переважно при гідрогенізували на 5% Pd-СаСО3 (1г) у піридині 3:30 і найбільше переважно при 3:10. (30мл) при атмосферному тиску. Після фільтрації, Завантаженість каталізатора знаходиться в межах для видалення каталізатора, і випарювання від 1 до 25%, переважно від 1 до 10% і найбільше розчинника осад кристалізували зі спирту для переважно від 1 до 5%. одержання твердої речовини, з температурою Виявлено, що збільшення тиску призвело до плавлення 209-211°С. Кінцеві продукти реакції не зниження селективності в процесі. Реакція приводяться [Irismetov and Goryayev, Izv. Akad. переважно проходить при тиску водню 1-5бар і Nauk Kaz. SSR, Ser. Khim., 2,47 (1982)]. Ця робота більш переважно - при 1-2бар. має недолік при промисловому виробництві Підвищена температура також знижує високі завантаження каталізатору (100%) і селективність, як було виявлено. Реакція розведені розчини. Піридин є токсичним переважно протікає при температурі 15-75°С, розчинником і більш широко використовується в більш переважно - при 20-50°С і найбільш стехіометричних кількостях як реагент, що сприяє переважно - при 20-30°С. видаленню кислоти в промисловому виробництві. ТГФ забезпечує кращу розчинність діосгенону У [патенті Великобританії №736818] в порівнянні з етанолом і іншими можливими ефір заміщеними розчинниками, такими як заявляється відновлення 3-кето-D4стероїдів у 5a-Η діетоксиметан і трет-бутил метил ефір, що стероїди на паладієвому каталізаторі у присутності неорганічної основи і у безводному середовищі. передбачає більш високу продуктивність і велику економічність процесу. Цей процес забезпечує Кращий розчинник - метанол, і краща основа більш просте дослідження в порівнянні з роботою гідроксид калію. Діосгенон не приведено як в системі етанол/водний розчин гідроксиду натрію. приклад. Виявлено, що діосгенон погано Дослідження полягає в концентрації реакційної розчиняється в спиртах (особливо в етанолі), що робить середовище цього процесу сильно суміші і виділенні смілагенону. Розчинник може бути повторно використаний. розведеним. Такий метод вимагає процедури Розчинники, що ефективні в очищенні екстрагування. смілагенону, включають циклогексан, 2-бутанон, [Патент Великобританії №763301] посилається ацетон, 2-пропанол і метанол; приклади їх на користь лугу (наприклад, гідроксиду натрію або наведені в Таблиці 3 нижче. калію) у збільшенні кількості 5b-Η продукту при відновленні 3-кето-D4стероїдів. У формулі цього патенту заявляється про застосування тріетиламіну в цьому контексті. Серед вибраних Перекристалізація неочищеного сміла розчинників мають місце етанол, ефір, етил ацетат і метилциклогексан, 1,4-діоксан є переважним розчинником. Розчинник Об'єм Кінцевий продукт Смілагенон (%) Тігог реакції/% Виявлено, що використання паладію на початкове основі, такої як сульфат барію (Pd-BaSO4) або 91,35 співвідношення карбонат кальцію (Pd-CaCO3) у прийнятному розчиннику забезпечує економічний і прийнятний 2-бутанон 5 70 97,77 спосіб. Розкрито методики, при яких циклогексан 8 72 97,71 використовують комерційно ефективні 2-пропанол 12 60 97,40 концентрації і низькі завантаження каталізаторів. Крім того, виявлено, що відновлені форми цих Переважний варіант винаходу полягає в каталізаторів більш селективні, ніж не відновлені переносі розчину смілагенону в ТГФ з етану форми, як показано нижче в Таблиці 2. гідрогенізації безпосередньо на етап відновлення відповідно до першого аспекту даного винаходу. Таблиця Це дозволяє уникнути необхідності виділяти 2і сушити проміжний смілагенон, заощаджує час і Загальний скринінг використовуване обладнання, і тому очікується зниження виробничих витрат. Виявлено, що Розчинник/каталізатор Смілагенон (%) Тігогенон(%) Тігогенін(%) домішки, які Діосгенон(%) утворилися в цьому процесі Pd-BaSO4(r)/ТГФ 95,7 2,1 1,2 (головним чином
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess of stereospecific synthesis of 3-hydroxy-5b-h steroidal sapogenins, process of conversion and processes for the preparation of smilagenin and epismilagenin
Автори англійськоюGunning Philip James
Назва патенту російськоюСпособ стереоспецифического получения 3-гидрокси-5b-н стероидного сапогенина, способ перегруппировки и способы получения смилагенина и эписмилагенина
Автори російськоюГаннинг Филип Джеймз
МПК / Мітки
МПК: C07J 71/00
Мітки: способи, спосіб, одержання, стереоспецифічного, епісмілагеніну, 3-гідрокси-5b-н, сапогеніну, перегрупування, смілагеніну, стероїдного
Код посилання
<a href="https://ua.patents.su/11-81133-sposib-stereospecifichnogo-oderzhannya-3-gidroksi-5b-n-sterodnogo-sapogeninu-sposib-peregrupuvannya-ta-sposobi-oderzhannya-smilageninu-i-epismilageninu.html" target="_blank" rel="follow" title="База патентів України">Спосіб стереоспецифічного одержання 3-гідрокси-5b-н стероїдного сапогеніну, спосіб перегрупування та способи одержання смілагеніну і епісмілагеніну</a>
Попередній патент: Фармацевтична комбінація змішаного або селективних лігандів для ppar рецепторів підтипу a
Наступний патент: Спосіб виготовлення деталі та деталь, виготовлена зі сталі, яка має абразивну стійкість
Випадковий патент: Відбивач струму












