Фармацевтична композиція, що містить zd6474
Формула / Реферат
1. Фармацевтична композиція, що містить ZD6474 або його фармацевтичнo прийнятну сіль, крихкий розріджувач і другий розріджувач, що є практично нерозчинним у воді та має пластичність при стисненні,
де крихкий розріджувач вибирають із: гідрофосфату кальцію, фосфату кальцію, безводного фосфату кальцію, карбонату кальцію, сульфату кальцію або оксиду магнію, і
де другий розріджувач вибирають із: мікрокристалічної целюлози, крохмалю, етилцелюлози та карбоксиметилцелюлози.
2. Фармацевтична композиція за п. 1, у якій крихкий розріджувач являє собою гідрофосфат кальцію.
3. Фармацевтична композиція за п. 1 або п. 2, у якій другий розріджувач, що є практично нерозчинним у воді та має пластичність при стисненні, являє собою мікрокристалічну целюлозу.
4. Фармацевтична композиція за п. 1, що містить:
(a) від 1 до 70 (зокрема від 5 до 50) частин ZD6474 або його фармацевтичнo прийнятної солі;
(b) від 1 до 96 (зокрема від 10 до 70) частин крихкого розріджувача; і
(c) від 0,1 до 20 (зокрема від 1 до 15) частин другого розріджувача, що є практично нерозчинним у воді та має пластичність при стисненні;
де всі частини зазначені за масою, а сума частин (а) + (b) + (с) = 100.
5. Фармацевтична композиція за п. 4, у якій крихкий розріджувач являє собою гідрофосфат кальцію, а другий розріджувач, що є практично нерозчинним у воді та має пластичність при стисненні, являє собою мікрокристалічну целюлозу.
Текст
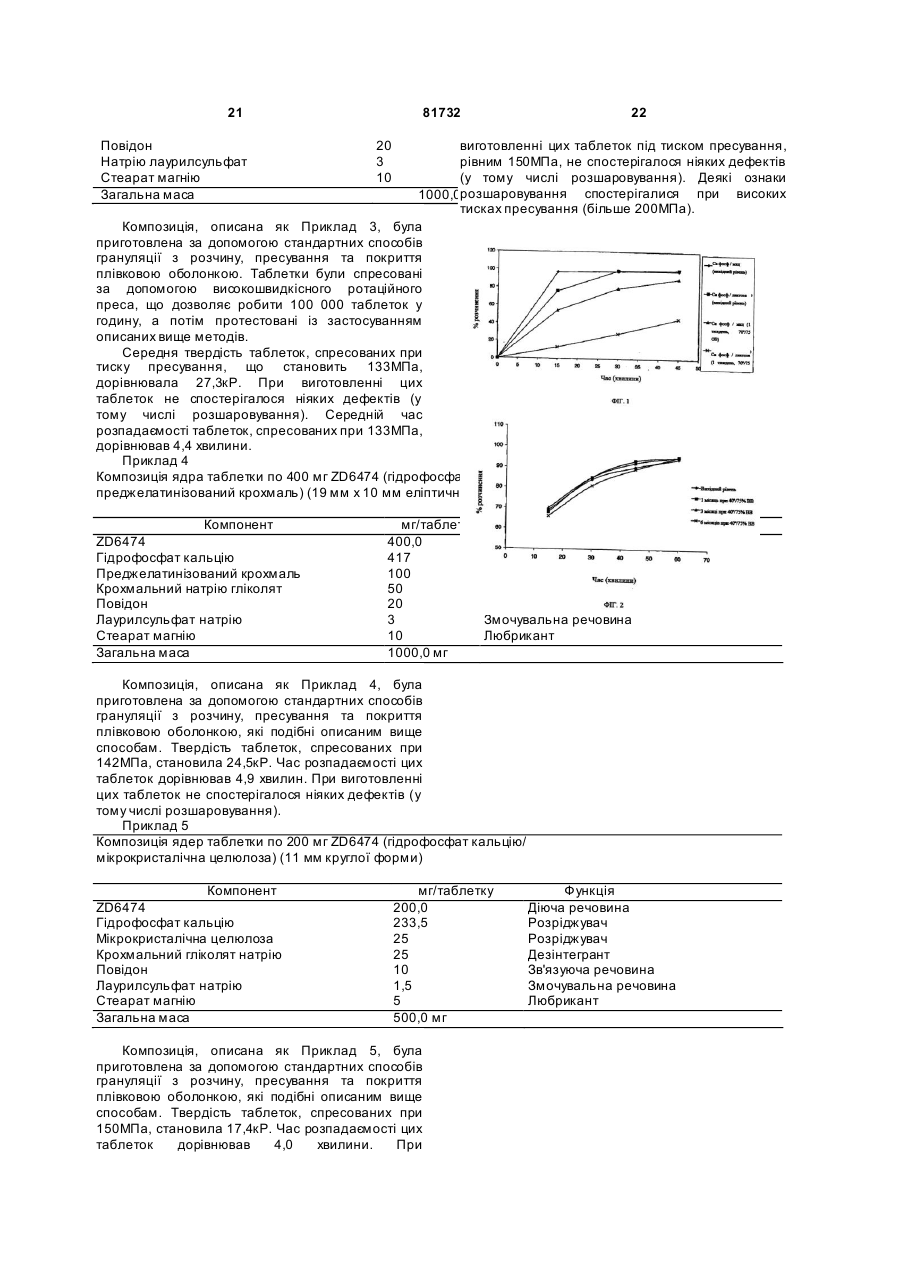
1. Фармацевтична композиція, що містить ZD6474 або його фармацевтичнo прийнятну сіль, крихкий розріджувач і другий розріджувач, що є практично нерозчинним у воді та має пластичність при стисненні, де крихкий розріджувач вибирають із: гідрофосфату кальцію, фосфату кальцію, безводного фосфату кальцію, карбонату кальцію, сульфату кальцію або оксиду магнію, і де другий розріджувач вибирають із: мікрокристалічної целюлози, крохмалю, етилцелюлози та карбоксиметилцелюлози. 2. Фармацевтична композиція за п. 1, у якій крихкий розріджувач являє собою гідрофосфат кальцію. C2 2 (13) 1 3 81732 Pharmacol. Sci. 16: 57-66; Folkman, 1995, Nature Medicine 1: 27-31]. Вважають, що зміна проникності судин відіграє роль як у нормальних, так і у патологічних фізіологічних процесах [Cullinan-Bove та інші, 1993, Endocrinology 133: 829-837; Sengeretal, 1993, Cancer and Metastasis Reviews, 12: 303-324]. Було виявлено кілька поліпептидів, включаючи, кислотні і основні фактори росту фібробластів (aFGF та bFGF) і судинно-ендотеліальний фактор росту (VEGF), з рістпромотуючою дією in vitro на ендотеліальні клітини. Через обмежену експресію його рецепторів, активність фактору росту VEGF, на відміну від FGF, є відносно специфічною до ендотеліальних клітин. Нещодавно отримані докази свідчать, що VEGF є важливим стимулятором як нормального, так і патологічного ангіогенезу [Jakeman та інші, 1993, Endocrinology, 133: 848-859; Kolch та інші, 1995, Breast Cancer Research and Treatment, 36: 139-155] і судинної проникності [Connolly та інші, 1989, J. Biol. Chem. 264: 20017-20024]. Антагонізм дії VEGF у результаті секвестрації VEGF з антитілом може привести до інгібування росту пухлини [Кіт та інші, 1993, Nature 362: 841-844]. Рецепторні тирозинкінази (RTK) відіграють важливу роль у передачі біохімічних сигналів через плазматичну мембрану клітин. Ці трансмембранні молекули як правило складаються з позаклітинного лігандзв'язуючого домену, приєднаного через сегмент у плазматичній мембрані до внутрішньоклітинного домену тирозинкінази. Зв'язування ліганду з рецептором обумовлює стимулювання пов'язаної з рецептором активності тирозинкінази, що приводить до фосфорилювання залишків тирозину на рецепторі та інших внутрішньоклітинних молекулах. Ці зміни у фосфорилюванні тирозину ініціюють сигнальний каскад, що приводить до різних клітинних реакцій. Дотепер було ідентифіковано принаймні дев'ятнадцять різних підродин RTK, які характеризуються за гомологією амінокислотних послідовностей. Одну із цих підродин на сьогоднішній день утворюють finsподібний тирозинкіназний рецептор, Flt-Ι (також згадується як VEGFR-1), рецептор, що містить домен з кіназною вставкою, KDR (що називають також як VEGFR-2 або Flk-Ι) та інший fins-подібний тирозинкіназний рецептор, Flt-4. Дві із цих родинних RTK (Fit та KDR), як було встановлено, зв'язують VEGF з високою афінністю [De Vries та інші, 1992, Science 255: 989-991; Terman та інші, 1992, Biochem. Biophys. Res. Comm. 1992, 187: 1579-1586]. Зв'язування VEGF із зазначеними рецепторами, експресованими в гетерологічних клітинах, асоціювалося зі змінами в стані фосфорилювання тирозину в клітинних білках і потоках кальцію. VEGF - ключовий стимул для васкулогенезу і ангіогенезу. Цей цитокін індукує фенотип судинного росту шляхом стимулювання проліферації ендотеліальних клітин, експресії та міграції протеази і переміщення, та наступної організації клітин для утворення капілярних трубок [Keck, P.J., Hauser, S.D., Krivi, G., Sanzo, К., Warren, Т., Feder, J., та Connolly, D.T., Science 4 (Washington DC), 246: 1309-1312, 1989; Lamoreaux, W.J., Fitzgerald, M.E., Reiner, Α., Hasty, K.A., і Charles, S.T., Microvasc. Res., 55: 29-42, 1998; Pepper, M.S., Montesano, R., Mandroita, S.J., Orci, L. і Vassalli, J.D., Enzyme Protein, 49: 138-162, 1996]. Крім того, VEGF індукує суттєве підвищення проникності судин [Dvorak, H.F., Detmar, Μ., Claffey, К. P., Nagy, J.A., van de Water, L., та Senger, D.R., (Int. Arch. Allergy Immunol., 107: 233235, 1995; Bates, D.O., Heald, R.I., Curry, F.E. і Williams, B. J. Ph ysiol. (Lond.), 533: 263-272, 2001], сприяючи утворенню гіперпроникної, незрілої судинної сітки, характерної для патологічного антіогенезу. Показано, що достатньо активації тільки KDR для того, щоб промотувати всі основні фенотипічні реакції на VEGF, включаючи проліферацію ендотеліальних клітин, міграцію і виживаність, а також індукцію проникності судин [Meyer, Μ., Clauss, Μ., Lepple-Wienhues, Α., Waltenberger, J., Augustin, H.G., Ziche, M., Lanz, C, Biittner, M., R ziha, H-J., і Dehio, C, EMBO J., 18: 363-374, 1999; Zeng, H., Sanyal, S. та Mukhopadhyay, D., J. Biol. Chem., 276: 32714-32719, 2001; Gille, H., Kowalski, J., Li, В., LeCouter, J., Moffat, B, Zioncheck, T.F., Pelletier, N. та Ferrara, N., J. Biol. Chem., 276: 32223230,2001]. Похідні хіназоліну, які є інгібіторами тирозинкінази рецептору VEGF, описані в [публікаціях міжнародних патентних заявок WO 98/13354 і WO 01/32651. У WO 98/13354 та WO 01/32651] описані сполуки, які мають активність проти тирозинкінази рецептору VEGF (VEGF RTK), одночасно маючи деяку активність проти рецепторної тирозинкінази епідермального фактору росту (EGF) (EGF RTK). ZD6474 являє собою 4-(4-бром-2-фторанілін)6-метокси-7-(1-метил-піперидин-4ілметокси)хіназолін: ZD6474 підпадає під широкий загальний опис [WO 98/13354] і проілюстрований прикладами в [WO 01/32651] (Приклад 2). ZD6474 є потужним інгібітором VEGF RTK, а також має деяку активність по відношенню до EGF RTK. Показано, що ZD6474 проявляє широкий спектр протипухлинної активності на ряді моделей після перорального прийому один раз на добу [Wedge S.R., Ogilvie D. J., Dukes Μ. та інші, Proc. Am. Assoc. Cane. Res. 2001; 42: abstract 3126]. В [WO 98/13354], Приклад 77 описує деякі лікарські форми сполуки формули І. У Прикладі 11 з [WO 01/32651] описані подібні лікарські форми сполуки формули І. В [WO 01/32651] також описується підготування лікарської форми сполук, 5 81732 яку застосовували для введення щурам в 14денному дослідженні токсичності: "Сполуки були спочатку підготовлені шляхом суспендування в 1% (об./об.) розчині поліоксіетилен (20) сорбітанмоноолеату в деіонізованій воді, перетиранням на кульовому млині при 4°С протягом ночі (не менше 15 годин). Сполуки повторно суспендували шляхом збовтування безпосередньо перед введенням." У цілому, фармацевтичні композиції сполук формули І в [WO 01/32651] можна приготувати стандартним способом, використовуючи звичайні допоміжні речовини. Розшукувалися пероральні лікарські форми (наприклад, таблетки, капсули, гранули, пелети, льодяники і т.д.) ZD6474 для клінічних випробувань і комерційного застосування. При розробці пероральної лікарської форми, особливо таблетки, необхідно враховува ти механічні властивості активного фармацевтичного компоненту і будь-яких запропонованих допоміжних речовин. Ме ханічні властивості матеріалів, таких як порошки, можна описати за допомогою наступних характеристик: (a) Твердість або опір деформації, що може бути виміряний шляхом визначення твердості вдавленням; (b) Тиск текучості (позначають Ру і також відомий як границя текучості), що являє собою точку, у якій відбувається пластична деформація, яку можна виміряти за допомогою досліджень пресування; (c) Чутливість до швидкості деформації (ЧШД), що являє собою процентне зростання тиску текучості, починаючи від повільної до швидкої швидкості удару, яку можна виміряти за допомогою досліджень пресування; та (d) Модуль пружності, що є відношенням напруги до розтягання (натягом), який можна виміряти за допомогою численних методів, які добре відомі фахівцеві, кваліфікованому в галузі приготування лікарських форм. Матеріали можна, у цілому, класифікувати шляхом, яким вони деформуються під стискальним зусиллям: або крихким руйнуванням, або пластичною деформацією. Ступінь деформації для крихкого матеріалу не залежить від швидкості та тривалості процесу стиснення (тобто застосування стиснення), у результаті чого значення чутливості до швидкості деформації для таких матеріалів дорівнює 0% (нульовий%). Деформація пластичного матеріалу залежить від швидкості та тривалості процесу стиснення, і це описується чутливістю до швидкості деформації. При розробці пероральної лікарської форми, особливо таблетки, звичайно використовують суміш порошків: деяких крихкої природи, щоб мінімізувати чутливість до швидкості деформації, а деяких помірної пластичної природи, щоб збільшити поверхні, доступні для утворення зв'язків при стисканні. Таблеткові преси, використовувані в комерційному виробництві, як правило, працюють із набагато більш високими швидкостями, ніж 6 преси, використовувані в дослідженнях та розробці. Оскільки швидкість преса зростає, тривалість процесу стиснення (тобто періоду, протягом якого застосовується стиснення; також відомий як час перебування), зменшується. Це не впливає на стиснення крихкого матеріалу зі ЧШД, що дорівнює 0%, але у випадку пластичного матеріалу, для якого деформація залежить від швидкості та тривалості стиснення, більш швидкий прес, як правило, робив би більш м'які таблетки. Тому, надлишок пластичного матеріалу в лікарській формі може привести до труднощів при переході до виробництва більших кількостей на більш швидких компресійних машинах, використовуваних у повномасштабному виробництві. ZD6474 є надзвичайно пластичним матеріалом з тиском текучості, що становить 22МПа, і з дуже високою чутливістю до швидкості деформації, що дорівнює 197%. Ці властивості роблять приготування твердої пероральної лікарської форми ZD6474 важким завданням. Наприклад, при виготовленні таблетки ці властивості можуть привести до проблем одержання досить твердих таблеток, особливо при переході від відносно повільних машин для таблетування (відповідно, із тривалими процесами стиснення), які використовуються в дослідженнях і розробці для маленької кількості таблеток, до більш швидких компресійних машин (з короткими періодами стиснення), які ι використовуються в повномасштабному комерційному виробництві. Для того щоб протидіяти пластичності діючої речовини, такої як ZD6474, фахівець, кваліфікований у даній галузі, як правило, зробив би спробу розріджувати матеріал більшими кількостями додаткової допоміжної речовини, такої як крихка допоміжна речовина. Однак, це може обмежити навантаження діючої речовини, що може бути досягнуте при приготуванні лікарської форми, тобто відсоток активного компонента в ній, і може привести до одержання дуже великих таблеток, які важко проковтнути. Стандартна крихка допоміжна речовина, важкий карбонат магнію, використовувався в початковій випробуваній композиції лікарської форми ZD6474, щоб протидіяти пластичності та високій чутливості до швидкості деформації ZD6474. Випробувана композиція лікарської форми включала: Композиція ядра таблетки по 100мг ZD6474 (композиція з карбон Компонент мг/таблетку Ф ZD6474 100,0 Важкий карбонат магнію 262,8 Гідроксипропілцелюлоза (ГПМЦ 606) 16,0 Кроскармелоза натрію (Ac-di-sol) 16,0 Лаурилсульфат натрію (НЛС) 1,2 Стеарат магнію 4,0 Загальна маса таблетування 400,0 мг Нажаль, карбонатом властивостей приготування композиція лікарської форми з магнію не мала необхідних розпадаємості та розчинення для таблеток, тому що, при зберіганні 7 81732 цієї лікарської форми в умовах високої вологості (75% відносна вологість) та високої температури (40°С), було виявлено, що у таблеток дуже тривалий період розпаду (більше 30 хвилин) і негативний результат у тесті «Розчинення». ZD6474 погано розчинний у воді (0,033мг/мл при 25°С) і по системі класифікації Британської Фармакопеї 2001-2002 (див. Таблицю 1 нижче), його можна охарактеризувати як 'практично нерозчинну' або 'нерозчинну' сполуку. Як правило, при приготуванні лікарської форми практично нерозчинної діючої речовини, з метою підвищення швидкості розчинення включають розчинні розріджувачі. Щоб поліпшити розчинення ZD6474, приготували ще одну композицію лікарської форми з вільно розчинним розріджувачем моногідратом лактози. Моногідрат лактози був обраний, тому що він являє собою вільно розчинний наповнювач, але також і тому, що у нього відносно низька чутливість до швидкості деформації, рівна 19,4%, і із цієї причини він також являє собою відносно крихкий наповнювач. Ця випробувана композиція лікарської форми включала: 8 Композиція ядер таблетки по 400мг ZD6474 (композиція з фосфа Компонент мг/таблетку Ф ZD6474 400,0 Д Гідрофосфат кальцію 317 Р Моногідрат лактози 200 Р Крохмальний гліколят натрію 50 Д Повідон 20 З Лаурилсульфат натрію 3 З Стеарат магнію 10 Л Загальна маса 1000,0 мг Однак, при зберіганні в умовах високої вологості (75% відносна вологість) і високої температури (70°С) ця композиція лікарської форми також демонструвала тривалі періоди розпадання та розчинення (див. фіг.1). Ціль даного винаходу полягає в тому, щоб забезпечити фармацевтичні композиції ZD6474, що мають необхідні гарні властивості стиснення, необхідну твердість, опір зламу, а також мають необхідну гарну розпадаємість та розчинність, що дозволяють забезпечити високе навантаження діючої речовини, при цьому без розшаровування при приготуванні таблетки. Композиція ядра таблетки по 200мг ZD6474 (композиція з моногідратом лактози) Переважно, фармацевтичні композиції ZD6474 Компонент мг/таблетку Функція пероральними лікарськими формами є твердими ZD6474 200,0 ZD6474, особливо таблетками з ZD6474. Діюча речовина Лактози моногідрат (450 меш) 356,2 Розріджувач Несподівано, нами було виявлено, що Кроскармелоза натрію (Ac-di-sol) 24,0 композиція ZD6474 з крихким наповнювачем як Дезінтегрант Повідон 12,0 основною допоміжною речовиною та другим Зв'язуюча речовина Лаурилсульфат натрію 1,8 Змочувальна речовина наповнювачем, що є практично нерозчинним і має Стеарат магнію 6,0 Любрикант пластичність при стисненні, має особливі Загальна маса 600,0 переваги. Можна було б очікувати, що практично нерозчинний наповнювач забезпечить більш При виробництві та випробуванні стабільності тривалий період розпадаємості та розчинення в композиції з моногідратом лактози було порівнянні з вільно розчинним наповнювачем відзначено, що доти, поки могли бути досягнуті (наприклад, моногідратом лактози), і можна було б відповідні розпадаємість і розчинення, таблетки очікувати, що додавання ще одного пластичного були м'якими, мали поганий зовнішній вигляд та матеріалу до композиції ZD6474 буде згубним для руйнувалися при наступній обробці та властивостей стиснення. Однак, несподівано та на маніпуляціях з ними. Ці проблеми виявилися при диво, нами було виявлено, що додавання другого застосуванні відносно повільних машин для пластичного наповнювача з відносно високою таблетування при розробці; вони б підсилилися ЧШД до композиції ZD6474, що включає крихкий при переході до більших масштабів виробництва з наповнювач, забезпечує поліпшені властивостей більш швидкими компресійними машинами. Крім стиснення з погляду твердості та опори до цього, максимальне навантаження діючої розшаровування. речовини, якого можна було б досягти із цією На Фіг.1 показане порівняння профілів композицією та зробити таблетку, що не розчинення таблеток ZD6474 прикладу даного розшаровується, становило 33%. Необхідно, щоб винаходу (що містять гідрофосфат кальцію та навантаження діючої речовини було як можна мікрокристалічну целюлозу (мкц)) та композицій з більш високим з метою мінімізації розміру фосфа том кальцію / моногідратом лактози, індивідуальної таблетки. описаних вище, перед і після зберігання при Щоб спробувати вирішити проблеми 70°С/75% відносної вологості (ВВ) протягом 7 днів пластичності та розчинення в окремо взятій (показані приклади - для варіантів по 100мг). лікарській формі, була створена ще одна Дані вказують, що композиція лікарської композиція лікарської форми, що включає крихкий форми, що містить практично нерозчинну наповнювач для поліпшення властивостей мікрокристалічну целюлозу забезпечує більш стиснення та вільно розчинний наповнювач для швидке розчинення та більшу стабільність після поліпшення розпадаємості та розчинення. зберігання при високій температурі та вологості. Для цієї композиції лікарської форми як Згідно із даним винаходом надається крихкий наповнювач використовувався фармацевтична композиція, що включає ZD6474 гідрофосфат кальцію, а як вільно розчинний або його фармацевтично прийнятну сіль, крихкий наповнювач -моногідрат лактози. Ця випробувана розріджувач і другий розріджувач, що є практично композиція лікарської форми включала: нерозчинним та має пластичність при стисненні. 9 81732 Крихкий розріджувач або наповнювач переважно є такою неорганічною сполукою, що містить кальцій або магній, такою як гідрофосфат кальцію, фосфат кальцію, безводний фосфат кальцію, карбонат кальцію, сульфат кальцію або оксид магнію. В одному аспекті даного винаходу крихкий розріджувач являє собою гідрофосфат кальцію. В іншому аспекті даного винаходу крихкий розріджувач являє собою фосфат кальцію. Практично нерозчинні розріджувачі або наповнювачі із пластичністю при стисненні включають мікрокристалічну целюлозу (мкц), крохмаль, етилцелюлозу та карбоксиметилцелюлозу. В одному аспекті даного винаходу практично нерозчинний розріджувач із пластичністю при стисненні являє собою мікрокристалічну целюлозу. Відповідно, співвідношення маси ZD6474 або його фармацевтично прийнятної солі, до крихкого наповнювача становить від 1:0,5 до 1:7, наприклад, від 1:1 до 1:6, зокрема від 1:1 до 1:4, і найбільше переважно від 1:1 до 1:2. Відповідно, співвідношення маси практично нерозчинного наповнювача із пластичністю при стисненні до крихкого наповнювача становить від 1:3 до 1:12, наприклад, від 1:3,5 до 1:10, зокрема від 1:4 до 1:4,5. Відповідно, фармацевтична композиція містить наприклад, від 20 до 80%, зокрема від 30 до 55%, головним чином від 40 до 50%, особливо від 40 до 45% за масою, у перерахунку на загальну масу композиції, крихкого розріджувача. Відповідно, фармацевтична композиція містить наприклад, від 0,1 до З30%, переважно від 2 до 15%, зокрема від 3 до 12%, головним чином від 4 до 11%, особливо від 5 до 10% за масою, у перерахунку на загальну масу композиції, практично нерозчинного розріджувача із пластичністю при стисненні. Фармацевтичні композиції даного винаходу переважно представлені в дозованій лікарській формі. ZD6474 буде, як правило, вводиться теплокровній тварині в дозі в межах діапазону, 5 5000 мг на квадратний метр площі тіла тварини, тобто приблизно 0,1-100 мг/кг. Передбачено дозу в діапазоні, наприклад, 1-100 мг/кг, переважно 1-50 мг/кг, і ця кількість звичайно забезпечує терапевтично ефективну дозу. Дозована лікарська форма, така як таблетки або капсули, буде звичайно містити, наприклад 1 - 500 мг активного компоненту, переважно 40 - 400 мг. Таким чином, композиція може містити від 1мг до 500 мг ZD6474 або його фармацевтично прийнятної солі. Прийнятні кількості ZD6474 або його фармацевтично прийнятної солі, становлять, наприклад, 1, 10, 50, 100, 150, 200, 250, 300, 350, 400, 450 або 500мг, залежно від необхідної дози та конкретної форми фармацевтичної композиції. В одному аспекті даного винаходу фармацевтична композиція містить 50, 100, 150, 200, 300 або 400 мг ZD6474 або його фармацевтично прийнятної солі. 10 Як правило, ZD6474 або його фармацевтично прийнятна сіль, будуть присутні в кількості, що знаходиться в межах діапазону від 1 до 99%, і відповідно від 1 до 70%, наприклад, від 5 до 65% та особливо від 10 до 60% за масою фармацевтичної композиції. Відповідно до іншого аспекту даного винаходу пропонується фармацевтична композиція, що містить ZD6474 або його фармацевтично прийнятну сіль, крихкий розріджувач, др угий розріджувач, що є практично нерозчинним та має пластичність при стисненні, та дезінтегрант. До прийнятних дезінтегрантів відносяться речовини, відомі в галузі приготування лікарських форм, такі як перераховані в Посібнику з Фармацевтичних допоміжних речовин [The Handbook of Pharmaceutical Excipients, 4-те видання, ред.. Rowe, R. С. та інші, Pharmaceutical Press, 2003]. Кращі дезінтегранти включають крохмальний гліколят натрію, кросповідон, кроскармелозу натрію та крохмаль. Прийнятне співвідношення маси ZD6474 або його фармацевтично прийнятної солі до дезінтегранту становить від 2:1 до 20:1, зокрема від 3:1 до 15:1, більш конкретно від 4:1 до 10:1 і найбільше конкретно від 6:1 до 9:1. Відповідно, фармацевтична композиція буде містити від 0,01 до 10%, наприклад, від 1 до 8%, зокрема від 2 до 7% і більш конкретно від 3 до 6% за масою дезінтегранту. У фармацевтичну композицію згідно із даним винаходу можуть бути необов'язково включені інші додаткові допоміжні речовини. До додаткових допоміжних речовин відносяться, наприклад, зв'язуючі речовини, змочувальні речовини та любриканти. Відповідно до іншого аспекту даного винаходу пропонується фармацевтична композиція, що містить ZD6474 або його фармацевтично прийнятну сіль, крихкий розріджувач, др угий розріджувач, що є практично нерозчинним та має пластичність при стисненні, дезінтегрант та одну або більше змочувальних речовин, зв'язуючих речовин і любрикантів. Відповідно до іншого аспекту даного винаходу пропонується тверда фармацевтична композиція для перорального застосування, що містить ZD6474 або його фармацевтично прийнятну сіль, крихкий розріджувач, другий розріджувач, що є практично нерозчинним та має пластичність при стисненні, дезінтегрант та одну або більше змочувальних речовин, зв'язуючи х речовин та любрикантів. Відповідно одна або більше зв'язуючих речовин будуть присутні в кількості від 0,5 до 50% за масою, наприклад, від 1 до 10% за масою. Відповідно одна або більше змочувальних речовин будуть присутні в кількості від 0,01 до 10%, наприклад, від 0,01 до 1% за масою. Відповідно один або більше любрикантів будуть присутні в кількості від 0,1 до 10% за масою, наприклад, від 0,5 до 1,5% за масою. До ще однієї гр упи додаткових допоміжних речовин, які можуть бути додані, відносяться консерванти, стабілізатори, антиоксиданти, 11 81732 покращувачі текучості кремнезему, антиадгезиви або гліданти. Певна фармацевтична композиція даного винаходу включає: (a) від 1 до 70 (зокрема від 5 до 50) частин ZD6474 або його фармацевтично прийнятної солі; (b) від 1 до 96 (зокрема від 10 до 70) частин крихкого розріджувача; та (c) від 0,1 до 20 (зокрема від 1 до 15) частин другого розріджувача, що є практично нерозчинним та має пластичність при стисненні; де всі частини зазначені за масою, а сума частин (а) + (b) + (с) = 100. Інша конкретна фармацевтична композиція даного винаходу включає: (a) від 1 до 70 (зокрема від 5 до 50) частин ZD6474 або його фармацевтично прийнятної солі; (b) від 1 до 96 (зокрема від 10 до 70) частин крихкого розріджувача; (c) від 0,1 до 20 (зокрема від 1 до 15) частин другого розріджувача, що є практично нерозчинним та має пластичність при стисненні; (d) від 0,1 до 12 (зокрема від 1 до 10) частин дезінтегранту; (є) від 0 до 5 (зокрема від 0 до 2) частин змочувальної речовини; (f) від 0,01 до 8 (зокрема від 0,05 до 5) частин зв'язуючої речовини; та (g) від 0,01 до 8 (зокрема від 0,05 до 5) частин любриканту; де всі частини зазначені за масою, а сума частин (а) + (b) + (с) + (d) + (є) + (f) + (g) = 100. Якщо фармацевтична композиція відповідно до винаходу є твердою дозованою формою, такою як таблетки, пелети або гранули, тверда композиція необов'язково може додатково включати прийнятну оболонку, наприклад, плівкову оболонку. Оболонка може використовува тися для забезпечення захисту, наприклад, від дії вологості або розкладання при світлі, для фарбування лікарської форми або, щоб модифікувати або контролювати вивільнення ZD6474 з лікарської форми. Відповідно до одного аспекту даного винаходу пропонується фармацевтична композиція, що включає ядро, яке містить ZD6474 або його фармацевтично прийнятну сіль, крихкийрозріджувач, др угий розріджувач, що є практично нерозчинним та має пластичність при стисненні, і оболонку. Термін «гарні властивості стиснення» стосується механічних властивостей матеріалу або суміші порошкоподібних компонентів. Матеріал з гарними властивостями стиснення буде затвердівати під стискальним зусиллям з утворенням "спресованої форми", що має необхідну твердість, не має схильності до руйнування при механічному перемішуванні, не схильна до розшаровування, і може бути сформована на більш високих швидкостях обробки, де швидкості натягу вище, а період часу, відведений для стиснення, коротше. Термін «необхідна твердість» означає достатню механічну силу, що буде охороняти спресовану форму від руйн ування при наступній 12 обробці або транспортуванні. Цей показник пов'язаний з розміром таблетки, і при вимірюванні в кілопондах (кр), як правило, становить не менше 0,8 x діаметр таблетки (мм), переважно не менше 1 x діаметр таблетки, більш переважно не менш 1,1 x діаметр таблетки, зокрема не менше 1,2 x діаметр таблетки, особливо не менш 1,3 x діаметр таблетки. Чим більше твердість, тим більш міцна таблетка, але при дуже високому рівні твердості період розпадаємості може бути неприпустимо великим. Термін «розшаровування» означає повне або часткове відділення блюдцеподібного диску від верхньої або нижньої поверхні таблетки при стисненні матеріалу для утворення таблетки або протягом наступних процесів та/або обробки. Відшарування описане в [Carstensen, J. Т., Solid pharmaceutics: mechanical properties and rate phenomena., Academic press, New York (1980) та у Sheth та інші., Pharmaceutical dosage forms: Tablets, том 1. Ред.. Liebermann та Lachmann, Pub. Marcel Dekker, New York (1980)]. Термін «старанність» означає явище, при якому поверхні таблетки руйнуються та/або демонструють ознаки розтріскування або розламу внаслідок механічного перемішування (наприклад, при обробці, маніпуляціях з ними або транспортуванні). Термін «розпадаємість» означає процес, внаслідок якого таблетка розпадається на складові частини при контакті з рідиною. Термін «відповідний час розпадаємості" означає, наприклад, час розпадаємості менше 12 хвилин, бажано менше 10 хвилин, зручно менше 9 хвилин, переважно менше 8 хвилин, більш переважно менше 7 хвилин, зокрема менше 6 хвилин, більш конкретно менше 5 хвилин та особливо менше 4 хвилин. Термін «розчинення» означає процес, при якому розчиняються частки діючої речовини. Для всмоктування діючої речовини, воно повинне спочатку розчиниться в рідині в місці всмоктування. Термін «високе навантаження діючої речовини» означає, що таблетки з високою дозою, наприклад, більше 300мг, можуть бути зроблені такого розміру, що їх можуть проковтнути пацієнти. Наприклад, навантаження діючої речовини 40% ZD6474 дозволяє одержати таблетку по 200мг із масою стиснення, тобто загальною вагою таблетки, 500мг, що у діаметрі мають 11мм. Термін «крихкий», як «крихкий розріджувач», означає, що матеріал має тиск текучості (Ру), що дорівнює більше ніж 300МПа та/або чутливість до швидкості деформації від 0 до 10%. Термін «пластичний» як «пластичність при стисненні» означає, що матеріал має тиск текучості менше 150 МПа, переважно менше ніж 120МПа, особливо менше ніж 100МПа та/або має чутливість до швидкості деформації від 10 до 150%, переважно від 10 до 100%, особливо від 30 до 80%. Термін «вільно розчинний» та «практично нерозчинний» описані в Британській Фармакопеї 2001-2002 р. та використовуються для опису 13 81732 кількості речовини (матеріалу), що може бути розчинена у воді при температурі 15 - 25°С. Повний набір визначень представлений у Таблиці 1. 14 стисненні, і, необов'язково, інших допоміжних речовин для одержання гомогенної суміші; (b) додавання прийнятної рідини до порошків при змішуванні до одержання прийнятної вологої маси; (c) висушування суміші. Таблиця 1 Згідно із даним винаходом пропонується Визначення розчинності у воді спосіб виготовлення фармацевтичної композиції, що містить ZD6474 або його фармацевтично прийнятну Приблизний об'єм води в сіль, що включає: Міліграми на мілілітр Описовий термін (a) змішування ZD6474, крихкого мілілітрах на грам (мг/мл) розріджувача, такого як гідрофосфат кальцію, речовини другого розріджувача, що є практично Дуже добре розчинний Менше ніж 1 > 1000 нерозчинним та має 100 до 1000 при стисненні, Вільно розчинний Від 1 до 10 Від пластичність такого як мікрокристалічна целюлоза, Розчинний Від 10 до 30 Від 33,3 до 100 необов'язково, з іншимидо 33,3 Помірно розчинний Від 30 до 100 Від 10 розріджувачами, такими як кросповідон і Від 1 до 10 разом у прийнятній повідон, Незначно розчинний Від 100 до 1000 Дуже незначно Від 1000 до 10000 ємкості, такій як гранулятор1 з великим зусиллям Від 0,1 до зсуву, для одержання гомогенної суміші; розчинний (b) додавання
ДивитисяДодаткова інформація
Назва патенту англійськоюPharmaceutical composition comprising zd6474
Автори англійськоюScott Pol William
Назва патенту російськоюФармацевтическая композиция, содержащая zd6474
Автори російськоюСкотт Пол Вилльям
МПК / Мітки
МПК: A61P 35/00, A61K 31/517, A61K 47/38, A61K 47/02
Мітки: zd6474, композиція, фармацевтична, містить
Код посилання
<a href="https://ua.patents.su/11-81732-farmacevtichna-kompoziciya-shho-mistit-zd6474.html" target="_blank" rel="follow" title="База патентів України">Фармацевтична композиція, що містить zd6474</a>
Попередній патент: Фунгіцидна суміш для боротьби з патогенними грибами та засіб, спосіб боротьби, посівний матеріал, застосування сполук у суміші
Наступний патент: Адсорбент для очистки води від органічних забруднень та спосіб його одержання (варіанти)
Випадковий патент: Електронна система для проведення торгів "шоу-біржа"