Фармацевтична композиція для використання в ветеринарній медицині “коцефен 200″
Формула / Реферат
1. Фармацевтична композиція для використання в ветеринарній медицині, що містить діючі речовини і допоміжні речовини, яка відрізняється тим, що як діючі речовини містить антибіотики цефалоспоринового ряду та нестероїдний протизапальний препарат групи похідних пропіонової кислоти при наступному співвідношенні компонентів, мас. %:
антибіотики цефалоспоринового ряду
0,1-20
нестероїдний протизапальний препарат групи похідних пропіонової кислоти
0,1-30
допоміжні речовини
решта.
2. Фармацевтична композиція за п. 1, яка відрізняється тим, що допоміжні речовини містять щонайменше одну речовину, вибрану з групи, що включає стабілізатори, консерванти, антиоксиданти.
3. Фармацевтична композиція за п. 1, яка відрізняється тим, що застосовується для лікування інфекцій, викликаних грампозитивними та грамнегативними мікроорганізмами, включаючи штами, які продукують бета-лактамазу і деякі анаеробні бактерії.
Текст
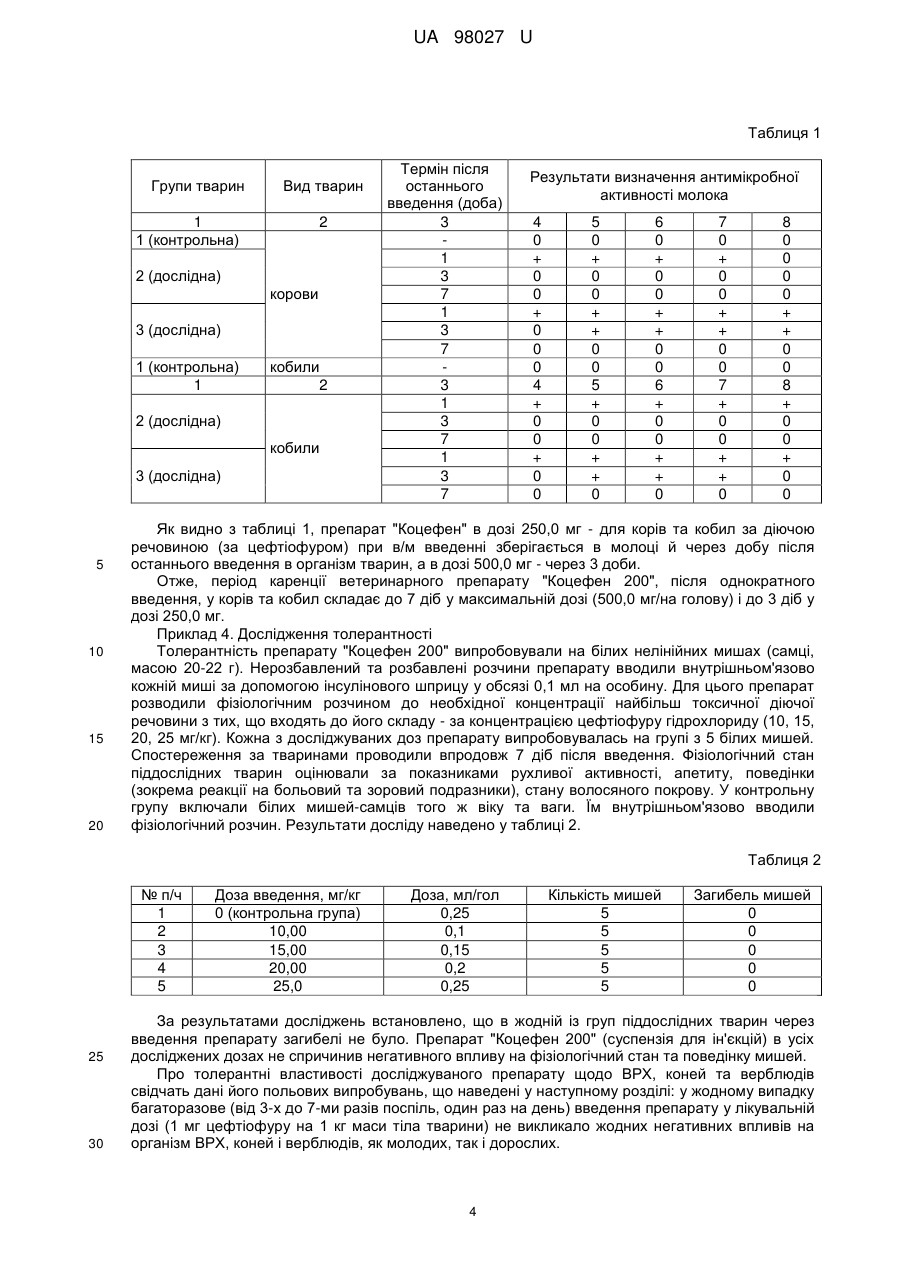
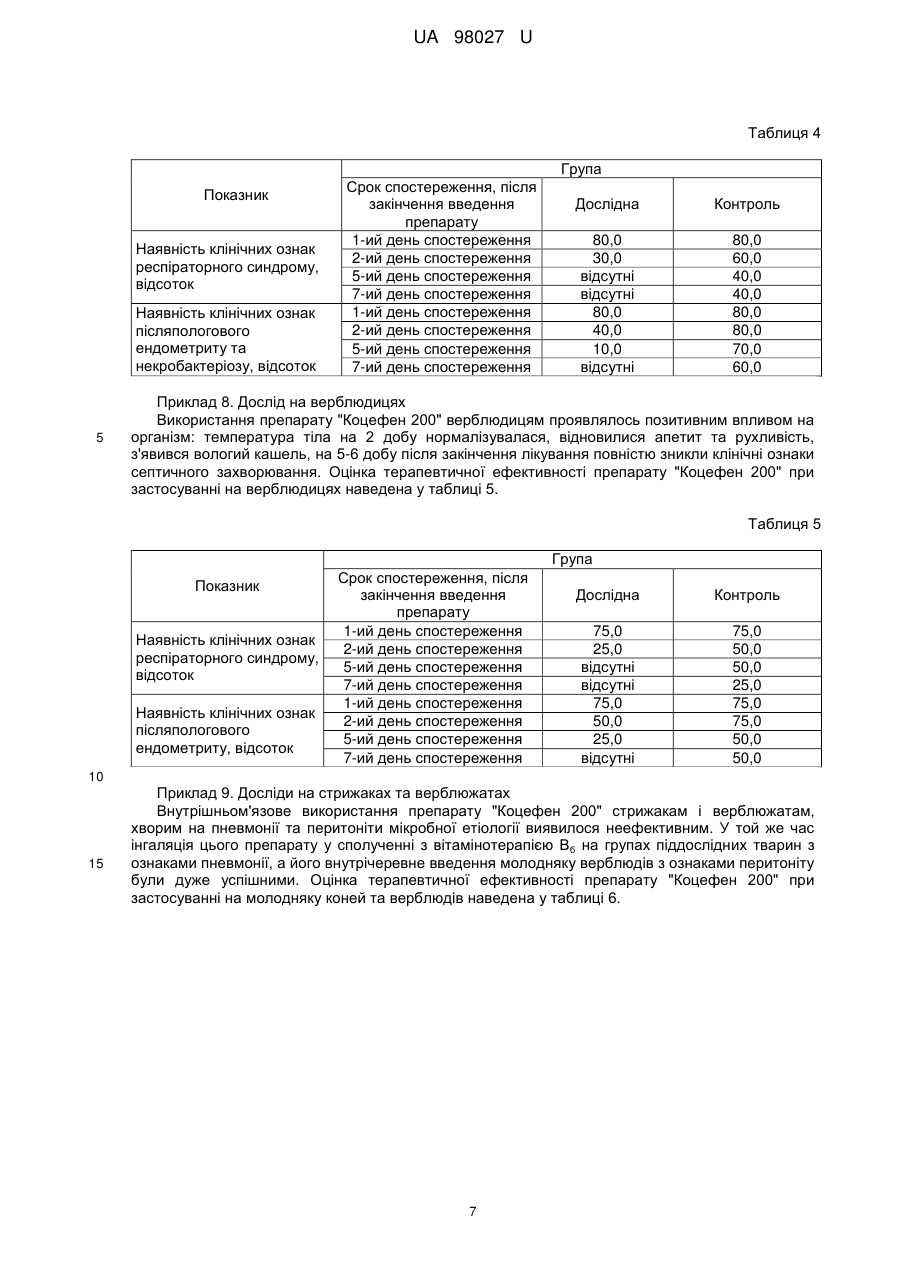
Реферат: UA 98027 U UA 98027 U 5 10 15 20 25 30 35 40 45 50 55 Корисна модель належить до ветеринарії, а саме до фармацевтичних композицій, призначених для лікувальної обробки великої рогатої худоби, коней та верблюдів, хворих на післяпологові ендометрити, некробактеріози, а також при захворюваннях органів дихання, викликаних мікроорганізмами (Pasteurella haemolytica, Pasteurella multocida, Haemophilus somnus, Streptococcus agalactiae, S. dysgalactiae, S. bovis, Escherichia coli, Fusobacterium necrophorum і Bacteroides melaninogenicus), чутливими до цефтіофуру та при комплексному лікуванні тварин при гострих та хронічних формах запальних процесів скелетно-м'язової системи, молочних залоз, а саме застосовується для лікування інфекцій, викликаних грампозитивними та грамнегативними мікроорганізмами, включаючи штами, які продукують бета-лактамазу і деякі анаеробні бактерії. Ендометрит це запалення слизової оболонки матки. За перебігом буває гострим і хронічним, за проявом клінічно вираженим і субклінічними (прихованим), за характерам ексудатів - серозні, катаральні, гнійні, фібринозні. Гострий післяпологовий ендометрит буває: катаральний, гнійнокатаральний і фібринозний. Основними причинами розвитку ендометритів є стрептококи, стафілококи, диплококи, кишкова і паратифозна палички, збудники вібріозів, трихомонозу, бруцельозу і туберкульозу. Лікування при ендометритах повинно бути спрямоване на виведення ексудату, який містить мікроби, їх токсини і продукти розпаду тканин; відновлення або посилення скорочувальної здатності матки; підвищення захисних сил організму і регенеративних процесів в матці. Відомі біологічні та фармакологічні препарати: пітуїтрин і окситоцин. Нейротропні препарати - 0,1-процентний розчин карбахоліну або 0,5-процентний розчин прозерину по 2-3 мл; 1процентний масляний розчин синестролу 2-4 мл; бревіколлін в дозі 0,6 мг на 1 кг ваги у вигляді 1-процентного розчину - всі ці препарати вводять підшкірно або внутрішньом'язово, введення повторюють через 12 годин. При будь-якому застосуванні хіміотерапевтичних і антибіотичних препаратів для лікування тварин, хворих післяродовими ендометритами, спостерігається подразнююча дія багатьох антимікробних препаратів на слизову оболонку матки, розвивається стійкість мікробів до цих препаратів. Крім того, ці речовини акумулюються в різних тканинах і органах, виділяються з молоком і продукти не можуть бути використані в їжу людям тривалий час. Водночас етіотропну терапію в багатьох випадках не можна виключити із загальної комплексної схеми лікування через високу вірулентності мікробів. Останнім часом при лікуванні почали розробляти і використовувати препарати мікробного походження. Встановлена висока терапевтична ефективність препарату ВІЖУС, який являє собою суспензію вбитих штамів різних серотипів синьогнійної палички. Препарат вводять внутрішньоматочно по 50-100 мл на одну обробку з інтервалом 24 години. Високий терапевтичний ефект обумовлений тим, що лімфоцити, сенсибілізовані до штаму синьогнійної палички певного серотипу, при повторному контакті з убитими мікробами цього ж імунотипами, виділяють бактерицидні фактори, що вбивають синьогнійну паличку. Високий терапевтичний ефект мають препарати метритах і тілозинокар. Метритах - це комплексний препарат, що містить тилозину тартрат, карбахолін, кислоту аскорбінову та основу. Являє собою однорідну рідину жовтуватого кольору. Тілозинокар складається з тилозину тартрату, карбахоліну, кароліну та основи. Препарати мають широкий спектр протимікробної дії, посилюють скоротливу функцію матки і сприяють регенерації слизової оболонки матки. Застосовуються метритах і тілозинокар внутрішньоматково за допомогою шприца Жане, до якого за допомогою гумової трубки приєднана полістиролова піпетка для ректо-цервікального осіменіння корів, з інтервалом 48-72 години, підігрітий до температури 3840 °C, з розрахунку 20 мл на 100 кг маси тіла тварини. Відомий препарат для лікування корів, хворих на ендометрит (UA, № 68200, 26.03.2012, бюл. № 6, А61K9/00), складається з комбінації антибіотиків. Включає комбінацію беталактамних антибіотиків: амоксициліну тригідрат - 0,8 г, клоксациліну натрієву сіль - 0,2 г та інгібітор бета-лактамази клавуланову кислоту - 0,2 г, жирову основу - до 10 мл, і виготовлений у формі суспензії. Існує препарат для лікування ендометритів у тварин "Міметон" (UA, № 67070, 15.06.2004, бюл. № 6, A61D 1/00) містить окситоцин та олійний розчин естрадіолу дипропіонату. Препарат додатково містить нафтизин, прозерин, вітаміни (А, Д 3, Е), 10 % ефірний розчин лецитину, NaCl і твін. Відома ветеринарна композиція для профілактики та лікування післяродових ендометритів у корів "Азокаптрин" (UA, № 13403, 30.04.1999, бюл. № 2, А61К 31/535), що включає активні компоненти та основу. Як активні компоненти використані морфолін 3-метил-1,2,4-триазоліл-5 1 UA 98027 U 5 10 15 20 25 30 35 40 45 50 тіоацетат і 2-меркаптобензтіазол. Як основа використана гідрогенізована соняшникова олія з емульгатором Т-І. Але враховуючи велику разову дозу препарату, що вводиться і кількість доз до повного одужання, витрати на лікування значні, тривалість же сервіс-періоду скорочується мало, оскільки цьому не сприяють больові відчуття пережиті коровою при зведенні їй препарату. Також ці препарати мають вузьку дію, лише на корів. В основу корисної моделі поставлено задачу удосконалення фармацевтичної композиції, в якої за рахунок зміни складу композиції досягається активність для лікувальної обробки великої рогатої худоби, коней та верблюдів, хворих на післяпологові ендометрити, некробактеріози, а також при захворюваннях органів дихання, викликаних мікроорганізмами (Pasteurella haemolytica, Pasteurella multocida, Haemophilus sommus, Streptococcus agalactiae, S. dysgalactiae, S. bovis, Escherichia coli, Fusobacterium necrophorum і Bacteroides melaninogenicus), чутливими до цефтіофуру та при комплексному лікуванні тварин при гострих та хронічних формах запальних процесів скелетно-м'язової системи, молочних залоз, для лікування інфекцій, викликаних грампозитивними та грамнегативними мікроорганізмами, включаючи штами, які продукують бета-лактамазу і деякі анаеробні бактерії. Поставлена задача вирішується тим, що фармацевтична композиція для використання в ветеринарній медицині "Коцефен 200", містить як діючі речовини - антибіотики цефалоспоринового ряду та нестероїдний протизапальний препарат групи похідних пропіонової кислоти, і допоміжні речовини, причому допоміжні речовини містять щонайменше одну речовину, вибрану з групи, що включає стабілізатори, консерванти, антиоксиданти, при наступному співвідношенні компонентів, мас. %: антибіотики цефалоспоринового 0,1-20 ряду нестероїдний протизапальний препарат групи похідних 0,1-30 пропіонової кислоти допоміжні речовини решта. Діючими речовинами препарату є антибіотик цефтіофур, у формі цефтіофуру гідрохлориду, який відноситься до групи цефалоспоринів III покоління, та кетопрофен, як нестероїдний протизапальний засіб. Цефтіофур активний проти грампозитивних і грамнегативних бактерій, включаючи штами, які продукують бета-лактамазу і деякі анаеробні бактерії: Escherichia coli, Pasteurella haemolytica, Pasteurella multocida, Haemophilus somnus, Actinobacillus pleuropneumoniae, Haemophilus parasuis, Salmonella cholerasuis, Streptococcus suis, Streptococcus zooepidemicus, Actynomyces pyogenes, Salmonella typhimurium, Streptococcus agalactiae, S. dysgalactiae, S. bovis, Fusobacterium necrophorum та Porphiromonas assacharolytica (Bacteroides melaninogenicus). Механізм дії цефтіофура полягає в порушенні синтезу клітинної стінки бактерії, пригнічуючи синтез пептидоглікану. В організмі цефтіофур швидко піддається метаболізму з утворенням десфуроілцефтіофура, який володіє еквівалентною цефтіофуру активністю щодо бактерій. Цей активний метаболіт зворотно зв'язується з білками плазми і накопичується у вогнищі інфекції, при цьому його активність не знижується в присутності некротизованих тканин. Виведення антибіотика відбувається головним чином з сечею і з фекаліями. Кетопрофен нестероїдний протизапальний препарат групи карбонових кислот, похідних пропіонової кислоти. Має протизапальну, знеболювальну та жарознижувальну дії. Кетопрофен є подвійним інгібітором процесу запалення. Механізм дії пов'язаний |із блокуванням синтезу простагландинів, ліпооксигенази, протибрадикініновою активністю, стабілізацією лізосомальних мембран, значним гальмуванням активності Нейтрофілів. Кетопрофен - це знеболювальний засіб, який впливає на центральну та периферійну нервові системи, пригнічує дію брадикініну, вазодилататора та медіатора болю. Понад 98 % кетопрофену зв'язується з білками плазми крові та накопичується у запалених тканинах. У тварин пікові рівні в плазмі (8,025±1,9 мкг/мл) досягаються менш, ніж за одну годину після внутрішньом'язового введення. Істотні концентрації кетопрофену знайдено в синовіальній рідині і його рівень тут вищий, ніж у плазмі, а період напіввиведення у 2-3 рази вищий, ніж у плазмі. Кетопрофен метаболізується у печінці до незначущих біологічно активних метаболітів, а 90 % його виводиться разом із сечею у вигляді сполук глюкуроніду. Спосіб отримання препарату полягає в наступному. В реактор для приготування суспензії вносять розрахункову кількість бавовняного масла, лецитину та сорбітану монооалету та ретельно перемішують. Для найкращого розчинення лецитину та сорбітану монооалету вміст реактору, за потребою, підігрівають. 2 UA 98027 U 5 10 15 20 25 30 35 40 45 50 На вагах відважують і вносять в реактор порціями розрахункову кількість цефтіафуру гідрохлориду, кетопрофену та ретельно перемішують. Об'єм суспензії у реакторі доводять до розрахункового бавовняним маслом і ретельно перемішують з допомогою мішалки протягом 30 хвилин. Отриману суспензію фільтрують через фільтри для видалення механічних домішок та розливають у простерилізовані флакони. Флакони закорковують гумовими пробками та обкатують алюмінієвими ковпачками. Флакони з розчином перевіряють на наявність механічних домішок. Флакони з виявленими механічними домішками бракують, а препарат, що пройшов контроль, маркують, пакують та передають на карантинний склад. Приклад 1. Вивчення антимікробної активності препарату "Коцефен 200" Антимікробну активність перевіряли диско-дифузійним методом на щільному поживному середовищі. На поверхню чашки Петрі наносили бактеріальну суспензію, до складу якої одночасно входили культури бактерій Pasteurella spp, Salmonella spp, Streptococcus spp. Встановлено, що оптимальна концентрація, яка пригнічувала ріст бактерій складала 1,0 %. Зона затримки росту для бактерій складала 30 мм, тобто мікроорганізми були високочутливі до препарату "Коцефен 200" в 1,0 % концентрації. Приклад 2. Токсикологічні властивості препарату "Коцефен 200" Гостру токсичність визначали на білих мишах. Було сформовано і 3 групи тварин вагою 183 20 гр. (n=5). Препарат задавали внутрішньом'язово у дозі 0,5 см у концентраціях 0,5 %, 1 % та 3 %. За лабораторними тваринами спостерігали 10 діб. За весь період спостереження загибелі дослідних тварин, які отримували препарат у зазначених вище концентраціях не було зареєстровано. Хронічну токсичність вивчали на білих мишах при тривалому в/м введенні препарату в дозі 3 0,2 см в тих самих концентраціях. Для досліду сформували 3 групи тварин (n=10). Препарат вводили впродовж тижня, щоденно. За весь період спостереження у мишей, яким застосовували препарати у концентраціях 0,5 % та 1 % не реєстрували змін в загальному клінічному стані. У тварин зберігався апетит, вони були активні, рухливі, шерсть гладка і блискуча. Впродовж проведення досліду ознаки отруєння були відсутні. У лабораторних тварин, яким вводили препарат в концентрації 3 % спостерігали пригнічення, схуднення, відсутність апетиту, що призводило до загибелі. У загиблих мишей на розтині спостерігали дегенеративні та дистрофічні зміни в печінці й нирках, гіперплаcтичні процеси в перибронхіальній тканині. Приклад 3. Для визначення залишків препарату "Коцефен 200" в молоці оброблених ним тварин, використовували варіант мікробіологічного методу "скринінг-тест STOP", розроблений американськими вченими і який широко застосовується в США на м'ясопереробних підприємствах та бойнях. У досліді дійним коровам та кобилам в/м вводили терапевтичні дози препарату "Коцефен". Було сформовано по 3 групи корів та кобил по 5 голів у кожній. Перша група була контрольною (без оброблення). Корови та кобили другої дослідної групи отримували внутрішньом'язово по 5 мл суспензії препарату "Коцефен", виробництва ТОВ "Ветсинтез" (Харків, Україна), в 1 мл якого міститься 50,0 мг цефтіофура гідрохлориду та 150,0 мг кетопрофену. Препарат вводили у дозі 250,0 мг діючої речовини (за цефтіофуром). Коровам та кобилам третьої дослідної групи аналогічно вводили препарат, але в дозі 500,0 мг на голову. Препарат вводили піддослідним тваринам однократно. Наступної доби, через 3 та 7 діб після останнього введення препарату "Коцефен" проводили відбір молока. Ватний тампон занурювали у кожну пробу молока, після цього тампони щільно накладали на агарову пластину чашки Петрі, засіяну тест-мікроорганізмом Pasteurella multocida. Для контролю якості поживного середовища та тест-культури на агарову пластину також клали стандартний диск з неоміцином (5 мг). Після інкубації чашок Петрі впродовж 18 год. за температури 29 °C визначали розміри зон затримки росту тест-культури навколо тампонів та диску з неоміцином (діаметр зони затримки росту навколо диску повинен становити 22-29 мм). Якщо спостерігалась зона інгібіції навколо тампона, результат тесту вважався позитивним, тобто в молоці присутня речовина - інгібітор росту тест-мікроорганізму. Тест вважався негативним, коли зона інгібіції не спостерігалася, що свідчило про відсутність у молоці залишків антимікробних препаратів чи про їх присутність в концентраціях, нижчих за нижній рівень чутливості методи (таблиця 1). 55 3 UA 98027 U Таблиця 1 Групи тварин Вид тварин 1 1 (контрольна) 2 2 (дослідна) корови 3 (дослідна) 1 (контрольна) 1 кобили 2 2 (дослідна) кобили 3 (дослідна) 5 10 15 20 Термін після останнього введення (доба) 3 1 3 7 1 3 7 3 1 3 7 1 3 7 Результати визначення антимікробної активності молока 4 0 + 0 0 + 0 0 0 4 + 0 0 + 0 0 5 0 + 0 0 + + 0 0 5 + 0 0 + + 0 6 0 + 0 0 + + 0 0 6 + 0 0 + + 0 7 0 + 0 0 + + 0 0 7 + 0 0 + + 0 8 0 0 0 0 + + 0 0 8 + 0 0 + 0 0 Як видно з таблиці 1, препарат "Коцефен" в дозі 250,0 мг - для корів та кобил за діючою речовиною (за цефтіофуром) при в/м введенні зберігається в молоці й через добу після останнього введення в організм тварин, а в дозі 500,0 мг - через 3 доби. Отже, період каренції ветеринарного препарату "Коцефен 200", після однократного введення, у корів та кобил складає до 7 діб у максимальній дозі (500,0 мг/на голову) і до 3 діб у дозі 250,0 мг. Приклад 4. Дослідження толерантності Толерантність препарату "Коцефен 200" випробовували на білих нелінійних мишах (самці, масою 20-22 г). Нерозбавлений та розбавлені розчини препарату вводили внутрішньом'язово кожній миші за допомогою інсулінового шприцу у обсязі 0,1 мл на особину. Для цього препарат розводили фізіологічним розчином до необхідної концентрації найбільш токсичної діючої речовини з тих, що входять до його складу - за концентрацією цефтіофуру гідрохлориду (10, 15, 20, 25 мг/кг). Кожна з досліджуваних доз препарату випробовувалась на групі з 5 білих мишей. Спостереження за тваринами проводили впродовж 7 діб після введення. Фізіологічний стан піддослідних тварин оцінювали за показниками рухливої активності, апетиту, поведінки (зокрема реакції на больовий та зоровий подразники), стану волосяного покрову. У контрольну групу включали білих мишей-самців того ж віку та ваги. Їм внутрішньом'язово вводили фізіологічний розчин. Результати досліду наведено у таблиці 2. Таблиця 2 № п/ч 1 2 3 4 5 25 30 Доза введення, мг/кг 0 (контрольна група) 10,00 15,00 20,00 25,0 Доза, мл/гол 0,25 0,1 0,15 0,2 0,25 Кількість мишей 5 5 5 5 5 Загибель мишей 0 0 0 0 0 За результатами досліджень встановлено, що в жодній із груп піддослідних тварин через введення препарату загибелі не було. Препарат "Коцефен 200" (суспензія для ін'єкцій) в усіх досліджених дозах не спричинив негативного впливу на фізіологічний стан та поведінку мишей. Про толерантні властивості досліджуваного препарату щодо ВРХ, коней та верблюдів свідчать дані його польових випробувань, що наведені у наступному розділі: у жодному випадку багаторазове (від 3-х до 7-ми разів поспіль, один раз на день) введення препарату у лікувальній дозі (1 мг цефтіофуру на 1 кг маси тіла тварини) не викликало жодних негативних впливів на організм ВРХ, коней і верблюдів, як молодих, так і дорослих. 4 UA 98027 U 5 10 15 20 25 30 35 40 45 50 55 60 Приклад 5. Ефективність клінічного застосування препарату "Коцефен 200" За результатами лабораторних досліджень з використанням диско-дифузійного методу (диски виготовляли з цільного препарату) було доведено, що препарат "Коцефен 200" бактерицидно діє на агарові колонії польових ізолятів бактерій Pasteurella haemolytica, Pasteurella multocida, Haemophilus somnus, Streptococcus agalactiae, S. dysgalactiae, S. bovis, Escherichia coli й Fusobacterium necrophorum, виділених у 2008-2013 рр. з патологічних та клінічних матеріалів від ВРХ, овець і свиней з господарств центральних та східних регіонів України. Зокрема була встановлена висока бактерицидна активність цього препарату ("3+") у відношенні ізолятів Streptococcus bovis та Fusobacterium necrophorum, виділених від хворих на післяродові ендометрити, мастити та панариції корів у піддослідному молочнотоварному господарстві Харківської області. Ще вищу активність препарату ("4+") виявлено у відношенні ізоляту Streptococcus zooepidemicus, виділеного у 2014 році від хворих на гострі кишкові розлади та перитоніт верблюжат та від хворих на підгострі форми риніту коней і пневмонії лошат-стрижаків, які спільно утримувалися у Харківському міському зоопарку. До препарату "Коцефен 200" також був високочутливим (на рівні "3+") ізолят збудника Pasteurella multocida, виділений у 2014 році від верблюжат, конематок і лошат-стрижаків, хворих на хронічну респіраторну інфекцію, які спільно утримувалися в зоопарку науково-навчального центру Харківської державної зооветеринарної академії (відомчий зоопарк). Для вивчення лікувальної ефективності препарату "Коцефен 200" у кожному господарстві було сформовано по 2 групи клінічно хворих тварин кожного виду (корови, кобили, верблюдиці): першій групі препарат застосовували внутрішньом'язово у дозі 1 мл на 50 кг живої маси тварини (1 мг цефтіофуру та 3 мг кетопрофену на 1 кг маси тіла). Другій групі тварин вводили 10 % розчин канаміцину сульфат внутрішньом'язово 0,5 мл на 10 кг живої ваги. Лікування препаратом "Коцефен 200" тривало впродовж 5 діб. Ним обробляли по 10 голів хворих на післяпологові ендометрити, некробактерійні панариції та мастити корів (згідно проекту листівки-вкладки на даний препарат) та хворих на риніт кобил, а також 5 верблюдиць з клінічними ознаками часткової втрати апетиту та схуднення і гнилісним запахом відрижки, які були в контакті з хворими на стрептококоз конями і верблюжатами (за тією ж схемою, що й ВРХ). Додатково, сім хворих на стрептококову) пневмонію лошат-стрижаків міського зоопарку лікували препаратом "Коцефен і 200" за допомоги інгаляційного методу: у саморобні індивідуальні мішки-інгалятори з поліетилену, закріплені на морді за допомогою скотчу через капілярні трубки вносили середньодисперсний аерозоль, приготований з суміші складу: 10 мл препарату "Коцефен 200", 1 мл скипидару, фізіологічний розчин - до 50 мл. Генератором аерозолю зазначеної суміші слугував комерційно доступний ручний агрохімічний оприскувач. Інгаляційну обробку кожного з хворих лошат-стрижаків проводили індивідуально, впродовж 1015 хвилин кожного, 1 раз на добу, 5 діб поспіль. Аналогічно ін'єкційним методом обробили 3 дорослих клінічно здорових верблюдів, які були в контакті з хворими на пастерельоз лошатами та верблюжатами у відомчому зоопарку. Хворих на пастерельозну бронхопневмонію лошатстрижаків (n=3) та верблюжат (n=4) цього зоопарку лікували препаратом "Коцефен 200" також за допомоги інгаляційного методу, описаного вище. У той же час трьох хворих на стрептококовий перитоніт верблюжат міського зоопарку лікували препаратом "Коцефен 200" за допомоги методу інтраперитонеальних ін'єкцій: кожній тварині, зафіксованій головою донизу у вертикальному положенні під кутом 45-60°, повільно вводили по 3-5 мл препарату, 1 раз на добу, 5 діб поспіль. Після оброблення препаратом "Коцефен 200" як зазначено вище, всіх тварин "вітамінізували" шляхом введення у м'язи шиї перед лопаткою по 5-7 мл молодняку та 12-15 мл дорослим тваринам комерційно доступного вітаміну В6. За дослідними і контрольними тваринами спостерігали впродовж двох тижнів після останнього застосування препарату. У результаті всіх зазначених вище терапевтичних маніпуляцій післяпологовий ендометрит та інші клінічні ознаки асоційованої інфекції за участі збудника некробактеріозу у оброблених препаратом "Коцефен 200" дійних корів майже повністю (за виключенням залишкових ознак панариціїв) зникли, їхня молочна продуктивність відновилась впродовж тижня після останнього введення препарату. Кобили і верблюдиці, як з міського, так і з відомчого зоопарків, які проявляли ознаки катарально-серозного риніту, почали швидко видужувати вже після другої-третьої ін'єкції препарату "Коцефен 200". Їхній клінічний стан повністю нормалізувався впродовж тижня після останньої ін'єкції. Канаміцину сульфат В той же час лошатам з міського зоопарку і третя внутрішньом'язова ін'єкція ні препарату "Коцефен 200", ні канаміцину сульфату не принесли жодного полегшення. Було прийнято рішення випробувати інгаляційний спосіб введення цього препарату. Вже після першої інгаляції стан всіх 7 стрижаків почав нормалізуватися (зникла лихоманка, частково відновився апетит); після п'ятої інгаляції клінічний стан всіх стрижаків 5 UA 98027 U 5 10 майже повністю нормалізувався: у трьох з семи лошат ще й через два тижні після останньої інгаляції реєстрували приступи "ранкового" кашлю - проте сила його поступово вщухала і температура тіла не підвищувалася. Стрижаки (n=3) та верблюжата (n=4) відомчого зоопарку, яких з самого початку лікували саме методом інгаляції, вже після другого сеансу терапії почали стрімко видужувати і вкінці лікувального курсу не проявляли жодних ознак захворювання. Приклад 6. Дослід на дійних коровах Після застосування препарату "Коцефен 200" серед корів на 3 добу реєстрували зниження температури тіла до норми, сухий кашель змінився на вологий, на 6-7 добу зникли клінічні ознаки післяпологового ендометриту у вигляді переміжної лихоманки у супроводі з піхвовими серозно-катаральними чи катарально-гнійними виділеннями. У той же час, 5-разове внутрішньом'язове введення препарату "Коцефен 200" не призвело до повного видужання молочних корів від асоційованих з некробацильозом хронічних маститів та панариціїв. Оцінка лікувальної ефективності "Коцефен 200" при лікуванні дійних корів наведена у таблиці 3. Таблиця 3 Група Срок спостереження, після закінчення введення Дослідна Контроль препарату 1-ий день спостереження 80,0 80,0 2-ий день спостереження 30,0 60,0 5-ий день спостереження відсутні 30,0 7-ий день спостереження відсутні 30,0 1-ий день спостереження 80,0 100,0 2-ий день спостереження 50,0 100,0 5-ий день спостереження 20,0 100,0 7-ий день спостереження 20,0 100,0 Показник Наявність клінічних ознак післяпологового ендометриту, відсоток Наявність клінічних ознак некробактерійних панариціїв та маститів корів, відсоток 15 20 25 30 Чотирьох корів з хронічними маститами та панариціями одночасно, з числа тих, що не вдалося остаточно вилікувати за терапевтичною схемою, наданою у листівці-вкладці у подальшому, через 10-12 діб після її завершення, піддали обробці методом лімфотропної терапії. Для цього у них на "молочному дзеркалі" ураженого вимені і на шкірі вінчика уражених копит безпечною бритвою видаляли шерсть на ділянках розміром 15×15 мм, обробляли шкіру спиртом і в шкіру вводили розчин лідази (18 УО) на 1 мл 1 %-ного розчину новокаїну. Через 5-7 хвилин після цього у підготовані зазначеним чином ділянки шкіри вводили як внутрішньо, так і підшкірно по 2-3 мл препарату "Коцефен 200". Через 24-30 годин введення комплексного препарату повторювали у той же спосіб. Всі 4 дійні корови з уповільненими формами перебігу інфекційних маститів та панариціїв мікробної етіології повністю видужали на 5-7 добу після другої ін'єкції препарату "Коцефен 200" методом лімфотропної терапії. Приклад 7. Дослід на кобилах Поліпшення загального стану організму у кобил спостерігали на 3 добу після закінчення введення препарату "Коцефен 200". Через 5 діб кобили були активні, відновився апетит, а вологий кашель ("пирхання") і витікання носового слизу (слизові "шнурки" з носа) повністю припинилися на 7 добу після закінчення лікування. Оцінка терапевтичної ефективності препарату "Коцефен 200" при застосуванні на кобилах наведена у таблиці 4. 6 UA 98027 U Таблиця 4 Група Показник Наявність клінічних ознак респіраторного синдрому, відсоток Наявність клінічних ознак післяпологового ендометриту та некробактеріозу, відсоток 5 Срок спостереження, після закінчення введення препарату 1-ий день спостереження 2-ий день спостереження 5-ий день спостереження 7-ий день спостереження 1-ий день спостереження 2-ий день спостереження 5-ий день спостереження 7-ий день спостереження Дослідна Контроль 80,0 30,0 відсутні відсутні 80,0 40,0 10,0 відсутні 80,0 60,0 40,0 40,0 80,0 80,0 70,0 60,0 Приклад 8. Дослід на верблюдицях Використання препарату "Коцефен 200" верблюдицям проявлялось позитивним впливом на організм: температура тіла на 2 добу нормалізувалася, відновилися апетит та рухливість, з'явився вологий кашель, на 5-6 добу після закінчення лікування повністю зникли клінічні ознаки септичного захворювання. Оцінка терапевтичної ефективності препарату "Коцефен 200" при застосуванні на верблюдицях наведена у таблиці 5. Таблиця 5 Група Показник Наявність клінічних ознак респіраторного синдрому, відсоток Наявність клінічних ознак післяпологового ендометриту, відсоток Срок спостереження, після закінчення введення препарату 1-ий день спостереження 2-ий день спостереження 5-ий день спостереження 7-ий день спостереження 1-ий день спостереження 2-ий день спостереження 5-ий день спостереження 7-ий день спостереження Дослідна Контроль 75,0 25,0 відсутні відсутні 75,0 50,0 25,0 відсутні 75,0 50,0 50,0 25,0 75,0 75,0 50,0 50,0 10 15 Приклад 9. Досліди на стрижаках та верблюжатах Внутрішньом'язове використання препарату "Коцефен 200" стрижакам і верблюжатам, хворим на пневмонії та перитоніти мікробної етіології виявилося неефективним. У той же час інгаляція цього препарату у сполученні з вітамінотерапією Вб на групах піддослідних тварин з ознаками пневмонії, а його внутрічеревне введення молодняку верблюдів з ознаками перитоніту були дуже успішними. Оцінка терапевтичної ефективності препарату "Коцефен 200" при застосуванні на молодняку коней та верблюдів наведена у таблиці 6. 7 UA 98027 U Таблиця 6 Група Показник Наявність клінічних ознак пневмонії стрижаків і верблюжат, відсоток Наявність клінічних ознак перитоніту верблюжат, відсоток 5 10 15 20 25 30 35 40 45 Срок спостереження, після закінчення введення препарату 1-ий день спостереження 2-ий день спостереження 5-ий день спостереження 7-ий день спостереження 1-ий день спостереження 2-ий день спостереження 5-ий день спостереження 7-ий день спостереження Дослідна Контроль 25,0 відсутні відсутні відсутні 50,0 5,0 відсутні відсутні 100,0 100,0 100,0 25,0 100,0 100 100,0 100,0 З таблиці видно, що вже на 2-у добу після останньої (5-ї) інгаляції суміші з препаратом "Коцефен 200" стрижакам та верблюжатам, хворим на хронічну інфекційну пневмонію/бронхопневмонію і на 5 добу після останнього (3-го) інтраперитонеального введення цього препарату верблюжатам, хворим на стрептококовий перитоніт будь-які клінічні прояви зазначених захворювань вже були відсутніми. Отримані нами експериментальні результати добре узгоджуються з даними світової та вітчизняної літератури. Так, ефективність введення антибіотиків та інших ліків різним видам продуктивних та домашніх тварин методом регіональної лімфотропної терапії докладно вивчена одеськими та підтверджена російськими фахівцями. Особливість української модифікації цього метода становить застосування для підготовки місця введення антибіотику ферменту лідази, який розкладає гіалуронову кислоту у міжклітинному просторі і тим самим збільшує проникність тканин для лімфи і тих ліків, що в неї потрапляють. Це забезпечує максимальну збереженість структури антибіотиків - адже при внутрішньом'язовому введенні, у процесі їхньої дифузії в кров і лімфу вони потерпають від цілої низки активних чинників, які значно зменшуються їхню первинну активність. Також давно і добре відомі переваги лікування респіраторних захворювань людей і сільськогосподарських тварин методами інгаляції. Антибіотична субстанція цефтіофуру виявилася особливо корисною для лікування бронхопневмоній телят, коней та інших видів саме цим методичним підходом - способом небулізації. Крім того, зі світової клінічно-ветеринарної практики добре відомо, що верблюди й інші камеліди (лами, альпаки тощо) дуже добре сприймають інтраперітонеальне введення антибіотиків для лікування гострих шлунково-кишкових захворювань мікробної і незаразної етіології. Ці дані дозволяють рекомендувати розробникам препарату "Коцефен 200" внести в листівку-вкладку інгаляційний та внутрішньоочеревинний способи введення, як переважні способи лікування коней та камелід (зокрема верблюдів), відповідно, від респіраторних та шлунково-кишкових інфекцій, а лімфотропну терапію - як рекомендовану для лікування некробактерійних маститів та панариціїв ВРХ. Крім того, отримані дані випробувань показали, що застосування препарату "Коцефен 200" у дозах згідно з проектом листівки-вкладки не викликає побічної дії, На організм корів, кобил та верблюдиць і забезпечує одужання від клінічних ознак післяпологового ендометриту, сприяє нормалізації молочної продуктивності а, в подальшому, відновлення відтворювальної функції. Також препарат мав позитивний вплив на організм при лікуванні молодняка тварин (верблюжата та стрижаки). Препарат "Коцефен 200" (суспензія для ін'єкцій) у лікувальних дозах, визначених проектом настанови, є нетоксичним, толерантним як для лабораторних білих мишей, так і для ВРХ, коней і верблюдів від 3-міс. до 7-річного віку, високоактивним при лікуванні зазначених свійських тварин від інфекційно ускладнених метритів, маститів, перитонітів, інфекцій хвороб шкіри, а також органів дихання, викликаних чутливою до цефалоспоринів мікрофлорою. При лікуванні інфекційних пневмоній молодняка коней та верблюдів особливо ефективним виявилося інгаляційне (аерозольне) застосування препарату у комплексі зі скипидаром та у супроводі вітамінотерапії у вигляді внутрішньом'язового введення вітаміну В6. Для лікування інфекційних метритів та інфекційного ураження інших внутрішніх органів тварин, що супроводжуються 8 UA 98027 U 5 перитонітами, доцільно застосовувати інтраперітонеальне введення препарату "Коцефен 200" (суспензії для ін'єкцій). Підгострі та хронічні інфекційні хвороби шкіри тварин (зокрема панариції некробацильозної етіології) і мастити корів інфекційного походження ефективно виліковуються при застосуванні препарату "Коцефен 200" (суспензії для ін'єкцій) методом лімфотропної терапії. ФОРМУЛА КОРИСНОЇ МОДЕЛІ 10 15 1. Фармацевтична композиція для використання в ветеринарній медицині, що містить діючі речовини і допоміжні речовини, яка відрізняється тим, що як діючі речовини містить антибіотики цефалоспоринового ряду та нестероїдний протизапальний препарат групи похідних пропіонової кислоти при наступному співвідношенні компонентів, мас. %: антибіотики цефалоспоринового 0,1-20 ряду нестероїдний протизапальний препарат групи похідних 0,1-30 пропіонової кислоти допоміжні речовини решта. 2. Фармацевтична композиція за п. 1, яка відрізняється тим, що допоміжні речовини містять щонайменше одну речовину, вибрану з групи, що включає стабілізатори, консерванти, антиоксиданти. 3. Фармацевтична композиція за п. 1, яка відрізняється тим, що застосовується для лікування інфекцій, викликаних грампозитивними та грамнегативними мікроорганізмами, включаючи штами, які продукують бета-лактамазу і деякі анаеробні бактерії. Комп’ютерна верстка С. Чулій Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 9
ДивитисяДодаткова інформація
МПК / Мітки
МПК: A61K 31/00
Мітки: ветеринарний, коцефен, використання, фармацевтична, медицині, композиція
Код посилання
<a href="https://ua.patents.su/11-98027-farmacevtichna-kompoziciya-dlya-vikoristannya-v-veterinarnijj-medicini-kocefen-200.html" target="_blank" rel="follow" title="База патентів України">Фармацевтична композиція для використання в ветеринарній медицині “коцефен 200″</a>
Попередній патент: Електромагнітно-акустичний перетворювач для контролю об’єктів складної форми
Наступний патент: Спосіб підвищення продуктивності курчат-бройлерів
Випадковий патент: Спосіб дистанційного визначення характеристик морської поверхні