Спосіб одержання високочистого поліморфу (i) донепезилу гідрохлориду
Номер патенту: 98102
Опубліковано: 25.04.2012
Автори: Грейнер Іштван, Гараднаї Шандор, Неу Йожеф, Чабаї Янош
Формула / Реферат
1. Спосіб одержання високочистого Поліморфу (І) донепезилу гідрохлориду, сполуки, що має Формулу І
 , (І)
, (І)
шляхом гідрогенізації солі 5,6-диметокси-2-(піридин-4-ілметилен)індан-1-ону, проміжної сполуки, що має Формулу IV
 , (IV)
, (IV)
і подальшого бензилування одержаного 4-[(5,6-диметоксі-1-інданон)-2-іл]-метилпіперидину, проміжної сполуки, що має Формулу V
 , (V)
, (V)
і подальших стадій утворення солі шляхом уведення в реакцію основи донепезилу, сполуки, що має Формулу VI
 , (VI)
, (VI)
і подальшої перекристалізації одержаного донепезилу гідрохлориду, сполуки, що має Формулу І, з розчину, що містить спирт з коротким вуглецевим ланцюгом, що включає не більше 4 атомів вуглецю,
згідно з яким:
a) здійснюють указану гідрогенізацію гідрохлориду 5,6-диметокси-2-(піридин-4-ілметилен)індан-1-ону, сполуки, що має Формулу IV, у присутності каталізатора у вигляді Pd на деревному вугіллі, і
b) здійснюють указані стадії утворення солі шляхом уведення в реакцію основи донепезилу, сполуки, що має Формулу VI, з оцтовою кислотою, потім екстрагування солі оцтової кислоти у водну фазу, потім знову перетворення її на основу донепезилу в присутності основи, потім перетворення останньої на донепезилу гідрохлорид, сполуку, що має Формулу І, у присутності хлористого водню, і
с) здійснюють указану перекристалізацію осадженням продукту, Поліморфу (І) донепезилу гідрохлориду, з водного спиртового розчину, що містить 2-18 (об/об) % води, підтримуючи температуру в діапазоні між -10 °С та +10 °С.
2. Спосіб за п. 1, у якому вказана гідрогенізація включає застосування деревного вугілля, що містить 5-15 % паладію, як каталізатора.
3. Спосіб за п. 2, в якому вказана гідрогенізація додатково включає застосування надлишкового тиску 4-6 атм. і температури, рівної 60-80 °С.
4. Спосіб за п. 1, у якому вказані стадії утворення солі здійснюють введенням в реакцію основи донепезилу з оцтовою кислотою в розчині етилацетату й переведенням донепезилу ацетату у водну фазу.
5. Спосіб за п. 1, у якому вказану перекристалізацію здійснюють розчиненням донепезилу гідрохлориду у водному метанолі, що містить 3-5 % (об/об) води.
6. Спосіб за п. 1, у якому вказану перекристалізацію здійснюють додаванням розчину донепезилу гідрохлориду у водному метанолі до осаджувача метил-трет-бутилового ефіру, що містить кристали-затравки Поліморфу (І).
Текст
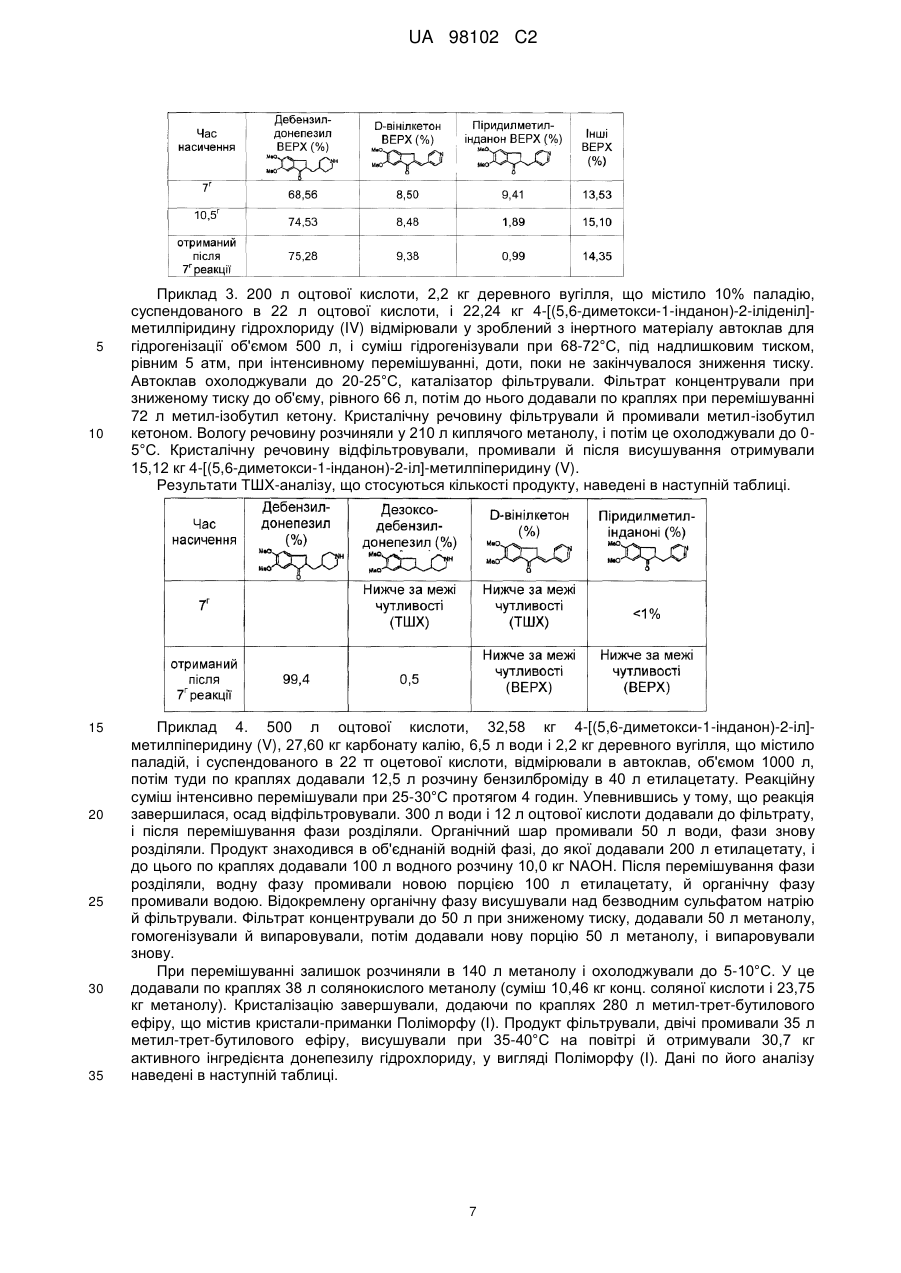
Реферат: Даний винахід пропонує новий, можливий для реалізації в промисловості й економічно переважний спосіб одержання високочистого гідрохлориду 1-бензил-4-[(5,6-диметоксі-1інданон)-2-іл]метилпіперидину, тобто донепезилу гідрохлориду, наведеного на наступній реакційній схемі, в морфологічній кристалічній формі Поліморфу (І). На одній з ключових стадій способу, в ході гідрогенізації, застосовуючи Pd на вугіллі, насичували гідрохлорид 5,6-диметокси-2-(піридин-4-ілметилен)індан-1-ону й отримували 4[(5,6-диметоксі-1-інданон)-2-іл]метилпіперидину з більше ніж 97 %-ною чистотою, визначеною методом ВЕРХ. На стадії кристалізації донепезилу гідрохлорид кристалізували з водного спиртового розчинника з одержанням Поліморфу (І) щонайменше з 99,95 %-ною чистотою, визначеною методом ВЕРХ. UA 98102 C2 (12) UA 98102 C2 UA 98102 C2 5 10 15 20 25 30 35 40 Цей винахід стосується нового способу одержання високочистого донепезилу гідрохлориду, тобто гідрохлориду 1-бензил-4-[(5,6-диметокси-1-інданон)-2-іл]метилпіперидину, сполуки, що має Формулу І, у морфологічній кристалічній формі Поліморф (І). Донепезилу гідрохлорид, сполука, що має Формулу І, відома своєю винятковою антиацетилхолінестеразною активністю, і вона є ефективним активним інгредієнтом у фармацевтичних лікарських засобах для лікування й запобігання таким захворюванням, як хвороба Альцгеймера і старече недоумство. Відомо декілька способів одержання донепезилу гідрохлориду. Більшість з них включають каталітичну гідрогенізацію етиленового подвійного зв'язку ("ілідний" зв'язок) у бічному ланцюзі або/та піридинового кільця. В одній групі цих способів застосовували гідрогенізацію після бензилування. Згідно з Прикладом 4, наведеним у патенті ЕР 296560, донепезилу гідрохлорид отримували шляхом відновлення гідрохлориду 1-бензил-4-[(5,6-диметокси-1-інданон)-2іліденіл]-метилпіперидину, як показано на наступній схемі. Згідно з Прикладом 3 ці патенти 5,6диметокси-1-інданон реагував з отриманим складним і дорогим способом N-бензилпіперидин-4карбальдегідом з утворенням гідрохлориду 1-бензил-4-[(5,6-диметокси-1-інданон)-2-іліденіл]метилпіперидину в громіздкій з погляду виробництва реакції при -70°С у присутності бутиллітію. Згідно з іншим способом, розкритим у цьому патенті, 5,6-диметокси-1-інданон реагував з Nбензоїлпіперидин-4-карбальдегідом і після насичення „ілідної’’ сполуки, що утворилася, бензоїльну групу видаляли, і кінцевий продукт отримували за допомогою N-бензилування. Звичайними недоліками цих технологій є дорогі вихідні матеріали, екстремальні умови проведення реакції' (-70°С) і низький вихід. Зазвичай вживана форма активного інгредієнта, сіль донепезилу гідрохлориду, була також розкрита в патенті ЕР 296560. Реакційну суміш очищали за допомогою колонкової хроматографії, потім основу розчиняли в дихлорметані, потім її обробляли солянокислим етилацетатом, з подальшим випаровуванням насухо при зниженому тиску. Кристалічний матеріал перекристалізували з діізопропілового ефіру. У публікаціях WO 97146526 і WO 97146527 кристалічна форма донепезилу гідрохлориду, отримана згідно з попереднім патентом ЕР 296560, була названа Поліморф (І) і охарактеризована наступними IR-смугами, отриманими в КВr пігулках: 463, 502, 563, 589; 604, 701, 750, 759, 799,.86О, 922, 947, 972, 1012, 1012,1038, 1104, 1120, 1128, 1175, 1192, 1218, 1250, 1267, 1316, 1368, 1410, 1433, 1440, 1455, 1472, 1502, 1591, 1606,1644, 1684, 2412,2530, -1 2559, 2595, 2620, 2717, 2840, 2858, 2924, 3004, 3074, 3259, 3373, 3547, 3589 см . Наступний складний 9-стадійний синтез був описаний у публікації WO 9722584, при проведенні цього синтезу також зіткнулися з додатковими труднощами: У частині методів синтезу проміжний продукт, що включає насичений бічний ланцюг і піперидинове кільце, перетворювали на кінцевий продукт. У WO 0009483 був також описаний складний 7-стадійний синтез, у якому після бензилування шляхом циклізації насиченого інтермедіату було отримано індольне кільце. 1 UA 98102 C2 Згідно з документом ЕР 1386607 основу донепезилу отримували за допомогою дезетоксикарбоксилування 1-бензил-4-[{(5,6-диметокси-2-етоксикарбоніл-індан-1 -он)-2-іл}метил]піперидину: 5 У схожій методиці, описаній у WO 0503092, зайву групу (Y) видаляли також на останній стадії: 10 15 20 25 30 Методики, наведені вище, не можуть бути розглянуті як промислові способи через їх низький вихід. Типові недоліки наступних методик - це вживання високосортного дорогого каталізатора Адамса (РtO2). У European Patent Application No. 1047674 спочатку з 5,6-диметокси-1-інданону отримували 5,6-диметокси-2-етоксикарбоніл-2-[(4-піридил)-метил-]-1-інданон, з потім проводили дезетоксикарбонілування, і потім його перетворювали на четвертинну сіль бензилгалогеніду. Кінцевий продукт отримували шляхом гідрогенізації з четвертинної солі: Згідно зі способом, описаним у документі European Patent Application No. 711756 4-[(5,6диметокси-1-інданон)-2-іліденіл]-метилпіридин отримували в реакції конденсації з 5,6диметокси-1-інданон-4-альдегіду, який був переведений у четвертинну форму за допомогою бензилгалогеніду. Ця четвертинна сіль була піддана каталітичній гідрогенізації: Головним недоліком наведених вище методик було широкомасштабне вживання дорогого каталізатора. Досвід наших досліджень підтверджує, що в цих умовах з'являлися значні кількості небажаних дебензилованих і надгідрогенізованих похідних (наприклад, циклогексил один). У цих методиках не повідомлялося про чистоту продуктів, і не були наведені способи одержання гідрохлоридної солі. 4-[(5,6-диметокси-1-інданон)-2-іліденіл]-метилпіридин застосовували також у патенті US 6,649,765. У цьому документі вихідну сполуку відновлювали у присутності 10%-ного (моль/моль) каталізатора Адамса, потім утворену похідну піридину бензилували. 2 UA 98102 C2 Схожа методика була розкрита в документі WO 04/082685 А1. У цій методиці „ілідний’’ зв'язок гідрогенізували за допомогою паладієвого каталізатора, і потім для гідрогенізації піридинового кільця застосовували каталізатора Адамса: 5 10 15 20 25 Методика насичення „ілідного’’ подвійного зв'язку у присутності паладієвого каталізатора була опублікована в роботах Bioorganic & Medicinal Chemistry Letters 2 (2002) 2565-2568, і Journal of Pharmaceutical and Biomedicinal Analysis 35 (2004) 1047-1058. У останній статті було описано, що в лужному середовищі 4-[(5,6-диметокси-1-інданон)-2-іліденіл]-метилпіридин відновлюється з утворенням чотирьох різних продуктів, з яких можуть бути виділені домішки донепезилу. У цих двох заявках відновлювали 4-[(5,6-диметокси-1-інданон)-2-іліденіл]-метилпіридин у вигляді основи. У документі WO 04/082685 було вказано, але не деталізовано, що можливе відновлення не лише відповідної основи, але також і її солі. Проте в цій заявці не повідомлялося про очевидні відмінності в чистоті відносно виділених продуктів. У відтворених експериментах ми також підтвердили те, що було встановлено в цій статті в Journal of Pharmaceutical and Biomedicinal Analysis. В ході відновлення основи, на жаль, були насичені не лише „ілідний’’ подвійний зв'язок і піридинове кільце, але також, щонайменше частково, кето-група 5,6-диметокси-1-інданону. Згідно з документом WO 05/076749 донепезил отримували згідно з наступною схемоюреакцій: У способі, розкритому в заявці US 04/143,121, 4-[(5,6-диметокси-1-інданон)-2-іліденіл]метилпіридин гідрогенізували з одержанням 4-[(5,6-диметокси-1-інданон)-2-іл]-метилпіперидину, з подальшим бензилуванням, що приводив до утворення донепезилу. Згідно з нашим досвідом таким шляхом, за допомогою гідрогенізації основи, не можна отримати досить чистий донепезил у промислових масштабах. У документі WO 05/044805 донепезил отримували згідно з наступною схемою реакцій: 30 35 Відомо, що на чистоту кінцевого продукту переважно впливає стадія гідрогенізації. Попри те, що, в принципі, цей опис встановлює широке розмаїття каталізаторів, згідно з прикладами 2 і 6, що стосується гідрогенізації, на практиці він обмежений лише очевидним вживанням каталізатора РtO2. Вживання цього каталізатора не лише робить цю процедуру дуже дорогою, але також включає ризик того, що гідрогенізація не контролюватиметься повною мірою, і виникнення недостатньо гідрогенізованих і надгідрогенізованих продуктів не можна уникнути. До 3 UA 98102 C2 5 10 15 20 25 недоліків також можна віднести вживання солей п-толуолсульфокислоти, це стає очевидним при порівнянні результатів, зведених у таблицях у прикладах 1 і 2 цих документів. Даний винахід забезпечує новий, реалізований у промисловому масштабі й економічно переважний спосіб одержання високочистого гідрохлориду 1-бензил-4-[(5,6-диметокси-1інданон)-2-іл]метилпіперидину, тобто донепезилу гідрохлориду, наведений на наступній схемі реакцій, у морфологічній кристалічній формі Поліморф (І)· На одній з ключових стадій способу, в ході гідрогенізації насичували гідрохлорид 5,6диметокси-2-(піридин-4-іл-метилен)індан-1-ону, застосовуючи Pd-вуглець, і отримували 4-[(5,6диметокси-1-інданон)-2-іл]-метилпіперидин з більш, ніж 97%-ною чистотою, визначеною за допомогою ВЕРХ. На стадії кристалізації донепезилу гідрохлорид кристалізували з водного спиртного розчинника і отримували Поліморф (І), щонайменше, з 99,95%-ною чистотою, визначеною за допомогою ВЕРХ. У ході нашої експериментальної роботи ми несподівано виявили, що, якщо відновлювали суттєво реакційно активну сіль гідрохлориду 4-[(5,6-диметокси-1-інданон)-2-іліденіл]метилпіридину (V), у присутності менш дорогого і менш вживаного в промисловості і менш активного паладій-вуглецевого каталізатора, при низькій температурі, то потім бажаний неочищений 4-[(5,6-диметокси-1-інданон)-2-іл]-метилпіперидин (V) може бути отриманий в одну стадію, з відповідною чистотою і з хорошим виходом. Оскільки бензилову групу вводили на останній стадії, то можна було уникнути утворення надгідрогенізованих домішок метилциклогексилу. В цьому способі гідрогенізації була досягнута більш, ніж 99,0%-на чистота, визначена за допомогою ВЕРХ. Висока чистота раніших проміжних продуктів забезпечувала високу чистоту пізніших проміжних продуктів, високо чисту сіль донепезилу гідрохлориду, з якої, нарешті, отримували вкрай чистий донепезилу гідрохлорид в бажаній кристалічній формі Поліморф (І), кінцевий продукт якого був практично вільний від усіляких залишків розчинника. В результаті може бути забезпечена висока чистота продукту згідно з наведеною вище схемою реакцій, у якій 5,6-диметокси-1-інданон (II) і піридин-4-альдегід (III) реагують у реакції конденсації з одержанням основи 4-[(5,6-диметокси-1-інданон)-2-іліденіл]-метилпіридину, потім 4 UA 98102 C2 5 10 15 20 25 30 35 40 45 50 55 60 солянокислу сіль останнього (IV) гідрогенізували в оцтовій кислоті при температурі 50-70°С і тиску 5 бар з одержанням 4-[(5,6-диметокси-1-інданон)-2-іл]-метилпіперидину (V). З цих проміжних продуктів за допомогою відомого способу бензилування, з подальшим утворенням солі, що включає обмін фазами для подальшого очищення, отримували донепезилу гідрохлорид. З цього матеріалу, після розчинення у водному спирті й осадження, отримували надчистий Поліморф (І) донепезилу гідрохлориду, практично вільний від залишків розчинника. Ми встановили, що такий високо чистий кінцевий продукт може бути отриманий лише, якщо всі наступні один за одним стадії проведені відповідним чином і, особливо, дві ключові стадії, гідрогенізація і кристалізація, несподівано були застосовані кращі способи, ніж ті, що застосовувалися раніше. Перший опис Поліморфу (І) гідрохлоридної солі донепезилу може бути знайдено в ЕР 296560, згідно з яким його можна отримати шляхом очищення реакційної суміші за допомогою колонкової хроматографії, розчиненням основи в дихлорметані, й потім обробкою розчиненої основи донепезилу за допомогою солянокислого етилацетату з подальшим випаровуванням при зниженому тиску. Кристалічну речовину перекристалізовували, застосовуючи метанол і ізопропіловий ефір. Пізніше, в документах WO 97/46526 і WO 97/46527 (ЕР 1019374 та 1211243) цю модифікацію, охарактеризовану за допомогою смуг поглинання інфрачервоного спектру цієї речовини, отриманих з пігулки з КВr, назвали Поліморф (І). Характеристики нових Форм II, III, IV і V також були описані в цих документах. Поліморф (III) був описаний у патенті US 6,140,321. Документ WO 04/87660 забезпечує спосіб одержання аморфних модифікацій. Згідно з даними, наведеними в документі WO 97/46527 (ЕР 1019374 та 1211243) донепезилу гідрохлорид може бути отриманий у вигляді Поліморфу (І) у лабораторних умовах. У одному з переважних способів (№№. 1-7), основу донепезилу розчиняли в нижчому спирту, сіль отримували за допомогою соляної кислоти або хлористого водню, потім бажаний Поліморф (І) осаджували за допомогою t-бутилметилового ефіру (приклад 29) або за допомогою діізопропілового ефіру (приклад 30) або за допомогою етилацетату (приклад 31). Через суспензію, що не піддається обробці, Поліморф (І) фільтрується погано. У промисловому масштабі спосіб не може бути застосований. У іншому переважному способі (No. 1-9) Поліморф (І) донепезилу гідрохлориду отримували за допомогою перекристалізації. Донепезилу гідрохлорид розчиняли в нижчому спирту (вигідно в метанолі), потім його розчинність знижували за допомогою різних осаджуючих агентів, таких як t-бутилметиловий ефір (приклад 39) або етилацетат (приклад 40) або н-гексан (приклад 41), і кристалічну речовину фільтрували й висушували. В усіх цих описах осаджувач додавали до розчину донепезилу або донепезилугідрохлориду. В цьому описі не були наведені дані про залишки розчинника в донепезилу гідрохлориді (І). Примітне те, що в цих Прикладах, з одного боку, вживані розчинники не придатні до великомасштабного виробництва (точка займання діетилового ефіру рівна 40°С), і, з іншого боку, їх уживання дозволене лише в украй виправданих випадках (як у разі діізопропілового ефіру) у фармацевтичній промисловості. З літератури (WO 97/46527) також відомо, що метилтрет-бутиловий ефір також придатний для одержання Поліморфу (І) донепезилу гідрохлориду. В цьому описі не повідомлялося про зворотне додавання, і воно не було пов'язане із залишком розчинника. Згідно з нашими дослідженнями, проведеними із залученням величезного числа експериментальних даних, ми виявили, що незалежно від порядку добавок (діетиловий ефір додавали до розчину донепезилу гідрохлориду в метанолі або навпаки) замість бажаного Поліморфу (І) можна було отримати кристали Поліморфу (III). Економічні промислові технології не можуть бути засновані на настільки ненадійній методиці. У відомих методиках Поліморф (І), що містила майже один моль зв'язаної води, закристалізовували з вільних від води розчинників. У ході експериментів було встановлено, що при 60-80°С донепезилу гідрохлорид може втратити цю воду, але при кімнатній температурі й відносній вологості, рівній 40-60%, він швидко набирав воду назад з повітря. Ми встановили, що згідно з відомими методиками спочатку виходить нестабільна безводна перехідна модифікація Поліморфу (І), а в ході обробки ця перехідна форма перетворюється на стабільну водовмісну кристалічну модифікацію Поліморфу (І). У широко масштабному технологічному процесі не можна допускати таке неконтрольоване одержання, оскільки при одержанні фармацевтичної продукції основною вимогою є добра відтворюваність. Несподівано було виявлено, що концентрація залишку розчинника продукту сильно залежить від порядку додавання компонентів. Так, якщо безводний розчин донепезилу гідрохлориду в метанолі додавали по краплях у розчин метил-трет-бутилового ефіру, що містив 5 UA 98102 C2 5 10 15 20 25 30 35 40 45 кристали-приманки Поліморфу (І), то залишок метил-трет-бутилового ефіру продукту був рівний приблизно 2500 м.д. Навпаки, якщо метил-трет-бутиловий ефір додавали по краплях до розчину донепезилу гідрохлориду в безводному метанолі, що містив кристали-приманки, то залишок метил-трет-бутилового ефіру був рівний приблизно 6500 м.д. Згідно з нашими дослідженнями, вміст води у вживаному спирту можна додатково збільшувати до певної межі без проблем для формування Поліморфу (IV), що можна було чекати згідно з ЕР 1211243. Поліморф (І) з необхідним умістом води, рівним один моль, може бути виділений за умови, що кількість води в розчині була в 2-20 разів більша, ніж теоретичний один моль. Ми були здивовані, що дані із залишку розчинника сильно залежали від кількості води у використовуваному спирті. Ми стверджуємо, що якщо донепезилу гідрохлорид розчиняли в метанолі, що містив 2-18%, сприятливо, що містив 4% води, то забруднюючий залишок розчинника буде на порядок нижчим; лише 200-300 м.д. Кристалізація Поліморфу (І) переважно гарантовано відбувалася з кристалами-приманками Поліморф (І), суспендованими в розчині осаджуючого засобу, який погано розчиняє донепезилу гідрохлорид. Наші подальші дослідження розкрили, що утворення Поліморфу (І) вимагає відповідного контролю температури. Незалежно від порядку додавання компонентів, при температурі вище 20°С кристалізувався Поліморф (III), зниження температури сприяло утворенню Поліморфу (І). Проте при дуже низьких температурах кількість залишку розчинника збільшувалася. ПРИКЛАДИ Приклад 1. Відтворений експеримент для одержання солі 2-(4-піперидинілметил)-5,6диметокси-1-інденон пара-толуолсульфонової кислоти згідно з Прикладом 2 у WO 2005/044805 А1: 4,02 г солі пара-толуолсульфонової кислоти 2-(4-піридилметилен)-5,6-диметокси-1-інденону розчиняли в 300 мл безводного метанолу, з подальшим додаванням 330 мг РtO2 каталізатора, суміш гідрогенізували при перемішуванні при кімнатній температурі при атмосферному тиску протягом 10,5 годин. Осад відфільтровували, промивали у 50 мл безводного метанолу. Рідку фазу випаровували насухо, залишок розчиняли в 150 мл безводного ізопропанолу при нагріванні, потім розчин охолоджували для кристалізації і отримували 2,02 г сполуки, вказаної в підзаголовку. Матковий розчин випаровували до об'єму 15 мл і отримували більш ніж 0,46 г речовини. Після об'єднання двох порцій отримували 2,86г сполуки, зазначеної в підзаголовку. Результати ВЕРХ-аналізу, що стосуються кількості продукту, наведені в наступній таблиці, де також показані результати експериментів з тривалішим часом реакції. Приклад 2. Відтворений експеримент для одержання НСІ солі 2-(4-піперидинілметил)-5,6диметокси-1-інденону згідно з прикладом 2, наведеним у WO 2005/044805 А1: 3,17 г солянокислої солі 2-(4-піридилметилен)-5,6-диметокси-1-інденону розчиняли в 300 мл безводного метанолу, потім додавали 330 мг РtO2 каталізатора, суміш гідрогенізували при перемішуванні, при кімнатній температурі, при атмосферному тиску протягом 10,5 годин. Осад фільтрували, промивали 50 мл безводного метанолу. Рідку фазу випаровували насухо, залишок розчиняли в 150 мл безводного ізопропанолу при нагріванні, потім розчин охолоджували до температури 0°С для кристалізації й отримували 2,02 г сполуки, вказаної в підзаголовку. Матковий розчин випаровували до об'єму, рівного 15 мл, і отримували більш ніж 1,11 г речовини. Після об'єднання двох порцій отримували 3,13 г сполуки, указаної в підзаголовку. У наступній таблиці наведені результати ВЕРХ-аналізу, що стосуються вмісту продукту. Також показані результати експериментів з тривалішими часом реакції. 6 UA 98102 C2 5 10 15 20 25 30 35 Приклад 3. 200 л оцтової кислоти, 2,2 кг деревного вугілля, що містило 10% паладію, суспендованого в 22 л оцтової кислоти, і 22,24 кг 4-[(5,6-диметокси-1-інданон)-2-іліденіл]метилпіридину гідрохлориду (IV) відмірювали у зроблений з інертного матеріалу автоклав для гідрогенізації об'ємом 500 л, і суміш гідрогенізували при 68-72°С, під надлишковим тиском, рівним 5 атм, при інтенсивному перемішуванні, доти, поки не закінчувалося зниження тиску. Автоклав охолоджували до 20-25°С, каталізатор фільтрували. Фільтрат концентрували при зниженому тиску до об'єму, рівного 66 л, потім до нього додавали по краплях при перемішуванні 72 л метил-ізобутил кетону. Кристалічну речовину фільтрували й промивали метил-ізобутил кетоном. Вологу речовину розчиняли у 210 л киплячого метанолу, і потім це охолоджували до 05°С. Кристалічну речовину відфільтровували, промивали й після висушування отримували 15,12 кг 4-[(5,6-диметокси-1-інданон)-2-іл]-метилпіперидину (V). Результати ТШХ-аналізу, що стосуються кількості продукту, наведені в наступній таблиці. Приклад 4. 500 л оцтової кислоти, 32,58 кг 4-[(5,6-диметокси-1-інданон)-2-іл]метилпіперидину (V), 27,60 кг карбонату калію, 6,5 л води і 2,2 кг деревного вугілля, що містило паладій, і суспендованого в 22 π оцетової кислоти, відмірювали в автоклав, об'ємом 1000 л, потім туди по краплях додавали 12,5 л розчину бензилброміду в 40 л етилацетату. Реакційну суміш інтенсивно перемішували при 25-30°С протягом 4 годин. Упевнившись у тому, що реакція завершилася, осад відфільтровували. 300 л води і 12 л оцтової кислоти додавали до фільтрату, і після перемішування фази розділяли. Органічний шар промивали 50 л води, фази знову розділяли. Продукт знаходився в об'єднаній водній фазі, до якої додавали 200 л етилацетату, і до цього по краплях додавали 100 л водного розчину 10,0 кг ΝΑΟΗ. Після перемішування фази розділяли, водну фазу промивали новою порцією 100 л етилацетату, й органічну фазу промивали водою. Відокремлену органічну фазу висушували над безводним сульфатом натрію й фільтрували. Фільтрат концентрували до 50 л при зниженому тиску, додавали 50 л метанолу, гомогенізували й випаровували, потім додавали нову порцію 50 л метанолу, і випаровували знову. При перемішуванні залишок розчиняли в 140 л метанолу і охолоджували до 5-10°С. У це додавали по краплях 38 л солянокислого метанолу (суміш 10,46 кг конц. соляної кислоти і 23,75 кг метанолу). Кристалізацію завершували, додаючи по краплях 280 л метил-трет-бутилового ефіру, що містив кристали-приманки Поліморфу (І). Продукт фільтрували, двічі промивали 35 л метил-трет-бутилового ефіру, висушували при 35-40°С на повітрі й отримували 30,7 кг активного інгредієнта донепезилу гідрохлориду, у вигляді Поліморфу (І). Дані по його аналізу наведені в наступній таблиці. 7 UA 98102 C2 5 10 15 Приклад 5. 34,5 л метанолу, 1,5 л демінералізованої води, 9,00 кг донепезилу гідрохлориду (в принципі придатна будь-яка модифікація Поліморфу) відмірювали в автоклав об'ємом 150 л, обладнаний мішалкою і дефлегматором. Коли температура суспензії піднімалася до 50-55°С, то осад розчинявся знову. Розчин охолоджували до 25-30°С і фільтрували до стану, вільного від волокон. 90 л метил-трет-бутилового ефіру і 90 г Поліморфу (І) донепезилу гідрохлориду відмірювали в 150 л автоклав, температуру суспензії знижували до 5-10°С, і при постійному інтенсивному перемішуванні постійно протягом 30 хвилин додавали розчин донепезилу гідрохлориду. Після нового 30-хвилинного перемішування кристалічний осад відфільтровували й промивали 9 л метил-трет-бутилового ефіру. Кристалічну речовину висушували при 35-40°С, отримували 8,7 кг Поліморфу (І) донепезилу гідрохлориду, що містив незначний залишок розчинника. Типова концентрація залишку метил-трет-бутилового ефіру була рівна 150-750 м.д., тоді як інші добавкові компоненти залишку розчинника були нижчі за чутливість методу. Одержаний кристалічний матеріал показав характеристичні піки для наступних кутів дифракції (2Θ): 9.83, 10.50, 12.59, 13.04, 13.79, 14.78, 15.17, 16.02, 16.82, 17.51, 18.43, 19.26, 19.76, 20.10, 21.16, 21.87, 22.34, 22.94, 23.67, 23.88, 26.34, 27.95, 29.41. ФОРМУЛА ВИНАХОДУ 20 1. Спосіб одержання високочистого Поліморфу (І) донепезилу гідрохлориду, сполуки, що має Формулу І MeO N x HCl MeO O , (І) шляхом гідрогенізації солі 5,6-диметокси-2-(піридин-4-ілметилен)індан-1-ону, проміжної сполуки, що має Формулу IV MeO NH+ MeO 25 ClO , (IV) і подальшого бензилування одержаного 4-[(5,6-диметоксі-1-інданон)-2-іл]-метилпіперидину, проміжної сполуки, що має Формулу V MeO NH MeO O 30 , (V) і подальших стадій утворення солі шляхом уведення в реакцію основи донепезилу, сполуки, що має Формулу VI MeO N MeO O 35 , (VI) і подальшої перекристалізації одержаного донепезилу гідрохлориду, сполуки, що має Формулу І, з розчину, що містить спирт з коротким вуглецевим ланцюгом, що включає не більше 4 атомів вуглецю, згідно з яким: 8 UA 98102 C2 5 10 15 20 a) здійснюють указану гідрогенізацію гідрохлориду 5,6-диметокси-2-(піридин-4-ілметилен)індан1-ону, сполуки, що має Формулу IV, у присутності каталізатора у вигляді Pd на деревному вугіллі, і b) здійснюють указані стадії утворення солі шляхом уведення в реакцію основи донепезилу, сполуки, що має Формулу VI, з оцтовою кислотою, потім екстрагування солі оцтової кислоти у водну фазу, потім знову перетворення її на основу донепезилу в присутності основи, потім перетворення останньої на донепезилу гідрохлорид, сполуку, що має Формулу І, у присутності хлористого водню, і с) здійснюють указану перекристалізацію осадженням продукту, Поліморфу (І) донепезилу гідрохлориду, з водного спиртового розчину, що містить 2-18 (об/об) % води, підтримуючи температуру в діапазоні між -10 °С та +10 °С. 2. Спосіб за п. 1, у якому вказана гідрогенізація включає застосування деревного вугілля, що містить 5-15 % паладію, як каталізатора. 3. Спосіб за п. 2, в якому вказана гідрогенізація додатково включає застосування надлишкового тиску 4-6 атм. і температури, рівної 60-80 °С. 4. Спосіб за п. 1, у якому вказані стадії утворення солі здійснюють введенням в реакцію основи донепезилу з оцтовою кислотою в розчині етилацетату й переведенням донепезилу ацетату у водну фазу. 5. Спосіб за п. 1, у якому вказану перекристалізацію здійснюють розчиненням донепезилу гідрохлориду у водному метанолі, що містить 3-5 % (об/об) води. 6. Спосіб за п. 1, у якому вказану перекристалізацію здійснюють додаванням розчину донепезилу гідрохлориду у водному метанолі до осаджувача метил-трет-бутилового ефіру, що містить кристали-затравки Поліморфу (І). Комп’ютерна верстка І. Скворцова Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 9
ДивитисяДодаткова інформація
Назва патенту англійськоюNovel process for production of highly pure polymorph (i) donepezil hydrochloride
Автори англійськоюNeu, Jozsef, Greiner, Istvan, Csabai Janos, Garadnay, Sandor
Назва патенту російськоюСпособ получения высокочистого полиморфа (i) донепезила гидрохлорида
Автори російськоюНеу Йожеф, Грейнер Иштван, Чабаи Янош, Гараднаи Шандор
МПК / Мітки
МПК: C07D 211/32, C07D 211/02
Мітки: гідрохлориду, спосіб, високочистого, поліморфу, одержання, донепезилу
Код посилання
<a href="https://ua.patents.su/11-98102-sposib-oderzhannya-visokochistogo-polimorfu-i-donepezilu-gidrokhloridu.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання високочистого поліморфу (i) донепезилу гідрохлориду</a>
Попередній патент: Трибуна стадіону
Наступний патент: Дисковий млин
Випадковий патент: Пристрій для правки шліфувальних кругів на торцешліфувальних верстатах