Біокомпозит для регенерації пошкоджених тканин та органів, набір для виготовлення біокомпозита і спосіб лікування
Номер патенту: 112450
Опубліковано: 12.09.2016
Автори: Деїв Роман Вадімовіч, Філоненко Єлєна Сєргєєвна, Бозо Ілья Ядігєровіч, Кісельов Сєргєй Львовіч, Ісаєв Артур Алєксандровіч
Формула / Реферат
1. Біокомпозит для забезпечення відновних процесів після пошкодження у ссавця, що включає носій, принаймні одну нуклеїнову кислоту, який відрізняється тим, що вказана нуклеїнова кислота є такою, що містить гістотипічні гени, які кодують VCGF та/або SDF-1, носій є таким, що містить фосфат кальцію, а також додатково включає клітини, що забезпечують репаративну регенерацію.
2. Біокомпозит за п. 1, який відрізняється тим, що носій представлений у твердій або рідкій формі, у формі геля, мазі або їх комбінації.
3. Біокомпозит за п. 1 або п. 2, який відрізняється тим, що носій представлений неорганічними та/або органічними сполуками, що містять фосфат кальцію.
4. Біокомпозит за будь-яким з пп. 1-3, який відрізняється тим, що носій є наноструктурованим.
5. Біокомпозит за будь-яким з пп. 1-4, який відрізняється тим, що принаймні одна нуклеїнова кислота є ДНК, яка включена у вектор, де вектор є плазмідою, вірусом, епісомою або транспозоном.
6. Біокомпозит за будь-яким з пп. 1-5, який відрізняється тим, що клітини, які забезпечують репаративну регенерацію, є аутогенними та/або алогенними клітинами.
7. Біокомпозит за будь-яким з пп. 1-6, який відрізняється тим, що клітини, які забезпечують репаративну регенерацію, є похідними від однієї або різних цитогенетичних ліній.
8. Біокомпозит за будь-яким з пп. 1-7, який відрізняється тим, що клітини, які забезпечують репаративну регенерацію, є стовбуровими клітинами, малодиференційованими прогеніторними або диференційованими клітинами, або сумішшю клітин різного ступеня диференціації.
9. Біокомпозит за будь-яким з пп. 1-8, який відрізняється тим, що клітини, які забезпечують репаративну регенерацію, є клітинами, отриманими від ссавця безпосередньо перед застосуванням біокомпозита, або клітинами, які попередньо піддавали лабораторним технологіям клітинного процесингу.
10. Спосіб отримання біокомпозита за будь-яким з пп. 1-9, що включає:
комбінування принаймні однієї нуклеїнової кислоти, що включає гістотипічні гени, які кодують VEGF та/або SDF-1, з носієм, з одержанням комплексу, і
додавання клітин, що забезпечують репаративну регенерацію, до одержаного комплексу носія з нуклеїновою кислотою, що включає гістотипічні гени, які кодують VEGF та/або SDF-1.
11. Спосіб отримання біокомпозита за п. 10, в якому клітини, які забезпечують репаративну регенерацію, є такими, що одержані від ссавця безпосередньо перед застосуванням біокомпозита, або клітинами, які попередньо піддавали лабораторним технологіям клітинного процесингу.
12. Спосіб отримання біокомпозита за п. 10, в якому клітини, які забезпечують репаративну регенерацію, є трансфікованими або нетрансфікованими.
13. Спосіб отримання біокомпозита за будь-яким з пп. 1-9, що включає:
комбінування принаймні однієї нуклеїнової кислоти, що включає гістотипічні гени, які кодують VEGF та/або SDF-1, з носієм, з одержанням комплексу, і
додавання клітин, що забезпечують репаративну регенерацію, які є попередньо трансфікованими при використанні принаймні однієї нуклеїнової кислоти, що включає гістотипічні гени, які кодують VEGF та/або SDF-1, до одержаного комплексу.
14. Спосіб отримання біокомпозита за будь-яким з пп. 1-9, що включає:
попередню трансфекцію клітин, що забезпечують репаративну регенерацію, при використанні принаймні однієї нуклеїнової кислоти, що включає гістотипічні гени, які кодують VEGF та/або SDF-1, і
комбінування трансфікованих клітин з носієм.
15. Спосіб забезпечення загоєння пошкодження у ссавця, що передбачає введення йому біокомпозита за будь-яким з пп. 1-9.
16. Спосіб за п. 15, який відрізняється тим. що введення біокомпозита здійснюють безпосередньо в область пошкоджених тканин при виконанні хірургічної операції або маніпуляції.
17. Спосіб за п. 15. який відрізняється тим, що введення біокомпозита здійснюють ін'єкційним способом: внутрішньовенно, внутрішньоартеріально, внутрішньом'язово, внутрішньошкірно, підшкірно, впутрішньокістково, ендолюмбально, субдурально, внутрішньосуглобово, ендобульбарно.
18. Спосіб за п. 15, який відрізняється тим, що введення біокомпозита здійснюють за допомогою аплікації.
19. Спосіб доставки принаймні однієї нуклеїнової кислоти, що міститься у біокомпозиті за будь-яким з пп. l-9, ссавцю, який цього потребує, методом, що передбачає введення біокомпозита.
20. Набір для приготування біокомпозита за п. 1, що містить в окремій ємкості комплекс носія з принаймні однією нуклеїновою кислотою, що включає гістотипічні гени, які кодують VEGF та/або SDF-, та ємкість для комбінування комплексу з біологічною рідиною або культуральним середовищем з клітинами, що забезпечують репаративну регенерацію.
Текст
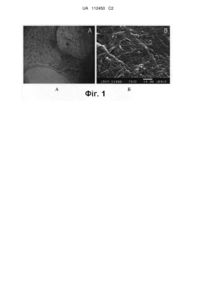
Реферат: Винахід належить до біокомпозита для забезпечення відновних процесів після пошкодження у ссавця, що включає носій, принаймні одну нуклеїнову кислоту. При цьому вказана нуклеїнова кислота є такою, що містить гістотипічні гени, які кодують VCGF та/або SDF-1, носій є таким, що містить фосфат кальцію, а також додатково включає клітини, що забезпечують репаративну регенерацію. Також винахід стосується способу отримання біокомпозита та набору для приготування біокомпозита. UA 112450 C2 (12) UA 112450 C2 UA 112450 C2 5 10 15 20 25 30 35 40 45 50 55 60 ОБЛАСТЬ ТЕХНІКИ ВИНАХОДУ Винаходи відносяться до медицини і ветеринарії і можуть бути використані для відновлення пошкоджених тканин і органів ссавців. РІВЕНЬ ТЕХНІКИ Відомі в даний час інноваційні способи відновлення тканин і органів базуються на використанні тканинноінженерних конструкцій, що містять або різні клітинні популяції, або різноманітні генетичні конструкції (нуклеїнові кислоти). Однак, обидва напрямки - клітинне і генне - є, хоч і перспективними, але помірно, обмежено ефективними. Відомий спосіб місцевого введення тільки генетичних конструкцій за допомогою ультразвуку [1, 2]. Однак, при безпечних для реципієнта параметрах ультразвукового випромінювання, ефективність введення генетичних конструкцій низька. Доставка потрібної кількості генетичних конструкцій можлива тільки під дією ультразвуку високої інтенсивності, який чинить на тканини шкідливу дію [3,4]. Відомий спосіб місцевого введення нуклеїнових кислот в комплексі з ліпосомами [5] і його модифікація - комбіноване введення кон'югату ліпосом з генетичними конструкціями під дією фізичних факторів (ультразвук) [6]. Однак, значна частина ліпосом руйнується під дією тканинних ліполітичних ферментів, що знижує ефективність доставки діючої речовини нуклеїнових кислот. Частина, що залишилася, надходить практично одноразово, що не дозволяє домогтися пролонгованої ефекту. Крім того, при транспорті в клітини-мішені комплекс "ліпосома - генетична конструкція" не руйнується - ліпосоми надходять в клітини, що знижує безпеку методу. Відомий спосіб введення нуклеїнових кислот за допомогою електропорації [6, 7]. Однак, метод заснований на застосуванні електричного поля, яке проштовхує генетичні конструкції (у "чистому вигляді" або в комплексах з допоміжними речовинами) через біологічні мембрани, в результаті чого значна частина генетичних конструкцій пошкоджується. Недоліком методу також є неможливість досягти пролонгованого ефекту, необхідність повторного застосування методу. Відомий спосіб місцевого введення тканинноінженерної конструкції, що складається з тривимірного носія і адгезованих до його поверхні клітин [8]. Однак, клітини вимагають активного кровопостачання - критична віддаленість від мікрогемоциркуляторного русла, при перевищенні якої клітини неминуче гинуть, становить 200-500 мкм [9]. У цьому зв'язку, об'єм тканинноінженерної конструкції, при якому клітини, що входять до її складу, після введення в 3 організм реципієнта можуть зберегти життєздатність, повинен складати не більше 1 см . Дефекти такого розміру взагалі не потребують додаткових оптимізуючих хід відновного процесу впливах, тому існує потреба в заміщенні протяжних (об'ємних) кісткових дефектів, у разі яких показані до застосування тканинноінженерні конструкції значимо більшого обсягу (від 3 1 см ). Однак, трансплантація таких великих конструкцій неминуче супроводжується загибеллю більшої частини клітин, що вводяться (особливо тих з них, які локалізовані в центральній частині виробу і найбільшою мірою відчувають брак оксигенації), що істотно зменшує ефективність методу. Клітини потребують оксигенації, тому, чим більший розмір тканинноінженерної конструкції, тим більше її клітин гине після трансплантації виробу. Таким 3 чином, в тканинноінженерних конструкціях великих розмірів (більше 1 см ) значна частина клітин гине, у зв'язку з чим ефективність цільової дії (забезпечення репаративного процесу) виробу стає порівнянна з ефективністю носія без клітин взагалі, що дозволяє зробити наступні висновки: включення тільки лише клітин до складу тканинноінженерних конструкцій не є достатньою мірою ефективним підходом; необхідний пошук інших, більш ефективних рішень. Найбільш близькими технічними рішеннями є активована матриця, спосіб її отримання і спосіб місцевого введення нуклеїнових кислот на біосумісних матрицях з різних матеріалів для забезпечення репаративних процесів [10]. Однак, ці технічні рішення мають відношення дострого двокомпонентного продукту, що складається тільки з носія і генетичних конструкцій. Клітинний елемент, як критично необхідний для оптимального гістотипічного відновлення тканин та органів, в даному випадку відсутній, тому ефективність застосування продукту помірна. СУТНІСТЬ ВИНАХОДУ Даний винахід відноситься до принципово нового підходу гістотипічного загоєння ушкодження у ссавця за рахунок введення в організм реципієнта єдиного генно-клітинного комплексу для оптимальної - вираженої і пролонгованої - прояви цільової дії. Створення і застосування генно-клітинного матеріалу дозволяє домогтися введення максимальної кількості нуклеїнових кислот і необхідних для оптимального відновлення тканин і органів клітинних елементів в цільову область, досягти синергічної дії активних компонентів, пролонгованого ефекту і уникнути недоліків аналогів. 1 UA 112450 C2 5 10 15 20 25 30 35 40 45 50 55 Спосіб підвищує ефективність відновлення тканин і органів за рахунок: - оптимальної доставки нуклеїнових кислот, захищених від пошкоджуючих факторів реципієнтного ложа, в організм реципієнта, а також - пролонгованого вивільнення їх із структури носія, тобто пролонгування цільового ефекту; - введення в організм реципієнта необхідної популяції клітин, що забезпечують гістотипічне відновлення цілісності тканин і органів. - синергічну дію нуклеїнових кислот і клітин, що входять до складу єдиного біокомпозиту медичного призначення. В одному аспекті винахід відноситься до біокомпозитів, що складається з носія, щонайменше, однієї нуклеїнової кислоти і клітин, що забезпечують гістотипічну репаративну регенерацію, в якості засобу для забезпечення відновних процесів після пошкодження у ссавця. Нуклеїнові кислоти вибирають з групи: ДНК, що кодують гени, ДНК, некодуючі гени, ДНК, що містяться у векторних молекулах (таких, як плазміди, віруси, епісоми, транспозони), вільні лінійні ДНК, одноланцюгові РНК, двохланцюгові РНК, РНК, що містять модифіковані рибонуклеотиди, РНК, що мають 5'- кеп чи ні, РНК, що містять 3' -полі А чи ні, мікроРНК або siPHK. Нуклеїнові кислоти можуть бути включені до складу композиту в декількох можливих варіантах залежно від того, з яким компонентом носія вони безпосередньо пов'язані. Засіб для відновлення тканин та органів містить, щонайменше, одну нуклеїнову кислоту або різні їх поєднання, при цьому нуклеїнова кислота може кодувати щонайменше один ген. Можливе використання полікасетних генетичних конструкцій. Вибір цільового гена або декількох цільових генів, укладених в один тип нуклеїнових кислот, або вибір відразу декількох типів нуклеїнових кислот, що містять різні цільові гени, для створення композиту визначається тим, за рахунок яких механізмів планується реалізувати відновлення тканин та органів і пов'язаний з біологічною дією конкретного фактора, кодованого цільовими генами нуклеїнових кислот. Зокрема, для відновлення тканин та органів за рахунок індукції ангіогенезу доцільно використовувати нуклеїнові кислоти, що містять гени, що кодують судинний ендотеліальний фактор росту (VEGF) або фактор стромальних клітин -1 (SDF-1). Носій може бути твердим, органічної або неорганічної природи, вибраний з групи: металевий, колагеновий, хітозановий, кальційфосфатний, гідроксіапатитовий, біокерамічний, біосклянний, алюмінатний матеріал, очищені білки, продукти позаклітинного матриксу або їх комбінації. Носій може бути рідким, а саме: 0,9 % розчин NaCl, розчини декстранів, сольові розчини (Рингера, Хенкса), розчини органічних кислот - компонентів аморфоного міжклітинного матриксу (гіалуронова, хондроітинсірчана кислоти, тощо). Носій може бути у формі гелю (колагеновий, альгінатний, желатиновий і т.ін.), золю, мазі, крему або їх комбінації. Носій може являти собою комплексний матеріал, що містить тверді, рідкі, гелеві, мазеві та кремові матеріали в різних комбінаціях. Носій може бути наноструктурованим матеріалом. Вибір клітинної популяції визначається гістогенетичною природою тканини, на відновлення цілісності якої спрямований одержуваний композит. Для створення композиту доцільно використовувати саме ті види клітин, які або здатні до диференціювання по напряму в клітини пошкоджених тканин, або вже є диференційованими клітинами, відповідними клітинам пошкоджених тканин, а також клітини, які можуть "забезпечити процеси гістотипічної репаративної регенерації". До таких належать практично будь-які клітини, здатні продукувати необхідні фактори росту або яким-небудь іншим опосередкованим шляхом оптимізувати хід репаративного процесу. Наприклад, шляхом стимуляції, забезпечення ангіогенезу. Біокомпозит може містити аутогенні та / або аллгогенніе клітини. Клітини можуть бути похідними однієї або різних цитогенетичних ліній. Біокомпозит може містити стовбурові, малодиференційовані прогеніторні або диференційовані клітини, або суміш клітин різного ступеня диференціювання. Біокомпозит може містити клітини, отримані безпосередньо від ссавця, тобто клітини, які використовували відразу ж після отримання - без лабораторних технологій клітинного процесингу (культивування, імунофенотипування, індукції диференціювання). Так само біокомпозит може містити клітини, які попередньо піддавали лабораторним технологіям клітинного процесингу (культивуванню, імунофенотипуванню, індукції диференціювання або трансфекції генетичними конструкціями). Винахід так само відноситься до способів отримання біокомпозиту. Можливі такі варіанти його здійснення: 2 UA 112450 C2 5 10 15 20 25 30 35 40 45 50 55 60 1. Поєднання, щонайменше, однієї нуклеїнової кислоти з носієм і наступне додавання клітин, що забезпечують гістотипічну репаративну регенерацію, до отриманого комплексу носій з, щонайменше, однією нуклеїнової кислотою. 2. Поєднання, щонайменше, однієї нуклеїнової кислоти з носієм і додавання попередньо трансфекованих, щонайменше, однієї нуклеїнової кислоти клітин, що забезпечують гістотипічнуй репаративну регенерацію, до отриманого комплексу носій з, щонайменше, однією нуклеїнової кислотою. 3. Поєднання, щонайменше, однієї нуклеїнової кислоти з носієм, при цьому нуклеїнову кислоту попередньо об'єднують з клітинами, що забезпечують гістотипічну репаративну регенерацію, після чого трансфековані клітини додають до носія. 4. Поєднання спочатку клітин з носієм, після чого - додавання нуклеїнових кислот. 5. Спосіб, в якому для створення виробу спочатку суміщають одну клітинну популяцію з носієм, в той же час іншу клітинну популяцію трансфекують генетичними конструкціями, а вже після цього - трансфековані клітини і виріб, що складається з клітин і носія, об'єднують в композит. Взаємодія нуклеїнових кислот і носія може полягати в зворотній взаємодії генетичних конструкцій з компонентами носія у вигляді слабких (тимчасових) хімічних зв'язків з компонентами носія, у вигляді імпрегнації в структуру носія (наприклад, рідкого, мазеподібного або гелевого носія) або у вигляді нанесення на поверхню твердого носія за допомогою різних клеючих субстанцій. У зв'язку зі зворотністю взаємодії нуклеїнових кислот і носія, після контакту (взаємодії) композиту з біологічними рідинами (зокрема, після введення в організм реципієнта), генетичні конструкції послідовно вивільняються під дією факторів реципієнтного ложа, а також при біорезорбціі носія (якщо носій складається з біорезорбтивних матеріалів). Компонентами носія, здатними утворювати хімічні зв'язки з нуклеїновими кислотами, можуть служити гідроксиапатит, флуороапатит [11], карбоні лімідазол [12], поліакриламід [13], полімери метакрилової кислоти [14] та ін. Носій захищає діючу речовину - компартменталізовану нуклеїнову кислоту - від ушкоджуючих факторів тканин реципієнтного ложа і дозволяє пролонгувати ефект за рахунок тимчасового хімічного зв'язку з генетичними конструкціями. Міцність хімічного зв'язку нуклеїнових кислот з носієм може бути різною залежно від матеріалу носія і виду нуклеїнових кислот: варіюється в інтервалі від повної відсутності до практично незворотнього зв'язку. Взаємодія нуклеїнових кислот і клітин, що входять до складу композиту, полягає в трансфекції клітин генетичними конструкціями. Введення нуклеїнових кислот всередину клітин може виконуватися як in vitro до суміщення з носієм, так і реалізовуватися вже в обсязі носія, коли спочатку суміщають нуклеїнові кислоти з носієм, а вже після цього привносять клітини. Кількість нуклеїнових кислот для створення композиту визначається ємністю носія, тобто максимальною кількістю нуклеїнових кислот, які можуть бути розміщені на його поверхні або в його об'ємі, а також - кількістю нуклеїнових кислот, якими може бути трансфекована популяція клітин, що підлягають суміщенням з носієм для створення композиту. Таким чином, кількість залежить від конкретної ситуації і може бути легко підібрано фахівцем. Клітини, що входять до складу композиту, адгезуються до поверхні твердого носія за рахунок реалізації різноманітних механізмів клітинно-матриксної і клітинно-клітинної взаємодії або локалізовані в об'ємі рідкого, гелевого або мазеподібного носія. Кількість клітин, необхідна для створення композиту, з одного боку, визначається площею поверхні (для твердих) або об'ємом (для рідких і гелеподібних) носіїв, а з іншого - мінімально необхідною концентрацією для забезпечення репаративної регенерації пошкоджених тканин. Також ефективна кількість може бути визначена фахівцем виходячи з конкретних умов. Синергічна дія нуклеїнових кислот і клітин може бути різною в залежності від технології їх об'єднання з носієм в єдиний виріб медичного призначення, від виду генетичних конструкції і типів клітин. Синергічна дія реалізується на двох етапах: при створенні виробу і безпосередньо після його трансплантації в організм реципієнта. На етапі створення виробу синергічність полягає в можливості трансфекції клітин нуклеїновими кислотами (всіма при трансфекції in vitro або частиною при трансфекції в об'ємі носія), що дозволяє, з одного боку, підвищити кількість нуклеїнових кислот, що вводяться, а з іншого - оптимізувати властивості клітинної популяції, індукувати експресію цільових генів, що містяться у введених нуклеїнових кислотах. Найбільш ефективними технологіями реалізації цього аспекту синергічної дії є трансфекція клітин in vitro (суміщення клітин і нуклеїнових кислот) і об'єднання з носієм вже трансфекованих клітин, суміщення клітин з комплексом "носій - нуклеїнові кислоти", трансфекція клітин in vitro і наступне об'єднання з комплексом "носій - нуклеїнові кислоти". Найменш ефективним варіантом є поєднання клітин з носієм з наступним додаванням нуклеїнових кислот, так як технологія 3 UA 112450 C2 5 10 15 20 25 30 35 40 45 50 55 60 внесення нуклеїнових кислот включає використання реагентів і фізичних факторів (висушування), що ушкоджують клітини. Після введення в організм реципієнта генетичні конструкції транспортуються клітинами реципієнтного ложа і клітинами трансплантованого виробу, експресуються, а продукт експресії індукує і підтримує морфофункціональну активність в тому числі і введених в складі виробу клітин. В іншому аспекті винахід відноситься до способів застосування біокомпозіту. Біокомпозіт може бути використаний для ефективної доставки нуклеїнових кислот ссавцю. Також біокомпозіт може застосовуватись для забезпечення гістотипічного загоєння ушкодження у ссавця. Способи введення бокомпозіта можуть бути різними і залежать від його форми і характеру пошкоджень тканин і органів. Так, наприклад, можливе введення безпосередньо в область пошкоджених тканин при виконанні хірургічної операції або маніпуляції. Допустиме ін'єкційне введення композиту (носієм якого є рідина або гель) в організм реципієнта - внутрішньовенне, внутрішньоартеріальне, внутрішньом'язове, внутрішньошкірне, підшкірне, внутрішньокісткове, ендолюмбальне, субдуральне, внутрішньосуглобове, ендобульбюарне, також - аплікаційне застосуванні композиту, при умови рідкої, гелевої, кремової, мазевої форми носія. Відповідно до етапності створення композиту, виникає необхідність використання двох наборів: перший - для утримання в підходящій ємності комплексу "носій - нуклеїнові кислоти", другий - для поєднання комплексу "носій - нуклеїнові кислоти" з клітинами, його розміщення та транспортування. Перший набір являє собою виріб з двох оболонок: внутрішня - стерильна і всередині і зовні (призначена для розміщення комплексу "носій - нуклеїнові кислоти" і збереження його стерильності); зовнішня - стерильна тільки зсередини, зовні нестерильна, щільно фіксує внутрішню, але при цьому легко розкривається руками без доторкання до внутрішньої стерильної частини і забезпечує стерильність внутрішньої частини, захист від механічних пошкоджень. Другий набір, призначений для поєднання комплексу "носій - нуклеїнові кислоти" представляє собою стерильну ємність зі скла або полімерних матеріалів різного об'єму, необхідного для розміщення носія з нуклеїновими кислотами, культурального середовища або біологічної рідини (наприклад, крові) з клітинами. Стерильна ємність вміщена також в упаковку з двох оболонок - внутрішньої стерильною з двох сторін і зовнішньої - стерильною зсередини, але нестерильного зовні. Таким чином, набір для приготування біокомпозиту містить в окремій ємності комплекс носій з, щонайменше, однією нуклеїновою кислотою і ємність для поєднання зазначеного комплексу з біологічної рідиною або культуральним середовищем з клітинами, що забезпечують гістотипічну репаративну регенерацію. КОРОТКИЙ ОПИС ФІГУР На фігурах наведені дані, що підтверджують ефективність введення хімічно компартменталізованного генетичного матеріалу та клітин для забезпечення репаративного остеогенезу. Фіг.1. Композит, що складається з клітин і нуклеїнових кислот, суміщених з носієм з остеопластичного матеріалу: А - світлова мікроскопія, Б - скануюча електронна мікроскопія. Фіг.2. Етап трансплантації виробу медичного призначення в експерименті. А - дефект до введення бІокомпозіту, введені спиці Кіршнера для фіксації диастаза і вісі кінцівки; Б біокомпозит, введений в кістковий дефект. Фіг.3. Великогомілкова кістка кролика. У центральній частині визначається кістковий регенерат (позначений білою стрілкою), утворений за допомогою композиту. Фіг.4. Кістковий регенерат, утворений за допомогою введеного хімічно компартменталізованного генетичного матеріалу і клітин. Гістологічна картина. Забарвлення: гематоксилін, еозин. Світлова мікроскопія. Зб. 100. ДОКЛАДНИЙ ОПИС ВИНАХОДУ Можливість здійснення винаходів доцільно проілюструвати в прикладах: створення композиту за рахунок об'єднання носія, що містить гідроксиапатит і кістковий колаген, з популяцією аутогенних мононуклеарних клітин крові та генетичною конструкцією, яка містить нуклеотидну послідовність з геном VEGF [див. патент RU 2297848], і його застосування для забезпечення репаративної регенерації кісткової тканини - заповнення кісткового дефекту протяжністю 2 см великогомілкової кістки кролика. Приклад 1. Хімічне зв'язування нуклеїнової кислоти і носія. 3 1. Підготовка носія (в даному прикладі його обсяг 1 см ). Як носій використана комбінація, що включає в себе синтетичний колаген І типу та гідроксиапатит (співвідношення 60 % / 40 %, відповідно). 4 UA 112450 C2 5 10 15 20 25 30 35 40 45 50 55 60 а) відмивання (інкубування в 0,5 Μ фосфату в об'ємі 1 мл при температурі 37° С при постійному струшуванні протягом 12 годин); б) зрівноважування (обробка 10 мМ фосфату в об'ємі 1 мл при температурі 37° С при постійному струшуванні, 3 рази по 10 хв); в) висушування (інкубування при температурі 37° С до повного висихання - 3 години). 2. Нанесення нуклеїнової кислоти (інкубування з розчином, що містить плазміди ДНК, в об'ємі 100 мкл в 10 мМ фосфату в концентрації Імкг/мкл при температурі 37° С і постійному струшуванні протягом 12 годин) з урахуванням розрахункової ємності носія для нуклеїнових кислот, яка в даному прикладі становить 202,765 нг нуклеїнових кислот на 1 мг носія. 3. Обробка отриманого комплексу "носій - генетична конструкція": а) промивання (обробка 5 мМ розчином фосфату в об'ємі 1 мл 3 рази); б) висушування (інкубування при температурі 37° С до повного висихання - 3 години). 4. Поєднання комплексу "носій - нуклеїнові кислоти" з популяцією аутогенних мононуклеарних клітин крові, отриманих безпосередньо перед операцією - при виконанні 3 операційного доступу. Комплекс "носій - нуклеїнові кислоти" об'ємом 1 см поміщали в стерильну ємність з 5 мл крові пацієнта, забраної шприцом з області пошкоджених тканин при реалізації операційного доступу. Час експозиції становив кілька хвилин - час, достатній для заповнення всіх пор носія з нуклеїновими кислотами кров'ю, що містить аутогенні мононуклеарні клітини, що забезпечують гістотипічну репаративну регенерацію кісткової тканини. Приклад 2. Трансплантація отриманого в прикладі 1 комплексу. Етап трансплантації виробу медичного призначення в експерименті. Модель: кістковий дефект протяжністю 2 см великогомілкової кістки кролика. Спочатку вводять спиці Кіршнера для фіксації диастаза і осі кінцівки, після чого поміщають в кістковий дефект біокомпозит. Для підтвердження хімічного зв'язування нуклеїнової кислоти і носія з остеопластичного матеріалу після промивання і висушування отриманого виробу виконували дисоціацію руйнування зв'язку і вивільнення нуклеїнової кислоти в розчин. Для цього виріб обробляли 0,5 Μ фосфату в обсязі 50 мкл при 37° С при постійному струшуванні протягом 10 хв, а розчин з елюйованою нуклеїновою кислотою піддавали спектрофотометрії (спектрофотометр Nanodrop1000). В результаті було встановлено вміст нуклеїнових кислот в розчині в кількості 202,765 нг на кожен мг носія (різні носії володіють різною ємністю). Для підтвердження можливості суміщення популяції аутогенних мононуклеарних клітин крові з виробом виконували світлову мікроскопію, ідентифікуючи клітини, адгезовані до поверхні носія. Методами світлової, скануючої і трансмісійної електронної мікроскопії було встановлено, що клітини адгезовані до поверхні матриксу, розпластані, займають практично всю вільну поверхню носія (Фіг. 1.). Наведений приклад демонструє здійснимість об'єднання нуклеїнових кислот, клітин і носія, можливість введення отриманого виробу медичного призначення в організм реципієнта, а також демонструє більш швидке і ефективне відновлення цілісності кістки гомілки кролика при використанні біокомпозиту у порівнянні з найближчим аналогом (відновлення завершилося на один місяць швидше). Приклад 3. Отримання різних варіантів біокомпозіту. Були виготовлені комплекси з різних матеріалів носіїв і нуклеїнових кислот в концентраціях, вказаних нижче: - Комплекс з кальцію фосфату і нуклеїнових кислот, доданих в концентрації 72,5 нг на 1 мг носія; - Комплекс з гідроксиапатиту і нуклеїнових кислот, доданих в концентрації 347,8 нг на 1 мг носія; - Комплекс з аллогенного демінералізованого кісткового матриксу і нуклеїнових кислот, доданих в концентрації 108,4 нг на 1 мг носія; - Комплекс з ксеногенного депротеїнізованого кісткового матриксу і нуклеїнових кислот, доданих в концентрації 285,7 нг на 1 мг носія; - Комплекс з кальцію фосфату з гідроксиапатиту і нуклеїнових кислот, доданих в концентрації 520,1 нг на 1 мг носія. Кожен із зазначених комплексів був отриманий за допомогою технології (протоколу), зазначеної у прикладі 1. Клітини були додані до комплексів з носіїв і нуклеїнових кислот на другому етапі отримання біокомпозіту. При цьому, в кожному випадку були використані різні клітинні типи (виділені за різними технологіями): культура мультипотентних мезенхімних стромальних клітин, культура фібробластів, культура остеогенних клітин окістя, свіжа кров з клітинами, стромально-васкулярна фракція клітин жирової тканини, отримана за допомогою спеціального апарату (Cytori). 5 UA 112450 C2 5 10 15 20 25 30 35 40 45 Приклад 4. Трансплантація отриманих в прикладі 3 комплексів. Отримані біокомпозіти були досліджені в експерименті на кроликах з краніальними дефектами. Краніальні дефекти діаметром 10 мм були обрані в якості моделі дефекту критичних розмірів, так як кістки даху черепа кроликів в цьому випадку не відновлюються самостійно - без додаткових оптимізуючих впливів. Кожній тварині були сформовані білатеральні ідентичні дефекти тім'яних кісток. Біокомпозити трансплантували в дефекти правих тім'яних кісток (експериментальна група), в дефекти лівих - носій без клітин і нуклеїнових кислот (контроль 1) або комплекс з носія з нуклеїновими кислотами без клітин (контроль 2). Результати оцінювалися через 15, 30, 45, 60,90 діб. Було показано, що тільки у разі трансплантації біокомпозиту (експериментальні групи) рівень трансфекції клітин реципієнтного ложа ДНК - плазмідами (з геном vegf) був найбільш високий, що призвело до статистично значимо більш вираженого ангіогенезу і репаративного остеогенезу на всіх тимчасових точках в порівнянні з контрольними групами. Таким чином, спосіб може бути застосовний в медичній практиці, особливо для стимуляції репаративних процесів в тканинах, а також - у ветеринарії для лікування ссавців. Джерела інформації: 1. Greenleaf W.J., Bolander M.E., Sarkar G. et al. Artificial cavitation nuclei significantly enhance acoustically induced cell transfection. Ultrasound in Medicine and Biology 1998; 24(4): 587-595. 2. Schratzberger P., Krainin J.G., Schratzberger G. et al. Transcutaneous ultrasound augments naked DNA transfection of skeletalmuscle. Molecular Therapy 2002, 6(5): 576-583. 3. Duvshani-Eshet M., Machluf M. Therapeutic ultrasound optimization for gene delivery: a key factor achieving nuclear DNA localization. Journal of Controlled Release 2005; 108(2-3): 513-528. 4. Kim H.J., Greenleaf J.F., Kinnick R.R. Ultrasound-mediated transfection of mammalian cells. Human Gene Therapy 1996; 7(11): 1339-1346,. 5. Fraley R., Subramani S., Berg P. et al. Introduction of liposome-encapsulated SV40 DNA into cells. J Biol Chem. 1980; 255(21): 10431-5. 6. Roos A.K., Eriksson F., Timmons J.A… Skin electroporation: effects on transgene expression, DNA persistence and local tissue environment. PLoS One. 2009; 4(9): e7226. 7. Schertzer J.D., Lynch G.S. Plasmid-based gene transfer in mouse skeletal muscle by electroporation. Methods Мої Biol. 2008; 433: 115-25. 8. Деев P.B., Цупкина Н.В., Бозо И.Я., Пинаев ГЛ., Тихилов Р.М.Способ совмещения культивированных остеогенных клеток и трехмерного материала-носителя. Патент №2008150694 от 22.12.2008. 9. Polykandriotis Ε., Arkudas Α., Horch R. et al. Autonomously vascularized cellular constructs in tissue engineering: opening a new perspective for biomedical science. J. Cell Мої. Med. 2007; 11(1): 6-20. 10. Гоулдстейн С.А. Способы переноса генов in vivo для заживления ран. Патент №2170104 от 10.07.2001. 11. Giovannini R., Freitag R. Comparison of different types of ceramic hydroxyapatite for the chromatographic separation of plasmid DNA and a recombinant anti-Rhesus D antibody. Bioseparation 2001; 9: 359-368. 12. Sousa Α., Tomaz C.T., Sousa F. et al. Successful application of monolithic innovative technology using a carbonyldiimidazole disk to purify supercoiled plasmid DNA suitable for pharmaceutical applications. J Chromatogr A. 2011; 1218(46): 8333-43. 13. Zhang Y.S., Bai X.F. A simple, rapid and high-resolution banding method in polyacrylamide gels. Yi Chuan. 2008; 30(2): 251-4. 14. Smrekar F., Podgornik Α., Ciringer M. et al. Preparation of pharmaceutical-grade plasmid DNA using methacrylate monolithic columns. Vaccine 2010; 28(8): 2039-45. 50 ФОРМУЛА ВИНАХОДУ 55 1. Біокомпозит для забезпечення відновних процесів після пошкодження у ссавця, що включає носій, принаймні одну нуклеїнову кислоту, який відрізняється тим, що вказана нуклеїнова кислота є такою, що містить гістотипічні гени, які кодують VCGF та/або SDF-1, носій є таким, що містить фосфат кальцію, а також додатково включає клітини, що забезпечують репаративну регенерацію. 2. Біокомпозит за п. 1, який відрізняється тим, що носій представлений у твердій або рідкій формі, у формі геля, мазі або їх комбінації. 6 UA 112450 C2 5 10 15 20 25 30 35 40 45 50 55 3. Біокомпозит за п. 1 або п. 2, який відрізняється тим, що носій представлений неорганічними та/або органічними сполуками, що містять фосфат кальцію. 4. Біокомпозит за будь-яким з пп. 1-3, який відрізняється тим, що носій є наноструктурованим. 5. Біокомпозит за будь-яким з пп. 1-4, який відрізняється тим, що принаймні одна нуклеїнова кислота є ДНК, яка включена у вектор, де вектор є плазмідою, вірусом, епісомою або транспозоном. 6. Біокомпозит за будь-яким з пп. 1-5, який відрізняється тим, що клітини, які забезпечують репаративну регенерацію, є аутогенними та/або алогенними клітинами. 7. Біокомпозит за будь-яким з пп. 1-6, який відрізняється тим, що клітини, які забезпечують репаративну регенерацію, є похідними від однієї або різних цитогенетичних ліній. 8. Біокомпозит за будь-яким з пп. 1-7, який відрізняється тим, що клітини, які забезпечують репаративну регенерацію, є стовбуровими клітинами, малодиференційованими прогеніторними або диференційованими клітинами, або сумішшю клітин різного ступеня диференціації. 9. Біокомпозит за будь-яким з пп. 1-8, який відрізняється тим, що клітини, які забезпечують репаративну регенерацію, є клітинами, отриманими від ссавця безпосередньо перед застосуванням біокомпозита, або клітинами, які попередньо піддавали лабораторним технологіям клітинного процесингу. 10. Спосіб отримання біокомпозита за будь-яким з пп. 1-9, що включає: комбінування принаймні однієї нуклеїнової кислоти, що включає гістотипічні гени, які кодують VEGF та/або SDF-1, з носієм, з одержанням комплексу, і додавання клітин, що забезпечують репаративну регенерацію, до одержаного комплексу носія з нуклеїновою кислотою, що включає гістотипічні гени, які кодують VEGF та/або SDF-1. 11. Спосіб отримання біокомпозита за п. 10, в якому клітини, які забезпечують репаративну регенерацію, є такими, що одержані від ссавця безпосередньо перед застосуванням біокомпозита, або клітинами, які попередньо піддавали лабораторним технологіям клітинного процесингу. 12. Спосіб отримання біокомпозита за п. 10, в якому клітини, які забезпечують репаративну регенерацію, є трансфікованими або нетрансфікованими. 13. Спосіб отримання біокомпозита за будь-яким з пп. 1-9, що включає: комбінування принаймні однієї нуклеїнової кислоти, що включає гістотипічні гени, які кодують VEGF та/або SDF-1, з носієм, з одержанням комплексу, і додавання клітин, що забезпечують репаративну регенерацію, які є попередньо трансфікованими при використанні принаймні однієї нуклеїнової кислоти, що включає гістотипічні гени, які кодують VEGF та/або SDF-1, до одержаного комплексу. 14. Спосіб отримання біокомпозита за будь-яким з пп. 1-9, що включає: попередню трансфекцію клітин, що забезпечують репаративну регенерацію, при використанні принаймні однієї нуклеїнової кислоти, що включає гістотипічні гени, які кодують VEGF та/або SDF-1, і комбінування трансфікованих клітин з носієм. 15. Спосіб забезпечення загоєння пошкодження у ссавця, що передбачає введення йому біокомпозита за будь-яким з пп. 1-9. 16. Спосіб за п. 15, який відрізняється тим, що введення біокомпозита здійснюють безпосередньо в область пошкоджених тканин при виконанні хірургічної операції або маніпуляції. 17. Спосіб за п. 15, який відрізняється тим, що введення біокомпозита здійснюють ін'єкційним способом: внутрішньовенно, внутрішньоартеріально, внутрішньом'язово, внутрішньошкірно, підшкірно, впутрішньокістково, ендолюмбально, субдурально, внутрішньосуглобово, ендобульбарно. 18. Спосіб за п. 15, який відрізняється тим, що введення біокомпозита здійснюють за допомогою аплікації. 19. Спосіб доставки принаймні однієї нуклеїнової кислоти, що міститься у біокомпозиті за будьяким з пп. 1-9, ссавцю, який цього потребує, методом, що передбачає введення біокомпозита. 20. Набір для приготування біокомпозита за п. 1, що містить в окремій ємкості комплекс носія з принаймні однією нуклеїновою кислотою, що включає гістотипічні гени, які кодують VEGF та/або SDF-, та ємкість для комбінування комплексу з біологічною рідиною або культуральним середовищем з клітинами, що забезпечують репаративну регенерацію. 7 UA 112450 C2 8 UA 112450 C2 9 UA 112450 C2 Комп’ютерна верстка М. Мацело Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 10
ДивитисяДодаткова інформація
Автори англійськоюIsaev, Artur Aleksandrovich, Kiselev, Sergej L'vovich, Deev, Roman Vadimovich, Bozo, Il'ya Yadigerovich, Filonenko, Elena Sergeevna
Автори російськоюИсаев Артур Александрович, Киселев Сергей Львович, Деев Роман Вадимович, Бозо Илья Ядигерович, Филоненко Елена Сергеевна
МПК / Мітки
МПК: A61K 48/00, C12N 5/0789, C12N 15/64, A61K 47/48, A61K 38/18
Мітки: виготовлення, пошкоджених, набір, тканин, органів, біокомпозит, біокомпозита, регенерації, спосіб, лікування
Код посилання
<a href="https://ua.patents.su/12-112450-biokompozit-dlya-regeneraci-poshkodzhenikh-tkanin-ta-organiv-nabir-dlya-vigotovlennya-biokompozita-i-sposib-likuvannya.html" target="_blank" rel="follow" title="База патентів України">Біокомпозит для регенерації пошкоджених тканин та органів, набір для виготовлення біокомпозита і спосіб лікування</a>
Попередній патент: Пристрій для тривимірної візуалізації з голографічним скануванням у міліметровому діапазоні довжини хвиль та спосіб огляду людcького тіла або виробу
Наступний патент: Сигналізація матриць квантування для відеокодування
Випадковий патент: Черв'ячна передача