Спосіб одержання cf3cнf-заміщених піразолів
Формула / Реферат
1. Спосіб одержання СF3СНF-заміщених піразолів загальної формули (І):
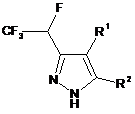 (I),
(I),
в якій R1 являє собою Н або COOR3;
R2 являє собою Н, -COOR3, -COR4 та -CN;
R3 являє собою Н або С1-С6алкіл2;
R4 являє собою Н, С1-С6алкіл або -N(С1-С6алкіл)2;
або R1 та R2 можуть бути об'єднані разом утворюючи 5-членну циклічну систему, що містить N як елемент кільця, і де кільце необов'язково заміщене одним або більшою кількістю замісників, незалежно вибраних з =O, С1-С6алкілу, С6-С10арилу, де С1-С6алкільний та С6-С10арильний фрагмент необов'язково заміщені одним або більшою кількістю замісників, незалежно вибраних з галогену, С1-С6алкілу, С1-С6алкокси, С3-С10циклоалкілу, С6-С10арилу, -СООС1-С6алкілу;
в якому алкени загальної формули (II):
![]() (II),
(II),
в якій R1 та R2 є такими як визначено вище;
вводять в реакцію з C2F5CHN2, що одержують in situ реакцією C2F5CH2NH2 з NaNO2, з одержанням проміжних С2F5-заміщених піразолінів, які обробляють органічною основою з одержанням СF3СНF-заміщених піразолів загальної формули (І).
2. Спосіб за п. 1, який відрізняється тим, що C2F5CH2NH2 використовують у формі гідрохлориду і реакцію одержання C2F5CHN2 проводять у суміші метиленхлориду та води.
3. Спосіб за п. 1, який відрізняється тим, що як органічну основу використовують DBU.
Текст
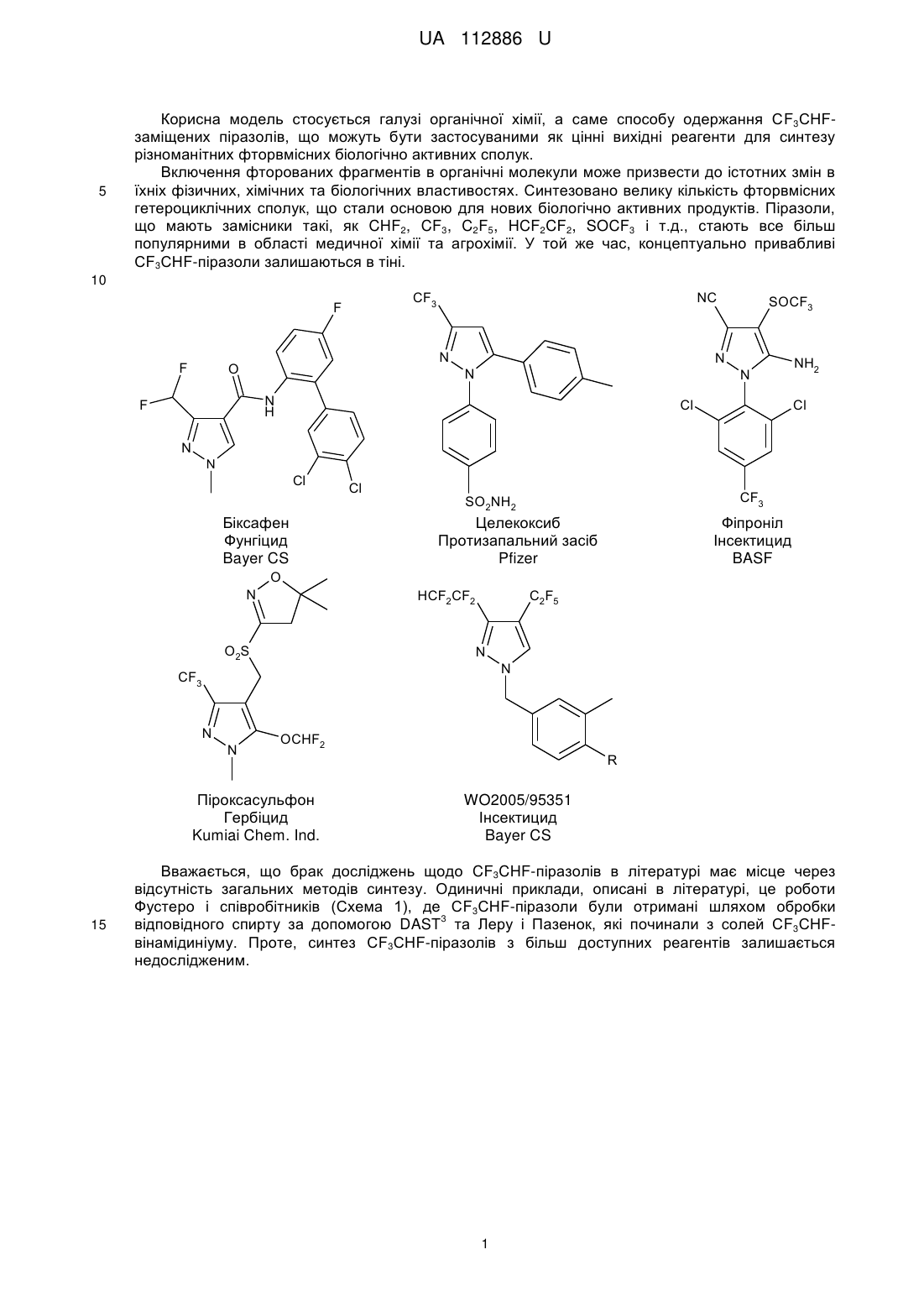
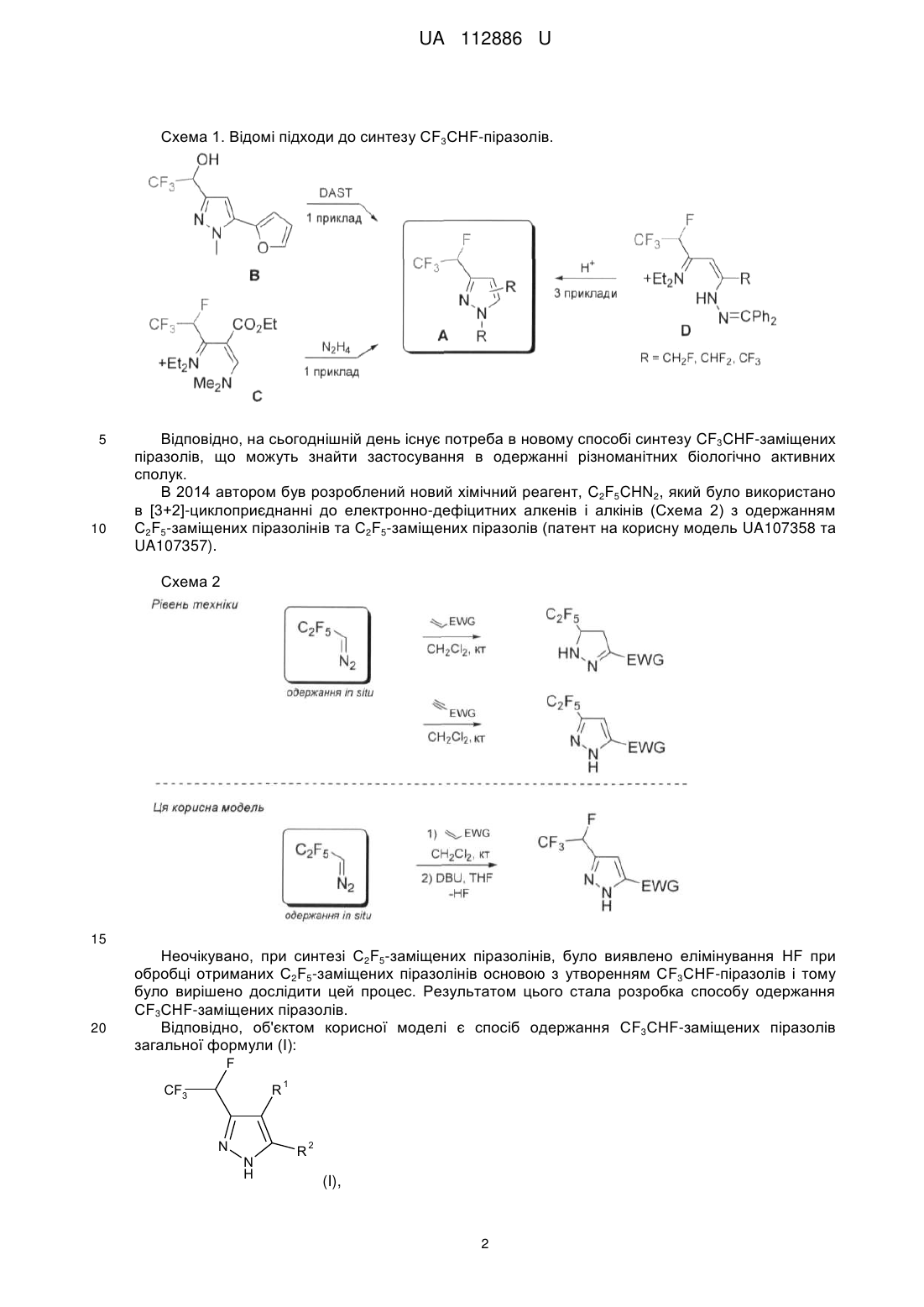
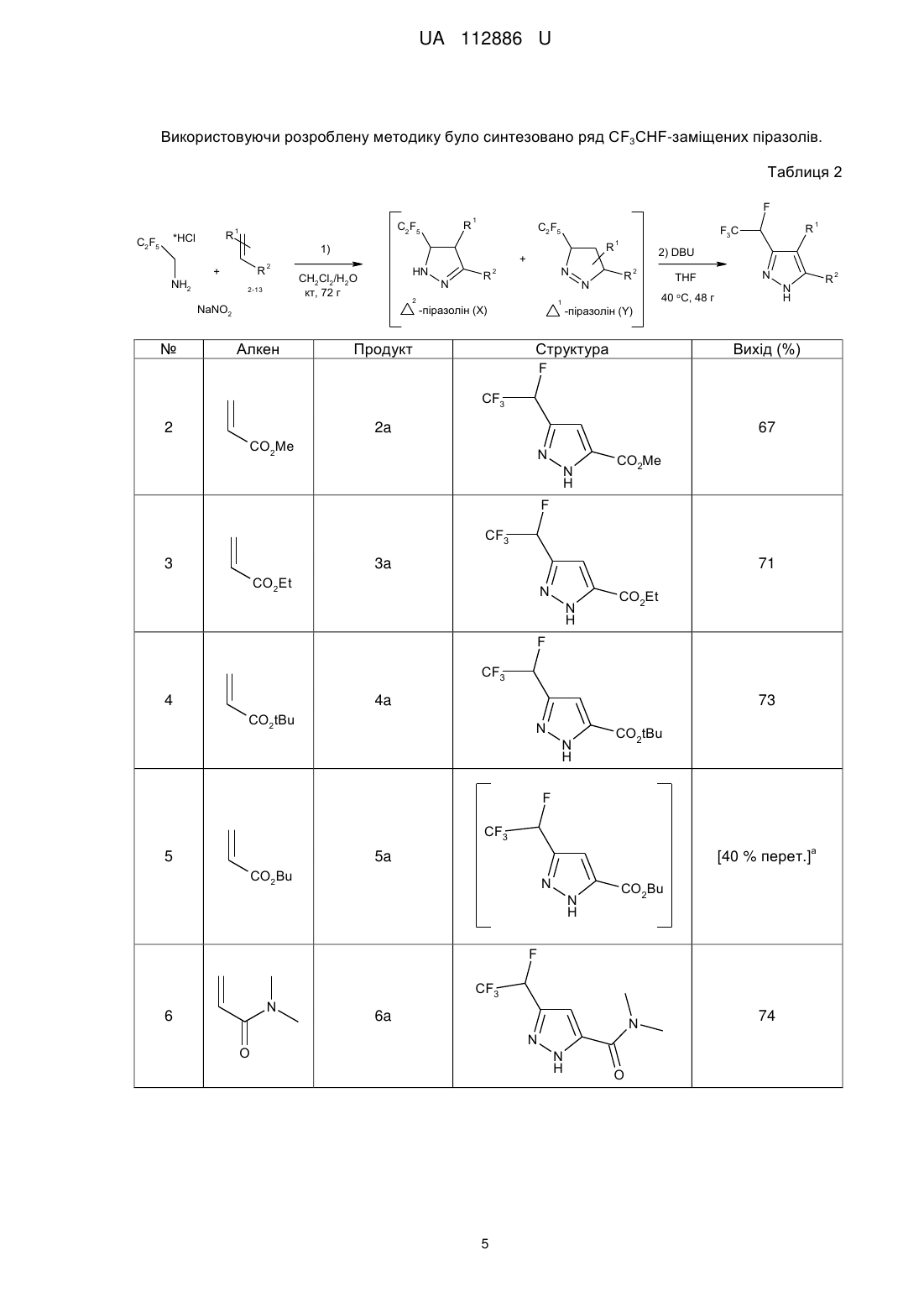
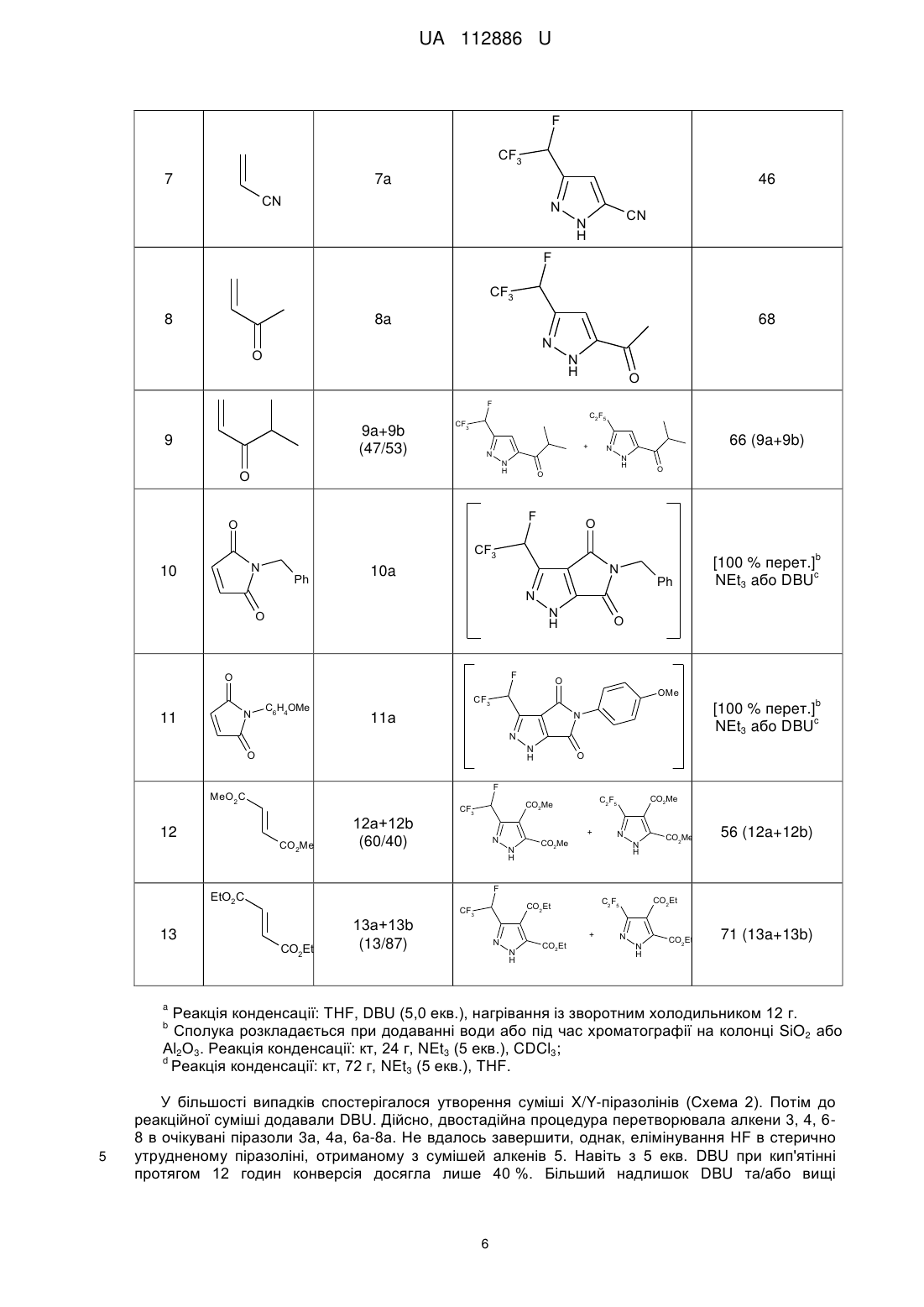
Реферат: Спосіб одержання СF3СНF-заміщених піразолів загальної формули (І): F CF3 R N N H 1 R 2 (I), в якому алкени загальної формули (II): R 1 R 2 (II), вводять в реакцію з C2F5CHN2, що одержують in situ реакцією C2F5CH2NH2 з NaNO2, з одержанням проміжних С2F5-заміщених піразолінів, які обробляють органічною основою з одержанням СF3СНF-заміщених піразолів загальної формули (І). UA 112886 U (54) СПОСІБ ОДЕРЖАННЯ CF3CHF-ЗАМІЩЕНИХ ПІРАЗОЛІВ UA 112886 U UA 112886 U 5 Корисна модель стосується галузі органічної хімії, а саме способу одержання СF3СНFзаміщених піразолів, що можуть бути застосуваними як цінні вихідні реагенти для синтезу різноманітних фторвмісних біологічно активних сполук. Включення фторованих фрагментів в органічні молекули може призвести до істотних змін в їхніх фізичних, хімічних та біологічних властивостях. Синтезовано велику кількість фторвмісних гетероциклічних сполук, що стали основою для нових біологічно активних продуктів. Піразоли, що мають замісники такі, як CHF2, CF3, C2F5, HCF2CF2, SOCF3 і т.д., стають все більш популярними в області медичної хімії та агрохімії. У той же час, концептуально привабливі СF3СНF-піразоли залишаються в тіні. 10 F NC CF3 F N O N N N N H F SOCF3 NH2 Cl Cl N N Cl Біксафен Фунгіцид Bayer CS Cl CF3 SO2NH2 Целекоксиб Протизапальний засіб Pfizer Фіпроніл Інсектицид BASF O N HCF2CF2 O2S C2F5 N N CF3 N N OCHF2 Піроксасульфон Гербіцид Kumiai Chem. Ind. 15 R WO2005/95351 Інсектицид Bayer CS Вважається, що брак досліджень щодо CF3CHF-піразолів в літературі має місце через відсутність загальних методів синтезу. Одиничні приклади, описані в літературі, це роботи Фустеро і співробітників (Схема 1), де СF3СНF-піразоли були отримані шляхом обробки 3 відповідного спирту за допомогою DAST та Леру і Пазенок, які починали з солей СF3СНFвінамідиніуму. Проте, синтез СF3СНF-піразолів з більш доступних реагентів залишається недослідженим. 1 UA 112886 U Схема 1. Відомі підходи до синтезу СF3СНF-піразолів. 5 10 Відповідно, на сьогоднішній день існує потреба в новому способі синтезу CF3CHF-заміщених піразолів, що можуть знайти застосування в одержанні різноманітних біологічно активних сполук. В 2014 автором був розроблений новий хімічний реагент, C2F5CHN2, який було використано в [3+2]-циклоприєднанні до електронно-дефіцитних алкенів і алкінів (Схема 2) з одержанням С2F5-заміщених піразолінів та С2F5-заміщених піразолів (патент на корисну модель UA107358 та UA107357). Схема 2 15 20 Неочікувано, при синтезі С2F5-заміщених піразолінів, було виявлено елімінування HF при обробці отриманих С2F5-заміщених піразолінів основою з утворенням СF3СНF-піразолів і тому було вирішено дослідити цей процес. Результатом цього стала розробка способу одержання СF3СНF-заміщених піразолів. Відповідно, об'єктом корисної моделі є спосіб одержання СF3СНF-заміщених піразолів загальної формули (І): F CF3 R N N H 1 R 2 (I), 2 UA 112886 U 1 5 10 R 20 25 30 35 40 45 50 55 1 R 15 3 в якій R являє собою Н або COOR ; 2 3 4 R являє собою Н, -COOR , -COR та -CN; 3 R являє собою Н або С1-С6алкіл2; 4 R являє собою Н, С1-С6алкіл або -N(C1-C6алкіл)2; 1 2 або R та R можуть бути об'єднані разом утворюючи 5-членну циклічну систему, що містить N як елемент кільця, і де кільце який необов'язково заміщене одним або більшою кількістю замісників, незалежно вибраних з =O, С1-С6алкілу, С6-С10арилу, де С1-С6 алкільний та С6С10арильний фрагменти необов'язково заміщені одним або більшою кількістю замісників, незалежно вибраних з галогену, С1-С6алкілу, С1-С6алкокси, С3-С10циклоалкілу, С6-С10арилу, СООС1-С6алкілу; в якому алкени загальної формули (II): 2 (II), 1 2 3 в якій R , R та R є такими як визначено вище; вводять в реакцію з C2F5CHN2, що одержують in situ реакцією C2F5CH2NH2 з NaNO2, з одержанням проміжних С2F5-заміщених піразолінів, які обробляють органічною основою з одержанням СF3СНF-заміщених піразолів загальної формули (І). В запропонованому способі C2F5CH2NH2 використовують у формі гідрохлориду і реакцію одержання C2F5CHN2 проводять у суміші метиленхлориду та води. Як органічна основа переважно використовують DBU. Термін "С1-С6 алкіл" стосується алкільного радикалу, що має від одного до шести атомів вуглецю, і має нерозгалужену або розгалужену будову. Прикладами алкільних груп є, але не обмежується, метил, етил, пропіл, ізопропіл, бутил, ізобутил, втор-бутил, тpeт-бутил, пентил, 2пентил, 3-пентил, ізопентил, неопентил, (R)-2-метилбутил, (S)-2-метилбутил, 3-метилбутил, 2,3диметилпропіл, 2,3-диметилбутил, гексил і т.і. Термін "С1-С6 алкокси", стосується алкокси радикала, що має від одного до шести атомів вуглецю, що мають нерозгалужену або розгалужену будову. Алкокси групами є, але не обмежується, метокси, етокси, пропокси, ізопропокси, бутокси, гексилокси і т.і. Термін "С3-С10 циклоалкіл", як тут використовується, стосується моно, конденсованих або місткованих біциклічних або трициклічних карбоциклічних кілець, що містять, в деяких втіленнях, від трьох до десяти атомів вуглецю. Як тут використовується, циклоалкільні кільця можуть необов'язково містити один або два подвійні зв'язки. Термін "циклоалкіл" також включає спіроциклоалкільні групи, включаючи поліциклічні системи, зв'язані через один атом. Циклоалкільними групами є, але не обмежується, циклопропіл, циклобутил, циклопентил, циклогексил, циклогептил, циклопентеніл, циклогексеніл, біцикло[2.2.1]гептаніл, біцикло[3.2.1]октаніл, біцикло[5.2.0]нонаніл, адамантил і т.і. Термін "С6-С10 арил", як тут використовується, стосується групи, що походить від ароматичного вуглеводню, що містить від шести до десяти атомів вуглецю. Прикладами таких груп є, але не обмежується, феніл і нафтил. Термін "арил" також включає конденсовані поліциклічні ароматичні системи, в яких ароматичне кільце є конденсованим з одним або більше кілець. Прикладами є, але не обмежується, 1-нафтил, 2-нафтил, 1-антрацил і 2антрацил. Також включеними в межі рамок терміну "арил", як тут використовується, є група, в якій ароматичне кільце є конденсованим з одним або більше неароматичних кілець, таким як інданіл, фенантридиніл або тетрагідронафтил, де радикал або точка приєднання знаходиться на ароматичному кільці. Термін "С2-С9 гетероарил, як тут використовується, стосується ароматичної моноциклічної або біциклічної гетероциклічної групи, що має загалом від 5 до 9 атомів в кільці, і що містить від 2 до 9 атомів вуглецю і від одного до чотирьох гетероатомів, що незалежно вибирають з азоту, кисню і сірки, за умови, що кільце згаданої групи не містить два сусідні атоми кисню або два сусідні атоми сірки. Гетероарильні групи є бензо-конденсованими циклічними системами. Прикладами гетероарильних груп є, але не обмежується, піроліл, фурил, тієніл, імідазоліл, піразоліл, оксазоліл, ізоксазоліл, ізотіазоліл, триазоліл, оксадіазоліл, фуразаніл, тіадіазоліл, тіазоліл, тетразоліл, піридиніл, піразиніл, піримідил, піридазиніл, триазиніл, індоліл, ізоіндоліл, індолізиніл, бензофураніл, бензотіофеніл, індазоліл, бензімідазоліл, бензоксазоліл, фуро[3,2b]піридиніл, бензотіазоліл, бензофуразаніл, пуриніл, хінолініл, ізохінолініл, хіназолініл, хіноксалініл, нафтиридиніл, цинолініл, фталазиніл, піридо[3,4-b]піримідил, птеридиніл і т.і. 3 UA 112886 U 5 10 Найпростішим способом одержання С2F5-заміщених піразолінів 1 є трикомпонентна реакцією між C2F5CH2NH2 * НСl, NaNO2 і метилакрилатом у воді/СН2Сl2 при кімнатній температурі. Далі ми досліджували відщеплення HF в 1 (Таблиця 1). Слабкі основи, такі як піридин, NEt3, iPrNEt2 або ДМАП не працювали при різних температурах (Таблиця 1, рядки 110). Коли була використана більш сильна основа, така як DBU, відщеплення HF відбувалось навіть при кімнатній температурі. Проте, з 1 екв. DBU, реакція не завершувалась, навіть із зворотним холодильником (Таблиця 1, рядки 11-13), в той час як великий надлишок основи забезпечував одержання побічні продукти (Таблиця 1, рядки 18-19). 1,5-2,0 екв. DBU було досить, щоб м'яко відщепити HF при кімнатній температурі або при слабкому нагріванні (Таблиця 1, рядки 14-16). Реакція ефективно проходила в THF, СНСl3 і навіть CDCl3, що 1 дозволяє її моніторинг за допомогою Н ЯМР. Було вирішено проводити подальші дослідження в THF, щоб уникнути будь-яких побічних реакцій у зв'язку з можливим утворенням дихлоркарбену з СНСl3 і DBU при нагріванні. Таблиця 1 Оптимізація синтезу СF3СНF-піразолу 2а. Вхід 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 Основа (екв) Ру (10) Ру (10) DMAP (10) DMAP (10) NEt3 (10) NEt3 (10) NEt3 (10) iPrNEt2 (10) iPrNEt2 (10) DBU (1) DBU (1) DBU (1) DBU (2) DBU (2) DBU (2) DBU (10) Розчинник СНСl3 СНСl3 СНСl3 СНСl3 СНСl3 СНСl3 СНСl3 СНСl3 СНСl3 СНСl3 СНСl3 СНСl3 СНСl3 СНСl3 THF THF СНСl3 Темп. (°С) кип'ят. кт кип'ят. кт кип'ят. кт кип'ят. кип'ят. кт кип'ят. кт кт кт кт кт 40 кт Час (г) 1 1 1 1 1 1 1 10 1 1 1 2 18 48 48 48 0,1 18 DBU (10) СНСl3 кт 6 19 DBU (10) СНСl3 кт 72 pKa 5 9 11 11 12 Вихід (%) 0 0 0 0 0 0 0 0 0 0 50 60 86 100 100 100 100 -20 % побічні продукти -50 % побічні продукти 15 Оптимізувавши процес [3+2]-циклоприєднання/НF-відщеплення, надалі проводили синтез в одній системі піразолу 2а, з 67 % виходом безпосередньо з алкену 2 без очищення проміжного С2F5-піразоліну 1. Структура 2а була підтверджена рентгеноструктурним аналізом. F C2F5 *HCl + NH2 1) CH2Cl2/H2O кт, 72 г CO2Me 2 NaNO2 CF3 2) DBU, THF 40 oC, 48 г 67% N N H 2a 20 4 CO2Me UA 112886 U Використовуючи розроблену методику було синтезовано ряд СF3СНF-заміщених піразолів. Таблиця 2 F C2F5 R *HCl NH2 C2F5 1 1 C2F5 1) R + HN CH2Cl2/H2O кт, 72 г 2-13 Алкен R + 2 N 2 NaNO2 № R R N 2 N 1 -піразолін (Х) Продукт R F3С 1 1 2) DBU R 2 THF N R N H 40 oC, 48 г -піразолін (Y) Структура Вихід (%) F CF3 2 2a 67 CO2Me NN H CO2Me F CF3 3 3a 71 CO2Et N N H CO2Et F CF3 4 4a 73 CO2tBu N N H CO2tBu F CF3 5 а [40 % перет.] 5a CO2Bu N N H CO2Bu F N 6 CF3 6a N N O N H 5 O 74 2 UA 112886 U F CF3 7 7a 46 CN N CN N H F CF3 8 8a 68 N O N H O F 9a+9b (47/53) 9 C2F5 CF3 + N N H N H O 66 (9a+9b) N O O F O O CF3 N 10 Ph b N 10a Ph N N H O F O 11 N C6 H4OMe O O OMe CF3 b [100 % пepeт.] c NEt3 aбo DBU N 11а N N H O CO2Me 12а+12b (60/40) + N N H CO2Me C2F5 CO2Me CF3 CO2Me N N H CO2Me 56 (12a+12b) F EtO2 C 13 O F MeO2C 12 [100 % пepeт.] c NEt3 aбo DBU CO2Et 13а+13b (13/87) + N N H CO2Et CO2Et C2F5 CO2Et CF3 N N H CO2Et 71 (13a+13b) a Реакція конденсації: THF, DBU (5,0 екв.), нагрівання із зворотним холодильником 12 г. Сполука розкладається при додаванні води або під час хроматографії на колонці SiO2 або Аl2О3. Реакція конденсації: кт, 24 г, NEt3 (5 екв.), CDCl3; d Реакція конденсації: кт, 72 г, NEt3 (5 екв.), THF. b 5 У більшості випадків спостерігалося утворення суміші X/Y-піразолінів (Схема 2). Потім до реакційної суміші додавали DBU. Дійсно, двостадійна процедура перетворювала алкени 3, 4, 68 в очікувані піразоли 3а, 4а, 6а-8а. Не вдалось завершити, однак, елімінування HF в стерично утрудненому піразоліні, отриманому з сумішей алкенів 5. Навіть з 5 екв. DBU при кип'ятінні протягом 12 годин конверсія досягла лише 40 %. Більший надлишок DBU та/або вищі 6 UA 112886 U 5 10 15 20 25 30 35 40 45 50 55 60 температури призводили до розкладання сполуки. Несподівано було виявлено, що інший стерично ускладнений алкен 9 дав майже рівну суміш необхідного піразолу 9А і продукт окиснення - С2F5-піразолу 9b. Малеїнмід 10, 11 плавно реагує і легко відщеплює HF навіть в присутності слабкої основи, такої як NEt3. На жаль, продукти 10а, 11а легко розкладаються при додаванні води, або під час очищення SiO2 або Аl2О3. На щастя, реакція HF-елімінування може бути здійснена в CDCl3 1 19 дозволяє прямий моніторинг ходу за даними Н-ЯМР і F-ЯМР. Був розроблений простий однореакторний спосіб одержання раніше не досліджуваних СF3СНF-піразолів. [3+2]-циклоприєднання між in situ утворюваним в системі C2F5CHN2 і електрон-дефіцитним алкеном забезпечило одержання C2F5 піразолінів. Подальше додавання DBU до реакційної суміші призвело до елімінування HF і забезпечило одержання СF3СНFпіразолів. З огляду на важливість фторованих гетероциклів в розробці ліків, в галузі агрохімії і координаційної хімії, ми вважаємо, що вчені незабаром використовуватимуть цю зручну реакцію отримання різноманітних фторвмісних піразолів. Експериментальна частина Дихлорметан очищали перегонкою. Всі реагенти були отримані від Enamine Ltd. Точки 1 19 13 плавлення не виправляли. Спектри Н-, F-, С-ЯМР знімали при 499,9 МГц, 470,3 МГц і 124,9 МГц, відповідно. Хімічні зсуви отримані в м.ч., як внутрішні стандарти використовували дейтерований тетраметилсилан (Н, С) або CFCl3 (F). MS-аналіз проводили на приладі РХМС з хімічною іонізацією. Загальна методика: Синтез піразоліну: До перемішуваної суспензії C2F5CH2NH2 * НСl (225 мг, 1,2 ммоль, 3,0 екв.) в СН2Сl2 (10,0 мл) / вода (0,5 мл), додавали нітрит натрію і (135 мг, 2,0 ммоль, 5,0 екв.) алкен (0,40 ммоль, 1,0 екв.). Реакційну суміш енергійно перемішували протягом 72 год. при кімнатній температурі. Додавали воду (2,5 мл) і СН2Сl2 (10 мл). Органічний шар відокремлювали. Водний шар промивали СН2Сl2 (2×10 мл). Об'єднані органічні шари сушили над Na2SO4 і випарювали у вакуумі з отриманням неочищеного піразоліну, який безпосередньо використовували на наступній стадії. Елімінування HF: Додавали THF (3,0 мл) і HF (122 мг, 0,80 ммоль, 2,0 екв.). Реакційну суміш нагрівали при 40 °C протягом 48 год. Розчинник обережно випарювали у вакуумі, і залишок очищали за допомогою колонкової хроматографії з використанням суміші пентан/EtOAc як елюенту, з одержанням чистих піразолів. Метил-3-(1,2,2,2-тетрафторетил)-1H-піразол-5-карбоксилат (2а) Сполука 2а була отримана як жовтувата тверда речовина (61 мг, 0,27 ммоль, 67 %) відповідно до методики з використанням пентан/EtOAc=2/1 як елюенту при хроматографії. Rf=0,5. Тпл.=91-92 °C. 1 2 3 Н ЯМР (500 МГц; CDCl3; Me4Si), : 7,08 (с, 1H, СH), 5,83 (дк, 1Н, JH-F=55,5 Гц, JH-F=7,5 Гц, CHFCF3), 3,95 (с, 3Н, СH3). 13 2 С ЯМР (125 МГц; CDCl3; Me4Si), : 159,6 (с, СО), 143,8 (д, JC-F=30,0 Гц, NCCHF), 135,6 1 2 1 (широкий с, C), 122,2 (кд, JC-F=279,0 Гц, JC-F=29,2 Гц, CHFCF3), 108,6 (с, СН), 84,1 (дк, JC2 F=183,1 Гц, JC-F=37,2 Гц, CFHCF3), 52,7 (с, СН3). 19 F ЯМР (375 МГц; CDCl3; CFCl3), : -79,1 (дд, 3F, J=15,0, 7,5 Гц, CHFCF3), -191,5 (дк, J=45,1, 11,3 Гц, 1F, CHFCF3). + МС (XI): m/z (%) = 227 [М+1] . Елементний аналіз для C7H6F4N2O2: С, 37,18; Н, 2,67; N, 12,39. Визначено: С, 36,82; Н, 3,02; N, 12,72. Кристали, придатні для рентгеноструктурного аналізу були отримані при повільному випаровуванні розведеного розчину 2а в СНСl3 при кімнатній температурі. Етил-3-(1,2,2,2-тетрафторетил)-1H-піразол-5-карбоксилат (3а) Сполука 3а була отримана як жовтувата тверда речовина (68 мг, 0,28 ммоль, 71 %) згідно з методикою з використанням пентан/ЕtOАс=2/1 як елюенту при хроматографії. Rf=0,8. Тпл.=6465 °C. 1 2 3 Н ЯМР (500 МГц; CDCl3; Me4Si), : 7,07 (с, 1Н, СH), 5,87 (дк, 1Н, JН-F=55,5 Гц, JH-F=7,5 Гц, CHFCF3), 4,43 (к, J= 7,2 Гц, СH2, 2Н), 1,40(т, J=7,2 Гц, СH3, 3Н). 13 2 С ЯМР (125 МГц; CDCl3; Me4Si), : 159,3 (с, СО), 143,6 (д, JС-F=30,0 Гц, NCCHF), 135,7 1 2 1 (вільний s, С), 122,1 (кд, JC-F=279,0 Гц, JC-F=29,1 Гц, CHFCF3), 108,7 (с, СН), 84,3 (дк, JC-F=183,1 2 Гц, JC-F=37,2 Гц, CFHCF3), 62,2 (с, СН2), 14,3 (с, СН3). 19 F ЯМР (375 МГц; CDCl3; CFCl3), : -79,6 (дд, 3F, J=15,0, 7,5 Гц, CHFCF3), -191,9 (дк, J=45,1, 11,3 Гц, 1F, CHFCF3). 7 UA 112886 U + 5 10 15 20 25 30 35 40 45 50 55 МС (XI): m/z (%) = 241 [М+1] . Елементний аналіз для C8H8F4N2O2: С, 40,01; Н, 3,36; N, 11,66. Визначено: С, 40,38; Н, 3,03; N, 11,29. трет-бутил-3-(1,2,2,2-тетрафторетил)-1Н-піразол-5-карбоксилат (4а) Сполука 4а була отримана у вигляді масла (78 мг, 0,29 ммоль, 73 % вихід) згідно з методикою з використанням пентан/ЕtOАс=3/1 як елюенту при хроматографії. Rf=0,7. Масло повільно кристалізується при кімнатній температурі при тривалому стоянні. Тпл.=51-52 °C. 1 2 3 Н ЯМР (500 МГц; CDCl3; Me4Si), : 6,98 (с, 1Н, СH), 5,79 (дк, 1Н, JH-F=55,5 Гц, JH-F=7,5 Гц, CHFCF3), 1,60 (с, OC(СH3)3, 9Н). 13 2 С ЯМР (125 МГц; CDCl3; Me4Si), : 158,2 (с, СО), 143,7 (д, JC-F=30,2 Гц, NCCHF), 137,0 1 2 1 (широкий с, С), 123,3 (кд, JC-F=279,0 Гц, JC-F=29,1 Гц, CHFCF3), 108,0 (с, СН), 85,0 (дк, JC2 F=183,1 Гц, JC-F=37,2 Гц, CFHCF3), 83,7 (с, С), 21,1 (с, СН3). 19 F ЯМР (375 МГц; CDCl3; CFCl3), : -78,9 (дд, 3F, J=15,0, 7,5 Гц, CHFCF3), -192,1 (дк, J=45,1, 11,3 Гц, 1F, CHFCF3). + МС (XI): m/z (%) - 269 [М+1] . Елементний аналіз для C10H12F4N2O2: С, 44,78; Н, 4,51; N, 10,44. Визначено: С, 44,51; H, 4,27; N, 10,79. Кристали, придатні для рентгеноструктурного аналізу були отримані при повільному випаровуванні розведеного розчину 4а в СНСl3 при кімнатній температурі. N,N-диметил-3-(1,2,2,2-тетрафторетил)-1H-піразол-5-карбоксамід (6а) Сполука 6а була отримана як жовтувата тверда речовина (71 мг, 0,30 ммоль, 74 % вихід) згідно з методикою з використанням пентан/ЕtOАс=1/1 як елюенту при хроматографії. Rf=0,5. Тпл.=89-90 °C. 1 2 3 Н ЯМР (500 МГц; CDCl3; Me4Si), : 6,74 (с, 1Н, СН), 5,75 (дк, 1Н, JH-F=55,5 Гц, JH-F=7,5 Гц, CHFCF3), 3,32 (с, 3Н, СH3), 3,18 (с, 3Н, СH3). 13 2 С ЯМР (125 МГц; CDCl3; Me4Si), : 160,1 (с, СО), 143,1 (д, JC-F=30,0 Гц, NCCHF), 135,6 1 2 1 (широкий с. С), 123,2 (кд, JC-F=279,0 Гц, JC-F=29,2 Гц, CHFCF3), 106,4 (с, СН), 84,8 (дк, JC2 F=183,1 Гц, JC-F=37,2 Гц, CFHCF3), 38,9 (с, СН3), 36,7 (с, СН3). 19 F ЯМР (375 МГц; CDCl3; CFCl3), : -78,9 (дд, 3F, J=15,0, 7,5 Гц, CHFCF3), -190,5 (дк, J=45,1, 11,3 Гц, 1F, CHFCF3). + МС (XI): m/z (%) = 240 [М+1] . Елементний аналіз для C8H9F4N3O: С, 40,18; Н, 3,79; N, 17,57. Визначено: С, 40,52; Н, 3,44; N, 17,81. Кристали, придатні для рентгеноструктурного аналізу були отримані при повільному випаровуванні розведеного розчину 6а в СНСl3 при кімнатній температурі. 3-(1,2,2,2-тетрафторетил)-1H-піразол-5-карбонітрил (7а) Сполука 7а була отримана як масло (35 мг, 0,18 ммоль, 46 % вихід) згідно з методикою з використанням пентан/EtOAc=2/1 як елюенту при хроматографії. Rf=0,8. Масло повільно кристалізується при кімнатній температурі при тривалому стоянні. Тпл.=65-66 °C. 1 2 3 Н ЯМР (500 МГц; CDCl3; Me4Si), : 7,01 (с, 1H, СH), 5,82 (дк, 1Н, JH-F=55,5 Гц, JН-F=7,5 Гц, CHFCF3). 13 2 С ЯМР (125 МГц; CDCl3; Me4Si), : 138,3 (д, JC-F=30,0 Гц, NCCHF), 135,6 (вільний с, О, 1 2 1 122,2 (кд, JC-F=279,0 Гц, JC-F=29,2 Гц, CHFCF3), 112,0 (с, CN), 109,6 (с, СН), 82,1 (дк, JC-F=183,1 2 Гц, JC-F=37,2 Гц, CFHCF3). 19 F ЯМР (375 МГц; CDCl3; CFCl3), : -79,0 (дд, 3F, J=15,0, 7,5 Гц, CHFCF3), -194,2 (дк, J=45,1, + МС (XI): m/z (%) = 194 [М+1] . Елементний аналіз для C8H9F4N3O: С, 37,32; Н, 1,57; N, 21,76. Визначено: С, 37,64; Н, 1,21; N, 22,08. Кристали, придатні для рентгеноструктурного аналізу були отримані при повільному випаровуванні розведеного розчину 7а в СНСl3 при кімнатній температурі. 1-[3-(1,2,2,2-тетрафторетил)-1H-піразол-5-іл]-етанон (8а) Сполука 8а була отримана як біла тверда речовина (57 мг, 0,27 ммоль, 68 % вихід) згідно з методикою з використанням пентан/EtOAc=2/1 як елюенту при хроматографії. Rf=0,6. Тпл.=8586 °C. 1 2 3 Н ЯМР (500 МГц; CDCl3; Me4Si), : 7,00 (с, 1Н, СН), 5,74 (дк, 1Н, JH-F=55,5 Гц, JH-F=7,5 Гц, CHFCF3), 2,52 (с, 3Н, СH3). 13 С ЯМР (125 МГц; CDCl3; Me4Si), : 188,6 (с, СО), 143,8 (широкий с, NCCHF), 135,6 (широкий 1 2 1 2 с, С), 121,2 (кд, JC-F=279,0 Гц, JC-F=29,2 Гц, CHFCF3), 108,6 (с, СH), 84,4 (дк, JС-F=183,1 Гц, JCF=37,2 Гц, CFHCF3), 29,7 (с, СН3). 8 UA 112886 U F ЯМР (375 МГц; CDCl3; CFCl3), : -79,1 (дд, 3F, J=15,0, 7,5 Гц, CHFCF3), -191,8 (дк, J=45,1, 11,3 Гц, 1F, CHFCF3). + МС (XI): m/z (%) = 211 [М+1] . Елементний аналіз для C7H6F4N2O: С, 40,01; Н, 2,88; N, 13,33. Визначено: С, 40,26; Н, 2,70; N, 13,02. 2-Метил-1-[3-(1,2,2,2-тетрафторетил)-1H-піразол-5-іл]-1-пропанон (9а) + 2-метил-1-[3(пентафтороетил)-1H-піразол-5-іл]-1-пропанон (9b) Суміш 9a/9b=47/53 отримували у вигляді масла жовтого кольору (66 мг, 0,26 ммоль, 66 % вихід) згідно з методикою (реакція з DBU протягом 120 год. замість 24 год.) з використанням пентан/EtOAc=5/ як елюенту при хроматографії. Rf=0,4. 1 Н ЯМР (500 МГц; CDCl3; Me4Si), : 7,06 (с, 0,6Н, CH, 9b), 7,03 (с, 0,4Н, СH, 9а), 5,87 (дк, 2 3 0,4Н, JH-F=55,5 Гц, JH-F=7,5 Гц, CHFCF3, 9а), 3,26 (m, 1Н, СH, 9a+9b), 1,27 (д, J=7,5 Гц, 6Н, СH, 9а+9b). 19 F ЯМР (375 МГц; CDCl3; CFCl3), : -79,1 (дд, J= 15,0, 7,5 Гц, CHFCF3, 9a), -85,0 (т, J=3,7 Гц, CF2CF3, 9b), -113,6 (д, J=3,7 Гц, CF2CF3, 9b), -191,8 (дк, J=45,1, 11,3 Гц, CHFCF3, 9a). + + MC (XI): m/z (%) = 239 [M(9a)+1], 257 [M(9b)+1] . Отриманий in situ 5-(фенілметил)-3-(1,2,2,2-тетрафторетил)-піроло[3,4-с]піразол-4,6(1H,5H)діон (10а) Відповідний піразолін синтезували за методикою, вказаною в літературі. Відщеплення HF проводили в CDCl3 (замість THF) як елюент при хроматографії NEt3 (10 екв., замість DBU). Елімінування закінчувалось протягом 1 год. при кімнатній температурі. Реакцію контролювали 1 за допомогою Н ЯМР. Продукт, однак, розкладається при додаванні води або при очищенні за допомогою колонкової хроматографії на SiO2, або Аl2О3. 1 Н ЯМР (500 МГц; NEt3+CDCl3; Me4Si), : 7,41 (д, J=7,4 Гц, 2Н, Ph), 7,33 (д, J=7,4 Гц, 2Н, Ph), 2 3 7,21 (т, J=7,4 Гц, 1Н, Ph), 5,88 (дк, 1H, JH-F=55,5 Гц, JH-F=7,5 Гц, СHFСF3), 4,67 (с, 2Н, СН2). Отриманий in situ 5-(4-метоксифеніл)-3-(1,2,2,2-тетрафторетил)-піроло[3,4-с]піразол4,6(1H,5H)-діон (11а) Експеримент проводили аналогічно 10а. 1 Н ЯМР (500 МГц; NEt3+CDCl3; Me4Si), : 7,22 (д, J=8,8 Гц, 2Н, Аr), 7,33 (д, J=8,8 Гц, 2Н, Аr), 2 3 5,87 (дк, 1Н, JH-F=55,2 Гц, JH-F=7,6 Гц, CHFCF3), 3,78 (с, 3Н, СH3). Диметил 3-(1,2,2,2-тетрафторетил)-1H-піразол-4,5-дикарбоксилат (12а) + диметил 3-(1,2,2,2пентафторетил)-1H-піразол-4,5-дикарбоксилат(12b) Суміш 12а/12b = 60/40 отримали у вигляді масла жовтого кольору, (65 мг, 0,22 ммоль, 56 % вихід) згідно з методикою з використанням пентан /ЕtOАс=2/1 як елюенту при хроматографії. Rf=0,6. 1 2 3 Н ЯМР (500 МГц; CDCl3; Me4Si), : 6,39 (дк, 0,6Н, JH-F=55,5 Гц, JH-F=7,5 Гц, CHFCF3, 12a), 3,96-3,91 (4 с, 6Н, CH3, 12a+12b). 19 F ЯМР (375 МГц; CDCl3; CFCl3), : -77,1 (дц, J=15,0, 7,5 Гц, CHFCF3, 12a), -84,0 (t, J=3,7 Гц, CF2CF3, 12b), -112,6 (д, J=3,7 Гц, CF2CF3, 12b), -197,8 (да, J=45,1, 11,3 Гц, CHFCF3, 12a). + + MC (XI): m/z (%) = 285 [M(12a)+1], 303 [M(12b)+1] . Диметил 3-(1,2,2,2-тетрафторетил)-1H-піразол-4,5-дикарбоксилат (13а)+диметил 3-(1,2,2,2пентафторетил)-1H-піразол-4,5-дикарбоксилат (13b) Суміш 13a/13b отримували у вигляді масла жовтого кольору (78 мг, 0,24 ммоль, 61 % вихід) згідно з методикою (3,0 екв. DBU). Використовуючи пентан/ЕtOАс=2/1 як елюент при хроматографії. Rf=0,6. 1 2 3 Н ЯМР (500 МГц; CDCl3; Me4Si), : 6,35 (дк, 0,15Н, JH-F=55,5 Гц, JH-F=7,5 Гц, CHFCF3, 13a), 4,40 (m, 4H, CH2, 13a+13b), 1,35 (т, J=14,0 Гц, 6Н, CH2, 13a+13b). 19 F ЯМР (375 МГц; CDCl3; CFCl3), : -77,1 (дц, J=15,0, 7,5 Гц, CHFCF3, 13a), -84,0 (t, J=3,7 Гц, CF2CF3, 13b), -112,6 (д, J=3,7 Гц, CF2CF3, 13b), -197,8 (дк, J=45,1, 11,3 Гц, CHFCF3, 13a). + + MC (XI): m/z (%)- 313 [M(13a)+1], 331 [M(13b)+1] . 19 5 10 15 20 25 30 35 40 45 50 ФОРМУЛА КОРИСНОЇ МОДЕЛІ 1. Спосіб одержання СF3СНF-заміщених піразолів загальної формули (І): 9 UA 112886 U F CF3 R N N H 5 10 R 2 (I), 1 3 в якій R являє собою Н або COOR ; 2 3 4 R являє собою Н, -COOR , -COR та -CN; 3 R являє собою Н або С1-С6алкіл2; 4 R являє собою Н, С1-С6алкіл або -N(С1-С6алкіл)2; 1 2 або R та R можуть бути об'єднані разом утворюючи 5-членну циклічну систему, що містить N як елемент кільця, і де кільце необов'язково заміщене одним або більшою кількістю замісників, незалежно вибраних з =O, С1-С6алкілу, С6-С10арилу, де С1-С6алкільний та С6-С10арильний фрагмент необов'язково заміщені одним або більшою кількістю замісників, незалежно вибраних з галогену, С1-С6алкілу, С1-С6алкокси, С3-С10циклоалкілу, С6-С10арилу, -СООС1-С6алкілу; в якому алкени загальної формули (II): R 1 R 15 1 2 (II), 1 2 в якій R та R є такими як визначено вище; вводять в реакцію з C2F5CHN2, що одержують in situ реакцією C2F5CH2NH2 з NaNO2, з одержанням проміжних С2F5-заміщених піразолінів, які обробляють органічною основою з одержанням СF3СНF-заміщених піразолів загальної формули (І). 2. Спосіб за п. 1, який відрізняється тим, що C2F5CH2NH2 використовують у формі гідрохлориду і реакцію одержання C2F5CHN2 проводять у суміші метиленхлориду та води. 3. Спосіб за п. 1, який відрізняється тим, що як органічну основу використовують DBU. 20 Комп’ютерна верстка Д. Шеверун Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 10
ДивитисяДодаткова інформація
МПК / Мітки
МПК: C07D 231/00
Мітки: одержання, піразолів, cf3cнf-заміщених, спосіб
Код посилання
<a href="https://ua.patents.su/12-112886-sposib-oderzhannya-cf3cnf-zamishhenikh-pirazoliv.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання cf3cнf-заміщених піразолів</a>
Попередній патент: Спосіб одержання 4-фторалкілоксазол-5-карбонової кислоти
Наступний патент: Спосіб одержання 3,5-дизаміщених 1,2,4-оксадіазолів
Випадковий патент: Спосіб лікування лікворно-дистензійного синдрому при хронічному арахноенцефаліті