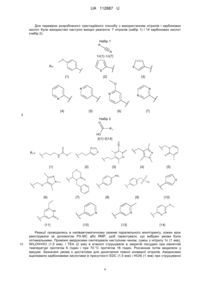
Спосіб одержання 3,5-дизаміщених 1,2,4-оксадіазолів
Формула / Реферат
1. Спосіб одержання 3,5-дизаміщеного 1,2,4-оксадіазолу формули (І):
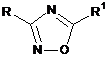 ,
,
в якій
R являє собою С1-Салкіл, С3-С10циклоалкіл, С6-С10арил або С2-С9гетероарил, кожен з яких необов'язково заміщений одним або більшою кількістю замісників, незалежно вибраних з С1-С6алкілу, С2-С6алкенілу, С2-С6алкінілу, С1-С6алкокси, С3-С10циклоалкілу, С6-С10арилу, С2-С9гетероарилу, галогену, -CN, NO2, NH2, -SC1-С6алкілу, -SOC1-С6алкілу, -SO2C1-С6алкілу, -NSO2C1-C6алкілу, -NHC1-С6алкілу, -N(C1-С6алкіл)2, -NHCOOC1-C6алкілу, -NHCONHC1-С6алкілу, -CONHC1-C6алкілу, -СОС1-С6алкілу, -СООС1-С6алкілу, -SC1-C6алкілу, -SOC1-C6 алкілу або -SO2C1-C6алкілу, де згадані С1-С6алкільні, С2-С6алкенільні, С2-С6алкінільні, С1-С6алкокси, С3-С10циклоалкільні, С6-С10арильні, С2-С9гетероарильні частини згаданих вище замісників можуть бути також заміщені одним або більшою кількістю додаткових замісників, незалежно вибраних з С1-С6алкілу, С1-С6алкокси, С3-С10циклоалкілу, С6-С10арилу, С2-С9гетероарилу, галогену, -CN, NO2 або NH2;
R1 являє собою С1-С6алкіл, С3-С10циклоалкіл, С6-С10арил або С2-С9гетероарил, кожен з яких необов'язково заміщений одним або більшою кількістю замісників, незалежно вибраних з С1-С6алкілу, С2-С6алкенілу, С2-С6алкінілу, С1-С6алкокси, С3-С10циклоалкілу, С6-С10арилу, С2-С9гетероарилу, галогену, -CN, NO2, -SC1-С6алкілу, -SOC1-С6алкілу, -SO2C1-С6алкілу, -SO2NH2, -NSO2C1-C6алкілу, -NHC1-С6алкілу, -N(C1-С6алкіл)2, -NHCOOC1-C6алкілу, -CONHC1-C6алкілу, -СОС1-С6алкілу, -СООС1-С6алкілу, -SC1-C6алкілу, -SOC1-C6алкілу або -SO2C1-C6алкілу, де згадані С1-С6алкільні, С2-С6алкенільні, С2-С6алкінільні, С1-С6алкокси, С3-С10циклоалкільні, С6-С10арильні, С2-С9гетероарильні частини згаданих вище замісників можуть бути також заміщені одним або більшою кількістю додаткових замісників, незалежно вибраних з С1-С6алкілу, С1-С6алкокси, С3-С10циклоалкілу, С6-С10арилу, С2-С9 гетероарилу, галогену, -CN, NO2 або NH2;
в якому нітрил загальної формули (II):
R-CºN,
де R є таким як визначено вище;
а) обробляють NH2OH•HCl та TEA в етанолі при кімнатній температурі і потім одержану реакційну суміш нагрівають при 70 °C;
б) розчинник видаляють і до одержаного проміжного амідоксиму додають карбонову кислоту формули (III):
R1-COOH,
де R1 є таким як визначено вище;
EDC (N-(3-диметиламінопропіл)-N'-етилкарбодіімід) та HOAt (1-гідроксі-7-аза-1Н-бензотриазол) і залишають;
в) до одержаної суміші додають триетиламін і нагрівають, одержуючи 3,5-дизаміщений 1,2,4-оксадіазол формули (І).
2. Спосіб за п. 1, який відрізняється тим, що нагрівання на стадії в) проводять при температурі 100-120 °C.
Текст
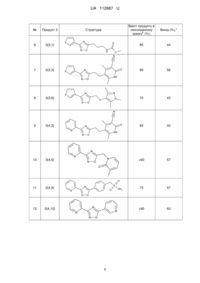
Реферат: Спосіб одержання 3,5-дизаміщеного 1,2,4-оксадіазолу формули (І): N R N R O 1 , в якій нітрил загальної формули (II): R-CN, а) обробляють NH2OH•HCl та TEA в етанолі при кімнатній температурі і потім одержану реакційну суміш нагрівають при 70 °C; б) розчинник видаляють і до одержаного проміжного амідоксиму додають карбонову кислоту формули (III): 1 R -COOH EDC (N-(3-диметиламінопропіл)-N'-етилкарбодіімід) та HOAt (1-гідроксі-7-аза-1Н-бензотриазол) і залишають; в) до одержаної суміші додають триетиламін і нагрівають, одержуючи 3,5-дизаміщений 1,2,4оксадіазол формули (І). UA 112887 U (54) СПОСІБ ОДЕРЖАННЯ 3,5-ДИЗАМІЩЕНИХ 1,2,4-ОКСАДІАЗОЛІВ UA 112887 U UA 112887 U 5 10 15 Корисна модель стосується галузі органічної хімії, а саме паралельного синтезу 3,5дизаміщених 1,2,4-оксадіазолів, що можуть бути використанні для пошуку нових біологічно активних сполук. Високопродуктивний скринінг (HTS) є корисним інструментом у багатьох проектах пошуку нових ліків. Для очікування високої ефективності HTS необхідні великі бібліотеки різноманітних сполук зі сприятливими фізико-хімічними профілями, які, як правило, синтезуються за допомогою паралельної хімії. Відкриття нових процедур паралельного синтезу і оптимізація умов, таким чином, є важливим напрямком у сприянні пошуку нових лікарських препаратів. Крім того, нова паралельна хімія дозволяє розширювати синтетично доступну область віртуального хімічного простору. Недавній наш проект було спрямовано на пошук агоністів вільних жирних кислот рецептора 1 (GPR40) - потенційних антидіабетичних засобів. HTS-тести, дозволили визначити, що рецептор взаємодіє з досі невідомим в такій ролі 1,2,4-оксадіазольним фрагментом, який не мав достатньої кількості аналогів для продовження досліджень. Саме це і спонукало створити паралельний підхід до синтезу цих сполук. Також, 3,5-дизаміщені 1,2,4-оксадіазоли широко використовуються в медичній хімії, даний фрагмент зустрічається в експериментальних і комерційних препаратах і має прийнятний ADME профіль. F N N N N N N O N Проксазол Розлади кишково-шлункового тракту O N Оксоламін Кашель O COOH Аталурен М'язова дистрофія Дученеа N O N O N O N N N CF3 25 30 35 40 O O Плеконаріл Противірусний 20 N N Фасіплон Анксіолітик Літературний пошук показав кілька відомих підходів до 3,5-дизаміщених 1,2,4-оксадіазолів. На наш подив, деякі з цих методів були запропоновані лише недавно, після більше 120 років з моменту відкриття 1,2,4-оксадіазолу, що вказує на зростаючий інтерес до сполук даного типу. Про паралельний синтез, однак, було повідомлено лише в реакції між амідоксимами і карбоновими кислотами (Borg, S.; Estenne-Bouhtou, G.; Luthman, K.; Csoeregh, I.; Hesselink, W.; Hacksell, U. Synthesis of 1,2,4-Oxadiazole-, 1,3,4-Oxadiazole-, and 1,2,4-Triazole-Derived Dipeptidomimetics. J. Org. Chem. 1995, 60, 3112-3120). Але цей підхід мав обмеження: амідоксими є малодоступними в порівнянні з карбоновими кислотами. Тому даний метод дозволить отримати бібліотеки низької різноманітності, а отже призведе до неефективного дослідження хімічного простору. Додаткові ознаки амідоксимів: нестабільність і відносно висока ціна, роблять ці реагенти незадовільними для умов паралельної хімії. Після ретельного вивчення інших відомих методів, було вибрано реакцію між нітрилами і карбоновими кислотами. Нітрили є стабільнішими і дешевшими реагентами. Дійсно, наявні у великій кількості нітрили дають можливість широко варіювати замісники в С(3)-положенні кільця, таким чином, отримувати диверсифіковані бібліотеки. Але описана методика (Nowrouzi, N.; Khalili, D.; Irajzadeh, M. One-Pot Synthesis of 1,2,4-Oxadiazoles from Carboxylic Acids Using 4(Dimethylamino)pyridinium Acetate as Efficient, Regenerable, and Green Catalyst with Ionic Liquid Character. J. Iran. Chem. Soc. 2014, 12, 801-806) з використанням цього підходу не підходить для паралельної хімії: а) відсутність розчинника ускладнила б перемішування реакційної суміші при субмілімолярних кількостях реагентів; 1 UA 112887 U 5 б) ацетат-аніон каталізатора 4-(диметиламіно)піридиноцтової кислоти, може реагувати з амідоксимами, що в результаті дає побічні продукти - 5-метил-1,2,4-оксадіазол; в) не було досліджено область застосування і обмеження способу. Відповідно, існує потреба в розробці способу одержання 3,5-дизаміщених 1,2,4-оксадіазолів через використання адаптованої паралельної реакції між нітрилами і карбоновими кислотами і її застосування до різних субстратів. Відповідно, об'єктом корисної моделі є спосіб одержання 3,5-дизаміщеного 1,2,4-оксадіазолу формули (I): N R N 10 15 20 25 30 R O 1 , в якій R являє собою С1-С6алкіл, С3-С10циклоалкіл, С6-С10 арил або С2-С9гетероарил, кожен з яких необов'язково заміщений одним або більшою кількістю замісників незалежно вибраних з С 1С6алкілу, С2-С6алкенілу, С2-С6алкінілу, С1-С6алкокси, С3-С10циклоалкілу, С6-С10арилу, С2С9гетероарилу, галогену, -CN, NO2, NH2, -SC1-С6алкілу, -SOC1-С6алкілу, -SO2C1-С6алкілу, NSO2C1-C6алкілу, -NHC1-С6алкілу, -N(C1-С6алкіл)2, -NHCOOC1-C6алкілу, -NHCONHC1-С6алкілу, CONHC1-C6алкілу, -СОС1-С6алкілу, -СООС1-С6алкілу, -SC1-C6алкілу, -SOC1-C6алкілу або -SO2C1C6алкілу, де згадані С1-С6алкільні, С2-С6алкенільні, С2-С6алкінільні, С1-С6алкокси, С3С10циклоалкільні, С6-С10арильні, С2-С9гетероарильні частини згаданих вище замісників можуть бути також заміщені одним або більшою кількістю додаткових замісників, незалежно вибраних з С1-С6алкілу, С1-С6алкокси, С3-С10циклоалкілу, С6-С10арилу, С2-С9 гетероарилу, галогену, -CN, NO2 або NH2; 1 R являє собою С1-С6алкіл, С3-С10циклоалкіл, С6-С10арил або С2-С9гетероарил, кожен з яких необов'язково заміщений одним або більшою кількістю замісників незалежно вибраних з С 1С6алкілу, С2-С6алкенілу, С2-С6алкінілу, С1-С6алкокси, С3-С10циклоалкілу, С6-С10арилу, С2С9гетероарилу, галогену, -CN, NO2, -SC1-С6алкілу, -SOC1-С6алкілу, -SO2C1-С6алкілу, -SO2NH2, NSO2C1-C6алкілу, -NHC1-С6алкілу, -N(C1-С6алкіл)2, -NHCOOC1-C6алкілу, -CONHC1-C6алкілу, СОС1-С6алкілу, -СООС1-С6алкілу, -SC1-C6алкілу, -SOC1-C6алкілу або -SO2C1-C6алкілу, де згадані С1-С6алкільні, С2-С6алкенільні, С2-С6алкінільні, С1-С6алкокси, С3-С10циклоалкільні, С6С10арильні, С2-С9гетероарильні частини згаданих вище замісників можуть бути також заміщені одним або більшою кількістю додаткових замісників незалежно вибраних з С 1-С6алкілу, С1С6алкокси, С3-С10циклоалкілу, С6-С10арилу, С2-С9гетероарилу, галогену, -CN, NO2 або NH2; в якому нітрил загальної формули (II): 35 R-CN, 40 де R є таким як визначено вище; а) обробляють NH2OH•HCl та TEA в етанолі при кімнатній температурі і потім одержану реакційну суміш нагрівають при 70 °C; б) розчинник видаляють і до одержаного проміжного амідоксиму додають карбонову кислоту формули (III): 1 R -COOH, 45 50 55 1 де R є таким як визначено вище; EDC (N-(3-диметиламінопропіл)-N'-етилкарбодіімід) та HOAt (1-гідроксі-7-аза-1Нбензотриазол) і залишають; в) до одержаної суміші додають триетиламін і нагрівають, одержуючи 3,5-дизаміщений 1,2,4-оксадіазол формули (І). На стадії в) нагрівання проводять при температурі 100-120 °C. Термін "С1-С6алкіл" стосується алкільного радикалу, що має від одного до шести атомів вуглецю, і має нерозгалужену або розгалужену будову. Прикладами алкільних груп є, але не обмежується, метил, етил, пропіл, ізопропіл, бутил, ізобутил, втop-бутил, трет-бутил, пентил, 2пентил, 3-пентил, ізопентил, неопентил, (R)-2-метилбутил, (S)-2-метилбутил, 3-метилбутил, 2,3диметилпропіл, 2,3-диметилбутил, гексил і т.і. 2 UA 112887 U 5 10 15 20 25 30 35 40 45 50 55 Термін "С1-С6алкокси" стосується алкокси радикала, що має від одного до шести атомів вуглецю, що мають нерозгалужену або розгалужену будову. Алкокси групами є, але не обмежується, метокси, етокси, пропокси, ізопропокси, бутокси, гексилокси і т.і. Термін "С3-С10циклоалкіл", як тут використовується, стосується моно, конденсованих або місткованих біциклічних або трициклічних карбоциклічних кілець, що містять, в деяких втіленнях, від трьох до десяти атомів вуглецю. Як тут використовується, циклоалкільні кільця можуть необов'язково містити один або два подвійні зв'язки. Термін "циклоалкіл" також включає спіроциклоалкільні групи, включаючи поліциклічні системи, зв'язані через один атом. Циклоалкільними групами є, але не обмежується, циклопропіл, циклобутил, циклопентил, циклогексил, циклогептил, циклопентеніл, циклогексеніл, біцикло[2.2.1]гептаніл, біцикло[3.2.1]октаніл, біцикло[5.2.0]нонаніл, адамантил і т.і… Термін "С6-С10арил", як тут використовується, стосується групи, що походить від ароматичного вуглеводню, що містить шести до десяти атомів вуглецю. Прикладами таких груп є, але не обмежується, феніл і нафтил. Термін "арил" також включає конденсовані поліциклічні ароматичні системи, в яких ароматичне кільце є конденсованим з одним або більше кілець. Прикладами є, але не обмежується, 1-нафтил, 2-нафтил, 1-антрацил і 2-антрацил. Також включеними в межі рамок терміну "арил", як тут використовується, є група, в якій ароматичне кільце є конденсованим з одним або більше неароматичних кілець, таким як інданіл, фенантридиніл або тетрагідронафтил, де радикал або точка приєднання знаходиться на ароматичному кільці. Термін "С2-С9 гетероарил, як тут використовується, стосується ароматичної моноциклічної або біциклічної гетероциклічної групи, що має загалом від 5 до 9 атомів в кільці, і що містить від 2 до 9 атомів вуглецю і від одного до чотирьох гетероатомів, що незалежно вибирають з азоту, кисню і сірки, за умови, що кільце згаданої групи не містить два сусідні атоми кисню або два сусідні атоми сірки. Гетероарильні групи є бензо-конденсованими циклічними системами. Прикладами гетероарильних груп є, але не обмежується, піроліл, фурил, тієніл, імідазоліл, піразоліл, оксазоліл, ізоксазоліл, ізотіазоліл, триазоліл, оксадіазоліл, фуразаніл, тіадіазоліл, тіазоліл, тетразоліл, піридиніл, піразиніл, піримідил, піридазиніл, триазиніл, індоліл, ізоіндоліл, індолізиніл, бензофураніл, бензотіофеніл, індазоліл, бензімідазоліл, бензоксазоліл, фуро[3,2b]піридиніл, бензотіазоліл, бензофуразаніл, пуриніл, хінолініл, ізохінолініл, хіназолініл, хіноксалініл, нафтиридиніл, цинолініл, фталазиніл, піридо[3,4-d]піримідил, птеридиніл і т.і. Запропонований спосіб одержання 3,5-дизаміщених 1,2,4-оксадіазолів з нітрилів і карбонових кислот - це тристадійний процес: 1) одержання амідоксиму in situ; 2) конденсація амідоксиму з карбоновою кислотою з утворенням О-ациламідоксиму; 3) циклодегідратація О-ациламідоксиму. При більш уважному вивченні цих перетворень видно, що процедура не потребує спеціальних умов реакції, наприклад, додавання реагентів краплинами, підтримки низької температури або інертної атмосфери і протікає при кімнатній або підвищеній температурі. Таким чином, реакції проводяться в шейкері печі. Класичний синтез амідоксимів з нітрилів і надлишку гідрохлориду гідроксиламіну (NH2OH•HCl) проводять в метанолі або етанолі, в присутності основи, такої як NaOH, Na 2CO3, K2CO3 і триетиламіну (TEA). Для отримання амідоксиму вибрали етанол, оскільки цей розчинник дозволяє помірне нагрівання для досягнення ефективного перетворення реагентів і може допомогти видалити воду шляхом азеотропної відгонки. TEA - недорога слабка основа, найбільш придатною для цієї стадії. TEA і його гідрохлорид розчинні в етанолі, тоді як інші основи зі списку мають низьку розчинність і можуть заважати ефективному перемішуванню в невеликих об'ємах. Сила цієї основи також була достатньою для проведення циклодегідратації О-ациламідоксимів. Наш попередній досвід в реакціях ацилювання показує, що найбільш ефективним для паралельних умов конденсуючим реагентом є N-(3-диметиламінопропіл)-N'-етилкарбодіімід (EDC) та 1-гідрокси-7-аза-1Н-бензотриазол (HOAt). EDC широко використовується в синтезі лікарських засобів; HOAt є пригнічувачем епімеризації, безпечним і більш стабільним аналогом 1-гідроксибензотриазолу (HOBt). Ці реагенти підтримують ацилювання навіть електронодефіцитною карбоновою кислотою і переносять водну обробку, оскільки не вступають в реакцію з EDC з утворенням N-(3-диметиламінопропіл)-N'-етилсечовини - побічного продукту, який розчинний у воді. Реакція ацилювання відбувається при кімнатній температурі, але наступна циклодегідратація О-ациламідоксиму потребує підвищених температур - 100-120 °C. Таким чином, для цих стадій було вибрано DMF як розчинник. 3 UA 112887 U Для перевірки розробленого тристадійного способу з використанням нітрилів і карбонових кислот були використані наступні вихідні реагенти: 7 нітрилів (набір 1) і 14 карбонових кислот (набір 2). Набір 1 R N 1n{1}-1n{7} O S R= S {1} {2} {3} O N N N N N {4} {5} {6} {7} 5 Набір 2 O R1 HO 2{1}-2{14} N O N N O S R1= N H O N NH {1} {2} O N {3} {4} {5} O NO2 N N N O O S O O {6} {7} {8} O NH2 {9} {10} O NH N N N N O {11} 10 {12} {13} {14} Реакції проводились в напівавтоматичному режимі паралельного моніторингу, кожен крок реєстрували за допомогою РХ-МС або ЯМР, щоб гарантувати, що вибрані умови були оптимальними. Проміжні амідоксими синтезували наступним чином: суміш з нітрилу 1n (1 екв), NH2OH•HCl (1,5 екв), і TEA (2 екв) в етанолі струшували в закритій посудині при кімнатній температурі протягом 6 годин і при 70 °C протягом 16 годин. Розчинник потім видаляли у вакуумі. Зазначені умови є достатніми для досягнення повної конверсії нітрилів. Амідоксими ацилювали карбоновими кислотами в присутності EDC (1,5 екв) і HOAt (1 екв) при струшуванні 4 UA 112887 U 5 10 віал при кімнатній температурі протягом 24 годин. Тривалим часом реакції забезпечується повне перетворення в О-ациламідоксими. Циклодегідратація 1,2,4-оксадіазолу при 100 °C в присутності TEA (1 екв) завершувалась за 3 години. Сумісність реагентів і розчинників дозволяла проводити реакції в одній системі. Екстрагуванням водного розчину за допомогою 1 СНСl3 одержували неочищені суміші продуктів, які аналізувалися за допомогою РХ-МС або Н ЯМР. Аналіз сирих сумішей показав високу ефективність розробленого способу (Таблиця 1): водна обробка забезпечує чисті сполуки (> 90 % вміст продукту) в більшості експериментів. Суміші з вмістом продукту не більше 90 %, піддавали обернено-фазовій ВЕРХ; ідентичність і 1 13 чистоту синтезованих сполук підтверджували Н, С ЯМР і РХ-МС. NH2OH,TEA 1) кт, 6 г 2) 70оC, 16 г R R N NH2 R1 + N EtOH O № Продукт 3 O Вміст продукту в неочищеному # зразку (%), Вихід (%),* 80 45 88 57 >90 66 >90 70 >90 76 N N 3{1,2} N S O O 2 R1 3{1}-3{20} Структура O 1 N 2{1}-2{14} 1n{1}-1n{7} N R DMF HO OH 1) EDC, HOAt, кт, 24 г 2) TEA, 100оC, 3 г N N 3{1,6} N O N O N S 3 N 3{2,5} N O O O N S 4 5 3{2,13} N 3{2,7} O N O N S N N O 5 UA 112887 U № Продукт 3 6 3{3,1} Вміст продукту в неочищеному # зразку (%), N N H O 80 56 70 O 44 43 65 40 >90 N S Вихід (%),* 85 Структура 57 75 47 >90 60 O N 7 3{3,3} N NH O N N S 8 O N S 3{3,6} N N O O N 9 3{4,3} O N N N NH O N N 10 3{4,5} N N O O O 11 3{4,9} N NH2 O N N 12 S O N 3{4,12} N N N O 6 UA 112887 U № Продукт 3 Вміст продукту в неочищеному # зразку (%), Вихід (%),* >90 74 87 63 75 56 >90 71 >90 63 70 Структура 54 88 79 O N N N 13 3{5,7} N O O O N 14 N 3{5,14} N N N O O 15 N 3{6,10} N O N O O 16 N 3{6,12} N N N O N N N 17 3{7,4} N O N N N 18 3{7,8} NO2 N N N O N 19 3{7,11} NH N N N O O 7 UA 112887 U № Продукт 3 Вміст продукту в неочищеному # зразку (%), N 20 3{7,14} Вихід (%),* 80 Структура 69 O N N N N N # O 1 - вміст продукту визначали РХ-МС або Н ЯМР; * - ізольований вихід. 5 10 15 20 Наступним кроком в процесі розробки способу було застосування розробленого підходу для синтезу набору зі щонайменше 100 сполук. Субстрати, вибрані випадковим чином з нашого складу, включають реагенти з різною реакційною здатністю і в тому числі такі, що містять додаткові функціональні групи. Вибирали такі комбінації нітрилів і карбонових кислот, щоб одержати 3-алкіл-5-алкіл-, 3-алкіл-5-арил-, 3-арил-5-арил-, і 3-арил-5-алкіл-похідні. Вибирали 30 нітрилів і 23 карбонові кислоти з привабливими фізико-хімічними властивостями і провели 120 паралельних реакцій на мілімолярній і субмілімолярній (0,2 ммоль) шкалі з використанням розробленого способу (наведені 40 прикладів, таблиці 2-5). Наступна обробка та виділення дають продукти з помірними виходами; ідентичність і чистоту сполук підтверджували ЯМР і РХМС. Більшість реагентів реагували нормально в умовах реакції (наприклад, 3 {3,1}, 3.2 {8,10}, і 3.4 {7,10}). Серед синтезованих сполук - відома біоактивна речовина піфексол, 5-(2-хлорфеніл)3-(піридин-4-іл)-1,2,4-оксадіазол, який був виділений з виходом 55 % (позиція 8 в таблиці 4), що має один порядок з раніше описаним способом отримання відповідного амідоксиму (71 %, якщо стадія отримання амідоксиму і ізоляція включена). В цілому, продукти отримували з ймовірністю успіху 82 %, прийнятного значенням для триступеневого трикомпонентного процесу. Таким чином, розроблений метод відповідає всім вимогам паралельної хімії: високий показник успіху, простота і застосування. Також розроблений спосіб було використано для одержання сполук, що є потенційними агоністами GPR40: було синтезовано і додатково модифіковано 14 похідних хлороцтової або 1хлорпропіонової кислот з отриманням 21 1,2,4-оксадіазолу. Для цих сполук проводили клітинні тести, що показали мікромолярні та субмікромолярні потенціали інгібування для більшості 1,2,4оксадіазолів, фармакокінетичні експерименти показали селективність відносно до інших GPRs і сприятливі профілі ADME. 25 Таблиця 1 3,5-дизаміщені 1,2,4-оксадіазоли, отримані з аліфатичних нітрилів та аліфатичних кислот № Продукт 3.1 1 Структура 3.1{1,5} Вихід* (%) CF3 N N 2 3.1{3,5} 44 N O O N N ‡ 47 N N 8 O UA 112887 U Таблиця 1 3,5-дизаміщені 1,2,4-оксадіазоли, отримані з аліфатичних нітрилів та аліфатичних кислот № Продукт 3.1 Структура Вихід* (%) N 3 3.1{4,4} O N N O 48 N N N 4 3.1{4,6} 52 O N N O # Br 5 3.1{6,2} N N ‡ 58 N N N N O N 6 N 3.1{7,7} N 7 49 N O 3.1{9,8} O N S 69 O N 8 3.1{10,2} ‡ $ O N N 55 N N O N O N 9 N 3.1{10,3} 47 O N O N O 9 UA 112887 U Таблиця 1 3,5-дизаміщені 1,2,4-оксадіазоли, отримані з аліфатичних нітрилів та аліфатичних кислот № Продукт 3.1 10 3.1{13,6} Структура Вихід* (%) N ‡ NH 45 N O # O * - вихід чистого продукту; ‡ - реакції проводили на субмілімолярному рівні; # - суміш ізомерів, 20/80, цис./транс, $ - суміші ізомерів 21/79, цис./транс. Таблиця 2 3,5-дизаміщені 1,2,4-оксадіазоли, отримані з аліфатичних нітрилів та ароматичних або гетероароматичних кислот. № Продукт 3.2 Структура Вихід* (%) N 1 3.2{2,3} N ‡ F N N 44 O N N N 2 N 3.2{5,9} 41 N S N O N 3 3.2{7,8} ‡ N N N 74 S N O N N 4 3.2{7,13} ‡ N 50 N N N 10 O UA 112887 U Таблиця 2 3,5-дизаміщені 1,2,4-оксадіазоли, отримані з аліфатичних нітрилів та ароматичних або гетероароматичних кислот. № Продукт 3.2 Структура Вихід* (%) N N 5 3.2{8,10} S O N N 42 O N 6 N 3.2{11,13} O 7 3.2{12,4} 57 N N O N ‡ O 45 O N O N 8 3.2{13,4} NH 59 O N O O N 9 3.2{13,5} NH N O 43 O O N N 10 3.2{13,8} ‡ NH O * - вихід чистого продукту; ‡ - реакції проводили на субмілімолярному рівні. 11 S N O 50 UA 112887 U Таблиця 3 3,5-дизаміщені 1,2,4-оксадіазоли, отримані з ароматичних або гетероароматичних нітрилів та ароматичних або гетероароматичних кислот. № Продукт 3.3 1 Структура 3.3{2,7} N O S N H O 3.3{3,12} N S 75 O O HN 2 Вихід* (%) ‡ 73 HN N N N N O CF3 N F 4 N 3.3{4,13} 42 N N O F 5 N F 3.3{5,6} O F N S 43 O O 3 3.3{6,5} N ‡ N N N 3.3{10,1} O 86 N N 7 42 NO2 N 6 O O N 3.3{12,4} 47 O N N O Cl 8 3.3{13,2} Піфексол N N N 55 O 12 UA 112887 U Таблиця 3 3,5-дизаміщені 1,2,4-оксадіазоли, отримані з ароматичних або гетероароматичних нітрилів та ароматичних або гетероароматичних кислот. № Продукт 3.3 9 Структура 3.3{15,6} N Вихід* (%) N N 59 S N O N 10 3.3{16,11} N ‡ N N N N 11 3.3{17,2} S N ‡ 50 N H O Cl 63 N N N O * - вихід чистого продукту; ‡ - реакції проводили на субмілімолярному рівні. Таблиця 4 3,5-дизаміщені 1,2,4-оксадіазоли, отримані з ароматичних або гетероароматичних нітрилів та аліфатичних кислот. № Продукт 3.4 Структура O 1 3.4{1,1} S O HN ‡ N N S 2 Вихід* (%) HO 3.4{7,10} N N 13 O 46 O O 44 UA 112887 U Таблиця 4 3,5-дизаміщені 1,2,4-оксадіазоли, отримані з ароматичних або гетероароматичних нітрилів та аліфатичних кислот. № Продукт 3.4 Структура Вихід* (%) N N S 3 3.4{8,4} N O N 72 N 4 3.4{9,2} N ‡ N 44 N N S N 5 3.4{10,5} O N 88 N N N O N N 6 3.4{10,7} 52 N N O N 7 3.4{11,4} ‡ N O 49 N O N N 8 3.4{12,9} O N ‡ 44 N N O 14 UA 112887 U Таблиця 4 3,5-дизаміщені 1,2,4-оксадіазоли, отримані з ароматичних або гетероароматичних нітрилів та аліфатичних кислот. № Продукт 3.4 Структура Вихід* (%) N 9 N N 3.4{14,4} 58 N O N N N 10 N 3.4{18,2} N 52 N N N O * - вихід чистого продукту; ‡ - реакції проводили на субмілімолярному рівні. 5 10 15 20 25 30 Був розроблений легкий однореакторний спосіб паралельного синтезу 3,5-дизаміщених 1,2,4-оксадіазолів. Перевірка на 141 субстратах із застосуванням мілімолярного або субмілімолярного масштабування показали, що підхід повністю задовольняє паралельним критеріям синтезу: 1) оснований на вихідних реагентах, комерційно доступних у великому різноманітті, що дозволяє широко варіювати замісники у 3-му і 5-му положеннях 1,2,4-оксадіазольного кільця. 2) простий у виконанні: використовується поширене лабораторне обладнання (шейкер, піч). 3) може бути застосований до різних реагентів і є толерантним до додаткових функціональних груп у субстратах. Винахідник вважає, що запропонований підхід буде корисним для дослідників, які шукають простий і швидкий доступ до великих наборів 3,5-дизаміщених 1,2,4-оксадіазолів. Експериментальна частина Всі хімічні речовини і розчинники були отримані з Enamine і використані без додаткової очистки. ЯМР-спектри знімали на спектрометрі Bruker Avance DRX 400 і Bruker Avance DRX 500 з використанням DMSO-d6 як розчинника і тетраметилсилану (ТМС) як внутрішнього стандарту. ІЧ-спектри знімали на Perkin-Elmer Spectrum BX II. Елементний аналіз проводили на мікроаналізаторі Vario MICRO Cube (Elementar). Точки плавлення визначали на апараті Buchi для визначення температури плавлення і дані представлені у некорегованому вигляді. Дані РХМС були отримані на Agilent 1100 HPLC системі, оснащеній діодною матрицею і масселективним детектором, колонка: Zorbax SB-C18, 4,6 мм × 15 мм. Елюент, А, ацетонітрил вода з 0,1 % TFA (95:5); В, вода з 0,1 % TFA. Неочищені зразки з вмістом продукту нижче 90 % очищали системою компанії Agilent 1200 ВЕРХ, що використовують різні градієнти в залежності від величини ClogP конкретної сполуки. Загальна методика паралельного синтезу 3,5-дизаміщених 1,2,4-оксадіазолів з нітрилів та карбонових кислот. Суміш тіофен-2-карбонітрилу 1n{2} (1 ммоль), NH2OH•HCl (1,5 ммоль) та TEA (2 ммоль) в етанолі струшували в закритій 8 мл віалі при кімнатній температурі на орбітальній струшувальній платформі протягом 6 годин. Потім реакційну суміш нагрівали при 70 °C в печі протягом 16 годин. Розчинник видаляли після нагрівання з використанням роторного 15 UA 112887 U 5 випаровувача. До in situ отриманого амідоксиму додавали 2-(3-метил-2-оксопіридин-1(2H)ил)оцтову кислоту 2{5} (1 ммоль), EDC (1,5 ммоль) та HOAt (0,7 мл 20 % розчин у DMF за масою) і суміш струшували при кімнатній температурі протягом 24 годин. Циклодегідратація проводилася в присутності триетиламіну (1 ммоль) при нагріванні реакційної суміші при 100 °C протягом 3 годин. Далі додавали 3 мл води і суміш екстрагували СНСl 3. Фазу хлороформу двічі промивали водою та випарювали. Вихід: 180 мг, 66 %. Ідентичні умови були застосовані до решти сполук. Для реакцій на субмілімолярному рівні кількості реагентів були скорочені відповідним чином. ФОРМУЛА КОРИСНОЇ МОДЕЛІ 10 1. Спосіб одержання 3,5-дизаміщеного 1,2,4-оксадіазолу формули (І): N R N 15 20 25 30 35 40 45 50 R 1 O , в якій R являє собою С1-Салкіл, С3-С10циклоалкіл, С6-С10арил або С2-С9гетероарил, кожен з яких необов'язково заміщений одним або більшою кількістю замісників, незалежно вибраних з С 1С6алкілу, С2-С6алкенілу, С2-С6алкінілу, С1-С6алкокси, С3-С10циклоалкілу, С6-С10арилу, С2С9гетероарилу, галогену, -CN, NO2, NH2, -SC1-С6алкілу, -SOC1-С6алкілу, -SO2C1-С6алкілу, NSO2C1-C6алкілу, -NHC1-С6алкілу, -N(C1-С6алкіл)2, -NHCOOC1-C6алкілу, -NHCONHC1-С6алкілу, CONHC1-C6алкілу, -СОС1-С6алкілу, -СООС1-С6алкілу, -SC1-C6алкілу, -SOC1-C6 алкілу або SO2C1-C6алкілу, де згадані С1-С6алкільні, С2-С6алкенільні, С2-С6алкінільні, С1-С6алкокси, С3С10циклоалкільні, С6-С10арильні, С2-С9гетероарильні частини згаданих вище замісників можуть бути також заміщені одним або більшою кількістю додаткових замісників, незалежно вибраних з С1-С6алкілу, С1-С6алкокси, С3-С10циклоалкілу, С6-С10арилу, С2-С9гетероарилу, галогену, -CN, NO2 або NH2; 1 R являє собою С1-С6алкіл, С3-С10циклоалкіл, С6-С10арил або С2-С9гетероарил, кожен з яких необов'язково заміщений одним або більшою кількістю замісників, незалежно вибраних з С 1С6алкілу, С2-С6алкенілу, С2-С6алкінілу, С1-С6алкокси, С3-С10циклоалкілу, С6-С10арилу, С2С9гетероарилу, галогену, -CN, NO2, -SC1-С6алкілу, -SOC1-С6алкілу, -SO2C1-С6алкілу, -SO2NH2, NSO2C1-C6алкілу, -NHC1-С6алкілу, -N(C1-С6алкіл)2, -NHCOOC1-C6алкілу, -CONHC1-C6алкілу, СОС1-С6алкілу, -СООС1-С6алкілу, -SC1-C6алкілу, -SOC1-C6алкілу або -SO2C1-C6алкілу, де згадані С1-С6алкільні, С2-С6алкенільні, С2-С6алкінільні, С1-С6алкокси, С3-С10циклоалкільні, С6С10арильні, С2-С9гетероарильні частини згаданих вище замісників можуть бути також заміщені одним або більшою кількістю додаткових замісників, незалежно вибраних з С 1-С6алкілу, С1С6алкокси, С3-С10циклоалкілу, С6-С10арилу, С2-С9 гетероарилу, галогену, -CN, NO2 або NH2; в якому нітрил загальної формули (II): R-CN, де R є таким як визначено вище; а) обробляють NH2OH•HCl та TEA в етанолі при кімнатній температурі і потім одержану реакційну суміш нагрівають при 70 °C; б) розчинник видаляють і до одержаного проміжного амідоксиму додають карбонову кислоту формули (III): 1 R -COOH, 1 де R є таким як визначено вище; EDC (N-(3-диметиламінопропіл)-N'-етилкарбодіімід) та HOAt (1-гідроксі-7-аза-1Н-бензотриазол) і залишають; в) до одержаної суміші додають триетиламін і нагрівають, одержуючи 3,5-дизаміщений 1,2,4оксадіазол формули (І). 2. Спосіб за п. 1, який відрізняється тим, що нагрівання на стадії в) проводять при температурі 100-120 °C. Комп’ютерна верстка Л. Ціхановська Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 16
ДивитисяДодаткова інформація
МПК / Мітки
МПК: C07D 231/00
Мітки: одержання, 1,2,4-оксадіазолів, 3,5-дизаміщених, спосіб
Код посилання
<a href="https://ua.patents.su/18-112887-sposib-oderzhannya-35-dizamishhenikh-124-oksadiazoliv.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання 3,5-дизаміщених 1,2,4-оксадіазолів</a>
Попередній патент: Спосіб одержання cf3cнf-заміщених піразолів
Наступний патент: Спосіб паралельного синтезу аліфатичних оксамідів
Випадковий патент: Застосування способу визначення швидкості відлущування рогового шару епідермісу як способу визначення ефективності лікування при дерматозах