Спосіб одержання піразолів, спосіб регіоселективного алкілування та застосування фосфату або фосфонату у способі
Номер патенту: 93860
Опубліковано: 25.03.2011
Автори: Ламберт Клеменс, Тоблер Ханс, Еренфройнд Йозеф, Вальтер Харальд, Корсі Камілла
Формула / Реферат
1. Спосіб одержання заміщеного піразолу формули І
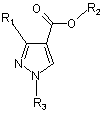 , (I)
, (I)
у якій R1 означає С1-С4галогеналкіл; R2 означає С1-С6алкіл і R3 означає метил або етил,
у якому заміщений піразол формули II
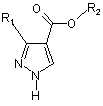 , (II)
, (II)
у якій R1 і R2 є такими, як визначено для формули І, вводять у реакцію з фосфатом або фосфонатом формули III
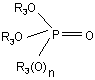 , (III)
, (III)
у якій R3 є таким, як визначено для формули І, і n дорівнює 0 або 1.
2. Спосіб за п. 1, у якому реакцію проводять без додавання розчинника.
3. Застосування фосфату або фосфонату формули III
 , (III)
, (III)
у якій R3 є таким, як визначено в п. 1, для регіоселективного алкілування заміщеного піразолу формули II
 , (II)
, (II)
у якій R1 і R2 є такими, як визначено в п. 1.
4. Спосіб регіоселективного алкілування заміщеного піразолу формули II
 , (II)
, (II)
у якій R1 і R2 є такими, як визначено в п. 1, у якому як алкілувальний реагент застосовують фосфат або фосфонат формули III
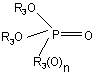 , (III)
, (III)
у якій R3 є таким, як визначено в п. 1.
Текст
1. Спосіб одержання заміщеного піразолу формули І R2 O R1 O 3 93860 у якій R3 є таким, як визначено в п. 1. R3 O R3O 4 P R3(O)n O (III) , Даний винахід стосується способу регіоселективного N-алкілування заміщених піразолів і застосування триалкілфосфатів або триалкілфосфонатів для регіоселективного N-алкілування заміщених піразолів. N-Алкіловані заміщені піразоли, наприклад, етиловий ефір 3-дифторметил-1 -метил-1Нпіразол-4-карбонової кислоти, є цінними проміжними продуктами для одержання фунгіцидів, як це описано, наприклад, в WO 03/074491. Відповідно до WO 95/25099, N-алкіловані заміщені піразоли можна одержати за реакцією відповідних заміщених піразолів з алкілгалогенідами у лужному середовищі. Однак застосування алкілгалогенідів для N-алкілування заміщених піразолів є складним внаслідок їх токсичності. Крім того, ці сполуки є дорогими й на додаток до цього характеризуються лише низькою регіоселективністю відносно двох атомів азоту піразольного кільця. Із цих причин такий спосіб є зовсім непридатним для великомасштабного виробництва N-алкілованих заміщених піразолів. Відповідно до JP-2000-044541 N-алкіловані заміщені піразоли можна одержати за реакцією відповідних заміщених піразолів з діалкіловими ефірами карбонової кислоти з додаванням основи. Застосування діалкілових ефірів карбонової кислоти небажане, оскільки ці сполуки мають низьку реакційну здатність і тому звичайно необхідно підвищити реакційну здатність заміщених піразолів шляхом додавання основи. Крім того, регіоселективність такого N-алкілування звичайно залежить від хімічної природи замісників піразольного кільця, так що N-алкілування з використанням діалкілових ефірів карбонової кислоти в деяких випадках характеризується незадовільною регіоселективністю. Тому задачею даного винаходу є розробка нового способу одержання N-алкілованих заміщених піразолів, у якому виключені недоліки відомих способів, відзначені вище, і який дає можливість одержувати ці сполуки з високими виходами й при гарній якості та економічно ефективним і простим у здійсненні шляхом. Відповідно до цього даний винахід стосується способу одержання сполук формули І у якій R1 означає С1-С4галогеналкіл; R2 означає С1-С6алкіл і R3 означає метил або етил, за реакцією сполуки формули II у якій замісники є такими, як визначено для формули І, зі сполукою формули III у якій R3 є таким, як визначено для формули І, і n дорівнює 0 або 1. Алкільні групи в наведених вище визначеннях замісників можуть мати лінійний або розгалужений ланцюг і являють собою, наприклад, метил, етил, н-пропіл, ізопропіл, н-бутил, втор-бутил, ізобутил або трет-бутил, краще - метил або етил. Галогеном звичайно є фтор, хлор, бром або йод, краще фтор. С1-С4Галогеналкільні групи утворені із зазначених С1-С4алкільних груп і переважно означають дифторметил або трифторметил. Спосіб, пропонований у даному винаході, переважно придатний для одержання сполук формули І, у якій R1 означає дифторметил або трифторметил; R2 означає метил або етил і/або R3 означає метил. Спосіб, пропонований у даному винаході, є особливо придатним для одержання сполук формули І, у якій R1 означає дифторметил. Спосіб, пропонований у даному винаході, є особливо придатним для одержання сполук формули І, у якій R1 означає дифторметил; R2 означає етил і R3 означає метил. Спосіб, пропонований у даному винаході, також є особливо придатним для одержання сполук формули І, у якій R1 означає трифторметил; R2 означає етил і R3 означає метил. У кращих способах сполуки формули II вводять у реакцію зі сполуками формули III, у якій n дорівнює 1. В особливо кращих способах сполуки формули II вводять у реакцію зі сполуками формули III, у якій n дорівнює 1 і R3 означає метил. Реакцію, пропоновану в даному винаході, переважно проводити в температурному діапазоні від 100 до 200°С, краще - від 150 до 200°С. 5 Реакцію, пропоновану в даному винаході, можна проводити в безводному інертному розчиннику. Придатними розчинниками є, наприклад, ксилол, мезитилен, трет-бутилбензол, хлорбензол, 1,2-дихлорбензол, декалін, дибутиловий ефір, дипентиловий ефір, дифеніловий ефір і анізол. Реакцію, пропоновану в даному винаході, краще проводити без розчинника. У реакціях, пропонованих у даному винаході, сполуки формули III використовують в еквімолярних кількостях або в надлишку відносно сполук формули II, переважно - у надлишку до 30кратного, більш краще - у надлишку до 10кратного, ще більш краще - у надлишку від 2кратного до 8-кратного. Спосіб, пропонований у даному винаході, є особливо придатним для одержання сполук формули І у якій R1 означає дифторметил, R2 означає етил і R3 означає метил, за реакцією сполуки формули II у якій R1 означає дифторметил і R2 означає етил, зі сполукою формули III у якій R3 означає метил і n дорівнює 1, у температурному діапазоні від 150 до 200°С, без розчинника, сполуки формули III використовують у надлишку від 2-кратного до 8-кратного відносно сполуки формули II. Сполуки формули II є відомими або їх можна одержати за методиками, аналогічними відомим з літератури. Наприклад, такі сполуки можна одержати з ефірів 3-оксокарбонової кислоти, на яких вони основані, за допомогою двостадійного синтезу по реакції із триметилортоформіатом з наступною реакцією з гідразином. Такі реакції описані, наприклад, в JP-2000-044541. Інший шлях синтезу для одержання сполук формули II описаний в JP2001-322983, у якій, наприклад, етиловий ефір 3трифторметил-1H-піразол-4-карбонової кислоти одержують виходячи з етилового ефіру 3-хлор4,4,4-трифтор-2-форміл-2-бутенової кислоти за реакцією з гідразином. Сполуки формули III відомі як алкілувальні реагенти і є у продажу. Наприклад, N-алкілування незаміщених азотовмісних гетероциклів описано в публікації Journal of the Chemical Society, Perkin Transactions 1, 21, 2506-2508 (1973) і в Bulletin of the Chemical Society of Japan, 50, 1510-1512 (1977). Немає вказівок на алкілувальні реагенти, які проявляють регіоселективність при Nалкілуванні піразолів. Даний винахід також стосується застосування сполук формули III для регіоселективного алкілування сполук формули II. Даний винахід також стосується способу регіоселективного алкілування сполук формули II, у якому сполука формули III застосовується як алкілувальний реагент. 93860 6 Даний винахід ілюструється за допомогою наведених нижче прикладів. Приклад Р1: Одержання етилового ефіру 3дифторметил-1-метил-1H-піразол-4-карбонової кислоти: Суміш 5,7 г етилового ефіру 3-дифторметил1Н-піразол-4-карбонової кислоти (30 ммоль) і 25 мл триметилфосфату (214 ммоль) перемішують при температурі, що дорівнює 180°С, протягом 18 год. Потім додають 250 мл суміші води з льодом. Одержаний продукт реакції фільтрують, промивають водою й розчиняють в 50 мл етилацетату. Органічну фазу промивають за допомогою 50 мл насиченого розчину хлориду натрію й сушать над сульфатом натрію та концентрують випарюванням. Одержують 3,9 г (64 % від теоретичного значення) етилового ефіру 3-дифторметил-1-метил1Н-піразол-4-карбонової кислоти у вигляді кристалів (температура плавлення 59-60°С). Приклад Р2: Одержання етилового ефіру 3трифторметил-1-метил-1Н-піразол-4-карбонової кислоти: Суміш 4,16 г етилового ефіру 3-трифторметил1Н-піразол-4-карбонової кислоти (20 ммоль) і 10 мл триметилфосфату (86,4 ммоль) перемішують при температурі, що дорівнює 180°С, протягом 16 год. Потім додають 200 мл суміші води з льодом. Одержаний продукт реакції фільтрують, промивають водою та розчиняють в 50 мл етилацетату. Органічну фазу двічі промивають порціями по 50 мл насиченого розчину хлориду натрію й сушать над сульфатом натрію й концентрують випарюванням. Одержують 4,0 г (90 % від теоретичного значення) етилового ефіру 3-трифторметил-1метил-1Н-піразол-4-карбонової кислоти у вигляді кристалів (температура плавлення 55-57°С). Приклад Р3: Одержання етилового ефіру 3трифторметил-1-метил-1H-піразол-4-карбонової кислоти: Суміш 2,08 г етилового ефіру 3-трифторметил1Н-піразол-4-карбонової кислоти (10 ммоль) і 2,3 мл триметилфосфату (20 ммоль) перемішують при температурі, що дорівнює 180°С, протягом 16 год. Потім додають 200 мл суміші води з льодом. Одержаний продукт реакції фільтрують, промивають водою та розчиняють в 50 мл етилацетату. Органічну фазу двічі промивають порціями по 50 мл насиченого розчину хлориду натрію й сушать над сульфатом натрію та концентрують випарюванням. Одержують 1,9 г (86 % від теоретичного значення) етилового ефіру 3-трифторметил-1-метил1Н-піразол-4-карбонової кислоти у вигляді кристалів (температура плавлення 55-57°С). Відповідно до наведених вище прикладів можна одержати наступні сполуки формули І: 7 93860 У контексті даного винаходу заміщені піразоли можна алкілувати регульованим чином з високим виходом, з високим ступенем регіоселективності й при низьких витратах. Іншою перевагою даного винаходу є те, що заміщені піразоли можна алкілувати без додавання основ. Комп’ютерна верстка Мацело В. 8 Вихідні речовини для способу, пропонованого в даному винаході, відрізняються доступністю та легкістю роботи з ними, а також є недорогими. У кращому варіанті здійснення даного винаходу спосіб здійснюють без розчинника, такий варіант здійснення є особливо економічним варіантом способу, пропонованого в даному винаході. Підписне Тираж 23 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the preparation of pyrazoles, process for the regioselective alkylation and use of phosphate or phosphonate
Автори англійськоюWalter Harald, Corsi Camilla, Ehrenfreund Josef, Lamberth Clemens, Tobler Hans
Назва патенту російськоюСпособ получения пиразолов, способ региоселективного алкилирования и применение фосфата или фосфоната b способе
Автори російськоюВальтер Харальд, Корси Камилла, Эренфройнд Йозеф, Ламберт Клеменс, Тоблер Ханс
МПК / Мітки
МПК: C07D 231/14
Мітки: застосування, одержання, способи, алкілування, піразолів, регіоселективного, спосіб, фосфату, фосфонату
Код посилання
<a href="https://ua.patents.su/4-93860-sposib-oderzhannya-pirazoliv-sposib-regioselektivnogo-alkiluvannya-ta-zastosuvannya-fosfatu-abo-fosfonatu-u-sposobi.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання піразолів, спосіб регіоселективного алкілування та застосування фосфату або фосфонату у способі</a>
Попередній патент: Виробництво поліпептидів
Наступний патент: Спосіб одержання n-фенілпіразол-1-карбоксамідів та сполука аніліну
Випадковий патент: Водорозчинна фотополімеризаційноздатна композиція








