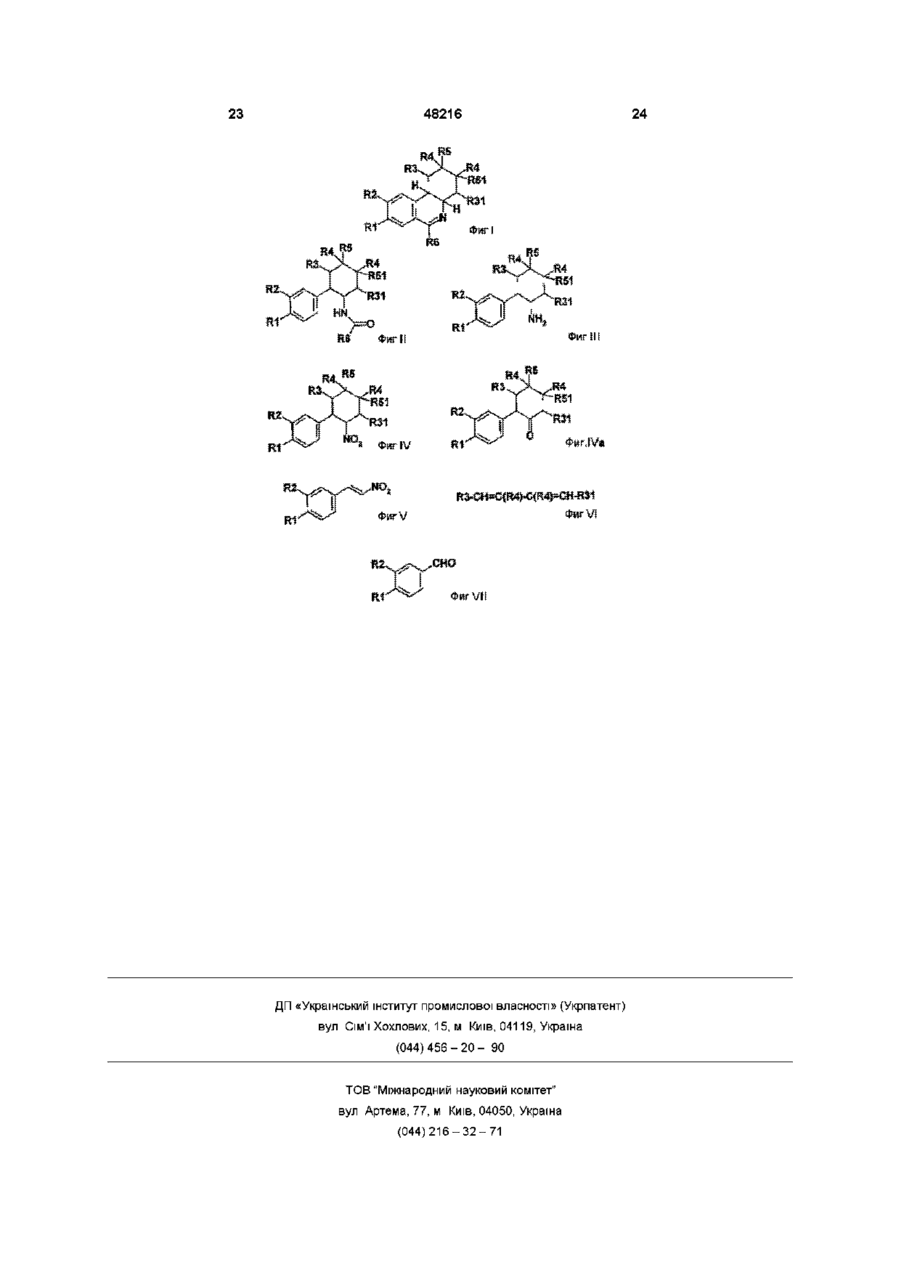
Фенантридини та лікарський засіб для лікування захворювань дихальних шляхів
Номер патенту: 48216
Опубліковано: 15.08.2002
Автори: Гуттерер Біте, Бар Томас, Амшлер Германн, Клей Ханс-Пітер, Беуме Рольф, Босс Хільдегард, Гебел Карл-Джозеф, Хатзелманн Армін, Хефнер Дітріх, Мартін Томас, Шудт Крістіан, Флокерзі Дітер, Улріх Вольф-Рудігер
Формула / Реферат
1. Фенантридины формулы I:
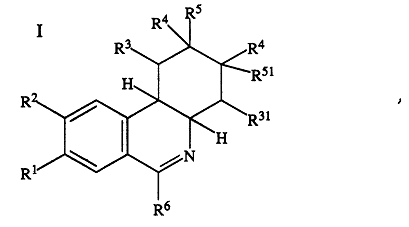
где
R1 обозначает гидрокси, С1-С4алкокси, С3-С7циклоалкокси или С3-С7циклоалкилметокси или полностью либо частично замещенный фтором С1-С4алкокси,
R2 обозначает гидрокси, С1-С4алкокси, С3-С7циклоалкокси или С3-С7циклоалкилметокси или полностью либо частично замещенный фтором С1-С4алкокси, или где
R1 и R2 оба вместе обозначают С1-С2алкилендиоксигруппу,
R3 обозначает водород или С1-С4алкил,
R31 обозначает водород или С1-С4алкил, или где
R3 и R31 оба вместе обозначают С1-С4алкиленовую группу,
R4 обозначает водород или С1-С4алкил,
R5 обозначает водород,
R51 обозначает водород, или где
R5 и R51 оба вместе представляют собой дополнительную связь,
R6 представляет собой замещенный R7 фенильный остаток, где
R7 обозначает COOR71 или CON(R72)R73, где
R71 обозначает водород, С1-С7алкил, С3-С7циклоалкил или С3-С7циклоалкилметил и
R72и R73 независимо друг от друга обозначают водород, С1-С7алкил, С3-С7циклоалкил или С3-С7циклоалкилметил, а также соли указанных соединений.
2. Соединения формулы I по п. 1, в которых
R1 обозначает С1-С4алкокси, С3-С7циклоалкокси или С3-С7циклоалкилметокси или полностью либо частично замещенный фтором С1-С2алкокси,
R2 обозначает С1-С4алкокси, С3-С7циклоалкокси или С3-С7циклоалкилметокси или полностью либо частично замещенный фтором С1-С2алкокси,
R3 обозначает водород,
R31 обозначает водород,
или в которых
R3 и R31 оба вместе обозначают С1-С2алкиленовую группу,
R4 обозначает водород или С1-С4алкил,
R5 обозначает водород,
R51 обозначает водород,
или в которых
R5 и R51 оба вместе представляют собой дополнительную связь,
R6 представляет собой замещенный R7 фенильный остаток, где
R7 обозначает COOR71 или CON(R72)R73, где
R71 обозначает водород, С1-С7алкил или С3-С7циклоалкилметил и
R72 и R73 независимо друг от друга обозначают водород или С1-С7алкил, а также соли указанных соединений.
3. Соединения формулы I по п. 1, в которых
R1 обозначает С1-С4алкокси, С3-С7циклоалкокси или полностью либо частично замещенный фтором С1-С2алкокси,
R2 обозначает С1-С4алкокси, С3-С7циклоалкокси или полностью либо частично замещенный фтором С1-С2алкокси,
R3 обозначает водород,
R31 обозначает водород,
или в которых
R3 и R31 оба вместе обозначают С1-С2алкиленовую группу,
R4 обозначает водород или С1-С4алкил,
R5 обозначает водород,
R51 обозначает водород,
или в которых
R5 и R51 оба вместе представляют собой дополнительную связь,
R6 представляет собой замещенный R7 фенильный остаток, где
R7 обозначает COOR71 или CON(R72)R73, где
R71 обозначает водород, С1-С7алкил или С3-С7циклоалкилметил и
R72 и R73 независимо друг от друга обозначают водород или С1-С4алкил, а также соли указанных соединений.
4. Соединения формулы I по п. 1, в которых
R1 обозначает метокси, этокси или дифторметокси,
R2 обозначает метокси, этокси или дифторметокси,
R3 и R31 обозначают водород,
R4 обозначает водород,
R5 и R51 обозначают водород,
R6 представляет собой замещенный R7 фенильный остаток, где
R7 обозначает COOR71 или CON(R72)R73, где
R71 обозначает водород или С1-С4алкил,
R72 обозначает водород и
R73 обозначает С1-С4алкил, а также соли указанных соединений.
5. Соединения формулы I по п. 1 для изготовления лекарственных средств, предназначенных для лечения заболеваний дыхательных путей.
6. Лекарственное средство, отличающееся тем, что содержит одно или несколько соединений по п. 1 совместно с фармацевтическими вспомогательными веществами и/или носителями, для лечения заболеваний дыхательных путей.
Текст
1 Фенантридины формулы І R (І) где R обозначает гидрокси, Сі-С4алкокси, СзСуциклоалкокси или Сз-Суциклоалкилметокси или полностью либо частично замещенный фтором R2 обозначает гидрокси, Сі-С4алкокси, СзСуциклоалкокси или Сз-Суциклоалкилметокси или полностью либо частично замещенный фтором СгС4алкокси, или где R1 и R2 оба вместе обозначают dСгалкилендиоксигруппу, R обозначает водород или СгС4алкил, R31 обозначает водород или СгС4алкил, или где R и R оба вместе обозначают dС4алкиленовую группу, R4 обозначает водород или СгС4алкил, R5 обозначает водород, R51 обозначает водород, или где 5 51 R и R оба вместе представляют собой дополнительную связь, R6 представляет собой замещенный R7 фенильный остаток, где R7 обозначает COOR71 или CON(R72)R73, где R71 обозначает водород, С-і-Суалкил, СзСуциклоалкил или Сз-Суциклоалкилметил и R 7 2 H R73 независимо друг от друга обозначают водород, СгСуалкил, Сз-Суциклоалкил или СзСуциклоалкилметил, а также соли указанных соединений 2 Соединения формулы І по п 1, в которых R1 обозначает Сі-С4алкокси, Сз-Суциклоалкокси или Сз-Суциклоалкилметокси или полностью либо частично замещенный фтором С-і-Сгалкокси, R2 обозначает Сі-С4алкокси, Сз-Суциклоалкокси или Сз-Суциклоалкилметокси или полностью либо частично замещенный фтором С-і-Сгалкокси, R3 обозначает водород, R31 обозначает водород, или в которых R3 и R31 оба вместе обозначают dС2алкиленовую группу, R4 обозначает водород или СгС4алкил, R5 обозначает водород, R51 обозначает водород, или в которых R5 и R51 оба вместе представляют собой дополнительную связь, R6 представляет собой замещенный R7 фенильный остаток, где R7 обозначает COOR71 или CON(R72)R73, где R71 обозначает водород, СгСуалкил или СзСтциклоалкилметил и R 2 и R73 независимо друг от друга обозначают водород или С-і-Суалкил, а также соли указанных соединений 3 Соединения формулы І по п 1, в которых R1 обозначает Сі-С4алкокси, Сз-Суциклоалкокси или полностью либо частично замещенный фтором СгС 2 алкокси, q (О 00 48216 R обозначает Сі-С4алкокси, Сз-Суциклоалкокси или полностью либо частично замещенный фтором С-і-Сгалкокси, 3 R обозначает водород, 31 R обозначает водород, или в которых 3 31 R и R оба вместе обозначают dСгалкиленовую группу, 4 R обозначает водород или СгС4алкил, 5 R обозначает водород, 51 R обозначает водород, или в которых 5 51 R и R оба вместе представляют собой дополнительную связь, 6 7 R представляет собой замещенный R фенильный остаток, где 7 71 72 73 R обозначает COOR или CON(R )R , где 71 R обозначает водород, Сі-С?алкил или СзСтциклоалкилметил и 2 73 R и R независимо друг от друга обозначают водород или Сі-С4алкил, а также соли указанных соединений 4 Соединения формулы І по п 1, в которых Изобретение относится к новым 6фенилфенантридинам, применяемым в фармацевтической промышленности для изготовления медикаментов В публикациях Chera Ber 1939, 72, 675-677, J Chem Soc, 1956, 4280-4283 и J Спет Soc (С), 1971, 1805-1808, описывается синтез 6фенилфенантридинов Было установлено, что новые фенантридины, более подробно описанные ниже, обладают неожиданными и особенно эффективными свойствами Объектом изобретения в соответствии с этим являются соединения формулы ФигІ (см прилагаемый лист с формулами), где R1 обозначает гидрокси, Сі-С4алкокси, СзСуциклоалкокси или Сз-Суциклоалкилметокси или полностью либо частично замещенный фтором R2 обозначает гидрокси, С ^ а л к о к с и , СзСуциклоалкокси или Сз-Суциклоалкилметокси или полностью либо частично замещенный фтором или где R1 и R2 оба вместе обозначают d Сгалкилендиоксигруппу, R3 обозначает водород или СгС4алкил, R31 обозначает водород или СгС4алкил, или где R3 и R31 оба вместе обозначают d С4алкиленовую группу, R4 обозначает водород или СгС4алкил, R5 обозначает водород, R51 обозначает водород, или где R5 и R51 оба вместе представляют собой дополнительную связь, R6 представляет собой замещенный R7 фенильный остаток, где R7 обозначает COOR71 или CON(R72)R73, где 4 1 R обозначает метокси, этокси или дифторметокси, 2 R обозначает метокси, этокси или дифторметокси, 3 31 R и R обозначают водород, 4 R обозначает водород, 5 51 R и R обозначают водород, 6 7 R представляет собой замещенный R фенильный остаток, где 7 71 72 73 R обозначает COOR или CON(R )R , где 71 R обозначает водород или СгС4алкил, 72 R обозначает водород и 73 R обозначает СгС4алкил, а также соли указанных соединений 5 Соединения формулы І по п 1 для изготовления лекарственных средств, предназначенных для лечения заболеваний дыхательных путей 6 Лекарственное средство, отличающееся тем, что содержит одно или несколько соединений по п 1 совместно с фармацевтическими вспомогательными веществами и/или носителями, для лечения заболеваний дыхательных путей R обозначает водород, С-і-Суалкил, СзСуциклоалкил или Сз-Суциклоалкилметил и R72 и R73 независимо друг от друга обозначают водород, Сі Суалкил, Сз-Суциклоалкил или СзС7Циклоалкилметил, а также соли указанных соединений Сі-С4алкокси представляет собой остатки, содержащие наряду с атомом кислорода прямоцепочечный либо разветвленный алкильный остаток с 1-4 атомами углерода В качестве примеров можно назвать следующие остатки бутокси, изобутокси, втор-бутокси, трет-бутокси, пропокси, изопропокси и предпочтительно этокси и метокси Сз-С7Циклоалкокси представляет собой, например, циклопропилокси, циклобутилокси, циклопентилокси, циклогексилокси и циклогептилокси, из которых предпочтительными являются циклопропилокси, циклобутилокси и циклопентилокси Сз-С7Циклоалкилметокси представляет собой, например, циклопропил метокси, циклобутил метокси, циклопентилметокси, циклогексилметокси и циклогептилметокси, из которых предпочтительными являются циклопропил метокси, циклобутилметокси и циклопентилметокси В качестве примеров полностью либо частично замещенного фтором СгС4алкокси можно назвать такие остатки, как 1, 2, 2-трифторэтокси, 2, 2, 3, 3, 3-пентафторпропокси, перфторэтокси, 1,1, 2, 2-тетрафторэтокси, трифторметокси, прежде всего 2, 2, 2-трифторэтокси и предпочтительно дифторметокси Сі-С4алкил представляет собой прямоцепочечный либо разветвленный алкильный остаток с 1-4 атомами углерода В качестве примеров можно назвать следующие остатки бутил, изобутил, втор-бутил, трет-бутил, пропил, изопропил и предпочтительно этил и метил СгСгалкилендиокси представляет собой метилендиоксильный остаток (-О-СН2-О-) и этилендиоксильный остаток (-О-СН2-СН2-О-) 48216 3 31 Если R и R оба вместе обозначают d Сгалкиленовую группу, 4 С4алкилен, то положения 1 и 4 в соединениях R обозначает водород или СгС4алкил, 5 формулы Фиг I соединены друг с другом d R обозначает водород, 51 С4алкиленовым мостиком, причем СгС4алкилен R обозначает водород, представляет собой прямоцепочечные либо разили в которых 5 51 ветвленные алкиленовые остатки с 1-4 атомами R и R оба вместе представляют собой доуглерода В качестве примеров можно назвать полнительную связь, 6 7 следующие остатки метилен (-СЬЬ-), этилен (R представляет собой замещенный R феСН2-СН2-), триметилен (-СН2-СН2-СН2-), 1, 2нильный остаток, где 7 71 72 73 диметилэтилен [-СН(СНз)-СН(СНз)-] и изопропиR обозначает COOR или CON(R )R , где 71 лиден [-С(СНз)2-1 R обозначает водород, Сі-С?алкил или Сз5 1 Суциклоалкилметил и Если R и R оба вместе представляют собой 72 73 дополнительную связь, то в этом случае атомы R и R независимо друг от друга обозначауглерода в положениях 2 и 3 в соединениях форют водород или С-і-Суалкил, а также соли указанмулы ФигІ соединены друг с другом двойной свяных соединений зью К особенно предпочтительным соединениям формулы Фиг I относятся таковые, в которых СгСталкил представляет собой прямоцепочечные либо разветвленные алкильные остатки с R обозначает Сі-С4алкокси, Сз1-7 атомами углерода В качестве примеров можС7Циклоалкокси или полностью либо частично но назвать такие остатки, как гептил, изогептил-(2замещенный фтором С-і-Сгалкокси, метилгексил), гексил, изогексил-(2-метилпентил), R2 обозначает Сі-С4алкокси, Сзнеогексил-(2, 2-д и метил бутил), пентил, изопентилС7Циклоалкокси или полностью либо частично (3-метилбутил), неопентил-(2, 2-д и метил пропил), замещенный фтором С-і-Сгалкокси, бутил, изобутил, втор-бутил, трет-бутил, пропил, R3 обозначает водород, изопропил,этил и метил R31 обозначает водород, Сз-Суциклоалкил представляет собой слеили в которых дующие остатки циклопропил, циклобутил, циклоR3 и R 1 оба вместе обозначают d пентил, циклогексил и циклогептил К предпочтиСгалкиленовую группу, тельным следует отнести Сз-СбЦиклоалкильные R4 обозначает водород или СгС4алкил, остатки, а именно, циклопропил, циклобутил и R5 обозначает водород, циклопентил R51 обозначает водород, Сз-Суциклоал кил метил представляет собой или в которых метальный остаток, замещенный одним из вышеR5 и R51 оба вместе представляют собой доуказанных Сз-С7Циклоалкильных остатков В качеполнительную связь, стве предпочтительных следует назвать СзR6 представляет собой замещенный R7 феСбЦиклоалкилметильные остатки, а именно, цикнильный остаток, где лопропилметил, циклобутил метил и циклопентилR7 обозначает COOR71 или CON(R72)R73, где метил R71 обозначает водород, С ^ а л к и л или Сз7 С7Циклоалкилметил и Заместитель R может быть связан в любом приемлемом положении в фенильном кольце R72 и R73 независимо друг от друга обозначаНаиболее предпочтительна связь этого заместиют водород или Сі-С4алкил, а также соли указантеля R7 в положении 4 фенильного кольца ных соединений В качестве примеров фенильных остатков, Предпочтительны далее такие соединения замещенных R7 , можно назвать 4-карбоксифенил, формулы Фиг І, в которых 3-карбоксифенил, 4-метоксикарбонилфенил, 3R обозначает метокси, этокси или дифтормеметоксикарбонилфенил, 2токси, 2 метоксикарбонилфенил, 4-этоксикарбонилфенил, R обозначает метокси, этокси или дифторме3-этоксикарбонилфенил, 2-этоксикарбонилфенил, токси, 3 31 4-(І\І-метиламинокарбо-нил)фенил, 3-(NR и R обозначают водород, 4 метиламинокарбонил)фенил, 4-(N,NR обозначает водород, диметиламинокарбонил)фенил, 4R5 и R51 обозначают водород, карбамоилфенил и 3-карбамоилфенил R6 представляет собой замещенный R7 феК предпочтительным соединениям формулы нильный остаток, где Фиг I относятся таковые, в которых R7 обозначает COOR71 или CON(R72)R73, где 1 R обозначает Сі-С4алкокси, СзR71 обозначает водород или СгС4алкил, С7Циклоалкокси или Сз-С7Циклоалкилметокси или R72 обозначает водород и, полностью либо частично замещенный фтором R73 обозначает СгС4алкил, а также соли укаС-і-Сгалкокси, занных соединений R2 обозначает Сі-С4алкокси, СзОдной из модификаций предпочтительных соС7Циклоалкокси или Сз-С7Циклоалкилметокси или единений формулы ФигІ являются таковые, в кополностью либо частично замещенный фтором торых С-і-Сгалкокси, R1 обозначает метокси или этокси, 3 R обозначает водород, R2 обозначает метокси, этокси или дифторметокси, R31 обозначает водород, или в которых R3 и R31 обозначают водород, R4 обозначает водород, R" и R оба вместе обозначают Сі 48216 8 5 51 R и R обозначают водород, этом (-)-цис-энантиомеры 6 7 R представляет собой замещенный R феЭнантиомеры можно отделять по известной нильный остаток, где методике (например, получением и разделением 7 71 соответствующих диастереомерных соединений) R обозначает COOR , где 71 Предпочтительно осуществлять разделение энанR обозначает водород или Сі-С4алкил, а тиомеров на стадии исходных соединений формутакже соли указанных соединений лы Фиг III (см прилагаемый лист с формулами) В качестве солей соединений формулы ФигІ Альтернативно этому исходные соединения форв зависимости от типа замещения - могут расмулы Фиг III, представляющие собой чистые энансматриваться все кислотно-аддитивные соли или тиомеры, могут быть получены также путем асимвсе соли, образуемые взаимодействием с основаметричного синтеза ниями Особо следует назвать фармакологически приемлемые соли неорганических и органических Еще одним объектом изобретения является кислот и оснований, обычно применяемые в галеспособ получения соединений формулы ФигІ, в 1 2 3 31 4 5 51 нике В качестве таких солей пригодны, во-первых, которых R , R , R , R , R , R , R и R имеют знаводорастворимые и водонерастворимые кислотчения, указанные выше, и их солей Способ отлино-аддитивные соли таких кислот, как, например, чается тем, что соединения формулы Фиг II (см 1 соляная кислота, бромистоводородная кислота, прилагаемый лист с формулами), в которых R , 2 3 31 4 5 51 фосфорная кислота, азотная кислота, серная киR , R , R , R , R , R и R имеют значения, укаслота, уксусная кислота, лимонная кислота, Dзанные выше, подвергают циклоконденсации, поглюконовая кислота, бензойная кислота, 2- (4сле чего при необходимости полученные соединегидроксибензоил) бензойная кислота, масляная ния формулы ФигІ переводят в их соли, или что кислота, сульфосалициловая кислота, малеинопри необходимости полученные соли соединений вая кислота, лауриновая кислота, яблочная кислоформулы Фиг I переводят затем в свободные сота, фамаровая кислота, янтарная кислота, щавеединения левая кислота, винная кислота, эмбоновая При необходимости полученные соединения кислота, стеариновая кислота, толуолсульфоноформулы Фиг I могут переводиться путем деривая кислота, метан сул ьфо новая кислота или 3ватизации и в другие соединения формулы Фиг I гидрокси-2-нафтойная кислота, причем кислоты Так, например, из соединений формулы ФигІ, где при получении солей - в зависимости от того, исR7 представляет собой сложноэфирную группу, пользуют ли одно- или многоосновную соль, и от кислотным либо щелочным омылением можно того, какая соль требуется - применяют в эквимополучить соответствующие кислоты взаимодейлярных количествах или в каких-либо других соотствием с аминами формулы HN(R 2 )R 73 можно ветствующих количественных соотношениях получить соответствующие амиды или же переэтерификацией сложных эфиров формулы ФигІ, Во-вторых, могут рассматриваться также соли, соответственно этерификацией кислот формулы I образуемые взаимодействием с основаниями В можно получить соответствующие сложные эфикачестве примеров таких солей можно назвать ры Реакции осуществляют предпочтительно анасоли щелочных металлов (лития, натрия, калия) логично методам, знакомым специалисту, наприили соли кальция, алюминия, магния, титана, аммер, таким образом, как это описано в мония, меглумина либо гуанидина, причем и в нижеследующих примерах этих случаях при получении солей основания применяют в эквимолярных количествах или в Циклоконденсацию осуществляют по известкаких-либо других количественных соотношениях ной специалисту методике согласно БишлерНапиеральски (например, так, как это описано в Фармакологически неприемлемые соли, котоJourn Chem Soc , 1956, 4280-4282) в присутствии рые могут образовываться сначала, например, соответствующего конденсирующего агента, такопри получении соединений по изобретению в прого, например, как полифосфорная кислота, пентамышленном масштабе в качестве продуктов спохлорид фосфора, оксид фосфора (V) или предсоба, специалист в данной области техники с попочтительно окситрихлорид фосфора, в мощью известных методов может перевести в соответствующем инертном растворителе, наприфармакологически приемлемые соли мер, в хлорированном углеводороде, таком, как Под соединениями формулы ФигІ имеются в хлороформ, либо в циклическом углеводороде, виду хиральные соединения с центрами хиральтаком, как толуол или ксилол, либо в ином инертности в положениях 4а и 10b а в зависимости от ном растворителе, таком, как ацетонитрил, либо значения заместителей R3, R \ R4, R5 и R51 еще и вообще без растворителя, но с использованием с другими центрами хиральности в положениях 1, избыточного количества конденсирующего агента, 2, 3 и 4 Объем изобретения включает поэтому предпочтительно при повышенной температуре, все возможные чистые диастереомеры и чистые прежде всего при температуре кипения примеэнантиомеры, равно как и их смеси в любом соотняемого растворителя, соответственно конденсиношении компонентов, включая рацематы Предрующего агента почтительными являются соединения формулы Фиг І, в которых атомы водорода в положениях 4а Выделение и очистку субстанций по изобреи 10b находятся в цис-положении относительно тению осуществляют по известной методике, надруг друга Предпочтительны при этой прежде пример, таким образом, что растворитель отгонявсего чистые цис-диастереомеры и чистые цисют под вакуумом, а полученный остаток энантиомеры, равно как и их смеси в любом соотперекристалл изовывают из соответствующего ношении компонентов, в том числе и рацематы В растворителя, или подвергают одному из обычных качестве предпочтительных следует назвать при методов очистки, как, например, колоночная хро 48216 10 матография на соответствующем носителе фенетиламина и 3-(-)-1-фенетиламина) путем гидрирования и последующего восстановительноСоли получают, растворяя свободное соедиго расщепления полученного вторичного амина нение в соответствующем растворителе, напри(например, таким образом, как это описано в Arch мер, в хлорированном углеводороде, таком, как Pharm 1989, 322, 187, или в нижеследующих приметилен-хлорид или хлороформ, либо в низкомомерах) лекулярном алифатическом спирте (в метаноле, этаноле, изопропаноле), который содержит треСоединения формулы ФигІУа могут быть побуемую кислоту, соответственно основание или к лучены, например, исходя из соединений формукоторому затем добавляют требуемую кислоту, лы Фиг IV по известной специалисту методике соответственно основание Завершающая стадия (например, таким образом, как это описано в Tetполучения солей может включать фильтрацию, rahedron 1968, 24, 6583, или в нижеследующих переосаждение, осаждение с помощью нераствопримерах) рителя для соли присоединения или выпаривание Соединения формулы Фиг IV (см прилагае1 2 3 31 растворителя Полученные соли можно преврамый лист с формулами), в которых R , R , R , R и 4 5 51 щать подщелачиванием или подкислением в своR имеют значения, указанные выше, a R и R бодные соединения, которые в свою очередь мообозначают водород, либо известны, либо могут гут переводиться в соли Таким путем быть получены из соответствующих соединений фармакологически неприемлемые соли можно формулы Фиг IV, в которых R и R51 оба вместе трансформировать в фармакологически приемлепредставляют собой еще одну связь Реакцию мые соли можно осуществлять по известной специалисту методике, предпочтительно гидрированием в приСоединения формулы Фиг II (см прилагаемый 1 2 3 31 4 сутствии катализатора, такого, например, как паллист с формулами), в которых R , R , R , R , R , ладий на активированном угле, например, таким R5, R51 и R имеют значения, указанные выше, образом, как это описано в Journ Chem Soc (С), могут быть получены из соответствующих соеди1971, 1805-1808, или в нижеследующих примерах нений формулы Фиг III (см прилагаемый лист с формулами), в которых R1, R2, R3, R31, R4, R5 и R51 Соединения формулы Фиг IV, в которых R5 и имеют значения, указанные выше, взаимодейстR51 оба вместе представляют собой еще одну вием с соединениями формулы R6-CO-X, где R6 связь, либо известны, либо могут быть получены имеет указанное выше значение, а X представлявзаимодействием соединений формулы Фиг V (см ет собой соответствующую уходящую группу, прилагаемый лист с формулами), в которых R1 и предпочтительно атом хлора Бензоилирование, R2 имеют указанные выше значения, с соединенапример, проводят так, как это описано в нижениями формулы Фиг VI (см прилагаемый лист с следующих примерах или в Journ Chem Soc (С), формулами), в которых R3, R31 и R4 имеют указан1971, 1805-1808 ные выше значения Соединения формулы R6-CO-X и соединения Циклоприсоединение осуществляют при этом формулы Фиг III либо известны, либо могут быть по известной специалисту реакции согласно Дильполучены по известной методике Так, например, су-Альдеру, например, таким образом, как это соединения формулы Фиг III можно получить из описано в Journ Amer Chem Soc 1957, 79, 6559, соединений формулы Фиг IV (см прилагаемый или в Journ Org Chem 1952, 17, 581, или же в лист с формулами), в которых R1, R , R3, R31, R4, нижеследующих примерах R5 и R51 имеют значения, указанные выше, восПолученные при циклоприсоединении соедистановлением нитрогруппы Восстановление осунения формулы Фиг VI, где фенильное кольцо и ществляют по методике, известной специалисту, нитрогруппа находятся в транс-положении относинапример, так, как это описано в Journ Org Chem тельно друг друга, могут переводиться по извест1962, 27, 4426, или в нижеследующих примерах ной специалисту методике в соответствующие Предпочтительно восстановление осуществляют цис-соединения, например, таким образом, как это путем каталитического гидрирования, например, в описано, например, в Journ Amer Chem Soc присутствии никеля Ренея, в низшем спирте, та1957, 79, 6559, или в нижеследующих примерах ком, как метанол или этанол, при комнатной темСоединения формул Фиг VI и V либо известпературе и при нормальном либо повышенном ны, либо могут быть получены по известной методавлении При необходимости к растворителю дике Так, соединения формулы Фиг V могут быть можно добавлять каталитическое количество киполучены, например, по известной специалисту слоты, такой, например, как соляная кислота методике из соответствующих соединений формулы Фиг VII, как это описано, в частности, в Получение чистых энантиомерных соединений Journ Chem Soc 1951, 2524, или в Journ Org формулы Фиг III осуществляют по известной спеChem 1944, 9, 170, или в нижеследующих примециалисту методике, например, через стадию обрах разования солей рацемических соединений формулы III с помощью оптически активных Соединения формулы Фиг VII (см прилагаекарбоновых кислот мый лист с формулами), в которых R1 и R2 имеют указанные выше значения, либо известны, либо Альтернативная возможность получения чисмогут быть получены по известной специалисту тых энантиомерных соединений формулы Фиг III методике, как это описано, например, в Вег Dtsch состоит также в том, что осуществляют асимметChem Ges 1925, 58, 203, или в нижеследующих ричный синтез исходя из соединений формулы примерах ФигІУа (см прилагаемый лист с формулами) после образования иминов с помощью оптически Нижеследующие примеры служат для более активных аминов (например, R-(+)-1подробного пояснения изобретения, не ограничи 11 48216 вая его объем Точно так же аналогичным путем или по известной специалисту технологии могут быть получены другие соединения формулы Ф и г І , получение которых не описано подробно Принятые в примерах сокращения означают следующее t m = температура плавления, t K m температура кипения, ч = час(ы), КГ = комнатная температура, MB = молекулярный вес, рассч = рассчитано, обн = обнаружено Представленные в примерах соединения и их соли являются предпочтительным объектом изобретения Примеры Конечные продукты 1 (+/-)цис-8, 9-диметокси-6[4(метоксикарбонил) фенил] - 1 , 2, 3, 4, 4а, 10b - гексагидрофенантридин 1,8г (+/-)-ц и с-N-[2-(3, 4-диметоксифенил) циклогексил]-4-метоксикарбонилбензамида растворяют в 50мл ацетонитрила и 1,0мл оксихлорида фосфора и перемешивают в течение 8ч при 50°С Затем реакционную смесь сливают в 100мл насыщенного раствора гидрокарбоната натрия и экстрагируют этиловым эфиром уксусной кислоты Органическую фазу промывают раствором гидрокарбоната натрия и водой, сушат с помощью сульфата натрия и концентрируют Остаток перекристаллизовывают из этилового эфира уксусной кислоты/петролейного эфира Таким путем получают 660мг (38,6% от теории) указанного в заголовке соединения с tnn 121,5-122,5°C Брутто-формула C23H25NO4, MB 379,46 Элементный анализ рассч С 72,80, Н 6,64, N 3,69, обн С 72,70, Н 6,61, N 3 , 5 8 Исходя из описанных ниже соответствующих исходных соединений аналогично методике согласно примеру 1 получают 2 (+/-)цис-8,9-диэтокси-б[4(метоксикарбонил)фенил] - 1 , 2, 3, 4, 4а,10Ьгексагидрофенантридин t m 136-137°C, выход 59,8% от теории Брутто-формула C25H29NO4, MB 407,51 Элементный анализ рассч С 73,69, Н 7,18, N 3,44, обн 0 73,83, Н 7,27, N 3 , 5 9 3 (+/-)- цис-Э-дифторметокси-8-метокси-б- [4(метоксикарбонил) фенил] - 1 , 2, 3, 4, 4а, 10Ь гексагидрофенантридин t m 126-127°C, выход 34,5% от теории Брутто-формула C23H23P2NO4, MB 415,44 Элементный анализ рассч С 66,50, Н 5,58, N 3,37, F 9,15, обн С 66,59, Н 5,55, N3,36, F 9,21 4 (+/-)цис-9-этокси-8-метокси-6[4(метоксикарбонил) фенил] - 1 , 2, 3, 4, 4а, 10Ь - гексагидрофенантридин t m 143,5-144,5°С, выход 88,6% от теории Брутто-формула C24H27NO4, MB 393,48 Элементный анализ рассч С 73,26, Н 6,92, N 3,56, обн 0 73,24, Н 6,92, N 3 , 7 0 5 (+/-)цис-8-этокси-9-метокси-6[4(метоксикарбонилфенил] - 1 , 2, 3, 4, 4а,10Ь гексагидрофенантридин t m 123-124,5°C, выход 81,9% от теории Брутто-формула C24H27NO4, MB 393,48 Элементный анализ рассч С 73,26, Н 6,92, N 3,56, обн 0 73,37, Н 6,97, N 3 , 5 6 6 (+/-)цис-8 9-диэтокси-б[3(метоксикарбонил)фенил] -1,2 3 4, 4а Л Ob - гекса 12 гидрофенантридин Масло, выход 40,4% от теории Брутто-формула C25H29NO4, MB 407,51 Элементный анализ рассч С 73,69, Н 7,17, N 3,44, обн 0 73,10, Н 7,10, N3,33 7 (+/-)цис-8, 9-диэтокси-б[2(метоксикарбонил) фенил] - 1 , 2, 3 4, 4а, 10Ь - гексагидрофенантридин Масло, выход 19,2% от теории Брутто-формула C25H29NO4, MB 407,51 Элементный анализ 0,5 НгО рассч С 72,79, Н 7,26, N 3,36, обн С 71,90, Н 7,26, N 3,20 8 (+/-)транс-8, 9-диметокси-б[4(метоксикарбонил) фенил] - 1 , 2, 3, 4, 4а, 10Ь - гексагидрофенантридин t m 212-214°C, выход 52,7% от теории Брутто-формула C23H25NO4, MB 379,46 Элементный анализ рассч С 72,80, Н 6,64, N 3,69, обн 0 72,69, Н 6,68, N 3 , 6 7 9 (-)цис-8, 9-диэтокси-б[4(метоксикарбонил) фенил] - 1 , 2, 3, 4, 4а, 10Ь - гексагидрофенантридин t m 92-95°C, выход 46,6% от теории Брутто-формула C25H29NO4, MB 407,51 Угол вращения [ a ] D -61,26° (с = 0,475, этанол) Элементный анализ рассч С 73,69, Н 7,17, N 3,44, обн 0 73,55, Н 7,25, N 3 , 3 5 10 (+)цис-8,9-диэтокси-6-[4(метоксикарбонил) фенил]-1, 2, 3, 4, 4а, 10Ь - гексагидрофенантридин t m 92-125°С, выход 48,2% от теории Брутто-формула C25H29NO4, MB 407,51 Угол вращения [ a ] D +60,08° (с = 0,23, этанол) Элементный анализ рассч С 73,69, Н 7,17, N 3,44, обн 0 73,66, Н 7,20, N 3 , 6 0 11 (-)цис-8, 9-диметокси-б[4(метоксикарбонил) фенил] - 1 , 2, 3, 4, 4а, 10Ь - гексагидрофенантридин Затвердевающее масло, выход 5 8 , 1 % от теории Брутто-формула C23H25NO4, MB 379,46 Угол вращения [ a ] D -90,0° (с = 0,2, этанол) Элементный анализ рассч С 72,80, Н6,64, N 3,69, обн 0 72,80, Н 6,90, N 3 , 5 4 12 (+)цис-8, 9-диметокси-б[4(метоксикарбонил) фенил] - 1 , 2, 3, 4, 4а, 10Ь - гексагидрофенантридин Затвердевающее масло, выход 86,9% от теории Брутто-формула C23H25NO4, MB 379,46 Угол вращения [ a ] D +83,9° (с = 0,2, этанол) Элементный анализ рассч С 72,80, Н 6,64, N 3,69, обн 0 72,99, Н 6,73, N 3 , 6 6 13 (+/-)цис-8, 9-диметокси-б[4(циклопропилметоксикарбонил) фенил] - 1 , 2, 3, 4, 4а, 10Ь-гексагидрофенантридин 2,0г (+/-)цис-8, 9-диметокси-6-(4карбоксифенил)-1, 2, 3, 4, 4а, 10Ь - гексагидрофенантридина суспендируют в 12,0мл циклопропилметанола, смешивают с 1,0мл тионилхлорида и в течение 4 дней перемешивают при 50°С Раствор концентрируют при пониженном давлении и остаток распределяют между этиловым эфиром уксус 14 13 48216 ной кислоты и разбавленным раствором гидрофенил-8, 9-диметокси-1, 2, 3, 4, 4а, 10Ь - гексагидкарбоната натрия Органическую фазу сушат с рофенантридин помощью сульфата натрия и концентрируют Ос680мг (+/-)цис-8, 9-диметокси-6-[4таток перекристаллизовывают из этилового эфира (метоксикарбонил) фенил-1, 2, 3, 4, 4а,10Ь - гексауксусной кислоты Таким путем получают 1,33г гидрофенантридина нагревают в автоклаве с 25мг (63,7% от теории) указанного в заголовке соедицианида натрия в 13мл 9-молярного раствора менения с t m 147-148°C тиламина в этаноле в течение 10 ч до 90°С Затем раствор концентрируют под вакуумом, остаток Брутто-формула C26H29NO4, MB 419,53 растворяют в метиленхлориде и экстрагируют Элементный анализ рассч С 74,44, Н 6,97, N водой Органическую фазу сушат с помощью 3,34, обн С 74,13, Н 6,84, N3,48 сульфата натрия, растворитель удаляют под ва14 Гидрохлорид (+/-)цис-6-(4куумом, остаток тонко растирают и размешивают в карбоксифенил)-8, 9-диэтокси-1, 2, 3, 4, 4а, 10b диэтиловом эфире, отфильтровывают с помощью гексагадрофенантридина вакуум-фильтра и сушат Таким путем получают 220мг (+/-)цис-8, 9-диэтокси-6-[4380мг (56,1% от теории) указанного в заголовке (метоксикарбонил) фенил]- 1, 2, 3, 4, 4а, 10Ь соединения с t m 209-211 °С гексагидрофенантридина растворяют в 3,0мл концентрированной соляной кислоты и 5,0мл воды и Брутто-формула C23H26N2O3, MB 378,48 в течение 4 ч перемешивают при 80°С ОбразуюЭлементный анализ рассч С 72,99, Н 6,92, N щийся при охлаждении осадок отфильтровывают 7,40, обн С 72,64, Н 6,99, N7,44 с помощью вакуум-фильтра и сушат Таким путем Исходные соединения получают 135мг (58,1% от теории) указанного в А1 (+/-)- цис-N- [2-(3, 4-диметоксифенил) цикзаголовке соединения с t m 269°C логексил] -4-метоксикарбонилбензамид Брутто-формула C24H27NO4 HCI, MB 429,95 2,6г (+/-)цис-1, 2-диметокси-4-(2Элементный анализ рассч С 67,05, Н 6,56, CI аминоциклогексил) бензола растворяют в 20мл метиленхлорида и 1мл триэтиламина Затем при 8.25, N 3,26, обн С 66,90, Н 6,51, CI 8,22, N 3,11 КГ в течение 3 ч добавляют по каплям раствор из Исходя из описанных выше соответствующих 2,4г хлорангидрида 4-метоксикарбонилбензойной исходных соединений по методике, аналогичной в кислоты в 30мл метиленхлорида, после перемепримере 1, получают шивания в течение 1 ч экстрагируют соответст15 Гидрохлорид (+/-)цис-6(4венно 50мл воды, 2н соляной кислотой, насыщенкарбоксифенил)-8, 9-диметокси-1, 2, 3, 4, 4а, 10Ь ным раствором гидрокарбоната натрия и повторно гексагидрофенантридина водой Органическую фазу сушат с помощью t m 220°C (разлож), выход 65% от теории сульфата натрия, концентрируют и кристаллизуют Брутто-формула C22H23NO4 HCI, MB 401,89 из этилового эфира уксусной кислоты Таким пуЭлементный анализ рассч С 65,75, Н 6,02, CI тем получают 2,0г (45,5% от теории) указанного в 8,82, N 3,48, обн С 65,63, Н 6,06, CI 8,58, N 3,60 заголовке соединения с t m 139-143°С 16 Гидрохлорид (+/-)цис-6(4карбоксифенил)- 9-этокси- 8-метокси-1, 2, 3, 4, Исходя из описанных ниже соответствующих 4а,10Ь - гексагидрофенантридина исходных соединений по методике, аналогичной в примере А1, получают t m 180°C (разлож), выход 53,4% от теории Брутто-формула C23H25NO4 HCI, MB 415,92 А2 (+/-)- цис-N- [2-(3-дифторметокси-4Элементный анализ 2.5Н20 рассч С 59,93, Н метоксифенил) циклогексил]-46,78, N 3,03, CI 7,68, обн С 59,70, Н 6,57, N 3,18, метоксикарбонилбензамид CI 7,71 Масло, выход 96,5% от теории 17 Гидрохлорид (+/-)цис-6(4A3 (+/-)- цис-N- [2-(3,4-диэтоксифенил) циклокарбоксифенил)- 8-этокси- 9-метркси-1, 2, 3, 4, 4а, гексил]-4-метоксикарбонилбензамид 10Ь - гексагидрофенантридина Масло, выход 58,7% от теории t m > 250°С, выход 32,4% от теории А4 (+/-)- цис-N- [2-(3-этокси-4-метоксифенил) Брутто-формула C23H25NO4 HCI, MB 415,92 циклогексил]-4-метоксикарбонилбензамид Элементный анализ рассч С 66,42, Н 6,30, N t m 151,5-152,5°C, выход 78,9% от теории 3,37, CI 8,52, обн С 66,37, Н 6,31, N 3,24, CI 8,79 А5 (+/-)- цис-N- [2-(2-этокси-3-метоксифенил) циклогексил]-4-метоксикарбонилбензамид 18 Гидрохлорид (+/-)цис-6(3карбоксифенил) 8, 9-диэтокси-1, 2, 3, 4, 4а, 10Ь t m 126,5-127,5°С, выход 58,7% от теории гексагидрофенантридина А6 (+/-)- цис-N- [2-(2,3-диэтоксифенил) циклогексил]-3-метоксикарбонилбензамид t m 259-260°C, выход 32,6% от теории Брутто-формула, C24H27NO4 HCI, MB 429,95 Масло, выход 96,27% от теории Элементный анализ рассч С 67,05, Н 6,56, N А7 (+/-)- цис-N- [2-(2,3-диэтоксифенил) циклогексил]-2-метоксикарбонилбензамид 3.26, CI 8,25, обн С 67,05, Н 6,67, N 3,19, CI 8,22 19 Гидрохлорид (+/-)цис-6-(4t m 144-144,5°С, выход 59,6% от теории карбоксифенил) -9-дифторметокси-8-метокси - 1 , А8 (+/-)- транс-N- [2-(3,4-диметоксифенил) 2, 3, 4, 4а, 10Ь - гексагидрофенантридина циклогексил]-4-метоксикарбонилбензамид t m 170°C (разлож), выход 69,8% от теории t m 189-193°C, выход 48,0% от теории Брутто-формула C22H21F2NO4 HCI, МБ 437,88 А9 (-)- цис-N- [2-(3,4-диэтоксифенил) циклоЭлементный анализ С2Н5ОН рассч С 59,57, гексил]-4-метоксикарбонилбензамид Н 5,83, N 2,89, F 7,85, CI 7,33, обн С 59,39, Н t m 122-124°C, выход 80,15% от теории 5,76, N2,65, F8.00, CI7.10 Угол вращения [ a ] D -137,3° (с = 0,11, эта20 (+/-)- цис-6- [4- (N-метиламииокарбонид) нол) 16 15 48216 A10 (+)- цис-N- [2- (3,4-диэтоксифенил) циклолизующийся продукт отфильтровывают с гексил]-4-метоксикарбонилбензамид помощью вакуум-фильтра и сушат U 123-125°С, выход 86,75% от теории t m 145-147°C, выход 59,0% от теории a a Угол вращения [ ] D -60° (с = 0,12, этанол) Угол вращения [ ] D +134,8° (с = 0,135, этаИсходя из описанных ниже соответствующих нол) исходных соединений по методике, аналогичной в А11 (-)- цис-N- [2-(3,4-диметоксифенил) цикпримере Б7, получают логексил]-4-метоксикарбонилбензамид t m 154,5-156°С, выход 85,2% от теории Б8 Гидрохлорид (+)-цис-1,2-диэтокси-4-(2a аминоциклогексил) бензола Угол вращения [ ] D -167,7° (с = 0,2, этанол) t m 149-151 °С, выход 52,9% от теории А12 (+)- цис-N- [2-(3,4-диметоксифенил) цикa Угол вращения [ ] D +70° (с = 0,21, этанол) логексил]-4-метоксикарбонилбензамид Б9 (-)цис-1,2-диметокси-4-(2t m 153,5-154,5°С, выход 85,1% от теории a аминодиклогексил) бензол Угол вращения [ ] D +165° (с = 0,2, этанол) 12,0г (+/-)цис-1,2-диметокси-4-(2Б1 (+/-) -цис-1,2-диметокси-4-(2аминоциклогексил) бензола и 6,2г (-)-миндальной аминоциклогексил) бензол кислоты растворяют в 420мл диоксана и 60мл 8,5г (+/-)-цис-1,2-диметокси-4-(2тетрагидрофурана и перемешивают в течение нитроциклогексил) бензола растворяют в 400мл ночи при КГ Затем твердое вещество отфильтрометанола и при КГ в течение 8 ч порциями смевывают, сушат, смешивают со 100мл насыщенношивают с 7мл гидрата гидразина и 2,5г никеля Ренея После перемешивания в течение ночи при го раствора гидрокарбоната натрия и экстрагируКГ реакционную смесь фильтруют, фильтрат конют этиловым эфиром уксусной кислоты центрируют и остаток хроматографируют через Органическую фазу сушат с помощью сульфата силикагель смесью из толуола/этилового эфира натрия и концентрируют при пониженном давлеуксусной кислотыл'риэтиламина в соотношении нии Таким путем получают 4,8г (40,0% от теории) 4 2 0,5 указанного в заголовке соединения с t m 80-81,5°С Угол вращения [а]о -58,5° (с = 1, этанол) Масло, выход 74,4% от теории Исходя из описанных ниже соответствующих Исходя из описанных ниже исходных соединений по методике, аналогичной в примере Б1, исходных соединений по методике, аналогичной в получают примере Б9, получают Б2 (+/-)транс-1,2-диметокси-4-(2Б10 (+)- цис -1,2- диметокси-4-(2- аминоциклоаминоциклогексил) бензол гексил) бензол Масло, выход 65,9% от теории t m 68-69°C, выход 37,2% от теории БЗ (+/-)цис -1,2-диэтокси-4-(2Угол вращения [а]о +59,2° (с = 1, этанол) аминоциклогексил) бензол 81 (-)- цис-1,2-ДИЭТОКСИ-4- [2- (1-фенилэтил) Масло, выход 42,8% от теории аминоциклогексил] бензол Б4 (+/-)- цис-2-дифторметокси-1-метокси-4-(24,0г 2-(3,4-диэтоксифенил) циклогексанона, аминоциклогексил) бензол 2,0мл Р-(+)-1-фенетиламина и 20мг толуолсуль14,6г (+/-)- цис-2-дифторметокси-1-метокси-4фоновой кислоты растворяют в 150мл толуола и в (2-нитроциклогекс-4-енил) бензола растворяют в течение 18 ч нагревают с использованием водо170мл этанола, смешивают с 3,0г никеля Ренея и отделителя и обратного холодильника Затем распри давлении водорода 50бар в течение 9 дней твор концентрируют при пониженном давлении, гидрируют в автоклаве Суспензию фильтруют, остаток растворяют в 200мл этанола, смешивают растворитель отгоняют под вакуумом и остаток с 5г увлажненного этанолом никеля Ренея и при хроматографируют через силикагель смесью из КГ и давлении водорода 30-60бар гидрируют в толуола/диоксанал'риэтиламина в соотношении течение 10 дней Далее отфильтровывают с по3 1 0,5 После упаривания соответствующих мощью вакуум-фильтра от катализатора, раствор фракций получают 3,4г (25,7% от теории) указанконцентрируют при пониженном давлении и останого в заголовке соединения в виде масла ток хроматографируют через силикагель смесью из толуола/диоксанал'риэтиламина в соотношении Исходя из описанных ниже соответствующих 20 2 1 После концентрирования соответствующих исходных соединений по методике, аналогичной в элюатных фракций получают 2,15г (38,4% от теопримере Б4, получают рии) указанного в заголовке соединения в виде Б5 (+/-)цис-2-этокси-1-метокси-4-(2масла аминоциклогексил) бензол Масло, выход количественный Угол вращения [а]о -3,7° (с = 0,27, этанол) Б6 (+ /-)- цис-1-этокси-2-метокси-4-(2Исходя из описанных ниже соответствующих аминоциклогексил) бензол исходных соединений по методике, аналогичной в Масло, выход количественный примере В1, получают Б7 Гидрохлорид (-)- цис-1,2-диэтокси-4-(282 (+)- цис-1,2-диэтокси-4-[2-(1 -фенилзтил) аминоциклогексил) бензола аминоциклогексил] бензол 2,2г (-)- цис-1,2-диэтокси-4- [2-(1-фенилэтил) Исходя из 2-(3,4-диэтоксифенил) циклогексааминоциклогексил] бензола суспендируют в 50мл нона и 8-(-)-1-фенетиламина получают указанное этанола, смешивают с 270мг 10%-ного палладия в заголовке соединение в виде масла Выход на угле и при 50°С и давлении водорода 50бар 64,6% от теории гидрируют в течение 6 дней После отфильтровыУгол вращения [а]о +7,1° (с = 0,56, этанол) вания катализатора раствор дополнительно конП 2-(3,4-диэтоксифенил) циклогексанон центрируют при пониженном давлении и кристал 18 17 48216 10,2г 2-(3,4-диэтоксифенил) циклогекс-4-енона (2-нитродиклогекс-4-енил) бензол в 600мл тетрагидрофурана смешивают с 1,5мл Масло, выход количественный концентрированной соляной кислоты и 400мг 10%ЖЗ (+/-)цис-1,2-диэтокси-4-(2ного палладия на угле и гидрируют После отнитроциклогекс-4-енил) бензол фильтровывания катализатора и концентрироваМасло, выход 96,5% от теории ния раствора при пониженном давлении остаток Ж4 (+/-)цис-2-этокси-1-метокси-4-(2хроматографируют через силикагель смесью из нитроциклогекс-4-енил) бензол петролейного эфира/этилового эфира уксусной t m 66-67°C, выход 97,2% от теории кислоты в соотношении 2 1 После концентрироЖ5 (+/-)цис-1 -это кс и-2-мето кс и-4-(2вания соответствующих элюатных фракций полунитроциклогекс-4-енил) бензол чают 8,25г (80,9% от теории) указанного в загоt m 96-97°C, выход 95,8% от теории ловке соединения в виде затвердевающего масла 31 (+/-)-транс-1,2-диметокси-4-(2нитроциклогекс-4-енил) бензол Д1 2-(3 4-диэтоксифенил) циклогекс-4-енон 15,0г (+/-)транс-1,2-диэтокси-4-(250,Ог З^-диметокси-^-нитростирола и 1,0г нитроциклогекс-4-енил) бензола растворяют в (9,1ммолей) гидрохинона суспендируют в 200мл 375мл этанола и по каплям добавляют в 42мл абсолютного толуола и при -70°С смешивают с 20%-ного раствора этилата натрия После пере55,Ог (1,02моля) жидкого 1,3-бутадиена Смесь мешивания в течение 20 мин при КГ по каплям перемешивают в автоклаве в течение 6 дней при добавляют в охлажденный льдом раствор из 67,5 160°С, после чего охлаждают Часть растворителя мл концентрированной соляной кислоты и 1,35г удаляют с помощью ротационного испарителя, мочевины в 225мл воды и 170мл этанола Затем образующийся осадок отфильтровывают с помораствор экстрагируют водой/дихлорметаном, орщью вакуум-фильтра и перекристаллизовывают в ганическую фазу сушат с помощью сульфата наэтаноле t m 113,5-115,5°С, выход 76,3% от теории трия и концентрируют при пониженном давлении Исходя из описанных ниже соответствующих Остаток хроматографируют через силикагель петисходных соединений по методике, аналогичной в ролейным эфиром/этиловым эфиром уксусной примере 31, получают кислоты в соотношении 2 1 После концентриро32 (+/-)- транс-2-дифторметокси-1-метокси-4вания соответствующих элюатных фракций полу(2-нитродиклогекс-4-енил) бензол чают 10,33г (77,1% от теории) указанного в загоt m 100-102° С, выход 62,3% от теории ловке соединения в виде масла 33 (+/-)транс-1,2-диэтокси-4-(2Е1 (+/-)цис-1,2-диметокси-4-(2нитроциклогекс-4-енил) бензод нитроциклогексил) бензол t m 80-81,5°С, выход 59,8% от теории 8,4г (+/-)цис-1,2-диметокси-4-(234 (+/-)транс-2-этокси-1-метокси-4-(2нитроциклогекс-4-енил) бензола растворяют в нитродиклогекс-4-енил)бензол 450мл метанола, смешивают с 2мл концентрироt m 129-130°C, выход 75,7% от теории ванной соляной кислоты и после добавления 35 (+/-)транс-1 -это кс и-2-мето кс и-4-(2500мг 10%-ного Pd/C гидрируют Затем реакционнитроциклогекс-4-енил)бензол ную смесь фильтруют и фильтрат концентрируют, t m 70,5-72°C, выход 66,8% от теории t m 84-86,5°С, выход количественный И1 3,4-диметокси-ш-нитростирол Исходя из описанных ниже соответствующих 207,0г 3,4-диметоксибензальдегида, 100,0г исходных соединений по методике, аналогичной в ацетата аммония и 125мл нитрометана нагревают примере Е1, получают в 1,0л ледяного уксуса в течение 3-4 ч до кипения Е2 (+/-)цис-1,2-диэтокси-4-(2После охлаждения в ледяной бане осадок отнитроциклогексил) бензол фильтровывают с помощью вакуум-фильтра, промывают ледяным уксусом и петролейным эфиром Масло, выход 96,5% от теории и сушат, t m 140-141 °С, выход 179,0г (68,5% от ЕЗ (+/-)-транс-1,2-диметокси-4-(2теории) нитроциклогексил) бензол Масло, выход 47,0% от теории Исходя из описанных ниже либо известных из Ж1 (+/-)-цис-1,2-диметокси-4-(2литературы исходных соединений по методике, нитроциклогекс-4-енил) бензол аналогичной в примере И1, получают 10,0г (+/-)-транс-1,2-диметокси-4-(2И2 З-дифторметокси-4-метоксиш нитроциклогекс-4-енил) бензола и 20,Ог гидроксинитростирол да калия растворяют в 150мл этанола и 35мл диt m 120-123°C, выход 24,8% от теории, метилформамида Затем по каплям добавляют ИЗ 3,4-диэтокси-о)-нитростирол раствор из 17,5мл концентрированной серной киt m 136-136,5°C, выход 76,2% от теории слоты в 60мл этанола таким образом, чтобы внутИ4 З-этокси-4-метокси- ш -нитростирол ренняя температура не превышала 4°С После t m 132-133°C, выход 70,3% от теории перемешивания в течение 1 ч сливают на 1л леИ5 4-этокси-З-метокси-ш-нитростирол дяной воды, осадок отфильтровывают с помощью t m 147-148,5°С, выход 68,6% от теории вакуум-фильтра, промывают водой, сушат и сыК З-дифторметокси-4-метоксибензальдегид рой продукт перекристаллизовывают из этанола В смесь из 200г изованилина, 6,7г хлорида t m 82,5-84°C, выход 86% от теории бензилтриметиламмония, 314г 50%-ного едкого натра и 2л диоксана при интенсивном перемешиИсходя из описанных ниже соответствующих вании подают в течение приблизительно 2 ч хлорисходных соединений по методике, аналогичной в дифторметан Затем смесь распределяют между примере Ж1, получают ледяной водой и этилацетатом, органическую фаЖ2 (+/-)- цис-2-дифторметокси-1-метокси-4 20 19 48216 зу отделяют, водную фазу дважды тонко растиралевания иммунной системы (СПИД, рассеянный ют и размешивают в етилацетате объединенные склероз), различные формы проявления шоковых органические фазы сушат над сульфатом магния состояний (септический шок, эндотоксинный шок, и концентрируют под вакуумом Для удаления неграм-отрицательный сепсис, токсический шоковый прореагировавшего изованилина масло хроматосиндром и респираторный дистресс-синдром у графируют на нейтральном силикагеле с помовзрослых, а также генерализованные воспаления щью толуола После упаривания элюата получают в области желудочно-кишечного тракта (болезнь 249г З-дифторметокси-4-метоксибензальдегида в Крона и язвенный колит), заболевания, связанные виде масла с аллергическими и/или хроническими, иммунологическими нарушениями в области верхних дыхаПромышленная применимость тельных путей (носоглотка) и в близлежащих обСоединения по изобретению обладают ценластях (околоносовые пазухи, глаза), как, ными фармакологическими свойствами, которые например, аллергический ринит/синусит, хроничеобеспечивают возможность их промышленной ский ринит/синусит, аллергический конъюнктивит, применимости В качестве ингибиторов избираа также полипы носа, наряду с вышеуказанными тельного действия по отношению к циклическитакже заболевания сердца, которые можно лечить нуклеотидной фосфодиэстеразе (ФДЭ) (а именно, с помощью ФДЭ-ингибиторов, в частности сертипа IV) они пригодны, с одной стороны, в качестдечную недостаточность, или заболевания, котове бронхиальных терапевтических средств (для рые можно лечить с использованием ФДЭлечения обструкции дыхательных путей благодаингибиторов благодаря их расслабляющему ткани ря их расширяющему, а также благодаря их подействию, как, например, эректильную дисфунквышающему частоту дыхания, соответственно цию или колики в почках либо в мочеточниках, стимулирующему дыхание действию) и для устрасвязанные с наличием почечных камней Другим нения эректильной дисфункции благодаря сосуобъектом изобретения является способ лечения дорасширяющему действию, с другой стороны, млекопитающих, в том числе человека, заболеводнако, прежде всего для лечения заболеваний, в ших одной из вышеназванных болезней Способ частности воспалительного характера, например, отличается тем, что больному млекопитающему заболеваний дыхательных путей (профилактика вводят терапевтически эффективное и фармакоастмы), кожи, кишечника, глаз, центральной нервлогически приемлемое количество одного либо ной системы и суставов, механизм развития котонескольких соединений по изобретению рых опосредован медиаторами, такими, как гистамин, ФАТ (фактор, активирующий тромбоциты), Еще одним объектом изобретения являются производные арахидоновой кислоты, такие, как соединения по изобретению, предназначенные лейкотриены и простагландины, цитокины, интердля применения при лечении и/или профилактике лейкины, хемокины, альфа-, бета- и гаммавышеназванных болезней интерферон, фактор некроза опухоли (TNF) или Изобретение относится также к применению кислородные радикалы и протеазы При этом сосоединений по изобретению для изготовления единения по изобретению отличаются малой токлекарственных средств, предназначенных для сичностью, хорошей энтеральной резорбцией лечения и/или профилактики вышеназванных бо(высокой биодоступностью), широким терапевтилезней ческим спектром и отсутствием каких-либо сущеОбъектом изобретения являются далее лественных побочных эффектов), карственные средства для лечения и/или профилактики вышеназванных болезней, содержащие Благодаря их подавляющим ФДЭ свойствам одно либо несколько соединений по изобретению соединения согласно изобретению могут применяться в медицине и ветеринарии в качестве теЛекарственные средства изготавливают с порапевтических средств, примем они могут испольмощью известных способов, знакомых специализоваться, например, для лечения и профилактики сту в данной области техники В качестве лекарследующих болезней острые и хронические (прественных средств соединения по изобретению жде всего воспалительные и аллергические) за(они же действующие вещества) применяют либо болевания дыхательных путей различного генеза индивидуально, либо предпочтительно в сочета(бронхит, аллергический бронхит, бронхиальная нии с соответствующими фармацевтическими астма), дерматозы (прежде всего пролиферативвспомогательными веществами, например, в виде ного, воспалительного и аллергического типа), как, таблеток, драже, капсул, суппозиториев, пластынапример, псориаз (обыкновенный), токсическая и рей, эмульсий, суспензий, гелей или растворов, аллергическая контактная экзема, атоническая причем содержание действующих веществ соэкзема, себорейная экзема, простой лишай, солставляет предпочтительно от 0,1 до 95% нечная эритема, зуд в генитально-анальной обВыбор соответствующих вспомогательных ласти, круговидное облысение, гипертрофические веществ для требуемых лекарственных композирубцы, дисковидная красная волчанка, фолликуций для специалиста не представит трудностей лярная и сливная пиодермия, эндогенные и экзоКроме растворителей, гелеобразователей, мазегенные угри, розацеа, а также другие пролиферавых основ и других носителей для действующих тивные, воспалительные и аллергические кожные веществ, могут использоваться также, например, заболевания, заболевания, обусловленные повыантиоксиданты, диспергаторы, эмульгаторы, коншенным высвобождением TNF и лейкотриенов, серванты, агенты, способствующие растворимотакие, например, как заболевания типа артритов сти, или промоторы проницаемости (ревматоидный артрит, ревматоидный спондилит, При лечении заболеваний дыхательных путей остеоартрит и другие артритные состояния), забосоединения по изобретению предпочтительно 22 21 48216 применять также для ингаляционной терапии С 1992, 43, 2041-2051, TorphyTJ и др , Phosphodiэтой целью их вводят в организм непосредственно esterase inhibitors new opportunities for treatment of в виде порошков (предпочтительно в тонко дисasthma, Thorax 1991, 46, 512-523, Schudt С и др , персной форме) либо распылением растворов или Zardaverme a cyclic AMP PDE III/IV inhibitor, в "New суспензий, содержащих указанные соединения Drugs for Asthma Therapy", 379-402, изд-во BirkКасательно приготовления соответствующих комhuuser Verlag Basel 1991, Schudt С и д р , Influence позиций и форм применения можно сослаться на of selective phosphodiesterase inhibitors on human выкладки в заявке на европейский патент 163965 neutrophil functions and levels of cAMP and Ca Naunyn-Schmiedebergs Arch Pharmacol 1991, 344 При лечении дерматозов соединения по изо682-690, Nielson С Р и др , Effects of selective бретению применяют прежде всего в виде таких phosphodiesterase inhibitors on polymorphonuclear лекарственных средств, которые пригодны для leukocyte respiratory burst, J Allergy Clm Immunol местного назначения Для приготовления таких 1990, 86, 801-808, Schade и др , The specific type III лекарственных средств соединения по изобретеand IV phosphodiesterase inhibitor zardaverme supнию (они же действующие вещества) предпочтиpress formation of tumor necrosis factor by macroтельно смешивать с соответствующими фармаphages, European Journal of Pharmacology 1993, цевтическими вспомогательными веществами и 230, 9-14) путем последующей переработки получать требуемые композиции В качестве таких лекарственПодавление активности ФДЭ IV ных композиций можно назвать, например, пудры, Методика эмульсии, суспензии, аэрозоли, масла, мази, жирТест на подавление активности проводили по ные мази, кремы, пасты, гели или растворы методу Бауэра и Швабе, адаптированному к работе с планшетами для микротитрования (NaunynПредлагаемые согласно изобретению лекарSchmiedeberg's Arch Pharmacol 1980, 311, 193ственные средства приготавливают по известным 198) При этом на первой стадии осуществляют способам Дозировку действующих веществ осуФДЭ-реакцию На второй стадии образовавшийся ществляют в пределах, обычных для ФДЭ5'-нуклеотид с помощью 5'-нуклеотидазы яда змеи ингибиторов Так, в частности, препараты, предCrotalus Atrox расщепляют до незаряженного нукназначенные для местного применения при лечелеозида На третьей стадии нуклеозид отделяют нии дерматозов (такие, например, как мази), сона ионообменных колонках от оставшегося зарядержат действующие вещества в концентрации, женного субстрата Колонки элюируют 2мл ЗмМ например, от 0,1 до 99% Доза для ингаляционноформиата аммония (рН 6,0) непосредственно в го применения составляет обычно от 0,01 до 1мг минифлакончики, в которые для подсчета добавна одну порцию Обычная доза при системной ляют еще 2мл сцинтиляционной жидкости терапии р о или і v составляет от 0,1 до 200мг на один прием Выявленные для соединений по изобретению показатели ингибирования представлены в нижеБиологические исследования следующей таблице А, в которой номера соедиПри исследовании подавления ФДЭ IV на кленений соответствуют номерам примеров точном уровне активации воспалительных клеток придается особое значение В качестве примера Таблица А можно назвать индуцируемое ФМЛФ (Nформилметиониллейцилфенилаланином) гиперПодавление активности ФДЭ IV продуцирование оксидов нейтрофильными грануСоединение -loglCso лоцитами, которое можно измерять по усиленной 1 7,39 луминолом хемолюминесценции [McPhail L С, 2 8,84 Strum S L , Leone Р А и Sozzam S , The neutrophil 3 7,73 respiratory burst mechanism В "Immunology Series" 4 8,73 1992, 57, 47-76, под ред Coffey RG (Marcel 5 7,02 Decker, Inc , New-York-Basel-Hong Kong)] 6 8,14 Субстанциями, ингибирующими хемолюми7 6,34 несценцию, а также секрецию цитокинов и секре8 5,92 цию усиливающих воспаление медиаторов в вос9 8,52 палительных клетках, прежде всего 10 7,48 нейтрофильные и эозинофильные гранулоциты, Тлимфоциты, моноциты и макрофаги, являются 11 7,52 таковые, которые подавляютФДЭ IV Этот изо12 4,95 фермент из семейства фосфодиэстераз присутст13 7,39 вует в первую очередь в гранулоцитах Его инги14 8,27 бирование приводит к повышению 15 6,81 внутриклеточной концентрации циклического аде16 8,66 нозинмонофосфата (цАМФ) и тем самым к подав17 6,79 лению клеточной активации Ингибирование ФДЭ 18 7,69 IV субстанциями по изобретению является, таким 19 7,55 образом, основным показателем подавления вос20 5,18 палительных процессов (Giembycz M А , Could isoenzyme-selective phosphodiesterase inhibitors render bronchodilatory therapy redundant in the treatment of bronchial asthma'?, Biochem Pharmacol 23 48216 ДП «Український інститут промислової власності» (Укрпатент) вул Сім'ї Хохлових, 15, м Київ, 04119, Україна ( 0 4 4 ) 4 5 6 - 2 0 - 90 ТОВ "Міжнародний науковий комітет" вул Артема, 77, м Київ, 04050, Україна (044)216-32-71 24
ДивитисяДодаткова інформація
Назва патенту англійськоюPhenanthridines and a drug for treating diseases of respiratory tract
Автори англійськоюSchudt Christian, Beume Rolf
Назва патенту російськоюФенантридины и лекарственное средство для лечения заболеваний дыхательных путей
Автори російськоюШудт Кристиан, Беуме Рольф
МПК / Мітки
МПК: A61P 11/08, A61K 31/47, C07D 221/12, A61K 31/473, A61P 11/00, A61K 31/00
Мітки: дихальних, лікарський, шляхів, захворювань, засіб, лікування, фенантридини
Код посилання
<a href="https://ua.patents.su/12-48216-fenantridini-ta-likarskijj-zasib-dlya-likuvannya-zakhvoryuvan-dikhalnikh-shlyakhiv.html" target="_blank" rel="follow" title="База патентів України">Фенантридини та лікарський засіб для лікування захворювань дихальних шляхів</a>
Попередній патент: Ванна (варіанти) та спосіб гарячого цинкування
Наступний патент: Датчик віброприскорень
Випадковий патент: Пристрій дистанційного управління включенням ланцюга електроживлення привода насоса