Моноклональне антитіло vff-18 проти сd44v6 і його фрагменти
Формула / Реферат
1. Моноклональное антитело к эпитопу с аминокислотной последовательностью, кодируемой вариабельным экзоном v6 гена CD44, представляющее собой антитело VFF-18, продуцируемое гибродомой DSM АСС 2174, или его фрагмент, сохраняющий его активность, причем моноклональное антитело или его фрагмент предназначены для диагностических или терапевтических целей.
2. Антитело по п. 1, отличающееся тем, что оно связано с другой молекулой, отличной от антитела.
3. Антитело по п. 2, отличающееся тем, что оно связано с полипептидом.
4. Антитело по п. 2, отличающееся тем, что оно связано с токсином.
5. Антитело по любому из пп. 2-4, отличающееся тем, что оно связано с радиоактивным изотопом.
6. Линия клеток гибридомы DSM ACC 2174, продуцирующая моноклональное антитело по п. 1.
7. Антитело к эпитопу с аминокислотной последовательностью, кодируемой вариабельным экзоном v6 гена CD44, полученное рекомбинантной и/или ферментативной и/или химической модификацией без изменения аминокислотной последовательности антитела VFF-18 в области места связывания антигена, или его фрагмент, сохраняющий его активность.
8. Антитело по п. 7, отличающееся тем, что оно связано с другой молекулой, отличной от антитела.
9. Антитело по п. 7, отличающееся тем, что оно связано с полипептидом.
10. Антитело по п. 7, отличающееся тем, что оно связано с токсином.
11. Антитело по любому из пп. 8-10, отличающееся тем, что оно связано с радиоактивным изотопом.
12. Рекомбинантное антитело к эпитопу с аминокислотной последовательностью, кодируемой вариабельным экзоном v6 гена CD44, имеющее идентичную аминокислотную последовательность моноклонального антитела VFF-18 в области места связывания антигена, или его фрагмент, сохраняющий его активность, причем рекомбинантное антитело или его фрагмент предназначены для диагностических или терапевтических целей.
13. Рекомбинантное антитело по п. 12, отличающееся тем, что оно представляет собой химерную, гуманизированную одноцепочечную или полученную путем сцепления цепей молекулу антитела.
14. Рекомбинантное антитело по п. 12 или 13, отличающееся тем, что оно связано с другой молекулой, отличной от антитела.
15. Рекомбинантное антитело по п. 14, отличающееся тем, что оно связано с полипептидом.
16. Рекомбинантное антитело по п. 14, отличающееся тем, что оно связано с токсином.
17. Рекомбинантное антитело по любому из пп. 14-16, отличающееся тем, что оно связано с радиоактивным изотопом.
Текст
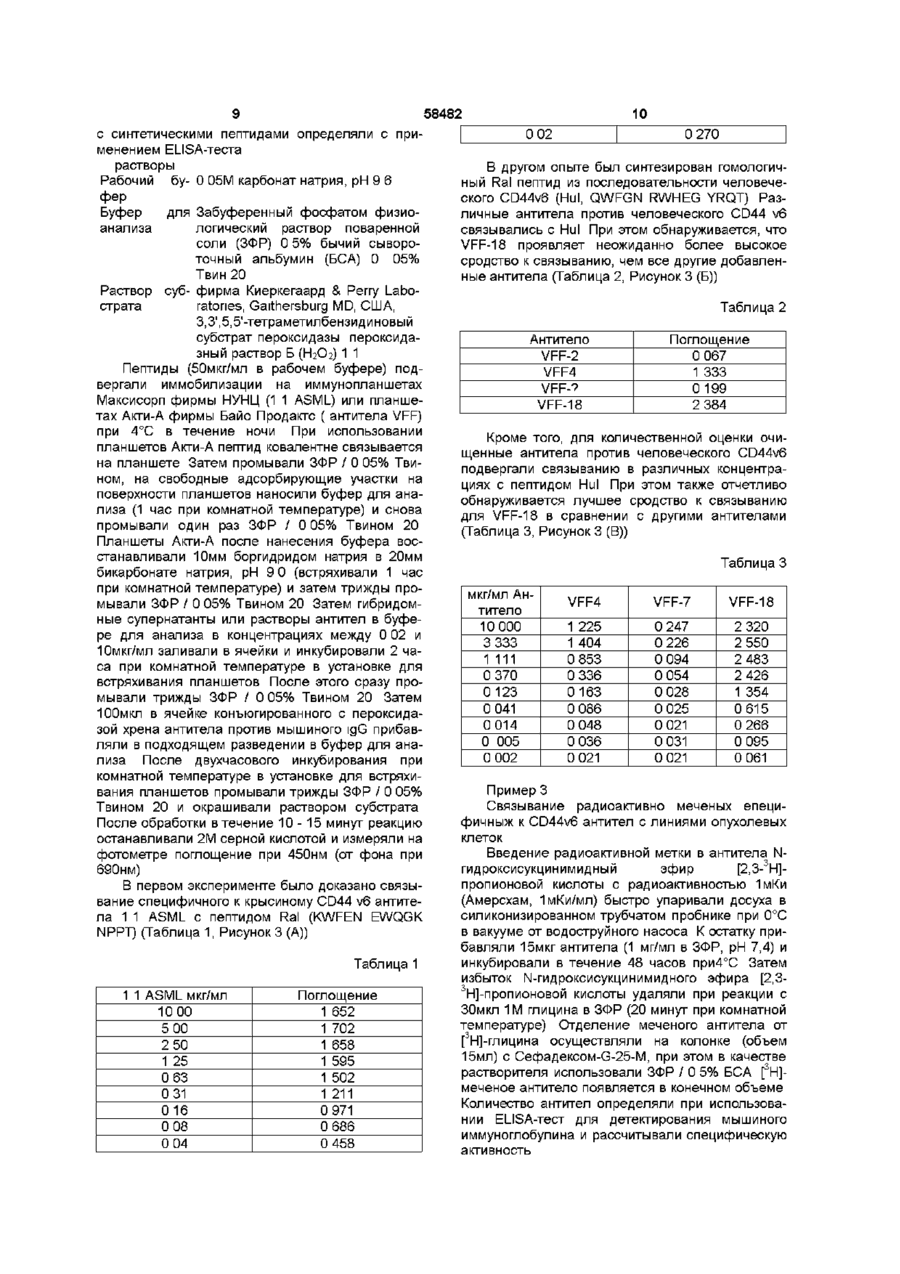
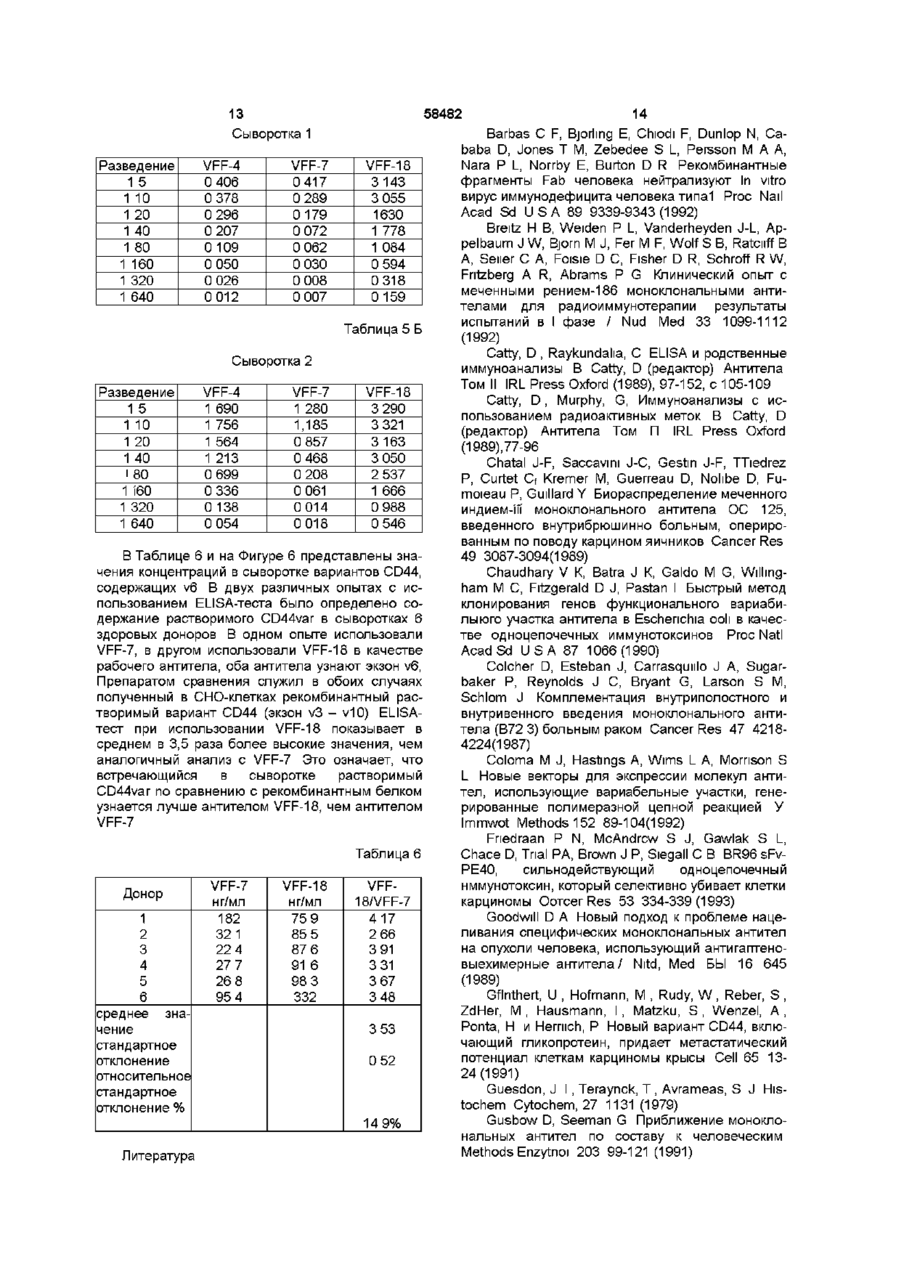
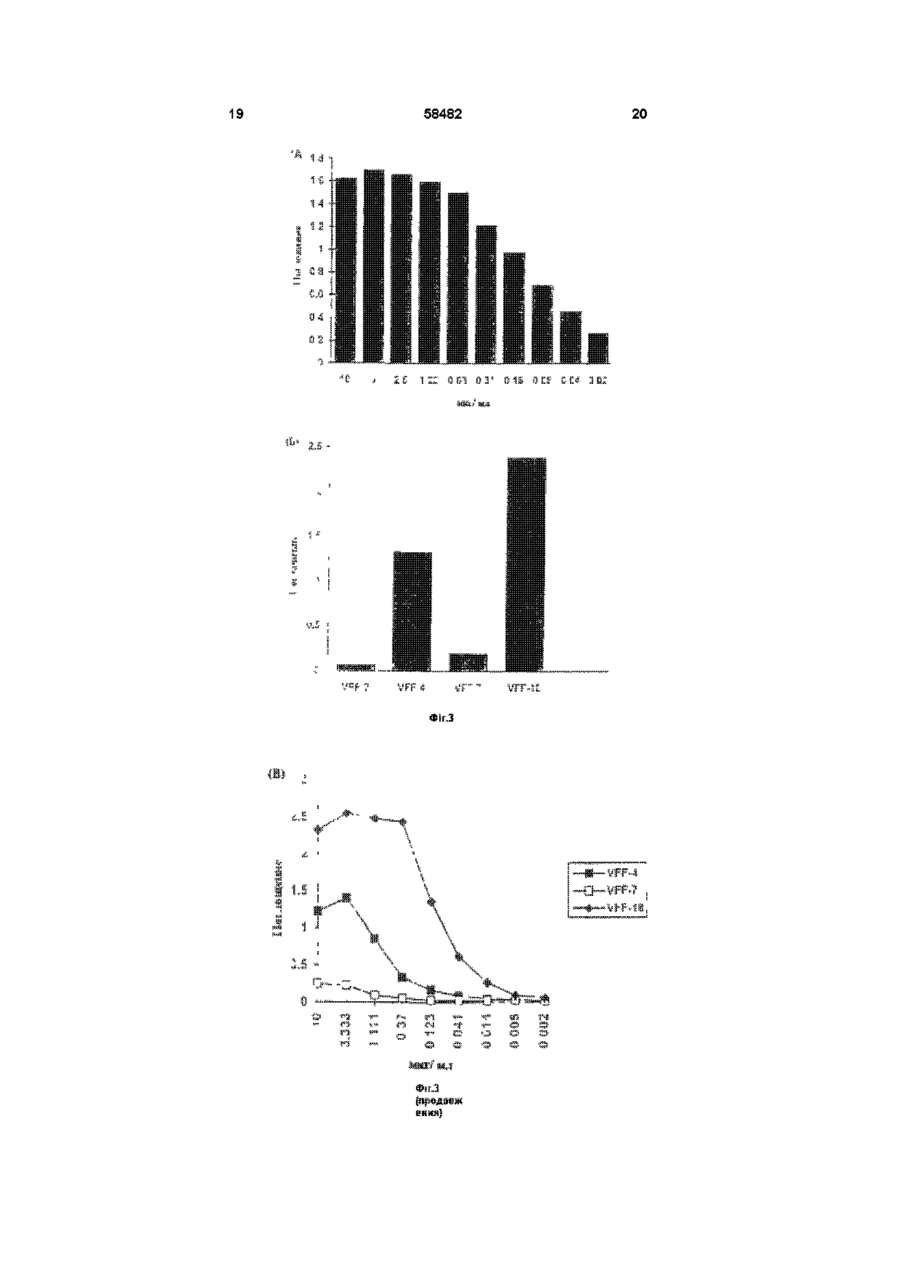
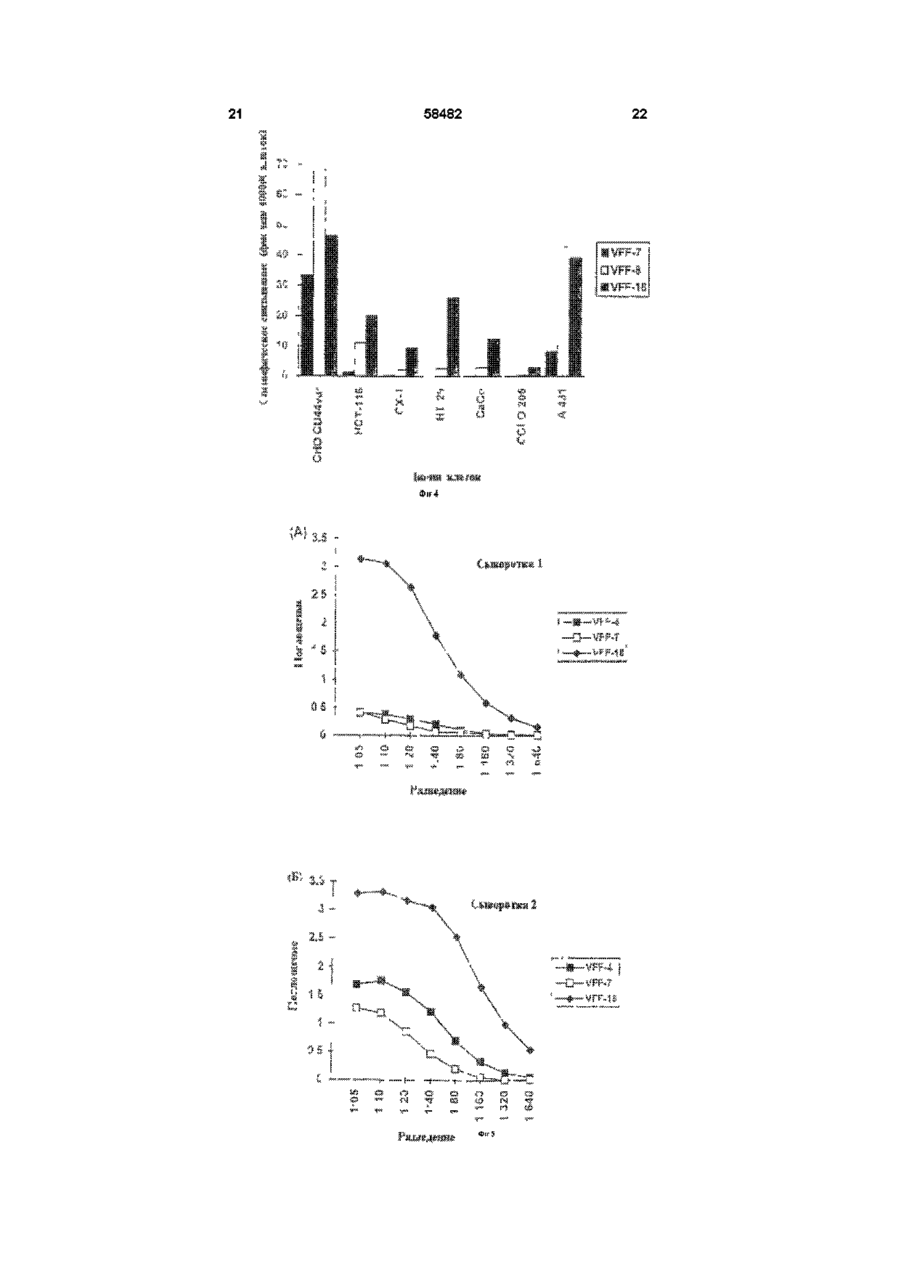
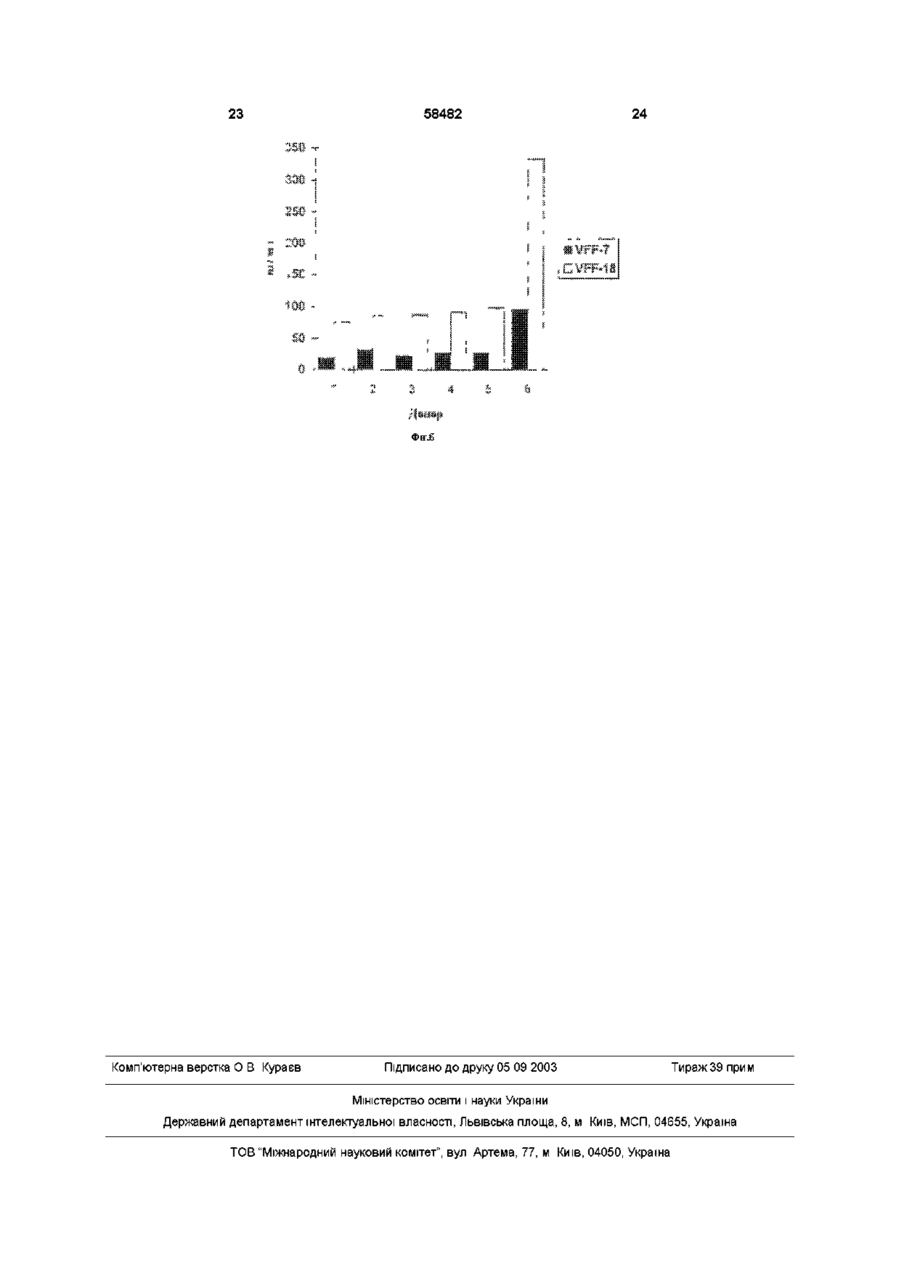
1 Моноклональное антитело к эпитопу с аминокислотной последовательностью, кодируемой вариабельным экзоном v6 гена CD44, представляющее собой антитело VFF-18, продуцируемое гибродомой DSM АСС 2174, или его фрагмент, сохраняющий его активность, причем моноклональное антитело или его фрагмент предназначены для диагностических или терапевтических целей 2 Антитело по п 1, отличающееся тем, что оно связано с другой молекулой, отличной от антитела 3 Антитело по п 2, отличающееся тем, что оно связано с полипептидом 4 Антитело по п 2, отличающееся тем, что оно связано с токсином 5 Антитело по любому из пп 2-4, отличающееся тем, что оно связано с радиоактивным изотопом 6 Линия клеток гибридомы DSM АСС 2174, продуцирующая моноклональное антитело по п 1 7 Антитело к эпитопу с аминокислотной последовательностью, кодируемой вариабельным экзоном v6 гена CD44, полученное рекомбинантной и/или ферментативной и/или химической модификацией без изменения аминокислотной последовательности антитела VFF-18 в области места связывания антигена, или его фрагмент, сохраняющий его активность 8 Антитело по п 7, отличающееся тем, что оно связано с другой молекулой, отличной от антитела 9 Антитело по п 7, отличающееся тем, что оно связано с полипептидом 10 Антитело по п 7, отличающееся тем, что оно связано с токсином 11 Антитело по любому из пп 8-10, отличающееся тем, что оно связано с радиоактивным изотопом 12 Рекомбинантное антитело к эпитопу с аминокислотной последовательностью, кодируемой вариабельным экзоном v6 гена CD44, имеющее идентичную аминокислотную последовательность моноклонального антитела VFF-18 в области места связывания антигена, или его фрагмент, сохраняющий его активность, причем рекомбинантное антитело или его фрагмент предназначены для диагностических или терапевтических целей 13 Рекомбинантное антитело по п 12, отличающееся тем, что оно представляет собой химерную, гуманизированную одноцепочечную или полученную путем сцепления цепей молекулу антитела 14 Рекомбинантное антитело по п 12 или 13, отличающееся тем, что оно связано с другой молекулой, отличной от антитела 15 Рекомбинантное антитело по п 14, отличающееся тем, что оно связано с полипептидом 16 Рекомбинантное антитело по п 14, отличающееся тем, что оно связано с токсином 17 Рекомбинантное антитело по любому из пп 14-16, отличающееся тем, что оно связано с радиоактивным изотопом О 00 ^00 ю 58482 Изобретение относится к биологическим средствам для диагностических или терапевтических целей, более конкретно, к антителу VFF-18 и его аналогам Недавно было показано, что экспрессия вариантов поверхностных гликопротеинов гена CD44 необходима и достаточна, чтобы вызвать так называемое спонтанное метастатическое поведение как в неметастазирующеи линии клеток аденокарциноми поджелудочной железы крысы, так и в неметастазирующеи линии клеток фибро-саркомы крысы (Giinthert и др , 1991) В то время, как наименьшая изоформа CD44, стандартная форма CD44s (или CD44std), выражается повсюду в ряду различных тканей, включая эпителиальные клетки, определенные сплайсинговые варианты CD44 (CD44v, CD44var) выражаются только в подгруппе эпителиальных клеток Варианты CD44 получают путем альтернативного сплайсинга таким образом, что последовательности 10 экзонов (v1 - v10) в CD44s полностью вырезаются, однако, в большем числе вариантов могут наблюдаться в различных комбинациях (Screaton и др , 1992, Tolg и др , 1993, Hofmann и др , 1991) Варианты отличаются тем, что различные аминокислотные последовательности включаются в определенное положение внеклеточных участков белков Такие варианты могли быть обнаружены в различных опухолевых клетках человека и опухолевых тканях человека Так, недавно была исследована экспрессия вариантов CD44 при образовании и развитии колоректального ракового новообразования (Heider и др , 1993а) Экспрессия вариантов CD44 отсутствует в нормальном эпителии толстой кишки человека, и лишь слабая экспрессия наблюдается в пролиферирующих клетках крипт На более поздних стадиях прогрессии опухоли, например, в случае аденокарцином, выражаются все злокачественные перерожденные варианты CD44 Экспрессия в ткани вариантов CD44 на высоком уровне могла быть также показана в случае агрессивных не-Ходжкинских лимфом (Koopman и др , 1993) Показано, что важную роль, в особенности при метастатическом развитии, играет экзон v6 (Rudy и др , 1993) На модели животного антитела против специфичных к v6 эпитопов могли препятствовать распространению метастазирующих клеток и росту метастазов (Seiter и др , 1993) При карциномах толстого кишечника экспрессия v6 коррелирует с прогрессией опухоли (Wielenga и др , 1993) При раке желудка экспрессия v6 является важным диагностическим индикатором при дифференцировании опухолей интестинального и рассеянного типа (Heider и др , 1993b) Экспрессия vo в обеих упомянутых последними работах была измерена с помощью антител против специфичных к v6 эпитопов Моноклональные антитела против эпитопа, кодируемые экзоном v6, известны из уровня техники (Hofmann и др , 1991, Wielenga и др , 1993) Из-за высокой потенциальной пользы, которую могут принести подобные антитела для диагностики и терапии, существует высокая потребность в антителах с улучшенными свойствами Задачей настоящего изобретения яляется получение антител, которые по сравнению с известными специфичными к v6 антителам проявляет лучшие свойства Поставленная задача решается предлагаемым моноклональным антителом к эпитопу с аминокислотой последовательностью, кодируемой вариабельным экзоном v6 гена CD44, представляющим собой антитело VFF-18, продуцируемое гибродомой DSM АСС 2174, или его фрагмент, причем моноклональное антитело или его фрагмент предназначены для диагностических или терапевтических целей Дополнительным объектом изобретения является линия клеток гибридомы DSM АСС 2174, продуцирующей предлагаемое моноклональное антитело Дальнейшим объектом изобретения является антитело к эпитопу с аминокислотной последовательностью, кодируемой вариабельным экзоном v6 гена CD44, полученное рекомбинантной и/или ферментативной и/или химической модификацией без изменения аминокислотной последовательности антитела VFF-18 в области места связывания антигена, или его фрагмент Еще одним объектом изобретения является рекомбинантное антитело к эпитопу с аминокислотой последовательностью, кодируемой вариабельным экзоном v6 гена, имеющее идентичную аминокислотную последовательность моноклонального антитела VFF-18 в обасти места связывания антитела, или его фрагмент, причем рекомбинантное антитело или его фрагмент предназначены для диагностических или терапевтических целей Признаки, развывающие и уточняющие вышеприведенные объекты изобретения, описаны в нижеследующем Из полного иммуыоглобулина антитела VFF18 могут быть, например, получены фрагменты Fab или Р(аЬ')з или другие фрагменты (Kreitman и др , 1993) Для диагностических способов можно соединять молекулы антитела VFF-18, их фрагменты или рекомбинантные молекулы антитела с одинаковым идиотипом, например, с радиоактивными изотопами, как 1 3 1 I , 1 1 1 ln, 99m Tc или радиоактивными соединениями (Larson и др , 1991, Thomas и др , 1989, Snvastava, 1988), с ферментами, такими, как пероксидаза или щелочная фосфатаза (Catty и Raykundaha, 1989), с флуоресцентными красителями (Johnson, 1989) или с молекулами биотина (Guesdon и др , 1979) Для терапевтического применения можно соединять VFF-18 или производные от VFF-18 молекулы антитела с токсинами (Vitetta и др , 1991, Vitetta и Thorpe, 1991, Kreitman и др, 1993, Theuer и др , 1993), с цитостатиками (Schrappe и др , 1992), с пролекарствами (Wang и др ,1992, Senter и др , 1989) или с радиоактивными веществами Антитело далее можно соединить с цитокином или другим иммуномодулирующим полипептидом, например, с фактором некроза опухоли или интерлейкином-2 Далее специалист может получить после ана 58482 лиза аминокислотной последовательности антитела VFF-18 и/или при использовании линии клеток гибридомы, продуцирующей это антитело, и, в частности, содержащейся там генетической информации рекомбинантные молекулы антитела с таким же, как у VFF-18, идиотипом Соответствующие способы составляют основу этой техники Такие рекомбинантные молекулы антител могут быть, например, антителами, приближенными к таковым для человека (Shin и др , 1989, Gbssow и Seeman, 1991), биспецифическими антителами (Werner и др, 1993, Goodwin, 1989), одноцепочечными антителами (scFv, Johnson и Bird, 1991), полными или фрагментарными иммуноглобулинами (Coloma и др , 1992, Nesbit и др , 1992, Barbas и др , 1992), или антителами, полученными путем сцепления цепей (Winter и др , 1994) Антитела, приближающиеся по составу к человеческим, могут, например, быть получены путем CDRтрансплантации (европейский патент 0239400) Также могут быть модифицированы каркасные участки (европейский патент 0519596) Для приближения к человеческим антителам сейчас могут быть использованы такие методы, как полимеразная цепная реакция (см , например, европейские патенты 0368684, 0438310, международная заявка 9207075) или компьютерное моделирование (см , например, международная заявка 9222653) Могут также быть получены составные белки, например, составные белки из одноцепочечного антитела и токсина (Chaudhary и др , 1990, Friedman и др , 1993) Такого рода молекулы антитела поэтому также включены в изобретение В пределах возможностей среднего специалиста находится также обнаружение точного эпитопа для VFF-18 и, располагая этими данными, получение эквивалентных антител с одинаковой специфичностью связывания Это может происходить, например, при изучении связывания пептидов, как в примере 2, возможно с помощью разновидности пептида Hul Поэтому подобные антитела также охватываются изобретением Диагностические способы при применении молекул антитела в соответствии с изобретением могут быть такими, как известные способы, например, ферментный иммуносорбентный анализ (ELISA) (Catty и Raykundaha, 1989), радиоиммунный анализ (Catty и Murphy, 1989), иммуногистохимические способы (Heider и др, 1993Ь) или Вестерн-блоты Подобные способы целесообразно осуществлять с взятыми из тела пробами тканей или с жидкостями тела, например, при биопсии Исследования могут проводиться качественно, полуколичественно или количественно При этом могут быть использованы антитело или молекулы антитела, как, например, заложено в основе техники, описанной в международной заявке 9500851 для других специфичных к v6 антител, при этом полезные свойства антитела или молекул антитела согласно изобретению означают важное улучшение подобных способов Помимо диагностики in vitro молекулы антитела согласно изобретению годятся также для диагностики in vivo, особенно опухолей Если молекула антитела имеет какую-нибудь детектируемую мет ку, можно использовать определение метки для диагностических целей, например, для визуального обнаружения опухоли in vivo, или, например, при хирургии с применением радиоактивных элементов Для использования антител, конъюгированных с радиоактивными изотопами, для иммуно-сцинтиграфии существует, к примеру, ряд протоколов, на основании которых специалист может осуществить изобретение (Siccardi и др , 1989, Кеепап и др , 1987, Perkins и Pimm, 1992, Colcher и др , 1987, Thompson и др , 1984) Терапевтическое применение можно, например, проводить аналогично применению антитела 1 1 ASML (Seiter и др , 1993) При этом применение осуществляют системно или местно, например, путем внутривенной (разовое или капельное вливание), внутрибрюшинной, внутримышечной, подкожной или других инъекций или вливаний Можно также осуществлять перфузию в отдельные органы или участки Представленные протоколы, касающиеся введения конъюгированных или неконъюгированных антител (будь это полные иммуноглобулины, фрагменты, рекомбинантные химерные молекулы и др), являются уровнем техники (Mulshme и др , 1991, Larson и др , 1991, Vitetta и Thorpe, 1991, Vitetta и др, 1991, Breitz и др , 1992, Press и др , 1989, Werner и др , 1989, Chatal и др , 1989, Sears и др , 1982) Лучшие свойства VFF-18 по сравнению с другими антителами против CD44v6 показаны в примерах 2-4 Рисунки Фигура 1 Схема получения составного белка GST-CD44(v3-v10) GST означает глутатион-8трансферазу Schisfosoma japomcum v3 - v10 = варианты вставки цитокератины-СО44 Стрелкой отмечено место расщепления тромбином Фигура 2 Сравнение последовательностей экзона v6 гена CD44 у человека и крысы Последовательности пептидов Ral и Hul, с которыми связываются антитела 1 1 ASML (против крысиного CD44v6) и VFF-18 (против человеческого CD44v6), выделяются жирно Идентичные аминокислоты обозначены звездочкой Фигура 3 Связывание специфичных к CD44v6 антител с синтетическими пептидами Связывание антител с пептидами определяли с применением ELISA-теста, при котором пептиды подвергали иммобилизации и затем инкубировали с растворами антител После соответствующих этапов промывания обнаруживали антитело, связанное с конъюгированным с пероксидазой антителом против мышиного IgG (А) В первом эксперименте было доказано связывание специфичного к CD44v6 крысы антитела 1 1 ASML с пептидом Ra1 (KWFEN EWQGK NPPT) (Б) В другом эксперименте был синтезирован гомологичный Ral пептид из последовательности человеческого CD44v6 Различные антитела из супернатантов гибридомы, полученной с использованием античеловеческого CD44v6, связывали с этим пептидом Hul (QWFGN RWHEG YRQT) При этом показано, что VFF-18 существенно лучше связывается с пептидом, чем остальные использованные антитела (В) Для количественной оценки этот эксперимент повторяли с использованием различных концентраций 58482 очищенных антител При этом также было обнаружено, что VFF-18 демонстрирует более высокое сродство к связыванию, чем другие антитела Фигура 4 Связывание радиоактивно меченых антител с опухолевыми клетками Три антитела VFF-7 (анти-уб), VFF-8 (анти-у5) HVFF-18 (анти-уб) метили радиоактивным N-гидроксисукцинимидным эфиром (2,3-3Н]-пропионовой кислоты и использовали в опытах по связыванию с различными линиями опухолевых клеток При этом были применены следующие линии клеток CHO-CD44var рекомбинантная линия клеток хомячка (яичник китайского хомячка), которая выражает на поверхности вариант человеческого CD44 (экзоны v3 - v10), НСГ-116, СХ-1, НТ-29, СаСо, COLO 205 линии клеток карциномы толстой кишки человека, А431 линия клеток карциномы плоского эпителия человека Показано специфическое связывание антител с различными линиями клеток В то время, как связывание специфичных к v6 антител VFF-7 и VFF-18 с рекомбинантной линией клеток CHO-CD44var имеет одинаковый порядок величин, антитела ведут себя совершенно по-разному при связывании с линиями опухолевых клеток В некоторых случаях наблюдается только связывание VFF-18 и в незначительной степени связывание VFF-8 (НТ-29, СаСо, COLO 205), с другими линиями клеток VFF-18 связывается существенно лучше, чем VFF-7 Фигура 5 Доказательство наличия растворимых вариантов CD44, содержащих экзон v6, анормальной сыворотке человека В сэндвич при ELISA-тесте помещались в качестве рабочих антител три специфичных к v6 антитела VPF-4, VFF7 HVFF-18 Во всех трех случаях в качестве антитела-свидетеля использовали коньюгированное с пероксидазой специфичное к CD44std антитело (BU-52, std = стандарт) Обнаруживается сигнал от двух различных нормальных сывороток человека при различных разведениях в этих опытах ((А) и (Б)) В обоих случаях наблюдают существенно более сильный сигнал с VFF-18, чем с двумя другими антителами Фигура 6 Содержание в сыворотке вариантов CD44, содержащих v6 С помощью двух различных иммуноферментных анализов (ELISA-тест) было определено содержание растворимого CD44var в сыворотке 6 здоровых доноров В одном из опытов в качестве рабочего антитела применяют VFF-7, в другом применяют VFF-18, оба антитела узнают экзон v6 В качестве препарата сравнения в обоих случаях служил получаемый в СНО-клетках рекомбинантный растворимый вариант CD44 (экзон v3 - v10) ELISA-тест при использовании VFF-18 показывает в среднем в 3 5 раза более высокие значения, чем в случае VFF-7 Это означает, что имеющийся в сыворотке растворимый CD44var лучше узнается антителом VFF18,чем VFF-7 Примеры Пример 1 Получение моноклоналыгого антитела VFF-18 Клонирование составных протеинов в pGEX Общий отличающийся от стандартного участок CD44v типа НРКП (Hofmaim и др , 1991) амплифицировали из человеческих цитокератинов кДНК с помощью полимеразной цепной реакции 8 (ПЦР) Обе ПЦР-затравки 511 CAGGCTGGGAGCCAAATGAAGAAAATG-3 , положения 25-52, и S'TGATAAGGAACGATTGACAITAGAGTTGGA-S1, положения 1013-984 вариантного участка LCLC97, как описано Hofmann и др , содержали узнаваемый EcoR1 сайт рестрикции, который использовали, чтобы продукт ПЦР непосредственно клонировать в векторе pGEX-2T (Smith и др, 1988) Получающийся в результате продукт (pGEX CD44v HPKII, v3 - v10) кодирует составной белок с массой около 70кД, состоящий из глутатион-Sтрансферазы Schistosomajapomcwn иэкзонов v3 v10 человеческого CD44 (рис 1, Неісіеги др, 1993а) Составной белок выражался в Е сої і, затем его очищали, используя сродство глутатионак агарозе (Smith и др , 1988) Иммунизация и скрининг Самок мышей линии Balb/c подвергали внутрибрюшинной иммунизации с помощью очищенного при аффинной хроматографии составного белка по следующей схеме 1 Иммунизация 90мкг составного белка в полном адьгованте Фрейнда 2 и 3 Иммунизация 50мкг составного белка в неполном адьюванте Фрейнда Иммунизации проводили с промежутками в 4 недели Через 14 дней после последней иммунизации животных еще в течение трех последующих дней иммунизировали каждый раз 10 мкг составного белка в забуференном фосфатом физиологическом растворе поваренной соли На следующий день клетки селезенки животного с высоким титром антител подвергали слиянию с миеломными клетками мыши РЗ Х63-Ад8 653 в полиэтиленгликоле 4000 Гибридомные клетки далее отбирали в планшеты для титрования на среде с гипоксантином, аминоптерином и тимидином (Kohler и Milstem, 1975, Kearney и др , 1979) Определение титра антител в сыворотке или скрининг гибридомных супернатантов проводили с помощью ELISA-теста При этом определении планшеты для титровании сначала покрывали составным белком (глутатион-З-трансфераза CD44 v3 - 10) или только глутатион-Sтрансферазой Затем подвергали инкубированию с серийными разведениями сывороточных проб или гибридомными супернатантами и доказывали наличие специфических антител с конъюгированными с пероксидазой антителами против мышиного иммуноглобулина Гибридомы, реагировавшие только с глутатион-8-трансферазой, были отвергнуты Оставшиеся антитела прежде всего охарактеризовывали с помощью ELISA-теста со специфичными к домену составными белками (экзон v3, экзон v5 + v6, экзон v6 + v7, экзон v8 - v10) (Koopman и др , 1993) Их иммуногистохимическая реакционная способность была испытана на разрезах кожи человека Антитело VFF-18 было затем идентифицировано по связыванию с синтетическим пептидом Hul (QWFGN RWHEG YRQT) Последовательность Hul является фрагментом экзона v6 человеческого CD44 Пример 2 Связывание специфичных к CD44v6 антител с синтетическими пептидами Связывание специфичных к CD44 v6 антител 58482 с синтетическими пептидами определяли с применением ELISA-теста растворы Рабочий бу- 0 05М карбонат натрия, рН 9 6 фер Буфер для Забуференный фосфатом физиоанализа логический раствор поваренной соли (ЗФР) 0 5% бычий сывороточ н ы й ал ьбум и н (БСА) 0 05% Твин 20 Раствор суб- фирма Киеркегаард & Perry Laboстрата ratones, Gaithersburg MD, США, 3,3',5,5'-тетраметилбензидиновый субстрат пероксидазы пероксидазный раствор Б (Н2О2) 1 1 Пептиды (50мкг/мл в рабочем буфере) подвергали иммобилизации на иммунопланшетах Максисорп фирмы НУНЦ (1 1 ASML) или планшетах Акти-А фирмы Байо Продактс ( антитела VFF) при 4°С в течение ночи При использовании планшетов Акти-А пептид ковалентне связывается на планшете Затем промывали ЗФР / 0 05% Твином, на свободные адсорбирующие участки на поверхности планшетов наносили буфер для анализа (1 час при комнатной температуре) и снова промывали один раз ЗФР / 0 05% Твином 20 Планшеты Акти-А после нанесения буфера восстанавливали 10мм боргидридом натрия в 20мм бикарбонате натрия, рН 9 0 (встряхивали 1 час при комнатной температуре) и затем трижды промывали ЗФР / 0 05% Твином 20 Затем гибридомные супернатанты или растворы антител в буфере для анализа в концентрациях между 0 02 и 10мкг/мл заливали в ячейки и инкубировали 2 часа при комнатной температуре в установке для встряхивания планшетов После этого сразу промывали трижды ЗФР / 0 05% Твином 20 Затем ЮОмкл в ячейке конъюгированного с пероксидазой хрена антитела против мышиного igG прибавляли в подходящем разведении в буфер для анализа После двухчасового инкубирования при комнатной температуре в установке для встряхивания планшетов промывали трижды ЗФР / 0 05% Твином 20 и окрашивали раствором субстрата После обработки в течение 10-15 минут реакцию останавливали 2М серной кислотой и измеряли на фотометре поглощение при 450нм (от фона при 690нм) В первом эксперименте было доказано связывание специфичного к крысиному CD44 v6 антитела 1 1 ASML с пептидом Ral (KWFEN EWQGK NPPT) (Таблица 1, Рисунок 3 (А)) Таблица 1 1 1 ASML мкг/мл 10 00 5 00 2 50 1 25 0 63 0 31 016 0 08 0 04 Поглощение 1 652 1 702 1 658 1 595 1 502 1 211 0 971 0 686 0 458 10 0 02 0 270 В другом опыте был синтезирован гомологичный Ral пептид из последовательности человеческого CD44v6 (Hul, QWFGN RWHEG YRQT) Различные антитела против человеческого CD44 v6 связывались с Hul При этом обнаруживается, что VFF-18 проявляет неожиданно более высокое сродство к связыванию, чем все другие добавленные антитела (Таблица 2, Рисунок 3 (Б)) Таблица 2 Антитело VFF-2 VFF4 VFF-7 VFF-18 Поглощение 0 067 1 333 0 199 2 384 Кроме того, для количественной оценки очищенные антитела против человеческого CD44v6 подвергали связыванию в различных концентрациях с пептидом Hul При этом также отчетливо обнаруживается лучшее сродство к связыванию для VFF-18 в сравнении с другими антителами (Таблица 3, Рисунок 3 (В)) Таблица 3 мкг/мл Антитело 10 000 3 333 1 111 0 370 0 123 0 041 0 014 0 005 0 002 VFF4 VFF-7 VFF-18 1 225 1 404 0 853 0 336 0 163 0 086 0 048 0 036 0 021 0 247 0 226 0 094 0 054 0 028 0 025 0 021 0 031 0 021 2 320 2 550 2 483 2 426 1 354 0 615 0 266 0 095 0 061 Пример 3 Связывание радиоактивно меченых епецифичныж к CD44v6 антител с линиями опухолевых клеток Введение радиоактивной метки в антитела Nгидроксисукцинимидный эфир [2,3-3Н]пропионовой кислоты с радиоактивностью 1мКи (Амерсхам, 1мКи/мл) быстро упаривали досуха в силиконизированном трубчатом пробнике при 0°С в вакууме от водоструйного насоса К остатку прибавляли 15мкг антитела (1 мг/мл в ЗФР, рН 7,4) и инкубировали в течение 48 часов при4°С Затем избыток N-гидроксисукцинимидного эфира [2,33 Н]-пропионовой кислоты удаляли при реакции с ЗОмкл 1М глицина в ЗФР (20 минут при комнатной температуре) Отделение меченого антитела от [3Н]-глицина осуществляли на колонке (объем 15мл) с Сефадексом-С-25-М, при этом в качестве растворителя использовали ЗФР / 0 5% БСА [3Н]меченое антитело появляется в конечном объеме Количество антител определяли при использовании ELISA-тест для детектирования мышиного иммуноглобулина и рассчитывали специфическую активность 12 11 58482 Связывание меченых антител с опухолевыми Буфер для клетками анализа Забуференный фосфатом Три антитела VFF-7 (анти-уб), VFF-8 (анти-у5) физиологический раствор пои VFF-18 (анти-уб) метили с помощью Nваренной соли (ЗФР) 0 5% 3 гидроксисукцинимидного эфира [2,3- Н]бычий сывороточный альбупропионовой кислоты и использовали для опытов мин (БСА) 0 05% Тайн 20 по связыванию с различными линиями опухолеРастворитель фирма Бендер Медсистемс вых клеток При этом применяли следующие лидля образцов Вена, Австрия фирма Киеркении клеток CHO-CD44var, рекомбииантная линия Раствор субгаард & Perry Laboratories, клеток хомячка (яичник китайского хомячка), котострата Gaithersburg MD, США, і і рая выражает на поверхности вариант человече3,3 ,5,5 ского CD44 (экзоны v3 - v10), НСТ-116, СХ-1 НТтетраметилбензидиновый 29, СаСо, COLO 205 линии клеток карциномы субстрат пероксидазы пероктолстой кишки человека, А431 линия клеток карсидазный раствор Б (Н2О2) 1 1 циномы плоского эпителия человека Клетки поНа планшеты для титрования (фирма Нунц, мещали на планшеты для тканевых культур с 12 иммунопланшеты Максисорп F96) наносили спеотверстиями, проводили инкубирование в течение цифичное к CD44 v6 антитело в концентрации ночи при 37°С в инкубаторе в углекислом газе, 5мкг/мл ( инкубирование при 4°С в течение ночи) затем один раз промывали с помощью ЗФР и фикЗатем промывали ЗФР/ 0 05% Твином, на свободсировали спиртом (1 минуту при комнатной темные адсорбирующие участки на поверхности пературе) Затем промывали один раз культупланшетов наносили буфер для анализа (1 час ральной средой (среда RPMI-1640 / 10% при комнатной температуре) и снова промывали сыворотка эмбриона теленка) и связывали с раодин раз ЗФР / 0 05% Твином 20 Пробы сыворотдиоактивными антителами (250000 распадов в ки затем предварительно разбавляли, по меньшей мин / ячейка в культуральной среде) После инкумере, в отношении 1 5 растворителем для образбации в течение 25 часов при комнатной темперацов и далее делали серийные разведения (1 2) в туре в устройстве для встряхивания планшетов планшете растворителем для образцов Затем трижды промывали ЗФР / 0 5% БСА, клетки рас50мкл/ ячейка конъюгированного с пероксидазой творяли в 0 1М едком натре/ 1% тритоне Х-100 и хрена антитела против CD44std (клон BU-52, Сайт измеряли радиоактивность сцинтилляционным связывания, Бирмингам) прибавляли в подходясчетчиком Неспецифическое связывание опредещем разведении (1 3000 - 1 10000) в буфере для ляли в присутствии 100-кратного избытка немечеанализа После трехчасового инкубирования при ного антитела Связывание относили к опредекомнатной температуре в устройстве для встряхиленному числу клеток (400000) После вания планшетов трижды промывали ЗФР / 0 05% определения специфической активности антител Твином 20 и окрашивали раствором субстрата количество связанных антител можно выразить в После обработки в течение 10-15 минут реакцию фмолях Таблица 4 и Рисунок 4 демонстрируют останавливали с помощью 2М серной кислоты и специфическое связывание антител с различными измеряли на фотометре поглощение при 450 нм линиями клеток В то время, как связывание спе(от фона при 690нм) цифичных к vo антител VFF-7 и VFF-18 с рекомбиДля количественной оценки делали серийное нантной линией клеток CHO-CD44var приблизиразведение в буфере для анализа растворимого тельно одинаково, антитела ведут себя очень постандартного препарата CD44 параллельно с разному при связывании с линиями опухолевых пробами сыворотки Этот препарат был выделен в клеток В некоторых случаях наблюдают только чистом виде из надосадочной жидкости от рекомсвязывание VFF-18, а связывание VFF-8 в незнабинантных клеток хомячка (СНО), которые вырачительном объеме (НТ-29, СаСо, COLO 205), в жают растворимый CD44 v3 - v10 В случае CD44 случае других линий клеток VFF-18 связывается v3 - v10 речь идет о человеческом варианте CD44, значительно лучше, чем VFF-7 который содержит кодируемые экзонами от v3 до v10 пептидные последовательности Таблица 4 Таблица 5 и Рисунок 5 показывают наличие в нормальной сыворотке человека растворимых вариантов CD44, содержащих экзон v6 При Линия клеток VFF-7 VFF-8 VFF-18 ELISA-тесте с применением техники сэндвича исфмоль фмоль фмоль пользовали три специфичных к vo антитела VFF4, СНО68 42 46 52 VFF-7 или VFF-18 в качестве рабочих антител Во CD44var 33 50 всех трех случаях применяли в качестве антитела НСТ-116 L44 11 08 2022 для идентификации конъюгированнос с пероксиСХ-1 019 220 9 48 дазой антитело, специфичное к CD44 -стандарту НТ-29 0 00 2 60 26 07 (BU-52) В этих опытах обнаруживался сигнал от СаСо 0 03 2 81 12 57 двух разных нормальных сывороток человека при COLO 205 0 00 0 32 2 88 различных разведениях В обоих случаях ((А) и А431 819 42 32 38 73 (Б)) с VTF-18 можно наблюдать существенно более сильный сигнал, чем с двумя другими антитеПример 4 ELISA-тест для определении раслами творимого CD44v6 в сыворотке Растворы Таблица 5А Рабочий буфер 0 05 Мкарбонат натрия, рН 9 6 Разведение 15 1 10 1 20 1 40 1 80 1 160 1 320 1 640 VFF-4 0 406 0 378 0 296 0 207 0 109 0 050 0 026 0 012 VFF-7 0 417 0 289 0 179 0 072 0 062 0 030 0 008 0 007 VFF-18 3 143 3 055 1630 1 778 1 084 0 594 0 318 0 159 Таблица 5 Б Сыворотка 2 Разведение 15 1 10 1 20 1 40 і 80 1 І60 1 320 1 640 VFF-4 1 690 1 756 1 564 1 213 0 699 0 336 0 138 0 054 VFF-7 1 280 1,185 0 857 0 468 0 208 0 061 0 014 0 018 VFF-18 3 290 3 321 3 163 3 050 2 537 1 666 0 988 0 546 В Таблице 6 и на Фигуре 6 представлены значения концентраций в сыворотке вариантов CD44, содержащих v6 В двух различных опытах с использованием ELISA-теста было определено содержание растворимого CD44var в сыворотках 6 здоровых доноров В одном опыте использовали VFF-7, в другом использовали VFF-18 в качестве рабочего антитела, оба антитела узнают экзон v6, Препаратом сравнения служил в обоих случаях полученный в СНО-клетках рекомбинантный растворимый вариант CD44 (экзон v3 - v10) ELISAтест при использовании VFF-18 показывает в среднем в 3,5 раза более высокие значения, чем аналогичный анализ с VFF-7 Это означает, что встречающийся в сыворотке растворимый CD44var no сравнению с рекомбинантным белком узнается лучше антителом VFF-18, чем антителом VFF-7 Таблица 6 Донор 1 2 3 4 5 6 среднее значение стандартное отклонение относительное стандартное отклонение % Литература VFF-7 нг/мл 182 32 1 22 4 27 7 26 8 95 4 VFF-18 нг/мл 75 9 85 5 87 6 91 6 98 3 332 14 Barbas С F, Bjorlmg E, Chiodi F, Dunlop N, Cababa D, Jones T M, Zebedee S L, Persson M A A, Nara P L, Norrby E, Burton D R Рекомбинантные фрагменты Fab человека нейтрализуют In vitro вирус иммунодефицита человека типа1 Proc Nail Acad Sd U S A 89 9339-9343(1992) Breitz H B, Weiden P L, Vanderheyden J-L, Appelbaum J W, Bjorn M J, Fer M F, Wolf S B, Ratciiff В A, Seiier С A, Foisie D C, Fisher D R, Schroff R W, Fntzberg A R, Abrams P G Клинический опыт с меченными рением-186 моноклональными антителами для радиоиммунотерапии результаты испытаний в I фазе / Nud Med 33 1099-1112 (1992) Catty, D , Raykundaha, С ELISA и родственные иммуноанализы В Catty, D (редактор) Антитела Том II IRL Press Oxford (1989), 97-152, с 105-109 Catty, D, Murphy, G, Иммуноанализы с использованием радиоактивных меток В Catty, D (редактор) Антитела Том П IRL Press Oxford (1989), 77-96 Chatal J-F, Saccavim J-C, Gestm J-F, TTiedrez P, Curtet Cf Kremer M, Guerreau D, Nohbe D, Fumoieau P, Guillard Y Биораспределение меченного индием-ііі моноклонального антитела ОС 125, введенного внутрибрюшинно больным, оперированным по поводу карцином яичников Cancer Res 49 3087-3094(1989) Chaudhary V К, Batra J К, Galdo M G, Willmgham M C, Fitzgerald D J, Pastan I Быстрый метод клонирования генов функционального вариабилыюго участка антитела в Eschenchia ooh в качестве одноцепочечных иммунотоксинов Proc Natl AcadSd U S A 87 1066(1990) Colcher D, Esteban J, Carrasquiilo J A, Sugarbaker P, Reynolds J C, Bryant G, Larson S M, Schlom J Комплементация внутриполостного и внутривенного введения моноклонального антитела (В72 3) больным раком Cancer Res 47 42184224(1987) Coloma M J, Hastings A, Wims L A, Morrison S L Новые векторы для экспрессии молекул антител, использующие вариабельные участки, генерированные полимеразной цепной реакцией У Immwot Methods 152 89-104(1992) Fnedraan P N, McAndrcw S J, Gawlak S L, Chace D, Trial PA, Brown J P, Siegall С В BR96 sFvPE40, сильнодействующий одноцепочечный нммунотоксин, который селективно убивает клетки карциномы OoTcerRes 53 334-339(1993) Goodwill D А Новый подход к проблеме нацеливания специфических моноклональных антител на опухоли человека, использующий антигаптеновыехимерные антитела/ Nitd, Med БЫ 16 645 (1989) Gflnthert, U , Hofmann, M , Rudy, W , Reber, S , ZdHer, M , Hausmann, I , Matzku, S , Wenzel, A , Ponta, H и Hernich, P Новый вариант CD44, включающий гликопротеин, придает метастатический потенциал клеткам карциномы крысы Cell 65 1324(1991) Guesdon, J I , Teraynck, T , Avrameas, S J Histochem Cytochem, 27 1131 (1979) Gusbow D, Seeman G Приближение моноклональных антител по составу к человеческим Methods Enzytnoi 203 99-121 (1991) 58482 13 Сыворотка 1 VFF18/VFF-7 417 2 66 3 91 3 31 3 67 3 48 3 53 0 52 14 9% 15 Heider, К-Н , Hofmann, M , Horst, E, van den Berg, F , Ponta, H , Hermch, P и Pals, S T Человеческий гомолог крысиного, связанного с метастазом варианта CD44 экспрессируется в колоректальных карциномах и кистозных полипах J CdlBiol 120 227-233 (1993а) Heider, К-Н , Dammnch, J , Skroch-Angel, P, Muller-Hermeimk, H-K, Vollmers, H , Hermch, P и Ponta, H Дифференциальная экспрессия спдайсинговых вариантов CD44 при карциномах желудка человека интестинального и рассеянного типа и при нормальной слизистой оболочке желудка Cancer Res S3 4197-4203(199366) Hofmann, M , Rudy, W , Zflller, M , Tolg, С , Ponta, H , Hermch, P , и Gunthert, U Силайсинговые варианты CD44 способствуют метастатическому действию у крыс гомологические последовательности экспрессируются в линиях опухолевых клеток человека Cancer Res 51 5292-5297(1991) Johnson, G D Иммунофлуоресценция В Catty, D (редактор) Антитела Том II IRL Press Oxford (1989), 179-200 с 180-189 Johnson S, Bird R E Создание одноцепочечных производных моноклоналышх антител и их продуцирование в Eschenchia coh Methods Enzymol 203 88-98(1991) Kearney, J F , Radbruch A , Liesegang В , Rajewski К Новая линия клеток мышиной мислоны, которая утратила экспрессию иммуноглобулина, но позволяет создать линии гибридных клеток, секретирующих антитела J ImmvnoL 123 1548(1979) Keenan A M, Weinstem J N, Carrasquillo J A, Bunn P A, Reynolds J C, Foon К А и др Иммунолимфосцинтиграфия идозовая зависимость меченного 1111п моноклонального антитела Т101 у больных с Т-клеточной лимфомой кожи Cancer Res 47 6093-6099(1987) Kohier, G , Milstem, С Непрерывное культивирование слитых клеток, выделяющих антитело предопределенной специфичности Nature 265 495(1975) Koopman, G, Heider, К-Н , Horts, E, Adolf, G R , van den Berg, F , Ponta, H , Herrhch, P, Pals, S T Активированные лимфоциты человека и агрессивные не-Ходжкинскне лимфомы экспрессируют гомолог крысиного, связанного с метастазом варианта CD44 J Exp Med 177 897-904(1993) Kreitman R J, Hansen H J, Jones A L, FitzGerald D J P, Goldenberg D M, Pastan L Иммунотоксины, основанные на экзотоксине Pseudomonas, содержащие антитело LL2 или LL2~Fab', индуцируют регрессию кожной человеческой В-клеточной лимфомы у мышей Cancer Res 53 819-825 (1993) Larson S M, Cheung N-K V, Leibel S А Радиоюотопные конъюгаты В DeVita V Т, Hellman S, Rosenberg S А (редактор) Биологическая терапия рака J В Lippmcott Сотр , Филадельфия, 496-511 (1991) Mulshme J L, Magnam J L, Lmnoila R I Применение моноклональных антител в лечении солидных опухолей В DeVitaVT, Hellman S, Rosenberg S А (редактор) Биологическая терапия рака J В Lippmcott Сотр , Филадельфия, 563-588 (1991) 16 Nesbit M, Fu Z F, McDonald-Smith J, Steplewski Z, Curtis P J Продуцирование функционального моноклонального антитела, узнающего клетки колоректальной карциномы человека из бакуповирусной экспресс-ионной системы J Immwol Methods 151 201-208 (1992) Perkins А С, Pimm M V Роль гамма-сцинтиграфии в иммунологии и иммунотерапии рака Eur, J Nucl А/ее/ 19 1054-1063 (1992) Press О W, Eary J F, Badger С С, Martin P J, Appelbaum F R, Levy R, Miller R, Brown S, Nelp W B, Krohn К A, Fisher D, DeSantes K, Porter B, Kidd P, Thomas E D, Bernstein I D Лечение резидентной не-Ходжкинской лимфомы радиоактивно меченым антителом MB-I (анти-СО37) J Clm Oncol 7 1027-1038(1989) Rudy, W , Hofmann, M , Schwartz-Albiez, R , Zoller, M , Heider, K-H , Ponta, FL, Herrhch, P Два главных белка гена CD44, экспрессированных на метастатической линии опухолевых клеток крысы, являются производными различных сплайсинговых вариантов каждый в отдельности достаточен для передачи метастатического действия Cancer Res 53 1262-1268(1993) Schrappe M, Bumol T F, Apelgren L D, Bnggs S L, Koppel G A, Markowitz D D, Mueher В М, Reisfeld R А Длительное подавление роста ксенотрансплантатов глиомы человека хемоиммуноконъюгатами 4-дезацетилвинбластин-З-карбоксигидразида и моноклонального антитела 91 27 Cancer Res 52 3838-3844(1992) Screaton, G В , Bell, M V , Jackson, D G , Cornells, F В , Gerth, U и Bell, J I Геномная структура ДНК, кодирующая лимфоцитный хоминговый рецептор CD44, обнаруживает, по крайней мере, 12 экзонов как результат24альтернативного сплайсинга Proc Natl Acad Sd U S A 89 12160-12164 (1992) Sears H F, Mattis J, Henyn D, Hayry P, Atkinson B, Ernst C, Steplewski Z, Koprowski H I фаза клинического испытания моноклонального антитела в лечении опухолей желудочнокишечного тракта Lancet 1982(1) 762-765(1982) Seiter, S , Arch, R , Reber, S , Komitowski, D , Hofmaim, M , Ponta, H , Herrhch, P , Matzku, S , Zoller, M Предупреждение образования метастазов опухоли с помощью анти-вариантного СШ4, J Exp Med 177 443455(1993) Senter P D, Schreiber G J, Hirschberg D L, Ashe S A, HellstrOm К E, Hehstrom I Повышение in vitro и in vivo противоопухолевой активности фосфорилированного митомицина С и производных этопозида с помощью конъюгатов моноклонального антитела с щелочной фосфатазой Cancer Res 49 5789-5792(1989) Shin S-U, Morrison S L Получение и свойства химерных молекул антител Methods Enzymoi 178 459476(1989) Siccardi A G, Buraggi G L, Callegaro L, Colella A C, DeFihppi P G и др Иммуносцинтиграфия аденокарцином с помощью радиоактивно меченых фрагментов F(ab')2 моноклонального антитела против карцииоэмбрионапьного антигена многоцентровое исследование Cancer Res 49 3095-3 103(1989) Smith, D B , Johnson, KS Одностадийная очи 58482 17 58482 стка полипептидов, экспрессированных в Eschenchia coh в виде соединений с глутатион-Sтрансферазой Gene 67 31-40(1988) Snvastava S С (редактор) Радиоактивно меченые моноклональные антитела для визуального обнаружения и терапии Life Sciences Series A 152 Plenum Нью-Йорк (1988) Tolg, С , Hofmann, M , Herrhch, Р и Ponta, H Выбор сплайсинга из 10 вариантных экзонов доказывает изменчивость CD44 Nucleic Acids Res 21 1225-1229(1993) Theuer С P, Kreitman R J FitzGerald D J, Pastan I Иммунотоксины приготовленные с рекомбинаншон формой экзотоксина А из pse ltd om on as, которые не нуждаются в прогеолизе для проявления активности Cancer Res 53 340-347(1993) Thomas G D, Dykes P W, Bradweh A R Антитела для инмунодетектирования опухоли и методы введения радиоактивной метки в антитела В Catty D (редактор) Антитела IRL Press Oxford, 223-244(1989) Thompson С Н, Stacker S A, Salehi N, Lichtenstem M, Leyden M J, Andrews J T Иммуносцинтиграфия для определения метастазов в лимфатические узлы в результате рака молочной железы Lancet 1994 (2) 1245-1247 (1984) Vitetta E S, Thorpe Р Е Иммунотоксины В DeVita V Т, Hellman S, Rosenberg S А (редактор) 18 Биологическая терапия рака J В Lippincott Сотр , Филадельфия, 482-495 (1991) Vitetta E S, Stone M, Amlot P, Fay J, May R, Till M, Newman J, Clark P, Collins R, Cunningham D, GhetieV, UhrJW, Thorpe PE I фаза испытания иммунотоксина у больных с В-клеточной лимфомой Cancer Res 51 4052-4058(1991) Wang S-M, Chera J-W, Yeh M-Y, Ng J C, Tung E, Roffler S R Специфическое активирование поокуронидных пролекарств для терапии рака конъюгатами антитело - фермент-мишень Cancer Res 52 44844491 (1992) Werner L M, O'Dwyer J, Kitson J, Comis R L, Frankei A E, Bauer R J, Kopnrad M S, Groves E S I фаза оценки действия против рака молочной железы цепочечного иммуноконъюгата моноклонального антитела 260F9 с рекомбинантным рицином А Cancer Res 49 4062-4067(1989) Wieienga, V J M , Heider, К-Н , Offer haus, G J A , Adolf, G R , van den Berg, F M , Ponta, H , Herrhch, P , Pals, S T Экспрессия белков варианта CD44 при кол о ректальном раке человека связана с прогрессией опухоли Corner Res 53 47544756 (1993) Winter, G , Griffith, A D, Hawkins, R E, Hoogenboom, H R Приготовление антител с помощью фаг воспроизводящей технологии Ann Rev ImmunoL 12,433455 (1994) 19 58482 20 21 58482 Фім 22 23 Комп'ютерна верстка О В Курасв 58482 24 Підписано до друку 05 09 2003 Тираж 39 прим Міністерство освіти і науки України Державний департамент інтелектуальної власності, Львівська площа, 8, м Київ, МСП, 04655, Україна ТОВ "Міжнародний науковий комітет", вул Артема, 77, м Київ, 04050, Україна
ДивитисяДодаткова інформація
Назва патенту англійськоюMonoclonal antibody vff-18 against cd44v6 and its fragments
Назва патенту російськоюМоноклональное антитело vff-18 против сd44v6 и его фрагменты
МПК / Мітки
МПК: C12N 15/02, G01N 33/53, G01N 33/574, C12P 21/08, A61P 35/00, C12N 15/09, C12P 21/02, C07K 14/705, C07K 16/28, C07K 16/42, C12N 5/10, C07K 16/30, A61K 51/00, A61K 39/395
Мітки: сd44v6, моноклональне, vff-18, антитіло, фрагменти
Код посилання
<a href="https://ua.patents.su/12-58482-monoklonalne-antitilo-vff-18-proti-sd44v6-i-jjogo-fragmenti.html" target="_blank" rel="follow" title="База патентів України">Моноклональне антитіло vff-18 проти сd44v6 і його фрагменти</a>
Попередній патент: Водорозчинний гідролітично стабільний активований полімер, спосіб одержання активованого поліетиленгліколю (варіанти), біологічно активний кон’югат
Наступний патент: Спосіб стереоселективного одержання енантіомера гетеробіциклічного спирту, проміжні сполуки та спосіб їх одержання
Випадковий патент: Сівалка