Фармацевтичний препарат для перорального прийому з контрольованим вивільненням активного інгрідієнта в тонкому кишечнику і спосіб його одержання
Формула / Реферат
1. Фармацевтичний препарат для перорального прийому з контрольованим вивільненням активного інгредієнта в тонкому кишечнику на основі носіїв активного інгредієнта, забезпечених принаймні одним активним інгредієнтом, які забезпечені внутрішнім шаром, щоб контролювати вивільнення активного інгредієнта й шаром гастрорезистентного покриття, розташованим на ньому, який відрізняється тим, що внутрішній шар складається принаймні із двох дифузійних шарів, проникність яких для активного інгредієнта, що дифундує, зменшується від внутрішньої частини до зовнішньої, дифузійні шари утворені з матриксного матеріалу, який нерозчинний в рідині тонкого кишечнику і в який включені пороутворювачі, що контролюють проникність активного інгредієнта, що дифундує, і є розчинними, та/або здатними до набухання, та/або абсорбції води в рідині тонкого кишечнику,
де матриксний матеріал дифузійних шарів, вибраний із групи, яку складають етилцелюлоза, фталат ацетат целюлози, сукцинат ацетат целюлози, шелак, сукцинат ацетат гідроксипропілметилцелюлози, ацетат целюлози, пропіонат ацетат целюлози, фталат гідроксипропілметилцелюлози, полівінілацетат, полівінілацетатфталат, бутират ацетат целюлози, співполімери бутилметакрилату-(2-диметиламіноетил)метакрилату-метилметакрилату, співполімери етилакрилату-метилметакрилату, співполімери метакрилової кислоти-метилметакрилату, співполімери метакрилової кислоти-етилакрилату, співполімери етилакрилату-метилметакрилату-хлориду триметиламонійметилметакрилату, хітозан, суспензія силіконового еластомерного латексу, гідрогенізоване касторове масло, стеаринова кислота, моностеарат гліцерину, дистеарат гліцерину, дибегенат гліцерину, стеариловий спирт, білий віск, жовтий віск, гідрогенізована рослинна олія і мікрокристалічний віск,
де пороутворювач дифузійних шарів вибраний із групи, яку складають співполімери полівінілового спирту-поліетиленгліколю, полівінілпіролідон, співполімери вінілпіролідону-вінілацетату, поперечнозшитий полівінілпіролідон, мікрокристалічна целюлоза, гідроксипропілцелюлоза, натрійкарбоксиметилцелюлоза, метилцелюлоза, гідроксіетилцелюлоза, метилетилцелюлоза, метилгідроксипропілцелюлоза, гідроксипропілметилцелюлоза, гідроксіетилметилпропілцелюлоза, поліетиленгліколь, порошок целюлози, сахароза, лактоза, маніт, сорбіт і полісорбат.
2. Фармацевтичний препарат за пунктом 1, який відрізняється тим, що дифузійні шари містять ідентичні або різні типи матриксних матеріалів.
3. Фармацевтичний препарат за одним з пунктів 1 і 2, який відрізняється тим, що дифузійні шари включають один або більше пороутворювачів ідентичних або різних типів.
4. Фармацевтичний препарат за принаймні одним з попередніх пунктів, який відрізняється тим, що проникність дифузійних шарів для активного інгредієнта, що дифундує, контролюється залежно від природи, кількості та/або розміру частинок, та/або розчинності, та/або здатності до набухання, та/або водоабсорбційної здатності пороутворювача.
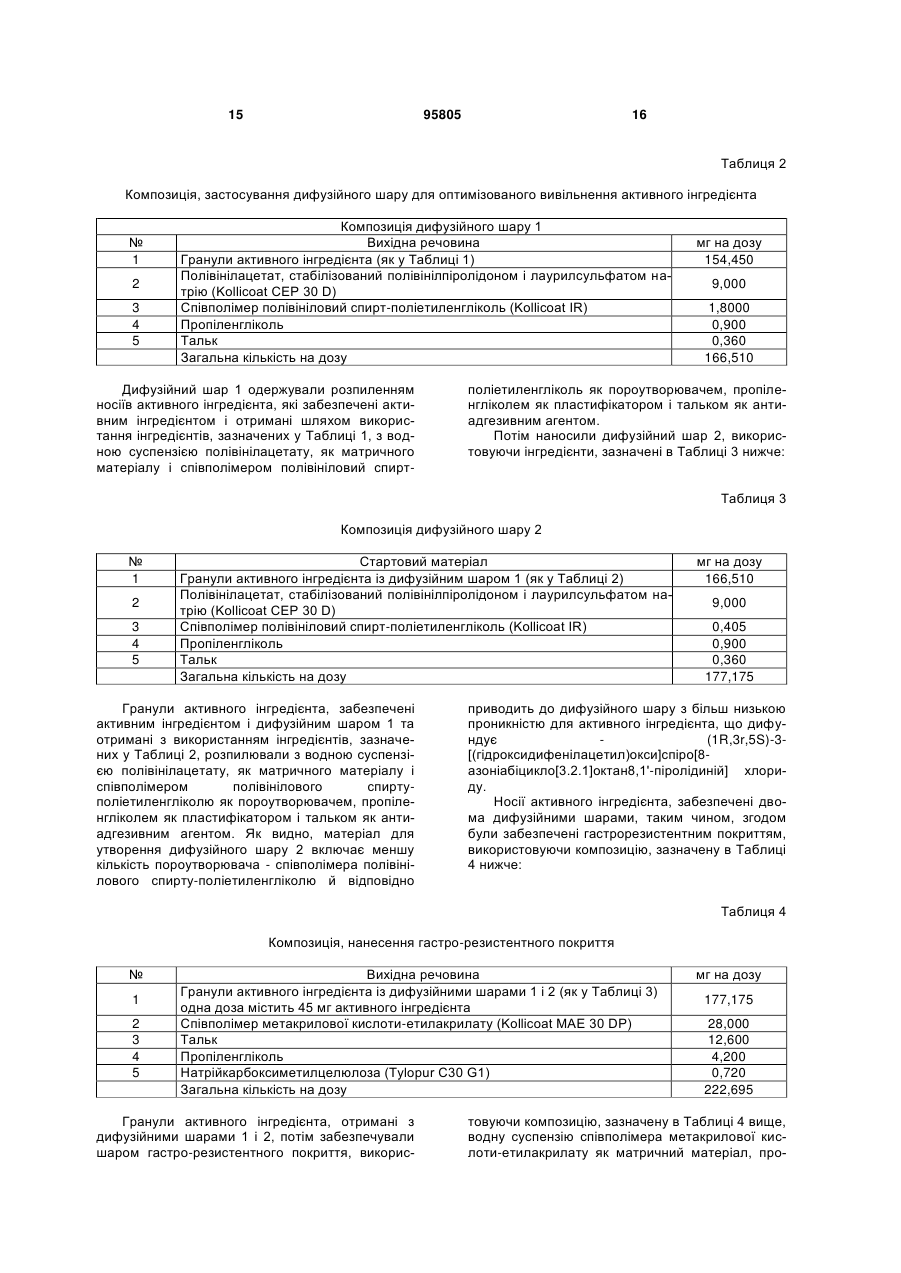
5. Фармацевтичний препарат за пунктом 4, який відрізняється тим, що внутрішній шар для контролювання вивільнення активного інгредієнта включає внутрішній і зовнішній дифузійні шари.
6. Фармацевтичний препарат за пунктом 5, який відрізняється тим, що у випадку ідентичного матеріалу пороутворювача, розмір частинок та/або концентрація пороутворювача у внутрішньому дифузійному шарі є більшою, ніж у зовнішньому дифузійному шарі.
7. Фармацевтичний препарат за пунктом 6, який відрізняється тим, що у випадку пороутворювачів, які є розчинними в рідині тонкого кишечнику, співвідношення концентрації пороутворювача у внутрішньому дифузійному шарі до концентрації пороутворювача у зовнішньому дифузійному шарі, перебуває в діапазоні від 20:1 до > 1:1, переважно від 10:1 до 1,1:1.
8. Фармацевтичний препарат за одним з попередніх пунктів, який відрізняється тим, що матриксний матеріал дифузійних шарів додатково включає пластифікатори і антиадгезивний агент.
9. Фармацевтичний препарат за пунктом 8, який відрізняється тим, що матриксний матеріал дифузійних шарів включає поліетиленгліколь, пропіленгліколь, триетилцитрат, триацетин, ацетилтрибутилцитрат, полісорбати, 2-піролідон, дибутилсебакат, стеаринову кислоту, касторове масло та/або середньо-ланцюгові тригліцериди як пластифікатор і тальк, стеаринову кислоту та її солі, жирні спирти, моно-, ди- або тригліцериди із прямим та/або розгалуженим ланцюгом, жирні кислоти, колоїдний діоксид кремнію, осаджений діоксид кремнію, оксид алюмінію, каолін, кукурудзяний крохмаль, пшеничний крохмаль, рисовий крохмаль, картопляний крохмаль, діоксид титану, силіконову емульсію та/або Veegum (магнієво-алюмінієво-силікатну дисперсію) як антиадгезивний агент.
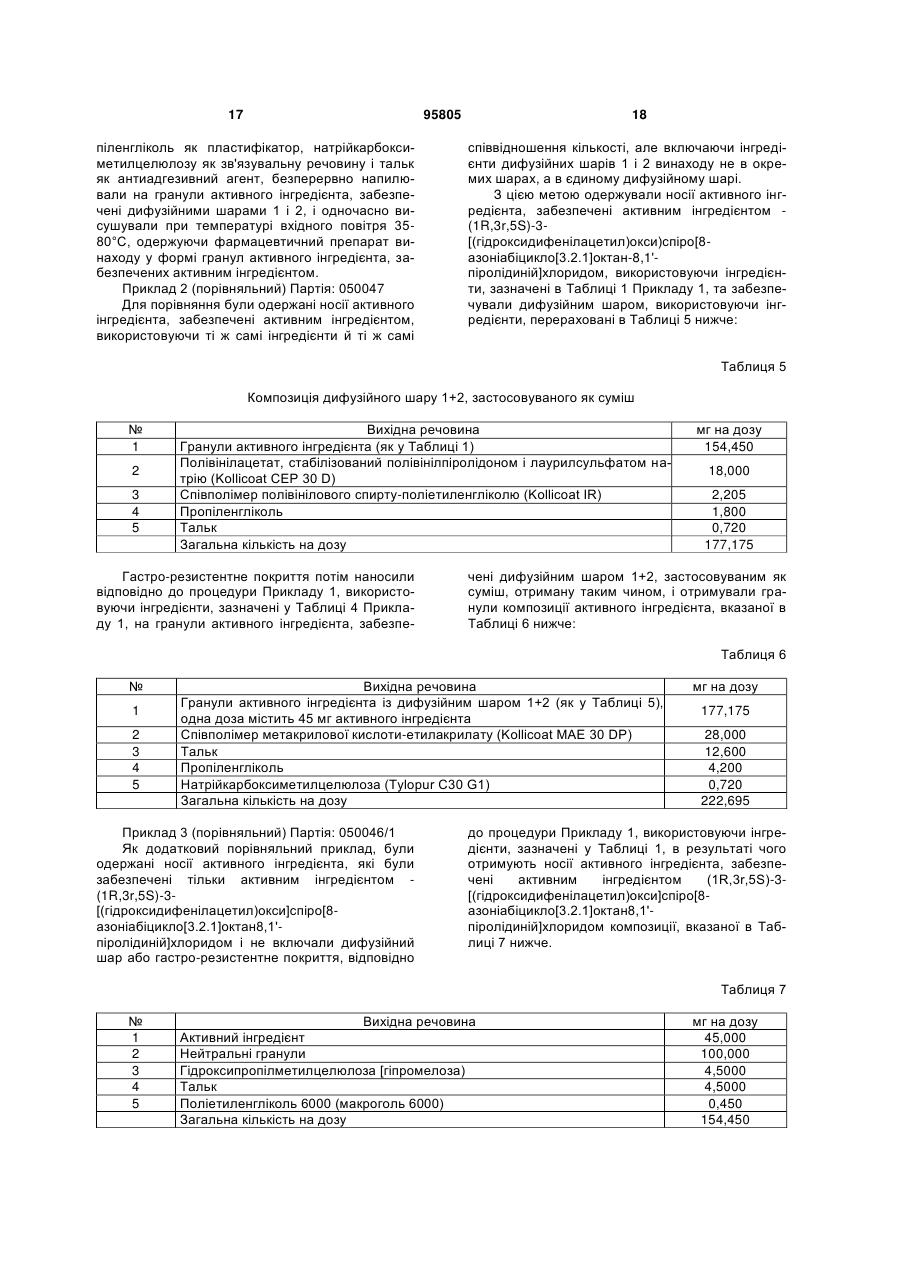
10. Фармацевтичний препарат за одним з попередніх пунктів, який відрізняється тим, що носії активного інгредієнта включають як активний інгредієнт гідрохлорид 4-діетиламіно-2-бутиніл-α-фенілцитогексанглюконату, карагенат етилдиметил(1-метил-3,3-дифенілпропіл)амонію, тартрат (+)-[R-2-[α-2-2-(діізопропіламіно)етил]бензил]-п-крезолу, бромід 8-(циклопропілметил)-6β,7β-епокси-3α-гідрокси-1αН,5α)-(S)-тропату, хлорид (1R,3r,5S)-3-[(гідроксидифенілацетил)окси]спіро[8-азоніабіцикло[3.2.1]октан-8,1'-піролідинію], гідрохлорид 2-діетиламіноетил(біциклогексил)-1-карбоксилату, гідрохлорид 1-метил-4-піперидилдифенілпропоксіацетату, (3R)-1-азабіцикло[2.2.2]окт-3-ил (1S)-1-феніл-3,4-дигідроізохінолін-2(1Н)-карбоксилатсукцинат, гідробромід (S)-1-[2-(2,3-дигідро-5-бензофураніл)етил]-α,α-дифеніл-3-піролідинацетаміду, (8R)-3α-гідрокси-5-ізопропіл-1αН,5αН-тропанійбромід (±тропат), 8-бутил-6β,7β-епокси-3α-[(S)-3-гідрокси-2-фенілпропаноїлокси]тропанійбромід, (+)-(S)-метил-γ-(1-нафтилокси)-2-тіофенпропіламін, 2-[(1R)-3-(діізопропіламіно)-1-фенілпропіл]-4-(гідроксиметил)фенілізобутират, 4-(діетиламіно)-бут-2-ин-1-іл (2S)-циклогексил(гідрокси)фенілацетат, бромід етилдиметил(1-метил-3,3-дифенілпропіл)амонію, гідрохлорид 2-піперидиноетил-3-метил-4-оксо-2-феніл-4Н-хромен-8-карбоксилату, гідрохлорид бензил(2-хлоретил)-(1-метил-2-феноксиетил)аміну та/або сіль, або іншу сіль цих активних інгредієнтів.
11. Фармацевтичний препарат за пунктом 10, який відрізняється тим, що активний інгредієнт присутній у кількості від 1 до 250 мг на одиницю дози носіїв активного інгредієнта.
12. Фармацевтичний препарат за пунктом 10 або 11, який відрізняється тим, що активний інгредієнт присутній у формі покриття на носіях активного інгредієнта.
13. Фармацевтичний препарат за одним з попередніх пунктів, який відрізняється тим, що носії активного інгредієнта перебувають у формі нейтральних гранул та/або кристалічних речовин, та/або гранульованих або екструдованих речовин носія.
14. Фармацевтичний препарат за пунктом 13, який відрізняється тим, що носії активного інгредієнта мають розмір частинок від 0,1 до 3,0 мм.
15. Фармацевтичний препарат за пунктом 13 або 14, який відрізняється тим, що носії активного інгредієнта включають як матеріал носія цукор, крохмаль, мікрокристалічну целюлозу, дикальцію фосфат, хлорид натрію, лимонну кислоту, винну кислоту, яблучну кислоту, цукрозу, лактозу, сорбіт, маніт, целюлозу, гідрофосфат кальцію, цитрат натрію, трикальцію фосфат, кукурудзяний крохмаль, пшеничний крохмаль, картопляний крохмаль, рисовий крохмаль та/або їх суміші.
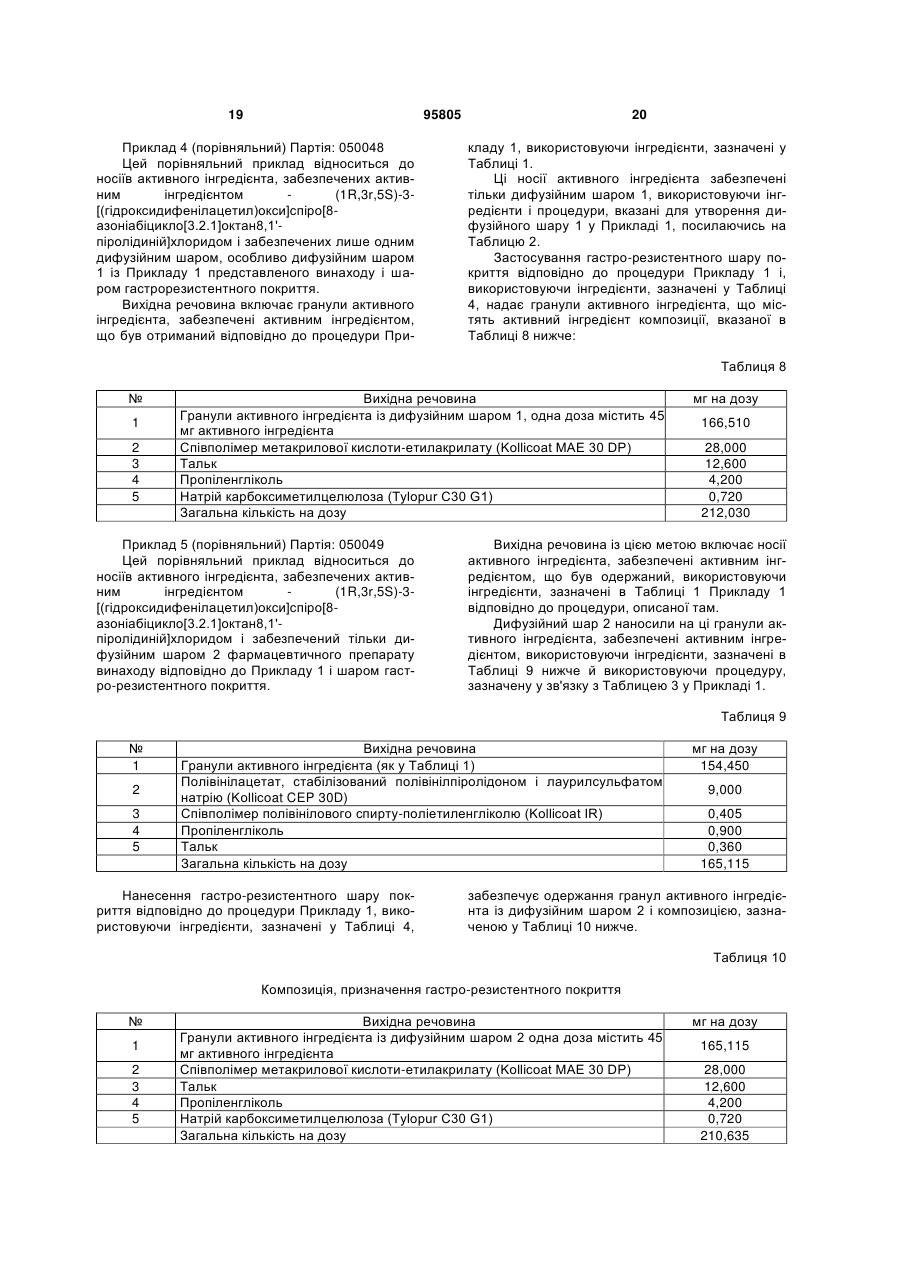
16. Фармацевтичний препарат за одним з попередніх пунктів, який відрізняється тим, що носії активного інгредієнта, забезпечені активним інгредієнтом, додатково мають, окрім активного інгредієнта, на їхній поверхні зв'язувальну речовину і, де прийнятно, антиадгезивний агент та/або буферні речовини.
17. Фармацевтичний препарат за пунктом 16, який відрізняється тим, що носії активного інгредієнта, забезпечені активним інгредієнтом, включають на одиницю дози від 1 до 250 мг активного інгредієнта, від 10 до 500 вагових частин матеріалу носія, від 1 до 100 вагових частин зв'язувальної речовини, від 1 до 100 вагових частин антиадгезивного агента й від 1 до 100 вагових частин буферної речовини.
18. Фармацевтичний препарат за пунктами 16 або 17, який відрізняється тим, що зв'язувальна речовина носіїв активного інгредієнта, забезпечених активним інгредієнтом, вибрана із групи, що включає гідроксипропілметилцелюлозу, співполімери бутилметакрилату-(2-диметиламіноетил)метакрилату-метилметакрилату, співполімери етилакрилату-метилметакрилату, співполімери метакрилової кислоти-метилметакрилату, співполімери метакрилової кислоти-етилакрилату, співполімери метилакрилату-метилметакрилату-метакрилової кислоти, співполімери етилакрилату-метилметакрилату-хлориду триметиламонійметилметакрилату, етилцелюлозу, натрійкарбоксиметилцелюлозу, метилцелюлозу, гідроксіетилцелюлозу, метилетилцелюлозу, гідроксіетилметилпропілцелюлозу, полівінілпіролідон, полівінілацетат, співполімери вінілпіролідону-вінілацетату, поліетиленгліколь, желатин, кукурудзяний крохмаль, пшеничний крохмаль, рисовий крохмаль й картопляний крохмаль і їх суміші.
19. Фармацевтичний препарат за будь-яким з пунктів 16-18, який відрізняється тим, що антиадгезивний агент носіїв активного інгредієнта, забезпечених активним інгредієнтом, вибраний із групи, що включає тальк, стеаринову кислоту і її солі, моно-, ди-, тригліцериди жирних кислот з лінійним та/або розгалуженим ланцюгом, жирні спирти, колоїдний діоксид кремнію, осаджений діоксид кремнію, оксид алюмінію, гідрогенізовану касторову олію і макроголь (поліетиленгліколь) і їх суміші.
20. Фармацевтичний препарат за будь-яким з пунктів 16-19, який відрізняється тим, що буферні речовини носіїв активного інгредієнта, забезпечених активним інгредієнтом, вибрані із групи, що включає гідроксид натрію, лимонну кислоту, винну кислоту, фосфорну кислоту, аскорбінову кислоту, бурштинову кислоту, адипінову кислоту, фумарову кислоту і їх фармацевтично прийнятні солі та їх суміші.
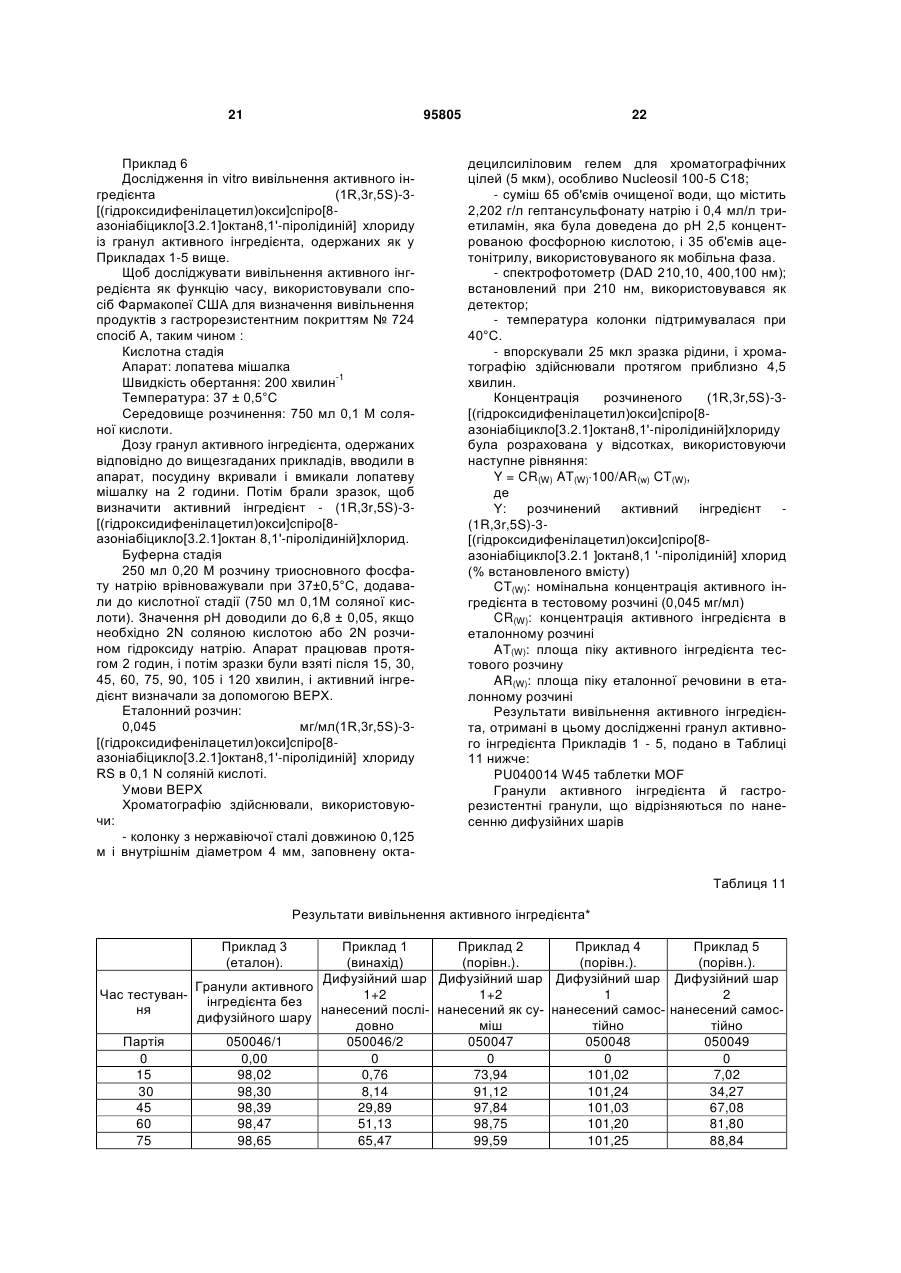
21. Фармацевтичний препарат за одним з попередніх пунктів, який відрізняється тим, що гастрорезистентний шар покриття, що розташований на носії активного інгредієнта, забезпеченому активним інгредієнтом і дифузійними шарами, утворений із групи, яка включає етилцелюлозу, фталат ацетат целюлози, сукцинат ацетат целюлози, шелак, сукцинат ацетат гідроксипропілметилцелюлози, ацетат целюлози, пропіонат ацетат целюлози, фталат гідроксипропілметилцелюлози, полівінілацетатфталат, ацетат бутират целюлози, співполімер бутилметакрилату-(2-диметиламіноетилметакрилату-метилметакрилату, співполімер етилакрилату-метилметакрилату, співполімер метакрилової кислоти-метилметакрилату, співполімер метакрилової кислоти-етилакрилату, співполімер метакрилової кислоти-метилметакрилату, співполімер метилакрилату-метилметакрилату-метакрилової кислоти, співполімер метилакрилату-метилметакрилату-хлориду триметиламіноетилметакрилату та/або їх суміші.
22. Фармацевтичний препарат за одним з попередніх пунктів, який відрізняється тим, що носії активного інгредієнта забезпечені активним інгредієнтом, дифузійними шарами і, де прийнятно, гастрорезистентним покриттям і резистентним щодо слини зовнішнім шаром.
23. Фармацевтичний препарат за пунктом 22, який відрізняється тим, що носії активного інгредієнта, забезпечені активним інгредієнтом, дифузійними шарами і де, прийнятно, гастрорезистентним покриттям, забезпечені резистентним щодо слини зовнішнім шаром із групи, що включає етилцелюлозу, фталат ацетат целюлози, сукцинат ацетат целюлози, шелак, сукцинат ацетат гідроксипропілметилцелюлози, ацетат целюлози, пропіонат ацетат целюлози, фталат гідроксипропілметилцелюлози, полівінілацетат, полівінілацетатфталат, співполімер полівінілового спирту-поліетиленгліколю, ацетат бутират целюлози, співполімер бутилметакрилату-(2-диметиламіноетилметакрилату-метилметакрилату, співполімер етилакрилату-метилметакрилату, співполімер метакрилової кислоти-метилметакрилату, співполімер метакрилової кислоти-етилакрилату, співполімер метакрилової кислоти- метилметакрилату, співполімер метилакрилату-метилметакрилату-метакрилової кислоти, співполімер метилакрилату-метилметакрилату-хлориду триметиламіноетилметакрилату та/або їх суміші
24. Фармацевтичний препарат за пунктом 23, який відрізняється тим, що резистентний щодо слини зовнішній шар включає ароматизатори, смакові добавки та/або підсолоджувачі.
25. Фармацевтичний препарат за одним з попередніх пунктів, який відрізняється тим, що носії активного інгредієнта, забезпечені активним інгредієнтом, дифузійними шарами, шаром гастрорезистентного покриття і, де прийнятно, резистентним щодо слини зовнішнім шаром, спресовані у таблетки з використанням звичайних наповнювачів або заповнюють капсули, виготовлені з желатину, целюлози, крохмалю або похідними крохмалю, або знаходяться у формі рідин або напівтвердих або твердих композицій, для одержання суспензії або суспензійного гелю.
26. Спосіб одержання фармацевтичного препарату за будь-яким з пунктів 1-25, який відрізняється тим, що носії активного інгредієнта покривають розчином або суспензією, яка включає активний інгредієнт, звязувальну речовину, антиадгезивний агент і, де прийнятно, буферні речовини, потім послідовно наносять принаймні два дифузійні шари, проникність яких для активного інгредієнта, що дифундує, зменшується від внутрішньої частини до зовнішньої, наносять гастрорезистентний шар покриття і, коли необхідно, забезпечують резистентним щодо слини зовнішнім шаром.
Текст
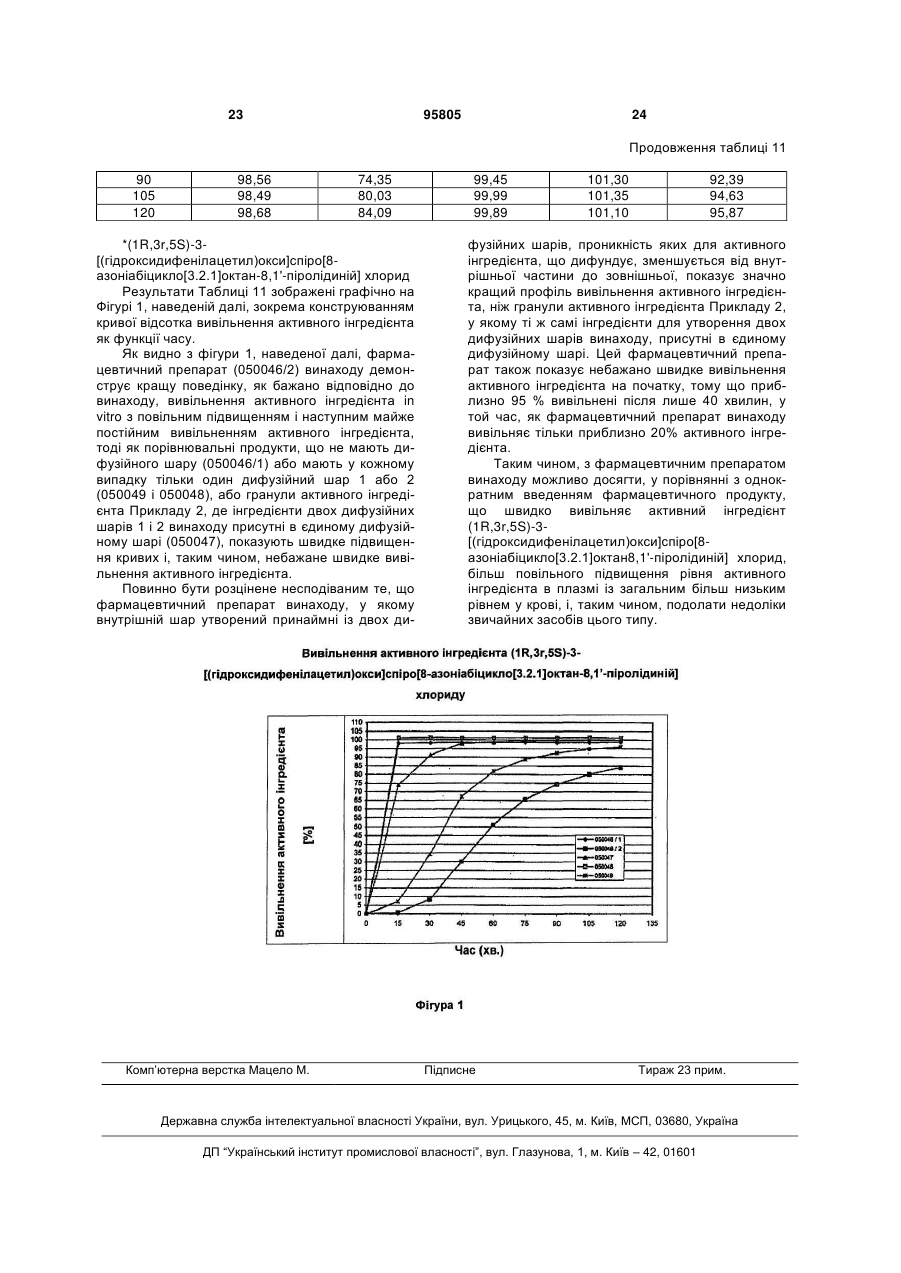
1. Фармацевтичний препарат для перорального прийому з контрольованим вивільненням активного інгредієнта в тонкому кишечнику на основі носіїв активного інгредієнта, забезпечених принаймні одним активним інгредієнтом, які забезпечені внутрішнім шаром, щоб контролювати вивільнення активного інгредієнта й шаром гастрорезистентного покриття, розташованим на ньому, який відрізняється тим, що внутрішній шар складається принаймні із двох дифузійних шарів, проникність яких для активного інгредієнта, що дифундує, зменшується від внутрішньої частини до зовнішньої, дифузійні шари утворені з матриксного матеріалу, який нерозчинний в рідині тонкого кишечнику і в який включені пороутворювачі, що контролюють проникність активного інгредієнта, що дифундує, і є розчинними, та/або здатними до набухання, та/або абсорбції води в рідині тонкого кишечнику, де матриксний матеріал дифузійних шарів, вибраний із групи, яку складають етилцелюлоза, фталат ацетат целюлози, сукцинат ацетат целюлози, шелак, сукцинат ацетат гідроксипропілметилцелюлози, ацетат целюлози, пропіонат ацетат целюлози, фталат гідроксипропілметилцелюлози, полівінілацетат, полівінілацетатфталат, бутират ацетат целюлози, співполімери бутилметакрилату-(2диметиламіноетил)метакрилатуметилметакрилату, співполімери етилакрилатуметилметакрилату, співполімери метакрилової кислоти-метилметакрилату, співполімери метакрилової кислоти-етилакрилату, співполімери етилакрилату-метилметакрилату-хлориду триметиламонійметилметакрилату, хітозан, суспензія 2 (19) 1 3 чів, які є розчинними в рідині тонкого кишечнику, співвідношення концентрації пороутворювача у внутрішньому дифузійному шарі до концентрації пороутворювача у зовнішньому дифузійному шарі, перебуває в діапазоні від 20:1 до > 1:1, переважно від 10:1 до 1,1:1. 8. Фармацевтичний препарат за одним з попередніх пунктів, який відрізняється тим, що матриксний матеріал дифузійних шарів додатково включає пластифікатори і антиадгезивний агент. 9. Фармацевтичний препарат за пунктом 8, який відрізняється тим, що матриксний матеріал дифузійних шарів включає поліетиленгліколь, пропіленгліколь, триетилцитрат, триацетин, ацетилтрибутилцитрат, полісорбати, 2-піролідон, дибутилсебакат, стеаринову кислоту, касторове масло та/або середньо-ланцюгові тригліцериди як пластифікатор і тальк, стеаринову кислоту та її солі, жирні спирти, моно-, ди- або тригліцериди із прямим та/або розгалуженим ланцюгом, жирні кислоти, колоїдний діоксид кремнію, осаджений діоксид кремнію, оксид алюмінію, каолін, кукурудзяний крохмаль, пшеничний крохмаль, рисовий крохмаль, картопляний крохмаль, діоксид титану, силіконову емульсію та/або Veegum (магнієвоалюмінієво-силікатну дисперсію) як антиадгезивний агент. 10. Фармацевтичний препарат за одним з попередніх пунктів, який відрізняється тим, що носії активного інгредієнта включають як активний інгредієнт гідрохлорид 4-діетиламіно-2-бутиніл-αфенілцитогексанглюконату, карагенат етилдиметил(1-метил-3,3-дифенілпропіл)амонію, тартрат (+)-[R-2-[α-2-2-(діізопропіламіно)етил]бензил]-пкрезолу, бромід 8-(циклопропілметил)-6β,7βепокси-3α-гідрокси-1αН,5α)-(S)-тропату, хлорид (1R,3r,5S)-3-[(гідроксидифенілацетил)окси]спіро[8азоніабіцикло[3.2.1]октан-8,1'-піролідинію], гідрохлорид 2-діетиламіноетил(біциклогексил)-1карбоксилату, гідрохлорид 1-метил-4піперидилдифенілпропоксіацетату, (3R)-1азабіцикло[2.2.2]окт-3-ил (1S)-1-феніл-3,4дигідроізохінолін-2(1Н)-карбоксилатсукцинат, гідробромід (S)-1-[2-(2,3-дигідро-5бензофураніл)етил]-α,α-дифеніл-3піролідинацетаміду, (8R)-3α-гідрокси-5-ізопропіл1αН,5αН-тропанійбромід (±тропат), 8-бутил-6β,7βепокси-3α-[(S)-3-гідрокси-2фенілпропаноїлокси]тропанійбромід, (+)-(S)метил-γ-(1-нафтилокси)-2-тіофенпропіламін, 2[(1R)-3-(діізопропіламіно)-1-фенілпропіл]-4(гідроксиметил)фенілізобутират, 4-(діетиламіно)бут-2-ин-1-іл (2S)циклогексил(гідрокси)фенілацетат, бромід етилдиметил(1-метил-3,3-дифенілпропіл)амонію, гідрохлорид 2-піперидиноетил-3-метил-4-оксо-2феніл-4Н-хромен-8-карбоксилату, гідрохлорид бензил(2-хлоретил)-(1-метил-2-феноксиетил)аміну та/або сіль, або іншу сіль цих активних інгредієнтів. 11. Фармацевтичний препарат за пунктом 10, який відрізняється тим, що активний інгредієнт присутній у кількості від 1 до 250 мг на одиницю дози носіїв активного інгредієнта. 95805 4 12. Фармацевтичний препарат за пунктом 10 або 11, який відрізняється тим, що активний інгредієнт присутній у формі покриття на носіях активного інгредієнта. 13. Фармацевтичний препарат за одним з попередніх пунктів, який відрізняється тим, що носії активного інгредієнта перебувають у формі нейтральних гранул та/або кристалічних речовин, та/або гранульованих або екструдованих речовин носія. 14. Фармацевтичний препарат за пунктом 13, який відрізняється тим, що носії активного інгредієнта мають розмір частинок від 0,1 до 3,0 мм. 15. Фармацевтичний препарат за пунктом 13 або 14, який відрізняється тим, що носії активного інгредієнта включають як матеріал носія цукор, крохмаль, мікрокристалічну целюлозу, дикальцію фосфат, хлорид натрію, лимонну кислоту, винну кислоту, яблучну кислоту, цукрозу, лактозу, сорбіт, маніт, целюлозу, гідрофосфат кальцію, цитрат натрію, трикальцію фосфат, кукурудзяний крохмаль, пшеничний крохмаль, картопляний крохмаль, рисовий крохмаль та/або їх суміші. 16. Фармацевтичний препарат за одним з попередніх пунктів, який відрізняється тим, що носії активного інгредієнта, забезпечені активним інгредієнтом, додатково мають, окрім активного інгредієнта, на їхній поверхні зв'язувальну речовину і, де прийнятно, антиадгезивний агент та/або буферні речовини. 17. Фармацевтичний препарат за пунктом 16, який відрізняється тим, що носії активного інгредієнта, забезпечені активним інгредієнтом, включають на одиницю дози від 1 до 250 мг активного інгредієнта, від 10 до 500 вагових частин матеріалу носія, від 1 до 100 вагових частин зв'язувальної речовини, від 1 до 100 вагових частин антиадгезивного агента й від 1 до 100 вагових частин буферної речовини. 18. Фармацевтичний препарат за пунктами 16 або 17, який відрізняється тим, що зв'язувальна речовина носіїв активного інгредієнта, забезпечених активним інгредієнтом, вибрана із групи, що включає гідроксипропілметилцелюлозу, співполімери бутилметакрилату-(2диметиламіноетил)метакрилатуметилметакрилату, співполімери етилакрилатуметилметакрилату, співполімери метакрилової кислоти-метилметакрилату, співполімери метакрилової кислоти-етилакрилату, співполімери метилакрилату-метилметакрилату-метакрилової кислоти, співполімери етилакрилатуметилметакрилату-хлориду триметиламонійметилметакрилату, етилцелюлозу, натрійкарбоксиметилцелюлозу, метилцелюлозу, гідроксіетилцелюлозу, метилетилцелюлозу, гідроксіетилметилпропілцелюлозу, полівінілпіролідон, полівінілацетат, співполімери вінілпіролідонувінілацетату, поліетиленгліколь, желатин, кукурудзяний крохмаль, пшеничний крохмаль, рисовий крохмаль й картопляний крохмаль і їх суміші. 19. Фармацевтичний препарат за будь-яким з пунктів 16-18, який відрізняється тим, що антиадгезивний агент носіїв активного інгредієнта, забезпечених активним інгредієнтом, вибраний із групи, що включає тальк, стеаринову кислоту і її солі, 5 95805 6 моно-, ди-, тригліцериди жирних кислот з лінійним та/або розгалуженим ланцюгом, жирні спирти, колоїдний діоксид кремнію, осаджений діоксид кремнію, оксид алюмінію, гідрогенізовану касторову олію і макроголь (поліетиленгліколь) і їх суміші. 20. Фармацевтичний препарат за будь-яким з пунктів 16-19, який відрізняється тим, що буферні речовини носіїв активного інгредієнта, забезпечених активним інгредієнтом, вибрані із групи, що включає гідроксид натрію, лимонну кислоту, винну кислоту, фосфорну кислоту, аскорбінову кислоту, бурштинову кислоту, адипінову кислоту, фумарову кислоту і їх фармацевтично прийнятні солі та їх суміші. 21. Фармацевтичний препарат за одним з попередніх пунктів, який відрізняється тим, що гастрорезистентний шар покриття, що розташований на носії активного інгредієнта, забезпеченому активним інгредієнтом і дифузійними шарами, утворений із групи, яка включає етилцелюлозу, фталат ацетат целюлози, сукцинат ацетат целюлози, шелак, сукцинат ацетат гідроксипропілметилцелюлози, ацетат целюлози, пропіонат ацетат целюлози, фталат гідроксипропілметилцелюлози, полівінілацетатфталат, ацетат бутират целюлози, співполімер бутилметакрилату-(2диметиламіноетилметакрилатуметилметакрилату, співполімер етилакрилатуметилметакрилату, співполімер метакрилової кислоти-метилметакрилату, співполімер метакрилової кислоти-етилакрилату, співполімер метакрилової кислоти-метилметакрилату, співполімер метилакрилату-метилметакрилату-метакрилової кислоти, співполімер метилакрилату-метилметакрилатухлориду триметиламіноетилметакрилату та/або їх суміші. 22. Фармацевтичний препарат за одним з попередніх пунктів, який відрізняється тим, що носії активного інгредієнта забезпечені активним інгредієнтом, дифузійними шарами і, де прийнятно, гастрорезистентним покриттям і резистентним щодо слини зовнішнім шаром. 23. Фармацевтичний препарат за пунктом 22, який відрізняється тим, що носії активного інгредієнта, забезпечені активним інгредієнтом, дифузійними шарами і де, прийнятно, гастрорезистентним покриттям, забезпечені резистентним щодо слини зовнішнім шаром із групи, що включає етилцелюлозу, фталат ацетат целюлози, сукцинат ацетат целюлози, шелак, сукцинат ацетат гідроксипропілметилцелюлози, ацетат целюлози, пропіонат ацетат целюлози, фталат гідроксипропілметилцелюлози, полівінілацетат, полівінілацетатфталат, співполімер полівінілового спиртуполіетиленгліколю, ацетат бутират целюлози, співполімер бутилметакрилату-(2диметиламіноетилметакрилатуметилметакрилату, співполімер етилакрилатуметилметакрилату, співполімер метакрилової кислоти-метилметакрилату, співполімер метакрилової кислоти-етилакрилату, співполімер метакрилової кислоти- метилметакрилату, співполімер метилакрилату-метилметакрилату-метакрилової кислоти, співполімер метилакрилату-метилметакрилатухлориду триметиламіноетилметакрилату та/або їх суміші 24. Фармацевтичний препарат за пунктом 23, який відрізняється тим, що резистентний щодо слини зовнішній шар включає ароматизатори, смакові добавки та/або підсолоджувачі. 25. Фармацевтичний препарат за одним з попередніх пунктів, який відрізняється тим, що носії активного інгредієнта, забезпечені активним інгредієнтом, дифузійними шарами, шаром гастрорезистентного покриття і, де прийнятно, резистентним щодо слини зовнішнім шаром, спресовані у таблетки з використанням звичайних наповнювачів або заповнюють капсули, виготовлені з желатину, целюлози, крохмалю або похідними крохмалю, або знаходяться у формі рідин або напівтвердих або твердих композицій, для одержання суспензії або суспензійного гелю. 26. Спосіб одержання фармацевтичного препарату за будь-яким з пунктів 1-25, який відрізняється тим, що носії активного інгредієнта покривають розчином або суспензією, яка включає активний інгредієнт, звязувальну речовину, антиадгезивний агент і, де прийнятно, буферні речовини, потім послідовно наносять принаймні два дифузійні шари, проникність яких для активного інгредієнта, що дифундує, зменшується від внутрішньої частини до зовнішньої, наносять гастрорезистентний шар покриття і, коли необхідно, забезпечують резистентним щодо слини зовнішнім шаром. Опис Даний винахід відноситься до фармацевтичного препарату для перорального прийому з контрольованим вивільненням активного інгредієнта в тонкому кишечнику на основі носіїв активного інгредієнта, забезпечених принаймні одним активним інгредієнтом і, які забезпечені внутрішнім шаром для контролювання вивільнення активного інгредієнта та шаром гастро-резистентного покриття, розташованим на ньому, і способу його одержання. Фармацевтичні препарати для перорального прийому з контрольованим вивільненням активно го інгредієнта в тонкому кишечнику були раніше описані. Так, DE 198 23 940 А1 описує ентеральні таблетки флуоксетину, які включають нейтральне ядро, на яке був накладений шар флуоксетину і який супроводжується відокремлюваним шаром, на який накладений ентеральний шар і довільно забезпечений фінішним шаром. У цьому випадку, ентеральний шар служить, щоб гарантувати, що активний інгредієнт буде проходити незмінним через шлунок пацієнта та буде розпадатися тільки тоді, коли активний інгредієнт залишає шлунок і надходить у тонкий кишечник. 7 ЕР 0 941 070 В1 відноситься до таблетки для смоктання з модифікованим вивільненням активних інгредієнтів у шлунково-кишковому тракті, що включає композицію активного інгредієнта у формі частинок із принаймні двошаровим покриттям, де зовнішній шар є резистентним щодо слини, але гастро-солюбільним, і внутрішній шар покриття істотно резистентний до розпадання у водному середовищі, але дозволяє уповільненому вивільненню активного інгредієнта дифузією. В додатковому втіленні, частинки з двошаровим покриттям включають зовнішній шар покриття, що є резистентним щодо слини, але гастро-солюбільним, і внутрішній шар покриття, що є гастро-резистентним, але розчинним у тонкому кишечнику. Патент США 2004/0142035 А1 розкриває фармацевтичний препарат, який має ядро, що включає один або більше активних фармацевтичних інгредієнтів, і шар покриття, що огортає ядро, де шар покриття включає комбінацію двох або більше матеріалів ентерального покриття, з яких принаймні два матеріали ентерального покриття розпадаються при різних значеннях рН, щоб таким чином досягти контрольованого профілю вивільнення активного інгредієнта залежно від рН. Ця розробка служить для запобігання втрати значної частини активного інгредієнта, усе ще присутнього в продукті після проходження через тонкий кишечник. Звичайні фармацевтичні препарати для перорального прийому з контрольованим вивільненням активного інгредієнта в тонкому кишечнику, однак, як виявилося, не були повністю задовільними, тому що, коли активний інгредієнт вивільняється у тонкому кишечнику, спостерігається спочатку значне підвищення вивільнення активного інгредієнта з відповідно високими рівнями в крові, що веде у багатьох випадках до збільшення ступеня й інтенсивності побічних ефектів. Для речовин, згаданих надалі, це стосується, наприклад, зокрема, сухості у роті, погіршення акомодації, шлунково-кишкових проблем або ефектів центральної нервової системи. Це особливо несприятливо, коли вся доза активного інгредієнта повинна застосовуватися тільки один раз у день. Далі помічено, що пероральний прийом, наприклад антихолінергічних засобів супроводжується більшою міжіндивідуумною варіацією плазмових профілів. З іншого боку, використання ентеральних речовин з різною розчинністю при різних значеннях рН, як розкрито в US 2004/0142035 А1, приводить до обмеження вибору речовин з одного боку, та з іншого боку - до неоднорідного вивільнення активного інгредієнта, коли спостерігається коливання рН. Тому, задачею представленого винаходу є одержання фармацевтичного препарату, зазначеного на початку типу, для перорального прийому активних інгредієнтів з контрольованим вивільненням активного інгредієнта у тонкому кишечнику, який, на відміну від звичайних композицій, показує менше початкове підвищення вивільнення активного інгредієнта і, таким чином, більш низький початковий пік активного інгредієнта у плазмі, але гарантує згодом більш низьку, але однорідну кон 95805 8 центрацію активного інгредієнта у плазмі, і, таким чином, приводить до більш низького ступеня побічних ефектів і інтенсивності побічних ефектів і до меншої міжіндивідуумної варіації плазмових профілів, особливо, коли вся доза активного інгредієнта повинна застосовуватися тільки один раз на день. Це досягається даним препаратом, в якому швидкість вивільнення активного інгредієнта становить 75 % за 60 хвилин при in vitro тестуванні вивільнення відповідно до американської Фармакопеї. Таким чином, можливо без проблем гарантувати необхідну дозу протягом цілого дня при однократному призначенні. Несподівано з'ясувалося, що ця задача може бути вирішена шляхом надання носія активного інгредієнта, забезпеченого активним інгредієнтом із внутрішнім шаром для контролювання вивільнення активного інгредієнта, що утворений принаймні із двох дифузійних шарів, проникність яких для активного інгредієнта, що дифундує, зменшується від внутрішньої частини до зовнішньої і, який додатково забезпечений шаром гастрорезистентного покриття, розташованим на ньому. Таким чином, винахід відноситься до фармацевтичного препарату відповідно до головного пункту формули винаходу та до його використання. Винахід, таким чином, відноситься до фармацевтичного препарату для перорального прийому з контрольованим вивільненням активного інгредієнта в тонкому кишечнику на основі носіїв активного інгредієнта з принаймні одним активним інгредієнтом, які забезпечені внутрішнім шаром для контролювання вивільнення активного інгредієнта й шаром гастро-резистентного покриття, розташованим на ньому, який відрізняється тим, що внутрішній шар утворений принаймні із двох дифузійних шарів, проникність яких для активного інгредієнта, що дифундує, зменшується від внутрішньої частини до зовнішньої. Така структура внутрішнього шару, що включає принаймні два дифузійні шари, надає можливість цільовому вивільненню активного інгредієнта в тонкому кишечнику, так, щоб у порівнянні із звичайними виробами цього типу могла бути досягнута більш низька початкова швидкість вивільнення активного інгредієнта, що веде до введення всієї добової дози активного інгредієнта в однократній дозі, з відповідно низькими, але достатніми рівнями в крові, до меншої міжіндивідуумної варіації плазмових профілів й, таким чином, до зменшеного ступеня й інтенсивності побічних ефектів. У втіленні винаходу, якому надається перевага, включено принаймні два дифузійні шари внутрішнього шару для контролювання вивільнення активного інгредієнта утворені з матричного матеріалу, який нерозчинний в рідині тонкого кишечнику й пороутворювачі якого контролюють проникність активного інгредієнта, що дифундує, і є розчинними та/або здатними до набрякання та/або абсорбції води в рідині тонкого кишечнику. В цьому зв'язку для дифузійних шарів можливо включити матричні матеріали, ідентичних або різних ти 9 пів, та/або один або кілька пороутворювачів ідентичних або різних типів. Таким чином, відповідно до винаходу проникність дифузійних шарів для активного інгредієнта, що дифундує, переважно контролюється залежно від природи, кількості та/або розміру частинок та/або розчинності, та/або здатності до набрякання та/або абсорбції води пороутворювачів, присутніх у матричному матеріалі. Відповідно до винаходу внутрішній шар має внутрішній і зовнішній дифузійні шари для контролювання вивільнення активного інгредієнта, і у випадку, коли матеріал пороутворювача та матричний матеріал ідентичні, розмір частинок та/або концентрація пороутворювача у внутрішньому дифузійному шарі є більшою, ніж у зовнішньому дифузійному шарі. У переважному втіленні, коли пороутворювачі є розчинними в рідині тонкого кишечнику, співвідношення концентрації пороутворювача у внутрішньому дифузійному шарі до концентрації пороутворювача у зовнішньому дифузійному шарі перебуває в діапазоні від 20:1 до > 1:1, переважно в діапазоні від 10:1 до 1,1:1. Матричний матеріал дифузійних шарів переважно вибраний із групи, що включає етилцелюлозу, фталатацетат целюлози, сукцинатацетат целюлози, шелак, сукцинатацетат гідроксипропіл метил целюлози, ацетат целюлози, пропіонатацетат целюлози, фталат гідроксипропілметилцелюлози, полівінілацетат, фталатполівінілацетат, бутиратацетат целюлози, бутилметакрилат-(2диметиламіноетил)метакрилат-метилметакрилатні співполімери, етил акрилат-метилметакрилатні співполімери, співполімери метакрилової кислотиметилметакрилату, співполімери метакрилової кислоти-етилакрилату, співполімери етилакрилатуметилметакрилату-хлориду триметиламонійметилметакрилату, натрійкарбоксиметилцелюлозу, метилцелюлозу, гідроксиетилцелюлозу, метилетилцелюлозу, метилгідроксипропілцелюлозу, гідроксипропілметилцелюлозу, гідроксиетилметилпропілцелюлозу, хітозан, ацетат хітозану, суспензію силіконового еластомерного латексу, гідрогенізоване касторове масло, стеаринову кислоту, моностеарат гліцерину, дистеарат гліцерину, дибегенат гліцерину, стеариловий спирт, білий віск, жовтий віск, гідрогенізоване рослинне масло й мікрокристалічний віск. Матеріал, вибраний для пороутворювача дифузійних шарів, включає матеріали із групи, що включає співполімери полівінілового спиртуполіетиленгліколю, полівінілпіролідон, співполімери вініл піролідону-вініл ацетату, поперечнозшитий полівінілпіролідон, мікрокристалічну целюлозу, гідроксипропілцелюлозу, натрійкарбоксиметилцелюлозу, метилцелюлозу, гідроксиетилцелюлозу, метилетилцелюлозу, метилгідроксипропілцелюлозу, гідроксипропілметилцелюлозу, гідроксиетилметилпропілцелюлозу, поліетиленгліколь, порошок целюлози, сахарозу, лактозу, манітол, сорбіт і полісорбат. Матричний матеріал дифузійних шарів може, якщо необхідно, додатково включати пластифікатори й антиадгезивні агенти, щоб регулювати властивість матричного матеріалу дифузійних шарів в 95805 10 бажаному руслі. Матричний матеріал дифузійних шарів як антиадгезивний агент переважно використовує поліетиленгліколь, пропіленгліколь, триетилцитрат, триацетин, ацетилтрибутилцитрат, полісорбати, 2-піролідон, дибутилсебакат, стеаринову кислоту, касторове масло та/або середньоланцюгові тригліцериди як пластифікатори і тальк, стеаринову кислоту та її солі, жирні спирти, моно-, ди- або тригліцериди із прямим та/або розгалуженим ланцюгом, жирні кислоти, колоїдний діоксид кремнію, осаджений діоксид кремнію, оксид алюмінію, каолін, кукурудзяний крохмаль, пшеничний крохмаль, рисовий крохмаль, картопляний крохмаль, діоксид титану, силіконову емульсію та/або Veegum (магнієво-алюмінієво силікатну дисперсію). Носії активного інгредієнта, присутні у фармацевтичному препараті винаходу, можуть включати, як активні інгредієнти, будь-які активні фармацевтичні інгредієнти, ефект яких може бути забезпечений через тонкий кишечник, такі як, наприклад, 4-діетиламіно-2-бутиніл-фенілциклогексанглюконату гідрохлорид, етилдиметил(1-метил-3,3-дифенілпропіл)амонію карагенат, (+)-[R-2-[-2-2-(діізопропіламіно)етил]бензил]п-крезолу тартрат, 8-(циклопропілметил)-6,7епокси-3-гідрокси-1Н,5-тропаній(S)-тропату бромід, (1R,3r,5S)-3[(гідроксидифенілацетил)окси]спіро[8азоніабіцикло[3.2.1]-октан-8,1'піролідинію] хлорид, 2діетиламіноетил(біциклогексил)-1 –карбоксилату гідрохлорид, 1-метил-4-піперидинілдифенілпропоксиацетату гідрохлорид, (3R)-1азабіцикло[2,2.2]окт-3-іл-(1S)-1-феніл-3,4дигідроізохінолін-2(1Н)-карбоксилату сукцинат, (S)1-[2-(2,3-дигідро-5-бензофураніл)етил]-,дифеніл-3-піролідинацетаміду гідробромід, (8R)3-гідрокси-5-ізопропіл-1Н,5Н-тропанію бромід (±тропат), 8-бутил-6,7-епокси-3-[(S)-3-гідрокси2-фенілпропаноїлокси]тропанію бромід, (+)-(S)-Nметил--(1-нафтилокси)-2-тіофенпропіламін, 2[(1R)-3-(діізопропіламіно)-1-фенілпропіл]-4(гідроксиметил)фенілу ізобутират, 4-(діетиламіно)бут-2-ін-іл (2S)-циклогексил(гідрокси)фенілацетат, етилдиметил(1-метил-3,3-дифенілпропіл)амонію бромід, 2-піперидиноетил-3-метил-4-оксо-2-феніл4Н-хромен-8-карбоксилату гідрохлорид, бензил (2хлоретил)-(1 -метил-2-феноксиетил)аміну гідрохлорид та/або сіль, або інша сіль цих активних інгредієнтів. Активний інгредієнт переважно присутній у кількості від 1 до 250 мг на одиницю дози носіїв активного інгредієнта, переважно в кількості, що відповідає добовій дозі. Для активного інгредієнта, крім того, можливо бути присутнім у формі покриття на носіях активного інгредієнта, яке може, крім активного інгредієнта, додатково включати зв'язувальну речовину й довільно антиадгезивний агент та/або буферні субстанції, щоб контролювати вивільнення активного інгредієнта в бажаному руслі. Носії активного інгредієнта перебувають переважно у формі нейтральних гранул та/або кристалічних субстанцій, та/або гранульованих або екструдованих субстанцій носія й переважно мають 11 розмір частинок від 0,1 до 3,0 мм, переважно від 0,2 до 2,0 мм. Такі носії активного інгредієнта є комерційно доступними і як матеріал носія включають, наприклад, цукор, крохмаль, мікрокристалічну целюлозу, дифосфат кальцію, хлорид натрію, лимонну кислоту, винну кислоту, яблучну кислоту, сахарозу, лактозу, сорбітол, манітол, целюлозу, гідрофосфат кальцію, цитрат натрію, трифосфат кальцію, кукурудзяний крохмаль, пшеничний крохмаль, картопляний крохмаль, рисовий крохмаль та/або їх суміші. У переважному втіленні винаходу носії активного інгредієнта, забезпечені активним інгредієнтом, містять на одиницю дози від 1 до 250 мг, переважно 5-100 мг, більш переважно 20 - 60 мг активного інгредієнта, від 10 до 500 вагових частин матеріалу носія, від 1 до 100 вагових частин зв'язувальної речовини, від 1 до 100 вагових частин антиадгезивного агента і від 1 до 100 вагових частин буферних речовин. Зв'язувальна речовина носія активного інгредієнта, забезпеченого активним інгредієнтом, може бути вибрана із групи, що включає гідроксипропілметилцелюлозу, співполімери бутилметакрилату-(2диметиламіноетил)метакрилатуметилметакрилату, співполімери етилакрилатуметилметакрилату, співполімери метакрилової кислоти-метилметакрилату, співполімери метакрилової кислоти-етилакрилату, співполімери метилакрилату-метилметакрилату-метакрилової кислоти, співполімери етилакрилатуметилметакрилату-хлориду триметиламонійметилметакрилату, етилцелюлозу, натрійкарбоксиметилцелюлозу, метилцелюлозу, гідроксиетилцелюлозу, метилетилцелюлозу, гідроксиетилметилпропілцелюлозу, полівінілпіролідон, полівінілацетат, співполімери вінілпіролідону-вінілацетату, поліетиленгліколь, желатин, кукурудзяний крохмаль, пшеничний крохмаль, рисовий крохмаль і картопляний крохмаль та їх суміші. Носій активного інгредієнта, забезпечений активним інгредієнтом, може включати як антиадгезивний агент тальк, стеаринову кислоту і її солі, моно-, ди-, тригліцериди жирних кислот з лінійним та/або розгалуженим ланцюгом, жирні спирти, колоїдний діоксид кремнію, осаджений діоксид кремнію, оксид алюмінію, гідрогенізоване касторове масло і макроголь (поліетиленгліколь) та їх суміші. Буферними речовинами, які можуть використовуватися, щоб запобігти можливим змінам в тонкому кишечнику рН носіїв активного інгредієнта, забезпечених активним інгредієнтом, є гідроксид натрію, лимонна кислота, винна кислота, фосфорна кислота, аскорбінова кислота, бурштинова кислота, адипінова кислота, фумарова кислота та їх фармацевтично прийнятні солі та їх суміші. Гастрорезистентний шар покриття, розташований на внутрішньому шарі, щоб контролювати вивільнення активного інгредієнта, переважно утворений із групи речовин, що включає етилцелюлозу, фталатацетат целюлози, сукцинатацетат целюлози, шелак, сукцинатацетат гідроксипропіл метилцелюлози, ацетат целюлози, пропіонатаце 95805 12 тат целюлози, фталат гідроксипропілметилцелюлози, полівінілацетатфталат, бутиратацетат целюлози, співполімер бутилметакрилату-2диметиламіноетилметакрилату- метилметакрилату, співполімер етилакрилату-метилметакрилату, співполімер метакрилової кислотиметилметакрилату, співполімер метакрилової кислоти-етилакрилату, співполімер метакрилової кислоти-метилметакрилату, співполімер метилакрилату-метилметакрилату-метакрилової кислоти, співполімер метилакрилату-метилметакрилатухлориду триметиламіноетилметакрилату та/або їх суміші. При одному типі введення носіїв активного інгредієнта, при яких останні контактують зі слиною безпосередньо в ротовій порожнині, можливе, завдяки рН умовам, розпадання гастрорезистентного шару, коли активний інгредієнт вивільняється там. Щоб запобігти цьому, відповідно до винаходу, необхідно переважно забезпечити носії активного інгредієнта, що мають активний інгредієнт, дифузійним шаром і, де прийнятно, гастро-резистентним покриттям з резистентним щодо слини зовнішнім шаром, що переважно утворений з наступних речовин: етилцелюлоза, фталатацетат целюлози, сукцинатацетат целюлози, шелак, сукцинатацетат гідроксипропілметилцелюлози, ацетат целюлози, пропіонатацетат целюлози, фталат гідроксипропілметилцелюлози, полівінілацетат, полівінілацетатфталат, співполімер полівінілового спирту-поліетиленгліколю, бутиратацетат целюлози, співполімер бутилметакрилату-2-диметиламіноетилметакрилатуметилметакрилату, співполімер етилакрилатуметилметакрилату, співполімер метакрилової кислоти-метилметакрилату, співполімер метакрилової кислоти-етилакрилату, співполімер метакрилової кислоти-метилметакрилату, співполімер метилакрилату-метилметакрилату-метакрилової кислоти, співполімер етилакрилату-метилметакрилатухлориду триметиламіноетилметакрилату та/або їх суміші. Резистентний щодо слини зовнішній шар може, якщо бажано, включати ароматизатори, смакові добавки та/або підсолоджувачі. В подальшому переважному втіленні винаходу носії активного інгредієнта, забезпечені активним інгредієнтом, дифузійними шарами, шаром гастрорезистентного покриття, і, де прийнятно, резистентним щодо слини зовнішнім шаром, пресували у таблетки, використовуючи звичайні ексціпієнти, або наповнювали капсули, виготовлені з желатину, целюлози, крохмалю або похідних крохмалю, або перебувають у формі рідин або напівтвердих або твердих композицій для одержання суспензії або суспензійного гелю. Фармацевтичний препарат винаходу може бути одержаний, використовуючи відомі по суті процедури, наприклад, за допомогою носія активного інгредієнта, що перебуває наприклад у формі комерційно доступних гранул, що покриваються розчином або суспензією, що включає активний інгредієнт, зв'язувальну речовину, антиадгезивний агент і, де прийнятно, буферні речовини, забезпечуючи таким чином проміжний продукт, отриманий 13 95805 послідовно принаймні із двома дифузійними шарами, проникність яких для активного інгредієнта, що дифундує, зменшується від внутрішньої частини до зовнішньої, накладаючи гастрорезистентний шар покриття і, де прийнятно, забезпечуючи резистентний щодо слини зовнішній шар. З'ясувалося, що регулювання відповідно до винаходу вивільнення активного інгредієнта через внутрішній шар, що складається принаймні із двох дифузійних шарів, проникність яких для активного інгредієнта, що дифундує, зменшується, від внутрішньої частини до зовнішньої, має несподівану перевагу у порівнянні з іншими відомими композиціями - менше підвищення вивільнення активного інгредієнта, і, таким чином, отримуються бажані більш низькі рівні в крові активного інгредієнта з характеристиками вивільнення активного інгредієнта, що несподівано є ще більш сприятливим у порівнянні US 2004/0142035 А1 через той факт, що два шари, які відрізняються за дифузійною проникністю, накладені замість одного шару, що включає ці два матеріали з різними дифузійними характеристиками у формі суміші. Ця ситуація повинна бути пояснена більш докладно наступними прикладами й порівняльними прикладами. Дві дозовані форми є можливими й переважними для фармацевтичного препарату винаходу: 1. Капсула, що заповнена носіями активного інгредієнта, забезпеченими активним інгредієнтом, дифузійними шарами, шаром гастрорезистентного покриття й додатковим резистентним щодо слини зовнішнім шаром; 14 2. Таблетка, що була отримана пресуванням носіїв активного інгредієнта, забезпечених активним інгредієнтом, дифузійними шарами, шаром гастрорезистентного покриття й, де прийнятно, резистентним щодо слини зовнішнім шаром, використовуючи загальноприйнятні ексціпієнти. Таблетка може бути діленою й може або ковтатися з рідиною, взятою з прийнятною їжею в незначних кількостях, або розсмоктуватися, або може розпадатися в ротовій порожнині без бажаного вивільнення активного інгредієнта в тонкому кишечнику, що послаблює таким чином її дію, оскільки при цих типах введення таблетка розпадається в окремі або агломеровані носії активного інгредієнта, які містять активний інгредієнт, дифузійні шари й гастрорезистентний шар покриття, таким чином гарантуючи бажаний профіль вивільнення активного інгредієнта. Наявність резистентного щодо слини зовнішнього шару та типи введення фармацевтичних препаратів не приводить до руйнування гастрорезистентного шару завдяки рН умовам в ротовій порожнині, і, таким чином, активний інгредієнт не вивільняється в ротовій порожнині, а, як призначено, тільки в тонкому кишечнику. Приклад 1 Партія: 050046/2 Фармацевтичний препарат винаходу у формі гранул з вмістом активного інгредієнта 45 мг (1R,3r,5S)-3-[(гідроксидифенілацетил)окси]спіро[8азоніабіцикло[3.2.1]октан-8,1'-піролідиній]хлориду як активного інгредієнта на дозовану одиницю Інгредієнти для одержання носіїв активного інгредієнта, забезпечених активним інгредієнтом, перераховані в Таблиці 1 нижче. Таблиця 1 Композиція, призначення активного інгредієнта № 1 2 3 4 5 Вихідна речовина Активний інгредієнт* Нейтральні гранули Гідроксипропілметилцелюлоза (гіпромелоза) Тальк Полі етиленгліколь (макроголь 6000) Загальна кількість на дозу *(1R,3r,5S)-3[(Гідроксидифенілацетил)окси]спіро[8азоніабіцикло[3.2.1]октан-8,1'-піролідиній] хлорид Нейтральні гранули - цукрово-крохмальні гранули з розміром частинок у діапазоні від 0,1 до 3,0 мм. Активний інгредієнт, гідроксипропілметилцелюлоа і макроголь 6000 розчиняли у воді і тальк суспендували у розчині. Суспензію безпе мг на дозу 45,000 100,000 4,500 4,500 0,450 154,450 рервно розпилювали на носії активного інгредієнта в грануляторі з псевдозрідженим шаром, і одночасно висушували при температурі вхідного повітря 30-80°С. Згодом, дифузійний шар 1 наносили на носії активного інгредієнта, забезпечені активним інгредієнтом, використовуючи інгредієнти, зазначені в Таблиці 2 нижче: 15 95805 16 Таблиця 2 Композиція, застосування дифузійного шару для оптимізованого вивільнення активного інгредієнта № 1 2 3 4 5 Композиція дифузійного шару 1 Вихідна речовина Гранули активного інгредієнта (як у Таблиці 1) Полівінілацетат, стабілізований полівінілпіролідоном і лаурилсульфатом натрію (Kollicoat CEP 30 D) Співполімер полівініловий спирт-поліетиленгліколь (Kollicoat IR) Пропіленгліколь Тальк Загальна кількість на дозу Дифузійний шар 1 одержували розпиленням носіїв активного інгредієнта, які забезпечені активним інгредієнтом і отримані шляхом використання інгредієнтів, зазначених у Таблиці 1, з водною суспензією полівінілацетату, як матричного матеріалу і співполімером полівініловий спирт мг на дозу 154,450 9,000 1,8000 0,900 0,360 166,510 поліетиленгліколь як пороутворювачем, пропіленгліколем як пластифікатором і тальком як антиадгезивним агентом. Потім наносили дифузійний шар 2, використовуючи інгредієнти, зазначені в Таблиці 3 нижче: Таблиця 3 Композиція дифузійного шару 2 № 1 2 3 4 5 Стартовий матеріал Гранули активного інгредієнта із дифузійним шаром 1 (як у Таблиці 2) Полівінілацетат, стабілізований полівінілпіролідоном і лаурилсульфатом натрію (Kollicoat CEP 30 D) Співполімер полівініловий спирт-поліетиленгліколь (Kollicoat IR) Пропіленгліколь Тальк Загальна кількість на дозу Гранули активного інгредієнта, забезпечені активним інгредієнтом і дифузійним шаром 1 та отримані з використанням інгредієнтів, зазначених у Таблиці 2, розпилювали з водною суспензією полівінілацетату, як матричного матеріалу і співполімером полівінілового спиртуполіетиленгліколю як пороутворювачем, пропіленгліколем як пластифікатором і тальком як антиадгезивним агентом. Як видно, матеріал для утворення дифузійного шару 2 включає меншу кількість пороутворювача - співполімера полівінілового спирту-поліетиленгліколю й відповідно мг на дозу 166,510 9,000 0,405 0,900 0,360 177,175 приводить до дифузійного шару з більш низькою проникністю для активного інгредієнта, що дифундує (1R,3r,5S)-3[(гідроксидифенілацетил)окси]спіро[8азоніабіцикло[3.2.1]октан8,1'-піролідиній] хлориду. Носії активного інгредієнта, забезпечені двома дифузійними шарами, таким чином, згодом були забезпечені гастрорезистентним покриттям, використовуючи композицію, зазначену в Таблиці 4 нижче: Таблиця 4 Композиція, нанесення гастро-резистентного покриття № 1 2 3 4 5 Вихідна речовина Гранули активного інгредієнта із дифузійними шарами 1 і 2 (як у Таблиці 3) одна доза містить 45 мг активного інгредієнта Співполімер метакрилової кислоти-етилакрилату (Kollicoat MAE 30 DP) Тальк Пропіленгліколь Натрійкарбоксиметилцелюлоза (Tylopur C30 G1) Загальна кількість на дозу Гранули активного інгредієнта, отримані з дифузійними шарами 1 і 2, потім забезпечували шаром гастро-резистентного покриття, викорис мг на дозу 177,175 28,000 12,600 4,200 0,720 222,695 товуючи композицію, зазначену в Таблиці 4 вище, водну суспензію співполімера метакрилової кислоти-етилакрилату як матричний матеріал, про 17 95805 піленгліколь як пластифікатор, натрійкарбоксиметилцелюлозу як зв'язувальну речовину і тальк як антиадгезивний агент, безперервно напилювали на гранули активного інгредієнта, забезпечені дифузійними шарами 1 і 2, і одночасно висушували при температурі вхідного повітря 3580°С, одержуючи фармацевтичний препарат винаходу у формі гранул активного інгредієнта, забезпечених активним інгредієнтом. Приклад 2 (порівняльний) Партія: 050047 Для порівняння були одержані носії активного інгредієнта, забезпечені активним інгредієнтом, використовуючи ті ж самі інгредієнти й ті ж самі 18 співвідношення кількості, але включаючи інгредієнти дифузійних шарів 1 і 2 винаходу не в окремих шарах, а в єдиному дифузійному шарі. З цією метою одержували носії активного інгредієнта, забезпечені активним інгредієнтом (1R,3r,5S)-3[(гідроксидифенілацетил)окси)спіро[8азоніабіцикло[3.2.1]октан-8,1'піролідиній]хлоридом, використовуючи інгредієнти, зазначені в Таблиці 1 Прикладу 1, та забезпечували дифузійним шаром, використовуючи інгредієнти, перераховані в Таблиці 5 нижче: Таблиця 5 Композиція дифузійного шару 1+2, застосовуваного як суміш № 1 2 3 4 5 Вихідна речовина Гранули активного інгредієнта (як у Таблиці 1) Полівінілацетат, стабілізований полівінілпіролідоном і лаурилсульфатом натрію (Kollicoat CEP 30 D) Співполімер полівінілового спирту-поліетиленгліколю (Kollicoat IR) Пропіленгліколь Тальк Загальна кількість на дозу Гастро-резистентне покриття потім наносили відповідно до процедури Прикладу 1, використовуючи інгредієнти, зазначені у Таблиці 4 Прикладу 1, на гранули активного інгредієнта, забезпе мг на дозу 154,450 18,000 2,205 1,800 0,720 177,175 чені дифузійним шаром 1+2, застосовуваним як суміш, отриману таким чином, і отримували гранули композиції активного інгредієнта, вказаної в Таблиці 6 нижче: Таблиця 6 № 1 2 3 4 5 Вихідна речовина Гранули активного інгредієнта із дифузійним шаром 1+2 (як у Таблиці 5), одна доза містить 45 мг активного інгредієнта Співполімер метакрилової кислоти-етилакрилату (Kollicoat MAE 30 DP) Тальк Пропіленгліколь Натрійкарбоксиметилцелюлоза (Tylopur C30 G1) Загальна кількість на дозу Приклад 3 (порівняльний) Партія: 050046/1 Як додатковий порівняльний приклад, були одержані носії активного інгредієнта, які були забезпечені тільки активним інгредієнтом (1R,3r,5S)-3[(гідроксидифенілацетил)окси]спіро[8азоніабіцикло[3.2.1]октан8,1'піролідиній]хлоридом і не включали дифузійний шар або гастро-резистентне покриття, відповідно мг на дозу 177,175 28,000 12,600 4,200 0,720 222,695 до процедури Прикладу 1, використовуючи інгредієнти, зазначені у Таблиці 1, в результаті чого отримують носії активного інгредієнта, забезпечені активним інгредієнтом (1R,3r,5S)-3[(гідроксидифенілацетил)окси]спіро[8азоніабіцикло[3.2.1]октан8,1'піролідиній]хлоридом композиції, вказаної в Таблиці 7 нижче. Таблиця 7 № 1 2 3 4 5 Вихідна речовина Активний інгредієнт Нейтральні гранули Гідроксипропілметилцелюлоза [гіпромелоза) Тальк Поліетиленгліколь 6000 (макроголь 6000) Загальна кількість на дозу мг на дозу 45,000 100,000 4,5000 4,5000 0,450 154,450 19 95805 Приклад 4 (порівняльний) Партія: 050048 Цей порівняльний приклад відноситься до носіїв активного інгредієнта, забезпечених активним інгредієнтом (1R,3r,5S)-3[(гідроксидифенілацетил)окси]спіро[8азоніабіцикло[3.2.1]октан8,1'піролідиній]хлоридом і забезпечених лише одним дифузійним шаром, особливо дифузійним шаром 1 із Прикладу 1 представленого винаходу і шаром гастрорезистентного покриття. Вихідна речовина включає гранули активного інгредієнта, забезпечені активним інгредієнтом, що був отриманий відповідно до процедури При 20 кладу 1, використовуючи інгредієнти, зазначені у Таблиці 1. Ці носії активного інгредієнта забезпечені тільки дифузійним шаром 1, використовуючи інгредієнти і процедури, вказані для утворення дифузійного шару 1 у Прикладі 1, посилаючись на Таблицю 2. Застосування гастро-резистентного шару покриття відповідно до процедури Прикладу 1 і, використовуючи інгредієнти, зазначені у Таблиці 4, надає гранули активного інгредієнта, що містять активний інгредієнт композиції, вказаної в Таблиці 8 нижче: Таблиця 8 № 1 2 3 4 5 Вихідна речовина Гранули активного інгредієнта із дифузійним шаром 1, одна доза містить 45 мг активного інгредієнта Співполімер метакрилової кислоти-етилакрилату (Kollicoat MAE 30 DP) Тальк Пропіленгліколь Натрій карбоксиметилцелюлоза (Tylopur C30 G1) Загальна кількість на дозу Приклад 5 (порівняльний) Партія: 050049 Цей порівняльний приклад відноситься до носіїв активного інгредієнта, забезпечених активним інгредієнтом (1R,3r,5S)-3[(гідроксидифенілацетил)окси]спіро[8азоніабіцикло[3.2.1]октан8,1'піролідиній]хлоридом і забезпечений тільки дифузійним шаром 2 фармацевтичного препарату винаходу відповідно до Прикладу 1 і шаром гастро-резистентного покриття. мг на дозу 166,510 28,000 12,600 4,200 0,720 212,030 Вихідна речовина із цією метою включає носії активного інгредієнта, забезпечені активним інгредієнтом, що був одержаний, використовуючи інгредієнти, зазначені в Таблиці 1 Прикладу 1 відповідно до процедури, описаної там. Дифузійний шар 2 наносили на ці гранули активного інгредієнта, забезпечені активним інгредієнтом, використовуючи інгредієнти, зазначені в Таблиці 9 нижче й використовуючи процедуру, зазначену у зв'язку з Таблицею 3 у Прикладі 1. Таблиця 9 № 1 2 3 4 5 Вихідна речовина Гранули активного інгредієнта (як у Таблиці 1) Полівінілацетат, стабілізований полівінілпіролідоном і лаурилсульфатом натрію (Kollicoat CEP 30D) Співполімер полівінілового спирту-поліетиленгліколю (Kollicoat IR) Пропіленгліколь Тальк Загальна кількість на дозу Нанесення гастро-резистентного шару покриття відповідно до процедури Прикладу 1, використовуючи інгредієнти, зазначені у Таблиці 4, мг на дозу 154,450 9,000 0,405 0,900 0,360 165,115 забезпечує одержання гранул активного інгредієнта із дифузійним шаром 2 і композицією, зазначеною у Таблиці 10 нижче. Таблиця 10 Композиція, призначення гастро-резистентного покриття № 1 2 3 4 5 Вихідна речовина Гранули активного інгредієнта із дифузійним шаром 2 одна доза містить 45 мг активного інгредієнта Співполімер метакрилової кислоти-етилакрилату (Kollicoat MAE 30 DP) Тальк Пропіленгліколь Натрій карбоксиметилцелюлоза (Tylopur C30 G1) Загальна кількість на дозу мг на дозу 165,115 28,000 12,600 4,200 0,720 210,635 21 95805 Приклад 6 Дослідження in vitro вивільнення активного інгредієнта (1R,3r,5S)-3[(гідроксидифенілацетил)окси]спіро[8азоніабіцикло[3.2.1]октан8,1'-піролідиній] хлориду із гранул активного інгредієнта, одержаних як у Прикладах 1-5 вище. Щоб досліджувати вивільнення активного інгредієнта як функцію часу, використовували спосіб Фармакопеї США для визначення вивільнення продуктів з гастрорезистентним покриттям № 724 спосіб А, таким чином : Кислотна стадія Апарат: лопатева мішалка -1 Швидкість обертання: 200 хвилин Температура: 37 ± 0,5°С Середовище розчинення: 750 мл 0,1 М соляної кислоти. Дозу гранул активного інгредієнта, одержаних відповідно до вищезгаданих прикладів, вводили в апарат, посудину вкривали і вмикали лопатеву мішалку на 2 години. Потім брали зразок, щоб визначити активний інгредієнт - (1R,3r,5S)-3[(гідроксидифенілацетил)окси]спіро[8азоніабіцикло[3.2.1]октан 8,1'-піролідиній]хлорид. Буферна стадія 250 мл 0,20 М розчину триосновного фосфату натрію врівноважували при 37±0,5°С, додавали до кислотної стадії (750 мл 0,1М соляної кислоти). Значення рН доводили до 6,8 ± 0,05, якщо необхідно 2N соляною кислотою або 2N розчином гідроксиду натрію. Апарат працював протягом 2 годин, і потім зразки були взяті після 15, 30, 45, 60, 75, 90, 105 і 120 хвилин, і активний інгредієнт визначали за допомогою ВЕРХ. Еталонний розчин: 0,045 мг/мл(1R,3r,5S)-3[(гідроксидифенілацетил)окси]спіро[8азоніабіцикло[3.2.1]октан8,1'-піролідиній] хлориду RS в 0,1 N соляній кислоті. Умови ВЕРХ Хроматографію здійснювали, використовуючи: - колонку з нержавіючої сталі довжиною 0,125 м і внутрішнім діаметром 4 мм, заповнену окта 22 децилсиліловим гелем для хроматографічних цілей (5 мкм), особливо Nucleosil 100-5 С18; - суміш 65 об'ємів очищеної води, що містить 2,202 г/л гептансульфонату натрію і 0,4 мл/л триетиламін, яка була доведена до рН 2,5 концентрованою фосфорною кислотою, і 35 об'ємів ацетонітрилу, використовуваного як мобільна фаза. - спектрофотометр (DAD 210,10, 400,100 нм); встановлений при 210 нм, використовувався як детектор; - температура колонки підтримувалася при 40°С. - впорскували 25 мкл зразка рідини, і хроматографію здійснювали протягом приблизно 4,5 хвилин. Концентрація розчиненого (1R,3r,5S)-3[(гідроксидифенілацетил)окси]спіро[8азоніабіцикло[3.2.1]октан8,1'-піролідиній]хлориду була розрахована у відсотках, використовуючи наступне рівняння: Y = CR(W) AT(W)100/AR(w) CT(W), де Y: розчинений активний інгредієнт (1R,3r,5S)-3[(гідроксидифенілацетил)окси]спіро[8азоніабіцикло[3.2.1 ]октан8,1 '-піролідиній] хлорид (% встановленого вмісту) CT(W): номінальна концентрація активного інгредієнта в тестовому розчині (0,045 мг/мл) CR(W): концентрація активного інгредієнта в еталонному розчині AT(W): площа піку активного інгредієнта тестового розчину AR(W): площа піку еталонної речовини в еталонному розчині Результати вивільнення активного інгредієнта, отримані в цьому дослідженні гранул активного інгредієнта Прикладів 1 - 5, подано в Таблиці 11 нижче: PU040014 W45 таблетки MOF Гранули активного інгредієнта й гастрорезистентні гранули, що відрізняються по нанесенню дифузійних шарів Таблиця 11 Результати вивільнення активного інгредієнта* Приклад 3 (еталон). Приклад 1 Приклад 2 Приклад 4 Приклад 5 (винахід) (порівн.). (порівн.). (порівн.). Дифузійний шар Дифузійний шар Дифузійний шар Дифузійний шар Гранули активного Час тестуван1+2 1+2 1 2 інгредієнта без ня нанесений послі- нанесений як су- нанесений самос- нанесений самосдифузійного шару довно міш тійно тійно Партія 050046/1 050046/2 050047 050048 050049 0 0,00 0 0 0 0 15 98,02 0,76 73,94 101,02 7,02 30 98,30 8,14 91,12 101,24 34,27 45 98,39 29,89 97,84 101,03 67,08 60 98,47 51,13 98,75 101,20 81,80 75 98,65 65,47 99,59 101,25 88,84 23 95805 24 Продовження таблиці 11 90 105 120 98,56 98,49 98,68 74,35 80,03 84,09 *(1R,3r,5S)-3[(гідроксидифенілацетил)окси]спіро[8азоніабіцикло[3.2.1]октан-8,1'-піролідиній] хлорид Результати Таблиці 11 зображені графічно на Фігурі 1, наведеній далі, зокрема конструюванням кривої відсотка вивільнення активного інгредієнта як функції часу. Як видно з фігури 1, наведеної далі, фармацевтичний препарат (050046/2) винаходу демонструє кращу поведінку, як бажано відповідно до винаходу, вивільнення активного інгредієнта in vitro з повільним підвищенням і наступним майже постійним вивільненням активного інгредієнта, тоді як порівнювальні продукти, що не мають дифузійного шару (050046/1) або мають у кожному випадку тільки один дифузійний шар 1 або 2 (050049 і 050048), або гранули активного інгредієнта Прикладу 2, де інгредієнти двох дифузійних шарів 1 і 2 винаходу присутні в єдиному дифузійному шарі (050047), показують швидке підвищення кривих і, таким чином, небажане швидке вивільнення активного інгредієнта. Повинно бути розцінене несподіваним те, що фармацевтичний препарат винаходу, у якому внутрішній шар утворений принаймні із двох ди Комп’ютерна верстка Мацело М. 99,45 99,99 99,89 101,30 101,35 101,10 92,39 94,63 95,87 фузійних шарів, проникність яких для активного інгредієнта, що дифундує, зменшується від внутрішньої частини до зовнішньої, показує значно кращий профіль вивільнення активного інгредієнта, ніж гранули активного інгредієнта Прикладу 2, у якому ті ж самі інгредієнти для утворення двох дифузійних шарів винаходу, присутні в єдиному дифузійному шарі. Цей фармацевтичний препарат також показує небажано швидке вивільнення активного інгредієнта на початку, тому що приблизно 95 % вивільнені після лише 40 хвилин, у той час, як фармацевтичний препарат винаходу вивільняє тільки приблизно 20% активного інгредієнта. Таким чином, з фармацевтичним препаратом винаходу можливо досягти, у порівнянні з однократним введенням фармацевтичного продукту, що швидко вивільняє активний інгредієнт (1R,3r,5S)-3[(гідроксидифенілацетил)окси]спіро[8азоніабіцикло[3.2.1]октан8,1'-піролідиній] хлорид, більш повільного підвищення рівня активного інгредієнта в плазмі із загальним більш низьким рівнем у крові, і, таким чином, подолати недоліки звичайних засобів цього типу. Підписне Тираж 23 прим. Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюPharmaceutical preparation for oral administration with controlled active ingredient release in the small intestine and methods for its production
Автори англійськоюJung Gerd, Schaupp Albert
Назва патенту російськоюФармацевтический препарат для перорального приема с контролируемым высвобождением активного ингридиента в тонком кишечнике и способ его получения
Автори російськоюЮнг Герд, Шаупп Альберт
МПК / Мітки
МПК: A61K 9/54, A61K 9/16, A61K 9/22
Мітки: прийому, контрольованим, інгрідієнта, активного, кишечнику, спосіб, одержання, вивільненням, тонкому, перорального, препарат, фармацевтичний
Код посилання
<a href="https://ua.patents.su/12-95805-farmacevtichnijj-preparat-dlya-peroralnogo-prijjomu-z-kontrolovanim-vivilnennyam-aktivnogo-ingridiehnta-v-tonkomu-kishechniku-i-sposib-jjogo-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">Фармацевтичний препарат для перорального прийому з контрольованим вивільненням активного інгрідієнта в тонкому кишечнику і спосіб його одержання</a>
Попередній патент: Захисний пристрій
Наступний патент: Протипухлинна вакцина, що містить моноклональне антиідіотипове антитіло проти са-125 та алюміній
Випадковий патент: Суміш композиційна молочно-рослинна