Комплекс нуклеїнової кислоти і композиція для доставки нуклеїнової кислоти
Номер патенту: 97559
Опубліковано: 27.02.2012
Автори: Тойобуку Хідеказу, Такеуті Хірофумі, Тозука Юіті, Хіра Ясуюкі
Формула / Реферат
1. Комплекс нуклеїнової кислоти, який включає нуклеїнову кислоту і сильно розгалужений циклічний декстрин, де сильно розгалужений циклічний декстрин являє собою глюкан зі ступенем полімеризації 50-5000, який включає внутрішній розгалужений циклічний структурний фрагмент, утворений α-1,4-глюкозидними зв'язками і як мінімум одним α-1,6-глюкозидним зв'язком, і зовнішній розгалужений структурний фрагмент, зв'язаний із внутрішнім розгалуженим циклічним структурним фрагментом.
2. Комплекс нуклеїнової кислоти за п. 1, де кількість сильно розгалуженого циклічного декстрину складає від 1 до 4000 масових частин на одну масову частину нуклеїнової кислоти.
3. Комплекс нуклеїнової кислоти за п. 1 або 2, де нуклеїнова кислота являє собою siRNA.
4. Комплекс нуклеїнової кислоти за п. 1 або 2, який являє собою агрегат, одержаний змішуванням нуклеїнової кислоти із сильно розгалуженим циклічним декстрином у водному розчині.
5. Композиція для доставки нуклеїнової кислоти, яка включає комплекс нуклеїнової кислоти за будь-яким із пп. 1-4 і носій для доставки нуклеїнової кислоти.
6. Композиція для доставки нуклеїнової кислоти за п. 5, де носій для доставки нуклеїнової кислоти являє собою композицію, яка включає (А) діацилфосфатидилхолін, (В) як мінімум одну сполуку, вибрану з холестерину і катіонних ліпідів зі скелетом холестерину, і (С) первинний аліфатичний амін.
7. Композиція для доставки нуклеїнової кислоти за п. 6, де компонент (А) носія для доставки нуклеїнової кислоти являє собою діацилфосфатидилхолін, в якому ацильний фрагмент включає від 4 до 23 атомів вуглецю.
8. Композиція для доставки нуклеїнової кислоти за п. 6, де компонент (В) носія для доставки нуклеїнової кислоти являє собою холестерин.
9. Композиція для доставки нуклеїнової кислоти за п. 6, де компонент (С) носія для доставки нуклеїнової кислоти являє собою алкіламін, який включає від 10 до 20 атомів вуглецю.
10. Композиція для доставки нуклеїнової кислоти за п. 6, де мольне співвідношення компонентів (А):(В):(С) становить 5-9:1-5:1.
11. Композиція для доставки нуклеїнової кислоти за п. 6, де носій для доставки нуклеїнової кислоти являє собою ліпосомальний препарат, в якому оболонка ліпосом утворена компонентами (А)-(С).
12. Фармацевтична композиція для доставки нуклеїнової кислоти в клітину, яка включає композицію за будь-яким із пп. 5-11.
13. Застосування композиції для доставки нуклеїнової кислоти за будь-яким із пп. 5-11 для одержання фармацевтичного засобу для доставки нуклеїнової кислоти в клітину.
14. Спосіб доставки нуклеїнової кислоти в клітину, який включає стадію приведення композиції за будь-яким із пп. 5-11 у контакт із клітиною.
Текст
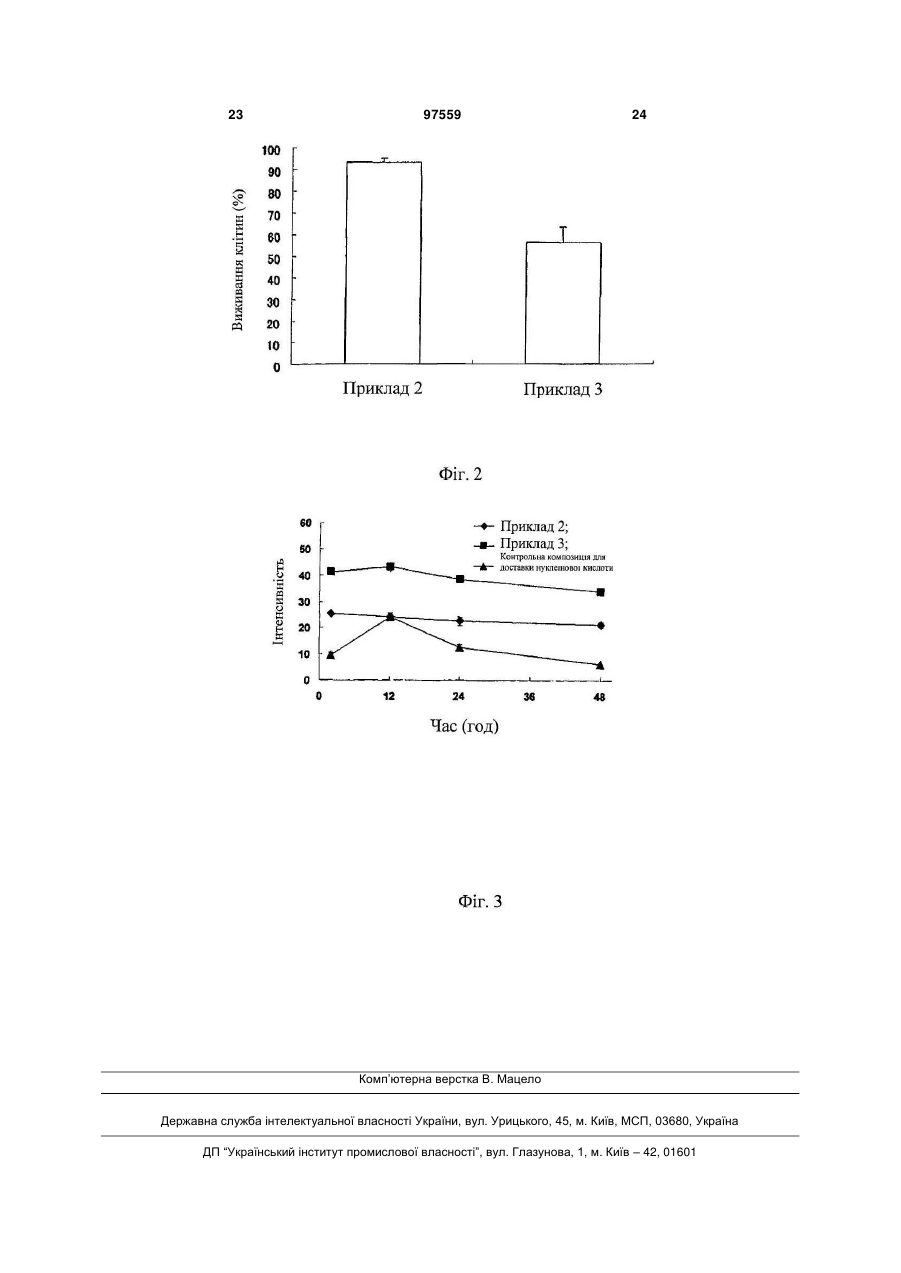
1. Комплекс нуклеїнової кислоти, який включає нуклеїнову кислоту і сильно розгалужений циклічний декстрин, де сильно розгалужений циклічний декстрин являє собою глюкан зі ступенем полімеризації 50-5000, який включає внутрішній розгалужений циклічний структурний фрагмент, утворений α-1,4-глюкозидними зв'язками і як мінімум одним α-1,6-глюкозидним зв'язком, і зовнішній розгалужений структурний фрагмент, зв'язаний із внутрішнім розгалуженим циклічним структурним фрагментом. 2. Комплекс нуклеїнової кислоти за п. 1, де кількість сильно розгалуженого циклічного декстрину складає від 1 до 4000 масових частин на одну масову частину нуклеїнової кислоти. 3. Комплекс нуклеїнової кислоти за п. 1 або 2, де нуклеїнова кислота являє собою siRNA. 4. Комплекс нуклеїнової кислоти за п. 1 або 2, який являє собою агрегат, одержаний змішуванням нуклеїнової кислоти із сильно розгалуженим циклічним декстрином у водному розчині. 5. Композиція для доставки нуклеїнової кислоти, яка включає комплекс нуклеїнової кислоти за будь-яким із пп. 1-4 і носій для доставки нуклеїнової кислоти. 2 (19) 1 3 Галузь техніки, до якої належить винахід Даний винахід стосується комплексу нуклеїнової кислоти, який здатний стійко знаходитися в клітині, маючи при цьому низьку токсичність і високий ступінь безпеки, а також композиції для доставки нуклеїнової кислоти. Рівень техніки Із розвитком біотехнології в останні роки був виявлений цілий ряд нуклеїнових кислот, що виявляють фізіологічну активність у клітинах. Наприклад, відомо, що siRNA (мала інтерферуюча РНК) спричиняє руйнування mRNA цільового гена в клітині і пригнічує експресію цільового гена (РНКінтерференція). Інгібуюча дія на експресію цільових генів внаслідок РНК-інтерференції є застосовною для полегшення або лікування симптомів захворювань, викликаних аномальною експресією певних генів або кластерів генів, й очікується розробка терапевтичних агентів, в яких застосовується siRNA. Однак, оскільки нуклеїнові кислоти є розчинними у воді макромолекулами, що несуть негативний заряд, ефективність їхньої доставки до внутрішньоклітинних генів є надзвичайно низькою, що призводить до неефективності генної терапії із застосуванням siRNA. Було відомо, що ефективній доставці генів у клітини сприяє застосування носія (вектора). Вектори включають вірусні вектори і невірусні вектори. Вірусні вектори виявляють високу ефективність при введенні нуклеїнових кислот у клітину; однак, є різні невідомі аспекти безпеки, що включають патогенність, імуногенність і цитотоксичність. Отже, для клінічних застосувань бажане застосування невірусних векторів. Приклади невірусних векторів включають Lipofectamin™2000, який у цей час є комерційно доступним. Далі, повідомлялося про катіонні ліпіди з особливою структурою (див. патентний документ 1), і композицію (див. патентний документ 2), що містить амфіфільну сполуку і полікатіон. Внутрішньоклітинну доставку нуклеїнових кислот із застосуванням невірусного вектора проводять, змішуючи на першій стадії нуклеїнову кислоту, доставку якої збираються здійснити, із цим невірусним вектором для утворення комплексу, і потім приводячи цей комплекс у контакт із цільовою клітиною. Якщо невірусний вектор може утворити ліпосому, цей вектор вводять у клітину з нуклеїновою кислотою, поміщеною в ліпосому, тим самим здійснюючи внутрішньоклітинну доставку нуклеїнової кислоти. Однак, такі нуклеїнові кислоти, як siRNA, мають специфічну особливість, яка полягає в низькій стабільності і значному електричному заряді. Тому при змішуванні з невірусним вектором зменшення стабільності нуклеїнової кислоти стає проблемою, яка перешкоджає безперервному надходженню нуклеїнової кислоти в клітину. Хоча був відомий приклад, в якому нуклеїнова кислота була захоплена ліпосомою за рахунок формування комплексу siRNA і катіонного полімеру (див. непатентний документ 1), це є незастосовним на практиці через цитотоксичність катіонного полімеру. Далі, навіть якщо може утворитися стабільний комплекс відомого невірусного вектора і нуклеїнової кислоти, 97559 4 цей комплекс може мати невисоку здатність проникати в клітину або ж може швидко доставлятися в клітину. Отже, такі відомі невірусні вектори не можуть забезпечити стійку наявність нуклеїнової кислоти в клітині, що не дозволяє зберігати бажані результати, які одержуються від дії нуклеїнової кислоти. З точки зору відомого рівня техніки, бажана розробка методик для ефективної доставки нуклеїнових кислот (наприклад, siRNA) у клітину і для стійкої підтримки наявності в клітині цих нуклеїнових кислот, що мають низьку токсичність і високу безпеку. Патентний документ 1: Japanese Unexamined Patent Publication No. 2002-529439 Патентний документ 2: Japanese Unexamined Patent Publication No. 2005-508394 Непатентний документ 1: Kentaro Kogure et al., Development of a non-viral-multifunctional-envelopetype nano device by a novel lipid film hydration method, J. Control. Release, 98 (2004) 317-323. Розкриття винаходу Проблеми, що вирішуються даним винаходом Завдання даного винаходу полягає в розв'язанні проблем відомого рівня техніки. Конкретно, завдання даного винаходу полягає в наданні комплексу нуклеїнової кислоти, що має низьку токсичність і високий ступінь безпеки, який здатний стійко забезпечувати наявність нуклеїнової кислоти, наприклад, siRNA або аналогічної, у клітині; а також композиції для доставки нуклеїнової кислоти, яка здатна ефективно доставляти комплекс нуклеїнової кислоти в клітину. Іншим завданням даного винаходу є надання фармацевтичної композиції, що включає композицію для доставки нуклеїнової кислоти, а також способу доставки нуклеїнової кислоти в клітину, шляхом приведення в контакт композиції для доставки нуклеїнової кислоти з клітиною. Засоби розв'язання зазначених проблем Автори даного винаходу провели численні дослідження для розв'язання зазначених вище проблем і виявили, що комплекс нуклеїнової кислоти, що має низьку токсичність і високий ступінь безпеки, який здатний стійко забезпечувати наявність нуклеїнової кислоти в клітині, може бути одержаний шляхом утворення комплексу нуклеїнової кислоти, яку збираються ввести в клітину, і сильно розгалуженого циклічного декстрину. Автори даного винаходу виявили далі, що безпека та ефективність внутрішньоклітинної доставки, а також внутрішньоклітинна стійкість нуклеїнової кислоти можуть бути додатково поліпшені застосуванням у ролі носія для доставки комплексу нуклеїнової кислоти в клітину, носія, що включає (А) діацилфосфатиділхолін, (В) холестерин і/або його похідне і (С) первинний аліфатичний амін. Робота над винаходом була завершена проведенням додаткових досліджень на основі цих даних. Суть даного винаходу може бути викладена в наступних абзацах: 5 Абзац 1. Комплекс нуклеїнової кислоти, що включає нуклеїнову кислоту і сильно розгалужений циклічний декстрин. Абзац 2. Комплекс нуклеїнової кислоти відповідно до абзацу, де кількість сильно розгалуженого циклічного декстрину складає від 1 до 4000 масових частин на одну масову частину нуклеїнової кислоти. Абзац 3. Комплекс нуклеїнової кислоти відповідно до абзацу 1 або 2, де нуклеїнова кислота являє собою siRNA. Абзац 4. Комплекс нуклеїнової кислоти відповідно до будь-якого з абзаців 1-3, де сильно розгалужений циклічний декстрин являє собою глюкан зі ступенем полімеризації 50-5000, що включає внутрішній розгалужений циклічний структурний фрагмент, утворений -1,4-глюкозидними зв'язками і як мінімум одним -1,6-глюкозидним зв'язком, і зовнішній розгалужений структурний фрагмент, зв'язаний із внутрішнім розгалуженим циклічним структурним фрагментом. Абзац 5. Комплекс нуклеїнової кислоти відповідно до будь-якого з абзаців 1-4, який являє собою агрегат, одержаний змішуванням нуклеїнової кислоти із сильно розгалуженим циклічним декстрином у водному розчині. Абзац 6. Композиція для доставки нуклеїнової кислоти, що включає комплекс нуклеїнової кислоти відповідно до будь-якого з абзаців 1-5 і носій для доставки нуклеїнової кислоти. Абзац 7. Композиція для доставки нуклеїнової кислоти відповідно до абзацу 6, де носій для доставки нуклеїнової кислоти являє собою композицію, що включає (А) діацилфосфатиділхолін, (В) як мінімум одну сполуку, вибрану з холестерину і його похідних і (С) первинний аліфатичний амін. Абзац 8. Композиція для доставки нуклеїнової кислоти відповідно до абзацу 7, де компонент (А) носія для доставки нуклеїнової кислоти являє собою діацилфосфатиділхолін, в якому ацильний фрагмент включає від 4 до 23 атомів вуглецю. Абзац 9. Композиція для доставки нуклеїнової кислоти відповідно до абзацу 7, де компонент (В) носія для доставки нуклеїнової кислоти являє собою холестерин. Абзац 10. Композиція для доставки нуклеїнової кислоти відповідно до абзацу 7, де компонент (С) носія для доставки нуклеїнової кислоти являє собою алкіламін, що включає від 10 до 20 атомів вуглецю. Абзац 11. Композиція для доставки нуклеїнової кислоти відповідно до абзацу 7, де мольне співвідношення компонентів (А):(В):(С) становить 5-9:1-5:1. Абзац 12. Композиція для доставки нуклеїнової кислоти відповідно до абзацу 7, де носій для доставки нуклеїнової кислоти являє собою ліпосомальний препарат, в якому оболонка ліпосом утворена компонентами (А)-(С). Абзац 13. Фармацевтична композиція, що включає композицію для доставки нуклеїнової кислоти відповідно до будь-якого абзацу 6-12. Абзац 14. Фармацевтична композиція відповідно до абзацу 13, де нуклеїнова кислота являє собою siRNA. 97559 6 Абзац 15. Застосування композиції для доставки нуклеїнової кислоти відповідно до будь-якого абзацу 6-12 для одержання фармацевтичного засобу для доставки нуклеїнової кислоти в клітину. Абзац 16. Застосування відповідно до абзацу 15, де нуклеїнова кислота являє собою siRNA. Абзац 17. Спосіб доставки нуклеїнової кислоти в клітину, де зазначений спосіб включає стадію приведення композиції для доставки нуклеїнової кислоти відповідно до будь-якого абзацу 6-12 у контакт із клітиною. Абзац 18. Спосіб відповідно до абзацу 17, де нуклеїнова кислота являє собою siRNA. Ефекти винаходу Комплекс нуклеїнової кислоти за даним винаходом одержують із нуклеїнової кислоти і сильно розгалуженого циклічного декстрину, що дає можливість одержати комплекс нуклеїнової кислоти з високим ступенем безпеки і постійно підтримувати присутність нуклеїнової кислоти в клітині протягом тривалого періоду часу так, щоб міг стійко виявлятися корисний ефект від дії нуклеїнової кислоти. Далі, комплекс нуклеїнової кислоти за даним винаходом може бути легко перетворений у комплекс із носієм для доставки нуклеїнової кислоти і може бути навіть легко інкапсульований у носій для доставки нуклеїнової кислоти в ліпосомальній формі. Отже, комплекс за даним винаходом має відмінні характеристики з точки зору легкості включення до складу композиції для доставки нуклеїнових кислот. Крім того, композиція для доставки нуклеїнових кислот за даним винаходом має здатність вводити комплекс нуклеїнової кислоти в клітину. Для доставки комплексу нуклеїнової кислоти за даним винаходом у клітину, застосування носія, що включає (А) діацилфосфатиділхолін, (В) холестерин і/або його похідне і (С) первинний аліфатичний амін, у ролі носія для внутрішньоклітинної доставки, може збільшити ефективність внутрішньоклітинної доставки комплексу нуклеїнової кислоти, а також здатне додатково поліпшити стабільність і безпеку такої внутрішньоклітинної доставки. Як зазначено вище, комплекс нуклеїнової кислоти і композиція для доставки нуклеїнової кислоти за даним винаходом можуть демонструвати корисні результати завдяки ефективності, стійкості і високому ступеню безпеки; отже зазначені комплекс і композиція є особливо застосовними як лікарські засоби для генної терапії. Таким чином, фармацевтична композиція або спосіб доставки нуклеїнової кислоти в клітину за даним винаходом, здатні забезпечити ефективнішу доставку нуклеїнової кислоти в клітину. Кращі варіанти здійснення даного винаходу Далі у тексті даний винахід описаний більш детально. (1) Комплекс нуклеїнової кислоти Комплекс нуклеїнової кислоти за даним винаходом включає нуклеїнову кислоту і сильно розгалужений циклічний декстрин. Нуклеїнова кислота, що входить у комплекс за даним винаходом, не обмежена за типом або структурою, якщо тільки існує необхідність доста 7 вити її в клітину. Конкретні приклади таких нуклеїнових кислот включають siRNA, mRNA, tRNA, rRNA, cDNA, miRNA (мікроРНК), рибозими, антисмислові олігонуклеотиди, олігонуклеотидні пастки, плазмідні ДНК, пептид-нуклеїнові кислоти, триплекс-утворювальні олігонуклеотиди (TFOs), аптамери, гени і т.д., причому серед перерахованих прикладів переважними є siRNA. Недолік siRNA полягає в низькій стабільності в присутності відомих раніше невірусних векторів, але якщо перетворити siRNA у комплекс нуклеїнової кислоти за даним винаходом, вона набуває здатність безперервно доставлятися в клітину, як ніби вона мала чудову стабільність. Нуклеїнова кислота, що застосовується в комплексі нуклеїнової кислоти за даним винаходом, може бути одержана з організмів людей, тварин, рослин, бактерій, вірусів і т.ін., або може бути синтезована хімічним шляхом. Ці нуклеїнові кислоти можуть бути однонитковими, двонитковими або тринитковими і не обмежені за молекулярною масою. Крім того, у даному винаході можуть застосовуватися нуклеїнові кислоти, модифіковані хімічними реагентами, ферментами або пептидами. Крім цього у даному винаході нуклеїнові кислоти можуть застосовуватися окремо або у вигляді комбінації двох або більшої кількості кислот. Сильно розгалужений циклічний декстрин, що застосовується в комплексі нуклеїнової кислоти за даним винаходом, одержують дією розгалуженого ферменту на сахарид, що включає -1,4-глікозидні зв'язки та як мінімум однин -1,6-глікозидний зв'язок, наприклад, амілопектин, і він являє собою глюкан зі ступенем полімеризації від 50 до 5000, що містить внутрішній розгалужений циклічний структурний фрагмент і зовнішній розгалужений структурний фрагмент. Внутрішній розгалужений циклічний структурний фрагмент являє собою циклічний структурний фрагмент, утворений -1,4глікозидними зв'язками і як мінімум одним -1,6глікозидним зв'язком; і зовнішній розгалужений структурний фрагмент являє собою нециклічний структурний фрагмент, зв'язаний із внутрішнім розгалуженим циклічним структурним фрагментом. Зовнішній розгалужений структурний фрагмент зв'язаний із внутрішнім розгалуженим циклічним структурним фрагментом як мінімум одним 1,6-глікозидним зв'язком. Переважні форми сильно розгалуженого циклічного декстрину включають згаданий вище глюкан, в якому внутрішній розгалужений циклічний структурний фрагмент має ступінь полімеризації від 10 до 100, згаданий вище глюкан, в якому зовнішній розгалужений структурний фрагмент має ступінь полімеризації 40 або вище і згаданий вище глюкан, в якому окремі ланцюги зовнішнього розгалуженого структурного фрагмента мають середній ступінь полімеризації від 10 до 20. Сильно розгалужений циклічний декстрин може, наприклад, являти собою молекулу, показану на фіг. 1, в якій внутрішній розгалужений циклічний структурний фрагмент помічений символом (і), і зовнішній розгалужений структурний фрагмент помічений символом (іі). Ступінь полімеризації можна визначити способом гель-фільтрації з використанням диференціа 97559 8 льного рефрактометра, виходячи з положення речовини з відомим ступенем полімеризації. За цих вимірювань, дані диференціального рефрактометра пропорційні концентрації глюкану, і дані фотометра розсіювання лазерного випромінювання під малими кутами пропорційні ступеню полімеризації продукту і концентрації глюкану. Отже, ступінь полімеризації глюкану можна визначити вимірюванням співвідношення даних двох зазначених приладів, тобто диференціального рефрактометра і фотометра розсіювання лазерного випромінювання під малими кутами. Конкретні умови описані в US 6248566В1 (патент Японії № 3107358). Сильно розгалужений циклічний декстрин і спосіб його одержання описані в US 6248566B1 (патент Японії № 3107358), причому сильно розгалужений циклічний декстрин продається під зареєстрованою товарною маркою "Cluster Dextrin" компанією Ezaki Glico Co., Ltd. У комплексі нуклеїнової кислоти за даним винаходом, співвідношення сильно розгалуженого циклічного декстрину і нуклеїнової кислоти не обмежене, але, як правило, воно складає від 1 до 4000 масових частин, переважно від 10 до 1000 масових частин і переважніше від 100 до 400 масових частин сильно розгалуженого циклічного декстрину на одну частину нуклеїнової кислоти. У величинах мольних співвідношень, наведені вище співвідношення складають, наприклад, від 0,1 до 1000 молів, переважно від 1 до 100 молів і переважніше від 10 до 20 молів сильно розгалуженого циклічного декстрину на моль нуклеїнової кислоти. Відповідність наведеним вище співвідношенням дає можливість добитися ще більш виняткової безперервності внутрішньоклітинної доставки нуклеїнової кислоти за допомогою носія для доставки нуклеїнової кислоти та її безпеки. Середній діаметр частинок комплексу нуклеїнової кислоти за даним винаходом як правило складає від 6 до 60 нм, переважно від 8 до 30 нм і переважніше від 10 до 20 нм. Середній діаметр частинок комплексу нуклеїнової кислоти вимірюють як діаметр частинок середнього об'єму із застосуванням способу динамічного розсіювання лазерного випромінювання. Комплекс нуклеїнової кислоти за даним винаходом являє собою комплекс, утворений шляхом агрегації нуклеїнової кислоти і сильно розгалуженого циклічного декстрину. Комплекс нуклеїнової кислоти за даним винаходом одержують змішуванням нуклеїнової кислоти і сильно розгалуженого циклічного декстрину в розчині, в якому можна стійко диспергувати дві ці речовини. Конкретні приклади розчинів, в яких можна стійко диспергувати нуклеїнову кислоту і сильно розгалужений циклічний декстрин, включають буферні розчини, такі як Tris і т.ін. Ці буферні розчини можуть містити хелатуючі засоби, наприклад, етилендіамінтетраоцтову кислоту (ЕДТО) і т.ін. Умови змішування нуклеїнової кислоти і сильно розгалуженого циклічного декстрину, як у разі згаданого вище розчину, можуть бути наприклад, наступними: приблизно 0,1 мкМ - 100 мкМ, переважно приблизно 1 мкМ - 10 мкМ нуклеїнової кис 9 лоти змішують із приблизно 1мкМ - 1000 мкМ і переважно приблизно 10мкМ - 100 мкМ сильно розгалуженого циклічного декстрину, при кімнатній температурі протягом приблизно 1-100 хвилин і переважно від приблизно 5 до приблизно 10 хвилин. Одержаний таким чином комплекс нуклеїнової кислоти за даним винаходом утворюється у вигляді дисперсії в розчині. Ця дисперсія може бути безпосередньо або, за необхідності, після розведення або концентрування, змішана з носієм для доставки нуклеїнової кислоти. (2) Композиція для доставки нуклеїнової кислоти Комплекс нуклеїнової кислоти вводять у носій для доставки нуклеїнової кислоти шляхом змішування з цим носієм, і за рахунок цього з'являється можливість доставки нуклеїнової кислоти в клітину. Тобто у даному винаході розроблена також композиція для доставки нуклеїнової кислоти, що включає комплекс нуклеїнової кислоти і носія для доставки нуклеїнової кислоти. Носій для доставки нуклеїнової кислоти являє собою невірусний вектор, що застосовується у ролі носія нуклеїнової кислоти для доставки (введення) нуклеїнової кислоти в клітину. Композиція для доставки нуклеїнової кислоти являє собою композицію, що застосовується для приведення нуклеїнової кислоти в контакт із клітиною, в яку збираються доставити нуклеїнову кислоту, із метою введення нуклеїнової кислоти, що міститься в композиції в клітину. Склад носія для доставки нуклеїнової кислоти Склад носія для доставки нуклеїнової кислоти, що застосовується в композиції для доставки нуклеїнової кислоти за даним винаходом, не має обмежень, за умови, що він здатний вводити нуклеїнову кислоту в клітину. Приклади застосовних носіїв для доставки нуклеїнових кислот включають відомі носії, наприклад Lipofectamine™ 2000 і т.ін. З точки зору подальшого поліпшення внутрішньоклітинної стійкості нуклеїнової кислоти, що міститься в комплексі нуклеїнової кислоти, і додаткового поліпшення ефективності та безпеки внутрішньоклітинної доставки, переважно застосовувати, наприклад, носій, що включає (А) діацилфосфатиділхолін, (В) холестерин і/або його похідне і (С) первинний аліфатичний амін (далі у тексті "носій, що іменується 1"). На діацилфосфатиділхолін (що іноді далі у тексті іменується "Компонент (А)"), що застосовується в носії 1, не накладається ніяких обмежень, якщо він є фармакологічно прийнятним, і він може являти собою, наприклад, діацилфосфатиділхолін, в якому ацильний фрагмент містить від 4 до 23 атомів вуглецю. Кількість атомів вуглецю в двох ацильних групах, що входять у діацилфосфатиділхолін, може бути однаковою або різною. Конкретні приклади діацилфосфатиділхолінів включають дилауроїлфосфатиділхолін, диміристоїлфосфатиділхолін, дипальмітоїлфосфатиділхолін, дистеароїлфосфатиділхолін, діолеоїлфосфатиділхолін, дилінолеоїлфосфатиділхолін, міристоїлпальмітоїлфосфатиділхолін, міристоїлстеароїлфосфатиділхолін, пальмітоїлстеароїлфос 97559 10 фатиділхолін, дибутилоїлфосфатиділхолін, дигексаноїлфосфатиділхолін, дигептаноїлфосфатиділхолін, дидеканоїлфосфатиділхолін, дифтаноїлфосфатиділхолін, дидодецилфосфатиділхолін, діейкозаноїлфосфатиділхолін, дигенейкозаноїлфосфатиділхолін, диерукоїлфосфатиділхолін, діарахідоноїлфосфатиділхолін, біс(трикозадиноїл)фосфатиділхолін і т.д. Переважні приклади з кількості перерахованих сполук включають діацилфосфатиділхоліни, в яких ацильний фрагмент включає від 12 до 18 атомів вуглецю; більш переважні приклади включають диміристоїлфосфатиділхолін, дипальмитоїлфосфатиділхолін, дистеароїлфосфатиділхолін, міристоїлпальмитоїлфосфатиділхолін, міристоїлстеароїлфосфатиділхолін, пальмітоїлстеароїлфосфатиділхолін і подібні діацилфосфатиділхоліни, в яких ацильний фрагмент включає від 13 до 17 атомів вуглецю; особливо переважні приклади включають диміристоїлфосфатиділхолін, дипальмітоїлфосфатиділхолін і дистеароїлфосфатиділхолін; і найбільш переважним прикладом є дистеароїлфосфатиділхолін. Перераховані діацилфосфатиділхоліни можуть застосовуватися окремо або в комбінації з двох або декількох сполук. Вибір холестерину і/або його похідного (що іноді далі у тексті іменується "компонентом В"), що застосовується в носії 1, не обмежений, у випадку якщо вони є фармакологічно прийнятними. Похідними холестерину є катіонні ліпіди зі скелетом холестерину, та їхні конкретні приклади включають 3-[N-(N',N'-диметиламіноетан)карбамоїл]холестерин (DC-Chol), 3-[N',N',N'триметиламіноетан]холестерину йодид (TC-Chol), біс(гуанідиній)-трен-холестерин (BGTC), Nхолестерилоксикарбоніл-3,7-діазанонан-1,94 диамін, -аланін-діетаноламін-холестерин, N 4 cпермін холестерил карбамат (GL-67), N[N -3амінопропілспермідин]холестерил карбамат (GL4 78), N -спермін холестерил карбоксамід (GL-90), 1 8 4 N ,N -бic(apгінін карбоксамід)-N -спермідин холес1 4 8 терил карбамат (GL-95) і N-[N ,N ,N -трис(3амінопропіл)спермідин]холестерил карбамат (GL96). Переважні приклади компонента (В) включають холестерин. У носії 1 холестерин і його похідні можуть застосовуватися як компонент (В) окремо або у вигляді комбінації з двох або більше сполук. Вибір первинного аліфатичного аміну (що далі у тексті іноді званого "компонентом (С)"), що застосовується в носії 1 не обмежений, у випадку якщо він є фармакологічно прийнятним, і цей амін може являти собою, наприклад, алкіламін, в якому алкільний фрагмент включає від 10 до 20 атомів вуглецю. Конкретні приклади первинних аліфатичних амінів включають лауриламін, міристиламін, пальмітиламін, стеариламін, олеїламін, деканоїламін, фтаноїламін і т.д. Серед перерахованих переважними є алкіламіни, в яких алкільний фрагмент включає від 12 до 18 атомів вуглецю; більш переважними є стеариламін, олеїламін і пальмітоїламін; і особливо переважним є стеариламін. Ці первинні аліфатичні аміни можуть застосовуватися окремо або в комбінації з двох або більше сполук. 11 Носій 1 включає комбінацію компонентів (А)(С), описаних вище. Для подальшого поліпшення ефективності внутрішньоклітинної доставки нуклеїнової кислоти і подальшого зниження токсичності, переважними є наступні комбінації: (А) діацилфосфатиділхолін, в якому ацильний фрагмент містить від 4 до 23 атомів вуглецю, (В) холестерин і/або його похідне і (С) С10-20 алкіламін; і переважніше, (А) диміристоїлфосфатиділхолін, дипальмітоїлфосфатиділхолін і/або дистеароїлфосфатиділхолін, (В) холестерин і (С) стеариламін. У носії 1 співвідношення компонентів (А)-(С) не обмежується і, наприклад, мольне співвідношення компонентів (А):(В):(С) може становити 5-9:1-5:1, переважно 6-9:1-4:1 і переважніше 7-8:2-3:1. Відповідність цим співвідношенням робить можливим добитися внутрішньоклітинної доставки нуклеїнової кислоти з найвищою ефективністю і меншою токсичністю. Загальна кількість компонентів (А)-(С) стосовно загальної маси носія 1 складає, наприклад, від 1 до 100 мас.%, переважно від 20 до 90 мас.% і переважніше від 30 до 70 мас.%. Крім компонентів (А)-(С), носій 1 може містити інші катіонні ліпіди. Конкретні приклади застосовних катіонних ліпідів включають скваламін, 3а, 7а, 12а-трис(3-амінопропокси)-5-холан-24-(N,N-біс(3амінопропіл)амін), 3а,7а, 12а-трис(3амінопропокси)-5-xoлан-24-(N-(N-(3амінопропіл))-3-амінопропіл)амін, 3а,7а,12атрис(3-азидопропокси)-5-холан-24-(N,N-біс(2ціаноетил)амін), 3а,7а, 12а-трис(3-азидопропокси)5-холан-24-(N-(бензилоксикарбоніл)-N-(3гідроксипропіл)амін) і подібні катіонні ліпіди, з якими зв'язані стероїди; "молекулярні "парасольки", що є кон'югатами сперміну, і подібні катіонні ліпіди, з якими зв'язана холева кислота; катіонні ліпіди, з якими зв'язаний глікозид стерину; катіонні ліпіди, з якими зв'язаний стероїд сапонін; диметилдіоктадециламонію бромід (DDAB), 1,2-диміристоїл-3триметиламоній пропан, 1,2-діолеоїл-3триметиламоній пропан (DOTAP), 1,2-діолеоїл-3триметиламоній пропан метилсульфат, 1,2дипальмітоїл-3-триметиламоній пропан, 1,2дистеароїл-3-триметиламоній пропан, N-(1-(2,3біс(олеоїлокси)пропіл)-N,N,N-триметиламонію гідрохлорид (DOTMA), сіль диміристоїлоксипропіл диметилгідроксіетиламонію бромід (DMRIE), діолеоїлоксипропіл диметилгідроксиетиламонію бромід (DORIE), диметилдидодециламонію бромід, N(а-триметиламонійацетил)додецил-D-глутаміну гідрохлорид, N-(а-триметиламонійацетил)-О,О'біс-(1Н,1Н,2Н,2Н-перфтордецил)-L-глутаміну гідрохлорид, О,О'-дидодеканоїл-N-(атриметиламонійацетил)діетаноламіну гідрохлорид, метилаліл дидодецил амонію бромід, N-{р-(wтриметиламонійбутилокси)бензоїл} дидодецил-Lглутаміну гідрохлорид, 9-(wтриметиламонійбутил)-3,6біс(додеканоїл)карбазолу бромід, диметилдіоктадецил амонію гідрохлорид, N-wтриметиламонійдеканоїл-дигексадецил-Оглутаміну бромід, N-{p-(wтриметиламонійгексилокси)бензоїл}дитетрадецил 97559 12 L-глутаміну бромід, p-(wтриметиламонійдецилокси)-р'-октилоксіазобензолу бромід (МС-1-0810), p-{w-(bгідроксіетил)диметиламонійдецилокси}-р'октилоксіазобензолу бромід (МС-3-0810), O,O',O"тридодеканоїл-N-(w-триметиламонійдодеканоїл)трис(гідроксиметил)амінометану бромід (ТС-1-12), 1,2-дилаурил-гліцеро-3-етилфосфохолін, 1,2диміристоїл-гліцеро-3-етилфосфохолін, 1,2дипальмітоїл-гліцеро-3-етилфосфохолін, 1,2дистеароїл-гліцеро-3-етилфосфохолін, 1,2діолеоїл-гліцеро-3-етилфосфохолін, 1-пальмітоїл2-олеоїл-гліцеро-3-етилфосфохолін і подібні катіонні ліпіди, що включають четвертині амонієві солі. Якщо носій 1 містить катіонний ліпід, що відрізняється від компонентів (А)-(С), частка цього катіонного ліпіду не обмежена, доти, поки не порушується ефект від даного винаходу, і ця частка може складати, наприклад, від 1 до 10 частин за масою, переважно від 2 до 8 частин за масою і переважніше від 4 до 6 частин за масою, на 100 частин за масою компонентів (А)-(С) разом. Далі, носій 1 може за необхідності включати масляну основу. Додавання масляної основи дозволяє використати її здатність регулювати ефективність введення нуклеїнової кислоти за участі носія 1. Наприклад, якщо масляну основу додають для того, щоб відрегулювати питому вагу носія 1, можна керувати контактом клітини з носієм 1, тим самим поліпшуючи ефективність введення in vitro. Далі, наприклад, якщо додають масляний носій із функцією температурної чутливості, ядро носія, що містить нуклеїнову кислоту, може руйнуватися в попередньо визначених температурних умовах, викликавши неоднорідність на клітинній поверхні і поліпшивши, тим самим ефективність введення нуклеїнової кислоти. Крім того, наприклад, якщо додана масляна основа, яка має здатність руйнуватися при зовнішніх впливах, ядро носія 1 може бути зруйноване цими зовнішніми впливами, спричинивши появу неоднорідності на клітинній поверхні, що поліпшує ефективність введення нуклеїнової кислоти. Приклади масляних основ, які можуть бути додані до носія 1, включають перфторвуглець, перфторпентан, перфтороктил бромід, перфторгексан, перфтортрибутиламін, соєву олію, рафіновану соєву олію, гідровану соєву олію, неомилену соєву олію, сквален, рицинову олію, гвоздичну олію, сорбітану триолеат, терпентинове масло, сафлорове масло, жирні кислоти сафлорового масла, олеїнову кислоту, пальмову олію, ріпакову олію, сивушне масло, оливкову олію, лляну олію, кунжутну олію, хлорофільну олію, кротонове масло, олію бергамота, кедрову олію, апельсинову олію, фенхелеву олію, евкаліптову олію, кукурудзяну олію, лавандову олію, майоранову олію, лимонну олію, бавовняну олію, кокосову олію, масло яєчних жовтків, трояндову олію, хвойну олію, мигдалеву олію, арахісову олію, олію камелії, очищену камфорну олію, олію ромашки звичайної, коричну олію, олію м'яти перцевої, етерифіковану кукурудзяну олію, імбирну олію, олію римської ромашки, олію горця зміїного, олію м'яти кучерявої, 13 соняшникову олію, какао-олію, олію проростків пшениці, масло з оксидом цинку, гідровані масла, гідровані рослинні олії, легкий рідкий парафін, рідкий парафін, тригліцериди жирних кислот із середньою довжиною ланцюга, молочний жир, гірку апельсинову олію, поліоксіетилен рицинову олію, поліоксіетилен гідровану рицинову олію 10, поліоксіетилен гідровану рицинову олію 100, поліоксіетилен гідровану рицинову олію 20, поліоксіетилен гідровану рицинову олію 40, поліоксіетилен гідровану рицинову олію 5, поліоксіетилен гідровану рицинову олію 50, поліоксіетилен гідровану рицинову олію 60, поліоксил 35 рицинову олію, технологічні масла і т.д. Серед перерахованих масляних основ перфторпентан є чутливим до температури і має властивість закипати при температурі 29,5°С, перетворюючись у газ. Крім того, перфторгексан, перфтороктилбромід і перфтортрибутиламін мають здатність руйнуватися при зовнішніх впливах і мають властивість спричиняти утворення пір в ядрі носія 1 і руйнувати його при одержанні зовнішнього сигналу, а саме ультразвукового впливу. Якщо масляна основа включена до складу носія, її частка не обмежена доти, поки це не перешкоджає одержанню ефекту даного винаходу, і ця частка може складати, наприклад, від 0,1 до 50 частин за масою, переважно від 1 до 30 частин за масою і переважніше від 5 до 20 частин за масою на 100 частин сукупної маси компонентів (А)-(С). Далі, носій 1 за необхідності може включати мембранно-фузогенний ліпід (допоміжний ліпід). При наявності мембранно-фузогенного ліпіду, ефективність внутрішньоклітинної доставки з участю носія 1 додатково поліпшується. Приклади таких мембранно-фузогенних ліпідів включають діолеоїлфосфатиділетаноламін, діолеоїлфосфатиділхолін, трансфосфатиділфосфатиділетаноламін, 1,2-біс-(10,12трикозадиноїл)фосфоетаноламін, 1,2діелаідоїлфосфоетаноламін, 1,2дигексадецилфосфоетаноламін, 1,2дигексаноїлфосфоетаноламін, 1,2дилауроїлфосфоетаноламін, 1,2дилінолеоїлфосфоетаноламін, 1,2диміристоїлфосфоетаноламін, 1,2діолеоїлфосфоетаноламін, 1,2дипальмітолеоїлфосфоетаноламін, 1,2дипальмітоїлфосфоетаноламін, 1,2дифітаноїлфосфоетаноламін, 1,2дистеароїлфосфоетаноламін, 1-пальмітоїл-2олеоїлфосфоетаноламін, 1-пальмітоїл-2-(10,12трикозадиноїл)фосфоетаноламін, 1,2діолеоїлфосфоетаноламін-N-капроїламін, 1,2дипальмітоїлфосфоетаноламін-N-капроіламін, 1,2діолеоїлфосфоетаноламін-N,N-диметил, 1,2дипальмітоїлфосфоетаноламін-N,N-диметил, 1,2дипальмітоїлфосфоетаноламін-N-додеканоїл, 1,2діолеоїлфосфоетаноламін-N-додеканоїл, 1,2діолеоїлфосфоетаноламін-N-додеканіламін, 1,2дипальмітоїлфосфоетаноламін-N-додеканіламін, 1,2-діолеоїлфосфоетаноламін-N-глутарил, 1,2дипальмітоїлфосфоетаноламін-N-глутарил, 1,2діолеоїлфосфоетаноламін-N-лактозу, 1,2діолеоїлфосфоетаноламін-N-[4-(рмалеімідметил)циклогексанкарбоксилат], дипаль 97559 14 мітоїлфосфоетаноламін-N-[4-(рмалеімідметил)циклогексанкарбоксилат], 1,2дипальмітоїлфосфоетаноламін-N-[4-(рмалеімідфеніл)бутиламід], 1,2діолеоїлфосфоетаноламін-N-[4-(рмалеімідфеніл)бутират], 1,2діолеоїлфосфоетаноламін-N-метил, дипальмітоїлфосфоетаноламін-N-метил, 1,2діолеоїлфосфоетаноламін-N-[3-(2піридилдитіо)пропіонат], 1,2дипальмітоїлфосфоетаноламін-N-[3-(2піридилдитіо)пропіонат], 1,2діолеоїлфосфоетаноламін-N-(сукциніл), 1,2дипальмітоїлфосфоетаноламін-N-(сукциніл) і т.д. Серед перерахованих ліпідів у носії 1 може переважно застосовуватися діолеоїлфосфатиділетаноламін. Якщо зазначений мембранно-фузогенний ліпід включений до складу носія 1, його частка не обмежена доти, поки це не перешкоджає одержанню ефекту даного винаходу, і ця частка може складати, наприклад, від 1 до 500 частин за масою, переважно від 10 до 250 частин за масою і переважніше від 25 до 100 частин за масою на 100 частин сукупної маси компонентів (А)-(С). Носій 1 може містити різні добавки, наприклад, засоби для надання ізотонічності, наповнювачі, розріджувачі, загусники, стабілізатори, буфери, консерванти і т.д.; і/або водні носії, наприклад, очищену воду, розчини цукру у воді, буферні розчини, фізіологічний сольовий розчин, водні розчини полімерів, воду, що не містить РНКазу, і т.д.; відповідно до форми застосування. Кількості таких добавок і водних носіїв можуть бути вибрані належним чином залежно від форми застосування носія для доставки нуклеїнових кислот. Форма носія для доставки нуклеїнової кислоти Форма носія для доставки нуклеїнової кислоти не обмежена, якщо тільки в цей носій може бути інкапсульована нуклеїнова кислота, яку збираються доставити в клітину, але переважно носій має форму ліпосоми. Наприклад, якщо носій 1 має форму ліпосоми, компоненти (А)-(С) та інші необов'язково застосовувані ліпіди, утворюють оболонку ліпосоми. Якщо носій для доставки нуклеїнової кислоти має форму ліпосоми, він може являти собою малу одношарову везикулу (SUV), велику одношарову везикулу (LUV) або багатошарову везикулу (MLV). Діаметр частки носія для доставки нуклеїнової кислоти може бути вибраний відповідно до типу клітини, в яку доставляють нуклеїнову кислоту, і може складати, наприклад, від приблизно 20 нм до приблизно 100 нм для SUV, від приблизно 200 нм до приблизно 1000 нм для LUV і від приблизно 400 нм до приблизно 3500 нм для MLV. Діаметр ліпосом вимірюють із застосуванням методики динамічного розсіювання лазерного випромінювання. Для одержання ліпосом і регулювання їхнього діаметра можна застосовувати способи, відомі в техніці. Наприклад, у разі носія 1, ліпосоми можуть бути одержані способом тонкої плівки, способом випаровування в зверненій фазі, способом уприскування розчину в ефірі, способом видалення ПАР і нагріванням, або подібними способами, із 15 застосуванням масляної фази, що містить компоненти (А)-(С) і водної фази (водного носія). Діаметр частинок може бути відрегульований способом екструзії, із застосуванням преса Френча, способом гомогенізації або подібними способами. Форма, склад і спосіб застосування композиції для доставки нуклеїнових кислот Якщо носій для доставки нуклеїнової кислоти має форму ліпосоми, комплекс нуклеїнової кислоти в композиції для доставки нуклеїнової кислоти за даним винаходом може бути інкапсульований у внутрішній водній фазі ліпосоми, або може бути зв'язаний із внутрішньою або зовнішньою поверхнею оболонки ліпосоми іонним або гідрофобним зв'язком. Якщо носій для доставки нуклеїнової кислоти має форму, що відрізняється від ліпосоми, комплекс нуклеїнової кислоти в композиції для доставки нуклеїнової кислоти за даним винаходом утворює комплекс із компонентами носія для доставки нуклеїнової кислоти за рахунок утворення іонного або гідрофобного зв'язку. Композицію для доставки нуклеїнової кислоти за даним винаходом одержують змішуванням комплексу нуклеїнової кислоти з носієм для доставки нуклеїнової кислоти і перетворенням суміші в бажану форму, або змішуванням компонентів комплексу нуклеїнової кислоти і композиції для доставки нуклеїнової кислоти в довільному порядку і перетворенням цієї суміші в бажану форму. У композиції для доставки нуклеїнової кислоти за даним винаходом, співвідношення комплексу нуклеїнової кислоти і носія для доставки нуклеїнової кислоти залежить від типу комплексу нуклеїнової кислоти, типу носія для доставки нуклеїнової кислоти і типу клітини, в яку доставляють нуклеїнову кислоту і т.д. Це співвідношення може складати, наприклад, від 1 до 100 частин за масою, переважно, від 10 до 100 частин за масою і переважніше від 20 до 100 частин за масою комплексу нуклеїнової кислоти на 100 масових частин загальної кількості носія для доставки нуклеїнової кислоти. Конкретніше, якщо у ролі носія для доставки нуклеїнової кислоти застосовують носій 1, співвідношення може складати, наприклад, від 1 до 100 частин за масою, переважно, від 10 до 100 частин за масою і переважніше від 20 до 100 частин за масою комплексу нуклеїнової кислоти на 100 масових частин загальної кількості компонентів (А)(С), що містяться в носії 1. Далі, якщо носій 1 застосовують у ролі носія для доставки нуклеїнової кислоти, загальна кількість компонентів (А)-(С), що містяться в носії 1, може складати, наприклад, від 10 до 90 мас.%, переважно від 30 до 80 мас.% і переважніше від 40 до 60 мас.%, стосовно загальної кількості композиції для доставки нуклеїнової кислоти. Композиція для доставки нуклеїнової кислоти за даним винаходом може містити різні добавки, наприклад, засоби для надання ізотонічності, наповнювачі, розріджувачі, загусники, стабілізатори, буфери, консерванти і т.д.; і/або водні носії, наприклад, очищену воду, водні розчини глюкози, буферні розчини, фізіологічний сольовий розчин тощо; відповідно до форми застосування. Кількості таких добавок і водних носіїв можуть бути вибрані нале 97559 16 жним чином залежно від форми застосування композиції для доставки нуклеїнової кислоти. Композиція для доставки нуклеїнової кислоти за даним винаходом може застосовуватися сама по собі як лікарський засіб для генної терапії, тобто як фармацевтична композиція. Якщо композицію для доставки нуклеїнової кислоти за даним винаходом застосовують як фармацевтичну композицію, вибирають носій для доставки нуклеїнової кислоти, основу, носій і т.ін., які є фармакологічно прийнятними. Фармацевтичну композицію за даним винаходом можна перетворювати в різні фармацевтичні форми. Приклади форм фармацевтичної композиції за даним винаходом включають рідкі препарати, наприклад, розчини (включаючи сиропи і т.ін.), краплі, препарати для ін'єкцій і т.ін.; і тверді препарати, наприклад, таблетки, пілюлі, порошки, гранули, капсули (включаючи м'які капсули) і т.ін. Якщо фармацевтична композиція за даним винаходом є рідким препаратом, її можна законсервувати шляхом заморозки, ліофілізації або подібного способу видалення води. Ліофілізовані препарати, сухі сиропи і т.д. можуть бути повторно розчинені в момент застосування в дистильованій воді для ін'єкцій, стерилізованій воді і т.д. Якщо фармацевтична композиція за даним винаходом є твердим препаратом, її можна повторно розчинити в момент - застосування в дистильованій воді для ін'єкцій, стерилізованій воді і т.д. У даному винаході не накладається обмежень на клітини, в які постачаються нуклеїнові кислоти, тобто клітини, до яких застосовується фармацевтична композиція за даним винаходом, і ці клітини можуть бути клітинною культурою, клітинами, ізольованими з організму (включаючи стійкі клітинні лінії), клітинами in vivo і т.д., і можуть бути людськими клітинами або клітинами тварин, що не є людиною. Фармацевтичні композиції за даним винаходом можуть застосовуватися або in vitro, або in vivo. У даному винаході нуклеїнова кислота може бути доставлена в клітину через стадію приведення в контакт фармацевтичної композиції за даним винаходом із клітиною. Спосіб приведення фармацевтичної композиції в контакт із клітиною не обмежується, за умови, що достатня кількість композиції для доставки нуклеїнової кислоти приведена в контакт із клітиною, в яку збираються ввести нуклеїнову кислоту. Наприклад, це може бути один зі способів, відомих до теперішнього часу в генній терапії, і це ж стосується кількості композиції, що приводиться в контакт: вибирають придатні спосіб і кількість. Так застосування фармацевтичної композиції за даним винаходом до клітини полегшує внутрішньоклітинну доставку нуклеїнової кислоти і сприяє стійкому і постійному перебуванню кислоти в клітині. Наприклад, для приведення фармакологічної композиції за даним винаходом у контакт із клітиною in vitro, клітину можна культивувати в присутності придатної кількості зазначеної фармацевтичної композиції. Для приведення фармацевтичної композиції за даним винаходом у контакт in vitro з культивованою клітиною або клітиною, ізольованою з організму, контакт можна здійснювати в при 17 сутності сироватки крові. Якщо фармацевтичну композицію за даним винаходом приводять у контакт із клітиною in vivo, це можна здійснити, наприклад, за допомогою безпосередньої ін'єкції в тканину; внутрішньовенної, підшкірної, внутрішньом'язової, інтраперитонеальної або внутрішньоочної ін'єкції або введення в травний тракт, зуб і т.ін.; введення за допомогою інгаляції в порожнину носа, порожнину рота, легені і т.ін.; перорального введення; трансдермального введення; трансмукозального введення через слизову оболонку рота, слизову оболонку піхви, слизову оболонку ока, слизову оболонку прямої кишки або слизову оболонку матки; і т.ін. За необхідності, фармацевтична композиція за даним винаходом може додатково містити фармакологічно прийнятний носій або основу. Вибір цього носія або основи не обмежений, за умови, що вони не впливають негативним чином на ефект від даного винаходу, і можна вибрати придатний носій відповідно до форми застосування. Приклади включають зазначені вище носії та основи. У цьому разі співвідношення фармацевтичної композиції, носія та основи також не обмежуються, за умови, що зберігається ефект від даного винаходу, і є можливість вибрати придатні співвідношення залежно від форми застосування. При застосуванні фармацевтичної композиції за даним винаходом, застосовується ефективна кількість цієї композиції. Наприклад, фармацевтичну композицію застосовують у такій кількості, щоб кількість комплексу нуклеїнової кислоти, що входить у композицію, складала від 0,001 до 10 пМ, переважно від 0,001 до 1 пМ і переважніше від 0,01 до 0,1 пМ на клітину. Фармацевтична композиція за даним винаходом здатна доставляти в клітину конкретну нуклеїнову кислоту. Тобто фармацевтична композиція за даним винаходом ефективна при доставці в клітину конкретної нуклеїнової кислоти, яка входить до складу фармацевтичної композиції, і яка утворює комплекс нуклеїнової кислоти, при приведенні фармацевтичної композиції в контакт із клітиною. Крім того, у даному винаході розроблений спосіб доставки нуклеїнової кислоти в клітину. Спосіб доставки нуклеїнової кислоти в клітину за даним винаходом включає стадію приведення в контакт із клітиною описаних вище комплексу нуклеїнової кислоти або композиції для доставки нуклеїнової кислоти. Цей контакт між комплексом нуклеїнової кислоти або композицією для доставки нуклеїнової кислоти і клітиною не обмежується, за умови, що придатна кількість комплексу нуклеїнової кислоти або композиції для доставки нуклеїнової кислоти приведена в контакт із клітиною, в яку вводиться нуклеїнова кислота. Наприклад, цей контакт може бути здійснений тими способами, які відомі до теперішнього часу в генній терапії, і те ж саме стосується кількості, яку необхідно привести в контакт: спосіб контакту і кількість вибирають придатним чином. При приведенні в контакт із клітиною комплексу нуклеїнової кислоти або композиції для доставки нуклеїнової кислоти описаним вище чином, нуклеїнова кислота може стало і постійно 97559 18 знаходитися в клітині. Для контакту з клітиною, комплекс нуклеїнової кислоти може бути застосований сам по собі або в комбінації з носієм або основою, як описано вище. Композиція для доставки нуклеїнової кислоти також може застосовуватися сама по собі або в комбінації з носієм або основою, як описано вище. Для більш ефективної внутрішньоклітинної доставки нуклеїнової кислоти переважно приводити в контакт із клітиною композицію для доставки нуклеїнової кислоти. У даному винаході, як зазначено вище, клітини, в які доставляються нуклеїнові кислоти, не обмежуються, і вони можуть бути культивованими клітинами, клітинами, ізольованими з організму (включаючи стійкі клітинні лінії), клітинами in vivo і т.ін., і вони можуть бути людськими клітинами або клітинами тварин, що не є людиною. Згаданий вище контакт може здійснюватися in vitro або in vivo. Наприклад, для приведення в контакт із клітиною in vitro комплексу нуклеїнової кислоти або композиції для доставки нуклеїнової кислоти, клітину можна культивувати в присутності придатної кількості комплексу нуклеїнової кислоти або композиції для доставки нуклеїнової кислоти. Для приведення комплексу нуклеїнової кислоти або композиції для доставки нуклеїнової кислоти в контакт із культивованою клітиною або клітиною, ізольованою з організму, in vitro, контакт можна здійснювати в присутності сироватки крові. Якщо комплекс нуклеїнової кислоти або композицію для доставки нуклеїнової кислоти приводять в контакт із клітиною in vivo, це можна здійснити, наприклад, за допомогою безпосередньої ін'єкції в тканину; внутрішньовенної, підшкірної, внутрішньом'язової, інтраперитонеальної або внутрішньоочної ін'єкції або введення в травний тракт, зуб і т.ін.; введення за допомогою інгаляції в порожнину носа, порожнину рота, легені і т.ін.; перорального введення; трансдермального введення; трансмукозального введення через слизову оболонку рота, слизову оболонку піхви, слизову оболонку ока, слизову оболонку прямої кишки або слизову оболонку матки; і т.ін. У способі доставки нуклеїнової кислоти в клітину за даним винаходом, ефективну кількість комплексу нуклеїнової кислоти або композиції для доставки нуклеїнової кислоти вводять у контакт із клітиною з метою введення нуклеїнової кислоти в клітину. Наприклад, кількість комплексу нуклеїнової кислоти або композиції для доставки нуклеїнової кислоти, яку необхідно ввести, вибирають таким чином, щоб було введено від 0,001 до 10 пМ, переважно від 0,001 до 1 пМ і переважніше від 0,01 до 0,1 пМ комплексу нуклеїнової кислоти на клітину. Спосіб доставки нуклеїнової кислоти в клітину за даним винаходом може бути реалізований шляхом приведення фармацевтичної композиції в контакт із клітиною. При застосуванні фармацевтичної композиції, спосіб за даним винаходом може бути втілений таким же чином, як описаний вище. Приклади Далі у тексті даний винахід буде описаний детальніше із залученням прикладів різного типу, 19 97559 але винахід не обмежений цими прикладами. У наведених нижче прикладах і тестових прикладах у ролі siRNA використали GL3-siRNA (siRNA люциферази жука-світляка; Dharmacon Research, Inc., (Boulder, CO), USA; смислова послідовність: 5'-CUUACGCUGAGUACUUCGAdTdT, антисмислова послідовність 5'UCGAAGUACUCAGCGUAAGdTdT). У ролі сильно розгалуженого циклічного декстрину використали продукт під торговою маркою "Cluster dextrin" (Ezaki Glico Co., Ltd.). Приклад 1 Одержання комплексу, що містить siRNA і сильно розгалужений циклічний декстрин 20 Розчин, що містить siRNA у концентрації 2 мкМ (розчин siRNA), готували з використанням буферного розчину Tris-EDTA (ТЕ) (що виробляється Fluka Co., Ltd.). Потім готували розчин, що містить сильно розгалужений циклічний декстрин, у концентрації 25 мкМ (розчин сильно розгалуженого циклічного декстрину) із використанням буферного розчину Tris-EDTA (ТЕ) (що виробляється Fluka). Однакові кількості цих розчинів змішували протягом 1 хвилини, одержуючи комплекс siRNA. У таблиці 1 показані властивості одержаного комплексу siRNA. Таблиця 1 Комплекс Діаметр частинок (нм) 31,1 * Зазначений розмір частинок був середнім діаметром частинок (нм), виміряним із використанням приладу ZETASIZER 3000HSA (MALVERN INSTRUMENT) (об'ємний середній діаметр частинок вимірювали способом дифракції лазерного випромінювання). Дзета-потенціал вимірювали з використанням приладу ZETASIZER 3000HSA (MALVERN INSTRUMENT). Приклад 2 Одержання композиції для доставки нуклеїнової кислоти, що містить комплекс siRNA Відважували дистеароїлфосфатиділхолін (DSPC), холестерин і стариламін, так щоб їх мольне співвідношення становило 7:3:1, і розчиняли сполуку в хлороформі, використовуючи колбу у формі баклажана (регенеруючу колбу). Розчин упарювали досуха при зниженому тиску з використанням роторного випарника, одержуючи тонкий шар ліпідної плівки. До одержаного тонкого шару ліпідної мембрани додавали розчин, що містить 0,028 мг/мл комплексу siRNA, одержаного в прикладі 1, у такій кількості, щоб концентрація DSPC у розчині становила 30 мг/мл, і потім перемішували. Після цього регулювали діаметр частинок у розчині пропущенням через мембрани, що мають діаметр пір 800 нм і 200 нм, із використанням екструдера, одержуючи композицію для доставки siRNA у формі катіонних ліпосом. Одержана композиція для доставки siRNA мала діаметр частинок приблизно 200 нм і знаходилася в ліпосомальній формі, причому всі частинки мали приблизно однаковий розмір. Дзета-потенціал композиції становив приблизно 50 мВ. Зазначений діаметр частинок був середнім діаметром частинок (нм), виміряним із використанням приладу ZETASIZER 3000HSA (MALVERN INSTRUMENT) (об'ємний середній діаметр частинок вимірювали способом дифракції лазерного випромінювання). Дзета-потенціал вимірювали з використанням приладу ZETASIZER 3000HSA (MALVERN INSTRUMENT). Приклад 3 Одержання композиції для доставки нуклеїнової кислоти, що містить комплекс siRNA Композицію для доставки нуклеїнової кислоти у формі катіонних ліпосом одержували способом, Дзета-потенціал (мВ) -42,9 аналогічним до способу прикладу 2, за винятком того, що співвідношення DSPC, холестерину і стеариламіну становило 7:3:2. Як і в прикладі 2, одержана композиція для доставки siRNA мала діаметр частинок приблизно 200 нм і мала ліпосомальну форму, де розмір частинок був приблизно однаковим. Дзета-потенціал композиції становив приблизно 50 мВ. Тестовий приклад 1 Оцінка ефективності включення siRNA в ліпосоми Комплекс siRNA, мічений FITC, одержували тим самим способом, що і вище в прикладі 1, використовуючи siRNA, попередньо мічену FITC. Використовуючи комплекс siRNA, мічений FITC, одержували композицію для доставки нуклеїнової кислоти в умовах прикладів 2 і 3. Зразу ж після одержання композицію для доставки siRNA осаджували центрифугуванням (при 75000 об/хв протягом 1 години) і вимірювали інтенсивність флуоресценції міченого FITC комплексу siRNA у надосадовій рідині для розрахунку ефективності включення siRNA у ліпосоми (частка в (%) siRNA, включеної в ліпосоми стосовно до загальної кількості siRNA). У результаті був продемонстрований максимальний рівень ефективності включення siRNA у ліпосоми, що дорівнює 97,2% при одержанні композиції в умовах прикладу 2, і 99,8% при одержанні композиції в умовах прикладу 3. Це показує, що комплекс нуклеїнової кислоти за даним винаходом має здатність ефективно включатися в носій для доставки нуклеїнової кислоти в ліпосомальній формі. Хоча обмежуюча інтерпретація цього факту небажана, приблизно це відбувається через те, що сильно розгалужений циклічний декстрин утворює компактний комплекс із siRNA. Тестовий приклад 2 Тест з оцінки безпеки для клітин композиції для доставки нуклеїнової кислоти Оцінку безпеки композиції проводили з використанням аналізу MTS. Для аналізу MTS використали колориметричний набір CellTiter 96 Aqueous One Solution Cell Proliferation Assay, що випускається Promega Corporation. Конкретно, клітини 21 A594 (ATCC, USA) висівали у 96-ямковий планшет 4 у кількості 3,16x10 клітин/ямку в 200 мкл середовища Ігла, модифікованого Дульбеко (DMEM), що містить 10 об.% сироватки телят (FBS) та інкубували при 37°С протягом 24 годин. Після трикратного промивання збалансованим сольовим розчином Хенка (HBSS), середовище змінювали на DMEM без FBS. Кожну з композицій для доставки нуклеїнових кислот додавали в кількості 20 мкл на ямку та інкубували при 37°С в атмосфері 5% СО2 протягом 4 годин. Далі культуральний супернатант в ямці змінювали на DMEM із 10 об.% FBS та інкубували при 37°С в атмосфері 5% СО2 протягом ще 20 годин. У кожну ямку додавали 20 мкл реагенту MTS (тетразолієвої солі) і 100 мкл середовища DMEM із 10 об.% FBS, та інкубували протягом двох годин. Потім визначали поглинання при 492 нм і розраховували виживаність клітин. Виживаність клітин розраховували, приймаючи за 100% поглинання при 492 нм, зафіксоване для клітин без додавання композиції для доставки нуклеїнової кислоти, які інкубували у зазначених вище умовах. Результати тесту показані на фіг. 2. Із фіг. 2 видно, що всі композиції для доставки нуклеїнової кислоти прикладів 2 і 3 мають низьку цитотоксичність і високий ступінь безпеки. Зокрема, підтверджено, що композиції для доставки нуклеїнової кислоти прикладів 2 і 3 мають дуже високий рівень безпеки. Тестовий приклад 3 Тест для оцінки ефективності доставки siRNA у клітини Ефективність введення siRNA у клітини оцінювали шляхом вимірювання інтенсивності флуоресценції міченої FITC siRNA із використанням потокової цитометрії. У цьому тесті використали композицію для доставки нуклеїнової кислоти, одержаної на основі siRNA, попередньо міченої FITC. Конкретно, клітини А594 (АТСС, USA) висі5 вали у 24-ямковий планшет у кількості 5x10 клітин/ямку в 500 мкл середовища DMEM, що містить 10 об.% FBS, та інкубували при 37°С в атмосфері 5% СО2 протягом 24 годин. Після трикратного промивання HBSS, додавали 0,95 мл середовища DMEM, що не містило FBS. Потім у кожну ямку додавали 0,05 мл кожної з композицій для доставки нуклеїнових кислот прикладів 1 і 2, та інкубували при 37°С в атмосфері 5% СО2 протягом 4 годин. Далі культуральний супернатант в ямці змі 97559 22 змінювали на DMEM із 10 об.% FBS та інкубували при 37°С в атмосфері 5% СО2 протягом ще 20 годин. Кожну ямку один раз промивали HBSS і додавали 0,2 мл CellScrubBuffer (що випускається Gene Therapy Systems, Inc.), здійснювали інкубування при 37°С в атмосфері 5% СО2 протягом 15 хвилин. Знову двічі промивали ямки HBSS, клітини, прикріплені до дна ямки, відділяли з використанням трипсину та осаджували клітини центрифугуванням. Одержані клітини суспендували в HBSS. Суспензію фільтрували через мембрану з діаметром пір 41 мкм. Інтенсивність флуоресценції клітин вимірювали способом потокової цитометрії через 2 години, 12 годин і 24 години після додавання композиції для доставки нуклеїнової кислоти. Як контрольний експеримент, вимірювали інтенсивність флуоресценції клітин, оброблених за описаною вище методикою, із використанням контрольної композиції для доставки нуклеїнової кислоти, одержаної змішуванням розчину Lipofectamine 2000™ (що випускається Invitrogen Corporation), що часто застосовується як комерційно доступний генний вектор, розведений середовищем OptiMEM до концентрації 0,1 мг/мл, і розчину siRNA, в якому siRNA був розведений буфером ТЕ до концентрації 2 мкМ, у співвідношенні об'ємів 1:1. Одержані результати показані на фіг. З. Ці результати підтверджують, що при застосуванні композицій для доставки нуклеїнових кислот прикладів 1 і 2, siRNA стійко знаходиться в клітинах, причому її концентрація в клітині залишається постійною. На противагу цьому, контрольні композиції для доставки нуклеїнових кислот продемонстрували не тільки низьку ефективність первинної доставки siRNA у клітини, але також зменшення вмісту siRNA у клітинах згодом, що призводить до недостатніх кількостей siRNA у клітинах через 12 і 24 години після додавання композиції. Стислий опис ілюстративного матеріалу На фіг. 1 показаний приклад сильно розгалуженого циклічного декстрину. На фіг. 2 показані результати Тестового Прикладу 2, тобто результати оцінки безпеки для клітини композицій для доставки нуклеїнової кислоти. На фіг. 3 показані результати оцінки введення siRNA у клітини за допомогою композицій для доставки нуклеїнової кислоти в Тестовому Прикладі 3. Значення по осі ординат на фіг. З показують середню інтенсивність флуоресценції на одну клітину. 23 97559 24 Комп’ютерна верстка В. Мацело Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюNucleic acid complex and a nucleic acid delivery composition
Автори англійськоюTakeuchi, Hirofumi, Tozuka, Yuichi, Hira, Yasuyuki, Toyobuku, Hidekazu
Назва патенту російськоюКомплекс нуклеиновой кислоты и композиция для доставки нуклеиновой кислоты
Автори російськоюТакэути Хирофуми, Тозука Юити, Хира Ясуюки, Тойобуку Хидэказу
МПК / Мітки
МПК: A61K 47/48, A61K 47/40, A61K 9/127, C12N 15/87, A61K 48/00
Мітки: доставки, композиція, комплекс, нуклеїнової, кислоти
Код посилання
<a href="https://ua.patents.su/12-97559-kompleks-nuklenovo-kisloti-i-kompoziciya-dlya-dostavki-nuklenovo-kisloti.html" target="_blank" rel="follow" title="База патентів України">Комплекс нуклеїнової кислоти і композиція для доставки нуклеїнової кислоти</a>
Попередній патент: Спосіб одержання сульфату калію
Наступний патент: Багатоповерховий гараж
Випадковий патент: Пристрій пішковці м.я. для визначення кута нахилу ретеновано-дистопованого (імпактного) зуба