Таблетка, що містить гранульований матеріал з kmd-3213
Формула / Реферат
1. Таблетка, яка містить:
(1) гранульований матеріал, що містить:
а) як активний інгредієнт сполуку, представлену формулою:
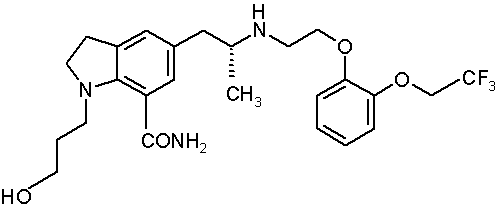 ,
,
b) D-маніт,
с) низькозаміщену гідроксипропілцелюлозу і
d) гідроксипропілцелюлозу, і
(2) змащувальну речовину, вибрану з стеарату магнію, стеарату кальцію або тальку,
де час розчинення на 85 % складає не більше ніж 60 хвилин при тесті розчинення відповідно до способу 2 (лопатковий спосіб) діючої Японської фармакопеї з використанням води як середовища тестування і швидкості обертання лопатки 50 об/хв.
2. Таблетка за п. 1, де час розчинення на 85 % складає не більше ніж 60 хвилин при тесті розчинення відповідно до способу 2 (лопатковий спосіб) діючої Японської фармакопеї з використанням першої рідини, передбаченої Японською фармакопеєю як середовища тестування дезінтеграції, і швидкості обертання лопатки 50 об/хв.
3. Таблетка за п. 1 або 2, де час розчинення на 85 % складає не більше ніж 30 хвилин.
4. Таблетка за п. 3, де час розчинення на 85 % складає не більше ніж 15 хвилин.
5. Таблетка за будь-яким з пп. 1-4, де змащувальна речовина являє собою стеарат магнію.
6. Таблетка за будь-яким з пп. 1-5, де таблетка покрита світлозахисною речовиною покриття.
7. Таблетка за п. 6, де світлозахисна речовина покриття містить оксид титану.
8. Таблетка за будь-яким з пп. 1-7, яка використовується для лікування дизурії.
9. Таблетка за п. 8, де дизурія пов'язана з органічною обструкцією уретри, розладом нервової регуляції сечовипускання або з функціональною обструкцією уретри.
10. Таблетка за п. 9, де дизурія пов'язана з гіпертрофією передміхурової залози, нейрогенним сечовим міхуром або розладом нижнього відділу сечовивідних шляхів.
11. Спосіб одержання таблетки, що включає стадії:
(1) гранулювання суміші сполуки, представленої формулою:
 ,
,
D-маніту, низькозаміщеної гідроксипропілцелюлози і розчину зв'язувальної речовини гідроксипропілцелюлози способом вологого гранулювання і
(2) змішування гранульованого матеріалу, одержаного на стадії (1), і змащувальної речовини, вибраної з стеарату магнію, стеарату кальцію або тальку, з наступним таблетуванням.
Текст
1. Таблетка, яка містить: (1) гранульований матеріал, що містить: а) як активний інгредієнт сполуку, представлену формулою: C2 2 (19) 1 3 85359 Даний винахід відноситься до лікарського засобу у вигляді твердої пероральної лікарської форми для лікування дизурії. Конкретніше, даний винахід відноситься до лікарського засобу у вигляді твердої пероральної лікарської форми для лікування дизурії, яка включає як активний інгредієнт індолінову сполуку, що володіє активністю, яка блокує a 1-адренорецептори (що далі іменується "a 1-AR"), і представлена формулою (І) (що далі іменується "KMD-3213"): її проліків, фармацевтично прийнятної солі або фармацевтично прийнятного сольвату, 85% часу розчинення якого складає не більше 60 хв. при тесті розчинення відповідно до способу 2 (способу перемішування) за діючою Японською фармакопеєю з використанням води як тестового середовища і швидкості обертання лопатки 50 об./хв. Даний винахід також відноситься до лікарського засобу у вигляді твердої пероральної лікарської форми для лікування дизурії, причому вказаний лікарський засіб включає як активний інгредієнт 1) KMD-3213, її проліки, фармацевтично прийнятну сіль або фармацевтично прийнятний сольват і 2) щонайменше один засіб, вибраний з групи, яка складається із засобу, що блокує a 1адренорецептори, антихолінергічного засобу, протизапального засобу і антибактеріального засобу, який відрізняється від KMD-3213, причому 85% часу розчинення складає не більше ніж 60 хв. при тесті на розчинення відповідно до способу 2 (способу перемішування) за діючою Японською фармакопеєю з використанням води як тестового середовища і швидкості обертання лопатки 50 об./хв. Даний винахід також відноситься до лікарського засобу у вигляді твердої пероральної лікарської форми і набору, який включає 1) лікарський засіб для лікування дизурії, що включає як активний інгредієнт KMD-3213, її проліки, фармацевтично прийнятну сіль або фармацевтично прийнятний сольват, причому 85% часу розчинення складає не більше ніж 60 хв. при тесті на розчинення відповідно до способу 2 (способу перемішування) за діючою Японською фармакопеєю з використанням води як тестового середовища і швидкості обертання лопатки 50 об./хв., в комбінації з 2) лікарський засіб, що включає як активний інгредієнт щонайменше один засіб, вибраний з групи, що складається із засобу, який блокує a 1адренорецептори, антихолінергічного засобу, про 4 тизапального засобу і антибактеріального засобу, який відрізняється від KMD-3213. При тестуванні лікарських засобів у вигляді твердих пероральних лікарських форм для лікування дизурії згідно з даним винаходом для виявлення їх властивостей розчинення відповідно до тесту на розчинення, способу 2 (способу перемішування) за діючою Японською фармакопеєю з використанням води як тестового середовища і швидкості обертання лопатки 50 об./хв., 85% часу розчинення (що далі іменуються "Т85%") вказаних лікарських засобів складає переважно не більше ніж 60 хв. Більш переважно, Т85% лікарських засобів за винаходом складає не більше ніж 60 хв. при тестуванні відповідно до способу 2 (способу перемішування) за діючою Японською фармакопеєю з використанням першої рідини, регульованої в тесті на дезінтеграцію Японської фармакопеї (що далі іменується «перша рідина») як тестового середовища і швидкості обертання лопатки 50 об./хв. Ще більш переважно, Т85% лікарських засобів за винаходом складає не більше ніж 30 хв., а найбільш переважно, не більше ніж 15 хв. при тестуванні відповідно до способу 2 (способу перемішування) за діючою Японською фармакопеєю з використанням води або першої рідини. Перша рідина, що використовується в тесті на розчинення згідно з винаходом, відноситься до першої рідини, регульованої в тесті дезінтеграції Японської фармакопеї, причому першу рідину одержують додаванням 2,0 г хлориду натрію до 7,0 мл хлористоводневої кислоти і води для одержання 1000 мл тестового середовища. Попередній рівень техніки Відомо, що KMD-3213, яка міститься як активний інгредієнт в лікарському засобі у вигляді твердої пероральної лікарської форми для лікування дизурії згідно з винаходом, володіє селективною переважною активністю відносно скорочення гладких м'язів уретри і являє собою надто корисну сполуку як лікарський засіб для лікування дизурії, що не викликає сильний гіпотензивний вплив або ортостатичну гіпотонію. Відносно фармацевтичних композицій, що включають як активний інгредієнт KMD-3213, її фармацевтично прийнятну сіль або фармацевтично прийнятний сольват, до теперішнього часу відомі наступні літературні джерела. У патентній публікації 1, яка розкриває індолінові сполуки, що включають KMD-3213, наводяться приклади декількох лікарських форм як тверда пероральна композиція. У ній також в загальних рисах описано, що такі лікарські форми можна одержати складанням композицій індолінових сполук відповідно до звичайних процедур складання композицій. Однак в патентній публікації 1 не розкрита конкретна композиція, що включає як активний інгредієнт KMD-3213. У патентній публікації 2, яка розкриває лікарський засіб, що включає як активний інгредієнт a 1 5 85359 AR блокуючий засіб, включаючи KMD-3213, для лікування розладів нижнього відділу сечовивідних шляхів, наведені приклади декількох лікарських форм у вигляді твердої пероральної композиції. Повідомляється також, що такі лікарські форми можна одержати з використанням звичайних фармацевтичних домішок відповідно до звичайних процедур складання композицій. Однак в патентній публікації 2 не розкрита певна фармацевтична композиція, що включає як активний інгредієнт KMD-3213. KMD-3213 є нестійкою до впливу світла. Змішування деяких видів фармацевтичних домішок з KMD-3213 приводить до несумісності і до виходу продуктів розпаду. Наприклад, сумісність між KMD-3213 і лактозою, яка найчастіше використовується як наповнювач, є низькою, і використання лактози як наповнювача надає небажані властивості відносно розчинення і незадовільну твердість таблеток. Крім того, KMD-3213 володіє сильною адгезійною властивістю, і у випадку виготовлення таблетки або капсули неминучим є використання змащувального засобу. Однак додавання таких змащувальних засобів викликає проблему подовження часу розчинення. Відповідно, дуже важко одержати практично застосовні лікарські засоби у вигляді твердої пероральної лікарської форми, що включають KMD-3213 як активний інгредієнт, її проліки, фармацевтично прийнятну сіль або фармацевтично прийнятний сольват звичайними способами складання композицій. Відносно таких проблем, патентні публікації 1 і 2 не розкривають і не пропонують способу для розв'язання вказаних проблем. У патентній публікації 2 розкривається спосіб виготовлення капсул, що включають як активний інгредієнт гідрохлорид тамуслосину або гідрохлорид алфузосину. Однак фармацевтичні композиції таких капсул абсолютно відрізняються від фармацевтичних композицій за винаходом. Крім того, фармацевтичні композиції за винаходом не можна одержати способами, розкритими в патентній публікації 2. Відповідно, в патентній публікації 2 даний винахід не описаний і з неї не витікає. Патентна публікація 1: Заявка на патент Японії Н06-220015 (стор. 12, стовпець 21), яка не пройшла експертизу. Патентна публікація 2: Заявка на патент Японії 2001-228115 (стор. 3, стовпці 3-4), яка не пройшла експертизу. Опис винаходу Даний винахід відноситься до придатного для практичного застосування лікарського засобу у вигляді твердої пероральної лікарської форми для лікування дизурії, що не надає дії на артеріальний тиск, який включає як активний інгредієнт KMD3213, її проліки, фармацевтично прийнятну сіль або фармацевтично прийнятний сольват, причому вказаний лікарський засіб має високу точність однорідного вмісту, хороші властивості стійкості і відмінні властивості розчинення. У випадках, коли лікарські засоби вводяться перорально, біологічна доступність активних інгредієнтів, що містяться в них, досить важлива, і також потрібна постійна ефективність. Для цієї 6 мети потрібне забезпечення однорідності, тобто біологічної еквівалентності між партіями композиції. У фармакопеях визначені процедури для тестування властивостей дезінтеграції або розчинення твердих композицій для забезпечення постійної якості і біологічної еквівалентності композицій. Відповідно, потрібно, щоб лікарські засоби відповідали специфікаціям, визначеним на основі таких тестів. Останнім часом тестування розчинення вважають важливим засобом оцінки профілів ефективності або безпеки лікарських засобів. Особливо у випадку важко розчинних лікарських субстанцій властивості розчинення більш важливі для оцінки якості лікарських засобів, що включають такі речовини, ніж властивості дезінтеграції. У світлі біологічної еквівалентності, тести на розчинення бажано проводити в різноманітних умовах тестування. Однак важко визначити специфікацію тестів на розчинення на основі різних умов, і звичайно тести на розчинення проводяться в умовах, в яких найбільш ймовірно, що лікарські засоби не будуть біологічно еквівалентними. Як тестові засоби при тесті на розчинення загалом використовуються тестові середовища у фізіологічному діапазоні рН, тобто від 1 до 7, або вода, хоча відмінності композицій ясно виявляються використанням тестуючого середовища, в якому активні інгредієнти повільно вивільняються з композицій. Вода чутлива до зміни рН. Навпаки, вода є тестовим середовищем, яке може оцінити незначні відмінності композицій або способів одержання. Відповідно, у випадках, коли воду можна використати як тестове середовище в тесті на розчинення, то бажано використати воду через ефективність тестування, економічну ефективність і впливи на навколишнє середовище. KMD-3213 має відносно високу розчинність в кислотному середовищі і важко розчинна в нейтральному середовищі, такому як вода. Отже, вода являє собою найбільш придатне тестове середовище для оцінки відсутності біологічної еквівалентності після проведення тесту на розчинення. При створенні композиції твердої пероральної лікарської форми, що включає KMD-3213 як активний інгредієнт, бажано знайти композицію, яка має хорошу властивість розчинення у воді. У лікарському засобі згідно з винаходом Т85% складає переважно не більше ніж 60 хв. при тесті на розчинення відповідно до способу 2 (спосіб перемішування) діючої Японської фармакопеї з використанням води як тестового середовища і швидкості лопатки 50 об./хв., більш переважно, Т85% складає не більше ніж 30 хв , а найбільш переважно, Т85% складає не більше ніж 15 хв. Бажано, щоб лікарські засоби у вигляді твердої пероральної лікарської форми виявляли хороші властивості розчинення в шлунку, за винятком випадків, коли лікарські засоби є композиціями, покритими ентеросолюбільним покриттям через нестабільність їх властивостей в кислотних умовах. Оскільки KMD-3213 стійка в кислотних умовах, бажано, щоб композиції твердої пероральної лікарської форми, що включають KMD-3213 як активний інгредієнт, виявляли властивості хорошого 7 85359 розчинення в першій рідині, яка відповідає шлунковому соку, в тесті на розчинення. Відповідно, в композиціях твердої пероральної лікарської форми згідно з винаходом, Т85% складає переважно не більше 60 хв. при тесті на розчинення з використанням першої рідини, як у випадках, коли тест на розчинення проводиться з використанням води, більш переважно, Т85% складає не більше 30 хв., а найбільш переважно, Т85% складає не більше 15 хв. Активні інгредієнти, що містяться в лікарських засобах, виявляють загалом біологічну активність в невеликій кількості дозування. Тому для надання постійного ефекту важливо забезпечити вміст активних інгредієнтів на постійному рівні і мінімізувати зменшення вмісту активних інгредієнтів під час зберігання. Для цих цілей бажано показати високу однорідність вмісту серед партій композиції і високі показники стійкості під час зберігання. KMD-3213, що міститься як активний інгредієнт в лікарському засобі у вигляді твердої пероральної лікарської форми, володіє сильними адгезійними і електростатичними властивостями. Зокрема, у випадках, коли композиції одержують сухим способом, електростатичні заряди генеруються фізичними подразненнями, викликаними такими способами як пульверизація, струшування, змішування, грануляція і ним подібні, які, в свою чергу, спричиняють зменшення текучості пульверизованих, змішаних або гранульованих матеріалів, погіршують властивості маніпулювання і знижують точність однорідності вмісту активного інгредієнту. У випадку таблеток або капсул, змащувальні агенти додають на стадіях заповнення або таблетування з урахуванням властивостей маніпулювання, точності заповнення і ним подібних. KMD3213, що міститься як активний інгредієнт в лікарському засобі у вигляді твердої пероральної лікарської форми згідно з винаходом, має потужні адгезійні властивості, і неминучим є використання змащувальних агентів. Однак використання змащувальних засобів спричиняє подовження часу розчинення. Крім того, KMD-3213, що міститься як активний інгредієнт в лікарському засобі у вигляді твердої пероральної лікарської форми згідно з винаходом, відносно нестійка до впливу світла і вимагає обережного маніпулювання. У таких випадках композиції загалом зберігаються в упаковці, стійкій до світла, однак в непрозорих стійких до світла упаковках важко виявити домішки чужорідних матеріалів. Більш того коли пацієнти починають приймати композиції, спочатку обгорнені в стійкі до світла упаковки, композиції іноді зберігаються витягнутими з стійких до світла упаковок. Відповідно, бажаними є композиції, які можна зберігати без стійкої до світла упаковки і які є високо стійкими до впливу світла. Автори даного винаходу провели ретельні дослідження лікарського засобу у вигляді твердої лікарської форми, яка містить як активний інгредієнт KMD-3213, її проліки, фармацевтично прийнятну сіль або фармацевтично прийнятний сольват, і дуже корисні для лікування дизурії, причому вка 8 заний лікарський засіб має високу точність однорідності вмісту, відмінні властивості розчинення у воді або воді і першій рідині і хороші показники стійкості. В результаті автори даного винаходу виявили, що використання лактози, яка найчастіше застосовується як наповнювач, викликає проблеми подовження часу розчинення, зменшення твердості таблеток і ним подібні. Отже, переважні композиції не можна одержати використанням лактози як наповнювача. Після подальшого дослідження наповнювачів автори даного винаходу виявили, що використання D-маніту як наповнювача забезпечує дуже переважну властивість відносно розчинення. Більш того автори даного винаходу досліджували різноманітні способи одержання композицій і виявили, що композиції, які мають задовільну однорідність вмісту без впливу електростатичних зарядів і мають хороші показники стійкості і відмінні властивості розчинення, можна одержати за допомогою гранулювання вологим способом і регуляції кількості змащувального агента і часу змішування. Автори даного винаходу також виявили, що у випадку капсул композиції з відмінними профілями розчинення одержують змішуванням змащувального агента у визначеному співвідношенні з іншою домішкою, яка являє собою тверду речовину з гідрофільними або поверхнево-активними властивостями. Крім того, автори даного винаходу вивчили стійку до світла композицію і виявили, що розпад KMD-3213 під дією світла ефективно запобігається окисом титану, і стійкі до світла композиції можна одержати використанням капсули, що містить окис титану, або покриваючого засобу, що містить окис титану. На основі цього відкриття був здійснений даний винахід. У багатьох випадках сполуки, що містяться як активний інгредієнт, є відносно нестійкими, і змішування таких сполук з фармацевтичними домішками, які використовуються для одержання композицій твердих лікарських форм, часто викликає несумісність, таку як знебарвлення, розпад і ним подібні проблеми. Однак важко заздалегідь оцінити сумісність між фармацевтичною домішкою і активним інгредієнтом. Автори даного винаходу вперше досліджували сумісність між KMD-3213, що міститься як активний інгредієнт даного лікарського засобу, і різними видами фармацевтичних домішок, що використовуються при одержанні композицій твердої лікарської форми, а потім відібрали домішки, які не спричиняють знебарвлення або розпад. Потім автори даного винаходу досліджували, чи можна відібрані фармацевтичні домішки комбінувати одна з одною, не викликаючи несумісність, чи ні, і чи підходять вони для виготовлення. Як показали дослідження наповнювача, лактоза, що частіше за все використовується як наповнювач, не викликає несумісності, але погіршує властивість розчинення і твердість таблеток. З цих причин важко одержати переважну композицію використанням лактози як наповнювача. Подовження часу розчинення, викликане лактозою, зменшується додаванням кристалічної целюлози, хоча твердість таблеток не підвищується при 9 85359 додаванні кристалічної целюлози. Більш того кристалічна целюлоза викликає несумісність після змішування з KMD-3213 і дає продукти розпаду. Отже, кристалічна целюлоза непридатна для одержання лікарського засобу у вигляді твердої лікарської форми за винаходом. Після подальшого дослідження наповнювачів автори даного винаходу виявили, що D-маніт є придатним для сумісності і можливості виготовлення і забезпечує надто хороші властивості розчинення і, відповідно, є найбільш придатним як наповнювач. Що стосується розпушувача, то карбоксиметилцелюлоза кальцію і карбоксиметилцелюлоза не придатні у зв'язку з тим, що вони викликають велику міру несумісності, в той час як переважними є крохмаль, низько заміщена гідроксипропілцелюлоза, частково заздалегідь желатинізований крохмаль або ним подібні. Приклади крохмалю включають кукурудзяний крохмаль і ним подібні. Приклади частково заздалегідь желатинізованого крохмалю включають Крохмаль 1500 (зареєстрований товарний знак, Japan Colorcon., Ltd.), PCS (зареєстрований товарний знак, Asahi Chemical Industry Co., Ltd.) і ним подібні. Що стосується зв'язувальної речовини, то гідроксипропілметилцелюлоза і гідроксипропілцелюлоза не придатні для того, щоб викликати невелику міру несумісності. Що стосується змащувальної речовини, то переважними є стеарат магнію, стеарат кальцію і тальк, які не викликають несумісності. Що стосується поверхнево-активної речовини, то макроголь (поліетиленгліколь), поліоксіетилен (105) поліоксипропілен (5) гліколь і цитрат триетилу не придатні в зв'язку з тим, що вони викликають велику міру несумісності. На основі описаних ви ще відкриттів вибирають переважні домішки. Потім досліджуються способи одержання композицій відповідно до звичайних процедур. По-перше, у випадках, коли композиції одержують сухими способами, пульверизовані, змішані або гранульовані матеріали, які можна одержувати способами пульверизації, змішування або гранулювання, генерують заряди і зменшують текучість матеріалів. В результаті, особливо у випадку одержання капсул, властивості маніпулювання погіршуються у процесі заповнення і погіршуються однорідність об'єму заповнення і точність заповнення. Для поліпшення властивостей маніпулювання або точності заповнення при процесі заповнення капсул або при процесі таблетування таблеток загалом використовуються змащувальні речовини. KMD-3213 володіє властивою їй могутньою адгезійною здатністю і, зокрема, у випадку сухи х способів, генеруються електростатичні заряди і погіршується текучість змішаних або гранульованих матеріалів, як описано вище, що вимагає набагато більшої кількості змащувальних речовин. Однак змащувальні речовини загалом мають гідрофобні властивості, і використання змащувальних речовин спричиняє подовження часу розчинення. Автори даного винаходу інтенсивно досліджували вид, комбінацію або співвідношення домішок, способів виготовлення і ним подібних і виявили 10 досить придатні для практичного застосування композиції, які мають відповідні властивості маніпулювання для способів виготовлення, високу точність для однорідності вмісту і відмінні властивості розчинення і корисні для ефективного вияву біологічної активності KMD-3213. По-перше, автори даного винаходу виявили, що подовження часу розчинення запобігається в деякій мірі зменшенням кількості змащувальних речовин або укороченням часу змішування. Конкретніше, хороші власти вості розчинення досягаються зменшенням кількості змащувальних речовин не більше ніж приблизно 1%, більш переважно, в діапазоні від приблизно 0,6% до приблизно 0,8%, і короткочасним розчиненням протягом періоду від близько 3 до близько 5 хв. Потім композиції з хорошою текучістю змішаних матеріалів, задовільними властивостями маніпулювання і високою точністю наповнення можна одержати гранулюванням за допомогою вологого способу замість сухого способу з використанням в кількості не більше ніж 1% і змішування протягом періоду приблизно 3 хв. Однак KMD-3213, що міститься як активний інгредієнт в лікарському засобі згідно з винаходом, володіє сильною адгезійною властивістю, і у випадках, коли капсули виготовляють з використанням змащувального засобу в кількості не більше ніж приблизно 1%, це пов'язано з ризиком викликати проблему із заповненням, таким як прилипання. Відносно таких проблем, автори даного винаходу досліджували спосіб укорочення тривалого часу розчинення навіть у випадку використання змащувальної речовини в кількості не менше ніж 1% і виявили, що тривалий час розчинення можна значно укоротити змішуванням твердої домішки, що має гідрофільні або поверхнево-активні властивості, і за допомогою цього можна одержати композиції з хорошими властивостями розчинення. Ефект укорочення тривалого часу розчинення вказаною вище домішкою відрізняється в залежності від комбінації домішки з змащувальною речовиною. Наприклад, коли стеарат магнію використовується як змащувальний засіб, лаурилсульфат натрію є найбільш переважним для ефекту поліпшення, а складний ефір сахарози і жирних кислот, текуча безводна кремнієва кислота і поліоксіетилен (105) поліоксипропілен (5) гліколь є незадовільними для цього ефекту. Для надання задовільного поліпшуючого ефекту переважно використати лаурилсульфат натрію в кількості від приблизно 0,1 до приблизно 2 частин, більш переважно, приблизно 0,5 частин на основі 1 частини стеарату магнію, при цьому властивості розчинення можна підтримувати на бажаному рівні. Ефект укорочення тривалого часу розчинення лаурилсульфатом натрію значною мірою варіює в залежності від способів додавання. Наприклад, коли лаурилсульфат натрію розчинений у воді і додається разом із зв'язаною водою при способі гранулювання (що далі іменується "додаванням під час гранулювання"), швидкості розчинення зменшуються в точці безпосередньо після початку тесту розчинення (5-хвилинна величина). При подальшому дослідженні автори даного винаходу 11 85359 виявили, що затримку при початковому підйомі можна запобігти додаванням лаурилсульфату натрію разом зі змащувальним засобом після процесу гранулювання (що далі іменується "додавання після гранулювання"). KMD-3213, що міститься як активний інгредієнт в лікарському засобі у вигляді твердої пероральної лікарської форми згідно з винаходом, є відносно нестійкою до впливу світла, і кількість активного інгредієнта зменшується згодом, в залежності від умов зберігання. Відповідно, KMD-3213 вимагає суворих умов зберігання і маніпулювання. У таких випадках композиції загалом зберігаються в стійкій до світла упаковці, однак, в непрозорих стійких до світла упаковках важко виявити домішки чужорідних матеріалів, і відповідно, є високий ризик упущення дефектного продукту. Більш того коли пацієнти починають приймати композиції, спочатку обгорнені в стійкі до світла упаковки, композиції іноді зберігаються витягнутими зі стійких до світла упаковок. Відповідно, бажаними є композиції, які можна зберігати без стійкої до світла упаковки і які є високо стійкими до впливу світла. Автори даного винаходу досліджували переважний світлозахисний матеріал для змішування в капсулах або покриваючих засобах і виявили, що окис титану є найбільш переважним як світлозахисний матеріал. Високо світлостійкі капсули або таблетки можна одержати шляхом використання капсул, що містять окис титану, або покриваючих речовин, що містять окис титану. Показник стійкості до світла оцінюється таким чином. По-перше, визначаються критерії верхньої межі прийнятності для кількостей (%) кожного з матеріалів, що розкладаються на світлі, (що далі іменуються «зв'язана речовина») і загальні кількості (%) всі х зв'язаних речовин. Потім показники стійкості до світла оцінюють визначенням того, чи узгоджуються кількості зв'язаних речовин з критеріями прийнятності при стандартному впливі світла. У JIS (Японських промислових стандартах) повідомляється, що стандартні рівні освітлення становлять 300-750 люкс/год, в лікарняній аптеці, де середня тривалість освітлення в годинах становить приблизно 8 год./д, а максимальна тривалість зберігання лікарських засобів складає 6 міс. Відповідно, за оцінками, стандартний вплив світла становить приблизно 1,2 мільйони люкс/год., який розраховується з урахуванням умови 750 люкс/год. як максимального рівня освітлення, приблизно, 8 год. як денної тривалості освітлення в годинах і 180 д як періоду впливу світла, що відповідає приблизно 1,08 мільйони люкс/год. впливу світла і відхилення його вимірювання. У керівництві з етичних лікарських засобів тестування світлочутливості потрібно проводити в умовах загального освітлення не менше ніж приблизно 1,2 мільйони люкс/год. Відповідно, потрібно, щоб етичні лікарські засоби були стійкими в умовах впливу світла приблизно 1,2 мільйони люкс/год. при тесті стійкості до світла. Встановлено, що є щонайменше 6 зв'язаних речовин в KMD-3213, яка міститься як активний інгредієнт в лікарському засобі у вигляді твердої пероральної лікарської форми за винаходом. По 12 передня специфікація визначається як не більше ніж 4% для найбільшої кількості зв'язаної речовини а, не більше ніж 1% для кожної з зв'язаних сполук від b до f і не більше ніж 5% для загальних кількостей всіх зв'язаних речовин, включаючи невеликі кількості інших зв'язаних речовин. Автори даного винаходу досліджували світлозахисну капсулу або речовину покриття на відповідність впливу сві тла приблизно 1,2 мільйони люкс/год. В результаті, окис титану виявився найбільш переважним як світлозахисний матеріал, і високо стійкі до світла лікарські засоби у формі твердої лікарської форми одержують шляхом використання капсул, що містять окис титану, або речовин покриття, що містять окис титану. Світлозахисні ефекти збільшуються при змішуванні з кількостями окису титану, в той час як міцність капсул зменшується при змішуванні з кількостями окису титан у. Переважні кількості, що змішуються, відповідно визначаються в залежності від розміру лікарських засобів. Для надання переважних світлозахисних ефектів в капсулах кількість окису титану, що змішується, складає не менше ніж приблизно 3%, більш переважно, приблизно 3,4-3,6%. Для таблеток кількість окису титану, що змішується, визначається площею поверхні таблеток, кількістю речовини покриття і тому подібним. Для надання переважних світлозахисних ефектів покриваюча кількість окису титану складає загалом не менше 0,5 мг/см 2, більш переважно, 1,1 мг/см 2 на основі площі поверхні таблеток. Відносно фармацевтичних композицій, що включають як активний інгредієнт KMD-3213, її фармацевтично прийнятну сіль або фармацевтично прийнятний сольват, існують тільки загальні описи в патентних публікаціях 1 і 2, в яких не описано і з яких не витікає жодної визначеної фармацевтичної композиції. Як описано вище, існує багато підлягаючих розв'язанню проблем для забезпечення лікарського засобу, що практично використовується у вигляді івердої пероральної лікарської форми, яка включає як активний інгредієнт KMD-3213, її проліки, фармацевтично прийнятну сіль або фармацевтично прийнятний сольват відповідно до звичайних способів складання композицій. Патентні публікації 1 і 2 не розкривають і не передбачають вказані проблеми і які-небудь способи вирішення таких проблем. KMD-3213, що міститься як активний інгредієнт лікарського засобу у вигляді твердої пероральної лікарської форми за винаходом, являє собою відому сполуку, і її можна одержати відповідно до процедур, описаних в патентній публікації 1. Приклади фармацевтично прийнятних солей KMD-3213, що міститься як активний інгредієнт лікарського засобу у вигляді твердої пероральної лікарської форми за винаходом, включають кислотно-адитивні солі, утворені з мінеральними кислотами, такі як хлористоводнева кислота, бромистоводнева кислота, йодистоводнева кислота, сірчана кислота, азотна кислота, фосфорна кислота і ним подібні; кислотно-адитивні солі, утворені з органічними кислотами, такі як оцтова кислота, 13 85359 пропіонова кислота, масляна кислота, щавлева кислота, лимонна кислота, янтарна кислота, винна кислота, фумарова кислота, яблучна кислота, молочна кислота, адипінова кислота, бензойна кислота, саліцилова кислота, метансульфонова кислота, бензолсульфонова кислота, паратолуолсульфонова кислота, глутамова кислота, аспарагінова кислота і ним подібні. Приклади сольвату включають сольвати з водою, етиловим спиртом або ним подібні. Лікарські засоби у вигляді твердої пероральної лікарської форми згідно з винаходом, такі як капсули, можна виготувати таким чином. KMD-3213, її фармацевтично прийнятну сіль або фармацевтично прийнятний сольват, якщо потрібно, змішують з наповнювачем, переважно D-манітом, відповідною зв'язувальною речовиною і розпушувачем. Потім суміш перемішують з додаванням водного розчину зв'язувальної речовини у відповідній концентрації і, якщо потрібно, просівають для одержання гранули. Потім до гранули додають змащувальну речовину, переважно, стеарат магнію і тверду домішку з гідрофільними або поверхнево-активними властивостями, переважно, лаурилсульфат, і в цьому випадку змащувальну речовину, що використовується, використовують в кількості 0,5-2,0% і тверду домішку використовують у співвідношенні від 1:10 до 20:10, більш переважно, від 5:10 до 10:10, ще більш переважно, 5:10 відносно стеарату магнію. Потім внаслідок змішування і заповнення у відповідну капсулу, переважно, в капсулу, що містить окис титану в кількості не менше ніж приблизно 3%, більш переважно, приблизно від 3,4 до 3,6% одержують капсулу. Таблетки можна виготувати таким чином. Гранулу одержують відповідно до процедур, аналогічних тим, які описані відносно капсул. Потім до гранули додають змащувальну речовину, переважно, стеарат магнію в кількості не більше 1%, переважно, від приблизно 0,6 до приблизно 0,8%, більш переважно, приблизно 0,7%. Потім змішування і таблетування звичайними способами надають непокриті таблетки. Потім, якщо потрібно, непокриті таблетки покривають напилюванням розчином покриття, який одержують розчиненням або суспендуванням речовини, що покриває плівкою, світлозахисного матеріалу, переважно, окису титану, пласти фікуючого матеріалу, якщо потрібно, відповідної змащувальної речовини, матеріалу, що придушує агломерацію, і фарбувальної речовини у відповідному розчиннику. Достатньо, щоб кількість окису титану була не менше 0,5 мг/см 2, більш переважно, 1,1 мг/см 2 на основі площі поверхні таблеток. KMD-3213 виявляє блокуючу активність відносно a 1-AR з меншим впливом на артеріальний тиск і являє собою дуже корисну сполуку для лікування дизурії, зв'язаної з гіпертрофією передміхурової залози і подібними захворюваннями. Повідомлялось, що гідрохлорид празосину і гідрохлорид тамуслосину, що володіють блокуючою активністю у відношенні αΐ-AR, можна також застосовувати для лікування дизурії, такої як склероз шийки сечового міхура, хронічний простатит, нейрогенний сечовий міхур і ним подібні. 14 Очікувалось, що KMD-3213 можна застосовувати для лікування дизурії, зв'язаної з органічними обструкціями уретри, такої як гіпертрофія передміхурової залози, стриктура уретри, камінь уретри, пухлини і ним подібні (що далі іменуються "гіпертрофією передміхурової залози і т.д.") і дизурії, зв'язаної з нервовими розладами контролю сечовипускання, а також дизурії, зв'язаної з функціональними обструкціями уретри, яка не включена в жоден з видів описаної вище дизурії, такий як склероз шийки сечового міхура, хронічний простатит, нестійкий сечовий міхур і ним подібні. Дизурія, зв'язана з нервовими розладами регуляції сечовипускання, означає дизурію, викликану розладами контролюючих нервів в уретрі або сечовому міхурі, наприклад, енцефалопатією, такою як цереброваскулярні розлади, пухлини мозку і ним подібні, розлади спинного мозку, такі як травми спинного мозку, розлади периферичних нервів, такі як цукровий діабет, стеноз поперекової ділянки спинномозкового каналу і ним подібні. Ці розлади можуть виникнути і у чоловіків, і у жінок, і загалом називаються нейрогенним сечовим міхуром. Дизурія, зв'язана з функціональними обструкціями уретри, що не супроводжуються органічними розладами уретри і з нервовими розладами регуляції сечовипускання, означає склероз шийки сечового міхура, хронічний простатит, нестійкий сечовий міхур, а також дизурію, викликану складністю сечовипускання, блокадою шийки сечового міхура, синдромом уретри, недостатністю спільної функції м'яза детрузору і м'яза сфінктера, хронічним циститом, простаодинією, синдромом Хінмана, синдромом Фоулера, психогенну дизурію, дизурію, викликану лікарськими засобами, старінням і ним подібну. Ці розлади загалом іменуються розладами нижнього відділу сечовивідних шляхі в. Лікарські засоби згідно з винаходом мають високу точність однорідності вмісту і відмінні властивості розчинення і, відповідно, можуть ефективно виявляти види активності KMD-3213. Лікарські засоби згідно з винаходом надто корисні для лікування дизурії, зв'язаної з органічними обструкціями уретри, такими як гіпертрофія передміхурової залози і т.д.; дизурії, зв'язаної з нервовими розладами регуляції сечовипускання, такої як нейрогенний сечовий міхур; і дизурії, зв'язаної з функціональними обструкціями уретри, такими як розлади нижнього відділу сечовивідних шля хів. У випадку введення лікарського засобу за винаходом, дозування активного інгредієнту відповідним чином визначають в залежності від статі, віку або маси тіла конкретного пацієнта, що підлягає лікуванню, стану і подібних факторів, причому дозування знаходиться приблизно в діапазоні від 1 до 50 мг, переважно, від 4 до 20 мг/д для дорослої людини. Лікарський засіб за винаходом може, крім того, включати як активний інгредієнт щонайменше один засіб, вибраний з групи, що складається із засобу, що блокує a 1-адренорецептори, антихолінергічного засобу, протизапального засобу і антибактеріального засобу, який відрізняється від KMD-3213, в доповнення до KMD-3213, її фарма 15 85359 цевтично прийнятної солі або фармацевтично прийнятного сольвату. Лікарський засіб за винаходом можна використати в комбінації з лікарським засобом, що включає як активний інгредієнт щонайменше один засіб, вибраний з групи, що складається із засобу, який блокує a 1-адренорецептори, антихолінергічного засобу, протизапального засобу і антибактеріального засобу, який відрізняється від KMD3213. У таких випадках дозування до KMD-3213, його фармацевтично прийнятної солі або фармацевтично прийнятного сольвату і дозування a 1адренорецепторів, антихолінергічного засобу, протизапального засобу і антибактеріального засобу, що відрізняється від KMD-3213, можна відповідним чином знизити. Короткий опис креслень Фіг. 1 являє собою креслення, яке показує зв'язок між часом змішування стеарату магнію і уповільнювальною дією стеарату магнію на час розчинення, на якому -··- означає композицію А, ○- означає композицію В при часі змішування 1 хв. (композиція В/1 хв.), -□- означає композицію В при часі змішування 3 хв. (композиція В/3 хв.) і -◊означає композицію В при часі змішування 7 хв (композиція В/7 хв.). По осі ординат показана швидкість розчинення (%), а по осі абсцис показаний час в хв. Фіг. 2 являє собою креслення, яке показує впливи різних видів домішок на подовження часу розчинення, викликаного стеаратом магнію, на якому -··- означає композицію A, -□- означає композицію В, -○- означає композицію С, - - означає композицію D, -♦- означає композицію Ε, -Δ- означає композицію F і -◊- означає композицію G. По осі ординат показана швидкість розчинення (%), а по осі абсцис показаний час в хв. Фіг. 3 являє собою креслення, яке показує зв'язок між співвідношеннями, що змішуються, між стеаратом магнію і лаурилсульфатом натрію і властивостями розчинення, на якому -○·- означає композицію Н, -□- означає композицію І, - Δ означає композицію J, -○- означає композицію К і ♦- означає композицію L. По осі ординат показана швидкість розчинення (%), а по осі абсцис показаний час в хв. Фіг. 4 являє собою креслення, яке показує властивості розчинення композицій прикладів 1-3, на якому -○-означає композицію прикладу 1, -·означає композицію прикладу 2 і -Δ- означає композицію прикладу 3. По осі ординат показана швидкість розчинення (%), а по осі абсцис показаний час в хв. Фіг.5 являє собою креслення, яке показує зв'язок між кількостями окису титану, що змішуються, і стійкості до світла в капсулах, що містять окис титану, на якому -○·- означає контроль (що зберігався в захи щеній від світла посудині), -Δ-означає капсулу А (що містить 1,2% окису титан у), - означає капсулу В (що містить 2,4% окису титану), і -○- означає капсулу С (що містить 3,6% окису титану). По осі ординат показані загальні кількості всіх зв'язаних речовин (%), і по осі абсцис показані кількості світлового впливу (1000 люкс/год.). 16 Найбільш переважний спосіб здійснення винаходу Наступні приклади і приклади тестів більш детально ілюструють винахід. Приклад 1 тестування Тест на сумісність KMD-3213 і різноманітні фармацевтичні домішки, які використовуються для складання композицій пероральних твердих лікарських форм, змішують і оцінюють на сумісність з KMD-3213. Домішки, які використовуються у великій кількості, такі як наповнювач, розпушувач і зв'язувальний агент, змішують з KMD-3213 у співвідношенні 1:1, та інші домішки, які використовуються в невеликій кількості, змішують у співвідношенні 10:1. Суміші зберігають в наступних умовах 1 і 2, і контролюють зміни після змішування, тобто несумісність. Продукти розпаду виявляють аналізом ВЕРХ відповідно до наступних умов ВЕРХ, а зовнішній вигляд контролюють візуальним дослідженням. Умови зберігання Умова 1: 40°С, відносна вологість 80% і 3 тижні Умова 2: 40°С, відносна вологість 75% і 4 місяці Метод аналізу Суміш KMD-3213 і фармацевтичної домішки, яка еквівалентна приблизно 5 мг KMD-3213, точно зважують і суміш розчиняють в метанолі для приготування точно 10 мл розчину після обробки ультразвуком протягом 10 хв. 4 мл розчину набирають в піпетку і додають метанол для приготування точно 5 мл розчину. Одержаний розчин фільтрують через мембранний фільтр з розміром пор не більше ніж 0,45 мкм. Цей розчин використовують як розчин, що тестується. 5 мкл кожного з розчинів, що тестуються, аналізують згідно з наступними умовами ВЕРХ. Співвідношення площі піка кожної з зв'язаних речовин відносно площі піка розчинів, за винятком площі піка розчинника, розраховують способом процентної частки площі. Умови ВЕРХ: Довжина хвиль: 225 нм Колонка: Capcell Pack С18 UG120 (Shiseido Co., Ltd.) Температура колонки: приблизно 25°С Рухома фаза: 6,8 г дигідрофосфату калію і 17,9 г динатрій гідрофосфат-12-гідрату розчиняють у воді для приготування 1000 мл розчину, потім розчин змішують з ацетонітрилом у співвідношенні 7:3 для приготування рухомої фази. Швидкість потоку: 1,0 мл/хв. Тривалість часу вимірювання: 40 хв. На таблицях 1 і 2 показані результати тестів відповідно в умовах 1 і 2. Як показано в таблицях 1 і 2, D-маніт є найбільш придатним як наповнювач, але мікрокристалічна целюлоза була несумісна. Що стосується розпушувачів, то найбільш придатним є кукурудзяний крохмаль, а карбоксиметилцелюлоза кальцію і карбоксиметилцелюлоза є надто несумісними. Що стосується зв'язувальних речовин, то гідроксипропілметилцелюлоза і гідроксипропілцелюлоза є досить несумісними. Що стосується по 17 85359 верхнево-активних речовин, то макроголь поліоксіетилен (105) поліоксипропілен (5) гліколь і цитрат триетилу є надто несумісними. Приклад 2 тестування Дослідження зв'язку між часом змішування стеарату магнію і подовженням часу розчинення Кореляцію між часом змішування і подовженням часу розчинення досліджують з використанням капсул, що містять D-маніт як наповнювач, частково заздалегідь желатинізований крохмаль (Крохмаль 1500 (зареєстрована марка), Japan Colorcon Co., Ltd.) як розпушувач і приблизно 1,0% стеарату магнію як змащувальну речовину. Кожну капсулу готують відповідно до композицій, показаних в таблиці 3, і оцінюють час їх розчинення. Спосіб тестування розчинення Тестування розчинення проводять з використанням 1 капсули при швидкості обертання лопатки 50 обертів в хвилину (об./хв,) відповідно до способу 2 тесту на розчинення (Японська фармакопея) з використанням лоту і 500 мл води як середовища, що тестується. 5 мл розчиненого розчину беруть через 5, 10, 15, 20 і 30 хв. після початку тесту, і такий же об'єм середовища, що тестується, наповнюють відразу. Розчин, взятий в кожну точку часу, фільтрують через мембранний фільтр з розміром пор не більше ніж 0,45 мкм. Пе 18 рші 4 мл фільтратів виливають і наступний фільтрат використовують як розчин, що тестується. Окремо зважують приблизно 0,01 г KMD-3213 і розчиняють у воді для приготування точно 100 мл розчину. 8 мл розчину набирають піпеткою і в нього додають воду для приготування точно 100 мл розчину, які використовують як стандартний розчин. Тест проводять з використанням 100 мкл кожного з розчинів, що тестуються, і стандартного розчину згідно з наступними умовами рідинної хроматографії. Швидкості розчинення розраховують за площею піка KMD-3213 в розчинах, що тестуються, і в стандартному розчині. Крім того, швидкості розчинення розраховують у вигляді середньої величини 6 зразків для кожної з капсул. Умови ВЕРХ: Довжина хвиль: 270 нм Колонка: Inertsil ODS-3 (GL Sciences Co., Ltd.) Температура колонки: приблизно 25°С Рухома фаза: 3,9 г дигідрофосфату дигідрату натрію і 2,5 мл водного розчину фосфорної кислоти (1 в 20) розчиняють у воді для приготування 1000 мл розчину, потім розчин змішують з ацетонітрилом у співвідношенні 5:2 для одержання рухомої фази. Швидкість потоку: 1,0 мл/хв. У випадках одержання капсул композиції В, які містять стеарат магнію, капсули виготовляли витягненням суміші через 1, 3, 5 і 7 хв. після початку змішування і ручним заповненням в оболонку капсули. Як показано на фіг. 1, спостерігається незначне подовження часу розчинення композиції В (час змішування: 1 хв.). Що стосується композиції В (час змішування: 3 хв.), то відбувається значне подовження часу розчинення. Приклад тестування 3 Дослідження поліпшуючи х ефектів фармацевтичних домішок на подовження часу розчинення, викликане стеаратом магнію Досліджували поліпшуючі ефекти різноманітних домішок на подовження часу розчинення, викликане додаванням 1% стеарату магнію для капсул. Капсули одержували додаванням такої ж кількості домішок, що тестуються, як і стеарату магнію до композиції В у прикладі тестування 2. Час розчинення капсул вимірюють відповідно до того ж способу тестування, як описано у прикладі тестування 2. Для одержання капсул спочатку одержують гранули, а потім домішки разом зі стеаратом магнію додають до гранул і змішують протягом 5 хв. Як показано на фіг.2, тільки лаурилсульфат натрію (композиція С) зменшував подовження часу розчинення, і композиція С виявила негайне роз 19 85359 20 чинення, як у випадку композиції А, в якій не вико ристовується стеарат магнію. Приклад тестування 4 Дослідження впливу співвідношення між стеаратом магнію і лаурилсульфатом натрію на час розчинення капсул Досліджували кореляцію між, з одного боку, співвідношенням між стеаратом магнію і лаурилсульфатом натрію, який виявив хороший поліпшуючий ефект на подовження часу розчинення, викликане додаванням стеарату магнію, і, з іншого боку, властивостями розчинення капсул. Капсули виготовляють відповідно до композицій, як показано в таблиці 5, і час їх розчинення оцінюють згідно зі способом 2 (спосіб перемішування) Японської фармакопеї за умови використання води як середовища тестування, яке описане в наступному способі тестування. Умови ВЕРХ такі ж, як в прикладі тестування 2. Спосіб тестування розчинення Тест на розчинення проводять з використанням 1 капсули при швидкості обертання лопатки 50 обертів в хвилину (об./хв.) відповідно до способу 2 тесту на розчинення (Японська фармакопея) з використанням лоту і 500 мл води як середовища, що тестується. 5 мл розчиненого розчину беруть через 5, 10, 15, 20 і 30 хв. після початку тесту, і такий же об'єм середовища, що тестується, наповнюють відразу. Після центрифугування розчинів, взятих в кожну точк у часу, при 3000 об./хв. протягом більше ніж 5 хв., 10 мкл концентрованої хлористоводневої кислоти додають до надосадової рідини центрифугованих розчинів і одержаний розчин використовують як розчин, що тестується. Окремо приблизно 0,01 г KMD-3213 зважують і розчиняють в 0,1 н. хлористоводневої кислоті для приготування точно 100 мл розчину. 2 мл розчину набирають піпеткою і додають 0,1 н. хлористоводневої кислоти для приготування точно 100 мл розчину, які використовують як стандартний розчин. Для одержання капсул спочатку одержують гранули, а потім до гранул додають домішки разом зі стеаратом магнію і змішують протягом 5 хв. Швидкості розчинення розраховують у вигляді середньої величини 6 зразків для кожної з капсул. Як показано на фіг.3, композиція І, що містить 10% лаурилсульфат натрію на основі стеарату магнію, виявляє хороший поліпшуючий ефект на властивість розчинення, і майже поліпшує час подовження розчинення. Приклад 1 Капсула, що містить 2,0 мг KMD-3213 2,0 частини KMD-3213, 134,4 частини Dманіту, 26,0 частин частково заздалегідь желатинізованого крохмалю (PCS (зареєстрований товарний знак), Asahi Chemical Industry Co., Ltd.) і 9,0 частин частково заздалегідь желатинізованого крохмалю (Крохмаль 1500 (зареєстрований товарний знак), Japan Colorcon., Ltd.) ретельно змішують. До суміші додають відповідну кількість води і суміш гранулюють. Гранули сушать з використанням сушіння рідкого шару при температурі повітря на впуску 60°С доти, доки повітря, що ви ходить, не досягне 40°С, і просівають через сито. Суміш 1,8 частин стеарату магнію і 1,8 частин лаурилсульфату натрію додають до просіяних гранул і змішують протягом 5 хв., і суміш заповнюють в оболонку капсули для виготовлення капсули, що містить 2,0 мг KMD-3213. Приклад 2 Капсула, що містить 4 мг KMD-3213 4,0 частини KMD-3213, 132,4 частини Dманіту, 26,0 частин частково заздалегідь желатинізованого крохмалю (PCS (зареєстрований товарний знак), Asahi Chemical Industry Co., Ltd.) і 9,0 частин частково заздалегідь желатинізованого крохмалю (Крохмаль 1500 (зареєстрований товарний знак), Japan Colorcon., Ltd.) ретельно змішують. До суміші додають відповідну кількість води і суміш гранулюють. Гранули сушать з використанням сушіння рідкого шару при температурі повітря на впуску 60°С доти, доки повітря, що ви ходить, не досягне 40°С, і просівають через сито. Суміш 1,8 частин стеарату магнію і 1,8 частин лаурилсульфату натрію додають до просіяних гранул і змішують протягом 5 хв., і суміш заповнюють в оболонку капсули для виготовлення капсули, що містить 4 мг KMD-3213. 21 85359 Приклад 3 Таблетка, що містить 4,0 мг KMD-3213 4,0 частини KMD-3213, 117,0 частин D-маніту, 7,0 частин низько заміщеної гідроксипропілцелюлози (L-HPC (зареєстрований товарний знак), Shin-Etsu Chemical Co., Ltd.) ретельно змішують. 12% водний розчин гідроксипропілцелюлози (4 частини гідроксипропілцелюлози і приблизно 30 частин води) додають в суміш і суміш гранулюють. Гранули суша ть з використанням сушіння рідкого шару при температурі повітря на впуску 60°С доти, доки повітря, що виходить, не досягне 40°С, і в сухому вигляді сортують за розміром і просівають через сито. 1,0 частину стеарату магнію додають до гранул і змішують протягом 3 хв. С уміш таблетують і покривають покриваючою речовиною для одержання таблетки, що містить 4,0 мг KMD-3213. Приклад тестування 5 Дослідження часу розчинення Для капсул або таблеток, описаних у прикладах 1-3, тест розчинення проводять згідно з наступним способом тестування розчинення. Умови ВЕРХ такі ж, як умови в прикладі тестування 2. Спосіб тестування розчинення Тест проводять з використанням 1 таблетки або 1 капсули, вміщеної в лот, при швидкості обертання лопатки 50 об./хв. відповідно до способу 2 тестування розчинення (Японська фармакопея) з використанням 500 мл води як тестового середовища. 5 мл розчиненого розчину беруть через 5, 10, 15, 20 і 30 хв. після початку тесту, і такий же об'єм середовища, що тестується, заповнюють відразу. Після центрифугування розчинів, взятих в кожну точку часу, при 3000 об./хв. протягом більше ніж 5 хв., 10 мкл концентрованої хлористоводневої кислоти додають до надосадової рідини центрифугованих розчинів, і одержаний розчин використовують як розчин, що тестується. Окремо зважують приблизно 0,01 г KMD-3213 і розчиняють в 0,1 н. хлористоводневої кислоти для виготовлення точно 100 мл розчину. У випадку лікарських форм, що містять 2 мг KMD-3213, у прикладі 1, 2 мл розчину набирають в піпетку і додають 0,1 н. хлористоводневу кислоту для приготування точно 100 мл розчину, які використовують як стандартний розчин. У випадку лікарських форм, що містять 4,0 мг KMD-3213, у прикладі 2 і 3, 4 мл розчину набирають в піпетку і додають 0,1 н. хлористоводневу кислоту для приготування точно 100 мл розчину, які використовують як стандартний розчин. Тест проводять з використанням 100 мкл кожного з розчинів, що тестуються, і стандартного розчину згідно з наступними умовами рідинної хроматографії. Швидкості розчинення розраховують за площею піка KMD-3213 в розчинах, що тестуються, і стандартному розчині. Крім того, швидкості розчинення розраховують як середню величину 6 зразків по кожній капсулі або таблетці. Умови ВЕРХ: Довжина хвиль: 270 нм Колонка: Inertsil ODS-3 (GL Sciences Co., Ltd.) Температура колонки: приблизно 25°С Рухома фаза: 3,9 г дигідрофосфату дигідрату натрію і 2,5 мл водного розчину фосфорної кисло 22 ти (1 в 20) розчиняють у воді для приготування 1000 мл розчину, потім розчин змішують з ацетонітрилом у співвідношенні 5:2 для одержання рухомої фази. Швидкість потоку: 1,0 мл/хв. Як показано на фіг.4, всі лікарські форми прикладів 1-3 виявили швидкість розчинення не менше 90% після початку тесту, і величини їх часу розчинення на 85% складають не більше 10 хв. Приклад тестування 6 Тест на світлочутливість капсули, що містить двоокис титану Тест на світлочутливість проводять для капсул, які були виготовлені відповідно до процедур, як описано у прикладі 1, з використанням оболонок капсул, що містять 1,2% (капсула А), 2,4% (капсула В) і 3,6% (капсула С) окису титану. Крім того, капсулу, виго товлену з використанням оболонки капсули, що містить 1,2% окису титану, упаковують в блістерну упаковку і алюмінієву кишеню для захисту від світла, і капсулу також тестують у вигляді сліпого контролю. Вміст, що заповнював капсулу, витягують на початку тесту і після впливу світла при загальному освітленні 0,672 і 1,2 мільйони люкс/год. і оцінюють їх зовнішній вигляд і кількість продуктів розпаду під дією світла (зв'язані речовини). Кількості продуктів розпаду під дією світла визначають згідно з наступними умовами ВЕРХ і зміни кольору спостерігають візуальним дослідженням. Аналіз продуктів розпаду під дією світла Вміст 5 капсул, що тестуються, витягують і вміщують в мірну колбу місткістю 50 мл. Пусті капсули промивають двічі рухомою фазою і промивні розчини вміщують в колбу. Приблизно 30 мл рухомої фази додають в колбу і суміш струшують протягом 15 хв. Потім в неї додають рухому фазу для одержання точно 50 мл розчину і розчин фільтрують через мембранний фільтр з розміром пор не більше ніж 0,45 мкм. Перші 2-3 мл фільтрати виливають і подальший фільтрат використовують як розчин, що тестується. 25 мкл кожного з розчинів, що тестуються, використовують для наступного аналізу ВЕРХ. Площу піка розчинів визначають способом автоматичного інтегрування і співвідношення між площею піка кожної зв'язаної речовини і площею піка KMD-3213 розраховують способом процентної частки площі. Умови ВЕРХ: Довжина хвиль: 225 нм Колонка: Inertsil ODS-3 (GL Sciences Co., Ltd.) Температура колонки: приблизно 25°С Рухома фаза: 3,9 г дигідрофосфату дигідрату натрію і 2,5 мл водного розчину фосфорної кислоти (1 в 20) розчиняють у воді для приготування 1000 мл розчину і розчин змішують з ацетонітрилом у співвідношенні 5:2 для одержання рухомої фази. Швидкість потоку: Довести час утримання KMD-3213 до 7 хв. Тривалість вимірювання: 30 хв. Як показано на фіг.5 і таблиці 6, капсула А, що містить 1,2% двоокису титану, не відповідала специфікації відносно зовнішнього вигляду і загальних кількостей всіх зв'язаних сполук після впливу світ 23 85359 24 ла при загальному освітленні 0,672 мільйони люкс/год. Капсула В, що містить 2,4% двоокису титану, також не відповідала специфікації після впливу світла при загальному освітленні 1,2 мільйони люкс/год. Навпаки, капсула С, що містить 3,6% двоокису титану, була найбільш стійкою і відповідала специфікації відносно зовнішнього вигляду і загальних кількостей всіх зв'язаних сполук. Промислова застосовність Лікарські засоби у вигляді твердої пероральної лікарської форми згідно з винаходом мають відповідні оперативні властивості для способів одержання, хорошу однорідність вмісту і відмінні властивості розчинення і широко застосовні на практиці як лікарський засіб у вигляді твердої пероральної лікарської форми для лікування дизурії. Лікарські засоби у вигляді твердої пероральної лікарської форми згідно з винаходом мають відповідні оперативні властивості при способі заповнення для капсул або при способі таблетування для таблеток, високу точність вмісту активного інгредієнту і стійкість. Крім того, лікарські засоби у вигляді твердої пероральної лікарської форми згідно з винаходом мають постійні і відмінні властивості розчинення при тесті розчинення з використанням води, в якій активний інгредієнт є найбільш важко розчинним, і найбільш ймовірно, що лікарські засоби не будуть біологічно еквівалентні. Відповідно, лікарські засоби у вигляді твердої пероральної лікарської форми згідно з винаходом дуже корисні як лікарський засіб у вигляді твердої пероральної лікарської форми для лікування дизурії. 25 Комп’ютерна в ерстка І.Скворцов а 85359 Підписне 26 Тираж 28 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюTablet containing granulated material with kmd-3213
Автори англійськоюNaganuma Tsuyoshi, Maramatsu Mitsuo
Назва патенту російськоюТаблетка, содержащая гранулированный материал с kmd-3213
Автори російськоюНаганума Цуйоси, Мурамацу Мицуо
МПК / Мітки
МПК: A61K 47/10, A61K 47/12, A61K 45/00, A61P 13/02, A61K 31/4045, A61K 9/20
Мітки: таблетка, містить, kmd-3213, матеріал, гранульований
Код посилання
<a href="https://ua.patents.su/13-85359-tabletka-shho-mistit-granulovanijj-material-z-kmd-3213.html" target="_blank" rel="follow" title="База патентів України">Таблетка, що містить гранульований матеріал з kmd-3213</a>
Попередній патент: Засіб, що є харчовим і кормовим продуктом та його застосування
Наступний патент: Статичний генератор електричної енергії
Випадковий патент: Спосіб підвищення продуктивності відлучених поросят












