(4r)-1′-[(2e)-3-(3,4-дихлорфеніл)проп-2-ен-1-іл]-2н,5н-спіро[імідазолідин-4,3′-індол]-2,2′,5(1’н)-тріон та його застосування
Формула / Реферат
1. Сполука (4R)-1'-[(2E)-3-(3,4-дихлорфеніл)проп-2-ен-1-іл]-2H,5H-спіро[імідазолідин-4,3'-індол]-2,2',5(1'Н)-тріон чи її сіль.
2. Сполука за п. 1 для застосування у терапії.
3. Застосування сполуки (4R)-1'-[(2E)-3-(3,4-дихлорфеніл)проп-2-ен-1-іл]-2H,5H-спіро[імідазолідин-4,3'-індол]-2,2',5(1'Н)-тріону чи її солі у виробництві медикаменту для лікування гострих та/чи хронічних больових розладів.
4. Застосування за п. 3, де хронічним больовим розладом є гострий біль.
5. Застосування за п. 3, де хронічним больовим розладом є невропатичний біль.
6. Застосування за будь-яким з пп. 3-5, де больовим розладом є будь-який гострий та хронічний запальний біль, гострий та хронічний ноцицептивний біль, поперековий біль, постоперативний біль, вісцеральний біль типу хронічного тазового болю, цистит, включаючи інтерстиціальний цистит та біль, пов'язаний з цим, ішемічний, сідничний біль, розсіяний склероз, артрит, фіброміалгія, індукований опіками біль та/або запальний біль в результаті опіків, біль та інші ознаки та симптоми, пов'язані з псоріазом, біль та інші ознаки та симптоми, пов'язані з раком, блюванням, нетриманням сечі, гіперактивним сечовим міхуром, ВІЛ-невропатією, шлунково-стравохідною рефлюксною хворобою (ШСРХ), синдромом подразненого кишечнику (СПК), запальною хворобою кишечнику (ЗХК) та/або панкреатитом, включаючи ознаки та/або симптоми, пов'язані з вказаними хворобами.
Текст
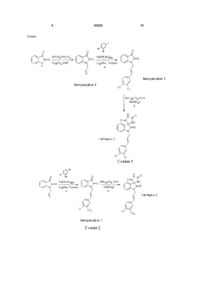
1. Сполука (4R)-1'-[(2E)-3-(3,4дихлорфеніл)проп-2-ен-1-іл]-2H,5Hспіро[імідазолідин-4,3'-індол]-2,2',5(1'Н)-тріон чи її сіль. 2. Сполука за п. 1 для застосування у терапії. 3. Застосування сполуки (4R)-1'-[(2E)-3-(3,4дихлорфеніл)проп-2-ен-1-іл]-2H,5Hспіро[імідазолідин-4,3'-індол]-2,2',5(1'Н)-тріону чи її C2 2 (19) 1 3 Сполуки з VR1-інгібіторною активністю, можна думати, мають потенційне застосування для лікування та/або профілактики розладів, як-то біль, особливо біль запального або травматичного походження, як-то артрит, ішемія, рак, фіброміалгія поперековий біль та постоперативний біль (Walker et al J Pharmacol Exp Ther (2003) Jan, 304(1) 5662). На додаток до цього вісцерального болю, якто хронічний тазовий біль, цистит синдром подразненого кишечнику (СПК), панкреатит тощо, а також невропатичний біль, як-то сідничний біль, ВІЛневропатія, розсіяний склероз, тощо (Walker et al ibid, Rashid et al J Pharmacol Exp Ther (2003) Mar 304(3) 940-8), є потенційні больові стани, що можна було б лікувати інгібіторами VR1. Ці сполуки, можна також думати, є потенційно корисними для запальних розладів типу астми, кашлю, запальної хвороби кишечнику (ЗХШ) (Hwang та Oh Curr Opin Pharmacol (2002) Jun, 2(3) 235-42) Сполуки з блокаторною активністю стосовно VR1 є також корисними для сверблячки та хвороб шкіри типу псоріазу та для хвороби шлунково-стравохідний рефлекс (ХШСР), блювота, рак, нетримання сечі та гіперактивний сечовий міхур (Yiangou et al BJU Int (2001) Jun; 87(9):774-9, Szallasi Am J Clin Pathol (2002) 118: 110-21). Інгібітори VR1 мають також потенційне застосування для лікування та/або профілактики від піддавання дії активаторів VR1 типу капсаїцину або сльозогінного газу, кислоти або жару (Szallasi ibid). Наступне потенційне застосування стосується лікування толерантності до активаторів VR1. Інгібітори VR1 можуть також бути корисними у лікуванні інтерстиціального циститу та болю, пов'язаного з інтерстиціальним циститом. Інгібітори VR1 можуть також бути корисними у лікуванні ожиріння та мігрені; WO2006/007851 розкриває застосування антагоністів VR1 для лікування ожиріння. ЕР 66378 та ЕР 28906 розкривають спіропохідні гідантоїну для застосування як інгібітори редуктази альдози. WO 92/07830 описує спіро-похідні гідантоїну та їх застосування як антагоністів пептиду вивільнення гастрину. Об'єктом заявленого винаходу є забезпечення сполук вказаного типу, котрі виявляють інгібіторну активність стосовно ванілоїдного рецептору 1 (VR1), разом з гарним метаболізмом ліків та фармакокінетичними (DMPK) властивостями. Наступним об'єктом є забезпечення таких сполук, що виявляють поліпшену потужність in vitro, поліпшену селективність та поліпшену розчинність. Відповідно, заявлений винахід стосується сполук формули І, 93226 4 де R1 та R2, незалежно, - галоген або С13галогеналкіл, X - етеніл або етиніл, або їх солей, за умови, що ними не є 1'-[(2Е)-3-(3,4дихлорфеніл)проп-2-ен-1-іл]-2Н,5Нспіро[імідазолідин-4,3'-індол]-2,2',5(1'Н)-трион у рацемічній формі. Одне втілення винаходу стосується сполук формули І, де R1 - галоген, a R2 - С1-3галогеналкіл. Ще одне втілення винаходу стосується сполук формули І, де R1 - хлор або флуор та R2 - С1-3хлоралкіл або С1-3флуоралкіл. Наступне втілення винаходу стосується сполук формули І, де R1 - хлор. Одне втілення винаходу стосується сполук формули І, де R1 та R2 - хлор. Ще одне втілення винаходу стосується сполук формули І, де Х або Наступне втілення винаходу стосується сполук формули І, де Χ - етиніл. Одне втілення винаходу стосується сполук формули І, вибраних з групи: 1'-[(2E)-3-(3-хлор-4-трифлуорфеніл)проп-2-ен1-іл]-2Н,5H-спіро[імідазолідин-4,3'-індол]2,2',5(1'Н)-трион та 1'-[3-(3,4-дихлорфеніл)проп-2-ін-1-іл]-2Н,5Нспіро[імідазолідин-4,3'-індол]-2,2',5(1'Н)-трион. 5 93226 6 Ще одне втілення винаходу стосується сполук формули І для застосування як медикаменту, за умови, що сполукою не є 1'-[(2Е)-3-(3,4дихлорфеніл)проп-2-ен-1-іл]-2Н,5Нспіро[імідазолідин-4,3'-індол]-2,2',5(1'Н)-трионом у рацемічній формі. Наступне втілення винаходу стосується сполук формули І де R1 та R2, незалежно, - галоген або С1галогеналкіл, 3 X - етеніл або етиніл, або її солі, у виробництві медикаменту для лікування опосередкованих VR1 розладів. Заявлений винахід також стосується по суті чистого одиничного енантіомеру, що має формулу II: де R1 та R2, незалежно, - галоген або С13галогеналкіл, X - етеніл або етиніл, або їх солей, для застосування як медикаменту для лікування опосередкованих VR1 розладів. Одне втілення винаходу стосується застосування сполуки, що має формулу І де R1 та R2, незалежно, - галоген або С1галогеналкіл, 3 X - етеніл або етиніл, або її солі, у виробництві медикаменту, за умови, що сполукою не є 1'-[(2Е)-3-(3,4дихлорфеніл)проп-2-ен-1-іл]-2Н,5Нспіро[імідазолідин-4,3'-індол]-2,2',5(1'Н)-трион у рацемічній формі; в одному втіленні це застосування є для лікування опосередкованих VR1 розладів. Ще одне втілення винаходу стосується застосування сполуки, що має формулу І де R1 та R2, незалежно, - галоген або С13галогеналкіл, X - етеніл або етиніл, або його солі. Одне втілення винаходу стосується енантіомеру формули II, де R1 - галоген та R2 - С13галогеналкіл. Ще одне втілення винаходу стосується енантіомеру формули II, де R1 - хлор або флуор та R2 С1-3хлоралкіл або С1-3флуоралкіл. Наступне втілення винаходу стосується енантіомеру формули II, де R1 - хлор. Одне втілення винаходу стосується енантіомеру формули II, де R1 та R2 - хлор. Ще одне втілення винаходу стосується енантіомеру формули II, де X або Наступне втілення винаходу стосується енантіомеру формули II, де X - етиніл. Одне втілення винаходу стосується енантіомеру формули II, вибраного з групи: (4R)-1'-[(2Е)-3-(3,4-дихлорфеніл)проп-2-ен-1іл]-2H,5H-спіро[імідазолідин-4,3'-індол]-2,2'5(1'Н)трион, (4R)-1'-[(2E)-3-(3-хлор-4-трифлуорфеніл)проп2-ен-1-іл]-2Н,5H-спіро[імідазолідин-4,3'-індол]2,2',5(1'Н)-трион, та 7 93226 (4R)-1'-[3-(3,4-дихлорфеніл)проп-2-ін-1-іл]2Н,5Н-спіро[імідазолідин-4,3'-індол]-2,2',5(1'Н)трион. Нижченаведене є визначеннями різних термінів, застосовуваних в описі та формулі винаходу для опису заявленого винаходу. Для запобігання невизначеності слід розуміти, що там, де у цьому описі група кваліфікована як 'визначено вище', вказана група охоплює перше та найширше визначення, а також кожне та усі з інших визначень цієї групи. Якщо не вказане інше у цьому описі, номенклатура застосовувана у цьому описі, загалом відповідає прикладам та правилам, встановленим у Nomenclature of Organic Chemistry, Sections A, B, C, D, E, F, and H, Pergamon Press, Oxford, 1979, що уведено тут як довідку стосовно хімічної структури та правил називання хімічних структур. Для запобігання невизначеності слід розуміти, що у цьому описі "С1-3 " означає групу, що має 1, 2, або 3 атоми карбону. У цьому описі, якщо не вказане інше, термін "алкіл" охоплює алкіли з лінійним та нелінійним ланцюгом, як-то, але без обмеження метил, етил, н-пропіл, і-пропіл, н-бутил, і-бутил, втор-бутил, тбутил, н-пентил, і-пентил, т-пентил, нео-пентил нгексилабо і-гексил, т-гексил. Як визначено у цьому описі, ляє транс-етеніл груп та представ представляє цис-етеніл груп. У цьому описі, якщо не вказане інше, термін "галоген" може означати флуор, йод, хлор або бром. Термін "галогеналкіл" позначає алкіл, де алкіл є заміщеним галогеном від одного до повністю заміщеного, де повністю заміщений галогеналкіл може бути представляеним формулою ChL2h+1, де L - галоген, a "h" представляє число атомів карбону, коли є більше, ніж один галоген, тоді галогени можуть бути тими ж або різними та вибраними з групи F, СІ, Вr та І, слід розуміти, що терміни "алкіл" та "галоген" мають ті ж визначення, як виявлені тут. У деяких втіленнях, галогеналкілом є "С13галогеналкіл", а група містить 1-3 карбони, деякі втілення містять 1-2 карбони, а деякі втілення містять 1 карбон. Коли гало геналкіл є повністю заміщеним атомами галогену, цю групу позначено тут як пергалогеналкіл, одним прикладом є алкіл, повністю заміщений атомами флуору та позначений тут як "перфлуоралкіл". У деяких втіленнях, приклади галогеналкілу охоплюють, але без обмеження, дифлуорметил, флуорметил, 2,2,2трифлуоретил, 2,2-дифлуоретил, 2-флуоретил, 1,2,2-трифлуоретил, 1,2-дифлуоретил, 1,1дифлуоретил, 1,1,2-трифлуоретил, 3,3,3трифлуорпропіл, 2,2-дифлуорпропіл, 3,3дифлуорпропіл, 3-флуорпропіл, 2,3,3трифлуорпропіл, 2,3-дифлуорпропіл, 2,2,3,3,3пентафлуорпропіл, 2,2,3,3-тетрафлуорпропіл, 8 2,2,3-трифлуорпропіл, 1,2,3,3-тетрафлуорпропіл, 1,2,3-трифлуорпропіл, 3,3-дифлуорпропіл, 1,2,2,3тетрафлуорпропіл, 4,4-дифлуорбутил, 3,3дифлуорбутил, 4,4,4-трифлуорбутил, 3,3дифлуорбутил, тощо. У деяких втіленнях, приклади перфлуоралкілу охоплюють, без обмеження, трифлуорметил, пентафлуоретил, гептафлуорпропіл, 1,2,2,2-тетрафлуор-1-трифлуорметил-етил, тощо. В одному втіленні термін "С1-3галогеналкіл" може охоплювати, але без обмеження флуорметил, дифлуорметил, трифлуорметил, флуор-етил, дифлуоретил або бром пропіл. Заявлений винахід стосується сполук формули І та енантіомерів формули II, які визначено вище, а також їх солей. Солі для застосування у фармацевтичних композиціях повинні бути фармацевтично прийнятними солями, але інші солі можуть бути корисними при отриманні сполук формули І та/або енантіомерів формули II. Придатною фармацевтично прийнятною сіллю сполук та енантіомерів винаходу є, наприклад, кислотно- або основно-адитивна сіль, наприклад, сіль з неорганічною або органічною основою або кислотою. На додаток, придатною фармацевтично прийнятною сіллю сполук та енантіомерів винаходу є сіль лужного металу, сіль лужноземельного металу або сіль з органічною основою. Інші фармацевтично прийнятні солі та способи отримання цих солей можуть бути виявлені, наприклад, у Remington's Pharmaceutical Sciences (18th Edition, Mack Publishing Co.). Винахід також стосується будь-яких та усіх таутомерних форм сполук формули І та енантіомери формули II. Способи отримання Заявлений винахід стосується способів отримання сполук та енантіомерів формули І та II, або їх солей. При описі таких способів слід розуміти що там, де прийнятно, придатні захисні групи треба додавати, а далі видаляти з різних реагентів та інтермедіатів таким чином, що зрозумілий фахівцю з органічного синтезу. Звичайні процедури застосування таких захисних груп, а також приклади придатних захисних груп є описаними, наприклад, у "Protective Groups in Organic Synthesis", T.W. Green, P.G.M. Wuts, Wiley-lnterscience, New York, (1999). Довідки та описи інших придатних реакцій є у довідниках з органічної хімії, наприклад, "Advanced Organic Chemistry", March, 4th ed. McGraw Hill (1992) або, Organic Synthesis", Smith, McGraw Hill, (1994). Для репрезентативних прикладів дивись, наприклад, "Heterocyclic Chemistry", J. A. Joule, K. Mills, G. F. Smith, 3rd ed. Chapman та Hall (1995), p. 189-224 та "Heterocyclic Chemistry", T. L. Gilchrist, 2nd ed. Longman Scientific та Technical (1992), p. 248-282. Термін "кімнатна температура" та "температура довкілля" означають, якщо не вказане інше, температуру між 16 та 25°С. Термін "підвищена температура" означає, якщо не вказане інше, температуру між 50 та 150°С. 9 Схеми 93226 10 11 93226 12 Одне втілення винаходу стосується способу отримання сполук формули І, де R1, R2 та X визначені вище, який полягає у: Реакції необов'язково захищеної сполуки формули III і) з KCN та (NH4)2CO3 при підвищеній температурі у придатному розчиннику, та після цього необов'язково: ii) перетворення сполуки формули І у ще одну сполуку формули І, та/або iii) видалення будь-якої захисної групи, та/або іν) утворення фармацевтично прийнятної солі. Одне втілення винаходу стосується способу отримання енантіомеру формули II, де R1, R2 та X визначені вище, який полягає у: Реакції необов'язково захищеної сполуки формули III і) із KCN та (NH4)2СО3 при підвищеній температурі у придатному розчиннику, та після цього відділення вказаного енантіомеру від рацемічної суміші надкритичною рідинною хроматографією. Інтермедіати Наступне втілення винаходу стосується сполук, вибраних з групи: 1-Аліл-1Н-індол-2,3-діон 1-[(2Е)-3-(3,4-дихлорфеніл)проп-2-ен-1-іл]-1Hіндол-2,3-діон 1-{(2Е)-3-[4-хлор-3(трифлуорметил)феніл]проп-2-ен-1-іл}-1H-індол2,3-діон 1-проп-2-ін-1-іл-1Н-індол-2,3-діон 1-[3-(3,4-дихлорфеніл)проп-2-ін-1-іл]-1H-індол2,3-діон котрі можна застосовувати як інтермедіати в отриманні сполук, придатних для лікування опосередкованих VR1 розладів, особливо для застосування як інтермедіатів для отримання сполук формули І та/або енантіомерів формули II. Одне втілення винаходу стосується способу отримання інтермедіатів формули III, де R1, R2 та X визначені вище, який полягає у: Реакції необов'язково захищеної сполуки формули IV 13 із де HAL - атом галогену, у присутності придатного паладієвого каталізатору, як-то Pd(P(T-Bu)3)2 або Pd(OAc)2, у придатному розчиннику, та після цього необов'язково: іі) перетворення інтермедіату формули III у ще один інтермедіат формули III; та/або iii) видалення будь-якої захисної групи. Фармацевтична композиція Згідно з одним втіленням заявленого винаходу запропоновано фармацевтичну композицію, що містить як активний інгредієнт терапевтично ефективну кількість сполуки формули І та/або енантіомеру формули II або його солі в асоціації із одним або більше фармацевтично прийнятними розріджувачами, наповнювачами та/або інертними носіями. Композиція може бути у формі для перорального застосування, наприклад, як таблетка, пілюля, сироп, порошок, гранула або капсула, для парентеральних ін'єкцій (охоплюючи внутрішньовенну, підшкірну, внутрішньом'язову, внутрішньосудинну або вливанням) як стерильний розчин, суспензія або емульсія, для місцевого застосування, наприклад, як мазь, пластир або крем, для ректального застосування, наприклад, як супозиторій або для інгаляцій. Загалом вищезгадані композиції можна отримувати звичайним чином, застосовуючи один або більше звичайних наповнювачів, фармацевтично прийнятних розріджувачів та/або інертних носіїв. Придатні добові дози сполуки формули І та/або енантіомеру формули II у лікуванні ссавця, охоплюючи людину, є приблизно 0,01-250 мг/кг маси тіла при пероральному застосуванні та приблизно 0,001-250 мг/кг маси тіла при парентеральному застосуванні. Типова добова доза активного інгредієнту варіює у широких межах та залежить від різних факторів, як-то важливих показань, суворості захворювання, що лікують, шляху застосування, віку, маси та статі пацієнта та конкретної сполуки, що є застосовуваною, та може бути визначеною лікарем. Медичне застосування Сполуки згідно з заявленим винаходом є корисними у терапії Сполуки та енантіомери винаходу, або їх солі, а також їх відповідні активні метаболі 93226 14 ти, виявляють високий ступінь потужності та селективності стосовно індивідуального ванілоїдного рецептору 1 (VR1). Відповідно, сполуки заявленого винаходу, як очікують, будуть корисними у лікуванні станів, пов'язаних із збуджувальним активуванням ванілоїдного рецептору 1 (VR1). Сполуки можна застосовувати для продукування інгібіторної дії VR1 у ссавців, охоплюючи людину. VR1 дуже експресується у периферійній нервовій системі та в інших тканинах. Таким чином, очікують, що сполуки та енантіомери винаходу є добре придатними для лікування опосередкованих VR1 розладів. Сполуки та енантіомери винаходу, як очікують, будуть придатними для лікування гострого та хронічного болю, гострого та хронічного невропатичного болю та гострого та хронічного запального болю. Приклади такого розладу можуть бути вибраними з групи поперековий біль, постоперативний біль, вісцеральний біль типу хронічного тазового болю тощо. Сполуки винаходу, як також очікують, будуть придатними для лікування гострого та хронічного ноцицептивного болю. Наступні важливі розлади можуть бути вибраними з групи цистит, охоплюючи інтерстиціальний цистит та біль, пов'язаний з цим, ішемічний, сідничний біль, розсіяний склероз, артрит, остеоартрит, ревматоїдний артрит, фіброміалгія, біль та інші ознаки та симптоми, пов'язані з псоріазом, біль та інші ознаки та симптоми, пов'язані з раком, блювота, нетримання сечі, гіперактивний сечовий міхур та ВІЛ-невропатія. Додаткові важливі розлади можуть бути вибраними з групи хвороба шлунково-стравохідний рефлюкс (ХШСР), синдром подразненого кишечнику (СПК), запальна хвороба кишечнику (ЗХШ) та панкреатит. Інші важливі розлади є пов'язаними з респіраторними хворобами та можуть бути вибраними з групи астма, кашель, хронічна обструктивна хвороба легень, особливо хронічна обструктивна хвороба легень (ХОХЛ) та емфізема, фіброз легень та інтерстиціальна хвороба легень. Іншими важливими розладами є ожиріння та хвороби або розлади, пов'язані з ожирінням, та мігрень. В одному втіленні ожиріння чи хвороби або розлади, пов'язані з ожирінням, вибрані з групи серцево-судинна хвороба, гіпертензія, рак та репродуктивні розлади. Інгібітори VR1 можна застосовувати перорально або інгаляцією. Респіраторною хворобою може бути гостре та хронічне захворювання та це може бути пов'язаним з інфекціями та/або піддаванням дії зовнішніх забруднень та/або подразників. Сполуки та енантіомери винаходу можна також застосовувати як антитоксин для лікування дії активаторів VR1 типу капсаїцину, сльозогінного газу, кислоти або жару. Стосовно жару, можливе потенційне застосування антагоністів VR1 при ін 15 дукованому опіками болю, або запальному болю в результаті опіку. Сполуки можна крім того застосовувати для лікування толерантності до активаторів VR1. Одне втілення винаходу стосується сполук та енантіомерів винаходу, які визначені вище, для застосування як медикаментів. Ще одне втілення винаходу стосується сполук та енантіомерів винаходу, які визначені вище, для застосування як медикаментів для лікування опосередкованих VR1 розладів. Наступне втілення винаходу стосується сполук та енантіомерів винаходу, які визначені вище для застосування як медикаментів для лікування гострих та хронічних больових розладів. Ще одне втілення винаходу стосується сполук та енантіомерів винаходу, які визначені вище, для застосування як медикаментів для лікування гострого та хронічного ноцицептивного болю. Ще одне втілення винаходу стосується сполук та енантіомерів винаходу, які визначені вище, для застосування як медикаментів для лікування гострого та хронічного невропатичного болю. Наступне втілення винаходу стосується сполук та енантіомерів винаходу, які визначені вище, для застосування як медикаментів для лікування гострого та хронічного запального болю. Одне втілення винаходу стосується сполук та енантіомерів винаходу, які визначені вище, для застосування як медикаментів для лікування поперекового болю, постоперативного болю та вісцерального болю типу хронічний тазовий біль. Ще одне втілення винаходу стосується сполук та енантіомерів винаходу, які визначені вище, для застосування як медикаментів для лікування циститу, охоплюючи інтерстиціальний цистит та біль пов'язаний з цим, ішемічний сідничний біль, розсіяний склероз, артрит, остеоартрит, ревматоїдний артрит, фіброміалгія, біль та інші ознаки та симптоми, пов'язані з псоріазом, біль та інші ознаки та симптоми, пов'язані з раком, блювота, нетримання сечі, гіперактивний сечовий міхур та ВІЛневропатія. Наступне втілення винаходу стосується сполук та енантіомерів винаходу, які визначені вище, для застосування як медикаментів для лікування хвороби шлунково-стравохідний рефлюкс (ХШСР), синдрому подразненого кишечнику (СПК), запальної хвороби кишечнику (ЗХШ) та панкреатиту. Наступне втілення винаходу стосується сполук та енантіомерів винаходу, які визначені вище, для застосування як медикаментів для лікування респіраторних хвороб, вибраних з групи астма кашель, хронічна обструктивна хвороба легень (ХОХЛ), хронічна обструктивна хвороба легень та емфізема, фіброз легень та інтерстиціальна хвороба легень. Одне втілення винаходу стосується застосування сполук та енантіомерів винаходу які визначені вище, у виробництві медикаментів для лікування опосередкованих VR1 розладів та лікування гострих та хронічних больових розладів, гострого та хронічного невропатичного болю та гострого та хронічного запального болю та респіраторних хвороб та будь-якого іншого вищезгаданого розладу. 93226 16 Ще одне втілення винаходу стосується способу лікування опосередкованих VR1 розладів та гострих та хронічних больових розладів, гострого та хронічного невропатичного болю та гострого та хронічного запального болю та респіраторних хвороб та будь-якого іншого вищезгаданого розладу, який полягає у застосуванні до ссавця охоплюючи людину, при необхідності такого лікування, терапевтично ефективної кількості сполуки та/або енантіомеру винаходу, які визначені вище. Наступне втілення винаходу стосується фармацевтичної композиції, що містить сполуку та/або енантіомер винаходу, які визначені вище, для застосування у лікуванні опосередкованих VR1 розладів та для лікування гострих та хронічних больових розладів, гострого та хронічного невропатичного болю та гострого та хронічного запального болю та респіраторних хвороб та будьякого іншого вищезгаданого розладу. У контексті опису, термін "терапія" та "лікування" охоплює попередження та профілактику, якщо не визначене інше Терміни "лікувальний", "терапевтичний" та "терапевтично" слід розуміти відповідно. У цьому описі, якщо не вказане інше, термін "інгібітор" та "антагоніст" означають сполуку, що будь-якими засобами, частково або повністю, блокує перетворення провідного шляху призводячи до отримання реакції на ліганд. Термін "розлад", якщо не вказане інше означає будь-які стан та хворобу, пов'язані з активністю ванілоїдного рецептору. Немедичне застосування На додаток до їх застосування у терапії, сполуки та енантіомери винаходу, або їх солі, є також корисними як фармакологічні інструментальні засоби у розробці та стандартизації of in vitro та in vivo тест-системи для оцінки дії інгібіторів пов'язаної з VR1 активності у лабораторних тварин, як-то кішки, собаки, кролі, мавпи, щури та миші, як частині дослідження нових терапевтичних агентів. Приклади Винахід далі ілюстровано наступними необмежувальними прикладами. Загальні способи Винахід далі ілюстровано наступними прикладами, у котрих загалом: (і) операції проводили при зовнішній або при кімнатній температурі, тобто у межах 17-25°С та в атмосфері інертного газу, як-то аргон, якщо не вказане інше; (ii) випарювання проводили роторним випарюванням у вакуумі та обробку проводили після видалення залишкових твердих продуктів фільтруванням; (iii) Спектри 1Н ЯМР реєстрували на Bruker при 400 МГц. Мас-спектри реєстрували застосовуючи електророзпилення (РХ-МС; РХ:Waters 2790, колонка ХТеrrа МС С8 2,5 мкм 2,1X30 мм, градієнт буферу Н2О+0,1%ТФОК:CH3CN+0 04%ТФОК, МС: micromass ZMD// амоній-ацетатний буфер) способи іонізації; (іν) вихід, де присутній, не є обов'язково максимальним; (ν) застосовані наступні скорочення: 17 alloc алілоксикарбоніл ДХЕ дихлоретан ДХМ дихлорметан DMAP диметиламінопіридин EDC 1-(3-диметиламінопропіл)-3етилкарбодіїмід гідрохлорид HATU О-(7-азабензотриазол-1-іл)-N,N,N',N'тетраметилуроній гексафлуорфосфат ВЕРХ високоефективна рідинна хроматографія РХ рідинна хроматографія MsCI метансульфонілхлорид МС мас-спектрометрія ТФОК трифлуороцтова кислота ТГФ тетрагідрофуран ДМФ диметилформамід TMEDA тетраметилетилендіамін EtOAc етилацетат BuLi Бутиллітій TMEDA тетраметилетилендіамін Інтермедіат 1: 1-Аліл-1Н-індол-2,3-діон Ізатин (10,102 г, 68,7 ммоль) розчиняли у 100 мл сухого ДМФ, та додавали Cs2CO3 (24,609 г, 75,5 ммоль). До утвореної пурпурово-коричневої суспензії додавали алілбромід (7,2 мл, 83 ммоль) та реакційну суміш перемішували при кімнатній температурі протягом 16 годин. Утворену мутну оранжево-коричневу суміш концентрували у вакуумі, та залишок розподіляли між EtOAc (160 мл) та водою (80 мл). Шари розділяли та водний шар екстрагували додатково EtOAc (2x80 мл). Комбіновані органічні фази сушили Na2SO4, фільтрували, та концентрували у вакуумі. До залишку додавали 300 мл гексанів. Суміш нагрівали до 70°C водяною банею, та додавали EtOAc до розчинення сполуки (приблизно 80 мл EtOAc). Невелику кількість нерозчинного червоного матеріалу видаляли, а тоді розчину давали охолонути. Утворені червоні кристали фільтрували, промивали 3x30 мл гексанів, та тоді сушили під вакуумом, отримуючи заголовну 1 сполуку (11,740 г, 91%). Н ЯМР (600 МГц, хлоро-1 форм-D) млн 4,36 (d, J=5,6 Гц, 2H), 5,26-5,34 (m, 2H), 5,78-5,88 (m, 1H), 6,88 (d, J=7,9 Гц, 1H), 7,11 (t, J=7,6 Гц, 1H), 7,56 (td, J=7,8, 1,3 Гц, 1H), 7,61 (d, J=7,4 Гц, 1H) MC (ESI) (M+H)+ = 188 Інтермедіат 2: 1-[(2Е)-3-(3,4дихлорфеніл)проп-2-ен-1-іл]-1H-індол-2,3-діон Суміш 1-аліл-1Н-індол-2,3-діону (1 00 г, 5,34 ммоль), Pd(P(T-Bu)3)2 (0,0819 г, 0,16 ммоль), 1,2дихлор-4-йодбензолу (1,458 г, 5,34 ммоль), сухого толуолу (10 мл), та N-циклогексил-Nметилциклогексанаміну (1,23 мл, 5,86 ммоль) у висушеній у шафі герметичній тубі в атмосфері N2 нагрівали протягом 16 годин при 80°C. Реакційну суміш охолоджували, розбавляли СН2СІ2, та завантажували безпосередньо на колонку з силікагелем, упаковану з СН2СІ2. Колонку елювали з градієнтом 100% СН2СІ2 - 95:5 СН2СІ2:EtOAc. Прийнятні фракції комбінували, отримуючи заголовну сполуку як оранжевий твердий матеріал (1,489 г, 84%). 1 Н ЯМР (600 МГц, хлороформ-D) млн-1 4,52 (d, J=5,9 Гц, 2H), 6,19 (dt, J=15,9, 5,9 Гц, 1H), 6,56 (d, J=15,6 Гц, 1H), 6,91 (d, J=7,9 Гц, 1H) 7,09-7,20 (m, 2H), 7,37 (d, J=8,2 Гц 1H), 7,42 (s, 1H), 7,57 (t, J=7,8 Гц, 1H), 7,64 (d, J=7,4 Гц, 1H). 93226 18 Інтермедіат 3: 1-{(2E)-3-[4-хлор-3(трифлуорметил)феніл]проп-2-ен-1-іл}-1Н-індол2,3-діон Шість окремих висушених у шафі герметичних туб завантажували 1-аліл-1H-індол-2,3-діоном (0,100 г, 0,534 ммоль), Pd(P(T-Bu)3)2 (0,0082 г, 0,016 ммоль), 4-бром-1-хлор-2(трифлуорметил)бензолом (0,139 г, 0,536 ммоль), сухим толуолом (1 мл), та N-циклогексил-Nметилциклогексанаміном (0,12 мл, 0,57 ммоль) в атмосфері N2. Туби нагрівали протягом 16 годин при 80°C у масляній бані, а тоді реакційні суміші охолоджували та концентрували у вакуумі. Сирий матеріал застосовували на наступному етапі. Інтермедіат 4: 1-проп-2-ін-1-іл-1Н-індол-2,3діон До розчину ізатину (200 мг, 1,36 ммоль) у ДМФ (5 мл) додавали цезій карбонат (487 мг, 1,5 ммоль). Реакційну суміш перемішували при кімнатній температурі протягом 90 хвилин. Пропаргілбромід (243 мкл, 1,63 ммоль) тоді додавали. Реакційну суміш перемішували протягом ночі при кімнатній температурі, концентрували у вакуумі, розчиняли у EtOAc та промивали насиченим NaHCO3(водн) (1х). Шари розділяли та водний шар екстрагували додатково EtOAc (2х). Комбіновані органічні фази сушили Na2SO4, фільтрували та концентрували у вакуумі. Наступна очистка залишку не була необхідною. Заголовну сполуку отримували як оранжевий твердий матеріал (255 мг, кількісний вихід). 1Н ЯМР (400 МГц, CDCI3) 2,31 (t, J=2,54 Гц, 1Н), 4,55 (d, J=2,54 Гц, 2H), 7,12-7,15 (m, 1H), 7,19 (dt, J=7,52, 0,78 Гц, 1H), 7,63-7 68 (m, 2H). Інтермедіат 5: 1-[3-(3,4-дихлорфеніл)проп-2-ін1-іл]-1H-індол-2,3-діон До суміші 1-проп-2-ін-1-іл-1Н-індол-2,3-діону (190 мг, 1,03 ммоль), 1,2-дихлор-4-йодбензолу (420 мг, 1,54 ммоль), купрум(І) йодиду (11,0 мг, 0,06 ммоль) та трифенілфосфіну (40,0 мг, 0,15 ммоль) у дегазованому ДМФ (24 мл) додавали триетил-амін (307 мкл, 2,15 ммоль). Реакційну суміш перемішували протягом 5 хвилин та тоді додавали Pd(OAc)2 (13,0 мг, 0,06 ммоль). Реакційну суміш перемішували при кімнатній температурі протягом 2 діб, концентрували у вакуумі, розчиняли у EtOAc та промивали насиченим NaHCO3(водн) (1х). Шари розділяли та водний шар екстрагували додатково EtOAc (2х). Комбіновані органічні фази сушили Na2SO4, фільтрували та концентрували у вакуумі. Сирий продукт очищали хроматографією на колонці з силікагелем, елюючи з градієнтом розчиннику 35% EtOAc/Гексани 75% EtOAc/Гексани, отримуючи заголовну сполуку як оранжевий твердий матеріал з 90% чистоти (375 мг, кількісний вихід). 1Н ЯМР (400 МГц, ДМСО-D6) 4,82 (s, 2Н), 7,18 (dt, J=7,52, 0,78 Гц, 1Н), 7,32 (d, J=8,01 Гц, 1Н), 7,41 (dd, J=8,40, 1,95 Гц, 1Н), 7,60 (dd, J=7,42, 0,78 Гц, 1Н), 7,63 (d, J=8,40 Гц, 1Н), 7,70-7,75 (m, 2H). Сполука 1: 1'-[(2E)-3-(3,4-дихлорфеніл)проп-2ен-1-іл]-2Н,5Нспіро[імідазолідин-4,3'-iндол]-2,2',5(1'H)-трион Чотири ідентичні реакції були проведеними. Для кожної реакції 1-[(2Е)-3-(3,4 19 дихлорфеніл)проп-2-ен-1-іл]-1H-індол-2,3-діон (200 мг, 0,602 ммоль) розчиняли у 5 мл Ν,Νдиметилацетаміду (5 мл) у герметичній тубі. Амоній карбонат (0,555 г, 5,78 ммоль) додавали, а потім розчин KCN (0,0470 г, 0,722 ммоль) у воді (5 мл). Туби герметизували та тоді нагрівали до 100°C у масляній бані протягом 2 годин. Реакційні суміші ставали від червоно-пурпурових до жовтих протягом перебігу реакцій. Реакційні суміші охолоджували та тоді концентрували у вакуумі. Кожну реакційну суміш переносили у EtOAc (5 мл) та воду (5 мл). Усі 4 реакційні суміші пропускали через одну колонку Varian ChemElut CE1020, та колонку промивали додатково EtOAc (2x20 мл). Органічні екстракти концентрували у вакуумі, та залишок очищали хроматографією на колонці з силікагелем (1:2 Гексани:EtOAc), отримуючи заголовну сполуку (0,7075 г, 73%) як білий твердий матеріал. 1Н ЯМР (400 МГц, МЕТАНОЛ-D4) млн-1 4,45-4,53 (m, 1H), 4,57-4,66 (m 1H), 6,35 (dt, J=16,1, 5,1 Гц, 1H), 6,59 (dt, J=16,2, 1,5 Гц, 1H), 7,08 (d, J=7,8 Гц, 1H), 7,17 (td, J=7,6, 0,9 Гц, 1H), 7,30 (dd, J=8,4, 2,0 Гц, 1H), 7,37 (dd, J=7,4, 1,0 Гц, 1H), 7,39-7,45 (m, 2H), 7,53 (d, J=2,1 Гц, 1H) MC (APPI) (M+H)+=402. Розраховано для С19Н13СІ2N3O3: С, 56,74; Н, 3,26, N; 10,45. Виявлено: С, 56,64; Н, 3,26; N, 10,27. Індивідуальні енантіомери 1'-[(2Е)-3-(3,4дихлорфеніл)проп-2-ен-1-іл]-2Н,5Нспіро[імідазолідин-4,3'-індол]-2,2',5(1'H)-триону отримували розділенням рацемічної суміші (214 мг) надкритичною рідинною хроматографією (НРХ) на хіральній твердій підкладці застосовуючи систему Berger НРХ Multigram II (Mettler Toledo) (умови НРХ 50% Етанол/СО2 елюент, колонка CHIRALCEL OD НРХ (Chiral Technologies), 21x250 мм, 10 мікрон, потік 50 мл/хвилин. УФдетектор 254 або 280 нм, перебіг 6 хвилин). Енантіомерну чистоту визначали за допомогою НРХ на хіральній твердій підкладці, застосовуючи систему Berger НРХ Analytix/MC (Mettler Toledo) (умови НРХ 50% Етанол/СO2 елюент колонка CHIRALCEL OD НРХ (Chiral Technologies), 4,6x250 мм, 5 мікрон, потік 2,2 мл/хвилин UV, МСдетектор, перебіг 6 хвилин). Вихід: 80,7 мг (38%) ельованого першим енантіомеру, 80,0 мг (37%) ельованого другим енантіомеру. Назви енантіомерів за IUPAC створювали, застосовуючи програму ACD/Name (ACD/Labs 7,00 Release Product version: 7,07, build: 16 Jul 2003). Енантіомер 1A: (45)-1'-[(2E)-3-(3,4дихлорфеніл)проп-2-ен-1-іл]-2Н,5Нспіро[імідазолідин-4,3'-індол]-2,2',5(1'Н)-трион Ельований першим енантіомер: Час утриман22 ня = 2,46 хвилин, e.н. >99%, D 16 .8 (с 0,959 г/100 мл, CD3OD), 1Н ЯМР (400 МГц, МЕТАНОЛD4) млн-1 4,44-4,53 (m, 1Н) 4,57-4,65 (m, 1Н), 6,35 (dt, J=16,1, 4,9 Гц, 1H), 6,58 (dt, J=16,0, 1,6 Гц, 1H), 7,08 (d, J=7,8 Гц, 1H), 7,17 (td, J=7,6, 0,9 Гц, 1H), 7,30 (dd, J=8,4, 2,0 Гц, 1H), 7,35-7,39 (m, 1H), 7,387,45 (m, 2H), 7,52 (d, J=2,0 Гц, 1H) MC (APPI) (M+H)+=402. Абсолютна конфігурація цього енантіомеру є визначеною рентгенокристалографією. 93226 20 Енантіомер 1В: (4R)-1'-[(2E)-3-(3,4дихлорфеніл)проп-2-ен-1-іл]-2Н,5Нспіро[імідазолідин-4,3'-індол]-2,2',5(1'H)-трион Ельований другим енантіомер: Час утримання 22 = 4,21 хвилин, e.н. >99%, D 15 .0 (с 0,908 1 г/100 мл, CD3OD), Н ЯМР (400 МГц, МЕТАНОЛD4) млн-1 4,44-4,53 (m, 1Н), 4,56-4,65 (m, 1Н), 6,35 (dt, J=16,0 5,1 Гц, 1H), 6,58 (dt, J=16,1, 1,5 Гц, 1H), 7,08 (d, J=7,8 Гц, 1H), 7,17 (td, J=7,6, 0,9 Гц, 1H), 7,30 (dd, J=8,5, 2,1 Гц, 1H), 7,35-7,39 (m, 1H), 7,397,45 (m, 2H) 7,52 (d, J=2,0 Гц, 1H) MC (APPI) (M+H)+=402. Абсолютна конфігурація цього енантіомеру є визначеною рентгенокристалографією. Сполука 2: 1'-{(2E)-3-[4-хлор-3(трифлуорметил)феніл]проп-2-ен-1-іл}-2H,5Нспіро[імідазолідин-4,3'-індол]-2,2',5(1'H)-трион Шість туб сирого 1-{(2Е)-3-[4-хлор-3(трифлуорметил)феніл]проп-2-ен-1-іл}-1Н-індол2,3-діону обробляли ідентично. Матеріал у кожній тубі розчиняли у Ν,Ν-диметилацетамід (4,4 мл). Амоній карбонат (0,493 г, 5,13 ммоль) додавали до кожної туби, а потім розчин KCN (0,0417 г, 0,640 ммоль) у воді (4,4 мл). Туби герметизували та тоді нагрівали до 100°C у масляній бані протягом 3 годин. Реакційні суміші охолоджували та тоді концентрували у вакуумі. Кожну реакційну суміш переносили у EtOAc (8 мл) та воду (5 мл), та тоді пропускали через колонку Vanan ChemElut CE1005. Колонки промивали додатково EtOAc (2x8 мл) та органічні екстракти концентрували у вакуумі. Залишок очищали зворотно-фазовою препаративною РХ/МС, отримуючи заголовну сполуку (0,2834 г, 20% протягом 2 етапів) як слабко оранжевий твердий матеріал після ліофілізації. 1Н ЯМР (400 МГц, ДMCO-D6) млн-1 4,48-4,59 (m, 2H), 6,52 (dt, J=16,2, 4,8 Гц, 1H) 6,58-6,65 (m, 1H), 7,10-7,18 (m, 2H), 7,38-7,45 (m, 2H), 7,64-7,68 (m, 1H), 7,717,81 (m, 2H), 8,68 (d, J=1,0 Гц, 1H), 11,43 (s, 1H) MC (APPI) (M+H)+=436. Індивідуальні енантіомери 1'-{(2Е)-3-[4-хлор-3(трифлуорметил)феніл]проп-2-ен-1-іл}-2Н,5Hспіро[імідазолідин-4,3'-індол]-2,2',5(1'Н)-триону отримували розділенням рацемічної суміші (19,96 г) надкритичною рідинною хроматографією (НРХ) на хіральній твердій підкладці, застосовуючи систему Novasep НРХ SuperSep 50 (Novasep, Inc) (умови НРХ 30% Метанол/СО2 елюент, колонка CHIRALCEL® OD-H НРХ (Chiral Technologies, Inc), 3x25 см, 5 мікрон, швидкість потоку 150 мл/хвилин УФ-детектор 230 нм, 5 хвилин перебігу). Енантіомерну чистоту визначали за допомогою НРХ на хіральній твердій підкладці, застосовуючи систему Berger НРХ (Mettler Toledo) (умови НРХ: 30% Метанол/СО2 елюент, колонка CHIRALCEL OD-H НРХ (Chiral Technologies, Inc), 4,6x250 мм, 5 мікрон, швидкість потоку 2 мл/хвилин УФ-детектор 220 нм, 9 хвилин перебігу). Вихід: 45% ельованого першим енантіомеру та 42% ельованого другим енантіомеру. Назви енантіомерів за IUPAC створювали застосовуючи програму ACD/Name (ACD/Labs 7,00 Release Product version: 7,07, build: 16 Jul 2003). 21 93226 Енантіомер 2A: (45)-1'-{(2Е)-3-[4-хлор-3(трифлуорметил)феніл]проп-2-ен-1-іл}-2Н,5Нспіро[імідазолідин-4,3'-індол]-2,2',5(1'Н)-трион Ельований першим енантіомер: Час утриман 22 ня = 4,29 хвилин, e.н. >99%, D 16 .8 (с 1,03 г/100 мл, CD3OD), 1Н ЯМР (400 МГц, ДМСО-D6) млн-1 4,53 (d, J=4,5 Гц, 2H), 6,52 (dt, J=16,2, 4,8 Гц, 1H), 6,58-6,67 (m, 1H), 7,09-7,19 (m, 2H), 7,37-7,46 (m, 2H), 7,63-7,69 (m, 1H), 7,71-7,76 (m, 1H), 7,79 (d, J=2,0 Гц, 1H), 8,68 (d, J=1,4 Гц, 1H), 11,43 (s, 1H). MC (APPI) (M+H)+=436. Абсолютна конфігурація цього енантіомеру є визначеною рентгенокристалографією. Енантіомер 2В: (4R)-1'-{(2Е)-3-[4-хлор-3(трифлуорметил)феніл]проп-2-ен-1-іл}-2Н,5Нспіро[імідазолідин-4,3'-індол]-2,2',5(1'Н)-трион Ельований другим енантіомер: Час утримання = 5,92 хвилин, е.н. >98%, 22 D 15,6 (с 1,33 г/100 мл, CD3OD), 1Н ЯМР (400 МГц, ДМСО-D6) млн-1 4,53 (d, J=4,5 Гц, 2H), 6,52 (dt, J=16,2, 4,8 Гц, 1H), 6,58-6,66 (m, 1H), 7,09-7,19 (m, 2H), 7,37-7,46 (m, 2H), 7,63-7,68 (m, 1H), 7,70-7,76 (m, 1H), 7,79 (d, J=2,0 Гц, 1H), 8,68 (d, J=1,4 Гц, 1H), 11,43 (s, 1H). MC (APPI) (M+H)+=436. Абсолютна конфігурація цього енантіомеру є визначеною рентгенокристалографією. Сполука 3: 1'-[3-(3,4-дихлорфеніл)проп-2-ін-1іл]-2H,5H-спіро[імідазолідин-4,3'-iндол]-2,2',5(1'H)трион Суміш інтермедіату 5 (50 мг, 0,15 ммоль), калій цианіду (12 мг, 0,18 ммоль), та амоній карбонату (140 мг, 1,45 ммоль) у 1:1 МеОН:Н2О (2,5 мл) нагрівали при 100°C протягом 6 годин. Реакційну суміш тоді охолоджували, концентрували у вакуумі для видалення МеОН, розбавляли EtOAc та промивали Н2О (1х). Шари розділяли та водний шар екстрагували додатково EtOAc (3х). Комбіновані органічні фази сушили Na2SO4, фільтрували та концентрували у вакуумі. Залишок очищали зворотно-фазовою ВЕРХ (градієнт 50-80% CH3CN у Н2О з вмістом 0,1% трифлуороцтової кислоти), отримуючи заголовну сполуку (2 мг, 3% вихід) як її ТФОК-сіль. Цей матеріал було ліофілізовано з CH3CN/H2O отримуючи блідо-жовтий твердий матеріал. Чистота (ВЕРХ): 95% (215 нм), 94% (254 нм); 1Н ЯМР (400 МГц, ДМСО-D6) млн-1 4,82-4,93 (m, 2H), 7,17 (dt, J=7,57, 0,88 Гц, 1Н), 7,32 (d, J=7,81 Гц, 1Н), 7,40 (dd, J=8,30, 2,05 Гц, 1Н), 7,44 (dd, J=7,42, 0,78 Гц, 1Н), 7,49 (dt, J=7,76, 1,27 Гц, 1Н), 7,64 (d, J=8,20 Гц, 1Н), 7,70 (d, J=1,95 Гц, 1Н), 8,69 (d, J=1,56 Гц, 1Н), 11,42 (s, 1Н). Виявлено: С, 57,05; Η, 2,75, Ν; 10,55. C19H11N3O3Cl2 має С, 57,02; Η, 2,77; Ν, 10,50%. Індивідуальні енантіомери 1'-[3-(3,4дихлорфеніл)проп-2-ін-1-іл]-2Н,5Нспіро[імідазолідин-4,3'-індол]-2,2',5(1'H)-трион отримували розділенням рацемічної суміші (200 мг) надкритичною рідинною хроматографією (НРХ) на хіральній твердій підкладці, застосовуючи систему Berger НРХ Multigram II (Mettler Toledo) (умови НРХ 50% Етанол/СО2 елюент, колонка ChiralCel OD НРХ (Chiral Technologies), 21x250 мм, 10 мікрон, потік 50 мл/хвилин УФ-детектор 254 або 280 нм, перебіг 6 хвилин). Енантіомерну чистоту ви 22 значали за допомогою НРХ на хіральній твердій підкладці, застосовуючи систему Berger НРХ Analytix/MC (Mettler Toledo) (умови НРХ 50% Етанол/СO2 елюент, колонка ChiralCel OD НРХ (Chiral Technologies), 4,6x250 мм, 5 мікрон, потік 2,2 мл/хвилин. UV, МС-детектор, перебіг 6 хвилин). Вихід: 83 мг (42%) ельованого першим енантіомеру, 82 мг (41%) ельованого другим енантіомеру назви енантіомерів за IUPAC створювали, застосовуючи програму ACD/Name (ACD/Labs 7,00 Release Product version: 7,07, build: 16 Jul 2003). Енантіомер 3А: (4S)-1'-[3-(3,4дихлорфеніл)проп-2-ін-1-іл]-2Н,5Нспіро[імідазолідин-4,3'-індол]-2,2',5(1'Н)-трион Ельований першим енантіомер: Час утриман22 ня = 3,19 хвилин, e.н. >99%, D 72 .8 (с 1,00 г/100 мл, CD3OD), 1Н ЯМР (400 МГц, CD3OD) млн-1 4,74-4,88 (m, 2Н), 7,20 (dt, J=7,57, 0,88 Гц, 1Н), 7,26-7,31 (m, 2H), 7,36 (dd, J=7,52, 0,68 Гц, 1Н), 7,45-7,51 (m, 2Н), 7,55 (d, J=1,76 Гц, 1H). MC (APPI) (M+H)+=400. Абсолютна конфігурація цього енантіомеру є визначеною рентгенокристалографією. Енантіомер 3В: (4R)-1'-[3-(3,4дихлорфеніл)проп-2-ін-1-іл]-2Н,5Нспіро[імідазолідин-4,3'-індол]-2,2\5(1'Н)-трион Ельований другим енантіомер: Час утримання = 4,47 хвилин, е.н. >99%, 22 D 75 .1 (с 1,03 г/100 мл, CD3OD), Η ЯМР (400 МГц, CD3OD) млн-1 4,74-4,87 (m, 2Н) 7,17-7,22 (m, 1H), 7,26-7,31 (m, 2H), 7,35-7,38 (m, 1H), 7,44-7,51 (m, 2H), 7,54 (d, J=1,76 Гц, 1Н). MC (APPI) (M+H)+=400. Абсолютна конфігурація цього енантіомеру є визначеною рентгенокристалографією. Фармакологія Скринінговий аналіз hVR1 ПЗФВ (Планшетний зчитувач флуорометричного відображення) Трансфектовані СНО клітини, стабільно експресуючі hVR1 (15000 клітини/лунку) засівають у 50 мкл середовища у чорному 384-лунковому планшеті з прозорим дном (Greiner) та вирощують у зволоженому інкубаторі (37°С, 2% СО2), за 24-30 годин перед дослідженням. Далі, середовища видаляють з планшету перевертанням та додають 2 мкМ Fluo-4. Через 40 хвилин інкубування барвнику у темряві при 37°С та 2% СО2, зовнішньоклітинний барвник вимивають, застосовуючи EMBLA (Scatron), залишаючи клітини у 40 мкл буферу для аналізу (1 X HBSS, 10 мМ D-Глюкоза, 1 мМ СаСІ2 10 мМ ГЕПЕС, 10 X 7,5% NaHCO3 та 2,5 мМ Пробенецид). ПЗФВ аналіз - протокол визначення ІК50 Для визначення ІК50 флуоресценцію зчитують, застосовуючи фільтр ПЗФВ 1 (520-545 нМ). Реєстрування клітин проводять протягом 30 с, а потім додають 10 по 20 мкл титрованих напівлогарифмічних концентрації тест-сполуки, отримуючи клітинну концентрацію від 3 мкМ до 0,1 нМ. Дані збирають кожні 2 с протягом ще 5 хвилин перед добавкою розчину агоністу VR1: 50 нМ розчину капсаїцину або буферу Μ ES (2-[Nморфоліно]етансульфонова кислота) (рН 5,2). ПЗФВ продовжує збирати дані протягом ще 4 хвилин. Сполуки, що мають антагоністичні властивос1 23 93226 ті проти hVR1, інгібуватимуть збільшення внутрішньоклітинного кальцію у реакціях на добавку капсаїцину. Це тому призводить до зменшення сигналу флуоресценції та зменшеного зчитування флуоресценції у порівнянні з буферними контролями без сполуки. Дані обробляють програмою ПЗФВ як величину флуоресценції, що розраховано під кривою при добавці капсаїцину. Максимум інгібування, нахил Хілла та ІК50 створюють для кожної сполуки. Порівняльне визначення активності редуктази альдози проводила компанія MDS Pharma Services - Taiwan Ltd; результати цього дослідження представлені у таблиці 1 нижче. 24 Перелік скорочень VR1 ванілоїдний рецептор 1 СПК синдром подразненого кишечнику ЗХШ запальна хвороба кишечнику ХШСР хвороба шлунково-стравохідний рефлюкс ГЕПЕС 4-(2-Гідроксіетил)піперазин-1етансульфонова кислота Результати Типові значення ІК50, які виміряно у вищенаведених аналізах, є 10 мМ або меншу. В одному аспекті винаходу ІК50 є нижче 3000 нМ. У ще одному аспекті винаходу ІК50 є нижче 1000 нМ. Таблиця 1 Результати порівняльного визначення активності стосовно hVR1 ПЗФВ та редуктази альдози Приклад No. Енантіомер 1А Енантіомер 1В Енантіомер 2А Енантіомер 2В Енантіомер 3А Енантіомер 3В ІК50(людини VR1, капсаїцин) нМ 10000 нМ 43 нМ 3850 нМ 241 нМ 15454 нМ 881 нМ Біологічні тести In vivo фармакологічні властивості заявленого винаходу визначені, застосовуючи дві класичні NSAID-чутливі запальні моделі, модель з карагеніном та модель з повним адьювантом Фрейнда (ПАФ). У першій карагенін-лямбда(похідний від водоростей полісахарид, типу IV, 100 мкл, від SigmaAldrich), розчинений у стерильному фізіологічному розчині 0,9% при концентрації 1%, а в останньому ПАФ (25 мкл, від Sigma-Aldrich, (1 мл ПАФ містить 1 мг туберкульозних мікобактерій, вбитих нагріванням та висушених, 0,85 мл мінеральної оливи та 0,15 мл манід моноолеат, cf. Nagakura et al. у Journal of Pharmacology and Experimental Therapeutics 2003; 306(2):490-497)) ін'єктують під шкіру у підошву (внутрішньопідошовно) лівої задньої лапи щура. Це створює запальну реакцію з набряком почервонінням та гіпералгезією. Теплова (та механічна) гіпералгезія повністю розвивається за 3 години для карагеніну, та залишається стабільною протягом 6 годин, тоді як з ПАФ повністю розвивається за 24 години та залишається стабільною протягом тижнів. Для оцінки ступеню гіпералгезії вибрали тепловий підошовний тест, оскільки він є надійним, відповідним та відтворюваним (на основі способу оцінки ноцицепції Харгревеса, cf. Pain, 1988; 32(1):77-88). Щурів поміщають у індивідуальні плексигласові бокси на скляній поверхні, котрі підтримують при 30°С, та джерело теплоти (швидкість підвищення теплоти ~1,1°C/с) фокусують на підошву враженої лапи. Час від ініціації теплоти до відсмикування лапи твариною реєструють. Зниження затримки відсмикування лапи (ЗВЛ) відносно необроблених тварин свідчить про стан гіпералгезії. Ступінь зворотності гіпералгезії вимірюють за здатністю сполуки до повернення ЗВЛ до норма ІК50(редуктаза альдози) нМ 25 нМ 758 нМ 33 нМ 3300 нМ 72,3 нМ 983 нМ льних рівнів (4R)-1'-[(2Е)-3-(3,4-дихлорфеніл)проп2-ен-1-іл]-2Н,5Н-спіро[імідазолідин-4,3'-індол]2,2',5(1'Н)-трион (Енантіомер 1В) перорально застосовували протягом створеної фази запалення та тестували при її Τ макс. ЗВЛ кожної тварини вимірюють двічі, та середнє з двох беруть як реакцію. Реакції усіх тварин у межах даної групи тоді усереднюють, та стандартне відхилення та стандартну похибку (СП) розраховують для кожної групи. Дані виражені як середнє±СП. Статистичну значність оцінюють за Т-тестом для порівняння між необробленою та обробленою групами, та одно-шляховим ANOVA, а потім багаторазовими порівняннями Холма-Сідака проти тесту контрольної (носій) групи стосовно ефективності ліків. Рівні статистичної значності виражені як p100 ЕС80 (мкМ) 10,7 100 Комп’ютерна верстка О. Гапоненко Підписне Тираж 23 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійською(4r)-1'-[(2e)-3-(3,4-dichlorophenyl)prop-2-ene-1-yl]-2h,5h-spiro[imidazolidine-4,3'-indole]-2,2',5(1'h)-trione and use thereof
Автори англійськоюLeung Carmen, Tomaszewski Miroslaw, Woo Simon
Назва патенту російською(4r)-1'-[(2e)-3-(3,4-дихлорфенил)проп-2-эн-1-ил]-2н,5н-спиро[имидазолидин-4,3'-индол]-2,2',5(1'н)-трион и его применение
Автори російськоюЛунг Кармен, Томашевски Мирослав, By Саймон
МПК / Мітки
МПК: A61P 25/02, A61K 31/4188, C07D 487/10
Мітки: 4r)-1'-[(2e)-3-(3,4-дихлорфеніл)проп-2-ен-1-іл]-2н,5н-спіро[імідазолідин-4,3'-індол]-2,2',5(1'н)-тріон, застосування
Код посилання
<a href="https://ua.patents.su/13-93226-4r-1-2e-3-34-dikhlorfenilprop-2-en-1-il-2n5n-spiroimidazolidin-43-indol-2251n-trion-ta-jjogo-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">(4r)-1′-[(2e)-3-(3,4-дихлорфеніл)проп-2-ен-1-іл]-2н,5н-спіро[імідазолідин-4,3′-індол]-2,2′,5(1’н)-тріон та його застосування</a>