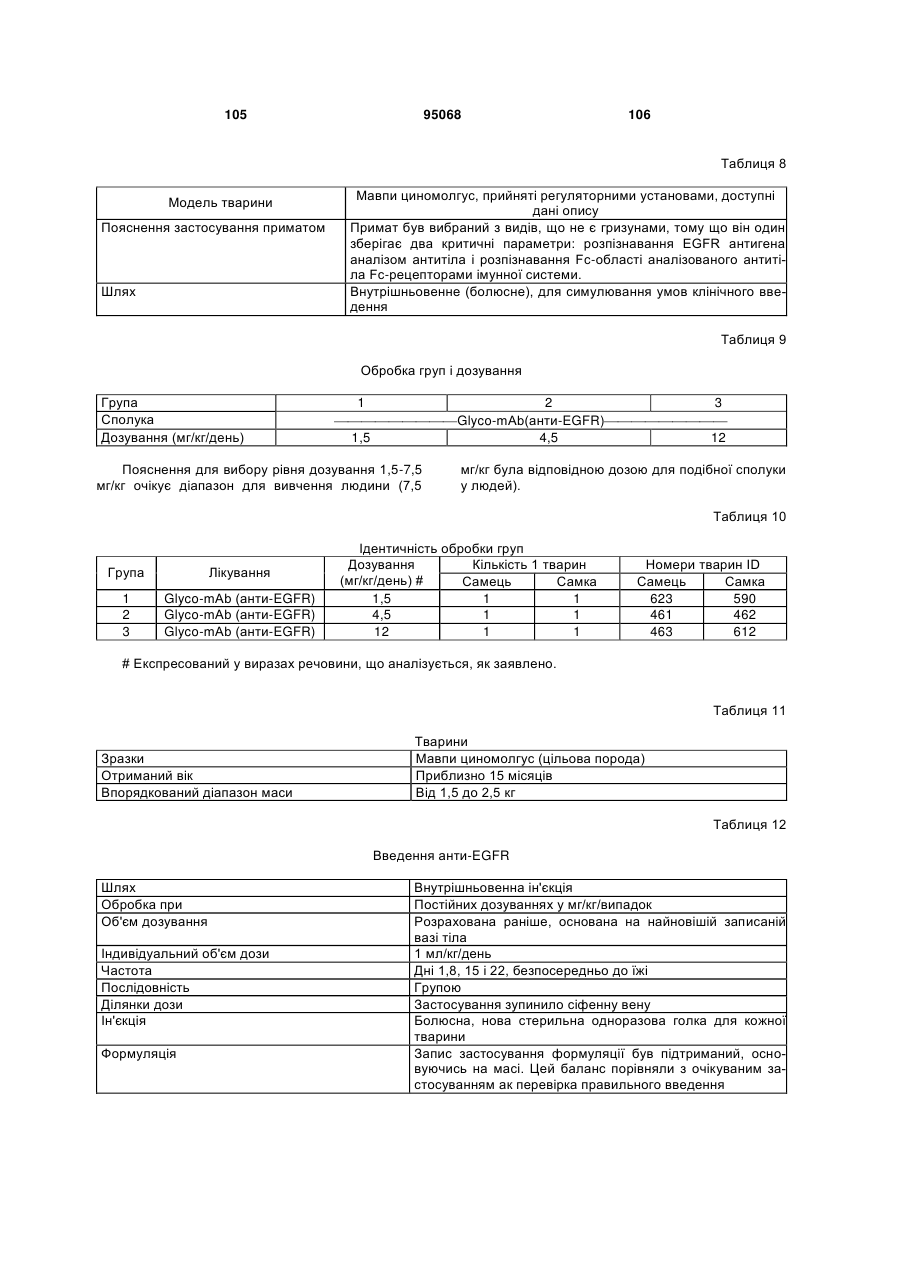
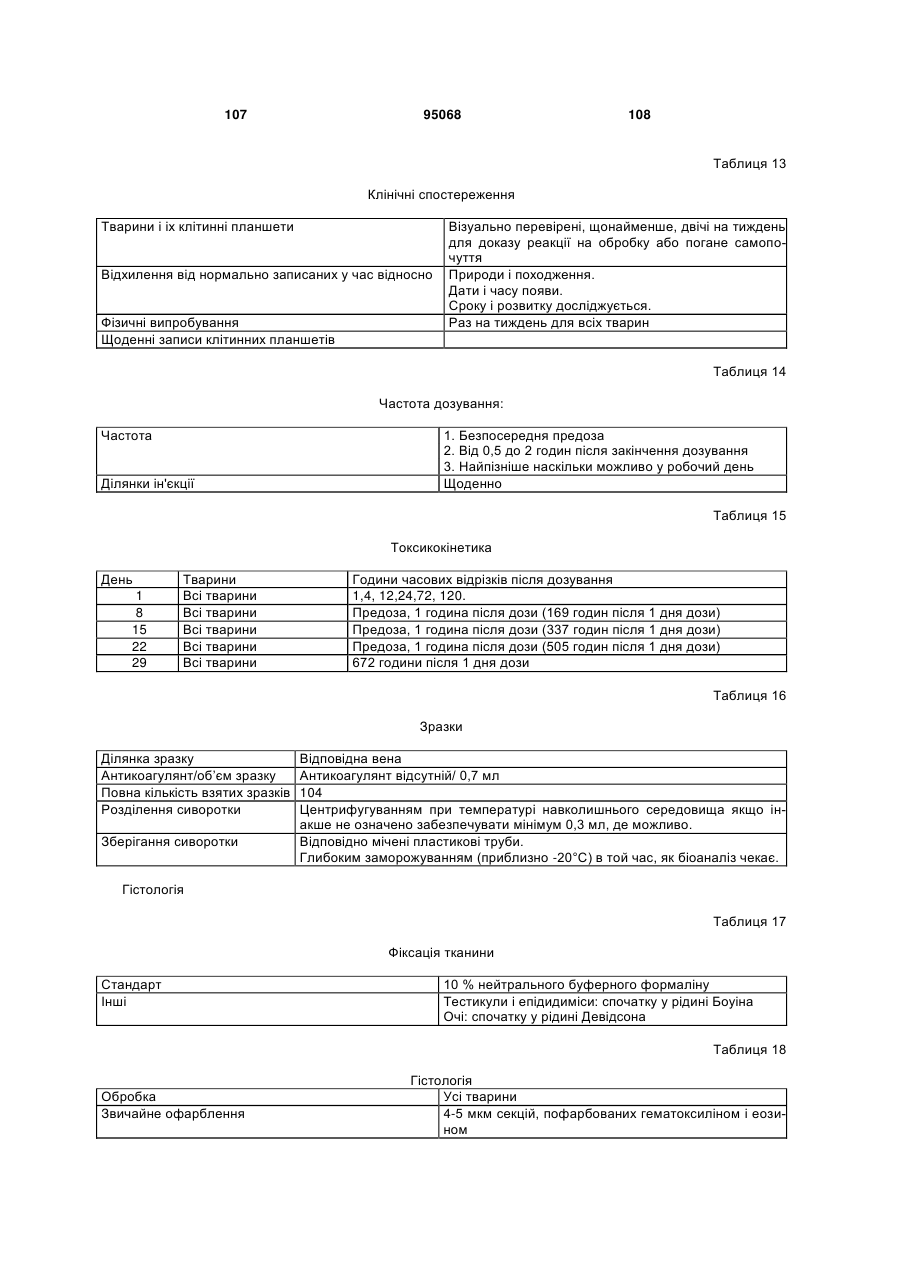
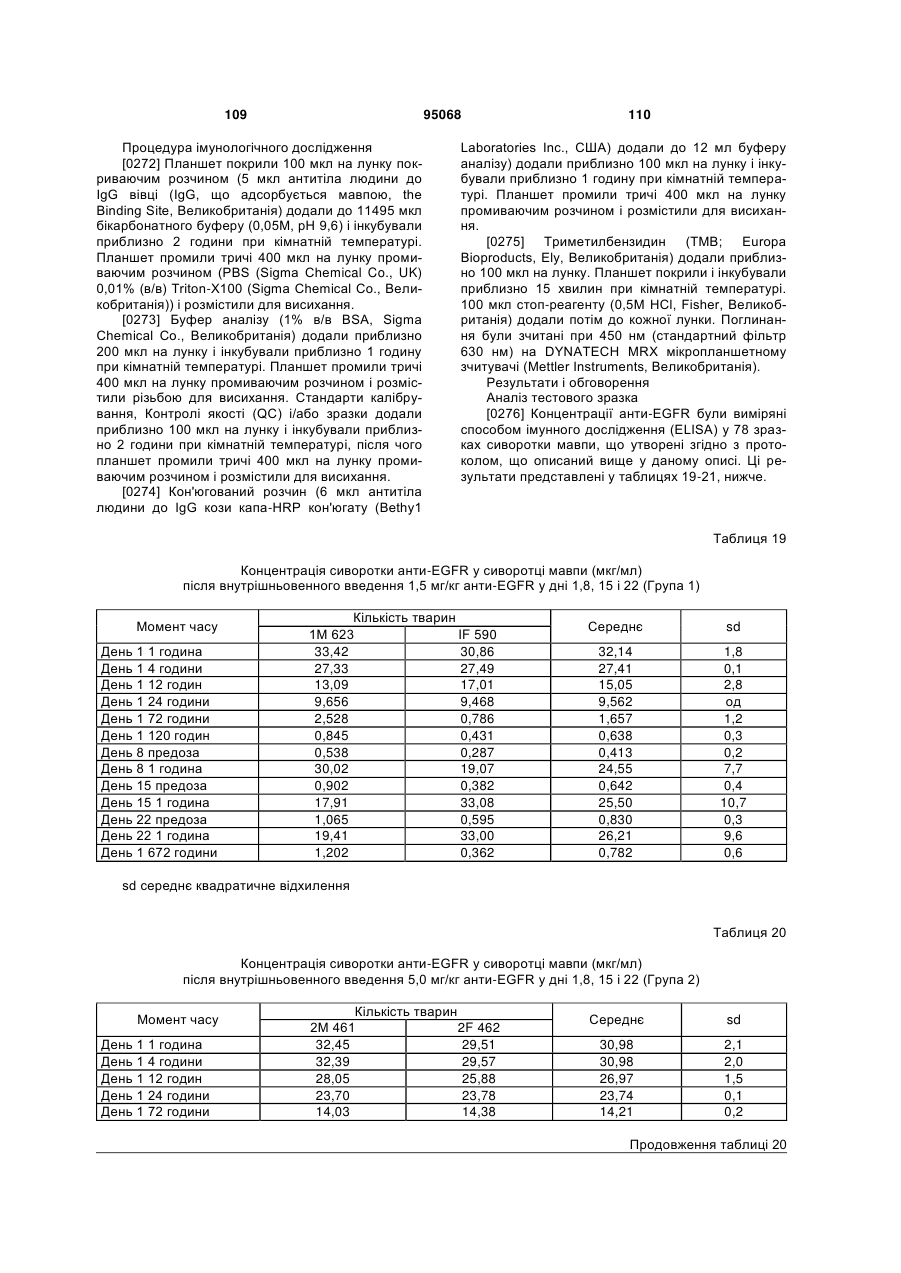
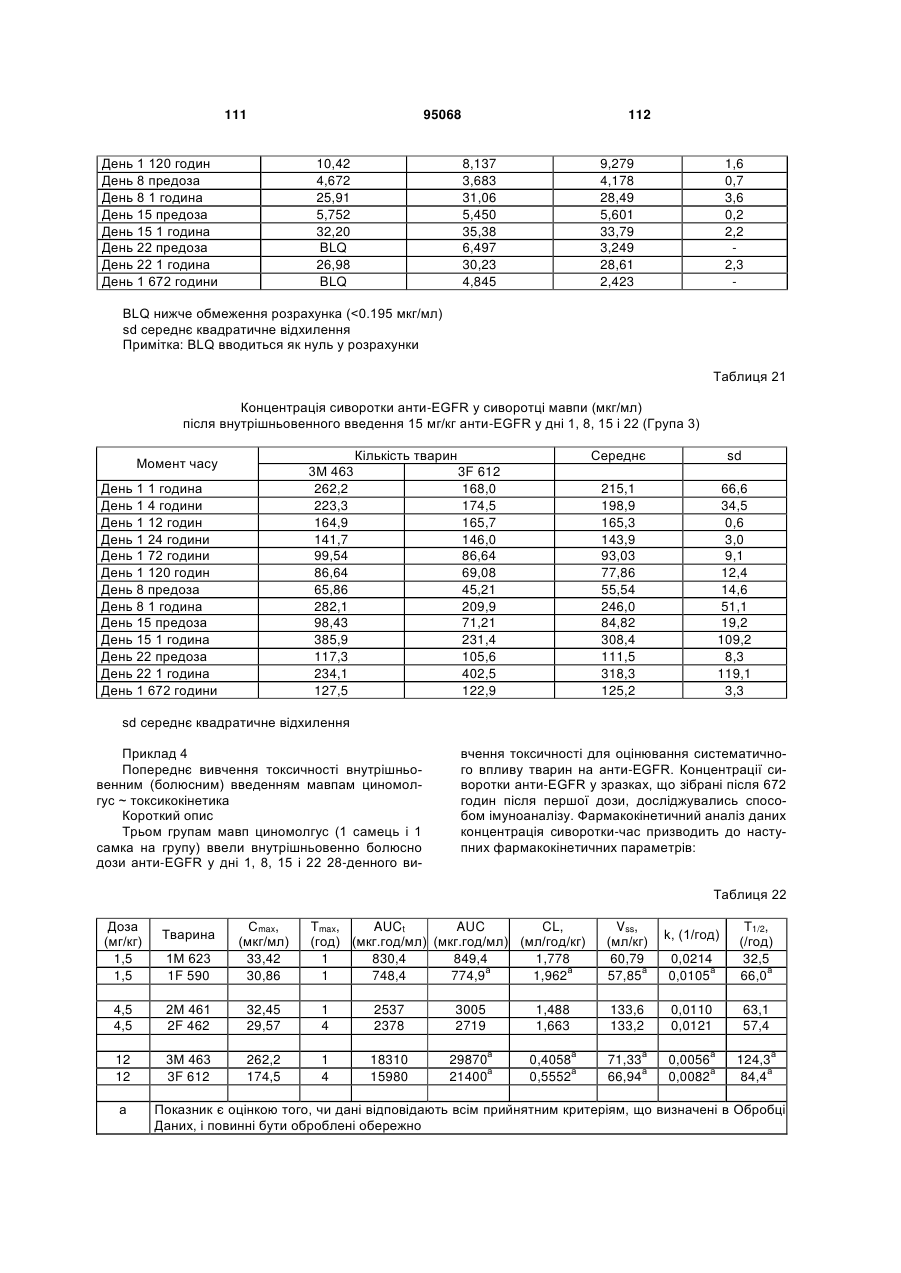
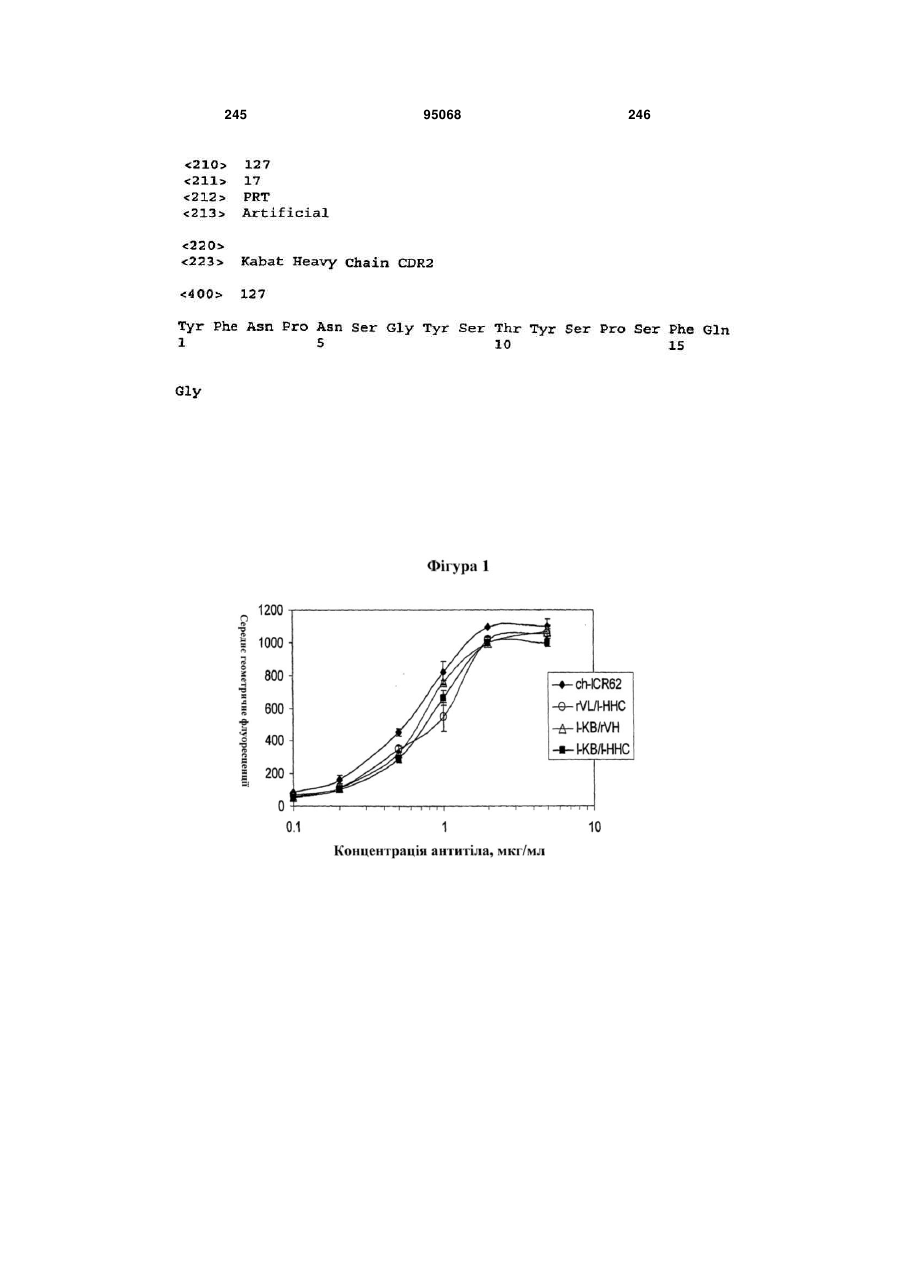
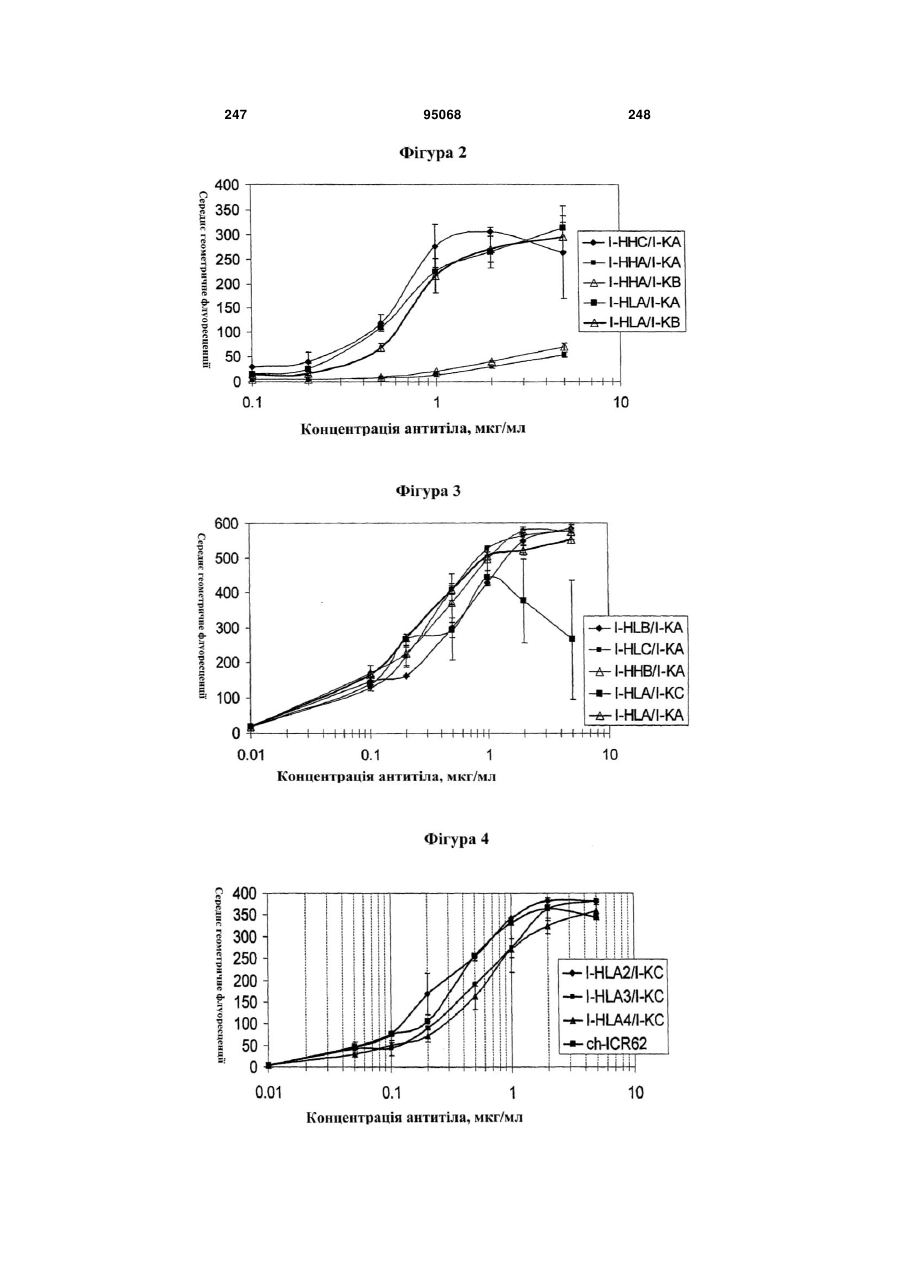
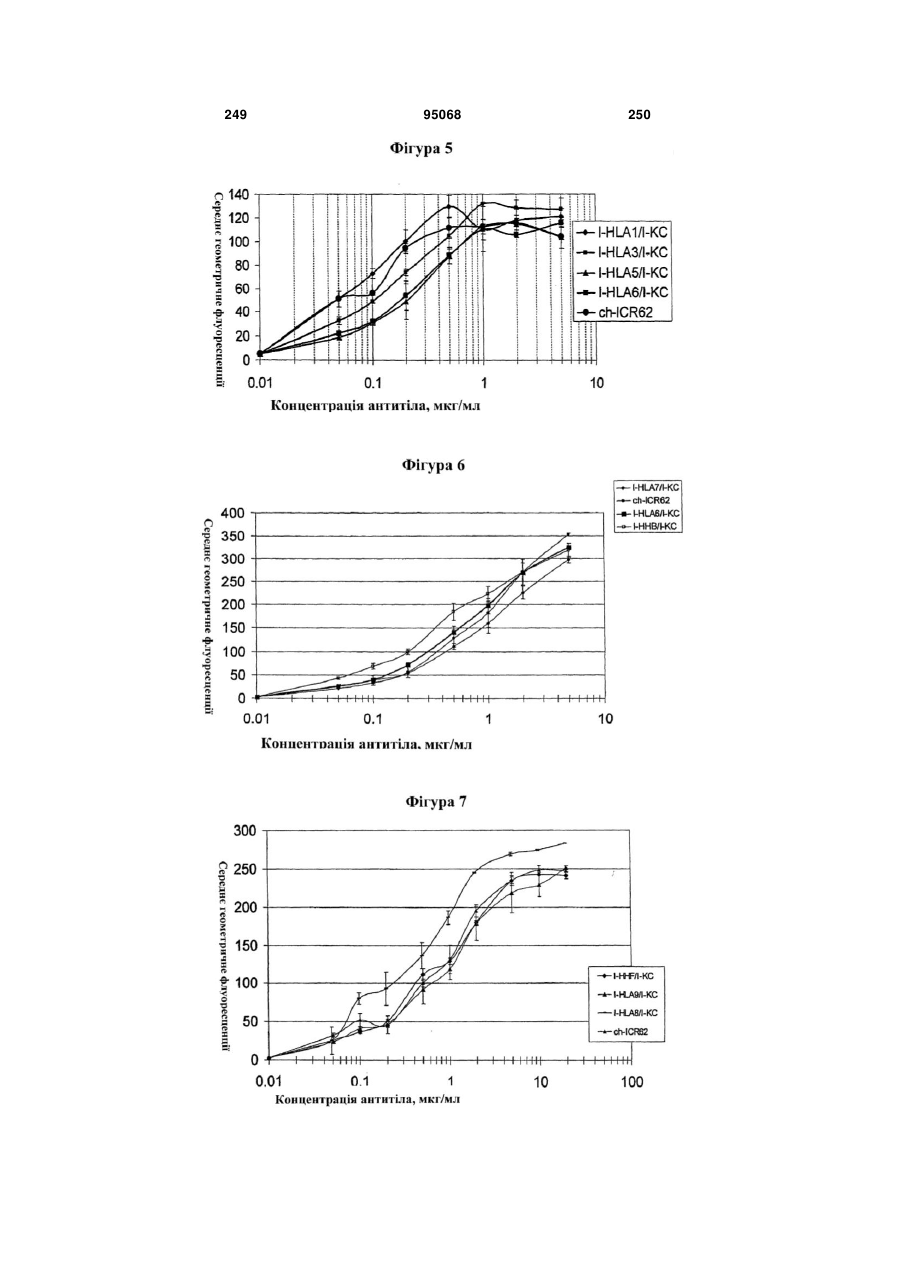
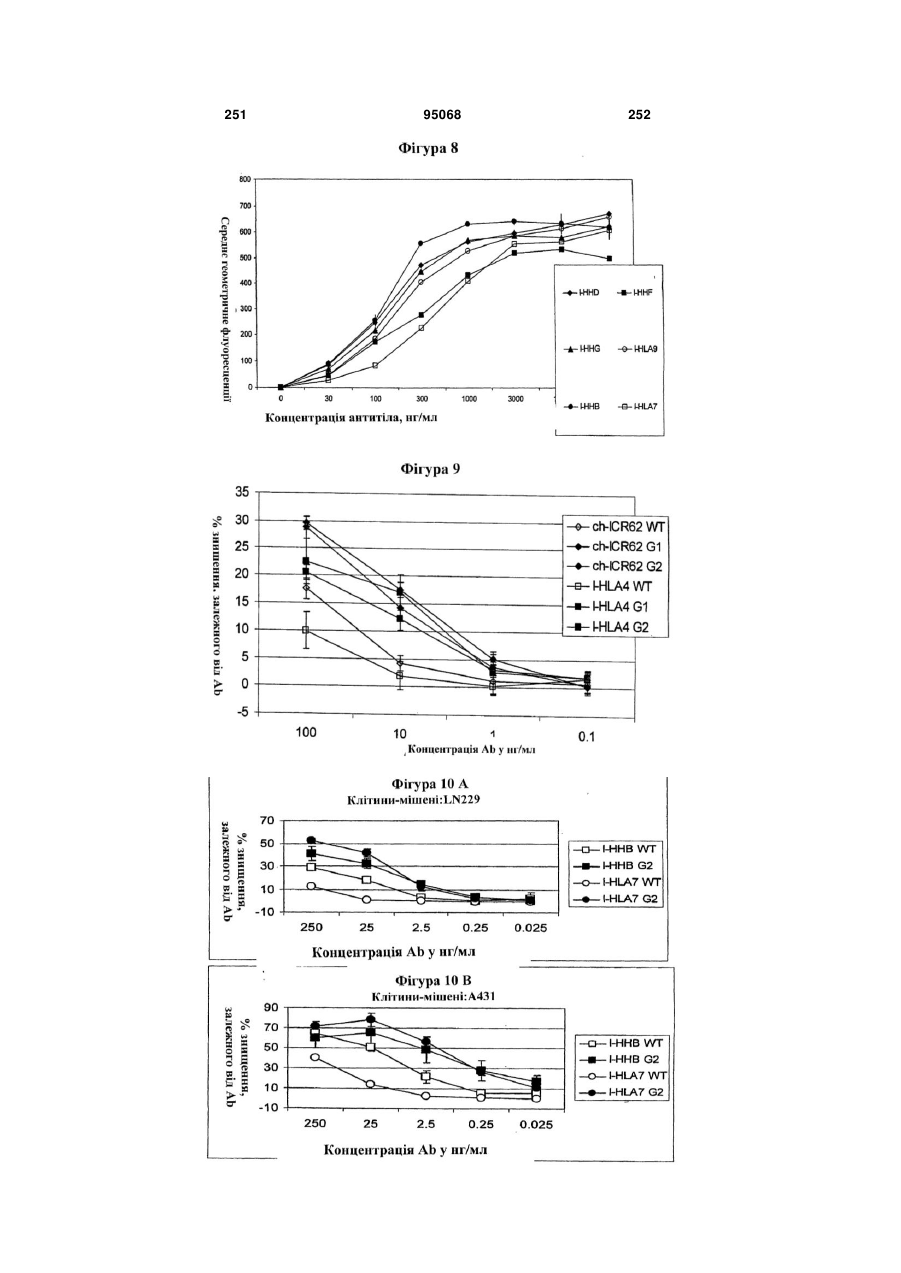
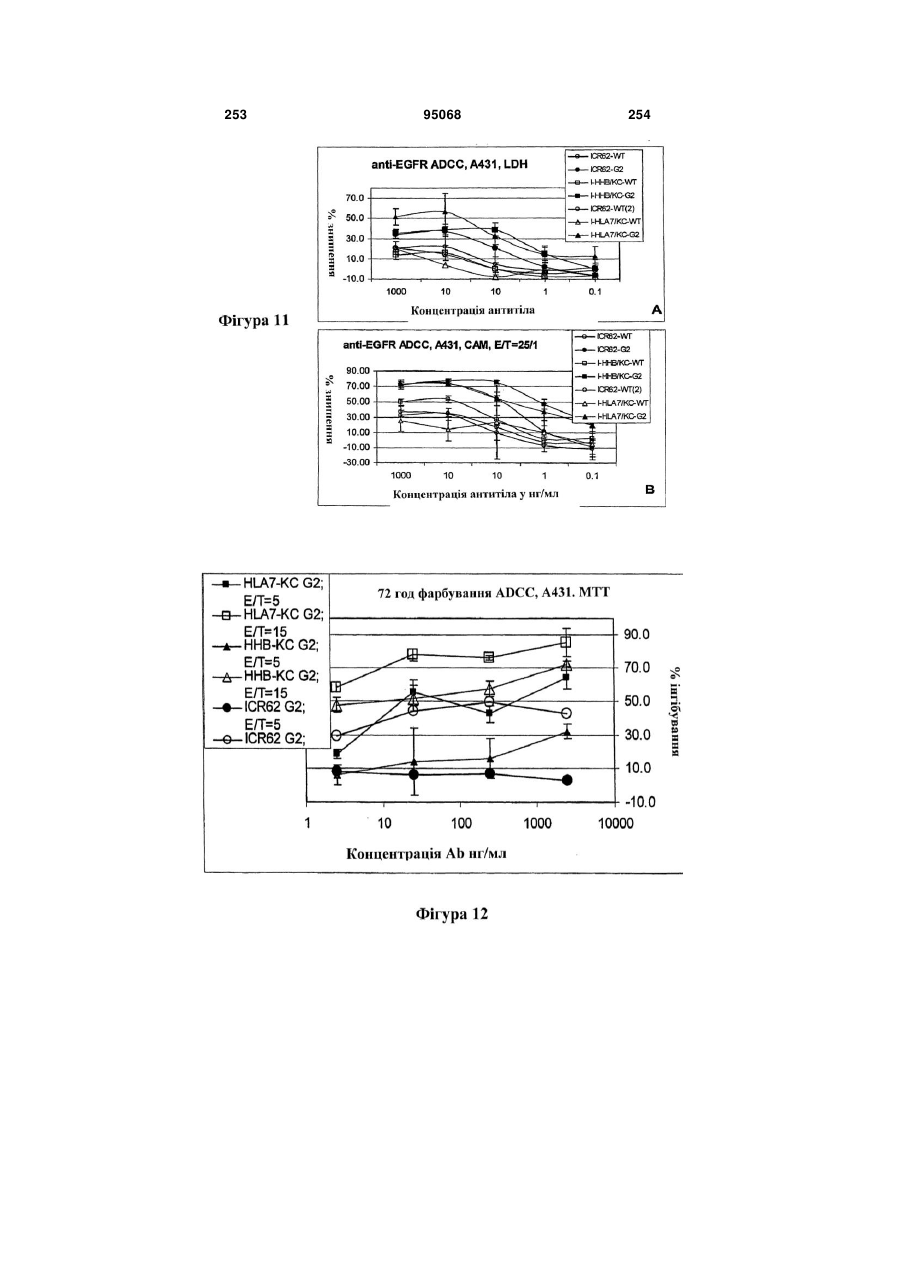
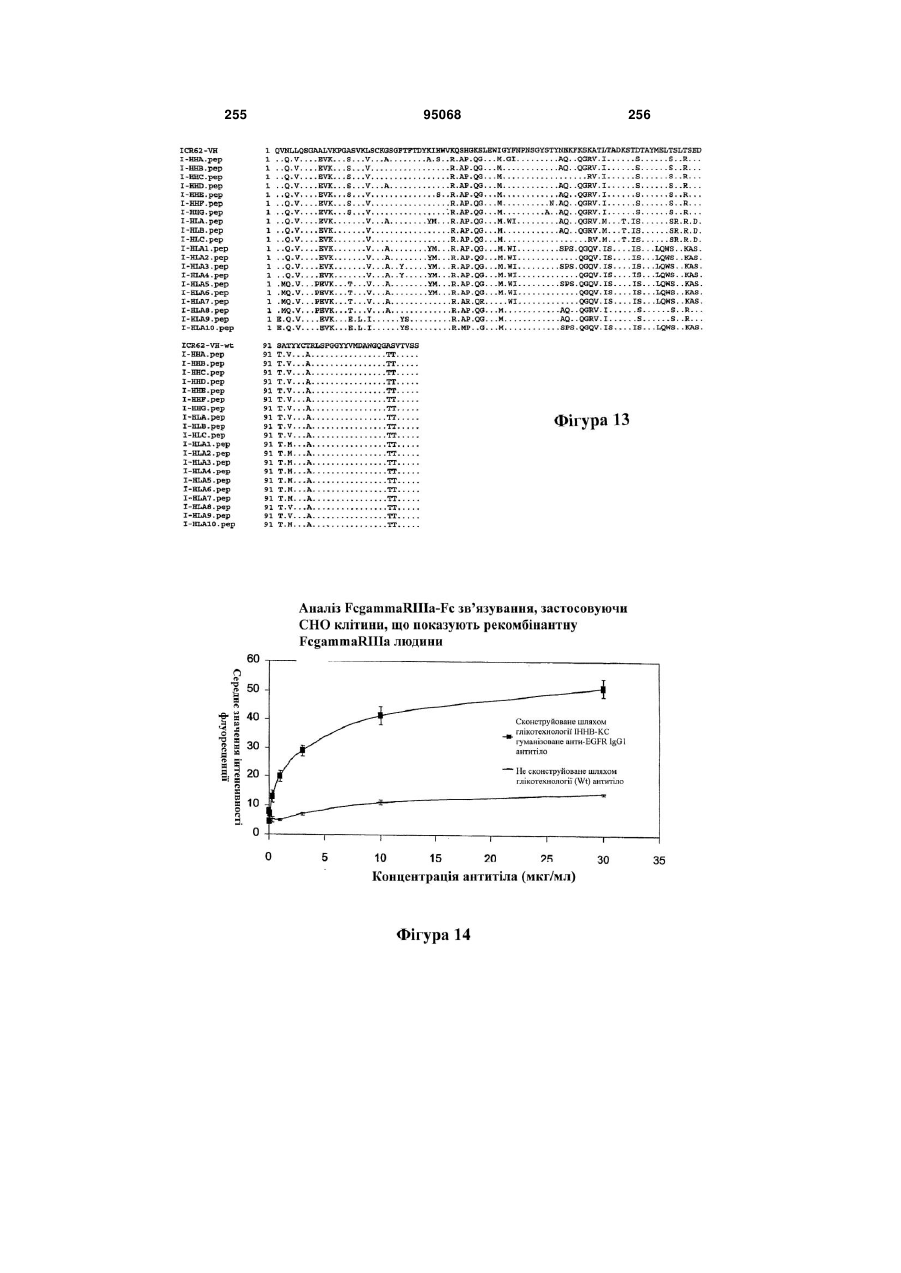
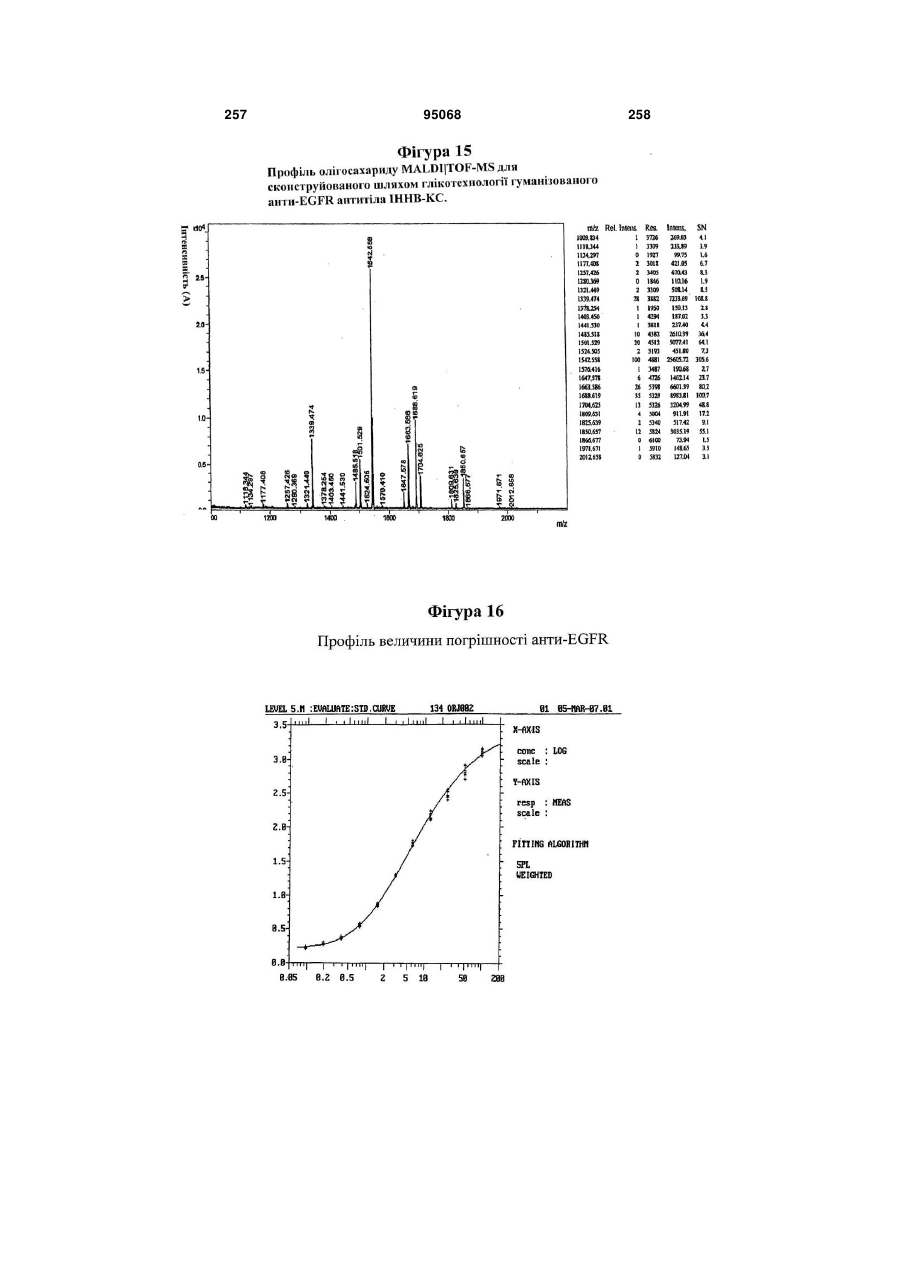
Антиген-зв’язуюча молекула, яка зв’язує еgfr, вектор, що її кодує, та їх застосування
Формула / Реферат
1. Ізольований полінуклеотид, що включає послідовність, яка кодує поліпептид, який включає варіабельну область важкого ланцюга, варіабельну область легкого ланцюга або їх комбінацію, що специфічно зв’язує EGFR людини, як частина гуманізованої, сконструйованої шляхом глікотехнології анти-EGFR антигензв'язуючої молекули,
де зазначена варіабельна область важкого ланцюга включає області, що визначають компліментарність (CDR), де:
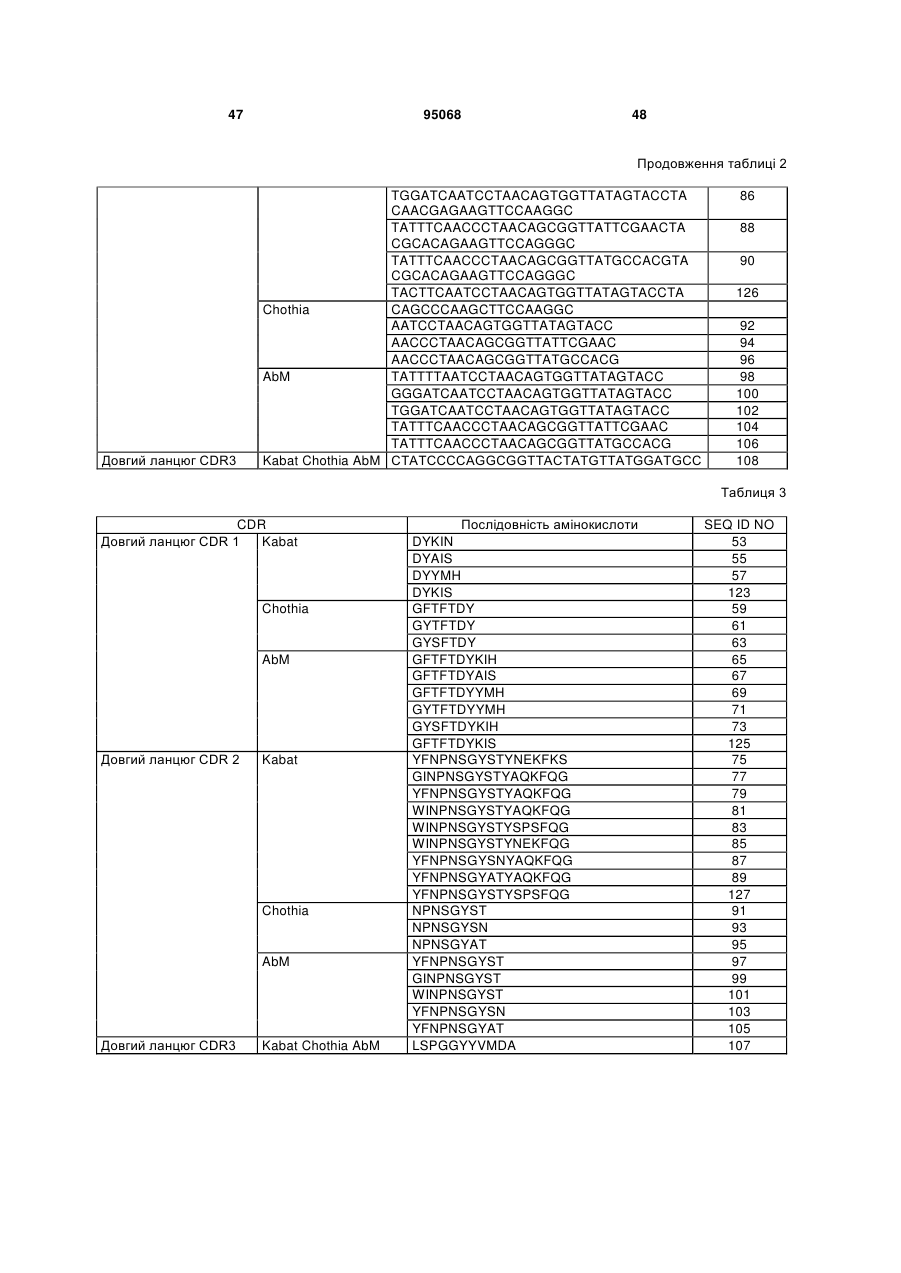
(a) CDR1 важкого ланцюга вибрана з групи, що складається з: SEQ ID NO:53, SEQ ID NO:55, SEQ ID NO:57, SEQ ID NO:59, SEQ ID NO:61, SEQ ID NO:63, SEQ ID NO:65, SEQ ID NO:67, SEQ ID NO:69, SEQ ID NO:71, SEQ ID NO:73, SEQ ID NO:123 і SEQ ID NO:125; і
(b) CDR2 важкого ланцюга вибрана з групи, що складається з: SEQ ID NO:75, SEQ ID NO:77, SEQ ID NO:79, SEQ ID NO:81, SEQ ID NO:83, SEQ ID NO:85, SEQ ID NO:87, SEQ ID NO:89, SEQ ID NO:127, SEQ ID NO:91, SEQ ID NO:93, SEQ ID NO:95, SEQ ID NO:97, SEQ ID NO:99, SEQ ID NO:101, SEQ ID NO:103, і SEQ ID NO:105; і
(c) CDR3 важкого ланцюга являє собою SEQ ID NO:107; і
де зазначена варіабельна область легкого ланцюга включає CDR, де
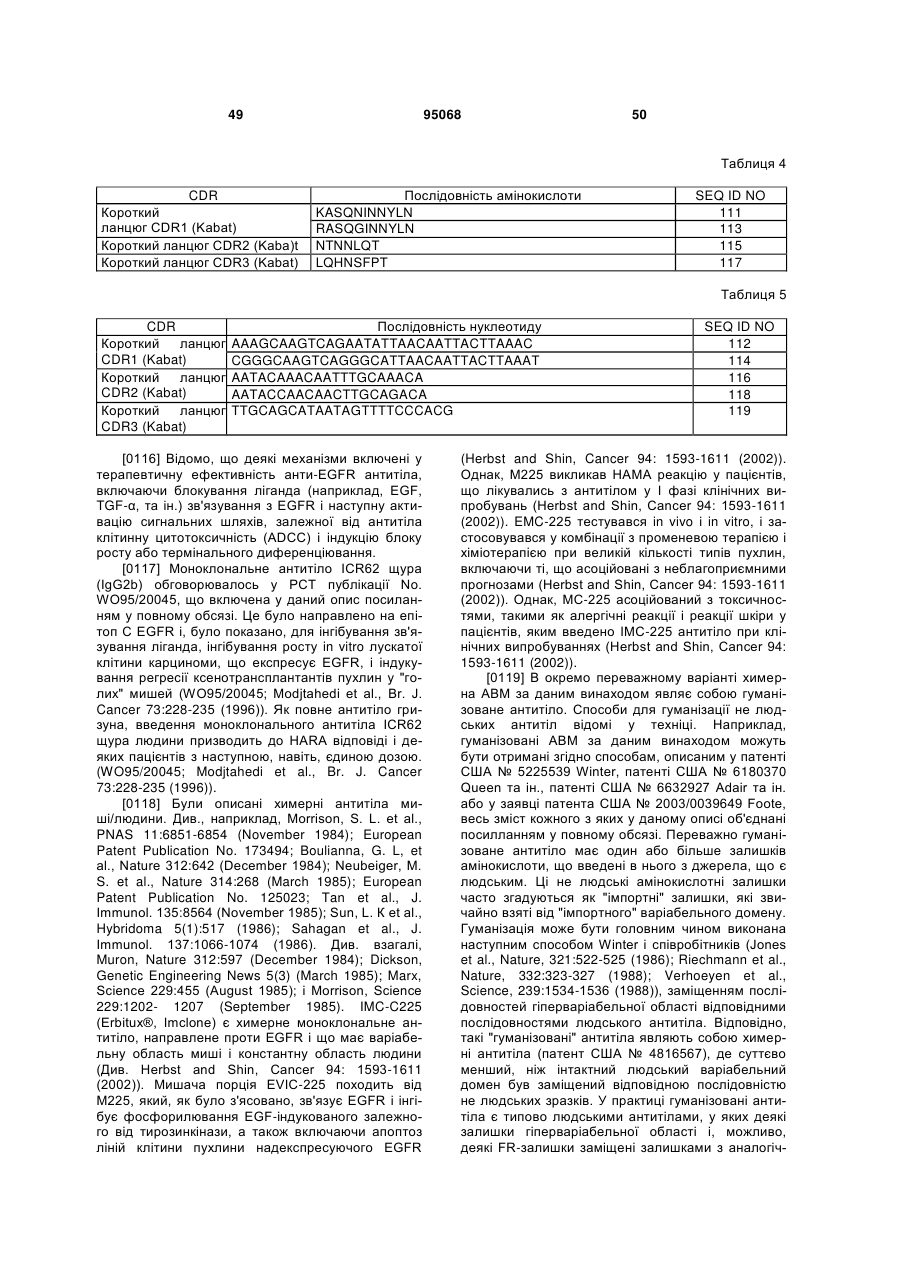
(d) CDR1 легкого ланцюга являє собою SEQ ID NO:111 або SEQ ID NO:113, і
(e) CDR2 легкого ланцюга являє собою SEQ ID NO:115; і
(f) CDR3 легкого ланцюга являє собою SEQ ID NO:117;
де зазначена анти-EGFR антигензв'язуюча молекула включає комбінацію зазначеної варіабельної області важкого ланцюга і зазначеної варіабельної області легкого ланцюга.
2. Ізольований полінуклеотид за п. 1, де зазначений полінуклеотид включає:
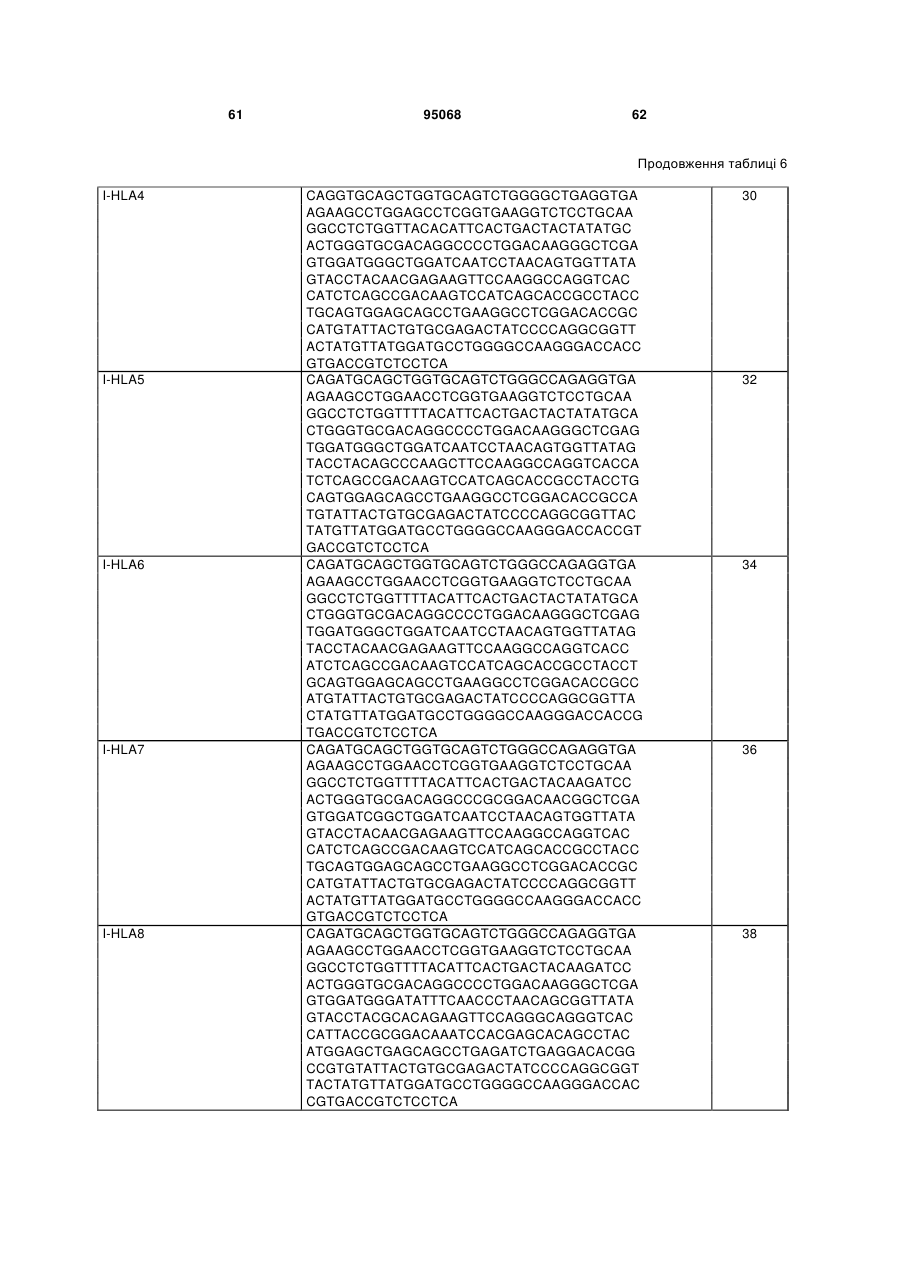
(a) послідовність, вибрану з групи, що складається з: SEQ ID NO:54, SEQ ID NO:56, SEQ ID NO:58, SEQ ID NO:60, SEQ ID NO:62, SEQ ID NO:64, SEQ ID NO:66, SEQ ID NO:68, SEQ ID NO:70, SEQ ID NO:72, SEQ ID NO:74, SEQ ID NO:122 і SEQ ID NO:124; і
(b) послідовність, вибрану з групи, що складається з: SEQ ID NO:76, SEQ ID NO:78, SEQ ID NO:80, SEQ ID NO:82, SEQ ID NO:84, SEQ ID NO:86, SEQ ID NO:88, SEQ ID NO:90, SEQ ID NO:126, SEQ ID NO:92, SEQ ID NO:94, SEQ ID NO:96, SEQ ID NO:98, SEQ ID NO:100, SEQ ID NO:102, SEQ ID NO:104 і SEQ ID NO:106; і
(c) послідовність SEQ ID NO:108.
3. Ізольований полінуклеотид за будь-яким з пп. 1-2, де зазначений ізольований полінуклеотид включає послідовність, яка має щонайменше 80 % ідентичності послідовності, вибраної з групи, що складається з: SEQ ID NO:2, SEQ ID NO:4; SEQ ID NO:6; SEQ ID NO:8; SEQ ID NO:10; SEQ ID NO:12; SEQ ID NO:14; SEQ ID NO:16; SEQ ID NO:18; SEQ ID NO:20; SEQ ID NO:22; SEQ ID NO:24; SEQ ID NO:26; SEQ ID NO:28; SEQ ID NO:30; SEQ ID NO:32; SEQ ID NO:34; SEQ ID NO:36; SEQ ID NO:38; SEQ ID NO:40 і SEQ ID NO:120.
4. Ізольований полінуклеотид за будь-яким з пп. 1-2, де зазначений ізольований полінуклеотид включає послідовність, яка має щонайменше 95 % ідентичності послідовності, вибраної з групи, що складається з: SEQ ID NO:2, SEQ ID NO:4; SEQ ID NO:6; SEQ ID NO:8; SEQ ID NO:10; SEQ ID NO:12; SEQ ID NO:14; SEQ ID NO:16; SEQ ID NO:18; SEQ ID NO:20; SEQ ID NO:22; SEQ ID NO:24; SEQ ID NO:26; SEQ IDNO:28; SEQ ID NO:30; SEQ ID NO:32; SEQ ID NO:34; SEQ ID NO:36; SEQ ID NO:38; SEQ ID NO:40 і SEQ ID NO:120.
5. Ізольований полінуклеотид за будь-яким з пп. 1-2, де зазначений ізольований полінуклеотид включає послідовність, вибрану з групи, що складається з: SEQ ID NO:2, SEQ ID NO:4; SEQ ID NO:6; SEQ ID NO:8; SEQ ID NO:10; SEQ ID NO:12; SEQ ID NO:14; SEQ ID NO:16; SEQ ID NO:18; SEQ ID NO:20; SEQ ID NO:22; SEQ ID NO:24; SEQ ID NO:26; SEQ ID NO:28; SEQ ID NO:30; SEQ ID NO:32; SEQ ID NO:34; SEQ ID NO:36; SEQ ID NO:38; SEQ ID NO:40 і SEQ ID NO:120.
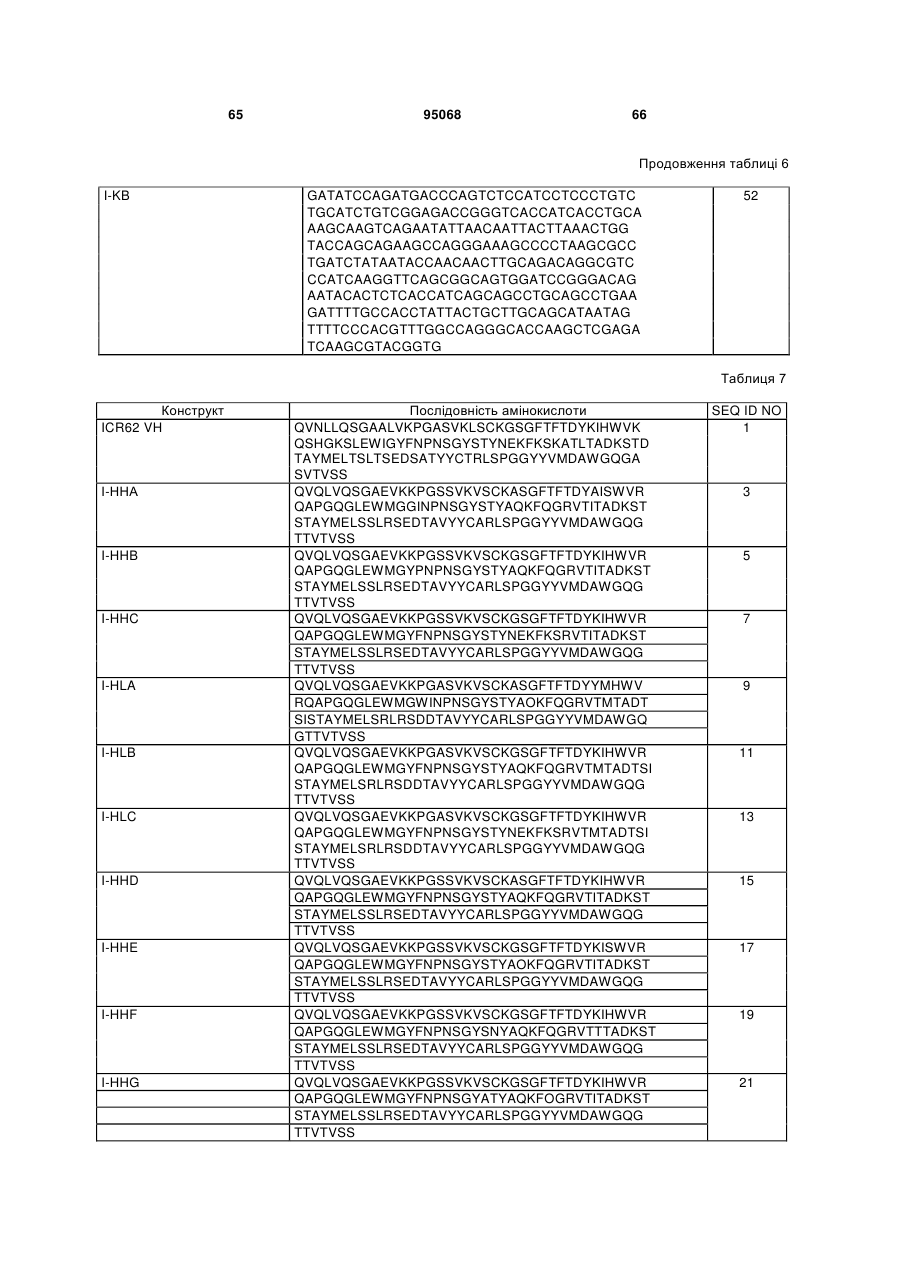
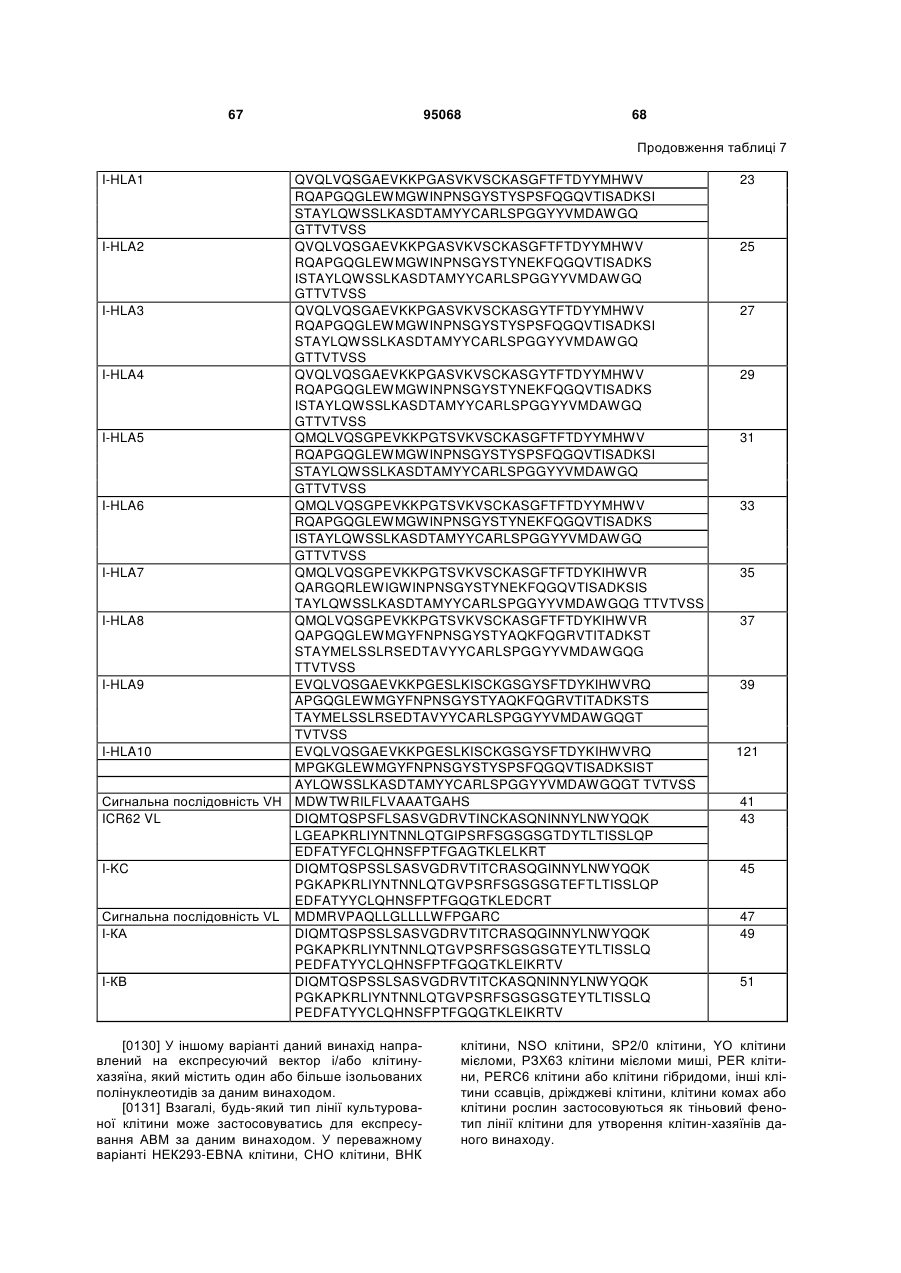
6. Ізольований полінуклеотид за будь-яким з пп. 1-5, де зазначений ізольований полінуклеотид кодує поліпептид, який включає послідовність, вибрану з групи, що складається з: SEQ ID NO:1; SEQ ID NO:3; SEQ ID NO:5; SEQ ID NO:7; SEQ ID NO:9; SEQ ID NO:11; SEQ ID NO:13; SEQ ID NO:15; SEQ ID NO:17; SEQ ID NO:19; SEQ ID NO:21; SEQ ID NO:23; SEQ ID NO:25; SEQ ID NO:27; SEQ ID NO:29; SEQ ID NO:31; SEQ ID NO:33; SEQ ID NO:35; SEQ ID NO:37; SEQ ID NO:39; і SEQ ID NO:121.
7. Ізольований полінуклеотид за будь-яким з пп. 1-6, де зазначений ізольований полінуклеотид включає послідовність, що кодує:
(a) CDR1 важкого ланцюга, вибрану з групи, що складається з: SEQ ID NO: 53, SEQ ID NO:59 і SEQ ID NO:65; і
(b) CDR2 важкого ланцюга, вибрану з групи, що складається з: SEQ ID NO: 79, SEQ ID NO:91 і SEQ ID NO:97; і
(c) CDR3 важкого ланцюга SEQ ID NO:107.
8. Ізольований полінуклеотид за п. 7, де зазначений ізольований полінуклеотид включає послідовність, що кодує:
(a) CDR1 важкого ланцюга SEQ ID NO:53; і
(b) CDR2 важкого ланцюга SEQ ID NO:79; і
(c) CDR3 важкого ланцюга SEQ ID NO:107.
9. Ізольований полінуклеотид за п. 7, де зазначений ізольований полінуклеотид включає послідовність, що кодує:
(а) CDR1 важкого ланцюга SEQ ID NO:59; і
(b) CDR2 важкого ланцюга SEQ ID NO:91; і
(c) CDR3 важкого ланцюга SEQ ID NO:107.
10. Ізольований полінуклеотид за п. 7, де зазначений ізольований полінуклеотид включає послідовність, що кодує:
(а) CDR1 важкого ланцюга SEQ ID NO:65; і
(b) CDR2 важкого ланцюга SEQ ID NO:97; і
(c) CDR3 важкого ланцюга SEQ ID NO:107.
11. Ізольований полінуклеотид за п. 7, де зазначений ізольований полінуклеотид включає:
(a) послідовність, вибрану з групи, яка складається з: SEQ ID NO: 54, SEQ ID NO: 60 і SEQ ID NO: 66; і
(b) послідовність, вибрану з групи, яка складається з: SEQ ID NO: 80; SEQ ID NO: 92 і SEQ ID NO: 98; і
(c) послідовність SEQ ID NO:108.
12. Ізольований полінуклеотид за п. 11, де зазначений ізольований полінуклеотид включає послідовність:
(a) SEQ ID NO:54; і
(b) SEQ ID NO:80; і
(с) SEQ ID NO:108.
13. Ізольований полінуклеотид за п. 11, де зазначений ізольований полінуклеотид включає послідовність:
(a) SEQ ID NO:60; і
(b) SEQ ID NO:92; і
(с) SEQ ID NO:108.
14. Ізольований полінуклеотид за п. 11, де зазначений ізольований полінуклеотид включає послідовність:
(a) SEQ ID NO:66; і
(b) SEQ ID NO:98; і
(c) SEQ ID NO:108.
15. Ізольований полінуклеотид за будь-яким з пп. 1-14, де зазначений поліпептид включає константну область важкого ланцюга або його фрагмент, з інших видів, окрім щура.
16. Ізольований полінуклеотид за п. 1, де зазначений ізольований полінуклеотид включає послідовність, що кодує:
(a) CDR1 легкого ланцюга SEQ ID NO:113; і
(b) CDR2 легкого ланцюга SEQ ID NO:115; і
(c) CDR3 легкого ланцюга SEQ ID NO:117.
17. Ізольований полінуклеотид за п. 1, де зазначений ізольований полінуклеотид включає послідовність:
(a) SEQ ID NO:112 або SEQ ID NO:114; і
(b) SEQ ID NO:116 або SEQ ID NO:118; і
(c) SEQ ID NO:119.
18. Ізольований полінуклеотид за п. 17, де зазначений ізольований полінуклеотид включає послідовність:
(a) SEQ ID NO:114; і
(b) SEQ ID NO:118; і
(c) SEQ ID NO:119.
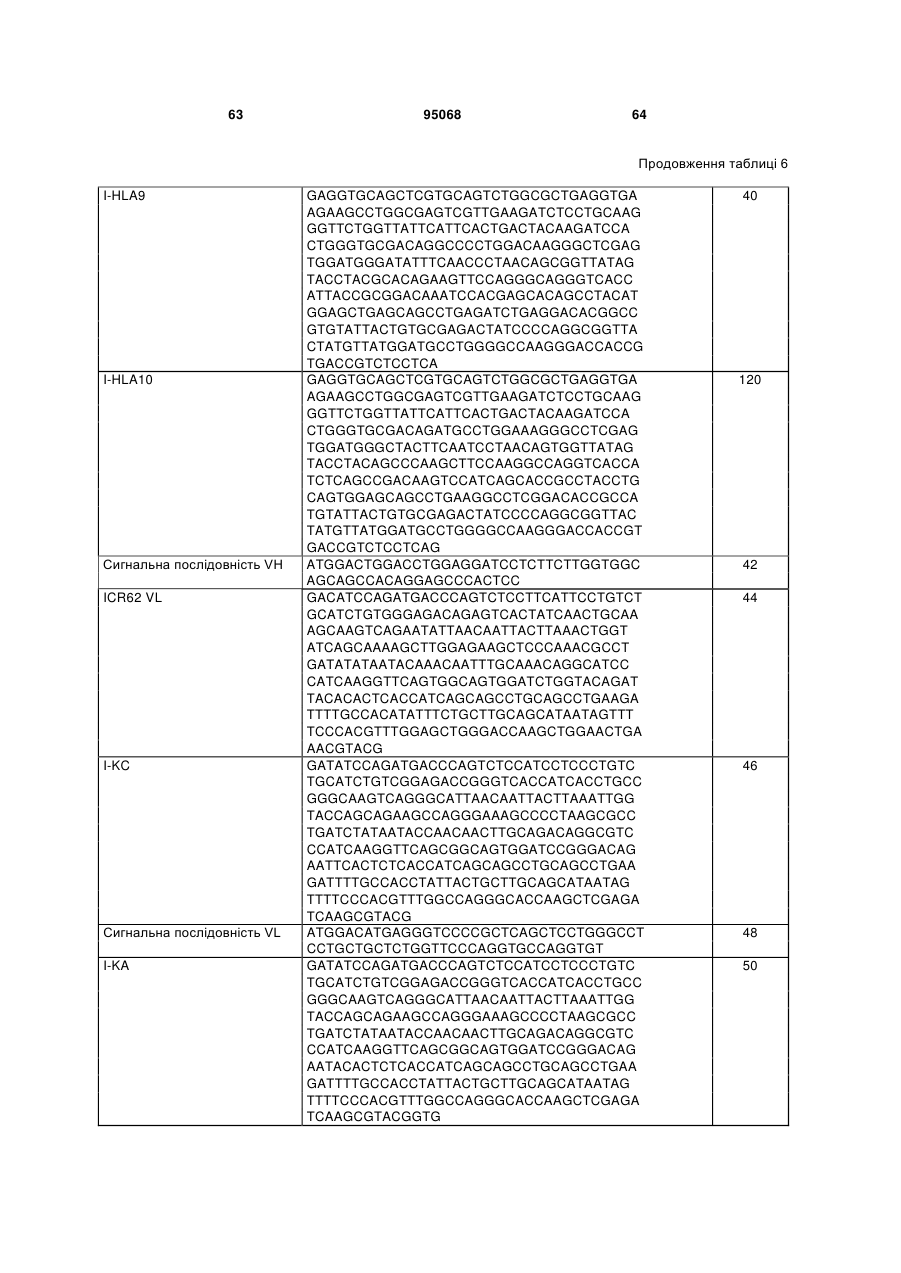
19. Ізольований полінуклеотид за будь-яким з пп. 1 або 16-18, де зазначений ізольований полінуклеотид включає послідовність, яка має щонайменше 80 % ідентичності послідовності, вибраної з групи, що складається з SEQ ID NO:44, SEQ ID NO:46, SEQ ID NO:50 і SEQ ID NO:52.
20. Ізольований полінуклеотид за будь-яким з пп. 1 або 16-18, де зазначений ізольований полінуклеотид включає послідовність, яка має щонайменше 95 % ідентичності послідовності, вибраної з групи, що складається з SEQ ID NO:44, SEQ ID NO:46, SEQ ID NO:50 і SEQ ID NO:52.
21. Ізольований полінуклеотид за будь-яким з пп. 1 або 16-18, де зазначений ізольований полінуклеотид включає послідовність, вибрану з групи, що складається з SEQ ID NO:44, SEQ ID NO:46, SEQ ID NO:50 і SEQ ID NO:52.
22. Ізольований полінуклеотид за будь-яким з пп. 1 або 16-21, де зазначений ізольований полінуклеотид кодує поліпептид, що містить послідовність, вибрану з групи, що складається з: SEQ ID NO:43, SEQ ID NO:45, SEQ ID NO:49 і SEQ ID NO:51.
23. Ізольований полінуклеотид за будь-яким з пп. 1 або 16-22, де зазначений поліпептид включає константну область легкого ланцюга або його фрагмент, з інших видів, окрім щура.
24. Ізольований полінуклеотид за п. 1,
де зазначений полінуклеотид включає першу послідовність, що кодує:
(a) CDR1 важкого ланцюга, вибрану з групи, що складається з SEQ ID NO:53, SEQ ID NO:59 і SEQ ID NO:65; і
(b) CDR2 важкого ланцюга, вибрану з групи, що складається з SEQ ID NO:79, SEQ ID NO:91 і SEQ ID NO:97; і
(c) CDR3 важкого ланцюгаSEQ ID NO:107; і
де зазначений полінуклеотид додатково включає другу послідовність, що кодує:
(d) CDR1 легкого ланцюга SEQ ID NO:111 або SEQ ID NO:113; і
(e) CDR2 легкого ланцюга SEQ ID NO:115; і
(f) CDR3 легкого ланцюга SEQ ID NO:117.
25. Ізольований полінуклеотид за п. 24,
де зазначена перша послідовність кодує:
(a) CDR1 важкого ланцюга SEQ ID NO:53; і
(b) CDR2 важкого ланцюга SEQ ID NO:79; і
(c) CDR3 важкого ланцюга SEQ ID NO:107; і
де зазначена друга послідовність кодує:
(d) CDR1 легкого ланцюга SEQ ID NO:113; і
(e) CDR2 легкого ланцюга SEQ ID NO:115; і
(f) CDR3 легкого ланцюга SEQ ID NO:117.
26. Ізольований полінуклеотид за п. 24,
де зазначена перша послідовність кодує:
(a) CDR1 важкого ланцюга SEQ ID NO:59; і
(b) CDR2 важкого ланцюга SEQ ID NO:91; і
(c) CDR3 важкого ланцюга SEQ ID NO:107; і
де зазначена друга послідовність кодує:
(d) CDR1 легкого ланцюга SEQ ID NO:113; і
(e) CDR2 легкого ланцюга SEQ ID NO:115; і
(f) CDR3 легкого ланцюга SEQ ID NO:117.
27. Ізольований полінуклеотид за п. 24,
де зазначена перша послідовність кодує:
(a) CDR1 важкого ланцюга SEQ ID NO:65; і
(b) CDR2 важкого ланцюга SEQ ID NO:97; і
(c) CDR3 важкого ланцюга SEQ ID NO:107; і
де зазначена друга послідовність кодує:
(d) CDR1 легкого ланцюга SEQ ID NO:113; і
(e) CDR2 легкого ланцюга SEQ ID NO:115; і
(f) CDR3 легкого ланцюга SEQ ID NO:117.
28. Ізольований полінуклеотид за п. 24,
де зазначена перша послідовність включає:
(a) SEQ ID NO:54, SEQ ID NO:60 або SEQ ID NO:66; і
(b) SEQ ID NO:80, SEQ ID NO:92 або SEQ ID NO:98; і
(c) SEQ ID NO:108; і
де зазначена друга послідовність включає:
(d) SEQ ID NO:112 або SEQ ID NO:114; і
(e) SEQ ID NO:116 або SEQ ID NO:118; і
(f) SEQ ID NO:119.
29. Ізольований полінуклеотид за п. 24,
де зазначена перша послідовність включає:
(a) SEQ ID NO:54; і
(b) SEQ ID NO:80; і
(c) SEQ ID NO:108; і
де зазначена друга послідовність включає:
(d) SEQ ID NO:114; і
(e) SEQ ID NO:118; і
(f) SEQ ID NO:119.
30. Ізольований полінуклеотид за п. 24,
де зазначена перша послідовність включає:
(a) SEQ ID NO:60; і
(b) SEQ ID NO:92; і
(c) SEQ ID NO:108; і
де зазначена друга послідовність включає:
(d) SEQ ID NO:114; і
(e) SEQ ID NO:118; і
(f) SEQ ID NO:119.
31. Ізольований полінуклеотид за п. 24,
де зазначена перша послідовність включає:
(a) SEQ ID NO:66; і
(b) SEQ ID NO:98; і
(c) SEQ ID NO:108; і
де зазначена друга послідовність включає:
(d) SEQ ID NO:114; і
(e) SEQ ID NO:118; і
(f) SEQ ID NO:119.
32. Ізольований полінуклеотид за будь-яким з пп. 24-31, де зазначений полінуклеотид, що включає зазначену першу послідовність, кодує поліпептид, який включає послідовність SEQ ID NO:15, і
де зазначений полінуклеотид, що включає зазначену другу послідовність, кодує поліпептид, який включає послідовність SEQ ID NO:45.
33. Ізольований полінуклеотид за п. 32, де зазначена перша послідовність включає SEQ ID NO: 16, і де зазначена друга послідовність включає SEQ ID NO:46.
34. Експресуючий вектор, що включає ізольований полінуклеотид за будь-яким з пп. 1-33.
35. Експресуючий вектор за п. 34, де зазначений експресуючий вектор включає ізольований полінуклеотид за будь-яким з пп. 2-15 і ізольований полінуклеотид за будь-яким з пп. 16-23.
36. Експресуючий вектор за п. 34, де зазначений експресуючий вектор включає ізольований полінуклеотид за будь-яким з пп. 24-33.
37. Композиція, що включає ізольований полінуклеотид за будь-яким з пп. 2-15 і ізольований полінуклеотид за будь-яким з пп. 16-23.
38. Клітина-хазяїн, що включає ізольований полінуклеотид за будь-яким з пп. 1-33.
39. Клітина-хазяїн, що включає експресуючий вектор за будь-яким з пп. 34-36.
40. Клітина-хазяїн, що включає композицію за п. 37.
41. Клітина-хазяїн за п. 38, що включає перший ізольований полінуклеотид і другий ізольований полінуклеотид,
де зазначений перший ізольований полінуклеотид включає послідовність, що кодує:
(a) CDR1 важкого ланцюга, вибрану з групи, яка складається з: SEQ ID NO:53, SEQ ID NO:59 і SEQ ID NO:65; і
(b) CDR2 важкого ланцюга, вибрану з групи, яка складається з: SEQ ID NO:79, SEQ ID NO:91 і SEQ ID NO:97; і
(с) CDR3 важкого ланцюга SEQ ID NO:107; і
де зазначений другий ізольований полінуклеотид включає послідовність, що кодує:
(a) CDR1 легкого ланцюга SEQ ID NO:111 або SEQ ID NO:113; і
(b) CDR2 легкого ланцюга SEQ ID NO:115; і
(с) CDR3 легкого ланцюга SEQ ID NO:117.
42. Клітина-хазяїн за п. 38, що включає перший ізольований полінуклеотид і другий ізольований полінуклеотид,
де зазначений перший ізольований полінуклеотид включає послідовність, що кодує:
(a) CDR1 важкого ланцюга SEQ ID NO:53; і
(b) CDR2 важкого ланцюга SEQ ID NO:79; і
(с) CDR3 важкого ланцюга SEQ ID NO:107; і
де зазначений другий ізольований полінуклеотид включає послідовність, що кодує:
(a) CDR1 легкого ланцюга SEQ ID NO:113; і
(b) CDR2 легкого ланцюга SEQ ID NO:115; і
(с) CDR3 легкого ланцюга SEQ ID NO:117.
43. Клітина-хазяїн за п. 38, що включає перший ізольований полінуклеотид і другий ізольований полінуклеотид,
де зазначений перший ізольований полінуклеотид включає послідовність, що кодує:
(a) CDR1 важкого ланцюга SEQ ID NO:59; і
(b) CDR2 важкого ланцюга SEQ ID NO:91; і
(с) CDR3 важкого ланцюга SEQ ID NO:107; і
де зазначений другий ізольований полінуклеотид включає послідовність, що кодує:
(a) CDR1 легкого ланцюга SEQ ID NO:113; і
(b) CDR2 легкого ланцюга SEQ ID NO:115; і
(с) CDR3 легкого ланцюга SEQ ID NO:117.
44. Клітина-хазяїн за п. 38, що включає перший ізольований полінуклеотид і другий ізольований полінуклеотид,
де зазначений перший ізольований полінуклеотид включає послідовність, що кодує:
(a) CDR1 важкого ланцюга SEQ ID NO:65; і
(b) CDR2 важкого ланцюга SEQ ID NO:97; і
(с) CDR3 важкого ланцюга SEQ ID NO:107; і
де зазначений другий ізольований полінуклеотид включає послідовність, що кодує:
(a) CDR1 легкого ланцюга SEQ ID NO:113; і
(b) CDR2 легкого ланцюга SEQ ID NO:115; і
(с) CDR3 легкого ланцюга SEQ ID NO:117.
45. Клітина-хазяїн за п. 38, що включає перший ізольований полінуклеотид і другий ізольований полінуклеотид,
де зазначений перший ізольований полінуклеотид включає:
(a) послідовність, вибрану з групи, що складається з: SEQ ID NO:54, SEQ ID NO:60 і SEQ ID NO:66; і
(b) послідовність, вибрану з групи, що складається з: SEQ ID NO:80, SEQ ID NO:92 і SEQ ID NO:98; і
(с) послідовність SEQ ID NO:108; і
де зазначений другий ізольований полінуклеотид включає послідовність:
(a) SEQ ID NO:112 або SEQ ID NO:114; і
(b) SEQ ID NO:116 або SEQ ID NO:118; і
(с) SEQ ID NO:119.
46. Клітина-хазяїн за п. 38, що включає перший ізольований полінуклеотид і другий ізольований полінуклеотид,
де зазначений перший ізольований полінуклеотид включає послідовність:
(a) SEQ ID NO:54; і
(b) SEQ ID NO:80; і
(c) SEQ ID NO:108; і
де зазначений другий ізольований полінуклеотид включає послідовність:
(a) SEQ ID NO:114; і
(b) SEQ ID NO:118; і
(c) SEQ ID NO:119.
47. Клітина-хазяїн за п. 38, що включає перший ізольований полінуклеотид і другий ізольований полінуклеотид,
де зазначений перший ізольований полінуклеотид включає послідовність:
(a) SEQ ID NO:60; і
(b) SEQ ID NO:92; і
(c) SEQ ID NO:108; і
де зазначений другий ізольований полінуклеотид включає послідовність:
(a) SEQ ID NO:114; і
(b) SEQ ID NO:118; і
(c) SEQ ID NO:119.
48. Клітина-хазяїн за п. 38, що включає перший ізольований полінуклеотид і другий ізольований полінуклеотид,
де зазначений перший ізольований полінуклеотид включає послідовність:
(a) SEQ ID NO:66; і
(b) SEQ ID NO:98; і
(c) SEQ ID NO:108; і
де зазначений другий ізольований полінуклеотид включає послідовність:
(a) SEQ ID NO:114; і
(b) SEQ ID NO:118; і
(c) SEQ ID NO:119.
49. Клітина-хазяїн за п. 38, що включає перший ізольований полінуклеотид і другий ізольований полінуклеотид,
де перший ізольований полінуклеотид включає послідовність SEQ ID NO:16, і
де другий ізольований полінуклеотид включає послідовність SEQ ID NO:46.
50. Клітина-хазяїн за п. 38, що включає перший ізольований полінуклеотид і другий ізольований полінуклеотид,
де перший ізольований полінуклеотид включає послідовність, що кодує поліпептид, що включає послідовність SEQ ID NO:15, і
де другий ізольований полінуклеотид включає послідовність, що кодує поліпептид, що включає послідовність SEQ ID NO:45.
51. Спосіб утворення гуманізованої, сконструйованої шляхом глікотехнології анти-EGFR антигензв'язуючої молекули, яка здатна конкурувати з антитілом щура ICR62 для зв'язування з EGFR людини, де зазначений спосіб містить етапи, на яких:
(a) культивують клітину-хазяїна за будь-яким з пп. 38-50, де зазначену клітину-хазяїна додатково конструюють для експресії щонайменше однієї нуклеїнової кислоти, що кодує поліпептид, який має активність β(l,4)-N-ацетилглюкозамінілтрансферази III, у середовищі при умовах, які дозволяють експресію зазначеного полінуклеотиду, який кодує зазначений поліпептид, який є частиною зазначеної антигензв'язуючої молекули, і які дозволяють модифікацію олігосахаридів, присутніх у Fc-області зазначеної антигензв'язуючої молекули; і
(b) відновлюють зазначену антигензв'язуючу молекулу.
52. Спосіб за п. 51, де зазначену клітину-хазяїна додатково конструюють для експресії нуклеїнової кислоти, що кодує поліпептид, який має активність манозидази II.
53. Ізольований поліпептид, кодований полінуклеотидом за будь-яким з пп. 1-33.
54. Гуманізована, сконструйована шляхом глікотехнології анти-EGFR антигензв'язуюча молекула, що містить перший ізольований поліпептид, кодований полінуклеотидом за будь-яким з пп. 2-15, і другий ізольований поліпептид, кодований полінуклеотидом за будь-яким з пп. 16-23.
55. Антигензв'язуюча молекула за п. 54, де зазначена антигензв'язуюча молекула включає перший поліпептид і другий поліпептид,
де зазначений перший поліпептид включає:
(a) CDR1 важкого ланцюга, вибрану з групи, що складається з: SEQ ID NO:53, SEQ ID NO:59 і SEQ ID NO:65; і
(b) CDR2 важкого ланцюга, вибрану з групи, що складається з: SEQ ID NO:79, SEQ ID NO:91 і SEQ ID NO:97; і
(c) CDR3 важкого ланцюга SEQ ID NO:107; і
де зазначений другий поліпептид включає послідовність:
(d) CDR1 легкого ланцюга SEQ ID NO:111 або SEQ ID NO:113; і
(e) CDR2 легкого ланцюга SEQ ID NO:115; і
(f) CDR3 легкого ланцюга SEQ ID NO:117.
56. Антигензв'язуюча молекула за п. 55,
де зазначений перший поліпептид включає послідовність:
(a) CDR1 важкого ланцюга SEQ ID NO:53; і
(b) CDR2 важкого ланцюга SEQ ID NO:79; і
(c) CDR3 важкого ланцюга SEQ ID NO:107; і
де зазначений другий поліпептид включає послідовність:
(d) CDR1 легкого ланцюга SEQ ID NO:113; і
(e) CDR2 легкого ланцюга SEQ ID NO:115; і
(f) CDR3 легкого ланцюга SEQ ID NO:117.
57. Антигензв'язуюча молекула за п. 55,
де зазначений перший поліпептид включає послідовність:
(a) CDR1 важкого ланцюга SEQ ID NO:59; і
(b) CDR2 важкого ланцюга SEQ ID NO:91; і
(c) CDR3 важкого ланцюга SEQ ID NO:107; і
де зазначений другий поліпептид включає послідовність:
(d) CDR1 легкого ланцюга SEQ ID NO:113; і
(e) CDR2 легкого ланцюга SEQ ID NO:115; і
(f) CDR3 легкого ланцюга SEQ ID NO:117.
58. Антигензв'язуюча молекула за п. 55,
де зазначений перший поліпептид включає послідовність:
(a) CDR1 важкого ланцюга SEQ ID NO:65; і
(b) CDR2 важкого ланцюга SEQ ID NO:97; і
(c) CDR3 важкого ланцюга SEQ ID NO:107; і
де зазначений другий поліпептид включає послідовність:
(d) CDR1 легкого ланцюга SEQ ID NO:113; і
(e) CDR2 легкого ланцюга SEQ ID NO:115; і
(f) CDR3 легкого ланцюга SEQ ID NO:117.
59. Гуманізована, сконструйована шляхом глікотехнології анти-EGFR антигензв'язуюча молекула, що специфічно зв’язує EGFR, де зазначена антигензв'язуюча молекула включає перший поліпептид і другий поліпептид, де зазначений перший поліпептид включає послідовність:
(a) CDR1 важкого ланцюга, вибрану з групи, що складається з: SEQ ID NO:53, SEQ ID NO:55, SEQ ID NO:57, SEQ ID NO:59, SEQ ID NO:61, SEQ ID NO:63, SEQ ID NO:65, SEQ ID NO:67, SEQ ID NO:69, SEQ ID NO:71, SEQ ID NO:73, SEQ ID NO:123 і SEQ ID NO:125; і
(b) CDR2 важкого ланцюга, вибрану з групи, що складається з: SEQ ID NO:75, SEQ ID NO:77, і SEQ ID NO:79, SEQ ID NO:81, SEQ ID NO:83, SEQ ID NO:85, SEQ ID NO:87, SEQ ID NO:89, SEQ ID NO:127, SEQ ID NO:91, SEQ ID NO:93, SEQ ID NO:95, SEQ ID NO:97, SEQ ID NO:99, SEQ ID NO:101, SEQ ID NO:103 і SEQ ID NO:105; і
(c) CDR3 важкого ланцюга SEQ ID NO:107; і
де зазначений другий поліпептид включає послідовність:
(d) CDR1 легкого ланцюга SEQ ID NO:111 або SEQ ID NO:113; і
(e) CDR2 легкого ланцюга SEQ ID NO:115; і
(f) CDR3 легкого ланцюга SEQ ID NO:117.
60. Антигензв'язуюча молекула за п. 59,
де зазначений перший поліпептид включає послідовність:
(a) CDR1 важкого ланцюга, вибрану з групи, що складається з: SEQ ID NO:53, SEQ ID NO:59 і SEQ ID NO:65; і
(b) CDR2 важкого ланцюга, вибрану з групи, що складається з: SEQ ID NO:79, SEQ ID NO:91 і SEQ ID NO:97; і
(c) CDR3 важкого ланцюга SEQ ID NO:107; і
де зазначений другий поліпептид включає послідовність:
(d) CDR1 легкого ланцюга SEQ ID NO:113; і
(e) CDR2 легкого ланцюга SEQ ID NO:115; і
(f) CDR3 легкого ланцюга SEQ ID NO:117.
61. Антигензв'язуюча молекула за п. 60,
де зазначений перший поліпептид включає послідовність:
(a) CDR1 важкого ланцюга SEQ ID NO:53; і
(b) CDR2 важкого ланцюга SEQ ID NO:79; і
(c) CDR3 важкого ланцюга SEQ ID NO:107; і
де зазначений другий поліпептид включає послідовність:
(d) CDR1 легкого ланцюга SEQ ID NO:113; і
(e) CDR2 легкого ланцюга SEQ ID NO:115; і
(f) CDR3 легкого ланцюга SEQ ID NO:117.
62. Антигензв'язуюча молекула за п. 60,
де зазначений перший поліпептид включає послідовність:
(a) CDR1 важкого ланцюга SEQ ID NO:59; і
(b) CDR2 важкого ланцюга SEQ ID NO:91; і
(c) CDR3 важкого ланцюга SEQ ID NO:107; і
де зазначений другий поліпептид включає послідовність:
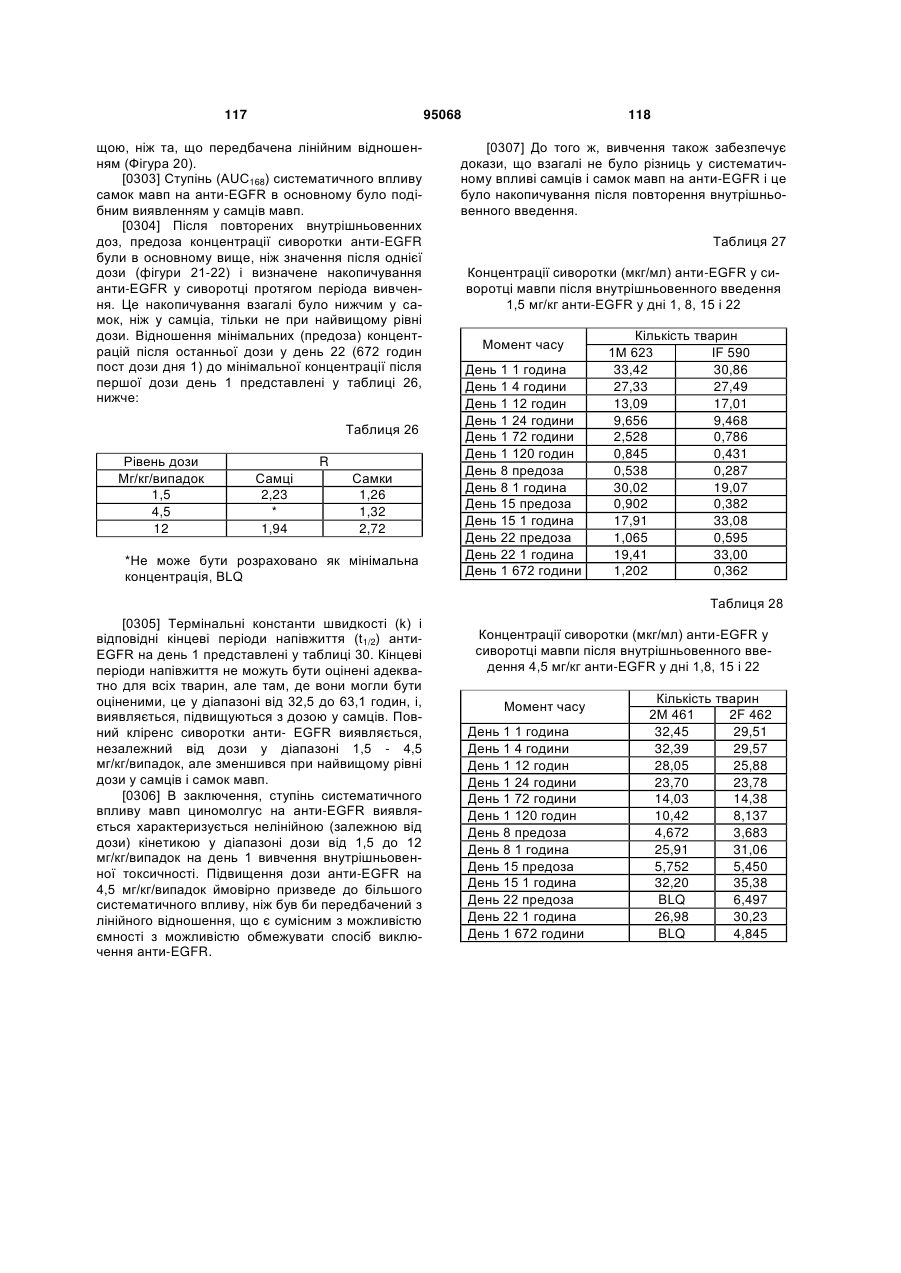
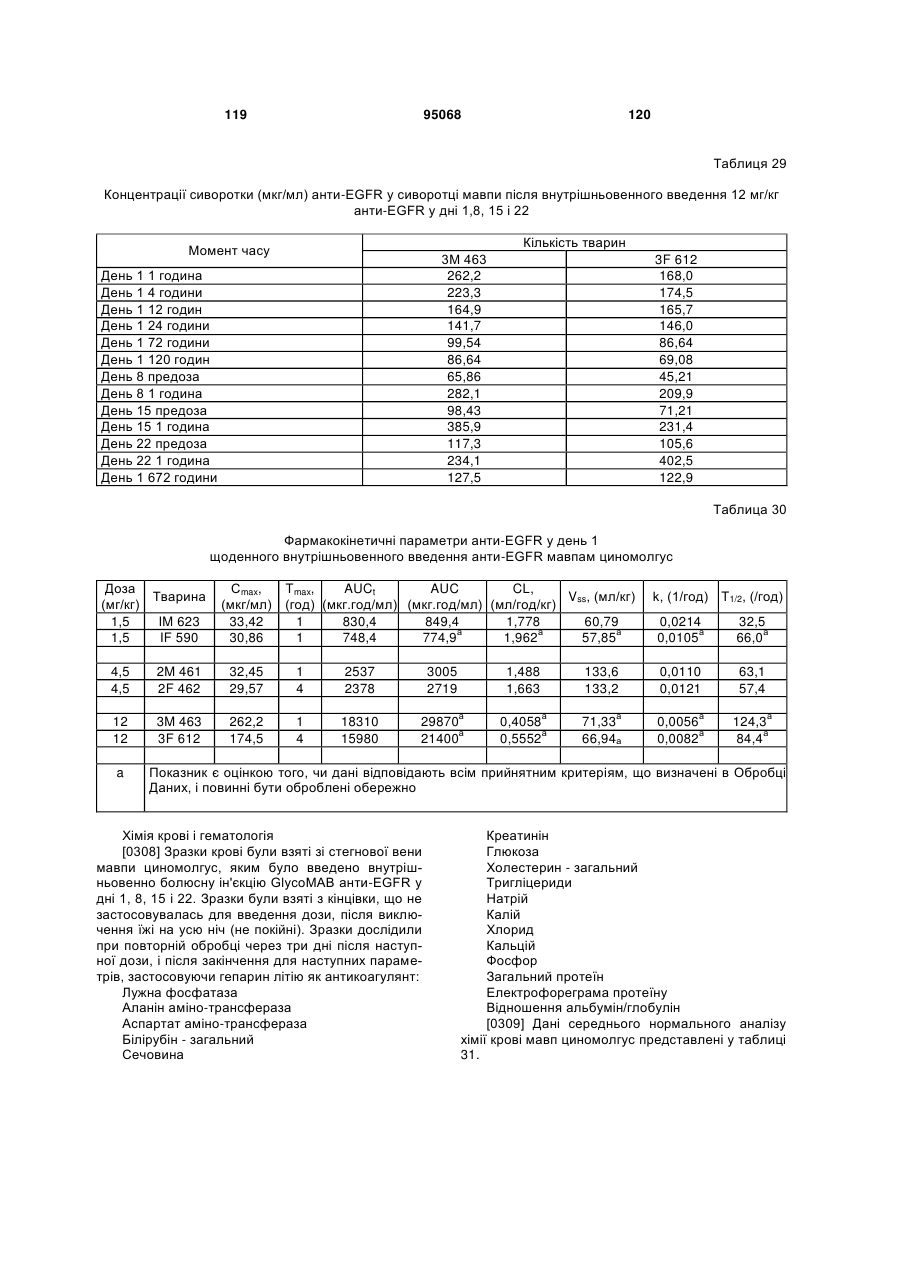
(d) CDR1 легкого ланцюга SEQ ID NO:113; і
(e) CDR2 легкого ланцюга SEQ ID NO:115; і
(f) CDR3 легкого ланцюга SEQ ID NO:117.
63. Антигензв'язуюча молекула за п. 60,
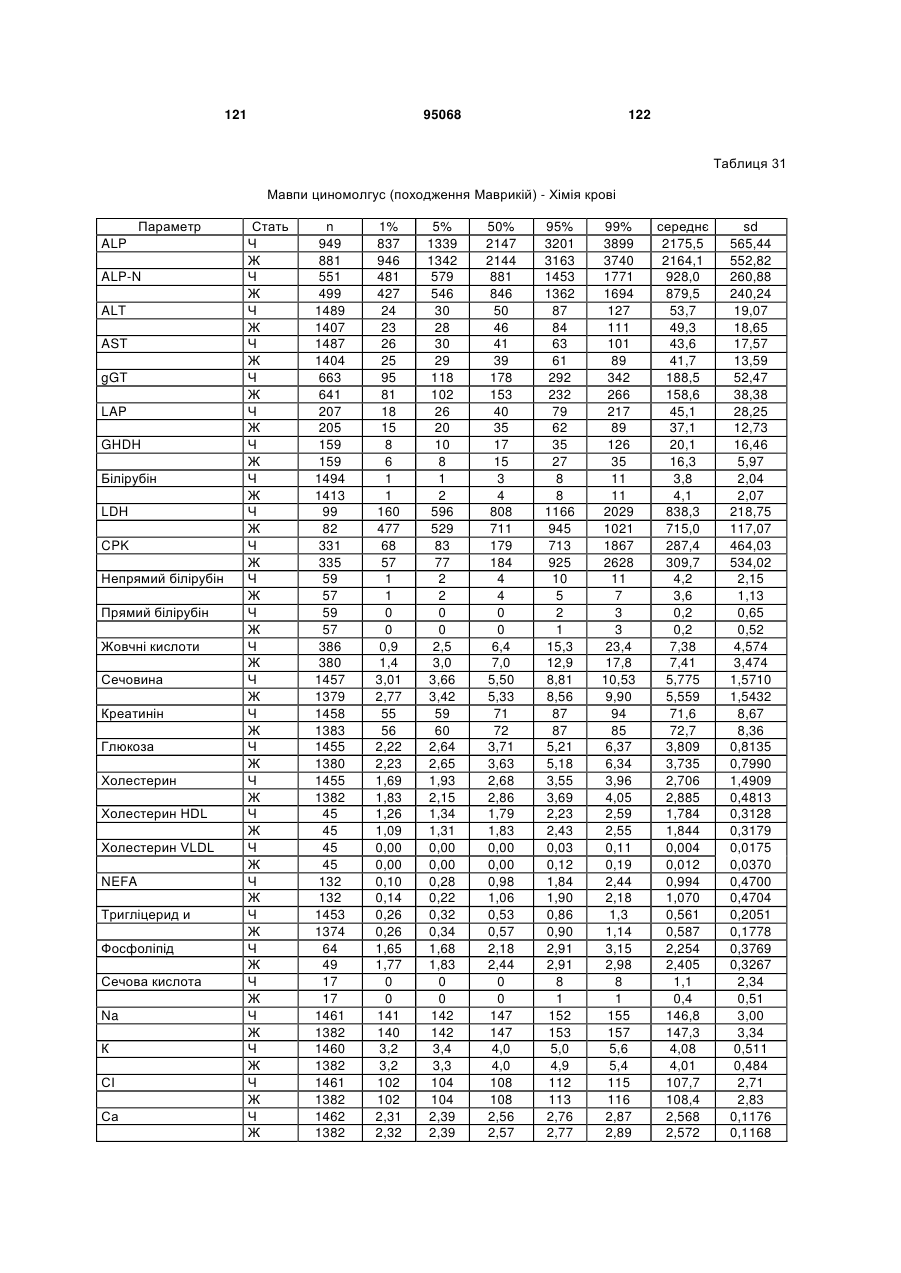
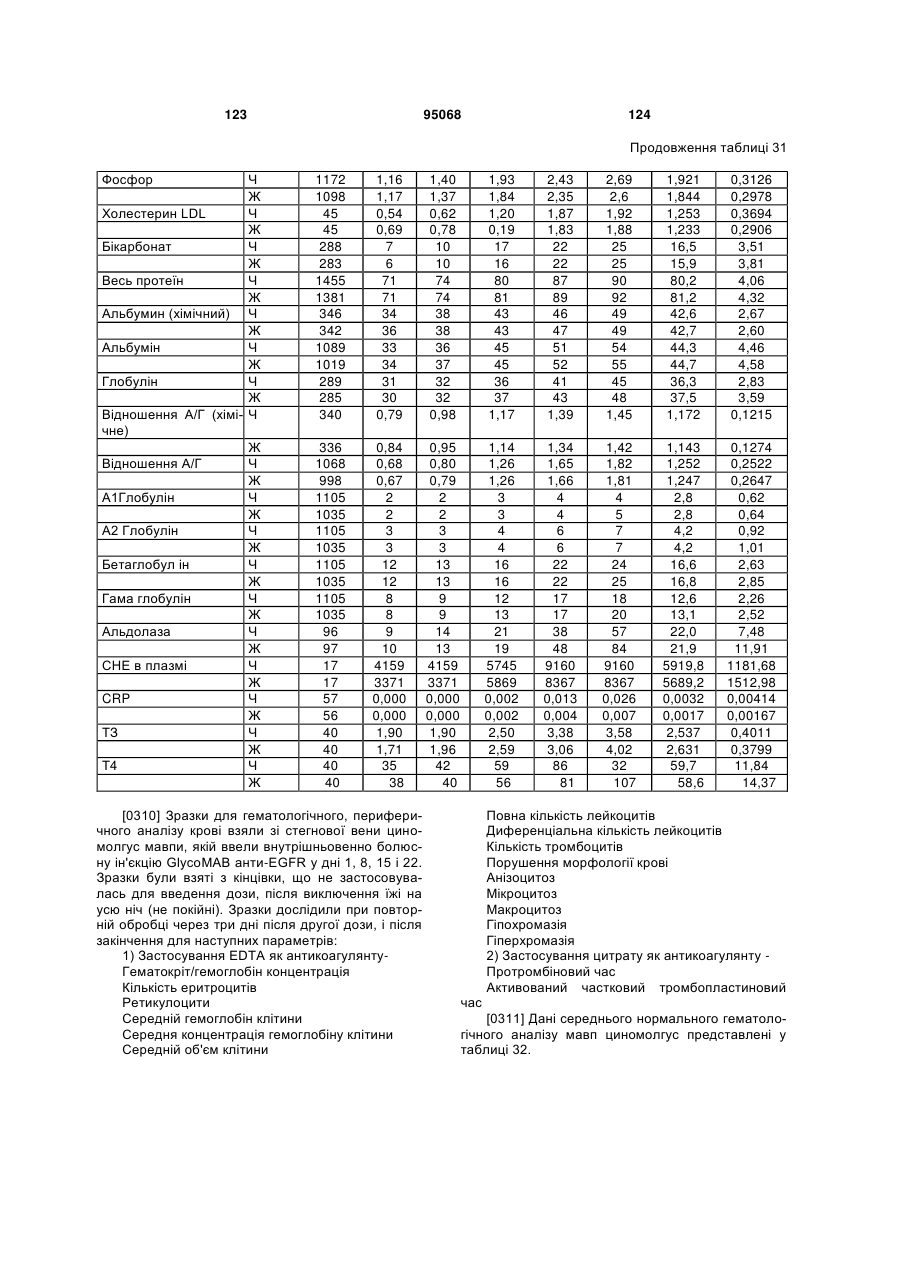
де зазначений перший поліпептид включає послідовність:
(a) CDR1 важкого ланцюга SEQ ID NO:65; і
(b) CDR2 важкого ланцюга SEQ ID NO:97; і
(c) CDR3 важкого ланцюга SEQ ID NO:107; і
де зазначений другий поліпептид включає послідовність:
(d) CDR1 легкого ланцюга SEQ ID NO:113; і
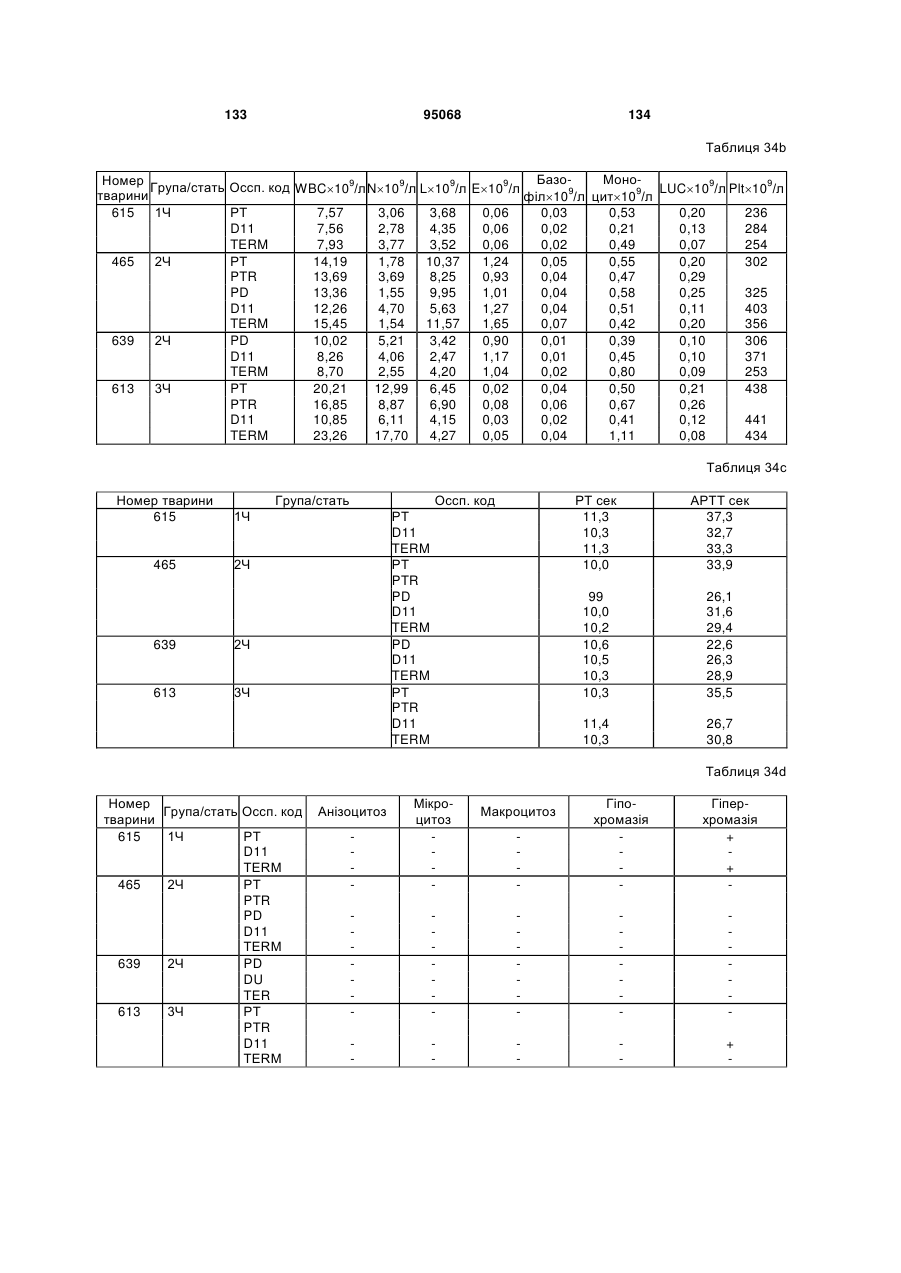
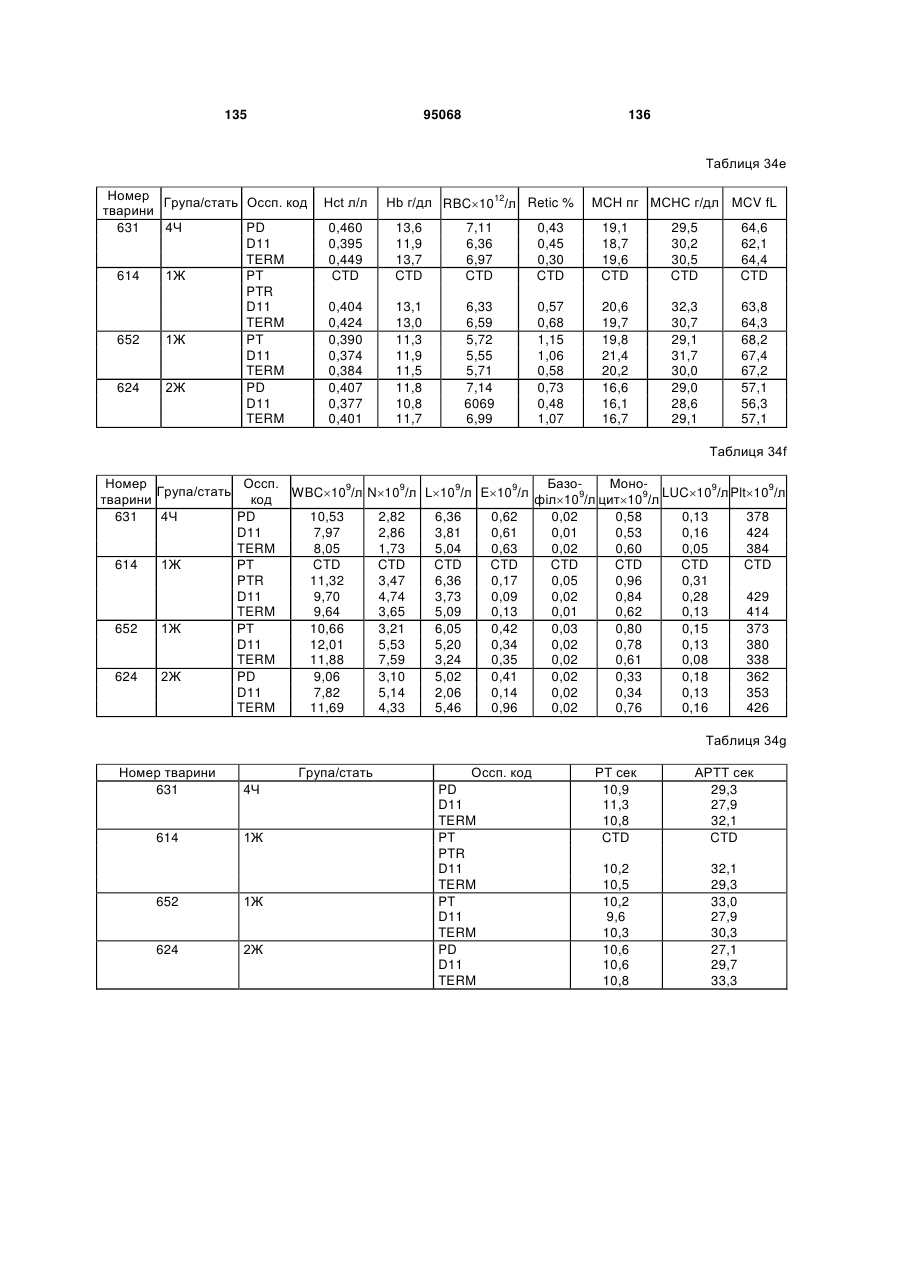
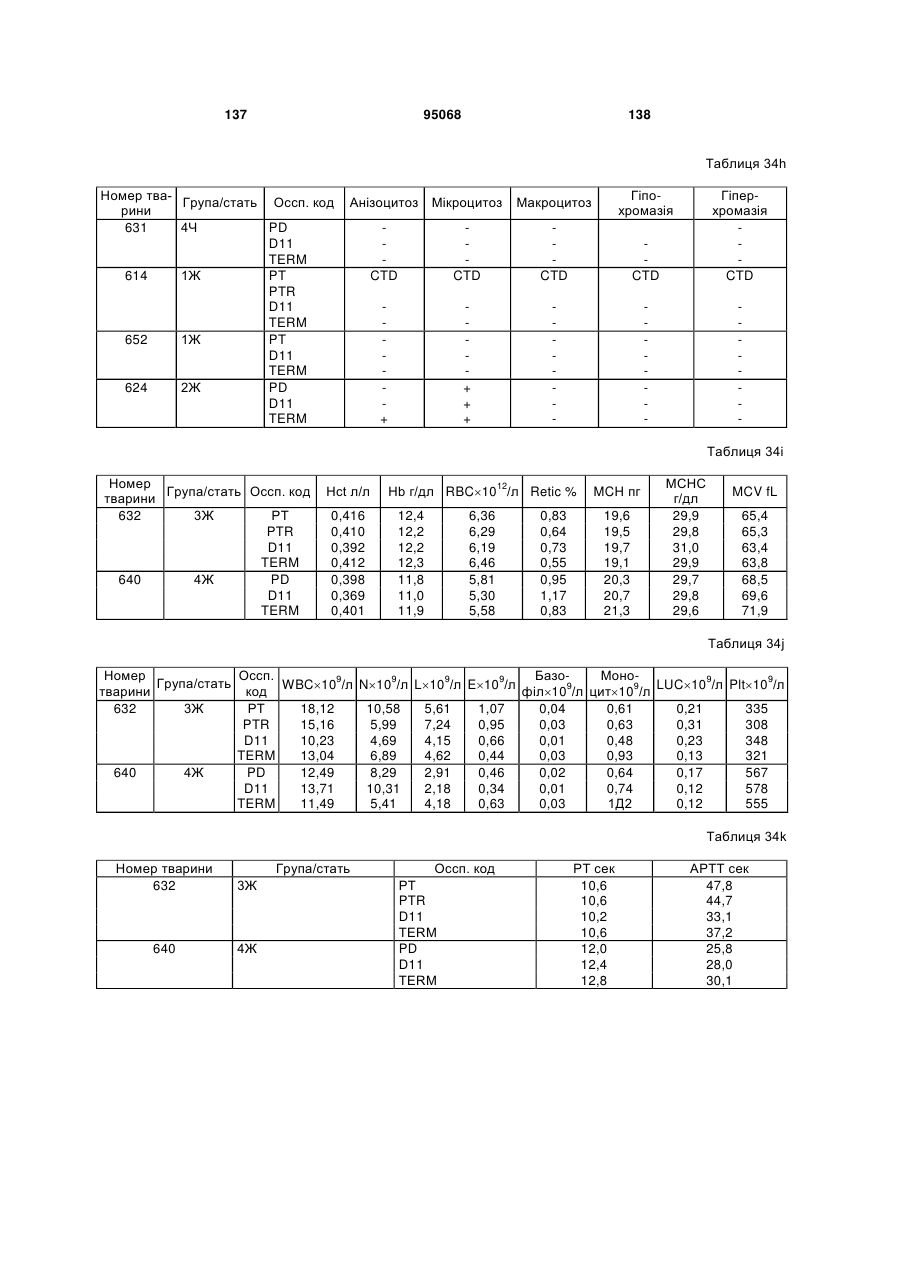
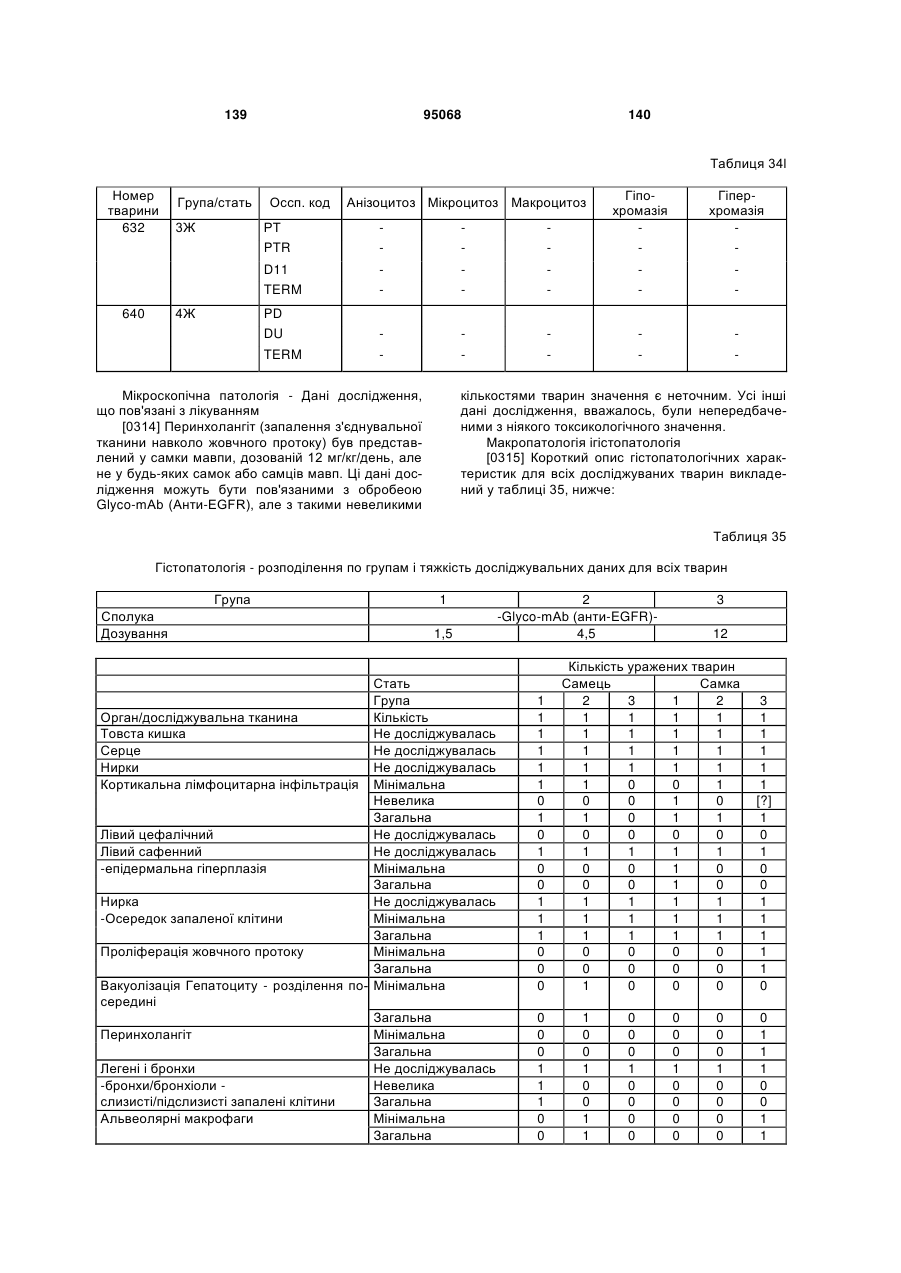
(e) CDR2 легкого ланцюга SEQ ID NO:115; і
(f) CDR3 легкого ланцюга SEQ ID NO:117.
64. Антигензв'язуюча молекула за будь-яким пп. 54-63, де зазначена антигензв'язуюча молекула включає перший поліпептид і другий поліпептид,
де зазначений перший поліпептид кодований полінуклеотидом, що включає послідовність:
(a) SEQ ID NO:54, SEQ ID NO:60 або SEQ ID NO:66; і
(b) SEQ ID NO:80, SEQ ID NO:92 або SEQ ID NO:98; і
(c) SEQ ID NO:108; і
де зазначений другий поліпептид кодований полінуклеотидом, що включає послідовність:
(d) SEQ ID NO:112 або SEQ ID NO:114; і
(e) SEQ ID NO:116 або SEQ ID NO:118; і
(f) SEQ ID NO:119.
65. Антигензв'язуюча молекула за п. 64,
де зазначений перший поліпептид кодований полінуклеотидом, що включає послідовність:
(a) SEQ ID NO:54; і
(b) SEQ ID NO:80; і
(c) SEQ ID NO:108; і
де зазначений другий поліпептид кодований полінуклеотидом, що включає послідовність:
(d) SEQ ID NO:114; і
(e) SEQ ID NO:118; і
(f) SEQ ID NO:119.
66. Антигензв'язуюча молекула за будь-яким пп. 54-65, де зазначена антигензв'язуюча молекула включає перший поліпептид, що включає послідовність SEQ ID NO:15 і другий поліпептид, що включає послідовність SEQ ID NO:45.
67. Антигензв'язуюча молекула за п. 66, де зазначений перший поліпептид кодований полінуклеотидом, що включає послідовність SEQ ID NO:16, і де зазначений другий поліпептид кодований полінуклеотидом, що включає послідовність SEQ ID NO:46.
68. Антигензв'язуюча молекула за будь-яким з пп. 54-67, де зазначена антигензв'язуюча молекула містить Fc-область людини.
69. Антигензв'язуюча молекула за п. 68, де зазначена антигензв'язуюча молекула була сконструйована шляхом глікотехнології так, що має змінену олігосахаридну структуру у Fc-області.
70. Антигензв'язуюча молекула за п. 69, де зазначена Fc-область має зменшену кількість залишків фукози у порівнянні з антигензв'язуючою молекулою, що не була сконструйована шляхом глікотехнології.
71. Антигензв'язуюча молекула за п. 69 або п. 70, де щонайменше 70 % олігосахаридів у Fc-області є нефукозильованими.
72. Антигензв'язуюча молекула за будь-яким пп. 54-71, де зазначена антигензв'язуюча молекула є гуманізованим антитілом.
73. Антигензв'язуюча молекула за будь-яким пп. 54-72 для застосування як лікарського засобу у лікуванні порушення, пов’язаного з EGFR.
74. Антигензв'язуюча молекула за п. 73, де зазначене порушення, пов’язане з EGFR, характеризується надекспресією EGFR.
75. Антигензв'язуюча молекула за п. 73 або п. 74, де зазначене порушення, пов’язане з EGFR, є раком.
76. Антигензв'язуюча молекула за п. 75, де зазначений рак вибраний з групи, що складається з раку молочної залози, раку сечового міхура, раку голови і шиї, раку шкіри, раку підшлункової залози, раку легень, раку яєчника, раку товстої кишки, раку простати, раку нирок і раку мозку.
77. Спосіб для визначення in vivo або in vitro присутності EGFR у зразку, що містить етапи, на яких:
(a) забезпечують взаємодію зі зразком для перевірки, необов'язково з контрольним зразком, з антигензв'язуючою молекулою за будь-яким з пп. 54-72 при умовах, які дозволяють формування комплексу між антигензв'язуючою молекулою і EGFR; і
(b) визначають зазначені комплекси антигензв'язуючої молекули-EGFR.
78. Клітина-хазяїн, що сконструйована для експресії щонайменше однієї нуклеїнової кислоти, що кодує поліпептид, який має активність β(1,4)-N-ацетилглюкозамінілтрансферази III у кількості, достатній, щоб модифікувати олігосахариди у Fc-області поліпептиду, що продукується зазначеною клітиною-хазяїном, де зазначений поліпептид являє собою антигензв'язуючу молекулу за будь-яким з пп. 54-72.
79. Клітина-хазяїн за п. 78, де зазначена клітина-хазяїн додатково сконструйована для експресії нуклеїнової кислоти, що кодує поліпептид, який має активність манозидази II у кількості, достатній, щоб модифікувати олігосахариди у Fc-області поліпептиду, що продукується зазначеною клітиною-хазяїном.
80. Клітина-хазяїн за п. 78 або п. 79, де зазначена антигензв'язуюча молекула, що продукується зазначеною клітиною-хазяїном, проявляє підвищення афінності зв'язування Fc-рецептора як результат зазначеної модифікації.
81. Клітина-хазяїн за п. 78 або п. 79, де зазначена антигензв'язуюча молекула, що продукується зазначеною клітиною-хазяїном, проявляє підвищення ефекторної функції як результат зазначеної модифікації.
82. Клітина-хазяїн за п. 81, де зазначена підвищена ефекторна функція являє собою підвищену Fc-опосередковану клітинну цитотоксичність.
83. Фармацевтична композиція, що містить антигензв'язуючу молекулу за будь-яким з пп. 54-72 і фармацевтично прийнятний носій.
84. Застосування фармацевтичної композиції за п. 83 для лікування порушення, пов'язаного з EGFR.
85. Застосування фармацевтичної композиції за п. 83 для лікування порушення, що характеризується надекспресією EGFR.
86. Застосування фармацевтичної композиції за п. 83 для діагнозу порушення, що характеризується надекспресією EGFR.
87. Застосування фармацевтичної композиції за п. 83 при лікуванні порушення клітинної проліферації, що виліковується блокуванням EGFR-опосередкованого сигналу.
88. Застосування антигензв'язуючої молекули за будь-яким з пп. 54-72 для виготовлення лікарського засобу для лікування або профілактики раку.
89. Застосування за п. 88, де зазначена антигензв’язуюча молекула застосовується у терапевтично ефективній кількості приблизно від 1,0 мг/кг приблизно до 15 мг/кг.
90. Застосування антигензв'язуючої молекули за будь-яким з пп. 54-72 для лікування порушення, пов’язаного з EGFR, де зазначене лікування призводить до концентрацій сироватки зазначеної антигензв'язуючої молекули приблизно від 1 і приблизно до 100 мкг/мл в період щонайменше 4 тижні, і де зазначене лікування не спричиняє клінічно суттєвий рівень токсичності.
Текст
1. Ізольований полінуклеотид, що включає послідовність, яка кодує поліпептид, який включає варіабельну область важкого ланцюга, варіабельну область легкого ланцюга або їх комбінацію, що специфічно зв’язує EGFR людини, як частина гуманізованої, сконструйованої шляхом глікотехнології анти-EGFR антигензв'язуючої молекули, де зазначена варіабельна область важкого ланцюга включає області, що визначають компліментарність (CDR), де: (a) CDR1 важкого ланцюга вибрана з групи, що складається з: SEQ ID NO:53, SEQ ID NO:55, SEQ ID NO:57, SEQ ID NO:59, SEQ ID NO:61, SEQ ID NO:63, SEQ ID NO:65, SEQ ID NO:67, SEQ ID NO:69, SEQ ID NO:71, SEQ ID NO:73, SEQ ID NO:123 і SEQ ID NO:125; і (b) CDR2 важкого ланцюга вибрана з групи, що складається з: SEQ ID NO:75, SEQ ID NO:77, SEQ ID NO:79, SEQ ID NO:81, SEQ ID NO:83, SEQ ID NO:85, SEQ ID NO:87, SEQ ID NO:89, SEQ ID NO:127, SEQ ID NO:91, SEQ ID NO:93, SEQ ID 2 (19) 1 3 NO:32; SEQ ID NO:34; SEQ ID NO:36; SEQ ID NO:38; SEQ ID NO:40 і SEQ ID NO:120. 4. Ізольований полінуклеотид за будь-яким з пп. 12, де зазначений ізольований полінуклеотид включає послідовність, яка має щонайменше 95 % ідентичності послідовності, вибраної з групи, що складається з: SEQ ID NO:2, SEQ ID NO:4; SEQ ID NO:6; SEQ ID NO:8; SEQ ID NO:10; SEQ ID NO:12; SEQ ID NO:14; SEQ ID NO:16; SEQ ID NO:18; SEQ ID NO:20; SEQ ID NO:22; SEQ ID NO:24; SEQ ID NO:26; SEQ ID NO:28; SEQ ID NO:30; SEQ ID NO:32; SEQ ID NO:34; SEQ ID NO:36; SEQ ID NO:38; SEQ ID NO:40 і SEQ ID NO:120. 5. Ізольований полінуклеотид за будь-яким з пп. 12, де зазначений ізольований полінуклеотид включає послідовність, вибрану з групи, що складається з: SEQ ID NO:2, SEQ ID NO:4; SEQ ID NO:6; SEQ ID NO:8; SEQ ID NO:10; SEQ ID NO:12; SEQ ID NO:14; SEQ ID NO:16; SEQ ID NO:18; SEQ ID NO:20; SEQ ID NO:22; SEQ ID NO:24; SEQ ID NO:26; SEQ ID NO:28; SEQ ID NO:30; SEQ ID NO:32; SEQ ID NO:34; SEQ ID NO:36; SEQ ID NO:38; SEQ ID NO:40 і SEQ ID NO:120. 6. Ізольований полінуклеотид за будь-яким з пп. 15, де зазначений ізольований полінуклеотид кодує поліпептид, який включає послідовність, вибрану з групи, що складається з: SEQ ID NO:1; SEQ ID NO:3; SEQ ID NO:5; SEQ ID NO:7; SEQ ID NO:9; SEQ ID NO:11; SEQ ID NO:13; SEQ ID NO:15; SEQ ID NO:17; SEQ ID NO:19; SEQ ID NO:21; SEQ ID NO:23; SEQ ID NO:25; SEQ ID NO:27; SEQ ID NO:29; SEQ ID NO:31; SEQ ID NO:33; SEQ ID NO:35; SEQ ID NO:37; SEQ ID NO:39; і SEQ ID NO:121. 7. Ізольований полінуклеотид за будь-яким з пп. 16, де зазначений ізольований полінуклеотид включає послідовність, що кодує: (a) CDR1 важкого ланцюга, вибрану з групи, що складається з: SEQ ID NO: 53, SEQ ID NO:59 і SEQ ID NO:65; і (b) CDR2 важкого ланцюга, вибрану з групи, що складається з: SEQ ID NO: 79, SEQ ID NO:91 і SEQ ID NO:97; і (c) CDR3 важкого ланцюга SEQ ID NO:107. 8. Ізольований полінуклеотид за п. 7, де зазначений ізольований полінуклеотид включає послідовність, що кодує: (a) CDR1 важкого ланцюга SEQ ID NO:53; і (b) CDR2 важкого ланцюга SEQ ID NO:79; і (c) CDR3 важкого ланцюга SEQ ID NO:107. 9. Ізольований полінуклеотид за п. 7, де зазначений ізольований полінуклеотид включає послідовність, що кодує: (а) CDR1 важкого ланцюга SEQ ID NO:59; і (b) CDR2 важкого ланцюга SEQ ID NO:91; і (c) CDR3 важкого ланцюга SEQ ID NO:107. 10. Ізольований полінуклеотид за п. 7, де зазначений ізольований полінуклеотид включає послідовність, що кодує: (а) CDR1 важкого ланцюга SEQ ID NO:65; і (b) CDR2 важкого ланцюга SEQ ID NO:97; і (c) CDR3 важкого ланцюга SEQ ID NO:107. 11. Ізольований полінуклеотид за п. 7, де зазначений ізольований полінуклеотид включає: 95068 4 (a) послідовність, вибрану з групи, яка складається з: SEQ ID NO: 54, SEQ ID NO: 60 і SEQ ID NO: 66; і (b) послідовність, вибрану з групи, яка складається з: SEQ ID NO: 80; SEQ ID NO: 92 і SEQ ID NO: 98; і (c) послідовність SEQ ID NO:108. 12. Ізольований полінуклеотид за п. 11, де зазначений ізольований полінуклеотид включає послідовність: (a) SEQ ID NO:54; і (b) SEQ ID NO:80; і (с) SEQ ID NO:108. 13. Ізольований полінуклеотид за п. 11, де зазначений ізольований полінуклеотид включає послідовність: (a) SEQ ID NO:60; і (b) SEQ ID NO:92; і (с) SEQ ID NO:108. 14. Ізольований полінуклеотид за п. 11, де зазначений ізольований полінуклеотид включає послідовність: (a) SEQ ID NO:66; і (b) SEQ ID NO:98; і (c) SEQ ID NO:108. 15. Ізольований полінуклеотид за будь-яким з пп. 1-14, де зазначений поліпептид включає константну область важкого ланцюга або його фрагмент, з інших видів, окрім щура. 16. Ізольований полінуклеотид за п. 1, де зазначений ізольований полінуклеотид включає послідовність, що кодує: (a) CDR1 легкого ланцюга SEQ ID NO:113; і (b) CDR2 легкого ланцюга SEQ ID NO:115; і (c) CDR3 легкого ланцюга SEQ ID NO:117. 17. Ізольований полінуклеотид за п. 1, де зазначений ізольований полінуклеотид включає послідовність: (a) SEQ ID NO:112 або SEQ ID NO:114; і (b) SEQ ID NO:116 або SEQ ID NO:118; і (c) SEQ ID NO:119. 18. Ізольований полінуклеотид за п. 17, де зазначений ізольований полінуклеотид включає послідовність: (a) SEQ ID NO:114; і (b) SEQ ID NO:118; і (c) SEQ ID NO:119. 19. Ізольований полінуклеотид за будь-яким з пп. 1 або 16-18, де зазначений ізольований полінуклеотид включає послідовність, яка має щонайменше 80 % ідентичності послідовності, вибраної з групи, що складається з SEQ ID NO:44, SEQ ID NO:46, SEQ ID NO:50 і SEQ ID NO:52. 20. Ізольований полінуклеотид за будь-яким з пп. 1 або 16-18, де зазначений ізольований полінуклеотид включає послідовність, яка має щонайменше 95 % ідентичності послідовності, вибраної з групи, що складається з SEQ ID NO:44, SEQ ID NO:46, SEQ ID NO:50 і SEQ ID NO:52. 21. Ізольований полінуклеотид за будь-яким з пп. 1 або 16-18, де зазначений ізольований полінуклеотид включає послідовність, вибрану з групи, що складається з SEQ ID NO:44, SEQ ID NO:46, SEQ ID NO:50 і SEQ ID NO:52. 22. Ізольований полінуклеотид за будь-яким з пп. 1 або 16-21, де зазначений ізольований полінуклеотид кодує поліпептид, що містить послідовність, 5 вибрану з групи, що складається з: SEQ ID NO:43, SEQ ID NO:45, SEQ ID NO:49 і SEQ ID NO:51. 23. Ізольований полінуклеотид за будь-яким з пп. 1 або 16-22, де зазначений поліпептид включає константну область легкого ланцюга або його фрагмент, з інших видів, окрім щура. 24. Ізольований полінуклеотид за п. 1, де зазначений полінуклеотид включає першу послідовність, що кодує: (a) CDR1 важкого ланцюга, вибрану з групи, що складається з SEQ ID NO:53, SEQ ID NO:59 і SEQ ID NO:65; і (b) CDR2 важкого ланцюга, вибрану з групи, що складається з SEQ ID NO:79, SEQ ID NO:91 і SEQ ID NO:97; і (c) CDR3 важкого ланцюга SEQ ID NO:107; і де зазначений полінуклеотид додатково включає другу послідовність, що кодує: (d) CDR1 легкого ланцюга SEQ ID NO:111 або SEQ ID NO:113; і (e) CDR2 легкого ланцюга SEQ ID NO:115; і (f) CDR3 легкого ланцюга SEQ ID NO:117. 25. Ізольований полінуклеотид за п. 24, де зазначена перша послідовність кодує: (a) CDR1 важкого ланцюга SEQ ID NO:53; і (b) CDR2 важкого ланцюга SEQ ID NO:79; і (c) CDR3 важкого ланцюга SEQ ID NO:107; і де зазначена друга послідовність кодує: (d) CDR1 легкого ланцюга SEQ ID NO:113; і (e) CDR2 легкого ланцюга SEQ ID NO:115; і (f) CDR3 легкого ланцюга SEQ ID NO:117. 26. Ізольований полінуклеотид за п. 24, де зазначена перша послідовність кодує: (a) CDR1 важкого ланцюга SEQ ID NO:59; і (b) CDR2 важкого ланцюга SEQ ID NO:91; і (c) CDR3 важкого ланцюга SEQ ID NO:107; і де зазначена друга послідовність кодує: (d) CDR1 легкого ланцюга SEQ ID NO:113; і (e) CDR2 легкого ланцюга SEQ ID NO:115; і (f) CDR3 легкого ланцюга SEQ ID NO:117. 27. Ізольований полінуклеотид за п. 24, де зазначена перша послідовність кодує: (a) CDR1 важкого ланцюга SEQ ID NO:65; і (b) CDR2 важкого ланцюга SEQ ID NO:97; і (c) CDR3 важкого ланцюга SEQ ID NO:107; і де зазначена друга послідовність кодує: (d) CDR1 легкого ланцюга SEQ ID NO:113; і (e) CDR2 легкого ланцюга SEQ ID NO:115; і (f) CDR3 легкого ланцюга SEQ ID NO:117. 28. Ізольований полінуклеотид за п. 24, де зазначена перша послідовність включає: (a) SEQ ID NO:54, SEQ ID NO:60 або SEQ ID NO:66; і (b) SEQ ID NO:80, SEQ ID NO:92 або SEQ ID NO:98; і (c) SEQ ID NO:108; і де зазначена друга послідовність включає: (d) SEQ ID NO:112 або SEQ ID NO:114; і (e) SEQ ID NO:116 або SEQ ID NO:118; і (f) SEQ ID NO:119. 29. Ізольований полінуклеотид за п. 24, де зазначена перша послідовність включає: (a) SEQ ID NO:54; і (b) SEQ ID NO:80; і (c) SEQ ID NO:108; і 95068 6 де зазначена друга послідовність включає: (d) SEQ ID NO:114; і (e) SEQ ID NO:118; і (f) SEQ ID NO:119. 30. Ізольований полінуклеотид за п. 24, де зазначена перша послідовність включає: (a) SEQ ID NO:60; і (b) SEQ ID NO:92; і (c) SEQ ID NO:108; і де зазначена друга послідовність включає: (d) SEQ ID NO:114; і (e) SEQ ID NO:118; і (f) SEQ ID NO:119. 31. Ізольований полінуклеотид за п. 24, де зазначена перша послідовність включає: (a) SEQ ID NO:66; і (b) SEQ ID NO:98; і (c) SEQ ID NO:108; і де зазначена друга послідовність включає: (d) SEQ ID NO:114; і (e) SEQ ID NO:118; і (f) SEQ ID NO:119. 32. Ізольований полінуклеотид за будь-яким з пп. 24-31, де зазначений полінуклеотид, що включає зазначену першу послідовність, кодує поліпептид, який включає послідовність SEQ ID NO:15, і де зазначений полінуклеотид, що включає зазначену другу послідовність, кодує поліпептид, який включає послідовність SEQ ID NO:45. 33. Ізольований полінуклеотид за п. 32, де зазначена перша послідовність включає SEQ ID NO: 16, і де зазначена друга послідовність включає SEQ ID NO:46. 34. Експресуючий вектор, що включає ізольований полінуклеотид за будь-яким з пп. 1-33. 35. Експресуючий вектор за п. 34, де зазначений експресуючий вектор включає ізольований полінуклеотид за будь-яким з пп. 2-15 і ізольований полінуклеотид за будь-яким з пп. 16-23. 36. Експресуючий вектор за п. 34, де зазначений експресуючий вектор включає ізольований полінуклеотид за будь-яким з пп. 24-33. 37. Композиція, що включає ізольований полінуклеотид за будь-яким з пп. 2-15 і ізольований полінуклеотид за будь-яким з пп. 16-23. 38. Клітина-хазяїн, що включає ізольований полінуклеотид за будь-яким з пп. 1-33. 39. Клітина-хазяїн, що включає експресуючий вектор за будь-яким з пп. 34-36. 40. Клітина-хазяїн, що включає композицію за п. 37. 41. Клітина-хазяїн за п. 38, що включає перший ізольований полінуклеотид і другий ізольований полінуклеотид, де зазначений перший ізольований полінуклеотид включає послідовність, що кодує: (a) CDR1 важкого ланцюга, вибрану з групи, яка складається з: SEQ ID NO:53, SEQ ID NO:59 і SEQ ID NO:65; і (b) CDR2 важкого ланцюга, вибрану з групи, яка складається з: SEQ ID NO:79, SEQ ID NO:91 і SEQ ID NO:97; і (с) CDR3 важкого ланцюга SEQ ID NO:107; і де зазначений другий ізольований полінуклеотид включає послідовність, що кодує: 7 (a) CDR1 легкого ланцюга SEQ ID NO:111 або SEQ ID NO:113; і (b) CDR2 легкого ланцюга SEQ ID NO:115; і (с) CDR3 легкого ланцюга SEQ ID NO:117. 42. Клітина-хазяїн за п. 38, що включає перший ізольований полінуклеотид і другий ізольований полінуклеотид, де зазначений перший ізольований полінуклеотид включає послідовність, що кодує: (a) CDR1 важкого ланцюга SEQ ID NO:53; і (b) CDR2 важкого ланцюга SEQ ID NO:79; і (с) CDR3 важкого ланцюга SEQ ID NO:107; і де зазначений другий ізольований полінуклеотид включає послідовність, що кодує: (a) CDR1 легкого ланцюга SEQ ID NO:113; і (b) CDR2 легкого ланцюга SEQ ID NO:115; і (с) CDR3 легкого ланцюга SEQ ID NO:117. 43. Клітина-хазяїн за п. 38, що включає перший ізольований полінуклеотид і другий ізольований полінуклеотид, де зазначений перший ізольований полінуклеотид включає послідовність, що кодує: (a) CDR1 важкого ланцюга SEQ ID NO:59; і (b) CDR2 важкого ланцюга SEQ ID NO:91; і (с) CDR3 важкого ланцюга SEQ ID NO:107; і де зазначений другий ізольований полінуклеотид включає послідовність, що кодує: (a) CDR1 легкого ланцюга SEQ ID NO:113; і (b) CDR2 легкого ланцюга SEQ ID NO:115; і (с) CDR3 легкого ланцюга SEQ ID NO:117. 44. Клітина-хазяїн за п. 38, що включає перший ізольований полінуклеотид і другий ізольований полінуклеотид, де зазначений перший ізольований полінуклеотид включає послідовність, що кодує: (a) CDR1 важкого ланцюга SEQ ID NO:65; і (b) CDR2 важкого ланцюга SEQ ID NO:97; і (с) CDR3 важкого ланцюга SEQ ID NO:107; і де зазначений другий ізольований полінуклеотид включає послідовність, що кодує: (a) CDR1 легкого ланцюга SEQ ID NO:113; і (b) CDR2 легкого ланцюга SEQ ID NO:115; і (с) CDR3 легкого ланцюга SEQ ID NO:117. 45. Клітина-хазяїн за п. 38, що включає перший ізольований полінуклеотид і другий ізольований полінуклеотид, де зазначений перший ізольований полінуклеотид включає: (a) послідовність, вибрану з групи, що складається з: SEQ ID NO:54, SEQ ID NO:60 і SEQ ID NO:66; і (b) послідовність, вибрану з групи, що складається з: SEQ ID NO:80, SEQ ID NO:92 і SEQ ID NO:98; і (с) послідовність SEQ ID NO:108; і де зазначений другий ізольований полінуклеотид включає послідовність: (a) SEQ ID NO:112 або SEQ ID NO:114; і (b) SEQ ID NO:116 або SEQ ID NO:118; і (с) SEQ ID NO:119. 46. Клітина-хазяїн за п. 38, що включає перший ізольований полінуклеотид і другий ізольований полінуклеотид, де зазначений перший ізольований полінуклеотид включає послідовність: (a) SEQ ID NO:54; і (b) SEQ ID NO:80; і 95068 8 (c) SEQ ID NO:108; і де зазначений другий ізольований полінуклеотид включає послідовність: (a) SEQ ID NO:114; і (b) SEQ ID NO:118; і (c) SEQ ID NO:119. 47. Клітина-хазяїн за п. 38, що включає перший ізольований полінуклеотид і другий ізольований полінуклеотид, де зазначений перший ізольований полінуклеотид включає послідовність: (a) SEQ ID NO:60; і (b) SEQ ID NO:92; і (c) SEQ ID NO:108; і де зазначений другий ізольований полінуклеотид включає послідовність: (a) SEQ ID NO:114; і (b) SEQ ID NO:118; і (c) SEQ ID NO:119. 48. Клітина-хазяїн за п. 38, що включає перший ізольований полінуклеотид і другий ізольований полінуклеотид, де зазначений перший ізольований полінуклеотид включає послідовність: (a) SEQ ID NO:66; і (b) SEQ ID NO:98; і (c) SEQ ID NO:108; і де зазначений другий ізольований полінуклеотид включає послідовність: (a) SEQ ID NO:114; і (b) SEQ ID NO:118; і (c) SEQ ID NO:119. 49. Клітина-хазяїн за п. 38, що включає перший ізольований полінуклеотид і другий ізольований полінуклеотид, де перший ізольований полінуклеотид включає послідовність SEQ ID NO:16, і де другий ізольований полінуклеотид включає послідовність SEQ ID NO:46. 50. Клітина-хазяїн за п. 38, що включає перший ізольований полінуклеотид і другий ізольований полінуклеотид, де перший ізольований полінуклеотид включає послідовність, що кодує поліпептид, що включає послідовність SEQ ID NO:15, і де другий ізольований полінуклеотид включає послідовність, що кодує поліпептид, що включає послідовність SEQ ID NO:45. 51. Спосіб утворення гуманізованої, сконструйованої шляхом глікотехнології анти-EGFR антигензв'язуючої молекули, яка здатна конкурувати з антитілом щура ICR62 для зв'язування з EGFR людини, де зазначений спосіб містить етапи, на яких: (a) культивують клітину-хазяїна за будь-яким з пп. 38-50, де зазначену клітину-хазяїна додатково конструюють для експресії щонайменше однієї нуклеїнової кислоти, що кодує поліпептид, який має активність β(l,4)-Nацетилглюкозамінілтрансферази III, у середовищі при умовах, які дозволяють експресію зазначеного полінуклеотиду, який кодує зазначений поліпептид, який є частиною зазначеної антигензв'язуючої молекули, і які дозволяють модифікацію олігоса 9 харидів, присутніх у Fc-області зазначеної антигензв'язуючої молекули; і (b) відновлюють зазначену антигензв'язуючу молекулу. 52. Спосіб за п. 51, де зазначену клітину-хазяїна додатково конструюють для експресії нуклеїнової кислоти, що кодує поліпептид, який має активність манозидази II. 53. Ізольований поліпептид, кодований полінуклеотидом за будь-яким з пп. 1-33. 54. Гуманізована, сконструйована шляхом глікотехнології анти-EGFR антигензв'язуюча молекула, що містить перший ізольований поліпептид, кодований полінуклеотидом за будь-яким з пп. 2-15, і другий ізольований поліпептид, кодований полінуклеотидом за будь-яким з пп. 16-23. 55. Антигензв'язуюча молекула за п. 54, де зазначена антигензв'язуюча молекула включає перший поліпептид і другий поліпептид, де зазначений перший поліпептид включає: (a) CDR1 важкого ланцюга, вибрану з групи, що складається з: SEQ ID NO:53, SEQ ID NO:59 і SEQ ID NO:65; і (b) CDR2 важкого ланцюга, вибрану з групи, що складається з: SEQ ID NO:79, SEQ ID NO:91 і SEQ ID NO:97; і (c) CDR3 важкого ланцюга SEQ ID NO:107; і де зазначений другий поліпептид включає послідовність: (d) CDR1 легкого ланцюга SEQ ID NO:111 або SEQ ID NO:113; і (e) CDR2 легкого ланцюга SEQ ID NO:115; і (f) CDR3 легкого ланцюга SEQ ID NO:117. 56. Антигензв'язуюча молекула за п. 55, де зазначений перший поліпептид включає послідовність: (a) CDR1 важкого ланцюга SEQ ID NO:53; і (b) CDR2 важкого ланцюга SEQ ID NO:79; і (c) CDR3 важкого ланцюга SEQ ID NO:107; і де зазначений другий поліпептид включає послідовність: (d) CDR1 легкого ланцюга SEQ ID NO:113; і (e) CDR2 легкого ланцюга SEQ ID NO:115; і (f) CDR3 легкого ланцюга SEQ ID NO:117. 57. Антигензв'язуюча молекула за п. 55, де зазначений перший поліпептид включає послідовність: (a) CDR1 важкого ланцюга SEQ ID NO:59; і (b) CDR2 важкого ланцюга SEQ ID NO:91; і (c) CDR3 важкого ланцюга SEQ ID NO:107; і де зазначений другий поліпептид включає послідовність: (d) CDR1 легкого ланцюга SEQ ID NO:113; і (e) CDR2 легкого ланцюга SEQ ID NO:115; і (f) CDR3 легкого ланцюга SEQ ID NO:117. 58. Антигензв'язуюча молекула за п. 55, де зазначений перший поліпептид включає послідовність: (a) CDR1 важкого ланцюга SEQ ID NO:65; і (b) CDR2 важкого ланцюга SEQ ID NO:97; і (c) CDR3 важкого ланцюга SEQ ID NO:107; і де зазначений другий поліпептид включає послідовність: (d) CDR1 легкого ланцюга SEQ ID NO:113; і (e) CDR2 легкого ланцюга SEQ ID NO:115; і 95068 10 (f) CDR3 легкого ланцюга SEQ ID NO:117. 59. Гуманізована, сконструйована шляхом глікотехнології анти-EGFR антигензв'язуюча молекула, що специфічно зв’язує EGFR, де зазначена антигензв'язуюча молекула включає перший поліпептид і другий поліпептид, де зазначений перший поліпептид включає послідовність: (a) CDR1 важкого ланцюга, вибрану з групи, що складається з: SEQ ID NO:53, SEQ ID NO:55, SEQ ID NO:57, SEQ ID NO:59, SEQ ID NO:61, SEQ ID NO:63, SEQ ID NO:65, SEQ ID NO:67, SEQ ID NO:69, SEQ ID NO:71, SEQ ID NO:73, SEQ ID NO:123 і SEQ ID NO:125; і (b) CDR2 важкого ланцюга, вибрану з групи, що складається з: SEQ ID NO:75, SEQ ID NO:77, і SEQ ID NO:79, SEQ ID NO:81, SEQ ID NO:83, SEQ ID NO:85, SEQ ID NO:87, SEQ ID NO:89, SEQ ID NO:127, SEQ ID NO:91, SEQ ID NO:93, SEQ ID NO:95, SEQ ID NO:97, SEQ ID NO:99, SEQ ID NO:101, SEQ ID NO:103 і SEQ ID NO:105; і (c) CDR3 важкого ланцюга SEQ ID NO:107; і де зазначений другий поліпептид включає послідовність: (d) CDR1 легкого ланцюга SEQ ID NO:111 або SEQ ID NO:113; і (e) CDR2 легкого ланцюга SEQ ID NO:115; і (f) CDR3 легкого ланцюга SEQ ID NO:117. 60. Антигензв'язуюча молекула за п. 59, де зазначений перший поліпептид включає послідовність: (a) CDR1 важкого ланцюга, вибрану з групи, що складається з: SEQ ID NO:53, SEQ ID NO:59 і SEQ ID NO:65; і (b) CDR2 важкого ланцюга, вибрану з групи, що складається з: SEQ ID NO:79, SEQ ID NO:91 і SEQ ID NO:97; і (c) CDR3 важкого ланцюга SEQ ID NO:107; і де зазначений другий поліпептид включає послідовність: (d) CDR1 легкого ланцюга SEQ ID NO:113; і (e) CDR2 легкого ланцюга SEQ ID NO:115; і (f) CDR3 легкого ланцюга SEQ ID NO:117. 61. Антигензв'язуюча молекула за п. 60, де зазначений перший поліпептид включає послідовність: (a) CDR1 важкого ланцюга SEQ ID NO:53; і (b) CDR2 важкого ланцюга SEQ ID NO:79; і (c) CDR3 важкого ланцюга SEQ ID NO:107; і де зазначений другий поліпептид включає послідовність: (d) CDR1 легкого ланцюга SEQ ID NO:113; і (e) CDR2 легкого ланцюга SEQ ID NO:115; і (f) CDR3 легкого ланцюга SEQ ID NO:117. 62. Антигензв'язуюча молекула за п. 60, де зазначений перший поліпептид включає послідовність: (a) CDR1 важкого ланцюга SEQ ID NO:59; і (b) CDR2 важкого ланцюга SEQ ID NO:91; і (c) CDR3 важкого ланцюга SEQ ID NO:107; і де зазначений другий поліпептид включає послідовність: (d) CDR1 легкого ланцюга SEQ ID NO:113; і (e) CDR2 легкого ланцюга SEQ ID NO:115; і (f) CDR3 легкого ланцюга SEQ ID NO:117. 63. Антигензв'язуюча молекула за п. 60, 11 де зазначений перший поліпептид включає послідовність: (a) CDR1 важкого ланцюга SEQ ID NO:65; і (b) CDR2 важкого ланцюга SEQ ID NO:97; і (c) CDR3 важкого ланцюга SEQ ID NO:107; і де зазначений другий поліпептид включає послідовність: (d) CDR1 легкого ланцюга SEQ ID NO:113; і (e) CDR2 легкого ланцюга SEQ ID NO:115; і (f) CDR3 легкого ланцюга SEQ ID NO:117. 64. Антигензв'язуюча молекула за будь-яким пп. 54-63, де зазначена антигензв'язуюча молекула включає перший поліпептид і другий поліпептид, де зазначений перший поліпептид кодований полінуклеотидом, що включає послідовність: (a) SEQ ID NO:54, SEQ ID NO:60 або SEQ ID NO:66; і (b) SEQ ID NO:80, SEQ ID NO:92 або SEQ ID NO:98; і (c) SEQ ID NO:108; і де зазначений другий поліпептид кодований полінуклеотидом, що включає послідовність: (d) SEQ ID NO:112 або SEQ ID NO:114; і (e) SEQ ID NO:116 або SEQ ID NO:118; і (f)SEQ ID NO:119. 65. Антигензв'язуюча молекула за п. 64, де зазначений перший поліпептид кодований полінуклеотидом, що включає послідовність: (a) SEQ ID NO:54; і (b) SEQ ID NO:80; і (c) SEQ ID NO:108; і де зазначений другий поліпептид кодований полінуклеотидом, що включає послідовність: (d) SEQ ID NO:114; і (e) SEQ ID NO:118; і (f) SEQ ID NO:119. 66. Антигензв'язуюча молекула за будь-яким пп. 54-65, де зазначена антигензв'язуюча молекула включає перший поліпептид, що включає послідовність SEQ ID NO:15 і другий поліпептид, що включає послідовність SEQ ID NO:45. 67. Антигензв'язуюча молекула за п. 66, де зазначений перший поліпептид кодований полінуклеотидом, що включає послідовність SEQ ID NO:16, і де зазначений другий поліпептид кодований полінуклеотидом, що включає послідовність SEQ ID NO:46. 68. Антигензв'язуюча молекула за будь-яким з пп. 54-67, де зазначена антигензв'язуюча молекула містить Fc-область людини. 69. Антигензв'язуюча молекула за п. 68, де зазначена антигензв'язуюча молекула була сконструйована шляхом глікотехнології так, що має змінену олігосахаридну структуру у Fc-області. 70. Антигензв'язуюча молекула за п. 69, де зазначена Fc-область має зменшену кількість залишків фукози у порівнянні з антигензв'язуючою молекулою, що не була сконструйована шляхом глікотехнології. 71. Антигензв'язуюча молекула за п. 69 або п. 70, де щонайменше 70 % олігосахаридів у Fc-області є нефукозильованими. 72. Антигензв'язуюча молекула за будь-яким пп. 54-71, де зазначена антигензв'язуюча молекула є гуманізованим антитілом. 95068 12 73. Антигензв'язуюча молекула за будь-яким пп. 54-72 для застосування як лікарського засобу у лікуванні порушення, пов’язаного з EGFR. 74. Антигензв'язуюча молекула за п. 73, де зазначене порушення, пов’язане з EGFR, характеризується надекспресією EGFR. 75. Антигензв'язуюча молекула за п. 73 або п. 74, де зазначене порушення, пов’язане з EGFR, є раком. 76. Антигензв'язуюча молекула за п. 75, де зазначений рак вибраний з групи, що складається з раку молочної залози, раку сечового міхура, раку голови і шиї, раку шкіри, раку підшлункової залози, раку легень, раку яєчника, раку товстої кишки, раку простати, раку нирок і раку мозку. 77. Спосіб для визначення in vivo або in vitro присутності EGFR у зразку, що містить етапи, на яких: (a) забезпечують взаємодію зі зразком для перевірки, необов'язково з контрольним зразком, з антигензв'язуючою молекулою за будь-яким з пп. 54-72 при умовах, які дозволяють формування комплексу між антигензв'язуючою молекулою і EGFR; і (b) визначають зазначені комплекси антигензв'язуючої молекули-EGFR. 78. Клітина-хазяїн, що сконструйована для експресії щонайменше однієї нуклеїнової кислоти, що кодує поліпептид, який має активність β(1,4)-Nацетилглюкозамінілтрансферази III у кількості, достатній, щоб модифікувати олігосахариди у Fcобласті поліпептиду, що продукується зазначеною клітиною-хазяїном, де зазначений поліпептид являє собою антигензв'язуючу молекулу за будьяким з пп. 54-72. 79. Клітина-хазяїн за п. 78, де зазначена клітинахазяїн додатково сконструйована для експресії нуклеїнової кислоти, що кодує поліпептид, який має активність манозидази II у кількості, достатній, щоб модифікувати олігосахариди у Fc-області поліпептиду, що продукується зазначеною клітиноюхазяїном. 80. Клітина-хазяїн за п. 78 або п. 79, де зазначена антигензв'язуюча молекула, що продукується зазначеною клітиною-хазяїном, проявляє підвищення афінності зв'язування Fc-рецептора як результат зазначеної модифікації. 81. Клітина-хазяїн за п. 78 або п. 79, де зазначена антигензв'язуюча молекула, що продукується зазначеною клітиною-хазяїном, проявляє підвищення ефекторної функції як результат зазначеної модифікації. 82. Клітина-хазяїн за п. 81, де зазначена підвищена ефекторна функція являє собою підвищену Fcопосередковану клітинну цитотоксичність. 83. Фармацевтична композиція, що містить антигензв'язуючу молекулу за будь-яким з пп. 54-72 і фармацевтично прийнятний носій. 84. Застосування фармацевтичної композиції за п. 83 для лікування порушення, пов'язаного з EGFR. 85. Застосування фармацевтичної композиції за п. 83 для лікування порушення, що характеризується надекспресією EGFR. 86. Застосування фармацевтичної композиції за п. 83 для діагнозу порушення, що характеризується надекспресією EGFR. 13 95068 14 87. Застосування фармацевтичної композиції за п. 83 при лікуванні порушення клітинної проліферації, що виліковується блокуванням EGFRопосередкованого сигналу. 88. Застосування антигензв'язуючої молекули за будь-яким з пп. 54-72 для виготовлення лікарського засобу для лікування або профілактики раку. 89. Застосування за п. 88, де зазначена антигензв’язуюча молекула застосовується у терапев тично ефективній кількості приблизно від 1,0 мг/кг приблизно до 15 мг/кг. 90. Застосування антигензв'язуючої молекули за будь-яким з пп. 54-72 для лікування порушення, пов’язаного з EGFR, де зазначене лікування призводить до концентрацій сироватки зазначеної антигензв'язуючої молекули приблизно від 1 і приблизно до 100 мкг/мл в період щонайменше 4 тижні, і де зазначене лікування не спричиняє клінічно суттєвий рівень токсичності. Передумови даного винаходу Галузь даного винаходу [0001] Даний винахід стосується антигензв'язуючих молекул (АВМ). В окремих варіантах здійснення даний винахід стосується рекомбінантних моноклональних антитіл, які включають химерні, приматизовані або гуманізовані антитіла, специфічні для рецептора епідермального фактору росту людини (EGFR). До того ж, даний винахід стосується молекул нуклеїнової кислоти, що кодують такі АВМ, векторів і клітин-хазяїна, що включають молекули нуклеїнової кислоти. Крім того, даний винахід стосується способів утворення АВМ за даним винаходом, і способів застосування даних АВМ при лікуванні захворювання. До того ж, даний винахід стосується АВМ з модифікованим глікозуванням, що покращує терапевтичні властивості, включаючи антитіла з підвищеним зв'язуванням рецептора Fc і підвищеною ефекторною функцією. Відомий рівень техніки EGFR і анти-EGFR антитіла [0002] Рецептор епідермального фактору росту людини (також відомий як HER-1 або Erb-B1, у даному описі позначений як "EGFR") являє собою трансмембранний рецептор довжиною 170 кДа, що кодований c-erbB протоонкогеном, і проявляє активність ендогенної тирозинкінази (Modjtahedi et al., Br. J. Cancer 73:228-235 (1996); Herbst and Shin, Cancer 94:1593-1611 (2002)). Послідовність EGFR представлена у базі даних SwissProt P00533. Існують також ізоформи і варіанти EGFR (наприклад, альтернативні транскрипти РНК, процесовані версії, поліморфізми, тощо), що включають встановлені базою даних Swissprot під номерами Р00533-1, Р00533-2, Р00533-3 і Р00533-4, але не обмежуються ними. Відомо, що EGFR зв'язує ліганди, що включають епідермальний фактор росту (EGF), трансформуючий фактор росту-α (TGf-α), амфірегулін, гепарин-зв'язуючий EGF (hbEGF), бетацелюлін і епірегулін (Herbst and Shin, Cancer 94:1593-1611 (2002); Mendelsohn and Baselga, Oncogene 19:6550-6' (2000)). EGFR регулює ряд клітинних процесів за допомогою шляхів трансдукції, опосередкованої тирозинкіназою, включаючи, але не обмежуючись, активацію шляху сигнальної трансдукції, що контролює клітинну проліферацію, диференціацію, виживання клітини, апоптоз, ангіогенезіс, мітогенез та метастазування (Atalay et al., Ann. Oncology 14:1346-1363 (2003); Tsao and Herbst, Signal 4:4-9 (2003); Herbst and Shin, Cancer 94:1593-1611 (2002); Modjtahedi et al., Br. J. Cancer 73:228-235 (1996)). [0003] Надекспресія EGFR виражається у ряді злоякісних станів людини, що включають рак крові, мозку, голови і шиї, підшлункової залози, легень, молочної залози, яєчника, товстої кишки, простати і нирки. (Atalay et al., Ann. Oncology 14:1346-1363 (2003); Herbst and Shin, Cancer 94:1593-1611 (2002) Modjtahedi et al., Br. J. Cancer 73:228- 235 (1996)). При багатьох даних умовах, надекспресія EGFR корелює або асоціюється з несприятливими прогнозами для пацієнтів. (Herbst and Shin, Cancer 94:1593-1611 (2002) Modjtahedi et al., Br. J. Cancer 73:228-235 (1996)). EGFR також виражений у клітинах нормальних тканин, зокрема епітеліальних тканин шкіри, печінки і шлунково-кишкового тракту, хоча, звичайно, на нижчих рівнях, ніж у злоякісних клітинах (Herbst and Shin, Cancer 94:1593-1611 (2002)). [0004] Некон'юговані моноклональні антитіла (mAb) можуть застосовуватись у медицині для лікування раку, як показано у дозволі Управління по санітарному нагляду за якістю харчових продуктів і медикаментів на Трастузумаб (Herceptin™; Genentech Inс,) для лікування поргресуючого раку молочної залози (Grillo-Lopez, A.-J., et al., Semin. Oncol. 26:66-73 (1999); Goldenberg, Μ. Μ., CHn. Ther. 27:309-18 (1999)), Ритуксимаб (Rituxan™; K)EC Pharmaceuticals, San Diego, CA, and Genentech Inc., San Francisco, CA) для лікування CD20 позитивної B-клітини, слабо вираженої або фолікулярної неходжкінської лімфоми, Гемтузумаб (Mylotarg™, Celltech/Wyeth-Ayerst) для лікування повторного гострого мієлолейкозу і Алемтузумаб (САМРАТН™, Millenium Pharmaceuticals/Schering AG) для лікування B-клітинного хронічного лімфолейкозу. Успіх даних продуктів залежить не тільки від їхньої ефективності, а також від їхніх характерних показників безпеки (Grillo-Lopez, A.J., et al., Semin. Oncol. 26:66-73 (1999); Goldenberg, Μ. Μ., Clin. Ther. 27:309-18 (1999)). Незважаючи на досягнення даних лікарських засобів, в даний час існує великий інтерес в отриманні більш високо специфічної активності антитіла, ніж до того, що звичайно передбачено некон'югованою mAb терапією. [0005] Результати великої кількості досліджень дають можливість вважати, що Fc-рецепторзалежні механізми внесли головний вклад до дії цитотоксичних антитіл проти пухлин і показали, що 15 оптимальне антитіло проти пухлин було б пов'язане з переважно активацією Fc рецепторів і мінімально з інгібуючим партнером FcRIIB. (Clynes, R. Α., et al., Nature Medicine 6(4):443-446 (2000); Kalergis, A.M., and Ravetch, J. V., J. Exp. Med. 195(12):1653-1659 (June 2002). Наприклад, результати хоча б одного вивчення свідчать, що поліморфізм у рецепторі FcRIIIa, зокрема, є дуже пов'язаним з ефективністю терапії антитіла. (Cartron, G., et al., Blood 99(3): 1 754-757 (February 2002)). Це вивчення показало, що гомозиготні пацієнти для FcRIIIa краще реагують на Ритуксимаб, ніж гетерозиготні пацієнти. Автори прийшли до висновку, що більш сильна реакція призводила до кращого зв'язування in vivo антитіла з FcRIIIa, що є результатом кращої активності ADCC проти лімфатичних клітин. (Cartron, G., et al., Blood 99(3):754-757 (February 2002)). [0006] Були викладені різні стратегії для ураження EGFR і блокування EGFR сигнальних шляхів. Інгібітори невеликої молекули тирозинкінази, такі як гефінитиб, ерлотиніб і СІ-1033 блокують аутофосфориляцію EGFR у внутрішньоклітинній області тирозинкінази, таким чином інгібують нижчерозташовані сигнальні події (Tsao and Herbst, Signal 4: 4-9 (2003)). Моноклональні антитіла, з іншого боку, уражують позаклітинну частину EGFR, що є результатом зв'язування у блокуючих лігандах і, таким чином, інгібують нижчерозташовані події, такі як клітинна поліферація (Tsao and Herbst, Signal 4: 4-9 (2003)). [0007] Було утворено декілька моноклональніх антитіл, які досягають такого блокування in vitro і які були оцінені по своїй здатності впливати на ріст пухлини у ксенотрансплантантних моделях миші (Masui, et al., Cancer Res. 46:5592-5598 (1986); Masui, et al., Cancer Res. 44:1002-1007 (1984); Goldstein, et al., Clin. Cancer Res. 1: 1311-1318 (1995)). Наприклад, EMD 55900 (EMD Pharmaceuticals) являє собою анти-EGFR моноклональне антитіло миші, яким індукували антитілогенез проти людської епідермальної клітинної лінії карциноми А431 і що було перевірено клінічними дослідженнями пацієнтів з розвиненою лускатою клітиною карциноми гортані або гіпофаринксу (Bier et al., Eur. Arch. Otohinolaryngol. 252:433-9 (1995)). До того ж, моноклональні антитіла щура ICR16, ICR62 і ICR80, що зв'язують позаклітинний домен EGFR, показували ефективність інгібування зв'язування EGF і TGF-α рецептора. (Modjtahedi et al., Int. J. Cancer 75:310-316 (1998)). Моноклональне антитіло миші 425 відрізняється від Mab тим, що їм індукували антитілогенез проти людської А431 клітинної лінії карциноми, і, як було з'ясовано, зв'язує з поліпептидним епітопом на зовнішньому домені рецептора епідермального фактору росту людини. (Murthy et al., Arch. Biochem. Biophys. 252(2):549-560 (1987). Можливою проблемою, пов'язаною із застосуванням антитіла миші при терапевтичних лікуваннях, є те, що не людські моноклональні антитіла можуть розпізнатися у людиніносії як чужорідний білок; таким чином, повторна ін'єкція такого чужорідного антитіла може призвести до індукції імунних реакцій, що призводять до небезпечних надчутливих реакцій. Для основаних 95068 16 на мишах моноклональних антитіл такі реакції часто називають реакція антимишачого антитіла людини, або "НАМА "-реакція, так і анти-щуряче антитіло людини, або "HARA "реакція. До того ж, ці "чужорідні" антитіла можуть бути атакованими імунною системою носія такими як вони є, у результатуючогося вони нейтралізуються до того, як досягнуть області своєї цілі. Більш того, не людські моноклональні антитіла (наприклад, моноклональні антитіла миші) звичайно позбавляються ефекторної функціональності людини, тобто, вони не є здатними до, зокрема, опосередковування лізису, пов'язаного з комплементом або лізису людських клітин-мішеней через клітинну токсичність, залежну від антитіла або Fc-рецептор-опосередкованого фагоцитозу. [0008] Химеричні антитіла містять частки антитіла від двох або більше різних видів (наприклад, миші і людини), і були розроблені як альтернатива до "кон'югованих" антитіл. Наприклад, у патенті США № 5891996 (Mateo de Acosta del Rio et al.) обговорюється химерне антитіло миші/людини, R3, що направлене проти EGFR, і у патенті США № 5558864 обговорюється генерація химерних і гуманізованих форм мишачого анти-EGFR МАb 425. Також, ІМС-С225 (Erbitux®; ImClone) являє собою химерне анти-EGFR моноклональне антитіло миші/людини (основане на М225 моноклональному антитілі миші, що призводить до НАМАреакцій при клінічних випробуваннях з людиною), це, як повідомлялось, показувало протипухлинну ефективність у різних людських ксенотрансплантантних моделях. (Herbst and Shin, Cancer 94:1593-1611 (2002)). Ефективність ІМС-С225 була приписана деяким механізмам, що включають інгібування подій в клітині, які регулюються EGFRсигнальними шляхами, і, можливо, підвищенням активності клітинної токсичності, залежної від антитіла (ADCC) (Herbst and Shin, Cancer 94:15931611 (2002)). IMC-C225 також застосовувався при клінічних випробуваннях, що включені у комбінацію з променевою терапією і хіміотерапією (Herbst and Shin, Cancer 94:1593-1611 (2002)). Нещодавно, Abgenix, Inc. (Fremont, CA) розробили ABXEGF для протиракової терапії. ABX-EGF являє собою повністю людське анти-EGFR моноклональне антитіло. (Yang et al., Crit. Rev. Oncol./Hematol. 38: 17-23 (2001)). Глікозилювання антитіла [0009] Компонент олігосахариду може головним чином впливати на властивості, що впливають на ефективність терапевтичного глікопротеїну, що включає фізичну стабільність, стійкість до нападу протеази, взаємодії з імунною системою, фармакокінетику і специфічну біологічну активність. Такі властивості можуть залежати не тільки від присутності або відсутності, а також від специфіки структур олігосахаридів. Можна зробити деякі узагальнення між структурою олігосахаридів і функцією глікопротеїна. Наприклад, певні структури олігосахаридів опосередковують швидке виведення глікопротеїну з кровотоку шляхом взаємодій зі специфічними протеїнами, що зв'язують вуглеводень, в той час як інші можуть бути зв'язаними антитілами 17 і викликати небажані імунні реакції. (Jenkins et al., Nature Biotechnol. 14:975-81 (1996)). [0010] Клітини ссавця є переважними хазяїнами для продукування терапевтичних глікопротеїнів через їхню здатніть до глікозилювання протеїнів у більш сумісній формі для назначення людині. (Cumming et al., Glycobiology 7:115-30 (1991); Jenkins et al., Nature Biotechnol. 14:975-81 (1996)). Бактерії дуже рідко глікозилюють протеїни, і подібно іншим типам типових хазяїнів, таких як дріжджі, міцеліальні гриби, клітини комах і рослин, профілі кінцевих пордуктів глікозиляції асоціювалися із швидким виведенням з кровотоку, небажаними імунними взаємодіями, і у деяких специфічних випадках, зниженою біологічною активністю. Серед клітин ссавця, протягом двох останніх десятиліть звичайно застосовувались клітини яєчника китайського хом'яка (СНО). В доповнення до наданих відповідних пофілів глікозиляції, ці клітини дозволяють сумісне утворення генетично стабільних, високопродуктивних клональних ліній клітини. Вони можуть бути культивованими до високих показників густини у простих біореакторах, застосовуючи середовище без сиворотки, і дозволити розвиток безпечних і репродуктивних біопроцессів. Інші клітини тварини, що звичайно застосовуються, включають клітини нирки дитинча хом'яка (ВНК), NSO- і SP2/0- клітини мієломи миші. Пізніше також досліджувалось продукування від трансгенних тварин. (Jenkins et al., Nature Biotechnol. 14:975-81 (1996)). [0011] Всі антитіла містять структури вуглеводу у консервативних положеннях у довгому ланцюгу константних областей, з кожним ізотопом, що має певну множину N-сполучених структур вуглеводу, які часом впливають на протеїнову зборку, секрецію або функціональну активність. (Wright, Α., and Morrison, S. L., Trends Biotech. 75:26-32 (1997)). Структура прикріпленого N-сполученого вуглеводу значно змінюється, в залежності від ступеню обробки, і може включати високоманозні, олігосахариди, розгалужені в багатьох напрямках, а також біантенальний комплекс. (Wright, Α., and Morrison, S. L., Trends Biotech. 15:26-32 (1997)). Звичайно, існує гетерогенна обробка ядра структур олігосахаридів, що приєднується біля окремої ділянки глікозиляції так, що навіть моноклональні антитіла існують як множинні глікоформи. Аналогічно, було показано, що головні відмінності у глюкозиляції антитіла відбуваються між лініями клітини, і навіть помічені незначні відмінності для лінії росту даної клітини при різних культурних умовах. (Lifely, Μ. R. et al., Glycobiology 5(8):813-22 (1995)). [0012] Одним способом отримати велике збільшення активності, підтримуючи звичайний процес продукування і потенційно уникаючи суттєвих, небажаних побічних ефектів, є посилення природніх, клітинно-опосередкованих ефекторних функцій моноклональних антитіл розробкою їхнього олігосахаридного компонента як описано у Umana, P. et al., Nature Biotechnol. 77:176-180 (1999) і патенті США № 6602684, зміст якого наведений в даному описі посиланням у повному обсязі. Тип IgG1 антитіл, звичайно застосовує антитіла в імунотерапії рака, являє собою глікопротеїни, що ма 95068 18 ють консервативну N-сполучену ділянку глікозиляції при Asn297 у кожному СН2 домені. Два комплекса біантенальніх олигосахаридів, приєднаних до Asn297, заглиблені між СН2 доменами, формуючи екстенсивні контакти з головним ланцюгом поліпептиду, й їхня присутність являє собою основу для антитіла для опосередкування ефекторних функцій, таких як залежної від антитіла клітинної цитотоксичності (ADCC) (Lifely, Μ. R., et al., Glycobiology 5:813-822 (1995); Jefferis, R., et al., Іmmunol Rev. 163:59-76 (1998); Wright, A. and Morrison, S. L., Trends Biotechnol 75:26-32 (1997)). [0013] Umana et al., показали попередньо, що надекспресія у клітинах яєчника китайського хом'яка (СНО) (1,4)-Nацетилглюкозамінілтрансферази III ("GnTIII"), глікозилтрансфераза каталізує формування розділених навпіл олігосахаридів, головним чином підвищує активність in vitro ADCC антинейробластомного химерного моноклонального антитіла (chCE7), продукованого утвореними СНО клітинами. (Див. Umana, P. et al., Nature Biotechnol 77:176-180 (1999); і міжнародну публікацію №. WO99/54342, весь зміст якого включено до даного опису посиланням). Антитіло chCE7 належить до великого класу некон'югованих mAbs, що мають високу пухлинну подібність і специфічність, але мають зовсім невелику можливість для клінічного застосування, якщо продукується у стандартних помислових лініях клітини при нестачі ензиму GnTIII (Umana, P., et al., Nature Biotechnol. 77:176180 (1999)). Це дослідження першим показало, що велике підвищення активності ADCC могло бути отримано шляхом розробки клітин, що продукують антитіло для експресії GnTIII, що також призводить до підвищення пропорції (Fс)-асоційованих з константною областю, розділених навпіл олігосахаридів, що включають розділені навпіл, нефукозильовані олігосахариди вище рівнів, що виявлені в природніх антитілах. [0014] Залишається потреба в посиленні терапевтичних підходів, що мають своєю ціллю EGFR, для лікування порушень проліферації клітини у приматів, включаючи, але не обмежуючись, людьми, де такі порушення характеризуються експресією EGFR, зокрема, патологічною експресією (наприклад, над експресією), включаючи рак крові, мозку, голови та шиї, підшлункової залози, легенів, молочної залози, яєчника, прямої кишки, простати та нирки, але не обмежуючись ними. Короткий опис винаходу [0015] Визнаючи великий терапевтичний потенціал антиген-зв'язуючих молекул (АВМ), що мають специфічність зв'язування антитіла щура ICR62 (наприклад, зв'язує той самий епітоп) і що були сконструйовані шляхом глікотехнології для досягнення спорідненості зв'язування Fcрецептора і ефекторної функції, дані винахідники розробили спосіб для продукування таких АВМ. Між іншим, даний спосіб включає виробництво рекомбінантних, химерних антитіл або їхніх химерних фрагментів. Ефективність цих АВМ біла подальше збільшена розробленням профілю глікозиляції Fc-області антитіла. 19 [0016] Відповідно, у одному аспекті, даний винахід, направлений на ізольований полінуклеотид, що містить: (а) послідовність, вибрану з групи, що складається з: SEQ ID NO:54, SEQ ID NO:56, SEQ ID NO:58, SEQ ID NO:60, SEQ ID NO:62, SEQ ID NO:64, SEQ ID NO:66, SEQ ID NO:68, SEQ ID NO:70, SEQ ID NO:72, SEQ ID NO:74, SEQ ID NO: 122 і SEQ ID NO: 124; (b) послідовність, вибрану з групи, що складається з: SEQ ID NO:76, SEQ ID NO:78, SEQ ID NO:80, SEQ ID NO:82, SEQ DD NO:84, SEQ ID NO:86, SEQ ID NO:88, SEQ ID NO:90, SEQ ID NO:92, SEQ ID NO:94, SEQ ID NO:96, SEQ ID NO:98, SEQ ID NO: 100, SEQ ID NO: 102, SEQ ID NO: 104, SEQ ID NO:106, і SEQ ID NO: 126; і (с) SEQ ID NO:108. В іншому аспекті, даний винахід направлений на ізольований полінуклеотид, що містить: (а) послідовність, вибрану з групи, що складається з SEQ ID NO: 112 і SEQ ID NO: 114; (b) послідовність, вибрану з групи, що складається з SEQ ID NO:116 і SEQ ID NO:118; і (с) SEQ ID NO:119. У одному варіанті будь-який з цих полінуклеотидів кодує поліпептид злиття. [0017] У подальшому аспекті, даний винахід направлений на ізольований полінуклеотид, що містить послідовність, вибрану з групи, що складається з SEQ ID No:2; SEQ ID No:4; SEQ ID No:6; SEQ ID No:8; SEQ ID No: 10; SEQ ID No: 12; SEQ ID No:14; SEQ ID No: 16; SEQ ID No: 18; SEQ ID No:20; SEQ ID No:22; SEQ ID No:24; SEQ ID No:26; SEQ ID No:28; SEQ ID No:30; SEQ ID No32; SEQ DD No:34; SEQ DD No:36; SEQ ID No:38; SEQ ID No:40 і SEQ ID No: 120. У іншому аспекті, даний винахід направлений на ізольований полінуклеотид, що містить послідовність, вибрану з групи, що складається з SEQ ID No:44; SEQ ID No:46; SEQ ID No:50; і SEQ ID No:52. В одному варіанті такі полінуклеотиди кодують поліпептиди злиття. [0018] Даний винахід, крім того, направлений на ізольований полінуклеотид, що містить послідовність, що має, щонайменше, 80%, 85%, 90%, 95% або 99% ідентично послідовності, вибраній з групи, що складається з SEQ ID No:2; SEQ ID No:4; SEQ ID No:6; SEQ ID No:8; SEQ ID No: 10; SEQ ID No: 12; SEQ ID No: 14; SEQ ID No: 16; SEQ ID No: 18; SEQ ID No:20; SEQ ID No:22; SEQ ID No:24; SEQ ID No:26; SEQ ID No:28; SEQ ID No:30; SEQ ID No32; SEQ ID No:34; SEQ ID No:36; SEQ ID No:38; SEQ ID No:40 і SEQ ID No: 120, де зазначений ізольований полінуклеотид кодує поліпептид злиття. У додатковому аспекті, даний винахід направлений на ізольований полінуклеотид, що містить послідовність, що має, щонайменше, 80% ідентичності послідовності, вибраної з групи, що складається з SEQ ID No:44; SEQ ID No:46; SEQ ID No:50; і SEQ ID No..52, де зазначений ізольований полінуклеотид кодує поліпептид злиття. [0019] Даний винахід також направлений на ізольований полінуклеотид, що кодує химерний поліпептид, що має послідовність SEQ ID No:1. В одному варіанті полінуклеотид містить послідовність, що кодує поліпептид, що має послідовність SEQ ID No.:1; і послідовність, що кодує поліпептид, що має послідовність Fc-області антитіла або його фрагмента в інших видів, окрім щура. Даний винахід також направлений на ізольований поліну 95068 20 клеотид, що кодує химерний поліпептид, що має послідовність, вибрану з групи, що складається з SEQ ID No:3; SEQ ID No:5; SEQ ID No:7; SEQ ID No:9; SEQ ID No:11; SEQ ID No: 13; SEQ ID No: 15; SEQ ID No: 17; SEQ ID No: 19; SEQ ID No:21; SEQ ID No:23; SEQ ID No:25; SEQ ID No:27; SEQ ID No:29; SEQ ID No:31; SEQ ID No33; SEQ ID No:35; SEQ ID No:37; SEQ ID No:39; і SEQ ID No:121. В одному варіанті полінуклеотид містить послідовність, що кодує поліпептид, що має послідовність вибрану з групи, що складається з SEQ ID No:3; SEQ ID No:5; SEQ ID No:7; SEQ ID No:9; SEQ ID No.11; SEQ ID No:13; SEQ ID No:15; SEQ ID No:17; SEQ ID NO:19; SEQ ID No:21; SEQ ID No:23; SEQ ID No:25; SEQ ID No:27; SEQ ID No:29; SEQ ID No:31; SEQ ID No33; SEQ ID No:35; SEQ ID No:37; SEQ ID No:39; і SEQ ID No: 121; і послідовність, що кодує поліпептид, що має послідовність Fc-області антитіла або його фрагмент у інших видів, окрім щура. [0020] У ще одному аспекті даний винахід направлений на ізольований полінуклеотид, що кодує химерний поліпептид, що має послідовність SEQ ID No.:43. У одному варіанті полінуклеотид містить послідовність, що кодує поліпептид, що має послідовність SEQ ID No.:43; і послідовність, що кодує поліпептид, що має послідовність Fcобласті антитіла або його фрагмент у інших видів, окрім щура. У ще одному аспекті даний винахід направлений на ізольований полінуклеотид, що кодує химерний поліпептид, що має послідовність вибрану з групи, що складається з SEQ ID No:45; SEQ ID No:49; і SEQ ID No:51. В одному варіанті полінуклеотид містить послідовність, що кодує поліпептид, що має послідовність вибрану з групи, що складається з SEQ ID No:45; SEQ ID No:49; і SEQ ID No.:51, і послідовність, що кодує поліпептид, що має послідовність константної області легкого ланцюга антитіла (CL) або його фрагмента у інших видів, окрім щура. [0021] Даний винахід також направлений на ізольований полінуклеотид, що містить послідовність, що кодує поліпептид, що має VH-область ICR62 антитіла або його фукнціональні варіанти, і послідовність, що кодує поліпептид, що має послідовність-Fс-області антитіла або його фрагмента у інших видів, окрім щура. В іншому аспекті даний винахід направлений на ізольований полінуклеотид, що містить послідовність, що кодує поліпептид, що має VL-область ICR62 антитіла або його функціональні варіанти, і послідовність, що кодує поліпептид, що має послідовність CL-області антитіла або його фрагмента в інших видів, окрім щура. [0022] Даний винахід, крім того, направлений на експресуючий вектор, що містить будь-який з ізольованих полінуклеотидів, описаних вище, і на клітину-хазяїна, що містить такий експресуючий вектор. У подальшому аспекті, даний винахід направлений на клітину-хазяїна, що містить будьякий з ізольованих полінуклеотидів, описаних вище. [0023] В одному аспекті даний винахід направлений на ізольований поліпептид, що містить: (а) послідовність вибрану з групи, що складається з: SEQ ID NO:53, SEQ ID NO:55, SEQ ID NO:57, SEQ 21 ID NO:59, SEQ ID NO:61, SEQ ID NO:63, SEQ ID NO:65, SEQ ID NO:67, SEQ ID NO:69, SEQ ID NO:71, SEQ ID NO:73, SEQ ID NO: 123 і SEQ ID NO: 125; (b) послідовність вибрану з групи, що складається з: SEQ ID NO:75, SEQ ID NO:77, SEQ ID NO:79, SEQ ID NO:81, SEQ ID NO:83, SEQ ID NO:85, SEQ ID NO:87, SEQ ID NO:89, SEQ ID NO:91, SEQ ID NO:93, SEQ ID NO:95, SEQ ID NO:97, SEQ ID NO:99, SEQ ID NO:101, SEQ ID NO:103, SEQ ID NO:105 і SEQ ED NO: 127; і (с) SEQ ID NO: 107, де зазначений поліпептид являє собою поліпептид злиття. В іншому аспекті винахід направлений на ізольований поліпептид, що містить (а) послідовність, вибрану з групи, що складається з SEQ ID NO:111 і SEQ ID NO:113; (b) SEQ ID NO: 115; і (с) SEQ ID NO: 117, де зазначений поліпептид являє собою поліпептид злиття. [0024] Даний винахід також направлений на химерний поліпептид, що містить послідовність SEQ ID NO:1 або її варіанти. Даний винахід, крім того, направлений на химерний поліпептид, містить послідовність SEQ ID NO.:43 або її варіанти. У одному варіанті будь-який з даних поліпептидів, крім того, містить Fc-область людини і/або CLобласть людини. Даний винахід також направлений на химерний поліпептид, що містить послідовність, вибрану з групи, що складається з SEQ ID No:3; SEQ ID No:5; SEQ ID No:7; SEQ ID No:9; SEQ ID No:11; SEQ ID No:13; SEQ ID No:15; SEQ ID No:17; SEQ ID No:19; SEQ ID No:21; SEQ ID No:23; SEQ ID No:25; SEQ ID No:27; SEQ ID No:29; SEQ ID No:31; SEQ ID No:33; SEQ ID No:35; SEQ ID No:37; SEQ ID No:39; і SEQ ID No: 121, або її варіанти. Даний винахід, крім того, направлений на химерний поліпептид, що містить послідовність, вибрану з групи, що складається з SEQ ID No:45; SEQ ID No:49; і SEQ ID No:51, або її варіанти. В одному варіанті будь-який з даних поліпептидів, крім того, містить Fc-область людини і/або CLобласть людини. В одному варіанті Fc-область людини містить IgG1. [0025] В іншому аспекті винахід направлений на поліпептид, що містить послідовність, отриману з ICR62 антитіла і послідовність, отриману з гетерогенного поліпептиду і на антиген-зв'язуючу молекулу, що містить такий поліпептид. В одному варіанті антиген-зв'язуюча молекула являє собою антитіло. У переважному варіанті антитіло є химерним. У іншому переважному варіанті антитіло є гуманізованим або приматизованим. [0026] В іншому аспекті даний винахід направлений на АВМ, які здатні конкурувати з ICR62 антитілом щура для зв'язування з EGFR і яке є химерним. В одному варіанті АВМ являє собою антитіло або його фрагмент. У подальшому варіанті АВМ являє собою рекомбінантне антитіло, містить VH-область, що має послідовність амінокислоти, вибрану з групи, що складається з SEQ ID NO.: 1; SEQ ID No:3; SEQ ID No:5; SEQ ID No:7; SEQ ID No:9; SEQ ID No:11; SEQ ID No:13; SEQ ID No:15; SEQ ID No:17; SEQ ID No:19; SEQ ID No:21; SEQ ID No:23; SEQ ID No:25; SEQ ID No:27; SEQ ID No:29; SEQ ID No:31; SEQ ID No:33; SEQ ID No:35; SEQ ID No:37; SEQ ID No:39; і SEQ ID No:121. В іншому варіанті АВМ являє собою реко 95068 22 мбінанте антитіло, містить VL-область, що має послідовність амінокислоти, вибрану з групи, що складається з SEQ ID NO:43, SEQ ID No:45; SEQ ID No:49; і SEQ ID No:51. У подальшому варіанті АВМ являє собою рекомбінантне антитіло, що є приматизованим. У ще одному подальшому варіанті АВМ являє собою рекомбінанте антитіло, що є гуманізованим. В іншому варіанті АВМ являє собою рекомбінанте антитіло, містить Fc-область людини. У подальшому варіанті будь-яка з АВМ, що обговорювались вище, може кон'югуватися до частини, такої як токсин або радіоізотопна мітка. [0027] Даний винахід також стосується АВМ даного винаходу, зазначена АВМ має модифіковані олігосахариди. В одному варіанті модифіковані олігосахариди мають знижену фукозиляцію у порівнянні з немодифікованими олігосахаридами. В інших варіантах модифіковані олігосахариди є гібридом або комплексом. У подальшому варіанті АВМ має підвищену пропорцію нефукозильованих олігосахаридів розділених навпіл, нефукозильованих олігосахаридів у Fc-області зазначеної молекули. В одному варіанті розділені навпіл, нефукозильовані олігосахариди є гібридом. У подальшому варіанті розділені навпіл, нефукозильовані олігосахариди є комплексом. В одному варіанті, щонайменше, 20% олігосахаридів у Fcобласті зазначеного поліпептиду є нефукозильованими або розділеними навпіл, нефукозильованими. У більш переважних варіантах, щонайменше, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70% або 75% або більше олігосахаридів є нефукозильованими або розділеними навпіл, нефукозильованими. [0028] Даний винахід, крім того, стосується полінуклеотида, що кодує будь-яку з АВМ, що обговорювались вище, і експресуючих векторів і клітин, що містять такий полінуклеотид. [0029] Даний винахід, крім того, стосується способу продукування АВМ, що здатна конкурувати з антитілом ICR62 щура для зв'язування EGFR і де зазначена АВМ є химерною; зазначений спосіб містить етапи, на яких: (а) культивують клітинухазяїн, що містить полінуклеотид, що кодує АВМ даного винаходу у середовищі при умовах, що дозволяють експресію зазначеного полінуклеотиду, що кодує зазначену АВМ; і (b) відновлюють зазначену АВМ з отриманої культури. [0030] В іншому аспекті даний винахід стосується фармацевтичної композиції, що містить АВМ даного винаходу. Передбачено, що фармацевтична композиція може, крім того, містити фармацевтично прийнятний носій, ад'ювант або їхню комбінацію. [0031] У подальшому аспекті даний винахід стосується способу лікування захворювання, що характеризується експресією EGFR (наприклад, патологія або надекспресія EGFR). Спосіб включає введення терапевтично ефективної кількості АВМ даного винаходу суб'єкту, переважно, ссавцю і, більш переважно, людині у разі потреби. У переважному варіанті захворювання лікується введенням АВМ, що є химерним (наприклад, гуманізованим) антитілом або химерним фрагментом антитіла. В одному варіанті АВМ вводиться у кіль 23 кості приблизно від 1,0 мг/кг до 15,0 мг/кг. В іншому варіанті АВМ вводиться у кількості приблизно від 1,5 мг/кг до 12,0 мг/кг. У подальшому варіанті АВМ вводиться у кількості приблизно від 1,5 мг/кг до 4,5 мг/кг. У подальшому варіанті АВМ вводиться у кількості приблизно від 4,5 мг/кг до 12,0 мг/кг. У подальшому варіанті АВМ вводиться у кількості, вибрану з групи, що складається з приблизно 1,5, приблизно 4,5 і приблизно 12,0 мг/кг. [0032] У ще одному аспекті, даний винахід стосується клітини-хазяїна, що утворена для експресування, щонайменше, однієї нуклеїнової кислоти, що кодує поліпептид, що має активність GnTIII у кількості, достатній модифікувати олігосахариди у Fc-області АВМ, що продукується клітиною-хазяїном, де АВМ здатна конкурувати з антитілом ICR62 щура для зв'язування EGFR і де є химерною. В одному варіанті поліпептид, що має активність GnTIII є поліпептидом злиття. У іншому варіанті АВМ, що продукується клітиною-хазяїном, є антитілом або фрагментом антитіла. В одному варіанті антитіло або фрагмент антитіл є гуманізованим. У подальшому варіанті АВМ містить область, еквівалентну Fc-області людини IgG. [0033] Даний винахід також направлений на ізольований полінуклеотид, що містить, щонайменше, одну (наприклад, один, два, три, чотири, п'ять або шість) гіперваріабельну область антитіла ICR62 щура або варіант або його процесовану форму, що містить, щонайменше, специфічнодосліджувальні залишки для зазначеної гіперваріабельної області, де зазначений ізольований полінуклеотид кодує поліпептид злиття. Переважно, такі ізольовані полінуклеотиди кодують поліпептид злиття, так як і антиген-зв'язуюча молекула. В одному варіанті полінуклеотид містить три гіперваріабельні області антитіла ICR62 щура, або варіанти або його процесовані форми, що містять, щонайменше, специфічно-досліджувальні залишки для кожної з зазначених трьох гіперваріабельних областей. В іншому варіанті полінуклеотид кодує цілісну варіабельну область короткого або довгого ланцюга химерного (наприклад, гуманізованого) антитіла. Даний винахід, крім того, направлений на поліпептиди, кодовані такими полінуклеотидами. [0034] В іншому варіанті даний винахід направлений на антиген-зв'язуючу молекулу, що містить, щонайменше, одну (наприклад, одну, дві, три, чотири, п'ять або шість) гіперваріабельних областей антитіла ICR62 щура або варіант або його процесовану форму, що містить, щонайменше, специфічно-досліджувальні залишки для зазначеної гіперваріабельної області, і містить послідовність, отриману з гетерогенного поліпептиду. В одному варіанті антиген-зв'язуюча молекула містить три гіперваріабельні області антитіла ICR62 щура або варіанти або його процесовані форми, що містять, щонайменше, специфічнодосліджувальні залишки для кожної з зазначених трьох гіперваріабельних областей. В іншому аспекті антиген-зв'язуюча молекула містить варіабельну область антитіла короткого або довгого ланцюга. В одному варіанті, що застосовується частково, антиген-зв'язуюча молекула є химерним, наприклад, гуманізованим, антитілом. Даний винахід 95068 24 також направлений на способи утворення таких антиген-зв'язуючих молекул, і застосування того ж самого при лікуванні захворювання, що містить злоякісний характер, таке як рак крові, мозку, голови та шиї, підшлункової залози, легенів, молочної залози, яєчника, прямої кишки, простати, шкіри і нирки. [0035] Клітина-хазяїн за даним винаходом може бути вибраною з групи, що включає, але не обмежується, HEK293-EBNA клітину, СНО клітину, ВНK клітину, NSO клітину, SP2/0 клітину, YO клітину мієломи, РЗХ63 клітину мишачої мієломи, PER клітину, PER.C6 клітину або клітину гібридоми. В одному варіанті клітина-хазяїн даного винаходу, крім того, містить трансфекторний полінуклеотид, що містить полінуклеотид, кодуючий VL-область антитіла ICR62 щура або його варіанти і послідовність, що кодує область, еквівалентну Fc-області людського імуноглобуліну. В іншому варіанті клітина-хазяїн даного винаходу, крім того, містить трансфекторний полінуклеотид, що містить полінуклеотид, що кодує VH-область антитіла ICR62 щура або його варіанти і послідовність, що кодує область, Fc-області людського імуноглобуліну. [0036] У подальшому аспекті даний винахід направлений на клітину-хазяїна, що продукує АВМ, що показує підвищення спорідненості зв'язування Fc-рецептора і/або підвищення ефекторної функції як результат модифікації його олігосахаридів. В одному варіанті існує підвищена спорідненість зв'язування до Fc-рецептора, зокрема, до FcRIIIA рецептора. Ефекторна функція, що розглянута у даному винаході, може бути вибраною з групи, що включає, але не обмежується, підвищену Fc-опосередковану клітинну цитотоксичність; підвищене зв'язування з NK клітинами; підвищене зв'язування з макрофагами; підвищене зв'язування з поліморфно-ядерними клітинами; підвищене зв'язування з моноцитами; підвищене пряме сигналювання, включаючи апоптоз; підвищене дозрівання дендритної клітини; і підвищене примірування Τ клітини. [0037] У подальшому варіанті клітина-хазяїн даного винаходу містить, щонайменше, одну нуклеїнову кислоту, що кодує поліпептид, який має активність GnTIII, це є функціонально зв'язаним з конститутивним елементом промотеру. [0038] В іншому аспекті даний винахід направлений на спосіб для продукування АВМ у клітиніхазяїні, що містить етапи, на яких: (а) культивують клітину-хазяїна, що утворена для експресування, щонайменше, одного полінуклеотиду, що кодує поліпептид злиття, який має активність GnTIII при умовах, які дозволяють продукування зазначеної АВМ і які дозволяють модифікацію олігосахаридів, присутніх у Fc-області зазначеної АВМ; і (b) ізолюють зазначену АВМ;де зазначена здатна конкурувати з ICR62 антитілом щура для зв'язування з EGFR і де зазначена АВМ є химерною (наприклад, гуманізованою). В одному варіанті поліпептид, який має активність GnTIII, являє собою поліпептид злиття, переважно містить каталітичний домен GnTIII і домен локалізації Гольджі гетерогенного резидентного поліпептиду Гольджі, що вибраний з групи, що складається з домену лока 25 лізації манозидази II, домену локалізації β(1,2)-Νацетилглюкозамінілтрансферази І ("GnTI"), домену локалізації манозидази І, домен локалізації β(1,2)Ν-ацетилглюкозамінілтрансферази II ("GnTII"), і домен локалізації α1-6 ядерної фукозилтрансферази. Преважно, домен локалізації Гольджі походить з манозидази II або GnTI. [0039] У подальшому аспекті даний винахід направлений на спосіб для модифікування профілю глікозиляції анти-EGFR АВМ, що продукується клітиною-хазяїном, яка містить внесення до клітини-хазяїна, щонайменше, однієї нуклеїнової кислоти або експресуючого вектора за даним винаходом. В одному варіанті АВМ являє собою антитіло або його фрагмент; переважно містить Fc-область IgG. Альтернативно, поліпептид являє собою протеїн злиття, що включає область, еквівалентну Fcобласті людини IgG. [0040] В одному аспекті винахід стосується рекомбінантного, химерного антитіла або його фрагмента, що здатний конкурувати з антитілом ICR62 щура для зв'язування з EGFR і має зменшену фукозиляцію. [0041] В іншому аспекті даний винахід направлений на спосіб модифікацій глікозиляції рекомбінантного антитіла або його фрагмента за даним винаходом, застосовуючи поліпептид злиття, який має активність GnTIII і містить домен локалізації Гольджі гетерогенного резидентного поліпептиду Гольджі. В одному варіанті поліпептиди злиття даного винаходу містять каталітичний домен GnTIII. В іншому варіанті домен локалізації Гольджі є вибраним з групи, що складається з: домену локалізації манозидази II, домену локалізації GnTI, домену локалізації манозидази І, домену локалізації GnTII і домену локалізації α1-6 ядерної фукозилтрансферази. Переважно, домен локалізації Гольджі походить з манозидази II або GnTI. [0042] В одному варіанті спосіб за даним винаходом направлений до продукування рекомбінантного, химерного антитіла або його фрагмента з модифікованими олігосахаридами, де зазначені модифіковані олігосахариди мають зменшену фукозиляцію у порівнянні з немодифікованими олігосахаридами. Згідно з даним винаходом ці модифіковані олігосахариди можуть бути гібридом або комплексом. В іншому варіанті спосіб за даним винаходом направлений до продукування рекомбінантного, химерного (наприклад, гуманізованого) антитіла або його фрагмента, що мають підвищену пропорцію розділених навпіл, нефукозильованих олігосахаридів у Fc-області зазначеного поліпептиду. В одному варіанті розділені навпіл, нефукозильовані олігосахариди є гібридом. В іншому варіанті розділені навпіл, нефукозильовані олігосахариди є комплексом. У подальшому варіанті спосіб за даним винаходом направлений на продукування рекомбінантного, химерного антитіла або його фрагмента, що має, щонайменше, 20% олігосахаридів у Fc-області зазначеного поліпептиду, які є розділеними навпіл, нефукозильованими. У переважному варіанті, щонайменше, 30% олігосахаридів у Fc-області зазначеного поліпептиду є розділеними навпіл, нефукозильованими. В іншому переважному варіанті, де, щонайме 95068 26 нше, 35% олігосахаридів у Fc-області зазначеного поліпептиду є розділеними навпіл, нефукозильованими. [0043] У подальшому аспекті даний винахід направлений на рекомбінантне, химерне антитіло або його фрагмент, що проявляє підвищення спорідненості зв'язування Fc-рецептора і/або підвищення ефекторної функції як результат модифікації його олігосахаридів. В одному варіанті підвищена спорідненість зв'язування спостерігається до Fc-рецептора активації. У подальшому варіанті Fc-рецептор являє собою Fс рецептор активації, зокрема, FcRIIIA рецептор. Ефекторна функція, що розглядається у даному винаході, може бути вибраною з групи, що включає, але не обмежується, підвищенням Fc-опосередкованою клітинною цитотоксичністю; підвищенням зв'язування з NK клітинами; підвищенням зв'язування з макрофагами; підвищенням зв'язування з поліморфно-ядерними клітинами; підвищенням зв'язування з моноцитами; підвищенням прямого сигналювання, включаючи апоптоз; підвищенням дозріванння дендритної клітини; і підвищенням примірування Τ клітини. [0044] В іншому аспекті даний винахід направлений на рекомбінантний, химерний (наприклад, гуманізований) фрагмент антитіла, що має спорідненість зв'язування антитіла ICR62 щура і що містить Fc-область, що утворена для підвищення ефекторної функції, що виробляється будь-яким зі способів за даним винаходом. [0045] В іншому аспекті даний винахід направлений на протеїн злиття, що включає поліпептид, що має послідовність вибрану з групи, що складається з SEQ ID NO.: 1; SEQ ID No:3; SEQ ID No:5; SEQ ID No:7; SEQ ID No:9; SEQ ID No:11; SEQ ID No:13; SEQ ID No:15; SEQ ID No:17; SEQ ID No:19; SEQ ID No:21; SEQ ID No:23; SEQ ID No:25; SEQ ID No:27; SEQ ID No:29; SEQ ID No:31; SEQ ID No:33; SEQ ID No:35; SEQ ID No:37; SEQ ID No:39; і SEQ ID No: 121, і область, еквівалентну Fcобласті імуноглобуліна і утворена для підвищення ефекторної функції, що отримують будь-яким зі способів за даним винаходом. [0046] В іншому аспекті даний винахід направлений на протеїн злиття, що включає поліпептид, що має послідовність вибрану з групи, що складається з SEQ ID NO:43, SEQ BD No:45; SEQ ID No:49; і SEQ ID No.:51; і область, еквівалентну Fcобласті імуноглобуліна і утворена для підвищення ефекторної функції, що отримують будь-яким зі способів за даним винаходом. [0047] В одному аспекті даний винахід направлений на фармацевтичну композицію, що містить рекомбінантне, химерне (наприклад, гуманізоване) антитіло, що отримують будь-яким зі способів за даним винаходом, і фармацевтично прийнятний носій. В іншому аспекті даний винахід направлений на фармацевтичну композицію, що містить рекомбінантний, химерний (наприклад, гуманізований) фрагмент антитіл, що отримують будь-яким зі способів за даним винаходом, і фармацевтично прийнятний носій. В іншому аспекті даний винахід направлений на фармацевтичну композицію, що містить протеїн злиття, що отримують будь-яким зі 27 способів за даним винаходом, і фармацевтично прийнятний носій. [0048] У подальшому аспекті даний винахід направлений на спосіб для ураження клітин in vivo або in vitro, що експресують EGFR. В одному варіанті даний винахід направлений на спосіб для ураження клітин, що експресують EGFR у суб'єкта, який містить введення суб'єкту композиції, що включає АВМ за даним винаходом. [0049] У ще одному аспекті даний винахід направлений на спосіб для визначення in vivo або in vitro присутності EGFR у зразку, наприклад, для діагностики захворювання, що стосується EGFR експресії. У одному варіанті визначення виконується контактуванням зразка для перевірки необов'язково з контрольним зразком, з АВМ за даним винаходом при умовах, що дозволяють формування комплексу між АВМ і EGFR. Потім визначається формування комплексу (наприклад, ELISA (твердофазний імуноферментативний аналіз) і бо іншими способами, відомими у техніці). Застосовуючи контрольний зразок з тестовим зразком, будь-яка статистично суттєва різниця у формуванні комплексів ABM-EGFR при порівнянні тестового і контрольного зразків вказує на присутність EGFR у тестовому зразку. [0050] Даний винахід, крім того, направлений на спосіб лікування захворювання, що стосується EGFR-експресії, зокрема, порушення проліферації клітини, де EGFR є експресованим, більш частково, де EGFR є надмірно експресованим (наприклад, надекспресованим), включаючи рак крові, мозку, голови та шиї, підшлункової залози, легенів, молочної залози, яєчника, прямої кишки, простати, шкіри і нирки, що містить введення терапевтично ефективної кількості рекомбінантного, химерного (наприклад, гуманізованого) антитіла або його фрагмент, що виробляється будь-яким зі способів за даним винаходом, людині у разі потреби. Короткий опис фігур [0051] Фігура 1 показує функціональну активність індивідуальних довгих і коротких химерних ICR62 поліпептидних ланцюгів щура-людини, коли вони комбіновані з гуманізованими ICR62 конструктами І-ННС (довгий ланцюг) і I-KB (короткий ланцюг). rVL представляє химерний короткий ланцюг і rVH представляє химерний довгий ланцюг. Позначення "r" вказує на те, що варіабельні домени походять від натурального антитіла щура. [0052] Фігура 2 показує зв'язуючу активність гуманізованого ICR62 антитіла, що містить довгий ланцюг конструктів варіабельної області І-ННС, ІННА і I-HLA, і гуманізований короткий ланцюг конструкту варіабельної області І-KА і І-KВ, сполучених у різних конфігураціях. [0053] Фігура 3 показує зв'язуючу активність гуманізованого ICR62 антитіла, що містить довгий ланцюг конструктів варіабельної області I-HLB, IHLC і I-HLA, і гуманізований короткий ланцюг конструкту варіабельної області І-KА і І-KС, сполучених у різних конфігураціях. [0054] Фігура 4 показує зв'язуючу активність гуманізованого ICR62 антитіла, що містить довгий ланцюг конструктів варіабельної області I-HLA2, IHLA3 і I-HLA4, і гуманізований короткий ланцюг 95068 28 конструкту варіабельної області І-KС у порівнянні з химерним антитілом ICR62 щура-людини. [0055] Фігура 5 показує зв'язуючу активність гуманізованого ICR62 антитіла, що містить довгий ланцюг конструктів варіабельної області I-HLA1, IHLA3, I-HLA5 і I-HLA6, і гуманізований короткий ланцюг конструкту варіабельної області І-KС у порівнянні з химерним ICR62 антитілом щуралюдини. [0056] Фігура 6 показує зв'язуючу активність гуманізованого ICR62 антитіла, що містить довгий ланцюг конструктів варіабельної області I-HLA7 1HLA6 і I-ННВ, і гуманізований короткий ланцюг конструкта варіабельної області І-KС у порівнянні з химерним ICR62 антитілом щура-людини. [0057] Фігура 7 показує зв'язуючу активність гуманізованого ICR62 антитіла, що містить довгий ланцюг конструктів варіабельної області I-HHF, IHLA9 і I-HLA8 і гуманізований короткий ланцюг конструкту варіабельної області І-КС у порівнянні з химерним ICR62 антитілом щура-людини. [0058] Фігура 8 показує зв'язуючу активність гуманізованих антитіл, що містять довгий ланцюг конструктів варіабельної області І-ННВ, I-HHD, IHHG, I-HHF, I-HLA7, і I-HLA9 і гуманізований короткий ланцюг конструкту варіабельної області І-КС. [0059] Фігура 9 показує порівняння антигенопосередкованої клітинної цитотоксичності (ADCC) для варіабельних глікоформ химерного ICR62 антитіла, так як для гуманізованого варіанта I-HLA4. "G1" відноситься до сконструйованого шляхом глікотехнології антитіла коекспресією з GnTIII. "G2 відноситься до сконструйованого шляхом глікотехнології антитіла коекспресією з GnTIII і Manll. "WT" відноситься до антитіла, що не було сконструйованого шляхом глікотехнології. Гуманізований довгий ланцюг конструктів був сполучений з коротким ланцюгом конструкту І-КС. [0060] Фігура 10 показує порівняння ADCC для форми, що не була сконструйована шляхом глікотехнології (WT) і G2 глікоформи (тобто, сконструйована шляхом глікотехнології коекспресією з GnTIII і МаnІІ) конструктів гуманізованого ICR62 антитіла І-ННВ і I-HLA7. Ті самі антитіла були застосовані до двох ліній клітини-мішені: у Графі А застосовувалась LN229 лінія клітини-мішені; у Графі В А431 лінія клітини-мішені. Конструкти гуманізованого довгого ланцюга були сполучені з конструктом І-КС короткого ланцюга. [0061] Фігура 11А і 11В показує порівняння ADCC для форм, що не були сконструйовані шляхом глікотехнології (WT) і G2 глікоформ конструктів химерного ICR62 і гуманізованого ICR62 антитіла І-ННВ і I-HLA7. Застосовувалась А431 лінія клітини-мішені. Конструкти гуманізованого довгого ланцюга були сполучені з конструктом І-KС короткого ланцюга. [0062] Фігура 12 показує порівняння 72h ADCC для G2 глікоформ конструктів химерного ICR62 і гуманізованого ICR62 антитіл І-ННВ і I-HLA7. Конструкти гуманізованого довгого ланцюга були сполучені з конструктом І-KС короткого ланцюга. [0063] Фігура 13 показує розміщеність послідовності амінокислоти конструктів гуманізованого ICR62 довгого ланцюга варіабельної області у 29 порівнянні з послідовностями ICR62 щура. Крапки представляють ідентичність залишків амінокислоти у даному положенні у межах даної конструкції. [0064] Фігура 14 показує FcgammaRlIIa-Fc аналіз зв'язування, застосовуючи СНО клітини, що появляють рекомбінантну людську FcgammaRIIIa. Сконструйоване шляхом глікотехнології І-ННВ/KС гуманізоване анти-EGFR IgG1 антитіло порівнювалось з не сконструйованим шляхом глікотехнології (Wt) антитілом. [0065] Фігура 15 показує профіль олігосахариду MALD/TOF-MS для сконструйованого шляхом глікотехнології гуманізованого анти-EGFR IgG1 антитіла, І-ННВ/KС. Сконструювання шляхом глікотехнології досяглось надекспресією у клітинах, що продукують антитіло у генах, що кодують ензими з GnTIII і активності манозидази II Гольджі, отримуючи більш, ніж 70% нефукозильованих FсАsn297-сполучених олігосахаридів. [0066] Фігура 16 показує точний профіль антиEGFR (n=6 реплікатів вздовж калібрувального ряду) для визначення анти-EGFR у 1% матриці сиворотки мавпи (суміш сиворотки мавпи CMS25/31/33, що поставляється HLS). [0067] Фігура 17 показує репрезентативну анти-EGFR калібрувальну криву для визначення анти-EGFR у 1 % матриці сиворотки мавпи. [0068] Фігура 18 показує концентрації сиворотки анти-EGFR на День 1 тижневого внутрішньовенного введення анти-EGFR до самців мавп циномолгус. [0069] Фігура 19 показує концентрації сиворотки анти-EGFR EGFR на День 1 тижневого внутрішньовенного введення анти-EGFR до самок мавп циномолгус. [0070] Фігура 20 показує відношення між площинами на кривих концентрації сиворотки антиEGFR (AUCi68) - час і рівня дози EGFR на День 1 тижневого внутрішньовенного введення антиEGFR до мавп циномолгус. [0071] Фігура 21 показує концентрації сиворотки анти-EGFR протягом тижневого внутрішньовенного введення анти-EGFR самцям мавп циномолгус. [0072] Фігура 22 показує концентрації сиворотки анти-EGFR протягом тижневого внутрішньовенного введення анти-EGFR самкам мавп циномолгус. [0073] Фігура 23 показує MALDI/TOF-MS профіль олігосахаридів з Fc-сконструйованим (сконструйованим шляхом глікотехнології) анти-EGFR антитіла, що застосовується in vivo для вивчення мавп, описаних у прикладах, що показані нижче. [0074] Фігура 24 показує зв'язування з EGFR, експресованого на поверхні людських А431 епідермоїдальних клітин карциноми. Антитіло, що застосовувалось для вивчення зв'язування, було Fcсконструйоване анти-EGFR антитіло (І-ННВ конструкт), що застосовується для вивчення мавпи in vivo, описаних у прикладах, що показані нижче. [0075] Фігура 25 показує зв'язування з EGFR, експресованим на поверхні COS-7 клітин нирки мавпи. Антитіло, що застосовувалось, було антиEGFR антитілом (І-ННВ довгий ланцюг; І-KС короткий ланцюг). Для порівняння показано зв'язуван 95068 30 ня зі слабкими EGFR-експресуючими клітинами людини, MCF-7 клітинами раку молочної залози. [0076] Фігура 26 показує Fc-FcgammaRIIIa зв'язування, застосовуючи всю клітину (СНО клітини, сконструйовані так, щоб експресувати людський FcgRIIIa на їхній поверхні). Антитіло, що застосовувалось, було Fc-сконструйованим (сконструйовано шляхом глікотехнології) анти-EGFR антитілом, що застосовується для вивчення in vivo мавп, описаних у прикладах нижче. Зв'язування не-Fcсконструйованого (немодифікованого) контрольного IgG1 антитіла показано для порівняння. [0077] Фігура 27 показує ADCC, опосередковану Fc-сконструйованим (сконструйованим шляхом глікотехнології) анти-EGFR антитілом. Клітинамимішенями є А549 клітини карциноми легені людини. Активність ADCC для не-Fc сконструйованої (немодифікованої) форми антитіла показана для порівняння. [0078] Фігура 28 показує ADCC, опосередковану Fc-опосередковану Fc-сконструйованим (сконструйованим шляхом глікотехнології) анти-EGFR антитілом. Клітинами-мішенями є CYNOM-K1 кератиноцитна клітинна лінія мавпи циномолгус. Активність ADCC для не-Fc сконструйованої (немодифікованої) форми антитіла показана для порівняння. [0079] Фігура 29 показує EGFR-мішень, що зв'язує різні варіанти конструктів з коротким ланцюгом, що основані на І-KС конструкті, спарованим з конструктом з довгим ланцюгом I-HHD. Детальний опис винаходу [0080] Терміни, що використовуються в даному описі в основному застосовуються у техніці, за винятком тих, що визначені наступним чином. [0081] Як використовують в даному описі, вираз антитіло включає всі молекули антитіла, включаючи моноклональні, поліклональні і багатоспецифічні (наприклад, біспецифічні) антитіла, а також фрагменти антитіла, що мають Fc-область і утримують специфічність зв'язування, і протеїни злиття, що включають область, еквівалентну Fcобласті імуноглобуліну і утримують специфічність зв'язування. Також включені фрагменти антитіла, що утримують специфічність зв'язування, включаючи, але не обмежуючись, VH фрагментами, VL фрагментами, Fab фрагментами, F(ab')2 фрагментами, scFv фрагментами, Fv фрагментами, мономерами, димерами, тримерами і тетрамерами (дивись, наприклад, Hudson and Souriau, Nature Med. 9: 129- 134 (2003)). Також включені гуманізоване, приматизоване і химерне антитіла. [0082] Як використовують в даному описі, вираз Fc-область відноситься до С-кінцевої області IgG довгого ланцюга. Також межі Fc-області IgG довгого ланцюга можуть повільно варіювати, IgG довгий ланцюг Fc-області людини звичайно визначають як той, що розташований від залишку амінокислоти у положенні Cys226 до карбоксильного кінця. [0083] Як використовують в даному описі, вираз область, еквівалента даній Fc-області імуноглобуліну включає природно виникаючі алельні 31 варіанти Fc-області імуноглобуліну, а також варіанти, що мають зміни, які продукуються замісниками, аддитивами або делеціями, але які не знижують головним чином властивість імуноглобуліну опосередковувати ефекторні функції (таку як антитіло-залежну клітинну цитотоксичність). Наприклад, одна або декілька амінокислот можуть бути видалені з N-кінців або С-кінців Fc-області імуноглобуліну без суттєвої втрати біологічної функції. Такі варіанти можуть бути вибраними згідно з основними правилами, відомими у техніці, так, щоб мати мінімальний ефект активності, (дивись, наприклад, Bowie, J. U. et al., Science 247:1306-1310 (1990). [0084] Як використовують в даному описі, вираз EGFR відноситься до рецептора епідермального фактору росту людини (також відомий як HER-1 або Erb-B1) (Ulrich, Α. et al., Nature 309:418425 (1984); SwissProt Accession #POO533; вторинні інвентарні номери: 000688, 000732, P06268, Q14225, Q92795, Q9BZS2, Q9GZX1, Q9H2C9, Q9H3C9, Q9UMD7, Q9UMD8, Q9UMG5), так як і природно виникаючі ізоформи і його варіанти. Такі ізоформи і варіанти включають, але не обмежуються варіантом EGFRvIII, альтернативними продуктами сполучення (наприклад, як встановлено SwissProt Accession numbers P00533-1, Р00533-2, Р00533-3, Р00533-4), варіантами GLN-98, ARG266, Lys-521, ILE-674, GLY-962, і PRO-988 (Livingston, R.J. et al., NIEHS-SNPs, environmental genome project (Проект Геном-Окружающая среда), NIEHS ES 15478, Department of Genome Sciences, Seattle, WA (2004)), та інші, що визначені наступними інвентарними номерами: NM_005228.3, NM_201282.1, NM_201283.1, NM_201284.1 (REFSEQ mRNAs); AF125253.1, AF277897.1, AF288738.1, AI217671.1, AK127817.1, AL598260.1, AU137334.1, AW163038.1, AW295229.1, BC057802.1, CB160831.1, K03193.1, U48722.1, U95089.1, X00588.1, X00663.1; H54484S1, H54484S3, H54484S2 (MIPS асамблея); DT.453606, DT.86855651, DT.95165593, DT.97822681, DT.95165600, DT. 100752430, DT.91654361, DT.92034460, DT.92446349, DT.97784849, DT.101978019, DT.418647, DT.86842167, DT.91803457, DT.92446350, DT.95153003, DT.95254161, DT.97816654, DT.87014330, DT.87079224 (DOTS Асамблея). [0085] Як використовують в даному описі, вираз EGFR-ліганд відноситься до поліпептиду, який зв'язується з і/або активує EGFR. Вираз включає мембранно-зв'язані попередні форми EGFRліганда, так як і протеолітично процесовані розчинні форми EGFR-ліганда. [0086] Як використовують в даному описі, вираз активація ліганда відноситься до сигнальної трансдукції (наприклад, що спричинена міжклітинним доменом кінази EGFR-рецептору, що фосфорилює залишки тирозину у EGFR або субстраті поліпептиду), опосередкований зв'язуванням лігандом EGFR. [0087] Як використовують в даному описі, вираз захворювання або порушення, що характеризується надмірною активацією або продукуванням EGFR або EGFR-ліганда або порушення, що сто 95068 32 сується EGFR-експресії, відноситься до стану, що може або може не включати злоякісне новоутворення або рак, де надмірна активація і/або продукування EGFR і/або EGFR-ліганда, що виникає у клітинах або тканинах суб'єкта, що має або схильний до захворювання або порушення. [0088] Як використовують в даному описі, вирази надекспресія, надекспресований і надекспресуючий, як застосовувались у поєднанні з клітинами, що експресують EGFR, відносяться до клітин, що мають деякою мірою вищі рівні EGFR на його поверхні у порівнянні з нормальною клітиною того ж тканинного типу. Така надекспресія може бути спричиненою генною ампліфікацією або збільшенням транскрипції або трансляції. EGFR-експресія (і, так само, надекспресія) може бути визначеною в діагностичному або прогностичному аналізі, оцінюючи рівні EGFR, що присутні на поверхні клітини або у клітинному лізаті технологіями, відомими у техніці: наприклад, шляхом імуногістохімічного аналізу, імунофлуоресцентного аналізу, імуноферментного аналізу, ELISA, проточною цитометрією, радіоімуноаналізом, Вестерн блотом, зв'язуванням ліганду, активністю кінази та ін. (див. загальну CELL BIOLOGY: A LABORATORY HANDBOOK, Celis, J., ed., Academic Press (2d ed., 1998); CURRENT PROTOCOLS IN PROTEIN SCIENCE, Coligan, J.E. et al., eds., John Wiley & Sons (1995-2003); див. також, Sumitomo et al., Clin. Cancer Res. 10: 794-801 (2004) (описує Вестерн блот, проточну цитометрію і імуногістохімію), весь зміст якого в даному описі включений посиланням)). Альтернативно або додатково, можна виміряти рівні EGFR-кодуючих молекул нуклеїнової кислоти у клітині, наприклад, шляхом флуоресценції гібридизації in situ, саузерн-блотингу або PCR (полімеразна ланцюгова реакція) технологіями. Рівні EGFR у нормальних клітинах порівнюють з рівнями клітин, ураженими клітинною проліферацією (наприклад, рак) для дослідження, якщо EGFR є надекспресованим. [0089] Як використовують в даному описі, вираз антиген-зв'язуюча молекула відноситься до свого широкого розуміння молекули, що специфічно зв'язує антигенний детермінант. Більш специфічно, антиген-зв'язуюча молекула, що зв'язує EGFR являє собою молекулу, що специфічно зв'язується з трансмембранним рецептором довжиною 170 кДа, що звичайно визначається як рецептор епідермального фактору росту (EGFR), але також відомий як HER-1 або ErbB1. "Специфічно зв'язується" означає, що зв'язування вибране для антигену і може відрізнятись від небажаних або неспецифічних взаємодій. [0090] Як використовують в даному описі, вирази злиття і химерне, коли застосовуються відносно поліпептидів, так як АВМ відноситься до поліпептидів, що містять послідовності амінокислоти, що походять від двох або більше гетерогенних поліпептидів, таких як порції антитіла з різних видів. Для химерних АВМ, наприклад, неантигенні зв'язуючі компоненти можуть походити з широкого різновиду видів, включаючи приматів, таких як шимпанзе і люди. Константна область химерної АВМ є більш переважною головним чином іденти 33 чній константній області натурального людського антитіла; варіабельна область химерного антитіла є більш переважною головним чином ідентичній рекомбінантного анти-EGFR антитіла, що має послідовність амінокислоти мишачої варіабельної області. Гуманізовані антитіла є більш переважною формою злиття або химерним антитілом. [0091] Як використовують в даному описі, поліпептид, що має GnTIII активність має відношення до поліпептидів, що здатні до каталізу додаткового залишку N-ацетилглюкозаміну (GIcNAc) у β-1-4 зв'язаному з β-зв'язаним манозидом триманозильного ядра N-зв'язаних олігосахаридів. Це включає поліпептиди злиття, що проявляють ензимну активність, подібну, але не обов'язково ідентичну активності β-(1,4)-N-ацетилглюкозамінілтрансферази III, також відомої як β-1,4-манозилглікопротеїн 4бета-N-ацетилглюкозамініл-трансферази (EC 2.4.1.144), згідно з Номенклатурою Комітету Міжнародного Біохімічного Союзу і Молекулярної Біології (NC-IUBMB), як виміряно у окремому біологічному аналізі з присутністі і при відсутності залежності дозування. У випадку, де існує залежність дозування, це не повинно бути ідентичним GnTIII, а скоріше, суттєво подібним залежності дозування при даній активності у порівнянні з GnTIII (тобто, поліпептид, що підходить, буде проявляти більшу активність або не більше, ніж приблизно у 25-кратному розмірі меншу і, переважно, не більше, ніж у десятикратному розмірі меншу активність, і більш переважно, не більше, ніж приблизно у трикратному розмірі меншу активність відносно GnTIII). [0092] Як використовують в даному описі, вираз варіант (або аналог) відноситься до поліпептиду, що відрізняється від специфічно зазначеного поліпептиду за даним винаходом вставками амінокислоти, делеціями і замісниками, що утворені, застосовуючи, наприклад, рекомбінантні ДНК технології. Варіанти АВМ за даним винаходом включають химерні, приматизовані або гуманізовані антиген-зв'язуючі молекули, де один або декілька залишків амінокислоти є модифікованими заміщеннями, додаванням і/або делецією у такий спосіб, що суттєво не діє на спорідненість зв'язування антигену (наприклад, EGFR). Керівництво при визначенні які залишки амінокислоти можуть бути заміненими, доданими або видаленими без відміни необхідної активності, може бути визначений порівнянням послідовності окремого поліпептиду з гомологічними пептидами і мінімізуванням числа змін послідовності амінокислоти, що зроблені в області високої гомології (консервативні області) або заміною амінокислот з консенсусною послідовністю. [0093] Альтернативно, рекомбінантні варіанти, що кодують такі самі або подібні поліпептиди, можуть бути синтезовані або вибраними із застосовуванням "надмірності" у генетичному коді. Різні замісники кодону, такі як приховані зміни, які продукують різні обмежувальні ділянки, можуть бути введеними для оптимізації клонування у плазміду або віральний вектор або експресії у окремій прокаріотичній або еукаріотичній системі. Мутації у послідовності полінуклеотиду можуть відбиватись 95068 34 на поліпептиді або доменах інших пептидів, доданих до поліпептиду для модифікування властивостей будь-якої частини поліпептиду, змінювати характеристики, такі як ліганд-зв'язана спорідненість, міжланцюгові спорідненості або деградація/інтенсивність кругообігу. [0094] Переважно, амінокислотні "замісники" є результатом заміни однієї амінокислоти іншою амінокислотою, що має подібні структурні і/або хімічні властивості, наприклад, консервативні амінокислотні заміщення. "Консервативні" амінокислотні замісники можуть бути отримані на основі схожості полярності, заряду, розчинності, гідрофобності, гідрофільності і/або амфіфільної природи включених залишків. Наприклад, неполярні (гідрофобні) амінокислоти включають аланін, лейцин, ізолейцин, валін, пролін, фенілаланін, триптофан і метіонін; полярні нейтральні амінокислоти включають гліцин, серин, треонін, цистеїн, тирозин, аспарагін і глутамін; позитивно заряджені (основні) амінокислоти включають аргінін, лізин і гістидин; а негативно заряджені (кислотні) амінокислоти включають аспарагінову кислоту і глутамінову кислоту. "Вставки" або "делеції" знаходяться переважно у діапазоні приблизно від 1 до 20 амінокислот, більш переважно від 1 до 10 амінокислот. Дозволене змінення може бути експериментально дослідженим систематичним утворенням вставок, делецій або замісників амінокислот у молекулі поліпептиду, застосовуючи технології рекомбінантної ДНК і оцінюючи отримані рекомбінантні варіанти для активності. [0095] Як використовують в даному описі, вираз гуманізоване застосовується відносно антигензв'язуючої молекули, що отримана з не людської антиген-зв'язуючої молекули, наприклад, мишаче антитіло, що утримує або суттєво утримує антизв'язуючі властивості вихідної молекули, але яке менш імуногенне у людей. Це може бути досягнуто різними способами, включаючи (а) прищеплення всіх нелюдських варіабельних доменів до людських константних для генерування химерних антитіл, (b) прищеплення тільки не людських CDR (гіпервербальні ділянки) до людських каркасних і константних областей в присутності або при відсутності утримання критичних каркасних залишків (наприклад, тих, що важливі для утримання високої спорідненості зв'язування антигену або функцій антитіла), або (с) пересадку всіх не людських варіабельних доменів, але "укриваючи" їх з подібною людині секцією заміною залишків поверхні. Такі способи розкриті у Jones et al., Morrison et al., Proc. Natl. Acad. ScL, 81:6851-6855 (1984); Morrison and Oi, Adv. Іmmunol., 44:65-92 (1988); Verhoeyen et al., Science, 239:1534-1536 (1988); Padlan, Molec. Іmmun., 28:489-498 (1991); Padlan, Molec. Іmmun., 31(3):169-217 (1994), всі з яких тут включені посиланням у повному обсязі. Існують основні 3 гіперваріабельні області або CDR, (CDR1, CDR2 і CDR3) у кожному з довгого і короткого ланцюга варіабельних доменів антитіла, які фланковані чотирма каркасними підобластями (наприклад, FR1, FR2, FR3 і FR4) у кожному з довгого і короткого ланцюга варіабельних доменів антитіла: FR1CDR1-FR2-CDR2-FR3-CDR3-FR4. Обговорення 35 95068 гуманізованих антитіл може бути знайденим, між іншим, у патенті США № 6632927, і у опублікованій заявці США № 2003/0175269, обидва з яких об'єднані у даному описі посиланням у повному обсязі. [0096] Аналогічно, як використовують в даному описі, вираз приматизований застосовується відносно антиген-зв'язуючої молекули, що походить від неприматизованої антиген-зв'язуючої молекули, наприклад, мишаче антитіло, що утримує або головним чином утримує антиген-зв'язуючі властивості вихідної молекули, але яке менше імуногенне у приматів. [0097] У випадку, де існують два або більше визначень виразу, який застосовується і/або прийнятий у межах техніки, визначення виразу, як використовують у даному описі, направлене на включення усіх таких значень якщо чітко не зазначене зворотне. Специфічний приклад являє собою застосування виразу "гіперваріабельна область" ("CDR") для описання не контактуючих антиген комбінованих ділянок, знайдених у межах варіабе 36 льної області обох довгого і короткого ланцюга поліпептидів. Ця окрема область була описана Kabat et al., U.S. Dept. of Health and Human Services, "Sequences of Proteins of Immunological Interest" (1983) і Chothia et al., J. Mol. Biol. 196:901917 (1987), які об'єднані тут посиланням, де визначення включають перекривання або субпопуляції залишків амінокислоти коли порівнюють один з одним. Однак, застосування будь-якого визначення для віднесення до CDR антитіла або його варіантів направлена, щоб бути у межах виразу як визначено і застосовується тут. Відповідні залишки амінокислоти, які охоплюють CDR, як визначено кожним з вище процитованих посилань, викладені нижче у Таблиці 1 як порівняння. Точні номери залишків, що охоплюють окремий CDR, будуть варіювати в залежності від послідовності і розміру CDR. Спеціалісти даної області можуть звичайно визначати, які залишки містять окремий CDR даної варіабельної області послідовності амінокислоти антитіла. Таблиця 1 1 Визначення CDR VH CDR1 VH CDR2 VH CDR3 VL CDR1 VLCDR2 VL CDR3 Kabat 31-35 50-65 95-102 24-34 50-56 89-97 Chlothia 26-32 52-58 95-102 26-32 50-52 91-96 2 АbМ 26-35 50-58 95-102 24-34 50-56 89-97 1 Нумерація всіх CDR визначень у таблиці 1 знаходиться згідно домовленостям щодо нумерації зазначеній в Kabat et al. (див. нижче). 2 "АbМ" відноситься до CDR, як визначено в Оксфордському молекулярному програмному забезпеченні моделювання "АbМ" антитіла. [0098] Kabat et al. також визначили систему нумерації для послідовностей варіабельного домену, що є придатним будь-якому антитілу. Один із спеціалістів даної області техніки точно визначив дану систему "нумерація Kabat" будь-якій послідовності варіабельного домену, без впевненості відносно будь-яких екпериментальних даних поза самою послідовністю. Як використовують в даному описі, "нумерація Kabat" стосується системи нумерації, сформульованої Kabat et al., U.S. Dept. of Health and Human Services, "Sequence of Proteins of Immunological Interest" (1983). Крім визначених інакше, посилання на нумерацію положень специфічного залишку амінокислоти у АВМ проводять згідно системи нумерації Kabat. Послідовності списку послідовностей (наприклад, від SEQ ID NO:1 до SEQ ID NO: 127) не нумеруються згідно системи нумерації Kabat. Однак, як вказано вище, це добре в межах дослідження спеціалістом даної області техніки схеми нумерації Kabat будь-якої послідовності варіабельної області у Списку Послідовностей, основаній на нумерації послідовностей як представлено у даному описі. [0099] Нуклеїновою кислотою або полінуклеотидом, що має послідовність нуклеотиду щонай менше, наприклад, 95%, "ідентичної" відповідній послідовності нуклеотиду за даним винаходом, назначено, що послідовність нуклеотиду полінуклеотиду являється ідентичною відповідній послідовності, окрім тієї послідовності полінуклеотиду, може включати до п'яти пунктів мутацій на кожні 100 нуклеотидів відповідної послідовності нуклеотиду. Іншими словами, щоб отримати полінуклеотид, який має послідовність нуклеотиду, щонайменше, 95%, ідентичну відповідній послідовності нуклеотиду, до 5% нуклеотидів в стандартній послідовності можуть бути видаленими або заміщеними іншим нуклеотидом або кількість нуклеотидів до 5% всіх нуклеотидів в стандартній послідовності можуть бути включені в стандартну послідовність. [00100] Як практичне питання, де будь-яка окрема молекула нуклеїнової кислоти або поліпептиду, щонайменше, має 80%, 85%, 90%, 95%, 96%, 97%, 98% або 99%, ідентичної послідовності нуклеотиду або послідовності поліпептиду за даним винаходом, може бути визначеною традиційно, застосовуючи відомі комп'ютерні програми. Переважний спосіб для дослідження кращої повної сумісності між заданою послідовністю (послідов 37 ність даного винаходу) і послідовністю суб'єкта, також згаданої як глобальне вирівнювання послідовності, може досліджуватись, застосовуючи комп'ютерну програму FASTDB, що основана на алгоритмі Brutlag et al., Соmp. App. Biosci. (5:237245 (1990). У вирівнюванні послідовності задана і досліджувана послідовності обидві являють собою ДНК послідовності. РНК послідовність може бути порівняною, перетворюючи урацили (U) на тимини (Т). Результат зазначеного глобального вирівнювання послідовності представлений у відсотковій ідентичності. Переважними параметрами, що застосовувались у FASTDB вирівнюванні ДНК послідовностей для розрахунку відсоткової ідентичності є: Матриця=Єдність, k-кратний=4, Вибракування невідповідності=1, Вибракування приєднання=30, Довжина групи рандомізації=0, Бал обриву=1, Вибракування пробілу=5, Вибракування розміру пробілу 0,05, Розмір вікна=500 або довжина досліджуваної послідовності нуклеотиду, яка більш коротка. [00101] Якщо досліджувана суб'єкта є коротшою, ніж задана послідовність через 5' або 3' делеції, не через внутрішні делеції, для результатів має бути зроблена корекція вручну. Це тому, що програма FASTDB не розраховує для 5' і 3' процесінгів досліджуваної послідовності, коли розраховується відсоткова ідентичність. Для послідовностей суб'єкта, процесовані у 5' або 3' кінцях, відносно заданої послідовності відсоткова ідентичність виправлена розрахунками числа основ заданої послідовності, що є 5' і 3' досліджуваної послідовності, які не є відповідними/вирівняними, як присутність повних основ заданої послідовності. Чи є один з нуклеотиду відповідним/вирівняним досліджували за результатами FASTDB вирівнювання послідовності. Даний відсоток потім відняли від відсотку, що ідентично розрахований вищеописаною програмою FASTDB, застосовуючи специфічні параметри для досягнення заключного рахунку відсоткової ідентичності. Даний виправлений рахунок являє собою те, що застосовується для цілей даного винаходу. Тільки основи за межами 5' і 3' основ досліджуваної послідовності, як показано вирівнюванням FASTDB, які не є відповідними/вирівняними із заданою послідовністю, розраховані для цілей установки вручну рахунку відсоткової ідентичності. [00102] Наприклад, 90 основ досліджуваної послідовності вирівняна до 100 основ заданій послідовності для дослідження відсотку. Делеції спостерігаються на 5' кінці досліджуваної послідовності і, таким чином, FASTDB вирівнювання не показує відповідних/вирівняних перших 10 основ на 5' кінці. 10 непарних основ представляють 10% послідовності (кількість основ на 5' і 3' кінцях, що не є відповідними/загальна кількість основ у заданій послідовності), таким чином 10% віднято від відсоткової ідентичності, що розрахована програмою FASTDB. Якщо ті 90 основ, що залишилися, повністю відповідають, кінцева відсоткова ідентичність досягла би 90%. У іншому прикладі 90 основ досліджуваної послідовності порівнюється зі 100 основами заданої послідовності. Цього разі делеції являють собою внутрішні делеції, таким чином не має основ на 5' або 3' досліджуваної послідов 95068 38 ності, що не є відповідними/вирівняними із заданою. У даному випадку відсоткову ідентичність, розраховану програмою FASTDB, вручну не виправляли. Знову тільки основи 5' і 3' досліджуваної послідовності, які не є відповідними/вирівняними із заданою послідовністю, виправляли вручну. Ніякі інші корекції вручну не робили для цілей даного винаходу. [00103] Поліпептидом, що має послідовність амінокислоти, щонайменше, наприклад, 95% "ідентичної" заданій послідовності амінокислоти за даним винаходом, визначають чи є амінокислотна послідовність досліджуваного поліпептиду ідентичною заданій послідовності, окрім того, що досліджувана поліпептидна послідовність може включати більш ніж п'ять амінокислотних альтерацій на кожні 100 амінокислот заданої послідовності амінокислоти. Іншими словами, для отримання поліпептиду, що має послідовність амінокислоти, щонайменше, 95%, ідентичної заданій послідовності амінокислоти, може бути вставлено до 5% залишків амінокислоти у досліджуваній послідовності, видалено або заміщено іншою амінокислотою. Ці зміни стандартної послідовності можуть виникати у аміно або карбокси кінцевих положеннях стандартної амінокислотної послідовності або будь-де між такими кінцевими положеннями, що розсіяні або індивідуально серед залишків у стандартній послідовності або у одній або більше суміжних групах у межах стандартної послідовності. [00104] Практично,чи є будь-який окремий поліпептид, щонайменше, 80%, 85%, 90%, 95%, 96%, 97%, 98% або 99% ідентичним відповідному поліпептиду, може бути визначений традиційно, застосовуючи відомі комп’ютерні програми. Переважний спосіб для дослідження найкращої відповідності між заданою послідовністю (послідовність даного винаходу) і досліджуваною послідовністю, що також має назву загальне вирівнювання послідовності, може бути дослідженим, застосовуючи комп'ютерну програму FASTDB, основану на алгоритмі Brutlag et al., Соmp. App. Biosci. 6:237-245 (1990). У вирівнюванні послідовності задана послідовність і досліджувана послідовність є або послідовностями нуклеотиду, або послідовностями амінокислоти. Результат зазначеного загального вирівнювання послідовності знаходиться у відсотковій ідентичності. Преважними параметрами, що застосовувались у FASTDB амінокислотному вирівнюванні, є: Матриця=РАМ 0, k-кратний=2, Вибракування несумісності=1, Вибракування поєднання=20, Довжина групи рандомізації=0, Бал обриву=1, Розмір вікна=довжина послідовності, Вибракування пробілу=5, Вибракування розміру пробілу=0.05, Розмір вікна=500 або довжина досліджуваної амінокислотної послідовності, яка б не була коротшою. [00105] Якщо досліджувана послідовність коротша, ніж задана послідовність через N- або Скінцеві делеції, не через внутрішні делеції, для результатів повинна бути зроблена корекція вручну. Це спостерігається тому, що програма FASTDB не розраховує для N- і С-кінцевих процесінгів досліджуваної послідовності при розрахунку загальної відсоткової ідентичності. Для досліджуваних пос 39 лідовностей, процесованих на N- і С-кінцях, що зв'язані з заданою послідовністю, відсоткова ідентичність виправлена розрахунком кількості залишків заданої послідовності, що є N- і С-кінцевими досліджуваними послідовностями, що не є відповідними/вирівняними з відповідним досліджуваним залишком, як відсоток повних основ заданої послідовності. Чи є залишок відповідним/вирівняним, досліджували за результатами FASTDB вирівнювання послідовності. Цей відсоток потім виділяли з відсоткової ідентичності, розраховувався вищеописаною програмою FASTDB, застосовуючи специфічні параметри для досягнення кінцевого балу відсоткової ідентичності. Цей кінцевий бал відсоткової ідентичності є тим, що застосовується для цілей даного винаходу. Тільки залишки N- і Скінців досліджуваної послідовності, що не є відповідними/вирівняними з заданою послідовністю, розглядаються для цілей регулювання вручну балу ідентичності. Це означає, що тільки заданий залишок розташований за межами самих крайніх N- і С-кінцевих залишків досліджуваної послідовності. [00106] Наприклад, 90 амінокислотний залишок досліджуваної послідовності є вирівняним із 100 залишком заданої послідовності для дослідження відсоткової ідентичності. Делеція, що спостерігається у N-кінці досліджуваної послідовності і, таким чином, FASTDB вирівнювання не показує відповідних/вирівняних перших 10 залишків на Nкінці. 10 непарних залишків представляють 10% послідовності (кількість залишків на N- і С- кінцях, що не є відповідними/загальна кількості залишків у заданій послідовності), так 10% відняли з балу відсоткової ідентичності, що розрахований програмою FASTDB. Якщо 90 залишків, що залишилися, повністю відповідали, кінцевий бал відсоткової ідентичності буде 90%. В іншому прикладі 90 залишків досліджуваної послідовності порівнюють зі 100 залишками заданої послідовності. Цього разу делеції є внутрішніми делеціями, таким чином нема жодних залишків у N- або С-кінцевій досліджуваній послідовності, що не є відповідною/вирівняною з заданою. У цьому випадку відсоткова ідентичність розрахована FASTDB, не коректувалась вручну. Ще раз, тільки зовнішні положення залишку N- і С-термінальних кінців досліджуваної послідовності, як показано у вирівнюванні FASTDB, що не є відповідною/вирівняною з заданою послідовністю, коректували вручну. Жодні інші корекції вручну не були зроблені для цілей даного винаходу. [0100] Як використовують в даному описі, нуклеїнова кислота, що "гібридизується при жорстких умовах" до послідовності нуклеїнової кислоти за даним винаходом, має відношення до полінуклеотиду, що гібридизується в інкубації протягом ночі при 42°С у розчині, що містить 50% формаміду, 5х SSC (750 мМ NaCl, 75 мМ цитрату натрію), 50 мМ фосфату натрію (pH 7,6), 5х розчину Денгхарта, 10% сульфату декстрану і 20 мкг/мл денатурованої, розщепленої ДНК сперми лосося, з наступним промиванням фільтрів у 0,1 SSC при приблизно 65°С. 95068 40 [0101] Як використовують в даному описі, вираз домен локалізації Гольджі відноситься до послідовності амінокислоти резидентного поліпептиду Гольджі, що є відповідальним за прикріплення поліпептиду у місцеположенні у межах комплексу Гольджі. В основному, домени локалізації містять амінокінцеві "хвости" ензиму. [0102] Як використовують в даному описі, вираз ефекторна функція відноситься до тих біологічних активностей, що мають відношення до Fcобласті (природна послідовність Fc-області або варіант послідовності амінокислоти Fc-області) антитіла. Приклади ефекторних функцій антитіла включають, але не обмежуються, спорідненість Fc-рецепторного зв'язування, антитіло-залежну клітинну цитотоксичність (ADCC), антитілозалежну клітинним фагоцитозом (ADCP), секрецією цитокіна, опосередкований імунокомплексом антиген, що поглинаються антигенпредставляючими клітинами, знижуючими регуляцію рецепторами поверхні клітини та ін. [0103] Як використовують в даному описі, вирази конструктор, сконструйований, той що конструює і інженерія шляхом глікотехнології включають будь-яку маніпуляцію глікозиляційного патерну природнього виникнення або рекомбінантного поліпептиду або його фрагменту. Інжененрія шляхом глікотехнології включає метаболічну інженерію механізму глікозиляції клітини, включаючи генетичні маніпуляції шляхів синтезу олігосахариду для досягнення зміненої глікозиляції глікопротеїнів, експресованих у клітинах. Більш того, інженерія шляхом глікотехнології включає ефекти мутацій і середовище клітини при глікозиляції. У одному варіанті, інженерія шляхом глікотехнології є зміною у активності глікозилтрансферази. В окремому варіанті, результати інженерії при зміненій активності глюкозамінілтрансферази і/або активності фукозилітрансферази. [0104] Як використовують в даному описі, вираз клітина-хазяїн розповсюджується на будь-яку клітинну систему, яка може бути сконструйована для генерування поліпептидів і антиген-зв'язуючих молекул за даним винаходом. У одному варіанті, клітина-хазяїн сконструйовона так, щоб дозволяти продукування антиген-зв'язуючої молекули з модифікованими глікоформами. У переважному варіанті, антиген-зв'язуюча молекула являє собою антитіло, фрагмент антитіла або протеїн злиття. У певних варіантах, клітини-хазяїни крім того проходять маніпуляції для експресування підвищених рівнів одного або більше поліпептидів, що мають GnTIII активність. Клітини-хазяїни містять культивовані клітини, наприклад, культивовані клітини ссавців, такі як СНО клітини, HEK293-EBNA клітини, ВНК клітини, NSO клітини, SP2/0 клітини, YO клітини мієломи, РЗХ63 мишачі клітини мієломи, PER клітини, PER.C6 клітини або клітини гібридоми, дріжджові клітини, клітини комах і рослинні клітини, названі тільки деякі, але також клітини включають в межах трансгенної тварини, трансгенної рослини або культивованої рослини або тканини тварини. [0105] Як використовують в даному описі, вираз Fc-опосередкована клітинна цитотоксичність 41 включає залежну від антитіла клітинну цитотоксичність і клітинну цитотоксичність, опосередковану розчинним Fc-протеїном злиття, що містить Fcобласть людини. Це є імунним механізмом, що призводить до лізису "клітин-мішеней антитіла" "імунними ефекторними клітинами людини", де: [0106] Імунні ефекторні клітини людини являють собою популяцію лейкоцитів, що показують Fc-рецептори на їхній поверхні, через яку вони зв'язуються з Fc-областю антитіла або Fcпротеїнами злиття і виконують ефекторні функції. Така популяція може включати, але не обмежується, периферичними кров'яними мононуклеарними клітинами (РВМС) і/або натуральними клітинамикілерами (NK). [0107] Клітини-мішені антитіла являють собою клітини, що зв'язані антитілами або Fc-протеїнами злиття, антитіла або Fc-протеїни злиття зв'язуються з клітинами-мішенями через частину Nтермального протеїна до Fc-області. [0108] Як використовують в даному описі, вираз підвищена Fc-опосередкована клітинна цитотоксичність визначається або як підвищення кількості "клітин-мішеней антитіла", які лізовані у даний час при даній концентрації антитіла або Fcпротеїна злиття у середовищі, що навколо клітинмішеней механізмом Fc-опосередкованої клітинної цитотоксичності, що визначена вище, і/або як зниження концентрації антитіла або Fc-протеїна злиття у середовищі, що навколо клітин-мішеней, необхідне для досягнення лізису даної кількості "клітин-мішеней антитіла" у даний час механізмом Fc-опосередкованої клітинної цитотоксичності. Підвищення Fc-опосередкованої клітинної цитотоксичності має відношення до клітинної цитотоксичності, опосередкованій тим самим антитілом або Fc-протеїном злиття, що продукуються тим самим типом клітин-хазяїнів, застосовуючи однакове стандартне виробництво, очищення, формуляцію і способи зберігання, які відомі спеціалістам даної області техніки, але що не були продуковані клітинами-хазяїнами, сконструйованими для експресування глікозилтрансферази GnTIII способами, що описані тут. [0109] Антитілом, що має підвищену залежну від антитіла клітинну цитотоксичність (ADCC) що означало антитіло, як вираз, що визначений у даному описі, який підвищує ADCC як досліджувалось будь-яким підходящим способом спеціалістами даної області техніки. Один прийнятний in vitro ADCC являє собою наступне: 1) аналіз, де застосовувались клітини-мішені, що відомі як такі, що експресують мішенний антиген, що розпізнається антиген-зв'язуючою областю антитіла; 2) аналіз, де застосовувались людські периферичні мононуклеарні клітини крові (PBMCs), ізольовані від крові, навмання вибраний здоровий донор як ефекторні клітини; 3) аналіз проводять згідно з наступним протоколом: і) РВМС (мононуклеари периферичної крові) є ізольованими, застосовуючи стандартні процедури 6 центрифугування густини і суспедовані у 5 10 95068 42 клітини/мл у RPMI (вказівник числа оборотів за хвилину) культуральному середовищі клітини; іі) клітини-мішені, вирощені стандартними тканевими культуральними методами, зібрані з експоненціальної фази росту з життєздатністю вище, ніж 90%, промиті у RPMI культуральному середовищі клітини, мічені 100 мікро-Кюрі 51Ки, двічі промиті культуральним середовищем клітини і пересуспендовані у культуральному середовищі клітини при густині 105 клітини/мл; ііі) 100 мікролітрів останньої вищеописаної мішенної клітинної суспензії передано кожній лунці 96-лунковому титраційному планшету; iv) антитіло є послідовно-розбавленим від 4000 нг/мл до 0,04 нг/мл у культуральному середовищі клітини і 50 мікролітрів отриманих розчинів антитіла додали до клітин-мішеней у 96-лунковому титраційному планшеті, тестуючи в трьох паралелях різні концентрації антитіл, покриваючи весь концентраційний діапазон; ν) для контролів максимального вивільнення (MR), 3 додаткові лунки планшету, що містили мічені клітини-мішені, отримали 50 мікролітрів 2% (в/в) водного розчину неіонного детергенту (Nonidet, Sigma, St. Louis) замість розчину антитіла (пункт іν вище); vi) для контролів спонтанного вивільнення (SR), додаткові лунки планшету, що містили мічені клітини-мішені, отримали 50 мікролітрів RPMI культурального середовища клітини замість розчину антитіла (пункт iv вище); vii) 96-лунковий мікротитрувальний планшет потім центрифугували 50 g протягом 1 хвилини і інкубували протягом 1 години при 4°С; viii) 50 мікролітрів суспензії РВМС (пункт і вище) додали до кожної лунки до отримання відношення ефектор : клітини-мішені 25:1, і планшети помістили у інкубатор у атмосферу 5% СО2 при 37°С на 4 години; іх) безклітинний супернатант зібраний з кожної лунки і експериментально вивільнена радіоактивність (ER) є кількісною, застосовуючи лічильник гамма-частинок; х) відсоток специфічного лізису розрахований для кожної концентрації антитіла за формулою (ER-MR)/(MR-SR) 100, де ER являє собою середнє значення радіоактивності, розрахованого (див. пункт іх вище) для даної концентрації антитіла, MR являє собою середнє значення радіоактивності, розрахованої (див. пункт іх вище) для контролів MR (див. пункт ν вище) і являє собою середнє значення радіоактивності, розрахованої (див. пункт іх вище) для контролів SR (див. пункт vi вище); 4) "підвищена ADCC" визначений або як підвищення максимального відсотку специфічного лізису, що досліджувався у межах ряду концентрації антитіла, перевіреної вище, і/або як зниження концентрації антитіла, необхідного для досягнення половини максимального відсотку специфічного лізису, що досліджувався у межах ряду концентрації антитіла, перевіреної вище. Підвищення ADCC відносно ADCC, виміряної аналізом, описаним вище, опосередковується тим самим антитілом, що продукується тим самим типом клітинхазяїнів, застосовуючи те саме стандартне вироб 43 ництво, очищення, формуляцію і способи зберігання, що відомі спеціалістам даної області, але не було продуковано клітинами-хазяїнами, сконструйованими для надекспресії GnTIIL [0110] В одному аспекті даний винахід відноситься до антиген-зв'язуючих молекул, що мають зв'язуючу специфічність щура ICR62 (наприклад, зв'язує головним чином з тим самим епітопом), і до відкриття, що їхні ефекторні функції можуть збільшуватись зміненою глікозиляцією. В одному варіанті антиген-зв'язуюча молекула являє собою химерне антитіло. У переважному варіанті винахід направлений на химерне антитіло або на його фрагмент, що містить один або більше (наприклад, один, два, три, чотири, п'ять або шість) CDR будь-якого з SEQ ID NO:53-108 і/або SEQ ID NO: 122-127. Специфічно, у переважному варіанті винахід направлений на ізольований полінуклеотид, що містить: (а) послідовність, вибрану з групи, що складається з: SEQ ID NO:54 SEQ ID NO:56, SEQ ID NO:58, SEQ ID NO:60, SEQ ID NO:62, SEQ ID NO:64, SEQ ID NO:66, SEQ ID NO:68, SEQ ID NO:70, SEQ ID NO:72, SEQ ID NO:74, SEQ ID NO:122 і SEQ ID NO: 124; (b) послідовність, вибрану з групи, що складається з: SEQ ID NO:76, SEQ ID NO:78, SEQ ID NO:80, SEQ ID NO:82, SEQ ID NO:84, SEQ ID NO:86, SEQ ID NO:88, SEQ ID NO:90, SEQ ID NO:92, SEQ ID NO:94, SEQ ID NO:96, SEQ ID NO:98, SEQ ID NO:100, SEQ ID NO:102, SEQ ID NO:104, SEQ ID NO:106 і SEQ ID NO:126; і (с) SEQ ID NO:108. В іншому переважному варіанті винахід направлений на ізольований полінуклеотид, що містить (а) послідовність, вибрану з групи, що складається з SEQ ID NO: 112 і SEQ ID NO:114; (b) послідовність, вибрану з групи, що складається з SEQ ID NO: 116 і SEQ ID NO: 118; і (с) SEQ ID NO: 119. У одному варіанті будьякий з даних полінуклеотидів кодує поліпептид злиття. [0111 В іншому варіанті антиген-зв'язуюча молекула містить VH домен антитіла щура ICR62, кодованого SEQ ID NO:1 або SEQ ID NO:2 або їхніми варіантами; і не мишачий поліпептид. В іншому переважному варіанті винахід направлений на антиген-зв'язуючу молекулу, що містить VL домен антитіла щура, кодованого SEQ ID NO:43 або SEQ ID NO: або їхніми варіантами; і не мишачий поліпептид. [0112] У іншому аспекті винахід направлений на антиген-зв'язуючі молекули, що містять один або більше (наприклад, один, два, три, чотири, п'ять або шість) процесованих CDR ICR62. Такі процесовані CDR буде містити, як мінімум, залишки амінокислоти, що визначають специфіку для даного CDR. "Залишком, що визначає специфіку" значаться ті залишки, що прямо включені у взаємодію з антигеном. Взагалі, тільки одна п'ята до однієї третьої залишків у даному CDR приймає участь у зв'язуванні з антигеном. Залишки, що визначають специфіку в окремому CDR можуть бути визначеними, наприклад, визначенням міжатомних контактів від тримірного моделювання і дослідження варіабельності послідовності у даному положенні залишку згідно зі способами, описаними з Padlan et al., FASEB J. P(7j:133-139 (1995), зміст 95068 44 якого, тим самим, об'єднаний посиланням у повному обсязі. [0113] Відповідно, даний винахід також направлений на ізольований полінуклеотид, що містить, щонайменше, одну (наприклад, одну, дві, три, чотири, п'ять або шість) гіперваріабельних областей антитіла ICR62 щура або варіант або його процесовану форму, що містить, щонайменше, залишки, що визначають специфіку для зазначеної гіперваріабельної області, де зазначений ізольований полінуклеотид кодує поліпептид злиття. Переважно, такі ізольовані полінуклеотиди кодують поліпептид злиття, а саме антиген-зв'язуючу молекулу. У одному варіанті полінуклеотид містить три гіперваріабельні області антитіла ICR62 щура або варіанти або його процесовані форми, що містять, щонайменше, залишки, що визначають специфіку для кожної з зазначених трьох гіперваріабельних областей. У одному варіанті полінуклеотид містить, щонайменше, один з CDR, сформульованих у таблицях 2-5, що нижче. У іншому варіанті полінуклеотид кодує всю варіабельну область короткого або довгого ланцюга химерного (наприклад, гуманізованого) антитіла. Даний винахід, крім того, направлений на поліпептиди, що кодовані такими полінуклеотидами. [0114] У іншому варіанті винахід направлений на антиген-зв'язуючу молекулу, що містить, щонайменше, одну (наприклад, одну, дві, три, чотири, п'ять або шість) гіперваріабельну область антитіла ICR62 щура або варіант або його процесовану форму, містить, щонайменше, залишки, що визначають специфіку для кожної з зазначених гіперваріабельних областей і містить послідовність, отриману з гетерогенного поліпептиду. У одному варіанті антиген-зв'язуюча молекула містить три гіперваріабельні області антитіла ICR62 щура або варіанти або його процесовані форми, що містять, щонайменше, залишки, що визначають специфіку для кожної з зазначених трьох гіперваріабельних областей. У одному варіанті антиген-зв'язуюча молекула містить, щонайменше, один з CDR, сформульованих у таблицях 2-5, що нижче. У іншому аспекті антиген-зв'язуюча молекула містить варіабельну область антитіла короткого або довгого ланцюга. У одному, варіанті, що застосовується окремо, антиген-зв'язуюча молекула являє собою химерне, наприклад, гуманізоване, антитіло. Даний винахід також направлений на способи утворень таких антиген-зв'язуючих молекул і їх застосування при лікуванні захворювання, зокрема порушень клітинної проліферації, де EGFR є експресований, зокрема, де EGFR є надмірно експресований (наприклад, надекспресований) у порівнянні з нормальною тканиною того самого клітинного типу. Такі порушення включають, але не обмежуються раком крові, мозку, голови та шиї, підшлункової залози, легень, молочної залози, яєчника, прямої кишки, простати, шкіри і нирки. Експресовані рівні EGFR можуть бути досліджені способами, відомими у техніці і описаними у даному описі (наприклад, шляхом імуногістохімічного аналізу, імунофлуоресцентним аналізом, імуноензимним аналізом, ELISA, проточною цитометрією, 45 95068 радіоімунним аналізом, Вестерн блотом, зв'язуванням ліганд, активністю кінази, та ін.). [0115] Даний винахід також направлений на спосіб для ураження in vivo або in vitro клітин, експресуючих EGFR. Клітини, що експресують EGFR можуть бути уражені для терапевтичних цілей (наприклад, лікувати порушення, що лікуються перериванням EGFR-опосередкованої подачі сигналів, наприклад блокуванням зв'язування ліганд або ураженням EGFR-експресуючих клітин для деструкції імунної системи). У одному варіанті даний винахід направлений на спосіб для ураження клітин, експресуючих EGFR у суб'єкта, що містить введення суб'єкту композиції, що містить АВМ за даним винаходом. Клітини, що експресують EGFR, можуть також бути ураженими для діагностичних цілей (наприклад, досліджувати, якщо вони екс 46 пресуючі EGFR, або нормально, або надмірно). Таким чином, даний винахід також направлений на способи для визначення присутності EGFR або клітини, експресуючої EGFR або in vivo або in vitro. Один спосіб для визначення EGFR експресії за даним винаходом включає контакт зі зразком, який буде перевірений, необов'язково з контрольним зразком, з АВМ даного винаходу при умовах, що дозволяють формування комплексу між АВМ і EGFR. Потім визначається формування комплексу (наприклад, ELISA або іншими способами, відомим у техніці). Застосовуючи контрольний зразок з досліджувальним зразком, будь-яка статистично суттєва різниця у формування ABM-EGFR комплексів, порівнюючи тестовий і контрольний зразки, вказує на присутність EGFR у досліджувальному зразку. Таблиця 2 CDR Довгий ланцюг CDR 1 Kabat Chothia AbM Довгий ланцюг CDR 2 Kabat Послідовність нуклеотиду GACTACAAGATACAC GACTACGCCATCAGC GACTACTATATGCAC GACTACAAGATATCC GGTTTTACATTCACTGACTAC GGTTACACATTCACTGACTAC GGTTATTCATTCACTGACTAC GGTTTTACATTCACTGACTACAAGATACAC GGTTTTACATTCACTGACTACGCCATCAGC GGTTTTACATTCACTGACTACTATATGCAC GGTTACACATTCACTGACTACTATATGCAC GGTTATTCATTCACTGACTACAAGATACAC GGTTTCACATTCACTGACTACAAGATATCC TATTTTAATCCTAACAGTGGTTATAGTACCTA CAATGAAAAGTTCAAGAGC GGGATCAATCCTAACAGTGGTTATAGTACCTA CGCACAGAAGTTCCAGGGC TATTTCAACCCTAACAGCGGTTATAGTACCTA CGCACAGAAGTTCCAGGGC TGGATCAATCCTAACAGTGGTTATAGTACCTA CGCACAGAAGTTTCAGGGC TGGATCAATCCTAACAGTGGTTATAGTACCTA CAGCCCAAGCTTCCAAGGC SEQ ID NO 54 56 58 122 60 62 64 66 68 70 72 74 124 76 78 80 82 84 47 95068 48 Продовження таблиці 2 Довгий ланцюг CDR3 TGGATCAATCCTAACAGTGGTTATAGTACCTA CAACGAGAAGTTCCAAGGC TATTTCAACCCTAACAGCGGTTATTCGAACTA CGCACAGAAGTTCCAGGGC TATTTCAACCCTAACAGCGGTTATGCCACGTA CGCACAGAAGTTCCAGGGC TACTTCAATCCTAACAGTGGTTATAGTACCTA Chothia CAGCCCAAGCTTCCAAGGC AATCCTAACAGTGGTTATAGTACC AACCCTAACAGCGGTTATTCGAAC AACCCTAACAGCGGTTATGCCACG AbM TATTTTAATCCTAACAGTGGTTATAGTACC GGGATCAATCCTAACAGTGGTTATAGTACC TGGATCAATCCTAACAGTGGTTATAGTACC TATTTCAACCCTAACAGCGGTTATTCGAAC TATTTCAACCCTAACAGCGGTTATGCCACG Kabat Chothia AbM CTATCCCCAGGCGGTTACTATGTTATGGATGCС 86 88 90 126 92 94 96 98 100 102 104 106 108 Таблиця 3 CDR Довгий ланцюг CDR 1 Kabat Chothia AbM Довгий ланцюг CDR 2 Kabat Chothia AbM Довгий ланцюг CDR3 Kabat Chothia AbM Послідовність амінокислоти DYKIN DYAIS DYYMH DYKIS GFTFTDY GYTFTDY GYSFTDY GFTFTDYKIH GFTFTDYAIS GFTFTDYYMH GYTFTDYYMH GYSFTDYKIH GFTFTDYKIS YFNPNSGYSTYNEKFKS GINPNSGYSTYAQKFQG YFNPNSGYSTYAQKFQG WINPNSGYSTYAQKFQG WINPNSGYSTYSPSFQG WINPNSGYSTYNEKFQG YFNPNSGYSNYAQKFQG YFNPNSGYATYAQKFQG YFNPNSGYSTYSPSFQG NPNSGYST NPNSGYSN NPNSGYAT YFNPNSGYST GINPNSGYST WINPNSGYST YFNPNSGYSN YFNPNSGYAT LSPGGYYVMDA SEQ ID NO 53 55 57 123 59 61 63 65 67 69 71 73 125 75 77 79 81 83 85 87 89 127 91 93 95 97 99 101 103 105 107 49 95068 50 Таблиця 4 CDR Короткий ланцюг CDR1 (Kabat) Короткий ланцюг CDR2 (Kaba)t Короткий ланцюг CDR3 (Kabat) Послідовність амінокислоти KASQNINNYLN RASQGINNYLN NTNNLQT LQHNSFPT SEQ ID NO 111 113 115 117 Таблиця 5 CDR Короткий ланцюг CDR1 (Kabat) Короткий ланцюг CDR2 (Kabat) Короткий ланцюг CDR3 (Kabat) Послідовність нуклеотиду AAAGCAAGTCAGAATATTAACAATTACTTAAAC CGGGCAAGTCAGGGCATTAACAATTACTTAAAT AATACAAACAATTTGCAAACA AATACCAACAACTTGCAGACA TTGCAGCATAATAGTTTTCCCACG [0116] Відомо, що деякі механізми включені у терапевтичну ефективність анти-EGFR антитіла, включаючи блокування ліганда (наприклад, EGF, TGF-α, та ін.) зв'язування з EGFR і наступну активацію сигнальних шляхів, залежної від антитіла клітинну цитотоксичність (ADCC) і індукцію блоку росту або термінального диференціювання. [0117] Моноклональне антитіло ICR62 щура (IgG2b) обговорювалось у РСТ публікації No. WO95/20045, що включена у даний опис посиланням у повному обсязі. Це було направлено на епітоп С EGFR і, було показано, для інгібування зв'язування ліганда, інгібування росту in vitro лускатої клітини карциноми, що експресує EGFR, і індукування регресії ксенотрансплантантів пухлин у "голих" мишей (WO95/20045; Modjtahedi et al., Вr. J. Cancer 73:228-235 (1996)). Як повне антитіло гризуна, введення моноклонального антитіла ICR62 щура людини призводить до HARA відповіді і деяких пацієнтів з наступною, навіть, єдиною дозою. (WO95/20045; Modjtahedi et al., Br. J. Cancer 73:228-235 (1996)). [0118] Були описані химерні антитіла миші/людини. Див., наприклад, Morrison, S. L. et al., PNAS 11:6851-6854 (November 1984); European Patent Publication No. 173494; Boulianna, G. L, et al., Nature 312:642 (December 1984); Neubeiger, Μ. S. et al., Nature 314:268 (March 1985); European Patent Publication No. 125023; Tan et al., J. Іmmunol. 135:8564 (November 1985); Sun, L. К et al., Hybridoma 5(1):517 (1986); Sahagan et al., J. Іmmunol. 137:1066-1074 (1986). Див. взагалі, Muron, Nature 312:597 (December 1984); Dickson, Genetic Engineering News 5(3) (March 1985); Marx, Science 229:455 (August 1985); і Morrison, Science 229:1202- 1207 (September 1985). IMC-C225 (Erbitux®, Imclone) є химерне моноклональне антитіло, направлене проти EGFR і що має варіабельну область миші і константну область людини (Див. Herbst and Shin, Cancer 94: 1593-1611 (2002)). Мишача порція EVIC-225 походить від М225, який, як було з'ясовано, зв'язує EGFR і інгібує фосфорилювання EGF-індукованого залежного від тирозинкінази, а також включаючи апоптоз ліній клітини пухлини надекспресуючого EGFR SEQ ID NO 112 114 116 118 119 (Herbst and Shin, Cancer 94: 1593-1611 (2002)). Однак, M225 викликав НАМА реакцію у пацієнтів, що лікувались з антитілом у І фазі клінічних випробувань (Herbst and Shin, Cancer 94: 1593-1611 (2002)). EMC-225 тестувався in vivo і in vitro, і застосовувався у комбінації з променевою терапією і хіміотерапією при великій кількості типів пухлин, включаючи ті, що асоційовані з неблагоприємними прогнозами (Herbst and Shin, Cancer 94: 1593-1611 (2002)). Однак, МС-225 асоційований з токсичностями, такими як алергічні реакції і реакції шкіри у пацієнтів, яким введено ІМС-225 антитіло при клінічних випробуваннях (Herbst and Shin, Cancer 94: 1593-1611 (2002)). [0119] В окремо переважному варіанті химерна АВМ за даним винаходом являє собою гуманізоване антитіло. Способи для гуманізації не людських антитіл відомі у техніці. Наприклад, гуманізовані АВМ за даним винаходом можуть бути отримані згідно способам, описаним у патенті США № 5225539 Winter, патенті США № 6180370 Queen та ін., патенті США № 6632927 Adair та ін. або у заявці патента США № 2003/0039649 Foote, весь зміст кожного з яких у даному описі об'єднані посилланням у повному обсязі. Переважно гуманізоване антитіло має один або більше залишків амінокислоти, що введені в нього з джерела, що є людським. Ці не людські амінокислотні залишки часто згадуються як "імпортні" залишки, які звичайно взяті від "імпортного" варіабельного домену. Гуманізація може бути головним чином виконана наступним способом Winter і співробітників (Jones et al., Nature, 321:522-525 (1986); Riechmann et al., Nature, 332:323-327 (1988); Verhoeyen et al., Science, 239:1534-1536 (1988)), заміщенням послідовностей гіперваріабельної області відповідними послідовностями людського антитіла. Відповідно, такі "гуманізовані" антитіла являють собою химерні антитіла (патент США № 4816567), де суттєво менший, ніж інтактний людський варіабельний домен був заміщений відповідною послідовністю не людських зразків. У практиці гуманізовані антитіла є типово людськими антитілами, у яких деякі залишки гіперваріабельної області і, можливо, деякі FR-залишки заміщені залишками з аналогіч 51 них ділянок у антитілах гризуна. Гуманізовані антиEGFR антитіла суб'єкта будуть містити константні області людського імуноглобуліну. Вибір людських варіабельних доменів, і коротких, і довгих, для застосування при утворенні гуманізованих антитіл є дуже важливим для зниження антигенності. Згідно з так названим "найкраще відповідним" способом, послідовність варіабельного домену антитіла гризуна екранована проти повної бібліотеки відомих послідовностей варіабельного домену людини. Людська послідовність, яка є найближчою до тієї, що у гризуна, потім приймається як область структури людини (FR) для гуманізованого антитіла (Sims et al., J. Іmmunol., 151:2296 (1993); Chothia et al., J. Mol. Biol, 196:901 (1987)). Інший спосіб вибору послідовності людської структури являє собою порівняння послідовності кожної індивідуальної підобласті всієї структури гризуна (тобто, FR1, FR2, FR3 і FR4) або деякої комбінації індивідуальних підобластей (наприклад, FR1 і FR2) з бібліотекою відомих послідовностей варіабельної області людини, що відповідає тій підобласті структури (наприклад, як досліджувалось нумерацією Kabat), і вибір послідовності людини для кожної підобласті або комбінації, яка є ближчою до тієї, що у гризуна (Leung, заявка на патент США № 2003/0040606А1, опублікована 27.02.2003) (повний зміст якої, таким чином, об'єднаний посиланням). Інший спосіб застосовує окрему область структури, що походить з консенсусної послідовності усіх антитіл людини окремих підобластей коротких або довгих ланцюгів. Ті самі структури можуть застосовуватись для декількох різних гуманізованих антитіл (Carter et al., Proc. Natl. Acad. Sсi. USA, 89:4285 (1992); Presta et al., J. Іmmunol., 151:2623 (1993)) (повний зміст кожного з яких тут об'єднаний посиланням). 95068 52 [0121] Крім того, важливо, що антитіла будуть гуманізовані з утриманням високої спорідненості до антигену і інших благоприємних біологічних властивостей. Для досягнення цієї мети за переважним способом, гуманізовані антитіла отримані способом аналізу парентеральних послідовностей і різних концептуальних гуманізованих продуктів, застосовуючи тривимірні моделі парентеральних і гуманізованих послідовностей. Тривимірні моделі імуноглобуліну можуть бути згенеровані, застосовуючи комп'ютерні програми, що відомі спеціалістам даної області техніки (наприклад, Insightll, Accelrys, Inc. (formerly MSI), або http://swissmodel.expasy.org). Ці комп'ютерні програми можуть ілюструвати і показати кандидатні тривимірні конформаційні структури вибраних можливих послідовностей імуноглобуліна. Огляд даних появів дозволяє аналіз можливої ролі залишків у функціонуванні кандидатної послідовності імуноглобуліну, тобто аналіз залишків, що впливають на здатність кандидатного імуноглобуліну зв'язувати свій антиген. Таким чином, FR-залишки можуть бути вибрані і комбіновані з реціпієнтних і імпортних послідовностей таким чином, щоб була досягнута необхідна характеристика антитіла, наприклад, підвищенням спорідненості до мішенного антигену (антигенів). Взагалі, залишки гіперваріабельної області безпосередньо і більш головним чином включені до впливу на зв'язування антигену. [0122] В одному ваіанті антитіла за даним винаходом містять Fc-область людини. У специфічному варіанті константна область людини являє собою IgG1, як сформульовано у SEQ ID NO 109 і 110 сформульовано нижче: IgG1 послідовність нуклеотиду (SEQ ID NO:110) 53 95068 54 IgG1 послідовність амінокислоти (SEQ ID NO: 109) [0123] Однак, варіанти і ізоформи Fc-області людини також охоплені у даному винаході. Наприклад, варіант Fc-областей, що підходять для застосування у даному винаході, може бути отриманий за способами, що обговорювались у патенті США № 6737056 Presta (варіанти Fc-області зі зміненою ефекторною функцією внаслідок однієї або більше модифікацій амінокислоти); або у заявці на патент США № 60/439498; 60/456041; 60/514549; або WO 2004/063351 (варіант Fcобластей з підвищеною спорідненостю зв'язування внаслідок модифікації амінокислоти); або у заявці на патент США № 10/672280 або WO 2004/099249 (Fc варіанти зі зміненим зв'язуванням з FcR внаслідок модифікації амінокислоти), зміст кожного з яких у даному описі об'єднаний посиланням у повному обсязі. [0124] У іншому варіанті антиген-зв'язуючі молекули за даним винаходом сконструйовані для збільшення спорідненості зв'язування згідно з, наприклад, способами, розкритими у заявці на патент США № 2004/0132066 Balint та ін., весь зміст якої, тим самим, об'єднаний посиланням у повному обсязі. [0125] У одному варіанті антиген-зв'язуюча молекула за даним винаходом кон'югована до додаткової частини, такої як радіоізотопна мітка або токсин. Такі кон'юговані АВМ можуть отримуватись великою кількість способів, що добре відомі у техніці. [0126] Різні радіонукліди підходять до даного винаходу, і спеціалісти даної області здатні швидко визначити, який радіонуклід є більш відповідним 131 під різновидом обставин. Наприклад, йод є добре відомим радіонуклідом, застосовується для наміченої імунотерапії. Однак, клінічна придатність 131 йоду може бути обмеженою декількома факторами, включаючи: восьмиденний фізичний період напіврозпаду; дегалогенізація йодованого антитіла і у крові, і у ділянках пухлини; особливості емісії (наприклад, великий гама-компонент), який може бути субоптимальним для зміщення дози, локалізованої у пухлині. З появою хелатних агентів високої якості, можливість для прикріплення металевих хелатних груп до протеїнів підвищує можливість 111 застосовувати інші радіонукліди, такі як індій і 90 90 ітрій. Ітрій забезпечує декілька переваг для застосування у радіоімунотерапевтичних введен90 нях: 64-годинний період напіврозпаду ітрію достатньо довгий, щоб дозволити акумуляцію антиті131 ла пухлиною і, несхоже до, наприклад, йоду, 90 ітрію, являє собою чистий бета-випромінювач високої енергії без супроводження гамма випромінювання при його розпаді в діапазоні в тканині 100 - 1000 діаметрів клітини. Більш того, мінімальна кількість проникаючої радіації перед90 бачає амбулаторне введення ітрій- мічені антитіла. Додатково, інтерналізація міченого антитіла не бажана для усунення клітини, і локальна емісія іонізаційної радіації повинна бути летальною для суміжних клітин пухлини, що відчувають нестачу мішенного антигену. [0127] Ефективні разові дозування обробки 90 (тобто, терапевтично ефективні кількості) ітріймічених анти-EGFR антитіл у діапазоні приблизно між 5 і приблизно 75 мКі, більш переважно приблизно між 10 і приблизно 40 мКі. Ефективна разова обробка не руйнуючими дозами іонізуючого 131 випромінювання для кісткового мозку йодмічених анти-EGFR антитіл у діапазоні приблизно між 5 і приблизно 70 мКі, більш переважно приблизно між 5 і приблизно 40 мКі. Ефективна разова обробка руйнуючими дозами іонізуючого випромінювання (тобто, може вимагати аналогічну пере131 садку кісткового мозку) йод-мічених анти-EGFR антитіл у діапазоні приблизно між 30 і приблизно 600 мКі, більш переважно приблизно між 50 і менш, ніж приблизно 500 мКі. У об'єднанні з химерним анти-EGFR антитілом, внаслідок довгого розповсюдження періоду напіврозпаду у відношенні до мишачих антитіл, ефективна разова обробка не руйнуючими дозами іонізуючого випромі131 нювання для кісткового мозку йод-мічених химерних анти-EGFR антитіл у діапазоні приблизно між 5 і приблизно 40 мКі, більш переважно менше, ніж приблизно 30 мКі. Відображення критеріїв 111 для, наприклад, індій-міченого, звичайно менше, ніж приблизно 5 мКі. [0128] Відносно радіоізотопної мітки антиEGFR антитіл, терапія, до того ж, може також виникнути, застосовуючи разове терапевтичне застосування або застосовуючи багаторазові застосування для лікування. Через компонент радіонукліда, переважним є те, що до лікування, периферійні стовбурові клітини ("PSC") або кістковий мозок ("ВМ") були "зібрані" для пацієнтів, що перенесли потенційно фатальну токсичність кісткового мозку, спричинену радіацією. ВМ і/або PSC зібрали, застосовуючи стандартні технології, і потім очищені і заморожені для можливої реінфузії. До того ж, це більш переважно, до лікування на пацієнті проводять діагностичне дозиметричне дослідження, застосовуючи діагностичне помічене 111 антитіло (наприклад, застосовуючи індій), метою чого є впевненість, що терапевтично мічене анти90 тіло (наприклад, застосовуючи ітрій) не буде 55 95068 становитися надлишково "концентрованим" у будь-якому нормальному органі чи тканині. [0129] У переважному варіанті даний винахід направлений на ізольований полінуклеотид, що містить послідовність, яка кодує поліпептид, що має послідовність амінокислоти у таблиці 7 нижче. У переважному варіанті на ізольований полінуклеотид, що містить послідовність, показану у таблиці 6 нижче. Винахід, крім того, направлений на ізольовану нуклеїнову кислоту, що містить послідовність, щонайменше, 80%, 85%, 90%, 95%, 96%, 97%, 98% або 99% ідентичну послідовністі нуклео 56 тида, показаного у таблиці 6 нижче. У іншому варіанті даний винахід направлений на ізольовану нуклеїнову кислоту, що містить послідовність, яка кодує поліпептид, що має послідовність амінокислоти, щонайменше, 80%, 85%, 90%, 95%, 96%, 97%, 98% або 99% ідентичної до послідовності амінокислоти у таблиці 7. Винахід також охоплює ізольовану нуклеїнову кислоту, що містить послідовність, що кодує поліпептид, який має послідовність будь-якої амінокилоти, що сконструйовано у таблиці 7 з консервативними замісниками амінокислоти. Таблиця 6 Конструкт ICR62 VH І-ННА 1-HHB I-HHC Послідовність нуклеотиду CAGGTCAACCTACTGCAGTCTGGGGCTGCACTGGT GAAGCCTGGGGCCTCTGTGAAGTTGTCTTGCAAAG GTTCTGGTTTTACATTCACTGACTACAAGATACAC TGGGTGAAGCAGAGTCATGGAAAGAGCCTTGAGT GGATTGGGTATTTTAATCCTAACAGTGGTTATAGT ACCTACAATGAAAAGTTCAAGAGCAAGGCCACAT TGACTGCAGACAAATCCACCGATACAGCCTATATG GAGCTTACCAGTCTGACATCTGAGGACTCTGCAAC CTATTACTGTACAAGACTATCCCCAGGGGGTTACT ATGTTATGGATGCCTGGGGTCAAGGAGCTTCAGTC ACTGTCTCCTC CAGGTGCAGCTGGTGCAGTCTGGGGCTGAGGTGA AGAAGCCTGGGTCCTCGGTGAAGGTCTCCTGCAAG GCTTCTGGATTTACATTCACTGACTACGCCATCAG CTGGGTGCGACAGGCCCCTGGACAAGGGCTCGAG TGGATGGGAGGGATCAATCCTAACAGTGGTTATAG TACCTACGCACAGAAGTTCCAGGGCAGGGTCACC ATTACCGCGGACAAATCCACGAGCACAGCCTACAT GGAGCTGAGCAGCCTGAGATCTGAGGACACGGCC GTGTATTACTGTGCGAGACTATCCCCAGGCGGTTA CTATGTTATGGATGCCTGGGGCCAAGGGACCACCG TGACCGTCTCCTCA CAGGTGCAGCTGGTGCAGTCTGGGGCTGAGGTGA AGAAGCCTGGGTCCTCGGTGAAGGTCTCCTGCAAG GGTTCTGGTTTTACATTCACTGACTACAAGATACA CTGGGTGCGACAGGCCCCTGGACAAGGGCTCGAG TGGATGGGATATTTCAACCCTAACAGCGGTTATAG TACCTACGCACAGAAGTTCCAGGGCAGGGTCACC ATTACCGCGGACAAATCCACGAGCACAGCCTACAT GGAGCTGAGCAGCCTGAGATCTGAGGACACGGCC GTGTATTACTGTGCGAGACTATCCCCAGGCGGTTA CTATGTTATGGATGCCTGGGGCCAAGGGACCACCG TGACCGTCTCCTCA CAGGTGCAGCTGGTGCAGTCTGGGGCTGAGGTGA AGAAGCCTGGGTCCTCGGTGAAGGTCTCCTGCAAG GGTTCTGGTTTTACATTCACTGACTACAAGATACA CTGGGTGCGACAGGCCCCTGGACAAGGGCTCGAG TGGATGGGATATTTCAACCCTAACAGCGGTTATAG TACCTACAATGAAAAGTTCAAGAGCAGGGTCACC ATTACCGCGGACAAATCCACGAGCACAGCCTACAT GGAGCTGAGCAGCCTGAGATCTGAGGACACGGCC GTGTATTACTGTGCGAGACTATCCCCAGGCGGTTA CTATGTTATGGATGCCTGGGGCCAAGGGACCACCG TGACCGTCTCCTCA SEQ ID NO 2 4 6 8 57 95068 58 Продовження таблиці 6 I-HLA I-HLB I-HLC I-HHD I-HHE CAGGTGCAGCTGGTGCAGTCTGGGGCTGAGGTGA AGAAGCCTGGGGCCTCGGTGAAGGTCTCCTGCAA GGCCTCTGGTTTTACATTCACTGACTACTATATGCA CTGGGTGCGACAGGCCCCTGGACAAGGGCTCGAG TGGATGGGCTGGATCAATCCTAACAGTGGTTATAG TACCTACGCACAGAAGTTTCAGGGCAGGGTCACCA TGACCGCCGACACGTCCATCAGCACAGCCTACATG GAGCTGAGCAGGCTGAGATCTGACGACACGGCCG TGTATTACTGTGCGAGACTATCCCCAGGCGGTTAC TATGTTATGGATGCCTGGGGCCAAGGGACCACCGT GACCGTCTCCTCA CAGGTGCAGCTGGTGCAGTCTGGGGCTGAGGTGA AGAAGCCTGGAGCCTCGGTGAAGGTCTCCTGCAA GGGTTCTGGTTTTACATTCACTGACTACAAGATCC ACTGGGTGCGACAGGCCCCTGGACAAGGGCTCGA GTGGATGGGATACTTCAACCCTAACAGCGGTTATA GTACCTACGCACAGAAGTTCCAGGGCAGGGTCAC CATGACCGCCGACACGTCCATCAGCACAGCCTACA TGGAGCTGAGCAGGCTGAGATCTGACGACACGGC CGTGTATTACTGTGCGAGACTATCCCCAGGCGGTT ACTATGTTATGGATGCCTGGGGCCAAGGGACCACC GTGACCGTCTCCTCA CAGGTGCAGCTGGTGCAGTCTGGGGCTGAGGTGA AGAAGCCTGGAGCCTCAGTGAAGGTCTCCTGCAA GGGTTCTGGTTTTACATTCACTGACTACAAGATCC ACTGGGTGCGACAGGCCCCTGGACAAGGGCTCGA GTGGATGGGATACTTCAACCCTAACAGCGGTTACA GTACTTACAACGAGAAGTTCAAGAGCCGGGTCAC CATGACCGCCGACACGTCCATCAGCACAGCCTACA TGGAGCTGAGCAGGCTGAGATCTGACGACACGGC CGTGTATTACTGTGCGAGACTATCCCCAGGGGGTT ACTATGTTATGGATGCCTGGGGCCAAGGGACCACC GTGACCGTCTCCTCA CAGGTGCAGCTGGTGCAGTCTGGGGCTGAGGTGA AGAAGCCTGGGTCCTCGGTGAAGGTCTCCTGCAAG GCCTCTGGTTTCACATTCACTGACTACAAGATACA CTGGGTGCGACAGGCCCCTGGACAAGGGCTCGAG TGGATGGGATATTTCAACCCTAACAGCGGTTATAG TACCTACGCACAGAAGTTCCAGGGCAGGGTCACC ATTACCGCGGACAAATCCACGAGCACAGCCTACAT GGAGCTGAGCAGCCTGAGATCTGAGGACACGGCC GTGTATTACTGTGCGAGACTATCCCCAGGCGGTTA CTATGTTATGGATGCCTGGGGCCAAGGGACCACCG TGACCGTCTCCTCA CAGGTGCAGCTGGTGCAGTCTGGGGCTGAGGTGA AGAAGCCTGGGTCCTCGGTGAAGGTCTCCTGCAAG GGTTCTGGTTTCACATTCACTGACTACAAGATATC CTGGGTGCGACAGGCTCCTGGACAAGGGCTCGAG TGGATGGGATATTTCAACCCTAACAGCGGTTATAG TACCTACGCACAGAAGTTCCAGGGCAGGGTCACC ATTACCGCGGACAAATCCACGAGCACAGCCTACAT GGAGCTGAGCAGCCTGAGATCTGAGGACACGGCC GTGTATTACTGTGCGAGACTATCCCCAGGCGGTTA CTATGTTATGGATGCCTGGGGCCAAGGGACCACCG TGACCGTCTCCTCA 10 12 14 16 18 59 95068 60 Продовження таблиці 6 I-HHF I-HHG I-HLA1 I-HLA2 I-HLA3 CAGGTGCAGCTGGTGCAGTCTGGGGCTGAGGTGA AGAAGCCTGGGTCCTCGGTGAAGGTCTCCTGCAAG GGTTCTGGTTTTACATTCACTGACTACAAGATACA CTGGGTGCGACAGGCCCCTGGACAAGGGCTCGAG TGGATGGGATATTTCAACCCTAACAGCGGTTATTC GAACTACGCACAGAAGTTCCAGGGCAGGGTCACC ATTACCGCGGACAAATCCACGAGCACAGCCTACAT GGAGCTGAGCAGCCTGAGATCTGAGGACACGGCC GTGTATTACTGTGCGAGACTATCCCCAGGCGGTTA CTATGTTATGGATGCCTGGGGCCAAGGGACCACCG TGACCGTCTCCTCA CAGGTGCAGCTGGTGCAGTCTGGGGCTGAGGTGA AGAAGCCTGGGTCCTCGGTGAAGGTCTCCTGCAAG GGTTCTGGTTTTACATTCACTGACTACAAGATACA CTGGGTGCGACAGGCCCCTGGACAAGGGCTCGAG TGGATGGGATATTTCAACCCTAACAGCGGTTATGC CACGTACGCACAGAAGTTCCAGGGCAGGGTCACC ATTACCGCGGACAAATCCACGAGCACAGCCTACAT GGAGCTGAGCAGCCTGAGATCTGAGGACACGGCC GTGTATTACTGTGCGAGACTATCCCCAGGCGGTTA CTATGTTATGGATGCCTGGGGCCAAGGGACCACCG TGACCGTCTCCTCA CAGGTGCAGCTGGTGCAGTCTGGGGCTGAGGTGA AGAAGCCTGGAGCCTCGGTGAAGGTCTCCTGCAA GGCCTCTGGTTTTACATTCACTGACTACTATATGCA CTGGGTGCGACAGGCCCCTGGACAAGGGCTCGAG TGGATGGGCTGGATCAATCCTAACAGTGGTTATAG TACCTACAGCCCAAGCTTCCAAGGCCAGGTCACCA TCTCAGCCGACAAGTCCATCAGCACCGCCTACCTG CAGTGGAGCAGCCTGAAGGCCTCGGACACCGCCA TGTATTACTGTGCGAGACTATCCCCAGGCGGTTAC TATGTTATGGATGCCTGGGGCCAAGGGACCACCGT GACCGTCTCCTCA CAGGTGCAGCTGGTGCAGTCTGGGGCTGAGGTGA AGAAGCCTGGAGCCTCGGTGAAGGTCTCCTGCAA GGCCTCTGGTTTTACATTCACTGACTACTATATGCA CTGGGTGCGACAGGCCCCTGGACAAGGGCTCGAG TGGATGGGCTGGATCAATCCTAACAGTGGTTATAG TACCTACAACGAGAAGTTCCAAGGCCAGGTCACC ATCTCAGCCGACAAGTCCATCAGCACCGCCTACCT GCAGTGGAGCAGCCTGAAGGCCTCGGACACCGCC ATGTATTACTGTGCGAGACTATCCCCAGGCGGTTA CTATGTTATGGATGCCTGGGGCCAAGGGACCACCG TGACCGTCTCCTCA CAGGTGCAGCTGGTGCAGTCTGGGGCTGAGGTGA AGAAGCCTGGAGCCTCGGTGAAGGTCTCCTGCAA GGCCTCTGGTTACACATTCACTGACTACTATATGC ACTGGGTGCGACAGGCCCCTGGACAAGGGCTCGA GTGGATGGGCTGGATCAATCCTAACAGTGGTTATA GTACCTACAGCCCAAGCTTCCAAGGCCAGGTCACC ATCTCAGCCGACAAGTCCATCAGCACCGCCTACCT GCAGTGGAGCAGCCTGAAGGCCTCGGACACCGCC ATGTATTACTGTGCGAGACTATCCCCAGGCGGTTA CTATGTTATGGATGCCTGGGGCCAAGGGACCACCG TGACCGTCTCCTCA 20 22 24 26 28
ДивитисяДодаткова інформація
Назва патенту англійськоюAntigen binding molecules that bind egfr, vectors encoding same, and uses thereof
Автори англійськоюUmana Pablo, Mossner Ekkehard
Назва патенту російськоюАнтиген-связующая молекула, которая связывает egfr, вектор, который ее кодирует, и их применение
Автори російськоюУмана Пабло, Мосснер Эккехард
МПК / Мітки
МПК: G01N 33/577, A61K 39/395, C07K 16/28, A61P 35/00, C12N 15/13, C12N 5/10
Мітки: молекула, антиген-зв'язуюча, яка, вектор, кодує, зв'язує, еgfr, застосування
Код посилання
<a href="https://ua.patents.su/136-95068-antigen-zvyazuyucha-molekula-yaka-zvyazueh-egfr-vektor-shho-kodueh-ta-kh-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Антиген-зв’язуюча молекула, яка зв’язує еgfr, вектор, що її кодує, та їх застосування</a>
Попередній патент: Залізнична гальмівна колодка
Наступний патент: Пристрій та спосіб підрахунку та вимірювання витрати насінин
Випадковий патент: Електронагрівальний пристрій