Стабільна комбінована фармацевтична композиція амлодипіну та бісопрололу фумарат
Номер патенту: 101407
Опубліковано: 25.03.2013
Автори: Фюльоп Агнеш, Тонка-Надь Петер, Гора Ласлон, Жігмонд Золт, Левентізне Хузар Магдолна, Вагнер Лазло, Барця Ержбет, Уйфалушші Дьордь, Селецкі Едіт
Формула / Реферат
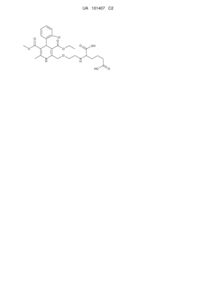
1. Стабільна тверда фармацевтична композиція, яка містить гомогенну суміш амлодипіну або його фармацевтично прийнятні солі і бісопрололу фумарату і фармацевтично прийнятні ексципієнти, упаковані в вологонепроникну упаковку і додатково містить менше ніж 0,5 % від маси активних інгредієнтів сполуки формули
 , 3
, 3
2. Фармацевтична композиція за п. 1, яка відрізняється тим, що композиція містить амлодипіну безилат із числа фармацевтично прийнятних солей амлодипіну.
3. Фармацевтична композиція за п. 1, яка відрізняється тим, що композиція містить менше ніж 0,3 % сполуки формули (3).
4. Фармацевтична композиция за п. 1, яка відрізняється тим, що композиція містить менше ніж 0,2 % сполуки формули (3).
5. Фармацевтична композиція за п. 1, яка відрізняється тим, що композиція упакована в блістерну упаковку холодного формування (так звана блістерна упаковка холодного формування/CFF/) з композитної фольги OPA/AL/PVC (фольга з орієнтованого поліаміду/алюмінію/полівінілхлориду), покритої алюмінієвою мембранною фольгою.
6. Фармацевтична композиція за п. 1, яка відрізняється тим, що композиція упакована в блістерну упаковку з термоформованої вологонепроникної композитної фольги і вкрита алюмінієвою мембранною фольгою.
7. Фармацевтична композиція за п. 1, яка відрізняється тим, що композиція упакована в скляну або поліпропіленову посудину, обладнану герметичною кришкою для контейнера із поліетилену або поліпропілену.
8. Фармацевтична композиція за будь-яким з пп. 1-7, яка відрізняється тим, що є таблеткою або капсулою.
9. Фармацевтична композиція за п. 8, яка являє собою таблетку, упаковану в вологонепроникну упаковку, яка відрізняється тим, що містить 2-20 %, переважно 2-10 %, більш переважно 1-6 % основи амлодипіну або його фармацевтично прийнятної солі приєднання кислоти, переважно амлодипіну безилату 2-20 %, переважно 2-10 %, більш переважно 1-6 % бісопрололу фумарату, додатково містить 60-90 %, переважно 70-90 %, більш переважно 80-90 % наповнювача, 1-10 %, переважно 4-6 % розпушувача, 0,5-3 %, переважно 1-2 % змащувальної речовини, 0,3-2 %, переважно 0,5-1 % антиадгезійного агента, при необхідності, 1-10 %, переважно 0,1-5 % зв'язуючого агента відносно до маси таблетки.
10. Фармацевтична композиція за п. 1, яка являє собою таблетку, упаковану в блістерну упаковку холодного формування (так звана блістерна упаковка холодного формування/CFF/) із композитної фольги OPA/AL/PVC, вкритої алюмінієвою мембранною фольгою, або в блістерній упаковці із термоформованої вологонепроникної композитної фольги, покритої алюмінієвою мембранною фольгою, або в скляній, або поліпропіленовій посудині, обладнаній герметичною кришкою для контейнера із поліетилену або поліпропілену, яка містить 1-6 % амлодипіну безилату, 1-6 % бісопрололу фумарату, 80-90 % мікрокристалічної целюлози, 4-6 % натрію крохмалгліколяту, 1-2 % стеарату магнію, 0,5-1 % колоїдного діоксиду кремнію відносно до маси таблетки.
11. Фармацевтична композиція за п. 1, яка є капсулою, упакованою в блістерну упаковку холодного формування (так звана блістерна упаковка холодного формування/CFF/) із композитної фольги OPA/AL/PVC, вкрита алюмінієвою мембранною фольгою, або в блістерній упаковці із термоформованої вологонепроникної композитної фольги, вкритої алюмінієвою мембранною фольгою, або в скляну, або поліпропіленову посудину, обладнану герметичною кришкою для контейнера із поліетилену або поліпропілену, яка містить 10-15 % амлодипіну безилату, 10-15 % бісопрололу фумарату, додатково 55-65 % мікрокристалічної целюлози, 4-6 % натрію крохмалгліколяту, 1-2 % стеарату магнію, 0,5-1 % колоїдного діоксиду кремнію відносно до маси речовини, яка заповнює капсулу.
12. Спосіб виготовлення стабільної твердої упакованої лікарської форми, яка містить амлодипін і бісопролол, при якому основу амлодипіну або його фармацевтично прийнятну сіль, бісопрололу фумарату, розпушувач, змащувальну речовину і, при необхідності, додаткові ексципієнти, які використовують в фармацевтичній промисловості, гомогенізують, потім додають антиадгезійний агент, гомогенізацію продовжують, потім
а) гомогенат пресують в таблетки з використанням способу прямого пресування або
б) заповняють в тверді желатинові капсули відомим чином,
потім одержані таблетки або капсули упаковують в вологонепроникні захисні упаковки відомим чином.
13. Спосіб виготовлення таблеток за п. 12, при якому застосовують 2-20 %, переважно 2-10 %, більш переважно 1-6 % основи амлодипіну або його фармацевтично прийнятної солі приєднання кислоти, переважно амлодипіну безилату, 2-20 %, переважно 2-10 %, більш переважно 1-6 % бісопрололу фумарату, додатково 60-90 %, переважно 70-90 %, більш переважно 80-90 % наповнювача, 1-10 %, переважно 4-6 % розпушувача, 0,5-3 %, переважно 1-2 % змащувальної речовини, 0,3-2 %, переважно 0,5-1 % антиадгезійного агента, при необхідності 1-10 %, переважно 0,5-1 % зв′язуючого агента відносно до маси таблеток.
14. Спосіб виготовлення капсул за п. 12, при якому застосовують 5-80 %, переважно 5-18 %, більш переважно 10-15 % основа амлодипіну або його фармацевтично прийнятної солі приєднання кислоти, переважно амлодипіну безилату, 5-80 %, переважно 5-15 %, більш переважно 10-15 % бісопрололу фумарату, додатково 1-10 %, переважно 4-6 % розпушувача, 0,5-3 %, переважно 1-2 % змащувальної речовини, 0,3-2 %, переважно 0,5-1 % антиадгезійного агента і, при необхідності, 10-75 %, переважно 45-75 %, більш перважно 55-65 % наповнювача відносно до маси речовини, яка заповнює капсулу.
Текст
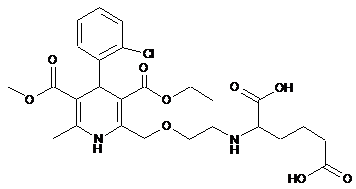
Реферат: Винахід стосується стабільної твердої фармацевтичної композицїї, що містить гомогенну суміш амлодипіну або його фармацевтично прийнятні солі і бісопрололу фумарат, а також фармацевтично прийнятні ексципієнти, упаковані у вологонепроникну упаковку, і що додатково містить менше ніж 0,5 % від маси активних інгредієнтів сполуки формули (3). UA 101407 C2 (12) UA 101407 C2 Cl O O O O N H O OH O N H HO O UA 101407 C2 Область винаходу Даний винахід відноситься до стабільної твердої фармацевтичної композиції, яка містить амлодипін формули 5 і бісопролол в якості активних інгредієнтів. Більш конкретно, даний винахід відноситься до композиції, упакованої в вологонепроникну упаковку, яка містить основу амлодипіну або його фармацевтично прийнятну сіль, переважно амлодипіну безилат і бісопрололу фумарат формули 10 а також наповнювач, розпушувач, змащуючу речовину і антиадгезійний агент, що використовуються в фармацевтичній промисловості, крім того, в якій кількість сполуки N-(2-{[4(2-хлорфент)-3-(етоксикарбоніл)-5-(метоксикарбоніл)-6-метил-1,4-дигідро-2-піридиніл]-метокси}етил)-аспарагінової кислоти формули 15 не перевищує 0,5% підчас приготування і зберігання композиції. Рівень техніки Необхідну величину кров'яного тиску для зменшення ризику серцево-судинних захворювань і смертності можна досягти за допомогою лікарського засобу, що складається із однієї сполуки, або оптимальної комбінації двох сполук у відповідності з практикою "доказової" терапії. Комбінована терапія більш ефективна; як правило, потрібна менша кількість кожної сполуки в порівнянні з монотерапією, таким чином, зменшується побічна дія і покращується дотримання пацієнтами схеми лікування. Завдяки даним перевагам роль комбінованої терапії фармацевтичними препаратами в лікувані гіпертензії і її ускладнень росте. Як правило, використовують комбінації бетаблокаторів, діуретичних агентів, інгібіторів АСЕ (ацетилхолінестерази), блокаторів рецепторів ангілотензину (ARB), відповідно блокаторів кальцієвих каналів. З недавнього часу, для кращого дотримання пацієнтом схеми лікування і зменшення вартості терапії ці комбінації все частіше продають у вигляді так званих "фіксованих комбінованих" форм, які містять обидва активні інгредієнти в одній лікарській формі. Застосування фіксованих комбінацій недвозначно рекомендується міжнародними нормами. Кілька фіксованих комбінацій, які містять блокатори кальцієвих каналів ("кальцієві антагоністи") і бета-блокатори, які використовуються переважно для лікування гіпертензії і стенокардії, такі як таблетки, які містять фелодипін і метопролол або ніфедипін і атенолол. 20 25 30 1 UA 101407 C2 5 10 15 20 25 30 35 40 45 50 55 60 Фіксована комбінація амлодипіну і бісопрололу до цих пір не представлена на ринку, але кілька виробів і заявок на патенти відносяться до цієї комбінації. В Міжнародній заявці на патент № WO2005/099699 розкриті комбінації S-амлодипіну і бета-блокаторів, включаючи комбінацію з бісопрололом. В заявці згадується кілька фармацевтичних розчинів для спільного приготування цих інгредієнтів, але замовчується основна проблема практичного застосування, а саме хімічної несумісності обох активних інгредієнтів. В так званих "монокомпозиціях", які містять тільки один активний інгредієнт, амлодипін у формі солі безилату, і бісопролол використовується як сіль фумарату. Композиція амлодипіну безилату і бісопрололу фумарату в одній лікарській формі, є вигідною оскільки як бісопрололу фумарат, так і амлодипіну безилат підходять для виготовлення стабільних фармацевтичних лікарських форм. Згідно заявки на патент Індії № 845/MUM/2004 амлодипіну безилат і бісопрололу фумарат взаємодіють між собою. В результаті проведених експериментів було встановлено, що продукт є сполукою N-(2-{[4-(2-хлорфеніл)-3-(етоксикарбоніл)-5-(метоксикарбоніл)-6-метил-1,4-дигідро-2піридиніл]-метокси}-етил)-аспарагінова кислота формули (3). Дана сполука утворюється в результаті хімічної реакції основи амлодипіну і фумарової кислоти. Утворення цього продукту неочікуване, оскільки в заявці на патент США № 6518288 вказано, що сіль амлодипіну, яка утворюється з фумарової кислоти, є стабільною і не перетворюється в сполуки формули (3). Існуючі в даний час вимоги міжнародних фармацевтичних регулюючих органів допускають тільки дуже низькі - кілька десятих доль масового проценту - границі вмісту продуктів деградації фармацевтичних композицій. Абсорбуючі властивості і фармакокінетичні ефекти вищезгаданих солей добре відомі. Пацієнти звикли використовувати композиції, які містять ці солі, і вони звикли до їх ефектів. Існує необхідність в стабільній твердій лікарській формі, яка містить амлодипін або його фармацевтично прийнятну сіль, переважно амлодипіну безилат і бісопрололу фумарат. Композиція повинна являти собою таблетку або капсулу, в якій кількість домішок, яка виникає в результаті несумісності обох активних інгредієнтів, підтримується на низькому рівні також і під час зберігання. У відповідності до заявки на патент Індії № 845/MUM/2004 комбінована композиція амлодипіну безилату і бісопрололу фумарату може бути , тільки якщо активні інгредієнти розділені в різних гранулах. Гранули змішують з додатковими ексціпієнтами і заповнюють в капсули або саше, або пресують в так звані двохшарові таблетки. Суть рішення в індійському винаході полягає у відділені обох інгредієнтів один від одного. При цьому фізичний контакт між активними інгредієнтами, який може сприяти утворенню продукту реакції формули (3) під час змішування гранул і в особливості під час процесу пресування таблеток при інтенсивному контакті великих поверхонь, по суті запобігається. Спосіб у відповідності з заявкою на патент Індії має кілька недоліків. Індивідуальне гранулювання і гомогенізація активних інгредієнтів збільшує кількість необхідних технологічних стадій. Виготовлення двохшарових таблеток вимагає складного спеціального обладнання. Існує необхідність в стабільній твердій лікарській формі, яка містить амлодипін або його фармацевтично прийнятну сіль, переважно амлодипіну безилат і бісопрололу фумарат. Композиція повинна бути таблеткою або капсулою, в якій кількість домішок, які виникають в результаті несумісності обох активних інгредієнтів, підтримується на низькому рівні навіть під час зберігання, і яка не потребує роздільної обробки активних інгредієнтів під час процесу виготовлення або в композиції. Короткий опис суті винаходу Автори винаходу несподівано виявили, що у випадку правильного вибору упаковки і умов може бути приготована стабільна фармацевтична композиція, яка, належним чином упакована, задовольняє вимоги жорстких норм безпеки, стосовно лікарських засобів, і де кількість N-(2-{[4(2-хлорфеніл)-3-(етоксикарбоніл)-5-(метоксикарбоніл)-6-метил-1,4-дигідро-2-піридинів]метокси}-етил)-аспарагінової кислоти формули (3) в композиції під час приготування або під час зберігання до закінчення строку придатності композиції, по меншій мірі протягом двох років, не перевищує 0,5%. Даний винахід відноситься до стабільної твердої фармацевтичної композиції, яка містить амлодипін або його фармацевтично прийнятну сіль, переважно амлодипіну безилат, бісопрололу фумарат, і крім того фармацевтично прийнятний органічний або неорганічний наповнювач, розпушувач, змащуючу речовину, антиадгезійні агенти упаковані в вологонепроникну упаковку. Додатковий опис винаходу 2 UA 101407 C2 5 Під час експериментів автори винаходу виявили, що обидва активні інгредієнти взаємодіють навіть в простій порошковій суміші і продукт реакції утворюється в значній кількості. Несумісність більш очевидна в том випадку, якщо обидва інгредієнти поміщають в лікарську форму з низькою пористістю, наприклад в таблетку, де їх кристали контактують один з одним за високого тиску на великій площині. Взаємодія сильно залежить від температури: вміст амлодипіну і бісопрололу в суміші амлодипіну безилату і бісопрололу фумарату варіює після зберігання протягом одного місяця за різної температури наступним чином: Таблиця 1 Амлодипін Бісопролол 25°С/1 місяць -100% -100% 40°С/1 місяць 59% 85% 70°С/1 місяць 25% 71% 10 15 20 25 30 35 40 45 50 Для спеціаліста в області фармацевтичної технології очевидно, що у випадку утворення композиції, яка містить два несумісних інгредієнти, ці інгредієнти повинні бути розділені за допомогою придатного способу. Для рішення цієї задачі покриття одного активного інгредієнта полімерним ексціпієнтом може бути достатнім. Полімерний шар оболонки може утворювати відповідний ізолюючий шар між кристалічними поверхнями обох активних інгредієнтів. Експерименти з розробкою рецептури, проведені авторами даного винаходу, виявилися невдалими. Активні інгредієнти виявилися термочутливими. З однієї сторони, термочутливість активних інгредієнтів викликає проблеми не тільки у випадку водних способів нанесення оболонки, але також і в випадку способів нанесення оболонки з використанням органічних розчинників, оскільки усунення розчинника викликає температурний стрес. З іншого боку, під час процесу сушіння в композиції залишаються сліди вологи, які також сприяють взаємодії активних інгредієнтів. Автори винаходу несподівано виявили, що попередження несумісності між обома активними інгредієнтами і температурна деградація активних інгредієнтів не достатня для того, щоб не допустити способів з використанням води або органічних розчинів, які супроводжуються тепловим стресом. Для попередження несприятливих ефектів температурного стресу автори винаходу виготовили комбіновані таблетки за допомогою способу прямого пресування. Якщо таблетки зберігали в скляній посудині, закритій поліетиленовою кришкою, при 30°С і 65% відносної вологості протягом трьох місяців, то продукти деградації залишалися нижче рівня детекції. У випадку, коли ті ж самі таблетки зберігали в термоформованій блістерній фользі типу PVC/PVdC (тип полівінілхлорид/полівініліденхлорид), закритій алюмінієвій фользі, при 30°С і 65% відносної вологості протягом трьох місяців, автори винаходу несподівано виявили, що мінімальна вологість, яка проникає через блістерну фольгу типу PVC/PVdC (відома як більш вологонепроникна в порівнянні з PVC), є достатньою для утворення неприйнятно високої ступені контамінації. Виявилось, що недостатньо захищати продукт від вологості під час процесу виготовлення, але і під час зберігання оточуюче середовище також слід підтримувати сухим. Ці експерименти вказують на те, що для початку взаємодії між інгредієнтами в твердій фазі достатньо присутності надзвичайно малої кількості води, абсорбованої на поверхнях кристалів. В композиції згідно даного винаходу реакції, що призводять до утворення домішок, не відбуваються зовсім або відбуваються тільки в дуже обмеженому діапазоні. Згідно з даним винаходом запропонована стабільна тверда упакована фармацевтична композиція, де активними фармацевтичними інгредієнтами є амлодипін і бісопролол, яка містить менше ніж 0,5%, переважно менше ніж 0,3%, більш переважно менше ніж 0,2% сполуки формули (3), упакована в вологонепроникну упаковку і містить основу амлодипіну або його фармацевтично прийнятну сіль, переважно амлодипіну безилат, бісопрололу фумарат, а також фармацевтично прийнятний наповнювач, розпушувач, змащуючу речовину, антиадгезійні агенти, можливо зв'язуючі агенти. Згідно з відкриттям авторів винаходу амлодипін реагує з фумаровою кислотою. Під час реакції, що призводить в результаті до утворення домішок, інший солеутворюючий компонен (наприклад, аніон бензолсульфонової кислоти) не відіграє ніякої ролі. Таким чином, згідно з даним винаходом амлодипін може бути використаний в формі основи або солі (наприклад, амлодипіну безилат). 3 UA 101407 C2 5 10 15 20 25 30 35 Композиція згідно даного винаходу має фундаментальну важливість з точки зору стабільності фармацевтичної композиції. Для виготовлення таблеток за допомогою сухого способу повинні використовуватися такі ексціпієнти, які мають відповідні властивості пресованості і вільної прохідності окрім їх основної функції. Згідно даного винаходу всі сполуки в композиції за виключенням активних інгредієнтів представляють собою ексціпієнти. Терміни, що посилаються на ексціпієнт, такі як наповнювач, розпушувач, змащуюча речовина, антиадгезійний і зв'язуючий агенти, означають категорії ексціпієнтів. Таким чином, вони також відносяться до сумішей відповідних ексціпієнтів і їх композицій, крім того, до звичного застосування ексціпієнтів тієї ж самої категорії в тій же самій композиції. Таке відбувається, наприклад, в тому випадку, якщо в якості наповнювача в композиції використовують два різні наповнювачі, які застосовують в фармацевтичній промисловості, такі як лактоза і мікрокристалічна целюлоза, в вигляді композиту. Терміни, які відносяться до вищеприведених ексціпієнтів, також відносяться до випадків, в яких композиція містить кілька ексціпієнтів різних категорій. Це відбувається якщо, наприклад, окрім, розпушувача використовується наповнювач, наприклад лактоза у вигляді композиції з повідоном і коповідоном, або якщо змащуюча речовина, або антиадгезійний агент зазвичай використовується з наповнювачем, наприклад у вигляді композиції мікрокристалічної целюлози з колоїдним діоксидом кремнію. Згідно з даним винаходом застосування таких композицій еквівалентно звичайному застосуванню різних компонентів, таким чином, дані технічні рішення також складають частину даного винаходу. В якості агентів-наповнювачів композиція згідно даного винаходу може містити наповнювачі, які використовуються в фармацевтичній промисловості, або їх домішки, переважно мікрокристалічну целюлозу, безводний гідрофосфат кальцію, висушену розпиленням лактозу або маніт або їх суміш, найбільш переважно сорти мікрокристалічної целюлози з низьким вмістом вологи. В продовженні авторами винаходу експериментів таблетування виявлено, що найменша швидкість деградації виявлена у випадку застосування мікрокристалічної целюлози (переважно використовували сорти мікрокристалічної целюлози з низьким вмістом вологи; дивись Таблицю 2). Таблиця 2 Ефекти наповнювачів для деградації і швидкості взаємодії після одного місяця зберігання при 50°С (суміші амлодипіну безилат/бісопрололу фумарату/агенту наповнювача у відношенні: 0,1:0,1:5) є наступними: Таблиця 2 Мікрокристалічна целюлоза (Vivapur) Сполуки формули (3) Всі домішки 40 45 50 Fillers Безводний гідрофосфат калію (Emcompress) Лактоза DC 11 (Tablettose) DC маніт (Perlitol) 0,06% 0,46% 0,24% 0,09% 0,29% 0,77% 0,56% 0,31% Норма агентів-наповнювачів, які підходять для способу прямого пресування в таблетках згідно даного винаходу, складають 60%-90%, переважно 70%-90%, більш переважно 80-90%. Застосування наповнювача у випадку продуктів-капсул не є необхідною. Для забезпечення однорідного розподілення активних інгредієнтів в одній виготовленій партії і того, щоб в кожну капсулу в процесі інкапсуляції завжди заповнювалась необхідна кількість обох активних інгредієнтів, переважно використовують відповідну кількість наповнювача, який має високу питому площу поверхні, що попереджає розділення інгредієнтів протягом процесу. Такі наповнювачі, які мають високу питому площу поверхні, представляють собою, наприклад порошкоподібну целюлозу або мікрокристалічну целюлозу. Мікрокристалічна целюлоза краща вже з тієї точки зору, що композиція, яка заповнює капсулу утримується разом при відносно низькому тискові загущувача завдяки механічно блокуючому зв'язуванні, що, відповідно, попереджає дисперсію речовин композиції під час процесу інкапсуляції. 4 UA 101407 C2 5 10 15 20 25 30 35 40 45 50 55 60 Завдяки вищевказаним причинам оптимальна кількість наповнювача в інкапсульованому продукті складає 10-75%, переважно 45%-75%, більш переважно 55%-65% на основі маси речовини-наповнювача в композиції. Застосування наповнювачів з низьким вмістом вологи згідно з даним винаходом більш переважно. Додатково до основних функціональних характеристик ексціпієнти, які використовуються для приготування таблетованих композицій за допомогою сухого способу, повинні також мати прийнятну пресованість і властивості сипучості. Розпушувач слід використовувати як у випадку таблетованих, так і у випадку інкапсульованих композицій, що забезпечує швидке розщеплення таблетки або капсули під дією шлункового соку, таким чином, розщеплення і абсорбція активних інгредієнтів відбуваються швидко і повністю. Будь-який розпушувач, який зазвичай використовується в фармацевтичній промисловості, може бути використаний в якості розпушувача. Великий вибір розпушувачів, особливо, які підходять для способу таблетування шляхом прямого пресування, є в розпорядженні спеціаліста в даній області техніки. Таким чином, композиція згідно даного винаходу може включати в якості розпушувача будьякий із розпушувачів, що зазвичай використовуються в фармацевтичній промисловості, або їх суміш, переважно кросповідон, натрій крохмаль гліколят, кроскармелозу, гідроксипропілцелюлозу з низькою ступінню заміщення або їх суміш, найбільш переважно натрій крохмаль гліколят. Згідно з даним винаходом оптимальна кількість розпушувачів в композиціях складає 1%-10%, переважно 4%-6%, на основі маси таблетки або речовини, яка заповняє капсулу. Застосування антиадгезійних агентів і змащуючих агентів необхідно в таблетованих і інкапсульованих композиціях, в яких антиадгезійні агенти попереджають зволоження агентівнаповнювачів, схильних до гігроскопічності, і адгезії їх частин один з одним завдяки інтенсивним гігроскопічним властивостям. Таким чином, в якості антиадгезійного агента композиція за даним винаходом може містити будь-які типи антиадгезійних агентів, які зазвичай використовують в фармацевтичній промисловості, або їх суміш. Переважно, вона містить сілоїди або колоїдні діоксиди кремнію або їх суміші. Найбільш переважно, вона містить колоїдний діоксид кремнію. Оптимальна кількість антиадгезійних агентів в композиціях за даним винаходом складає 0,3%-2%, переважно 0,5%-1%. Застосування так званих змащуючих агентів, які зменшують властивості прилипання і тертя, необхідно в випадку приготування таблетованих і інкапсульованих композицій для полегшення екструзії таблеток або заповнення речовини в капсули із форми (приладу) і попередження приклеювання компонентів до формуючих або заповнюючих приладів. В якості змащуючої речовини композиції відповідно до даного винаходу можуть містити будь-які типи змащуючих речовин, які використовуються у фармацевтичній промисловості, або їх суміш. Переважно, вони містять стеарат магнію, стеарилфумарат натрію, гліцерилбегенат або їх суміш. Найбільш переважно, вони містять стеарат магнію. Згідно з даним винаходом оптимальна кількість змащуючих речовин в композиціях складає 0,5%-3%, переважно 1%-2%. Тверда лікарська форма згідно з даним винаходом переважно представляє собою таблетку або капсулу. Несподівано виявилося, що в переважному випадку для виготовлення таблеток не вимагаються ніякі із зв'язуючих агентів, які використовуються в фармацевтичній промисловості. Якщо завдяки змінам властивостей таблетки, наприклад збільшення її твердості, необхідно використовувати зв'язуючі агенти, то будь-який зв'язуючий агент, наприклад полівінілпіролідон, крохмаль і т.д. може бути використаний в якості зв'язуючого агенту. В тому випадку, коли тверда лікарська форма за даним винаходом представляє собою таблетку, то у відповідності з переважним втіленням даного винаходу, упаковані в вологонепронину захисну упаковку, містить 2%-20%, переважно 2%-10%, найбільш переважно 1%-6% основу амлодипіну або його фармацевтично прийнятної солі, переважно амлодипіну безилату, 2%-20%, переважно 2%-10%, найбільш переважно 1%-6% бісопрололу фумарату, додатково 60%-90%, переважно 70%-90%, більш переважно 80%-90% наповнювача, 1%-10%, переважно 4%-6% розпушувача, 0,5%-3%, переважно 1%-2% змащуючої речовини, 0,3%-2%, переважно 0,5%-1% антиадгезійного агенту, і якщо необхідно, то 1%-10%, переважно 0,1%-5% зв'язуючого агента, в перерахунку на масу таблеток. У випадку, коли тверда лікарська форма за даним винаходом представляє собою капсулу, то у відповідності з переважним втіленням даного винаходу капсули, упаковані в вологонепроникну захисну упаковку, містять 5%-80%, переважно 5%-18%, найбільш переважно 5 UA 101407 C2 5 10 15 20 25 30 35 40 45 50 55 60 10%-15% основи амлодипіну або його фармацевтично прийнятної солі, переважно амлодипіну безилат, 5%-80%, переважно 5%-15%, найбільш переважно 1%-10% бісопрололу фумарату, додатково 1%-10%, переважно 4%-б% розпушувача, 0,5%-3%, переважно 1%-2% змащуючої речовини, 0,3%-2%, переважно 0,5%-1% антиадгезійного агента і при необхідності 10%-75%, переважно 45%-75%, більш переважно 55%-65% наповнювача, в перерахунку на масу речовини-наповнювача капсули. В упакованих лікарських формах згідно даного винаходу фармацевтична композиція, яка містить активні інгредієнти, наприклад таблетки або капсули, знаходяться в упаковці, яка відділяє лікарські форми від оточуючого середовища, таким чином захищаючи лікарські форми від дії оточуючого середовища до введення. В якості прикладів згадані різні упаковочні матеріали, для яких використовують наступні скорочення: CFF - фольга для холодного формування. фольга OPA/AL/PVC (фольга із орієнтованого поліаміду/алюмінію/полівінілхлориду). фольга PVC/PE/PVdC (фольга із полівінілхлориду/поліетилену/полівінілденхлориду). фольга PVC/PCTFE (фольга полівінілхлорид/поліхлортрифторетилен) шар/фольга PVdC (полівініліденхлорид) фольга PVC (полівінілхлорид). Вологонепроникна упаковка твердої лікарської форми за даним винаходом представляє собою герметично закриту посудину або вологонепроникну так звану блістерну упаковку для холодного формування (CFF) або термоформовану блістерну упаковку. Згідно з одним із втілень даного винаходу вологонепроникна упаковка може представляти собою посудину, яка має закриваючий компонент (наприклад, флакон, пластиковий контейнер, скляну посудину, яка має герметичну поліетиленову або поліпропіленову кришку, поліпропіленову банку і т.д.), в яку поміщають одну або більше як одну таблетку або капсулу. Посудина, яка містить таблетки або капсули, за необхідності може містити окрім капсул і таблеток допоміжні агенти, які здатні зв'язувати вологу з внутрішньої атмосфери посудини, такі сполуки для зв'язування вологи представляють собою, наприклад цеоліти або силікагель. Допоміжні агенти для зв'язування вологи можуть бути поміщені безпосередньо серед капсул або таблеток, але вони також можуть бути поміщені в окрему посудину або в контейнер, проникний для повітря і розташований серед лікарських форм. Такі посудини також підходять для упаковування твердих лікарських форм згідно з даним винаходом, в яких лікарська форма і сполука, що зв'язують вологу, розташовуються в двох окремих частинах, і при цьому забезпечується повітрообмін. В атмосфері упаковки може знаходитися повітря, інертні гази або вакуум. Згідно з втіленням даного винаходу вологонепроникна захисна упаковка представляє собою так звану блістерну упаковку для холодного формування. Блістерна упаковка холодного формування представляє собою форму упаковки, в якій блістерна упаковка підлягає холодному формуванню із композитної фольги і покривається алюмінієвою мембранною фольгою. Така композитна фольга може представляти собою OPA/AL/PVC (фольга із орієнтованого поліаміду/алюмінію/полівінілхлориду). Згідно даного винаходу лікарські форми, які містять активні інгредієнти, наприклад таблетки або капсули, упаковані в так звану блістерну упаковку для холодного формування. Згідно ще одного втілення даного винаходу вологонепроникна упаковка представляє собою, наприклад, блістерну упаковку, виготовлену з термоформованої, вологонепроникної композитної фольги, що покривають алюмінієвою мембранною фольгою. Згідно ще одного втілення даного винаходу лікарська форма, яка містить активні інгредієнти, наприклад таблетки або капсули, упакована в блістерну упаковку, виготовлена з термоформованої вологонепроникної фольги, яку вкривають алюмінієвою мембранною фольгою. Така вологонепроникна композитна фольга може представляти собою, наприклад PVC/PE/PVdC, так звану "потрійну фольгу" або фольгу PVC/PCTFE. Згідно з найбільш переважним втіленням даного винаходу лікарська форма представляє собою таблетку, упаковану в блістерну упаковку для холодного формування із композитної фольги OPA/AL/PVC і вкриту алюмінієвою мембранною фольгою (так звана блістерна упаковка холодного формування/CFF/), або упаковану в блістерну упаковку із термоформованої вологонепроникної композитної фольги (наприклад потрійної фольги PVC/PE/PVdC, або фольги PVC/PCTFE), вкритої алюмінієвою мембранною фольгою, або в скляній або поліпропіленовій посудині, яка має герметичну кришку для контейнера із поліетилену або поліпропілену, де таблетка містить 1%-6% амлодипіну безлату, 1%-6% бісопрололу фумарату, 80%-90% мікрокристалічної целюлози, 4%-6% натрій крохмальгліколяту, 1%-2% стеарату магнію, 0,5%1% колоїдного діоксиду кремнію, по відношенню до загальної маси таблетки. 6 UA 101407 C2 5 10 15 20 25 30 35 40 45 50 55 Згідно з ще одного дуже переважного втілення даного винаходу запропонована капсула, упакована в блістерну упаковку для холодного формування із композитної фольги OPA/AL/PVC і покрита алюмінієвою мембранною фольгою (так звана блістерна упаковка холодного формування/CFF/), або упакована в блістерну упаковку з термоформованої вологонепроникної композитної фольги (наприклад потрійної фольги PVC/PE/PVdC, або фольги PVC/PCTFE), вкритої алюмінієвою мембранною фольгою, або в скляній або поліпропіленовій посудині, яка має герметичну кришку із поліетилену або поліпропілену, де капсула містить 10%-15% амлодипіну безилату, 10%-15% бісопрололу фумарату, 55%-65% мікрокристалічної целюлози, 4%-6% натрій крохмальгліколяту, 1%-2% стеарату магнію, 0,5%-1% колоїдного діоксиду кремнію, від загальної маси речовини, яка заповнює капсулу. Композиція згідно з даним винаходом містить менше ніж 0,5%, переважно від 0,01% до 0,5%-(2-{[4-(2-хлорфеніл)-3-(етоксикарбоніл)-5-(метоксикарбоніл)-6-метил-1,4-дигідро-2піридиніл]-метокси}-етил)-аспарагінової кислоти. Згідно з переважним втіленням даного винаходу кількість похідної аспарагінової кислоти складає менше ніж 0,3%, більш переважно кількість складає 0,01%-0,3%. Згідно з більш переважним втіленням даного винаходу кількість похідної аспарагінової кислоти складає менше ніж 0,2%, більш переважно 0,01%-0,2%. Спеціаліст в даній області техніки може приготувати продукт, який містить сполуку формули (3) в недетектованій кількості з використанням суттєвих характеристик даного винаходу. Таким чином, об'єм захисту даного винаходу включає продукти, в яких використовуються суттєві характеристики даного винаходу і продукт містить недетектовану кількість сполуки формули (3). В процесі приготування композиції згідно з даним винаходом основа амлодипіну або його фармацевтично прийнятна сіль, переважно амлодипіну безилат, бісопрололу фумарат, доповнена органічним або неорганічним наповнювачем, розпушувачем, змащуючою речовиною і можливо зв'язуючим агентом, який використовується в фармацевтичній промисловості, гомогенізують відомим чином, потім додають адгезійний агент і гомогенізують А.) одержаний гомогенізат пресують в таблетки відомим чином або Б.) заповняють у тверді желатинові капсули відомим чином, потім одержані таблетки або капсули упаковують в вологонепроникну упаковку відомим чином. За необхідності гомогенізації може передувати просіювання для досягнення однорідного розміру гранул компонентів. Для просіювання переважно може бути використане сито розміром 250 мкм. Гомогенізація може бути втілена в будь-якому обладнанні, яке підходить для гомогенізації, переважно в змішувачі барабанного типу. Таблетки можуть бути пресовані з використанням будь-якого типу обладнання для виготовлення таблеток шляхом прямого пресування відомим чином. Капсули можуть бути виготовлені відомим чином з використанням будь-якого обладнання, що підходить для процесу інкапсуляції. Таблетки або капсули упаковують у відповідні блістерні упаковки або посудини відомим чином. Таблетки готують, використовуючи 2%-20%, переважно 2%-10%, найприйнятніше 1%-6% основи амлодипіну або його фармацевтично прийнятні солі, переважно амлодипіну безилату, 2%-20%, переважно 2%-10%, найприйнятніше 1%-6% бісопрололу фумарату крім того 60%90%, переважно 70%-90%, найприйнятніше 80%-90% наповнювача, 1%-10%, переважно 4%-6% розпушувача, 0,5-3%, переважно 1%-2% змащуючої речовини, 0,3-2%, переважно 0,5%-1% антиадгезійного агента, і при необхідності 1%-10%, переважно 0,1-5% зв'язуючого агента. Капсули готують, використовуючи 5%-80%, переважно 5%-18%, найприйнятніше 10%-15% основ амлодипіну або його фармацевтично прийнятні солі, переважно амлодипіну безилату 5%80%, переважно 5%-15%, найприйнятніше 10%-15% бісопрололу фумарату крім того, 1%-10%, переважно 4%-6% розпушувача, 0,5-3%, переважно 1%-2% змащуючих речовини, 0,3-2%, переважно 0,5%-1% антиадгезійного агента, і при необхідності 10%-90%, переважно 45%-75%, найпереважно 55%-65% наповнювача на основі маси заповнюючої речовини капсул. Мікрокристалічна целюлоза, безводний гідрофосфат кальцію, висушена розпиленням лактоза або маніт, переважно мікрокристалічна целюлоза або її суміш, прийнятніше мікрокристалічна целюлоза, яка має низьку вологість можуть бути використані в якості наповнювача, кросповідон, натрій крохмальгліколят, кроскармелоза, низькозаміщена гідроксипропілцелюлоза або їх суміш, переважно натрій крохмальгліколят, можуть бути використані в якості розпушувача, стеарат магнію стеарилфумарат натрію, гліцерилбегенат або їх суміш, переважно стеарат магнію, можуть бути використані в якості змащуючої речовини для виготовлення пігулок або капсул відповідно до даного винаходу. Сілоїди або колоїдний діоксид кремнію або їх суміш, переважно колоїдний діоксид кремнію, використовують як антиадгезійні агенти, і при необхідності, полівінілпіролідон або крохмаль використовують як зв'язуючий агент. 7 UA 101407 C2 5 10 15 20 25 30 35 40 45 50 Пігулки або капсули упаковують переважно в блістерну упаковку для холодного формування з композитної фольги OPA/AL/PVC завтовшки 130 мкм, покриту алюмінієвою мембранною фольгою завтовшки 20 мкм (так звана блістерна упаковка холодного формування/CFF/) чи в блістерну упаковку, отриману з термоформованої вологонепроникної композитної фольги, покритої алюмінієвою мембранною фольгою завтовшки 20 мкм, або в посудини, обладнані герметичною кришкою для контейнера з поліетилену або поліпропілену. Найприйнятніше, композицію упаковують в так звану блістерну упаковку для холодного формування (CFF). Ще одне втілення вологонепроникної упаковки, як згадано вище, полягає в упаковці таблеток або капсул разом з осушувачами, які зв'язують вологу. Ці форми упаковки і допоміжні агенти детально описані вище. Відповідно до найбільш прийнятного способу приготування твердої фармацевтичної лікарської форми таблеток, 1%-6% амлодипіну безилату, 1%-6% бісопрололу фумарату, 80%90% мікрокристалічної целюлози, 4%-6% натрій крохмальгліколяту 1%-2% стеарату магнію гомогенізують, потім додають 0,5%-1% колоїдного діоксиду кремнію і гомогенізують, потім гомогенат пресують в пігулки з використанням способу прямого пресування відомим чином, одержані таблетки упаковують в блістерну упаковку для холодного формування з композитної фольги OPA/AL/PVC і покривають алюмінієвою мембранною фольгою (так звана блістерна упаковка холодного формування/CFF/) або в упаковку блістера з термоформованою вологонепроникною композитною фольгою, наприклад потрійної фольги PVC/PE/PVdC, або фольги PVC/PCTFE, покритої алюмінієвою мембранною фольгою, або упаковують в скляну або поліпропіленову посудину, що має герметичну кришку із поліетилену або поліпропілену переважно таблетки упаковують в блістерну упаковку для холодного формування з композитної фольги OPA/AL/PVC, покритою алюмінієвою мембранною фольгою (так звана блістерна упаковка холодного формування/CFF/). Відповідно до найбільш прийнятного способу приготування твердої фармацевтично прийнятної лікарської форми капсул, 10%-15% амлодипіну безилату, 10%-15% бісопрололу фумарат, 55%-65% мікрокристалічної целюлози, 4%-6% натрій крохмальгліколят 1%-2% стеарати магнію на основі загальної маси наповнюючої речовини гомогенізують, потім додають 0,5%-1% колоїдний діоксид кремнію і гомогенізують потім гомогенат інкапсулюють в тверді желатинові капсули відомим чином і упаковують в блістерну упаковку холодного формування з композитної фольги OPA/AL/PVC і покривають алюмінієвою мембранною фольгою (так звана блістерна упаковка холодного формування/CFF/) або в блістерну упаковку з термоформованої вологонепроникної композитної фольги наприклад потрійної фольги PVC/PE/PVdC, або фольги PVC/PCTFE, покритої алюмінієвою мембранною фольгою, або в скляну або поліпропіленову посудину, що має герметичну кришку контейнера з поліетилену або поліпропілену переважно таблетки упаковують в упаковку блістера холодного формування з композитної фольги OPA/AL/PVC, покритої алюмінієвою мембранною фольгою (так звана блістерна упаковка для холодного формування/CFF/). Перевага даного винаходу полягає в тому, що даний винахід робить можливим застосування простого і дешевого способу прямого таблетування, навіть у разі композиції відповідно до даного винаходу, що містить несумісні активні інгредієнти. Вміст сполуки (3) в композиції відповідно до даного винаходу не перевищує 0,5% щонайменше 2 роки. У разі застосування комбінованої композиції пацієнт краще дотримується схеми лікування, таким чином, ці композиції є більш сприятливими ніж композиції, що використовуються у вигляді монотерапії. Даний винахід продемонстрований прикладами нижче, що не обмежують об'єм захисту. Приклад 1 Композиція для 1000 таблеток: Амлодипіну безилат 13,9 г Бісопрололу фумарат 10,0 г Мікрокристалічна целюлоза 265,1 г Натрій крохмальгліколят 10,0 г Стеарат магнію 4,0 г Колоїдний діоксид кремнію 2,0 г Спосіб: Обидва активні інгредієнти просіюють з використанням сита з отвором 250 мкм, потім гомогенізують з мікрокристалічною целюлозою, натрій крохмальгліколятом і колоїдним діоксидом кремнію в змішувачі барабанного типу впродовж десяти хвилин. Потім стеарат магнію додають до суміші, і суміш, що виходить, гомогенізують впродовж ще двох хвилин. 8 UA 101407 C2 5 Гомогенат пресують в пігулки, що мають масу 305 мг, за допомогою апарату для пресування пігулок. Пігулки упаковують в блістерну упаковку холодного формування з композитної фольги OPA/AL/PVC завтовшки 130 мкм і покриту алюмінієвою мембранною фольгою завтовшки 20 мкм. Результати перевірки вмісту домішок в таблетках, приготованих відповідно до Прикладу 1 на дату виготовлення і після зберігання впродовж 3 місяців при 40°С/75% відносній вологості приведені нижче: Домішки На дату виготовлення Через 3 місяці (40°С/75% відносна вологість) Через 6 місяців (40°С/75% відносна вологість) N-(2-{[4-(2-хлорфеніл)-3-(етоксікарбоніл)5-(метоксікарбоніл)-6-метил-1,4-дигідро-2піридиніл]-метоксі}-етил)-аспарагінова кислота < 0,02% 0,15% 0,26% 10 Додаткові дані про якість продукту відповідно Прикладу 1 приведені нижче: 1' Через 3 місяця (40°С/75% відносна вологість) 1' 103,1% 102,6% 104 Н 0% 3,3% 97,9% 98,9% 113 Н 0% 3,5% На дату виготовлення Час розпаду: Розчинення активного інгредієнту (15 хв) Амлодипіну безилат: Бісопрололу фумарат: Опір руйнуванню Втрати при терті: вологість (За Карлом Фішером): 15 20 25 Приклад 2 Композиція для 1000 капсул: Амлодипіну безилат 6,95 г Бісопрололу фумарат 5,0 г Макрокристалічна целюлоза 30,05 г Натрій крохмальгліколят 2,0 г Стеарат магнію 2,0 г Колоїдний діоксид кремнію 1,0 г Спосіб: Обидва активні інгредієнти просіюють з використанням сита з отвором 250 мкм, потім гомогенізують з мікрокристалічною целюлозою, натрій крохмальгліколятом і колоїдним діоксидом кремнію в змішувачі барабанного типу впродовж десяти хвилин. Потім стеарат магнію додають до суміші, і суміш, що виходить, гомогенізують впродовж ще двох хвилин. Гомогенат заповнюють в капсули, що містять 47 мг заповнюючої речовини, з використанням апарату для пресування пігулок. Таблетки упаковують в блістерну упаковку холодного формування з композитної фольги OPA/AL/PVC завтовшки 130 мкм і покривають алюмінієвою мембранною фольгою завтовшки 20 мкм. Результати перевірки вмісту домішок в капсулах, приготованих і упакованих відповідно до Прикладу 2, на дату виготовлення і після зберігання впродовж 3 місяців при 40°С/75% відносній вологості приведені нижче: 9 UA 101407 C2 Домішок 10 15 Через 3 місяці (40°С/75% відносна вологість) Через 6 місяців (40°С/75% відносна вологість) N-(2-{[4-(2-хлорфеніл)-3-(етоксикарбоніл)5-(метоксикарбоніл)-6-метил-1,4-дигідро-2піридиніл]-метоксі}-етил)-аспарагінова кислота 5 На дату виготовлення < 0,02% 0,11% 0,23% Референсний приклад: Композиція для 1000 таблеток: Амлодипіна безилат 13,9 г Бісопрололу фумарат 10,0 г Гідрофосфат калію x 2Η2Ο 189,0 (Emcompress) г Кукурудзяний крохмаль (STA RX1500) 40,1 г Повідон K-25 14,0 г Кросповідон 10,0 г Стеарат магнію 2,0 г Колоїдний діоксид кремнію 1,0г Спосіб: Обидва активні інгредієнти просіюють з використанням сита з отвором 250 мкм, потім гомогенізують з Emcompres, кукурудзяним крохмалем, повідоном, кросповідоном і колоїдним діоксидом кремнію в змішувачі барабанного типу впродовж десяти хвилин. Потім стеарат магнію додають до суміші і суміш, яка виходить, гомогенізують впродовж ще двох хвилин. Гомогенат пресують в таблетки масою 280 мг, за допомогою апарату для пресування пігулок. Таблетки упаковують в блістерну упаковку для термоформування з фольги PVC завтовшки 2 250 мкм і наносять шар покриття 60 г/м PVdC, блістер покривають алюмінієвою мембранною фольгою завтовшки 20 мкм. Результати перевірки вмісту домішок в пігулках приготованих відповідно Референсного прикладу, на дату виготовлення і після зберігання впродовж 3 місяців при 40°С/75% відносній вологості приведені нижче: Таблиця На дату виготовлення Домішок N-(2-{[4-(2-хлорфеніл)-3-(етоксикарбоніл)-5(метоксикарбоніл)-6-метил-1,4-дигідро-2-піридиніл]метокси}-етил)-аспарагінова кислота 20 25 30 Через 3 місяці (40°С/75% відносна вологість) < 0,02% 0,47% Домішки в таблетках відповідно до Референсного прикладу значно вищі після зберігання впродовж 3 місяців, що є частково наслідком хімічних властивостей ексціпієнтів, які використовуються (вологість і хімічна несумісність) частково наслідком недостатніх властивостей вологонепроникності системи упаковки. ФОРМУЛА ВИНАХОДУ 1. Стабільна тверда фармацевтична композиція, яка містить гомогенну суміш амлодипіну або його фармацевтично прийнятні солі і бісопрололу фумарату і фармацевтично прийнятні ексципієнти, упаковані в вологонепроникну упаковку і додатково містить менше ніж 0,5 % від маси активних інгредієнтів сполуки формули 10 UA 101407 C2 Cl O O O O N H O OH O N H HO 5 10 15 20 25 30 35 40 45 O ,3 2. Фармацевтична композиція за п. 1, яка відрізняється тим, що композиція містить амлодипіну безилат із числа фармацевтично прийнятних солей амлодипіну. 3. Фармацевтична композиція за п. 1, яка відрізняється тим, що композиція містить менше ніж 0,3 % сполуки формули (3). 4. Фармацевтична композиция за п. 1, яка відрізняється тим, що композиція містить менше ніж 0,2 % сполуки формули (3). 5. Фармацевтична композиція за п. 1, яка відрізняється тим, що композиція упакована в блістерну упаковку холодного формування (так звана блістерна упаковка холодного формування/CFF/) з композитної фольги OPA/AL/PVC (фольга з орієнтованого поліаміду/алюмінію/полівінілхлориду), покритої алюмінієвою мембранною фольгою. 6. Фармацевтична композиція за п. 1, яка відрізняється тим, що композиція упакована в блістерну упаковку з термоформованої вологонепроникної композитної фольги і вкрита алюмінієвою мембранною фольгою. 7. Фармацевтична композиція за п. 1, яка відрізняється тим, що композиція упакована в скляну або поліпропіленову посудину, обладнану герметичною кришкою для контейнера із поліетилену або поліпропілену. 8. Фармацевтична композиція за будь-яким з пп. 1-7, яка відрізняється тим, що є таблеткою або капсулою. 9. Фармацевтична композиція за п. 8, яка являє собою таблетку, упаковану в вологонепроникну упаковку, яка відрізняється тим, що містить 2-20 %, переважно 2-10 %, більш переважно 1-6 % основи амлодипіну або його фармацевтично прийнятної солі приєднання кислоти, переважно амлодипіну безилату 2-20 %, переважно 2-10 %, більш переважно 1-6 % бісопрололу фумарату, додатково містить 60-90 %, переважно 70-90 %, більш переважно 80-90 % наповнювача, 1-10 %, переважно 4-6 % розпушувача, 0,5-3 %, переважно 1-2 % змащувальної речовини, 0,3-2 %, переважно 0,5-1 % антиадгезійного агента, при необхідності, 1-10 %, переважно 0,1-5 % зв'язуючого агента відносно до маси таблетки. 10. Фармацевтична композиція за п. 1, яка являє собою таблетку, упаковану в блістерну упаковку холодного формування (так звана блістерна упаковка холодного формування/CFF/) із композитної фольги OPA/AL/PVC, вкритої алюмінієвою мембранною фольгою, або в блістерній упаковці із термоформованої вологонепроникної композитної фольги, покритої алюмінієвою мембранною фольгою, або в скляній, або поліпропіленовій посудині, обладнаній герметичною кришкою для контейнера із поліетилену або поліпропілену, яка містить 1-6 % амлодипіну безилату, 1-6 % бісопрололу фумарату, 80-90 % мікрокристалічної целюлози, 4-6 % натрію крохмалгліколяту, 1-2 % стеарату магнію, 0,5-1 % колоїдного діоксиду кремнію відносно до маси таблетки. 11. Фармацевтична композиція за п. 1, яка є капсулою, упакованою в блістерну упаковку холодного формування (так звана блістерна упаковка холодного формування/CFF/) із композитної фольги OPA/AL/PVC, вкрита алюмінієвою мембранною фольгою, або в блістерній упаковці із термоформованої вологонепроникної композитної фольги, вкритої алюмінієвою мембранною фольгою, або в скляну, або поліпропіленову посудину, обладнану герметичною кришкою для контейнера із поліетилену або поліпропілену, яка містить 10-15 % амлодипіну безилату, 10-15 % бісопрололу фумарату, додатково 55-65 % мікрокристалічної целюлози, 4-6 % натрію крохмалгліколяту, 1-2 % стеарату магнію, 0,5-1 % колоїдного діоксиду кремнію відносно до маси речовини, яка заповнює капсулу. 12. Спосіб виготовлення стабільної твердої упакованої лікарської форми, яка містить амлодипін і бісопролол, при якому основу амлодипіну або його фармацевтично прийнятну сіль, бісопрололу фумарату, розпушувач, змащувальну речовину і, при необхідності, додаткові 11 UA 101407 C2 5 10 15 20 ексципієнти, які використовують в фармацевтичній промисловості, гомогенізують, потім додають антиадгезійний агент, гомогенізацію продовжують, потім а) гомогенат пресують в таблетки з використанням способу прямого пресування або б) заповняють в тверді желатинові капсули відомим чином, потім одержані таблетки або капсули упаковують в вологонепроникні захисні упаковки відомим чином. 13. Спосіб виготовлення таблеток за п. 12, при якому застосовують 2-20 %, переважно 2-10 %, більш переважно 1-6 % основи амлодипіну або його фармацевтично прийнятної солі приєднання кислоти, переважно амлодипіну безилату, 2-20 %, переважно 2-10 %, більш переважно 1-6 % бісопрололу фумарату, додатково 60-90 %, переважно 70-90 %, більш переважно 80-90 % наповнювача, 1-10 %, переважно 4-6 % розпушувача, 0,5-3 %, переважно 12 % змащувальної речовини, 0,3-2 %, переважно 0,5-1 % антиадгезійного агента, при необхідності 1-10 %, переважно 0,5-1 % зв′язуючого агента відносно до маси таблеток. 14. Спосіб виготовлення капсул за п. 12, при якому застосовують 5-80 %, переважно 5-18 %, більш переважно 10-15 % основа амлодипіну або його фармацевтично прийнятної солі приєднання кислоти, переважно амлодипіну безилату, 5-80 %, переважно 5-15 %, більш переважно 10-15 % бісопрололу фумарату, додатково 1-10 %, переважно 4-6 % розпушувача, 0,5-3 %, переважно 1-2 % змащувальної речовини, 0,3-2 %, переважно 0,5-1 % антиадгезійного агента і, при необхідності, 10-75 %, переважно 45-75 %, більш перважно 55-65 % наповнювача відносно до маси речовини, яка заповнює капсулу. Комп’ютерна верстка А. Крулевський Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 12
ДивитисяДодаткова інформація
Назва патенту англійськоюNormal;heading 1;heading 2;heading 3;stable combination pharmaceutical composition containing amlodipine and bisoprolol fumarate
Автори англійськоюWagner, Laszlo, Zsigmond, Zsolt, Ujfalussy, Gyorgy, Leventiszne Huszar, Magdolna, Tonka-Nagy, Peter, Barczay, Erzsebet, Gora, Laszlone, Szeleczki, Edit, Fulop, Agnes
Назва патенту російськоюСтабильная комбинированная фармацевтическая композиция амлодипина и бисопролола фумарат
Автори російськоюВагнер Лазло, Жигмонд Золт, Уйфалушши Дьордь, Левентизне Хузар Магдолна, Тонка-Надь Петер, Барця Эржбет, Гора Ласлон, Селецки Эдит, Фюльоп Агнеш
МПК / Мітки
МПК: A61K 9/20, A61K 31/138, A61K 31/4422, A61P 9/00
Мітки: фармацевтична, амлодипіну, бісопрололу, фумарат, комбінована, стабільна, композиція
Код посилання
<a href="https://ua.patents.su/14-101407-stabilna-kombinovana-farmacevtichna-kompoziciya-amlodipinu-ta-bisoprololu-fumarat.html" target="_blank" rel="follow" title="База патентів України">Стабільна комбінована фармацевтична композиція амлодипіну та бісопрололу фумарат</a>
Попередній патент: Спосіб визначення довжини хвилі в металодіелектричному хвилеводі
Наступний патент: Пристрій поступально-реверсивного переміщення вихідної ланки
Випадковий патент: Спосіб профілактики остеомієліту при переломах кісток верхніх кінцівок