Тверда дозована форма гіпурату (s)-2-аміно-3-(4-(2-аміно-6-((r)-1-(4-хлор-2-(3-метил-1н-піразол-1-іл)феніл)-2,2,2-трифторетокси)піримідин-4-іл)феніл)пропаноату
Номер патенту: 114412
Опубліковано: 12.06.2017
Автори: Дівер Меттью С., Нугуру Каліан, Холл Річард Дж., Чень Цзиньлін
Формула / Реферат
1. Таблетка, отримана з інтрагранулярних і екстрагранулярних компонентів, де інтрагранулярні компоненти складаються із гіпурату (S)-2-аміно-3-(4-(2-аміно-6-((R)-1-(4-хлор-2-(3-метил-1Н-піразол-1-іл)феніл)-2,2,2-трифторетокси)піримідин-4-іл)феніл)пропаноату, безводної лактози, гідроксипропілцелюлози, натрію кроскармелози, стеарату магнію, і екстрагранулярні компоненти складаються з безводної лактози, натрію кроскармелози, колоїдного діоксиду кремнію і стеарату магнію.
2. Таблетка за п. 1, в якій гіпурат (S)-2-аміно-3-(4-(2-аміно-6-((R)-1-(4-хлор-2-(3-метил-1Н-піразол-1-іл)феніл)-2,2,2-трифторетокси)піримідин-4-іл)феніл)пропаноату є кристалічним.
3. Таблетка за п. 1, яка є покритою ентеросолюбільним покриттям.
4. Таблетка за п. 1, яка містить щонайменше 100 мг гіпурату (S)-2-аміно-3-(4-(2-аміно-6-((R)-1-(4-хлор-2-(3-метил-1Н-піразол-1-іл)феніл)-2,2,2-трифторетокси)піримідин-4-іл)феніл)пропаноату.
5. Таблетка за п. 4, яка містить щонайменше 200 мг гіпурату ((S)-2-аміно-3-(4-(2-аміно-6-((R)-1-(4-хлор-2-(3-метил-1Н-піразол-1-іл)феніл)-2,2,2-трифторетокси)піримідин-4-іл)феніл)пропаноату.
Текст
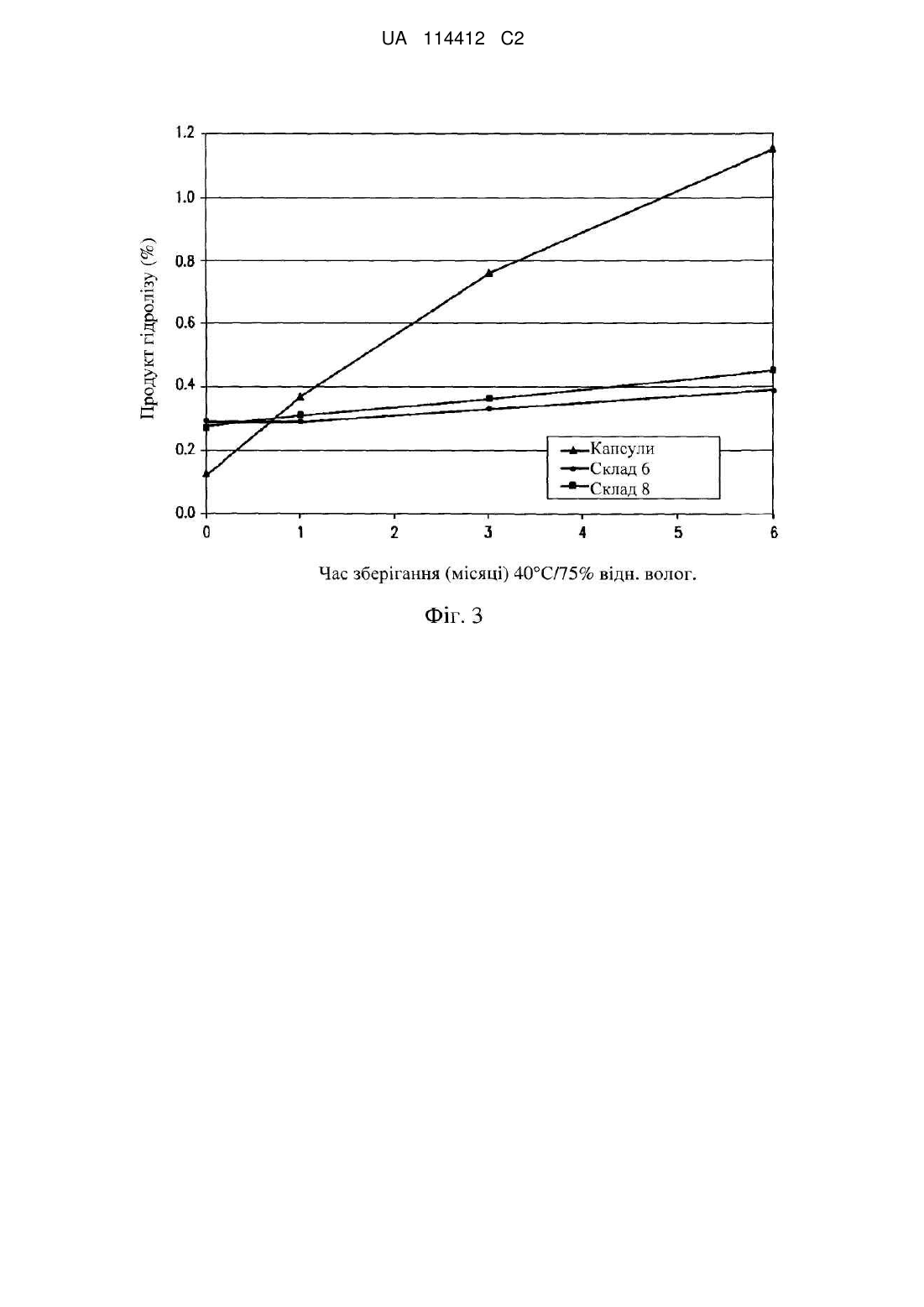
Реферат: Винахід стосується твердої фармацевтичної дозованої форми, яка містить гіпурат (S)-етил 2аміно-3-(4-(2-аміно-6-((R)-1-(4-хлор-2-(3-метил-1Н-піразол-1-іл)феніл)-2,2,2трифторетокси)піримідин-4-іл)феніл)пропаноату. UA 114412 C2 (12) UA 114412 C2 UA 114412 C2 5 10 15 20 25 30 35 40 45 50 55 60 По даній заявці заявляється пріоритет згідно з попередньою заявкою на патент США № 61/547894, поданою 17 жовтня 2011 року, зміст якої повністю включений в дану заявку за допомогою посилання. Галузь техніки, до якої належить винахід Даний винахід стосується твердих фармацевтичних дозованих форм (S)-етил 2-аміно-3-(4(2-аміно-6-((R)-1-(4-хлор-2-(3-метил-1H-піразол-1-іл)феніл)-2,2,2-трифторетокси)піримідин-4іл)феніл)пропаноату (телотристату). Передумови створення винаходу Сполука, якої стосується даний винахід, а саме (S)-етил 2-аміно-3-(4-(2-аміно-6-((R)-1-(4хлор-2-(3-метил-1H-піразол-1-іл)феніл)-2,2,2-трифторетокси)піримідин-4-іл)феніл)пропаноат (телотристат) являє собою інгібітор триптофан гідроксилази, тобто ферменту, який відповідає за швидкість-визначальну стадію біосинтезу 5-гідрокситриптаміну (серотоніну). Див., наприклад, патент США № 7709493. Вважається, що ця сполука застосовна в лікуванні захворювань і розладів, пов'язаних з аномальними рівнями серотоніну, наприклад, синдрому подразненого кишечнику з переважанням діареї і карциноїдного синдрому. На жаль, фізико-хімічні властивості телотристату утруднюють його включення в комерційно доцільні дозовані форми. Телотристат гідролізується при контакті з водою. Тому дозовані форми, які містять його, повинні в максимально можливій мірі обмежувати це руйнування, і виготовлення цих дозованих форм потрібно здійснювати із застосуванням способів, які обмежують вплив вологи на сполуку. Погана сипкість кристалічного гіпурату телотристату (телотристату етипрату) додатково ускладнює виробництво включаючих його дозованих форм. Ще більше ускладнює проблему необхідність отримання дозованої лікарської форми, яка містить не менше 100 мг діючої сполуки і швидко вивільнює її при пероральному введенні. Внаслідок вказаних факторів, існує потреба в отриманні твердих дозованих форм телотристату, які можна зберігати при звичайних рівнях температури і вологості протягом комерційно доцільного періоду часу, а також в розробці способів їх виготовлення. Переважні дозовані форми повинні мати здатність швидко доставляти сполуку після перорального прийому. Особливо необхідні склади телотристату в формі таблеток з швидким вивільненням, які мають хорошу хімічну стійкість, задовільну пероральну біодоступність, хороші технологічні властивості і високий вміст діючого начала. Суть винаходу Даний винахід направлений на тверді дозовані форми телотристату. Конкретні дозовані форми являють собою таблетки, виготовлені на основі гіпурату телотристату (телотристату етипрату). Один з варіантів здійснення винаходу стосується таблетки, яка підходить для введення пацієнту, що містить, щонайменше 100, 200 або 300 мг діючого фармацевтичного інгредієнта (API), де вказана таблетка має час руйнування у воді менший ніж 10, 5,0, 2,3, 2,0 або 1,8 хвилини, причому API являє собою телотристат або його фармацевтично прийнятну сіль. Інший варіант здійснення винаходу стосується таблетки, яка підходить для введення пацієнту, що містить щонайменше 100, 200 або 300 мг API в перерахунку на вільну основу, де вказана таблетка забезпечена покриттям і має час руйнування у воді менший ніж 5,5, 4,5 або 4,0 хвилини, причому API являє собою телотристат або його фармацевтично прийнятну сіль. Наступний варіант здійснення стосується таблетки, що має ядро, яке складається в основному з телотристату гіпурату, лактози, гідроксипропілцелюлози, натрій кроскармелози, стеарату магнію і діоксиду кремнію. Ще один варіант здійснення стосується таблетки, що містить телотристат або його фармацевтично прийнятну сіль, в якій утворюється менше ніж 1,0, 0,8 або 0,5 процента (S)-2аміно-3-(4-(2-аміно-6-((R)-1-(4-хлор-2-(3-метил-1H-піразол-1-іл)феніл)-2,2,2трифторетокси)піримідин-4-іл)феніл)пропанової кислоти при зберіганні при температурі приблизно 40 °C і відносній вологості приблизно 75 % протягом шести місяців. Інший варіант здійснення стосується таблетки, що містить телотристат або його фармацевтично прийнятну сіль, в якій утворюється менше ніж приблизно 0,5, або 0,4 процента (S)-2-аміно-3-(4-(2-аміно-6-((R)-1-(4-хлор-2-(3-метил-1H-піразол-1-іл)феніл)-2,2,2трифторетокси)піримідин-4-іл)феніл)пропанової кислоти при зберіганні при температурі приблизно 40 °C і відносній вологості приблизно 75 % протягом трьох місяців. Наступний варіант здійснення стосується гранул, що містять телотристат етипрат, лактозу, гідроксипропілцелюлозу, натрій кроскармелозу, стеарат магнію і діоксид кремнію. Ще один варіант здійснення стосується способу отримання таблеток, який включає: змішування гранул, які містять інтрагранулярні (включені в гранули) інгредієнти зі щонайменше одним екстрагранулярним (не включеним в гранули) інгредієнтом і пресування гранул з 1 UA 114412 C2 5 10 15 20 25 30 35 40 45 50 отриманням таблеток; де інтрагранулярні інгредієнти містять телотристат або його фармацевтично прийнятну сіль, стеарат магнію і лактозу; і щонайменше один екстрагранулярний інгредієнт являє собою лактозу. Короткий опис ілюстративних матеріалів Деякі аспекти даного винаходу можна зрозуміти, звернувшись до прикладених ілюстративних матеріалів. На фіг. 1 показана дифрактограма на порошку (XRPD) кристалічної форми телотристату. Дифрактограму реєстрували з використанням дифрактометра Rigaku MiniFlex (випромінювання міді Kα). На фіг. 2 показана дифрактограма XRPD кристалічної форми телотристату етипрату. Дифрактограму реєстрували з використанням дифрактометра Bruker D8 Advance (випромінювання міді Kα). На фіг. 3 показаний вплив температури, вологості і часу на утворення продукту гідролізу, тобто (S)-2-аміно-3-(4-(2-аміно-6-((R)-1-(4-хлор-2-(3-метил-1H-піразол-1-іл)феніл)-2,2,2трифторетокси)піримідин-4-іл)феніл)пропанової кислоти в різних дозованих формах телотристату. Докладний опис винаходу Даний винахід направлений на тверді фармацевтичні дозовані форми, в якого діючий фармацевтичний інгредієнт (API) являє собою (S)-етил 2-аміно-3-(4-(2-аміно-6-((R)-1-(4-хлор-2(3-метил-1H-піразол-1-іл)феніл)-2,2,2-трифторетокси)піримідин-4-іл)феніл)пропаноат (телотристат): або його фармацевтично прийнятну сіль. Цю сполуку, її солі і кристалічні форми можна отримувати способами, відомими в техніці. Див., наприклад, патент США № 7709493. Деякі дозовані форми за даним винаходом включають кристалічний телотристат в формі вільної основи. Одна з форм цієї сполуки має температуру плавлення приблизно 104 °C за даними диференціальної скануючої калориметрії (DSC) (температура початку плавлення). В зв'язку з температурами, що визначаються в методиці DSC, термін "приблизно" означає ±3 °C. Дифрактограма на порошку (XRPD) для цієї форми містить піки при кутах 2θ, які дорівнюють приблизно 10,7, 12,2, 12,8, 17,7 і/або 22,0 градусів. Як добре відомо фахівцеві в даній галузі, відносна інтенсивність піків на дифрактограмі XRPD кристалічного матеріалу може змінюватися залежно від способу приготування зразка і методики реєстрації даних. З урахуванням цього факту, приклад дифрактограми XRPD даної кристалічної форми приведений на фіг. 1. Інші конкретні дозовані форми містять гіпурат телотристату (телотристату гіпурат; телотристат етипрат). Конкретна кристалічна форма цієї солі має температуру плавлення приблизно 142 °C (температура початку плавлення по даних DSC, піків при температурі приблизно 147 °C). Дифрактограма XRPD цієї кристалічної форми містить піки при кутах 2θ, які дорівнюють приблизно 8,2, 9,5, 12,6, 16,9, 21,8, 22,0, 22,7, 24,3 і/або 29,1 градусів. Приклад дифрактограми XRPD даної форми приведений на фіг. 2. При контакті з водою, телотристат здатний гідролізуватися з утворенням (S)-2-аміно-3-(4-(2аміно-6-((R)-1-(4-хлор-2-(3-метил-1H-піразол-1-іл)феніл)-2,2,2-трифторетокси)піримідин-4іл)феніл)пропанової кислоти. Переважні дозовані форми за даним винаходом зводять це розкладання до мінімуму. На фіг. 3 показана відмінність між двома таблетками за даним винаходом - складами 6 і 8, описаними в прикладах нижче по тексту, і капсульною дозованою формою, яка використовувалася в ході фаз 1 і 2 клінічних випробувань у людей. Ці капсули містили суміш 250 мг телотристату і 2 % стеарату магнію. Обидва склади таблеток виявилися явно більш стабільними, ніж склад капсули. Біодоступність API може значною мірою залежати від складу, в якому діючий інгредієнт доставляється пацієнту. У цьому випадку, бажано отримати таблетки, які швидко руйнуються при введенні пацієнту. Конкретні таблетки без покриття за даним винаходом мають час руйнування у воді менший 2,3, 2,0 або 1,8 хвилин, або менший 4,0, 3,0 або 2,7 хвилин в 0,1 н 2 UA 114412 C2 5 10 15 20 25 30 35 40 45 50 55 60 HCl. Конкретні таблетки з покриттям за даним винаходом мають час руйнування у воді менший 5,5, 4,5 або 4,0 хвилин, або менший 5,4, 5,0 або 4,8 хвилин в 0,1 н HCl. У даній заявці термін "час руйнування" стосується часу руйнування в 100 мл очищеної води або 0,1 н HCl, який вимірюють по методиці тесту USP . На руйнування таблетки можуть впливати дезінтегруючі засоби, які містяться в цій таблетці. Приклади дезінтегруючих засобів включають альгінати, целюлоза, натрій кроскармелозу, кросповідон і натрій крахмалгліколят. Переважним дезінтегруючим засобом є натрій кроскармелоза. Однак здатність таблетки швидко руйнуватися або розчинятися повинна бути збалансованою, в зв'язку з необхідністю того, щоб таблетка зберігала цілісність всередині своєї упаковки. Так, наприклад, конкретні таблетки за даним винаходом мають твердість більшу 8, 9 або 10 КПа і стираність меншу 0,4, 0,3 або 0,25 (втрата в процентах). На твердість і стійкість таблетки впливають ексципієнти, які містяться в ній. Ці ексципієнти можуть також впливати на легкість отримання таблетки (наприклад, за рахунок впливу на сипкість інгредієнтів таблетки і здатність до пресування). Конкретні таблетки за даним винаходом включають телотристат етипрат, целюлозу, лактозу, натрій кроскармелозу, стеарат магнію і діоксид кремнію. Даний винахід охоплює способи отримання твердих дозованих форм телотристату і його солей, які обмежують дію вологи на ці сполуки і вирішують проблеми, пов'язані з поганою сипкістю, яку демонструють багато форм діючої сполуки. У конкретному варіанті здійснення, для отримання гранульованого матеріалу ("грануляту"), що складається з гранул, які включають діючу сполуку, застосовують пресування на роликовому пресі, і отримані гранули потім змішують з додатковими інгредієнтами і пресують, отримуючи ядро таблетки. Потім це ядро необов'язково покривають оболонкою для збільшення стабільності готової таблетки. Гранули, які складаються з дрібнодисперсних частинок, містять телотристат етипірат, гідроксипропіл целюлозу, лактозу, натрій кроскармелозу, стеарат магнію і діоксид кремнію. Переважні грануляти мають хорошу сипкість і пресованість, що дозволяє легко отримувати таблетки, які мають бажану твердість, стабільність і здатність до руйнування, які описані в даній заявці. Тверді дозовані форми (наприклад, таблетки) за даним винаходом можуть бути упаковані способами і із застосуванням контейнерів, які відомі в техніці. З пакувального матеріалу можна формувати велике число окремих контейнерів, як, наприклад, в розділеному на осередки флаконі або розділеному на осередки пакеті з фольги. Цей контейнер може мати будь-яку стандартну форму, або форму, відому в техніці, і може бути виготовлений з фармацевтично прийнятного матеріалу, наприклад, може являти собою коробку з паперу або картону, скляний або пластмасовий флакон або банку з осушувачем або без нього, пакет, який можна закривати повторно (наприклад, що містить додаткову порцію таблеток для вміщення їх в інший контейнер) або блістерну упаковку (наприклад, блістери з матеріалу Aclar або блістери фольга/фольга) з індивідуальними дозами, які видавлюють з упаковки відповідно до розкладу введення. У переважному варіанті здійснення, таблетки зберігають у флаконах з HDPE, які запаяні індукційним способом і містять пакетик осушувача. ПРИКЛАДИ 1. Таблетки і визначення характеристик інгредієнтів Тест на руйнування таблеток проводили згідно з USP , використовуючи методику тесту для таблеток без покриття і таблеток з гладким покриттям. Руйнування таблеток здійснювали в 1000 мл очищеної води або 0,1 н HCl. Кінець руйнування визначали візуально. Розчинення таблеток визначали в 900 мл 0,1 н HCl при 37 °C, використовуючи апарат 2 USP (мішалку з лопатями) при швидкості обертання 50 об./хв. Фільтрати розчинів, отриманих в тесті на розчинення, збирали через певні інтервали часу. Зразки аналізували за допомогою високоефективної рідинної хроматографії (ВЕРХ), використовуючи колонку PhenomenexSynergi 4μ Max-RP і суміш 70/30/0,2 (об'єм/об'єм/об'єм) метанол/вода/фосфорна кислота як рухома фаза при швидкості потоку 1,0 мл/хв… В системі ВЕРХ використали ультрафіолетове (УФ) детектування на довжині хвилі 237 нм. Розмір частинок грануляту визначали за допомогою просіювання, для чого фіксували вагу кожного з декількох сит (25, 40, 60, 100, 140, 230 меш і більш дрібні), сита складали стосом, в якому сита з більш грубими комірками розташовані вище, а з більш дрібними - нижче, і вміщували на верхнє сито приблизно 5 грамів грануляту. Набір сит скріплювали і вміщували на ультразвукової просіювач ATM Sonic sifter, встановлюючи амплітуду імпульсу і амплітуду просіювання на положення 5. Через 5 хвилин сита знімали з просіювача і зважували окремі сита разом з вмістом. Сипкість визначали за допомогою приладу J.R.Johanson Flow Indicizer. 2. Загальна методика отримання таблеток 3 UA 114412 C2 5 10 15 20 25 Таблетки, що включають 300 мг (в перерахунку на вільну основу) API телотристату в формі гіпурату, виготовляли способом, що включав дві основні стадії. На першій стадії отримували гранули, що включають кристалічний телотристат етипрат і ряд ексципієнтів (інтрагранулярних компонентів). Матеріал пресували, використовуючи роликовий прес, і подрібнювали. Потім отримані гранули змішували з додатковими ексципієнтами ("екстрагранулярними компонентами") і пресували отриману суміш, отримуючи таблетки. У деяких випадках на таблетки наносили покриття. Суміші для отримання таблеток готували, просіваючи всі інтрагранулярні матеріали, крім стеарату магнію, через сито 20 меш. Компоненти змішували в V-подібному блендері необхідного об'єму протягом 10 хвилин. Інтрагранулярний стеарат магнію змішували з частиною суміші і повторно просівали через сито 20 меш. Потім просіяну суміш, що включала стеарат магнію, вміщували в V-подібний блендер і перемішували протягом ще трьох хвилин. Потім суміш пресували, використовуючи роликовий прес Vector TF-Mini з цільовою товщиною стрічки 1,5 мм. Отримані стрічки продукту подрібнювали, пропускаючи їх при дії вібрації через сита 14 меш і 20 меш. Всі екстрагранулярні компоненти за винятком стеарату магнію змішували і просівали через сито 20 меш. Приблизно половину грануляту вміщували в V-подібний блендер і потім додавали в нього просіяні екстрагранулярні компоненти. Завантажували в блендер половину грануляту, що залишилася, і здійснювали перемішування протягом п'яти хвилин. Невелику частину суміші відділяли, змішували зі стеаратом магнію і пропускали через сито 20 меш. Суміш, що включає стеарат магнію, завантажували в V-подібний блендер і перемішували протягом ще трьох хвилин. Отриману в результаті суміш пресували в 300-мг таблетки LX-1606. Деякі партії таблеток забезпечували покриттям в пристрої для нанесення покриття в киплячому шарі Strea 1 Fluid Bed Coater з використанням складу Opadry 2 Clear до приросту маси на 4 %. 3. Склад 1 У цьому прикладі таблетки отримували з інгредієнтів, перерахованих в приведеній нижче в таблиці 1: Таблиця 1 Інтрагранулярні компоненти (мг/таблетка) API Лимонна кислота, безводна Лактоза, безводна Гідроксипропілцелюлоза Натрій кроскармелоза Стеарат магнію Екстрагранулярні компоненти (мг/таблетка) Лактоза, безводна Натрій кроскармелоза Колоїдний діоксид кремнію Стеарат магнію Загальна маса ядра таблетки 402,12* 83,79 90,77 34,91 20,95 3,49 34,28 20,95 3,49 5,24 700,0 *Еквівалентно 300 мг телотристату в формі вільної основи. 30 35 40 На першій стадії інтрагранулярні компоненти змішували і пресували на роликовому пресі під 2 тиском 70 кг/см . Отримані стрічки мали товщину 0,99-1,42 мм. Здійснювали стендовий тест на руйнування стрічки, вміщуючи шматок стрічки довжиною один дюйм в склянку, що містить приблизно 500 мл DI води і залишали руйнуватися. Руйнування стрічки сталося за 12,5 хвилин. Огляд валків роликового преса показав, що сталося деяке налипання складу, що пресується. Стрічки продукту подрібнювали, послідовно пропускаючи їх при дії вібрації через сита 14 меш і 20 меш. Гранулят змішували з екстрагранулярними компонентами і проводили фізичні тести. Гранулят мав погану сипкість, і в первинному варіанті у таблеток спостерігалися коливання маси і низька середня маса таблетки. На першій партії отриманих таблеток були також борозенки і фарбування. Крім того, спочатку отримана партія таблеток не пройшла тест на стираність з межею втрати маси (0,8 %, оскільки налипання заважало збільшенню тиску при пресуванні, що могло б поліпшити стираність). Ці проблеми вдалося подолати шляхом збільшення вмісту екстрагранулярного стеарату магнію на 0,25 %, змішавши додатковий стеарат магнію із залишком суміші (вміст стеарату магнію, приведений в таблиці 1, відображає 4 UA 114412 C2 цю додаткову кількість). Отриману остаточну суміш пресували в таблетки (0,300"×0,680" в формі капсули). При цьому налипання більше не спостерігалося. Характеристики грануляту і таблеток показані в приведеній нижче таблиці 2: Таблиця 2 Приблизний час руйнування стрічки (хв.) Об'ємна густина до ущільнення (г/мл) Об'ємна густина після ущільнення (г/мл) Середній коефіцієнт швидкості потоку (кг/сек.) Діапазон твердості ядра (кПа) Середня маса ядра (г) Середня товщина таблетки (мм) Стираність таблетки (% втрати) 12,5 0,6644 0,886 0,511 8,1-12,0 0,679 5,65 0,3 5 Параметри розчинності таблетки показані в приведеній нижче таблиці 3: Таблиця 3 Час (хв.) 10 20 30 45 60 10 % Вивільнення діючого начала 50,7 81,6 94,6 98,2 98,2 4. Склад 2 У цьому прикладі виготовляли таблетки з інгредієнтів, перерахованих нижче в таблиці 4: Таблиця 4 Інтрагранулярні компоненти (мг/таблетка) API Лимонна кислота, безводна Мікрокристалічна целюлоза Гідроксипропілцелюлоза Натрій кроскармелоза Стеарат магнію Екстрагранулярні компоненти (мг/таблетка) Мікрокристалічна целюлоза Натрій кроскармелоза Колоїдний діоксид кремнію Стеарат магнію Загальна маса ядра таблетки 15 20 403,13 84,00 89,25 35,00 28,00 5,25 18,62 28,00 3,50 5,25 700,0 На першій стадії інтрагранулярні компоненти змішували і пресували роликовим пресом під 2 тиском 45 кг/см . Товщина стрічки продукту знаходилася в межах 1,16-1,46 мм. Стендовий тест на руйнування стрічки показав, що час руйнування становить 3 хвилини. При пресуванні на роликовому пресі спостерігалося певне налипання суміші. Стрічки продукту подрібнювали, послідовно пропускаючи їх при дії вібрації через сита 14 меш і 20 меш. У даному прикладі стрічки були твердими і подрібнювалися тяжко. Приблизно 0,75 % партії не пройшло через вібраційний пристрій. Гранулят змішували з екстрагранулярними компонентами і проводили фізичні тести. Гранулят продемонстрував погані характеристики сипкості, хоча піддавався пресуванню. При пресуванні таблеток спочатку спостерігалося невелике налипання суміші на форму для пресування, але воно зменшилося після очищення форми. Таблетки мали матову поверхню, і цей недолік зберігався при збільшенні зусилля пресування. 5. Склад 3 5 UA 114412 C2 У цьому прикладі виготовляли таблетки, використовуючи інгредієнти, перераховані в приведеній нижче в таблиці 5: Таблиця 5 Інтрагранулярні компоненти (мг/таблетка) API Лимонна кислота, безводна Мікрокристалічна целюлоза Гідроксипропілцелюлоза Кросповідон Стеарат магнію Екстрагранулярні компоненти (мг/таблетка) Мікрокристалічна целюлоза Кросповідон Колоїдний діоксид кремнію Стеарат магнію Загальна маса ядра таблетки 5 10 15 403,13 84,00 89,25 35,00 28,00 5,25 18,62 28,00 3,50 5,25 700,0 2 Суміш інтрагранулярних компонентів пресували роликовим пресом під тиском 50 кг/см . Товщина стрічки продукту знаходилася в межах 1,40-1,90 мм. Стендовий тест на руйнування стрічки показав небажаний час руйнування, який дорівнював 11 хвилинам. При пресуванні на роликовому пресі спостерігалося певне налипання суміші. Стрічки були аналогічні стрічкам складу 2 і насилу піддавалися подрібненню. Гранулят змішували з екстрагранулярними компонентами і проводили фізичні тести. Гранулят демонстрував погану сипкість, і при пресуванні в приймальному бункері спостерігалося певне злипання, яке вдавалося подолати струшуванням бункера. Пресування таблеток здійснювалося без видимих проблем. Однак тест на руйнування таблеток у воді і 0,1 н HCl показав, що час руйнування таблеток значно перевищує відповідний показник для інших складів, і це дало основу передбачити, що в складах даного типу кросповідон є менш ефективним дезінтегруючим засобом, ніж натрій кроскармелоза. 6. Склад 4 У цьому прикладі гранули виготовляли з використанням інгредієнтів, перерахованих в приведеній нижче таблиці 6: 20 Таблиця 6 Інтрагранулярні компоненти (мг/таблетка) API Лимонна кислота, безводна Маніт Мікрокристалічна целюлоза Гідроксипропілцелюлоза Кросповідон Стеарат магнію 25 403,13 84,00 44,45 44,80 35,00 28,00 5,25 Оскільки тести на руйнування, виконані для стрічки, виготовленої з цієї суміші, продемонстрували час руйнування 11 хвилин, подальші роботи над цим складом не проводилися. 7. Склад 5 У цьому прикладі виготовляли таблетки, використовуючи інгредієнти, перераховані в приведеній нижче таблиці 7: 6 UA 114412 C2 Таблиця 7 Інтрагранулярні компоненти (мг/таблетка) API Лимонна кислота, безводна Маніт Гідроксипропілцелюлоза Натрій кроскармелоза Стеарат магнію Екстрагранулярні компоненти (мг/таблетка) Мікрокристалічна целюлоза Натрій кроскармелоза Колоїдний діоксид кремнію Стеарат магнію Загальна маса ядра таблетки 403,13 84,00 44,45 35,00 28,00 5,25 18,62 28,00 3,50 5,25 700,0 2 5 10 15 20 25 30 Суміш інтрагранулярних компонентів пресували роликовим пресом під тиском 50 кг/см . Товщина стрічки продукту знаходилася в межах 1,37-1,83 мм. Стендовий тест на руйнування стрічки показав, що час руйнування становив 1 хвилину. При пресуванні спостерігалося незначне налипання складу на ролики. Гранулят змішували з екстрагранулярними компонентами і проводили фізичні тести. Гранулят продемонстрував погану сипкість, але пресування таблеток пройшло без помітних проблем. Твердість складу могла досягати більше 18 КПа. Тестування руйнування таблеток у воді і 0,1 н HCl показало прийнятний час руйнування для таблеток з негайним вивільненням: 2,0 хвилини у воді 4,0-5,25 хвилин в 0,1 н HCl. Однак аналіз і тестування на похідні речовини показали, що вміст сполуки, яка, ймовірно, є продуктом гідролізу API, зростав до неприйнятних значень вже через місяць зберігання при 40 °C/75 % відносній вологості без поглинача вологи. Отримували додаткову порцію складу 5 і в цьому випадку виготовлені таблетки покривали 2 складом Opadry Clear. Компоненти грануляту пресували роликовим пресом під тиском 50 кг/см , отримуючи товщину стрічки продукту в межах 1,24-1,57 мм. За даними стендового тесту, час руйнування стрічки продукту становив 3,25 хв. Під час пресування спостерігалося мінімальне налипання продукту на ролики. Крім того, спостерігалося налипання суміші на стінки бункера і погана сипкість суміші. Гранулят змішували з екстрагранулярними компонентами і проводили фізичні тести. Налипання спостерігалося через 5 хвилин після початку пресування таблеток. Форму для пресування очищали і поновлювали пресування, але налипання складу для отримання таблеток поновлювалося негайно, вказуючи на те, що грануляту може бути потрібне додаткове змащування або збільшення часу змазування для подолання проблеми з налипанням. На отримані таблетки наносили покриття до приросту маси 4 %. Профіль розчинення цих таблеток був прийнятним, хоча час руйнування таблеток у воді і 0,1 н HCl був істотно вищим, ніж для таблеток без покриття. Аналіз і тестування на похідні речовини показали, що покриття таблеток до приросту маси в 4 % знижувало ступінь розпаду API, причому цей ступінь можна було знизити ще більше, застосовуючи поглинач вологи. 8. Склад 6 У цьому прикладі виготовляли таблетки, використовуючи інгредієнти, перераховані в приведеній нижче таблиці 8: 7 UA 114412 C2 Таблиця 8 Інтрагранулярні компоненти (мг/таблетка) API Маніт Мікрокристалічна целюлоза Гідроксипропілцелюлоза Натрій кроскармелоза Стеарат магнію Екстрагранулярні компоненти (мг/таблетка) Мікрокристалічна целюлоза Натрій кроскармелоза Колоїдний діоксид кремнію Стеарат магнію Загальна маса ядра таблетки 403,13 86,45 86,45 35,00 28,00 5,25 18,97 28,00 3,50 5,25 700,0 2 5 10 15 Суміш інтрагранулярних компонентів пресували роликовим пресом під тиском 50 кг/см . Товщина стрічки продукту знаходилася в межах 1,11-1,52 мм. Стендовий тест на час руйнування стрічки показав, що цей час дорівнює 1 хвилині. При пресуванні спостерігалося дуже незначне налипання складу на ролики. Хоча гранулят продемонстрував погану сипкість, його змішували і пресували в таблетки, причому під час пресування спостерігалося незначне налипання. При тестуванні на стираність, таблетки продемонстрували певну схильність до фарбування. Час розчинення і руйнування становив 1,3-1,5 хвилини у воді і 1,5-2,8 хвилин в 0,1 н HCl. Ці таблетки виявилися дуже стабільними (площа піка на хроматограмі 0,23 % через 1 місяць зберігання при 40 °C/75 % відн. волог.) і ще більша стабільність була виявлена при зберіганні в присутності поглинача вологи (площа 0,16 % через 1 місяць зберігання при 40 °C/75 % відн. волог.). 9. Склад 7 У цьому прикладі виготовляли таблетки, використовуючи інгредієнти, перераховані в приведеній нижче таблиці 9: Таблиця 9 Інтрагранулярні компоненти (мг/таблетка) API Лимонна кислота, безводна Лактоза, безводна Гідроксипропілцелюлоза Натрій кроскармелоза Стеарат магнію Екстрагранулярні компоненти (мг/таблетка) Лактоза, безводна Натрій кроскармелоза Колоїдний діоксид кремнію Стеарат магнію Загальна маса ядра таблетки 403,13 84,00 80,50 35,00 28,00 5,25 27,37 28,00 3,50 5,25 700,0 2 20 25 Суміш інтрагранулярних компонентів пресували роликовим пресом під тиском 50 кг/см . Товщина стрічки продукту знаходилася в межах 1,45-1,63 мм. Стендовий тест показав, що час руйнування стрічки дорівнює 3 хвилинам. При пресуванні спостерігалося дуже незначне налипання складу на ролики. Гранулят, який продемонстрував погану сипкість, змішували і пресували в таблетки. На лицьовій стороні форми і стінках штампу під час пресування таблеток спостерігалося налипання матеріалу. При тестуванні на стираність також було відмічено фарбування. Час розчинення і руйнування знаходився в прийнятному діапазоні, хоч аналіз і тестування на наявність похідних речовин показали значне збільшення вмісту передбачуваного продукту гідролізу API при зберіганні протягом одного місяця в умовах прискореного старіння 8 UA 114412 C2 5 без поглинача вологи (площа 1,01 % через 1 місяць зберігання при 40 °C/75 % відн. волог.). Поглинач вологи зменшував спостережуваний рівень продукту гідролізу до 0,16 %. 10. Склад 8 У цьому прикладі виготовляли таблетки, використовуючи інгредієнти, перераховані в приведеній нижче таблиці 10: Таблиця 10 Інтрагранулярні компоненти (мг/таблетка) API Лактоза, безводна Гідроксипропілцелюлоза Натрій кроскармелоза Стеарат магнію Екстрагранулярні компоненти (мг/таблетка) Лактоза безводна Натрій кроскармелоза Колоїдний діоксид кремнію Стеарат магнію Загальна маса ядра таблетки 403,13 164,50 35,00 35,00 5,25 27,37 21,00 3,50 5,25 700,0 2 10 15 Суміш інтрагранулярних компонентів пресували роликовим пресом під тиском 55 кг/см . Товщина стрічки продукту знаходилася в межах 1,07-1,52 мм. Суміш дуже добре піддавалася обробці, утворюючи довгі стрічки. Стендовий тест на час руйнування стрічки показав, що цей час дорівнює 2,5 хвилинам. Приблизно 2 % стрічки не могло пройти через вібруюче сито 20 меш. Гранулят змішували і пресували в таблетки. Пресування суміші проходило добре, і налипання не спостерігалося. На поверхні таблеток спостерігалася невелика кількість незначних виїмок. Фізичні характеристики грануляту і таблеток показані в приведеній нижче таблиці 11: Таблиця 11 Приблизний час руйнування стрічки (хв.) Діапазон твердості ядра (кПа) Середня маса ядра (г) Середня товщина таблетки (мм) Стираність таблетки (% втрати) 20 2,5 8,5-11,9 0,711 6,03 0,3 Таблетки мали прийнятний профіль руйнування: таблетки без покриття руйнувалися протягом 1,8-2,3 хвилин у воді і 2,7-4,0 хвилин в 0,1 н HCl; таблетки з покриттям руйнувалися протягом 3,1-5,5 хвилин у воді і 4,4-5,4 хвилин в 0,1 н HCl. Профіль розчинення таблеток показаний в приведеній нижче таблиці 12: Таблиця 12 Час (хв.) 10 20 30 45 25 Середній % заявленого вмісту Таблетки без покриття Таблетки з покриттям 93,6 84,6 98,3 94,7 99,5 96,0 99,8 96,0 Даний склад показав хороші результати при дослідженні стабільності, причому вміст продукту гідролізу був невеликим, а саме: в таблетках без покриття за відсутністю поглинача вологи (площа 0,39 % через 1 місяць зберігання при 40 °C/75 % відн. волог.), в таблетках без покриття при наявності поглинача вологи (площа 0,32 % через 1 місяць зберігання при 40 °C/75 % відн. волог.), в таблетках з покриттям при наявності поглинача вологи (площа 0,31 % через 1 місяць зберігання при 40 °C/75 % відн. волог.), в блістерах з матеріалу Aclar (площа 9 UA 114412 C2 5 0,42 % через 1 місяць зберігання при 40 °C/75 % відн. волог.) і в блістерах фольга/фольга (площа 0,39 % через 1 місяць зберігання при 40 °C/75 % відн. волог.). 11. Дослідження стабільності таблеток Стабільність таблеток визначали за допомогою методики на основі ВЕРХ на зворотній фазі, яку проводили при наступних умовах: Waters XTerra MS C18 (4,6150 мм, розмір частинок 3,5 мкм) 40 °C Колонка: Температура колонки: Температура автоматичного пристрою подачі зразків: Рухома фаза А: Рухома фаза В: Швидкість потоку: Довжина хвилі детектування: Об'єм вприску: Час реєстрації даних: 5 °C 0,05 % TFA у воді 0,05 % TFA в ACN 1,0 мл/хв. 254 нм 5 мкл 41 хвилина Гарантує потрапляння піка в діапазон вимірювань Виведення даних: Використовувалася наступна програма роботи насоса: Час (хв.) 0 30 35 36 41 Рухома фаза А (%) 100 5 5 100 100 Рухома фаза В (%) 0 95 95 0 0 10 15 20 25 30 Стандартний розчин готували, розчиняючи телотристат етипрат в ТГФ в концентрації приблизно 0,25 мкг/мл. Зразки отримували з 300 мг таблеток по наступній методиці: 1) зважували, як мінімум, 4 таблетки; 2) подрібнювали таблетки за допомогою ступки і товкача; 3) кількість, еквівалентну приблизно 50 мг діючої речовини (тобто приблизно 117 мг) зважували і переносили в 100-мл мірну колбу; 4) додавали в колбу розріджувач (ТГФ) в кількості приблизно 1/2-2/3 об'єму колби; 5) вміщували колбу на шейкер і струшували не менше 20 хвилин на низькій швидкості; 6) потім розчин розбавляли до повного об'єму і добре перемішували; 7) аліквоту центрифугували протягом приблизно 5 хвилин на швидкості приблизно 3000 об./хв.; 8) відбирали аліквоту супернатанта для уприскування в хроматограф; 9) стадії 3-8 повторювали, щоб отримати два дублюючі один одного зразки для уприскування; 10) визначали середній час втримування для піка API, здійснюючи перші шість впорскувань стандартного розчину; і 11) обчислювали відношення часу втримування для будь-якого з піків в зразку препарату до середнього часу втримування піка API в перших шести впорскуваннях стандартного розчину. Вміст діючого начала визначали з використанням наступної формули: API(мг) на таблетку = (Aзразк.×W заг.)/(RFстд×W зразк×Nзаг.)×DFзразк., де: Азразк. = площа піка API в зразку; W заг. = загальна маса таблеток (мг); DFзразк. = об'єм розбавлення зразка в мл (100 мл для таблеток 300 мг); RF стд = стандартний середній фактор відгуку (для перших 6 впорскувань); W зразк. = маса індивідуального зразка (мг); і Nзаг. = число використаних таблеток (як мінімум 4). Індивідуальні домішки визначали в процентах від загальної інтегральної площі піка. Всі процитовані в заявці джерела (наприклад, патенти і заявки на патенти) включені в заявку в повному об'ємі. 35 ФОРМУЛА ВИНАХОДУ 40 1. Таблетка, отримана з інтрагранулярних і екстрагранулярних компонентів, де інтрагранулярні компоненти складаються із гіпурату (S)-2-аміно-3-(4-(2-аміно-6-((R)-1-(4-хлор-2-(3-метил-1Нпіразол-1-іл)феніл)-2,2,2-трифторетокси)піримідин-4-іл)феніл)пропаноату, безводної лактози, гідроксипропілцелюлози, натрію кроскармелози, стеарату магнію, і екстрагранулярні 10 UA 114412 C2 5 10 компоненти складаються з безводної лактози, натрію кроскармелози, колоїдного діоксиду кремнію і стеарату магнію. 2. Таблетка за п. 1, в якій гіпурат (S)-2-аміно-3-(4-(2-аміно-6-((R)-1-(4-хлор-2-(3-метил-1Нпіразол-1-іл)феніл)-2,2,2-трифторетокси)піримідин-4-іл)феніл)пропаноату є кристалічним. 3. Таблетка за п. 1, яка є покритою ентеросолюбільним покриттям. 4. Таблетка за п. 1, яка містить щонайменше 100 мг гіпурату (S)-2-аміно-3-(4-(2-аміно-6-((R)-1-(4хлор-2-(3-метил-1Н-піразол-1-іл)феніл)-2,2,2-трифторетокси)піримідин-4-іл)феніл)пропаноату. 5. Таблетка за п. 4, яка містить щонайменше 200 мг гіпурату ((S)-2-аміно-3-(4-(2-аміно-6-((R)-1(4-хлор-2-(3-метил-1Н-піразол-1-іл)феніл)-2,2,2-трифторетокси)піримідин-4іл)феніл)пропаноату. 11 UA 114412 C2 Комп’ютерна верстка В. Мацело Міністерство економічного розвитку і торгівлі України, вул. М. Грушевського, 12/2, м. Київ, 01008, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 12
ДивитисяДодаткова інформація
Назва патенту англійськоюSolid dosage forms of (s)-ethyl 2-amino-3-(4-(2-amino-6-((r)-1-(4-chloro-2-(3-methyl-1h-pyrazol-1-yl)phenyl)-2,2,2-trifluoroethoxy)pyrimidin-4-yl)phenyl)propanoate
Автори англійськоюChen, Jinling, Deaver, Matthew S., Holl, Richard J., Nuguru, Kalyan
Автори російськоюЧень Цзиньлин, Дивер Мэттью С., Холл Ричард Дж., Нугуру Калиан
МПК / Мітки
МПК: A61K 47/38, A61K 47/26, A61K 9/16, A61K 31/506, A61K 9/20
Мітки: форма, гіпурату, s)-2-аміно-3-(4-(2-аміно-6-((r)-1-(4-хлор-2-(3-метил-1н-піразол-1-іл)феніл)-2,2,2-трифторетокси)піримідин-4-іл)феніл)пропаноату, дозована, тверда
Код посилання
<a href="https://ua.patents.su/14-114412-tverda-dozovana-forma-gipuratu-s-2-amino-3-4-2-amino-6-r-1-4-khlor-2-3-metil-1n-pirazol-1-ilfenil-222-triftoretoksipirimidin-4-ilfenilpropanoatu.html" target="_blank" rel="follow" title="База патентів України">Тверда дозована форма гіпурату (s)-2-аміно-3-(4-(2-аміно-6-((r)-1-(4-хлор-2-(3-метил-1н-піразол-1-іл)феніл)-2,2,2-трифторетокси)піримідин-4-іл)феніл)пропаноату</a>
Попередній патент: Таблетка, що містить 7-[4-(4-бензо[b]тіофен-4-іл-піперазин-1-іл)бутокси]-1н-хінолін-2-он або його сіль
Наступний патент: Пристрій для обробки курильного виробу
Випадковий патент: Спосіб утилізації побутових хімічних джерел електричного струму