2-[(5-хлор-2-{[3-метил-1-(1-метилетил)-1н-піразол-5-іл]аміно}-4-піридиніл)аміно]-n-метилбензамід як інгібітор кінази фокальної адгезії (fak)
Номер патенту: 103208
Опубліковано: 25.09.2013
Автори: Меллінджер Марк, Адамс Джеррі Лерой, Се Рен, Джонсон Нейл В., Каспарец Іржі, Пенг Сінь, Фейтг Томас Х., Лін Хонг
Формула / Реферат
1. Сполука, яка являє собою 2-[(5-хлор-2-{[3-метил-1-(1-метилетил)-1Н-піразол-5-іл]аміно}-4-піридиніл)аміно]-N-метилбензамід та має структурну формулу
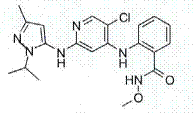 ,
,
або її фармацевтично прийнятна сіль.
2. Фармацевтична композиція, що містить сполуку за п. 1 і фармацевтично прийнятний носій.
3. Фармацевтична композиція за п. 2, яка відрізняється тим, що має форму пігулки.
4. Спосіб одержання фармацевтичної композиції, що містить фармацевтично прийнятний носій і сполуку за п. 1, згідно з яким сполуку за п. 1 поєднують з фармацевтично прийнятним носієм.
5. Застосування сполуки за п. 1 для інгібування активності FAK у ссавця, який цього потребує.
6. Застосування за п. 5, яке відрізняється тим, що ссавцем є людина.
7. Застосування за п. 5, де ссавець потребує лікування або зменшення тяжкості раку.
8. Застосування за п. 7, яке відрізняється тим, що рак є вибраним з групи, яка включає рак шкіри, молочної залози, мозку, карциноми шийки матки, карциноми сім'яників, астроцитарні, колоректальні, ендометрія, стравоходу, шлунку, голови й шиї, гепатоцелюлярні, ларингеальні, легенів, порожнини рота, яєчників, передміхурової залози, щитовидної залози, сарком, легенів, лімфоми, мезотеліоми; шлунково-кишкового тракту, шлунку, підшлункової залози, тонкого кишечнику, товстого кишечнику, нирок, сечового міхура й сечовипускального канапу, печінки, кісток, саркоми Юїнга, злоякісну лімфому, множинну мієлому, злоякісну гігантоклітинну хордому, мозку, мультиформну гліобластому, спинного мозку, матки, шийки матки, яєчників, плоскоклітинну карциному, та пухлини гематологічного походження.
Текст
Реферат: Даний винахід стосується 2-[(5-хлор-2-{[3-метил-1-(1-метилетил)-1Н-піразол-5-іл]аміно}-4піридиніл)аміно]-N-метилбензаміду, що має структурну формулу , або його фармацевтично прийнятної солі, які є придатними для лікування злоякісних пухлин. UA 103208 C2 (12) UA 103208 C2 UA 103208 C2 5 10 15 20 25 30 35 40 45 50 55 Галузь техніки, до якої належить винахід Даний винахід належить до класу піразоліламінопіридинів, які інгібують кіназу фокальної адгезії (FAK), а також до їх композицій. Сполуки за даним винаходом придатні для лікування проліферативних захворювань, що включають як необмежуючі приклади злоякісну пухлину. Попередній рівень техніки Тирозинкінази грають важливу роль у регуляції безлічі клітинних процесів, включаючи клітинну проліферацію, виживання клітин і клітинну міграцію. Відомо, що в багатьох злоякісних пухлинах людини певні тирозинкінази активуються мутаціями або аномально експресовані. Наприклад, виявлено, що при раку молочної залози, раку легенів, злоякісній пухлині головного мозку, плоскоклітинному раку, раку шлунку та інших злоякісних пухлинах людини мутовано й/або надекспресовано рецептор епідермального фактора зростання (EGFR). Показано, що клінічне значення при лікуванні злоякісних пухлин з мутованим і/або надекспресованим EGFR мають селективні інгібітори тирозинкіназної активності EGFR. Таким чином, для лікування проліферативних захворювань, таких як злоякісна пухлина, придатні селективні інгібітори конкретної тирозинкінази. FAK (кодована геном PTK2) являє собою нерецепторну тирозинкіназу, об'єднуючу сигнали від рецепторів інтегринів і факторів зростання. Опубліковано, що FAK грає роль у регуляції виживання, зростання, міграції та інвазії клітин (McLean et al 2005, Nat Rev Cancer 5:505-515). Крім того, FAK регулюється й активується за допомогою фосфорилування декількох залишків тирозину. Надекспресія мРНК і/або білка FAK зареєстрована при багатьох солідних пухлинах людини, включаючи як необмежуючі приклади злоякісні пухлини молочної залози, товстої кишки, щитовидної залози, легені, яєчника й передміхурової залози; але також включаючи злоякісні пухлини гематологічного походження, включаючи як необмежуючі приклади лейкоз, такий як гострий мієлолейкоз (AML). (Owens et al. 1995, Cancer Research 55: 2752-2755; Agochiya et al. 1999, Oncogene 18:5646-5653; Gabarro-Niecko et al. 2003, Cancer Metastasis Rev. 22:359-374; Recher et al. 2004, Cancer Research 64:3191-3197; Zhao and Guan, 28:35-49, 2009, Cancer Metastasis Rev.). Істотніше, що існують докази того, що вміст фосфорильованої FAK у злоякісних тканинах у порівнянні з нормальними збільшений (Grisaru-Granovsky et al. 2005, Int. J. Cancer 113: 372-378) і може служити прогностичним маркером метастазування. При злоякісних пухлинах на пізніх стадіях і метастазуючих злоякісних пухлинах у людини явно залучена активність FAK (Zhao and Guan, 28:35-49, 2009, Cancer Metastasis Rev.). Показано, що видалення FAK за допомогою РНКі або експресії домінантно-негативної FAK викликає втрату адгезійної здатності й загибель клітин у клітинних лініях молочної залози й меланоми людини й збільшує опосередкований доцетакселом апоптоз клітин раку яєчників (Beviglia et al 2003, Biochem J. 373:201-210, Smith et al 2005, Melanoma Res. 15:357-362, Halder et al 2005, Clin. Cancer Res. 11:8829-8836). Проте виявлено, що інгібування FAK у нормальних фібробластах або іморталізованих клітинах молочної залози (MCF10A) людини не викликає втрату адгезійної здатності або апоптозу (Xu et al. 1996 Cell Growth and Diff 7:413-418). У моделі на сингенних щурах також показано, що інгібування FAK за допомогою експресії домінантнонегативної форми зменшує зростання пухлини й усуває метастазування клітин аденокарциноми молочної залози в легені (van Nimwegen et al 2005, Cancer Res. 65:4698-4706). Аналогічно, інгібування FAK за допомогою кшРНК в моделі на сингенних мишах інгібувало метастазування в легені й знижувало летальність на 40% (Mitra et al 2006, Oncogene 25: 4429-4440). У цьому дослідженні транзиторна реекспресія FAK дикого типу, але не FAK без кіназної активності, обертала фенотипи, обумовлені кшРНК. Інгібування FAK за допомогою експресії домінантнонегативної форми в клітинах карциноми мишей 4T1 зменшувало зростання пухлини й ангіогенез у мишей (Mitra et al 2006, Oncogene 25:5969-5984). Крім того, втрата каталітичної активності FAK (реконструкція клітин FAK-/- з FAK без кіназної активності) знижувала зростання пухлин vSrc у мишей і знижувала ангіогенез. Таким чином, існують переконливі докази щоб вважати, що інгібування активності FAK індукує апоптоз, втрату адгезійної здатності, інгібування зростання й міграції клітин, і що таке інгібування знижує ангіогенез. Таким чином, сполуки, що інгібують активність FAK, могли б бути придатними для лікування злоякісної пухлини. Суть винаходу Даний винахід стосується сполук формули (I): 1 UA 103208 C2 5 10 15 20 25 30 35 40 45 50 або їхніх солей, де: 1 R означає галоген, CF3, C1-C6-алкіл, ізопропеніл, (C2-C6-алкілен) C3-C6-циклоалкіл, C1-C6алкокси або ціано; 2 2 у R , коли p відрізняється від 0, кожен R незалежно означає F, Cl, CF3, метил, метокси, 4 5 6 5 CH2CF3, -(X)q-C1-C4-алкілен-R , -(X-C1-C4-алкілен)q-NR -C(O)-R , -(X-C1-C4-алкілен)q-(NR )q-SOx7 8 9 R , -(X-C1-C4-алкілен)q-Y-N(R )2; групу 5-6-членний гетероциклоалкіл-(R )q або групу 5-6-членний 10 гетероарил-(R )r; 3 4 R незалежно означає H, C3-C6-циклоалкіл, C1-C6-алкіл, C1-C6алкокси, C1-C6-алкілен-R , O4 3 C1-C6-алкілен-R або, групи R , спільно з Z, утворюють 5-6 членну циклічну групу, необов'язково 4 заміщену метилом, C1-C4-алкілен-R або C3-C6-циклоалкілом; 4 8 R означає H, -(Q)q-N(R )2, ОН, SH, C1-C6-алкокси, C1-C6-тіоалкіл або групу 5-6-членний 9 гетероциклоалкіл-(R )q; 5 R означає H або C1-C6-алкіл; 6 8 10 R означає H, C1-C6-алкіл, C1-C6-алкокси, N(R )2 або групу 5-6-членний гетероарил-(R )r; 7 9 10 R означає C1-C6-алкіл, феніл-(R )q або 5-6-членний гетероарил-(R )r 8 R незалежно означає H, C1-C6-алкіл, -O-C1-C6-алкіл або, спільно з атомом азоту, до якого вони приєднані, утворюють 5-6 членну гетероциклоалкільну групу; 9 8 4 R означає H, C1-C6-алкіл, C1-C6-алкокси, -(Q)q-N(R )2, Q-C1-C6-алкіл, -C1-C6алкілR або 5-6членний гетероциклоалкіл; 10 R означає H, C1-C6-алкіл, C1-C6-алкокси або -Q-C2-C6-алкіл; 11 4 8 5 R означає C1-C6-алкіл, CF3 -CH2CF3, -(Q)q-C1-C4-алкілен-R , -Q-N(R )2, феніл-(R )s, групу 59 10 6-членний гетероциклоалкіл-(R )q або групу 5-6-членний гетероарил-(R )r; 12 1 6 8 R означає H, C -C -алкіл, F, Cl, CF3, ОН, CN, нітро, COOH, -COO-C1-C6-алкіл, -Y-N(R )2, C314 4 5 6 C6-циклоалкіл-R , -(X)q-C1-C6-алкілен-R , -(X-C1-C6-алкілен)q-NR -C(O)-R , -(X-C1-C6-алкілен)q5 7 8 9 10 (NR )q-SOx-R , -(X-C1-C6-алкілен)q-Y-N(R )2, гетероциклоалкіл-(R )q, гетероарил-(R )r або феніл15 (R )s; 13 12 13 R означає H, F, Cl, C1-C6-алкіл або C3-C6-циклоалкіл; або R і R , спільно з атомами вуглецю, до яких вони приєднані, утворюють об'єднану 5- або 6-членну карбоциклоалкільну або гетероциклоалкільну групу; 14 5 7 8 4 R незалежно означає H, C1-C6-алкіл, -NR -SO2-R , -Y-N(R )2 або -(X)q-C1-C6-алкілен-R ; 15 R незалежно означає F, Cl, CF3, C1-C3-алкіл або C1-C3-алкокси; p дорівнює 0, 1, 2 або 3; q дорівнює 0 або 1; r дорівнює 0, 1 або 2; s дорівнює 0, 1, 2 або 3; x дорівнює 1 або 2; Q дорівнює -C(O) -, -S(O) - або -SO2-; 5 X дорівнює NR , O, S, -S(O) - або -SO2-; Y означає зв'язок, SO2 або C(O); і 5 Z означає N або CR . У додатковому варіанті здійснення даний винахід стосується композиції, що містить а) сполуку формули (I) або її фармацевтично прийнятну сіль і b) фармацевтично прийнятний ексципієнт. У додатковому варіанті здійснення даний винахід відноситься до способу лікування проліферативного захворювання, такого як злоякісна пухлина, або захворювання з аномальним ангіогенезом, такого як дегенерація жовтої плями, що включає введення пацієнтові, що потребує цього, фармацевтично ефективної кількості сполуки формули (I). Детальний опис винаходу У іншому аспекті даний винахід відноситься до сполук формули (Ia): 2 UA 103208 C2 де різні групи є такими самими, як указано вище для формули (I); або їхніх фармацевтично прийнятних солей. У іншому аспекті даний винахід представлений сполукою формули (Ib): 5 10 15 20 25 30 35 40 де різні групи є такими самими, як указано вище для формули (I); або її фармацевтично прийнятною сіллю. У іншому аспекті даного винаходу Q є C(O), а Z є N. 1 У іншому аспекті даного винаходу R є Cl, CF3 або CN; 2 У іншому аспекті даного винаходу R є F; 3 3 У іншому аспекті даного винаходу один R є метилом, а інший R є H; 3 3 У іншому аспекті даного винаходу один R є метокси, а інший R є H; 11 У іншому аспекті даного винаходу R означає C1-C6-алкіл; 12 У іншому аспекті даного винаходу R означає C1-C6-алкіл, гідроксиметил або циклопропіл; 13 У іншому аспекті даного винаходу R є H; У іншому аспекті даного винаходу p є 0 або 1; Як застосовано в цьому документі, "галоген" означає фтор, хлор або бром. "C1-C6-алкіл" відноситься до лінійної або розгалуженої алкільної групи, що включає метил, етил, н-пропіл, ізопропіл, н-бутил, ізобутил, трет-бутил, н-пентил і н-гексил. "C1-C6-алкокси" стосується груп C1-C6-алкіл-O-, що включають метокси-, етокси-, н-пропокси, ізо-пропокси- і н-бутоксигрупи. Термін "алкілен" (наприклад, C2-C4-алкілен або C1-C6-алкілен) стосується лінійного або розгалуженого вуглеводневого радикала з указаною кількістю атомів вуглецю. Група "-алкілен4 R " відноситься до заміщеної або незаміщеної алкільної групи з указаною кількістю атомів 4 вуглецю; таким чином, коли R є H, "алкілен" є синонімом "алкілу"; в іншому випадку алкіленом є 4 бівалентний радикал. Приклади -(X)q-C2-C4-алкілен-R включають -CH2CH2-N(CH3)2, -CH2CH2OH, -CH2CH(CH3)-OCH3, -N(CH3)-CH2CH2CH2-піперидиніл; -O-CH2CH(CH3)-OCH3 і т.п. C3-C6-циклоалкіл стосується циклопропільної, циклобутильної, циклопентильної або циклогексильної груп. Як застосовують у цьому документі, "5- або 6-членний гетероциклоалкіл" стосується 5- або 6-членної аліфатичної циклічної групи, що містить гетероатом O, N або S або їх поєднання. Приклади відповідних гетероциклоалкільних груп включають піролідинільну, піролідинонільну, піперидинільну, піперазинільну, оксопіперазинільну, морфолінову й тіоморфолінову групи. 8 Групи R спільно з атомом азоту, до якого вони приєднані, можуть утворювати 5-6-членну циклічну групу, приклади якої включають піролідинільну, піролідинонільну, піперидинільну, піперазинільну, оксопіперазинільну, морфолінову й тіоморфолінову групи. Термін "гетероарил" стосується 5- або 6-членної ароматичної групи, що містить щонайменше один атом N, O або S. Приклади відповідних гетероарильних груп включають піридиніл, піридазиніл, піримідиніл, піразиніл, піроліл, фурил, тієніл, піразоліл, імідазоліл, фуразаніл, оксазоліл, тіазоліл, ізоксазоліл, 1,2,3-триазоліл, 1,2,4-триазоліл, тетразоліл та ізотіазоліл. 3 UA 103208 C2 5 10 15 20 25 30 35 40 45 50 55 60 Як застосовують у цьому документі, "фармацевтично прийнятний" стосується сполук, речовин, композицій і лікарських форм, які в обсязі обґрунтованого лікарського рішення придатні для використання в контакті з тканинами людей і тварин без надлишкової токсичності, подразнення або інших проблем або ускладнень. Фахівцям у даній галузі зрозуміло, що можна одержувати фармацевтично прийнятні солі сполук формули (I). Конкретніше, оскільки сполуки за формулою (I) містять основну функціональну групу - і можуть включати кислотну функціональну групу - вони при обробці відповідною кислотою або основою здатні до формування фармацевтично прийнятних солей. Відповідні кислоти включають фармацевтично прийнятні неорганічні кислоти й органічні кислоти. Характерні фармацевтично прийнятні кислоти включають соляну кислоту, бромистий водень, азотну кислоту, сірчану кислоту, сульфонову кислоту, фосфорну кислоту, оцтову кислоту, гідроксіоцтову кислоту, фенілоцтову кислоту, пропіонову кислоту, масляну кислоту, валеріанову кислоту, малеїнову кислоту, акрилову кислоту, фумарову кислоту, яблучну кислоту, малонову кислоту, винну кислоту, лимонну кислоту, саліцилову кислоту, бензойну кислоту, дубильну кислоту, мурашину кислоту, стеаринову кислоту, молочну кислоту, аскорбінову кислоту, п-толуолсульфонову кислоту, олеїнову кислоту й лауринову кислоту. Придатні основи включають неорганічні основи, такі як гідриди, гідроксиди й карбонати літію, натрію, калію, кальцію, магнію й цинку, а також органічні основи, такі як аргінін, холін, діетилентриамін, диметиламін, етилендіамін, імідазол, лізин, морфолін, пролін і триметиламін. Як застосовують у цьому документі, термін "сполука формули (I)" відноситься до однієї або декількох сполук формули (I). Сполука формули (I) може існувати в кристалічній або некристалічній формі або у вигляді їх суміші. Фахівцям у даній галузі зрозуміло, що кристалічні сполуки можуть утворювати фармацевтично прийнятні сольвати, де в кристалічну решітку при кристалізації вбудовуються молекули розчинника. Вбудовані молекули розчинника можуть бути молекулами води або молекулами сполуки, що не є водою, такі як молекули етанолу, ізопропанолу, DMSO, оцтової кислоти, етаноламіну й етилацетату. Кристалічну решітку з вбудованими молекулами води, як правило, позначають як "гідрати." Гідрати включають стехіометричні гідрати, а також композиції, що містять різні кількості води. Даний винахід стосується всіх таких сольватів. Деякі зі сполук, що описуються в цьому документі, можуть містити один або декілька хіральних атомів або можуть іншим чином існувати у вигляді двох енантіомерів. Сполуки, що заявляються нижче, включають суміші енантіомерів, а також очищені енантіомери або збагачені енантіомерами суміші. Також в обсяг винаходу включені індивідуальні ізомери сполук, представлених формулою (I), або що заявляються нижче, а також їх будь-які повністю або частково урівноважені суміші. Даний винахід також стосується індивідуальних ізомерів сполук, що заявляються, у вигляді сумішей з їхніми ізомерами, в яких один або декілька хіральних центрів інвертовані. Коли існують різні ізомерні форми, їх можна загальноприйнятими способами розділяти або відокремлювати одну від іншої, або будь-який даний ізомер можна одержувати загальноприйнятими способами синтезу або за допомогою стереоспецифічного або асиметричного синтезу. Хоча можливо, що для застосування в терапії сполуку формули (I), а також її солі, сольвати й тому подібне, можна вводити у вигляді чистого препарату, тобто без додаткового носія, звичайнішою практикою є надання активного інгредієнта, одержаного з носієм або розчинником. Таким чином, винахід додатково відноситься до фармацевтичних композицій, що включають сполуку формули (I) і її солі, сольвати й тому подібне, й один або декілька фармацевтично прийнятних носіїв, розчинників або ексципієнтів. Сполуки формули (I) та їхні солі, сольвати й так далі є такими, як описано вище. Носій(ї), розчинник(и) або ексципієнт(и) мають бути прийнятними в сенсі необхідності сумісності з іншими інгредієнтами складу й відсутності їх шкідливої дії на споживача. За іншим аспектом винаходу також наданий спосіб одержання фармацевтичного складу, що включає змішування сполуки формули (I) або її солей, сольватів і так далі, з одним або декількома фармацевтично прийнятними носіями, розчинниками або ексципієнтами. Фахівцям у даній галузі зрозуміло, що певні захищені похідні сполук формули (I), які можна одержувати до стадії кінцевого зняття захисту, по суті можуть не мати фармакологічну активність, але, в деяких варіантах, їх можна вводити перорально або парентерально, й потім вони будуть метаболізуватися в організмі з утворенням сполук за винаходом, які є фармакологічно активними. Таким чином, такі похідні можна описати як "пролікарські засоби". Крім того, певні сполуки за винаходом можуть діяти як пролікарські засоби інших сполук за винаходом. Всі захищені похідні й пролікарські засоби сполук за винаходом включені в обсяг 4 UA 103208 C2 5 10 15 20 25 30 35 40 45 50 55 60 винаходу. Крім того, фахівцям у даній галузі зрозуміло, що у відповідні функціональні групи, коли такі функціональні групи знаходяться у сполуках за винаходом, можна вводити певні групи, відомі фахівцям у даній галузі як "про-групи". Переважні пролікарські засоби сполук за винаходом включають: складні ефіри, складні карбонатні ефіри, складні напівефіри, складні фосфатні ефіри, складні нітроефіри, складні сульфатні ефіри, сульфоксиди, аміди, карбамати, азосполуки, фосфаміди, глікозиди, прості ефіри, ацеталі й кеталі. Фармацевтичні композиції можна надавати в стандартних лікарських формах, що містять зумовлену кількість активного інгредієнта на стандартну дозу. Така стандартна лікарська форма може містити, наприклад, від 0,5 мг до 3500 мг, переважно від 1 мг до 700 мг, переважніше - від 5 мг до 100 мг сполуки формули (I), залежно від стану, що підлягає лікуванню, способу введення й віку, маси й стану пацієнта, або фармацевтичні композиції можна надавати в стандартних лікарських формах, що містять зумовлену кількість активного інгредієнта на стандартну дозу. Переважними стандартними лікарськими формами є форми, що містять добову дозу або піддозу, як перераховано в цьому документі вище, або їх відповідні частини, активного інгредієнта. Крім того, такі фармацевтичні композиції можна одержувати будь-якими добре відомими в галузі фармацевтики способами. Фармацевтичні композиції можна адаптувати для введення будь-яким придатним способом введення, наприклад, за допомогою перорального (включаючи букальний або сублінгвальний), ректального, назального, топічного (включаючи букальний, сублінгвальний або трансдермальний), вагінального або парентерального (включаючи підшкірний, внутрішньом'язовий, внутрішньовенний або інтрадермальний) способу введення. Такі композиції можна одержувати будь-яким відомим у галузі фармацевтики способом, наприклад поєднуючи сполуку формули (I) з носієм(ями) або ексципієнтом(ами). Фармацевтичні композиції, адаптовані для перорального введення, можна надавати у вигляді дискретних одиниць, таких як капсули або пігулки; порошки або гранули; розчини або суспензії у водних або неводних рідинах; їстівні піни або креми; або рідкі емульсії масло-у-воді або рідкі емульсії вода-в-маслі. Капсули виготовляють, одержуючи порошкову суміш, як описано вище, й заповнюючи сформовані желатинові оболонки. Перед заповненням у порошкову суміш можна додавати сприяючі ковзанню засоби й змащувальні засоби, такі як колоїдний діоксид кремнію, тальк, стеарат магнію, стеарат кальцію або твердий поліетиленгліколь. Також для поліпшення доступності лікарського засобу при прийомі капсули можна додавати дезінтегратор або солюбілізатор, такі як агар-агар, карбонат кальцію або карбонат натрію. Крім того, за бажання або необхідності в суміш також можна вводити відповідні сполучні засоби, змащувальні засоби, дезінтегруючі засоби й фарбники. Відповідні сполучні засоби включають крохмаль, желатин, природні цукри, такі як глюкоза або бета-лактоза, кукурудзяні підсолоджувачі, природні й синтетичні камеді, такі як гуміарабік, трагакант або альгінат натрію, карбоксиметилцелюлозу, поліетиленгліколь, воски тощо. Змащувальні засоби, використовувані в цих лікарських формах, включають олеат натрію, стеарат натрію, стеарат магнію, бензоат натрію, ацетат натрію, хлорид натрію тощо. Дезінтегруючі засоби включають як необмежуючі приклади крохмаль, метилцелюлозу, агар, бентоніт, ксантанову камедь і тому подібне. Пігулки формулюють, наприклад, одержуючи порошкову суміш, гранулюючи або агрегуючи, додаючи змащувальний засіб і дезінтегрант і пресуючи в пігулки. Порошкову суміш одержують, змішуючи відповідним чином подрібнену сполуку з розчинником або основою, як описано вище, і, необов'язково, із сполучним засобом, таким як карбоксиметилцелюлоза, альгінат, желатин або полівінілпіролідон, сповільнювачем розчинення, таким як парафін, прискорювачем розсмоктування, таким як четвертинна сіль і/або засобом для всмоктування, таким як бентоніт, каолін або дифосфат кальцію. Порошкову суміш можна гранулювати за допомогою пресів, що формують пігулки, за допомогою додавання стеаринової кислоти, солі стеаринової кислоти, тальку або мінерального масла. Потім суміш з доданим мастилом пресують у пігулки. Сполуки за даним винаходом також можна комбінувати з інертним носієм з високою текучістю й пресувати в пігулки безпосередньо без проходження стадій гранулювання або агрегації. Можна наносити прозоре або непрозоре захисне покриття, що складається з герметизуючого покриття з шелаку, покриття з цукру або полімерної речовини й поліруючого покриття з воску. До цих покриттів можна додавати фарбувальні речовини для розрізнення різних одиниць дозування. Пероральні рідини, такі як розчини, сиропи й еліксири, можна одержувати в стандартній лікарській формі так, щоб задана кількість містила зумовлену кількість сполуки формули (I). Сиропи можна одержувати, розчиняючи сполуки у відповідним чином ароматизованому водному розчині, тоді як еліксири одержують, використовуючи нетоксичний спиртний носій. Суспензії можна формулювати, диспергуючи сполуку в нетоксичному носієві. Також можна 5 UA 103208 C2 5 10 15 20 25 30 35 40 45 50 55 60 додавати солюбілізатори й емульгатори, такі як етоксиловані ізостеарилові спирти й прості поліоксіетиленсорбітні ефіри, консерванти, ароматизатори, такі як масло перцевої м'яти або природні підсолоджувачі або сахарин або інші штучні підсолоджувачі й т.п. За необхідністю, одиниці дозування фармацевтичних композицій для перорального введення можна мікроінкапсулювати. Також можна отримувати склад для пролонгованого або тривалого вивільнення, наприклад, як за допомогою нанесення покриття або розміщення часток у полімери, віск або т.п. Фармацевтичні склади, придатні для парентерального введення, включають водні й неводні стерильні розчини для ін'єкцій, які можуть містити антиоксиданти, буфери, бактеріостатики й розчини, що роблять композицію ізотонічною з кров'ю передбачуваного реципієнта; і водні й неводні стерильні суспензії, які можуть включати суспендуючі засоби й загусники. Фармацевтичні композиції можна надавати в контейнерах з одиничною дозою й контейнерах з декількома дозами, наприклад, у герметизованих ампулах і флаконах, та їх можна зберігати у висушеному сублімацією (ліофілізованому) стані, що вимагає лише додавання стерильного рідкого носія, наприклад води для ін'єкцій, безпосередньо перед використанням. Приготовані для негайного вживання розчини й суспензії для ін'єкцій можна одержувати зі стерильних порошків, гранул і пігулок. Терапевтично ефективна кількість сполуки за даним винаходом залежить від ряду чинників, що включають, наприклад, вік і масу передбачуваного реципієнта, конкретного стану, що вимагає лікування, та його важкості, характеру й маршруту введення складу, і, насамкінець, залежить від думки особи, що призначає лікарський засіб. Проте ефективна кількість сполуки формули (I) для лікування злоякісної пухлини, як правило, знаходиться в діапазоні від 0,001 до 100 мг/кг маси тіла реципієнта на добу, відповідно в діапазоні від 0,01 до 10 мг/кг маси тіла на добу. Для дорослого масою 70 кг фактична кількість на добу відповідно складає від 7 до 700 мг і цю кількість можна вводити однократною дозою на добу або декількома (наприклад, двома, трьома, чотирма, п'ятьма або шістьма) піддозами на добу так, щоб загальна добова доза залишалася такою самою. Ефективну кількість солі або сольвату й так далі по суті можна визначати як пропорційну частину від ефективної кількості сполуки формули (I). Вважають, що для лікування різних указаних вище станів, можуть бути придатні схожі дози. Терапія Сполуки й композиції за винаходом використовують для лікування клітиннопроліферативних захворювань. Хворобливі стани, які можна лікувати способами й композиціями, що надаються за цим документом, включають як необмежуючі приклади, злоякісну пухлину, аутоіммунне захворювання, грибкові порушення, артрит, відторгнення трансплантата, запальне захворювання кишечнику, проліферацію, індуковану після медичних маніпуляцій, включаючи як необмежуючі приклади хірургію, ангіопластику й тому подібне. Слід розуміти, що в деяких випадках клітини можуть не знаходитися у стані гіпер- або гіпопроліферації (аномальний стан) і, втім, може бути потрібним лікування. Наприклад, при загоєнні ран клітини можуть проліферувати "нормально", але бажаним може бути посилення проліферації. Таким чином, в одному з варіантів здійснення винахід за цим документом включає застосування для клітин або індивідуумів, уражених або із загрозою ураження будь-яким з цих порушень або станів. Ці сполуки також можна використовувати для лікування дегенерації жовтої плями, що асоціюється з неоваскуляризацією, як-от AMD. Композиції і способи, що надаються за цим документом, вважають особливо придатними для лікування злоякісної пухлини, включаючи такі пухлини, як пухлини шкіри, молочної залози, головного мозку, карциноми шийки матки, карциноми сім'яників тощо. Вони особливо придатні для лікування метастазуючих або злоякісних пухлин. Конкретніше, злоякісні пухлини, які можна лікувати композиціями і способами за винаходом, включають як необмежуючі приклади таких типів пухлин, як карциноми й саркоми: астроцитарні, молочної залози, шийки матки, колоректальні, ендометрію, стравоходу, шлунку, голови й шиї, гепатоцелюлярні, ларингеальні, легенів, порожнини рота, яєчників, передміхурової залози й щитовидної залози. Конкретніше, ці сполуки можна використовувати для лікування: серця: саркоми (ангіосаркоми, фібросаркоми, рабдоміосаркоми, ліпосаркоми), міксоми, рабдоміоми, фіброми, ліпоми й тератоми; легені: бронхогенної карциноми (плоскоклітинної, недиференційованої дрібноклітинної, недиференційованої крупноклітинної, аденокарциноми), альвеолярної (бронхіолярної) карциноми, бронхіальної аденоми, саркоми, лімфоми, хондроматозної гамартоми, мезотеліоми; шлунково-кишкового тракту: стравоходу (плоскоклітинної карциноми, аденокарциноми, лейоміосаркоми, лімфоми), шлунку (карциноми, лімфоми, лейоміосаркоми), підшлункової залози (протокової аденокарциноми, інсуліноми, глюкагономи, гастриноми, карциноїдних пухлин, Віпоми), тонкого кишечнику (аденокарциноми, лімфоми, карциноїдних пухлин, саркоми 6 UA 103208 C2 5 10 15 20 25 30 35 40 45 50 55 60 Капоші, лейоміоми, гемангіоми, ліпоми, нейрофіброми, фіброми), товстого кишечнику (аденокарциноми, тубулярної аденоми, ворсинчастої аденоми, гамартоми, лейоміоми); сечостатевих шляхів: нирок (аденокарциноми, пухлини Вільма (нефробластоми), лімфоми, лейкозу), сечового міхура й сечовипускального каналу (плоскоклітинної карциноми, перехідноклітинної карциноми, аденокарциноми), передміхурової залози (аденокарциноми, саркоми), сім'яників (семіноми, тератоми, ембріональної карциноми, тератокарциноми, хоріокарциноми, саркоми, карциноми інтерстиціальних клітин, фіброми, фіброаденоми, аденоматоїдних пухлин, ліпоми); печінки: гепатоми (печінковоклітинної карциноми), холангіокарциноми, гепатобластоми, ангіосаркоми, печінковоклітинної аденоми, гемангіоми; кісток: остеогенної саркоми (остеосаркоми), фібросаркоми, злоякісної фіброзною гістіоцитоми, хондросаркоми, саркоми Юїнга, злоякісної лімфоми (саркоми ретикулярних клітин), множинної мієломи, злоякісної гігантоклітинної хордоми, остеохондроми (кістково-хрящового екзостозу), доброякісної хондроми, хондробластоми, хондроміксофиброми, остеоїдної остеоми й гігантоклітинних пухлин; нервової системи: черепа (остеоми, гемангіоми, гранулеми, ксантоми, деформуючого оститу), оболонок головного мозку (менінгіоми, менінгіосаркоми, гліоматозу), головного мозку (астроцитоми, медулобластоми, гліоми, епендимоми, герміноми (пінеаломи), мультиформної гліобластоми, олігодендрогліоми, шваноми, ретинобластоми, спадкових пухлин), нейрофіброми спинного мозку, менінгіоми, гліоми, саркоми); гінекологічних порушень: матки (карциноми ендометрію), шийки матки (карциноми шийки матки, передпухлинної дисплазії шийки матки), яєчників (карциноми яєчників (серозної цистаденокарциноми, слизової цистаденокарциноми, некласифікованої карциноми), гранулезоклітинних пухлин, пухлин з клітин Сертолі-Лейдіга, дисгерміноми, злоякісної тератоми), зовнішніх жіночих статевих органів (плоскоклітинної карциноми, інтраепітеліальної карциноми, аденокарциноми, фібросаркоми, меланоми), піхви (світлоклітинного раку, плоскоклітинної карциноми, ботріоїдної саркоми (ембріональної рабдоміосаркоми), фалопієвих труб (карциноми); гематологічних порушень: крові (мієлолейкозу (гострого й хронічного), гострого лімфобластного лейкозу, хронічного лімфоцитарного лейкозу, мієлопроліферативних захворювань, множинної мієломи, мієлодиспластичного синдрому), хвороби Ходжкіна, неходжкінської лімфоми (злоякісної лімфоми); шкіри: злоякісної меланоми, базально-клітинної карциноми, плоскоклітинної карциноми, саркоми Капоші, родимок диспластичних невусів, ліпоми, ангіоми, дерматофіброми, келоїдів, псоріазу; й надниркових: нейробластоми. Таким чином, як надано в цьому документі, термін "злоякісна клітина" включає клітину, уражену будь-яким з указаних вище станів або родинних їм. Порівняно з родинними 2,4-діамінопіридиновими похідними, описаними в інших джерелах, сполуки за даним винаходом містять функціональну групу складного ефіру гідроксамової кислоти в 2 положенні 4-амінофенільного циклу й амінопіразол у 2 положенні піридинівого циклу. Функціональна група складного ефіру гідроксамової кислоти на фенільному циклі в порівнянні з відповідним амідом збільшує ефективність проти FAK порядку в 2,5 рази, особливо in vitro, і знаходить селективність для FAK відносно інших ферментів. Піразол знижує реакційну здатність відносно цитохромів P450. Таким чином, комбінація конструкції складного ефіру гідроксамової кислоти на фенільному циклі з амінопіразолом у 2 положенні в піридиновому циклі дає сполуку з покращуваною безпекою й ефективністю відносно інших інгібіторів FAK, таких як 2,4-діамінопіридинові похідні. Сполуки за даним винаходом можна комбінувати або спільно вводити з іншими терапевтичними засобами, зокрема, із засобами, які можуть збільшувати активність або час розподілу сполук. Способи комбінованого лікування за винаходом включають введення щонайменше одної сполуки за винаходом і використання щонайменше одного іншого способу лікування. В одному з варіантів здійснення способи комбінованого лікування за винаходом включають введення щонайменше однієї сполуки за винаходом і хірургічне лікування. В одному з варіантів здійснення способи комбінованого лікування за винаходом включають введення щонайменше однієї сполуки за винаходом і променеву терапію. В одному з варіантів здійснення способи комбінованого лікування за винаходом включають введення щонайменше однієї сполуки за винаходом і щонайменше одного засобу симптоматичної терапії (наприклад, щонайменше одного протиблювотного засобу). В одному з варіантів здійснення способи комбінованого лікування за даним винаходом включають введення щонайменше однієї сполуки за винаходом і щонайменше одного іншого хіміотерапевтичного засобу. В одному конкретному варіанті здійснення винахід включає введення щонайменше однієї сполуки за винаходом і щонайменше одного протипухлинного засобу. У ще одному варіанті здійснення винахід включає схему лікування, де інгібітори FAK за даним винаходом як такі не активні або не активні на значимому рівні, але при комбінуванні з іншим способом лікування, який може бути активний 7 UA 103208 C2 5 10 15 20 25 30 35 40 45 50 55 60 або може не бути активний як самостійне лікування, комбінація забезпечує успішний терапевтичний результат. Як застосовують у цьому документі під терміном "спільне введення" і похідними від нього мають на увазі або одночасне введення, або будь-який спосіб роздільного послідовного введення інгібуючої FAK сполуки, як описано в цьому документі, й додаткового активного інгредієнта або інгредієнтів, які відомі як придатні для лікування злоякісної пухлини, включаючи хіміотерапевтичне й радіаційне лікування. Як застосовують у цьому документі, термін додатковий активний інгредієнт або інгредієнти, включає будь-яку сполуку або терапевтичний засіб, у якого відомі або який демонструє корисні властивості при введенні пацієнтові, що потребує лікування злоякісної пухлини. Переважно, якщо введення не є одночасним, сполуки вводять у безпосередній тимчасовій близькості одну з одною. Крім того, не має значення, чи вводять сполуки в однаковій лікарській формі, наприклад, одну зі сполук можна вводити топічно, а іншу сполуку можна вводити перорально. Як правило, за даним винаходом для лікування конкретних злоякісних пухлинможна спільно вводити будь-який протипухлинний засіб, що має активність проти чутливої пухлини, що піддається лікуванню. Приклади таких засобів можна знайти в Cancer Principles and Practice of Oncology by V.T. Devita and S. Hellman (editors), 6th edition (February 15, 2001), Lippincott Williams & Wilkins Publishers. Фахівець у даній галузі зможе визначити, які комбінації засобів підійдуть на основі конкретних характеристик лікарських засобів і розглядуваної злоякісної пухлини. Типові протипухлинні засоби, придатні за даним винаходом, включають як необмежуючі приклади засоби проти мікротрубочок, такі як дитерпеноїди й алкалоїди барвінку; координаційні комплекси платини; алкілуючі засоби, такі як азотисті іприти, оксазофосфорини, алкілсульфонати, нітрозосечовини й триазени; антибіотики, такі як антрацикліни, актиноміцини й блеоміцини; інгібітори топоізомерази II, такі як епіподофілотоксини; антиметаболіти, такі як аналоги пуринів і піримідинів і антифолатні сполуки; інгібітори топоізомерази I, такі як камптотецини; гормони й аналоги гормонів; інгібітори шляхів передачі сигналу; інгібітори ангіогенезу під дією нерецепторних тирозинкіназ; імунотерапевтичні засоби; проапоптотичні засоби й інгібітори передачі сигналів клітинного циклу. Як правило, в комбінації зі сполуками за винаходом можна використовувати будь-який хіміотерапевтичний засіб з активністю проти сприйнятливої неоплазії, що піддається лікуванню, за умови, що цей конкретний засіб клінічно сумісний з терапією, в якій застосовують сполуку за винаходом. Типові протипухлинні засоби, придатні за даним винаходом, включають як необмежуючі приклади: алкілуючі засоби, антиметаболіти, протипухлинні антибіотики, антимітотичні засоби, інгібітори топоізомераз I і II, гормони й аналоги гормонів; ретиноїди, інгібітори шляхів передачі сигналу, що включають інгібітори клітинного зростання або функціонування факторів зростання, інгібітори ангіогенезу й інгібітори серин/треонінових або інших кіназ; інгібітори циклін-залежних кіназ; лікарські засоби на основі антисмислових послідовностей та імунотерапевтичні засоби, включаючи моноклональні антитіла, вакцини або інші біологічні засоби. Інгібіторами шляхів передачі сигналу є інгібітори, що блокують або інгібують хімічний процес, що викликає внутрішньоклітинні зміни. Як застосовують у цьому документі, ця зміна є проліферацією, або диференціюванням, або тривалістю життя клітин. Інгібітори шляхів передачі сигналу, придатні за даним винаходом, включають як необмежуючі приклади інгібітори рецепторних тирозинкіназ, нерецепторних тирозинкіназ, блокаторів доменів SH2/SH3, серин/треонінових кіназ, фосфатидилінозитол-3-OH-кіназ, передачі сигналу міоїнозитолом і Ras-онкогенів. Інгібітори шляхів передачі сигналу можна застосовувати в комбінації зі сполуками за винаходом у композиціях і способах, описаних вище. Також за даним винаходом можуть знайти застосування інгібітори ангіогенезу під дією рецепторних кіназ. Вище наведено обговорення інгібіторів ангіогенезу, пов'язаного з VEGFR і TIE-2, відносно інгібіторів передачі сигналу (обидва є рецепторні тирозинкінази). В комбінації зі сполуками за винаходом можна використовувати інші інгібітори. Наприклад, антитіла до VEGF, що не розпізнають VEGFR (рецепторна тирозинкіназа), але зв'язуються з лігандом; низькомолекулярні інгібітори інтегрину (альфаv, бета3), що інгібують ангіогенез; також корисними в комбінації зі сполуками за винаходом можуть виявитися ендостатин і ангіостатин (не RTK). Одним з прикладів антитіла до VEGFR є бевацизумаб (авастин®). У розробці знаходяться декілька інгібіторів рецепторів факторів зростання, і вони включають антагоністи лігандів, антитіла, інгібітори тирозинкіназ, антисмислові олігонуклеотиди й аптамери. Будь-який з цих інгібіторів рецепторів факторів зростання можна застосовувати в комбінації зі сполуками за винаходом в будь-яких з композицій і способів/застосувань, що описуються в цьому документі. Прикладом інгібітору функціонування фактора зростання на 8 UA 103208 C2 ® 5 10 15 20 25 30 35 40 45 50 55 60 основі антитіла до erbB2 є трастузумаб (герцептин ). Одним з прикладів інгібітору функціонування фактора зростання на основі антитіла до erbB1 є цетуксимаб (ербітукс™, ® C225). Прикладом моноклонального антитіла до VEGFR є бевацизумаб (авастин ). Приклади низькомолекулярних інгібіторів рецепторів епідермального фактора зростання включають як ® необмежуючі приклади лапатиніб (тайкерб™) і ерлотиніб (тарцева ). одним з прикладів ® інгібіторів PDGFR є іматинібу мезилат (глівек ). Приклади інгібіторів VEGFR включають пазопаніб, ZD6474, AZD2171, PTK787, сунітиніб і сорафеніб. Особливий інтерес становлять пазопаніб і сполуки формули I та їхні солі. Засобами проти мікротрубочок або антимітотичними засобами є фазоспецифічні засоби, активні проти мікротрубочок пухлинних клітин протягом M-фази або мітозу клітинного циклу. Приклади засобів проти мікротрубочок включають як необмежуючі приклади дитерпеноїди й алкалоїди барвінку. Дитерпеноїди, які одержують з природних джерел, являють собою фазоспецифічні засоби проти злоякісних пухлин, які діють у фазах G 2/M клітинного циклу. Вважають, що дитерпеноїди стабілізують -субодиницю тубуліну мікротрубочок за допомогою зв'язування з цим білком. Потім, ймовірно, відбувається інгібування розбирання білка з арештом мітозу й подальшою загибеллю клітин. Приклади дитерпеноїдів включають як необмежуючі приклади паклітаксел та його аналог доцетаксел. Паклітаксел, 4,10-діацетат-2-бензоат 5,20-епокси-1,2,4,7,10,13-гексагідрокситакс-11ен-9-ону зі складноефірним зв'язком у положенні 13 з (2R,3S)-N-бензоїл-3-фенілізосерином; є природним дитерпеновим продуктом, виділеним з тихоокеанського тиса Taxus brevifolia і є ® комерційно доступним як ін'єктований розчин таксол . Він є представником таксанового сімейства терпенів. Його вперше виділили в 1971 році за Wani et al. J. Am. Chem, Soc., 93:2325. 1971, що охарактеризував його структуру за допомогою хімічних і рентгенокристалографічних способів. Один з механізмів його активності пов'язаний зі здатністю паклітакселу зв'язувати тубулін, інгібуючи, таким чином, зростання злоякісних клітин. Schiff et al., Proc. Natl, Acad, Sci. USA, 77:1561-1565 (1980); Schiff et al., Nature, 277:665-667 (1979); Kumar, J. Biol, Chem, 256: 10435-10441 (1981). Для огляду синтезу й протипухлинної активності деяких похідних паклітакселу див.: D. G. I. Kingston et al., Studies in Organic Chemistry vol. 26, під назвою "New trends in Natural Products Chemistry 1986", Attaur-Rahman, P.W. Le Quesne, Eds. (Elsevier, Amsterdam, 1986) pp 219-235. Паклітаксел схвалений для клінічного застосування для лікування раку яєчників, що не піддається лікуванню, в Сполучених Штатах Америки (Markman et al., Yale Journal of Biology and Medicine, 64:583, 1991; McGuire et al., Ann. lntem, Med., 111:273, 1989) і для лікування раку молочної залози (Holmes et al., J. Nat. Cancer Inst., 83:1797, 1991). Він є потенційним кандидатом на лікування неоплазії шкіри (Einzig et. al., Proc. Am. Soc. Clin. Oncol., 20:46) і карциноми голови й шиї (Forastire et. al., Sem. Oncol., 20:56, 1990). Сполука також демонструє потенціал для лікування полікістозного захворювання нирок (Woo et. al., Nature, 368:750. 1994), раку легенів й малярії. Лікування пацієнтів паклітакселом приводить до супресії кісткового мозку (декілька ліній клітин, Ignoff, R.J. et. al, Cancer Chemotherapy Pocket Guide, 1998), пов'язаної з тривалістю дозування вище порогової концентрації (50 нМ) (Kearns, C.M. et. al., Seminars in Oncology, 3(6) p.16-23, 1995). Доцетаксел, складний (2R,3S)-N-карбокси-3-фенілізосериновий, N-трет-бутиловий ефір у положенні 13 з 4-ацетат-2-бензоатом 5-20-епокси-1,2,4,7,10,13-гексагідрокситакс-11-ен-9® ону, тригідрат; є комерційно доступним у вигляді ін'єктованого розчину таксотер . Доцетаксел призначений для лікування раку молочної залози. Доцетаксел є напівсинтетичною похідною паклітакселу, див. вище, одержаною з природного попередника, 10-деацетилбакатину III, екстрагованого з голок європейського тиса. Лімітуючою дозу токсичністю доцетакселу є нейтропенія. Алкалоїди барвінку є фазоспецифічними протипухлинними засобами, що отримуються з рослини барвінку. Алкалоїди барвінку діють у M-фазі (мітозі) клітинного циклу, специфічно зв’язуючись з тубуліном. Таким чином, зв'язана молекула тубуліну не здатна до полімеризації в мікротрубочки. Вважають, що відбувається затримка мітозу в метафазі з подальшою загибеллю клітин. Приклади алкалоїдів барвінку включають як необмежуючі приклади вінбластин, вінкристин і вінорелбін. ® Вінбластин, сульфат вінкалейкобластину, комерційно доступний як велбан у вигляді ін'єктованого розчину. Хоча він має можливе показання як терапія другої лінії різних солідних пухлин, він, перш за все, призначений для лікування раку яєчка й різних лімфом, включаючи хворобу Ходжкіна й лімфоцитарні й гістіоцитарні лімфоми. Лімітуючим дозу побічним ефектом вінбластину є мієлосупресія. 9 UA 103208 C2 ® 5 10 15 20 25 30 35 40 45 50 55 60 Вінкристин, сульфат 22-оксовінкалейкобластину, комерційно доступний як онковін у вигляді ін'єктованого розчину. Вінкристин призначений для лікування гострих лейкозів, а також знаходить застосування у схемах лікування злоякісної лімфоми Ходжкіна й неходжкінських злоякісних лімфом. Найбільш частими побічними ефектами вінкристину є алопеція й неврологічні ефекти й у меншій мірі виникають мієлосупресія і шлунково-кишковий мукозит. Вінорелбін, 3',4'-дидегідро-4'-дезокси-C'-норвінкалейкобластин [R-(R*,R*)-2,3-дигідроксибутандіоат (1:2) (сіль)], комерційно доступний у вигляді ін'єктованого розчину тартрату ® вінорелбіну (навельбін ), являє собою напівсинтетичний алкалоїд барвінку. Вінорелбін показаний як єдиний засіб або в комбінації з іншими хіміотерапевтичними засобами, такими як цисплатин, для лікування різних солідних пухлин, зокрема недрібноклітинного раку легенів, раку молочної залози на пізніх стадіях і стійкого до гормонів раку передміхурової залози. Найбільш частим обмежуючим дозу побічним ефектом вінорелбіну є мієлосупресія. Координаційні комплекси платини є нефазоспецифічними протипухлинними засобами, які взаємодіють з ДНК. Комплекси платини проникають у пухлинні клітини, гідратуються й утворюють усередині й міжланцюжкові зв'язки з ДНК, викликаючи несприятливі біологічні ефекти для пухлини. Приклади координаційних комплексів платини включають як необмежуючі приклади цисплатин і карбоплатин. ® Цисплатин, цис-діаміндихлорплатина, комерційно доступний як платинол у вигляді ін'єктованого розчину. Цисплатин, перш за все, призначений для лікування метастазуючого раку яєчка й раку яєчників і раку сечового міхура на пізніх стадіях. Первинні обмежуючі дозу побічні ефекти цисплатину є нефротоксичність, яку можна контролювати гідратацією, й діурезом, і ототоксичністю. Карбоплатин, діамін-[1,1-циклобутандикарбоксилат(2-)-O,O']-платина, комерційно доступний ® як параплатин у вигляді ін'єктованого розчину. Карбоплатин перш за все призначений для лікування першої й другої лінії карцином яєчників на пізніх стадіях. Лімітуючою дозу токсичністю карбоплатину є супресія кісткового мозку. Алкілуючі засоби є нефазоспецифічними протипухлинними засобами і строгими електрофілами. Як правило, алкілуючі засоби утворюють ковалентні зв'язки за допомогою алкілування ДНК за нуклеофільними групами молекули ДНК, як-от фосфатні, аміно-, сульфгідрильні, гідроксильні, карбоксильні й імідазольні групи. Таке алкілування порушує функцію нуклеїнової кислоти, приводячи до загибелі клітин. Приклади алкілуючих засобів включають як необмежуючі приклади азотисті іприти, такі як циклофосфамід, мелфалан і хлорамбуцил; алкілсульфонати, такі як бусульфан; похідні нітрозосечовини, такі як кармустин; і триазени, такі як дакарбазин. Циклофосфамід, моногідрат 2-[біс(2-хлоретил)аміно]тетрагідро-2H-1,3,2-оксазафосфорин-2® оксиду, комерційно доступний у вигляді ін'єктованого розчину або пігулки як цитоксан . Циклофосфамід показаний як єдиний засіб або в комбінації з іншими хіміотерапевтичними засобами для лікування злоякісних лімфом, множинної мієломи й лейкозу. Найбільш частими обмежуючими дозу побічними ефектами циклофосфаміду є алопеція, нудота, блювота й лейкопенія. Мелфалан, 4-[біс(2-хлоретил)аміно]-L-фенілаланін, комерційно доступний у вигляді ® ін'єктованого розчину або пігулки як алкеран . Мелфалан призначений для паліативного лікування множинної мієломи й неоперабельних епітеліальних карцином яєчника. Найбільш частим обмежуючим дозу побічним ефектом мелфалану є супресія кісткового мозку. Хлорамбуцил, 4-[біс(2-хлоретил)аміно]бензолбутанова кислота, комерційно доступний у ® вигляді пігулок лейкерану . Хлорамбуцил призначений для паліативного лікування хронічного лімфатичного лейкозу й злоякісних лімфом, таких як лімфосаркома, макрофолікулярна лімфома й хвороба Ходжкіна. Найбільш частим обмежуючим дозу побічним ефектом хлорамбуцилу є супресія кісткового мозку. Бусульфан, 1,4-бутандіолдиметансульфонат, комерційно доступний у вигляді пігулок ® мілерану . Бусульфан призначений для паліативного лікування хронічного мієлогенного лейкозу. Найбільш частим обмежуючим дозу побічним ефектом бусульфану є супресія кісткового мозку. Кармустин, 1,3-[біс(2-хлоретил)-1-нітрозосечовина, комерційно доступний у вигляді окремих ® ампул ліофілізованої речовини як Бікну . Кармустин призначений для паліативного лікування пухлин головного мозку, множинної мієломи, хвороби Ходжкіна й неходжкінських лімфом у вигляді єдиного засобу або в комбінації з іншими засобами. Найбільш частим обмежуючим дозу побічним ефектом кармустину є пролонгована мієлосупресія. Дакарбазин, 5-(3,3-диметил-1-триазено)імідазол-4-карбоксамід, комерційно доступний у ® вигляді окремих ампул речовини як DTIC-Dome . Дакарбазин призначений для лікування 10 UA 103208 C2 5 10 15 20 25 30 35 40 45 50 55 60 метастазуючої злоякісної меланоми і, в комбінації з іншими засобами, для лікування другої лінії хвороби Ходжкіна. Найбільш частими обмежуючими дозу побічнимиефектами дакарбазину є нудота, блювота й анорексія. Антибіотичними антинеопластичними засобами є нефазоспецифічні засоби, які зв'язуються з ДНК або включаються в ДНК. Як правило, така дія приводить до стабільних комплексів або розриву ланцюгів ДНК, що порушує нормальне функціонування нуклеїнових кислот, приводячи до загибелі клітин. Приклади антибіотичних протипухлинних засобів включають як необмежуючі приклади актиноміцини, такі як дактиноміцин, антрацикліни, такі як даунорубіцин і доксорубіцин; і блеоміцини. Дактиноміцин, також відомий як актиноміцин D, комерційно доступний в ін'єктованій формі ® як космеген . Дактиноміцин призначений для лікування пухлини Вільма й рабдоміосаркоми. Найбільш частими обмежуючими дозу побічними ефектами дактиноміцину є нудота, блювота й анорексія. Даунорубіцин, гідрохлорид (8S-цис-)-8-ацетил-10-[(3-аміно-2,3,6-тридезокси--Lліксогексопіранозил)окси]-7,8,9,10-тетрагідро-6,8,11-тригідрокси-1-метокси-5,12-нафтациндіону, ® комерційно доступний у вигляді ліпосомальної ін'єктованої форми як дауноксом або у вигляді ® ін'єктованого препарату як церубідин . Даунорубіцин призначений для індукції ремісії для лікування гострого нелімфоцитарного лейкозу й асоційованої з ВІЛ саркоми Капоші на пізніх стадіях. Найбільш частим обмежуючим дозу побічним ефектом даунорубіцину є мієлосупресія. Доксорубіцин, гідрохлорид (8S,10S)-10-[(3-аміно-2,3,6-тридезокси--Lліксогексопіранозил)окси]-8-гліколю, 7,8,9,10-тетрагідро-6,8,11-тригідрокси-1-метокси-5,12® ® нафтациндіону, комерційно доступний як ін'єктована форма як рубекс або АДРІАМІЦИН RDF . Доксорубіцин перш за все призначений для лікування гострого лімфобластного лейкозу й гострого мієлобластного лейкозу, але також є відповідним компонентом для лікування деяких солідних пухлин і лімфом. Найбільш частим обмежуючим дозу побічним ефектом доксорубіцину є мієлосупресія. Блеоміцин, суміш цитотоксичних глікопептидних антибіотиків, виділених зі штаму ® Streptomyces verticillus, комерційно доступний як бленоксан . Блеоміцин показаний як паліативне лікування, у вигляді єдиного засобу або в комбінації з іншими засобами, плоскоклітинної карциноми, лімфоми й карциноми яєчка. Найбільш частими обмежуючими дозу побічними ефектами блеоміцину є легенева й шкірна токсичність. Інгібітори топоізомерази II включають як необмежуючі приклади епіподофілотоксини. Епіподофілотоксини являють собою фазоспецифічні протипухлинні засоби, що отримуються з рослини мандрагори. Епіподофілотоксини, як правило, діють на клітини у фазах S і G 2 клітинного циклу, формуючи потрійний комплекс з топоізомеразою II і ДНК, викликаючи розриви ланцюгів ДНК. Розриви ланцюгів накопичуються й услід настає загибель клітин. Приклади епіподофілотоксинів включають як необмежуючі приклади етопозид і теніпозид. Етопозид, 4'-деметилепіподофілотоксин-9[4,6-0-(R)-етиліден--D-глюкопіранозид], ® комерційно доступний у вигляді ін'єктованого розчину або капсули як вепезид і загальновідомий як VP-16. Етопозид показаний як єдиний засіб або в комбінації з іншими хіміотерапевтичними засобами для лікування раку яєчок і недрібноклітинного раку легенів. Найбільш частим побічним ефектом етопозиду є мієлосупресія. Вплив лейкопенії зазвичай буває важчим, ніж тромбоцитопенії. Теніпозид, 4'-деметилепіподофілотоксин-9[4,6-0-(R)-теніліден--D-глюкопіранозид], ® комерційно доступний у вигляді ін'єктованого розчину як Вумон і загальновідомий як VM-26. Теніпозид показаний як єдиний засіб або в комбінації з іншими хіміотерапевтичними засобами для лікування гострого лейкозу в дітей. Найбільш частим обмежуючим дозу побічним ефектом теніпозиду є мієлосупресія. Теніпозид може індукувати й лейкопенію, й тромбоцитопенію. Антиметаболічні антинеопластичні засоби являють собою фазоспецифічні протипухлинні засоби, що діють у S-фазі (синтезу ДНК) клітинного циклу, інгібуючи синтез ДНК або інгібуючи синтез пуринових або піримідинових основ і, таким чином, обмежуючи синтез ДНК. Таким чином, S-фаза не проходить і відбувається загибель клітин. Приклади антиметаболічних протипухлинних засобів включають як необмежуючі приклади фторурацил, метотрексат, цитарабін, меркаптопурин, тіогуанін і гемцитабін. 5-фторурацил, 5-фтор-2,4-(1H,3H)-піримідиндіон комерційно доступний як фторурацил. Введення 5-фторурацилу приводить до інгібування синтезу тимідилату, а також він вбудовується в РНК і ДНК. Як правило, результатом є загибель клітин. 5-фторурацил показаний як єдиний засіб або в комбінації з іншими хіміотерапевтичними засобами для лікування карциноми молочної залози, товстої кишки, прямої кишки, шлунку й підшлункової залози. Обмежуючими дозу побічними ефектами 5-фторурацилу є мієлосупресія й мукозит. Інші 11 UA 103208 C2 5 10 15 20 25 30 35 40 45 50 55 60 аналоги фторпіримідинів включають 5-фтордезоксіуридин (флоксуридин) і монофосфат 5фтордезоксіуридину. Цитарабін, 4-аміно-1--D-арабінофуранозил-2-(1H)-піримідинон, комерційно доступний як ® цитозар-U і загальновідомий як Ara-C. Вважають, що цитарабін фазоспецифічно діє на клітини в S-фазі, інгібуючи подовження ланцюга ДНК за допомогою кінцевого включення цитарабіну у зростаючий ланцюг ДНК. Цитарабін показаний як єдиний засіб або в комбінації з іншими хіміотерапевтичними засобами для лікування гострого лейкозу. Інші аналоги цитидину включають 5-азацитидин і 2',2'-дифтордезоксицитидин (гемцитабін). Цитарабін індукує лейкопенію, тромбоцитопенію й мукозит. Меркаптопурин, моногідрат 1,7-дигідро-6H-пурин-6-тіону, комерційно доступний як ® Пуринетол . Меркаптопурин фазоспецифічно діє на клітини в S-фазі, інгібуючи синтез ДНК за допомогою ще не встановленого механізму. Меркаптопурин показаний як єдиний засіб або в комбінації з іншими хіміотерапевтичними засобами для лікування гострого лейкозу. Вважають, що побічними ефектами меркаптопурину у високих дозах є мієлосупресія й мукозит шлунковокишкового тракту. Відповідним аналогом меркаптопурину є азатіоприн. ® Тіогуанін, 2-аміно-1,7-дигідро-6H-пурин-6-тіон, комерційно доступний як таблоїд . Тіогуанін фазоспецифічно діє на клітини в S-фазі, інгібуючи синтез ДНК за допомогою ще не встановленого механізму. Тіогуанін показаний як єдиний засіб або в комбінації з іншими хіміотерапевтичними засобами для лікування гострого лейкозу. Найбільш частим обмежуючим дозу побічним ефектом введення тіогуаніну є мієлосупресія, що включає лейкопенію, тромбоцитопенію й анемію. Проте виникають і можуть обмежувати дозу шлунково-кишкові побічні ефекти. Інші аналоги пуринів включають пентостатин, еритрогідроксиноніладенін, фосфат флударабіну й кладрибін. Гемцитабін, моногідрохлорид 2'-дезокси-2',2'-дифторцитидину (-ізомер), комерційно ® доступний як гемзар . Гемцитабін фазоспецифічно діє на клітини у S-фазі й блокує просування клітин через кордон G1/S. Гемцитабін показаний у комбінації з цисплатином для лікування локального поширеного недрібноклітинного раку легенів і у вигляді самостійного засобу для лікування локально поширеного раку підшлункової залози. Найбільш частим обмежуючим дозу побічним ефектом введення гемцитабіну є мієлосупресія, що включає лейкопенію, тромбоцитопенію й анемію. Метотрексат, N-[4[[(2,4-діаміно-6-птеридиніл)метил]метиламіно]бензоїл]-L-глутамінова кислота, комерційно доступний як метотрексат натрію. Метотрексат фазоспецифічно діє на клітини в S-фазі, інгібуючи синтез, репарацію й/або реплікацію ДНК за допомогою інгібування дигідрофолатредуктази, необхідної для синтезу пуринових нуклеотидів і тимідилату. Метотрексат показаний як єдиний засіб або в комбінації з іншими хіміотерапевтичними засобами для лікування хоріокарциноми, менінгеального лейкозу, неходжкінської лімфоми й карцином молочної залози, голови, шиї, яєчника й сечового міхура. Вважають, що побічними ефектами введення метотрексату є мієлосупресія (лейкопенія, тромбоцитопенія й анемія) й мукозит. Як інгібітори топоізомерази I доступні або знаходяться в розробці камптотецини, включаючи камптотецин і похідні камптотецину. Вважають, що цитотоксична активність камптотецинів пов'язана з їх інгібуючою дією на топоізомеразу I. Приклади камптотецинів включають як необмежуючі приклади іринотекан, топотекан і різні оптичні форми 7-(4метилпіперазинoметилен)-10,11-етилендіокси-20-камптотецину, описані нижче. Іринотекан HCl, гідрохлорид (4S)-4,11-діетил-4-гідрокси-9-[(4-піперидинoпіперидинo)карбонілокси]-1H-пірано[3',4',6,7]індолізино[1,2-b]хінолін-3,14(4H,12H)-діону, комерційно ® доступний як ін'єктований розчин камптосара . Іринотекан є похідною камптотецину, що зв'язується разом з його активним метаболітом SN38 з комплексом топоізомераза I-ДНК. Вважають, що цитотоксичність виникає в результаті необоротних подвійних розривів ланцюгів, що викликаються взаємодією потрійного комплексу топоізомераза I:ДНК:іринотекан або SN-38 з ферментами реплікації. Іринотекан призначений для лікування метастазуючої злоякісної пухлини товстої або прямої кишки. Обмежуючими дозу побічними ефектами іринотекану HCl є мієлосупресія, що включає нейтропенію, і дія на ШКТ, що включає діарею. Топотекан HCl, моногідрохлорид (S)-10-[(диметиламіно)метил]-4-етил-4,9-дигідрокси-1Hпірано[3',4',6,7]індолізино[1,2-b]хінолін-3,14-(4H,12H)-діону, комерційно доступний як ® ін'єктований розчин гікамтина . Топотекан є похідною камптотецину, що зв'язується з комплексом топоізомераза I-ДНК і запобігає зворотному лігуванню одиночних розривів ланцюгів, викликаних топоізомеразою I у відповідь на деформацію скручування молекули ДНК. Топотекан призначений для лікування другої лінії метастазуючих карциноми яєчника й 12 UA 103208 C2 5 10 15 20 25 30 35 дрібноклітинного раку легенів. Обмежуючим дозу побічним ефектом топотекану HCl є мієлосупресія, переважно нейтропенія. Наведені нижче схеми ілюструють те, як можна одержувати сполуку за даним винаходом. Вказані конкретні розчинники й умови реакцій також наведені як ілюстрація й не призначені для обмеження. Схеми Сполуки формули (I) можна одержувати способами, наведеними в схемі 1 нижче. Сполуки формули (II) і (III) є комерційно доступними, або їх можна синтезувати із застосуванням загальноприйнятих у даній галузі способів. Група L у сполуці (III) є відхідною групою, як-от F або Cl. Сполуки формули (II) і (III) можна піддавати реакції при кип'ятінні із зворотним холодильником або в умовах мікрохвильової печі з одержанням проміжної сполуки (IV). Реакцію приєднання, як правило, виконують із застосуванням полярних протонних розчинників, таких як н-бутанол або ізопропанол. Альтернативно можна використовувати умови реакцій приєднання, каталізованих металами. Коли сполука (II) включає функціональну групу, що потребує захисту, наприклад гідроксильну групу або аміногрупу, переважно використовують відповідну захисну групу. Потім сполуку формули (IV) можна піддавати реакції з амінопіразолом (V), який є комерційно доступним або який можна синтезувати із застосуванням загальноприйнятих у даній галузі способів, з одержанням сполуки формули (I). Як правило, реакцію проводять у присутності металевого каталізатора, такого як сіль паладію, а також з відповідним фосфіновим лігандом. Альтернативно реакцію можна проводити з каталітичною кількістю кислоти, як-от соляна або трифтороцтова кислота, й у відповідному розчиннику, такому як вода, 1,4-діоксан або ізопропанол або їх поєднання; реакцію переважно проводять при підвищеній температурі, наприклад, в умовах кип'ятіння із зворотним холодильником або із застосуванням мікрохвильового пристрою. Як правило, кислотний каталізатор відносно сполуки формули (I) наявний у кількості 10-30 моль%. Схема 1 Сполуки формули (VIII) можна зручно одержувати способами, наведеними на схемі 1, але починаючи з відповідного антраніламіду (VI), як наведено на схемі 2. Схема 2 Сполука (VI) може містити додаткові замісники. Наприклад, як показано на схемі 3, у бензоксазину (IX), який є або комерційно доступним, або синтезованим з використанням загальноприйнятих у даній галузі способів, можна виробити розмикання циклу за допомогою аміну з утворенням бензаміду (X), до якого потім можна додавати сполуку (III) з виходом сполуки формули (XI). Схема 3 13 UA 103208 C2 5 10 15 Сполуку формули (XII) можна одержувати за допомогою реакції сполуки формули (II) зі сполукою формули (XIII). Цю реакцію можна виконувати, як описано на схемі 1. Потім сполуки формули (XII) можна піддавати реакції зі сполукою формули (XIV) з одержанням сполук формули (I). Реакцію можна виконувати в інертному розчиннику за наявності металевого каталізатора й відповідного ліганду. Схема 4 Певні сполуки формули (I) також можна одержувати, як наведено на схемі 5. Спочатку аміногрупу сполуки формули (XV) можна піддавати реакції з дикетеном з подальшим ацилуванням і обробкою гідразином. Потім за допомогою обробки кислотою можна одержувати сполуку формули (XVI), потім проводити реакцію зі сполукою формули (II) з одержанням сполуки формули (I). Цю останню реакцію можна проводити, як описано на схемі 1. Схема 5 20 Сполуку формули (V) можна одержувати за допомогою конденсації заміщеного гідразину (XVIII) з відповідним ціанокетоном (XVII), наприклад, відповідно до способів Honma, T. et al. J. Med. Chem. 2002, Vol. 44 (26), 4628-4640 або Adachi, I. et al. Chemical & Pharmaceutical Bulletin 1987, 35(8), 3235-52, як наведено на схемі 6. Схема 6 25 Схема 7 Сполуку формули (XXI) також можна одержувати, як наведено на схемі 7. Нітрил формули (XIV) можна гідролізувати до карбонової кислоти формули (XX), а потім зв'язувати з аміном з одержанням сполук формули (XXI). 14 UA 103208 C2 5 10 15 20 25 30 35 40 Експериментальна частина Біохімічний аналіз активності FAK Аналіз 1: мічену GST (мічену глутатіон-S-трансферазою) FAK набували в Invitrogen (PV3832) (www.invitrogen.com). Активність FAK вимірювали за допомогою моніторингу фосфорилування пептидного субстрату (Ac-RRRRRRSETDDYAEIID-NH2; (SEQ ID NO: 1) тобто Ac-Arg-Arg-Arg-ArgArg-Ser-Glu-Thr-Asp-Asp-Tyr-Ala-Glu-Ile-Ile-Asp-NH2) у присутності радіоактивно міченої АТФ. Для вимірювання активності інгібіторів FAK спочатку одержували сполуку у вигляді 10 вихідного розчину в 10% DMSO. Невелику частину кожного розчину (4 мкл) додавали в 96лунковий планшет (Corning, 3884). Одержували 6 нМ розчин GST-FAK в 1,1 буфері для реакції, що містить 44 мМ HEPES, pH=7,2, 11 мМ MgCl2, 2,2 мМ MnCl2, 1,1 мМ DTT і 0,011% Tween-20. Потім 20 мкл 6 нМ розчину GST-FAK заздалегідь інкубували зі сполукою протягом 30 хвил при кімнатній температурі. Реакцію ініціювали додаванням 16мкл субстратів (62,5 мкМ пептид, 5 33 мкМ АТФ і 0,02 мКи/мл P--АТФ), одержаних у вказаному вище буфері для реакції. Реакції перед гасінням 40 мкл 1% H3PO4 дозволяли протікати протягом 90 хвил. Частину реакційної суміші (60 мкл) переносили у фосфоцелюлозний планшет для фільтрування (Millipore; www.millipore.com, MAPHNOB50) й інкубували протягом 20 хвилин. Планшет фільтрували, тричі промивали з використанням 150 мкл 0,5% H3PO4 і сушили при 50°C протягом 30 хвил. Після додавання в планшет 60 мкл Microscint-20 вимірювали радіоактивність і використанням TopCount (PerkinElmer; www.PerkinElmer.com). Аналіз 2: У лабораторії одержували Flag-His-TEV-FAK1. Повнорозмірну FAK людини з використанням бакуловірусу експресували з N-кінцевими мітками FLAG-6His з подальшою ділянкою розщеплювання TEV (FLAG-6xHis-TEV-huFAK) у клітинах Sf9. Активність FAK вимірювали за допомогою моніторингу фосфорилування субстрату LANCE Ultra NH 2-(ULight) CSETDDYAEIID-COOH (SEQ ID NO: 2) (C = цистеїн S = серин, E = глутамінова кислота, T = треонін, D = аспарагінова кислота, Y = тирозин, A = аланін, I = ізолейцин) (придбаного в Perkin Elmer Life Sciences). Для вимірювання активності інгібіторів FAK спочатку одержували 100 вихідні розчини сполуки в 100% DMSO. Невелику частину розчину кожної сполуки (50 нл) додавали в чистий 384-лунковий планшет для мікротитрування малого об'єму (Greiner 784076). Одержували 1,2 нМ розчин Flag-His-TEV-FAK1 в 1 буфері для реакції, що містить 40мМ Tris/Tris-HCL, 10 мМ MgCl2, 1 мМ CHAPS при pH 7,5 з додаванням 1 мМ DTT. 2,5 мкл 1,2 нМ розчину FLAG-FAK додавали в планшети і заздалегідь інкубували зі сполуками протягом 30 хвил при кімнатній температурі. Потім у планшет для ініціації реакції додавали 2,5 мкл розчину субстрату (0,1мкМ специфічного для пептиду FAK P2 субстрату (Lance Ultra NH2-(ULight)CSETDDYAEIID-COOH (SEQ ID NO: 2) з Perkin Elmer), 10 мкМ АТФ і 1 буфер для реакції, описаний вище). Після інкубації протягом 120 хвилин при кімнатній температурі реакцію гасили додаванням 5 мкл 20 мМ ЕДТА і 5 нМ антитіла Eu-Anti-pTyr в 1 буфері для детекції LANCE. Після інкубації протягом 30 хвилин при кімнатній температурі планшет сканували в пристрої Perkin Elmer Viewlux з фільтром збудження 320-340 нм і вимірюючи випускання при 615 нм і 665 нм. Для нормалізації даних використовували співвідношення 665 нм/615 нм. У наведеній нижче таблиці A надані конкретні дані для сполук з прикладів нижче, які аналізували в одному або обох з наведених вище аналізів. Ці дані в указаному аналізі отримували щонайменше за один прохід; у повторних аналізах могли отримувати або можуть отримувати дані, які до деякої міри варіюють відносно цих даних. 45 15 UA 103208 C2 Таблиця A № прикладу 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 36 37 38 39 40 41 42 43 44 45 46 47 49 50 51 52 53 54 55 56 Аналіз 1 PXC50 TRF FAK 8,7 8,8 9,2 9 9 8,9 9,1 9,2 9 9,1 8,7 8,6 9,3 8,6 8,6 8,9 8,9 8 8,3 8 8,5 7,5 7,1 8,2 8,6 9,4 8,7 9,4 9,3 9,4 8,4 9,4 9,4 9,3 9,4 8,4 6,6 9,4 8,9 9,4 7,9 8,3 8,2 8 Аналіз 2 PXC50 TRF FAK H 31284A 7,8 8 8,3 8,2 8,1 8,3 8 8,3 8,2 8 8,2 8,3 8,7 7,7 7,7 7,7 7,4 7,2 7,4 7,2 6,6 6,7 7,2 7,5 8,4 8,1 8,6 8,7 8,8 9 8,8 7,7 6 8,3 8,6 8,7 7,3 7,6 7,2 7,2 7,9 8,6 7,2 7,9 7,7 8,2 7,4 7,5 8 7,8 16 UA 103208 C2 Таблиця A № прикладу 58 59 60 61 62 63 64 65 66 67 69 70 71 72 73 5 10 15 20 25 30 35 40 Аналіз 1 PXC50 TRF FAK Аналіз 2 PXC50 TRF FAK H 31284A 7,3 8,3 7,9 7,6 9,2 7,3 7,1 7,8 7,5 8,3 8,6 8,2 8,2 8,6 8,9 8,7 7,2 Хімічні приклади Наведені нижче хімічні приклади подані лише з ілюстративними цілями й не призначені для обмеження обсягу даного винаходу. Сполуки названі з використанням програмного забезпечення ACD Name (Advanced Chemistry Development, www.acdlabs.com). Всі сполуки для описаного вище біохімічного аналізу мають pIC50 більшу 6,5. Мас-спектрометр з одним квадруполем PE Sciex API 150 (PE Sciex, Thornhill, Ontario, Canada) діяв з використанням іонізації розпилюванням в електричному полі в режимі детекції позитивних іонів. Розпилюваний газ отримували з генератора чистого повітря (Balston Inc., 2 Haverhill, MA; www.parker.com) і випускали при 45699,5227 кг/м , а загороджувальним газом був 2 високочистий азот, що подається з судини Дьюара з рідким азотом при 35153,479 кг/м . Напруга, що подавалася до голки для електророзпилювання, складала 4,8 кВ. Вихідний отвір встановлювали на 25 В і сканування мас-спектрометра проводили при швидкості 0,5 скан/сек з використанням кроку маси 0,2 а.е.м. і збираючи дані профілю. Спосіб A, LCMS. Зразки вводили у мас-спектрометр з використанням автодозатора CTC PAL (LEAP Technologies, Carrboro, NC), обладнаного 10 мкл уприскувачем Hamilton, що проводить ін'єкцію в10-портовий інжекторний клапан Valco. Насос ВЕРХ був Shimadzu LC10ADvp (Shimadzu Scientific Instruments, Columbia, MD), що функціонує при 0,3 мл/хвил і лінійному градієнті від 4,5% A до 90% B протягом 3,2 хвил. з утриманням 0,4 хвил. Рухлива фаза складалася з 100% (H2O 0,02% TFA) в судині A і 100% (CH3CN 0,018% TFA) в судині B. Нерухома фаза є Aquasil (C18), а розміри колонки є 1 мм 40мм. Детекцію проводили за допомогою УФ-опромінення при 214 нм, випарного світлорозсіювання (ELSD) і MS. Спосіб B, LCMS. Альтернативно використовували аналітичну систему ВЕРХ Agilent 1100 з LC/MS та її експлуатували при 1 мл/хвил і лінійному градієнті від 5% A до 100% B протягом 2,2 хвил з утриманням 0,4 хвил. Рухлива фаза складалася з 100% (H2O 0,02% TFA) в судині A і 100% (CH3CN 0,018% TFA) в судині B. Нерухома фаза була Zobax (C8) з розміром часток 3,5 мкм, а розміри колонки складали 2,1 мм 50 мм. Детекцію проводили за допомогою УФопромінювання при 214 нм, випарного світлорозсіювання (ELSD) і MS. Спосіб B, LCMS. Альтернативно використовували MDSSCIEX API 2000, обладнане капілярною колонкою (504,6 мм, 5 мкм). ВЕРХ проводили на системі СЕРХ серії Agilent-1200, обладнаній колонкою Zorbax SB-C18 (504,6 мм, 1,8 мкм), проводячи елюцію буфером CH3CN:амоній ацетат. Реакції проводили в мікрохвильовій печі (CEM, Discover). 1 іСпектри H-ЯМР (далі в цьому документі "ЯМР") отримували при 400 МГц із застосуванням пристрою Bruker AVANCE 400 MHz із застосуванням ACD Spect manager версії 10 для обробки. Вказані мультиплетності є: s = синглет, d = дублет, t = триплет, q = квартет, m = мультиплет, dd = подвійний дублет, dt = подвійний триплет тощо, а br означає широкий сигнал. Аналітична ВЕРХ: Продукти аналізували за допомогою системи для аналітичної хроматографії Agilent 1100 з колонкою Zorbax XDB-C18 4,575 мм (3,5 мкм) при 2 мл/хвил з 4 хвил градієнтом від 5% CH3CN (0,1% мурашина кислота) до 95% CH3CN (0,1% мурашина кислота) в H2O (0,1% мурашина кислота) і з утриманням 1 хвил. Препаративна ВЕРХ: Продукти очищали із застосуванням системи для препаративної 17 UA 103208 C2 5 10 15 20 25 30 35 40 хроматографії Gilson з колонкою I. D. YMC CombiPrep ODS-A column 7530 мм (5 мкм) (www.waters.com) при 50 мл/хвил з 10 хвил градієнтом від 5% CH 3CN (0,1% мурашина кислота) до 95% CH3CN (0,1% мурашина кислота) в H2O (0,1% мурашина кислота) і утриманні 2 хвил; альтернативно продукти очищували із застосуванням системи для препаративної хроматографії Agilent 1100 з колонкою Gemini C18 10030 мм (5 мкм) при 60 мл/хвил з 10 хвил градієнтом від 5% CH3CN (0,1% мурашина кислота) до 95% CH3CN (0,1% мурашина кислота) в H2O (0,1% мурашина кислота) і утриманням 2 хвил. Препаративну хроматографію з нормальними фазами проводили із застосуванням системи Analogix IntelliFlash 280 з колонками SuperFlash Sepra Si 50. Альтернативно ВЕРХ з оберненою фазою проводили на Agilent з використанням колонки Zorbax SB - C18 (21,2250 мм, 7 мкм), проводячи елюцію буфером CH3CN:амоній ацетат (10 мкМ) при pH 6,8. Приклади Приклад 1 1a) 2-[(2,5-дихлор-4-піридиніл)аміно]-N-метилбензамід У 150-мл пробірку, що закривається, поміщали 2,5-дихлор-4-йодопіридин (3,5 г, 12,78 ммоль), 2-аміно-N-метилбензамід (1,919 г, 12,78 ммоль) і трикалійфосфат (8,14 г, 38,3 ммоль) в 1,4-діоксані (100 мл). Реакційну суміш дегазували азотом протягом 10 хвил. Додавали простий біс(2-дифенілфосфінофеніловий) ефір (DPEPhos, 0,688 г, 1,278 ммоль) і Pd(OAc) 2 (0,115 г, 0,511 ммоль) і реакційну суміш нагрівали в масляній бані при 120°C протягом ночі. Реакційну суміш фільтрували через целіт, який промивали діоксаном. Розчинник випаровували насухо й тверду речовину промивали EtOH (10 мл 3) з одержанням 2,14 г (56%) продукту у вигляді майже білої твердої речовини. 1b) 2-[5-хлор-2-(2-метил-5-феніл-2H-піразол-3-іламіно)піридин-4-іламіно]-N-метилбензамід У 50-мл пробірку, що закривається, поміщали Pd(OAc)2 (18 мг, 0,08 ммоль) і 2,2'біс(дифенілфосфіно)-1,1'-бінафтил (BINAP, 50 мг, 0,08 ммоль) у 1,4-діоксані (10 мл). Суміш дегазували із застосуванням азоту, що барботувався, протягом 40 хвил і нагрівали при 50°C протягом 1 години. Потім суміш охолоджували до кімнатної температури, після чого в атмосфері інертного газу додавали 2-[(2,5-дихлор-4-піридиніл)аміно]-N-метилбензамід (300 мг, 1,01 ммоль), 2-метил-5-феніл-2H-піразол-3-іламін (704 мг, 4,06 ммоль) і карбонат цезію (960 мг, 2,96 ммоль). Пробірку закривали й нагрівали при 120°C протягом ночі. Реакційну суміш концентрували при зниженому тиску й неочищений продукт очищували за допомогою колонкової хроматографії (силікагель, що елююється дихлорметаном-метанолом (DCM-MeOH), 99:1 з подальшим очищенням за допомогою препаративної TLC з одержанням бажаної сполуки 1 у вигляді майже білої твердої речовини (25 мг, 5%). H ЯМР (400 МГц, ДМСО-d6) 2,76 (д, 3H, J=4,52 Гц), 3,68 (с, 3H), 6,69 (с, 1H), 6,85 (с, 1H), 7,07-7,14 (м, 1H), 7,25-7,31 (м, 1H), 7,36-7,42 (м, 2H), 7,46-7,53 (м, 1H), 7,63 (д, 1H, J=8,08 Гц), 7,69 (д, 1H, J=7,4 Гц), 7,75 (д, 2 H, J=7,16 Гц), 8,04 (с, 1H), 8,69 (уш.с, 1H), 8,81 (с, 1H), 10,13 (с, 1H). LC-MS розраховували для C23H21ClN6O (M+H), 433,15, виявили 433,3. Чистота при ВЕРХ складала 96% при =200 нм і 99% при =260 нм. Приклад 2 2-({5-хлор-2-[(1-метил-1H-піразол-5-іл)аміно]-4-піридиніл}аміно)-N-метилбензамід 18 UA 103208 C2 5 10 15 20 25 30 35 Суміш 2-[(2,5-дихлор-4-піридиніл)аміно]-N-метилбензаміду (100 мг, 0,338 ммоль), 5-аміно-1метил-1H-піразолу (65,6 мг, 0,675 ммоль), Cs2CO3 (220 мг, 0,675 ммоль), трис(дибензиліденацетон) дипаладію (0) (Pd2(dba)3, 61,8 мг, 0,068 ммоль) і 4,5біс(дифенілфосфіно)-9,9-диметилксантену (Xantphos, 48,8 мг, 0,084 ммоль) нагрівали при 150°C в мікрохвильовій печі протягом 30 хвил. Реакційну суміш фільтрували й фільтрат концентрували й одержаний неочищений продукт очищали за допомогою ВЕРХ з оберненою фазою і продукт обробляли 2 Н HCl з одержанням 34 мг продукту у вигляді солі HCl (24%). LCMS (ES) m/z=357,1 1 (M+H); H ЯМР (400 МГц, метанол-d4) м.д. 8,01 (с, 1H), 7,76-7,74 (м, 1H), 7,62-7,61 (м, 2H), 7,55 (д, J=2 Гц, 1H), 7,42-7,39 (м, 1H), 6,52 (с, 1H), 6,33 (д, J=2 Гц, 1H), 3,76 (с, 3H), 2,91 (с, 3H). Приклад 3 2-({5-хлор-2-[(1-етил-1H-піразол-5-іл)аміно]-4-піридиніл}аміно)-N-метилбензамід Вказану в заголовку сполуку одержували по суті, як описано в прикладі 2, за винятком використання 5-аміно-1-етил-1H-піразолу замість 5-аміно-1-метил-1H-піразолу. LCMS (ES) 1 m/z=371,1 (M+H); H ЯМР (400 МГц, метанол-d4) м.д. 8,06 (м, 1H), 7,77-7,61 (м, 4H), 7,44-7,40 (м, 1H), 6,61 (м, 1H), 6,40 (с, 1H), 4,17-4,10 (м, 2H), 2,91 (с, 3H), 1,40 (триплет, J=7,2 Гц, 3H). Приклад 4 2-[(5-хлор-2-{[3-метил-1-(1-метилетил)-1H-піразол-5-іл]аміно}-4-піридиніл)аміно]-Nметилбензамід Зазначену в заголовку сполуку одержували способом за прикладом 2, за винятком використання 5-аміно-1-ізопропіл-1H-піразолу замість 5-аміно-1-метил-1H-піразолу. LCMS (ES) 1 m/z=399,2 (M+H); H ЯМР (400 МГц, метанол-d4) м.д. 8,06 (с, 1H), 7,78-7,76 (м, 1H), 7,65-7,63 (м, 2H), 7,45-7,38 (м, 1H), 6,64 (с, 1H), 6,29 (с, 1H), 4,70-4,55 (м, 1H), 2,91 (с, 3H), 2,34 (с, 1H), 1,47(д, J=6,8 Гц, 6H). Приклад 5 2-({5-хлор-2-[(1,3-диметил-1H-піразол-5-іл)аміно]-4-піридиніл}аміно)-N-метилбензамід Зазначену в заголовку сполуку одержували способом за прикладом 2, за винятком використання 5-аміно-1-метил-3-метил-1H-піразолу замість 5-аміно-1-метил-1H-піразолу. LCMS 1 (ES) m/z=371,1 (M+H); H ЯМР (400 МГц, метанол-d4) м.д. 8,12 (с, 1H), 7,78-7,76 (д, J=7,6 Гц, 1H), 7,66-7,64 (м, 2H), 7,45-7,41 (м, 1H), 6,67 (с, 1H), 6,38 (с, 1H), 3,80 (с, 3H), 2,91 (с, 3H), 2,35 (с, 3H). Приклад 6 2-({5-хлор-2-[(3-циклопропіл-1-метил-1H-піразол-5-іл)аміно]-4-піридиніл}аміно)-N 19 UA 103208 C2 метилбензамід 5 10 Зазначену в заголовку сполуку одержували способом за прикладом 2, за винятком використання 5-аміно-3-циклопропіл-1-метил-1H-піразолу замість 5-аміно-1-метил-1H-піразолу. 1 LCMS (ES) m/z=397,1 (M+H); H ЯМР (400 МГц, метанол-d4) м.д. 8,06 (с, 1H), 7,78-7,76 (м, 1H), 7,64-7,62 (м, 2H), 7,44-7,40 (м, 1H), 6,57 (с, 1H), 6,15 (с, 1H), 3,71 (с, 3H), 2,91 (с, 3H), 1,97-1,90 (м, 1H), 1,04-1,00 (м, 2H), 0,79-0,76 (м, 2H). Приклад 7 2-({5-хлор-2-[(1,3-диметил-1H-піразол-5-іл)аміно]-4-піридиніл}аміно)-5-фтор-Nметилбензамід 7a) 2-аміно-5-фтор-N-метилбензамід 15 20 25 30 6-фтор-2H-3,1-бензоксазин-2,4(1H)-діон (200 мг, 1,104 ммоль) розчиняли в безводному тетрагідрофурані (THF) (10 мл), після чого додавали метиламін (3,31 мл, 6,63 ммоль). Реакційну суміш перемішували при кімнатній температурі протягом 1 години, потім концентрували у вакуумі. Неочищений продукт очищали на силікагелі (Biotage, 40% EtOAc/гексен) з одержанням вказаної в заголовку сполуки (120 мг, 65%) у вигляді білої твердої речовини. LC-MS (ES) + m/z=169,1 (M+H) 7b) 2-({5-хлор-2-[(1,3-диметил-1H-піразол-5-іл)аміно]-4-піридиніл}аміно)-5-фтор-N-метилбензамід Зазначену в заголовку сполуку одержували у вигляді білої твердої речовини, спочатку проводячи реакцію 2-аміно-5-фтор-N-метилбензаміду з 2,5-дихлор-4-йодопіридином з утворенням 2-[(2,5-дихлор-4-піридиніл)аміно]-5-фтор-N-метилбензаміду по суті відповідно до способу для проміжної сполуки 1, потім проводячи реакцію цієї проміжної сполуки з 1,3диметил-1H-піразол-5-аміном по суті відповідно до способу прикладу 2.: LC-MS (ES) m/z=389,1 + 1 (M+H) , H ЯМР (CD3OD, 400 МГц) 8,01 (с, 1H), 7,60 (м, 1H), 7,51 (м, 1H), 7,38 (м, 1H), 6,39 (с, 1H), 6,18 (с, 1H), 3,69 (с, 3H), 2,89 (с, 3H), 2,24 (с, 3H) Приклад 8 2-({5-хлор-2-[(1,3-диметил-1H-піразол-5-іл)аміно]-4-піридиніл}аміно)-3-фтор-Nметилбензамід 8a) 2-аміно-3-фтор-N-метилбензамід 20 UA 103208 C2 5 10 15 20 2-аміно-3-фторбензонітрил (3,8 г, 27,9 ммоль) розчиняли в етанолі, воді (15 мл) і THF (0,3 мл), додавали гідроксид калію (7,83 г, 140 ммоль). Суміш нагрівали при 85°C протягом 12 годин, охолоджували й фільтрували. Фільтрат концентрували й залишок розчиняли в дихлорметані (DCM, 50 мл). Потім додавали діізопропілетиламін (19,50 мл, 112 ммоль) з подальшим додаванням метиламіну (20,94 мл, 41,9 ммоль) і бром-трис-піролідинoгексафторфосфату фосфонію (PyBrOP, 21,79 г, 41,9 ммоль). Реакційну суміш перемішували при кімнатній температурі протягом 2 годин, промивали насиченим сольовим розчином і сушили над MgSO 4. Розчинник видаляли й залишок очищали за допомогою хроматографії на силікагелі (20% EtOAc/Гексан) з одержанням 1,5 г (35% вихід) проміжної сполуки а. 8b) 2-({5-хлор-2-[(1,3-диметил-1H-піразол-5-іл)аміно]-4-піридиніл}аміно)-3-фтор-N-метилбензамід Зазначену в заголовку сполуку одержували у вигляді білої твердої речовини відповідно до способу прикладу 7, за винятком використання 2-аміно-3-фтор-N-метилбензаміду замість 2+ 1 аміно-5-фтор-N-метилбензаміду: LC-MS (ES) m/z=389,1 (M+H) , H ЯМР (CD3OD, 400 МГц) 8,01 (с, 1H), 7,50 (м, 3H), 6,14 (с, 1H), 5,87 (м, 1H), 3,65 (с, 3H), 2,89 (с, 3H), 2,22 (с, 3H) 2-{[5-хлор-2-(амінопіразол)-4-піридиніл]аміно}бензамідні сполуки, що ілюструються в таблиці 1, одержували з різних 2-[(2,5-дихлор-4-піридиніл)аміно]метилбензамідів і амінопіразолів по суті відповідно до способу прикладу 7. У наведених нижче таблицях пунктирні лінії вказують точки приєднання. Таким чином, для прикладу 9 сполука відповідає наступній структурі: Таблиця 1 Приклад Назва 9 2-({5-хлор-2-[(1-етил-1Hпіразол-5-іл)аміно]-4піридиніл}аміно)-4,5дифтор-Nметилбензамід 11 Rb 2-({5-хлор-2-[(1,3диметил-1H-піразол-5іл)аміно]-4піридиніл}аміно)-4,5дифтор-Nметилбензамід 10 Ra 5-хлор-2-({5-хлор-2-[(1,3диметил-1H-піразол-5іл)аміно]-4піридиніл}аміно) -Nметилбензамід 21 Дані LC-MS (ES) m/z=407,1 + 1 (M+H) , H ЯМР (CD3OD, 400 МГц) 8,04 (с, 1H), 7,71 (м, 1H), 7,61 (м, 1H), 6,63 (с, 1H), 6,28 (с, 1H), 3,72 (с, 3H), 2,89 (с, 3H), 2,72 (с, 3H) LC-MS (ES) m/z=460,1 + 1 (M+H) , H ЯМР (CD3OD, 400 МГц) 8,00 (с, 1H), 7,70 (м, 1H), 7,59 (м, 2H), 6,56 (с, 1H), 6,33 (с, 1H), 4,11 (м, 2H), 2,90 (м, 3H), 1,38 (м, 3H) LC-MS (ES) m/z=407,0 + 1 (M+H) , H ЯМР (CD3OD, 400 МГц) 8,03 (с, 1H), 7,78 (м, 1H), 7,61 (м, 2H), 6,56 (с, 1H), 6,23 (с, 1H), 3,70 (с, 3H), 2,90 (с, 3H), 2,26 (с, 3H) UA 103208 C2 Таблиця 1 Приклад Назва 12 5-хлор-2-({5-хлор-2-[(1етил-1H-піразол-5іл)аміно]-4піридиніл}аміно) -Nметилбензамід 13 2-({5-хлор-2-[(1-етил-3метил-1H-піразол-5іл)аміно]-4піридиніл}аміно)-Nметилбензамід 14 2-[(5-хлор-2-{[3-(1,1диметилетил)-1-метил1H-піразол-5-іл]аміно}-4піридиніл)аміно]-Nметилбензамід 15 2-[(5-хлор-2-{[1-етил-3(гідроксиметил)-1Hпіразол-5-іл]аміно}-4піридиніл)аміно]-Nметилбензамід 16 2-[(5-хлор-2-{[1-(2гідроксіетил)-3-метил1H-піразол-5-іл]аміно}-4піридиніл)аміно]-Nметилбензамід 17 етил-5-{[5-хлор-4-({2[(метиламіно)карбоніл]феніл}-аміно)2-піридиніл]аміно}-1етил-1H-піразол-3карбоксилат Ra Rb 22 Дані LC-MS (ES) m/z=407,0 + 1 (M+H) , H ЯМР (CD3OD, 400 МГц) 8,00 (с, 1H), 7,78 (м, 1H), 7,59 (м, 3H), 6,50 (с, 1H), 6,32 (м, 1H), 4,10 (м, 2H), 2,89 (с, 3H), 1,37 (с, 3H) LC-MS (ES) m/z=384,8 + H (M+H) , 1 ЯМР (400 МГц, метанол-d4) м.д. 8,01 (с, 1H), 7,76-7,74 (м, 1H), 7,627,61 (м, 2H), 7,41-7,37 (м, 1H), 6,59 (с, 1H), 6,20 (с, 1H), 4,07-4,01 (м, 2Н), 2,91 (с, 3H), 2,27 (с, 3H), 1,35 (триплет, J=7,2 Гц, 3Н). LCMS (ES) m/z=412,8 1 (M+H); H ЯМР (400 МГц, метанол-d4) м.д. 8,05 (с, 1H), 7,75-7,72 (м, 1H), 7,607,58 (м, 2H), 7,40-7,35 (м, 1H), 6,52 (с, 1H), 6,27 (с, 1H), 3,70 (с, 3H), 2,91 (с, 3H), 1,30 (с, 9H). LCMS (ES) m/z=401,1 1 (M+H); H ЯМР (400 МГц, метанол-d4) м.д. 7,99 (с, 1H), 7,75-7,73 (м, 1H), 7,617,59 (м, 2H), 7,39-7,35 (м, 1H), 6,58 (с, 1H), 6,31 (с, 1H), 4,56 (с, 2H), 4,08-4,03 (м, 2H), 2,91 (с, 3H), 1,36 (триплет, J=7,2 Гц, 6H). LCMS (ES) m/z=401,1 1 (M+H); H ЯМР (400 МГц, метанол-d4) м.д. 8,07 (с, 1H), 7,78-7,76 (м, 1H), 7,657,63 (м, 2H), 7,43-7,39 (м, 1H), 6,69 (с, 1H), 6,31 (с, 1H), 4,18 (триплет, J=5,2 Гц, 2H), 3,85 (триплет, J=5,2 Гц, 2H), 2,91 (с, 3H), 2,32 (с, 3H). LCMS (ES) m/z=443,1 1 (M+H); H ЯМР (400 МГц, метанол-d4) м.д. 8,02 (с, 1H), 7,75-7,74 (м, 1H), 7,627,60 (м, 2H), 7,40-7,36 (м, 1H), 6,82 (с, 1H), 6,59 (с, 1H), 4,41-4,36 (м, 2H), 4,194,14 (м, 2H), 2,91 (с, 3H), 1,43-1,37(м, 6H). UA 103208 C2 Таблиця 1 Приклад Назва 18 5-{[5-хлор-4-({2[(метиламіно)карбоніл]феніл}-аміно)2-піридиніл]аміно}-1етил-N-(метилокси)-1Hпіразол-3-карбоксамід 20 5-{[5-хлор-4-({2[(метиламіно)карбоніл]феніл}-аміно)2-піридиніл]аміно}-1етил-N-метил-1Hпіразол-3-карбоксамід 21 2-[(5-хлор-2-{[3-метил-1(2,2,2-трифторетил)-1Hпіразол-5-іл]аміно}-4піридиніл)аміно]-Nметилбензамід 22 Rb 5-{[5-хлор-4-({2[(метиламіно)карбоніл]феніл}-аміно)2-піридиніл]аміно}-1етил-1H-піразол-3карбонова кислота 19 Ra 2-[(5-хлор-2-{[1-(1метил-4-піперидиніл)1H-піразол-5-іл]аміно}-4піридиніл)аміно]-Nметилбензамід 23 Дані LCMS (ES) m/z=415,1 1 (M+H); H ЯМР (400 МГц, метанол-d4) м.д. 8,02 (с, 1H), 7,78-7,76 (м, 1H), 7,657,63 (м, 2H), 7,44-7,40 (м, 1H), 6,83 (с, 1H), 6,59 (с, 1H), 4,20-4,14 (м, 2H), 2,91 (с, 3H), 1,42 (триплет, J=6,8 Гц, 3H). LCMS (ES) m/z=444,1 1 (M+H); H ЯМР (400 МГц, метанол-d4) м.д. 8,01 (с, 1H), 7,76-7,74 (м, 1H), 7,637,62 (м, 2H), 7,41-7,37 (м, 1H), 6,74 (с, 1H), 6,57 (с, 1H), 4,16-4,13 (м, 2H), 3,81 (с, 3H), 2,91 (с, 3H), 1,42 (триплет, J=6,8 Гц, 3H). LCMS (ES) m/z=428,1 1 (M+H); H ЯМР (400 МГц, метанол-d4) м.д. 8,01 (с, 1H), 7,76-7,74 (м, 1H), 7,627,61 (м, 2H), 7,41-7,38 (м, 1H), 6,71 (с, 1H), 6,55 (с, 1H), 4,16-4,10 (кв., J=7,2 Гц, 2H), 2,92 (с, 3H), 2,91 (с, 3H), 1,42 (триплет, J=7,2 Гц, 3H). LCMS (ES) m/z=439,1 1 (M+H); H ЯМР (400 МГц, метанол-d4) м.д. 8,00 (с, 1H), 7,76-7,74 (м, 1H), 7,627,58 (м, 2H), 7,40-7,36 (м, 1H), 6,61 (с, 1H), 6,25 (с, 1H), 4,82-4,76 (кв., J=8,4 Гц, 2H), 2,91 (с, 3H), 2,27(с, 3H). LCMS (ES) m/z=440,1 1 (M+H); H ЯМР (400 МГц, метанол-d4) м.д. 8,04 (с, 1H), 7,75-7,73 (м, 1H), 7,617,57 (м, 3H), 7,42-7,38 (м, 1H), 6,45 (с, 1H), 6,33 (с, 1H), 4,60-4,50 (м, 1H), 3,673,63 (м, 2H), 3,25-3,15 (м, 2H), 2,91 (с, 3H), 2,90 (с, 3H), 2,40-2,12 (м, 4H). UA 103208 C2 Таблиця 1 Приклад Назва 23 2-{[5-хлор-2-({1-[2(диметиламіно) етилу]-3метил-1H-піразол-5іл}аміно)-4піридиніл]аміно}-Nметилбензамід 24 5-{[5-хлор-4-({2[(метиламіно)карбоніл]феніл}-аміно)2-піридиніл]аміно}-N-[2(диметиламіно)-етил]-1етил-1H-піразол-3карбоксамід 25 5-{[5-хлор-4-({2[(метиламіно)карбоніл]феніл}аміно)-2піридиніл]аміно}-N-[2(диметиламіно)-етил]-1етил-N-метил-1Hпіразол-3-карбоксамід 26 2-({5-хлор-2-[(1,3диметил-1H-піразол-4іл)аміно]-4піридиніл}аміно)-Nметилбензамід 27 2-({5-хлор-2-[(1,3диметил-1H-піразол-4іл)аміно]-4піридиніл}аміно)-Nметилбензамід Ra Rb Дані LCMS (ES) m/z=428,1 1 (M+H); H ЯМР (400 МГц, метанол-d4) м.д. 8,06 (с, 1H), 7,76-7,74 (м, 1H), 7,627,61 (м, 2H), 7,43-7,38 (м, 1H), 6,59 (с, 1H), 6,18 (с, 1H), 4,41-4,38 (т, J=5,6 Гц, 2H), 3,63-3,60 (т, J=5,6 Гц, 2H), 2,98 (с, 6H), 2,91 (с, 3H), 2,25 (с, 3H). LCMS (ES) m/z=485,2 1 (M+H); H ЯМР (400 МГц, метанол-d4) м.д. 8,03 (с, 1H), 7,76-7,74 (м, 1H), 7,627,60 (м, 2H), 7,40-7,35 (м, 1H), 6,76 (с, 1H), 6,56 (с, 1H), 4,16-4,14 (кв., J=7,2 Гц, 2H), 3,77 (триплет, J=6,0 Гц, 2H), 3,38 (триплет, J=6,0 Гц, 2H), 2,99(с, 6H), 2,91 (с, 3H), 1,42 (триплет, J=7,2 Гц, 3H). LCMS (ES) m/z=499,2 1 (M+H); H ЯМР (400 МГц, метанол-d4) м.д. 8,04 (с, 1H), 7,76-7,74 (м, 1H), 7,627,60 (м, 2H), 7,40-7,35 (м, 1H), 6,70 (с, 1H), 6,52 (с, 1H), 4,16-4,10 (м, 2H), 3,953,90 (м, 1H), 3,58-3,40 (м, 5H), 3,20-3,15 (м, 1H), 3,03 (с, 6H), 2,91 (с, 3H), 1,42 (триплет, J=7,2 Гц, 3H). LC-MS (ES) m/z=371,1 + 1 (M+H) ; H ЯМР (CD3OD, 400 МГц) 7,88 (с, 1H), 7,84 (с, 1H), 7,75 (м, 1H), 7,64 (м, 2H), 7,40 (м, 1H), 6,58 (с, 1H), 3,92 (с, 3H), 2,92 (с, 3H), 2,18 (с, 3H) LC-MS (ES) m/z=425,0 + 1 (M+H) , H ЯМР (CD3OD, 400 МГц) 7,98 (с, 1H), 7,90 (с, 1H), 7,76 (м, 1H), 7,63 (м, 2H), 7,40 (м, 1H), 6,58 (с, 1H), 4,00 (с, 3H), 2,91 (с, 3H) 2-{[5-трифторметил-2-(амінопіразол)-4-піридиніл]аміно}бензамідні сполуки, що ілюструються в таблиці 2, одержували з 2-[(2-хлор-5-трифторметил-4-піридиніл)аміно]метилбензаміду й відповідного амінопіразолу по суті відповідно до способу прикладу 2. 5 24 UA 103208 C2 Таблиця 2 Приклад Назва 28 2-{[2-[(1,3-диметил-1H-піразол-5-іл)аміно]5-(трифторметил)-4-піридиніл]аміно}-Nметилбензамід LC-MS (ES) + m/z=405,1 (M+H) 29 2-{[2-[(1-етил-1H-піразол-5-іл)аміно]-5(трифторметил)-4-піридиніл]аміно}-Nметилбензамід LC-MS (ES) + m/z=405,1 (M+H) 30 N-метил-2-{[2-{[3-метил-1-(1-метилетил)1H-піразол-5-іл]аміно}-5-(трифторметил)4-піридиніл]аміно}бензамід LC-MS (ES) + m/z=433,2 (M+H) 31 2-{[2-({1-[2-(диметиламіно)етил]-3-метил1H-піразол-5-іл}аміно)-5-(трифторметил)4-піридиніл]аміно}-N-метилбензамід LC-MS (ES) + m/z=462,2 (M+H) 32 2-{[2-[(1-етил-3-метил-1H-піразол-5іл)аміно]-5-(трифторметил)-4піридиніл]аміно}-N-метилбензамід LCMS (ES) m/z=419,2 (M+H) 33 N-метил-2-{[2-[(3-метил-1-феніл-1Hпіразол-5-іл)аміно]-5-(трифторметил)-4піридиніл]аміно}бензамід LCMS (ES) m/z=467,1 (M+H) 34 2-{[2-{[1-(2-гідроксіетил)-3-метил-1Hпіразол-5-іл]аміно}-5-(трифторметил)-4піридиніл]аміно}-N-метилбензамід LCMS (ES) m/z=435,1 (M+H) Pyr Дані Проміжна сполука 1 2-[(2,5-дихлор-4-піридиніл)аміно]бензойна кислота 5 Суміш 2,5-дихлор-4-йодопіридину (10 г, 36,5 ммоль), 2-амінобензойної кислоти (4,85 г, 35,4 ммоль), DPEPhos [простий біс(2-дифенілфосфінофеніловий)ефір] (1,6 г, 2,97 ммоль), ацетату 25 UA 103208 C2 5 10 15 20 25 30 35 40 45 паладію (II) (160 мг, 0,713 ммоль) і K3PO4 (20 г, 94 ммоль) дегазували й нагрівали при 120°C (температура масляної бані) протягом 20 годин. Через 20 годин, LCMS показала, що витратилося 33% (відносно бажаного продукту) вихідної речовини. До суміші додавали додаткові 160 мг Pd(OAc)2 і нагрівали до 120°C протягом додаткових 24 годин. LCMS продемонструвала завершення конверсії. Суміш охолоджували до кімнатної температури, з подальшою фільтрацією й відмиванням EtOAc. Тверду речовину підкисляли до pH=7-8 з подальшою фільтрацією. Проте суміш була пастою, й зібрану тверду речовину не можна було повністю висушити. Тверду речовину (11 г) підкисляли 6 Н HCl до pH=1. Одержану пасту фільтрували й промивали водою і TBME. Тверду речовину сушили у вакуумі над P 2O5 протягом 2 діб з одержанням вказаної в заголовку сполуки (7,32 г, 60,2% вихід). MS: + 1 M(C12H8Cl2N2O2)=283,11, (M+H) =283,8; H ЯМР (400 МГц, ДМСО) м.д. 13,6 (с, 1H), 10,2 (с, 1H), 8,3 (с, 1H), 8,0 (д, 1H), 7,6 (кв., 2H), 7,3 (с, 1H), 7,2 (м, 1H). Приклад 35 2-({5-хлор-2-[(1,3-диметил-1H-піразол-5-іл)аміно]-4-піридиніл}аміно)бензойна кислота У пробірку для створення тиску поміщали 2-[(2,5-дихлор-4-піридиніл)аміно]бензойну кислоту (1,0 г, 3,53 ммоль), 1,3-диметил-1H-піразол-5-амін (0,589 г, 5,30 ммоль) (±)-2,2’біс(дифенілфосфіно)-1,1’-бінафталін (0,330 г, 0,530 ммоль), трис(дибензиліденацетон)дипаладій (0) (Pd2(dba)3, 0,162 г, 0,177 ммоль) і трет-бутоксид натрію (0,849 г, 8,83 ммоль) в 1,4-діоксані (30 мл). Пробірку дегазували N2 і закривали й реакційну суміш нагрівали в масляній бані при 120°C протягом 18 годин. Реакційну суміш випаровували насухо у високому вакуумі. Залишок повертали у водний розчин і pH доводили до значеньвід 4 до 5 із застосуванням 6,0 Н сірчаної кислоти. Реакційну суміш концентрували насухо й одержану тверду речовину розчиняли в MеOH і очищали за допомогою ВЕРХ з оберненою фазою з одержанням вказаної в заголовку сполуки у вигляді твердої речовини (285 мг, 21% + вихід). MS: M(C17H16ClN5O2)=357,79, (M+H) =358,360. Приклад 36 2-({5-хлор-2-[(1,3-диметил-1H-піразол-5-іл)аміно]-4-піридиніл}аміно)-N-(метилокси)бензамід У судину поміщали 3-({5-хлор-2-[(1,3-диметил-1H-піразол-5-іл)аміно]-4піридиніл}аміно)бензойну кислоту (100 мг, 0,279 ммоль), гідрохлорид 1-(3-диметиламінопроліл)3-етилкарбодиіміду (53,6 мг, 0,279 ммоль) і гідроксибензотриазол (42,8 мг, 0,279 ммоль) у N,Nдиметилформаміді (DMF, 1,0 мл) і вміст перемішували при кімнатній температурі протягом 30 хвил. До цієї суміші додавали гідрохлорид метоксиламіну (23,34 мг, 0,279 ммоль) і перемішування продовжували протягом додаткових 10 хвилин. Реакційну суміш охолоджували до 0°C. Додавали діізопропілетиламін (DIEA, 0,098 мл, 0,559 ммоль) і реакційну суміш перемішували при кімнатній температурі протягом ночі. Кінцеву неочищену речовину очищали із застосуванням ВЕРХ з оберненою фазою, (Gilson) елюювали CH3CN/H2O 0,1% мурашиною + 1 кислотою з виходом 15 мг (18% вихід) MS: M(C 18H19ClN6O2)=386,84, (M+H) =387; H ЯМР (400 МГц, MеOD) м.д. 8,16 (с, 1H), 7,93 (с, 1H), 7,50-7,66 (м, 2H), 7,11-7,25 (м, 1H), 6,62 (с, 1H), 5,99 (с, 1H), 3,80 (с, 3H), 3,55-3,70 (с, 3H), 2,11-2,26 (с, 3H). 2-({5-хлор-2-[(1,3-диметил-1H-піразол-5-іл)аміно]-4-піридиніл}аміно)-N-алкіл-N(алкілілокси)бензамідні сполуки, що ілюструються в таблиці 3, одержували з 3-({5-хлор-2-[(1,3диметил-1H-піразол-5-іл)аміно]-4-піридиніл}аміно)бензойної кислоти й аміноспиртів по суті відповідно до способу прикладу 36. 26 UA 103208 C2 Таблиця 3 Приклад Назва 37 2-({5-хлор-2-[(1,3диметил-1H-піразол-5-іл)аміно]-4-піридиніл}-аміно)N-метил-N-(метилокси)бензамід 38 2-({5-хлор-2-[(1,3диметил-1H-піразол-5-іл)аміно]-4-піридиніл}аміно)N-{[2-(диметиламіно)етил]-окси}бензамід Rc Дані + 1 LC-MS (ES) m/z=387 (M+H) ; H ЯМР (400 МГц, MеOD) м.д. 8,16 (с, 1H), 7,93 (с, 1H), 7,50-7,66 (м, 2H), 7,117,25 (м, 1H), 6,62(с, 1H), 5,99 (с, 1H), 3,80 (с, 3H), 3,55-3,70 (с, 3H), 2,112,26 (с, 3H) + 1 LC-MS (ES) m/z=444, 446 (M+H) ; H ЯМР (400 МГц, MеOD) м.д. 8,50 (с, 1H), 7,93 (с, 1H), 7,64-7,71 (м, 1H), 7,51-7,61 (м, 2H), 7,21 (ддд, J=8,0, 6,2, 2,3 Гц, 1H), 6,58 (с, 1H), 5,98 (с, 1H), 4,22-4,31 (м, 2H), 3,61 (с, 3H), 3,33--3,40 (м, 2H), 2,96 (с, 6H), 2,19 (с, 3H) Приклад 39 2-({5-хлор-2-[(1-етил-3-метил-1H-піразол-5-іл)аміно]-4-піридиніл}аміно)-N(метилокси)бензамід 5 39a) 2-[(2,5-дихлор-4-піридиніл)аміно]-N-(метилокси)бензамід 10 15 20 У ємність поміщали 3-[(2,5-дихлор-4-піридиніл)аміно]бензойну кислоту (1,0 г, 3,53 ммоль), гідрохлорид 1-(3-диметиламінопроліл)-3-етилкарбодиіміду (677 мг, 3,53 ммоль) і гідроксибензотриазол (HОBT) (541 мг, 3,53 ммоль) у N,N-диметилформаміді (DMF, 7,0 мл) і перемішували при кімнатній температурі протягом 30 хвил. До цього розчину додавали гідрохлорид метоксиламіну (0,3 г, 3,53 ммоль) і реакційну суміш перемішували протягом додаткових 10 хвилин. Реакційну суміш охолоджували до 0°C із застосуванням крижаної бані. До цієї реакційної суміші додавали діізопропілетиламін (1,2 мл, 7,06 ммоль) і суміш перемішували при кімнатній температурі протягом ночі. Після концентрації у вакуумі, залишок обробляли із застосуванням насиченого водного розчину NaHCO 3 і CH2Cl2. Органічну фазу промивали насиченим сольовим розчином, потім сушили над MgSO 4 і фільтрували. CH2Cl2 видаляли випаровуванням на роторному випарнику. Неочищену речовину вносили до колонки з силікагелем і елюювали MеOH в CH2Cl2 з 0,1% NH4OH, що давало бажаний продукт 2-[(2,5дихлор-4-піридиніл)аміно]-N-(метилокси)бензамід (850 мг, 2,72 ммоль, 77% вихід) MS: + 1 M(C13H11Cl2N3O2)=312,15, (M+H) =312, 314; H ЯМР (400 МГц, хлороформ-d) м.д. 9,57 (уш.с, 1H), 8,72 (с, 1H), 8,22 (с, 1H), 7,51-7,67 (м, 3H), 7,25 (с, 1H), 7,07-7,21 (м, 1H), 3,92 (с, 3H). 27 UA 103208 C2 5 10 15 39b) 2-({5-хлор-2-[(1-етил-3-метил-1H-піразол-5-іл)аміно]-4-піридиніл}аміно)-N-(метилокси) бензамід У 20-мл мікрохвильову пробірку поміщали 2-[(2,5-дихлор-4-піридиніл)аміно]-N-(метилокси) бензамід (100 мг, 0,320 ммоль), 1-етил-3-метил-1H-піразол-5-амін (60,1 мг, 0,481 ммоль), карбонат цезію (313 мг, 0,961 ммоль), 1,4-діоксан (5,0 мл) і THF (1,0 мл). Реакційну суміш дегазували азотом протягом 10 хвил. Потім додавали (±)-2,2’-біс(дифенілфосфіно)-1,1’бінафталін (19,95 мг, 0,032 ммоль) і ацетат паладію (II) (3,60 мг, 0,016 ммоль) у мінімальній кількості 1,4-діоксану. Пробірку закривали й реакційну суміш нагрівали в мікрохвильовій печі при 160°C протягом 40 хвилин. Одержану суспензію охолоджували до кімнатної температури й фільтрували через целіт. Фільтрат випаровували насухо й неочищену реакційну суміш очищали за допомогою ВЕРХ з оберненою фазою з одержанням вказаної в заголовку сполуки у вигляді + 1 твердої речовини (16 мг, 24% вихід) MS: M(C19H21ClN6O2)=400,86, (M+H) =401; H ЯМР (400 МГц, MеOD) м.д. 7,92 (с, 1H), 7,44-7,66 (м, 3H), 7,11-7,25 (м, 1H), 6,61 (с, 1H), 5,99 (с, 1H), 3,98 (кв., J=7,3 Гц, 2H), 3,80 (с, 3H), 2,21 (с, 3H), 1,32 (т, J=7,2 Гц, 3H). 2-({5-хлор-2-(піразол-5-іл)аміно]-4-піридиніл}аміно)-N-(метилокси)бензамідні сполуки, подані в таблиці 4, одержували з 2-[(2,5-дихлор-4-піридиніл)аміно]-N-(метилокси)бензаміду й амінопіразолів по суті відповідно до способу прикладу 39. Таблиця 4 Приклад 40 20 25 30 35 Назва Pyr 2-({5-хлор-2-[(1-етил-1Hпіразол-5-іл)аміно]-4піридиніл}аміно)-N(метилокси)-бензамід Дані + 1 LC-MS (ES) m/z=387, 388 (M+H) ; H ЯМР (400 МГц, MеOD) м.д. 1H 7,907,96 (м, 1H), 7,49-7,66 (м, 3H), 7,45 (т, J=2,2 Гц, 1H), 7,10 -7,22 (м, 1H), 6,61 (с, 1H), 6,19 (д, J=1,8 Гц, 1H), 4,06 (кв., J=7,1 Гц, 2H), 3,80 (с, 3H), 1,35 (т, J=7,2 Гц, 3H) Проміжна сполука 2 2-[(2,5-дихлор-4-піридиніл)аміно]-N-(метилокси)бензамід Розчин 3-[(2,5-дихлор-4-піридиніл)аміно]бензойної кислоти (500 мг, 1,766 ммоль), N-(3диметиламінопроліл)-N’-етилкарбодиіміду (EDC) (339 мг, 1,766 ммоль) і 1гідроксибензотриазолу (HOBT) (270 мг, 1,766 ммоль) у N,N-диметилформаміді (3532 мкл) перемішували при кімнатній температурі протягом 30 хвил. Потім до цього розчину додавали Oметилгідроксиламін (амінокси) метан (148 мг, 1,766 ммоль) і перемішували протягом додаткових 10 хвилин. Реакційну суміш охолоджували із застосуванням крижаної водної бані. Потім додавали діізопропілетиламін (617 мкл, 3,53 ммоль). Після завершення додавання реакційну суміш перемішували при кімнатній температурі протягом ночі. Реакційну суміш контролювали за допомогою ВЕРХ і LCMS. Кінцеву неочищену речовину обробляли додаванням насичених водних NaHCO3 і CH2Cl2. Органічну фазу промивали насиченим сольовим розчином, потім сушили над MgSO4. Розчин фільтрували й розчинник видаляли за допомогою випаровування. Маслоподібну неочищену речовину наносили на колонку з силікагелем і елюювали MеOH в CH2Cl2 з 0,1% NH4OH з одержанням цільової сполуки 2-[(2,5-дихлор-4-піридиніл)аміно]-N(метилокси)бензаміду (320 мг, 1,025 ммоль, 58,0% вихід) у вигляді жовтої твердої речовини; MS; 28
ДивитисяДодаткова інформація
Назва патенту англійськоюPyrazolylaminopyridines as inhibitors of fak
Автори російськоюAdams, Jerry, Leroy, Faitg, Thomas, H., Johnson, Neil, W., Lin, Hong, Kasparec, Jiri, Mellinger, Mark, Peng, Xin, Xie, Ren
МПК / Мітки
МПК: A61P 35/00, A61K 31/535
Мітки: 2-[(5-хлор-2-{[3-метил-1-(1-метилетил)-1н-піразол-5-іл]аміно}-4-піридиніл)аміно]-n-метилбензамід, фокальної, адгезії, fak, кінази, інгібітор
Код посилання
<a href="https://ua.patents.su/61-103208-2-5-khlor-2-3-metil-1-1-metiletil-1n-pirazol-5-ilamino-4-piridinilamino-n-metilbenzamid-yak-ingibitor-kinazi-fokalno-adgezi-fak.html" target="_blank" rel="follow" title="База патентів України">2-[(5-хлор-2-{[3-метил-1-(1-метилетил)-1н-піразол-5-іл]аміно}-4-піридиніл)аміно]-n-метилбензамід як інгібітор кінази фокальної адгезії (fak)</a>
Попередній патент: Гідравлічна система із середовищем під тиском (варіанти) та спосіб її застосування
Наступний патент: Звіт про вимірювання сусідніх комірок
Випадковий патент: Ректальний електрод












