Шипуча композиція у твердій формі для використання у вагінальних аплікаціях для лікування вагінальних інфекцій
Формула / Реферат
1. Шипуча композиція у твердій формі, що містить:
- кислотно-основну систему, до якої входить органічна кислота та сіль карбонат- та/або бікарбонат-аніону, де вказана сіль є присутньою у кількості, що дорівнює 1-15 % за вагою відносно загальної ваги композиції, де органічна кислота є вибраною з групи, що охоплює лимонну кислоту, яблучну кислоту, винну кислоту, фумарову кислоту, молочну кислоту та їх суміші,
- суміш, що містить мікрокристалічну целюлозу та арабіногалактан;
- принаймні один пробіотичний бактеріальний штам, що має здатність до зменшення та/або до усунення присутності патогенних агентів, вибраних з групи, що охоплює Candida albicans, Candida glabrata, Candida parapsilosis, Candida krusei, Candida tropicalis, Gardnerella vaginalis, Trichomonas vaginalis, Neisseria gonorrhoeae, Escherichia coli, Herpes simplex та Haemophilus ducreyi, де вказаний штам належить до принаймні одного виду, вибраного з групи, що охоплює Lactobacillus plantarum, Lactobacillus pentosus, Lactobacillus casei, Lactobacillus casei ssp. paracasei, Lactobacillus rhamnosus, Lactobacillus acidophilus, Lactobacillus delbrueckii, Lactobacillus delbrueckii ssp. bulgaricus, Lactobacillus delbrueckii ssp. delbrueckii, Lactobacillus fermentum, Lactobacillus gasseri, Lactobacillus reuteri, Bifidobacterium longum, Bifidobacterium bifidum, Bifidobacterium breve, Bifidobacterium animalis ssp. lactis, Bifidobacterium adolescentis, Bifidobacterium pseudocatenulatum, Bifidobacterium catenulatum або Bifidobacterium infantis;
вказана композиція призначена для застосування у вагінальних аплікаціях для лікування вагінальних інфекцій.
2. Композиція для застосування за п. 1, яка знаходиться у вигляді таблеток, супозиторіїв, пастилок або гранул.
3. Композиція для застосування за п. 1 або 2, де органічна кислота є лимонною кислотою.
4. Композиція для застосування за будь-яким одним з пп. 1-3, в якій сіль карбонат- та/або бікарбонат-аніону є вибраною з групи, що охоплює карбонат натрію, карбонат калію, карбонат кальцію, карбонат магнію, натрієвий карбонат гліцину, бікарбонат натрію, бікарбонат калію, бікарбонат кальцію, бікарбонат магнію, лактат натрію, лактат калію, карбонату лактат та їх суміші.
5. Композиція для застосування за п. 4, де сіль є сіллю бікарбонат-аніону.
6. Композиція для застосування за п. 5, в якій сіль карбонат- та/або бікарбонат-аніону є присутньою у кількості, що дорівнює 3-13 % за вагою відносно загальної ваги композиції; переважно у кількості, що дорівнює 4-12 % за вагою відносно загальної ваги композиції; більш переважніше у кількості, що дорівнює 5-10 % за вагою відносно загальної ваги композиції.
7. Композиція для застосування за будь-яким одним з пп. 1-6, в якій кислотно-основна система складається з бікарбонату натрію та лимонної кислоти та де бікарбонат натрію є присутнім у кількості, що дорівнює 3-13 % за вагою відносно загальної ваги композиції; переважно у кількості, що дорівнює 4-12 % за вагою відносно загальної ваги композиції; більш переважно, у кількості, що дорівнює 5-10 % за вагою відносно загальної ваги композиції.
8. Композиція для застосування за п. 1, в якій вказана мікрокристалічна целюлоза та арабіногалактан є присутніми у співвідношенні, що дорівнює 1:1-3:1 за вагою.
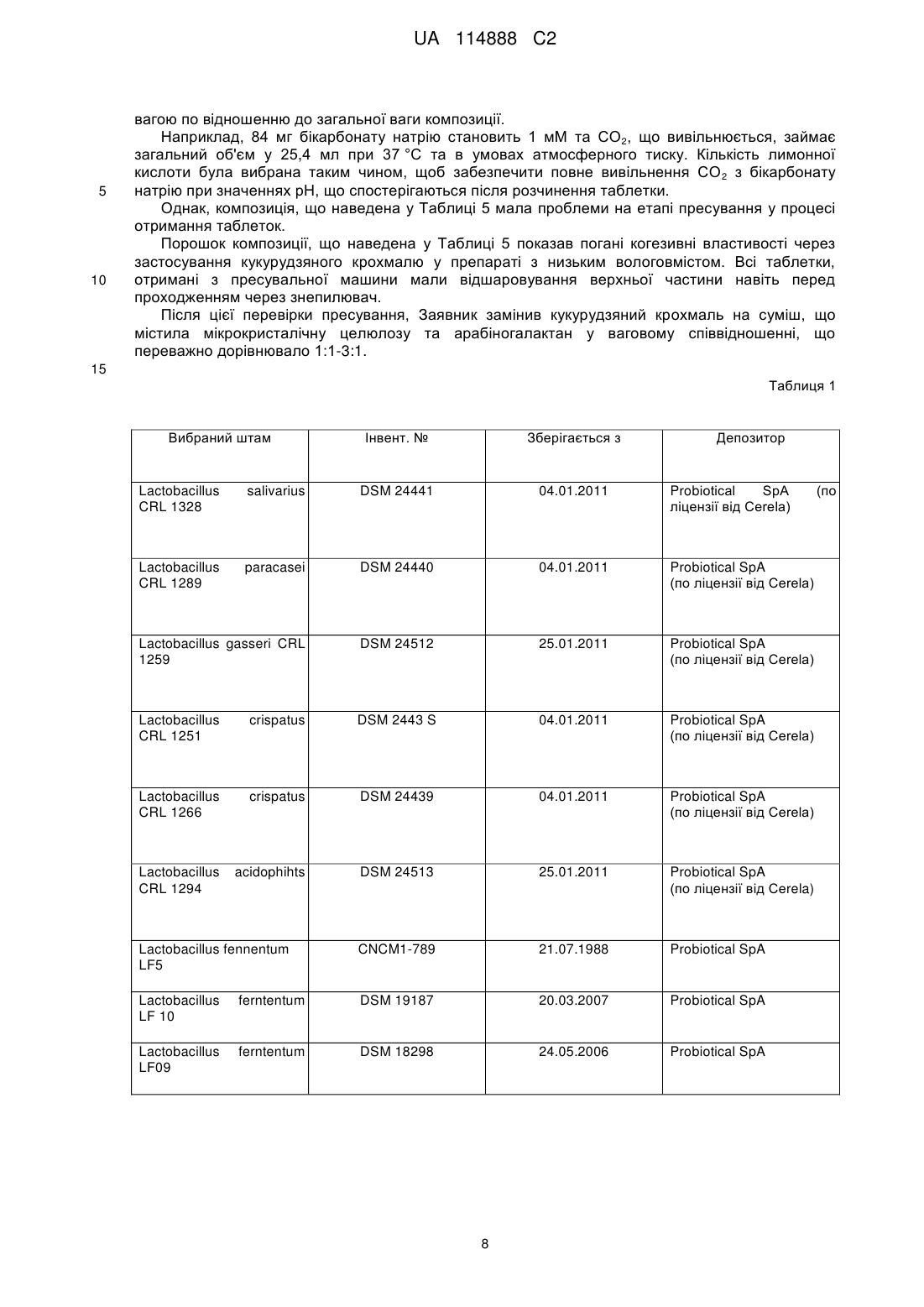
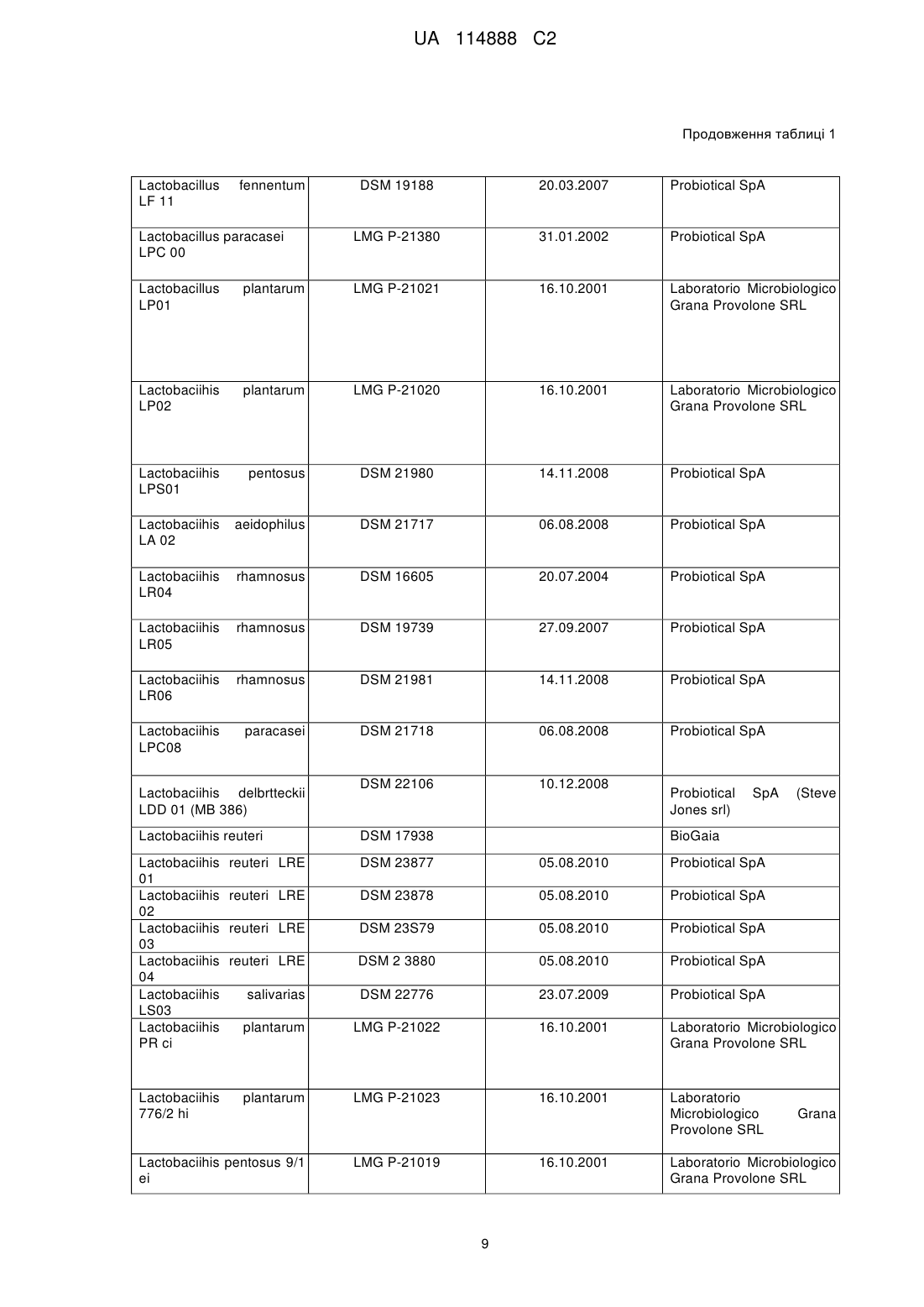
9. Композиція для застосування за будь-яким одним з пп. 1-8, в якій вказаний принаймні один пробіотичний бактеріальний штам є переважно вибраним з наступного: Lactobacillus salivarius CRL 1328 (депозитарний № DSM 24441, зберігається з 04.01.2011), Lactobacillus paracasei CRL 1289 (депозитарний № DSM 24440, зберігається з 04.01.2011, Lactobacillus gasseri CRL 1259 (депозитарний № DSM 24512, зберігається з 25.01.2011), Lactobacillus crispatus CRL 1251 (депозитарний № DSM 24438, зберігається з 04.01.2011), Lactobacillus crispatus CRL 1266 (депозитарний № DSM 24439, зберігається з 04.01.2011), Lactobacillus acidophilus CRL 1294 (депозитарний № DSM 24513, зберігається з 25.01.2011), Lactobacillus paracasei LPC 00 (депозитарний № LMG P-21380, зберігається з 31.01.2002), Lactobacillus plantarum LP 02 (депозитарний № LMG P-21020, зберігається з 16.10.2001) є Lactobacillus fermentum LF 10 (депозитарний № DSM 19187, зберігається з 20.03.2007).
10. Композиція для застосування за будь-яким одним з пп. 1-9, яка призначена для лікування вагініту, вагінозу, кандидозу, гонореї, герпесу та м'якого шанкру.
11. Шипуча таблетка у твердій формі, що містить:
- кислотно-основну систему, що містить бікарбонат натрію та лимонну кислоту; вказаний бікарбонат є присутнім у кількості, що дорівнює 1-15 % за вагою відносно загальної ваги композиції;
- суміш, що містить мікрокристалічну целюлозу та арабіногалактан у співвідношенні, що дорівнює 1:1-3:1 за вагою;
- принаймні один пробіотичний бактеріальний штам, що має здатність до зменшення та/або до усунення присутності патогенних агентів, вибраних з групи, що охоплює: Candida albicans, Candida glabrata, Candida parapsilosis, Candida krusei, Candida tropicalis, Gardnerella vaginalis, Trichomonas vaginalis, Neisseria gonorrhoeae, Escherichia coli, Herpes simplex та Haemophilus ducreyi, вказана композиція призначена для застосування у вагінальних аплікаціях для лікування вагінальних інфекцій.
Текст
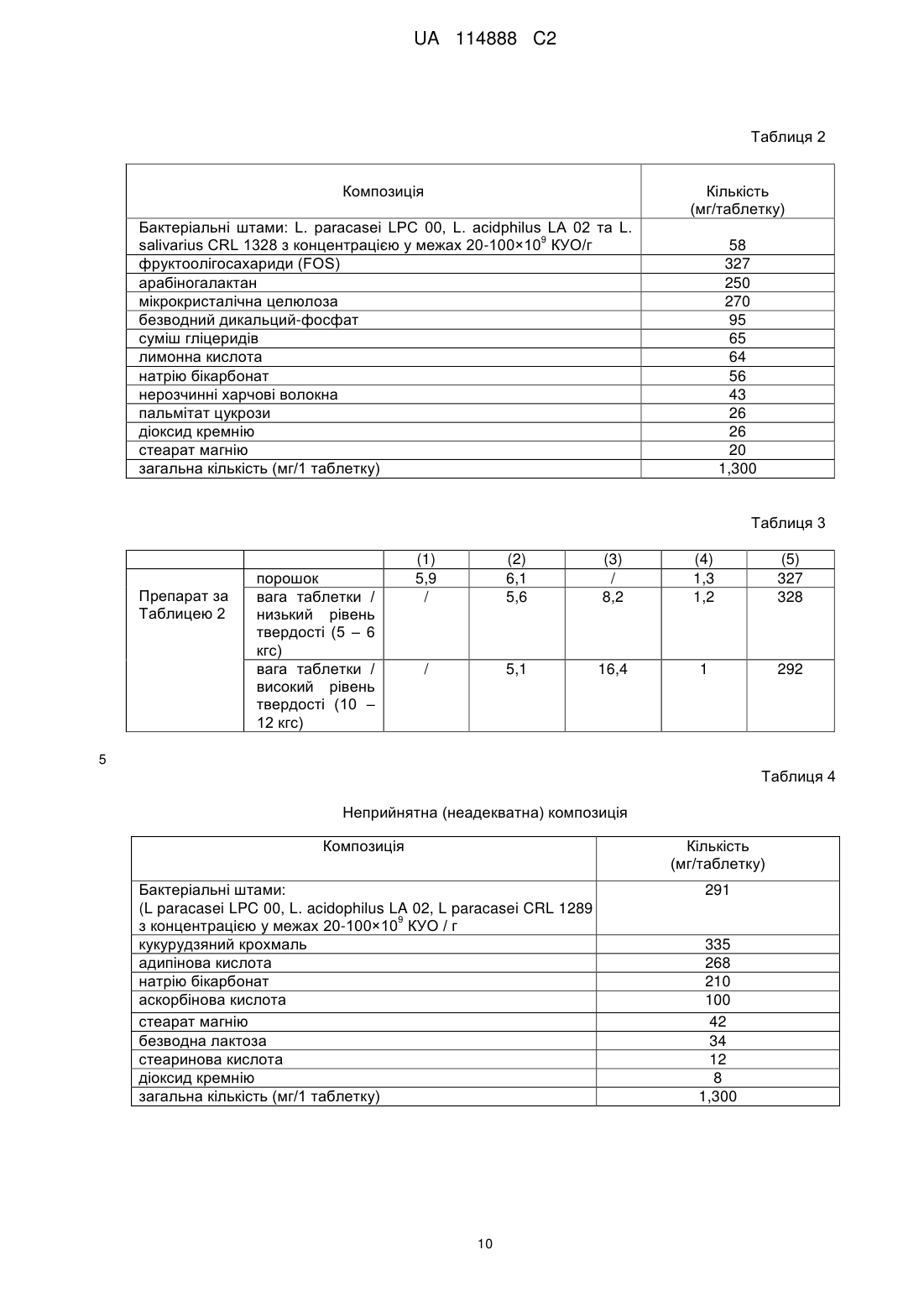
Реферат: Винахід стосується шипучої композиції у твердій формі для застосування у вагінальних аплікаціях для лікування вагінальних інфекцій, що містить кислотно-основну систему, до якої входить органічна кислота та сіль карбонат- та/або бікарбонат-аніону, де вказана сіль є присутньою у кількості, що дорівнює 1-15 % за вагою відносно загальної ваги композиції, де органічна кислота є вибраною з групи, що охоплює лимонну кислоту, яблучну кислоту, винну кислоту, фумарову кислоту, молочну кислоту та їх суміші, суміш, що містить мікрокристалічну целюлозу та арабіногалактан, та пробіотичний бактеріальний штам. UA 114888 C2 (12) UA 114888 C2 UA 114888 C2 5 10 15 20 25 30 35 40 45 50 55 60 Заявлений винахід стосується шипучої композиції у твердій формі для застосування у вагінальних аплікаціях для лікування вагінальних інфекцій. Добре відомо, що склад кишкової та урогенітальної мікрофлори є критичним пунктом здоров'я та благополуччя людини. Вагінальна екосистема складається з епітеліальних клітин, що покривають піхву та матку, залозистих клітин, що утворюють секрецію у просвіт органу та комплексу бактеріальної флори, яка представлена різними видами мікроорганізмів. Ці мікроорганізми мають здатність до ферментування глікогену, що виникає в процесі розкладання парабазальних клітин евтрофічної вагінальної слизової оболонки з наступним отриманням молочної кислоти, кінцевим ефектом дії якої є запровадження та підтримання кислого вагінального середовища (зі значеннями pH 4-4,5 у фізіологічних умовах). + Іони H , що походять з молочної кислоти сприяють утворенню пероксиду водню. Ця молекула є токсичною для великої кількості видів бактерій, що позбавлені ферменту каталази. На етапі вагінальних секрецій, концентрації у 0,75-5 мкг/мл досягаються легко та у великій кількості, достатній для проявлення токсичної дії. Комбінована дія перекису водню, пероксидази матки (що виробляється шийкою та слизовою оболонкою матки) та іонів Cl та I також обмежує бактеріальне зростання шляхом безпосереднього активування поліморфонуклеатів, що проявляють бактерицидну дію в епітеліальних міжклітинних просторах. У жінок часто виникає дисбаланс вагінальної екосистеми, спричинений різними ендогенними та екзогенними факторами, як-то прийомом антибіотиків, станом стресу чи гормональними модуляціями, пов'язаними з вагітністю та менструальним циклом або зі споживанням високих концентрацій естрогену. Змінення балансу вагінальної екосистеми веде до поширення так званих "опортуністичних" мікроорганізмів (наприклад, Candida albicans та Candida glabrata) та/або патогенних мікроорганізмів (наприклад, Neisseria gonorrheae та Trichomonas vaginalis), що може призвести до кандидозів, вагінітів або до форм вагінозу. Епідеміологічні дані свідчать про те, що зараз щороку від вагінальних інфекцій страждає більше мільярда жінок у всьому світі з серйозними наслідками з соціально-економічної точки зору. Загальноприйнятна терапія звичайно полягає у вживанні антибіотиків та/або фунгіцидів, що звичайно дає добрі результати в короткостроковій перспективі, але, як показано, вона неспроможна запобігти рецидивуючим інфекціям через постійно зростаючий опір патогенів. Більш того, не всі суб'єкти, що потребують лікування спроможні приймати та переносити антибіотичну або фунгіцидну терапію. У цій галузі добре відомо застосування мікроорганізмів, здатних до відновлення належного складу вагінальної мікрофлори, однак режим доставки мікроорганізмів до вагінального середовища є дуже критичним фактором. Наприклад, відомо, що вживання м'яких желатинових капсул, звичайно відомих, як м'які гелі, тягне за собою призупинення дії пробіотичних компонентів у олійній основі матриці, яка після застосування продукту звичайно утворює фізичний бар'єр, що може уповільнювати або майже повністю пригнічувати здатність вказаного пробіотичного компоненту до колонізації вагінальної слизової оболонки. Крім того, олійна основа може спричинити токсичну дію відносно мікроорганізмів до такого ступеня, що значно зменшить їх кількість та життєздатність. Наприклад, капсули можуть вимагати багато часу для розчинення та у будь - якому разі вони не гарантують адекватного розповсюдження активного інгредієнта у вагінальному середовищі. Наприклад, гідрофільні суспензії або гідрогелі потребують такого режиму застосування, що не є легким та зручним. Фактично, після їх застосування, суб'єкти повинні лежати протягом принаймні 20-30 хв. для запобігання витікання продукту. Нарешті, традиційні вагінальні таблетки мають проблему, пов'язану з високим рівнем загибелі мікроорганізмів під час їх виробництва та, більш того, вони нездатні забезпечити адекватне розподілення мікроорганізмів у вагінальному середовищі. Отже, залишається потреба у композиції, що буде здатна доставляти живі пробіотичні бактерії до вагінального середовища та забезпечить їх повний розподіл / розповсюдження. Крім того, залишається потреба у фармацевтичній формі для легкого введення та зручного застосування. Зокрема, залишається потреба у композиції, що буде являти собою дійсну альтернативу антибіотичній та/або фунгіцидній терапії та в той же час буде являти собою покращену, ніж зараз відомі форму введення. Заявник несподівано виявив, що вирішити проблеми, які досі були невирішеними у обмежувальній частині Формули Винаходу може пробіотичний препарат у вигляді твердої 1 UA 114888 C2 5 10 15 20 25 30 35 40 45 50 55 60 композиції зі зручним отриманням. Предметом заявленого винаходу є шипуча композиція у твердій формі, як це зазначено у доданій незалежній Формулі Винаходу. Інші бажані втілення заявленого винаходу наведені у доданій незалежній Формулі Винаходу. У Таблиці 1 наведені бактеріальні штами, перевірені Заявником, що утворюють предмет заявленого винаходу. У Таблиці 2 наведено приклад композиції відповідно до винаходу. У Таблиці 3 наведені дані відносно загибелі пробіотичних бактерій відповідно до застосованих різних показників тиску та стійкості таблеток (виражені у вигляді напівжиття бактеріального навантаження) після їх двохрічного зберігання при 25 °C. У Таблиці 4 наведена композиція, яка не є у відповідності з заявленим винаходом. У Таблиці 5 наведена композиція у вигляді таблеток, яка також не є у відповідності з заявленим винаходом. Заявник провів тривалу та інтенсивну експериментальну дослідницьку діяльність з метою визначення оптимального кількісного та якісного складу для отримання композиції заявленого винаходу, а також для визначення робочих параметрів для її отримання. Композиція заявленого винаходу є шипучою композицією. Цей процес відбувається завдяки утворенню діоксиду вуглецю при контактуванні кислотно-лужної системи, що містить органічну кислоту та сіль карбонат - та / або бікарбонат- аніону з водою / вологою, присутньою у вагінальній порожнині. Система на основі кислоти здатна стійко підтримувати значення внутрішньовагінального pH у межах 3-5,5, переважно 4-5. Переважно, значення внутрішньовагінального pH є у межах 4,2-4,5. Композиція заявленого винаходу є шипучою композицією у твердій формі. У бажаному втіленні, органічна кислота знаходиться у твердій формі, переважно у вигляді порошку або гранул та солі карбонат- та/або бікарбонат- аніонів також у твердій формі, переважно у вигляді порошку або гранул. У бажаному втіленні, шипуча композиція у твердій формі знаходиться у вигляді таблеток, супозиторіїв, пастилок або гранул. Органічна кислота є вибраною з групи, що складається або, альтернативно, що містить лимонну кислоту, яблучну кислоту, винну кислоту, фумарову кислоту, молочну кислоту та їх суміші. У бажаному варіанті втілення, органічна кислота являє собою лимонну кислоту. Заявник виявив, що застосування адипінової та/або аскорбінової кислоти у якості органічної кислоти, присутньої у вищезазначеній кислотно-основній системі викликає токсичний ефект відносно мікроорганізмів, що веде до їх загибелі одразу під час отримання композиції у твердій формі, наприклад, у вигляді порошку або гранул. У разі отримання таблеток, вказана загибель мікроорганізмів виникає після перемішування компонентів з отриманням композиції у твердій формі, наприклад у вигляді порошку гранул, але перед етапом стискування. Отже, композиція заявленого винаходу не містить адипінової та/або аскорбінової кислоти. Сіль карбонат- та/або бікарбонат- аніону є вибраною з групи, що складається з або, альтернативно, що містить: карбонат натрію, карбонат калію, карбонат кальцію, карбонат магнію, карбонат натрію, гліцин, бікарбонат натрію, бікарбонат калію, бікарбонат кальцію, бікарбонат магнію, лактат натрію, лактат калію, карбонат лактату та їх суміші. Переважно, зазначена сіль вибрана з групи, що складається з або, альтернативно, що містить сіль бікарбонат- аніону. У бажаному втіленні, сіль є бікарбонатом натрію. У переважному втіленні, кількість солі карбонат- або бікарбонат- аніону дорівнює 1-15 % за вагою по відношенню до загальної ваги композиції. Переважно, вона дорівнює 3-13 % за вагою по відношенню до загальної ваги композиції; ще переважніше вона дорівнює 4-12 % завагою по відношенню до загальної ваги композиції, переважно 5-10 % за вагою по відношенню до загальної ваги композиції. У переважному втіленні, кількість бікарбонату натрію дорівнює 1-15 % за вагою по відношенню до загальної ваги композиції, переважно 3-13 % за вагою по відношенню до загальної ваги композиції; ще переважніше вона дорівнює 5-10 % за вагою по відношенню до загальної ваги композиції, переважно 5-10 % за вагою по відношенню до загальної ваги композиції. У переважному втіленні, кислотно-основна система складається з лимонної кислоти та бікарбонату натрію у кількості за вагою, як описано вище. Заявник виявив, що коли сіль карбонат- або бікарбонат- аніону, наприклад, бікарбонату натрію, знаходиться у кількості, більшій ніж 15 % за вагою по відношенню до загальної ваги композиції, то завдяки осмотичній дії виникає токсичний ефект, спрямований проти мікроорганізмів. 2 UA 114888 C2 5 10 15 20 25 30 35 40 45 50 55 60 Кількість застосованої у кислотно-основній системі органічної кислоти обчислюють одразу після визначення кількості солі карбонат- або бікарбонат- аніонів, застосованої у відповідності з вищеописаними концентраціями. Кількість застосованої органічної кислоти є стехіометричним значенням та функцією застосованої солі та служить виключно для отримання діоксиду вуглецю. У присутності вказаної солі, органічна кислота є здатною до розвитку спінювання завдяки утворенню двоокису вуглецю після гідратації у вагінальній порожнині. Отримана відповідним чином шипуча таблетка здатна доставляти велику популяцію молочнокислих бактерій для швидкої колонізації всього епітелію та слизової оболонки піхви. Завдяки pH-контрольованої та стабілізованої шипучої системі, молочні бактерії постачаються до вагінальної порожнини у доброму фізіологічному стані, що дозволяє їм зростати та розмножуватися. Переважно, композиція за даним винаходом у формі шипучої таблетки здатна забезпечити оптимальний розподіл бактерій у слизовій оболонці піхви. Крім того, вказана композиція є здатною до забезпечення та підтримання анаеробного або мікроаеробного середовища у порожнині піхви завдяки утворенню двоокису вуглецю. Заявник виявив, що суміш, яка містить або, альтернативно, складається з суміші мікрокристалічної целюлози та арабіногалактану, переважно у ваговому співвідношенні 1:1-3:1, є здатною до збереження кількості та життєздатності клітин мікроорганізмів, коли це є бажаним для отримання таблеток з композицією у вигляді порошку. У переважному втіленні, композиція заявленого винаходу містить суміш, до складу якої входить мікрокристалічна целюлоза та арабіногалактан у ваговому співвідношенні 1:1-3:1. Переважним чином був застосований арабіногалактан рослинного походження, переважно отриманий з модрини (наприклад, FiberAid®, з асортименту продуктів Larex® від Lonza Inc. USA). Заявник також виявив, що застосування кукурудзяного крохмалю в якості агрегуючої речовини у композиції заявленого винаходу при застосуванні композиції у вигляді порошку для отримання таблеток веде до незадовільних результатів, оскільки спостерігалося відшарування верхньої частини у таблеток, отриманих після пресування порошку. Навпаки, суміш, що містить або, альтернативно, складається з мікрокристалічної целюлози та арабіногалактану у ваговому співвідношенні 1:1-1:3 дозволяє отримати таблетки без випадків відшарування верхньої частини. Отже, таблетки, отримані з композиції заявленого винаходу не містять кукурудзяний крохмаль. Замість нього застосовано суміш, що містить мікрокристалічну целюлозу та арабіногалактан у ваговому співвідношенні, що переважно дорівнює 1:1-3:1. Мікрокристалічна целюлоза може бути або частково або повністю заміщена целюлозою у вигляді порошку. Обидва види целюлози, як мікрокристалічна целюлоза, так і целюлоза у вигляді порошку присутні у списку харчових добавок під назвою E460. Арабіногалактан є біополімером, що складається з мономерів арабінози та галактози. Існують два класи арабіногалактанів – рослинного та мікробного походження. Мікрокристалічна целюлоза (або целюлоза у вигляді порошку) є присутньою у кількості, що дорівнює 2-45 % за вагою по відношенню до загальної ваги композиції, переважно 5-25 %. Арабіногалактан є присутнім у кількості, що дорівнює 5-30 % за вагою по відношенню до загальної ваги композиції, переважно з 10-20 %. Переважним чином, композиція заявленого винаходу може додатково містити принаймні один додатковий компонент, вибраний з групи, що охоплює натрієву сіль карбоксиметилцелюлози, безводний вторинний кислий фосфат кальцію та гідроксипропил метилцелюлозу. Вказаний принаймні один додатковий компонент є присутнім у композиції заявленого винаходу у загальній кількості, що знаходиться у діапазоні 3-70 % у ваговому співвідношенні, більш переважно у діапазоні 6-40 % у ваговому співвідношенні та більш переважніше у діапазоні 10-25 % у ваговому співвідношенні по відношенню до загальної ваги композиції. Відповідно до бажаного втілення винаходу, композиція заявленого винаходу додатково містить стеарат магнію у кількості 0,5 % - 7 % у ваговому співвідношенні, переважно 1 % - 3,5 % у ваговому співвідношенні по відношенню до загальної ваги композиції. Відповідно до бажаного втілення винаходу, композиція заявленого винаходу може ще додатково містити діоксид кремнію у кількості 0,5 % - 4 % у ваговому співвідношенні, переважно 1 % - 2 % у ваговому співвідношенні по відношенню до загальної ваги композиції. Відповідно до бажаного втілення винаходу, композиція заявленого винаходу може ще додатково містити пальмітат цукрози у кількості 0,5 % - 7 % у ваговому співвідношенні, переважно 1 % - 3,5 % у ваговому співвідношенні по відношенню до загальної ваги композиції. 3 UA 114888 C2 5 10 15 20 25 30 35 40 45 50 55 60 Відповідно до бажаного втілення винаходу, композиція заявленого винаходу може ще додатково містити суміш гліцеридів (жирів, що здатні до омилювання) у кількості 0,5 % - 10 % у ваговому співвідношенні, переважно 2 % - 7 % у ваговому співвідношенні по відношенню до загальної ваги композиції. Відповідно до бажаного втілення винаходу, композиція заявленого винаходу може ще додатково містити складний ефір цукрози у кількості 0,5 % - 10 % у ваговому співвідношенні, переважно 1 % - 5 % у ваговому співвідношенні, де відсотки наведені по відношенню до загальної маси композиції. Композиція винаходу призначена для вагінальних аплікацій для лікування вагінальних інфекцій, як-то вагініту, вагінозу, кандидозу, гонореї, герпесу та м'якого шанкру. У переважному втіленні, композиція існує у вигляді таблеток. Альтернативно, таблетки можуть бути вкриті одним або декількома відомими у цій галузі полімерними матеріалами. Відносно мікробної популяції препаратів відповідно заявленого винаходу, бажаним є застосування пробіотичних мікроорганізмів або індивідуально або у суміші, навіть якщо вона складається з мікроорганізмів різних родів або видів. Пробіотичні мікроорганізми є мікроорганізмами по визначенню, переважно бактеріями людинного походження, що здатні викликати корисні дії, якщо їх вживати регулярно в достатній кількості протягом достатнього періоду часу. Композиція заявленого винаходу містить принаймні один пробіотичний бактеріальний штам, що має здатність зменшувати та/або повністю усувати присутність патогенних агентів, вибраних з групи, що охоплює Candida albicans, Candida glabrata, Candida parapsilosis, Candida krusei, Candida tropicalis, Gardnerella vaginalis, Trichomonas vaginalis, Neisseria gonorrhoeae, Escherichia coli, Herpex simplex та Haemophilus ducreyi. Переважно, вказаний бактеріальний штам належить до принаймні одного виду, вибраного з групи, що охоплює Lactobacillus plantarum, Lactobacillus pentosus, Lactobacillus casei, Lactobacillus casei ssp. paracasei, Lactobacillus rhamnosus, Lactobacillus acidophilus, Lactobacillus delbrueckii, Lactobacillus delbrueckii ssp. bulgaricus, Lactobacillus delbrueckii ssp. delbrueckii, Lactobacillus fermentum, Lactobacillus gasseri, Lactobacillus reuteri, Bifidobacterium longum, Bifidobacterium bifidum, Bifidobacterium breve, Bifidobacterium animalis ssp. lactis, Bifidobacterium adolescentis, Bifidobacterium pseudocatenulatum, Bifidobacterium catenulatum або Bifidobacterium infantis. Серед вищезазначених бактеріальних видів, особливо прийнятними проявили себе штами, перелічені у Таблиці 1. У переважному втіленні, бактеріальні штами є вибраними з наступного: Lactobacillus salivarius CRL 1328, Lactobacillus paracasei CRL 1289, Lactobacillus gasseri CRL 1259, Lactobacillus crispatus CRL 1251, Lactobacillus crispatus CRL 1266, Lactobacillus acidphilus CRL 1294, Lactobacillus paracasei LPC 00, Lactobacillus plantarum LP 02 та Lactobacillus fermentum LF 10. У бажаному втіленні, композиція заявленого винаходу, що переважно знаходиться у вигляді таблетки містить принаймні два штами, вибрані з вищезазначеної групи. У бажаному втіленні, композиція заявленого винаходу, що переважно знаходиться у вигляді таблетки містить принаймні три штами, вибрані з вищезазначеної групи. У бажаному втіленні, композиція заявленого винаходу, що переважно знаходиться у вигляді таблетки містить принаймні чотири штами, вибрані з вищезазначеної групи. Найбільш прийнятними проявили себе штами, вибрані з наступного: Lactobacillus salivarius CRL 1328, Lactobacillus paracasei CRL 1289, Lactobacillus gasseri CRL 1259, Lactobacillus crispatus CRL 1266 та Lactobacillus fermentum LF 10. Мікроорганізми у складі таблеток відповідно до винаходу переважно застосовують у вигляді ліофілізованих культур, що мають кількість життєздатних мікроорганізмів, яка звичайно дорівнює 10-200 мільярдів колонієутворюючих одиниць (КУО) / грам, що переважно є присутніми у кількості 0,5-20 % у ваговому співвідношенні, ще переважніше у кількості 1-15 % у ваговому співвідношенні, навіть більш переважно у кількості 3-10 % у ваговому співвідношенні відносно загальної ваги таблетки. У одному з бажаних втілень, для посилення пробіотичної ефективності препарату відповідно до заявленого винаходу, до порошкової суміші додають певні пребіотичні компоненти з отриманням симбіотичної композиції. Пребіотичний компонент звичайно є нерозчинною сумішшю сахаридної природи, яка принаймні частково розчинюється у воді або у водному розчині, що стимулює зростання та/або активність одного або декількох описаних вище пробіотичних бактеріальних штамів. Серед цих пребіотичних агентів, бажаними для застосування є харчові волокна. 4 UA 114888 C2 5 10 15 20 25 30 35 40 45 50 55 60 Переважним чином, вказані пребіотичні волокна є вибраними з групи, що охоплює фруктоолігосахаріди (FOS), галактоолігосахариди (GOS), транс - галактоолігосахариди (TOS), ксило-олігосахариди (XOS), олігосахариди хітозану (COS), α-галактозиди (як-то рафіноза та стахіоза), пектини, гуми, частково гідролізовані гуми, інулін, псиліум (оболонки насіння подорожнику блошиного), акацію, ріжкове дерево, волокна вівса або бамбука, цитрусові волокна та, загалом, волокна, що містять розчинні та нерозчинні частки у змінному співвідношенні між собою. Переважно вказані пребіотичні волокна є вибраними з фруктоолігосахарідів (FOS), галактоолігосахаридів (GOS) та ксило-олігосахаридів (XOS). Ці волокна не вживаються дріжджами роду Candida, що також надає конкурентну перевагу бактеріальним штамам, присутнім у композиції заявленого винаходу. Переважно, пребіотичний компонент є присутнім у композиції у кількості до 70 % у ваговому співвідношенні, переважно ця кількість дорівнює 5-50 % у ваговому співвідношенні, ще переважніше 10-30 % у ваговому співвідношенні по відношенню до загальної ваги композиції. У переважному втіленні, композиція відповідно до винаходу може містити додаткові активні компоненти, наприклад, вітаміни, мінерали, рослинні екстракти або інші сполуки з синергетичною або доповнюючою дією, спрямованою на популяцію мікроорганізмів, присутніх у препаратах відповідно до винаходу. Переважним чином, вказані додаткові активні компоненти є присутніми у композиції у кількості до 70 % у ваговому співвідношенні, що переважно дорівнює 0,5-40 % у ваговому співвідношенні, більш переважніше 1-20 % у ваговому співвідношенні по відношенню до загальної ваги композиції. Комбінація технологічних наповнювачів для пресування та піноутворювання відповідно до заявленого винаходу надає порошкам таблеток адекватної згуртованості та сприяє досягненню бажаних кінетичних характеристик вивільнення активного компонента після його прийому. Змішування різних компонентів, звичайно наданих у вигляді порошку може бути здійснено шляхом додавання цих компонентів в будь-якому порядку з обережним додаванням культури мікроорганізмів, яка переважно знаходиться у вигляді ліофілізату у якості останнього інгредієнту для запобігання можливості виникнення механічних пошкоджень стінок бактеріальних клітин через надмірне перемішування, що може привести до порушень та зниження стійкості кінцевого продукту. Препарати, отримані у відповідності зі способом заявленого винаходу відрізняється відмінною плинністю, параметром, що сприяє рівномірному завантаженню матриць таблеток (тобто впливає на простір, призначений для розміщення певної кількості порошку) у пресувальних машинах. Вказані пресувальні машини звичайно мають пристрій для завантаження матриць таблеток (звичайно у вигляді бункеру для подачі порошкової суміші) та металевий диск відповідного радіусу для отримання матриць з потрібною товщиною; де вказані пристрої є присутніми у кількості, що може змінюватися в залежності від машини. Процес пресування порошку відбувається за допомогою одночасного та синергетичного руху двох рухливих частин цієї машини, що мають назву пуансонів. Під час етапу пресування, нижній пуансон визначає зі свого положення об'єм матриці (та, відповідно, кількість порошку, яку щоразу завантажують), тоді як верхній пуансон, що розташований поза матрицею під час завантаження її порошковою сумішшю та може бути зменшений протягом етапу пресування, вступає у контакт з порошком, який знаходиться у матриці, що завдяки прикладеному зусиллю веде до виникнення більш-або менш помітних механічних деформацій частинок, що знаходяться у складі порошку. Наприкінці етапу пресування, верхній пуансон піднімається та таким чином відходить від матриці, після чого піднімається також нижній пуансон, виштовхуючи з матриці новостворену таблетку. Вказані пресувальні машини додатково містять декілька приладів контролю головних робочих параметрів (положення нижнього пуансону на старті циклу пресування, найнижчого положення, якого може досягти верхній пуансон впродовж циклу пресування, швидкості обертання диску, у якому знаходяться матриці тощо). Також існують ще альтернативні та роторні пресувальні машини, що відрізняються кількістю загальних робочих режимів та, відповідно, кількістю таблеток, яку вони здатні виробляти протягом заданого часу. Отже, таблетки можна отримати за допомогою відомих у цей галузі машин та з застосуванням пуансонів різної форми, переважно круглих опуклих з подвійним радіусом та овальних. Застосовану протягом виробництва силу пресування обчислюють шляхом кількісного вимірювання сили, потрібної для руйнування таблеток (за допомогою твердоміру). Вказану силу вимірюють у кгс (кілограм-сила) (1 кгс = 9,807 ньютонів (N)). Шкідлива дія пресування на 5 UA 114888 C2 5 10 15 20 25 30 35 40 45 50 55 60 популяцію мікроорганізмів виникає, коли для пресування застосовують великі зусилля, наприклад, для отримання таблеток з твердістю 10-12 кгс, а також коли такі зусилля є малими, як-то, наприклад, у таблетках з твердістю 5-6 кгс. Шкідлива дія при застосуванні великих зусиль головним чином полягає у зменшенні кількості мікроорганізмів, тоді як застосування малих зусиль звичайно веде до крихкості отриманої таблетки. Сила пресування для отримання таблеток заявленого винаходу дорівнює 5-12 кгс в залежності від бажаного типу таблеток. У дослідженнях по виробництву таблеток, що містили L. paracasei LPC 00, L. acidphilus LA 02 та L. salivarius CRL 1328 (Таблиця 2), Заявник отримав дуже добрі результати відносно життєздатності та подальшої стабільності мікроорганізмів. Зокрема, відсоток загиблих бактерій при застосованому зусиллі, необхідному для отримання таблеток з твердістю, що дорівнювала 5-6 кгс знаходився у діапазоні 4-15 % та відсоток загиблих бактерій при застосованому зусиллі, необхідному для отримання таблеток з твердістю, що дорівнювала 10-12 кгс знаходився у діапазоні 10-25 %. Іншою перевагою способу відповідно до винаходу є можливість отримання таблеток з прийнятною згуртованістю навіть при низьких зусиллях пресування, наприклад, при отриманні таблеток з твердістю у 5-6 кгс. Таблетки, отримані у відповідності з заявленим винаходом були перевірені з метою обчислення часу їх розпаду відповідно до Європейської Фармакопеї (European Pharmacopoeia, Ed. X, ref. 2.9.1). Крихкість таблеток без покриття перевіряли відповідно до розділу 2.9.7 Європейської Фармакопеї та стійкість до руйнування - відповідно до розділу 2.9.8. У Таблиці 2 наведено приклад композиції відповідно до винаходу. У Таблиці 3 наведені дані, що відображають відсоток загиблих пробіотичних бактерій (композиція показана у Таблиці 2) відповідно до різних значень застосованого тиску та стійкості таблеток (що показано у вигляді часу напівжиття бактеріального навантаження) після їх двохрічного зберігання при 25 °C. Таблетки, отримані з препаратів відповідно до винаходу мали товщину біля 7,7 мм (для таблеток з високим ступенем твердості) та біля 8,4 мм (для таблеток з низьким ступенем твердості). У Таблиці 3 стійкість наведена у вигляді часу напівжиття пробіотичного компоненту препарату, тобто часу, що минає перед зменшенням у два рази початкової кількості життєздатних клітин. Потім також було виміряно: 9 (1) Кількість життєздатних клітин 1×10 КУО/г порошку, що очікується в нульовий момент часу. 9 (2) Кількість життєздатних клітин 1×10 КУО/г порошку, отримана в нульовий момент часу. (3) % загибелі клітин, спричиненої пресуванням. 9 (4) Кількість життєздатних клітин 1×10 КУО/ таблетку після двохрічного зберігання при 25 °C. (5) Час напівжиття у днях. Вищевказані дані були отримані шляхом оцінки кількості пробіотичних бактерій, присутніх у порошковій композиції та у композиції після пресування з застосуванням відомого фахівцям способу визначення кількості життєздатних мікроорганізмів шляхом посіву на чашках Петрі. У випадку порошкової композиції, кількість, що дорівнювала 1-4 грам зразка ресуспендували у прийнятному об'ємі стерильного рідкого середовища, звичайно 0,85 % сольового розчину хлориду натрію, до якого був доданий бактеріологічний пептон у співвідношенні 1 г/л. Після розчинення порошку з наступною гомогенізацією за допомогою відповідного пристрою з поршневим приводом, кількість клітин /мл була зменшена шляхом наступних десяти серійних базових розведень. На практиці, 1 мл з найбільш концентрованого розведення кожен раз переносили за допомогою стерильної піпетки до 9 мл розчинника. Цю процедуру проводили декілька разів, що достатньо для отримання потрібної кількості мікроорганізмів, присутніх на мл розчинника, яка дорівнювала 10-300, з наступним їх перенесенням на чашки Петрі та додаванням прийнятного агаризованого культурального середовища, де вони утворювали окремі, тобто прийнятні для підрахунку, колонії. У разі таблеток дотримувалися умов, що передбачають попереднє руйнування 3 – 5 таблеток та продовження аналізу для композиції порошку, як описано вище. Результати експериментів показали низькі показники загибелі мікроорганізмів у таблетках з високим ступенем твердості (приблизно 16,4 % від початкової популяції) та у таблетках з більш низьким ступенем твердості (приблизно 8,2 % від початкової популяції). Додатковим корисним аспектом композиції заявленого винаходу є покращена стійкість присутніх у неї пробіотичних мікроорганізмів (пробіотичного компоненту) протягом часу порівняно з типовими показниками стійкості препаратів обмежувальної частини Формули Винаходу. Ця перевага виникає завдяки 6 UA 114888 C2 5 10 15 20 25 30 35 40 45 50 55 60 застосуванню суміші, що містить мікрокристалічну целюлозу та арабіногалактан, переважно у ваговому співвідношенні 1:1-3:1. Ця суміш є здатною значно обмежити механічні пошкодження пробіотичних бактеріальних клітин на етапі пресування та дозволяє отримати таблетки без випадків відшаровування верхньої частини. Заявник також виявив, що показники часу напівжиття пробіотичного компоненту у порошковій композиції відповідно до винаходу та у таблетках різної твердості, отриманих з препарату відповідно до винаходу є схожими, що демонструє факт того, що застосовані технологічні компоненти здатні мінімізувати механічні пошкодження, спричинені етапом пресування. Переважним чином, таблетки відповідно до винаходу демонструють високий рівень життєздатності пробіотичних мікроорганізмів навіть після етапу пресування. Додатковим корисним аспектом також є здатність вивільнювати двоокис вуглецю при розчиненні таблетки, що веде до отримання особливо сприятливого до вагінальної колонізації застосованими пробіотиками анаеробного або мікроаерофільного середовища. Додатково, спінення здатне забезпечити адекватне та гомогенне розподілення пробіотичного активного інгредієнту у вагінальному середовищі шляхом підвищення ефективності колонізування. Завдяки тому, що компоненти, які утворюють склад композицій заявленого винаходу були вибрані та відібрані з метою зниження показників загибелі мікроорганізмів в результаті змішування та в результаті пресування без погіршення згуртованості порошку, композиції заявленого винаходу надають можливість отримати таблетки, що містять ефективні та стійкі протягом часу навіть не у прохолодних температурних умовах пробіотичні мікроорганізми. З цієї причини, композиція заявленого винаходу, що переважно знаходиться у формі таблеток є позбавленою адипінової чи аскорбінової кислоти, кількість присутньої солі карбонат- або бікарбонат- аніону у композиції є меншою, ніж 15 % за вагою по відношенню до загальної ваги композиції та замість кукурудзяного крохмалю у композиції винаходу застосовано суміш мікрокристалічної целюлози та арабіногалактану. Заявник досягнув цих результатів, починаючи з композиції, що проявила себе неадекватним чином (Таблиця 4). Композиція, наведена у Таблиці 4 показала 80,8 % випадків загибелі мікроорганізмів через перемішування, 40,5 % випадків загибелі мікроорганізмів через пресування та загальний результат випадків загибелі мікроорганізмів (перемішування + пресування) у 88,6 %. Композиція, наведена у Таблиці 4 показала помітний рівень загибелі мікроорганізмів вже у порошковому стані перед пресуванням. Значення рН розчинення (у сольовому розчині зі співвідношенням 1:10) не було проблемним та дорівнювало 5,22 для першого препарату та 5,53 для другого. Було виявлено, що адипінова кислота має токсичні властивості, але ця токсичність становила лише деяку частину спостереженої загибелі мікроорганізмів (біля 60 % від загальної кількості). Також було виявлено, що аскорбінова кислота має токсичні властивості, але ця токсичність лише додає додаткову відсоткову частину спостереженої загибелі мікроорганізмів. Усунення аскорбінової кислоти з композиції, що наведена у Таблиці 4 зменшує відсоток загибелімікроорганізмів з 73,8 до 26,7 %. Адипінова кислота сама по собі була у будь – якому разі токсичною (45.8 % при pH 4.24), однак, здається, її токсичність збільшувалася у присутності аскорбінової кислоти, отже, аскорбінова кислота проявила токсичні властивості синергічно з токсичністю адипінової кислоти. Однак, слід зазначити, що сумарна токсичність, викликана адипіновою та аскорбіновою кислотою не співпадає з загальним показником спостереженої загибелі мікроорганізмів. Отже, позосталий відсоток токсичності повинен бути спричинений якимось іншим компонентом (виключаючи вже розглянутий вплив pH) таким саме чином, як і токсичність, що була спричинена адипіновою та аскорбіновою кислотою. З цієї причини, Заявник дослідив наявність інших компонентів, здатних викликати токсичну дію з метою виявлення причин загальної токсичності, яку спостерігали у композиції, наведеній у Таблиці 4. Було встановлено, що осмотичний тиск, що виникає через присутність надмірної кількості бікарбонату також у певній мірі спричинює загибель мікроорганізмів, яка дорівнювала приблизно 20 % від загальної кількості. Отже, спостережена токсичність виникала через дію адипінової кислоти, аскорбінової кислоти та осмотичні ефекти, опосередковані бікарбонатом. Сам по собі бікарбонат не проявляв токсичних властивостей: він являв небезпеку тільки через викликання осмотичного ефекту. Отже, нова композиція (Таблиця 5) була отримана без адипінової та аскорбінової кислоти та з кількістю бікарбонат- аніону (наприклад, бікарбонату натрію), що була меншою, ніж 15 % за 7 UA 114888 C2 5 10 вагою по відношенню до загальної ваги композиції. Наприклад, 84 мг бікарбонату натрію становить 1 мМ та CO2, що вивільнюється, займає загальний об'єм у 25,4 мл при 37 °C та в умовах атмосферного тиску. Кількість лимонної кислоти була вибрана таким чином, щоб забезпечити повне вивільнення CO 2 з бікарбонату натрію при значеннях рН, що спостерігаються після розчинення таблетки. Однак, композиція, що наведена у Таблиці 5 мала проблеми на етапі пресування у процесі отримання таблеток. Порошок композиції, що наведена у Таблиці 5 показав погані когезивні властивості через застосування кукурудзяного крохмалю у препараті з низьким вологовмістом. Всі таблетки, отримані з пресувальної машини мали відшаровування верхньої частини навіть перед проходженням через знепилювач. Після цієї перевірки пресування, Заявник замінив кукурудзяний крохмаль на суміш, що містила мікрокристалічну целюлозу та арабіногалактан у ваговому співвідношенні, що переважно дорівнювало 1:1-3:1. 15 Таблиця 1 Вибраний штам Інвент. № Зберігається з Депозитор Lactobacillus CRL 1328 salivarius DSM 24441 04.01.2011 Probiotical SpA ліцензії від Cerela) Lactobacillus CRL 1289 paracasei DSM 24440 04.01.2011 Probiotical SpA (по ліцензії від Cerela) Lactobacillus gasseri CRL 1259 DSM 24512 25.01.2011 Probiotical SpA (по ліцензії від Cerela) Lactobacillus CRL 1251 crispatus DSM 2443 S 04.01.2011 Probiotical SpA (по ліцензії від Cerela) Lactobacillus CRL 1266 crispatus DSM 24439 04.01.2011 Probiotical SpA (по ліцензії від Cerela) Lactobacillus CRL 1294 acidophihts DSM 24513 25.01.2011 Probiotical SpA (по ліцензії від Cerela) Lactobacillus fennentum LF5 CNCM1-789 21.07.1988 Probiotical SpA Lactobacillus LF 10 ferntentum DSM 19187 20.03.2007 Probiotical SpA Lactobacillus LF09 ferntentum DSM 18298 24.05.2006 Probiotical SpA 8 (по UA 114888 C2 Продовження таблиці 1 Lactobacillus LF 11 fennentum DSM 19188 20.03.2007 Probiotical SpA Lactobacillus paracasei LPC 00 LMG P-21380 31.01.2002 Probiotical SpA Lactobacillus LP01 plantarum LMG P-21021 16.10.2001 Laboratorio Microbiologico Grana Provolone SRL Lactobaciihis LP02 plantarum LMG P-21020 16.10.2001 Laboratorio Microbiologico Grana Provolone SRL Lactobaciihis LPS01 pentosus DSM 21980 14.11.2008 Probiotical SpA Lactobaciihis LA 02 aeidophilus DSM 21717 06.08.2008 Probiotical SpA Lactobaciihis LR04 rhamnosus DSM 16605 20.07.2004 Probiotical SpA Lactobaciihis LR05 rhamnosus DSM 19739 27.09.2007 Probiotical SpA Lactobaciihis LR06 rhamnosus DSM 21981 14.11.2008 Probiotical SpA Lactobaciihis LPC08 paracasei DSM 21718 06.08.2008 Probiotical SpA DSM 22106 10.12.2008 Lactobaciihis delbrtteckii LDD 01 (MB 386) Probiotical Jones srl) SpA (Steve Lactobaciihis reuteri DSM 17938 Lactobaciihis 01 Lactobaciihis 02 Lactobaciihis 03 Lactobaciihis 04 Lactobaciihis LS03 Lactobaciihis PR ci reuteri LRE DSM 23877 05.08.2010 Probiotical SpA reuteri LRE DSM 23878 05.08.2010 Probiotical SpA reuteri LRE DSM 23S79 05.08.2010 Probiotical SpA reuteri LRE DSM 2 3880 05.08.2010 Probiotical SpA salivarias DSM 22776 23.07.2009 Probiotical SpA plantarum LMG P-21022 16.10.2001 Laboratorio Microbiologico Grana Provolone SRL Lactobaciihis 776/2 hi plantarum LMG P-21023 16.10.2001 Laboratorio Microbiologico Provolone SRL Lactobaciihis pentosus 9/1 ei BioGaia LMG P-21019 16.10.2001 9 Grana Laboratorio Microbiologico Grana Provolone SRL UA 114888 C2 Таблиця 2 Композиція Кількість (мг/таблетку) Бактеріальні штами: L. paracasei LPC 00, L. acidphilus LA 02 та L. 9 salivarius CRL 1328 з концентрацією у межах 20-100×10 КУО/г фруктоолігосахариди (FOS) арабіногалактан мікрокристалічна целюлоза безводний дикальций-фосфат суміш гліцеридів лимонна кислота натрію бікарбонат нерозчинні харчові волокна пальмітат цукрози діоксид кремнію стеарат магнію загальна кількість (мг/1 таблетку) 58 327 250 270 95 65 64 56 43 26 26 20 1,300 Таблиця 3 Препарат за Таблицею 2 порошок вага таблетки / низький рівень твердості (5 – 6 кгс) вага таблетки / високий рівень твердості (10 – 12 кгс) (1) 5,9 / (2) 6,1 5,6 (3) / 8,2 (4) 1,3 1,2 (5) 327 328 / 5,1 16,4 1 292 5 Таблиця 4 Неприйнятна (неадекватна) композиція Композиція Кількість (мг/таблетку) Бактеріальні штами: (L paracasei LPC 00, L. acidophilus LA 02, L paracasei CRL 1289 9 з концентрацією у межах 20-100×10 КУО / г кукурудзяний крохмаль адипінова кислота натрію бікарбонат аскорбінова кислота стеарат магнію безводна лактоза стеаринова кислота діоксид кремнію загальна кількість (мг/1 таблетку) 291 10 335 268 210 100 42 34 12 8 1,300 UA 114888 C2 Таблиця 5 Композиція (1,300 мг) Компоненти Кількість (мг/таблетку) Бактеріальні штами: (L. paracasei LPC 00, L. acidophilus LA 02, L 9 paracasei CRL 1328 з концентрацією 20-10 / г) арабіногалактин галактоолігосахариди (GOS) кукурудзяний крохмаль нерозчинні харчові волокна лимонна кислота стеарат магнію 199 300 315 315 43 38 34 натрію бікарбонат діоксид кремнію стеаринова кислота загальна кількість (мг/1 таблетку) 28 18 10 1,300 ФОРМУЛА ВИНАХОДУ 5 10 15 20 25 30 35 1. Шипуча композиція у твердій формі, що містить: - кислотно-основну систему, до якої входить органічна кислота та сіль карбонат- та/або бікарбонат-аніону, де вказана сіль є присутньою у кількості, що дорівнює 1-15 % за вагою відносно загальної ваги композиції, де органічна кислота є вибраною з групи, що охоплює лимонну кислоту, яблучну кислоту, винну кислоту, фумарову кислоту, молочну кислоту та їх суміші, - суміш, що містить мікрокристалічну целюлозу та арабіногалактан; - принаймні один пробіотичний бактеріальний штам, що має здатність до зменшення та/або до усунення присутності патогенних агентів, вибраних з групи, що охоплює Candida albicans, Candida glabrata, Candida parapsilosis, Candida krusei, Candida tropicalis, Gardnerella vaginalis, Trichomonas vaginalis, Neisseria gonorrhoeae, Escherichia coli, Herpes simplex та Haemophilus ducreyi, де вказаний штам належить до принаймні одного виду, вибраного з групи, що охоплює Lactobacillus plantarum, Lactobacillus pentosus, Lactobacillus casei, Lactobacillus casei ssp. paracasei, Lactobacillus rhamnosus, Lactobacillus acidophilus, Lactobacillus delbrueckii, Lactobacillus delbrueckii ssp. bulgaricus, Lactobacillus delbrueckii ssp. delbrueckii, Lactobacillus fermentum, Lactobacillus gasseri, Lactobacillus reuteri, Bifidobacterium longum, Bifidobacterium bifidum, Bifidobacterium breve, Bifidobacterium animalis ssp. lactis, Bifidobacterium adolescentis, Bifidobacterium pseudocatenulatum, Bifidobacterium catenulatum або Bifidobacterium infantis; вказана композиція призначена для застосування у вагінальних аплікаціях для лікування вагінальних інфекцій. 2. Композиція для застосування за п. 1, яка знаходиться у вигляді таблеток, супозиторіїв, пастилок або гранул. 3. Композиція для застосування за п. 1 або 2, де органічна кислота є лимонною кислотою. 4. Композиція для застосування за будь-яким одним з пп. 1-3, в якій сіль карбонат- та/або бікарбонат-аніону є вибраною з групи, що охоплює карбонат натрію, карбонат калію, карбонат кальцію, карбонат магнію, натрієвий карбонат гліцину, бікарбонат натрію, бікарбонат калію, бікарбонат кальцію, бікарбонат магнію, лактат натрію, лактат калію, карбонату лактат та їх суміші. 5. Композиція для застосування за п. 4, де сіль є сіллю бікарбонат-аніону. 6. Композиція для застосування за п. 5, в якій сіль карбонат- та/або бікарбонат-аніону є присутньою у кількості, що дорівнює 3-13 % за вагою відносно загальної ваги композиції; переважно у кількості, що дорівнює 4-12 % за вагою відносно загальної ваги композиції; більш переважніше у кількості, що дорівнює 5-10 % за вагою відносно загальної ваги композиції. 11 UA 114888 C2 5 10 15 20 25 30 7. Композиція для застосування за будь-яким одним з пп. 1-6, в якій кислотно-основна система складається з бікарбонату натрію та лимонної кислоти та де бікарбонат натрію є присутнім у кількості, що дорівнює 3-13 % за вагою відносно загальної ваги композиції; переважно у кількості, що дорівнює 4-12 % за вагою відносно загальної ваги композиції; більш переважно, у кількості, що дорівнює 5-10 % за вагою відносно загальної ваги композиції. 8. Композиція для застосування за п. 1, в якій вказана мікрокристалічна целюлоза та арабіногалактан є присутніми у співвідношенні, що дорівнює 1:1-3:1 за вагою. 9. Композиція для застосування за будь-яким одним з пп. 1-8, в якій вказаний принаймні один пробіотичний бактеріальний штам є переважно вибраним з наступного: Lactobacillus salivarius CRL 1328 (депозитарний № DSM 24441, зберігається з 04.01.2011), Lactobacillus paracasei CRL 1289 (депозитарний № DSM 24440, зберігається з 04.01.2011, Lactobacillus gasseri CRL 1259 (депозитарний № DSM 24512, зберігається з 25.01.2011), Lactobacillus crispatus CRL 1251 (депозитарний № DSM 24438, зберігається з 04.01.2011), Lactobacillus crispatus CRL 1266 (депозитарний № DSM 24439, зберігається з 04.01.2011), Lactobacillus acidophilus CRL 1294 (депозитарний № DSM 24513, зберігається з 25.01.2011), Lactobacillus paracasei LPC 00 (депозитарний № LMG P-21380, зберігається з 31.01.2002), Lactobacillus plantarum LP 02 (депозитарний № LMG P-21020, зберігається з 16.10.2001) є Lactobacillus fermentum LF 10 (депозитарний № DSM 19187, зберігається з 20.03.2007). 10. Композиція для застосування за будь-яким одним з пп. 1-9, яка призначена для лікування вагініту, вагінозу, кандидозу, гонореї, герпесу та м'якого шанкру. 11. Шипуча таблетка у твердій формі, що містить: - кислотно-основну систему, що містить бікарбонат натрію та лимонну кислоту; вказаний бікарбонат є присутнім у кількості, що дорівнює 1-15 % за вагою відносно загальної ваги композиції; - суміш, що містить мікрокристалічну целюлозу та арабіногалактан у співвідношенні, що дорівнює 1:1-3:1 за вагою; - принаймні один пробіотичний бактеріальний штам, що має здатність до зменшення та/або до усунення присутності патогенних агентів, вибраних з групи, що охоплює: Candida albicans, Candida glabrata, Candida parapsilosis, Candida krusei, Candida tropicalis, Gardnerella vaginalis, Trichomonas vaginalis, Neisseria gonorrhoeae, Escherichia coli, Herpes simplex та Haemophilus ducreyi, вказана композиція призначена для застосування у вагінальних аплікаціях для лікування вагінальних інфекцій. Комп’ютерна верстка О. Гергіль Міністерство економічного розвитку і торгівлі України, вул. М. Грушевського, 12/2, м. Київ, 01008, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 12
ДивитисяДодаткова інформація
Назва патенту англійськоюEffervescent composition in solid form for use in vaginal applications for the treatment of vaginal infections
Автори англійськоюMogna, Giovanni, Strozzi, Gian, Paolo, Mogna, Luca
Автори російськоюМоня Джованни, Строцци Джан Паоло, Моня Лука
МПК / Мітки
МПК: A61K 31/164, A61K 31/717, A61K 35/74, A61K 9/02, A61K 9/20, A61K 9/46, A61K 33/10
Мітки: форми, лікування, твердий, композиція, інфекцій, аплікаціях, шипуча, використання, вагінальних
Код посилання
<a href="https://ua.patents.su/14-114888-shipucha-kompoziciya-u-tverdijj-formi-dlya-vikoristannya-u-vaginalnikh-aplikaciyakh-dlya-likuvannya-vaginalnikh-infekcijj.html" target="_blank" rel="follow" title="База патентів України">Шипуча композиція у твердій формі для використання у вагінальних аплікаціях для лікування вагінальних інфекцій</a>
Попередній патент: Тверді лікарські форми з контрольованим вивільненням
Наступний патент: Пробка для закривання коробчастих корпусів
Випадковий патент: Вібратор для диспергування водно-паливних емульсій в двигунах внутрішнього згоряння