Композиція з модифікованим характером вивільнення з оболонки для перорального уведення та спосіб для лікування запальних кишкових захворювань
Формула / Реферат
1. Перорально вводимая композиция с модифицированным характером высвобождения из оболочки, предназначенная для лечения воспалительных кишечных заболеваний, обладающая способностью обеспечивать биологическое присутствие 5-аминосалициловой кислоты (5-АСК) как в тонкой, так и в толстой кишке, и состоящая из гранул с индивидуальными оболочками, отличающаяся тем, что каждая гранула включает ядро, содержащее 5-аминосалициловую кислоту (5-АСК) или ее фармацевтически приемлемую соль или эфир и физиологически приемлемую сферонизирующую добавку, предпочтительно производное целлюлозы, в частности, микрокристаллическую целлюлозу, и оболочку, заключающую в себе указанное ядро, причем указанная оболочка содержит материал, являющийся барьером, ограничивающим скорость, предпочтительно полупроницаемый полимер, в частности, этилцеллюлозу, а большинство гранул, предпочтительно выше 80 %, более предпочтительно выше 90 %, имеет в основном сферическую форму, оцениваемую по параметру aspect ratio (определяемому как отношение длины к ширине) как 1,00-1,25, предпочтительно 1,00-1,20, более предпочтительно 1,00-1,15, и большинство гранул, предпочтительно выше 70 %, более предпочтительно выше 90 %, имеет по данным гранулометрического анализа размеры в интервале более 0,5 мм и менее 1,4 мм, предпочтительно в интервале более 0,7 мм и менее 1,1 мм, и композиция обеспечивает скорости растворения in vitro (при измерениях в модельной системе, использующей имитатор кишечной жидкости в системе USP Paddle System 2 и работающей при 37°С со скоростью перемешивания 100 об./мин.), в пределах 2-20 %, предпочтительно 5-15 %, общего количества 5-АСК, высвобожденного после 15 минут пребывания в модельной системе, 20-50 %, предпочтительно 25-45 %, общего количества 5-АСК, высвобожденного после 60 минут пребывания в модельной системе, 30-70 %, предпочтительно 40-60 %, общего количества 5-АСК, высвобожденного после 90 минут пребывания в модельной системе, 50-90 %, предпочтительно 55-80 %, общего количества 5-АСК, высвобожденного после 150 минут пребывания в модельной системе, 75-100 % общего количества 5-АСК, высвобожденного после 240 минут пребывания в модельной системе.
2. Композиция по п. 1, отличающаяся тем, что при условии, что опорожнение желудка соответствует норме, 50 % гранул обладают способностью оставить желудок в течение 60 минут, предпочтительно в течение 30 минут, после приема композиции.
3. Композиция по п. 1, отличающаяся тем, что при условии, что время прохождения тонкой кишки соответствует норме, 50 % гранул присутствует в тонкой кишке в течение 3-6 часов после приема композиции.
4. Композиция по п. 1, отличающаяся тем, что при условии, что время прохождения толстой кишки соответствует норме, 50 % гранул присутствует в толстой кишке в течение 12-50 часов после приема композиции.
5. Композиция по п. 1, в которой содержание по весу 5-АСК от общего веса указанной гранулы лежит в интервале от 30-90 %, предпочтительно от 40-80 %, более предпочтительно от 50-60 %.
6. Композиция по п. 1, отличающаяся тем, что 5-АСК находится в дозированной форме и содержание 5-АСК достаточно для введения от 250 мг до 12 г, предпочтительно от 500 мг до 6 г, более предпочтительно от 500 мг до 4 г, предпочтительно - в дозированных формах, каждая из которых содержит 500 мг, 1 г, 2 г, 5 г или 6 г.
7. Композиция по п. 1, отличающаяся тем, что 5-АСК в лекарственных формах содержится в запечатанных упаковках, предназначенных для вскрытия непосредственно перед применением, например в пакетах-саше или "карандашах".
8. Композиция по п. 1, отличающаяся тем, что воспалительным кишечным заболеванием является болезнь Крона, язвенный колит, не поддающаяся классификации форма указанных болезней или диагностируемый подвид указанной болезни.
9. Способ лечения воспалительных кишечных заболеваний (ВКЗ), в частности болезни Крона, язвенного колита, не поддающейся классификации формы указанных болезней или диагностированного подвида указанной болезни, включающий введение лекарственного средства, отличающийся тем, что в качестве лекарственного средства вводят средство, состоящее из гранул с индивидуальными оболочками, причем каждая гранула включает ядро, содержащее 5-аминосалициловую кислоту (5-АСК) или ее фармацевтически приемлемую соль или эфир и физиологически приемлемую сферонизирующую добавку, предпочтительно производное целлюлозы, в частности микрокристаллическую целлюлозу, и оболочку, заключающую в себе указанное ядро, причем указанная оболочка содержит материал, являющийся барьером, ограничивающим скорость, предпочтительно полупроницаемый полимер, в частности этилцеллюлозу, и большинство гранул, предпочтительно выше 80 %, более предпочтительно выше 90 %, имеет в основном сферическую форму, оцениваемую по параметру aspect ratio (определяемому как отношение длины к ширине) как 1,00-1,25, предпочтительно 1,00-1,20, более предпочтительно 1,00-1,15, и большинство гранул, предпочтительно выше 70 %, более предпочтительно выше 90 %, имеет по данным гранулометрического анализа размеры в интервале более 0,5 мм и менее 1,4 мм, предпочтительно в интервале более 0,7 мм и менее 1,1 мм, и композиция обеспечивает скорости растворения in vitro (при измерениях в модельной системе, использующей имитатор кишечной жидкости в системе USP Paddle System 2 и работающей при 37°С со скоростью перемешивания 100 об./мин.), равные 2-20 %, предпочтительно 5-15 %, общего количества 5-АСК, высвобожденного после 15 минут пребывания в модельной системе, 20-50 %, предпочтительно 25-45 %, общего количества 5-АСК, высвобожденного после 60 минут пребывания в модельной системе, 30-70 %, предпочтительно 40-60 %, общего количества 5-АСК, высвобожденного после 90 минут пребывания в модельной системе, 50-90 %, предпочтительно 55-80 %, общего количества 5-АСК, высвобожденного после 150 минут пребывания в модельной системе, 75-100 % общего количества 5-АСК, высвобожденного после 240 минут пребывания в модельной системе.
Текст
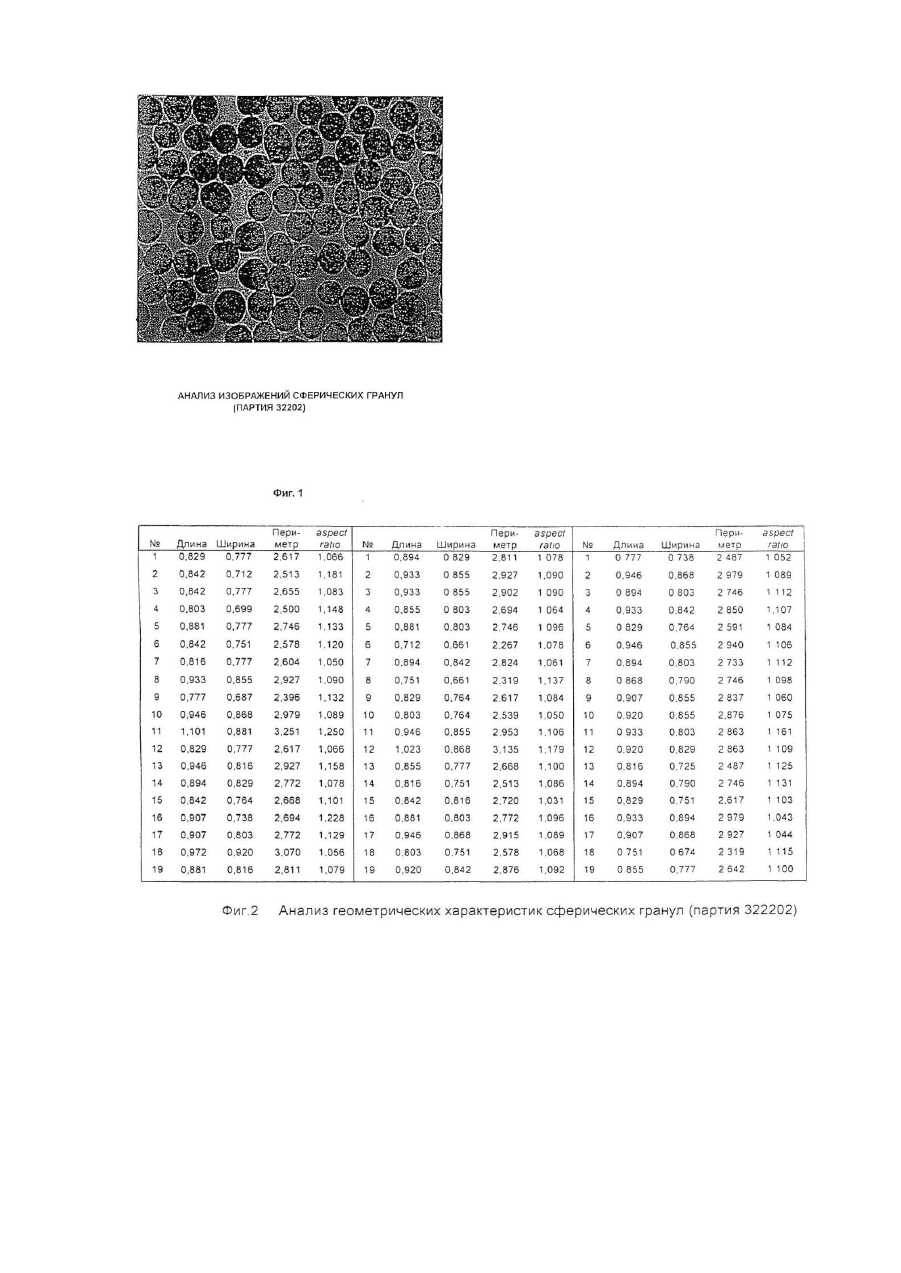
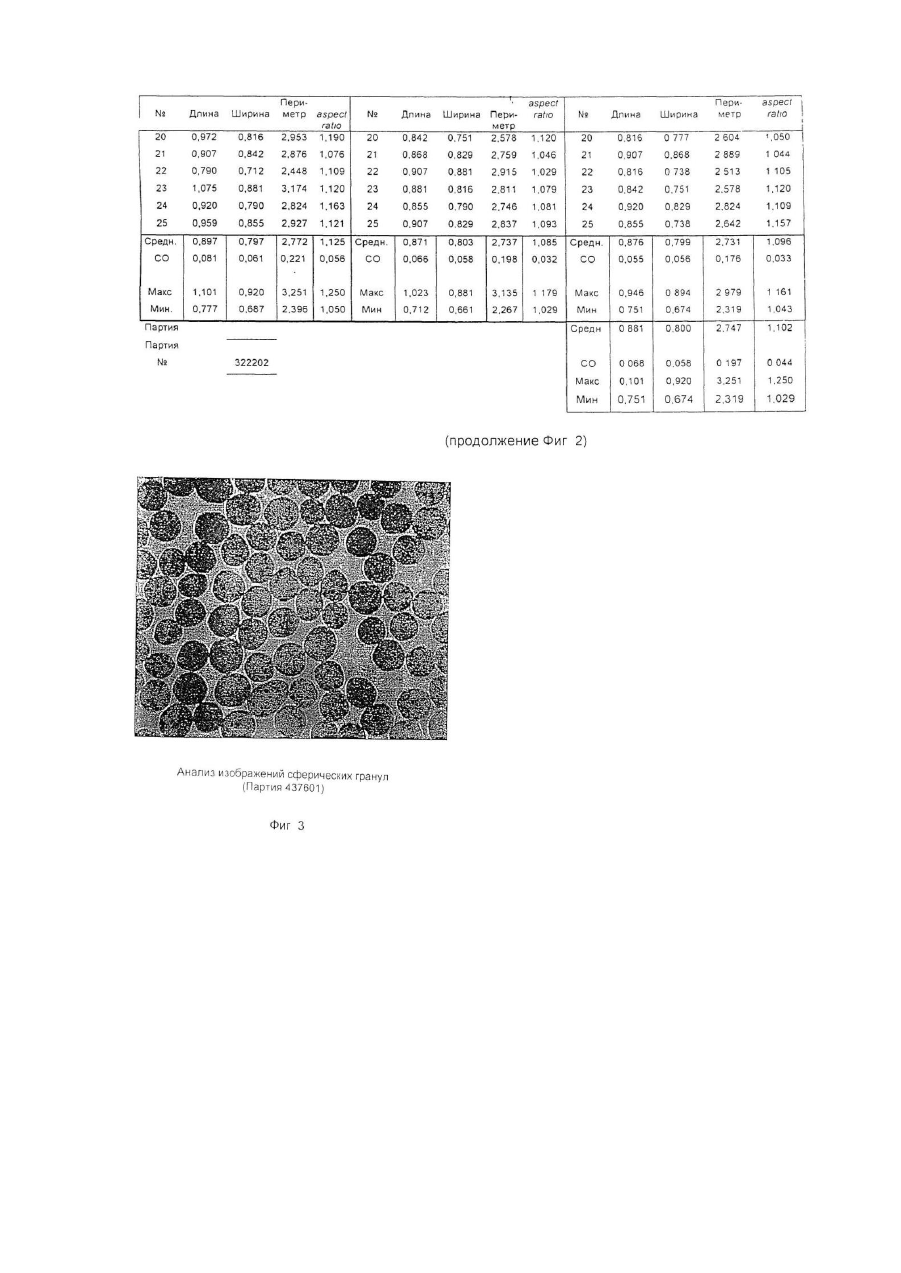
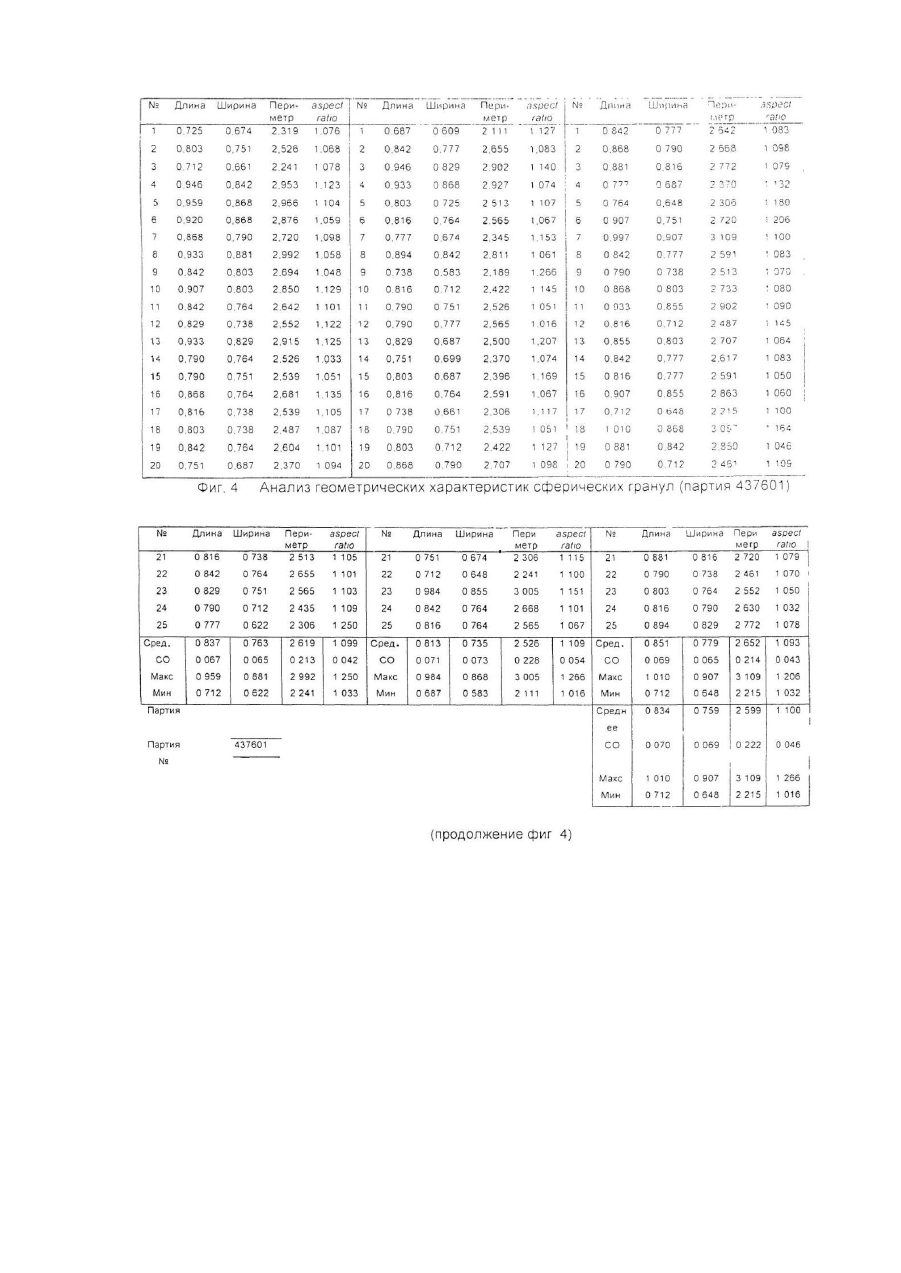
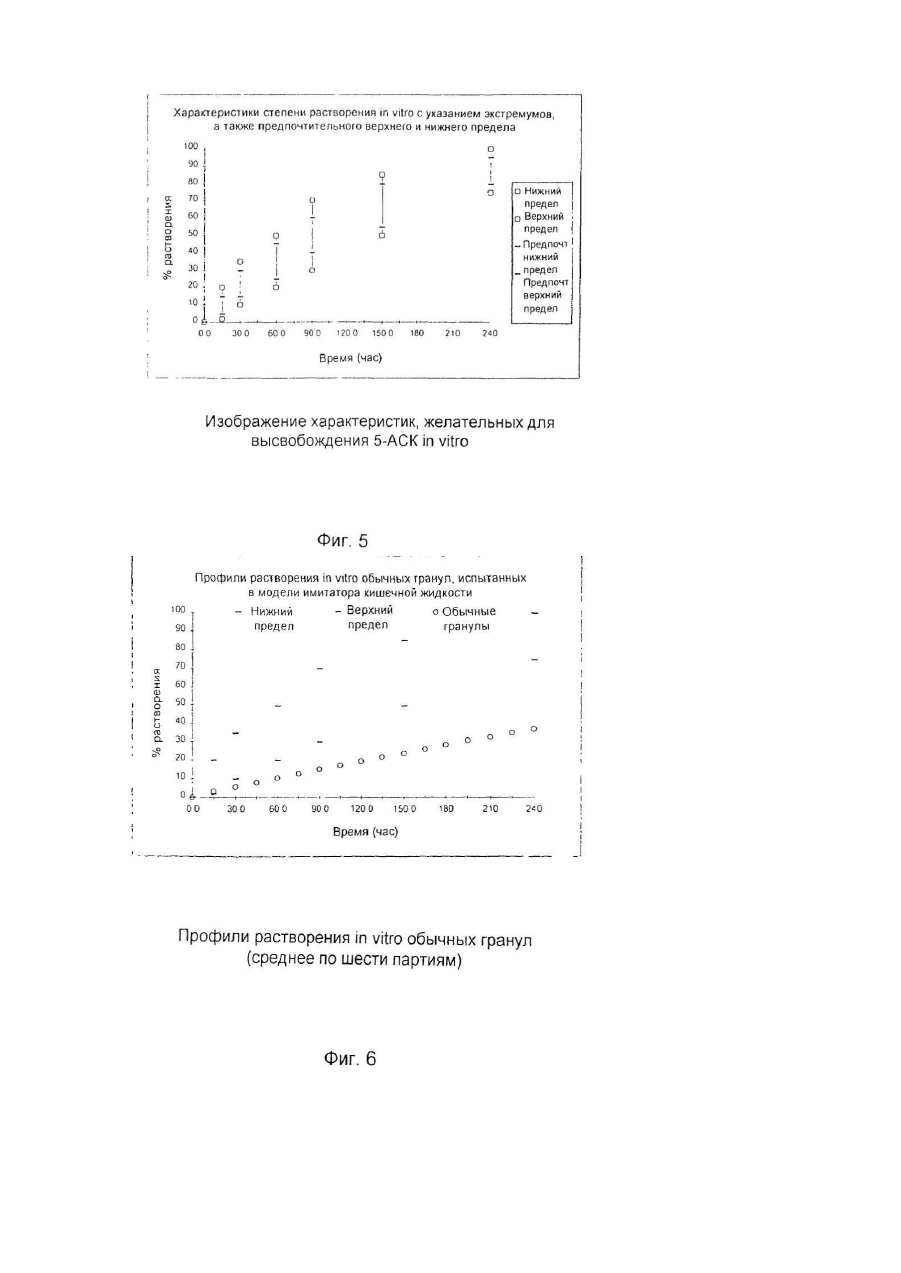
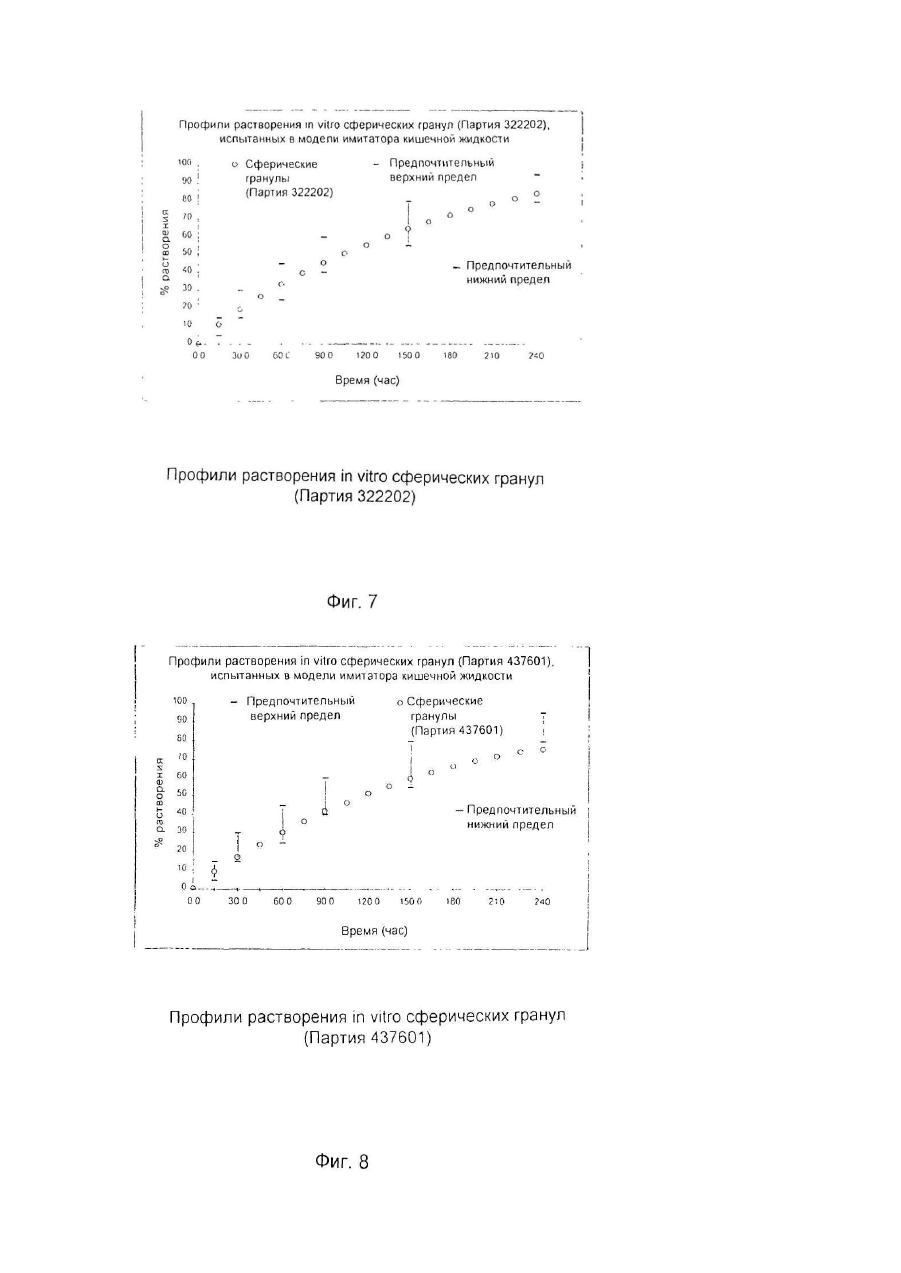
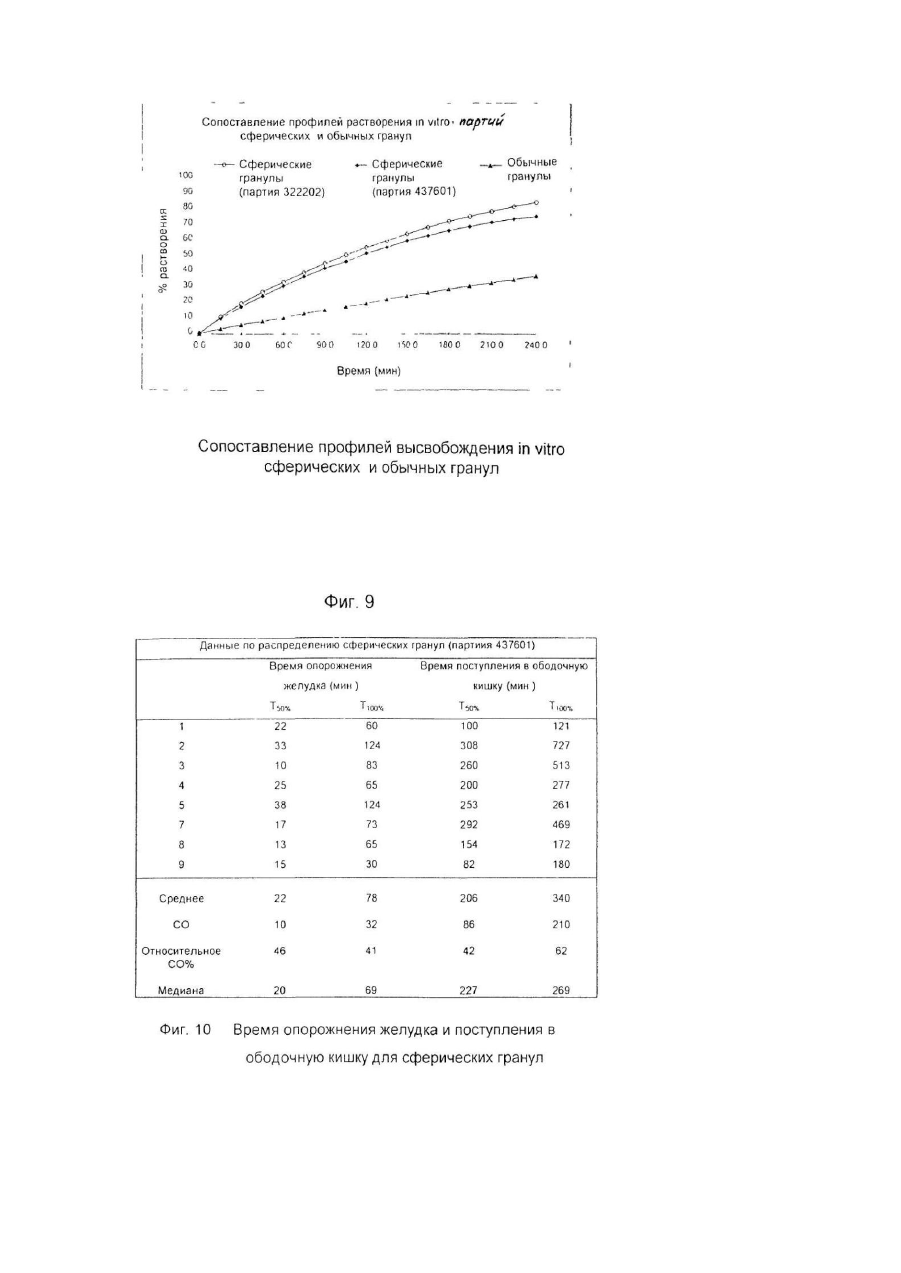
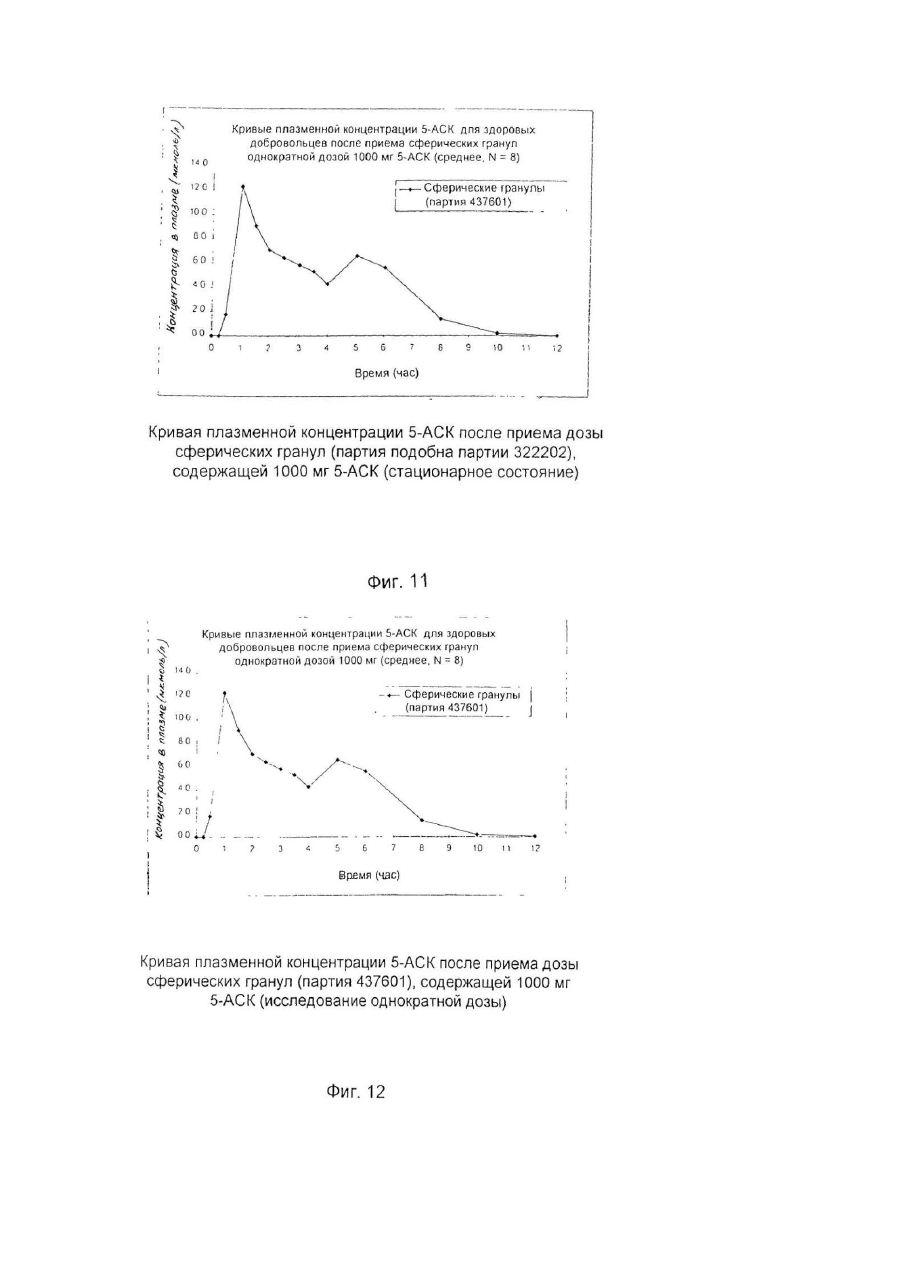
Настоящее изобретение относится к улучшенной перорально вводимой фармацевтической композиции для лечения воспалительных кишечных заболеваний (ВКЗ) типа болезни Крона, язвенного колита и других болезней подобного рода, например, не поддающейся классификации формы указанных болезней или диагностированного подвида одной из указанных болезней. Изобретение относится также к способу лечения ВКЗ. Композиция согласно настоящему изобретению содержит в качестве активного ингредиента 5аминосалициловую кислоту (5-АСК) или ее фармацевтически приемлемые соли или эфиры и адаптирована для модифицированного и направленного высвобождения указанной 5-АСК из оболочки в пораженных участках кишечника с целью получения имеющего преимущества и клинически важного высвобождения из оболочки и эффективного профиля (распределения) 5-АСК. Таким образом, указанная форма введения и высвобождения является улучшенной по сравнению с известными терапевтическими лечебными схемами. Уровень техники Композиция согласно изобретению представляет собой гранулы с индивидуальной оболочкой, адаптированные для перорального введения, как такового, т.е. композиция, в общем, является "гранулятной" композицией, готовой к использованию. Гранулированная композиция согласно изобретению является формой введения, имеющей преимущества во многих клинических ситуациях, например, для пациента, имеющего проблемы с заглатыванием, или для детей, не желающих заглатывать таблетки. К дополнительным преимуществам относится то обстоятельство, что гранулы изобретения могут быть расфасованы в однократные лекарственные формы (дозы на один прием), с более высокими количествами активной 5-АСК, например, в пакеты-саше или "карандаши". В принципе, в отличие от максимального содержания таблеток и капсул, для количества активного ингредиента в однократной лекарственной форме композиции согласно изобретению верхнего предела не существуе т. Таким образом, преимуществом гранулированной композиции согласно настоящему изобретению является ее способность улучшать такой клинически важный параметр лечения хронических заболеваний, как значения активности терапевтической лечебной схемы. В целом следует отметить, что вопрос удовлетворительной активности особенно важен в случае ВКЗ, т.к. из-за невозможности отвечать требованиям медицинского лечения во многих случаях необходимо хирургическое вмешательство, причем стандартная хирургическая операция при лечении язвенного колита во многих случаях имеет характер общей проктоколэктомии (удаления ободочной кишки и прямой кишки). Патенты США №№ 4496553 и 4980173 описывают способ лечения ВКЗ путем перорального введения композиций 5-АСК, содержащих, в основном, свободную 5-АСК и носители, регулирующие в итоге высвобождение эффективного количества 5-АСК. Однако, в отличие от заявляемого изобретения, введение гранул 5-АСК как таковых не было раскрыто и все композиции, описанные для клинического применения, имели форму таблеток. Содержание указанных патентов США, включая примеры, полностью игнорирует вопрос об использовании специфического типа гранулированной композиции для прямого перорального приема. В описаниях к указанным патентам нигде не предполагается создание или введение гранулированной композиции. Так, в примерах к указанным выше патентам США, приготовленные гранулы спрессовывались до формирования таблеток диаметром 13,5мм и весом 650мг/таблетка, содержащих 250мг 5-АСК. Полученные таблетки использовали в клинических испытаниях. В примерах к патентам США описаны промежуточные приготовления двух гранулятов, один из которых содержит 5-АСК, а другой является "вспомогательным" гранулятом без 5-АСК, причем указанный "вспомогательный" гранулят, включавший тальк и смазывающую смесь, приготавливался и добавлялся для облегчения прессования таблеток. Патент США №4980173 более конкретно формулирует способ приготовления таблеток с пролонгированным действием, полезных для лечения язвенного колита или болезни Крона, включающий следующие стадии: а) приготовление первого гранулята из 5-АСК или ее фармакологически приемлемой соли или эфира и из примерно 10% по весу (содержание твердой фазы, соотносящееся с 5-АСК) поливинилпирролидона в органическом растворителе, обеспечивающее после испарения растворителя получение гранул с размером частиц от примерно 0,7 до 1мм; б) нанесение на указанные гранулы оболочечной композиции, содержащей растворенный в органическом растворителе фармацевтически приемлемый материал оболочки, который будет постепенно высвобождать активный ингредиент после доставки в тонкую кишку с тем, чтобы после испарения растворителя получить заключенные в оболочку гранулы; в) смешивание первого гранулята со смазывающим веществом (примерно 5% по весу, рассчитанному для общего содержания твердой фазы) и с обычным фармацевтическим наполнителем таблеток в количестве, соответствующем требуемому размеру таблетки и содержанию в ней активного ингредиента, и г) формирование таблеток из полученной в результате смеси. Предпочтительным материалом оболочки является производное целлюлозы. Международная заявка WO 94/28911 описывает в общем виде перорально вводимые фармацевтические композиции, обладающие эффектом регулирования рН, в частности, для увеличения субнормального рН в кишечнике, и содержащие заключенный в оболочку щелочной материал, регулирующий рН, предпочтительно карбонат кальция. Композиция может быть приготовлена как оболочечные грануляты или таблетки для кишечника. Композиция может, далее, содержать терапевтически активный ингредиент, например, 5-АСК. Такие композиции могут быть приготовлены как комбинированные грануляты, в которых 5-АСК заключена в оболочку, как это описано выше со ссылкой к патенту США № 4496553, или как комбинированные таблетки. Специфические требования к свойствам высвобождения 5-АСК для гранулированной композиции в том виде, как она идентифицирована изобретателями заявляемого изобретения и определена в настоящей заявке, не были описаны и предположены в указанных патентах США и в заявке WO 94/28911. Более того, не были описаны и предложены указания или какие-либо намеки на то, как создать специфические варианты осуществления изобретения, решающие указанные проблемы и, таким образом, обеспечивающие преимущества в непредсказуемом направлении. Сущность изобретения Было обнаружено, что согласно настоящему изобретению особые геометрические формы каждой гранулы в сочетании с выбором и подмешиванием особых типов вспомогательных ингредиентов обеспечивают получение гранул, обладающих клинически важным эффектом желудочно-кишечного высвобождения 5-АСК, обладающего особыми преимуществами. Неожиданно обнаружилось, что гранулированная композиция согласно настоящему изобретению обеспечивает благоприятный профиль высвобождения, гарантирующий клинически важное биологическое присутствие. Такое полезное биологическое присутствие достигается благодаря следующим характеристикам: в желудке происходит только несущественное высвобождение 5-АСК, в то время как в тонкой кишке и в толстой кишке за соответствующий период времени оказывается значительное количество 5-АСК. Таким образом, в одном из своих главных аспектов изобретение обеспечивает композицию для перорального введения, причем указанная композиция представляет собой перорально вводимую композицию с модифицированным характером высвобождения, гарантирующую биологическое присутствие указанной 5-АСК как в тонкой, так и в толстой кишке, и содержащую гранулы с индивидуальными оболочками, причем каждая гранула содержит - ядро, содержащее 5-аминосалициловую кислоту (5-АСК) (или ее соль или эфир) и физиологически приемлемый первый вспомогательный ингредиент, предпочтительно производное целлюлозы, в частности, микрокристаллическую целлюлозу, и - оболочку, заключающую в себе указанное ядро, причем указанная оболочка содержит второй вспомогательный ингредиент, предпочтительно полупроницаемый полимер, в частности, этилцеллюлозу; причем большинство гранул, предпочтительно свыше 80%, более предпочтительно свыше 90%, имеют по существу сферическую форму, оцениваемую по параметру aspect ratio как 1,00-1,25, предпочтительно 1,001,20, более предпочтительно 1,00-1,15; большинство гранул композиции, предпочтительно свыше 70%, более предпочтительно свыше 90%, имеют по данным гранулометрического анализа размеры в интервале 0,5мм-2,0мм, предпочтительно в интервале 0,7мм-1,1мм; композиция обеспечивает следующие скорости растворения in vitro (измеренные для модельной системы, использующей имитатор кишечной жидкости в системе USP Paddle System 2, и действующей при 37°С со скоростью перемешивания 100об./мин.): а) 2-20%, предпочтительно 5-15%, общего количества 5-АСК высвобождается в модельной системе через 15 минут; б) 20-50%, предпочтительно 25-45%, общего количества 5-АСК высвобождается в модельной системе через 60 минут; в) 30-70%, предпочтительно 40-60%, общего количества 5-АСК высвобождается в модельной системе через 90 минут; г) 50-90%, предпочтительно 55-80%, общего количества 5-АСК высвобождается в модельной системе через 150 минут; д) 75-100% общего количества 5-АСК высвобождается в модельной системе через 240 минут. В данном описании термин "5-АСК" используется также в более широком смысле для обозначения фармацевтически приемлемых солей и эфиров указанной кислоты. Солями 5-АСК могут быть соли, образованные за счет ассоциации с кислотами, в частности, с соляной кислотой, но может быть использована любая фармацевтически приемлемая, нетоксичная органическая или неорганическая кислота. Могут быть использованы также соли, образованные карбоксильной группой кислоты. В качестве примера можно указать соли щелочных металлов (К, Na), соли щелочноземельных металлов (Са, Мg), но, опять-таки, может быть использована любая фармацевтически приемлемая, нетоксичная соль. Предпочтительны соли Na и Са. Пригодными для применения эфирами являются, например, C1-C18 алкиловые эфиры с прямой и разветвленной цепью, например, метиловый, этиловый, пропиловый, изопропиловый, бутиловый, изобутиловый, амиловый, гексиловый, гептиловый, октиловый, нониловый, дециловый, лауриловый, миристиловый, цетиловый, стеариловый и т.д.; C2-C18 алкениловые эфиры с прямой и разветвленной цепью, например, виниловый, аллиловый, ундецениловый, олеиловый, линолениловый и т.д.; С3-C8 циклоалкиловые эфиры, например, циклопропиловый, циклобутиловый, циклопентиловый, циклогексиловый, циклогептиловый, циклооктиловый и т.д.; ариловые эфиры, например, фениловый, толуиловый, ксилиловый, нафтиловый и т.д.; эпициклические эфиры, например, ментиловый и т.д., или аралкиловые эфиры, например, бензиловый, фенетиловый и т.д. Настоящее изобретение относится к перорально вводимой композиции в форме гранул, предназначенных для прямого перорального введения, т.е. гранул, удовлетворяющих фармацевтическим требованиям без формирования их, например, в виде таблеток или, например, без капсулирования. Специфические проблемы, которые было необходимо разрешить, заключались прежде всего в том, что индивидуальные гранулы должны обладать способностью относительно быстро проходить через желудок без сколько-нибудь заметного растворения 5-АСК и, далее, доля 5-АСК должна распределяться как в тонкой, так и в толстой кишке, и находиться там в течение времени, достаточного для проявления локализованного эффекта. Согласно настоящему изобретению предлагается перорально вводимая композиция с модифицированным характером высвобождения для лечения воспалительных кишечных заболеваний, причем указанная композиция обеспечивает проявление биологическое ценности 5-аминосалициловой кислоты (5-АСК) как в тонкой, так и в толстой кишке, и содержит гранулы с индивидуальными оболочками, причем каждая гранула содержит: - ядро, содержащее 5-аминосалициловую кислоту (5-АСК) или ее фармацевтически приемлемые соль или эфир и физиологически приемлемый первый вспомогательный ингредиент, предпочтительно производное целлюлозы, в частности, микрокристаллическую целлюлозу, и - оболочку, заключающую в себе указанное ядро, причем указанная оболочка содержит второй вспомогательный ингредиент, предпочтительно полупроницаемый полимер, в частности, этилцеллюлозу; причем большинство гранул, предпочтительно свыше 80%, более предпочтительно свыше 90%, имеют по существу сферическую форму, оцениваемую по параметру aspect ratio как 1,00-1,25, предпочтительно 1,001,20, более предпочтительно 1,00-1,15; большинство гранул композиции, предпочтительно свыше 70%, более предпочтительно свыше 90%, обеспечивает после просеивания размеры в интервале 0,5мм-2,0мм, предпочтительно в интервале 0,7мм1,1мм; композиция обеспечивает следующие скорости растворения in vitro (измеренные для модельной системы, использующей имитатор кишечной жидкости в системе USP Paddle System 2, и действующей при 37°С со скоростью перемешивания 100 об./мин.): а) 2-20%, предпочтительно 5-15%, общего количества 5-АСК высвобождается в модельной системе через 15 минут; б) 20-50%, предпочтительно 25-45%, общего количества 5-АСК высвобождается в модельной системе через 60 минут; в) 30-70%, предпочтительно 40-60%, общего количества 5-АСК высвобождается в модельной системе через 90 минут; г) 50-90%, предпочтительно 55-80%, общего количества 5-АСК высвобождается в модельной системе через 150 минут; д) 75-100% общего количества 5-АСК высвобождается в модельной системе через 240 минут. В обсуждаемом контексте "первый вспомогательный ингредиент" представляет собой сферонизирующую добавку, предпочтительно микрокристаллическую целлюлозу. "Второй вспомогательный ингредиент" представляет собой материал оболочки, который предпочтительно действует как барьер, ограничивающий скорость диффузии, но может также действовать как барьер, ограничивающий скорость возможного разъедания и разложения. Предпочтительным материалом ингредиента является этилцеллюлоза. Композиция согласно изобретению обеспечивает следующие параметры высвобождения 5-АСК in vivo: при условии, что опорожнение желудка соответствует норме, 50% гранул покидало желудок в течение 60 минут после приема композиции, предпочтительно за 30 минут. Кроме того, композиция обеспечивает следующие параметры высвобождения 5-АСК in vivo: при условии, что время прохождения тонкой кишки соответствует норме, 50% гранул присутствует в тонкой кишке в течение 3-6 часов после приема композиции. Кроме того, композиция обеспечивает следующие параметры высвобождения 5-АСК in vivo: при условии, что время прохождения толстой кишки соответствует норме, 50% гранул присутствует в толстой кишке в течение 12-50 часов после приема композиции. Время прохождения различных фармацевтических составов было предметом многочисленных исследований. Бехгаард (Bechgaard Η., Acta Pharmaceutica Technologica 28(2), 1982) изучала критические факторы, влияющие на желудочно-кишечное поглощение и, конкретно, время прохождения желудочно-кишечного тракта и его рН. Она отметила существенную разницу времени прохождения моноединичных лекарственных форм, т.е. перорально вводимых фармацевтических составов, содержащих одну нераспадающуюся единицу, и мультиединичной лекарственной формы, т.е. перорально вводимых фармацевтических составов, содержащих единицу, распадающуюся в желудке на большое число субъединиц. Для моноединичных лекарственных форм Бехгаард сообщает об опорожнении желудка за время в интервале от 0 до 24 часов, в то время как наиболее новые исследования (Богентофт - Bogentoft et al.) для мультиединичных лекарственных форм приводят значения, изменяющиеся от 1,5 до 2,5 часов в режиме голодания и от 2,3 до 3 часов не в режиме голодания. Бехгаард не приводит общего времени прохождения кишечника, приводя только время прохождения от рта до слепой кишки. Опять-таки имеет место очень большой разброс для моноединичных лекарственных форм (от 5 до 40 часов), в то время, как время прохождения для мультиединичных лекарственных форм лежит в более узком интервале. Бехгаард получила результаты, свидетельствующие о большом разбросе данных как функции плотности пилюль, что, однако, не смог подтвердить Богентофт (от 6,1 ± 0,9 до 7,1 ± 0,8 часов). Состав препарата Pentasaâ согласно упомянутым выше патентам США является мультиединичным и высвобождение 5-АСК из Pentasa в процессе нормального и ускоренного времени прохождения кишечника у 7 здоровых добровольцев исследовали Christensen at al., Br. J. Clin. Pharmac. (1987), 23, 365-369. Ежедневной дозой была 1500 Pentasa, нормальное время прохождения (НВП) составляло 24 часа (16-26 часов), а ускоренное время прохождения (УВП), индуцированное слабительным, составляло 5 часов (4-9 часов). Медианное значение полного выделения (24 часа, 4-АСК + ацетил-5-АСК) составляло 87% (61-129%) (НВП) и 81% (56-100%) (УВП), соответственно, (Р>0,10). В процессе НВП имеет место почти полное высвобождение 5-АСК из Pentasa. В условиях УВП высвобождается примерно 88%, что указывает на то, что Pentasa является приемлемым источником 5-АСК также и в состояниях диареи. Несмотря на то, что была исследована относительно небольшая группа добровольцев, 6 из них имели НВП в интервале от 24 до 26 часов, а 1 имел НВП, равное 16 часам. Fallingborg at al., Aliment. Pharmacol, therap. (1989), 3, 605-613, измерили рН-профиль и местные времена прохождения нормальной кишки с помощью радиотелеметрического устройства. рН в просвете кишки измеряли у 39 здоровых людей, используя рН-чувстви тельную радиопередающую капсулу. 13 человек изучалось дважды. Локализацию капсулы определяли рентгеновским облучением. рН увеличивался от 6,4 в двенадцатиперстной кишке до 7,3 в дистальной части тонкой кишки. У 17 человек в процессе последних часов прохождения тонкой кишки рН упал на 0,1-0,8. В слепой кишке рН составлял 5,7, но увеличивался., до 6,6 в прямой кишке. Время пребывания в желудке составляло 1,1 часа, а время прохождения тонкой кишки и ободочной кишки составляло, соответственно, 8 часов и 17,5 часов (медианные значения). Эти результаты обеспечивают более надежный базис для прогнозирования уровня и скорости высвобождения активного вещества из рН-зависимых пероральных препаратов пролонгированного действия и подтверждают данные, полученные Christensen et al. в указанной работе. Другие преимущества композиции согласно изобретению относятся к улучшениям активности и воспроизводимости фармацевтических характеристик, включающих лабораторные характеристики, в особенности, воспроизводимости параметров технологии нанесения оболочки. Описание процесса приготовления 5-АСК и первый вспомогательный ингредиент отвешивают в предварительно определенной пропорции, например, в % по весу 5-АСК от общего веса указанной гранулы, лежащей в интервале 30-90%, предпочтительно 40-80%, более предпочтительно 50-60%, наиболее предпочтительно приблизительно 50%. Ингредиенты тщательно перемешивают в смесительном контейнере. Следующей стадией является операция гранулирования, включающая смешивание ингредиентов с гранулирующим реагентом, предпочтительно с водой, например, в количестве 70-90% по весу воды от общего количества ингредиентов 5-АСК и вспомогательного вещества. Предпочтительно грануляцию проводить в смесительном контейнере. Преимущество этой стадии процесса заключается в том, что она может быть осуществлена с водой, избегая, таким образом, использования органических растворителей. В следующей стадии может быть проведена экструзия путем экструдирования вышеупомянутой смеси через сита с порами диаметром, например, 1,0мм. Следующая стадия включает сферонизацию смеси с помощью сферонизирующей аппаратуры, предпочтительно сферонизатора NICA. Операцию тщательно контролируют, скорость и интервал рабочего времени устанавливали согласно инструкциям к аппаратуре, например, проводили операцию на максимально допустимой скорости и таким образом, чтобы получить размер и форму гранул 5-АСК, соответствующие указанным заданным значениям. После стадии сферонизации гранулы переносят в осушительную систему с псевдоожиженным слоем и, после высушивания, гранулы по отдельности покрывают вторым вспомогательным ингредиентом, предпочтительно этилцеллюлозой, причем указанный вспомогательный ингредиент растворяли, например, в органическом растворителе, предпочтительно в ацетоне, в частности, в концентрации от 0,1-5% процентного соотношения весов. Контроль получения гранул со специфическими формами и размерами может быть проведен с помощью следующей процедуры: I. Процесс обработки и анализа изображения: Серийно выпускаемый микроскоп и программа анализа были получены от фирмы Leica ("Leica Q500MC Image Analysis System") и использованы для определения размеров и параметров aspect ratio приготовленных гранул. Термин aspect ratio в том смысле, в котором он используется в данном случае, определяется как отношение длины к ширине. Длина определяется как длина самого длинного размера гранулы. Ширина определяется как длина самого короткого размера гранулы. Образцы выбирались случайным образом, например, в трех экземплярах. Композиции согласно изобретению должны отвечать следующим критериям: большинство гранул, предпочтительно свыше 80%, более предпочтительно свыше 90%, имеют существенно сферическую форму, оцениваемую значениями параметра aspect ratio 1,00-1,25, предпочтительно 1,00-1,20, более предпочтительно 1,00-1,15. II. Кроме того, распределение размеров частиц в гранулах композиции может быть определено с помощью системы LEICA ANAL YSIS SYSTEM, как это описано выше, а также следующим образом: Типичные образцы гранулированных препаратов подвергают гранулометрическому анализу; т.е. просеивают через набор различных сит с использованием фиксированных времени и режима вибрации, причем типичными ситами были 1,40мм - 1,25мм - 1,12мм - 1,00мм - 0,710мм - 0,50мм - 0,355мм -0,250мм. Композиции согласно изобретению должны отвечать следующим критериям: большинство гранул композиции, предпочтительно свыше 70%, более предпочтительно свыше 90%, обеспечивают при просеивании размеры в интервале 0,5мм-2,00мм, предпочтительно в интервале 0,7мм-1,1мм. Кроме того, изготовленные гранулированные препараты испытываются в модельной системе USP Paddle System 2 in vitro для профилей растворения, использующей имитатор кишечной жидкости, 0,1Μ Na фосфатный буфер, рН 7,5 и работающей при 37°С со скоростью перемешивания 100 об./мин. Партии образцов, обеспечивающих описанные ниже профили растворения, выбираются, исходя из клинических задач. Предпочтительными профилями растворения гранул согласно изобретению являются следующие: а) 2-20%, предпочтительно 5-15%, общего количества 5-АСК высвобождается в модельной системе через 15 минут; б) 20-50%, предпочтительно 25-45%, общего количества 5-АСК высвобождается в модельной системе через 60 минут; в) 30-70%, предпочтительно 40-60%, общего количества 5-АСК высвобождается в модельной системе через 90 минут; г) 50-90%, предпочтительно 55-80%, общего количества 5-АСК высвобождается в модельной системе через 150 минут; д) 75-100% общего количества 5-АСК высвобождается в модельной системе через 240 минут. Детальное описание геометрических и структурных характеристик гранул Гранулы согласно изобретению выбираются таким образом, чтобы обеспечить следующие геометрические и структурные характеристики: большинство гранул, предпочтительно свыше 80%, более предпочтительно свыше 90%, имеют по существу сферическую форму, оцениваемую по параметру aspect ratio как 1,00-1,25, предпочтительно 1,001,20, более предпочтительно 1,00-1,15; и большинство гранул композиции, предпочтительно свыше 70%, более предпочтительно выше 90%, обеспечивают просеянные размеры в интервале 0,5-2,0мм, предпочтительно в интервале 0,7-1,1мм. Предпочтительный вариант осуществления изобретения (ПАРТИЯ 322202) - см.фиг.2 Для подходящих гранул согласно изобретению были получены следующие результаты (измерения на основании 75 замеров гранул со случайным отбором образцов); Длина Для длины гранул, определяемой в данном случае самого длинного размера гранулы, были получены следующие результаты: Минимум = 0,751мм - максимум = 1,101мм, т.е. набор значений составлял ряд от 0,75 до 1,10мм. Гранулы имели значения длины, изменяющиеся в следующих пределах (среднее значение ±1 СО) (СО среднеквадратическое отклонение): 0,881мм ± 0,068мм = от 0,813мм до 0,949мм, или (среднее значение ±2 СО): 0,881мм ± 0,136мм = от 0,745 мм до 1,017 мм. Таким образом, большинство (95%) гранул имело длину (значение самого длинного размера) от 0,75 мм до 1,02 мм. Ширина Для ширины гранул, определяемой в данном случае как длина самого короткого размера гранулы, были получены следующие результаты: Минимум = 0,674мм - максимум = 0,920мм, т.е. набор значений составлял ряд от 0,67 до 0,92 мм. Гранулы имели значения ширины, изменяющиеся в следующи х пределах (среднее значение ± СО): 0,800мм ± 0,058мм = от 0,742мм до 0,858мм, или (среднее значение ± 2 СО): 0,800мм ± 0,116мм = от 0,684мм до 0,916мм. Таким образом, большинство (95%) гранул имело ширину (значение самого короткого размера) от 0,68мм до 0,92мм. Aspect ratio Для параметра aspect ratio, определяемого в данном случае как отношение длины к ширине (длина и ширина определялись как, соответственно, значения самого длинного и самого короткого размеров гранулы) были получены следующие результаты: Минимум = 1,029 - максимум = 1,250, т.е. набор значений составлял ряд от 1,03 до 1,25. Гранулы имели значения aspect ratio, изменяющиеся в следующих пределах (среднее значение ± 1 СО): 1,102 ± 0,044 = от 1,058 до 1,146, или (среднее значение ± 2 СО), 1,102 ± 0,088 = от 1,014 до 1,190. Таким образом, большинство (97%) гранул имело значения aspect ratio от 1,01 до 1,19. Предпочтительный вариант осуществления изобретения (ПАРТИЯ 437601) - см.фиг.4 Для подходящих гранул согласно изобретению были получены следующие результаты (измерения на основании 75 замеров гранул со случайным отбором образцов): Длина Для длины гранул, определяемой в данном случае как значение самого длинного размера гранулы, были получены следующие результаты: Минимум = 0,712мм - максимум = 1,010мм, т.е. набор значений составлял ряд от 0,71 до 1,01мм. Гранулы имели значения длины, изменяющиеся в следующи х пределах (среднее значение ± 1 СО): 0,834мм ± 0,070мм = от 0,764мм до 0,904мм, или (среднее значение ± 2 СО): 0,834мм ± 0,140мм = от 0,694мм до 0,974мм. Таким образом, большинство (98%) гранул имело длину (значение самого длинного размера) от 0,69мм до 1,02мм. Ширина Для ширины гранул, определяемой в данном случае как значение самого короткого размера гранулы, были получены следующие результаты: Минимум = 0,648мм - максимум = 0,907мм, т.е. набор значений составлял ряд от 0,65 до 0,91мм. Гранулы имели значения ширины, изменяющиеся в следующи х пределах (среднее значение ± СО): 0,759мм ± 0,069мм = от 0,690мм до 0,828мм, или (среднее значение ± 2 СО): 0,759мм ± 0,138мм = от 0,621мм до 0,897мм. Таким образом, большинство (95%) гранул имело ширину (значение самого короткого размера) от 0,62мм до 0,90мм. Aspect ratio Для параметра aspect ratio, определяемого в данном случае как отношение длины к ширине (длина и ширина определялись как, соответственно, значения самого длинного и самого короткого размеров гранулы) были получены следующие результаты: Минимум = 1,016 - максимум = 1,266, т.е. набор значений составлял ряд от 1,02 до 1,27. Гранулы имели значения aspect ratio, изменяющиеся в следующих пределах (среднее значение ± 1 СО): 1,100 ± 0,046 = от 1,054 до 1,146, или (среднее значение ± 2 СО), 1,100 ± 0,092 = от 1,008 до 1,192. Таким образом, большинство (95%) гранул имело значения aspect ratio от 1,01 до 1,19. Лечение воспалительных кишечных заболеваний Главным аспектом изобретения является способ лечения воспалительных кишечных заболеваний (ВКЗ), в частности, болезни Крона, язвенного колита, не поддающейся классификации формы указанных заболеваний и диагностированного подвида указанной болезни, включающий пероральное введение фармакологически эффективного количества композиции согласно изобретению. Термин "фармакологически эффективное количество" в данном случае означает количество соединения согласно изобретению, которое способно индуцировать желаемый терапевтический эффект в нуждающемся в нем индивидууме. Конкретная доза 5-АСК, вводимая согласно настоящему изобретению, будет, конечно, определяться конкретными для данного случая обстоятельствами, включая рассмотрение конкретного условия и местонахождения патологии, пол, возраст и вес индивидуума, а также другие соображения такого рода. Настоящее изобретение полезно также в проведении лечения более или менее хронической воспалительной кишечной болезни, inter alia, из-за того, что системные эффекты и другие вредные эффекты, вызываемые приемом 5-АСК пренебрежимо малы. Благодаря этому могут быть предписаны относительно длинные циклы лечения, использующие относительно высокое общее количество лекарств с сопутствующим уменьшением вероятности вредных эффектов. Участком-мишенью желудочно-кишечного тракта является участок в проксимальной тонкой кишке, в средней части тонкой кишки, в дистальной части тонкой кишки, в слепой кишке, восходящей ободочной кишке, поперечной ободочной кишке, нисходящей ободочной кишке, сигмовидной ободочной кишке и/или прямой кишке. Аспектом изобретения является композиция, в которой 5-АСК входит в однократную лекарственную форму, причем указанная композиция содержит 5-АСК в количествах, достаточных для введения от 250мг до 12г, предпочтительно от 500мг до 6г, более предпочтительно от 500мг до 4г, например, входит в однократные лекарственные формы, каждая из которых содержит 500мг, 1г, 2г, 5г или 6г. Термин "однократная лекарственная форма" относится к физически дискретным единицам, пригодным к использованию в качестве однократных доз для клинического применения, причем каждая единица содержит заранее определенное количество 5-АСК, рассчитанное для произведения желаемого терапевтического эффекта. Более того, композиция предпочтительно является композицией, в которой 5-АСК хранится как однократные лекарственные формы в запечатанных упаковках, вскрываемых непосредственно перед использованием, например, в пакетах-саше или в "карандашах". Краткое описание фигур графических материалов На фиг. 1 представлен анализ изображений сферических гранул предпочтительного варианта осуществления изобретения, приготовленных по описанному ниже способу. На фиг. 2 представлены соответствующие определения параметра aspect ratio, полученные с помощью системы LEICA Q500MC Image Analysis System. На фиг. 3 и 4 представлены аналогичные данные, полученные для другой партии. На фиг. 5 представлено графическое изображение интервалов предпочтительной скорости растворения гранул согласно изобретению. На фиг. 6 представлено графическое изображение, показывающее те же интервалы скорости растворения, что и на рис. 5, совмещенные с данными, полученными в контрольном эксперименте. Видно, что профиль растворения обычных гранул очень сильно отличается от профилей гранул согласно изобретению. На рис. 7 представлено графическое изображение данных, полученных для сферических гранул согласно изобретению. Методика испытания была та же, что и на фиг. 6. Результаты лежат в предпочтительных пределах. На рис. 8 представлено графическое изображение данных, полученных для сферических гранул согласно изобретению. Методика испытания была та же, что и на фиг. 6. Результаты лежат в предпочтительных пределах. На фиг. 9 на одном графике представлено графическое изображение результатов, описанных на фиг.6, 7 и 8. На фиг. 10 показана таблица, представляющая для сферических гранул время опорожнения желудка in vi vo и время доставки в ободочную кишку. На фиг. 11 и 12 показаны кривые плазменной концентрации 5-АСК, полученные в клиническом исследовании, описанном на фиг. 10. Пример 1 Производство гранулированных композиций согласно изобретению 5000г 5-АСК и 5000г микрокристаллической целлюлозы отвесили и тщательно перемешали при фиксированных времени и скорости. 8000г дистиллированной воды залили в смесительный контейнер и ингредиенты перемешали. Смесь экструдировали через сито 1,0мм и сферонизировали при фиксированных времени и скорости. После тщательно контролируемой сферонизации, проводящейся с использованием максимальной скорости (790об./мин.) сферонизирующего аппарата типа NICA (NICA S2-450) для фиксированного интервала времени, например, 5 минут, адаптированного к количеству помещенной в аппарат гранулированной смеси, сферонизированные гранулы перенесли в осушительную систему с псевдоожиженным слоем. После высушивания шарики покрыли оболочками путем распыления этилцеллюлозы, растворенной в ацетоне. На последнем этапе гранулы анализировали и отбирали описанным выше способом с точки зрения геометрических свойств. Для определения распределения размеров частиц, как правило, использовали 400 г гранул. Определение проводили на лабораторной просеивающей машине Retsch типа VIBRO (1,400 - 1,250 - 1,120 - 1,000 - 0,710 0,500 - 0,355 - 0,250мм). Контрольный регулятор амплитуды вибрации был установлен на значении 60 на время 10 минут. Конкретные партии гранул, приготовленных описанным выше способом, далее иллюстрируются соответствующими фигурами чертежей. Описание испытаний и результатов Анализ изображений сферических гранул предпочтительного варианта осуществления согласно изобретению (партия 322201) иллюстрируется фиг. 1. На фиг. 2 представлена таблица, демонстрирующая соответствующие геометрические характеристики, полученные для одной партии, включающие данные, представляющие определение длины, ширины и параметра aspect ratio; все результаты были получены на аппаратуре LEICA Q500MC Image Analysis System. Как правило, для обработки и анализа изображения отбирали случайным образом приблизительно 3х300мг гранул. На фиг. 3 и 4 показан анализ изображений и геометрические данные, полученные для партии 437601. Процедура испытания для скоростей растворения Скорости растворения in vitro испытывались в имитаторе кишечной жидкости с использованием системы USP Paddle system 2 Dissolution System. Выдерживались следующие условия: Растворяющая жидкость: 0,1 Μ Na-фосфатный буфер, рН = 7,5; Объем жидкости: 1000мл; Температура: 37°С; Скорость перемешивания: 100 об./мин. Графическое изображение предпочтительных интервалов скоростей растворения гранул согласно изобретению показано на фиг. 5. Сравнительное изучение Сравнительное изучение проводили с использованием порции некоторого количества гранул, представляющих собой 5-АСК гранулят, приготовленный в виде промежуточного продукта перед добавлением ингредиентов для таблеток и прессованием в таблетки, т.е. в виде промежуточного 5-АСК гранулята на стадии приготовления перед получением обычных таблеток 5-АСК. Сравнение результатов показало, что такой "обычный" гранулят не обеспечивал свойств, характерных для гранул согласно настоящему изобретению. Обычные гранулы, использованные в сравнительном изучении, представляли собой гранулы, приготовленные из гомогенной смеси 5% поливинилпирролидона и 95% 5-АСК, которые были отгранулированы, экструдированы (сито 1,0мм) и затем покрыты оболочкой из этилцеллюлозы. Были испытаны 6 партий. На фиг. 6 представлено графическое изображение, показывающее те же интервалы скоростей растворения, что и на фиг. 5, и, кроме того, данные, полученные из сравнительного эксперимента. Видно, что профиль растворения обычных гранул сильно отличается от профилей гранул согласно изобретению. На фиг. 7 представлено графическое изображение данных, полученных для сферических гранул со гласно изобретению (партия 322202). Процедура испытания была той же, что и для фиг. 6. Результаты находятся в предпочтительных пределах. На фиг. 8 представлено графическое изображение данных, полученных для сферических гранул со гласно изобретению (партия 437601). Процедура испытания была той же, что и для фиг. 6. Результаты находятся в предпочтительных пределах. На фиг. 9 на одном графике представлено графическое изображение результатов, описанных на фиг. 6 (контрольные данные), фиг. 7 и фи г. 8. Испытательная процедура in vivo Распределение сферических гранул в организме исследовалось на восьми здоровых добровольцах. Эксперименты проводили согласно документу Clynical Study Protocol, приведенному в Pharmaceutical Profiles Ltd, Nottingham, UK, с использованием гранул, меченных радиоактивным изотопом 153Sm для локализации положения распределенной композиции. Результаты представлены на фиг. 10, представляющей таблицу, демонстрирующую время опорожнения желудка и время доставки испытуемых сферических гранул к ободочной кишке. На фиг. 11 и 12 показаны дальнейшие результаты клинического изучения: кривые плазменной концентрации 5-АСК после введения (1000мг однократной дозой) гранулированной композиции согласно изобретению.
ДивитисяДодаткова інформація
Назва патенту англійськоюModified release pharmaceutical composition and method for treatment of inflammatory bowel diseases
Назва патенту російськоюФармацевтическая композиция с модифицированным характером высвобождения из оболочки для перорального применения и способ лечения воспалительных кишечных заболеваний
МПК / Мітки
МПК: A61K 31/60, A61K 9/16
Мітки: оболонки, вивільнення, перорального, композиція, кишкових, лікування, уведення, характером, модифікованим, запальних, захворювань, спосіб
Код посилання
<a href="https://ua.patents.su/14-67721-kompoziciya-z-modifikovanim-kharakterom-vivilnennya-z-obolonki-dlya-peroralnogo-uvedennya-ta-sposib-dlya-likuvannya-zapalnikh-kishkovikh-zakhvoryuvan.html" target="_blank" rel="follow" title="База патентів України">Композиція з модифікованим характером вивільнення з оболонки для перорального уведення та спосіб для лікування запальних кишкових захворювань</a>
Попередній патент: Способи одержання фенілімідазолідинових похідних
Випадковий патент: Пристрій для нагрівання та сушіння футеровки металургійних ковшів