Мікробіологічні способи одержання 7a,17a-заміщених 11b-галогенстероїдів
Номер патенту: 89472
Опубліковано: 10.02.2010
Автори: Цорн Лудвіг, Галлус Норберт, Кюнцер Херманн, Мун Ханс-Петер, Больманн Рольф, Нуббемайер Райнхард
Формула / Реферат
1. 7α,17α-заміщені 11β-галогенстероїди загальної формули 8, 10, 12
 , 8, 10, 12
, 8, 10, 12
у якій
U-V-W-X-Y-Z являє собою одну з циклічних структур С1-С2-С3-С4=C5-C10, С1-С2-С3-С4-С5=С10 або С1-С2-С3-С4-С5-С10, при цьому в даному випадку оксогрупа (=O) зв'язана з W(=С3), або являє собою циклічну структуру С1=С2-С3=С4-С5=С6, при цьому в даному випадку залишок OR3 зв'язаний з W (=С3),
R3 являє собою Н, C1-C4алкіл, C1-C4алканоїл або простий циклічний С3-С7ефір із O-атомом залишку OR3,
R7 являє собою угруповання P-Q, де
Р означає C1-C4алкілен, a Q означає водень, C1-C4алкіл або С1-С4фторалкіл, і це угруповання P-Q через Р зв'язане із стероїдним каркасом,
R10 може знаходитися в α- або β-положенні і являє собою Н, СН3 або СF3, однак він присутній лише за умови, що X-Y-Z не означає С4-С5=С10,
R11 являє собою галоген,
R13 являє собою метил або етил,
R17 являє собою Н, С1-С18алкіл, аліциклічний С1-С18алкіл, С1-С18алкеніл, аліциклічний С1-С18алкеніл, С1-С18алкініл, С1-С18алкіларил, С1-С8алкіленнітрил або угруповання P-Q, де це угруповання P-Q має вказане вище значення,
R17' являє собою Н, С1-С18алкіл, аліциклічний С1-С18алкіл, С1-С18алкеніл, аліциклічний С1-С18алкеніл, С1-С18алкініл або С1-С18алкіларил, при цьому R17' може бути також через кетогрупу зв'язаний з 17 β-оксигрупою і, крім того, R17' додатково може бути заміщений однією або декількома групами NR18R19 або однією або декількома групами SOxR20, де х означає 0, 1 або 2, a R18, R19 і
R20 кожен незалежно один від одного може мати ті ж значення, які і R17,
а також їх фармацевтично прийнятні адитивні солі, складні ефіри й аміди.
2. 7α,17α-заміщені 11β-галогенстероїди за п. 1, які відрізняються тим, що U-V-W-X-Y-Z являє собою циклічну структуру С1-С2-С3-С4=С5-С10, С1-С2-С3-С4-С5=С10 або С1=С2-С3=С4-С5=С10.
3. 7α,17α-заміщені 11β-галогенстероїди за п. 1 або 2, які відрізняються тим, що R1 являє собою Н.
4. 7α,17α-заміщені 11β-галогенстероїди за будь-яким з пп. 1-3, які відрізняються тим, що R7 являє собою СН3.
5. 7α,17α-заміщені 11β-галогенстероїди за будь-яким з пп. 1-4, які відрізняються тим, що R11 являє собою фтор.
6. 7α,17α-заміщені 11β-галогенстероїди за будь-яким з пп. 1-5, які відрізняються тим, що R13 являє собою СН3.
7. 7α,17α-заміщені 11β-галогенстероїди за будь-яким з пп. 1-6, які відрізняються тим, що R17 являє собою Н, СН3, С1-С18алкініл, CH2CN або СF3.
8. 7α,17α-заміщені 11β-галогенстероїди за будь-яким з пп. 1-7, які відрізняються тим, що R17 являє собою етиніл.
9. 7α,17α-заміщені 11β-галогенстероїди за будь-яким з пп. 1-8, які відрізняються тим, що R17' являє собою Н.
10. 7α,17α-заміщені 11β-галогенстероїди за будь-яким з пп. 1-9 із групи, яка включає
17α-етиніл-11β-фтор-17β-гідрокси-7α-метилестр-4-ен-3-он,
17α-етиніл-11β-фтор-17β-гідрокси-7α-метилестр-5(10)-ен-3-он і
17α-етиніл-11β-фтор-7![]() -метилестра-1,3,5(10)-триєн-3,17β-діол.
-метилестра-1,3,5(10)-триєн-3,17β-діол.
11. 7α-заміщені 11β-галогенестра-1,3,5(10)-триєни загальної формули 6
 , 6
, 6
у якій
R3 являє собою Н, C1-C4алкіл, C1-C4алканоїл або простий циклічний С3-С7ефір із
O-атомом залишку OR3, R7 являє собою угруповання P-Q, де
Р означає C1-C4алкілен, a Q означає водень, C1-C4алкіл або С1-С4фторалкіл, і це угруповання P-Q через Р зв'язане із стероїдним каркасом, R11 являє собою галоген, R13 являє собою метил або етил, а також їх фармацевтично прийнятні адитивні солі, складні ефіри й аміди.
12. 7α-заміщені 11![]() -галогенестра-1,3,5(10)-триєни за п. 11, конкретно 11β-фтор-3-гідрокси-7
-галогенестра-1,3,5(10)-триєни за п. 11, конкретно 11β-фтор-3-гідрокси-7![]() -метилестра-1,3,5( 10)-триєн-17-он.
-метилестра-1,3,5( 10)-триєн-17-он.
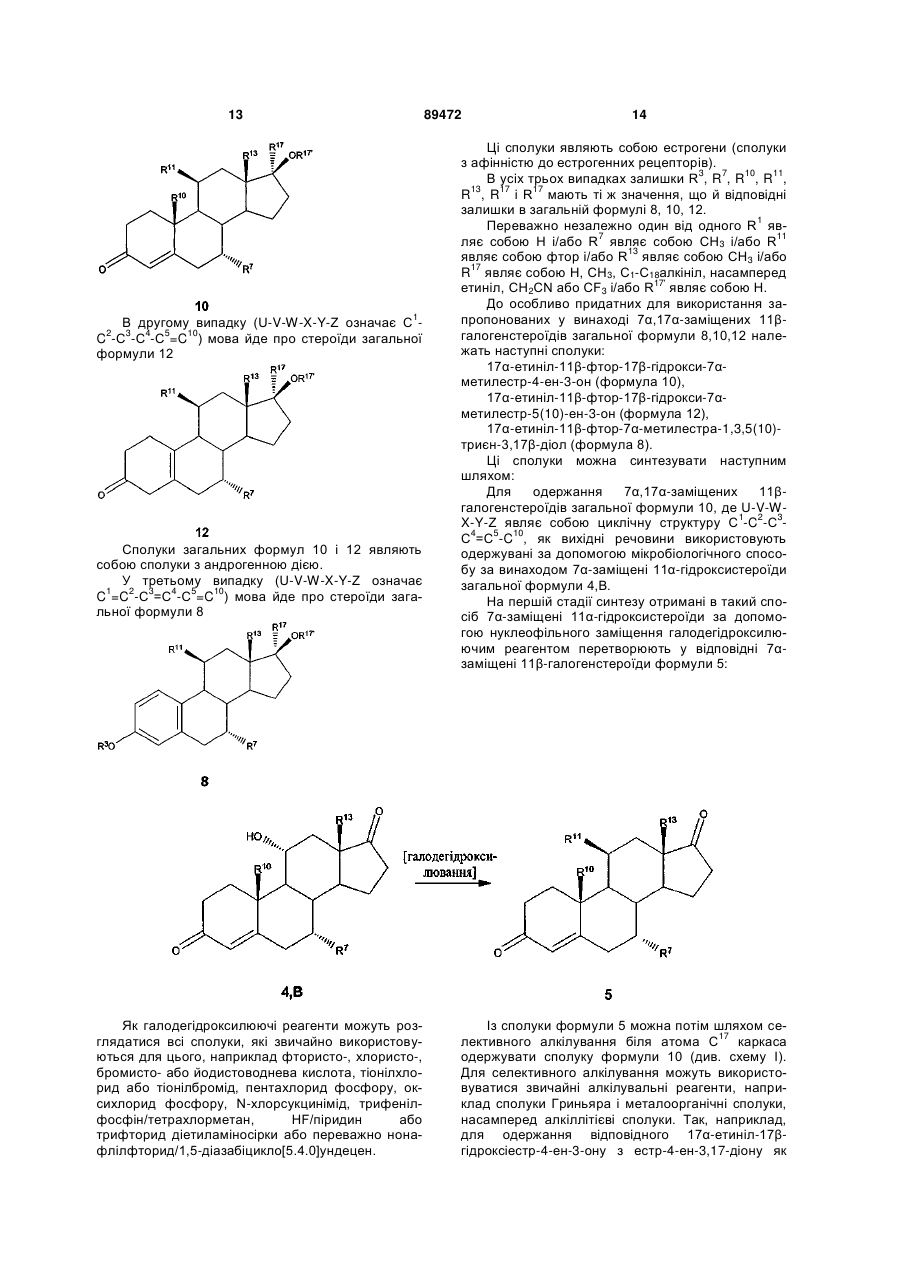
13. Спосіб одержання 7α,17α-заміщених 11β-галогенстероїдів загальної формули 10 за будь-яким з пп. 1-10, у яких U-V-W-X-Y-Z являє собою циклічну структуру С1-С2-С3-С4=С5-С10, який полягає в тому, що він включає наступні стадії:
- нуклеофільне заміщення у відповідному 7α-заміщеному 11α-гідроксистероїді загальної формули 4,В в положенні 11 галодегідроксилюючим реагентом,
- взаємодію утвореного таким шляхом 7α-заміщеного 11β-галогенстероїду з алкілувальним агентом вибірно біля атома С17 каркаса з одержанням у результаті 7α,17α-заміщеного 11β-галогенстероїду загальної формули 10.
14. Спосіб одержання 7α,17α-заміщених 11β-галогенстероїдів загальної формули 12 за будь-яким з пп. 1-10, у яких U-V-W-X-Y-Z являє собою циклічну структуру С1-С2-С3-С4-С5=С10, який полягає в тому, що він включає наступні стадії:
- нуклеофільне заміщення у відповідному 7α-заміщеному 11α-гідроксистероїді загальної формули 4,В в положенні 11 галодегідроксилюючим реагентом,
- взаємодію утвореного таким шляхом 7α-заміщеного 11β-галогенстероїду з алкілувальним агентом вибірно біля атома С17 каркаса з одержанням у результаті 7α,17α-заміщеного 11β-галогенстероїду загальної формули 10,
- ізомеризацію 7α,17α-заміщеного 11β-галогенстероїду загальної формули 10 з утворенням відповідного ізомеру загальної формули 12, у якому U-V-W-X-Y-Z являє собою циклічну структуру С1-С2-С3-С4-С5=С10.
15. Спосіб одержання 7α,17α-заміщених 11β-галогенстероїдів загальної формули 8 за будь-яким з пп. 1-10, у яких U-V-W-X-Y-Z являє собою циклічну структуру С1=С2-С3=С4-С5=С6, який полягає в тому, що він включає наступні стадії:
- нуклеофільне заміщення у відповідному 7α-заміщеному 11α-гідроксистероїді загальної формули 4,В в положенні 11 галодегідроксилюючим реагентом,
- окислення утвореного таким шляхом 7α-заміщеного 11β-галогенстероїду до 7α-заміщеного естра-1,3,5(10)-триєну загальної формули 6 за п. 7 або 8,
- взаємодію 7α-заміщеного естра-1,3,5(10)-триєну загальної формули 6 з алкілувальним агентом вибірно біля атома С17 каркаса з одержанням у результаті 7α,17α-заміщеного 11β-галогенстероїду загальної формули 8.
16. Застосування 7α,17α-заміщених 11β-галогенстероїдів загальної формули 8, 10, 12 за будь-яким з пп. 1-10 для одержання відповідних лікарських засобів.
17. Фармацевтичні препарати, які містять принаймні один 7α,17α-заміщений 11β-галогенстероїд загальної формули 8, 10, 12 за будь-яким з пп. 1-10 і принаймні один фармацевтично прийнятний носій.
Текст
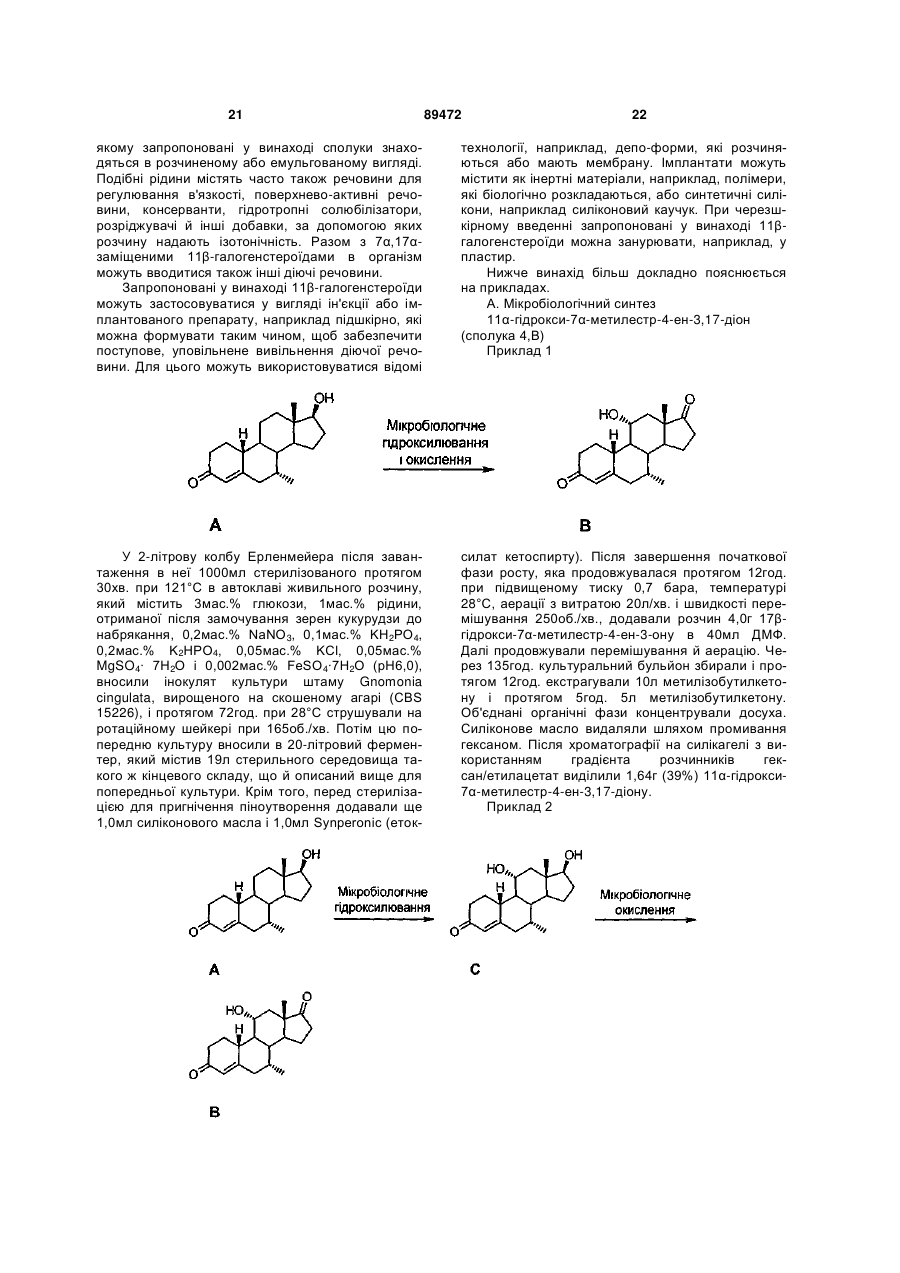
1. 7α,17α-заміщені 11β-галогенстероїди загальної формули 8, 10, 12 2 3 може бути заміщений однією або декількома гру18 19 пами NR R або однією або декількома групами 20 SOxR , де х означає 0, 1 або 2, a R18, R19 і 20 R кожен незалежно один від одного може мати ті ж значення, які і R17, а також їх фармацевтично прийнятні адитивні солі, складні ефіри й аміди. 2. 7α,17α-заміщені 11β-галогенстероїди за п.1, які відрізняються тим, що U-V-W-X-Y-Z являє собою циклічну структуру С1-С2-С3-С4=С5-С10, С1-С2-С3С4-С5=С10 або С1=С2-С3=С4-С5=С10. 3. 7α,17α-заміщені 11β-галогенстероїди за п.1 або 1 2, які відрізняються тим, що R являє собою Н. 4. 7α,17α-заміщені 11β-галогенстероїди за будь7 яким з пп.1-3, які відрізняються тим, що R являє собою СН3. 5. 7α,17α-заміщені 11β-галогенстероїди за будьяким з пп.1-4, які відрізняються тим, що R11 являє собою фтор. 6. 7α,17α-заміщені 11β-галогенстероїди за будьяким з пп.1-5, які відрізняються тим, що R13 являє собою СН3. 7. 7α,17α-заміщені 11β-галогенстероїди за будьяким з пп.1-6, які відрізняються тим, що R17 являє собою Н, СН3, С1-С18алкініл, CH2CN або СF3. 8. 7α,17α-заміщені 11β-галогенстероїди за будьяким з пп.1-7, які відрізняються тим, що R17 являє собою етиніл. 9. 7α,17α-заміщені 11β-галогенстероїди за будьяким з пп.1-8, які відрізняються тим, що R17' являє собою Н. 10. 7α,17α-заміщені 11β-галогенстероїди за будьяким з пп.1-9 із групи, яка включає 17α-етиніл-11β-фтор-17β-гідрокси-7α-метилестр-4ен-3-он, 17α-етиніл-11β-фтор-17β-гідрокси-7α-метилестр5(10)-ен-3-он і 17α-етиніл-11β-фтор-7 -метилестра-1,3,5(10)триєн-3,17β-діол. 11. 7α-заміщені 11β-галогенестра-1,3,5(10)-триєни загальної формули 6 R11 R3O R13 R7 O , 6 у якій R3 являє собою Н, C1-C4алкіл, C1-C4алканоїл або простий циклічний С3-С7ефір із 3 7 O-атомом залишку OR , R являє собою угруповання P-Q, де Р означає C1-C4алкілен, a Q означає водень, C1C4алкіл або С1-С4фторалкіл, і це угруповання P-Q через Р зв'язане із стероїдним каркасом, R11 являє собою галоген, R13 являє собою метил або етил, а також їх фармацевтично прийнятні адитивні солі, складні ефіри й аміди. 12. 7α-заміщені 11 -галогенестра-1,3,5(10)-триєни за п.11, конкретно 11β-фтор-3-гідрокси-7 метилестра-1,3,5( 10)-триєн-17-он. 89472 4 13. Спосіб одержання 7α,17α-заміщених 11βгалогенстероїдів загальної формули 10 за будьяким з пп.1-10, у яких U-V-W-X-Y-Z являє собою 1 2 3 4 5 10 циклічну структуру С -С -С -С =С -С , який полягає в тому, що він включає наступні стадії: - нуклеофільне заміщення у відповідному 7αзаміщеному 11α-гідроксистероїді загальної формули 4,В в положенні 11 галодегідроксилюючим реагентом, - взаємодію утвореного таким шляхом 7αзаміщеного 11β-галогенстероїду з алкілувальним 17 агентом вибірно біля атома С каркаса з одержанням у результаті 7α,17α-заміщеного 11βгалогенстероїду загальної формули 10. 14. Спосіб одержання 7α,17α-заміщених 11βгалогенстероїдів загальної формули 12 за будьяким з пп.1-10, у яких U-V-W-X-Y-Z являє собою циклічну структуру С1-С2-С3-С4-С5=С10, який полягає в тому, що він включає наступні стадії: - нуклеофільне заміщення у відповідному 7αзаміщеному 11α-гідроксистероїді загальної формули 4,В в положенні 11 галодегідроксилюючим реагентом, - взаємодію утвореного таким шляхом 7αзаміщеного 11β-галогенстероїду з алкілувальним агентом вибірно біля атома С17 каркаса з одержанням у результаті 7α,17α-заміщеного 11βгалогенстероїду загальної формули 10, ізомеризацію 7α,17α-заміщеного 11βгалогенстероїду загальної формули 10 з утворенням відповідного ізомеру загальної формули 12, у якому U-V-W-X-Y-Z являє собою циклічну структуру С1-С2-С3-С4-С5=С10. 15. Спосіб одержання 7α,17α-заміщених 11βгалогенстероїдів загальної формули 8 за будьяким з пп.1-10, у яких U-V-W-X-Y-Z являє собою циклічну структуру С1=С2-С3=С4-С5=С6, який полягає в тому, що він включає наступні стадії: - нуклеофільне заміщення у відповідному 7αзаміщеному 11α-гідроксистероїді загальної формули 4,В в положенні 11 галодегідроксилюючим реагентом, - окислення утвореного таким шляхом 7αзаміщеного 11β-галогенстероїду до 7α-заміщеного естра-1,3,5(10)-триєну загальної формули 6 за п.7 або 8, - взаємодію 7α-заміщеного естра-1,3,5(10)-триєну загальної формули 6 з алкілувальним агентом 17 вибірно біля атома С каркаса з одержанням у результаті 7α,17α-заміщеного 11β-галогенстероїду загальної формули 8. 16. Застосування 7α,17α-заміщених 11βгалогенстероїдів загальної формули 8, 10, 12 за будь-яким з пп.1-10 для одержання відповідних лікарських засобів. 17. Фармацевтичні препарати, які містять принаймні один 7α,17α-заміщений 11β-галогенстероїд загальної формули 8, 10, 12 за будь-яким з пп.1-10 і принаймні один фармацевтично прийнятний носій. 5 Даний винахід стосується мікробіологічних способів одержання 7α-заміщених 11αгідроксистероїдів, 7α,17α-заміщених 11βгалогенстероїдів, які одержують з них,способів одержання цих останніх сполук, а також їх застосування і фармацевтичних препаратів, які містять ці сполуки. Крім того, винахід стосується інших 7αзаміщених 11β-галогенстероїдів, конкретно 7αзаміщених естра-1,3,5(10)-триєнів, які одержують з 7α-заміщених 11α-гідроксистероїдів. Для терапії клімактеричних розладів у чоловіків (Climacterium virile) і для розвитку чоловічих статевих органів, так само як і для контролю репродуктивної здатності (фертильності) чоловіків застосовують андрогени, насамперед тестостерон. Крім того, ці гормони містять також активні компоненти, які мають частково анаболічну дію, які, серед іншого, сприяють росту м'язів. Клімактеричний період у чоловіків характеризується природним, обумовленим віковими змінами організму зниженням вироблення андрогенів, для поповнення недостатності яких проводять гормонзамісну терапію (ГЗТ). Введення в організм ЛГ (лютеінізуючого гормону) і РГ (рилізинг-гормону) для контролю фертильності чоловіків поряд зі зменшенням сперматогенезу приводить також до надлишкової активізації ("висипання") ЛГ і до зниження рівня тестостерону і згасання лібідо, для підвищення яких використовують лікарські засоби, які містять тестостерон (D.E. Cummings і ін., "Prostate-Sparing Effects of the Potent Androgen 7α-Methyl-19Nortestosterone: A Potential Alternative to Testosterone for Androgen Replacement and Male Contraception", Journal of Clinical Endocrinology and Metabolism, том 83, №12,1998, стор.4212-4219). Для контролю чоловічої фертильності може застосовуватися комбінована терапія з використанням андрогенів і компонента, який має гестагену дію (див., наприклад, заявку WO 01/60376 А, а також джерела, наведені в цій публікації як посилання). При лікуванні з використанням тестостерону була встановлена поява побічних ефектів, таких насамперед, як збільшення передміхурової залози, зумовлене збільшенням кількості клітин і залоз строми (доброякісна гіперплазія простати, ДГТ). При метаболізмі тестостерону, опосередкованому 5α-редуктазою, утворюється дигідротестостерон (ДГТ), який серед іншого може привести до ДГП (Cummings і ін., див. вище; заявка WO 99/13883 А1). Тому в клінічній практиці пригнічення 5αредуктази використовують для лікування ДГП (застосування фінастеридів). Швидкий метаболізм андрогенного стероїду, яким є тестостерон, в організмі людини приводить далі не тільки до утворення небажаного ДГТ, але й обумовлює необхідність перорального введення високих доз для досягнення необхідного ефективного рівня тестостерону. Тому виникає необхідність у використанні альтернативних лікарських 89472 6 форм, таких як внутрішньом'язові ін'єкції або великі пластирі. Для заміни тестостерону, який застосовується при вищезгаданих показаннях, був запропонований 7α-метил-19-нортестостерон (МеНТ), біологічна ефективність якого, по-перше, вище в порівнянні з тестостероном, оскільки він має більш високу афінність до андрогенних рецепторів, і який, по-друге, утворює завдяки 7α-метильній групі своєрідний стеричний бар'єр, перешкоджає, як припускають, процесу метаболізму під дією 5αредуктази (Cummings і ін., див. вище; WO 99/13883 А1; WO 99/13812 А1; US 5342834). При метаболізмі тестостерону, крім того, деяка частина цієї сполуки в результаті ароматизації кільця А стероїдної системи перетворюється в естрадіол, насамперед подібне відбувається в головному мозку, у печінці й у жировій тканині. Естрадіол щодо загальної дії тестостерону і його метаболітів у вирішальній ступені відповідає за обумовлені специфікою статі властивості і регуляцію, яка здійснюється гонадотропінами. Тому дію естрадіолу, так само як і дію тестостерону в організмі дорослого чоловіка слід розглядати як позитивний фактор (Cummings і ін., див. вище). Разом з тим було встановлено, що фармакокінетика тестостерону є незадовільною. Насамперед при пероральному введенні тестостерон швидко знову виводиться з організму, внаслідок чого ефективність і тривалість дії лікарських засобів на основі тестостерону також не дає задовільних результатів. Тому був синтезований цілий ряд похідних тестостерону. Подібні похідні описані, зокрема, у патенті US 5952319. Насамперед мова йде про 7α,11β-диметильні похідні 19нортестостерону, таких конкретно, як 7α,11βдиметил-17β-гідроксіестр-4-ен-3-он, 7α, 11βдиметил-17β-гептаноилоксіестр-4-ен-3-он, 7α,11βдиметил-17β-[[(2циклопентилетил)карбоніл]окси]естр-4-ен-3-он, 7α,11β-диметил-17β-(фенілацетилокси]естр-4-ен3-он і 7α,11β-диметил-17β-[[(транс-4-[нбутил]циклогексил)карбоніл]окси]естр-4-ен-3-он. Названі 7α,11β-диметильні похідні мають аналогічно до МеНТ такі ж переваги, включаючи поліпшену фармакокінетику, іншими словами, їх ефективність і тривалість дії підняті на більш високий рівень у порівнянні з тестостероном. Однак істотним недоліком цих похідних є їх синтез, який вимагає значних матеріально-технічних витрат. Одна з можливостей синтезу стероїдів мікробіологічним шляхом описана в ЕР 0900283 В1. У цій публікації вказується, що естр-4-ен-3,17-діон і канренон з використанням певного мікроорганізму, вибраного з групи, яка включає Aspergillus nigricans, Rhizopus arrhizm і штами Pestelotia, можна трансформувати у відповідний 11αгідроксіаналог. Разом з тим у вступній частині опису названої публікації дається посилання на роботу Shibahara і ін. авторів у Biochim. Biophys. Acta 202, 1970, стор.172-179, де зазначається, що здійснювана мікробіологічним шляхом реакція 11α 7 гідроксилювання стероїдів стосується реакцій, які не піддаються точному розрахунку. Виходячи з вищевикладеного, в основу даного винаходу була покладена задача одержати похідні тестостерону, які відрізнялися б несприйнятливістю до відновлення під дією 5α-редуктази, мали б поліпшену фармакокінетику і насамперед характеризувалися би простотою і легкістю їх одержання. Один із надзвичайно важливих аспектів даного винаходу полягає відповідно до цього в розробці з метою спростити одержання форпродуктів такого способу, який без проблем дозволяв би одержувати ці форпродукти. Покладена в основу даного винаходу задача вирішується за допомогою мікробіологічних способів одержання 7α-заміщених стероїдів згідно із пп.1, 3 і 6 формули винаходу, за допомогою 7α,17α-заміщених 11β-галогенстероїдів згідно із п.11 формули винаходу, способів одержання 7α,17α-заміщених 11β-галогенстероїдів згідно із пп.23, 24 і 25 формули винаходу, завдяки застосуванню цих 7α,17α-заміщених 11β-галогенстероїдів згідно із п.26 формули винаходу, завдяки фармацевтичним препаратам, які містять ці 7α,17αзаміщені 11β-галогенстероїди, згідно із п.27 формули винаходу, а також за допомогою 7αзаміщених 11β-галогенестра-1,3,5(10)-триєнів згідно із п.21 формули винаходу. Переважні варіанти здійснення винаходи представлені в залежних пунктах формули винаходу. Нижченаведені пояснення стосуються всіх розділів опису і пунктів формули винаходу, а також доданої схеми І. Всі угруповання, залишки й інші структурні одиниці можуть відповідно незалежно один від одного змінюватися у вказаних діапазонах значень. Всі алкільні, алкіленові, алкенільні, алкеніленові, алкінільні й алкініленові групи можуть мати або прямий, або розгалужений ланцюг. Так, наприклад, пропенільну групу можна представити у вигляді наступних хімічних структур: -СН=С-СН3, СН2-С=СН2 і -С(СН3)=СН2. Тим самим під поняття "С1-18алкіл" підпадають, наприклад, метил, етил, нпропіл, ізопропіл, н-бутил, ізобутил, трет-бутил, нпентил, ізопентил, трет-пентп, неопентил, нгексил, 1-метил-н-пентил, 2-метил-н-пентил, 3метил-н-пентил, 4-метил-н-пентил, 1-етил-н-бутил, 2-етил-н-бутил і т.д. Аліциклічний алкіл являє собою або циклоалкіл, або заміщений однією алкільною групою або декількома алкільними групами циклоалкіл, який приєднаний безпосередньо через циклоалкільне кільце або через одну з алкільних груп. Аналогічно до цього аліциклічний алкеніл являє собою або циклоалкеніл, або заміщений однією або декількома алкенільними групами або однією або декількома алкенільними й алкільними групами або однією або декількома алкільними групами циклоалкеніл або циклоалкіл, який приєднаний безпосередньо через циклоалкенільне кільце або через одну з алкенільних або відповідно через одну з алкільних груп, при цьому в аліциклічному алкенілі міститься принаймні один подвійний зв'язок. 89472 8 Арил може являти собою феніл, а також 1нафтил або 2-нафтил. Поняття "арил" включає в принципі також гетероарил, насамперед 2-, 3- і 4піридиніл, 2- і 3-фурил, 2- і 3-тієніл, 2- і 3-піроліл, 2-, 4- і 5-імідазоліл, піридазиніл, 2-, 4- і 5піримідиніл, а також 3- і 4-піридазиніл. Галоген являє собою фтор, хлор, бром або йод. Фармацевтично прийнятними адитивними солями служать солі відповідних сполук з неорганічними й органічними кислотами, такими як, наприклад, хлористоводнева кислота, бромистоводнева кислота, йодистоводнева кислота, оцтова кислота, лимонна кислота, щавлева кислота, винна кислота і метансульфонова кислота. Ефіри можна утворювати насамперед з янтарною кислотою. Числа, надруковані у вигляді верхнього індексу біля відповідного символу R, наприклад R13, означають його положення в стероїдному каркасі, при цьому С-атоми в цьому каркасі мають нумерацію відповідно до номенклатури ІЮПАК. Числа, надруковані у вигляді верхнього індексу біля відповідного символу С, наприклад С10, означають положення відповідного атома вуглецю в стероїдному каркасі. Мікробіологічні способи нового типу призначені для одержання 7α-заміщених 11αгідроксистероїдів загальної формули 4,В у якій R7 являє собою угруповання P-Q, де Ρ означає С1-С4алкілен, a Q означає водень, С1-С4алкіл або С1-С4фторалкіл (алкіл частково або повністю фторований), і це угруповання Р-Q через Ρ зв'язане із стероїдним каркасом, 10 13 R являє собою Н, СН3 або CF3 і R являє собою метил або етил. В одному з перших варіантів способу одержання даних сполук відповідний 7α-заміщений стероїд загальної формули 3,А у якій R7, R10 і R13 мають ті ж значення, які і вказані для сполук загальної формули 4,В, з використанням відповідного мікроорганізму, вибраного з групи, яка включає Aspergillus sp., Beauveria sp., 9 Glomerella sp., Gnomonia sp., Haplosporella sp. і Rhizopus sp., на відповідній стадії способу гідроксилюють і окислюють. Особливо переважні Aspergillus awamori, Aspergillus fischeri, Aspergillus malignus, Aspergillus niger, Beauveria bassiana, Glomerella cingulata, Gnomonia cingulata, Haplosporella hesperedica і Rhizopus stolonifer, при цьому доцільно використовувати насамперед Aspergillus awamori (CBS), Aspergillus fischeri (ATCC 1020), Aspergillus malignus (IM 16061), Aspergillus niger (ATCC 9142), Beauveria bassiana (ATCC 7159), Glomerella cingulata (CBS 15226, CBS 23849, CBS 98069, ATCC 56596, ATCC 64682, IFO 6425), Gnomonia cingulata (CBS 15226), Haplosporella hesperedica (CBS 20837) і Rhizopus stolonifer (ATCC 15441). Цей мікробіологічний спосіб можна здійснювати також за двостадійним механізмом, здійснюючи послідовно реакцію гідроксилювання і реакцію окислення. Перебіг реакції можна регулювати за рахунок її тривалості. Так, наприклад, припинивши реакцію після закінчення певного проміжку часу, можна виділяти гідроксильовані, але ще не окислені продукти. Обидві вказані стадії можна проводити тому окремо або за змішаною ферментативною реакцією. Для цього сполуку загальної формули 3,А на першій стадії мікробіологічного способу з використанням одного з мікроорганізмів, вибраного з групи, яка включає Aspergillus sp., Beauveria sp., Gibberella sp., Glomerella sp., Gnomonia sp., Metarrhizium sp., Nigrospora sp., Rhizopus sp. і Verticillium sp., гідроксилюють у положенні 11 з утворенням у результаті 7α-заміщеного стероїду з гідроксигрупою у положенні 11. Така сполука відповідає загальній формулі С 7 10 89472 10 23849, CBS 23749, ATCC 16646, ATCC 16052, IFO 6459, IFO 6425, IFO 6470, CBS 98069, IFO 7478, IFO 5257, ATCC 64682, ATCC 15470), Glomerella fusaroides (ATCC 9552), Gnomonia cingulata (CBS 15226), Metarrhizium anisopliae (IFO 5940), Nigrospora sphaerica (ATCC 12772), Rhizopus oryzae (ATCC 4858, ATCC 34102, ATCC 34102), Rhizopus stolonifer (ATCC 6227b, ATCC 15441) і Verticillium dahliae (ATCC 11405). Після завершення гідроксилювання проміжний продукт формули С на другій стадії мікробіологічного способу з використанням іншого мікроорганізму, вибраного з групи, яка включає Bacillus sp., Mycobacterium sp., Nocardia sp. і Pseudomonas sp., окислюють з утворенням у результаті 7αзаміщених 11-α-гідроксистероїдів загальної формули 4,В. Для цього використовують насамперед наступні мікроорганізми: Bacillus lactimorbus, Bacillus sphaericus, Mycobacterium neoaurum, Mycobacterium smegmatis, Nocardia corallina, Nocardia globerula, Nocardia minima, Nocardia restrictus, Nocardia rubropertincta, Nocardia salmonicolor і Pseudomonas testosteroni, найбільш переважно при цьому використовувати Bacillus lactimorbus (ATCC 245), Bacillus sphaericus (ATCC 7055), Mycobacterium neoaurum (ATCC 9626, NRRL B-3683, NRRL B-3805), Mycobacterium smegmatis (ATCC 14468), Nocardia corallina (ATCC 31338), Nocardia globerula (ATCC 9356), Nocardia minima (ATCC 19150), Nocardia restrictus (NCIB 10027), Nocardia rubropertincta (ATCC 14352), Nocardia salmonicolor (ATCC 19149) і Pseudomonas testosteroni (ATCC 11996). Згідно із ще одним варіантом способу сполуки загальної формули 4,В можна одержувати за допомогою мікробіологічної реакції з 7α-заміщених стероїдів загальної формули D 13 у якій R , R і R мають ті ж значення, які і вказані вище для сполук загальної формули 4,В. Насамперед використовують наступні мікроорганізми: Aspergillus malignus, Aspergillus melleus, Aspergillus niger, Aspergillus ochraceus, Beauveria bassiana, Gibberella fujikuroi, Gibberella zeae, Glomerella cingulata, Glomerella fusaroides, Gnomonia cingulata, Metarrhizium anisopliae, Nigrospora sphaerica, Rhizopus oryzae, Rhizopus stolonifer і Verticillium dahliae. Найбільш переважно використовувати для гідроксилювання Aspergillus malignus (IMI 16061), Aspergillus melleus (CBS), Aspergillus niger (ATCC 11394), Aspergillus ochraceus (NRRL 405, CBS 13252, ATCC 46504), Beauveria bassiana (ATCC 7159, IFO 5838, ATCC 13144, IFO 4848, CBS 11025, CBS 12736), Gibberella fujikuroi (ATCC 14842), Gibberella zeae (CBS 4474), Glomerella cingulata (ATCC 10534, CBS у якій R7, R10 і R13 мають ті ж значення, які і вказані для сполук загальної формули 4,В. Дану реакцію проводять з використанням відповідного мікроорганізму, вибраного з групи, яка включає Aspergillus sp., Beauveria sp., Curvularia sp., Gibberella sp., Glomerella sp., Gnomonia sp., Haplosporella sp., Helicostylum sp., Nigrospora sp., Rhizopus sp. і Syncephalastrum sp., при цьому стероїдний каркас гідроксилюють у положенні 11α, і в результаті утворюється 7α-заміщений 11αгідроксистероїд загальної формули 4,В. Переважні для цієї мети наступні мікроорганізми: Aspergillus alliaceus, Aspergillus awamori, Aspergillus fischeri, Aspergillus malignus, Aspergillus melleus, Aspergillus nidualans, Aspergillus niger, Aspergillus ochraceus, Aspergillus variecolor, Beauveria bassiana, Curvularia lunata, Gibberella zeae, Glomerella 11 cingulata, Glomerella fusaroides, Gnomonia cingulata, Haplosporella hesperedica, Helicostylum piriformae, Nigrospora sphaerica, Rhizopus oryzae і Syncephalastrum racemosum, насамперед при цьому використовують Aspergillus alliaceus (ATCC 10060), Aspergillus awamori (CBS), Aspergillus fischeri (ATCC 1020), Aspergillus malignus (IMI 16061), Aspergillus melleus (CBS), Aspergillus nidualans (ATCC 11267), Aspergillus niger (ATCC 9142, ATCC 11394), Aspergillus ochraceus (NRRL 405, ATCC 13252, ATCC 46504), Aspergillus variecolor (ATCC 10067), Beauveria bassiana (IFO 5838, ATCC 13144, IFO 4848, CBS 11025, CBS 12736, ATCC 7159), Curvularia lunata (ІX3), Gibberella zeae (CBS 4474), Glomerella cingulata (ATCC 10534, CBS 23849, CBS 23749, ATCC 16646, IFO 6459, IFO 6425, IFO, 6470, ATCC 15093, ATCC 10529, IFO 5257, ATCC 56596, ATCC 64682), Glomerella fusaroides (ATCC 9552), Gnomonia cingulata (CBS 15226), Haplosporella hesperedica (CBS 20837), Helicostylum piriformae (ATCC 8992), Nigrospora sphaerica (ATCC 12772), Rhizopus oryzae (ATCC 4858) і Syncephalastrum racemosum (IFO 4827). Найбільш придатними є способи, за допомогою яких одержують 7α-заміщені 11αгідроксистероїди загальної формули 4,В, де незалежно один від одного R7 являє собою СН3 і/або R10 являє собою Η і/або R13 являє собою СН3. Спосіб здійснюють за звичайною методикою. Звичайно спочатку готують стерилізований живильний розчин для штаму і потім для культивування штаму в цей живильний розчин вносять культуральний розчин, який його містить. Далі отриману таким шляхом попередню культуру переносять у ферментер, у якій завантажений також відповідний живильний розчин. Переважно після початкової стадії вирощування культури штаму у ферментер додають потім вихідну речовину, у розглянутому випадку або сполуку загальної формули 3,А, або сполуку загальної формули D, ініціюючи в такий спосіб запропоновану у винаході реакцію. Після завершення реакції суміш речовин для виділення необхідного 7α-заміщеного 11α-гідроксистероїду очищають за звичайною технологією. З отриманих таким шляхом сполук загальної формули 4,В можна синтезувати інші запропоновані у винаході сполуки за допомогою також запропонованих у винаході способів. Насамперед 7α,17α-заміщені 11β-галогенстероїди загальної формули 8,10,12 у якій U-V-W-X-Y-Z являє собою одну з циклічних 1 2 3 4 5 10 1 2 3 4 5 10 структур C -C -С -С =С -C , С -С -С -С -С =С 89472 12 1 2 3 4 5 10 або C -C -С -С -С -С , при цьому в даному випад3 ку оксогрупа (=О) зв'язана з W (=С ), або являє 1 2 3 собою циклічну структуру С =С -С =С4-С5=С6, при 3 цьому в даному випадку залишок OR зв'язаний з 3 W (=С ), R3 являє собою Н, С1-С4алкіл, С1-С4алканоїл або простий циклічний С3-С7ефір із О-атомом за3 лишку OR , 7 R являє собою угруповання P-Q, де Ρ означає С1-4алкілен, a Q означає водень, С1С4алкіл або С1-С4фторалкіл (алкіл частково або повністю фторований), і це угруповання P-Q через Ρ зв'язане із стероїдним каркасом, 10 R може знаходитися в α- або β-положенні і являє собою Н, СН3 або CF3, однак він присутній 4 5 10 лише за умови, що X-Y-Z не означає С -С =С , 11 R являє собою галоген, R13 являє собою метил або етил, 17 R являє собою Н, С1-С18алкіл, аліциклічний С1-С18алкіл, С1-С18алкеніл, аліциклічний С1-С18алкеніл, С1-С18алкініл, С1С18алкіларил, С1-С8алкіленнітрил або угруповання P-Q, де це угруповання P-Q має вказане вище значення, R17' являє собою Н, С1-С18алкіл, аліциклічний С1-С18алкіл, С1-С18алкеніл, аліциклічний С1С18алкеніл, С1-С18алкініл або С1-С18алкіларил, при цьому R17' може бути також через кетогрупу зв'язаний з 17β-оксигрупою і, крім того, R17' додатково може бути заміщений однією або декількома групами NR18R19 або однією або декількома групами SOхR20, де х означає 0, 1 або 2, a R18, R19 і R20 кожен незалежно один від одного може мати ті ж значення, які і R17, так само як і їх фармацевтично прийнятні адитивні солі, складні ефіри й аміди являють собою діючі речовини, які мають багато важливих переваг. Ці одержувані в результаті проведення інших стадій способу з 7αзаміщеного 11α-гідроксистероїду загальної формули 4,В сполуки є цінними активними речовинами з яскраво вираженою андрогенною дією, не виявляючи при їх застосуванні згаданих вище побічних ефектів. Дані сполуки придатні для одержання відповідних лікарських засобів, і насамперед ефективних контрацептивів і діючих речовин для гормонзамісної терапії (ГЗТ). 17' У випадку додаткового заміщення R групою 18 19 NR R мова може йти про метиламіно-, диметиламіно-, етиламіно-, діетиламіно-, циклогексиламіно-, дициклогексиламіно-, феніламіно-, дифеніламіно-, бензиламіно- або дибензиламіногрупу. До особливо придатних для використання в вказаних цілях 7α, 17α-заміщених 11βгалогенстероїдів загальної формули 8,10,12 належать сполуки, у яких U-V-W-X-Y-Z являє собою циклічну структуру C1-C2-С3-С4=С5-C10, С1-С2-С34 5 10 1 2 3 4 5 10 С -С =С або C =C -С =С -С =С . 1 У першому випадку (U-V-W-X-Y-Z означає C C2-С3-С4=С5-C10) мова йде про стероїди загальної формули 10 13 В другому випадку (U-V-W-X-Y-Z означає C13 4 5 10 C -С -С -С =C ) мова йде про стероїди загальної формули 12 2 Сполуки загальних формул 10 і 12 являють собою сполуки з андрогенною дією. У третьому випадку (U-V-W-X-Y-Z означає C1=C2-С3=С4-С5=C10) мова йде про стероїди загальної формули 8 Як галодегідроксилюючі реагенти можуть розглядатися всі сполуки, які звичайно використовуються для цього, наприклад фтористо-, хлористо-, бромисто- або йодистоводнева кислота, тіонілхлорид або тіонілбромід, пентахлорид фосфору, оксихлорид фосфору, N-хлорсукцинімід, трифенілфосфін/тетрахлорметан, HF/піридин або трифторид діетиламіносірки або переважно нонафлілфторид/1,5-діазабіцикло[5.4.0]ундецен. 89472 14 Ці сполуки являють собою естрогени (сполуки з афінністю до естрогенних рецепторів). В усіх трьох випадках залишки R3, R7, R10, R11, 13 17 17 R , R і R мають ті ж значення, що й відповідні залишки в загальній формулі 8, 10, 12. Переважно незалежно один від одного R1 яв7 11 ляє собою Η і/або R являє собою СН3 і/або R 13 являє собою фтор і/або R являє собою СН3 і/або 17 R являє собою Н, СН3, С1-С18алкініл, насамперед етиніл, CН2CN або CF3 і/або R17' являє собою Н. До особливо придатних для використання запропонованих у винаході 7α,17α-заміщених 11βгалогенстероїдів загальної формули 8,10,12 належать наступні сполуки: 17α-етиніл-11β-фтор-17β-гідрокси-7αметилестр-4-ен-3-он (формула 10), 17α-етиніл-11β-фтор-17β-гідрокси-7αметилестр-5(10)-ен-3-он (формула 12), 17α-етиніл-11β-фтор-7α-метилестра-1,3,5(10)триєн-3,17β-діол (формула 8). Ці сполуки можна синтезувати наступним шляхом: Для одержання 7α,17α-заміщених 11βгалогенстероїдів загальної формули 10, де U-V-WX-Y-Z являє собою циклічну структуру C1-C2-С3С4=С5-C10, як вихідні речовини використовують одержувані за допомогою мікробіологічного способу за винаходом 7α-заміщені 11α-гідроксистероїди загальної формули 4,В. На першій стадії синтезу отримані в такий спосіб 7α-заміщені 11α-гідроксистероїди за допомогою нуклеофільного заміщення галодегідроксилюючим реагентом перетворюють у відповідні 7αзаміщені 11β-галогенстероїди формули 5: Із сполуки формули 5 можна потім шляхом селективного алкілування біля атома С17 каркаса одержувати сполуку формули 10 (див. схему І). Для селективного алкілування можуть використовуватися звичайні алкілувальні реагенти, наприклад сполуки Гриньяра і металоорганічні сполуки, насамперед алкіллітієві сполуки. Так, наприклад, для одержання відповідного 17α-етиніл-17βгідроксіестр-4-ен-3-ону з естр-4-ен-3,17-діону як 15 89472 алкілувального реагенту можна використовувати етинілмагнійбромід. Для одержання 7α,17α-заміщених 11βгалогенстероїдів, у яких U-V-W-X-Y-Z являє собою циклічну структуру С1-С2-С3-С4-С5=С10 і які відповідають загальній формулі 12, використовують і ізомеризують сполуки загальної формули 10, у ре4 зультаті чого подвійний зв'язок Δ ізомеризується в 5(10) подвійний зв'язок Δ . Для захисту 3-кетогрупи спочатку утворюють простий циклічний ефір у положенні 3. Потім подвійний зв'язок Δ4 ізомеризу5(10) ють у подвійний зв'язок Δ з утворенням при цьому 7α,17α-заміщеного 11β-галогенстероїду загальної формули 12, після чого захисну групу знову відщеплюють. При одержанні інших 7α,17α-заміщених 11βгалогенстероїдів загальної формули 8, де U-V-WX-Y-Z являє собою циклічну структуру С1=С23 4 5 10 С =С -С =С , працюють у такий спосіб: Спочатку, як вже описувалося вище, з отриманого в результаті мікробіологічного гідроксилювання й окислення 7α-заміщеного 11αгідроксистероїду загальної формули 4,В шляхом галодегідроксилювання за реакцією нуклеофільного заміщення утворюють відповідний 11βгалогенстероїд загальної формули 5. Потім з цього 11β-галогенстероїду шляхом окислення, наприклад сіллю міді(ІІ), утворюють 7αзаміщений естра-1,3,5(10)-триєн загальної формули 6 3 7 11 13 у якій R , R , R і R мають вказані вище зна3 чення. Якщо R являє собою Н, то ці сполуки можна синтезувати безпосередньо. Якщо ж R3 має значення, відмінне від Н, то після утворення шляхом окислення 1,3,5(10)-триєнового кільця необхідно за звичайною методикою утворювати відповідні прості і складні ефіри. 7α-заміщені 11β-галогенестра-1,3,5(10)-триєни загальної формули 6, так само як і їх фармацевтично прийнятні адитивні солі, складні ефіри й аміди є новими і включені тому в обсяг даного винаходу як проміжні продукти, які використовують при синтезі також запропонованих у винаході 7α,17αзаміщених 11β-галогенстероїдів загальної формули 8. Одним з особливо переважних 7α-заміщених 11β-галогенестра-1,3,5(10)-триєнів загальної формули 6 є 11β-фтор-3-гідрокси-7α-метилестра1,3,5(10)-триєн-17-он. З 7α-заміщеного 11β-галогенестра-1,3,5(10)триєну загальної формули 6 аналогічно до описаного вище синтезу сполуки загальної формули 10 17 шляхом селективного алкілування біля атома С каркаса можна утворювати запропонований у ви 16 наході 7α,17α-заміщений 11β-галогенстероїд загальної формули 8. Крім того, з отриманих у результаті мікробіологічного гідроксилювання й окислення з 7αзаміщених стероїдів загальної формули 3,А або D речовин загальної формули 4,В можуть бути отримані також 7α-заміщені 11β-галогенстероїди загальної формули 9, які мають андрогенну дію: у якій R7, R11 і R13 мають вказані вище значення. Однією з особливо переважних сполук є 11βфтор-17β-гідрокси-7α-метилестр-4-ен-3-он. Сполуки загальної формули 9, так само як і їх фармацевтично прийнятні адитивні солі, складні ефіри й аміди також мають андрогенну дію. Для одержання сполук загальної формули 9 естр-4-ен-3,17-діон формули 5 відновлюють до 17β-гідроксіестр-4-ен-3-ону формули 9, наприклад за допомогою відповідного борогідриду. Сполуки загальної формули 9 можна перетворювати, крім того, у відповідні 7α-заміщені 11βгалогенестра-5(10)-ени формули 7 10 11 13 у якій R , R , R і R мають ті ж значення, які і вказані в загальній формулі 8,10,12. З цією метою сполуки загальної формули 9 ізомеризують за рахунок зсуву подвійного зв'язку Δ4 у подвійний зв'я5(10) зок Δ . Для захисту 3-кетогрупи спочатку утворюють простий циклічний ефір у положенні 3. Потім подвійний зв'язок Δ4 ізомеризують у подвій5(10) ний зв'язок Δ з утворенням при цьому вищевказаного 7α-заміщеного 11β-галогенстероїду, після чого захисну групу знову відщеплюють. Ще вона можливість одержання відповідних 7α-заміщених 11β-галогенестра-5(10)-енів формули у якій R7, R10, R11 і R13 мають ті ж значення, які і вказані в загальній формулі 8,10,12, полягає в 17 тому, що їх утворюють зі сполук загальної форму4 ли 5 за рахунок ізомеризації подвійного зв'язку Δ 5(10) у подвійний зв'язок Δ . З цією метою сполуки загальної формули 5 ізомеризують за рахунок зсуву подвійного зв'язку Δ4 у подвійний зв'язок Δ5(10). Для захисту 3-кетогрупи спочатку утворюють простий циклічний ефір у положенні 3. Потім подвійний 4 5(10) зв'язок Δ ізомеризують у подвійний зв'язок Δ з утворенням при цьому вищевказаного 7αзаміщеного 11β-галогенстероїду, після чого захисну групу знову відщеплюють. Усі названі сполуки можна також етерифікувати далі з утворенням складних або простих ефірів, але тільки за наявності відповідних гідроксигруп у положенні 3 або 17β. Так, наприклад, сполуку формули 9 можна перетворювати у відповідний простий 17β-ефір або складний 17β-ефір. Однією із переважних сполук даної групи є 11β-фтор-17β-(4сульфамоїлбензокси)-7α-метилестр-4-ен-3-он. Як замісники біля атома кисню оксигрупи при С17 придатні в принципі такі ж залишки, що вказані для 17' R . Насамперед 7α,17α-заміщені 11βгалогенстероїди загальної формули 8,10,12 придатні для одержання відповідних лікарських засобів. З урахуванням цього даний винахід стосується також застосування названих сполук загальної формули 8,10,12 для одержання відповідних лікарських засобів, так само як і фармацевтичних препаратів, які містять принаймні одну з вказаних сполук загальної формули 8,10,12 і принаймні один фармацевтично прийнятний носій. Запропоновані у винаході 7α,17α-заміщені 11β-галогенстероїди загальної формули 10,12 являють собою сполуки з яскраво вираженою андрогенною дією, не виявляючи при їх застосуванні вказаних вище побічних ефектів, таких, наприклад, як стимуляція передміхурової залози (насамперед ніякої доброякісної гіперплазії простати). До переваг сполук слід віднести і їх простий у здійсненні синтез. Як було встановлено, запропоновані у винаході сполуки загальної формули 10 або 12 можуть застосовуватися не тільки для ГЗТ чоловіків вони придатні також без додаткового введення в організм яких-небудь інших діючих речовин як ефективні чоловічі контрацептиви при відповідно підібраному дозуванні з метою необхідного зниження рівня змісту в крові ЛГ, тестостерону який виробляється в організмі, і ФСГ (фолікулостимулювального гормону). Це пояснюється здатністю запропонованих у винаході 11β-галогенстероїдів інгібувати надлишкову активацію ("висипання") ЛГ і ФСГ. ЛГ стимулює клітини Лейдига таким чином, що вони секретують тестостерон. Якщо вміст ЛГ у крові підтримувати на низькому рівні, то при цьому знижується також виділення в організмі тестостерону. Тестостерон використовується для сперматогенезу, тоді як ФСГ стимулює зародкові клітини. Тому для ефективного сперматогенезу потрібен досить високий рівень змісту ФСГ і ЛГ у крові, при цьому досить високий рівень змісту ЛГ у крові обумовлює необхідну для сперматогенезу надлишкову активацію тестостерону. Оскільки використання для стерилізації тільки одних 7α,17α-заміщених 11β-галогенстероїдів без 89472 18 додавання яких-небудь додаткових діючих речовин уже може привести до ефективної чоловічої контрацепції, це дозволить не тільки істотно спростити введення відповідного лікарського засобу, призначеного для цих цілей, але і значно знизити витрати, зв'язані з його застосуванням. Для контролю чоловічої фертильності запропоновані у винаході 7α, 17α-заміщені 11βгалогенстероїди можуть застосовуватися також у комбінації з гестагеном. Крім цього запропоновані у винаході 7α,17αзаміщені 11β-галогенстероїди ефективно інгібують 5α-редуктазу і стероїд-11-гідроксилазу [CYP11B (Р450с11) G. Zhang, W.L. Miller, Journal of Clinical Endocrinology and Metabolism, том 81, 1996, стор.3254-3256], завдяки чому вдається, наприклад, вибірним шляхом уникнути стимулюючого впливу на передміхурову залозу, і сполуки виявляють поліпшену фармакокінетику. Інгібування 11гідроксилази приводить до зменшення ступеня дезактивації сполук, які мають андрогенну дію, і зниження їх виділення з організму людини. Завдяки цьому підвищуються ефективність і тривалість дії даних сполук у порівнянні з відомими сполуками, насамперед при пероральному застосуванні. Вищезгадані властивості дозволяють застосовувати запропоновані у винаході сполуки насамперед для контролю репродуктивної здатності чоловіків, так само як і для андрогензамісної терапії зі зниженою схильністю до відновлення 5αредуктази при ароматизації, що одночасно зберігається, з утворенням естроген них стероїдів і позитивному впливі на сироваткові ліпіди і центральну нервову систему. Андрогенна дія і відсутність, як було попередньо встановлене, вищезгаданих побічних ефектів досліджували в дослідах на сім'яних пухирцях з використанням запропонованих у винаході сполук загальних формул 10 і 12. Ефективність же запропонованих у винаході сполук загальної формули 8 тестували в досліді на естрогенну дію, яку ці сполуки виявляють на ріст матки. Запропоновані у винаході 7α,17α-заміщені 11β-галогенстероїди загальної формули 10 або 12, так само як і запропоновані у винаході фармацевтичні препарати, які містять ці сполуки, придатні для винятково успішного лікування чоловіків, які не страждають від безплідності, а також в принципі для лікування самців ссавців. Застосування з метою чоловічої контрацепції приводить лише до тимчасової втрати чоловіками репродуктивної здатності. Після завершення прийому діючих речовин за винаходом, відповідно фармацевтичних препаратів первинний стан відновлюється, тобто до чоловіка повертається репродуктивна здатність і сперматогенез здійснюється в тому ж обсязі, що і раніше. Для досягнення тимчасової стерильності і підтримання її на постійному рівні протягом необхідного проміжку часу діючу речовину, відповідно препарат необхідно вводити в організм постійно, без перерв, причому залежно від форми застосування їх слід призначати щодня, а в інших випадках передбачити періодичне повторення через певні короткі або ж тривалі проміжки часу. Після однократного або багаторазового введення діючої 19 речовини або препарату відновлення первинного "не стерильного" стану чоловіка не обов'язково відбувається відразу, воно може відновлюватися поступово, для чого буде потрібно певний період часу, який залежить від різних факторів, таких, наприклад, як дозування, особливості конституції людини й одночасний прийом інших лікарських засобів. Якщо метою застосування є контрацепція, то дозування 7α, 17α-заміщених 11β-галогенстероїдів слід вибирати настільки високою, щоб вміст ЛГ і ФСГ у крові становив відповідно максимум 2,5МО/мл, насамперед максимум 1,0МО/мл, а вміст тестостерону становив максимум 10нмолів/л, насамперед максимум 3нмоля/л. Якщо запропоновані у винаході 7α,17αзаміщені 11β-галогенстероїди передбачається застосовувати для ГЗТ без досягнення при цьому контрацепції, то дозування слід вибирати більш низьким. У цьому випадку прагнуть досягти такого рівня діючих речовин, який забезпечує вміст ЛГ і ФСГ у крові відповідно вище 2,5МО/мл, а вміст тестостерону вище 10нмолів/л. Дозування запропонованих у винаході 7α,17αзаміщених 11β-галогенстероїдів загальної формули 10 або 12, необхідне для регуляції рівня вмісту в крові ЛГ, ФСГ і тестостерону, залежить від багатьох факторів і повинне визначатися тому, виходячи зі специфіки застосування. У першу чергу дозування залежить, як очевидно, від виду терапії. Якщо сполуки передбачається застосовувати для чоловічої контрацепції, то їх необхідно призначати в істотно більш високих дозах, ніж при використанні для ГЗТ. Дозування визначається далі типом 7α,17α-заміщеного 11β-галогенстероїду і його біодоступністю. Специфіка застосування вкрай важлива також для вибору кількості сполуки, яка вводиться. Крім того, дозування залежить від конституції людини і від інших факторів, таких, наприклад, як необхідність враховувати можливий рівнобіжний прийом інших лікарських засобів. Сполуки можуть призначатися для перорального і парентерального введення, наприклад інтраперитонеального, внутрішньовенного, внутрішньом'язового або черезшкірного. Сполуки можна також імплантувати у тканину. Кількість сполук, яка призначається для введення в організм, може змінюватися в широких межах з урахуванням ефективності цієї кількості. Вона може змінюватися в широких межах також залежно від стану, який підлягає лікуванню, і від методики введення. Добова доза для людини становить від 0,1 до 100мг. Переважна добова доза для людини становить від 0,1 до 10мг. Тривалість застосування відповідної сполуки визначається кінцевою метою. Для практичного застосування можуть призначатися капсули, пілюлі, таблетки, драже, креми, мазі, примочки, рідини, наприклад сиропи, гелі, ін'єковані рідини, наприклад для інтраперитонеальної, внутрішньовенної, внутрішньом'язової або черезшкірної ін'єкції, і т.п., при цьому окремі лікарські форми вивільняють сполуки за винаходом залежності від їх типу або поступово вивільняють усю кількість через короткий проміжок часу. 89472 20 Для перорального введення застосовують капсули, пігулки, таблетки, драже і рідини або якінебудь інші пероральні лікарські форми як фармацевтичні препарати. У цих випадках подібні лікарські засоби можна виготовляти таким чином, щоб забезпечити вивільнення ними діючих речовин або через короткий проміжок часу, або забезпечити ефект депо, що дозволить діючій речовині надходити в організм поступово, з уповільненням (пролонгована дія). Уніфіковані дози разом з 7α,17αзаміщеним 11β-галогенстероїдом можуть містити один або декілька фармацевтично прийнятних носіїв, наприклад речовини для регуляції реологічних властивостей лікарського засобу, поверхнево-активні речовини, гідротропні солюбілізатори, мікрокапсули, мікрочастинки, грануляти, розріджувачі, в'яжучі, такі як крохмаль, цукор, сорбіт і желатин, а також наповнювачі, такі як кремнієва кислота і тальк, мастила, барвники, ароматизатори й інші речовини. Запропоновані у винаході 7α,17α-заміщені 11β-галогенстероїди можуть бути представлені також у вигляді розчину, призначеного для перорального застосування й який містить разом з активним 11β-галогенстероїдом як інші компоненти фармацевтично прийнятну олію і/або фармацевтично прийнятну ліпофільну, поверхнево-активну речовину і/або фармацевтично прийнятну гідрофільну, поверхнево-активну речовину і/або фармацевтично прийнятний розчинник, який змішується з водою. У цьому відношенні можна послатися, крім того, на заявку WO 97/21440. Для досягнення переважної біодоступності стероїду сполуки можна використовувати для одержання циклодекстринових клатратів. З цією метою сполуки піддають взаємодії з α-, β- або yциклодекстрином або з їх похідними. Якщо передбачається використовувати креми, мазі, примочки й інші призначені для зовнішнього застосування рідини, то дані лікарські засоби слід формувати таким чином, щоб забезпечити для сполук за винаходом можливість надходження в організм у достатній кількості. До складу таких лікарських форм входять певні допоміжні речовини, наприклад речовини для регуляції реологічних властивостей, поверхнево-активні речовини, консерванти, гідротропні солюбілізатори, розріджувачі, речовини для підвищення здатності запропонованих у винаході стероїдів проникати через шкіру, барвники, ароматизатори і засобу захисту шкіри, такі як кондиціонери і регулятори вологості. До складу лікарського засобу разом зі стероїдами за винаходом можуть входити й інші діючі речовини. Для парентерального введення діючі речовини можна розчиняти або суспендувати у відповідному фізіологічно сумісному розріджувачі. Як розріджувачі в багатьох випадках використовують олії з додаванням або без додавання гідротропного солюбілізатора, поверхнево-активної речовини, суспендувального або емульгувального агента. Як приклад використовуваних у вказаних цілях олій можна назвати маслинову олія, арахісову олія, бавовняну олія, соєву олія, рицинову олія і кунжутну олія. Для приготування ін'єкованого препарату може використовуватися будь-який рідкий носій, у 21 89472 22 якому запропоновані у винаході сполуки знаходяться в розчиненому або емульгованому вигляді. Подібні рідини містять часто також речовини для регулювання в'язкості, поверхнево-активні речовини, консерванти, гідротропні солюбілізатори, розріджувачі й інші добавки, за допомогою яких розчину надають ізотонічність. Разом з 7α,17αзаміщеними 11β-галогенстероїдами в організм можуть вводитися також інші діючі речовини. Запропоновані у винаході 11β-галогенстероїди можуть застосовуватися у вигляді ін'єкції або імплантованого препарату, наприклад підшкірно, які можна формувати таким чином, щоб забезпечити поступове, уповільнене вивільнення діючої речовини. Для цього можуть використовуватися відомі технології, наприклад, депо-форми, які розчиняються або мають мембрану. Імплантати можуть містити як інертні матеріали, наприклад, полімери, які біологічно розкладаються, або синтетичні силікони, наприклад силіконовий каучук. При черезшкірному введенні запропоновані у винаході 11βгалогенстероїди можна занурювати, наприклад, у пластир. Нижче винахід більш докладно пояснюється на прикладах. А. Мікробіологічний синтез 11α-гідрокси-7α-метилестр-4-ен-3,17-діон (сполука 4,В) Приклад 1 У 2-літрову колбу Ерленмейера після завантаження в неї 1000мл стерилізованого протягом 30хв. при 121°С в автоклаві живильного розчину, який містить 3мас.% глюкози, 1мас.% рідини, отриманої після замочування зерен кукурудзи до набрякання, 0,2мас.% NaNO3, 0,1мас.% KН2РО4, 0,2мас.% K2НРО4, 0,05мас.% KСl, 0,05мас.% MgSO4· 7Н2О і 0,002мас.% FeSO4·7H2O (рН6,0), вносили інокулят культури штаму Gnomonia cingulata, вирощеного на скошеному агарі (CBS 15226), і протягом 72год. при 28°С струшували на ротаційному шейкері при 165об./хв. Потім цю попередню культуру вносили в 20-літровий ферментер, який містив 19л стерильного середовища такого ж кінцевого складу, що й описаний вище для попередньої культури. Крім того, перед стерилізацією для пригнічення піноутворення додавали ще 1,0мл силіконового масла і 1,0мл Synperonic (еток силат кетоспирту). Після завершення початкової фази росту, яка продовжувалася протягом 12год. при підвищеному тиску 0,7 бара, температурі 28°С, аерації з витратою 20л/хв. і швидкості перемішування 250об./хв., додавали розчин 4,0г 17βгідрокси-7α-метилестр-4-ен-3-ону в 40мл ДМФ. Далі продовжували перемішування й аерацію. Через 135год. культуральний бульйон збирали і протягом 12год. екстрагували 10л метилізобутилкетону і протягом 5год. 5л метилізобутилкетону. Об'єднані органічні фази концентрували досуха. Силіконове масло видаляли шляхом промивання гексаном. Після хроматографії на силікагелі з використанням градієнта розчинників гексан/етилацетат виділили 1,64г (39%) 11α-гідрокси7α-метилестр-4-ен-3,17-діону. Приклад 2 23 89472 24 У 2-літрову колбу Ерленмейера після завантаження в неї 1000мл стерилізованого протягом 30хв. при 121°С в автоклаві живильного розчину, який містить 3мас.% глюкози, 1мас.% рідини, отриманої після замочування зерен кукурудзи до набрякання, 0,2мас.% NaNO3, 0,1мас.% KН2РО4, 0,2мас.% K2НРО4, 0,05мас.% KСl, 0,05мас.% MgSO4·7Н2О і 0,002мас.% FeSO4·7H2O (рН6,0), вносили інокулят культури штаму Glomerella cingulata (IFO 6425), вирощеної на скошеному агарі, і протягом 72год. при 28°С струшували на ротаційному шейкере при 165об./хв. Потім цю попередню культуру вносили в 20-літровий ферментер, який містив 19л стерильного середовища такого ж кінцевого складу, що й описаний вище для попередньої культури. Крім того, перед стерилізацією для пригнічення піноутворення додавали ще 1,0мл силіконового масла і 1,0мл Synperonic (етоксилат кетоспирту). Після завершення початкової фази росту, яка продовжувалася протягом 12год. при підвищеному тиску 0,7 бара, температурі 28°С, аерації з витратою 20л/хв. і швидкості перемішування 350об./хв., додавали розчин 2,0г 17βгідрокси-7α-метилестр-4-ен-3-ону в 30мл ДМФ. Далі продовжували перемішування й аерацію. Через 19год. культуральний бульйон збирали і протягом 16год. екстрагували 20л метилізобутилкетону і протягом 23год. 20л метилізобутилкетону. Об'єднані органічні фази концентрували досуха. Залишок практично цілком розчиняли в метанолі. Силіконове масло відфільтровували. Потім концентрували і після хроматографії на силікагелі з використанням градієнта розчинників дихлорметан/ацетон виділили 1,55г (73%) 11α,17βдигідрокси-7α-метилестр-4-ен-3-ону. Після перекристалізації з ацетону/діізопропілового ефіру виді лили 827мг (39%) білих кристалів з температурою плавлення 163°С і [α]D=-16° (СНСl3, с=0,501). У 2-літрову колбу Ерленмейера після завантаження в неї 500мл стерилізованого протягом 30хв. при 121°С в автоклаві живильного розчину, який містить 0,5мас.% глюкози, 0,5мас.% бактодріжджового екстракту, 0,1мас.% пептону і 0,2мас.% рідини, отриманої після замочування зерен кукурудзи до набрякання (рН7,5), вносили чотири отриманих кріогенним шляхом кульки культури штаму Bacillus sphaericus (ATCC 7055) і протягом 24год. при 28°С струшували на ротаційному шейкері при 165об./хв. Потім цю попередню культуру вносили в чотири 2-літрові колби Ерленмейера, які містили 500мл стерильного середовища такого ж складу, що й описаний вище для попередньої культури, при цьому в кожну колбу інокулювали по 10% культурального бульйону. Після завершення початкової фази росту, яка продовжувалася протягом 4год. при температурі 28°С с використанням ротаційного шейкера при 165об./хв., у кожну з чотирьох колб додавали 50мг 11α,17β-дигідрокси-7αметилестр-4-ен-3-ону в 2,5мл ДМФ. Струшування продовжували ще протягом 48год. Об'єднані культуральні бульйони двічі екстрагували 2л метилізобутилкетону. Об'єднані органічні фази сушили над сульфатом натрію і концентрували досуха. При цьому одержали 630мг маслянистогокристалічного залишку. Після перекристалізації з ацетону/діізопропілового ефіру виділили 103мг (49,2%) жовтуватих кристалів з температурою плавлення 189°С і [α]D=+40,4° (CHCI3, с=0,529) (безпосередня кристалізація, без попереднього хроматографічного очищення). Приклад 3 У 2-літрову колбу Ерленмейера після завантаження в неї 500мл стерилізованого протягом 30хв. при 121°С в автоклаві живильного розчину, який містить 3мас.% глюкози, 1мас.% рідини, отриманої після замочування зерен кукурудзи до набрякання, 0,2мас.% NaNO3, 0,1мас.% KН2РО4, 0,2мас.% K2НРО4, 0,05мас.% KСl, 0,05мас.% MgSO4·7H2O і 0,002мас.% FeSO4·7H2O (рН 6,0), вносили половину інокулята культури штаму Aspergillus ochraceus (CBS 13252), вирощеного на скошеному агарі, і протягом 72год. при 28°С струшували на ротаційному шейкері при 165об./хв. Потім цю попередню культуру вносили в 10літровий ферментер, який містив 9,5л стерильного середовища такого ж кінцевого складу, що й описаний вище для попередньої культури. Крім того, перед стерилізацією для пригнічення ціноутворен ня додавали ще 0,5мл силіконового масла і 0,5мл Synperonic (етоксилат кетоспирту). Після завершення початкової фази росту, яка продовжувалася протягом 6год. при підвищеному тиску 0,7 бара, температурі 28°С, аерації з витратою 5л/хв. і швидкості перемішування 350об./хв., додавали розчин 1,0г 7α-метилестр-4-ен-3,17-діону в 15мл ДМФ. Далі продовжували перемішування й аерацію. Через 22год. культуральний бульйон збирали і двічі протягом 4год. екстрагували 7л метилізобутилкетону. Об'єднані органічні фази концентрували досуха. Залишок практично повністю розчиняли в метанолі. Силіконове масло відфільтровували. Потім концентрували і після хроматографії на силікагелі з використанням градієнта розчинників дихлорметан/ацетон виділили 0,78г (74%) 11αгідрокси-7α-метилестр-4-ен-3,17-діону. Після пере 25 кристалізації з ацетону/діізопропілового ефіру виділили 311мг (29,6%) білих кристалів з температурою плавлення 200°С і [α]D=+52° (СНСІ3, с=0,5905). Б. Хімічний спосіб одержання Приклад 4: Одержання 11β-фтор-17β-гідрокси7α-метилестр-4-ен-3-ону А) 11β-фтор-7α-метилестр-4-ен-3,17-діон До розчину 13,08г 11α-гідрокси-7α-метилестр4-ен-3,17-діону (отриманого запропонованим у винаході мікробіологічним синтезом [розділ А]) у 250мл толуолу і 18,2мл 1,8діазабіцикло[5,4,0]ундец-7-ену при 0°С додавали по краплях 11,5мл фторангідриду перфторбутан-1сульфонової кислоти. Через 1год. нейтралізували 2-молярною соляною кислотою, зливали на воду, чотири рази екстрагували етилацетатом, промивали насиченим розчином хлориду натрію, сушили і концентрували у вакуумі. Після хроматографії сирого продукту на силікагелі з використанням градієнта розчинників гексан/етилацетат одержали 8,7г 11β-фтор-7α-метилестр-4-ен-3,17-діону. Температура плавлення 101,4°С, [α]D=+135,8° (СНСІ3). б) 11β-фтор-17β-гідрокси-7α-метилестр-4-ен-3он Розчин 8,7г 11β-фтор-7α-метилестр-4-ен-3,17діону в 148мл тетрагідрофурану по краплях змішували при 0°С с 29,5мл 1-молярного алюмотритрет-бутоксигідриду літію і протягом 5,5год. перемішували при 0°С. Потім при 0°С додавали розведену сірчану кислоту, після чого реакційний розчин зливали на суміш льоду і води, тричі екстрагували етилацетатом, промивали до нейтрального стану, сушили над сульфатом натрію, концентрували у вакуумі і хроматографували на силікагелі з використанням гексану/етилацетату. У результаті одержали 5,8г 11β-фтор-17β-гідрокси-7α-метилестр-4ен-3-ону з температурою плавлення 143-144°С, [α]D=+89,9° (СHCI3). Приклад 5: Одержання 11β-фтор-17β-(4сульфамоїлбензокси)-7α-метилестр-4-ен-3-ону Розчин 500мг 11β-фтор-17β-гідрокси-7αметилестр-4-ен-3-ону в 7,5мл піридину змішували при кімнатній температурі з 750мг 4сульфамоїлбензойної кислоти, 800мг Ν,Νдициклогексилкарбодііміду і 125мг птолуолсульфонової кислоти і перемішували протягом 8,5год. Потім суміш зливали в розчин гідрокарбонату натрію, чотири рази екстрагували дихлорметаном, промивали до нейтрального стану, сушили над сульфатом натрію, концентрували у вакуумі і хроматографували на силікагелі з використанням дихлорметану/ацетону. У результаті одержали 302мг 11β-фтор-17β-(4сульфамоїлбензокси)-7α-метилестр-4-ен-3-ону з температурою плавлення 232°С, [α]D=+100,5° (СНСl3). Приклад 6: Одержання 17α-етиніл-11β-фтор17β-гідрокси-7α-метилестр-4-ен-3-ону а) 11β-фтор-3-метокси-7α-метилестра-3.,5диен-17-он Розчин 2г 11β-фтор-7α-метилестр-4-ен-3,17діону в 20мл 2,2-диметоксипропану перемішували разом з 200мг тозилату піридинію протягом 6,5год. при 80°С. Потім розбавляли етилацетатом, про 89472 26 мивали розчином гідрокарбонату натрію і хлориду натрію, сушили над сульфатом натрію і концентрували у вакуумі. Таким шляхом одержали 2г сирого 11β-фтор-3-метокси-7α-метилестра-3,5-диен17-ону. б) 17α-етиніл-11β-фтор-17β-гідрокси-7αметилестр-4-ен-3-он Розчин 9,17г хлориду церію(ІІІ) у 60мл тетрагідрофурану по краплях змішували при 0°С с 74,2мл розчину етинілмагнійброміду (0,5-молярний розчин у тетрагідрофурані) і протягом 1год. перемішували при 0°С. Потім по краплях додавали розчин 2г сирого 11β-фтор-3-метокси-7α-метилестра3,5-диен-17-ону в 40мл тетрагідрофурану і перемішування продовжували ще протягом 3,5год. при 0°С. Для наступної переробки додавали насичений розчин хлориду амонію, зливали на воду, тричі екстрагували етилацетатом, промивали напівконцентрованою соляною кислотою, розчином гідрокарбонату натрію і хлориду натрію, сушили над сульфатом натрію, концентрували у вакуумі і хроматографували на силікагелі з використанням гексану/етилацетату. У результаті одержали 1,15г чистого 17α-етиніл-11β-фтор-17β-гідрокси-7αметилестр-4-ен-3-ону з температурою плавлення 218-220°С, [α]D=+19,2° (СНСІ3). Приклад 7: Одержання 17α-етиніл-11β-фтор17β-гідрокси-7α-метилестр-5(10)-ен-3-ону а) 3,3-етандіілдіокси-17α-етиніл-11β-фтор-7αметилестр-5(10)-ен-17β-ол Розчин 700мг 17α-етиніл-11β-фтор-17βгідрокси-7α-метилестр-4-ен-3-ону в 7мл дихлорметану і 4,7мл етиленгліколю перемішували разом з 2,3мл триметилортоформіату і 30мг гідрату птолуолсульфонової кислоти протягом 6,5год. при кімнатній температурі. Потім суміш зливали в розчин гідрокарбонату натрію, тричі екстрагували етилацетатом, промивали до нейтрального стану, сушили над сульфатом натрію, концентрували у вакуумі і хроматографували на силікагелі з використанням гексану/етилацетату. Таким шляхом одержали 205мг 3,3-етандіілдіокси-17α-етиніл-11βфтор-7α-метилестр-5(10)-ен-17β-олу. б) 17α-етиніл-11β-фтор-17β-гідрокси-7αметилестр-5(10)-ен-3-он Розчин 205мг 3,3-етандіілдіокси-17α-етиніл11β-фтор-7α-метилестр-5(10)-ен-17β-олу в 27мл метанолу і 3,6мл води перемішували разом з 361мг щавлевої кислоти протягом 24год. при кімнатній температурі. Потім суміш зливали в розчин гідрокарбонату натрію, тричі екстрагували етилацетатом, промивали до нейтрального стану, сушили над сульфатом натрію, концентрували у вакуумі і хроматографували на силікагелі з використанням гексану/етилацетату. У результаті одержали 95мг 17α-етиніл-11β-фтор-17β-гідрокси7α-метилестр-5(10)-ен-3-ону з температурою плавлення 112-114°С. Приклад 8: Одержання 17α-етиніл-11β-фтор7α-металестра-1,3,5(10)-триєн-3,17β-діолу а) 11β-фтор-3-гідрокси-7α-метилестра1,3,5(10)-триєн-17-он Розчин 500мг 11β-фтор-7α-метилестр-4-ен3,17-діону в 16,5мл ацетонітрилу перемішували разом з 400мг броміду міді (II) протягом 6,5год. при 27 89472 25°С. Потім розбавляли етилацетатом, промивали розчином гідрокарбонату натрію і хлориду натрію, сушили над сульфатом натрію, концентрували у вакуумі і хроматографували на силікагелі з використанням гексану/ацетону. Таким шляхом одержали 280мг чистого 11β-фтор-3-гідрокси-7αметилестра-1,3,5(10)-триєн-17-ону з температурою плавлення 185-186°С. б) 17α-етиніл-11β-фтор-7α-метилестра1,3,5(10)-триєн-3,17β-діол Суспензію 2,03г хлориду церію(ІІІ) у 7,5мл тетрагідрофурану по краплях змішували при 0°С с 16,5мл розчину етинілмагнійброміду (0,5молярного в тетрагідрофурані) і протягом 0,5год. Комп’ютерна верстка Т. Чепелева 28 перемішували при 0°С. Потім по краплях додавали розчин 280мг 11β-фтор-3-гідрокси-7α-метилестра1,3,5(10)-триєн-17-ону в 2,8мл тетрагідрофурану і перемішування продовжували ще протягом 3,5год. при 0°С. Для наступної переробки додавали насичений розчин хлориду амонію, потім зливали на воду, чотири рази екстрагували етилацетатом, промивали до нейтрального стану, сушили над сульфатом натрію, концентрували у вакуумі і хроматографували на силікагелі з використанням гексану/етилацетату. У результаті одержали 220мг 17α-етиніл-11β-фтор-7α-метилестра-1,3,5(10)триєн-3,17β-діолу з температурою плавлення 115117°С. Підписне Тираж 28 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюMicrobiological method for the production of 7 alpha-substituted 11 alpha-hydroxysteroids
Автори англійськоюZorn Ludwig, Bohlmann Rolf, Gallus Norbert, Kuenzer Hermann, Muhn Hans-Peter, Nubbemeyer Reinhard
Назва патенту російськоюМикробиологические способы получения 7a-замещенных 11a-гидроксистероидов
Автори російськоюЦорн Лудвиг, Больманн Рольф, Галлус Норберт, Кюнцер Херманн, Мун Ханс-Петер, Нуббемайер Райнхард
МПК / Мітки
МПК: C07J 3/00, C07J 7/00, C07J 9/00, C07J 5/00, C07J 11/00, C07J 41/00, C12P 33/00, C07J 1/00, C07J 31/00
Мітки: 11b-галогенстероїдів, мікробіологічні, 7a,17a-заміщених, одержання, способи
Код посилання
<a href="https://ua.patents.su/14-89472-mikrobiologichni-sposobi-oderzhannya-7a17a-zamishhenikh-11b-galogensterodiv.html" target="_blank" rel="follow" title="База патентів України">Мікробіологічні способи одержання 7a,17a-заміщених 11b-галогенстероїдів</a>
Попередній патент: Спосіб визначення параметрів руху користувача за сигналами супутникових радіонавігаційних систем
Наступний патент: Спосіб витягання інгредієнтів з біологічного матеріалу та пристрій для його здійснення
Випадковий патент: Пристрій для запобігання зсуву вантажів у трюмі