Олігонуклеотиди або їх функціональні гомологи, композиція, яка містить їх, та спосіб лікування в-клітинної пухлини
Формула / Реферат
1. Спосіб лікування у ссавця В-клітинної пухлини, що включає введення суб'єктові, який потребує лікування, терапевтично ефективної кількості фармацевтичної композиції, що містить олігонуклеотид, який має послідовність SEQ ID NO: 1.
2. Спосіб за п. 1, що включає індукування апоптозу клітин В-клітинної пухлини.
3. Спосіб за п. 1, що включає збільшення експресії CD40 на клітинах В-клітинної пухлини.
4. Спосіб за п. 1, що включає стимулювання продукції IL-10 клітинами В-клітинної пухлини.
5. Спосіб за п. 1, в якому В-клітинна пухлина являє собою В-клітинний лейкоз, В-клітинну лімфому або мієлому.
6. Спосіб за п. 5, в якому вказаним В-клітинним лейкозом є В-клітинний хронічний лімфоцитарний лейкоз або В-клітинний гострий лімфоцитарний лейкоз.
7. Спосіб за п. 5, в якому вказаною В-клітинною лімфомою є лімфома з малих лімфоцитів.
8. Спосіб за п. 1, в якому вказаним ссавцем є людина.
9. Спосіб за п. 1, в якому вказану фармацевтичну композицію вводять ентерально, парентерально або місцево, або шляхом інгаляції.
Текст
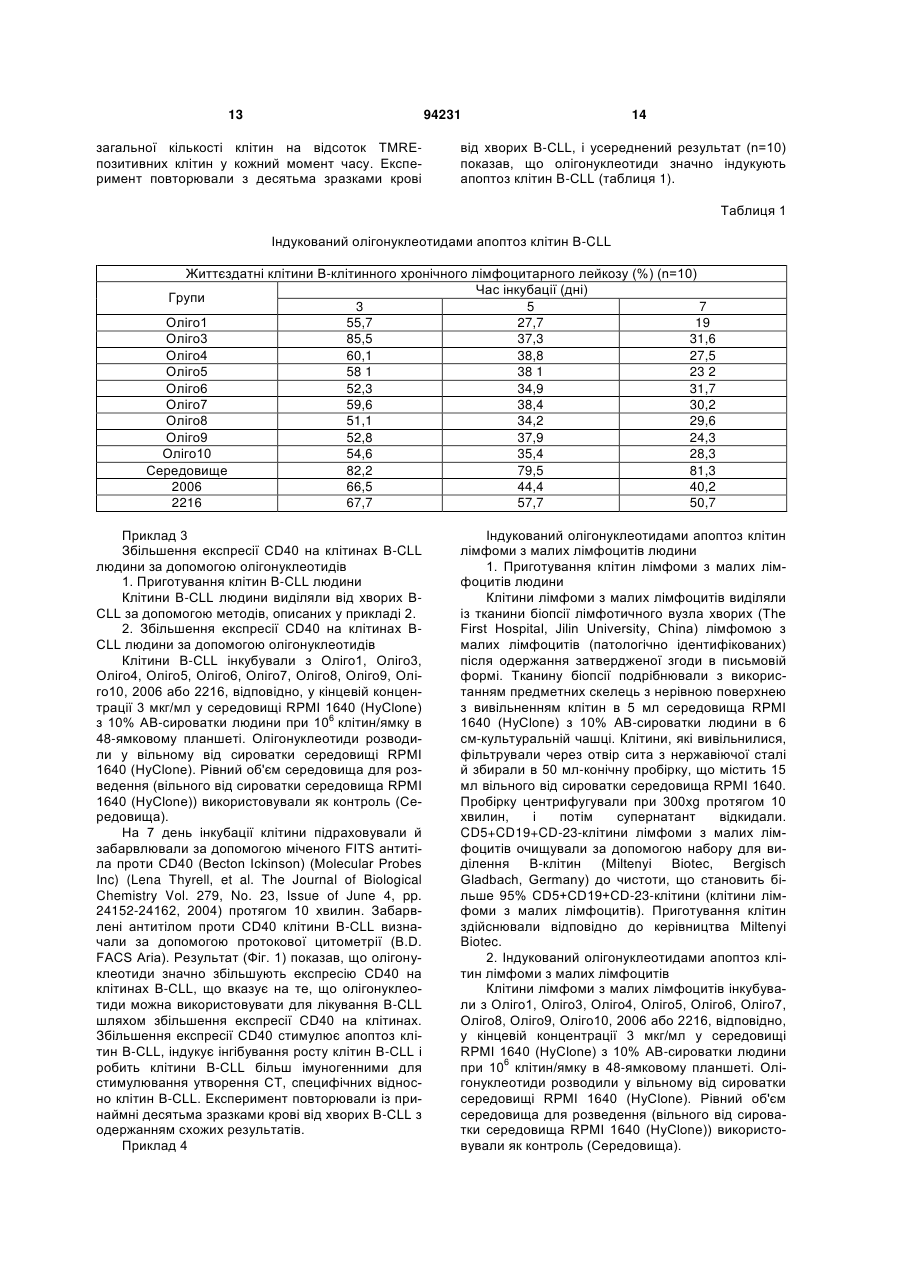
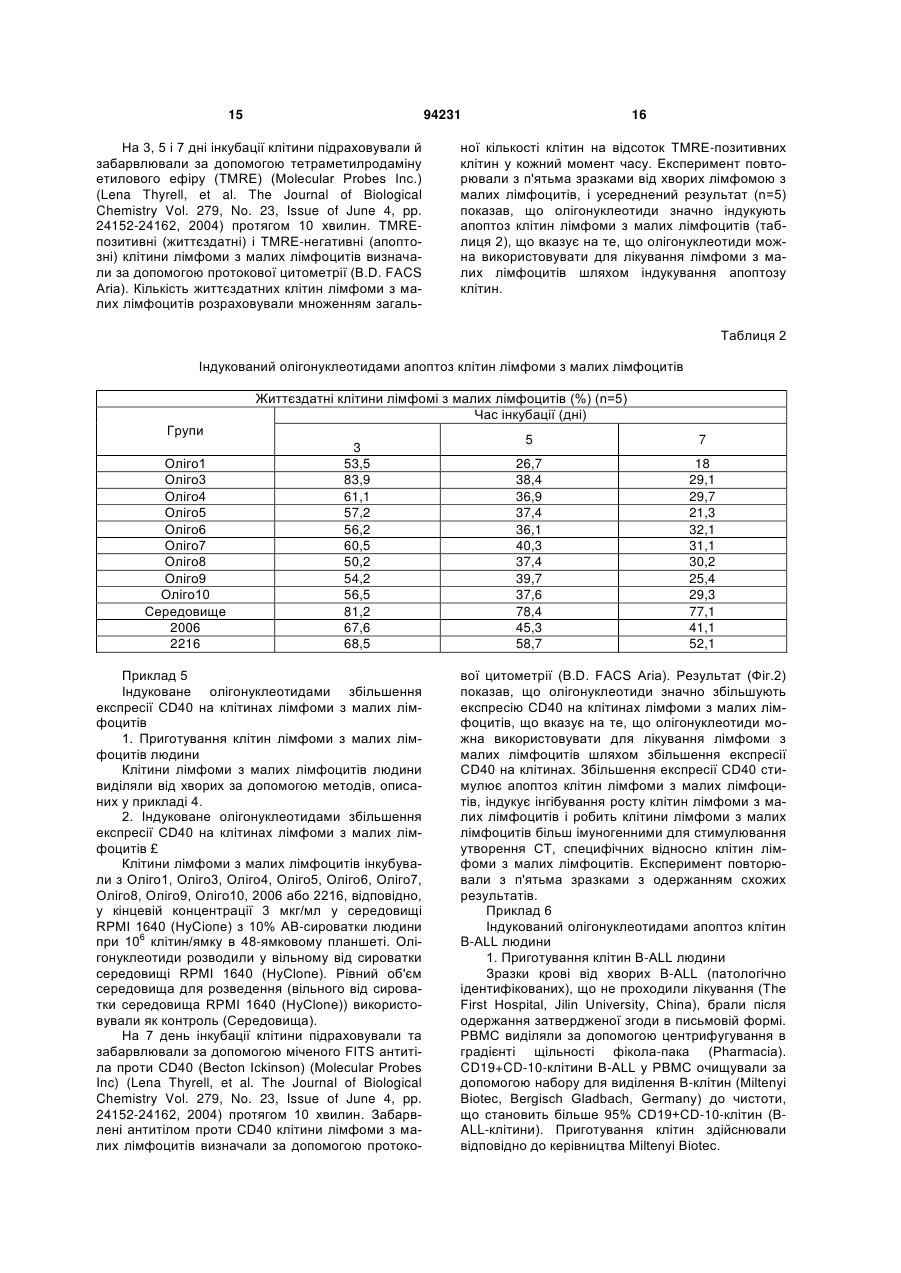
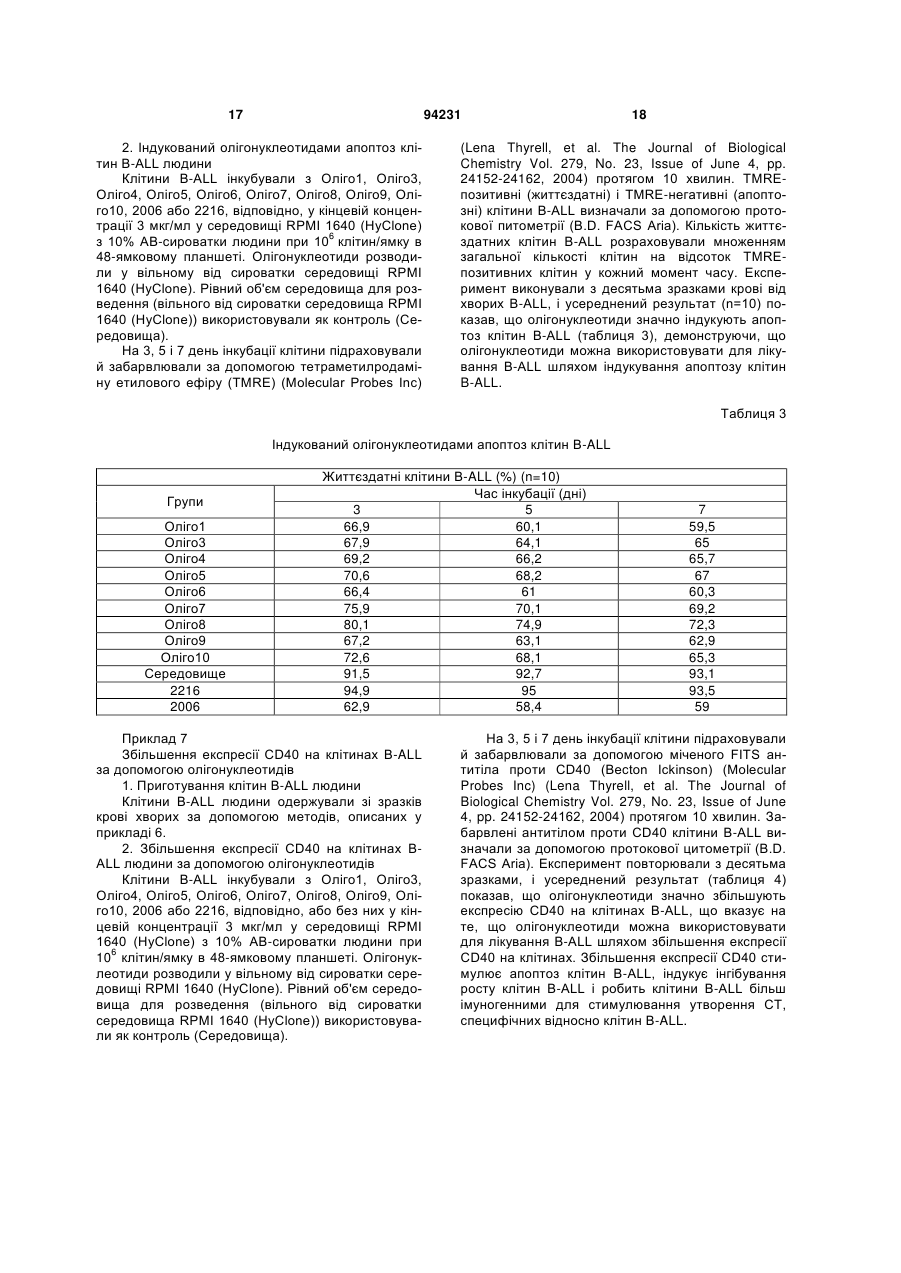
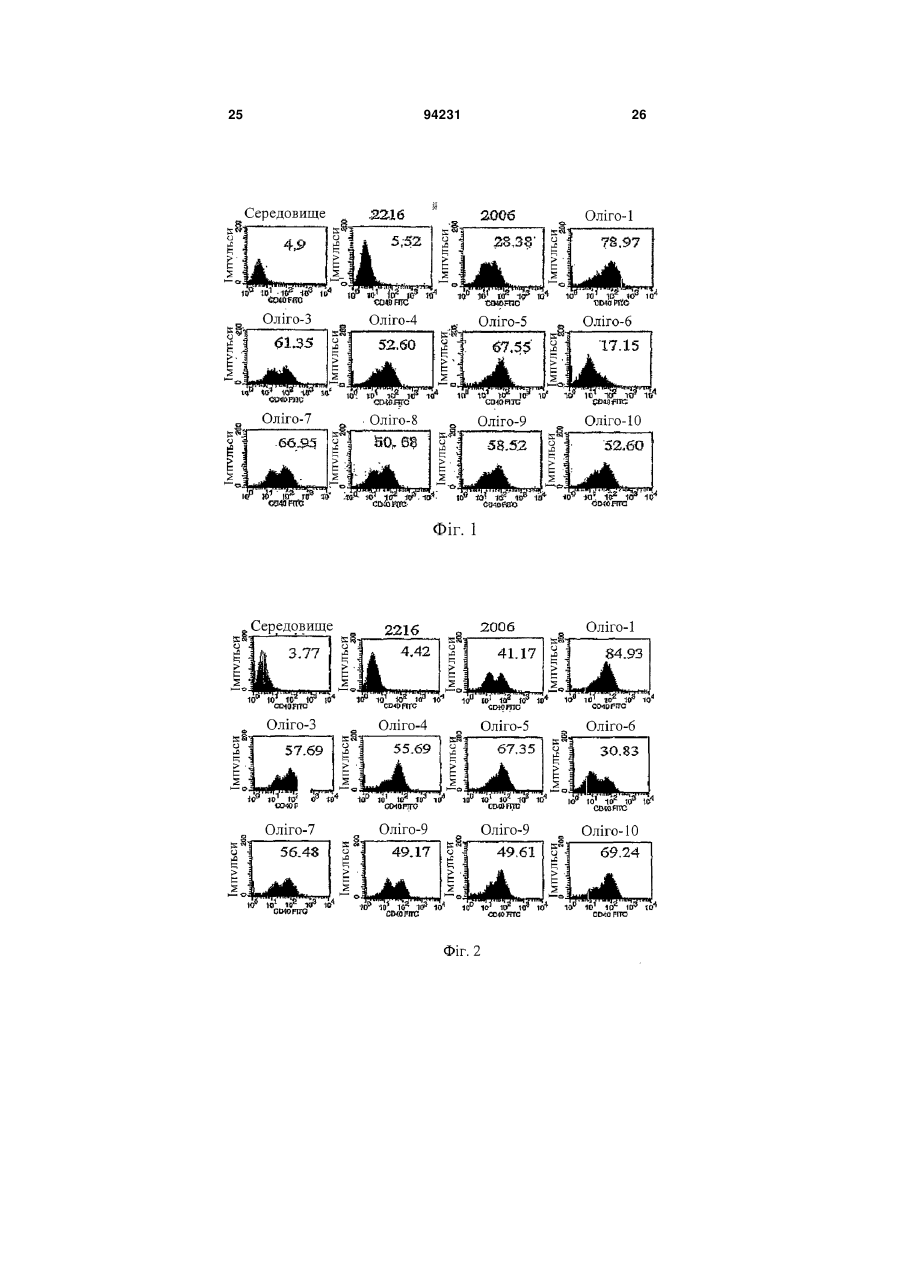
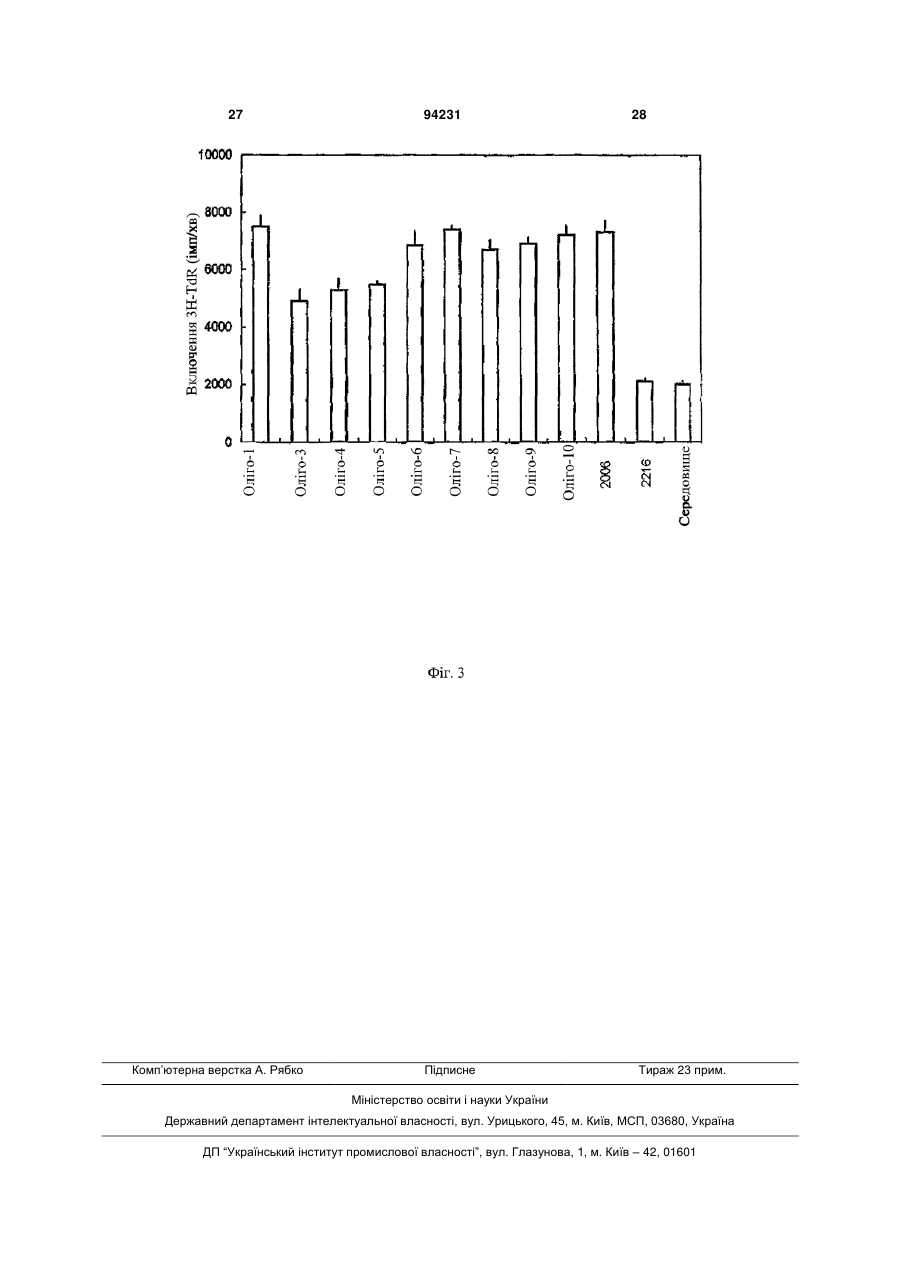
1. Спосіб лікування у ссавця В-клітинної пухлини, що включає введення суб'єктові, який потребує лікування, терапевтично ефективної кількості фармацевтичної композиції, що містить олігонуклеотид, який має послідовність SEQ ID NO: 1. 2. Спосіб за п. 1, що включає індукування апоптозу клітин В-клітинної пухлини. 3. Спосіб за п. 1, що включає збільшення експресії CD40 на клітинах В-клітинної пухлини. 4. Спосіб за п. 1, що включає стимулювання продукції IL-10 клітинами В-клітинної пухлини. 5. Спосіб за п. 1, в якому В-клітинна пухлина являє собою В-клітинний лейкоз, В-клітинну лімфому або мієлому. 6. Спосіб за п. 5, в якому вказаним В-клітинним лейкозом є В-клітинний хронічний лімфоцитарний лейкоз або В-клітинний гострий лімфоцитарний лейкоз. 7. Спосіб за п. 5, в якому вказаною В-клітинною лімфомою є лімфома з малих лімфоцитів. 8. Спосіб за п. 1, в якому вказаним ссавцем є людина. 9. Спосіб за п. 1, в якому вказану фармацевтичну композицію вводять ентерально, парентерально або місцево, або шляхом інгаляції. UA (21) a200714106 (22) 13.02.2006 (24) 26.04.2011 (86) PCT/CN2006/000215, 13.02.2006 (31) 200510069576.4 (32) 17.05.2005 (33) CN (46) 26.04.2011, Бюл.№ 8, 2011 р. (72) ВАН ЛІ-ІН, CN, БАО МУ-ШЕН, CN, ЮЙ ЮН-ЛІ, CN (73) ЧАНЧУНЬ ХУАПУ БАЙОТЕКНОЛОДЖИ КО., ЛТД., CN (56) CN1526718 A, 08.09.04. WO0197843 A2, 27.12.01. WO0122972 A2, 05.04.01. JAHRSDORFER B ET AL: "B-cell Lymphomas Differ in their Responsiveness to CpG Oligodeoxynucleotides" CLINICAL CANCER RESEARCH, THE AMERICAN ASSOCIATION FOR CANCER RESEARCH, US LNKDDOI:10.1158/1078-0432.CCR-04-1890, vol. 11, 15 February 2005 (2005-02-15), pages 1490-1499. REID G S D ET AL: "CpG stimulation of precursor Blineage acute lymphoblastic leukemia induces a distinct change in costimulatory molecule expression and shifts allogeneic T cells toward a Th1 response" BLOOD, AMERICAN SOCIETY OF HEMATOLOGY, US LNKD- DOI:10.1182/BLOOD-2004-06-2468, vol. 105, no. 9, 1 May 2005 (2005-05-01), pages 36413647. DECKER THOMAS ET AL: "Sensitization of B-cell chronic lymphocytic leukemia cells to recombinant immunotoxin by immunostimulatory phosphorothioate oligodeoxynucleotides" BLOOD 15 FEB 2002 LNKDPUBMED:11830482,, vol. 99, no. 4, 15 February 2002 (2002-02-15), pages 1320-1326. LI JIALI: "CpG in the immunotherapy of B cell lymphoma in an animal model" JOURNAL OF IMMUNOTHERAPY, vol. 27, no. 6, November 2004 (2004-11), page S60. 2 (19) 1 3 Даним винаходом забезпечуються дев'ять олігонуклеотидів з послідовностями, показаними в SEQ ID NO: 1-9, або їхні функціональні гомологи, композиція, яка містить їх, та спосіб лікування Вклітинної пухлини з використанням олігонуклеотидів шляхом індукування апоптозу клітин Вклітинної пухлини, збільшення експресії CD40 на клітинах В-клітинної пухлини та стимуляції продукування IL-10 клітинами В-клітинної пухлини. Олігонуклеотиди або їхні функціональні гомологи можна використовувати окремо або разом або використовувати в комбінації з хіміотерапією, імунотерапією і опроміненням для лікування Вклітинної пухлини. Ґрунтуючись на класифікаційній системі WHO (American Journal of Surgical Pathology, 1997, 21(1): 114-121), лімфоїдні злоякісні пухлини групують у три основних класи: В-клітинна пухлина, Тклітинна/МК-клітинна (природні кілери) пухлина й лімфоми Ходжкіна. В-клітинну пухлину далі поділяють на дві групи: пухлина з В-клітин-попередників і периферична В-клітинна пухлина. Пухлина з В-клітинпопередників включає гострий лімфобластний лейкоз із В-клітин-попередників (В-клітинний гострий лімфобластний лейкоз, В-АLL)/лімфобластну лімфому (LBL). Периферична В-клітинна пухлина включає В-клітинний хронічний лімфоцитарний лейкоз (B-CLL), лімфому з малих лімфоцитів, Вклітинний пролімфоцитарний лейкоз, лімфоплазмацитарну лімфому/імуноцитому, лімфому кори головного мозку, фолікулярну лімфому, фолікулярну лімфому шкіри, екстранодальну В-клітинну лімфому маргінальної зони MALT-типу, нодальну В-клітинну лімфому маргінальної зони (+/моноцитоїдні В-клітини), лімфому маргінальної зони селезінки (+/-ворсинчасті лімфоцити), волосатоклітинний лейкоз, плазмацитому/плазмаклітинну мієлому, дифузійну великоклітинну В-клітинну лімфому, медіастинальну (тимусну) великоклітинну В-клітинну лімфому, інтраваскулярну великоклітинну В-клітинну лімфому, первинну лімфому з випотом і лімфому Беркітта. В-клітинний хронічний лімфоцитарний лейкоз (B-CLL) і В-клітинний гострий лімфобластний/лімфоцитарний лейкоз (B-ALL) являють собою два типи В-клітинного лейкозу. Клітини B-CLL експресують CD19, CD5 і CD23 (Nicholas Chiorazzi, M.D., et al. N. Engl. J. Med. 2005; 352: 804-15). Клітини B-ALL експресують маркери CD19 і CD10. Лімфома з малих лімфоцитів є В-клітинною пухлиною. Клітини лімфоми з малих лімфоцитів експресують CD19, CD5 і CD23 (Catherine Thieblemont, et al. Blood. 2004; 103: 2727-2737). Залежно від типу В-клітинної пухлини існуючими в даний час варіантами лікування є хіміотерапія, радіотерапія та імунотерапія. CD40, що експресується на клітинній поверхні нормальних В-лімфоцитів і дендритних клітин, є членом сімейства рецепторів факторів некрозу пухлини (TNFR). CD40L (CD154), що експресується на Т-лімфоцитах, є членом сімейства факторів некрозу пухлини (Castle BE, et al. J. Immunol. 1993; 94231 4 151: 1777-1788). Взаємодія CD40L і CD40 стимулює проліферацію, диференціацію В-лімфоцитів, дендритних клітин і моноцитів і презентацію ними антигенів (Ranheim EA, et al. J. Exp. Med. 1993; 177: 925-935; Yellin MJ, et al. J. Immunol. 1994; 153: 666-674; Banchereau J., et al. Annu. Rev. Immunol. 1994; 12: 881-922; M.von Bergwelt-Baildon MS, etal. Blood 2002; 99: 3319-3325). CD40 також експресується на клітинах Вклітинної пухлини. Показано, що збільшення експресії CD40 стимулює апоптоз клітин В-клітинної пухлини (Peter Chu, et al. PNAS, March 19, 2002, vol.99, no.6: 3854-3859; Frank Dicker, et al. Blood, 15 April 2005 Volume 105, Number 8: 3193-3198). І експерименти in vitro, і експерименти in vivo указували на те, що стимуляція й збільшення експресії CD40 індукують інгібування росту клітин Вклітинної пухлини (Funakoshi et al., Blood 83: 27872794, 1994; Murphy et al., Blood 86: 1946-1953, 1995; Eliopoulos, A.G. et al. 1996. Oncogene 13:2243; Hirano, Α., et al. 1999. Blood 93: 2999; Tong, A.W., Μ et al. 2001. Clin. Cancer Res. 7: 691). Стимуляція експресії CD40 на клітинах Вклітинної пухлини, як повідомлялося, посилює антигенні властивості клітин В-клітинної пухлини й, отже, сприяє утворенню цитотоксичних Тлімфоцитів (CTL), специфічних відносно цих клітин. CTL можуть ефективно знищувати клітини Вклітинної пухлини (Dilloo D., et al. Blood. 1997; 90: 1927-1933; Kato К. et al. J. Clin. Invest. 1998; 101: 1133-1141; Wierda WG, et al. Blood. 2000; 96: 29172924; Takahashi S., et al. Hum. Gene Ther. 2001; 12: 659-670; Takahashi S., et al. Cancer Gene Ther. 2001; 8: 378-387). У присутності CD40L СD40експресуючі клітини В-клітинного хронічного лімфоцитарного лейкозу можуть бути знищені за допомогою СО4-цитотоксичних Т-лімфоцитів (Frank Dicker, et al. Blood, 15 April 2005 Vol. 105, Num. 8: 3193-3198). Взаємодія CD40L і CD40 на клітинах лімфоми Беркітта може стимулювати презентацію цими клітинами пухлинних антигенів специфічним CTL (Khanna, R. et al. 1997. J. Immunol. 159: 5782). В експериментах in vivo і в клінічних випробуваннях також продемонстровано, що активація CD40 може підсилювати імуногенність клітин Вклітинного хронічного лімфоцитарного лейкозу (BCLL) і, отже, індукувати утворення CTL, специфічних відносно цих клітин (Kato, К., et al. 1998. J. Clin. Invest. 101: 1133; Wierda, W.G., etal. 2000. Blood 96: 2917). Разом узяті ці дані вказують на те, що збільшення експресії CD40 на клітинах В-клітинної пухлини може стимулювати протипухлинний імунітет проти В-клітинної пухлини. Протипухлинний імунітет включає, без обмеження, наступне: 1) стимулювання апоптозу клітин В-клітинної пухлини; 2) інгібування росту клітин В-клітинної пухлини; 3) посилення імуногенності клітин В-клітинної пухлини й, отже, сприяння утворенню CTL, специфічних відносно цих клітин. Інтерлейкін-10 (IL-10) являє собою гомодимерний цитокін, що продукується певними Т 5 клітинами, моноцитами, макрофагами та деякими клітинами, які відносяться до пухлин, що походять з В-клітин, Т-клітин або NK-клітин (Kitabayashi et al., 1995; Masood et al., 1995; Sjoberg et al., 1996; Beatty et al., 1997; Boulland et al., 1998; Jones et al., 1999). Активність IL-10 опосередковується специфічним у відношенні нього рецептором клітинної поверхні, що експресується на антигенпрезентуючих клітинах, лімфоцитах і клітинах Вклітинного хронічного лімфоцитарного лейкозу (BCLL). Виявлено, що додавання екзогенного EL-10 інгібує проліферацію клітин B-CLL, недавно виділених із хворих (Jesper Jurlander, Chun-Fai Lai, Jimmy Tan, et al. Characterization of interleukin-10 receptor expression on B-cell chronic lymphocytic leukemia cells. Blood, Vol. 89, No. 11 (June 1), 1997: pp. 4146-4152). Також повідомлялося, що IL-10 інгібує проліферацію клітин B-CLL і підсилює апоптоз клітин B-CLL (Anne-Catherine Fluckiger, Isabelle Durand, and Jacques Banchereau. Interleukin 10 Induces Apoptotic Cell Death of B-Chronic Lymphocytic Leukemia Cells. J. Exp. Med. Volume 179 January 1994 91-99). Імуностимулювання протиракових властивостей IL-10 обговорювалося в огляді, на підставі якого можна припустити, що надекспресія IL-10 у пухлинному мікросередовищі може каталізувати імунне відторгнення злоякісної пухлини (Simone Mocellin, Francesco M., Marincola and Howard A. Young. Interleukin-10 and the immune response against cancer: a counterpoint. Journal of Leukocyte Biology. 2005; 78: 1043-1051). У першому варіанті здійснення даним винаходом забезпечуються дев'ять олігонуклеотидів, також позначуваних Оліго1, Оліго3, Оліго4, Оліго5, Оліго6, Оліго7, Оліго8, Оліго9, Оліго10, з послідовностями, показаними в SEQ ID NO: 1, 2, 3, 4, 5, 6, 7, 8, 9, відповідно, і їхні функціональні гомологи. Олігонуклеотиди або їхні функціональні гомологи можуть мати модифікацію у фосфатному кістяку, що являє собою модифікацію у вигляді фосфоротіоату або фосфородитіоату, що є часткової або повної. Олігонуклеотиди або їхні функціональні гомологи можуть мати хімічні модифікації або заміни рідкими основами. Олігонуклеотиди або їхні функціональні гомологи можуть бути функціональними частинами будь-яких інших ДНК-фрагментів, або вони можуть бути клоновані в плазмідний, бактеріальний, вірусний вектор, або ДНК-вакцину, відповідно. Олігонуклеотиди з послідовностями SEQ ID NO: 1-9 можна модифікувати додаванням однієї або декількох основ (переважно від 1 до 10 основ) до кожного з їхніх кінців або зміною в них від одного до декількох основ. Фахівці в даній галузі можуть визначити, як використовувати олігонуклеотиди з послідовностями SEQ ID NO: 1-9 або їхні функціональні гомологи окремо або разом, або як використовувати ДНК-фрагменти, що включають олігонуклеотиди з послідовностями SEQ ID NO: 1-9, відповідно, для досягнення мети даного винаходу, ґрунтуючись на тому, що добре відомо в даній галузі техніки, і на доктрині даного винаходу. У другому варіанті здійснення даним винаходом забезпечується спосіб лікування у суб'єкта Вклітинної пухлини з використанням олігонуклеотидів або їхніх функціональних гомологів даного ви 94231 6 находу окремо або разом або з використанням композиції, що містить олігонуклеотиди або їхні функціональні гомологи даного винаходу. Суб'єктом є людина або тварина. В-клітинна пухлина включає, але не обмежується перерахованими, Вклітинний лейкоз, В-клітинну лімфому та мієлому. У третьому варіанті здійснення даним винаходом забезпечується спосіб лікування В-клітинної пухлини з використанням олігонуклеотидів або їхніх функціональних гомологів даного винаходу окремо або разом або з використанням композиції, яка містить олігонуклеотиди або їхні функціональні гомологи даного винаходу, шляхом індукування апоптозу клітин В-клітинної пухлини. У четвертому варіанті здійснення даним винаходом забезпечується спосіб лікування В-клітинної пухлини з використанням олігонуклеотидів або їхніх функціональних гомологів даного винаходу окремо або разом або з використанням композиції, що містить олігонуклеотиди або їхні функціональні гомологи даного винаходу, шляхом збільшення експресії CD40 на клітинах В-клітинної пухлини. У п'ятому варіанті здійснення даним винаходом забезпечується спосіб лікування В-клітинної пухлини з використанням олігонуклеотидів або їхніх функціональних гомологів даного винаходу окремо або разом або з використанням композиції, що містить олігонуклеотиди або їхні функціональні гомологи даного винаходу, шляхом стимуляції продукування IL-10 клітинами В-клітинної пухлини. В іншому варіанті здійснення даним винаходом забезпечується композиція, що містить терапевтично ефективну кількість олігонуклеотидів або їхніх функціональних гомологів даного винаходу окремо або в/с одним або декількома фармацевтично прийнятними носіями. Композицію вводять ентерально, парентерально та місцево або шляхом інгаляції. У ще одному варіанті здійснення даним винаходом забезпечується спосіб лікування В-клітинної пухлини, що включає введення терапевтично ефективної кількості олігонуклеотидів або їхніх функціональних гомологів даного винаходу окремо або разом або композиції, що містить їх, або із принаймні одним агентом проти В-клітинної пухлини, у тому числі хіміотерапевтичними, імунотерапевтичними агентами й агентами, застосовуваними в радіотерапії. Фіг.1. Вплив олігонуклеотидів на збільшення експресії CD40 на клітинах В-CLL. Клітини B-CLL інкубували з олігонуклеотидами або без них протягом 7 днів і потім забарвлювали за допомогою міченого FITS (ФІТЦ) антитіла проти CD40 для аналізу експресії CD40 з використанням протокової цитометрії. Рівень експресії вказаний кількістю MFI (середньократний приріст). Фіг.2. Вплив олігонуклеотидів на збільшення експресії CD40 на клітинах лімфоми з малих лімфоцитів. Клітини лімфоми з малих лімфоцитів інкубували з олігонуклеотидами або без них. На 7 день клітини забарвлювали за допомогою міченого FITS (ФІТЦ) антитіла проти CD40 для аналізу експресії CD40 з використанням протокової цитометрії. Рівень експресії вказаний кількістю MFI. 7 Фіг.3. Вплив олігонуклеотидів на проліферацію нормальних PBMS людини. Нормальні PBMS людини культивували з олігонуклеотидами або без них і піддавали включен3 ню [ Н]-тимідину для визначення проліферації клітин. Проліферацію клітин виражали в імп/хв. У даному винаході наступні терміни мають вказані нижче значення. "Олігонуклеотид" означає полінуклеотиди (тобто молекули, які включають цукор (наприклад, дезоксирибозу), зв'язаний з фосфатною групою та із взаємозамінною органічною основою). Існують чотири органічних основи: цитозин (С), тимін (Т), аденін (А) і гуанін (G). Олігонуклеотид можна синтезувати за допомогою автоматизованого синтезатора олігонуклеотидів, наявного на ринку, або приготувати із вже існуючих послідовностей нуклеїнових кислот з використанням відомих методів. "Модифікація в кістяку" олігонуклеотиду означає, що олігонуклеотид може мати модифікований у вигляді фосфоротіоату фосфатний кістяк (тобто принаймні один кисень фосфату замінений сіркою) або інший модифікований кістяк. "Хімічна модифікація" олігонуклеотиду означає модифікацію з використанням активних груп нуклеотиду або зі створенням аналогів нуклеотидів. Модифікації можуть відбуватися або під час синтезу олігонуклеотиду, або після нього. Під час синтезу модифіковані основи (у т.ч., без обмеження, аналоги тимідину) можуть бути включені всередину або на 5'-кінці. Після синтезу модифікацію можна здійснити з використанням активних груп (за допомогою аміномодіфикатора, через 3'- або 5'гідроксильні групи або через фосфатну групу). "В-клітинна пухлина" означає захворювання, що розвинулося в результаті аномальної проліферації клітин В-лімфоцитарної лінії. В-клітинні пухлини можна згрупувати в В-клітинний лейкоз, Вклітинну лімфому та мієлому (плазмацитому/плазмаклітинну мієлому). В-клітинний лейкоз включає В-клітинний хронічний лімфоцитарний лейкоз (B-CLL), гострий лімфобластний лейкоз із В-клітин-попередників (В-клітинний гострий лімфобластний лейкоз, B-ALL), В-клітинний пролімфоцитарний лейкоз і волосатоклітинний лейкоз. Вклітинна лімфома включає лімфому з малих лімфоцитів, лімфоплазмацитарну лімфому/імуноцитому, лімфому кори головного мозку, фолікулярну лімфому, фолікулярну лімфому шкіри, екстранодальну В-клітинну лімфому маргінальної зони MALT-типу, нодальну В-клітинну лімфому маргінальної зони (+/-моноцитоїдні Вклітини), лімфому маргінальної зони селезінки (+/ворсинчасті лімфоцити), дифузійну великоклітинну В-клітинну лімфому, медіастинальну (тимусну) великоклітинну В-клітинну лімфому, інтраваскулярну великоклітинну В-клітинну лімфому, первинну лімфому з випотом і лімфому Беркітта. "Суб'єкт" означає ссавця, у тому числі, але без обмеження, людину, мавпу, собаку, кішку, коня, корову, свиню, козу, вівцю, мишу й щура. Олігонуклеотид даного винаходу можна вводити суб'єктові з В-клітинною пухлиною. "Агент проти В-клітинної пухлини" означає агент, використовуваний для лікування В-клітинної 94231 8 пухлини у суб'єкта. Агент включає олігонуклеотиди даного винаходу, хіміотерапевтичні агенти, імунотерапевтичні агенти та агенти, використовувані в радіотерапії. Олігонуклеотиди даного винаходу можна вводити до, разом з або після введення одного або декількох інших агентів проти Вклітинної пухлини для досягнення синергічного ефекту при лікуванні В-клітинної пухлини. "Хіміотерапія" означає хіміотерапію, за допомогою якої лікують В-клітинну пухлину в комбінації з олігонуклеотидами даного винаходу. Олігонуклеотиди даного винаходу можна використовувати з одним або декількома хіміотерапевтичними агентами при лікуванні В-клітинної пухлини. Хіміотерапевтичні агенти включають, але не обмежуються перерахованими, алкілувальні агенти, такі як циклофосфамід або хлорамбуцил, вінка-алкалоїди (наприклад, вінкристин і вінбластин), прокарбазин, метотрексат, преднізон, антрациклін, Lаспарагіназу, аналоги пурину (наприклад, флударабін монофосфат, 2-хлордезоксіаденозин і пентостатин), цитозин, арабінозид, цисплатин, етопозид та іфосфамід. Олігонуклеотиди даного винаходу можна також використовувати з однієї або декількома хіміотерапевтичними комбінаціями при хіміотерапії. Комбінації включають, але не обмежуються перерахованими, CVP (циклофосфамід, вінкристин і преднізон), CHOP (CVP і доксорубіцин), С-МОРР (циклофосфамід, вінкристин, преднізон і прокарбазин), CAP-ВОР (CHOP плюс прокарбазин і блеоміцин), m-BACOD (CHOP плюс метотрексат, блеоміцин і лейковорин), ProMACEΜΟΡΡ (преднізон, метотрексат, доксорубіцин, циклофосфамід, етопозид і лейковорин плюс стандартна МОРР), РrоМАСЕ-CytaBOM (преднізон, доксорубіцин, циклофосфамід, етопозид, цитарабін, блеоміцин, вінкристин, метотрексат і лейковорин), МАСОР-В (метотрексат, доксорубіцин, циклофосфамід, вінкристин, преднізон встановленої дози, блеоміцин і лейковорин), IMVP-16 (іфосфамід, метотрексат і етопозид), МІМЕ (метил-гаг, іфосфамід, метотрексат та етопозид), DHAP (дексаметазон, цитарабін високої дози та цисплатин), ESHAP (етопозид, метилпреднізолон, цитарабін високої дози, цисплатин), СЕРР(В) (циклофосфамід, етопозид, прокарбазин, преднізон і блеоміцин), CAMP (ломустин, мітоксантрон, цитарабін і преднізон), CHOP плюс блеоміцин, метотрексат, прокарбазин, нітроген мустард, цитозин, арабінозид і етопозид. МОРР (мехлоретамін (нітроген мустард). вінкристин (онковін), прокарбазин і преднізон), ABVD (наприклад, адріаміцин, блеоміцин, вінбластин і дакарбазин), ChlVPP (хлорамбуцил, вінбластин, прокарбазин і преднізон), CABS (ломустин, доксорубіцин, блеоміцин і стрептозотоцин), МОРР плюс ABVD, МОРР плюс ABV (доксорубіцин, блеоміцин і вінбластин) або BCVPP (кармустин, циклофосфамід, вінбластин, прокарбазин і преднізон) і CAP (циклофосфамід, доксорубіцин і преднізон). "Імунотерапія" означає імунотерапію, за допомогою якої лікують В-клітинну пухлину в комбінації з олігонуклеотидами даного винаходу. Олігонуклеотиди даного винаходу можна використовувати з одним або декількома імунотерапевтичними аген 9 тами при лікуванні В-клітинної пухлини. Імунотерапевтичні агенти включають, без обмеження, антитіла проти CD20. Антитіла проти CD20 включають імуноглобуліни і їхні фрагменти, які специфічно взаємодіють із білком CD20 на клітинній поверхні клітин В-клітинної пухлини. Антитіла проти CD20 можуть бути поліклональними та моноклональними антитілами, химерними антитілами, двоспецифічними антитілами та гуманізованими антитілами. "CD20" є мембранним білком В-клітин (Tedder et al., Immunology Today 15: 450-454 (1994)) та експресується і на нормальних, і на Вклітинах, які відноситься до пухлини (John С. Byrd, et al. J. Clin. Oncol. 2001; 19: 2165-2170; Huhn D., et al. Blood 2001, 98: 1326-1331). "Фармацевтично прийнятний носій" означає один або декілька твердих або рідких наповнювачів, розріджувачів або інкапсулюючих речовин, які придатні для введення суб'єктові олігонуклеотидів даного винаходу. Носій може бути органічним, неорганічним, таким, що зустрічається в природі, або синтетичним. Носій включає будь-який і всі розчини, розріджувачі, розчинники, дисперсні середовища, ліпосому, емульсії, покриття, антибактеріальні та протигрибкові агенти, ізотонічні агенти й агенти, які уповільнюють абсорбцію, і будь-який інший носій, придатний для введення олігонуклеотидів даного винаходу, і їхнє застосування добре відоме в даній галузі техніки. "Терапевтично ефективна кількість" олігонуклеотидів даного винаходу стосується дози, використовуваної для досягнення бажаного результату лікування В-клітинної пухлини у суб'єкта. Дозу можна визначити за допомогою стандартних методів, добре відомих фахівцям у даній галузі техніки, і доза може варіювати залежно від факторів, що включають, але не обмежуються перерахованими, розмір і/або загальний стан здоров'я суб'єкта або тяжкість захворювання. Введення олігонуклеотидів даного винаходу можна здійснити у вигляді одиничного введення або протягом ряду введень. Дози олігонуклеотидів даного винаходу, які підлягають введенню, перебувають у діапазоні від приблизно 1 мкг до 100 мг на введення. Однак для лікування В-клітинної пухлини можна використовувати дози в діапазоні, що перевищує в 10-1000 разів вказаний вище діапазон доз. Фахівці в даній галузі можуть регулювати схему прийому лікарського засобу для забезпечення оптимального терапевтичного ефекту. "Спосіб" введення олігонуклеотидів даного винаходу означає ентеральне, парентеральне та місцеве введення або інгаляцію. Використовуваний тут термін "ентеральне" включає оральне введення, введення в шлунок, введення в кишечник і ректальне введення. Термін "парентеральне" включає внутрішньовенне, внутрішньочеревинне, внутрішньом'язове, підшкірне, ректальне або вагінальне введення. Термін "місцеве" означає застосування олігонуклеотидів зовнішньо на епідерміс, у щічну карман та у вухо, око й ніс. "Фармацевтична композиція" означає композицію, що містить терапевтично ефективну кількість олігонуклеотидів з фармацевтично прийнятним носієм або без нього. Композиція включає, 94231 10 але не обмежується перерахованими, водні або сольові розчини, частинки, аерозолі, пігулки, гранули, порошки, таблетки, покриті таблетки, (мікро)капсули, супозиторії, сиропи, емульсії, суспензії, креми, краплі й інші фармацевтичні композиції, придатні для використання для множини систем доставки лікарського засобу. Композиції придатні для ін'єкції, перорального, трансбукального, ректального та вагінального використання, інгаляції й застосування для зберігання на складі. У всіх випадках композиція повинна бути стерильною та стабільною в умовах виробництва й зберігання та захищена від мікробного зараження. Композиція для ін'єкції включає водні розчини або дисперсії та порошки для приготування експромтом ін'єктованих розчинів або дисперсії. "Порошок" у цьому винаході стосується композиції, що містить тонко дисперговані тверді частинки, які містять олігонуклеотиди. Можна скласти композицію порошку з іншими фармацевтично прийнятними носіями (наприклад, водою, PBS (ЗФР), фізіологічним розчином та іншими фармацевтично прийнятними буферами) перед використанням. Розчини можна приготувати шляхом включення олігонуклеотидів в один або декілька придатних розчинників і інших необхідних інгредієнтів. Дисперсії можна приготувати шляхом включення олігонуклеотидів у носій, що містить дисперсне середовище (наприклад, гліцерин, рідкі поліетиленгліколі та масла) і інші необхідні інгредієнти. Композицію для орального введення готують із їстівними носіями з формуванням таблеток, пігулок, драже, капсул, рідин, гелів, сиропів, шламів, суспезій і т.п. Композиція для трансбукального введення являє собою таблетки або коржі звичайного сорту. Композиція для інгаляції являє собою аерозоль із упаковок, що перебувають під тиском, або розпилювач, або сухий порошок і може бути вибрана кваліфікованим у даній галузі фахівцем. Олігонуклеотиди можна також приготувати у вигляді фармацевтично прийнятних композицій для ректального або вагінального застосування або застосування для зберігання на складі. У композиції можна використовувати тільки олігонуклеотиди або їхню комбінацію з одним або декількома іншими агентами, що включають, але не обмежуються перерахованими, хіміотерапевтичні агенти, імунотерапевтичні агенти та ліганд, що впізнається специфічним рецептором або молекулою клітини-мішені. Олігонуклеотиди в комбінації з іншим агентом можуть бути окремими композиціями й використатися в такий спосіб: 1) до введення олігонуклеотиди змішують із другим агентом; 2) олігонуклеотиди та другий агент вводять суб'єктові в різний час; 3) олігонуклеотиди та другий агент вводять у різні місця суб'єкта. Крім того, композиція може містити плазмідні, бактеріальні вектори, вірусні вектори й вакцини з нуклеїнових кислот, що несуть послідовність олігонуклеотидів даного винаходу. Наступні приклади є ілюстративними та не повинні розглядатися як обмеження обсягу даного винаходу. Тут можна здійснити без відхилення від обсягу даного винаходу прийнятні варіації, такі як ті, що приходять на розум розважливому майстрові. 11 Приклад 1 Синтез олігонуклеотиду Автори даного винаходу сконструювали й синтезували олігонуклеотиди з наступними послідовностями та номенклатурою: Оліго1:5'-TCgACgTTCgTCgTTCgTCgTTC-3' (вказаний у SEQ ID NO: 1) Оліго3:5'-TCggCACgCgACgTgCTggCCgTCgTTTCC3' (вказаний у SEQ ID NO: 2) Oлiгo4:5'-TCgTCgTCgTCgTTgTCgTTgggg-3' (вказаний у SEQ ID NО: 3) Оліго5:5'-TCgTTgCCgTCgg-3' (вказаний у SEQ ID NО: 4) Оліго6:5'-TCgTCgggTgCgACgTCgCAgggggg-3' (вказаний у SEQ ID NО: 5) Оліго7:5'-TCgTCgggTgCgATCgCAgggggg-3' (вказаний у SEQ ID NО: 6) Oлiгo8:5'-TCgTCgggTgCATCgATgCAgggggg-3' (вказаний у SEQ ID NО: 7) Оліго9:5'-tcgtcgggtgcgacgtcgca-3' (вказаний у SEQ ID NО: 8) Оліго10:5'-TCggggACgATCgTCgggggg-3' (вказаний у SEQ ID NО: 9). Для аналізу функцій вищевказаних олігонуклеотидів також синтезували два контрольних олігонуклеотиди: 2006 з послідовністю 5'tcgtcgttttgtcgttttgtcgtt-3' і 2216 з послідовністю 5'gggggacgatcgtcgggggg-3'. Всі олігонуклеотиди синтезували в Sangon Biotech Company (Shanghai, China), перевіряли на ендотоксин у реакції з лізатом амебоцитів мечохвоста Limulus (Associates of Cape Cod, Inc.) і маніпулювали у вільних від пірогенів реагентах. 2006 (J. Immunol. 2000; 164: 1617) є добре дослідженим олігонуклеотидом, що сильно активує нормальні В-клітини. 2216 (Eur. J. Immunol. 2001; 31: 2154) являє собою інший добре досліджений олігонуклеотид, який індукує більші кількості інтерферону типу І у плазмацитоїдних дендритних клітинах. Способи синтезу олігонуклеотиду добре відомі фахівцям у даній галузі техніки, і серед інших, як правило, використовується твердофазний синтез. Зокрема, у процесі синтезу використовується тверда основа, яка являє собою кульку зі скла з контрольованим розміром пор (CPG). Ця кулька має поверхню з порами й довгими порами, і саме в них відбувається прикріплення захищеного нуклеотиду. Синтез олігонуклеотиду починається з найбільш 3'-кінцевого нуклеотиду й триває завдяки ряду циклів, що складаються з п'яти стадій, які повторюють доти, поки не приєднається найбільш 5'-кінцевий нуклеотид. Цими стадіями є зняття захисту, активація, приєднання, кепірування й стабілізація. Стадія 1. Зняття захисту Захисну групу в захищеному нуклеозиді, прикріпленому до кульки з CPG (скла з контрольованим розміром пор), видаляють за допомогою трихлороцтової кислоти (ТСА) з вивільненням реакційноздатної 5'-гідроксильної групи. Стадія 2. Активація На цій стадії тетразол атакує нуклеотид, що приєднується, у вигляді фосфорамідиту з утворенням проміжної сполуки тетразолілфосфорамідиту. 94231 12 Стадія 3. Приєднання Проміжна сполука тетразолілфосфорамідит взаємодіє з гідроксильною групою реципієнта, і утворюється 5'-3'-зв'язок. Тетразол відновлюється, і процес триває. Стадія 4. Кепірування На цій стадії використовується ацетилувальний реагент, що складається з оцтового ангідриду та N-метилімідазолу, для блокування реакційноздатної гідроксильної групи на найбільш 5'кінцевому нуклеотиді для запобігання неправильного приєднання. Стадія 5. Стабілізація Після виконання стадії кепірування останньою стадією циклу є окислювання, що стабілізує фосфатний зв'язок між зростаючим олігонуклеотидним ланцюгом і останньою з доданих основ. Цю стадію здійснюють у присутності йоду як слабкого окислювача у тетрагідрофурані (THF) і воді. Після цієї кінцевої стадії цикл повторюють із кожним нуклеотидом у послідовності. Після завершення синтезу одноланцюгову ДНК-молекулу очищують за допомогою таких методів, як НАР, PAGE, HPLC, С18 і ОРС. Приклад 2 Індукований олігонуклеотидами апоптоз клітин B-CLL людини 1. Приготування клітин B-CLL людини Зразки крові від хворих B-CLL (патологічно ідентифікованих), що не проходили лікування (The First Hospital, Jilin University, China), брали після одержання затвердженої згоди в письмовій формі. Мононуклеарні клітини периферичної крові (РВМС) виділяли за допомогою центрифугування в градієнті щільності фікола-пака (Pharmacia). Клітини CD5+CD19+CD-23-B-CLL у РВМС очищували за допомогою набору для виділення В-клітин (Miltenyi Biotec, Bergisch Gladbach, Germany) до чистоти, яка становить більше 95% CD5+CD19+CD-23-клітин (Клітинк-клітин-В-СLLклітин). Приготування клітин здійснювали відповідно до керівництва Miltenyi Biotec. 2. Індукований олігонуклеотидами апоптоз клітин B-CLL людини Клітини B-CLL інкубували з Оліго1, Оліго3, Оліго4, Оліго5, Оліго6, Оліго7, Оліго8, Оліго9, Оліго10, 2006 або 2216, відповідно, у кінцевій концентрації З мкг/мл у середовищі RPMI 1640 (НуСіопе) з 10% АВ-сироватки людини при 106 клітин/ямку в 48-ямковому планшеті. Олігонуклеотиди розводили у вільному від сироватки середовищі RPMI 1640 (НуСlоnе). Рівний об'єм середовища для розведення (вільного від сироватки середовища RPMI 1640 (НуСlоnе)) використовували як контроль (Середовища). На 3, 5 і 7 день інкубації клітини підраховували й забарвлювали за допомогою тетраметилродаміну етилового ефіру (TMRE) (Molecular Probes Inc) (Lena Thyrell, et al. The Journal of Biological Chemistry Vol. 279, No. 23, Issue of June 4, pp. 24152-24162, 2004) протягом 10 хвилин. TMREпозитивні (життєздатні) і TMRE-негативні (апоптозні) клітини B-CLL визначали за допомогою протокової цитометрії (B.D. FACS Aria). Кількість життєздатних клітин B-CLL розраховували множенням 13 94231 загальної кількості клітин на відсоток TMREпозитивних клітин у кожний момент часу. Експеримент повторювали з десятьма зразками крові 14 від хворих B-CLL, і усереднений результат (n=10) показав, що олігонуклеотиди значно індукують апоптоз клітин B-CLL (таблиця 1). Таблиця 1 Індукований олігонуклеотидами апоптоз клітин B-CLL Життєздатні клітини В-клітинного хронічного лімфоцитарного лейкозу (%) (n=10) Час інкубації (дні) Групи 3 5 7 Оліго1 55,7 27,7 19 Оліго3 85,5 37,3 31,6 Оліго4 60,1 38,8 27,5 Оліго5 58 1 38 1 23 2 Оліго6 52,3 34,9 31,7 Оліго7 59,6 38,4 30,2 Оліго8 51,1 34,2 29,6 Оліго9 52,8 37,9 24,3 Оліго10 54,6 35,4 28,3 Середовище 82,2 79,5 81,3 2006 66,5 44,4 40,2 2216 67,7 57,7 50,7 Приклад 3 Збільшення експресії CD40 на клітинах B-CLL людини за допомогою олігонуклеотидів 1. Приготування клітин B-CLL людини Клітини B-CLL людини виділяли від хворих BCLL за допомогою методів, описаних у прикладі 2. 2. Збільшення експресії CD40 на клітинах BCLL людини за допомогою олігонуклеотидів Клітини B-CLL інкубували з Оліго1, Оліго3, Оліго4, Оліго5, Оліго6, Оліго7, Оліго8, Оліго9, Оліго10, 2006 або 2216, відповідно, у кінцевій концентрації 3 мкг/мл у середовищі RPMI 1640 (НуСlоnе) з 10% АВ-сироватки людини при 106 клітин/ямку в 48-ямковому планшеті. Олігонуклеотиди розводили у вільному від сироватки середовищі RPMI 1640 (НуСlоnе). Рівний об'єм середовища для розведення (вільного від сироватки середовища RPMI 1640 (НуСlоnе)) використовували як контроль (Середовища). На 7 день інкубації клітини підраховували й забарвлювали за допомогою міченого FITS антитіла проти CD40 (Becton Ickinson) (Molecular Probes Inc) (Lena Thyrell, et al. The Journal of Biological Chemistry Vol. 279, No. 23, Issue of June 4, pp. 24152-24162, 2004) протягом 10 хвилин. Забарвлені антитілом проти CD40 клітини B-CLL визначали за допомогою протокової цитометрії (B.D. FACS Aria). Результат (Фіг. 1) показав, що олігонуклеотиди значно збільшують експресію CD40 на клітинах B-CLL, що вказує на те, що олігонуклеотиди можна використовувати для лікування B-CLL шляхом збільшення експресії CD40 на клітинах. Збільшення експресії CD40 стимулює апоптоз клітин B-CLL, індукує інгібування росту клітин B-CLL і робить клітини B-CLL більш імуногенними для стимулювання утворення СТ, специфічних відносно клітин B-CLL. Експеримент повторювали із принаймні десятьма зразками крові від хворих B-CLL з одержанням схожих результатів. Приклад 4 Індукований олігонуклеотидами апоптоз клітин лімфоми з малих лімфоцитів людини 1. Приготування клітин лімфоми з малих лімфоцитів людини Клітини лімфоми з малих лімфоцитів виділяли із тканини біопсії лімфотичного вузла хворих (The First Hospital, Jilin University, China) лімфомою з малих лімфоцитів (патологічно ідентифікованих) після одержання затвердженої згоди в письмовій формі. Тканину біопсії подрібнювали з використанням предметних скелець з нерівною поверхнею з вивільненням клітин в 5 мл середовища RPMI 1640 (НуСlоnе) з 10% АВ-сироватки людини в 6 см-культуральній чашці. Клітини, які вивільнилися, фільтрували через отвір сита з нержавіючої сталі й збирали в 50 мл-конічну пробірку, що містить 15 мл вільного від сироватки середовища RPMI 1640. Пробірку центрифугували при 300xg протягом 10 хвилин, і потім супернатант відкидали. CD5+CD19+CD-23-клітини лімфоми з малих лімфоцитів очищували за допомогою набору для виділення В-клітин (Miltenyi Biotec, Bergisch Gladbach, Germany) до чистоти, що становить більше 95% CD5+CD19+CD-23-клітини (клітини лімфоми з малих лімфоцитів). Приготування клітин здійснювали відповідно до керівництва Miltenyi Biotec. 2. Індукований олігонуклеотидами апоптоз клітин лімфоми з малих лімфоцитів Клітини лімфоми з малих лімфоцитів інкубували з Оліго1, Оліго3, Оліго4, Оліго5, Оліго6, Оліго7, Оліго8, Оліго9, Оліго10, 2006 або 2216, відповідно, у кінцевій концентрації 3 мкг/мл у середовищі RPMI 1640 (НуСlоnе) з 10% АВ-сироватки людини при 106 клітин/ямку в 48-ямковому планшеті. Олігонуклеотиди розводили у вільному від сироватки середовищі RPMI 1640 (НуСlоnе). Рівний об'єм середовища для розведення (вільного від сироватки середовища RPMI 1640 (НуСlоnе)) використовували як контроль (Середовища). 15 94231 На 3, 5 і 7 дні інкубації клітини підраховували й забарвлювали за допомогою тетраметилродаміну етилового ефіру (TMRE) (Molecular Probes Inc.) (Lena Thyrell, et al. The Journal of Biological Chemistry Vol. 279, No. 23, Issue of June 4, pp. 24152-24162, 2004) протягом 10 хвилин. TMREпозитивні (життєздатні) і TMRE-негативні (апоптозні) клітини лімфоми з малих лімфоцитів визначали за допомогою протокової цитометрії (B.D. FACS Aria). Кількість життєздатних клітин лімфоми з малих лімфоцитів розраховували множенням загаль 16 ної кількості клітин на відсоток TMRE-позитивних клітин у кожний момент часу. Експеримент повторювали з п'ятьма зразками від хворих лімфомою з малих лімфоцитів, і усереднений результат (n=5) показав, що олігонуклеотиди значно індукують апоптоз клітин лімфоми з малих лімфоцитів (таблиця 2), що вказує на те, що олігонуклеотиди можна використовувати для лікування лімфоми з малих лімфоцитів шляхом індукування апоптозу клітин. Таблиця 2 Індукований олігонуклеотидами апоптоз клітин лімфоми з малих лімфоцитів Життєздатні клітини лімфомі з малих лімфоцитів (%) (n=5) Час інкубації (дні) Групи Оліго1 Оліго3 Оліго4 Оліго5 Оліго6 Оліго7 Оліго8 Оліго9 Оліго10 Середовище 2006 2216 3 53,5 83,9 61,1 57,2 56,2 60,5 50,2 54,2 56,5 81,2 67,6 68,5 Приклад 5 Індуковане олігонуклеотидами збільшення експресії CD40 на клітинах лімфоми з малих лімфоцитів 1. Приготування клітин лімфоми з малих лімфоцитів людини Клітини лімфоми з малих лімфоцитів людини виділяли від хворих за допомогою методів, описаних у прикладі 4. 2. Індуковане олігонуклеотидами збільшення експресії CD40 на клітинах лімфоми з малих лімфоцитів £ Клітини лімфоми з малих лімфоцитів інкубували з Оліго1, Оліго3, Оліго4, Оліго5, Оліго6, Оліго7, Оліго8, Оліго9, Оліго10, 2006 або 2216, відповідно, у кінцевій концентрації 3 мкг/мл у середовищі RPMI 1640 (НуСіопе) з 10% АВ-сироватки людини при 106 клітин/ямку в 48-ямковому планшеті. Олігонуклеотиди розводили у вільному від сироватки середовищі RPMI 1640 (НуСlоnе). Рівний об'єм середовища для розведення (вільного від сироватки середовища RPMI 1640 (НуСlоnе)) використовували як контроль (Середовища). На 7 день інкубації клітини підраховували та забарвлювали за допомогою міченого FITS антитіла проти CD40 (Becton Ickinson) (Molecular Probes Inc) (Lena Thyrell, et al. The Journal of Biological Chemistry Vol. 279, No. 23, Issue of June 4, pp. 24152-24162, 2004) протягом 10 хвилин. Забарвлені антитілом проти CD40 клітини лімфоми з малих лімфоцитів визначали за допомогою протоко 5 7 26,7 38,4 36,9 37,4 36,1 40,3 37,4 39,7 37,6 78,4 45,3 58,7 18 29,1 29,7 21,3 32,1 31,1 30,2 25,4 29,3 77,1 41,1 52,1 вої цитометрії (B.D. FACS Aria). Результат (Фіг.2) показав, що олігонуклеотиди значно збільшують експресію CD40 на клітинах лімфоми з малих лімфоцитів, що вказує на те, що олігонуклеотиди можна використовувати для лікування лімфоми з малих лімфоцитів шляхом збільшення експресії CD40 на клітинах. Збільшення експресії CD40 стимулює апоптоз клітин лімфоми з малих лімфоцитів, індукує інгібування росту клітин лімфоми з малих лімфоцитів і робить клітини лімфоми з малих лімфоцитів більш імуногенними для стимулювання утворення СТ, специфічних відносно клітин лімфоми з малих лімфоцитів. Експеримент повторювали з п'ятьма зразками з одержанням схожих результатів. Приклад 6 Індукований олігонуклеотидами апоптоз клітин B-ALL людини 1. Приготування клітин В-ALL людини Зразки крові від хворих B-ALL (патологічно ідентифікованих), що не проходили лікування (The First Hospital, Jilin University, China), брали після одержання затвердженої згоди в письмовій формі. РВМС виділяли за допомогою центрифугування в градієнті щільності фікола-пака (Pharmacia). CD19+CD-10-клітини B-ALL у РВМС очищували за допомогою набору для виділення В-клітин (Miltenyi Biotec, Bergisch Gladbach, Germany) до чистоти, що становить більше 95% CD19+CD-10-клітин (BALL-клітини). Приготування клітин здійснювали відповідно до керівництва Miltenyi Biotec. 17 94231 2. Індукований олігонуклеотидами апоптоз клітин В-ALL людини Клітини B-ALL інкубували з Оліго1, Оліго3, Оліго4, Оліго5, Оліго6, Оліго7, Оліго8, Оліго9, Оліго10, 2006 або 2216, відповідно, у кінцевій концентрації 3 мкг/мл у середовищі RPMI 1640 (НуСlоnе) з 10% АВ-сироватки людини при 106 клітин/ямку в 48-ямковому планшеті. Олігонуклеотиди розводили у вільному від сироватки середовищі RPMI 1640 (НуСlоnе). Рівний об'єм середовища для розведення (вільного від сироватки середовища RPMI 1640 (НуСlоnе)) використовували як контроль (Середовища). На 3, 5 і 7 день інкубації клітини підраховували й забарвлювали за допомогою тетраметилродаміну етилового ефіру (TMRE) (Molecular Probes Inc) 18 (Lena Thyrell, et al. The Journal of Biological Chemistry Vol. 279, No. 23, Issue of June 4, pp. 24152-24162, 2004) протягом 10 хвилин. TMREпозитивні (життєздатні) і TMRE-негативні (апоптозні) клітини B-ALL визначали за допомогою протокової питометрії (B.D. FACS Aria). Кількість життєздатних клітин B-ALL розраховували множенням загальної кількості клітин на відсоток TMREпозитивних клітин у кожний момент часу. Експеримент виконували з десятьма зразками крові від хворих B-ALL, і усереднений результат (n=10) показав, що олігонуклеотиди значно індукують апоптоз клітин B-ALL (таблиця 3), демонструючи, що олігонуклеотиди можна використовувати для лікування B-ALL шляхом індукування апоптозу клітин B-ALL. Таблиця 3 Індукований олігонуклеотидами апоптоз клітин B-ALL Групи Оліго1 Оліго3 Оліго4 Оліго5 Оліго6 Оліго7 Оліго8 Оліго9 Оліго10 Середовище 2216 2006 Життєздатні клітини В-ALL (%) (n=10) Час інкубації (дні) 3 5 66,9 60,1 67,9 64,1 69,2 66,2 70,6 68,2 66,4 61 75,9 70,1 80,1 74,9 67,2 63,1 72,6 68,1 91,5 92,7 94,9 95 62,9 58,4 Приклад 7 Збільшення експресії CD40 на клітинах B-ALL за допомогою олігонуклеотидів 1. Приготування клітин B-ALL людини Клітини B-ALL людини одержували зі зразків крові хворих за допомогою методів, описаних у прикладі 6. 2. Збільшення експресії CD40 на клітинах BALL людини за допомогою олігонуклеотидів Клітини B-ALL інкубували з Оліго1, Оліго3, Оліго4, Оліго5, Оліго6, Оліго7, Оліго8, Оліго9, Оліго10, 2006 або 2216, відповідно, або без них у кінцевій концентрації 3 мкг/мл у середовищі RPMI 1640 (НуСlоnе) з 10% АВ-сироватки людини при 106 клітин/ямку в 48-ямковому планшеті. Олігонуклеотиди розводили у вільному від сироватки середовищі RPMI 1640 (НуСlоnе). Рівний об'єм середовища для розведення (вільного від сироватки середовища RPMI 1640 (НуСlоnе)) використовували як контроль (Середовища). 7 59,5 65 65,7 67 60,3 69,2 72,3 62,9 65,3 93,1 93,5 59 На 3, 5 і 7 день інкубації клітини підраховували й забарвлювали за допомогою міченого FITS антитіла проти CD40 (Becton Ickinson) (Molecular Probes Inc) (Lena Thyrell, et al. The Journal of Biological Chemistry Vol. 279, No. 23, Issue of June 4, pp. 24152-24162, 2004) протягом 10 хвилин. Забарвлені антитілом проти CD40 клітини B-ALL визначали за допомогою протокової цитометрії (B.D. FACS Aria). Експеримент повторювали з десятьма зразками, і усереднений результат (таблиця 4) показав, що олігонуклеотиди значно збільшують експресію CD40 на клітинах В-ALL, що вказує на те, що олігонуклеотиди можна використовувати для лікування B-ALL шляхом збільшення експресії CD40 на клітинах. Збільшення експресії CD40 стимулює апоптоз клітин B-ALL, індукує інгібування росту клітин B-ALL і робить клітини B-ALL більш імуногенними для стимулювання утворення СТ, специфічних відносно клітин В-ALL. 19 94231 20 Таблиця 4 Збільшення експресії CD40 на клітинах B-ALL за допомогою олігонуклеотидів Експресія CD40 на клітинах В-клітинного гострого лімфоцитарного лейкозу (MFI) (n=10) Час інкубації (дні) Групи 3 5 7 Оліго1 33,6 33,9 34,2 Оліго3 29,9 29,1 30,2 Оліго4 30,1 29,9 31,6 Оліго5 25,3 26,6 26,9 Оліго6 32,9 32,8 33,1 Оліго7 27,8 28,1 29,2 Оліго8 15,9 17,2 17,8 Оліго9 28,2 28,1 29,2 Оліго10 26,9 27,4 27,8 Середовище 7,2 7,9 8,5 2216 9,9 9,5 10,6 2006 33,7 33,8 34,1 Приклад 8 Індукована олігонуклеотидами продукція IL-10 клітинами B-CLL 1. Приготування клітин B-CLL людини Клітини B-CLL людини виділяли від хворих BCLL за допомогою методів, описаних у прикладі 2. 2. Індукована олігонуклеотидами продукція IL10 клітинами B-CLL Клітини B-CLL інкубували з Оліго1, Оліго3, Оліго4, Оліго5, Оліго6, Оліго7, Оліго8, Оліго9, Оліго10, відповідно, або без них у кінцевій концентрації 3 мкг/мл у вільному від сироватки середовищі RPMI 1640 (НуСlоnе) при 106 клітин/ямку в 48ямковому планшеті в трьох повторах. Олігонуклеотиди розводили у вільному від сироватки середовищі RPMI 1640 (НуСlоnе). Рівний об'єм середовища для розведення (вільного від сироватки середовища RPMI 1640 (НуСlоnе)) використовували як контроль (Середовища). Супернатант культур збирали через 24 години або у вказані моменти часу та оцінювали у відно шенні IL-10 у системі імунологічних ранжованих рядів Fluorokine MAP Immunoarray (R&D Systems). Отримані авторами даного винаходу дані показали, що пусковий механізм із використанням олігонуклеотидів призводить до продукції високого рівня IL-10 клітинами B-CLL (таблиця 5). Крім того, отримані надалі авторами даного винаходу дані показали, що додавання екзогенного rh-IL-10 (Schering Corp.) до культур клітин B-CLL індукує апоптоз клітин B-CLL залежним від дози IL-10 способом, якому можна специфічно блокувати антитілом проти IL-10 (R&D Systems). Ці відкриття демонструють, що олігонуклеотиди можна використовувати для лікування B-CLL шляхом індукції продукції IL-10, що провокує апоптоз клітин B-CLL аутокринним способом. Експеримент повторювали із принаймні десятьма зразками від хворих B-CLL з одержанням схожих результатів. Таблиця 5 Індукована олігонуклеотидами продукція інтерлейкіну-10 клітинами B-CLL Продукція IL-10 клітинами B-CLL Група Оліго1 Оліго3 Оліго4 Оліго5 Оліго6 Оліго7 Оліго8 Оліго9 Оліго10 Середовище Приклад 9 Вплив олігонуклеотидів на проліферацію нормальних PBMS людини PBMS людини виділяли з лейкоцитних плівок нормальної крові донорів (The Blood Center of Jilin пг/мл 800 621 469 523 112 576 502 455 752 1,2 Province, China) за допомогою центрифугування в градієнті щільності фікола-гіпака (Pharmacia). Життєздатність PBMS становила 95-99%, як визначено по виключенню трипанового синього. 21 PBMS (6Х105/ямку) помішували в 96-ямкові планшети з U-подібним дном (Costar) і культивували з Оліго1, Оліго3, Оліго4, Оліго5, Оліго6, Оліго7, Оліго8, Оліго9, Оліго10, 2006 або 2216, відповідно, у кінцевій концентрації 6 мкг/мл у трьох повторах протягом 36 годин з наступним додаванням [3Н]-тимідину (New England Nuclear, Boston, MA) і інкубуванням протягом 16 годин. Клітини збирали на фільтри зі скловолокна та визначали в сцинтиляційному лічильнику. Проліферацію клітин виражали в імп/хв (з ямок трьох повторів). Представлено дані, отримані при використанні п'яти зразків нормальної крові. Як контролі використо 94231 22 вували 2006 і 2216. Результати показали, що олігонуклеотиди явно можуть стимулювати проліферацію PBMS (Фіг.3), що вказує на те, що олігонуклеотиди, замість індукування апоптозу, є такими, що стимулюють проліферацію нормальних PBMS людини та не є токсичними у відношенні культивованих клітин. Після опису даного винаходу в деталях і з посиланням на переважні варіанти здійснення для фахівців у даній галузі буде очевидно, що можливі модифікації й варіації без відхилення від обсягу винаходу, зумовленого наступною прикладеною формулою винаходу. 23 94231 24 25 94231 26 27 Комп’ютерна верстка А. Рябко 94231 Підписне 28 Тираж 23 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюOligonucleotides or their functional homologues, a composition comprising the same and a method of treating b cell neoplasm
Автори англійськоюWang Li-ying, Bao Mu-sheng, Yu Yong-li
Назва патенту російськоюОлигонуклеотиды или их функциональные гомологи, композиция, которая содержит их, и способ лечения в-клеточной опухоли
Автори російськоюВан Ли-ин, Бао Му-шен, Юй Юн-ли
МПК / Мітки
МПК: A61K 31/7088, C12N 15/00, C07H 21/04, A61P 35/02
Мітки: композиція, пухлини, спосіб, містить, в-клітинної, їх, функціональні, гомологи, лікування, олігонуклеотиди, яка
Код посилання
<a href="https://ua.patents.su/14-94231-oligonukleotidi-abo-kh-funkcionalni-gomologi-kompoziciya-yaka-mistit-kh-ta-sposib-likuvannya-v-klitinno-pukhlini.html" target="_blank" rel="follow" title="База патентів України">Олігонуклеотиди або їх функціональні гомологи, композиція, яка містить їх, та спосіб лікування в-клітинної пухлини</a>
Попередній патент: Композиція, яка містить волокна цитрусових фруктів та її застосування в виробництві м’ясних продуктів
Наступний патент: Способи одержання кристалів гідроксиду алюмінію та композиція модифікатора кристалізації для їх здійснення
Випадковий патент: Взуття з повітропроникними та водонепроникними підошвою і верхом (варіанти) та спосіб виготовлення повітропроникної та водонепроникної підошви (варіанти)