Спосіб отримання суміші похідних лактиду
Номер патенту: 108835
Опубліковано: 25.06.2015
Автори: Мюлбауер Удо, олер Клаус-Дітер, Шульз Йоакім, Хаґен Рейнер, Вервей Адам Бастіан, Тетз Вольфґанґ
Формула / Реферат
1. Спосіб отримання суміші сполук формули Ia, Ib та/або Іс
 ,
,
 ,
,
 ,
,
Ia
Ib
Ic
де повністю стереоізомерно чисту сполуку формули Ia, Ib або Іс, або суміш двох або трьох сполук, де,
відповідно у вказаних сполуках R означає радикал лінійного або розгалуженого аліфатичного алкілу із 1-6 С-атомами,
перетворюють з каталізатором або сумішшю принаймні двох каталізаторів,
де, якщо спосіб починають із суміші сполук формули Ia, Ib та/або Іс, суміш цих сполук отримують знов, але зі зміненим складом,
де каталізатор вибрано з наступного:
a) оксиди, гідроксиди, карбонати, бензоати, лактати, октоати Na, K, Са, Fe, Ті, Zn, Sn або Sb, та/або
b) первинні, вторинні та/або третинні аміни, та/або аліфатичні або ароматичні N-гетероциклічні сполуки з 5-7 кільцевими атомами, або фосфіни,
де перетворення здійснюють при температурі від 80 до 160 ºС.
2. Спосіб за п. 1, де оксиди, гідроксиди, карбонати, бензоати, лактати, октоати Na, K, Са, Fe, Ті, Zn, Sn або Sb вибирають з групи, що містить СаО, К2СО3, натрій лактат, калій бензоат, станум октоат SnOc2, дибутилстанум оксид Bu2SnO, BuSnOc3, SnO.
3. Спосіб за будь-яким з попередніх пунктів, де первинні, вторинні та/або третинні аміни вибирають з групи, що містить первинні, вторинні та/або третинні аміни з 1-20 С-атомами.
4. Спосіб за п. 3, де первинні, вторинні та/або третинні аміни з 1-20 С-атомами та/або аліфатичні або ароматичні N-гетероциклічні сполуки з 5-7 кільцевими атомами або фосфіни вибирають з групи, що містить триетиламін, етилдіізопропіламін, дибутиламін, трибутиламін, триоктиламін, дициклогексиламін, 4-(N,N-диметил)амінопіридин, 2,2,6,6-тетраметилпіперидин, 1,2,2,6,6-пентаметилпіперидин та/або трибутилфосфін.
5. Спосіб за будь-яким з попередніх пунктів, де каталізатор стосовно стереоізомерно чистої сполуки формули Ia, Ib або Іс, або суміші двох або трьох сполук, застосовують у співвідношенні по масі між 1:1 та 1:10000, краще - між 1:10 та 1:5000, найкраще - між 1:100 та 1:1000.
6. Спосіб за будь-яким з попередніх пунктів, де молярне співвідношення сполук формули Іа та Іb, отримане у способі, є між 1:2 та 2:1, краще - між 1:1,2 та 1,2:1, по суті, найкраще - 1:1.
7. Спосіб за будь-яким з попередніх пунктів, де молярне співвідношення суми сполук формули Іа та Іb, отримане у способі, до сполуки формули Іс
(Іа+Іb)/Іс
є між 10:1 та 1:1, краще - між 10:1 та 2:1.
8. Спосіб за будь-яким з попередніх пунктів, де реакцію проводять за період часу між 1 хв. та 48 год., краще - між 0,5 та 4 год.
9. Спосіб за будь-яким з попередніх пунктів, де після або протягом реакції перетворення здійснюють принаймні один етап очищення суміші сполук формули Іа, Іb та/або Іс, отриманих реакцією перетворення, співвідношення суми сполук формули Іа та Іb до сполук формули Іс
(Іа+Іb)/Іс
збільшено принаймні до 10:1, краще принаймні до 100:1, ще краще принаймні до 1000:1, зокрема сполуку формули Іс по суті повністю або повністю видалено.
10. Спосіб за попереднім пунктом, де етап очищення вибрано з наступного: фільтрування, промивання, дистиляція, кристалізація та/або перекристалізація суміші сполук формули Іа, Іb та/або Іс, і також комбінація вказаних етапів очищення.
11. Спосіб за попереднім пунктом, де кристалізацію та/або перекристалізацію роблять з розплаву або з розчинників, розчинник переважно вибрано з наступного: спирти, естери, кетони, вуглеводні, зокрема, ацетон, ізопропанол, етилацетат, толуол та/або їх комбінації.
12. Спосіб за будь-яким з попередніх пунктів, де суміш після її отримання використовують для отримання аморфних полілактидів або для отримання стереокомплексів полімолочної кислоти та/або стереоблокспівполімерів молочної кислоти.
Текст
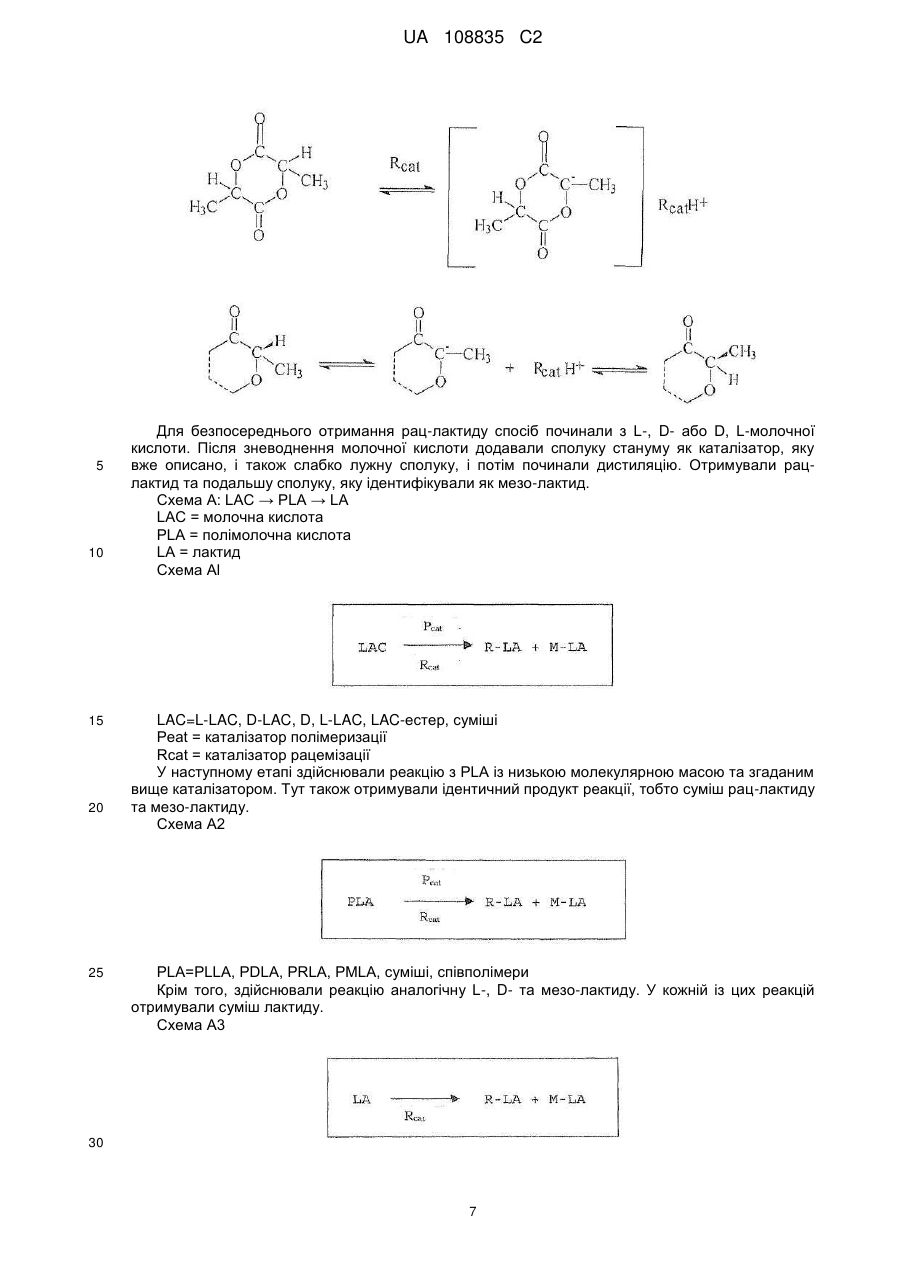
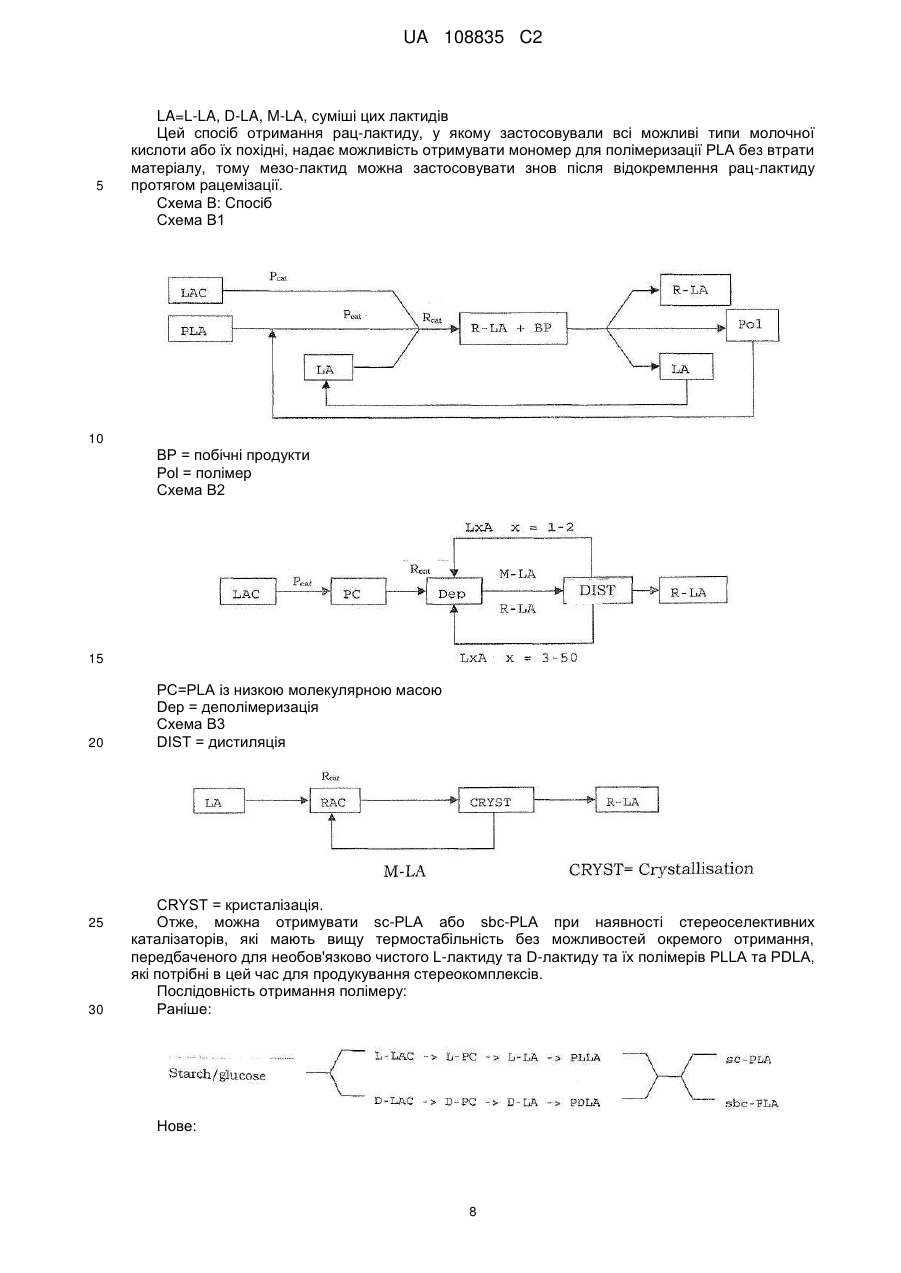
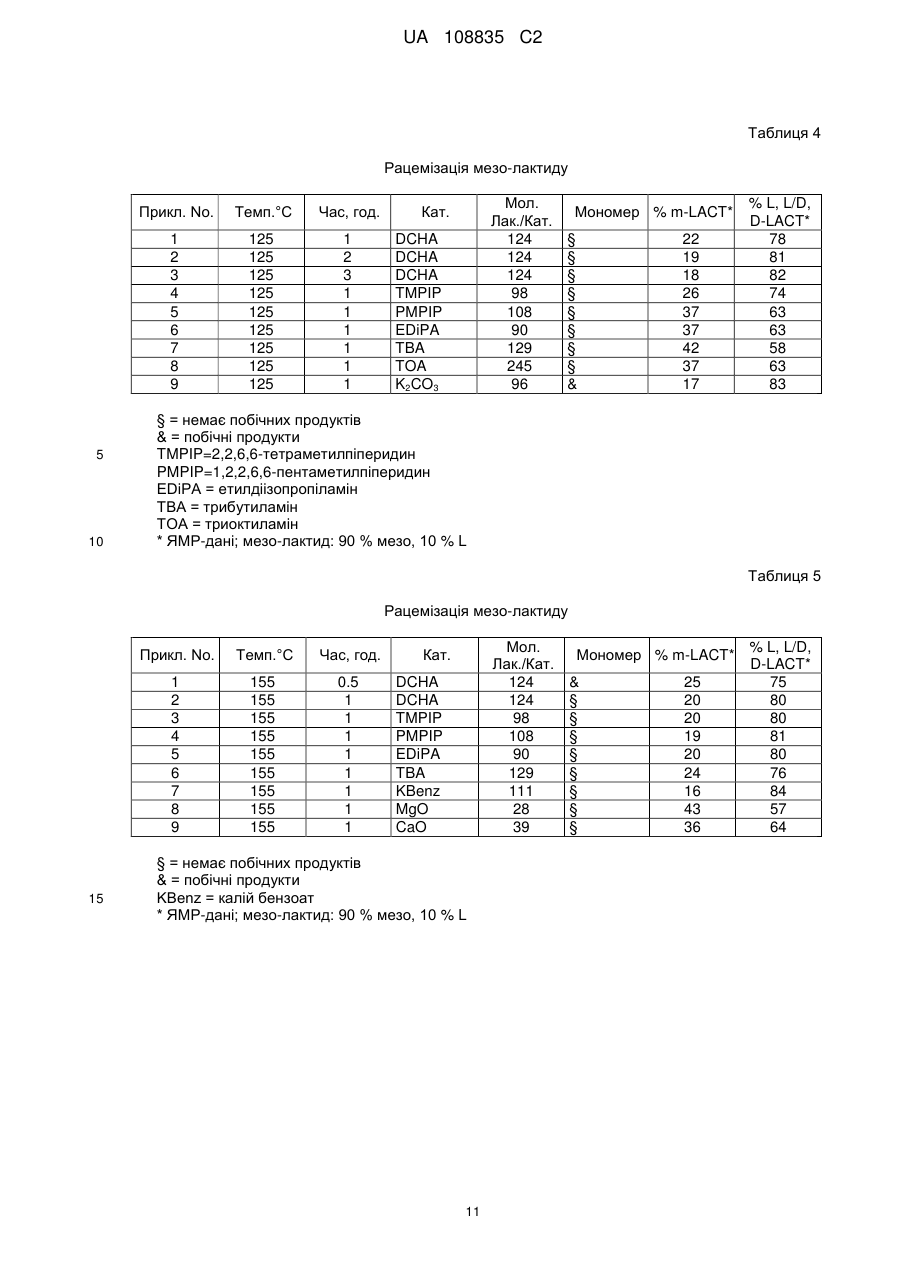
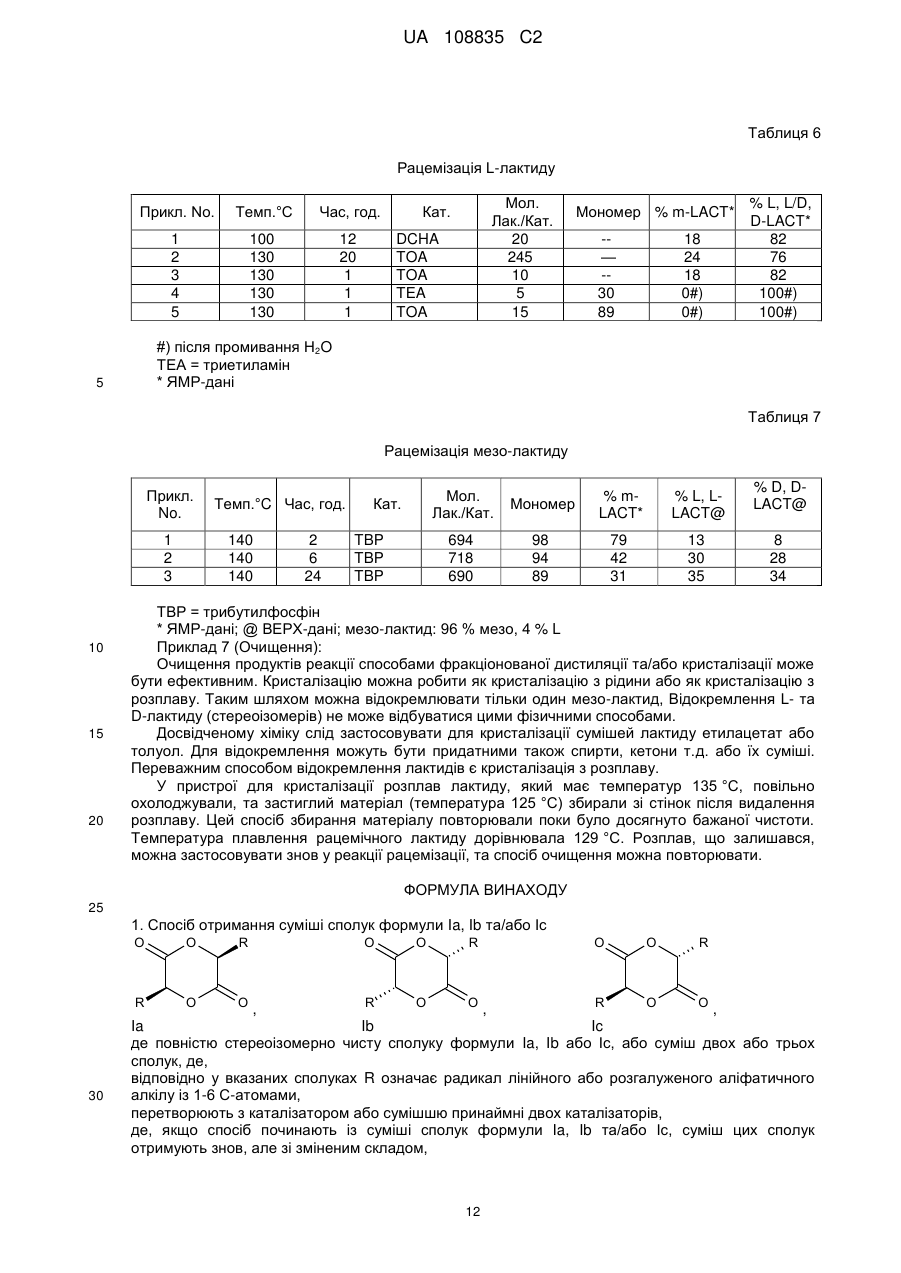
Реферат: Заявлений винахід стосується отримання суміші циклічних діестерів, отриманих із молочної кислоти та, зокрема, рацемату дилактиду. Отже, спосіб необов'язково можна починати з відповідних -гідроксикарбонових кислот, відповідних циклічних діестерів або олігомерів відповідних -гідроксикарбонових кислот. UA 108835 C2 (12) UA 108835 C2 UA 108835 C2 5 10 15 Заявлений винахід стосується трьох варіантів отримання суміші циклічних діестерів, отриманих із молочної кислоти, та, зокрема, рацемату дилактиду. Отже, спосіб необов'язково можна починати з відповідних α-гідроксикарбонових кислот, відповідних циклічних діестерів або олігомерів відповідних α−гідроксикарбонових кислот. Усі 3 варіанти способу разом охоплюють рацемізацію хірального атому карбону виділених речовин. Полімолочна кислота є перспективним біополімером. Проблемою осягнення успіху при серійному випуску полімеру є його низька термостабільність. Для можливості досягнення кращих термальних властивостей можна було б значно підвищити можливості застосування Для того щоб отримувати PLLA з оптимальними термальними властивостями, (необов'язково) потрібним є дуже чистий L-лактид (L-LA). Тепер найбільш застосовуваний спосіб отримання L-лактиду полягає в застосуванні для утворення олігомеру поліконденсації молочної кислоти у два етапи, а потім − деполімеризації. Внаслідок того що переважними є високі температури, котрі потрібні для швидкого протікання реакції, і також внаслідок катіонних домішок молочної кислоти або впливу реакційних посудин (наприклад, внаслідок корозії), існує проблема рацемізації, результатом якої є утворення як побічного продукту мезо-лактиду. Цей продукт слід відокремлювати від головного продукту, бо мезо-лактид (M-LA) має негативну дію на властивості полімеру, утвореного протягом полімеризації L-лактиду. Отже, результатом є помітне зниження температури плавлення й температури склування, а також зміна механічних властивостей. 20 Таблиця 1 Тс°C Тпл.°C 25 30 35 40 45 50 55 PLLA 55-60 140-170 PRLA 50-55 PMLA (a/s) 40-45/34 -/153 sc-PLA 80-90 210-230 sbc-PLA 50-55 185-195 Тс: температура склування Тпл.: точка плавлення PLLA: L-полімолочна кислота PRLA: рацемічна полімолочна кислота PMLA: мезо-полімолочна кислота a: аморфний s: синдотактичний sc: стереокомплекс sbc: стереоблоксополімер Мезо-лактид, як-то L-лактид, є циклічним діестером із двома необов'язково активними атомами карбону в кільці. Він має оптичний R- та S-центр і тому необов'язково є неактивним. Полімеризація мезо-лактиду призводить до аморфного полімеру; застосовуючи стереоселективний каталізатор можна отримати синдіотактичний полімер (Tina M. Quitt and Geoffrey W. Coates, J. Am. Chem. Soc. 1999, 121, 4072-4073), термальні властивості якого, однак, є гіршими ніж у PLLA. Стереокомплекси полімолочної кислоти (PLA) можуть вирішити проблему низької термальної стабільності, але оптичний аналог L-полімолочної кислоти (PLLA) є потрібним для отримання стереокомплексів. D-Полімолочна кислота (PDLA) є доступною тільки в малих кількостях та є дуже дорогою. Рац-лактид на цей час можна отримувати плавленням рівних кількостей D, D- та L, Lлактиду. Оскільки D, D-лактид є відносно дорогим внаслідок великої складності отримання Dмолочної кислоти, повторне застосування як мономеру для отримання полімолочної кислоти має на цей час більш ніж теоретичне зацікавлення. Отже, властивості D, D-L, L-стереополімерів є дуже важливими, бо ці речовини мають значно кращі термостабільності та можуть усувати один із недоліків полімолочної кислоти. Уже відомі. дилактиди, котрі є складовими енантіомерів молочної кислоти. У WO 1984/04311 Al описано спосіб отримання полімеру з капролактону та лактиду, який застосовують для отримання звичайних предметів медицини та засобів нагляду. Дилактид є в продажу та переважно складається із двох енантіомерів молочної кислоти, L-(-)- та D-(+)-молочної кислоти. Цю суміш звичайно асоційовано з дилактидом, і вона містить ті ж самі енантіомери молочної кислоти, тобто енантіомери D-молочної кислоти або L-молочної кислоти. Відсутні посилання на отримання цих дилактидів, скомпонованих із тих самих енантіомерів. Полімеризація суміші мезо-лактиду та L-лактиду призводить до співполімеру, термальні властивості якого є нижчими ніж у PLLA. Мезо-лактид також можна застосовувати в отриманні 1 UA 108835 C2 рацемічної молочної кислоти (D/L-LA) гідролізом водою. Однак, ці заявки з комерційної точки зору мають тільки другорядний інтерес внаслідок зростання економічної вартості. Отже, виходячи із цього, згідно із заявленим винаходом запропоновано спосіб отримання суміші циклічних діестерів загальної формули la, Ib та/або Ic 5 10 Цієї мети досягнуто за п. 1 формули винаходу. Особливу суміш, яку можна отримати цим способом указано в п. 12 формули винаходу. У п. 12 формули винаходу описано можливості застосування суміші, утвореної способом згідно з винаходом. Отже, згідно з винаходом показано три варіанти отримання згаданої вище суміші. Згідно з першим варіантом заявленого винаходу запропоновано спосіб отримання суміші сполук формули la, Ib та/або Ic , 15 де α−гідроксикарбонову кислоту формули Ila та/або lib 20 25 30 35 40 (відповідно в сполуках формули I та II, R − лінійний або розгалужений аліфатичний алкілрадикал із 1 − 6 C-атомами) перетворено з каталізатором або сумішшю, принаймні, двох каталізаторів. Згідно із цим першим варіантом способу згідно з винаходом отримання суміші сполук la, Ib та/або Ic спосіб починається з α−гідроксикарбонової кислоти формули la та/або Ib, які перетворено у присутності множинності каталізаторів. Отже, відповідно обидві сполуки la та Ib можна застосовувати як суттєво або повністю енантіомерно чисті сполуки, однак, спосіб також можна починати із суміші двох енантіомерно чистих сполук у будь-якому стехіометричному співвідношенні. Зрозуміло, що "по суті енантіомерно чиста" − це суміш сполук la та Ib із енантіомерним надлишком більше 99 %. Згідно із другим варіантом способу отримання згаданої вище суміші сполуку la, Ib та/або Ic по суті або повністю стереоізомерно чисту сполуку формули la, Ib або Ic, або також суміш la, Ib та Ic перетворювали з каталізатором або із сумішшю, принаймні, двох каталізаторів. Отже, зрозуміло, що "по суті стереоізомерно чиста" означає суміш сполук la, Ib та/або Ic, де одна з указаних сполук є присутньою в надлишку стосовно суми двох інших сполук, принаймні, у 99 %. Згідно з винаходом цей варіант способу починається з одиничної сполуки формули la, Ib або Ic, у цьому способі має місце конверсія стереоцентрів застосованих циклічних діестерів. Якщо спосіб починається із суміші сполук la, Ib та/або Ic, суміш цих сполук отримують знов, але зі зміненим складом. Згідно із третім варіантом способу винаходу запропоновано отримання суміші сполук la, Ib та/або Ic, у котрій олігомерну або полімерну гідроксикарбонову кислоту загальної формули 2 UA 108835 C2 5 10 15 20 25 30 35 40 45 50 (n=1 − 50 у формулі III) перетворюють із каталізатором або сумішшю, принаймні, двох каталізаторів. Отже, згідно із цим третім варіантом запропоновано деполімеризацію олігомерної або полімерної гідроксикарбонової кислоти формули III. Згідно зі способом варіанту III всі можливі стереоізомери можна застосовувати для гідроксикарбонової кислоти формули III. Це вказано у формулі III звивистим зв'язком радикалу R. Отже, абсолютна конфігурація відповідного стереоцентру (R або S) є недоречною. По суті, каталізатор можна вибирати для всіх трьох згаданих вище варіантів способу згідно з винаходом із наступної групи: a) сполуки металу груп 1 − 14 періодичної системи елементів, краще − солі металу та/або металоорганічні сполуки, алкоксиди, оксиди, солі органічних кислот, подальші переважні солі металу та/або металоорганічні сполуки Na, K, Mg, Ca, Fe, Ti, Zn, Sn, Sb, ще краще − їх оксиди, гідроксиди, карбонати, бензоати, лактати, октоати, зокрема, MgO, CaO, K2CO3, натрій лактат, калій бензоат, станум октоат SnOc2, дибутилстанум оксид Bu2SnO, BuSnOc3, SnO та/або b) нітроген-умісні або фосфор-умісні органічні сполуки, переважно − первинні, вторинні та/або третинні аміни та/або аліфатичні, ароматичні N-гетероциклічні сполуки з 5-7 кільцевими атомами або фосфіни, подальші переважні первинні, вторинні та/або третинні аміни з 1 − 20 Cатомами, конкретно переважні − триетиламін, етилдіізопропіламін, дибутиламін, трибутиламін, триоктиламін, дициклогексиламін, 4-(N, N-диметил)-амінопіридин, 2,2,6,6-тетраметилпіперидин, 1,2,2,6,6-пентаметилпіперидин та/або трибутилфосфін. Згідно з винаходом у трьох варіантах найкраще розрізняють три типи каталізаторів: 1. Каталізатори полімеризації 2. Каталізатори рацемізації 3. Стереоселективні каталізатори. 1. Велика кількість сполук відома як каталізатори полімеризації PLA. Найчастіше це солі металу або металоорганічні солі, як-то алкоксиди, оксиди, солі органічних кислот т.д. Станум октоат (SnOc2) є найбільше застосовуваним. Крім того, також застосовують інші сполуки стануму, як-то, наприклад, BuSnOc3, Bu2SnO, SnO, або також станум. Також можна застосовувати сполуки Ti, Fe, Zn, Sb т.д. 2. Каталізаторам рацемізації, котрі застосовують для рацемізації лактидів, слід бути слабколужними сполуками та не діяти на полімеризацію з розкриттям циклу (ROP). Тут знайдено три класи сполук: a) Оксиди металу групи la та 2a, карбонати, гідроксиди або солі органічних кислот, як-то, наприклад, натрій лактат, калій бензоат, K2CO3) MgO, CaO т.д. b) Аміни, первинні, вторинні або третинні аміни з точкою кипіння або плавлення, достатньо високими ніж ті, при котрих сполука перебуває в реакції. Переважними тут є вторинні або третинні аміни, як-то, наприклад, триетиламін (TEA), трибутиламін (TBA), триоктиламін (TOA), дибутиламін (DBA), ді-циклогексиламін (DCHA), диметиламінопіридин (DMAP) т.д. c) Первинні, вторинні або третинні фосфіни. У всіх указаних тут застосованих летючих каталізаторів точці кипіння слід бути достатньо вищою ніж та, при котрій сполука перебуває в реакції. Каталізатор рацемізації слід вибирати такий. що каталізує тільки рацемізацію але не дециклізацію лактиду. Ці дві несумісні реакції залежать від хімічної та стеричної структури каталізатору. Дециклізація робить більш важким відокремлення суміші лактиду після рацемізації та зменшує вихід. Чистота рацемічної суміші лактиду після відокремлення є важливою для стереоселективного каталізу при отриманні sc-PL та sbc-PLA. Внаслідок наявності стеричних перепон активного центру вторинні та третинні аміни та фосфіни є переважними каталізаторами. Конкретно переважними є об'ємні органічні радикали, як-то, наприклад, група циклогексилу в DCHA. 3 UA 108835 C2 5 10 15 20 25 30 35 40 45 50 Утруднена дециклізація та їх слабка лужна активність є достатньою для рацемізації. Однак, усі вказані каталізатори втрачають селективність при високих температурах або при довгому часі реакції. 3. Стереоселективні каталізатори (Spassky et al., Macromol. Chem. Phys. (1996), 197, 2672; Ovitt and Coates, J. Am. Chem. Soc, (2002), 124, 1316; Radano and Baker, J. Am. Chem. Soc, (2000), 122, 1552) є дуже специфічними каталізаторами полімеризації, які мають хіральний центр. Вони каталізують виключно реакцію полімеризації специфічних ізомерів. Тут розрізнюють різні типи. Один клас цих каталізаторів може каталізувати тільки реакцію ізомеру (L, L/D, Dлактид + ssc → PLLA+D, D-лактид), хоч інший тип із двома активними центрами може полімеризувати два ізомери за той же час (L, L/D, D-лактид + ssc → PLLA+PDLA=sc-PLA). Також відомі каталізатори, які можуть полімеризувати почергово L- або D-лактид (L, L/D, D-лактид + ssc → (PLLA-co-PDLA)n=sbc-PLA). Крім того, згідно зі згаданими вище варіантами способу згідно з винаходом є сприятливим, якщо каталізатор, стосовно різних варіантів відповідних виділених речовин, як-то α−гідроксикарбонова кислота формули ІІa та/або ІІb по суті стереоізомерно чиста або стереоізомерно чисті сполуки формули la, Ib або Ic, або суміш двох або трьох сполук, або олігомерні або полімернї гідроксикарбонові кислоти загальної формули III, застосовано у співвідношенні по масі між 1: 1 та 1: 10000, краще − між 1: 10 та 1: 5000, найкраще − між 1: 100 та 1: 1000. Несподівано, удалося виявити, що отримане в способі краще молярне співвідношення сполук формули la та Ib є між 1: 2 та 2:1, краще − між 1: 1,2 та 1,.2: 1, по суті, найкраще − 1:1. Крім того, несподівано знайдено, що отримане в способі краще молярне співвідношення суми сполук формули la та Ib до сполуки формули Ic є між 10: 1 та 1:1, краще − між 10: 1 та 2:1. У подальшому корисному втіленні реакцію проводять при температурах між 80 та 300 °C, краще − між 100 та 200 °C, найкраще − між 120 та 160 °C. Краще реакцію проводять протягом періоду 1 хвил. − 48 год., краще − 0.5 − 4 год. Найкраще, якщо після або протягом реакції перетворення відбувається або здійснюється, принаймні, один етап очищення суміші сполук формули la, Ib та/або Ic, отриманих реакцією перетворення, то співвідношення суми сполук формули la та Ib до сполук формули Ic збільшено, принаймні, до 10: 1, краще, принаймні, до 100: 1, ще краще, принаймні, до 1000: 1, зокрема, тоді сполуку формули Ic по суті повністю або повністю видалено. Отже, зрозуміло, що "по суті повністю видалено" означає зменшення вмісту сполуки Ic до концентрацій діапазону 0 /oo. Отже, згідно із цим переважним утіленням способу можливим є отримання суміші, яка містить тільки сполуки формули la та Ib. Ще краще, якщо ця суміш є рацематом, тобто еквімолярною сумішшю сполук la та Ib, яка є рацемічним лактидом. Крім того, раніше вказаний етап очищення вибрано з наступного: фільтрування, промивання, дистиляція, кристалізація та/або перекристалізація суміші сполук формули la, Ib та/або Ic, , і також комбінація вказаних етапів очищення. Отже, комбінації можуть реалізувати раніше вказані способи очищення, а потім − кожний інший один за одним або одночасно. Наприклад, фільтрування або промивання суміші, отриманої протягом реакції перетворення, є можливим для цієї мети, а потім − дистиляція або кристалізація; або, наприклад, також можливою є дистиляція, а потім − кристалізація. Кристалізацію та/або перекристалізацію можна робити з розплаву або з розчинників, розчинник краще вибирати з наступного: спирти, естери, кетони, вуглеводні т.д., наприклад, ацетон, ізо-пропанол, етилацетат, толуол та/або їх комбінації. Сирий продукт, отриманий з la, Ib та Ic, краще очищати перекристалізацією з розплав, la та Ib кристалізовано як чистий продукт. Таблиця 2 Температури плавлення лактидів Т.пл.°C L, L-лакт. 97 D, D-лакт. 97 4 M-лакт. 54 L, L/D, D-лакт. 129 UA 108835 C2 5 10 15 20 25 30 35 40 45 50 55 60 Після відокремлення розплаву, що залишається протягом кристалізації та містить сполуку Ic можливо в суміші з la та/або Ib, , останнє можна повернути до етапу реакції. Таким шляхом, наприклад, можна повністю завершити реакцію перетворення Ic до еквімолярної суміші la та Ib. Краще по суті енантіомерно чисту або енантіомерно чисту сполуку формули Ila або lib можна застосовувати згідно з варіантом 1). Згідно з винаходом найкращий спосіб полягає в отриманні еквімолярної суміші двох енантіомерів дилактиду молочної кислоти, D, D-дилактиду та L, L-дилактиду, де a) (-)-форму L-(-)-молочної кислоти перетворено із триоктиламіном у триоктиламоній лактат, b) триоктиламоній лактат дистильовано в присутності каталізатору, отриману фракцію скомпоновано по суті із двох енантіомерів дилактиду молочної кислоти, D, D-дилактиду та L, Lдилактиду, та вона ще може місти D, L-лактид, c) згадану вище фракцію змішували з ацетоном та потім перекристалізовували та отримували безбарвні кристали з точкою плавлення 112 − 119 °C, які мали по суті еквімолярний або еквімолярний склад D, D-дилактиду та L, L-дилактиду. Згідно з винаходом надано кращу можливість отримання рацемату L, L-дилактиду та D, Dдилактиду. Отже, одночасно має місце реакція перетворення (реакція з каталізатором) та перший етап очищення (дистиляція). Згідно з винаходом можливості застосування суміші, утвореної згідно зі способом згідно з винаходом, наприклад, складаються з подальшого отримання (наприклад, безпосередньо після способу згідно з винаходом) аморфних полілактидів та, зокрема, отримання стереокомплексу полімолочної кислоти та/або стереоблоксополімерів молочної кислоти зі стереоселективними каталізаторами. Варіант 1), зокрема, стосується способу отримання еквімолярної суміші D, D-дилактиду та L, L-дилактиду, способу отримання цих речовин, починаючи з L-(-)-молочної кислоти, яку перетворювали із триоктиламіном у триоктиламоній лактат, який піддавали розділенню дистиляцією (як-то конденсація двох одиниць молочної кислоти з рацемізацію), отриманий дистилят перекристалізовували з ацетону, і, таким чином, згідно з винаходом отримували дилактид. Тепер знайдено, що суміш дилактиду, яка містить у рівних частинах D, D-дилактид та L, Lдилактид, можна легко утворювати, якщо дистилят, отриманий із термолізу амоній лактату, піддавали перекристалізації. Отже, отримана суміш дилактиду має суттєві переваги в отримання полімерів із молочної кислоти, які мають покращені фізичні властивості. Для того щоб отримувати цей дилактид, спосіб починали з L-молочної кислоти, яку перетворювали із триоктиламіном у триоктиламоній лактат. Три-н-октиламін застосовувати краще як триоктиламін. Таким чином отримували триоктиламоній лактат, який піддавали розділенню дистиляцією (як-то конденсація двох одиниць молочної кислоти з рацемізацією). Протягом розділення дистиляцією отримували суміш, яка містить молочну кислоту та триоктиламін. Подальша фракція містить дилактид, який спочатку після дистиляції був безбарвний як вода, а потім усе більше жовтів. Розділення дистиляцією (як-то конденсація двох одиниць молочної кислоти з рацемізацією) мало місце в присутності каталізатору. Фракція від розділення дистиляцією, яка переважно містить дилактид, перекристалізовували після охолодження. Як розчинник краще застосовувати ацетон. Отримували безбарвні кристали, які мають точку плавлення 112 °C − 119 °C. Отримані кристали піддавали аналізу газовою хроматографією, застосовуючи колонку для хірального розділення. Протягом аналізу спостерігали дві однакові області сигнальних піків, які стосуються D, D-дилактиду та L, L-дилактиду. Стереохімічну конфігурацію дилактидів підтверджували ферментативним гідролізом дилактидів, де отримували суміш, скомпоновану з такою ж масою молочної кислоти відповідно одної стереохімічної конфігурації. У неочищеному дистиляті додатковий значно слабший сигнал отримували протягом гідролізу при процесі аналізу газовою хроматографією, який відносили до мезо-лактиду (димер D- та L-молочної кислоти). Отже, зокрема, заявлено спосіб отримання еквімолярної суміші двох енантіомерів дилактиду молочної кислоти, один енантіомерний дилактид, який позначено як D, D-дилактид, отримували із двох (+)-форм енантіомерів молочної кислоти, та інший енантіомерний дилактид, який позначено як L, L-дилактид, отримували із двох (-)-форм енантіомерів молочної кислоти, де • триоктиламоній лактат утворено по-перше з (-)-форми L-(-)- молочної кислоти та триоктиламіну, • отриманий триоктиламоній лактат піддавали розділенню дистиляцією (суміш триоктиламіну та молочної кислоти знов дистильовано) та 5 UA 108835 C2 5 10 15 20 25 30 35 40 • розділення дистиляцією триоктиламоній лактату робили в присутності каталізатору та • отримували подальшу фракцію, яку скомпоновано з переважною долею дилактиду молочної кислоти та яка може містити ще D, L-дилактид та • цю фракцію змішували з ацетоном, та перекристалізовували для того, щоб отримати безбарвні кристали з точкою плавлення 112 − 119 °C, які скомпоновано еквімолярно щодо D, Dдилактиду та L, L-дилактиду. Утворення енантіомерно подібних дилактидів з енантіомерно чистої молочної кислоти як вихідного матеріалу можна пояснювати тим, що вміст триоктиламіну протягом дистиляції здійснює рацемізацію молочної кислоти, яка тоді утворює рацемічний триоктиламоній лактат, який після розділення дистиляцією краще кристалізується для утворення енантіомерно подібного. дилактиду Вихідний матеріал мав енантіомерну чистоту D-молочної кислоти, приблизно, 1 процент за масою. Також заявлено спосіб, де отриману суміш скомпоновано у відповідно рівних частинах 40 − 50 процентів за масою D, D-дилактиду та L, L-дилактиду, та суміш містить іншу складову, наприклад, мезо-лактид (D, L-дилактид). Згідно з отриманням інша складова також може охоплювати оліголактиди або додаткові продукти дистиляції. Розділення дистиляцією триоктиламоній лактату краще робити в присутності каталізатору. Стануморганічні сполуки є конкретно приданими для цієї мети. Наприклад, дибутилстанум оксид застосовують як каталізатор у кількості 0.1 − 1 процент за масою стосовно суміші у дистиляційному відстійнику протягом розділення дистиляцією. Для бажаної чистоти та виходу дилактиду розділення дистиляцією робили на дистиляційній колонці. Застосування дистиляційної колонки є переважним для дистиляції у вакуумі (наприклад, 20 Мбар). Протягом розділення дистиляцією отримували попередник, який містив молочну кислоту та триоктиламін невідомого складу. Це відповідало кількості 30 − 35 процентів за масою вихідної кількості триоктиламоній лактату. Це співвідношення залежало від температури випаровувача. У дистиляті вимірювали вміст аміну, 15 процентів за масою (140 °C) − 25 процентів за масою (165 °C). Очевидно, на додаток до молочної кислоти і аміну в дистиляті також містилися ще певні кількості оліголактидів. Залишкову складову кількість дистильовано як дилактид. У дистиляційному відстійнику залишалось, приблизно, 2 − 3 проценти за масою темної коричневої рідини. Також заявлено матеріал, який отримано способом згідно з винаходом. Отже, це стосується дилактиду молочної кислоти, яку тут охарактеризовано, це стосується суміші, яку скомпоновано відповідно в рівних частинах по 50 процентів за масою D, D-дилактиду та L, L-дилактиду, та яку отримано способом згідно з винаходом. Згідно зі способом отримання суміш також може містити домішки. Тому, також заявлено дилактид молочної кислоти, яку охарактеризовано тут як суміш D, D-дилактиду та L, L-дилактиду та подальші складові, названу суміш отримано способом згідно з винаходом. Утілення способу згідно з винаходом пояснено загальною схемою отримання та експериментальними прикладами, ці приклади є тільки типовими втіленнями. Загальна схема отримання Протягом отримання лактиду здійснено рацемізацію та, окрім того, утворено бажане R-LA, M-LA. Рацемізація має місце на молекулі лактиду. Протон на асиметричному атомі карбону є чутливим до слабко лужних сполук та його видалено в рівноважній реакції. Заміщенням протону можна змінювати стереогенічний центр та формувати іншу стеричну конфігурацію. 45 6 UA 108835 C2 5 10 15 20 25 Для безпосереднього отримання рац-лактиду спосіб починали з L-, D- або D, L-молочної кислоти. Після зневоднення молочної кислоти додавали сполуку стануму як каталізатор, яку вже описано, і також слабко лужну сполуку, і потім починали дистиляцію. Отримували рацлактид та подальшу сполуку, яку ідентифікували як мезо-лактид. Схема A: LAC → PLA → LA LAC = молочна кислота PLA = полімолочна кислота LA = лактид Схема Al LAC=L-LAC, D-LAC, D, L-LAC, LAC-естер, суміші Peat= каталізатор полімеризації Rcat = каталізатор рацемізації У наступному етапі здійснювали реакцію з PLA із низькою молекулярною масою та згаданим вище каталізатором. Тут також отримували ідентичний продукт реакції, тобто суміш рац-лактиду та мезо-лактиду. Схема A2 PLA=PLLA, PDLA, PRLA, PMLA, суміші, співполімери Крім того, здійснювали реакцію аналогічну L-, D- та мезо-лактиду. У кожній із цих реакцій отримували суміш лактиду. Схема A3 30 7 UA 108835 C2 5 LA=L-LA, D-LA, M-LA, суміші цих лактидів Цей спосіб отримання рац-лактиду, у якому застосовували всі можливі типи молочної кислоти або їх похідні, надає можливість отримувати мономер для полімеризації PLA без втрати матеріалу, тому мезо-лактид можна застосовувати знов після відокремлення рац-лактиду протягом рацемізації. Схема B: Спосіб Схема B1 10 BP = побічні продукти Pol = полімер Схема B2 15 20 25 30 PC=PLA із низкою молекулярною масою Dep = деполімеризація Схема B3 DIST = дистиляція CRYST = кристалізація. Отже, можна отримувати sc-PLA або sbc-PLA при наявності стереоселективних каталізаторів, які мають вищу термостабільність без можливостей окремого отримання, передбаченого для необов'язково чистого L-лактиду та D-лактиду та їх полімерів PLLА та PDLA, які потрібні в цей час для продукування стереокомплексів. Послідовність отримання полімеру: Раніше: Нове: 8 UA 108835 C2 Ланцюг полімеру PFD 5 10 15 20 25 30 35 40 45 50 : CON LAC-концентратор RDR2 Реактивна дистиляція та реактор рацемізації MC Кристалізатор розплаву POL Пристрій полімеризації Способи аналізу: 1 H-ЯМР: ЯМР-спектр регістрували на спектрометрі Varian-Inova з 500 МГц при частоті 499.85 МГц. Зразки вимірювали, приблизно, у 5 % розчині CDCI3 із тетраметилсиланом як внутрішнім стандартом ВЕРХ: система Knauer із насосом Smartline 1000 та УФ-детектором Smartline 2500. Колонка Eurocel 03 5 мкм 250 × 4.6 мм. Розчинник гексан: етанол = 90: 10 (об'єм: об'єм) 1 мл/хвил… Концентрація зразку 1-10 мг/мл. ГХ: Perkin-Elmer Clams 500 з FID; колонка FS-CW20M-CB-0.25 (довжина = 25 м, діаметр = 0.25 мм, товщина плівки = 0.22 мкм) інж. 200 °C прогр.темп. 50-200 °C, об'єм інж… =1.0 мкл, газ = нітроген. Приклад 1: У посудині з перемішуванням триоктиламін та L-молочну кислоту (варіант 1) з оптичною чистотою 99 % L-молочної кислоти перетворювали нагріванням до триоктиламоній лактату. Це розміщали в дистилятор, який оснащено холодильником Liebig та насадкою для дистиляції Anschutz-Thiele. Крім того, уводили в приймач 1 процент за масою (стосовно молочної кислоти) дибутилстанум оксиду як каталізатору. c Тоді нагрівали до 250 °C. Спочатку отримували дві фракції при температур дистиляції 140 C та 165 °C, які згідно з газовим хроматографічним аналізом, містили 15 процентів за масою (140 °C) та 25 процентів за масою (165 °C) аміну. Потім безбарвну рідину піддавали дистилюванню, і вона отримувала жовте забарвлення при дистиляції. Рідину охолоджували та розміщували в ацетон, з якого кристалізовано безбарвні кристали з точкою плавлення 112 °C − 119 °C. Склад цього визначали ГХ-аналізом та гідролітичним розщеплення ферментами, який дорівнював відповідно до 50 процентів за масою D, D-дилактиду та L, L-дилактиду молочної кислоти. Приклад 2: Зокрема, згідно з винаходом запропоновано подальший варіант згаданого вище способу, щоб рацемізувати по суті енантіомерно чистий дилактид або мезо-дилактид і також перетворити суміш L-лактиду та/або D-лактиду, та/або мезо-лактиду рацемізацією (варіант 2). Несподівано знайдено, що вказані вище каталізатори змінюють чистий мезо-лактид або суміш мезо-лактиду та L, L-лактиду в їхню композицію. Після очищення та аналізу встановлено, що отримували рацемічний лактид, отже, каталізатор перетворював мезо-лактид у рацемічний лактид. Рацемічний лактид можна утворювати з рацемічної молочної кислоти поліконденсацією та подальшою деполімеризацією. Отже, з одного боку, є проблематичними велика кількість мезолактиду, який утворено як побічний продукт (40-60 %), та придатність, та ціна рацемату молочної кислоти. Рацемізація мезо-лактиду до рацемічного лактиду пропонує великий шанс збільшення величини мезо-лактиду, тому що із придатними стереоселективними каталізаторами можна отримувати sc-PLА та/або sbc-PLA. З економічного погляду ці продукти є дуже цікавими матеріалами, бо вони мають гарні термальні властивості в порівнянні з PLLA. 9 UA 108835 C2 5 10 15 20 25 Стимульовані цим знанням винахідники випробовували велику кількість сполук щодо їх каталітичної активності в цій реакції та несподівано знайшли, що деякі класи сполук демонструють цю дію. Сполуки також випробовували на їх активність у реакції L-лактиду та Dлактиду: рацемізацію також удалося встановити тут. Приклад 3: У круглодонній колбі із пристроєм для дистиляції,холодильником Liebig та насадкою для дистиляції Anschutz-Thiele, змішували чисту L-молочну кислоту 99 % та триоктиламін. Після додавання 1 % за масою дибутилстанум оксиду (стосовно молочної кислоти), суміш нагрівали до 250 °C та збирали дві фракції, одну − при T < 140 °C, та одну − при T=140-165 °C. ГХаналізом визначали вміст аміну 15 та 25 % за масою. Третя фракція є прозорою рідиною, з якої можна отримувати безбарвні кристали. Точка плавлення кристалів дорівнювала 112-119 °C та, за допомогою ГХ-аналізу та гідролізу з ферментами встановлено 50: 50 суміш D, D-лактиду та L, L-лактиду (варіант 1). Приклад 4: Пристрій для дистиляції наповнювали 396.8 г L-LAC та 2.93 г KOH. Після видалення води у вакуумі додавали 0.506 г SnOc2; температуру підвищували від 150 °C до 240 °C та тиск знижували до 10 Мбар. Три фракції, які збирали в діапазоні температури 100 °C − 150 °C містили сполуки. Загальний вихід − 46 % (L-LA: D-LA: M-LA=54: 18: 28) (варіант 1). Приклад 5: Пристрій для дистиляції наповнювали 253 г PLLA (Mn=750), 0.97 г Acima TW-30 (SnOc2) та 2.53 г K2CO3. Температуру підвищували до 210 °C та тиск знижували до 10 Мбар. Фракцію збирали в діапазоні температури 140 °C − 148 °C, отриманий аналіз композиції: 33 % L-лактиду, 30 % D-лактиду та 37 % мезо-лактиду з виходом 75 % (варіант 3). Приклад 6: У вільній посудині змішували лактид та каталізатор рацемізації та нагрівали до 105 °C − 155 °C. Через 1 − 6 год. реакцію зупиняли охолодженням посудини. Продукт реакції аналізували 1 H-ЯМР. Точні умови реакції, також виділені продукти та застосовані каталізатори показано в таблицях 3 − 7. 30 Таблиця 3 Рацемізація мезо-лактиду Прикл. No. Час, год. 1 2 3 4 5 6 7 8 9 35 Темп.°C 140 140 140 140 140 140 140 140 140 4 6 6 6 24 6 24 6 24 Мол. Лак./Кат. 824 825 679 693 690 709 708 718 690 Кат. K2CO3 K2CO3 TBA DCHA DCHA DMAP DMAP TBP TBP TBA = трибутиламін DCHA = дициклогексиламін DMAP = диметиламінопіридин TBP = трибутилфосфін * ЯМР-дані; мезо-лактид: 97 % мезо, 3 % L 10 Мономер % m-LACT* 82 77 94 95 87 84 20 94 89 37 27 30 34 24 27 20 47 31 % L, L/D, D-LACT* 63 73 70 66 76 73 80 53 69 UA 108835 C2 Таблиця 4 Рацемізація мезо-лактиду Прикл. No. 10 Час, год. 1 2 3 4 5 6 7 8 9 5 Темп.°C 125 125 125 125 125 125 125 125 125 1 2 3 1 1 1 1 1 1 Мол. Лак./Кат. 124 124 124 98 108 90 129 245 96 Кат. DCHA DCHA DCHA TMPIP PMPIP EDiPA TBA TOA K2CO3 Мономер % m-LACT* § § § § § § § § & 22 19 18 26 37 37 42 37 17 % L, L/D, D-LACT* 78 81 82 74 63 63 58 63 83 § = немає побічних продуктів & = побічні продукти TMPIP=2,2,6,6-тетраметилпіперидин PMPIP=1,2,2,6,6-пентаметилпіперидин EDiPA = етилдіізопропіламін TBA = трибутиламін TOA = триоктиламін * ЯМР-дані; мезо-лактид: 90 % мезо, 10 % L Таблиця 5 Рацемізація мезо-лактиду Прикл. No. Час, год. 1 2 3 4 5 6 7 8 9 15 Темп.°C 155 155 155 155 155 155 155 155 155 0.5 1 1 1 1 1 1 1 1 Мол. Лак./Кат. 124 124 98 108 90 129 111 28 39 Кат. DCHA DCHA TMPIP PMPIP EDiPA TBA KBenz MgO CaO § = немає побічних продуктів & = побічні продукти KBenz = калій бензоат * ЯМР-дані; мезо-лактид: 90 % мезо, 10 % L 11 Мономер % m-LACT* & § § § § § § § § 25 20 20 19 20 24 16 43 36 % L, L/D, D-LACT* 75 80 80 81 80 76 84 57 64 UA 108835 C2 Таблиця 6 Рацемізація L-лактиду Прикл. No. Темп.°C Час, год. 1 2 3 4 5 100 130 130 130 130 12 20 1 1 1 Мол. Лак./Кат. 20 245 10 5 15 Кат. DCHA TOA TOA TEA TOA Мономер % m-LACT* -— -30 89 18 24 18 0#) 0#) % L, L/D, D-LACT* 82 76 82 100#) 100#) #) після промивання H2O TEA = триетиламін * ЯМР-дані 5 Таблиця 7 Рацемізація мезо-лактиду Прикл. No. 1 2 3 10 15 20 Темп.°C Час, год. 140 140 140 2 6 24 Мол. Лак./Кат. TBP TBP TBP Мономер % mLACT* % L, LLACT@ 694 718 690 Кат. 98 94 89 79 42 31 13 30 35 % D, DLACT@ 8 28 34 TBP = трибутилфосфін * ЯМР-дані; @ ВЕРХ-дані; мезо-лактид: 96 % мезо, 4 % L Приклад 7 (Очищення): Очищення продуктів реакції способами фракціонованої дистиляції та/або кристалізації може бути ефективним. Кристалізацію можна робити як кристалізацію з рідини або як кристалізацію з розплаву. Таким шляхом можна відокремлювати тільки один мезо-лактид, Відокремлення L- та D-лактиду (стереоізомерів) не може відбуватися цими фізичними способами. Досвідченому хіміку слід застосовувати для кристалізації сумішей лактиду етилацетат або толуол. Для відокремлення можуть бути придатними також спирти, кетони т.д. або їх суміші. Переважним способом відокремлення лактидів є кристалізація з розплаву. У пристрої для кристалізації розплав лактиду, який має температур 135 °C, повільно охолоджували, та застиглий матеріал (температура 125 °C) збирали зі стінок після видалення розплаву. Цей спосіб збирання матеріалу повторювали поки було досягнуто бажаної чистоти. Температура плавлення рацемічного лактиду дорівнювала 129 °C. Розплав, що залишався, можна застосовувати знов у реакції рацемізації, та спосіб очищення можна повторювати. ФОРМУЛА ВИНАХОДУ 25 1. Спосіб отримання суміші сполук формули Ia, Ib та/або Іс O R O O R O O R R 30 O O O, R O O, R O O, Ia Ib Ic де повністю стереоізомерно чисту сполуку формули Ia, Ib або Іс, або суміш двох або трьох сполук, де, відповідно у вказаних сполуках R означає радикал лінійного або розгалуженого аліфатичного алкілу із 1-6 С-атомами, перетворюють з каталізатором або сумішшю принаймні двох каталізаторів, де, якщо спосіб починають із суміші сполук формули Ia, Ib та/або Іс, суміш цих сполук отримують знов, але зі зміненим складом, 12 UA 108835 C2 5 10 15 20 25 30 35 40 де каталізатор вибрано з наступного: a) оксиди, гідроксиди, карбонати, бензоати, лактати, октоати Na, K, Са, Fe, Ті, Zn, Sn або Sb, та/або b) первинні, вторинні та/або третинні аміни, та/або аліфатичні або ароматичні N-гетероциклічні сполуки з 5-7 кільцевими атомами, або фосфіни, де перетворення здійснюють при температурі від 80 до 160 ºС. 2. Спосіб за п. 1, де оксиди, гідроксиди, карбонати, бензоати, лактати, октоати Na, K, Са, Fe, Ті, Zn, Sn або Sb вибирають з групи, що містить СаО, K2СО3, натрій лактат, калій бензоат, станум октоат SnOc2, дибутилстанум оксид Bu2SnO, BuSnOc3, SnO. 3. Спосіб за будь-яким з попередніх пунктів, де первинні, вторинні та/або третинні аміни вибирають з групи, що містить первинні, вторинні та/або третинні аміни з 1-20 С-атомами. 4. Спосіб за п. 3, де первинні, вторинні та/або третинні аміни з 1-20 С-атомами та/або аліфатичні або ароматичні N-гетероциклічні сполуки з 5-7 кільцевими атомами або фосфіни вибирають з групи, що містить триетиламін, етилдіізопропіламін, дибутиламін, трибутиламін, триоктиламін, дициклогексиламін, 4-(N,N-диметил)амінопіридин, 2,2,6,6-тетраметилпіперидин, 1,2,2,6,6-пентаметилпіперидин та/або трибутилфосфін. 5. Спосіб за будь-яким з попередніх пунктів, де каталізатор стосовно стереоізомерно чистої сполуки формули Ia, Ib або Іс, або суміші двох або трьох сполук, застосовують у співвідношенні по масі між 1:1 та 1:10000, краще - між 1:10 та 1:5000, найкраще - між 1:100 та 1:1000. 6. Спосіб за будь-яким з попередніх пунктів, де молярне співвідношення сполук формули Іа та Іb, отримане у способі, є між 1:2 та 2:1, краще - між 1:1,2 та 1,2:1, по суті, найкраще - 1:1. 7. Спосіб за будь-яким з попередніх пунктів, де молярне співвідношення суми сполук формули Іа та Іb, отримане у способі, до сполуки формули Іс (Іа+Іb)/Іс є між 10:1 та 1:1, краще - між 10:1 та 2:1. 8. Спосіб за будь-яким з попередніх пунктів, де реакцію проводять за період часу між 1 хв. та 48 год., краще - між 0,5 та 4 год. 9. Спосіб за будь-яким з попередніх пунктів, де після або протягом реакції перетворення здійснюють принаймні один етап очищення суміші сполук формули Іа, Іb та/або Іс, отриманих реакцією перетворення, співвідношення суми сполук формули Іа та Іb до сполук формули Іс (Іа+Іb)/Іс збільшено принаймні до 10:1, краще принаймні до 100:1, ще краще принаймні до 1000:1, зокрема сполуку формули Іс по суті повністю або повністю видалено. 10. Спосіб за попереднім пунктом, де етап очищення вибрано з наступного: фільтрування, промивання, дистиляція, кристалізація та/або перекристалізація суміші сполук формули Іа, Іb та/або Іс, і також комбінація вказаних етапів очищення. 11. Спосіб за попереднім пунктом, де кристалізацію та/або перекристалізацію роблять з розплаву або з розчинників, розчинник переважно вибрано з наступного: спирти, естери, кетони, вуглеводні, зокрема, ацетон, ізопропанол, етилацетат, толуол та/або їх комбінації. 12. Спосіб за будь-яким з попередніх пунктів, де суміш після її отримання використовують для отримання аморфних полілактидів або для отримання стереокомплексів полімолочної кислоти та/або стереоблокспівполімерів молочної кислоти. Комп’ютерна верстка О. Рябко Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 13
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for preparing a mixture of lactide derivatives
Автори російськоюHagen, Rainer, Verweij, Adam, Bastiaan, Muhlbauer, Udo, Schulze, Joachim, Tietz, Wolfgang, Gohler, Klaus-Dieter
МПК / Мітки
МПК: C07B 55/00, C07D 319/12
Мітки: суміші, отримання, спосіб, похідних, лактиду
Код посилання
<a href="https://ua.patents.su/15-108835-sposib-otrimannya-sumishi-pokhidnikh-laktidu.html" target="_blank" rel="follow" title="База патентів України">Спосіб отримання суміші похідних лактиду</a>
Попередній патент: Трансгенне насіння сої, яке має підвищений загальний вміст жирних кислот
Наступний патент: Спосіб одержання секретованого білка в підживлюваній культурі клітин яєчників китайського хом’ячка
Випадковий патент: Агрегат ґрунтообробний дисковий