Карбаматзаміщені піразолопіридини
Номер патенту: 78314
Опубліковано: 15.03.2007
Автори: Шташ Йоханнес-Петер, Фойрер Ахім, Мюнтер Клаус, Бішофф Ервін, Шталь Ельке, Алонсо-Алія Крістіна, Вайганд Штефан
Формула / Реферат
1. Сполуки формули (І)
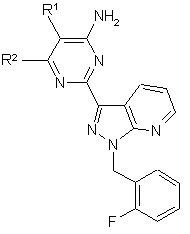 , (I)
, (I)
в якій
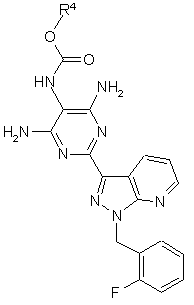
R1 означає -NR3С(=O)OR4,
R2 означає водень або NH2,
R3 означає водень або (С1-С4)-алкіл,
R4 означає (С1-С6)-алкіл,
а також їх солі, ізомери та гідрати.
2. Сполуки за п. 1, в яких
R1 означає -NR3С(=O)OR4,
R2 означає водень або NН2,
R3 означає (С1-С4)-алкіл,
R4 означає (С1-С4)-алкіл,
а також їх солі, ізомери та гідрати.
3. Сполуки за п. 1, в яких
R1 означає -NR3С(=O)OR4,
R2 означає NН2,
R3 означає метил або етил,
R4 означає метил, етил або ізопропіл,
а також їх солі, ізомери та гідрати.
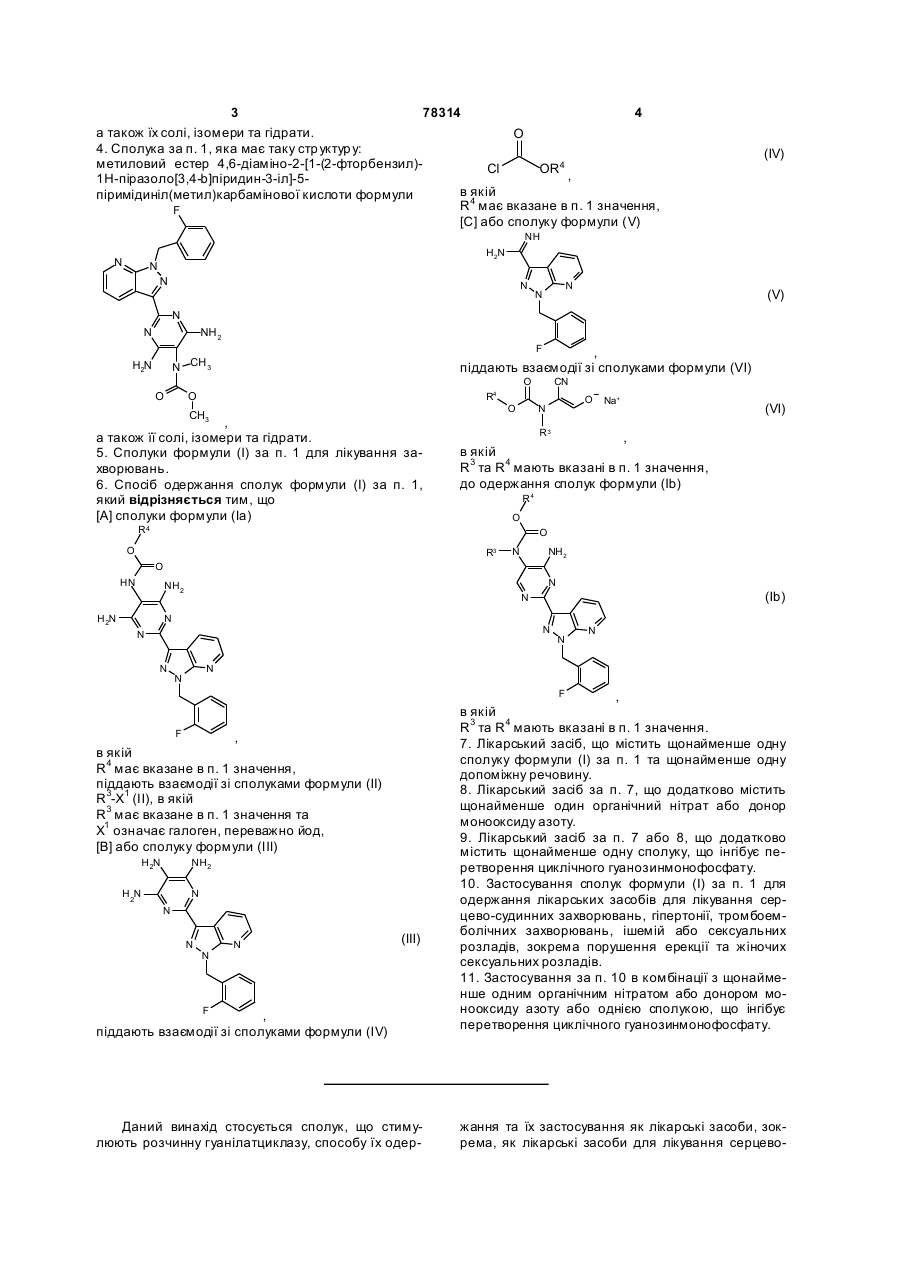
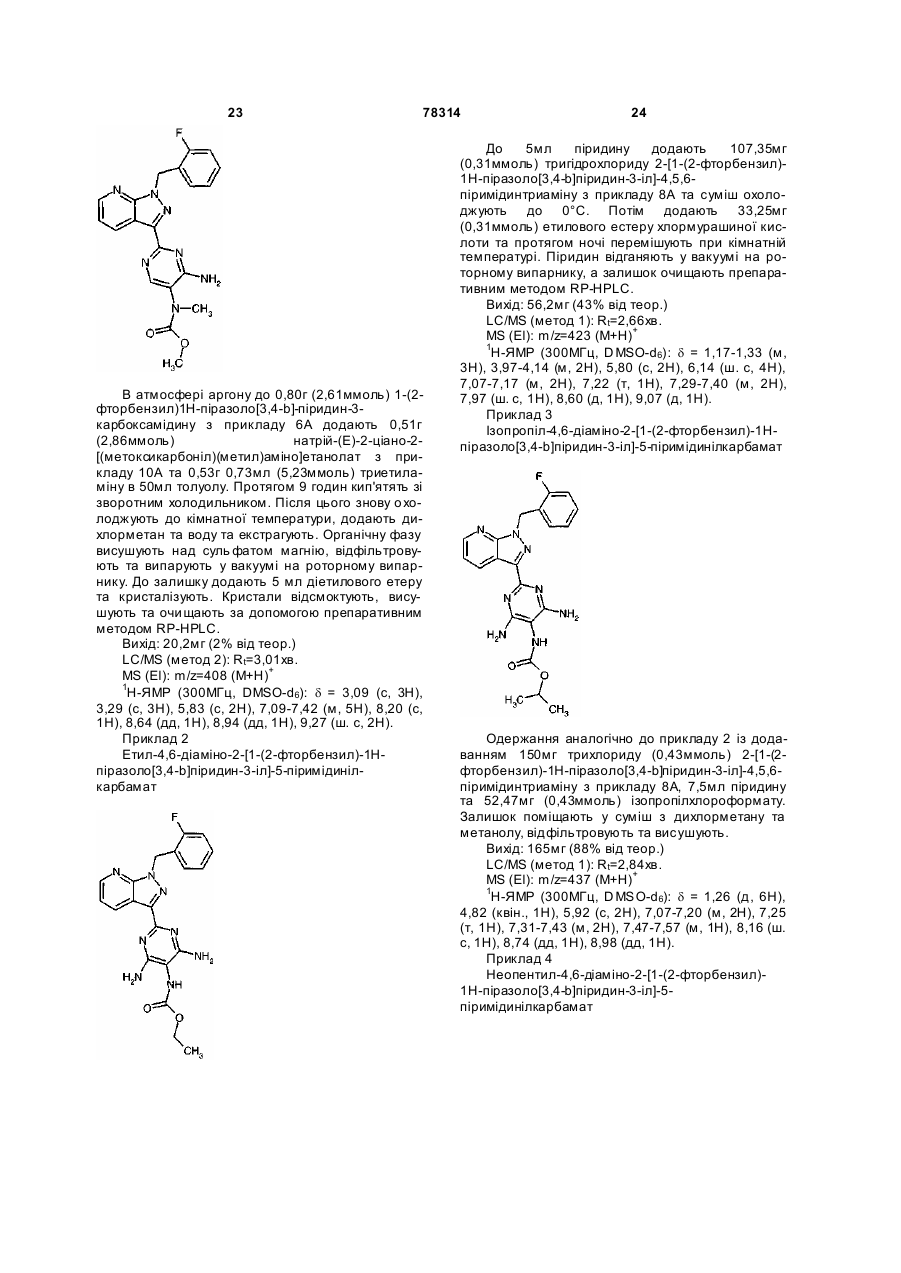
4. Сполука за п. 1, яка має таку структуру:
метиловий естер 4,6-діаміно-2-[1-(2-фторбензил)-1Н-піразоло[3,4-b]піридин-3-іл]-5-піримідиніл(метил)карбамінової кислоти формули
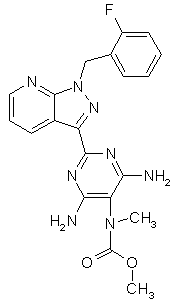 ,
,
а також її солі, ізомери та гідрати.
5. Сполуки формули (І) за п. 1 для лікування захворювань.
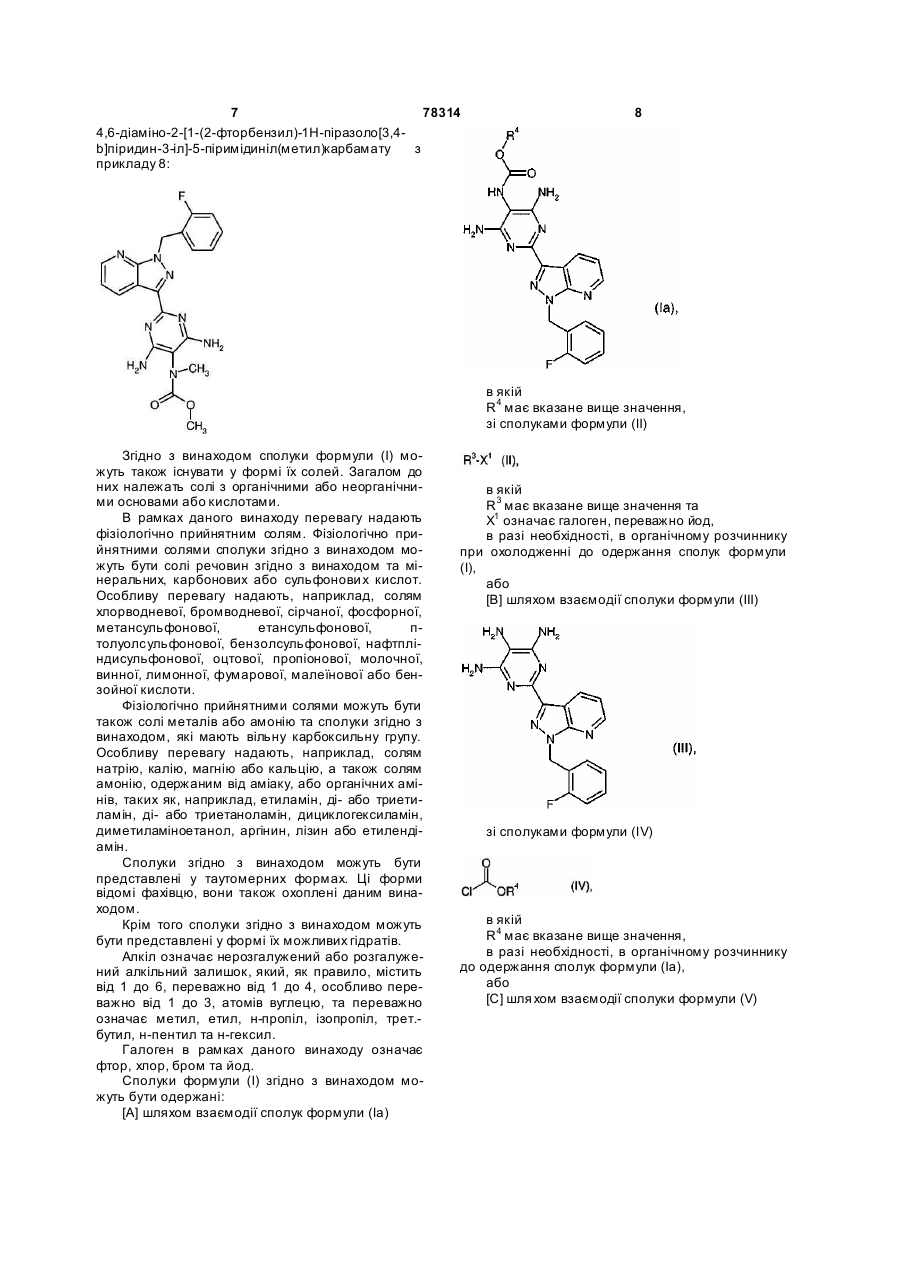
6. Спосіб одержання сполук формули (І) за п. 1, який відрізняється тим, що
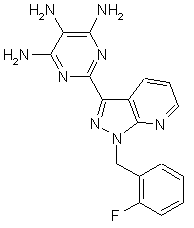
[А] сполуки формули (Іа)
 ,
,
в якій
R4 має вказане в п. 1 значення,
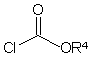
піддають взаємодії зі сполуками формули (II)
R3-X1 (II), в якій
R3 має вказане в п. 1 значення та
X1 означає галоген, переважно йод,
[В] або сполуку формули (III)
 , (III)
, (III)
піддають взаємодії зі сполуками формули (IV)
 , (IV)
, (IV)
в якій
R4 має вказане в п. 1 значення,
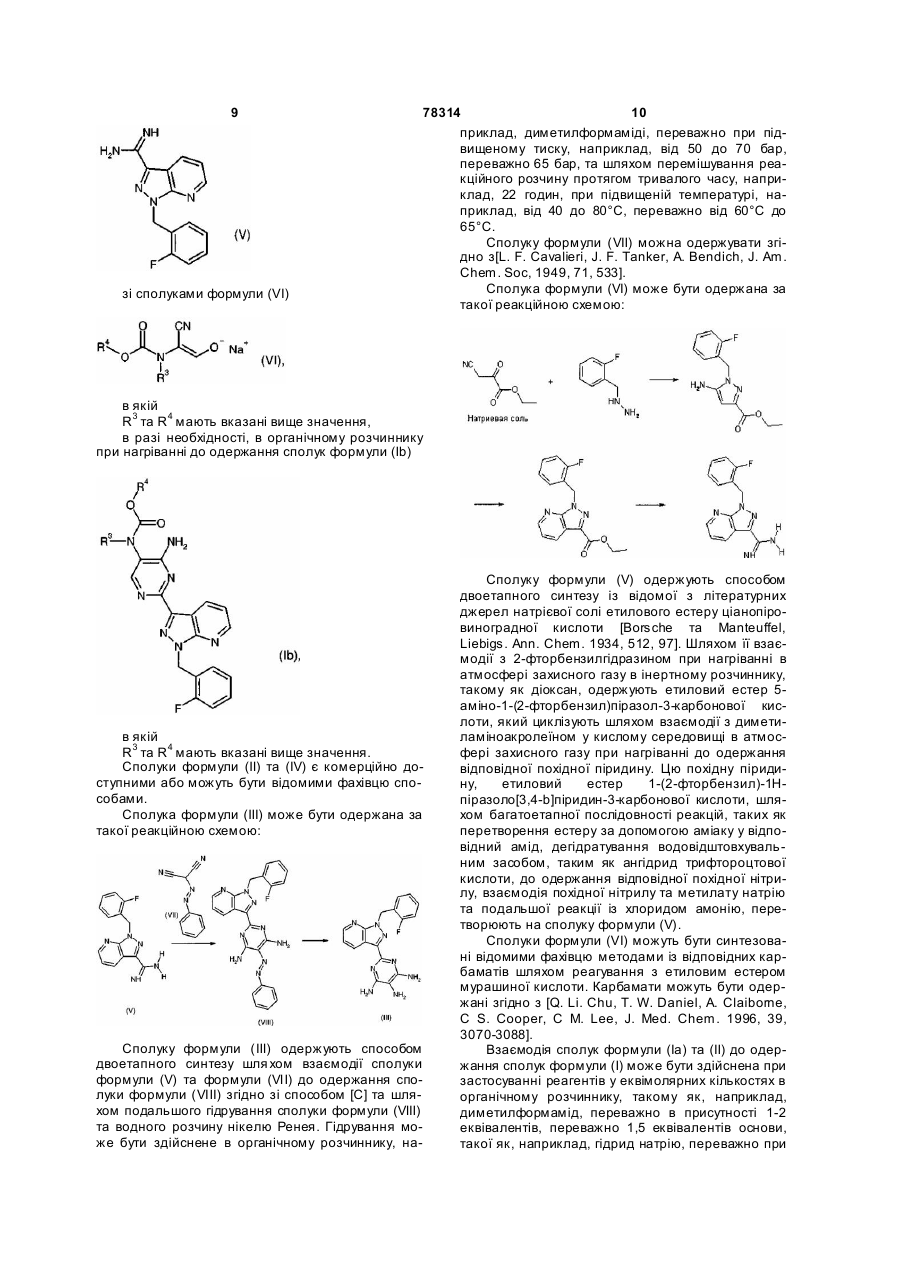
[С] або сполуку формули (V)
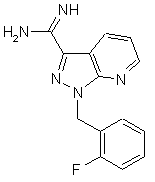 , (V)
, (V)
піддають взаємодії зі сполуками формули (VI)
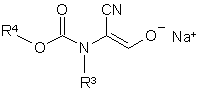 , (VI)
, (VI)
в якій
R3 та R4 мають вказані в п. 1 значення,
до одержання сполук формули (Ib)
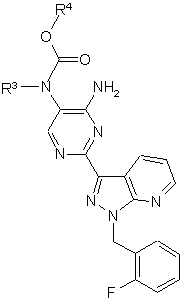 , (Ib)
, (Ib)
в якій
R3 та R4 мають вказані в п. 1 значення.
7. Лікарський засіб, що містить щонайменше одну сполуку формули (І) за п. 1 та щонайменше одну допоміжну речовину.
8. Лікарський засіб за п. 7, що додатково містить щонайменше один органічний нітрат або донор монооксиду азоту.
9. Лікарський засіб за п. 7 або 8, що додатково містить щонайменше одну сполуку, що інгібує перетворення циклічного гуанозинмонофосфату.
10. Застосування сполук формули (І) за п. 1 для одержання лікарських засобів для лікування серцево-судинних захворювань, гіпертонії, тромбоемболічних захворювань, ішемій або сексуальних розладів, зокрема порушення ерекції та жіночих сексуальних розладів.
11. Застосування за п. 10 в комбінації з щонайменше одним органічним нітратом або донором монооксиду азоту або однією сполукою, що інгібує перетворення циклічного гуанозинмонофосфату.
Текст
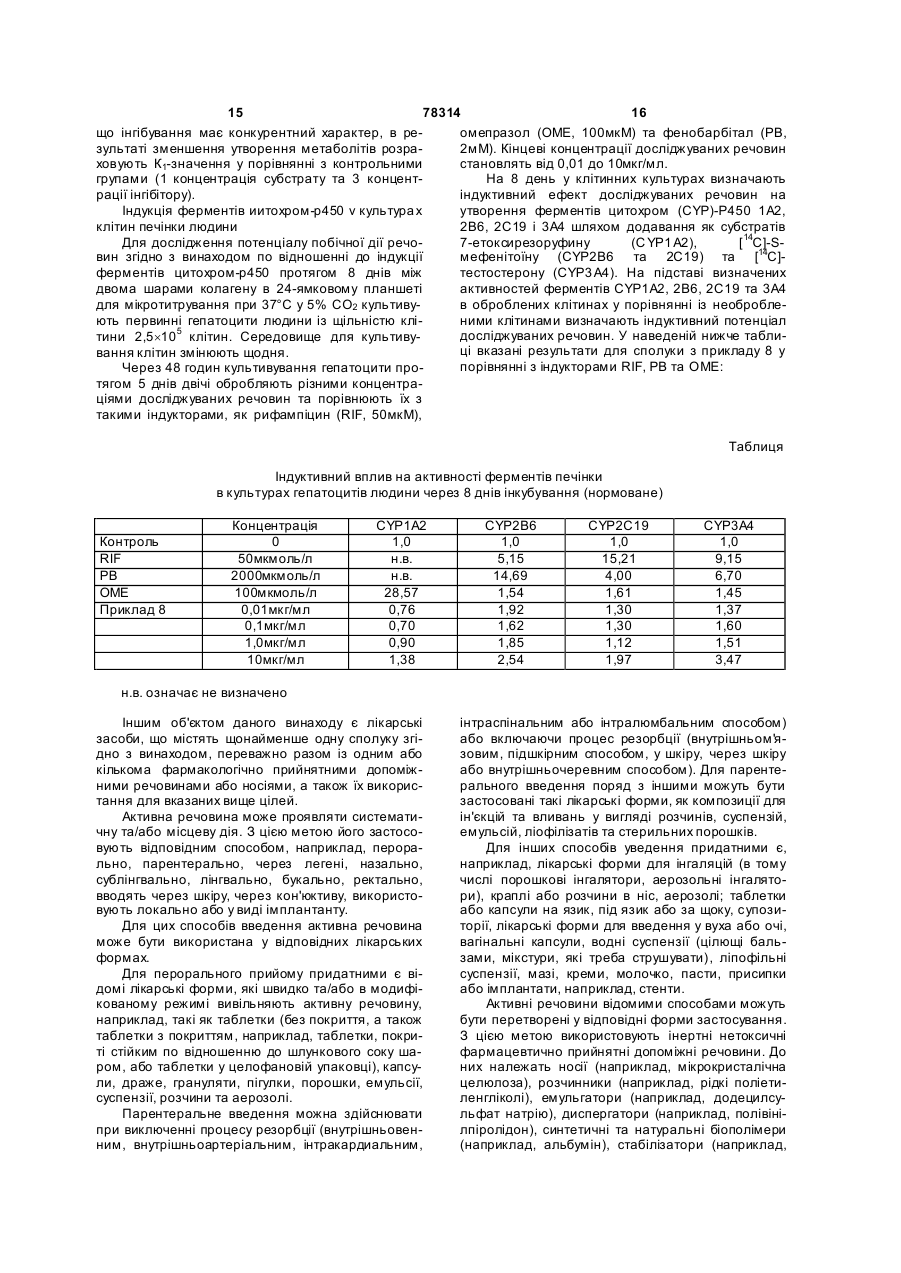
1. Сполуки формули (І) 2 C2 1 3 78314 4 а також їх солі, ізомери та гідрати. O 4. Сполука за п. 1, яка має таку структур у: метиловий естер 4,6-діаміно-2-[1-(2-фторбензил)Cl OR 4 , 1Н-піразоло[3,4-b]піридин-3-іл]-5в якій піримідиніл(метил)карбамінової кислоти формули R4 має вказане в п. 1 значення, F [С] або сполуку формули (V) (IV) NH N H 2N N N N N N (V) N N NH 2 H2N N F , піддають взаємодії зі сполуками формули (VI) CH 3 O O O CN R4 O CH3 , а також її солі, ізомери та гідрати. 5. Сполуки формули (І) за п. 1 для лікування захворювань. 6. Спосіб одержання сполук формули (І) за п. 1, який відрізняється тим, що [А] сполуки формули (Іа) O N Na+ (VI) R3 , в якій R3 та R4 мають вказані в п. 1 значення, до одержання сполук формули (Ib) R4 O R4 O O R3 N NH 2 O HN N NH2 N H2N N N N NH2 N H2N N N N N F , в якій R4 має вказане в п. 1 значення, піддають взаємодії зі сполуками формули (II) R3-X1 (II), в якій R3 має вказане в п. 1 значення та X1 означає галоген, переважно йод, [В] або сполуку формули (III) H2N (Ib) N N N N N (III) F , піддають взаємодії зі сполуками формули (IV) Даний винахід стосується сполук, що стимулюють розчинну гуанілатциклазу, способу їх одер F , в якій R3 та R4 мають вказані в п. 1 значення. 7. Лікарський засіб, що містить щонайменше одну сполуку формули (І) за п. 1 та щонайменше одну допоміжну речовину. 8. Лікарський засіб за п. 7, що додатково містить щонайменше один органічний нітрат або донор монооксиду азоту. 9. Лікарський засіб за п. 7 або 8, що додатково містить щонайменше одну сполуку, що інгібує перетворення циклічного гуанозинмонофосфату. 10. Застосування сполук формули (І) за п. 1 для одержання лікарських засобів для лікування серцево-судинних захворювань, гіпертонії, тромбоемболічних захворювань, ішемій або сексуальних розладів, зокрема порушення ерекції та жіночих сексуальних розладів. 11. Застосування за п. 10 в комбінації з щонайменше одним органічним нітратом або донором монооксиду азоту або однією сполукою, що інгібує перетворення циклічного гуанозинмонофосфату. жання та їх застосування як лікарські засоби, зокрема, як лікарські засоби для лікування серцево 5 78314 6 судинних захворювань та/або сексуальних розлаPharmacol. 114 (1995), 1587], а також різні заміщедів. ні похідні піразолу [W0 98/16223]. Однією з найважливіших клітинних медіаторКрім того, як стимулятори розчинної гуанілатних систем у клітинах ссавців є циклічний гуанозициклази в заявках [WO 98/16507, W0O98/23619, нмонофосфат (cGMP). Разом із монооксидом азоWO 00/06567, WO 00/06568, WO 00/06569, WO ту (NO), який вивільняється із ендотелію та 00/21954, WO 02/42299, WO 02/42300, WO переносить гормональні та механічні сигнали, во02/42301, WO 02/42302, WO 02/092596 та WO ни утворюють NO/cGMP-систему. Гуанілатциклази 03/004503] описані похідні піразолопіридину. У цих каталізують біосинтез cGMP із гуанозинтрифосфаматеріалах поряд з іншими описані також піразоту (GTP). Відомі до цього часу представники цього лопіридини з піримідиновим залишком у положенні сімейства як за структурними ознаками, так і за 3. Такі сполуки проявляють дуже високу активність природою лігандів можуть бути розділені на дві in vitro щодо стимуляції розчинної гуанілатциклази. групи: специфічні гуанілатциклази, які стимулюХоча виявилося, що властивості in vi vo цих сполук ються натрійуретичними пептидами, та розчинні мають певні недоліки, наприклад, щодо їх впливу гуанілатциклази, які стимулюються NO. Розчинні на печінку, фармакокінетичних властивостей, співгуанілатциклази складаються з двох підодиниць та відношень між дозою та дією або їх метаболізму. скоріше за все містять один гем на гетеродимер, Тому задача даного винаходу полягає в одерякий є частиною регуляторного центру. Він відіграє жанні інших похідних піразолопіридину, які діють ключову роль у механізмі активації. NO може бути як стимулятори розчинної гуанілатциклази, але в приєднаний до атому заліза гема і таким чином той же час не проявляють наведених вище недолізначно підвищувати активність ферменту. На відків сполук з рівня техніки. міну від цього форми ферменту, які не містять гем, Ця задача вирішується за допомогою сполук не можуть бути стимульовані NO. Центральний за п. 1 формули винаходу. Цей новий клас похідатом заліза гема може також утворювати зв'язок із них піразолопіридинів відрізняється наявністю CO, причому стимуляція CO значно слабша, ніж піримідинового залишку в положенні 3, який має стимуляція NO. визначений склад замісників, а саме карбаматний Завдяки утворенню cGMP та регулюванню залишок у положенні 5 піримідинового циклу, а фосфодіестераз, іонних каналів та протеїнкіназ також аміногрупу в положенні 4 піримідинового гуанілатциклаза відіграє вирішальну роль у різних циклу. фізіологічних процесах, зокрема, у розслабленні Зокрема даний винахід стосується сполук фота проліферації клітин гладкої мускулатури, в агрермули (І) гації та адгезії тромбоцитів та в нейрональній передачі сигналів, а також у захворюваннях, які засновуються на порушенні вказаних вище процесів. У патофізиологічних умовах NO/cGMP-система може бути заблокована, що може призвести, наприклад, до підвищення тиску крові, активації тромбоцитів, посилення проліферації клітин, порушення функціонування ендотелію, атеросклерозу, стенокардії, серцевої недостатності, тромбозів, нападів, до сексуальних розладів та інфаркту міокарда. Незалежна від NO можливість лікувального впливу на такі захворювання, яка впливає на проходження сигналу cGMP в організмі, є багатообіцяючою на основі її очікуваної високої ефективнов якій сті та незначних побічних дій. R1 означає -NR3C(=O)OR4, Для терапевтичної стимуляції розчинної гуаніR2 означає водень або NH2, латциклази до цього часу були застосовані виклюR3 означає водень або (С1-С4)-алкіл, чно такі сполуки, як органічні нітрати, дія яких баR4 означає (С1-С6)-алкіл, зується на NO. Він утворюється в результаті а також їх солей, ізомерів та гідратів. біотрансформації та активує розчинну гуанілатциПеревагу надають сполукам формули (І), в клазу шляхом впливу на центральний атом заліза яких гема. Поряд з побічними ефектами до значних R1 означає -NR3C(=O)OR4, недоліків такого способу лікування належить також R2 означає водень або NH2, виникнення звикання. R3 означає (С1-С4)-алкіл, В останні роки були описані деякі речовини, які R4 означає (С1-С4)-алкіл, активують розчинну гуанілатциклазу безпосереда також їх солям, ізомерам та гідратам. ньо, тобто без попереднього вивільнення NO; до Особливу перевагу надають сполукам формуних належать, наприклад, 3-(5'-гідроксиметил-2'ли (І), в яких фурил)-1-бензиліндазол [YC-1, Wu та ін., Blood 84 R1 означає -NR3C(=O)OR4, (1994), 4226; Mulsch та ін., Brit. J. Pharmacol. 120 R2 означає NH2, (1997), 681], жирні кислоти [Goldberg та ін., J. Biol. R3 означає метил або етил, Chem. 252 (1977), 1279], гексафторфосфат ди феR4 означає метил, етил або ізопропіл, нілйодонію [Pettibone та ін., Eur. J. Pharmacol. 116 а також їх солям, ізомерам та гідратам. (1985), 307], ізоліквирітигенін [Yu та ін., Brit. J. Найбільшу перевагу надають сполуці метил 7 78314 4,6-діаміно-2-[1-(2-фторбензил)-1Н-піразоло[3,4b]піридин-3-іл]-5-піримідиніл(метил)карбамату з прикладу 8: 8 в якій R4 має вказане вище значення, зі сполуками формули (II) Згідно з винаходом сполуки формули (І) можуть також існувати у формі їх солей. Загалом до них належать солі з органічними або неорганічними основами або кислотами. В рамках даного винаходу перевагу надають фізіологічно прийнятним солям. Фізіологічно прийнятними солями сполуки згідно з винаходом можуть бути солі речовин згідно з винаходом та мінеральних, карбонових або сульфонови х кислот. Особливу перевагу надають, наприклад, солям хлорводневої, бромводневої, сірчаної, фосфорної, метансульфонової, етансульфонової, птолуолсульфонової, бензолсульфонової, нафтпліндисульфонової, оцтової, пропіонової, молочної, винної, лимонної, фумарової, малеїнової або бензойної кислоти. Фізіологічно прийнятними солями можуть бути також солі металів або амонію та сполуки згідно з винаходом, які мають вільну карбоксильну групу. Особливу перевагу надають, наприклад, солям натрію, калію, магнію або кальцію, а також солям амонію, одержаним від аміаку, або органічних амінів, таких як, наприклад, етиламін, ді- або триетиламін, ді- або триетаноламін, дициклогексиламін, диметиламіноетанол, аргінин, лізин або етилендіамін. Сполуки згідно з винаходом можуть бути представлені у таутомерних формах. Ці форми відомі фахівцю, вони також охоплені даним винаходом. Крім того сполуки згідно з винаходом можуть бути представлені у формі їх можливих гідратів. Алкіл означає нерозгалужений або розгалужений алкільний залишок, який, як правило, містить від 1 до 6, переважно від 1 до 4, особливо переважно від 1 до 3, атомів вуглецю, та переважно означає метил, етил, н-пропіл, ізопропіл, трет.бутил, н-пентил та н-гексил. Галоген в рамках даного винаходу означає фтор, хлор, бром та йод. Сполуки формули (І) згідно з винаходом можуть бути одержані: [A] шляхом взаємодії сполук формули (Іа) в якій R3 має вказане вище значення та X1 означає галоген, переважно йод, в разі необхідності, в органічному розчиннику при охолодженні до одержання сполук формули (І), або [B] шляхом взаємодії сполуки формули (III) зі сполуками формули (IV) в якій R4 має вказане вище значення, в разі необхідності, в органічному розчиннику до одержання сполук формули (Іа), або [С] шля хом взаємодії сполуки формули (V) 9 зі сполуками формули (VI) 78314 10 приклад, диметилформаміді, переважно при підвищеному тиску, наприклад, від 50 до 70 бар, переважно 65 бар, та шляхом перемішування реакційного розчину протягом тривалого часу, наприклад, 22 годин, при підвищеній температурі, наприклад, від 40 до 80°С, переважно від 60°С до 65°С. Сполуку формули (VII) можна одержувати згідно з[L. F. Cavalieri, J. F. Tanker, A. Bendich, J. Am. Chem. Soc, 1949, 71, 533]. Сполука формули (VI) може бути одержана за такої реакційною схемою: в якій R3 та R4 мають вказані вище значення, в разі необхідності, в органічному розчиннику при нагріванні до одержання сполук формули (Іb) в якій R3 та R4 мають вказані вище значення. Сполуки формули (II) та (IV) є комерційно доступними або можуть бути відомими фахівцю способами. Сполука формули (III) може бути одержана за такої реакційною схемою: Сполуку формули (III) одержують способом двоетапного синтезу шля хом взаємодії сполуки формули (V) та формули (VII) до одержання сполуки формули (VIII) згідно зі способом [С] та шляхом подальшого гідрування сполуки формули (VIII) та водного розчину нікелю Ренея. Гідрування може бути здійснене в органічному розчиннику, на Сполуку формули (V) одержують способом двоетапного синтезу із відомої з літературних джерел натрієвої солі етилового естеру ціанопіровиноградної кислоти [Borsche та Manteuffel, Liebigs. Ann. Chem. 1934, 512, 97]. Шляхом її взаємодії з 2-фторбензилгідразином при нагріванні в атмосфері захисного газу в інертному розчиннику, такому як діоксан, одержують етиловий естер 5аміно-1-(2-фторбензил)піразол-3-карбонової кислоти, який циклізують шляхом взаємодії з диметиламіноакролеїном у кислому середовищі в атмосфері захисного газу при нагріванні до одержання відповідної похідної піридину. Цю похідну піридину, етиловий естер 1-(2-фторбензил)-1Нпіразоло[3,4-b]піридин-3-карбонової кислоти, шляхом багатоетапної послідовності реакцій, таких як перетворення естеру за допомогою аміаку у відповідний амід, дегідратування водовідштовхувальним засобом, таким як ангідрид трифтороцтової кислоти, до одержання відповідної похідної нітрилу, взаємодія похідної нітрилу та метилату натрію та подальшої реакції із хлоридом амонію, перетворюють на сполуку формули (V). Сполуки формули (VI) можуть бути синтезовані відомими фахівцю методами із відповідних карбаматів шляхом реагування з етиловим естером мурашиної кислоти. Карбамати можуть бути одержані згідно з [Q. Li. Chu, Т. W. Daniel, A. Claiborne, С S. Cooper, С Μ. Lee, J. Med. Chem. 1996, 39, 3070-3088]. Взаємодія сполук формули (Іа) та (II) до одержання сполук формули (І) може бути здійснена при застосуванні реагентів у еквімолярних кількостях в органічному розчиннику, такому як, наприклад, диметилформамід, переважно в присутності 1-2 еквівалентів, переважно 1,5 еквівалентів основи, такої як, наприклад, гідрид натрію, переважно при 11 78314 12 нормальному тиску та при перемішуванні реакційСполуки формули (І) згідно з винаходом моного розчину протягом кількох годин, наприклад, 1 жуть бути використані і для лікування захворювань години, при охолодженні, наприклад від -10°С до центральної нервової системи, що відзначені покімнатної температури, переважно при 0°С. рушеннями NO/cGMP-системи. Зокрема, вони є Взаємодія сполук формул (III) та (IV) до одерпридатними для покращення сприйняття, підвижання сполук формули (Іа) може бути здійснена щення концентрації уваги, покращення здатності при застосуванні реагентів у еквімолярних кількосдо вивчення або пом'яті після розладів пізнавальтях в органічному розчиннику, такому як, наприних функцій, які виникають зокрема при таких обуклад, органічна основа, переважно піридин, перемовлених ситуацією та хворобою синдромах, як важно при нормальному тиску та при легке погіршення функцій, пов'язаних зі сприйнятперемішуванні реакційного розчину протягом багатям ("mild cognitive impairment"), пов'язані з віком тьох годин, наприклад, протягом 12 годин, при порушення здатності до вивчення та пам'яті, потемпературі від 0 °С до кімнатної температури, в'язані з віком провали в пам'яті, судинне слабопереважно при кімнатній температурі. умство, травми черепа та мозку, інсульт, слабоумВзаємодія сполук формул (V) та (VI) до одерство як наслідок інсульту ("post stroke dementia"), жання сполук формули (Іb) або сполук формул (V) посттравматичний стан, пов'язаний із травмою та (VII) до одержання сполук формули (VIII) може черепа та мозку, загальні порушення концентрації бути здійснена при застосуванні реагентів у еквіуваги, порушення концентрації уваги у дітей, що молярних кількостях або при застосуванні сполуки мають проблеми з навчанням і запам'ятовуванформули (VI) у незначній надлишковій кількості в ням, хвороба Альцгеймера, слабоумство, обумоворганічному розчиннику, такому як, наприклад, лене тільцями Леві, слабоумство з дегенерацією вуглеводень, переважно ароматичний вуглеволобової частини, включаючи синдром Піка, хвородень, зокрема толуол або ксилол, переважно в бу Паркінсона, прогресуючий ядерний параліч, присутності 2-3 еквівалентів, переважно 2 еквіваслабоумство з кортикобазальною дегенерацією, лентів основи, такої як, наприклад, триетиламін аміолатеральний склероз (ALS), хворобу Хантінгабо метанолат натрію, переважно при нормальтона, розсіяний склероз, таламічну дегенерацію, ному тиску та при перемішуванні реакційного розслабоумство Кройтцфельда-Якоба, слабоумство чину протягом багатьох годин, наприклад, 9 годин, при Віл-інфекціях, шизофренію із слабоумством при підвищеній температурі, наприклад, від 80 до або психоз Корсакова. Вони також можуть бути 160°С, переважно від 100 до 150°С, зокрема при застосовані для лікування таких захворювань 110°С. центральної нервової системи, як стан страху, Сполуки формули (І) згідно з винаходом пронапруги та депресії, пов'язані з центральною нерявляють не передбачуваний цінний фармакологічвовою системою сексуальні розлади та порушення ний спектр дії. сну, а також для регуляції відхилень при вживанні Сполуки формули (І) згідно з винаходом вихарчових продуктів, виробів смакової промисловокликають релаксацію судин та блокують агрегацію сті та наркотичних речовин. тромбоцитів, вони приводять до зниження тиску Крім того сполуки формули (І) згідно з винахокрові та покращення коронарного кровообігу. В дом придатні також для регуляції церебрального основі цих ефектів лежить безпосередня стимулякровообігу та є ефективні засоби для боротьби з ція розчинної гуанілатциклази та підвищення вмісмігренню. ту cGMP всередині клітини. Крім того, сполуки фоСполуки формули (І) згідно з винаходом підхормули (І) згідно з винаходом посилюють дію дять також для профілактики та лікування таких речовин, які підвищують рівень cGMP, наприклад, наслідків церебрального інфарктного процесу EDRF (фактору релаксації із ендотелію), NO(Apoplexia cerebri), як інсульт, церебральні ішемії донорів, протопорфірину IX, арахідонової кислоти та травми черепа та мозку. Вони також можуть або похідних фенілгідразину. бути використані для боротьби з больовими синдТому вони можуть бути застосовані у медикаромами. ментах для лікування серцево-судинних захворюДо того ж сполуки формули (І) згідно з винаховань, наприклад, для лікування гіпертонії та сердом проявляють протизапальну дію і тому вони цевої недостатності, хронічної та гострої можуть бути використані як протизапальні засоби. стенокардії, захворювань периферійних та короКрім того даний винахід охоплює також комбінарних судин, аритмії, для лікування таких тромнації щонайменше однієї сполуки формули (І) згідбоемболічних захворювань та ішемій, як інфаркт но з винаходом та одного або кількох органічних міокарда, інсульт, перемежувальні та ішемічні нанітратів або NO-донорів. пади, порушення периферійного кровообігу, для В рамках даного винаходу органічні нітрати та запобігання рестенозів, наприклад, після тромбоNO-донори загалом є речовинами, терапевтична літичних терапій, перкутанної транслюмінальної активність яких виявляється через вивільнення NO ангіопластичної операції (РТА), перкутанної або видів NO. Прикладами таких речовин є нітротранслюмінальної пластичної операції на коронапрусид натрію, нітрогліцерин, динітрат ізосорбіду, рних судинах (РТС А), після шун тування, а також мононітрат ізосорбіду, молсидомін та SIN-1. для лікування артеріосклерозу, астматичних заКрім того даний винахід охоплює комбінації хворювань та захворювань сечостатевої системи, однієї або декількох сполук, які інгібують розпад наприклад, гіпертрофії передміхурової залози, циклічного гуанозинмонофосфату (cGMP). Перепорушення ерекції, жіночих сексуальних розладах, важно вони є інгібіторами фосфодіестераз 1, 2 та остеопорозу, глаукоми, легеневої гіпертонії, паре5; за номенклатурою [Beavo та Reifsnyder (1990) зу шлунку та нетримання. TiPS 11, стор.150-155]. Особливу перевагу при 13 78314 14 цьому надають інгібіторам фосфодіестерази 5 (Vречовини, а при пероральному введення на додаінгібітори PDE), зокрема, однією із сполук є силдетково ще через 3, 4, 5 та 6 годин. Для цього тварин щораз витягають із клітки, тримають їх за шерсть нафіл [ViagraÔ , ЕР-А 0463756, WO 94/28902], варна зашийку та задні лапи, повертають на спину та денафіл [WO 99/24433] або тадалафіл [WO здійснюють вимірювання. Проводять відповідні95/19978]. Ці інгібітори підсилюють дію сполук згіконтрольні дослідження з одним розчинником дно з винаходом та покращують бажаний фарма[див.: E.Bischoff, K.Schneider, Int. J. of Impotence кологічний ефект. Біологічні дослідження Res. 2001, 13, 230-235; E.Bischoff, U.Niewoehner, H.Haning, M.Es Sayed, T.Schenke, K.H.Schlemmer, Дія релаксації судин in vitro The Journal of Urology, 2001, 165, 1316-1318; Кроликів оглушають ударом у потилицю та E.Bischoff, Int. J. Impotence Res. 2001, 13, 146-148]. знекровлюють. Витягають аорту, вивільняють її від Мінімальна ефективна доза сполуки із приклазв'язаних з нею тканин, розділяють на кільця шириною 1,5мм та кожне окремо переносять з попеду 8 при пероральному введенні становить 0,03мг/кг (при одночасному внутрішньовенному реднім натягом у ванну об'ємом 5мл, які містять введенні нітропрусиду натрію SNP у дозі 0,2мг/кг). нагрітий до 37°С насичений карбогеном розчин Визначення фармакокінетичних показників піКребса-Гензелейта такого складу (мМ): NaCI: 119; сля внутрішньовенного та перорального введення KСІ: 4,8; СаСІ2´2Н2О: 1; MgSO4 ´7Н2О; 1,4; Досліджувану речовину вводять тваринам (наKН2РО4: 1,2; NaHCO3: 25; глюкоза: 10. Силу скороприклад, мишам, пацюкам, собакам) внутрішньочення визначають за допомогою Statham UC-2венно у вигляді розчину, пероральне введення клітин, підсилюють та оцифровують його A/Dздійснюють у вигляді розчину або суспензії через перетворювачем (DAS-1802 НС, Keithley, глотковий зонд. Після введення речовини у визнаInstruments, Мюнхен), а також паралельно з цим чені інтервали часу у тварин беруть кров, обробреєструють його за допомогою самописа. Скороляють її гепарином та після цього центрифугуванчення викликають кумулятивним додаванням у ням одержують з неї плазму. Кількісне визначення ванну фенілефрину при збільшенні концентрації. речовини в плазмі проводять за допомогою рідинПісля декількох контрольних циклів досліджувану ної хроматомас-спектрометрії. На основі отримаречовину оцінюють, підвищуючи при цьому її дозу них таким чином співвідношень концентрації в на кожнім наступному етапі оцінювання, та порівплазмі та часу розраховують фармакокінетичні нюють показник скорочення з отриманим на попепоказники за допомогою сертифікованої фармакоредньому етапі значенням. Виходячи з цього, викінетичної обчислювальної програми. значають концентрацію, необхідну для зниження Після перорального введення 0,3 та 1,0мг/кг (у отриманого в контрольному дослідженні значення вигляді розчину в суміші солутолу, етанолу та вона 50% (ІС50)- Стандартний об'єм нанесення склади в співвідношенні 1:1:8) пацюкам сполука із придає 5мкл, вміст DMSO у розчині у ванні відповідає кладу 8 має наведені далі концентрації в плазмі значенню 0,1%. (AUC): Значення ІС50 для сполуки із прикладу 1 доріAUCnorm (0,3мг/кг)=0,326[кг*год/л] внює 670нМ, відповідне значення для сполуки із AUCnorm (1,0мг/кг)=0,548[кг*год/л] прикладу 8 дорівнює 500нМ. Інгібування Ферментів иитохром-р450 Зразок дослідження на кроликах Потенціал інгібування Р-450 ізоферментів, що Дорослі самці кроликів шиншила вагою 3-5кг мають велике значення для метаболізму, досліпісля надходження кілька днів адаптуються в одджують в автоматичному режимі у 96-ямковому накових умовах. Вони мають вільний доступ до форматі. При цьому використовують два різних води та два рази на день можуть приймати корм. зразки проведення дослідження. Тварин тримають в режимі 10/14 діб (світло вклюУ дослідженні, заснованому на утворенні флучають з 8.00 години), температура приміщення оресціюючих метаболітів, використовують рекомстановить 22-24°С. бінантні ферменти (наприклад, CYP1A2, 2С8, 2С9, Кожна піддослідна група складається із 3-6 2С19, 2D6 або 3A4) та в загальному випадку субтварин, яких зважують безпосередньо перед почастрати, які включають флуоресцеїнові або куматком дослідження. Для внутрішньовенного вверинові структури. У кожнім окремому випадку видення речовини розчиняють у транскутолі користовують одну концентрацію субстрату та 8 (GATTEFOSSE Gmb) та розводять у співвідношенконцентрації потенційного інгібітору. Після інкубуні 3/7 20%-ним розчином кремофору (Cremophor вання відповідним рекомбінантним CYP фермен(BASF), у воді). Речовину із розрахунку 0,5мл/кг том за допомогою флуоресцентного аналізатора вводять у вушн у вену. Для ін'єкції розчинних у воді визначають кількість флуоресціюючих метаболітів, речовин використовують 0,9%-ний розчин хлориспорівнюють з контрольною групою (без інгібітору) того натрію. та розраховують значення ІС50 [Anal. Biochem. 248, Для перорального введення досліджувані ре188 (1997)]. човини розчиняють у суміші гліцерину, води та В другому дослідженні як джерело ферментів поліетиленгликолю в співвідношенні 6:10:9,69 та використовують мікросоми печінки людини, а як вводять через глотковий зонд у кількості 1мл/кг. субстрати, селективні по відношенню до CYPУ стані спокою статевий орган кролика не видізоформ, використовують фенацетин (CYP1A2), но, він повністю покритий шкірою статевого оргадиклофенак (CYP2C9), декстрометорфан на. Ерекцію оцінюють, визначаючи довжину висту(CYP2D6) та мідазолам (CYP3A4). Утворення відпаючого статевого органа за допомогою повідних метаболітів визначають за допомогою штангенциркуля. Вимірювання проводять через 5, рідинної хроматомас-спектрометрії. Припустивши, 10, 15, 30, 45, 60 та 120 хвилин після введення 15 78314 16 що інгібування має конкурентний характер, в реомепразол (ОМЕ, 100мкМ) та фенобарбітал (РВ, зультаті зменшення утворення метаболітів розра2мМ). Кінцеві концентрації досліджуваних речовин ховують К1-значення у порівнянні з контрольними становлять від 0,01 до 10мкг/мл. групами (1 концентрація субстрату та 3 концентНа 8 день у клітинних культурах визначають рації інгібітору). індуктивний ефект досліджуваних речовин на Індукція ферментів иитохром-р450 ν культура х утворення ферментів цитохром (CYP)-P450 1А2, клітин печінки людини 2В6, 2С19 і 3А4 шляхом додавання як субстратів Для дослідження потенціалу побічної дії речо7-етоксирезоруфину (C YP1 A2), [ 14С]-Sвин згідно з винаходом по відношенні до індукції мефенітоїну (CYP2B6 та 2С19) та [14С]ферментів цитохром-р450 протягом 8 днів між тестостерону (CYP3 A4). На підставі визначених двома шарами колагену в 24-ямковому планшеті активностей ферментів CYP1A2, 2В6, 2С19 та 3А4 для мікротитрування при 37°С у 5% СО2 культивув оброблених клітинах у порівнянні із необроблеють первинні гепатоцити людини із щільністю кліними клітинами визначають індуктивний потенціал досліджуваних речовин. У наведеній нижче таблитини 2,5´105 клітин. Середовище для культивуці вказані результати для сполуки з прикладу 8 у вання клітин змінюють щодня. порівнянні з індукторами RIF, PB та ОМЕ: Через 48 годин культивування гепатоцити протягом 5 днів двічі обробляють різними концентраціями досліджуваних речовин та порівнюють їх з такими індукторами, як рифампіцин (RIF, 50мкМ), Таблиця Індуктивний вплив на активності ферментів печінки в культурах гепатоцитів людини через 8 днів інкубування (нормоване) Контроль RIF РВ ОМЕ Приклад 8 Концентрація 0 50мкмоль/л 2000мкмоль/л 100мкмоль/л 0,01мкг/мл 0,1мкг/мл 1,0мкг/мл 10мкг/мл CYP1A2 1,0 н.в. н.в. 28,57 0,76 0,70 0,90 1,38 CYP2B6 1,0 5,15 14,69 1,54 1,92 1,62 1,85 2,54 CYP2C19 1,0 15,21 4,00 1,61 1,30 1,30 1,12 1,97 CYP3A4 1,0 9,15 6,70 1,45 1,37 1,60 1,51 3,47 н.в. означає не визначено Іншим об'єктом даного винаходу є лікарські засоби, що містять щонайменше одну сполуку згідно з винаходом, переважно разом із одним або кількома фармакологічно прийнятними допоміжними речовинами або носіями, а також їх використання для вказаних вище цілей. Активна речовина може проявляти систематичну та/або місцеву дія. З цією метою його застосовують відповідним способом, наприклад, перорально, парентерально, через легені, назально, сублінгвально, лінгвально, букально, ректально, вводять через шкіру, через кон'юктиву, використовують локально або у виді імплантанту. Для цих способів введення активна речовина може бути використана у відповідних лікарських формах. Для перорального прийому придатними є відомі лікарські форми, які швидко та/або в модифікованому режимі вивільняють активну речовину, наприклад, такі як таблетки (без покриття, а також таблетки з покриттям, наприклад, таблетки, покриті стійким по відношенню до шлункового соку шаром, або таблетки у целофановій упаковці), капсули, драже, грануляти, пігулки, порошки, емульсії, суспензії, розчини та аерозолі. Парентеральне введення можна здійснювати при виключенні процесу резорбції (внутрішньовенним, внутрішньоартеріальним, інтракардиальним, інтраспінальним або інтралюмбальним способом) або включаючи процес резорбції (внутрішньом'я зовим, підшкірним способом, у шкіру, через шкіру або внутрішньочеревним способом). Для парентерального введення поряд з іншими можуть бути застосовані такі лікарські форми, як композиції для ін'єкцій та вливань у вигляді розчинів, суспензій, емульсій, ліофілізатів та стерильних порошків. Для інших способів уведення придатними є, наприклад, лікарські форми для інгаляцій (в тому числі порошкові інгалятори, аерозольні інгалятори), краплі або розчини в ніс, аерозолі; таблетки або капсули на язик, під язик або за щоку, супозиторії, лікарські форми для введення у вуха або очі, вагінальні капсули, водні суспензії (цілющі бальзами, мікстури, які треба струшувати), ліпофільні суспензії, мазі, креми, молочко, пасти, присипки або імплантати, наприклад, стенти. Активні речовини відомими способами можуть бути перетворені у відповідні форми застосування. З цією метою використовують інертні нетоксичні фармацевтично прийнятні допоміжні речовини. До них належать носії (наприклад, мікрокристалічна целюлоза), розчинники (наприклад, рідкі поліетиленгліколі), емульгатори (наприклад, додецилсульфат натрію), диспергатори (наприклад, полівінілпіролідон), синтетичні та натуральні біополімери (наприклад, альбумін), стабілізатори (наприклад, 17 78314 18 такі антиоксиданти, як аскорбінова кислота), барвRf індекс утримування (при тонкошароники (наприклад, такі неорганічні пігменти, як оквій хроматографії), сиди заліза) або добавки для коригування смаку RP-HPLC HPLC зі зворотними фазами, та/або запаху. В разі необхідності, активна речоRT кімнатна температура, вина одного або декількох вказаних вище носії Rt час утримування (при HPLC), може також бути представлена у мікрокапсульоTHF тетрагідрофуран. ваній формі. Розчинники для тонкошарової хроматографії Терапевтично ефективна сполука формули (І) Т1 Е1: толуол - етиловий естер оцтової повинна входити до складу названих вище фаркислоти (1:1) мацевтичних композицій у концентрації від приТ1 ЕtOН1:толуол - етанол (1:1) близно 0,1 до 99,5ваг.%, переважно від приблизно С1 Е1: циклогексан - етиловий естер оцто0,5 до 95ваг.% від усієї суміші. вої кислоти (1:1) Приведені вище фармацевтичні композиції С1 Е2: циклогексан - етиловий естер оцтопоряд зі сполукою формули (І) згідно з винаходом вої кислоти (1:2) можуть містити також інші фармацевтичні активні LCMS- та HPLC-методи речовини. Метод 1 (LC MS) У загальному випадку для досягнення бажаних Інструмент: Micromass Platform LCZ, HP1100; результатів як при лікуванні людей, так і у ветериколонна: Symmetry C18, 50мм´2,1мм, 3,5мкм; нарній медицині ефективним виявилося введення елюент А: ацетонітрил + 0,1% мурашиної кислоти, активної речовини згідно з винаходом у загальній елюент В: вода + 0,1% мурашиної кислоти; градікількості від приблизно 0,001 до приблизно 50, єнт: 0,0 хв. 10%А®4,0хв. 90%А®6,0 хв. 90%А; піч: переважно від 0,001 до 10мг на кілограм ваги тіла, 40°С; потік: 0,5мл/хв.; УФ-детектор: 208-400нм. кожні 24 години, в разі необхідності, у формі кільМетод 2 (LC MS) кох окремих доз. Окрема доза містить від приблиІнструмент: Micromass Quattro LCZ, HP1100; зно 0,001 до приблизно 30, зокрема від 0,001 до колонна: Symmetry C18, 50мм´2,1мм, 3,5мкм; 3мг активної речовини згідно з винаходом на кілоелюент А: ацетонітрил + 0,1% мурашиної кислоти, грам ваги тіла. елюент В: вода + 0,1% мурашиної кислоти; градіНижче наведені переважні приклади, які більш єнт: 0,0 хв. 10%А®4,0хв. 90%А®6,0 хв. 90%А; піч: детальний ілюструють даний винахід, але в жод40°С; потік: 0,5мл/хв.; УФ-детектор: 208-400нм. ному разі не обмежують обсяг його охорони. Якщо Метод 3 (LC MS) не зазначено нічого іншого, всі кількісні дані стоІнструмент: Waters Alliance 2790 LC; колонна: суються ваг.%. Співвідношення розчинників, проSymmetry C18, 50мм´2,1мм, 3,5мкм; елюент А: порції розведення та дані щодо концентрацій розвода + 0,1% мурашиної кислоти, елюент В: ацеточинів рідина/рідина в кожнім окремому випадку нітрил + 0,1% мурашиної кислоти; градієнт: 0,0хв. стосуються об'єму. 5%В®5,0хв. 10%В®6,0хв. 10%В; температура: Скорочення 50°С; потік: 1,0мл/хв.; УФ-детектор: 210нм. ACN ацетонітрил, Метод 4 (HPLC) ВАВА н-бутилацетат/н-бутанол/льодяна Інструмент: HP 1100 з цифровим діодоцтова кислота/фосфатний буфер матричним детектором (DAD); колонна: Kromasil рН 6 (50 : 9 : 25.15; орг. фаза), RP-18, 60мм´2мм, 3,5мкм; елюенті: А=5мл DC тонкошарова хроматографія, НСIO4/Л Н2О, В=ACN; градієнт: 0хв. 2%В, 0,5хв. DCI пряма хімічна іонізація (при MS) 2%В, 4,5хв. 90%В, 6,5хв. 90%В; потік: 0,75мл/хв.; DCM дихлорметан, температура: 30°С; УФ-детектор: 210нм. DIEA N,N-діізопропілетиламін, Препаративний метод RP-HfPLC DMSO диметилсульфоксид, Колонна: YMC-Gel; елюент: ацетонітрил/вода DMF N,N-диметилформамід, (градієнт); потік: 50мл/хв.; температура: 25°С; УФвід. теор. від теоретичного, детектор: 210нм. ЕЕ етилацетат (етиловий естер оцтової Вихідні сполуки: кислоти), Приклад 1А ΕΙ іонізація при електронному ударі Етиловий естер 5-аміно-1-(2(при MS), фторбензил)піразол-3-карбонової кислоти ESI іонизація електророзпилюванням (при MS), Т.пл. температура плавлення, нас. насичений, год. години, HPLC високоефективна рідинна хроматографія (при високому тиску), конц. концентрований, LC-MS рідинна хроматомасспектроскопія, LDA літій-діізопропіламід, МСРВА м-хлорпероксибензойна кислота, MS масспектроскопія, NMR спектроскопія ядерного магнітного 100г (0,613моль) натрієвої солі етилового есрезонансу (ЯМР), теру ціанопіровиноградної кислоти [за аналогією з ВІДСОТ. відсотковий, Borsche та Manteuffel, Liebigs Ann. 1934, 512, 97] 19 78314 20 при ретельному перемішуванні в атмосфері аргону при кімнатній температурі поміщають у 2,5л діоксану, додають 111,75г (75мл, 0,98моль) трифтороцтової кислоти та перемішують протягом 10 хвилин, причому більша частина едикту переходить у розчин. Після цього додають 85,93г (0,613моль) 2-фторбензилгідразину та кип'ятять протягом ночі. Після охолодження відсмоктують кристали трифторацетату натрію, що випали в осад, промивають діоксаном та розчин без очищення піддають подальшій взаємодії. 36,1г (133ммоль) 1-(2-фторбензил)-1НПриклад 2А піразоло[3,4-b]піридин-3-карбоксаміду з прикладу Етиловий естер 1-(2-фторбензил)-1Н3А розчиняють в 330мл THF та додають 27г піразоло[3,4-b]піридин-3-карбонової кислоти (341ммоль) піридину. Після цього протягом 10 хвилин додають 47,76мл (71,66г, 341ммоль) ангідриду три фтороцтової кислоти, причому температуру збільшують до 40°С. Протягом ночі перемішують при кімнатній температурі. Потім реакційну суміш поміщають у 1л води та тричі екстрагують відповідно 0,5л етилового естеру оцтової кислоти. Органічну фазу промивають насиченим розчином гідрокарбонату натрію та 1N соляною кислотою, висушують сульфатом магнію та випарюють на роторному випарнику. Вихід: 33,7г (100% від теор.) В одержаний з прикладу 1А розчин додають Температура плавлення: 81°С 61,25мл (60,77г, 0,613моль) диметиламіноакролеїRf(SiO2, T1 E1): 0,74 ну та 56,28мл (83,88г, 0,736моль) трифтороцтової Приклад 5А кислоти та в атмосфері аргону кип'ятять протягом Метиловий естер (2-фторбензил)-1Н3 днів. Після цього розчинник випаровують у вакупіразоло[3,4-b]піридин-3-карбоксімідної кислоти умі, залишок поміщають у 2л води та тричі екстрагують відповідно 1л етилового естеру оцтової кислоти. Об'єднані органічні фази висушують сульфатом магнію та випарюють на роторному випарнику. Хроматографують на 2,5кг силікагелю та вимивають градієнтом толуол/толуол-етиловий естер оцтової кислоти = 4:1. Вихід: 91,6г (49,9% від теор. на двох стадіях). Температура плавлення 85°С Rf(SiO2, Т1 Е1): 0,83 Приклад 3А 1-(2-фторбензил)-1Н-піразоло[3,4-b]піридин-3карбоксамід 30,37г (562ммоль) метилату натрію розчиняють в 1,5л метанолу та додають 36,45г (144,5ммоль) 3-ціано-1-(2-фторбензил)-1Нпіразоло[3,4-b]піридину (з прикладу 4А). Протягом 2 годин перемішують при кімнатній температурі та одержаний розчин в такому вигляді використовують на наступній стадії. Приклад 6А 1-(2-фторбензил)1Н-піразоло[3,4-b]піридин-3карбоксамідину 10,18г (34ммоль) одержаного в прикладі 2А естеру поміщають в 150мл метанолу насиченого аміаком при 0-10°С. Два дні перемішують при кімнатній температурі та концентрують у вакуумі. Rf(SiO2, T1 Е1):0,33 Приклад 4А 3-ціано-1-(2-фторбензил)-1Н-піразоло[3,4b]піридин До одержаного з прикладу 5А розчину метилового естеру (2-фторбензил)-1Н-піразоло-[3,4 21 78314 22 b]піридин-3-карбоксімідної кислоти в метанолі додають в 33,76г (32,19мл, 562ммоль) крижаної оцУ 60мл DMF протягом 22 годин при тиску водтової кислоти та 9,28г (173ммоль) хлориду амонію ню 65бар та температурі 62°С гідрують 5г та протягом ночі перемішують та кип'ятять зі зво(11,38ммоль) 2-[1-(2-фторбензил)-1Н-піразоло[3,4ротним холодильником. Розчинник випаровують у b]піридин-3-іл]-5-[(Е)-фенілдіазеніл]-4,6вакуумі, залишок ретельно розтирають з ацетопіримідиндіаміну з прикладу 7А з 800мг 50%-ного ном, тверду речовину, яка випала в осад, відсмокнікелю Ренея у воді. Відсмоктують каталізатором тують, поміщають в 2л води, при перемішуванні через кізельгур, розчин випарюють у вакуумі та додають 31,8г карбонату натрію та тричі екстрагуперемішують з 5N соляною кислотою. Речовину ють 1л етилового естеру оцтової кислоти, органічжовто-коричневого кольору, що випала в осад, ну фаз у висушують сульфатом магнію та випаровідсмоктують та висушують. Одержують 3,1г вують у вакуумі. (59,3% від теор.) цільової сполуки. Вільну основу Вихід: 27,5г (76,4% від теор. на дво х стадіях) одержують струшуванням з розведеним розчином Температура плавлення: 86°С гідрокарбонату натрію та екстрагують етиловим Rf(SiO2, T1 EtOH1): 0,08 естером оцтової кислоти. Нерозчинну в обох фаПриклад 7А зах тверду речовину відсмоктують. Фаза етилово2-[1-(2-фторбензил)-1Н-піразоло[3,4-b]піридинго естеру оцтової кислоти також містить незначну 3-іл]-5-[(Е)фенілдіазеніл]-4,6-піримідиндіамін кількість вільної основи. Приклад 9А Метилціанометил(метил)карбам ат Одержання аналогічно до: [Q. Li. Chu, Т. W. Daniel, A. Claiborne, С S. Cooper, С. М. Lee, J. Med. Chem. 1996, 39, 3070-3088]. Приклад 10А Натрій-(Е)-2-ціано-2[(метоксикарбоніл)(метил)аміно]етанолат До розчину 21,92г (71,7ммоль) 1-(2фторбензил)1Н-піразоло[3,4-b]піридин-3карбоксамідину з прикладу 6 А в Ν,Νдиметилформаміді при перемішуванні додають 3,87г метанолату натрію та після цього 12,2г (71,7ммоль) фенілазомалононітрилу [L. F. Cavalieri, J. F. Tanker, A. Bendich, J. Am. Chem. Soc, 1949, 71, 533]. Протягом ночі перемішують при температурі 110°С та дають розчину охолонути. Тверду речовину, яка випала в осад, відсмоктують та промивають етанолом після висушування одержують 23г (73% від теор.) цільової сполуки. Приклад 8А Тригідрохлорид 2-[1-(2-фторбензил)-1Нпіразоло[3,4-b]піридин-3-іл]-4,5,6піримідинтриаміну В атмосфері аргону до тетрагідрофурану додають 0,46г (0,01ммоль) метилату натрію (розчин А). Після цього в 1,73г (0,02ммоль) етилового естеру мурашиної кислоти додають 1,00г (0,01ммоль) метилціанометил(метил)карбамату з прикладу 9А. До цієї суміші повільно та обережно по краплях додають розчин А. Протягом ночі перемішують при кімнатній температурі. Розчинник відганяють на роторному випарнику у вакуумі, а до залишку додають діетиловий етер. Кристали, що випадають в осад, відсмоктують та висушують у високому вакуумі. Вихід: 1,05г (76% від теор.) HPLC (метод 4): R t=1,35хв. 1 Н-ЯМР (200Мгц, D MSO-d6): d = 2,90 (д, 1Н), 3,35 (с, 3Н), 3,47 (с, 3Н). Приклади Приклад 1 Етил-4-аміно-2-[1-(2-фторбензил)-1Нпіразоло[3,4-b]піридин-3-іл]-5-піримідиніл(метил)карбам ат 23 78314 В атмосфері аргону до 0,80г (2,61ммоль) 1-(2фторбензил)1Н-піразоло[3,4-b]-піридин-3карбоксамідину з прикладу 6А додають 0,51г (2,86ммоль) натрій-(Е)-2-ціано-2[(метоксикарбоніл)(метил)аміно]етанолат з прикладу 10А та 0,53г 0,73мл (5,23ммоль) триетиламіну в 50мл толуолу. Протягом 9 годин кип'ятять зі зворотним холодильником. Після цього знову о холоджують до кімнатної температури, додають дихлорметан та воду та екстрагують. Органічну фазу висушують над суль фатом магнію, відфільтровують та випарують у вакуумі на роторному випарнику. До залишку додають 5 мл діетилового етеру та кристалізують. Кристали відсмоктують, висушують та очи щають за допомогою препаративним методом RP-HPLC. Вихід: 20,2мг (2% від теор.) LC/MS (метод 2): R t=3,01хв. MS (El): m/z=408 (М+Н)+ 1 Н-ЯМР (300МГц, DMSO-d6): d = 3,09 (с, 3Н), 3,29 (с, 3Н), 5,83 (с, 2Н), 7,09-7,42 (м, 5Н), 8,20 (с, 1Н), 8,64 (дд, 1Н), 8,94 (дд, 1Н), 9,27 (ш. с, 2Н). Приклад 2 Етил-4,6-діаміно-2-[1-(2-фторбензил)-1Нпіразоло[3,4-b]піридин-3-іл]-5-піримідинілкарбамат 24 До 5мл піридину додають 107,35мг (0,31ммоль) тригідрохлориду 2-[1-(2-фторбензил)1Н-піразоло[3,4-b]піридин-3-іл]-4,5,6піримідинтриаміну з прикладу 8А та суміш охолоджують до 0°С. Потім додають 33,25мг (0,31ммоль) етилового естеру хлормурашиної кислоти та протягом ночі перемішують при кімнатній температурі. Піридин відганяють у вакуумі на роторному випарнику, а залишок очищають препаративним методом RP-HPLC. Вихід: 56,2мг (43% від теор.) LC/MS (метод 1): R t=2,66хв. MS (El): m/z=423 (М+Н)+ 1 Н-ЯМР (300МГц, D MSO-d6): d = 1,17-1,33 (м, 3Н), 3,97-4,14 (м, 2Н), 5,80 (с, 2Н), 6,14 (ш. с, 4Н), 7,07-7,17 (м, 2Н), 7,22 (т, 1Н), 7,29-7,40 (м, 2Н), 7,97 (ш. с, 1Н), 8,60 (д, 1Н), 9,07 (д, 1Н). Приклад 3 Ізопропіл-4,6-діаміно-2-[1-(2-фторбензил)-1Нпіразоло[3,4-b]піридин-3-іл]-5-піримідинілкарбамат Одержання аналогічно до прикладу 2 із додаванням 150мг трихлориду (0,43ммоль) 2-[1-(2фторбензил)-1Н-піразоло[3,4-b]піридин-3-іл]-4,5,6піримідинтриаміну з прикладу 8А, 7,5мл піридину та 52,47мг (0,43ммоль) ізопропілхлороформату. Залишок поміщають у суміш з дихлорметану та метанолу, відфільтровують та висушують. Вихід: 165мг (88% від теор.) LC/MS (метод 1): R t=2,84хв. MS (El): m/z=437 (М+Н)+ 1 Н-ЯМР (300МГц, D MSO-d6): d = 1,26 (д, 6Η), 4,82 (квін., 1Н), 5,92 (с, 2Н), 7,07-7,20 (м, 2Н), 7,25 (т, 1Н), 7,31-7,43 (м, 2Н), 7,47-7,57 (м, 1Н), 8,16 (ш. с, 1Н), 8,74 (дд, 1Н), 8,98 (дд, 1Н). Приклад 4 Неопентил-4,6-діаміно-2-[1-(2-фторбензил)1Н-піразоло[3,4-b]піридин-3-іл]-5піримідинілкарбамат 25 78314 26 ють з 300мл киплячого діетилового етеру. Продукт, що випадає, відсмоктують та висушують у вакуумі. Вихід: 32,6г (92% від теор.) LC/MS (метод 1): R t=2,61хв. MS (El): m/z=409 (М+Н)+ 1 Н-ЯМР (400МГц, DMSO-d6): d = 3,61 (с, 3Н), 5,80 (с, 2Н), 6,19 (ш. с, 4Н), 7,08-7,16 (м, 2Н), 7,22 (т, 1Н), 7,28-7,39 (м, 2Н), 7,99 (ш. с, 1Н), 8,60 (дд, 1Н), 9,05 (дд, 1Н). Приклад 6 Етил-4,6-діаміно-2-[1-(2-фторбензил)-1Нпіразоло[3,4-b]піридин-3-іл]-5-піримідиніл(метил)карбамат Одержання аналогічно до прикладу 2 із додаванням 100мг (0,29ммоль) трихлориду 2-[1-(2фторбензил)-1Н-піразоло[3,4-b]піридин-3-іл]-4,5,6піримідинтриаміну з прикладу 8А, 5мл піридину та 43мг (0,29ммоль) неопентилхлоридокарбонату. Вихід: 54мг (41% від теор.) LC/MS (метод 1): R t=3,10хв. MS (El): m/z=465 (М+Н)+ 1 Н-ЯМР (400МГц, DMSO-d6): d = 0,95 (ш. с, 9Н), 3,74 (с, 2Н), 5,79 (с, 2Н), 6,10 (ш. с, 4Н), 7,087,17 (м, 2Н), 7,22 (т, 1Н), 7,29-7,39 (м, 2Н), 8,00 (ш. с, 1Н), 8,60 (дд, 1Н), 9.06 (дд, 1Н). Приклад 5 Метил-4,6-діаміно-2-[1-(2-фторбензил)-1Нпіразоло[3,4-b]піридин-3-іл]-5-піримідинілкарбамат У 30мл піридину розчиняють 30,5г (87,0ммоль) тригідрохлориду 2-[1-(2-фторбензил)-1Нпіразоло[3,4-b]піридин-3-іл]-4,5,6піримідинтриаміну з прикладу 8А. Одержаний розчин охолоджують до 0°С. Додають 8,22г (87,0ммоль) метилового ефіру хлормурашиної кислоти та перемішують ще 2 години при 0°С. Після цього дають нагрітися до кімнатної температури та перемішують ще 12 годин. Після розпарювання у вакуумі промивають залишок водою та висушують. Для подальшого очищення перемішу 54мг (0,13ммоль) етил-4,6-діаміно-2-[1-(2фторбензил)-1Н-піразоло-[3,4-b]піридин-3-іл]-5піримідинілкарбамату з прикладу 3 поміщають в 5мл DMF, суміш охолоджують до 0°С та додають 7,67мг (0,19ммоль) гідриду натрію. Після цього по краплях додають 18,14мг (0,13ммоль) йод метану та протягом години перемішують. У суміш додають воду та екстрагують дихлорметаном. Об'єднані органічні фази висушують сульфатом магнію та випарюють на роторному випарнику. Залишок спочатку очищують колонковим хроматогруванням (розчинник: дихлорметан/метанол = 10:1) та після цього методом препаративної RP-HPLC. Вихід: 32мг (58% від теор.) LC/MS (метод 2): R t=2,91хв. MS (El): m/z=437 (М+Н)+ 1 Н-ЯМР (200МГц, DMSO-d6): d = 1,08 (т, 3Η), 2,99 (с, 3Н), 2,93-4,11 (м, 2Н), 5,79 (с, 2Н), 6,35 (ш. с, 4Н), 7,06-7,14 (м, 2Н), 7,16-7,28 (м, 1Н), 7,287,32 (м, 2Н). 8,59 (дд, 1Н), 9,06 (дд, 1Н). Приклад 7 Ізопропіл-4,6-діаміно-2-[1-(2-фторбензил)-1Нпіразоло[3,4-b]піридин-3-іл]-5піримідиніл(метил)карбам ат 27 78314 28 бути одержані відповідно до вказаного нижче способу синтезу: У 275мл тетрагідрофурану розчиняють 20,0г (49,0ммоль) метил-4,6-діаміно-2-[1-(2фторбензил)-1Н-піразоло[3,4-b]піридин-3-іл]-5піримідинілкарбамату з прикладу 5 та охолоджують до 0°С. Протягом 15 хвилин по краплях додають 53,9мл (49,0ммоль 1Μ розчину у те трагідрофурані) біс-(триметил)силіламіду літію. Перемішують 20 хвилин при 0°С та після цього додають 6,95г (53,9ммоль) йодметану. Через 1 годину дають розчину нагрітися до кімнатної температури та зупиняють реакцію шляхом додавання насиченого водного розчину хлориду амонію. Фази розділяють. Водяну фазу кілька разів екстрагують етилацетатом та дихлорметаном. Об'єднані органічні фази випарюють у вакуумі. Одержаний таким чином залишок суспендують у суміші дихлорметаОдержання аналогічно до прикладу 6 із додану та тетрагідрофурану (1:1). Нерозчинні кристали ванням 75мг (0,17ммоль) ізопропіл-4,6-діаміно-2відсмоктують та поміщають у метанол. Протягом [1-(2-фторбензил)-1Н-піразоло[3,4-b]піридин-3-іл]однієї години нагрівають зі зворотним холодильни5-піримідинілкарбамату з прикладу 3, 10,31мг ком. Після охолодження осад, що випав, відфільт(0,26ммоль) гідриду натрію та 24,4мг (0,17ммоль) ровують. Одержану при цьому тверду речовину йодметану. Залишок очищують методом препарачервоного кольору суспендують у 100мл суміші тивної RP-HPLC. діоксану та дихлорметану (1:1) та при температурі Вихід: 32мг (41% від теор.) кипіння додають 20мл метанолу до утворення LC/MS (метод 1): R t=2,97хв. прозорого розчину. Додають активоване вугілля, MS (El): m/z=451 (М+Н)+ 1 недовго нагрівають до кипіння та фільтрують гаряН-ЯМР (300МГц, D MSO-d6): d = 1,09 (д, 6Н), чий розчин через кізельгур. Одержаний таким чи2,98 (с, 3Н), 4,80 (квін., 1Н), 5,79 (с, 2Н), 6,31 (ш. с, ном розчин випарюють до суха. Додають метанол 4Н), 7,05-7,16 (м, 2Н), 7,22 (т, 1Н), 7,28-7,40 (м, та протягом однієї години перемішують суспензію 2Н), 8,59 (дд, 1Н), 9,07 (дд, 1Н). при кімнатній температурі. Кристали білого кольоПриклад 8 ру відфільтровують. Метил-4,6-діаміно-2-[1-(2-фторбензил)-1НВихід: 14,9г (72 % від теор.) піразоло[3,4-b]піридин-3-іл]-5LC/MS (метод 3): R t=1,85хв. піримідиніл(метил)карбам ат MS (El): m/z=423 (М+Н)+ 1 Н-ЯМР (200МГц, DMSO-d6): d = 3,01 (с, 3Н), 3,57 (с, 3Н), 5,92 (с, 2Н), 7,05-7,17 (м, 2Н), 7,187,46 (м, 3Н), 7,47-7,61 (м, 2Н), 7,59-7,97 (м, 2Н), 8,71-8,81 (м, 1Н), 8,97 (дд, 1Н). Приклад 9 Ізопропіл-4,6-діаміно-2-[1-(2-фторбензил)-1Нпіразоло[3,4-b]піридин-3-іл]-5піримідиніл(етил)карбамат Одержання аналогічно до прикладу 6 із додаванням 310мг (0,76ммоль) метил-4,6-діаміно-2-[1(2-фторбензил)-1Н-піразоло[3,4-b]піридин-3-іл]-5піримідинілкарбпмату з прикладу 5, 27,32мг (1,14ммоль) гідриду натрію та 215,5мг (1,52ммоль) йодметану. Для обробки у суміш додають воду, 2Μ розчин гідроксиду калію та екстрагують дихлорметаном. Об'єднані органічні фази висушують сульфатом магнію та випарюють на роторному випарнику. Залишок очищують методом препаративної RP-HPLC. Вихід: 93мг (29% від теор.) Більші кількості сполуки з прикладу 8 можуть Одержання аналогічно до прикладу 6 із додаванням 60мг (0,14ммоль) ізопропіл-4,6-діаміно-2[1-(2-фторбензил)-1Н-піразоло[3,4-b]піридин-3-іл]5-піримідинілкарбамату з прикладу 3, 4,95мг 29 78314 30 (0,21ммоль) гідриду натрію та 21,4мг (0,17ммоль) MS (El): m/z=465 (М+Н)+ 1 йодетан. Для повного перетворення ще раз додаН-ЯМР (200МГц, D MSO-d6): d = 0,96-1,06 (м, ють ту саму кількість гідриду натрію та йодетану. 3Н), 1,09 (д, 6Н), 2,79-2,93 (м, 2Н), 4,82 (квін., 1Н), Залишок очищають за допомогою препаративної 5,80 (с, 2Н), 6,25 (ш. с, 4Н), 7,01-7,14 (м, 2Н), 7,15RP-HPLC. 7,50 (м, 3Н), 8,60 (дд, 1Н),9,09(дд, 1Н). Вихід: 43мг (67% від теор.) LC/MS (метод 1): R t=2,97хв. Комп’ютерна в ерстка О. Гапоненко Підписне Тираж 26 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюCarbamate-substituted pyrazolopyridines
Автори англійськоюMunter, Klaus, Stasch Johannes-Peter, Weigand Stefan, Feurer Achim
Назва патенту російськоюКарбамат-замещенные пиразолопиридины
Автори російськоюМюнтэр Клаус, Шташ Йоханнес-Петер, Вайганд Штефан, Фойрер Ахим
МПК / Мітки
МПК: A61P 27/06, A61P 9/02, A61P 15/10, A61P 25/28, A61P 9/12, A61K 45/06, A61P 25/00, A61K 31/506, A61P 25/24, A61P 15/00, A61P 9/10, A61P 25/16, A61P 13/00, C07D 471/04, A61P 19/10, A61P 9/00
Мітки: піразолопіридини, карбаматзаміщені
Код посилання
<a href="https://ua.patents.su/15-78314-karbamatzamishheni-pirazolopiridini.html" target="_blank" rel="follow" title="База патентів України">Карбаматзаміщені піразолопіридини</a>
Попередній патент: Спосіб утилізації автомобільних покришок
Наступний патент: Жниварка
Випадковий патент: Цифровий вимірювач поверхневої концентрації хлорофілу у листках рослин