Рідкі композиції перорального призначення
Номер патенту: 80085
Опубліковано: 27.08.2007
Автори: Десаі Ашок Дж., Уілсон Едвард С., Меєр Гленн А., Треспіді Лаура А., Сансіліо Фредерік Д., Кларк Крісті М.
Формула / Реферат
1. Фармацевтична композиція, яка містить
один або декілька фармацевтично активних агентів, вибраних з групи, яка складається зі згаданих агентів, в яких принаймні один зі згаданих агентів має принаймні один кислотний фрагмент; і принаймні один зі згаданих агентів має принаймні одну естерну групу чи інший хімічно активний фрагмент, у якому кінцевий залишок естерної групи чи іншого хімічно активного фрагмента гідролізується або іншим чином видаляється in situ чи in vivo, утворюючи принаймні один кислотний фрагмент; і де фармацевтично активний агент є розчинним у кислоті у співвідношенні від приблизно 3 : 1 (кислота до розчинювальної речовини) до приблизно 10000 : 1 (кислота до розчинювальної речовини), або їх фармацевтично прийнятні солі;
принаймні один диспергувальний агент; і
принаймні один солюбілізувальний агент.
2. Фармацевтична композиція за п. 1, яка відрізняється тим, що додатково містить принаймні одну поверхнево-активну речовину і/або принаймні один пластифікатор.
3. Фармацевтична композиція за п. 1, яка відрізняється тим, що диспергувальний агент вибраний з групи, яка складається з диспергувальних агентів на основі полімерів та диспергувальних агентів на основі карбогідратів.
4. Фармацевтична композиція за п. 3, яка відрізняється тим, що співвідношення одного або декількох фармацевтично активних агентів до одного або декількох диспергувальних агентів на основі полімеру знаходиться в межах від приблизно 3 : 1 (мас./мас.) до приблизно 1 : 50 (мас./мас.).
5. Фармацевтична композиція за п. 4, яка відрізняється тим, що одним або більше диспергувальними агентами на основі полімера є полівінілпіролідон.
6. Фармацевтична композиція за п. 5, яка відрізняється тим, що полівінілпіролідоном є полівінілпіролідон К29-32.
7. Фармацевтична композиція за п. 3, яка відрізняється тим, що співвідношення одного або декількох фармацевтично активних агентів до одного або декількох диспергувальних агентів на основі карбогідрату знаходиться в межах від приблизно 3 : 1 (мас./мас.) до приблизно 1 : 20 (мас./мас.).
8. Фармацевтична композиція за п. 7, яка відрізняється тим, що один або декілька диспергувальних агентів на основі карбогідрату вибрані із групи, що складається з гідроксипропілцелюлози, гідроксипропілметилцелюлози і циклодекстрину.
9. Фармацевтична композиція за п. 2, яка відрізняється тим, що концентрація одного або декількох солюбілізувальних агентів знаходиться в межах приблизно від нуля до приблизно 99 % (мас./мас.) від загальної маси композиції.
10. Фармацевтична композиція за п. 9, яка відрізняється тим, що один або декілька солюбілізувальних агентів вибрані із групи, що складається з води та поліетиленгліколю.
11. Фармацевтична композиція за п. 10, яка відрізняється тим, що молекулярна маса поліетиленгліколю знаходиться в межах приблизно від 200 до приблизно 8000.
12. Фармацевтична композиція за п. 10, яка відрізняється тим, що концентрація поліетиленгліколю знаходиться в межах приблизно від 20 до приблизно 99 % (мас./мас.) від загальної маси композиції.
13. Фармацевтична композиція за п. 9, яка відрізняється тим, що концентрація води знаходиться в межах приблизно від нуля до приблизно 99 % (мас./мас.) від загальної маси композиції.
14. Фармацевтична композиція за п. 4, яка відрізняється тим, що концентрація одного або декількох солюбілізувальних агентів знаходиться в межах приблизно від нуля до приблизно 99 % (мас./мас.) від загальної маси композиції.
15. Фармацевтична композиція за п. 7, яка відрізняється тим, що концентрація одного або декількох солюбілізувальних агентів знаходиться в межах приблизно від нуля до приблизно 99 % (мас./мас.) від загальної маси композиції.
16. Фармацевтична композиція за п. 1, яка відрізняється тим, що один або декілька фармацевтично активних агентів вибрані з групи, яка складається з нестероїдних протизапальних лікарських засобів, квінаприлу, флувастатину, ловастатину, правастатину, цервістатину, аторвастатину, симвастатину, фексофенадину, хромоліну, омепразолу, гемфіброзилу, ципрофібрату, ципрофлоксацину, ломефлоксацину, офлоксацину, карбідопу, леводопу, ретиноєвої кислоти, карбопросту, пеніцилінів, ![]() -лактамів, цефалоспоринів, ліотироніну та пробенециду.
-лактамів, цефалоспоринів, ліотироніну та пробенециду.
17. Фармацевтична композиція за п. 16, яка відрізняється тим, що нестероїдні протизапальні лікарські засоби вибрані з групи, що складається з аралкілкарбонових кислот та арилкарбонових кислот.
18. Фармацевтична композиція за п. 17, яка відрізняється тим, що аралкілкарбонові кислоти вибрані з групи, що складається з диклофенаку, фенопрофену, флурбіпрофену, ібупрофену, індометацину, кетопрофену, кеторолаку, напроксену, суліндаку, етодолаку та тометину.
19. Фармацевтична композиція за п. 17, яка відрізняється тим, що арилкарбонові кислоти вибрані з групи, що складається з дифлунізалу, мефенамінової кислоти, меклофенамінової кислоти і флуфенамінової кислоти.
20. Фармацевтична композиція за п. 16, яка відрізняється тим, що пеніциліни вибрані з групи, що складається з амоксицилінів та ампіцилінів.
21. Фармацевтична композиція за п. 14, яка відрізняється тим, що один або декілька фармацевтично активних агентів вибрані з групи, яка складається з нестероїдних протизапальних лікарських засобів, квінаприлу, флувастатину, ловастатину, правастатину, цервістатину, аторвастатину, симвастатину, фексофенадину, хромоліну, омепразолу, гемфіброзилу, ципрофібрату, ципрофлоксацину, ломефлоксацину, офлоксацину, карбідопу, леводопу, ретиноєвої кислоти, карбопросту, пеніцилінів, ![]() -лактамів, цефалоспоринів, ліотироніну та пробенециду.
-лактамів, цефалоспоринів, ліотироніну та пробенециду.
22. Фармацевтична композиція за п. 15, яка відрізняється тим, що один або декілька фармацевтично активних агентів вибрані з групи, яка складається з нестероїдних протизапальних лікарських засобів, квінаприлу, флувастатину, ловастатину, правастатину, цервістатину, аторвастатину, симвастатину, фексофенадину, хромоліну, омепразолу, гемфіброзилу, ципрофібрату, ципрофлоксацину, ломефлоксацину, офлоксацину, карбідопу, леводопу, ретиноєвої кислоти, карбопросту, пеніцилінів, ![]() -лактамів, цефалоспоринів, ліотироніну та пробенециду.
-лактамів, цефалоспоринів, ліотироніну та пробенециду.
23. Фармацевтична композиція за п. 14, яка відрізняється тим, що концентрація необов'язкового принаймні одного пластифікатора знаходиться в межах приблизно від нуля до приблизно 75 % (мас./мас.) від загальної маси композиції.
24. Фармацевтична композиція за п. 23, яка відрізняється тим, що пластифікатор вибраний із групи, що складається з гліцерину, пропіленгліколю та сорбітолу.
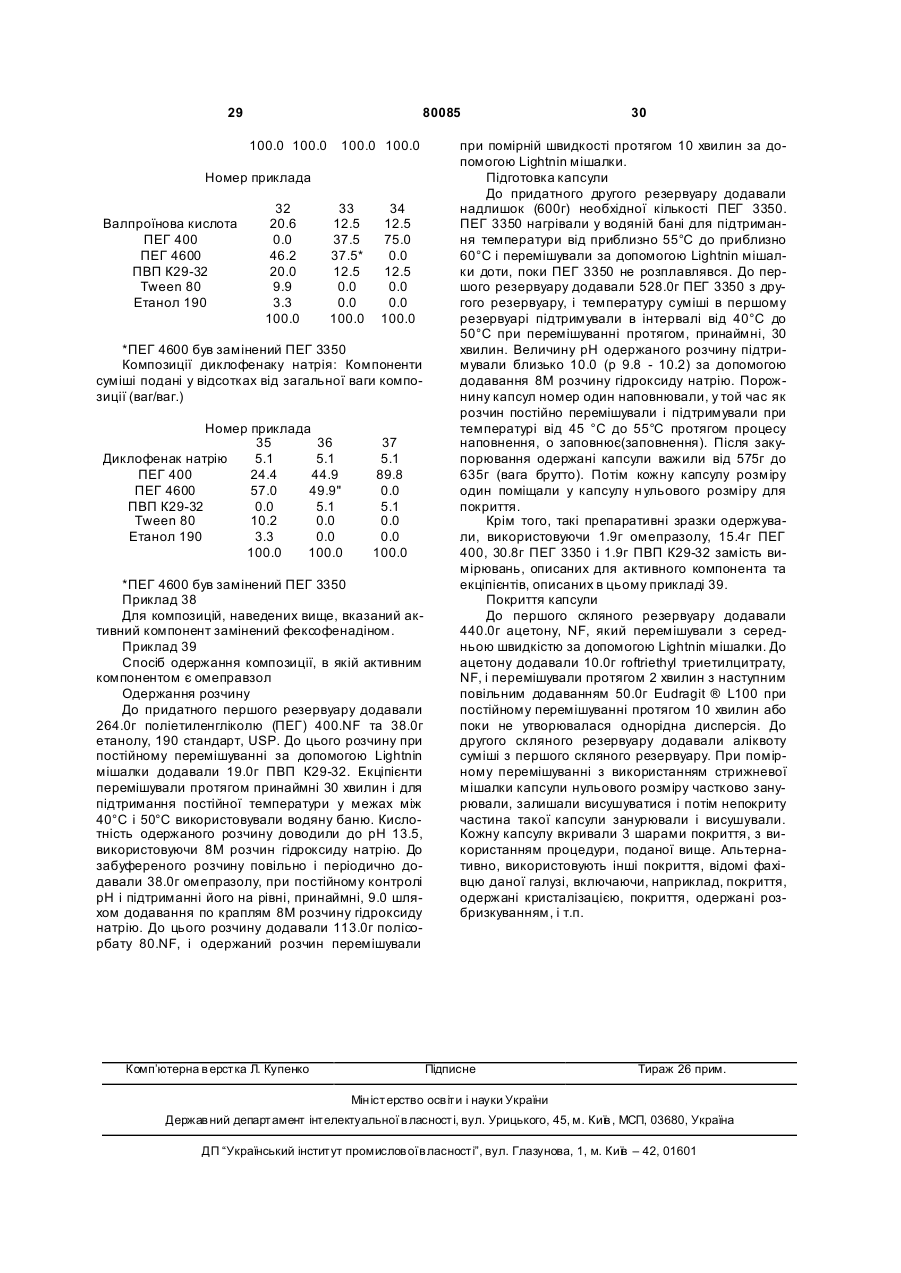
25. Фармацевтична композиція за п. 15, яка відрізняється тим, що концентрація необов'язкового принаймні одного пластифікатора знаходиться в межах приблизно від нуля до приблизно 75 % (мас./мас.) від загальної маси композиції.
26. Фармацевтична композиція за п. 25, яка відрізняється тим, що пластифікатор вибраний із групи, що складається з гліцерину, пропіленгліколю та сорбітолу.
27. Фармацевтична композиція за п. 23, яка відрізняється тим, що концентрація необов'язкової принаймні однієї поверхнево-активної речовини знаходиться в межах приблизно від нуля до приблизно 10 % (мас./мас.) від загальної маси композиції.
28. Фармацевтична композиція за п. 25, яка відрізняється тим, що концентрація необов'язкової принаймні однієї поверхнево-активної речовини знаходиться в межах приблизно від нуля до приблизно 10 % (мас./мас.) від загальної маси композиції.
29. Фармацевтична композиція у вигляді капсули, заповненої композицією згідно з п. 1.
30. Фармацевтична композиція за п. 29, яка відрізняється тим, що капсула вибрана з групи, що складається з м'яких желатинових капсул і твердих желатинових капсул.
31. Фармацевтична композиція у вигляді капсули, заповненої композицією згідно з п. 27, яка необов'язково має покриття.
32. Фармацевтична композиція за п. 31, яка відрізняється тим, що капсула вибрана з групи, що складається з м'яких желатинових капсул і твердих желатинових капсул.
33. Фармацевтична композиція, у вигляді капсули, заповненої композицією згідно з п. 28, яка необов'язково має покриття.
34. Фармацевтична композиція за п. 33, яка відрізняється тим, що капсула вибрана з групи, що складається з м'яких желатинових капсул і твердих желатинових капсул.
35. Фармацевтична композиція за п. 31, яка відрізняється тим, що один або декілька фармацевтично активних агентів вибрані з групи, яка складається з нестероїдних протизапальних лікарських засобів, квінаприлу, флувастатину, ловастатину, правастатину, цервістатину, аторвастатину, симвастатину, фексофенадину, хромоліну, омепразолу, гемфіброзилу, ципрофібрату, ципрофлоксацину, ломефлоксацину, офлоксацину, карбідопу, леводопу, ретиноєвої кислоти, карбопросту, пеніцилінів, ![]() -лактамів, цефалоспоринів, ліотироніну та пробенециду.
-лактамів, цефалоспоринів, ліотироніну та пробенециду.
36. Фармацевтична композиція за п. 33, яка відрізняється тим, що один або декілька фармацевтично активних агентів вибрані з групи, яка складається з нестероїдних протизапальних лікарських засобів, квінаприлу, флувастатину, ловастатину, правастатину, цервістатину, аторвастатину, симвастатину, фексофенадину, хромоліну, омепразолу, гемфіброзилу, ципрофібрату, ципрофлоксацину, ломефлоксацину, офлоксацину, карбідопу, леводопу, ретиноєвої кислоти, карбопросту, пеніцилінів, ![]() -лактамів, цефалоспоринів, ліотироніну та пробенециду.
-лактамів, цефалоспоринів, ліотироніну та пробенециду.
37. Спосіб поліпшення швидкості абсорбції одного або декількох фармацевтично активних агентів у ссавця, де фармацевтично активний агент вибраний з групи, яка складається зі згаданих агентів, в яких:
принаймні один зі згаданих агентів має принаймні один кислотний фрагмент, і
принаймні один із згаданих агентів має принаймні одну естерну групу чи інший хімічно активний фрагмент, у якому кінцевий залишок згаданої естерної групи чи іншого хімічно активного фрагмента гідролізується або іншим чином видаляється in situ чи in vivo, утворюючи принаймні один кислотний фрагмент; і де згаданий фармацевтично активний агент є розчинним у кислоті у співвідношенні від приблизно 3 : 1 (кислота до розчинювальної речовини) до приблизно 10000 : 1 (кислота до розчинювальної речовини), або їх фармацевтично прийнятних солей,
який полягає в уведенні ссавцю, що має потребу в лікуванні таким фармацевтично активним агентом, ефективної кількості композиції згідно з п. 1 за умови, що така композиція необов'язково містить згадану поверхнево-активну речовину.
38. Спосіб підсилення терапевтичної дії одного або декількох фармацевтично активних агентів у ссавця, де фармацевтично активний агент вибраний з групи, яка складається зі згаданих агентів, в яких:
принаймні один зі згаданих агентів має принаймні один кислотний фрагмент, і
принаймні один із згаданих агентів має принаймні одну естерну групу чи інший хімічно активний фрагмент, у якому кінцевий залишок естерної групи чи іншого хімічно активного фрагмента гідролізується або іншим чином видаляється in situ чи in vivo, утворюючи принаймні один кислотний фрагмент; і де згаданий фармацевтично активний агент є розчинним у кислоті у співвідношенні від приблизно 3 : 1 (кислота до розчинювальної речовини) до приблизно 10000 : 1 (кислота до розчинювальної речовини), або їх фармацевтично прийнятних солей,
який полягає в уведенні ссавцю, що має потребу в лікуванні таким фармацевтично активним агентом, ефективної кількості композиції згідно з п. 1 за умови, що така композиція необов'язково містить поверхнево-активну речовину.
39. Спосіб інгібування подразнення шлунку у ссавця, викликаного прийомом одного або декількох нестероїдних протизапальних засобів, який полягає в уведенні композиції згідно з п. 1, в якій принаймні одним з фармацевтично активних агентів є ефективна кількість нестероїдного протизапального засобу.
40. Спосіб лікування ссавців, які мають потребу в лікуванні одним або декількома фармацевтично активними агентами, вибраними з групи, яка складається зі згаданих агентів, в яких:
принаймні один зі згаданих агентів має принаймні один кислотний фрагмент, і
принаймні один із згаданих агентів має принаймні одну естерну групу чи інший хімічно активний фрагмент, у якому кінцевий залишок естерної групи чи іншого хімічно активного фрагмента гідролізується або іншим чином видаляється in situ чи in vivo, утворюючи принаймні один кислотний фрагмент; і де фармацевтично активний агент є розчинним у кислоті у співвідношенні від приблизно 3 : 1 (кислота до розчинювальної речовини) до приблизно 10000 : 1 (кислота до розчинювальної речовини), або їх фармацевтично прийнятних солей,
який полягає в уведенні ссавцю, що має потребу в лікуванні таким фармацевтично активним агентом, ефективної кількості композиції згідно з п. 1.
41. Спосіб за п. 40, який відрізняється тим, що фармацевтичну композицію використовують для заповнення однієї або більшої кількості капсул, що необов'язково мають покриття, для уведення ссавцю.
42. Спосіб за п. 41, який відрізняється тим, що капсула вибрана з групи, що складається з м'яких желатинових капсул і твердих желатинових капсул.
43. Спосіб за п. 40, який відрізняється тим, що один або декілька фармацевтично активних агентів є одним або декількома нестероїдними протизапальними засобами і, необов'язково, прокінетиком, і ссавець має потребу в болезаспокійливому лікуванні.
44. Спосіб за п. 43, який відрізняється тим, що один або декілька нестероїдних протизапальних засобів вибрані з групи, що складається з диклофенаку, індометацину та суліндаку.
45. Спосіб за п. 44, який відрізняється тим, що ссавець також потребує протизапального лікування.
46. Спосіб за п. 44, який відрізняється тим, що композицію використовують для заповнення однієї або більшої кількості капсул, що необов'язково мають покриття, для уведення ссавцю.
47. Спосіб за п. 40, який відрізняється тим, що одним або більше фармацевтично активним агентом є фексофенадин і ссавець має потребу в антигістамінному лікуванні.
48. Спосіб за п. 40, який відрізняється тим, що одним або більше фармацевтично активним агентом є омепразол і ссавець має потребу в інгібуванні секреції шлункової кислоти.
49. Спосіб за п. 48, який відрізняється тим, що інгібітором протонної помпи є омепразол.
50. Спосіб за п. 49, який відрізняється тим, що композицію використовують для заповнення однієї або більшої кількості капсул, що необов'язково мають покриття, для уведення ссавцю.
51. Спосіб одержання фармацевтичної композиції за п. 1, в якій принаймні один кислотний фрагмент одного або декількох фармацевтично активних агентів є кислотнолабільним, який полягає в:
одержанні розчину принаймні одного диспергувального агента і принаймні одного солюбілізувального агента і, необов'язково, одного або декількох нижчих (С1-С4) алканолів;
додаванні достатньої кількості основи, щоб довести в згаданому розчині рН до принаймні 9,0; і
додаванні одного або декількох фармацевтично активних агентів для підтримання розчину при рН принаймні 9,0; і, необов'язково,
однієї або більшої кількості поверхнево-активних речовин; і далі, необов'язково,
одного або більшої кількості пластифікаторів.
52. Спосіб за п. 51, який відрізняється тим, що диспергувальний агент вибраний із групи, що складається з диспергувальних агентів на основі полімеру та диспергувальних агентів на основі карбогідрату.
53. Спосіб за п. 52, який відрізняється тим, що співвідношення вмісту одного або декількох фармацевтично активних агентів до вмісту диспергувального агента, вибране з групи, що складається з інтервалу від приблизно 3 : 1 (мас/мас.) до приблизно 1 : 50 (мас/мас.) для диспергувальних агентів на основі полімеру і від приблизно 3 : 1 (мас./мас.) до приблизно 1 : 20 (мас/мас.) для диспергувальних агентів на основі карбогідрату, і концентрація одного чи декількох солюбілізувальних агентів лежить в межах приблизно від нуля до приблизно 99 % (мас./мас.) від загальної маси композиції.
54. Спосіб за п. 53, який відрізняється тим, що принаймні одним диспергувальним агентом на основі полімеру є полівінілпіролідон, принаймні один диспергувальний агент на основі карбогідрату вибраний із групи, що складається з гідроксипропілцелюлози, гідроксипропілметилцелюлози і циклодекстрину, і принаймні один або декілька солюбілізувальних агентів вибрані із групи, що складається з поліетиленгліколю та води.
55. Спосіб за п. 54, який відрізняється тим, що включає додаткову стадію заповнення капсули фармацевтичною композицією.
56. Спосіб за п. 55, який відрізняється тим, що капсула вибрана з групи, що складається з м'яких желатинових капсул і твердих желатинових капсул.
57. Спосіб за п. 51, який відрізняється тим, що має додаткову стадію заповнення капсули фармацевтичною композицією.
58. Спосіб за п. 57, який відрізняється тим, що включає додаткову стадію заповнення капсули фармацевтичною композицією.
59. Спосіб за п. 51, який відрізняється тим, що одним або декількома фармацевтично активними агентами є інгібітор протонної помпи.
60. Спосіб за п. 59, який відрізняється тим, що інгібітором протонної помпи є омепразол.
61. Спосіб за п. 56, який відрізняється тим, що одним або декількома фармацевтично активними агентами є інгібітор протонної помпи.
62. Спосіб за п. 61, який відрізняється тим, що інгібітором протонної помпи є омепразол.
63. Спосіб за п. 57, який відрізняється тим, що включає додаткову стадію покривання капсули нетоксичним, фармацевтично прийнятним покриттям.
64. Спосіб за п. 63, який відрізняється тим, що покриттям є кишкове покриття.
65. Спосіб за п. 61, який відрізняється тим, що включає додаткову стадію покривання капсули нетоксичним, фармацевтично прийнятним покриттям.
66. Спосіб за п. 65, який відрізняється тим, що покриттям є кишкове покриття.
67. Спосіб за п. 50, який відрізняється тим, що необов'язковим покриттям є кишкове покриття.
68. Спосіб за п. 44, який відрізняється тим, що необов'язковим прокінетиком є метоклопрамід.
69. Фармацевтична композиція, одержана способом за п. 51.
70. Фармацевтична композиція за п. 69, яка відрізняється тим, що одним або декількома фармацевтично активними агентами є омепразол.
Текст
1. Фармацевтична композиція, яка містить один або декілька фармацевтично активних агентів, вибраних з групи, яка складається зі згаданих агентів, в яких принаймні один зі згаданих агентів має принаймні один кислотний фрагмент; і принаймні один зі згаданих агентів має принаймні одну естерну гр упу чи інший хімічно активний фрагмент, у якому кінцевий залишок естерної групи чи іншого хімічно активного фрагмента гідролізується або іншим чином видаляється in situ чи in vivo, утворюючи принаймні один кислотний фрагмент; і де фармацевтично активний агент є розчинним у кислоті у співвідношенні від приблизно 3 : 1 (кислота до розчинювальної речовини) до приблизно 10000 : 1 (кислота до розчинювальної речовини), або їх фармацевтично прийнятні солі; принаймні один диспергувальний агент; і принаймні один солюбілізувальний агент. 2. Фармацевтична композиція за п. 1, яка відрізняється тим, що додатково містить принаймні одну поверхнево-активну речовину і/або принаймні один пластифікатор. 3. Фармацевтична композиція за п. 1, яка відрізняється тим, що диспергувальний агент вибраний з групи, яка складається з диспергувальних агентів на основі полімерів та диспергувальних агентів на основі карбогідратів. 4. Фармацевтична композиція за п. 3, яка відрізняється тим, що співвідношення одного або декі 2 (19) 1 3 14. Фармацевтична композиція за п. 4, яка відрізняється тим, що концентрація одного або декількох солюбілізувальних агентів знаходиться в межах приблизно від нуля до приблизно 99 % (мас./мас.) від загальної маси композиції. 15. Фармацевтична композиція за п. 7, яка відрізняється тим, що концентрація одного або декількох солюбілізувальних агентів знаходиться в межах приблизно від нуля до приблизно 99 % (мас./мас.) від загальної маси композиції. 16. Фармацевтична композиція за п. 1, яка відрізняється тим, що один або декілька фармацевтично активних агентів вибрані з групи, яка складається з нестероїдних протизапальних лікарських засобів, квінаприлу, флуваста тину, ловаста тину, правастатину, цервістатину, аторвастатину, симвастатину, фексофенадину, хромоліну, омепразолу, гемфіброзилу, ципрофібрату, ципрофлоксацину, ломефлоксацину, офлоксацину, карбідопу, леводопу, ретиноєвої кислоти, карбопросту, пеніцилінів, b -лактамів, цефалоспоринів, ліотироніну та пробенециду. 17. Фармацевтична композиція за п. 16, яка відрізняється тим, що нестероїдні протизапальні лікарські засоби вибрані з групи, що складається з аралкілкарбонових кислот та арилкарбонових кислот. 18. Фармацевтична композиція за п. 17, яка відрізняється тим, що аралкілкарбонові кислоти вибрані з групи, що складається з диклофенаку, фенопрофену, флурбіпрофену, ібупрофену, індометацину, кетопрофену, кеторолаку, напроксену, суліндаку, етодолаку та тометину. 19. Фармацевтична композиція за п. 17, яка відрізняється тим, що арилкарбонові кислоти вибрані з групи, що складається з дифлунізалу, мефенамінової кислоти, меклофенамінової кислоти і флуфенамінової кислоти. 20. Фармацевтична композиція за п. 16, яка відрізняється тим, що пеніциліни вибрані з групи, що складається з амоксицилінів та ампіцилінів. 21. Фармацевтична композиція за п. 14, яка відрізняється тим, що один або декілька фармацевтично активних агентів вибрані з групи, яка складається з нестероїдних протизапальних лікарських засобів, квінаприлу, флуваста тину, ловаста тину, правастатину, цервістатину, аторвастатину, симвастатину, фексофенадину, хромоліну, омепразолу, гемфіброзилу, ципрофібрату, ципрофлоксацину, ломефлоксацину, офлоксацину, карбідопу, леводопу, ретиноєвої кислоти, карбопросту, пеніцилінів, b -лактамів, цефалоспоринів, ліотироніну та пробенециду. 22. Фармацевтична композиція за п. 15, яка відрізняється тим, що один або декілька фармацевтично активних агентів вибрані з групи, яка складається з нестероїдних протизапальних лікарських засобів, квінаприлу, флуваста тину, ловаста тину, правастатину, цервістатину, аторвастатину, симвастатину, фексофенадину, хромоліну, омепразолу, гемфіброзилу, ципрофібрату, ципрофлоксацину, ломефлоксацину, офлоксацину, карбідопу, леводопу, ретиноєвої кислоти, карбопросту, пені 80085 4 цилінів, b -лактамів, цефалоспоринів, ліотироніну та пробенециду. 23. Фармацевтична композиція за п. 14, яка відрізняється тим, що концентрація необов'язкового принаймні одного пластифікатора знаходиться в межах приблизно від нуля до приблизно 75 % (мас./мас.) від загальної маси композиції. 24. Фармацевтична композиція за п. 23, яка відрізняється тим, що пластифікатор вибраний із групи, що складається згліцерину, пропіленгліколю та сорбітолу. 25. Фармацевтична композиція за п. 15, яка відрізняється тим, що концентрація необов'язкового принаймні одного пластифікатора знаходиться в межах приблизно від нуля до приблизно 75 % (мас./мас.) від загальної маси композиції. 26. Фармацевтична композиція за п. 25, яка відрізняється тим, що пластифікатор вибраний із групи, що складається з гліцерину, пропіленгліколю та сорбітолу. 27. Фармацевтична композиція за п. 23, яка відрізняється тим, що концентрація необов'язкової принаймні однієї поверхнево-активної речовини знаходиться в межах приблизно від нуля до приблизно 10 % (мас./мас.) від загальної маси композиції. 28. Фармацевтична композиція за п. 25, яка відрізняється тим, що концентрація необов'язкової принаймні однієї поверхнево-активної речовини знаходиться в межах приблизно від нуля до приблизно 10 % (мас./мас.) від загальної маси композиції. 29. Фармацевтична композиція у вигляді капсули, заповненої композицією згідно з п. 1. 30. Фармацевтична композиція за п. 29, яка відрізняється тим, що капсула вибрана з групи, що складається з м'яких желатинових капсул і твердих желатинових капсул. 31. Фармацевтична композиція у вигляді капсули, заповненої композицією згідно з п. 27, яка необов'язково має покриття. 32. Фармацевтична композиція за п. 31, яка відрізняється тим, що капсула вибрана з групи, що складається з м'яких желатинових капсул і твердих желатинових капсул. 33. Фармацевтична композиція, у вигляді капсули, заповненої композицією згідно з п. 28, яка необов'язково має покриття. 34. Фармацевтична композиція за п. 33, яка відрізняється тим, що капсула вибрана з групи, що складається з м'яких желатинових капсул і твердих желатинових капсул. 35. Фармацевтична композиція за п. 31, яка відрізняється тим, що один або декілька фармацевтично активних агентів вибрані з групи, яка складається з нестероїдних протизапальних лікарських засобів, квінаприлу, флуваста тину, ловаста тину, правастатину, цервістатину, аторвастатину, симвастатину, фексофенадину, хромоліну, омепразолу, гемфіброзилу, ципрофібрату, ципрофлоксацину, ломефлоксацину, офлоксацину, карбідопу, леводопу, ретиноєвої кислоти, карбопросту, пеніцилінів, b -лактамів, цефалоспоринів, ліотироніну та пробенециду. 5 80085 36. Фармацевтична композиція за п. 33, яка відрізняється тим, що один або декілька фармацевтично активних агентів вибрані з групи, яка складається з нестероїдних протизапальних лікарських засобів, квінаприлу, флуваста тину, ловаста тину, правастатину, цервістатину, аторвастатину, симвастатину, фексофенадину, хромоліну, омепразолу, гемфіброзилу, ципрофібрату, ципрофлоксацину, ломефлоксацину, офлоксацину, карбідопу, леводопу, ретиноєвої кислоти, карбопросту, пеніцилінів, b -лактамів, цефалоспоринів, ліотироніну та пробенециду. 37. Спосіб поліпшення швидкості абсорбції одного або декількох фармацевтично активних агентів у ссавця, де фармацевтично активний агент вибраний з групи, яка складається зі згаданих агентів, в яких: принаймні один зі згаданих агентів має принаймні один кислотний фрагмент, і принаймні один із згаданих агентів має принаймні одну естерну групу чи інший хімічно активний фрагмент, у якому кінцевий залишок згаданої естерної групи чи іншого хімічно активного фрагмента гідролізується або іншим чином видаляється in situ чи in vivo, утворюючи принаймні один кислотний фрагмент; і де згаданий фармацевтично активний агент є розчинним у кислоті у співвідношенні від приблизно 3 : 1 (кислота до розчинювальної речовини) до приблизно 10000 : 1 (кислота до розчинювальної речовини), або їх фармацевтично прийнятних солей, який полягає в уведенні ссавцю, що має потребу в лікуванні таким фармацевтично активним агентом, ефективної кількості композиції згідно з п. 1 за умови, що така композиція необов'язково містить згадану поверхнево-активну речовину. 38. Спосіб підсилення терапевтичної дії одного або декількох фармацевтично активних агентів у ссавця, де фармацевтично активний агент вибраний з групи, яка складається зі згаданих агентів, в яких: принаймні один зі згаданих агентів має принаймні один кислотний фрагмент, і принаймні один із згаданих агентів має принаймні одну естерну групу чи інший хімічно активний фрагмент, у якому кінцевий залишок естерної групи чи іншого хімічно активного фрагмента гідролізується або іншим чином видаляється in situ чи in vivo, утворюючи принаймні один кислотний фрагмент; і де згаданий фармацевтично активний агент є розчинним у кислоті у співвідношенні від приблизно 3 : 1 (кислота до розчинювальної речовини) до приблизно 10000 : 1 (кислота до розчинювальної речовини), або їх фармацевтично прийнятних солей, який полягає в уведенні ссавцю, що має потребу в лікуванні таким фармацевтично активним агентом, ефективної кількості композиції згідно з п. 1 за умови, що така композиція необов'язково містить поверхнево-активну речовину. 39. Спосіб інгібування подразнення шлунку у ссавця, викликаного прийомом одного або декількох нестероїдних протизапальних засобів, який полягає в уведенні композиції згідно з п. 1, в якій принаймні одним з фармацевтично активних агентів є 6 ефективна кількість нестероїдного протизапального засобу. 40. Спосіб лікування ссавців, які мають потребу в лікуванні одним або декількома фармацевтично активними агентами, вибраними з групи, яка складається зі згаданих агентів, в яких: принаймні один зі згаданих агентів має принаймні один кислотний фрагмент, і принаймні один із згаданих агентів має принаймні одну естерну групу чи інший хімічно активний фрагмент, у якому кінцевий залишок естерної групи чи іншого хімічно активного фрагмента гідролізується або іншим чином видаляється in situ чи in vivo, утворюючи принаймні один кислотний фрагмент; і де фармацевтично активний агент є розчинним у кислоті у співвідношенні від приблизно 3 : 1 (кислота до розчинювальної речовини) до приблизно 10000 : 1 (кислота до розчинювальної речовини), або їх фармацевтично прийнятних солей, який полягає в уведенні ссавцю, що має потребу в лікуванні таким фармацевтично активним агентом, ефективної кількості композиції згідно з п. 1. 41. Спосіб за п. 40, який відрізняється тим, що фармацевтичну композицію використовують для заповнення однієї або більшої кількості капсул, що необов'язково мають покриття, для уведення ссавцю. 42. Спосіб за п. 41, який відрізняється тим, що капсула вибрана з групи, що складається з м'яких желатинових капсул і твердих желатинових капсул. 43. Спосіб за п. 40, який відрізняється тим, що один або декілька фармацевтично активних агентів є одним або декількома нестероїдними протизапальними засобами і, необов'язково, прокінетиком, і ссавець має потребу в болезаспокійливому лікуванні. 44. Спосіб за п. 43, який відрізняється тим, що один або декілька нестероїдних протизапальних засобів вибрані з групи, що складається з диклофенаку, індометацину та суліндаку. 45. Спосіб за п. 44, який відрізняється тим, що ссавець також потребує протизапального лікування. 46. Спосіб за п. 44, який відрізняється тим, що композицію використовують для заповнення однієї або більшої кількості капсул, що необов'язково мають покриття, для уведення ссавцю. 47. Спосіб за п. 40, який відрізняється тим, що одним або більше фармацевтично активним агентом є фексофенадин і ссавець має потребу в антигістамінному лікуванні. 48. Спосіб за п. 40, який відрізняється тим, що одним або більше фармацевтично активним агентом є омепразол і ссавець має потребу в інгібуванні секреції шлункової кислоти. 49. Спосіб за п. 48, який відрізняється тим, що інгібітором протонної помпи є омепразол. 50. Спосіб за п. 49, який відрізняється тим, що композицію використовують для заповнення однієї або більшої кількості капсул, що необов'язково мають покриття, для уведення ссавцю. 51. Спосіб одержання фармацевтичної композиції за п. 1, в якій принаймні один кислотний фрагмент 7 80085 8 одного або декількох фармацевтично активних агентів є кислотнолабільним, який полягає в: одержанні розчину принаймні одного диспергувального агента і принаймні одного солюбілізувального агента і, необов'язково, одного або декількох нижчих (С1-С4) алканолів; додаванні достатньої кількості основи, щоб довести в згаданому розчині рН до принаймні 9,0; і додаванні одного або декількох фармацевтично активних агентів для підтримання розчину при рН принаймні 9,0; і, необов'язково, однієї або більшої кількості поверхнево-активних речовин; і далі, необов'язково, одного або більшої кількості пластифікаторів. 52. Спосіб за п. 51, який відрізняється тим, що диспергувальний агент вибраний із групи, що складається з диспергувальних агентів на основі полімеру та диспергувальних агентів на основі карбогідрату. 53. Спосіб за п. 52, який відрізняється тим, що співвідношення вмісту одного або декількох фармацевтично активних агентів до вмісту диспергувального агента, вибране з групи, що складається з інтервалу від приблизно 3 : 1 (мас/мас.) до приблизно 1 : 50 (мас/мас.) для диспергувальних агентів на основі полімеру і від приблизно 3 : 1 (мас./мас.) до приблизно 1 : 20 (мас/мас.) для диспергувальних агентів на основі карбогідрату, і концентрація одного чи декількох солюбілізувальних агентів лежить в межах приблизно від нуля до приблизно 99 % (мас./мас.) від загальної маси композиції. 54. Спосіб за п. 53, який відрізняється тим, що принаймні одним диспергувальним агентом на основі полімеру є полівінілпіролідон, принаймні один диспергувальний агент на основі карбогідрату вибраний із групи, що складається з гідроксипропілцелюлози, гідроксипропілметилцелюлози і циклодекстрину, і принаймні один або декілька солюбілізувальних агентів вибрані із групи, що складається з поліетиленгліколю та води. 55. Спосіб за п. 54, який відрізняється тим, що включає додаткову стадію заповнення капсули фармацевтичною композицією. 56. Спосіб за п. 55, який відрізняється тим, що капсула вибрана з групи, що складається з м'яких желатинових капсул і твердих желатинових капсул. 57. Спосіб за п. 51, який відрізняється тим, що має додаткову стадію заповнення капсули фармацевтичною композицією. 58. Спосіб за п. 57, який відрізняється тим, що включає додаткову стадію заповнення капсули фармацевтичною композицією. 59. Спосіб за п. 51, який відрізняється тим, що одним або декількома фармацевтично активними агентами є інгібітор протонної помпи. 60. Спосіб за п. 59, який відрізняється тим, що інгібітором протонної помпи є омепразол. 61. Спосіб за п. 56, який відрізняється тим, що одним або декількома фармацевтично активними агентами є інгібітор протонної помпи. 62. Спосіб за п. 61, який відрізняється тим, що інгібітором протонної помпи є омепразол. 63. Спосіб за п. 57, який відрізняється тим, що включає додаткову стадію покривання капсули нетоксичним, фармацевтично прийнятним покриттям. 64. Спосіб за п. 63, який відрізняється тим, що покриттям є кишкове покриття. 65. Спосіб за п. 61, який відрізняється тим, що включає додаткову стадію покривання капсули нетоксичним, фармацевтично прийнятним покриттям. 66. Спосіб за п. 65, який відрізняється тим, що покриттям є кишкове покриття. 67. Спосіб за п. 50, який відрізняється тим, що необов'язковим покриттям є кишкове покриття. 68. Спосіб за п. 44, який відрізняється тим, що необов'язковим прокінетиком є метоклопрамід. 69. Фармацевтична композиція, одержана способом за п. 51. 70. Фармацевтична композиція за п. 69, яка відрізняється тим, що одним або декількома фармацевтично активними агентами є омепразол. Дана заявка є частковим продовженням [заявки №09/232,354, поданої 15 січня 1999p]., розкриття якої включено як посилання, і по якій заявлено пріоритет попередньої [заявки US №60/071,865, поданої 20 січня 1998p]., розкриття якої включено як посилання. Даний винахід стосується фармацевтично поліпшених композицій для перорального призначення, і способів застосування таких композицій для підвищення швидкості і ступеня абсорбції фармацевтично активного інгредієнта таких композицій, і для зменшення шлункового подразнення, індукованого чи викликаного вживанням таких фармацевтично активних інгредієнтів. Фармацевтично активний інгредієнт композицій даного винаходу включає принаймні один фармацевтично активний агент, що має принаймні один кислотний залишок, переважно залишок карбонової кислоти, особливо класу агентів, відомих як нестероїдні протизапальні засоби (НПЗЗ), що є розчинними у кислоті у співвідношенні від приблизно 30 до 1 (кислота до розчинювальної речовини) до приблизно 10,000 до 1 (кислота до розчинювальної речовини). У фармацевтичній галузі композиції фармацевтично активних сполук у придатній до використання формі дозування, у яких абсорбція активного інгредієнта оптимізована, і ступінь контрольованих побічних ефектів мінімізований, є перспективними с точки зору фахівців в галузі фармацевтики і, часто, непередбачуваними. Зокрема, фармацевтичні композиції фармацевтичних 9 80085 агентів, що мають принаймні один кислотний залишок, переважно залишок карбонової кислоти, і які є розчинними у кислоті у співвідношенні від приблизно 30 до 1 (кислота до розчинювальної речовини) до приблизно 10,000 до 1 [кислота до розчинювальної речовини; від недостатньо розчинних до практично нерозчинних або нерозчинних [див., наприклад, Sokoloski, Т. D., Remington's Pharmaceutical Sciences, 16:208; 1990]], загалом відомі у даній галузі як такі, що мають абсорбцію меншу, ніж оптимальна, і у деяких випадках викликають інакші контрольовані побічні ефекти при уведенні ссавцям. Представники цих сполук включають, наприклад, фармацевтичні агенти, добре відомі в даній галузі, як нестероїдні протизапальні засоби (НПЗЗ), інгібітори ацетилхолінестерази ("АСЕ"), представлені "ргіl"-сімейством, інгібітори HMG-CoA редуктази, представлені "statin"сімейством, антагоністи Н 1-гістаминових рецепторів, такі як, наприклад, фексофенадин, інгібітори секреції шлункової кислоти, такі як омепразол, стабілізатори клітинного каркасу, антигіперліпідемічні агенти, пеніциліни, агенти проти акне, цефалоспорини, включаючи, наприклад, β-лактами, саліцилати і безліч індивідуальних фармацевтичних агентів. Наприклад, [патент США №4,880,835] описує виготовлення пероральних рідких композицій суліндаку кальцію з використанням фармацевтичного носія, що містять гліколь, поліол і, необов'язково, спирт. Патент далі описує добре знану проблему абсорбції фармацевтичних агентів, як описано вище, особливо НПЗЗ, з кишки. К. Chan, та ін., Pharma Research. 7:1027 (1990) показав, що диклофенак натрію (НПЗЗ) був більш біодоступний з пероральної таблетки з ентеральною оболонкою, ніж з водного розчину. Це суперечить закономірності і підтверджує той факт, що проблема в даній галузі існує. Патент США №4,704,405 також розкриває проблему абсорбції вищезгаданих сполук, особливо НПЗЗ, таких як, суліндак, з шлунково-кишкового тракту. N.M. Najib, та ін. International Journal Pharmaceutics. 45:139 (1988) повідомили, що ібулрофен-полівінилпіролідон може утворювати комплекс типу слабка кислота - слабка основа у твердому стані або в розчині. В цій статті не повідомляється про будь-які дослідження засобів або екціпієнтів, використовуваних в представленому винаході. Британський патент №2,059,768 описує утворення більш розчинних похідних НПЗЗ із TRIS групою сполук. Крім того, патент США № 5,183,829 описує виготовлення композицій НПЗЗ, які, як з'ясувалося, частково поліпшують абсорбцію фармацевтично активного агента при наявності позитивного впливу на ви щезгадані шлункові побічні ефекти, викликані НПЗЗ. Патент описує гліколь-поліольні середовища, що не можуть ефективно використовува тися з м'якими желатиновими капсулами. Більш конкретно, було виявлено, що поліоли і концентрація поліолів, вивчена в цьому відношенні, зпричиняють те, що м'які желатинові капсули стають клейкими і прилипають до сусідніх 10 м'яких капсул. Ця проблема стосується фармацевтичної композиції, розкритої в патенті №5,183,829, яку неможливо використовувати в м'яких желатинових капсулах. Відповідно, фармацевтичні композиції даного винаходу є вирішенням проблем, що випливають з композицій, описаних в патенті №5,183,829, а також прогресом у галузі створення поліпшених медикаментів на основі фармацевтичних композицій таких активних речовин. Цей винахід стосується поліпшених пероральних композицій, що є корисними як пероральні, рідкі медикаменти, які можуть також використовуватися для заповнення м'яких або затверділих капсул, як описується тут, та для використання у твердих капсулах, особливо м'яких желатинових капсулах і твердих желатинових капсулах, відповідно, що містять один або більшу кількість фармацевтично активних агентів, де згаданий фармацевтично активний агент вибраний з групи, що складається зі згаданих агентів, в яких, принаймні, один із згаданих агентів має, принаймні, один кислотний фрагмент; і, принаймні, один із згаданих агентів має, принаймні, один естерну груп у чи інший хімічно активний фрагмент, у якому кінцевий залишок згаданого естерної групи чи іншого хімічно активного фрагменту гідролізують або іншим чином видаляють in situ чи in vivo, утворюючи, принаймні, один кислотний фрагмент; і де згаданий фармацевтично активний агент є розчинним у кислоті у співвідношенні від приблизно 3:1 (кислота до розчинювальної речовини) до приблизно 10,000:1 [кислота до розчинювальної речовини), або його фармацевтично прийнятна сіль (надалі «активний інгредієнт»); принаймні, один диспергувальний агент; і принаймні, один солюбілізувальний агент; і, необов'язково, принаймні, одну поверхнево-активну речовину; і далі, необов'язково принаймні, один пластифікатор. Даний винахід надалі стосується використання композицій даного винаходу для поліпшення адсорбції активних інгредієнтів і для зменшення контрольованих побічних ефектів, викликаних такими активними інгредієнтами, особливо НПЗЗ. Винахід також охоплює способи використання композицій даного винаходу, де згадана композиція містить як активний інгредієнт принаймні один НПЗЗ і, необов'язково, прокінетик або антиеметик для лікування пароксизмального головного болю, особливо мігренозного головного болю. Один з аспектів даного винаходу охоплює композиції, що є корисними як оральні, рідкі ліки, що можуть також використовуватися для наповнення м'яких капсул або затверділих, як описано тут, які повинні використовуватися як тверді капсули, особливо м'яких желатиновихі твердих желатинових капсул відповідно, які містять один або більшу кількість фармацевтично активних агентів, де згаданий фармацевтично активний агент вибраний з групи, що складається зі згаданих агентів, в яких, принаймні, один із згаданих агентів має, принаймні, один кислотний фрагмент; і, принаймні, один із згаданих агентів має, принаймні, один ес 11 80085 терну груп у чи інший хімічно активний фрагмент, у якому кінцевий залишок згаданого естерної групи чи іншого хімічно активного фрагменту гідролізують або іншим чином видаляють in situ чи in vivo, утворюючи, принаймні, один кислотний фрагмент; і де згаданий фармацевтично активний агент є розчинним у кислоті у співвідношенні від приблизно 3:1 (кислота до розчинювальної речовини) до приблизно 10,000:1 [кислота до розчинювальної речовини), або його фармацевтично прийнятна сіль (надалі «активний інгредієнт»); принаймні, один диспергувальний агент; і принаймні, один солюбілізувальний агент; і, необов'язково, принаймні, одну поверхнево-активну речовину; і далі, необов'язково принаймні, один пластифікатор. Даний винахід надалі стосується використання композицій даного винаходу для поліпшення адсорбції активних інгредієнтів і для зменшення контрольованих побічних ефектів, викликаних такими активними інгредієнтами, особливо НПЗЗ. Винахід також охоплює способи використання композицій даного винаходу, де згадана композиція містить як активний інгредієнт принаймні один НПЗЗ і, необов'язково, прокінетик або антиеметик для лікування пароксизмального головного болю, особливо мігренозного головного болю. Один з аспектів даного винаходу охоплює композиції, що є корисними як оральні, рідкі ліки, що можуть також використовуватися для наповнення м'яких капсул або затверділих, як описано тут, які повинні використовуватися як тверді капсули, особливо м'яких желатинових і твердих желатинових капсул відповідно, які містять один або більшу кількість фармацевтично активних агентів, де згаданий фармацевтично активний агент вибраний з групи, що складається зі згаданих агентів, в яких, принаймні, один із згаданих агентів має, принаймні, один кислотний фрагмент; і, принаймні, один із згаданих агентів має, принаймні, один естерну груп у чи інший хімічно активний фрагмент, у якому кінцевий залишок згаданого естерної групи чи іншого хімічно активного фрагменту гідролізується або іншим чином видаляється in situ чи in vi vo, утворюючи, принаймні, один кислотний фрагмент; і де згаданий фармацевтично активний агент є розчинним у кислоті у співвідношенні від приблизно 3:1 (кислота до розчинювальної речовини) до приблизно 10,000:1 [кислота до розчинювальної речовини), або його фармацевтично прийнятна сіль (надалі «активний інгредієнт»); принаймні, один диспергувальний агент; і принаймні, один солюбілізувальний агент; і, необов'язково, принаймні, одну поверхнево-активну речовину; і далі, необов'язково принаймні, один пластифікатор. Активні інгредієнти, використовувані в даних композиціях, є добре відомими у фармацевтичній галузі, отримуються методами, відомими в хімічній і фармацевтичній галузях, і включають, наприклад, фармацевтично активні сполуки, які описані вище, що мають, принаймні, один кислотний фрагмент, і де такий кислотний фрагмент є, найбільш перева 12 жно, карбоновою кислотою. Інші кислотні фрагменти добре відомі фахівцям. Представники активних інгредієнтів включають, наприклад, нестероїдні протизапальні засоби (НПЗЗ), прикладами яких є аралкілкарбонові кислоти, такі як, наприклад, диклофенак, фенопрофекн, флурбіпрофен, ібупрофен, індометацин, кетопрофен, кеторолак, напроксен, суліндак, етодолак і тометин, і арилкарбонові кислоти таки як, наприклад, дифлунізал, мефенамінова кислота, меклофенамінова кислота і флуфенамінова кислота. Цей перелік НПЗЗ представлений винятково з метою ілюстрації і не розглядається як обмеження. Інші НПЗЗ, також як інші активні інгредієнти, що використовуються в композиціях даного винаходу, описані, на додаток до їхніх режимів дозування, у добре відомих джерелах, таких як, наприклад, Physician's Desk Reference та Merck Index. Наприклад, як активні інгредієнти для композицій даного винаходу використовують без обмеження наступні сімейства сполук, індивідуальні сполуки: "ΑΧΕ" інгібітори, що включають, наприклад, квінаприл, раміприл, каптоприл, беназаприл, трандолаприл, фозиноприл, лізиноприл, моексиприл і еналаприл; інгібітори HMG-Co редуктази, що включають, наприклад, флувастатин, ловастатин, правастатин, цервістатин, аторвастатин і симваститин; антагоністи Н1-рецепторів гістаміну, що включають, наприклад, фексофенадин; стабілізатори тучних клітин, що включають, наприклад, хромолін; інгібітори секреції шлункової кислоти, що включають, наприклад, омепразол; . антигіперліпідемічні агенти, що включають, наприклад, гемфіброзил; гіполіпідемічні агенти, що включають, наприклад, ципрофібрат; фторовані хінолони, що включають, наприклад, ципрофлоксацин, ломефлоксацин, і офлоксацин; інгібітори периферичної декарбоксилази, що включають, наприклад, карбідопу і леводопу; агенти проти акне, що включають, наприклад, ретиноєву ислоту; аналоги простагландину, що включають, наприклад, карбопрост; різні добре відомі пеніциліни (що включають, наприклад, амоксициліни і ампіциліни), β-лактами і цефалоспорини; і різні сполуки, такі як, наприклад, ліотиронін, пробенецид і т.п. Звичайно, вищенаведений список активних інгредієнтів представлений з метою ілюстрації, і не призначений для того, щоб обмежити об'єм даного винаходу в будь-якому аспекті, і не повинний тлумачитися таким чином. Як показано вище, сполуки, включені в даний винахід також охоплюють ті фармацевтично активні речовини, які, коли виготовляються як фармацевтична композиція, включають, принаймні, одну естерну групу або інший хімічно активний фрагмент, у яких кінцевий залишок такої естерної групи або іншого хімічно активного фрагменту гідролізують або інакшим чином видаляють in situ чи in vi vo, утворюючи, принаймні, один кислотний фрагмент, такі як, наприклад, ловастатин, симвастатин, (наприклад лактон ® -СООН). Такі інші хіміч 13 80085 но активні фрагменти відомі в даній галузі. Як використовується тут, термін "активні інгредієнти" включають фармацевтично прийнятні солі всіх сполук, раніше описаних. Виготовлення вище описаних активних інгредієнтів, включаючи виготовлення відповідних фармацевтично прийнятних солей, достатньо описане в хімічній, медичній, патентній, і фармацевтичній літературі. У композиціях даного винаходу, використовується фармацевтично нетоксична кількість активного інгредієнта. Відповідно, концентрація кожного такого активного інгредієнта відома в даній галузі або може бути визначена, використовуючи стандартні методи, відомі в даній галузі. Зокрема, концентрація активного інгредієнта в композиціях даного винаходу може знаходитись в межах від приблизно менше, ніж один відсоток до приблизно більше, ніж дев'яносто дев'ять відсотків (ваг./ваг.), але зазвичай лежить в межах від приблизно менше, ніж один відсоток до приблизно сорока відсотків, переважно, від приблизно менше, ніж один відсоток (1%) до приблизно менше, ніж двадцять відсотків (20%), і додатково переважно від приблизно одного відсотка (1%) до приблизно менше або дорівнює п'ятнадцяти відсоткам (15%). Загалом концентрація НПЗЗ, що використовується в даних композиціях, знаходиться в межах від приблизно 5 відсотків до приблизно 25 відсотків (ваг./ва г.), переважно від приблизно менше, ніж один відсоток (1%) до приблизно, менше ніж двадцять відсотків (20%), і додатково переважно від приблизно одного відсотка (1%) до приблизно менше або дорівнює п'ятнадцяти відсоткам (15%). Також у композиції даного винаходу включений, принаймні, один фармацевтично прийнятний, нетоксичний диспергувальний агент. Використовуваний тут термін "фармацевтично прийнятний" по відношенню до одного або усіх компонентів представлених композицій означає, що такі компоненти є сумісними з іншими компонентами в композиції і не шкідливі для реціпієнта. Такі диспергувальні агенти відомі в даній галузі і включають, наприклад, диспергувальні агенти на полімерній основі, до яких відносяться, наприклад, полівінилпіролідон (ПВП; комерційно відомий як Plasdone®), та диспергувальні агенти на основі карбогідрату, такі як, наприклад, гідроксипропілметилцелюлоза (ГПМЦ), гідроксипропіллцелюлоза (ГПЦ) і циклодекстрини. Перевага надається диспергувальним агентам, які включають ПВП К29-32, декстрини, крохмаль, похідні крохмалю і декстранів, при цьому декстринам та похідним циклодекстринів надається особлива перевага. Такі циклодекстрини, п'дроксипропіл- β-циклодекстрин і g-циклодекстрин є особливо переважними. Цифри відносяться до молекулярної ваги полімеру, наприклад, ПВП К-30 має середню молекулярну вагу приблизно 30,000 з відповідними характеристиками в'язкості. Загалом вибирають здатні до диспергування полімери, щоб гарантува ти відповідну однорідність, використовуючи в'язкість для забезпечення фармацевтично кращого вигляду одержаного розчину. Співвідношення активного інгредієнта або активних інгредієнтів та диспергувальних агентів на основі полімерів становить від приблизно 3 до 14 приблизно 1 (ваг./ваг.) до приблизно 1 до приблизно 50 (ваг./ваг). Більш переважне співвідношення становить від приблизно 2 до приблизно 1 (ваг/ваг.) до приблизно 1 до приблизно 20 (ваг./ва г.). Для композицій даного винаходу, що містять як активний інгредієнт, принаймні, один НПЗЗ, переважне співвідношення вмісту НПЗЗ до вмісту диспергувального агента на основі полімеру становить від приблизно 1 до приблизно 1 (ваг./ва г.) до приблизно 1 до приблизно 5 (ваг./ва г.). Співвідношення вмісту активного інгредієнта до вмісту диспергувального агента на основі карбогідрату становить від приблизно 3 до приблизно 1 (ваг./ваг.) до приблизно 1 до приблизно 30 (ваг./ва г.), із зазвичай переважним діапазоном від приблизно 2 до приблизно 1 (ваг./ваг.) до приблизно 1 до приблизно 10 (ваг./ваг.). Для композицій даного винаходу, що містять як активний інгредієнт, принаймні, один НПЗЗ, переважне співвідношення вмісту НПЗЗ до вмісту диспергувального агента на основі карбогідрату становить від приблизно 1 до приблизно 1 (ваг/ваг.) до приблизно 1 до приблизно 3 (ваг./ваг.). Для представлених композицій можуть використовуватися один або більше диспергувальних агентів, щоб одержати співвідношення активного інгредієнта до диспергувального агента, яке вказане вище. Іншим необхідним компонентом композицій даного винаходу є принаймні один фармацевтично прийнятний нетоксичний солюбілізувальний агент. Такі легкодоступні солюбілізувальні агенти відомі в даній галузі і типово представлені групою сполук, відомих як поліетиленгліколі (ПЕГ), що мають молекулярну масу від приблизно 200 до приблизно 8,000. Для композицій даного винаходу, коли бажаною є рідка композиція для утворення кінцевої лікарської форми або рідка композиція для заповнення м'яких капсул, переважно м'яких желатинових капсул, переважна молекулярна вага лежить в межах від приблизно 200 до приблизно 600, при цьому особлива перевага надається ПЕГ 400. Для композиції даного винаходу, коли переважною є напівтверда форма, особливо для заповнення твердої капсули, переважно твердої желатинової капсули, переважна молекулярна вага становить приблизно 3350, при цьому особливо переважною молекулярною вагою є 3350 плюс достатня кількість ПЕГ з молекулярною вагою 400, щоб поліпшити характеристики наповнювача капсули. Інший солюбілізувальний агент, що може використовуватися в композиціях даного винаходу, є вода, особливо очищена, і найбільш переважно, деіонізована. Для таких композицій, концентрація води лежить в межах від приблизно нуля відсотків до приблизно дев'яноста дев'яти відсотків (ваг/ваг.). Більш конкретно, для композицій даного винаходу, якими повинні заповнюватися м'які капсули, максимальна концентрація води переважно становить від приблизно 0% до приблизно 5%, хоча концентрація загальної кількості солюбілізувального агента може бути у вигляді повного діапазону концентрацій, представлених тут. 15 80085 Як використовується в представлених композиціях, в яких може застосовуватися більше, ніж один пластифікатор, загальна концентрація використовуваного солюбілізувального агента, лежить в межах від приблизно 0 відсотків до приблизно 99 відсотків (ваг./ваг.). Переважно концентрація солюбілізувального агента в представлених композиціях знаходиться в межах від приблизно 60 відсотків до приблизно 90 відсотків (ваг/ваг.). Одним необов'язковим компонентом композицій даного винаходу, але який повинен використовуватися, коли такі композиції повинні бути наповнювачем м'яких желатинових капсул, є принаймні один фармацевтично прийнятний, нетоксичний пластифікатор. Такі пластифікатори, що є добре відомими у фармацевтичній галузі, включають, наприклад, гліцерин, пропіленгліколь і сорбітол. Такі комерційно доступні пластифікатори можуть бути виготовлені для включення більше, ніж одного пластифікувального компонента, але переважним пластифікувальним агентом для представлених композицій є гліцерин. Крім використання у якості пластифікатора, пропіленгліколь може використовуватися як солюбілізувальний агент, коли використовується самостійно або в комбінації з іншим солюбілізувальним агентом, як описано тут. Як використовується в представленому винаході, загальна концентрація використовуваних пластифікаторів, коли може використовуватися більше, ніж один пластифікатор, становить від приблизно нуля відсотків (трошки більше, ніж нуль) до приблизно 75 відсотків (ваг/ваг). Переважно вміст пластифікатора складає від приблизно нуля відсотків (0%) до приблизно п'ятдесяти відсотків (50%), і особливо переважним є, коли концентрація лежить в межах від приблизно одного відсотка (1 %) до приблизно тридцяти відсотків (30%). Коли композиції даного винаходу використовуються для наповнення м'яких желатинових капсул, переважна концентрація такого пластифікатора становить від приблизно 5 відсотків до приблизно 10 відсотків (ваг/ваг.). Такі пластифікатори особливо корисні для виготовлення м'яких желатинових капсул тому, що такі капсули мають тенденцію твердіти і втрачати вигідні властивості, тріскаючись або стаючи ламкими. Іншим необов'язковим компонентом представлених композицій, якому надається перевага, є принаймні одна фармацевтично прийнятна, нетоксична поверхнево-активна речовина, переважно неіонна поверхнево-активна речовина. Такі поверхнево-активні речовини добре відомі у фармацевтичній галузі і включають доступні поверхневоактивні речовини в концентрації від приблизно нуля відсотків до приблизно 90 відсотків, такі як, наприклад, макрогель ефіри (Labrafils), Tandem 522®, Span 80®, Gelucieres®, такі як, наприклад, токоферол поліетиленгліколь 1000 сукцинат, полісорбат 20 та полісорбат 80. Серед них перевага надається полісорбату 20 та полісорбату 80. Як використовується в представленому винаході, загальна концентрація використовуваної неіонної поверхнево-активної речовини, за умови, що може використовува тися більше, ніж одна така поверхнево-активна речовина, складає від при 16 близно нуля відсотків до приблизно 10 відсотків (ваг/ваг), переважно в діапазоні від приблизно 1 відсотка до приблизно 5 відсотків (ваг/ваг). Особлива перевага надається концентрації близько 3 відсотків (ваг/ваг). Як правило, порядок додавання різних компонентів даного винаходу не буде впливати на утворення розчину даного винаходу. Однак, коли така поверхнево-активна речовина використовується, кращим може бути додавання поверхневоактивної речовини або поверхнево-активних речовин після додавання активного інгредієнта та диспергувального агента, як описано тут. Порядок додавання таких компонентів, ймовірно, буде більш критичним при виготовленні композицій НПЗЗ даного винаходу, особливо з диклофенаком, який використовується як НПЗЗ. Повинно бути зрозумілим, що кожен компонент, що входить до складу композицій даного винаходу, повинний бути фармацевтично прийнятним і застосовуватись в нетоксичній концентрації. Крім того, коли відомо, що бажаний активний інгредієнт, який використовується у композиціях даного винаходу, р уйнується в середовищі кислоти (наприклад, кислотолабільні сполуки, такі як, наприклад, інгібітори протонної помпи, у тому числі, наприклад, такі, які представлені хімічним класом, до складу якого входять ланзопразол і омепразол), доцільно розчиняти такий активний інгредієнт у розчині сильної основи, що має рН принаймні 9.0, і підтримувати рН принаймні 9.0 протягом виготовлення композиції даного винаходу. Однак, рН 9.0 або вище може перешкоджати заповненню желатинових м'яких капсул. Відповідно, композиції даного винаходу, для яких потрібний вищий рН (наприклад, більший, ніж від приблизно 7.5 до приблизно 9.0) потрібно використовува ти для заповнення, коли це необхідно, твердих капсул, як описано тут. Як правило, для такої кислото-лабільної сполуки змішують принаймні один диспергувальний агент, принаймні один солюбілізувальний агент і, необов'язково, один або більше пластифікаторів і нижчий (С1-C4) алканол і перемішують при нагріванні, якщо необхідно розчинити диспергувальний агент. Загалом, постійна температура від приблизно 40°С до приблизно 50°С з перемішуванням протягом близько 30 хвилин є достатнім для переведення цих екціпієнтів у розчин. До цього розчину додають основу, переважно сильну основу, таку як, наприклад, гідроксид натрію, гідроксид аммонію, гідроксид калію, гідроксид магнію, гідроксид кальцію і т.п., у достатній кількості, щоб підняти рН розчину принаймні до 9.0. До цього розчину додають один або більше активних інгредієнтів, у тому числі, кислотолабільний активний інгредієнт. Такий активний інгредієнт повинний додаватися повільно і періодично, при одночасному контролюванні рН кінцевого розчину і підтриманні рН на рівні принаймні 9.0, шляхом додавання, при необхідності, додаткової кількості основи, як викладається вище. При досягненні необхідної концентрації активного інгредієнта і підтриманні рН на рівні принаймні 9.0, можуть додаватися необов'язково одна або декілька поверхнево-активних речовин, переважно 17 80085 неіонних поверхнево-активних речовин, і/або необов'язково один чи більше пластифікаторів. Згідно з методикою одержання композиції даного винаходу розчин може бути перетворений у напівтвердий стан методами, добре відомими фахівцю в даній галузі, або може бути викорстаний для наповнення капсул, твердих або м'яких, відповідно. Концентрація активного інгредієнта(ів) і кожного екціпієнта є такими, як викладено тут. Переважним активним інгредієнтом для використання в цьому процесі є один або декілька інгібіторів протонної помпи, що є відомими фахівцю в даній галузі, серед яких перевага надається омепразолу. Крім того, капсули, що заповнені фармацевтичними композиціями, виготовленими описаними вище способами, або будь-які капсули, що містять фармацевтичну композицію даного винаходу, можуть бути покриті, якщо це є доцільним, наприклад, у випадку омепразолу, будь-якою нетоксичною фармацевтично прийнятною оболонкою. До таких оболонок відносяться, наприклад, ентеральні, оболонки, що маскують смак, кольорові оболонки, тривалого вивільнення, нефункціональні смакові оболонки і т.п., які виготовляють і застосовують добре відомими в даній галузі методами. Переважно, капсули, що містять фармацевтичну композицію даного винаходу, в якій активним інгредієнтом є омепразол, вкриті ентеральною оболонкою. Цей спосіб забезпечує несподіваний результат збереження згаданого активного інгредієнта в розчинному стані протягом процесу, що проявляється в стійкості фармацевтичної композиції даного винаходу з її перевагами, які викладено тут. Відповідно, іншим аспектом даного винаходу охоплюється спосіб одержання фармацевтичної композиції, в якій принаймні один кислотний фрагмент одного або декількох фармацевтично активних агентів є кислото-лабільним, який складається з наступних операцій: утворення розчину принаймні одного диспергувального агенту і принаймні одного солюбілізувального агенту, і, необов'язково, одного або більше нижчих (С1-С4) апканолів; додавання достатньої кількості основи для встановлення рН згаданого розчину на рівні принаймні 9.0; і додавання одного або більшої кількості фармацевтично активних агентів при одночасному підтриманні рН згаданого розчину на рівні принаймні 9.0; і, необов'язково, одного або більшої кількості поверхневоактивних речовин; і, надалі необов'язково, одного або більшої кількості пластифікаторів. Іншим аспектом даного винаходу охоплюється фармацевтична композиція, що одержується вищеописаним способом. В композицію даного винаходу можуть бути включені інші фармацевтично прийнятні, нетоксичні фармацевтичні ад'юванти, такі як, наприклад, підсолоджувачі, місцеві анестетики, антибактеріальні агенти, нижчі алканоли, такі як, етанол і т. ін. Зазвичай використовують фармацевтичні агенти, такі як, наприклад, 0,1N - 2N розчин соляної кислоти, щоб регулювати рН композиції та/або, 18 коли принаймні один активний інгредієнт знаходиться у формі солі, зазвичай солі лужного металу, для перетворення активного інгредієнту у вільну кислоту. Переважний діапазон рН представлених композицій, коли вони використовується для заповнення м'я ких желатинових капсул, лежить в межах від приблизно 4.0 до приблизно 9.0. Відповідно, нові композиції даного винаходу забезпечують вигідні фармацевтичні властивості при використанні мінімальної кількості компонентів. Як правило, розчин для перорального використання, який містить один або більше активних інгредієнтів, буде змішуватися з шлунковою кислотою, агломерувати і утворювати осад у короткий період часу, роблячи активний інгредієнт менш біологічно доступним. Композиції даного винаходу з мінімальною кількістю інгредієнтів, принаймні з одним з кожних наступних: активний інгредієнт, диспергувальний агент і солюбілізувальний агент, необов'язково, поверхнево-активна речовина і, далі необов'язково, пластифікатор, кожний з яких описаний вище, переважно, коли такі композиції використовуються для заповнення нетоксичних фармацевтично прийнятних капсул, серед яких особливо переважними є м'які желатинові капсули та тверді желатинові капсули, являють собою нові рідкі фармацевтичні композиції. Такі композиції поліпшують диспергуючі власти вості активного інгредієнта при контакті з шлунковою кислотою, що приводить до більш швидкої, повторюваної і більш рівномірної абсорбції, ніж фармацевтичні композиції поза межами даного винаходу. Більш швидка, рівномірна абсорбція активних інгредієнтів загалом забезпечує більш швидку прояву терапевтичних переваг, що забезпечуються, відповідно, кожним активним інгредієнтом. НПЗЗ, як відомо, викликають гастроінтестинальне подразнення, зазвичай у формі пептичної виразки, кровотечі і перфорації. Завдяки поліпшеній дисперсності і абсорбційним властивостям композицій даного винаходу, такі композиції інгібують шлункове подразнення, викликане хронічним використанням таких НПЗЗ. В даному контексті визначається, що термін "інгібування" включає його загальноприйняте значення і включає, без обмеження, зменшення тривалу латентність та/або мінімізацію шлункового подразенння у ссавця, викликаного і/або отриманого в результаті уведення одного чи більшої кількості НПЗЗ ссавцеві, у порівнянні з таким шлунковим подразненням, викликаним і/або отриманим в результаті уведення загальноприйнятих фармацевтичних композицій НПЗЗ. Несподівано, особливо у світлі обговорення, проведеного у вищезгаданому патенті США №5,183,829, додавання принаймні однієї поверхнево-активної речовини, особливо не-іонної, як описано вище, до композицій даного винаходу поліпшувало дисперсійні властивості активних інгредієнтів у порівнянні з композиціями даного винаходу, що не містили такої неіонної поверхнево-активної речовини. Відповідно, композиції даного винаходу, що включають таку поверхнево 19 80085 активну речовину, особливо ті, які містять як активний інгредієнт один чи більшу кількість НПЗЗ, також забезпечують більш швидку прояву терапевтичних переваг, відповідно, забезпечену кожним активним інгредієнтом. Такі композиції, що містять такі поверхнево-активної речовини, також інгібують подразнення шлунку у ссавця, викликане і/або отримане в результаті уведення композиції даного винаходу, в якій активним інгредієнтом є принаймні один НПЗЗ, у порівнянні з таким шлунковим подразненням, викликаним і/або отриманим в результаті уведення загальноприйнятих фармацевтичних композицій НПЗЗ. Як такий, інший аспект даного винаходу охоплює спосіб поліпшення швидкості абсорбції активних інгредієнтів у ссавців, особливо людей, який полягає в уведенні ссавцю, який має потребу в лікуванні таким активним інгредієнтом, композиції даного винаходу. Додатковий аспект даного винаходу стосується способу прискорення прояви терапевтичної переваги у ссавців, особливо людей, що відповідно забезпечується кожним активним інгредієнтом, який полягає в уведенні ссавцю, який має потребу в лікуванні таким активним інгредієнтом, композиції даного винаходу. Композиції даного винаходу зазвичай уводять в рецептури, щоб забезпечити стандартну, нетоксичну щоденну дозу на рівні від приблизно 0.25мг до приблизно 400мг на день активного інгредієнта. Переважні дози для кожного активного інгредієнта, використовуваного в композиціях даного винаходу, будуть, звичайно, визначені конкретними обставинами, що стосуються випадку, у тому числі, наприклад, лікарем, який обслуговує та приймає до уваги стан пацієнта, та серйозностю патологічного стану, який потрібно лікувати. Переважні щоденні дози, в яких активним інгредієнтом є НПЗЗ, або його фармацевтично прийнятна сіль, будуть знаходитися в межах від приблизно 10мг до приблизно 2,000мг у день. Як правило, композиції даного винаходу для перорального використання сформульовані таким чином, щоб забезпечувати від приблизно 10мг до 500мг на чайну ложку рідкого продукту. Рідкі або напівтверді композиції даного винаходу також використовуються для наповнення капсул, особливо твердих желатинових капсулах і, особливо, м'яких желатинових капсулах, в яких кількість активного інгредієнту в кожній такій капсулі складає від приблизно 10мг до приблизно 250мг. Виготовлення таких капсул добре відоме у фармацевтичній галузі [див., наприклад, Modern Pharmaceutics. Третє видання, (під редакцією G. S. Banker і С. Т. Rhodes; 1996); та The Theory and Practice of Industrial Pharmacy. Третє Видання, (під редакцією L Lachman, H. A. Lieberman, i J. L. Kanig; 1986)]. Відповідно, інший аспект даного винаходу стосується способу лікування ссавців, які мають потребу в лікуванні, забезпеченому одним або декількома активними інгредієнтами або їх фармацевтично прийнятними солями, який полягає в уведенні згаданому ссавцю, особливо людині, композиції даного винаходу, причому згадана 20 композиція містить принаймні один активний інгредієнт. Переважні активні інгредієнти включають один або більшу кількість НПЗЗ, зокрема, диклофенак, суліндак або індометацин - для лікування ссавця, який потребує антизапального або болезаспокійливого лікування, омепразол - для інгібування секреції шлункової кислоти, та антигістамінний фексофенадин. Подальший аспект даного винаходу стосується такого способу лікування, як визначено в цьому параграфі, згідно з яким композиція даного винаходу призначається перорально такому ссавцю або у вигляді рідини або в м'яких чи твердих желатинових капсулах. Через унікальність фармакодінаміки in vivo композицій даного винаходу, такі композиції, особливо ті, в яких принаймні одним активним інгредієнтом є НПЗЗ, переважно диклофенак, індометацин чи суліндак, проявляють підвищену активність, забезпечуючи клінічні результати, що іншим чином не досягається. Наприклад, визнано, що НПЗЗ зазвичай не забезпечують позбавлення від сильного пароксизмапьного головного болю, особливо мігренозного головного болю. Однак, композиції даного винаходу, в яких активним інгредієнтом є принаймні один НПЗЗ, забезпечують більш швидке усунення мігренозного головного болю, коли уводяться перорально в одиничній дозі від приблизно 10мг до приблизно 2,000мг, переважно від приблизно 50мг до приблизно 250мг, повторюючи при необхідності прийом з інтервалом від приблизно 2 до приблизно 4 годин, у порівнянні з існуючими композиціями, що містять той же самий фармацевтично активний компонент. Така допомога при мігренозному головному болю також досягається уведенням таких композицій, призначених у комбінації з прокінетиком, при одночасному їх уведенні або, переважно, після уведення прокінетика, наприклад, метоклопроміда. Коли призначається одночасне уведення такої композиції даного винаходу, такий прокінетик може бути включений у таку композицію, як необов'язковий компонент. Зазвичай метоклопрамід буде ефективний, як прокінетик, коли він призначається таким чином в інтервалі доз, який лежить в межах від приблизно 5мг до приблизно 15мг для кожного уведення такої композиції даного винаходу. Відповідно, інший аспект даного винаходу охоплює спосіб лікування пароксизмального головного болю, особливо мігренозного головного болю, який полягає в уведенні ссавцю, зазвичай людині, що має потребу в такому лікуванні, композиції даного винаходу, переважно у формі капсули, і особливо у формі м'якої желатинової капсули, в якій згаданим активним інгредієнтом є ефективна кількість принаймні одного НПЗЗ або його фармацевтично прийнятної солі, переважно диклофенаку, суліндаку або індометацину і, необов'язково, ефективна кількість прокінетика, переважно метоклопраміду. Крім того, композиції даного винаходу, в яких активним інгредієнтом є принаймні один НПЗЗ, які переважно уводяться у комбінації з прокінетиком, при одночасному їх уведенні або, переважно, після уведення прокінетика, як описано вище, забезпечують більш швидке усунення болю, як звичай 21 80085 ний болезаспокійливий засіб, особливо болю від травми або хірургічних процедур, таких як, зубна хірургія, гістеректомія та артроскопія. На додаток до болезаспокійливого ефекту таких композицій ці композиції, в яких активним інгредієнтом є принаймні один НПЗЗ, також забезпечують більш швидке усунення запалення, викликаного травмою, стресом, хір ургічними процедурами і т.п. Режим дозування і дозове навантаження для використання таких композицій даного винаходу як болезаспокійливого та антизапального засобу є таким, як вказано вище для лікування пароксизмального головного болю. Відповідно, інший аспект даного винаходу стосується способу лікування болю та лікування запалення у ссавця, переважно людини, який полягає в уведенні ссавцю, який має потребу в такому лікуванні, композиції даного винаходу, переважно у формі капсули, і особливо у формі м'якої желатинової капсули, в якій згаданий активним інгредієнтом є ефективна кількість принаймні одного НПЗЗ або його фармацевтично прийнятної солі, переважно диклофенаку, суліндаку або індометацину, і, необов'язково, ефективна кількість агента, переважно метоклопраміду. В даному контексті під терміном "лікування" або похідним від нього, розуміється часткове або повне інгібування встановленого хворобливого стану, такого як, наприклад, біль, коли композиція даного винаходу уводиться профілактично або на початку хворобливого стану, для якого композиція даного винаходу призначається. Інший аспект даного винаходу стосується способу інгібування секреції шлункової кислоти, який полягає в уведенні ссавцю, зазвичай людині, що має потребу в такому лікуванні, композиції даного винаходу, переважно у формі капсули, в якій згаданим активним інгредієнтом є ефективна кількість інгібітора протонної помпи, переважно омепразолу або його фармацевтично прийнятної солі. Додатковий аспект даного винаходу стосується способу забезпечення антигістамінного ефекту у ссавців, переважно людей, який полягає в уведенні ссавцю, який має потребу в такому лікуванні, композиції даного винаходу, переважно в рідкій формі, в якій згаданим активним інгредієнтом є ефективна кількість фексофенадину або його фармацевтично прийнятної солі. Композиції даного винаходу, в яких омепразол або його фармацевтично прийнятна сіль є активним інгредієнтом, зазвичай призначають в нетоксичному щоденному рівні дозувань від приблизно 5мг до приблизно 40мг, особлива перевага надається дозам близько 20мг. Композиції даного винаходу, в яких фексофенадин або його фармацевтично прийнятна сіль є активним інгредієнтом, зазвичай призначають в нетоксичному щоденному рівні дозувань від приблизно 30мг до приблизно 120мг, особлива перевага надається дозам близько 60мг. Даним винаходом також охоплюються композиції, що містять ефективну кількість принаймні одного активного інгредієнта, яким є НПЗЗ або його фармацевтично прийнятна сіль, переважно диклофенак, суліндак або індометацин, та ефек 22 тивну кількість принаймні другого активного інгредієнта, яким є прокінетик або його фармацевтично прийнятна сіль, зокрема, метоклопрамід. Для дослідження поведінки активних інгредієнтів після контакту з кислим середовищем, яке визнається, як таке, що імітує шлункову рідину (SGF) без ферментів, використовувалися наступні аналітичні методики: А. Візуальна дисперсія До чистої скляної мензурки об'ємом 400мл додавали 100мл або 150мл 0.1N розчину соляної кислоти. До кислоти додавали 1мл композиції даного винаходу при одночасному енергійному перемішуванні суміші і спостерігали поведінку дисперсії. Візуальні спостереження включали однорідність, утворення агломератів, відносний час до утворення агломератів і т.п.. Віз уальні спостереження підтвердили, що композиції даного винаходу мали поліпшені дисперсійні властивості і мали тенденцію менше утворювати агломерати. 6. Пропускання світла До чистої скляної мензурки об'ємом 400мл додавали 150мл 0.1N розчину соляної кислоти. До кислоти додавали близько 1 мл композиції даного винаходу, і суміш перемішували при постійній швидкості. Протягом змішування одержаний розчин прокачували через Hewlett-Packard (Roseville, Каліфорнія) спектрофотометр, обладнаний 1см кюветою для визначення відсотку пропускання світла при довжині хвилі 530нм. Результати продемонстрували, що відсоток пропускання світла для композицій даного винаходу, особливо тих композицій, що містять принаймні одну неіонну поверхнево-активну речовину, був менший, ніж для композицій, які лежать поза межами даного винаходу. Ці дані підтверджують, що композиції даного винаходу забезпечують більшу ступінь дисперсності активних інгредієнтів, ніж у згадуваних раніше композицій. С. Мутність До скляного пробовідбірника у вигляді пляшечки, обладнаного турбідіметром моделі 2100AN, що продається фірмою Hach (Loveland, Colorado) додавали 30мл 0.1 Μ розчину соляної кислоти. До кислоти додавали 0.1г композиції даного винаходу. С уміш енергійно струшували, і мутність суміші вимірювали в нефелометричних одиницях мутності (NTU). Мутність вимірювали з використанням різних інтервалів часу, використовуючи, наприклад, один з наступних режимів: (і) 30, 45, 60, 75, 90 і 120 хвилин; (іі) 10, 20, 30 і 45 секунд і потім один раз кожної хвилини, починаючи з 1 хвилини до 15 хвилин; і (ііі) 10 і 30 секунд і далі 3, 5, 10, 15, 20, 30 і 60 хвилин. Результати підтвердили, що композиції даного винаходу забезпечували більшу ступінь дисперсності і утворювали меншу кількість агломератів в середовищі, яке моделює шлункову рідину, ніж композиції, які лежать поза межами даного винаходу. Наступні втілення винаходу призначені для ілюстрації і вивчення конкретного використання винаходу і не призначені для обмеження об'єму винаходу в будь-якому відношенні і не повинні так розглядатися. 23 80085 Приклад 1 Одержання рідкої композиції диклофенаку натрію До скляної мензурки об'ємом 100мл додавали 35.95г поліетиленгліколю 400 (ПЕГ 400) і ПЕГ 400 перемішували, використовуючи стрижневу або пластинчасту мішалку, при нагріванні, температуру якого підтримували між приблизно 45-55°С. До мензурки повільно додавали 3.15g ПВП К29-32. Після повного розчинення (візуальне спостереження) ПВП К29-32 додавали 3.15г діклофенаку натрію, і суміші залишали охолоджуватися до температури навколишнього середовища, і потім додавали 1.5г полісорбату 80. Цю суміш перемішували протягом приблизно двох хвилин і додавали 5.0г гліцерину при продовженні перемішування суміші протягом приблизно двох додаткових хвилин і потім додавали 1.25г соляної кислоти, отримуючи злегка каламутний розчин. Цю суміш перемішували протягом близько 10-15 додаткових хвилин. Цю композицію уводять у вигляді орального розчину або використовують для заповнення м'яких желатинових капсул, використовуючи стандартні процедури. Приклад 2 Використовуючи препаративний зразок Приклада 1, одержували наступні композиції: % W/w Диклофенак натрію 6.3 Поліетиленгліколь 400 71.9 2N Соляна кислота 2.5 Гліцерин 10.0 Полісорбат 80 3.0 ПВП К29-32 6.3 100.0% Приклад 3 Одержання рідкої композиції хромоліну натрію До скляної мензурки об'ємом 100мл додавали 37.00г поліетиленгліколю 400 (ПЕГ 400) і ПЕГ 400 перемішували, використовуючи стрижневу або пластинчасту мішалку, при нагріванні, температуру якого підтримували між приблизно 45-55°С. До мензурки додавали 5.0г гліцерину при продовженні перемішування протягом приблизно 2 додаткових хвилин, потім додавали 2.5г очищеної води, і суміш перемішували додатково протягом приблизно 2-3 хвилин. Потім до суміші додавали 2.0г ПВП К29-32, продовжуючи перемішування доти, поки П6П К29-32 повністю не розчинявся (візуальне спостереження). Потім додавали 2.0г хромоліну натрію, і суміш перемішування доти, поки хромолін натрію повністю не розчинявся (візуальне спостереження). Суміш залишали охолоджуватися до температури навколишнього середовища перед додаванням 1.5г полісорбату 80. Цю суміш перемішували протягом приблизно 10-15 хвилин, отримуючи злегка каламутний розчин. Цю композицію уводять у вигляді орального розчину або використовують для заповнення м'яких желатинових капсул, використовуючи стандартні процедури. Приклад 4 Використовуючи препаративний зразок Приклада 3, одержували наступні композиції: %w/w Хромолін натрію 4.0 24 Поліетиленгліколь 400 Очищена вода Гліцерин Полісорбат 80 ПВП К29-32 74.0 5.0 10.0 3.0 4.0 100.0% Приклад 5 Одержання рідкої композиції суліндаку До скляної мензурки об'ємом 100мл додавали 31.0г поліетиленгліколю 400 (ПЕГ 400) і ПЕГ 400 перемішували, використовуючи стрижневу або пластинчасту мішалку, при нагріванні, температуру якого підтримували між приблизно 55-65°С. До мензурки додавали 5.0г гліцерину при продовженні перемішування протягом приблизно 2 додаткових хвилин, потім додавали 2.5г очищеної води, і суміш перемішували додатково протягом приблизно 2-3 хвилин. Потім до суміші ловильно додавали 5.0г ПВП К29-32, продовжуючи перемішування доти, поки ПВП К29-32 повністю не розчинявся (візуальне спостереження). Потім додавали 5.0г суліндаку, і суміш перемішування доти, поки суліндак повністю не розчинявся (візуальне спостереження). Суміш залишали охолоджуватися до температури навколишнього середовища перед додаванням 1.5г полісорбату 80. Цю суміш перемішували протягом приблизно 10-15 хвилин, отримуючи злегка каламутний розчин. Цю композицію уводять у вигляді орального розчину або використовують для заповнення м'яких желатинових капсул, використовуючи стандартні процедури. Приклад 6 Використовуючи препаративний зразок Приклада 5, одержували наступні композиції: %w/w Суліндак 10.0 Поліетиленгліколь 400 62.0 Очищена вода 5.0 Гліцерин 10.0 Полісорбат 80 3.0 ПВП К29-32 10.0 100.0% Приклад 7 Одержання рідкої композиції гемфіброзилу До скляної мензурки об'ємом 100мл додавали 27.25г поліетиленгліколю 400 (ПЕГ 400) і ПЕГ 400 перемішували, використовуючи стрижневу або пластинчасту мішалку, при нагріванні, температуру якого підтримували між приблизно 45-55°С. До мензурки повільно додавали 7.5г ПВП К29-32. Після закінчення розчинення (візуальне спостереження) ПВП К29-32, повільно додаваои 7.5г гемфіброзилу і перемішування продовжували доти, поки гемфіброзил повністю не розчинявся (візуальне спостереження). Суміш залишали охолоджуватися до температури навколишнього середовища і потім додавали 1.5г полісорбату 80. Цю суміш перемішували протягом приблизно двох хвилин, отримуючи злегка каламутний розчин. Потім до цієї суміші додавали 5.0г гліцерину, продовжуючи перемішування протягом приблизно двох хвилин, потім додавали 1.25г очищеної води і розчин перемішували протягом додаткових 10-15 хвилин. Цю композицію уводять у вигляді орального розчину або використовують для заповнення м'яких 25 80085 желатинових капсул, використовуючи стандартні процедури. Приклад 8 Використовуючи препаративний зразок Приклада 7, одержували наступні композиції: %w/w Гемфіброзил 15.0 Поліетиленгліколь 400 54.5 Очищена вода 2.5 Гліцерин 10.0 Полісорбат 80 3.0 ПВП К29-32 10.0 100.0% Приклад 9 Одержання композиції диклофенаку натрію До скляної мензурки об'ємом 100мл додавали 37.45г поліетиленгліколю 400 (ПЕГ 400) і ПЕГ 400 перемішували, використовуючи стрижневу або пластинчасту мішалку, при нагріванні, температуру якого підтримували між приблизно 45-55°С. До мензурки повільно додавали 3.15г ПВП К29-32. Після закінчення розчинення (візуальне спостереження) ПВП К29-32, повільно додаваои 3.15г диклофенаку натрію і перемішування продовжували доти, поки диклофенак натрію повністю не розчинявся (візуальне спостереження). Суміш залишали охолоджуватися до температури навколишнього середовища. Цю суміш перемішували протягом приблизно двох хвилин, отримуючи злегка каламутний розчин. Потім до цієї суміші додавали 5.0г гліцерину, продовжуючи перемішування протягом приблизно двох хвилин, потім додавали 1.25г 2.0 N соляної кислоти, і розчин перемішували протягом додаткових 10-15 хвилин. Цю композицію уводять у ви гляді орального розчину або використовують для заповнення м'яких желатинових капсул, використовуючи стандартні процедури. Приклад 10 Використовуючи препаративний зразок Приклада 9, одержували наступні композиції: %w/w Диклофенак натрію 6.3 Поліетиленгліколь 400 74.9 2.0 N Соляна кислота 2.5 Гліцерин 10.0 ПВП К29-32 6.3 100.0% Приклад 11 Одержання рідкої композиції гемфіброзилу До скляної мензурки об'ємом 100мл додавали 28.75г поліетиленгліколю 400 (ПЕГ 400) і ПЕГ 400 перемішували, використовуючи стрижневу або пластинчасту мішалку, при нагріванні, температуру якого підтримували між приблизно 45-55°С. До суміші повільно додавали 7.5г ПВП К29-32 і продовжували перемішування доти, поки ПВП К29-32 повністю не розчинявся (візуальне спостереження). До суміші повільно додаваои 7.5г гемфіброзилу і суміш перемішували доти, поки гемфіброзил повністю не розчинявся (візуальне спостереження). Суміш залишали охолоджуватися до температури навколишнього середовища і потім додавали 5.0г гліцерину. Суміш перемішували протягом приблизно 2 хвилин, потім додавали 1.25г очищеної води і розчин перемішували протягом додатко 26 вих 10-15 хвилин. Цю композицію уводять у вигляді орального розчину або використовують для заповнення м'яких желатинових капсул, використовуючи стандартні процедури. Приклад 12 Використовуючи препаративний зразок Приклада 11, одержували наступні композиції: %w/w Гемфіброзил 15.0 Поліетиленгліколь 400 57.5 Очищена вода 2.5 Гліцерин 10.0 ПВП К29-32 15.0 100.0% Приклад 13 Одержання рідкої композиції гемфіброзилу До скляної мензурки об'ємом 100мл додавали 35мг поліетиленгліколю 400 (ПЕГ 400) і ПЕГ 400 перемішували, використовуючи стрижневу або пластинчасту мішалку, при нагріванні, температуру якого підтримували між приблизно 45-55°С. До суміші повільно додавали 7.5г ПВП К29-32 і продовжували перемішування доти, поки ПВП К29-32 повністю не розчинявся (візуальне спостереження). До суміші повільно додаваои 7.5г гемфіброзилу і суміш перемішували доти, поки гемфіброзил повністю не розчинявся (візуальне спостереження). Суміш залишали охолоджуватися до температури навколишнього середовища. Цю композицію уводять у вигляді орального розчину або використовують для заповнення м'яких желатинових капсул, використовуючи стандартні процедури. Приклад 14 Використовуючи препаративний зразок Приклада 13, одержували наступні композиції: %w/w Гемфіброзил 15.0 Поліетиленгліколь 400 70.0 ПВП К29-32 15.0 100.0% Приклад 15 Одержання рідкої композиції диклофенаку До скляної мензурки об'ємом 100мл додавали 43.7мг поліетиленгліколю 400 (ПЕГ 400) і ПЕГ 400 перемішували, використовуючи стрижневу або пластинчасту мішалку, при нагріванні, температуру якого підтримували між приблизно 45-55°С. До суміші повільно додавали 3.15г ПВП К29-32 і продовжували перемішування доти, поки ПВП К29-32 повністю не розчинявся (візуальне спостереження). До суміші повільно додаваои 3.15г диклофенаку і суміш перемішували доти, поки диклофенак повністю не розчинявся (візуальне спостереження). Суміш залишали охолоджуватися до температури навколишнього середовища. Цю композицію уводять у вигляді орального розчину або використовують для заповнення м'яких желатинових капсул, використовуючи стандартні процедури. Приклад 16 Використовуючи препаративний зразок Приклада 15, одержували наступні композиції: %w/w Диклофенак 6.3 Поліетиленгліколь 400 87.4 ПВП К29-32 6.3 27 80085 100.0% Приклад 17 Одержання рідкої композиції хромоліну натрію До скляної мензурки об'ємом 100мл додавали 46мг поліетиленгліколю 400 (ПЕГ 400) і ПЕГ 400 перемішували, використовуючи стрижневу або пластинчасту мішалку, при нагріванні, температуру якого підтримували між приблизно 45-55°С. До суміші повільно додавали 2.0г ПВП К29-32 і продовжували перемішування доти, поки ПВП К29-32 повністю не розчинявся (візуальне спостереження). До суміші повільно додаваои 2.0г хромоліну натрію і суміш перемішували доти, поки хромолін натрію повністю не розчинявся (візуальне спостереження). Суміш залишали охолоджуватися до температури навколишнього середовища. Цю композицію уводять у вигляді орального розчину або використовують для заповнення м'яких желатинових капсул, використовуючи стандартні процедури. Приклад 18 Використовуючи препаративний зразок Приклада 17, одержували наступні композиції: %w/w Хромолін натрію 4.0 Поліетиленгліколь 400 92.0 ПВП К29-32 4.0 100.0% Приклад 19 Одержання рідкої композиції суліндаку До скляної мензурки об'ємом 100мл додавали 40мг поліетиленгліколю 400 (ПЕГ 400) і ПЕГ 400 перемішували, використовуючи стрижневу або пластинчасту мішалку, при нагріванні, температуру якого підтримували між приблизно 45-55°С. До суміші повільно додавали 5.0г ПВП К29-32 і продовжували перемішування доти, поки ПВП К29-32 повністю не розчинявся (візуальне спостереження). До суміші повільно додавати 5.0г суліндаку і суміш перемішували доти, поки суліндак повністю не розчинявся (візуальне спостереження). Суміш залишали охолоджуватися до температури навколишнього середовища. Цю композицію уводять у вигляді орального розчину або використовують для заповнення м'яких желатинових капсул, використовуючи стандартні процедури. Приклад 20 Використовуючи препаративний зразок Приклада 19, одержували наступні композиції: %w/w Суліндак 10.0 Поліетиленгліколь 400 80.0 ПВП К29-32 10.0 100.0% Приклади 21-37 Наступний процес використовували для одержання Прикладів 21-37: До придатного контейнеру з нержавіючої сталі додавали поліетиленгліколь (ПЕГ) і, де необхідно, етанол. Суміш перемішували в Lightnin змішувачі при низькій швидкості протягом 3 хвилин. До цієї суміші, що підтримувалася при постійній температурі (40°С до 50°С) за допомогою плитки, додавали полівінлпіролідон і перемішували в Lightnin змішувачі протягом принаймні 30 хвилин або поки 28 полівінлпіролідон повністю не розчинявся. До цього розчину додавали вибраний активний компонент, і суміш перемішували протягом принаймні 20 хвилин, використовуючи Lightnin змішувач, при підтримці постійної температури, не ви щої 50°С, доти, поки цей активний компонент повністю не розчинявся. До цього розчину додавали неіоногенну поверхнево-активну речовину, де необхідно, і розчин перемішували в Lightnin змішувачі протягом приблизно 10 хвилин. Одержані рідкі композиції даного винаходу уводили відповідно до методики, описаної тут, або далі готували для заповнення в нетоксичних, фармацевтично прийнятних капсул. До другого придатного контейнеру з нержавіючої сталі додавали надлишок ПЕГ 4600, який нагрівали від приблизно 55°С до приблизно 60°С. Після того, як ПЕГ 4600 розплавлявся його підтримували в розплавленому стані за допомогою перемішування в Lightnin змішувачі. До першого контейнеру з нержавіючої сталі додавали відповідну кількість ПЕГ 4600 з другого контейнеру з нержавіючої сталі. Розчин в першому сталевому контейнері підтримували при температурі від приблизно 45°С до приблизно 50°С перед і в процесі додавання ПЕГ 4600. Одержану суміш перемішували протягом принаймні 30 хвилин. Композиції індометацину: Компоненти суміші подані у відсотках від загальної ваги композиції (ваг/ваг.). Номер приклада Індометацин ПЕГ 400 ПЕГ 4600 ПВП К29-32 Tween 80 Етанол 190 Індометацин ПЕГ 400 ПЕГ 4600 ПВП К29-32 Tween 80 Етанол 190 21 8.9 25.0 50.0 1.8 10.7 3.6 100.0 22 5.0 24.0 56.0 1.7 10.0 3.3 100.0 23 8.7 24.3 48.7 4.3 10.4 3.6 100.0 Номер приклада 25 26 9.0 8.9 25.2 41.1 50.5 41.Г 10.8 8.9 0.9 0.0 3.6 0.0 100.0 100.0 24 8.3 23.3 46.8 8.3 10.0 3.3 100.0 27 8.9 82.2 0.0 8.9 0.0 0.0 100.0 *ПЕГ 4600 був замінений ПЕГ 3350 Композиції валпроїнової кислоти: Компоненти суміші подані у відсотках від загальної ваги композиції (ваг./ваг.). Номер приклада Валпроїнова кислота ПЕГ 400 ПЕГ 4600 ПВП К29-32 Tween 80 Етанол 190 28 40.3 0.0 45.2 1.6 9.7 3.2 29 25.3 0.0 56.6 2.0 12.1 4.0 30 25.8 0.0 57.7 0.0 12.4 4.1 31 23.2 0.0 51.9 0.0 11.1 3.8 29 80085 100.0 100.0 100.0 100.0 Номер приклада Валпроїнова кислота ПЕГ 400 ПЕГ 4600 ПВП К29-32 Tween 80 Етанол 190 32 20.6 0.0 46.2 20.0 9.9 3.3 100.0 33 12.5 37.5 37.5* 12.5 0.0 0.0 100.0 34 12.5 75.0 0.0 12.5 0.0 0.0 100.0 *ПЕГ 4600 був замінений ПЕГ 3350 Композиції диклофенаку натрія: Компоненти суміші подані у відсотках від загальної ваги композиції (ваг/ваг.) Номер приклада 35 36 Диклофенак натрію 5.1 5.1 ПЕГ 400 24.4 44.9 ПЕГ 4600 57.0 49.9" ПВП К29-32 0.0 5.1 Tween 80 10.2 0.0 Етанол 190 3.3 0.0 100.0 100.0 37 5.1 89.8 0.0 5.1 0.0 0.0 100.0 *ПЕГ 4600 був замінений ПЕГ 3350 Приклад 38 Для композицій, наведених вище, вказаний активний компонент замінений фексофенадіном. Приклад 39 Спосіб одержання композиції, в якій активним компонентом є омеправзол Одержання розчину До придатного першого резервуару додавали 264.0г поліетиленгліколю (ПЕГ) 400.NF та 38.0г етанолу, 190 стандарт, USP. До цього розчину при постійному перемішуванні за допомогою Lightnin мішалки додавали 19.0г ПВП К29-32. Екціпієнти перемішували протягом принаймні 30 хвилин і для підтримання постійної температури у межах між 40°С і 50°С використовували водяну баню. Кислотність одержаного розчину доводили до рН 13.5, використовуючи 8М розчин гідроксиду натрію. До забуференого розчину повільно і періодично додавали 38.0г омепразолу, при постійному контролі рН і підтриманні його на рівні, принаймні, 9.0 шляхом додавання по краплям 8М розчину гідроксиду натрію. До цього розчину додавали 113.0г полісорбату 80.NF, і одержаний розчин перемішували Комп’ютерна в ерстка Л. Купенко 30 при помірній швидкості протягом 10 хвилин за допомогою Lightnin мішалки. Підготовка капсули До придатного другого резервуару додавали надлишок (600г) необхідної кількості ПЕГ 3350. ПЕГ 3350 нагрівали у водяній бані для підтримання температури від приблизно 55°С до приблизно 60°С і перемішували за допомогою Lightnin мішалки доти, поки ПЕГ 3350 не розплавлявся. До першого резервуару додавали 528.0г ПЕГ 3350 з другого резервуару, і температуру суміші в першому резервуарі підтримували в інтервалі від 40°С до 50°С при перемішуванні протягом, принаймні, 30 хвилин. Величину рН одержаного розчину підтримували близько 10.0 (р 9.8 - 10.2) за допомогою додавання 8М розчину гідроксиду натрію. Порожнину капсул номер один наповнювали, у той час як розчин постійно перемішували і підтримували при температурі від 45 °С до 55°С протягом процесу наповнення, о заповнює(заповнення). Після закупорювання одержані капсули важили від 575г до 635г (вага брутто). Потім кожну капсулу розміру один поміщали у капсулу н ульового розміру для покриття. Крім того, такі препаративні зразки одержували, використовуючи 1.9г омепразолу, 15.4г ПЕГ 400, 30.8г ПЕГ 3350 і 1.9г ПВП К29-32 замість вимірювань, описаних для активного компонента та екціпієнтів, описаних в цьому прикладі 39. Покриття капсули До першого скляного резервуару додавали 440.0г ацетону, NF, який перемішували з середньою швидкістю за допомогою Lightnin мішалки. До ацетону додавали 10.0г roftriethyl триетилцитрату, NF, і перемішували протягом 2 хвилин з наступним повільним додаванням 50.0г Eudragit ® L100 при постійному перемішуванні протягом 10 хвилин або поки не утворювалася однорідна дисперсія. До другого скляного резервуару додавали аліквоту суміші з першого скляного резервуару. При помірному перемішуванні з використанням стрижневої мішалки капсули нульового розміру частково занурювали, залишали висушуватися і потім непокриту частина такої капсули занурювали і висушували. Кожну капсулу вкривали 3 шарами покриття, з використанням процедури, поданої вище. Альтернативно, використовують інші покриття, відомі фахівцю даної галузі, включаючи, наприклад, покриття, одержані кристалізацією, покриття, одержані розбризкуванням, і т.п. Підписне Тираж 26 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюOral liquid compositions
Назва патенту російськоюЖидкие композиции перорального назначения
МПК / Мітки
МПК: A61K 9/64, A61K 9/48, A61K 9/66, A61K 9/52
Мітки: рідкі, композиції, призначення, перорального
Код посилання
<a href="https://ua.patents.su/15-80085-ridki-kompozici-peroralnogo-priznachennya.html" target="_blank" rel="follow" title="База патентів України">Рідкі композиції перорального призначення</a>