Похідні бензотіазину і бензотіадіазину, спосіб їх одержання і фармацевтична композиція, яка їх містить
Формула / Реферат
1. Сполука формули (I):
, (I)
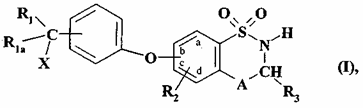
де:
r1 являє собою атом водню, атом галогену або лінійну або розгалужену (С1-С6)алкільну групу,
R1a являє собою атом водню або лінійну або розгалужену (C1-C6)алкільну групу,
R2 являє собою атом водню,
А являє собою атом азоту і, разом з розташованою поряд -СНR3-групою, утворює кільце 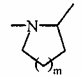 , де m являє собою 1, 2 або 3,
, де m являє собою 1, 2 або 3,
R3 являє собою атом водню, лінійну або розгалужену (C1-C6)алкільну групу або (C3-C7)циклоалкільну групу,
X являє собою NR6R7, S(O)nR8 або гетероциклічну групу, де:
R6 являє собою атом водню, лінійну або розгалужену (C1-C6)алкільну групу, S(O)PR9 або COR9,
R7 являє собою атом водню, лінійну або розгалужену (C1-C6)алкільну групу,
або R6 і R7, разом з атомом азоту, який містить їх, утворює пірольну групу,
R8, R9 і R10, які можуть бути однаковими або різними, являють собою атом водню; лінійну або розгалужену (C1-C6)алкільну групу, необов’язково заміщену одним або більше атомами галогену; арил-(C1-C6)алкільну групу, в якій частина алкілу є лінійною або розгалуженою; або арильну групу,
n і p, які можуть бути однаковими або різними, являють собою 1 або 2,
при цьому гетероциклічна група означає імідазольну, пірольну, тетразольну або оксадіазольну групу,
її енантіомери і діастереоізомери, а також її адитивні солі з фармацевтично прийнятною кислотою або основою.
2. Сполука формули (I) за п. 1, де група 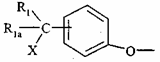 знаходиться у положенні b фенілу, який її містить.
знаходиться у положенні b фенілу, який її містить.
3. Сполука формули (I) за будь-яким з пп. 1 або 2, де X являє собою NR6R7 або S(O)nR8 групу, або гетероциклічну групу.
4. Сполука формули (I) за будь-яким з пунктів 1, 2 або 3, де X являє собою NR6R7 групу.
5. Сполука формули (I) за будь-яким з пунктів 1-4, де 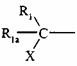 знаходиться у мета-положенні структури феноксикільця, яке її містить.
знаходиться у мета-положенні структури феноксикільця, яке її містить.
6. Сполука формули (I) за будь-яким з пунктів 1-4, де 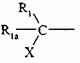 знаходиться у пара-положенні структури феноксикільця, яке її містить.
знаходиться у пара-положенні структури феноксикільця, яке її містить.
7. Сполука формули (I) за будь-яким з пунктів 1-6, де А являє собою атом азоту і, разом з розташованою поряд -CHR3-групою, утворює кільце 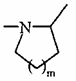 , де m являє собою 1, 2 або 3, переважно 1.
, де m являє собою 1, 2 або 3, переважно 1.
8. Сполука формули (I) за п. 1, яка являє собою {3-[(5,5-діоксидо-2,3,3a,4-тетрагідро-1Н-піроло[2,1-c][1,2,4]бензотіадіазин-7-іл)окси]феніл}метанамін, а також її адитивні солі.
9. Сполука формули (I) за п. 1, яка являє собою N-{3-[(5,5-діоксидо-2,3,3a,4-тетрагідро-1Н-піроло[2,1-с][1,2,4]бензотіадіазин-7-іл)окси]бензил}-метансульфонамід, а також її адитивні солі.
10. Сполука формули (I) за п. 1, яка являє собою N-{4-[(5,5-діоксидо-2,3,3a,4-тетрагідро-1Н-піроло[2,1-c][1,2,4]бензотіадіазин-7-іл)окси]бензил}-метансульфонамід, а також її адитивні солі.
11. Спосіб одержання сполук формули (I) за п. 1, де А являє собою NR4 групу або А являє собою атом азоту і, разом з розташованою поряд -CHR3-групою, утворює кільце 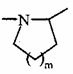 , де m являє собою 1, 2 або 3, який відрізняється тим, що як вихідну сполуку використовують сполуку формули (II):
, де m являє собою 1, 2 або 3, який відрізняється тим, що як вихідну сполуку використовують сполуку формули (II):
, (II)
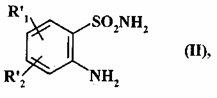
де:
R'1 являє собою лінійну або розгалужену (С1-С6)алкоксигрупу,
R'2 являє собою атом водню, атом галогену або лінійну або розгалужену (С1-С6)алкоксигрупу,
яку:
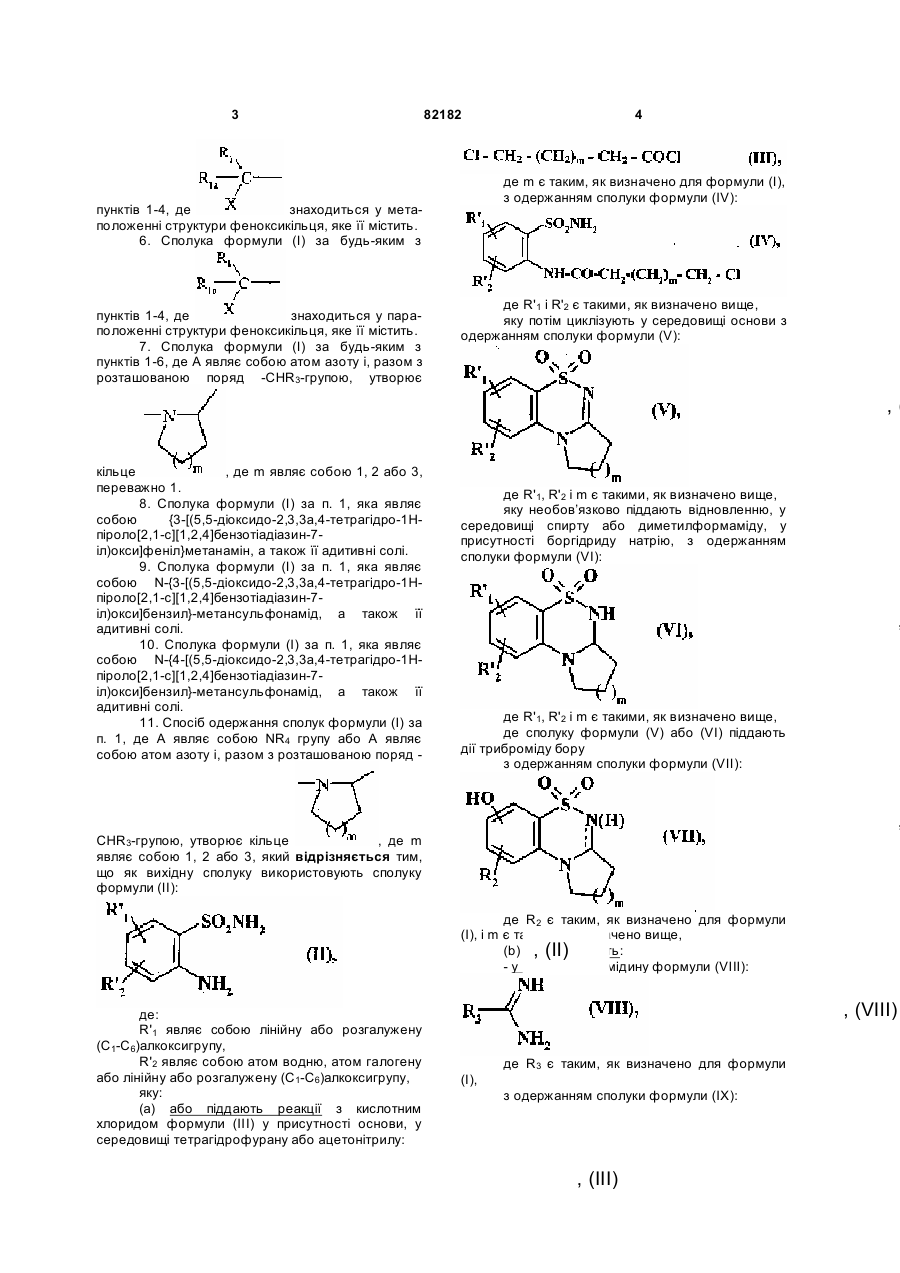
, (III)
(a) або піддають реакції з кислотним хлоридом формули (III) у присутності основи, у середовищі тетрагідрофурану або ацетонітрилу:![]()
де m є таким, як визначено для формули (I),
з одержанням сполуки формули (IV):
, (IV)
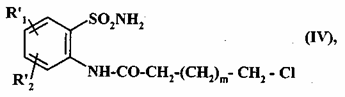
де R'1 і R'2 є такими, як визначено вище,
яку потім циклізують у середовищі основи з одержанням сполуки формули (V):
, (V)
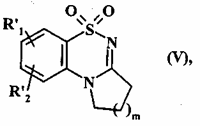
де R'1, R'2 і m є такими, як визначено вище,
яку необов’язково піддають відновленню, у середовищі спирту або диметилформаміду, у присутності боргідриду натрію, з одержанням сполуки формули (VI):
, (VI)
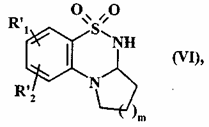
де R'1, R'2 і m є такими, як визначено вище,
де сполуку формули (V) або (VI) піддають дії триброміду бору
з одержанням сполуки формули (VII):
, (VII)
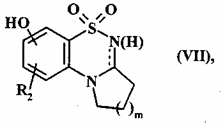
де R2 є таким, як визначено для формули (I), і m є таким, як визначено вище,
(b) або циклізують:
- у присутності амідину формули (VIII):
, (VIII)
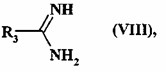
де R3 є таким, як визначено для формули (I),
з одержанням сполуки формули (IX):
, (IX)
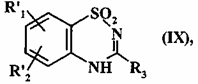
де R'1, R'2 і r3 є такими, як визначено вище,
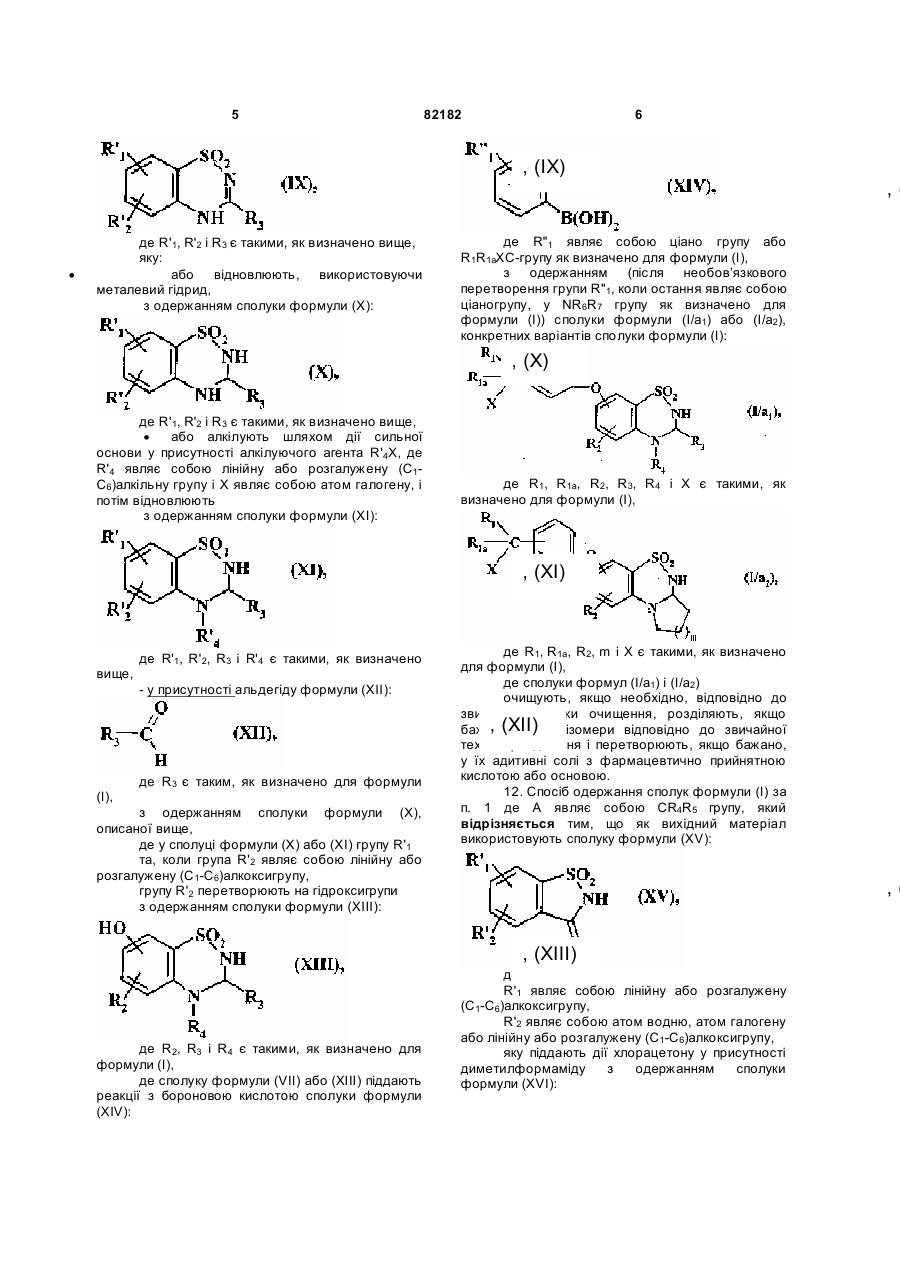
яку:
· або відновлюють, використовуючи металевий гідрид,
з одержанням сполуки формули (X):
, (X)
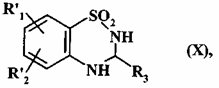
де R'1, R'2 і R3 є такими, як визначено вище,
· або алкілують шляхом дії сильної основи у присутності алкілуючого агента R'4X, де R'4 являє собою лінійну або розгалужену (C1-C6)алкільну групу і X являє собою атом галогену, і потім відновлюють
з одержанням сполуки формули (XI):
, (XI)
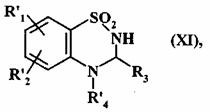
де R'1, R'2, R3 і R'4 є такими, як визначено вище,
- у присутності альдегіду формули (XII):
, (XII)
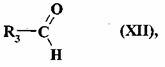
де R3 є таким, як визначено для формули (I),
з одержанням сполуки формули (X), описаної вище,
де у сполуці формули (X) або (XI) групу R'1
та, коли група R'2 являє собою лінійну або розгалужену (C1-C6)алкоксигрупу,
групу R'2 перетворюють на гідроксигрупи
з одержанням сполуки формули (XIII):
, (XIII)
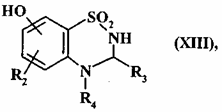
де R2, R3 і R4 є такими, як визначено для формули (I),
де сполуку формули (VII) або (XIII) піддають реакції з бороновою кислотою сполуки формули (XIV):
, (XIV)
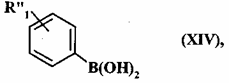
де R"1 являє собою ціано групу або R1R1aXC-групу як визначено для формули (I),
з одержанням (після необов’язкового перетворення групи R"1, коли остання являє собою ціаногрупу, у NR6R7 групу як визначено для формули (I)) сполуки формули (I/a1) або (I/а2), конкретних варіантів сполуки формули (I):
, (I/a1)
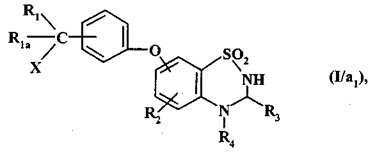
де R1, R1a, R2, R3, R4 і X є такими, як визначено для формули (I),
, (I/a2)
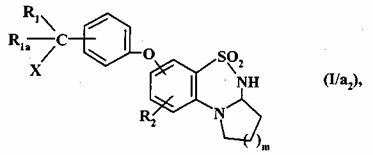
де R1, R1a, R2, m і X є такими, як визначено для формули (I),
де сполуки формул (I/a1) і (І/а2)
очищують, якщо необхідно, відповідно до звичайної техніки очищення, розділяють, якщо бажано, на їх ізомери відповідно до звичайної техніки розділення і перетворюють, якщо бажано, у їх адитивні солі з фармацевтично прийнятною кислотою або основою.
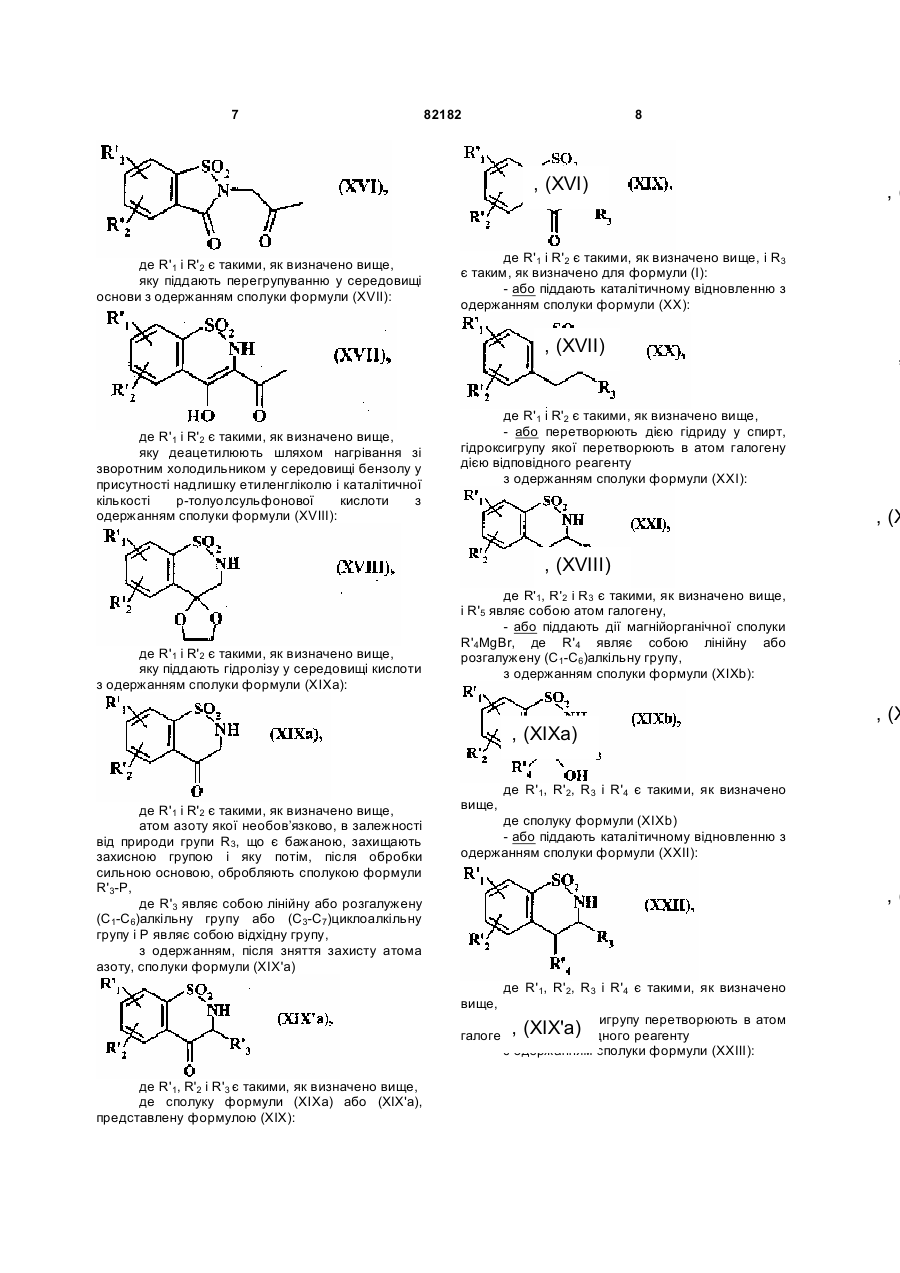
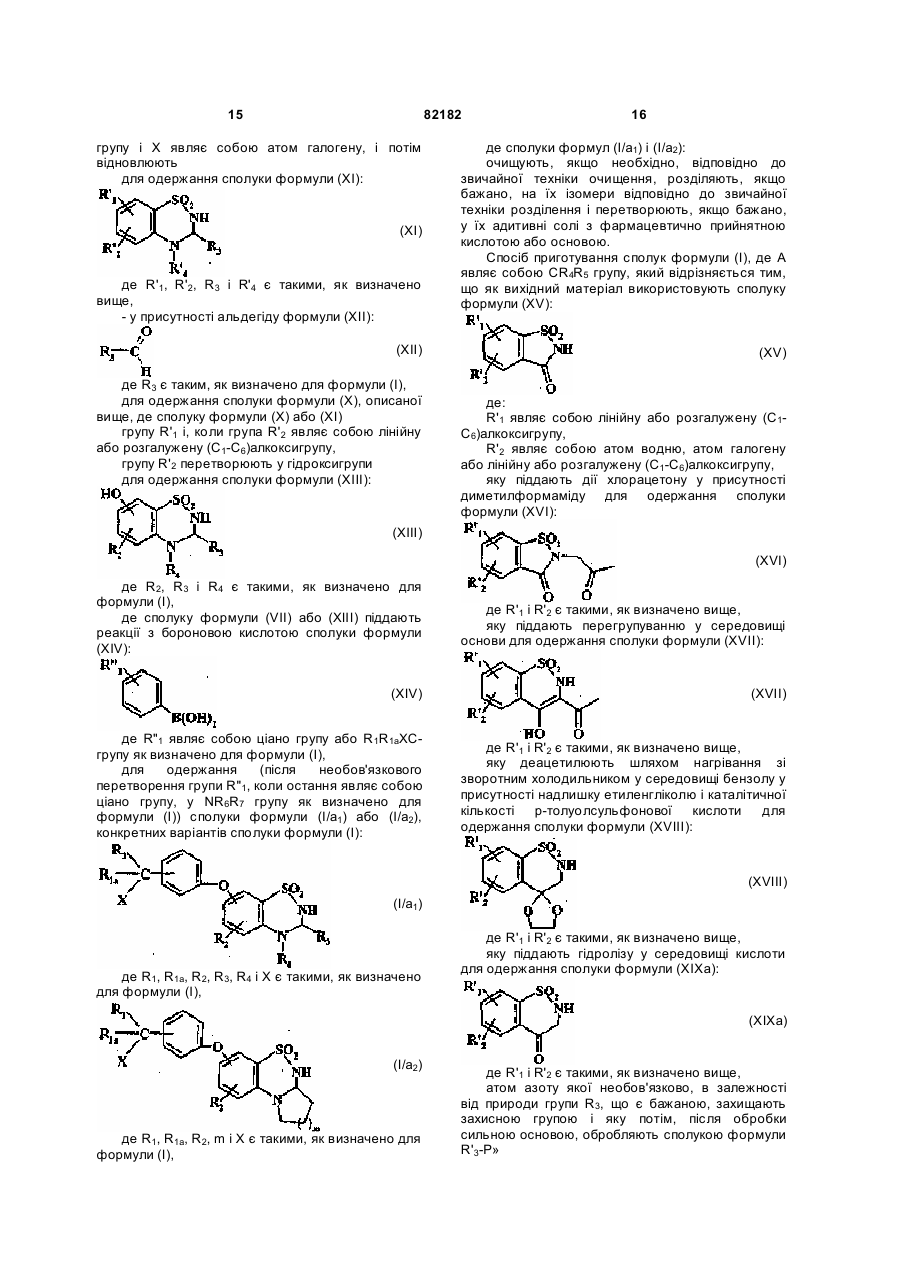
12. Спосіб одержання сполук формули (I) за п. 1 де А являє собою CR4R5 групу, який відрізняється тим, що як вихідний матеріал використовують сполуку формули (XV):
, (XV)
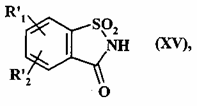
де:
R'1 являє собою лінійну або розгалужену (C1-C6)алкоксигрупу,
R'2 являє собою атом водню, атом галогену або лінійну або розгалужену (C1-C6)алкоксигрупу,
яку піддають дії хлорацетону у присутності диметилформаміду з одержанням сполуки формули (XVI):
, (XVI)
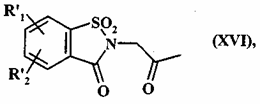
де R'1 і R'2 є такими, як визначено вище,
яку піддають перегрупуванню у середовищі основи з одержанням сполуки формули (XVII):
, (XVII)
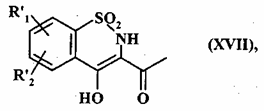
де R'1 і R'2 є такими, як визначено вище,
яку деацетилюють шляхом нагрівання зі зворотним холодильником у середовищі бензолу у присутності надлишку етиленгліколю і каталітичної кількості р-толуолсульфонової кислоти з одержанням сполуки формули (XVIIІ):
, (XVIII)
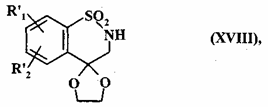
де R'1 і R'2 є такими, як визначено вище,
яку піддають гідролізу у середовищі кислоти з одержанням сполуки формули (XIXa):
, (XIXa)
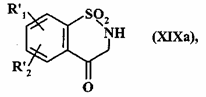
де R'1 і R'2 є такими, як визначено вище,
атом азоту якої необов’язково, в залежності від природи групи R3, що є бажаною, захищають захисною групою і яку потім, після обробки сильною основою, обробляють сполукою формули R'3-Р,
де R'3 являє собою лінійну або розгалужену (C1-C6)алкільну групу або (C3-C7)циклоалкільну групу і Р являє собою відхідну групу,
з одержанням, після зняття захисту атома азоту, сполуки формули (XIX'a)
, (XIX'a)
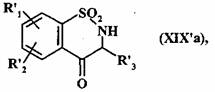
де R'1, R'2 і R'3 є такими, як визначено вище,
де сполуку формули (XІXa) або (XІX'a), представлену формулою (XIX):
, (XIX)
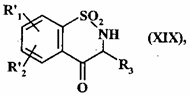
де R'1 і R'2 є такими, як визначено вище, і R3 є таким, як визначено для формули (I):
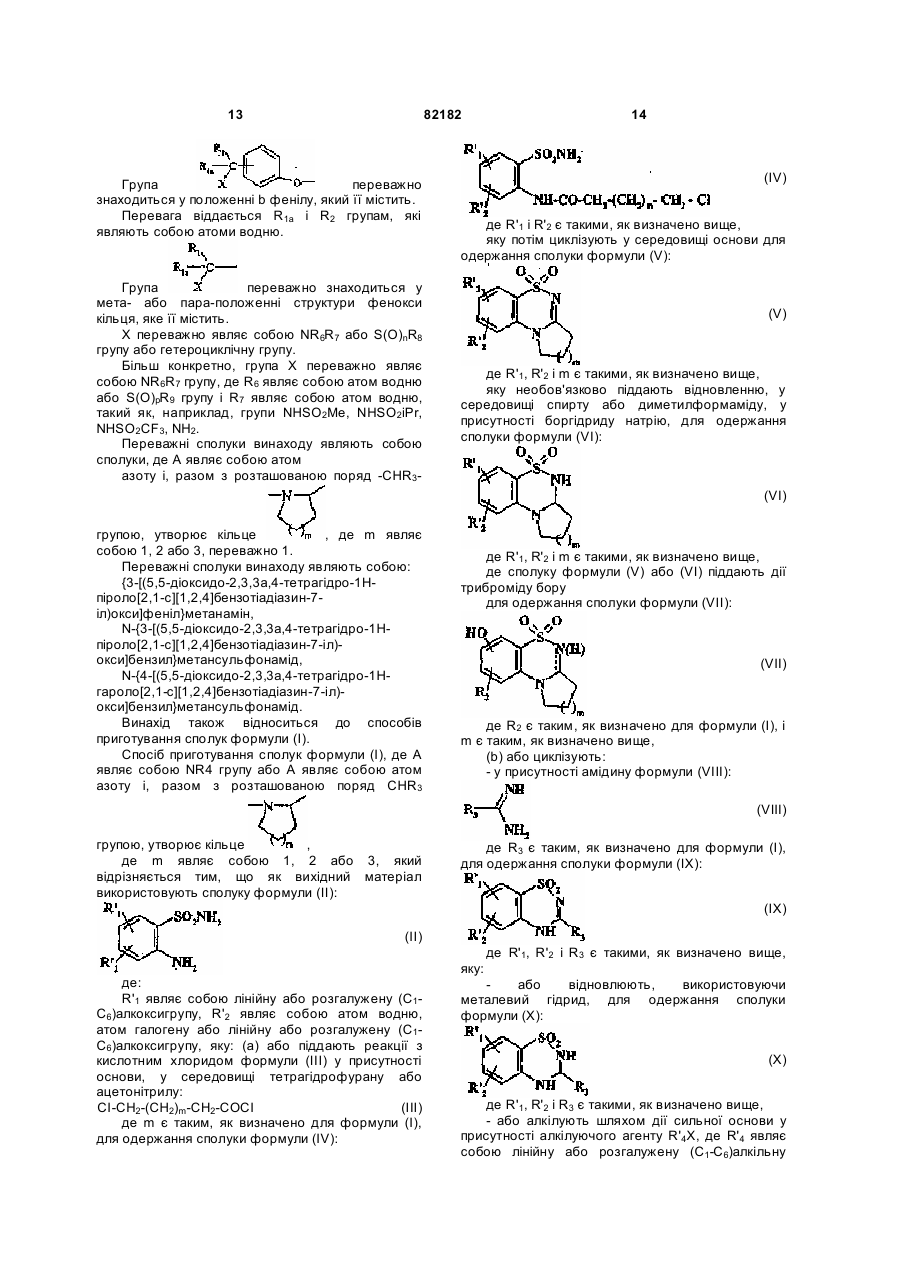
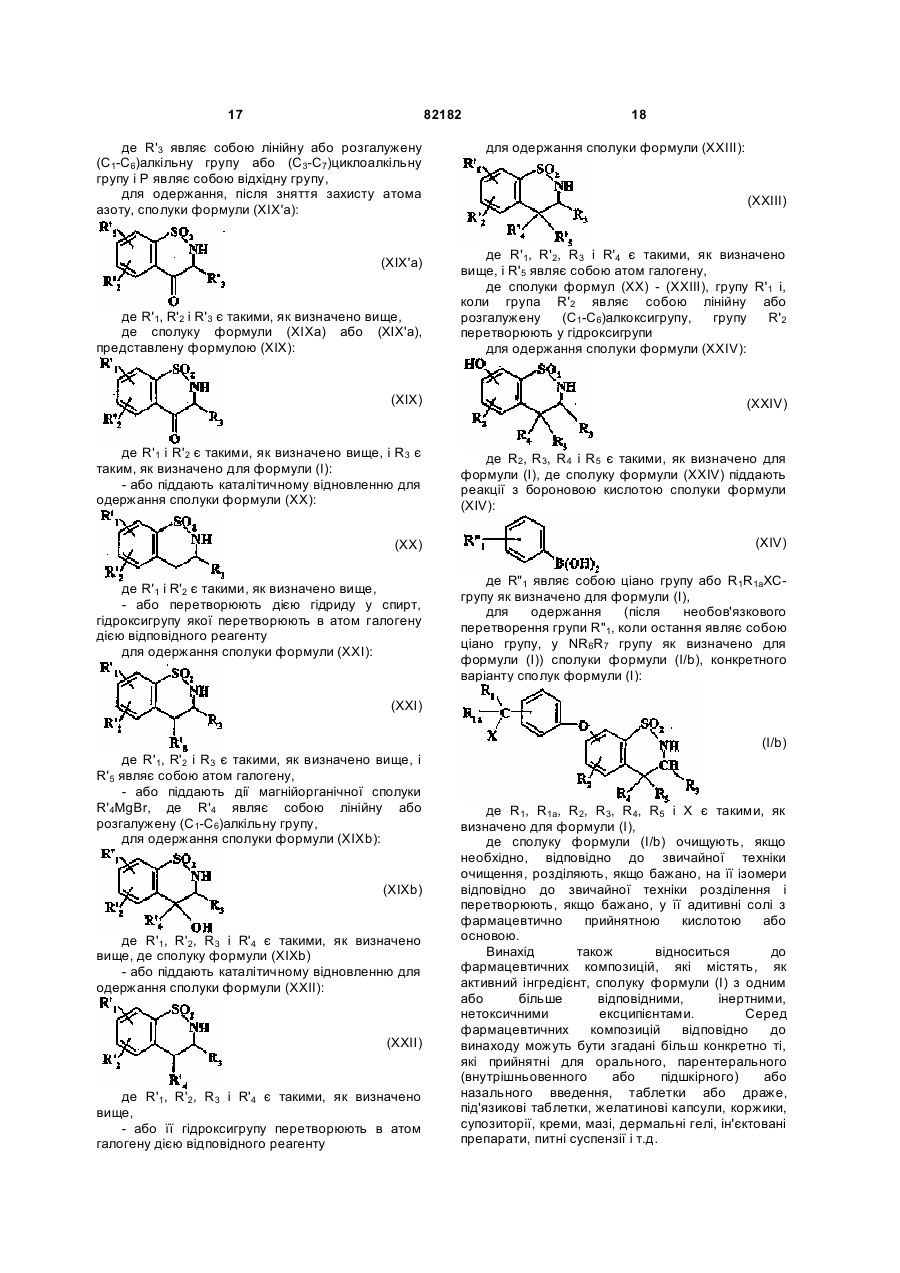
- або піддають каталітичному відновленню з одержанням сполуки формули (XX):
, (XX)
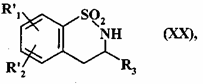
де R'1 і R'2 є такими, як визначено вище,
- або перетворюють дією гідриду у спирт, гідроксигрупу якої перетворюють в атом галогену дією відповідного реагенту
з одержанням сполуки формули (XXI):
, (XXI)
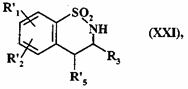
де R'1, R'2 і R3 є такими, як визначено вище, і R'5 являє собою атом галогену,
- або піддають дії магнійорганічної сполуки R'4МgBr, де R'4 являє собою лінійну або розгалужену (C1-C6)алкільну групу,
з одержанням сполуки формули (XІXb):
, (XIXb)
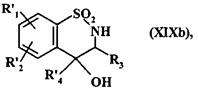
де R'1, R'2, R3 і R'4 є такими, як визначено вище,
де сполуку формули (XІXb)
- або піддають каталітичному відновленню з одержанням сполуки формули (XXII):
, (XXII)
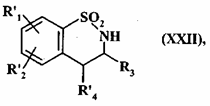
де R'1, R'2, R3 і R'4 є такими, як визначено вище,
- або її гідроксигрупу перетворюють в атом галогену дією відповідного реагенту
з одержанням сполуки формули (XXIII):
, (XXIII)
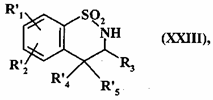
де R'1, R'2, R3 і R'4 є такими, як визначено вище, і R'5 являє собою атом галогену,
де сполуки формул (XX) - (XXIII), групу R'1 і, коли група R'2 являє собою лінійну або розгалужену (C1-C6)алкоксигрупу, групу R'2 перетворюють у гідроксигрупи
з одержанням сполуки формули (XXIV):
, (XXIV)
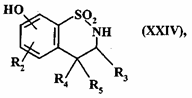
де R2, R3, R4 і R5 є такими, як визначено для формули (I),
де сполуку формули (XXIV) піддають реакції з бороновою кислотою сполуки формули (XIV):
, (XIV)
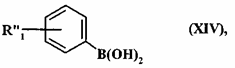
де R"1 являє собою ціаногрупу або R1RlaXC-групу як визначено для формули (I),
з одержанням (після необов’язкового перетворення групи R"1, коли остання являє собою ціаногрупу, у NR6R7 групу як визначено для формули (I)) сполуки формули (I/b), конкретного варіанта сполуки формули (I):
, (I/b)
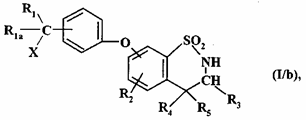
де R1, R1a, R2, R3, R4, R5 і X є такими, як визначено для формули (I),
де сполуку формули (I/b) очищують, якщо необхідно, відповідно до звичайної техніки очищення, розділяють, якщо бажано, на її ізомери відповідно до звичайної техніки розділення і перетворюють, якщо бажано, у її адитивні солі з фармацевтично прийнятною кислотою або основою.
13. Фармацевтична композиція, яка містить як активний інгредієнт сполуку за будь-яким з пп. 1-10 у поєднанні з одним або більше інертними, нетоксичними, фармацевтично прийнятними ексципієнтами або носіями.
14. Фармацевтична композиція за п. 13, яка містить як активний інгредієнт сполуку за будь-яким з пп. 1-10, для застосування як лікарських засобів як AMPA модуляторів.
Текст
1. Сполука формули (I): 2 (19) 1 3 82182 де m є таким, як визначено для формули (I), з одержанням сполуки формули (IV): пунктів 1-4, де знаходиться у метаположенні структури феноксикільця, яке її містить. 6. Сполука формули (I) за будь-яким з пунктів 1-4, де знаходиться у параположенні структури феноксикільця, яке її містить. 7. Сполука формули (I) за будь-яким з пунктів 1-6, де А являє собою атом азоту і, разом з розташованою поряд -CHR3-групою, утворює 4 де R'1 і R'2 є такими, як визначено вище, яку потім циклізують у середовищі основи з одержанням сполуки формули (V): ,( кільце , де m являє собою 1, 2 або 3, переважно 1. 8. Сполука формули (I) за п. 1, яка являє собою {3-[(5,5-діоксидо-2,3,3a,4-тетрагідро-1Нпіроло[2,1-c][1,2,4]бензотіадіазин-7іл)окси]феніл}метанамін, а також її адитивні солі. 9. Сполука формули (I) за п. 1, яка являє собою N-{3-[(5,5-діоксидо-2,3,3a,4-тетрагідро-1Нпіроло[2,1-с][1,2,4]бензотіадіазин-7іл)окси]бензил}-метансульфонамід, а також її адитивні солі. 10. Сполука формули (I) за п. 1, яка являє собою N-{4-[(5,5-діоксидо-2,3,3a,4-тетрагідро-1Нпіроло[2,1-c][1,2,4]бензотіадіазин-7іл)окси]бензил}-метансульфонамід, а також її адитивні солі. 11. Спосіб одержання сполук формули (I) за п. 1, де А являє собою NR4 групу або А являє собою атом азоту і, разом з розташованою поряд де R'1, R'2 і m є такими, як визначено вище, яку необов’язково піддають відновленню, у середовищі спирту або диметилформаміду, у присутності боргідриду натрію, з одержанням сполуки формули (VI): , де R'1, R'2 і m є такими, як визначено вище, де сполуку формули (V) або (VI) піддають дії триброміду бору з одержанням сполуки формули (VII): , CHR3-групою, утворює кільце , де m являє собою 1, 2 або 3, який відрізняється тим, що як вихідну сполуку використовують сполуку формули (II): де R2 є таким, як визначено для формули (I), і m є таким, як визначено вище, (b) або(II) , циклізують: - у присутності амідину формули (VIII): де: R'1 являє собою лінійну або розгалужену (С1-С6)алкоксигрупу, R'2 являє собою атом водню, атом галогену або лінійну або розгалужену (С1-С6)алкоксигрупу, яку: (a) або піддають реакції з кислотним хлоридом формули (III) у присутності основи, у середовищі тетрагідрофурану або ацетонітрилу: , (VIII) де R3 є таким, як визначено для формули (I), з одержанням сполуки формули (IX): , (III) 5 82182 6 , (IX) ,( · де R'1, R'2 і R3 є такими, як визначено вище, яку: або відновлюють, використовуючи металевий гідрид, з одержанням сполуки формули (X): де R"1 являє собою ціано групу або R1R1aXC-групу як визначено для формули (I), з одержанням (після необов’язкового перетворення групи R"1, коли остання являє собою ціаногрупу, у NR6R7 групу як визначено для формули (I)) сполуки формули (I/a1) або (I/а2), конкретних варіантів сполуки формули (I): , (X) де R'1, R'2 і R3 є такими, як визначено вище, · або алкілують шляхом дії сильної основи у присутності алкілуючого агента R'4X, де R'4 являє собою лінійну або розгалужену (C1C6)алкільну групу і X являє собою атом галогену, і потім відновлюють з одержанням сполуки формули (XI): де R1, R1a, R2, R3, R4 і X є такими, як визначено для формули (I), , (XI) вище, де R'1, R'2, R3 і R'4 є такими, як визначено - у присутності альдегіду формули (XII): де R3 є таким, як визначено для формули (I), з одержанням сполуки формули (X), описаної вище, де у сполуці формули (X) або (XI) групу R'1 та, коли група R'2 являє собою лінійну або розгалужену (C1-C6)алкоксигрупу, групу R'2 перетворюють на гідроксигрупи з одержанням сполуки формули (XIII): де R1, R1a, R2, m і X є такими, як визначено для формули (I), де сполуки формул (I/a1) і (І/а2) очищують, якщо необхідно, відповідно до звичайної техніки очищення, розділяють, якщо , (XII) бажано, на їх ізомери відповідно до звичайної техніки розділення і перетворюють, якщо бажано, у їх адитивні солі з фармацевтично прийнятною кислотою або основою. 12. Спосіб одержання сполук формули (I) за п. 1 де А являє собою CR4R5 групу, який відрізняється тим, що як вихідний матеріал використовують сполуку формули (XV): ,( , (XIII) де R2, R3 і R4 є такими, як визначено для формули (I), де сполуку формули (VII) або (XIII) піддають реакції з бороновою кислотою сполуки формули (XIV): де: R'1 являє собою лінійну або розгалужену (C1-C6)алкоксигрупу, R'2 являє собою атом водню, атом галогену або лінійну або розгалужену (C1-C6)алкоксигрупу, яку піддають дії хлорацетону у присутності диметилформаміду з одержанням сполуки формули (XVI): 7 82182 8 , (XVI) де R'1 і R'2 є такими, як визначено вище, яку піддають перегрупуванню у середовищі основи з одержанням сполуки формули (XVII): де R'1 і R'2 є такими, як визначено вище, і R3 є таким, як визначено для формули (I): - або піддають каталітичному відновленню з одержанням сполуки формули (XX): , (XVII) де R'1 і R'2 є такими, як визначено вище, яку деацетилюють шляхом нагрівання зі зворотним холодильником у середовищі бензолу у присутності надлишку етиленгліколю і каталітичної кількості р-толуолсульфонової кислоти з одержанням сполуки формули (XVIIІ): ,( , де R'1 і R'2 є такими, як визначено вище, - або перетворюють дією гідриду у спирт, гідроксигрупу якої перетворюють в атом галогену дією відповідного реагенту з одержанням сполуки формули (XXI): , (X , (XVIII) де R'1 і R'2 є такими, як визначено вище, яку піддають гідролізу у середовищі кислоти з одержанням сполуки формули (XIXa): де R'1, R'2 і R3 є такими, як визначено вище, і R'5 являє собою атом галогену, - або піддають дії магнійорганічної сполуки R'4МgBr, де R'4 являє собою лінійну або розгалужену (C1-C6)алкільну групу, з одержанням сполуки формули (XІXb): , (XIXa) де R'1 і R'2 є такими, як визначено вище, атом азоту якої необов’язково, в залежності від природи групи R3, що є бажаною, захищають захисною групою і яку потім, після обробки сильною основою, обробляють сполукою формули R'3-Р, де R'3 являє собою лінійну або розгалужену (C1-C6)алкільну групу або (C3-C7)циклоалкільну групу і Р являє собою відхідну групу, з одержанням, після зняття захисту атома азоту, сполуки формули (XIX'a) вище, де R'1, R'2, R3 і R'4 є такими, як визначено де сполуку формули (XІXb) - або піддають каталітичному відновленню з одержанням сполуки формули (XXII): ,( де R'1, R'2, R3 і R'4 є такими, як визначено вище, - або її гідроксигрупу перетворюють в атом , (XIX'a) галогену дією відповідного реагенту з одержанням сполуки формули (XXIII): де R'1, R'2 і R'3 є такими, як визначено вище, де сполуку формули (XІXa) або (XІX'a), представлену формулою (XIX): , (X 9 82182 10 перетворення групи R"1, коли остання являє собою ціаногрупу, у NR6R7 групу як визначено для формули ,(I)) сполуки формули (I/b), конкретного (XXIII) варіанта сполуки формули (I): де R'1, R'2, R3 і R'4 є такими, як визначено вище, і R'5 являє собою атом галогену, де сполуки формул (XX) - (XXIII), групу R'1 і, коли група R'2 являє собою лінійну або розгалужену (C1-C6)алкоксигрупу, групу R'2 перетворюють у гідроксигрупи з одержанням сполуки формули (XXIV): де R2, R3, R4 і R5 є такими, як визначено для формули (I), де сполуку формули (XXIV) піддають реакції з бороновою кислотою сполуки формули (XIV): де R1, R1a, R2, R3, R4, R5 і X є такими, як визначено для формули (I), де сполуку формули (I/b) очищують, якщо необхідно, відповідно до звичайної техніки очищення, розділяють, якщо бажано, на її ізомери , (XXIV) відповідно до звичайної техніки розділення і перетворюють, якщо бажано, у її адитивні солі з фармацевтично прийнятною кислотою або основою. 13. Фармацевтична композиція, яка містить як активний інгредієнт сполуку за будь-яким з пп. 1-10 у поєднанні з одним або більше інертними, нетоксичними, фармацевтично прийнятними ексципієнтами або носіями. 14.,Фармацевтична композиція за п. 13, яка (XIV) містить як активний інгредієнт сполуку за будьяким з пп. 1-10, для застосування як лікарських засобів як AMPA модуляторів. де R"1 являє собою ціаногрупу або R1RlaXCгрупу як визначено для формули (I), з одержанням (після необов’язкового Даний винахід відноситься до нових похідних бензотіазину і бензотіадіазину, до способу їх приготування і фармацевтичних композицій, які їх містять. На сьогоднішній день відомо, що збуджувальні амінокислоти, особливо глутамат, відіграють ключову роль у фізіологічних процесах нейрональної пластичності і у механізмах, що лежать в основі навчання та запам'ятовування. Патофізіологічні дослідження чітко показали, що дефіцит у глутаматергічній нейротрансмісії тісно пов'язаний з розвитком хвороби Альцгеймера [Neuroscience і Biobehavioral reviews, 1992,16, 1324 ; Progress in Neurobiology, 1992, 39, 517-545]. Більше того, численні роботи за останні роки продемонстрували існування підтипів збуджувальних рецепторів амінокислот і їх функціональні взаємодії [Molecular Neuropharmacology, 1992, 2, 15-31]. Серед таких рецепторів, АМРА (α-аміно-3гідрокси-5-метил-4-ізоксазол-пропіонова кислота) рецептор виявляється таким рецептором, який найбільше залучений в явище фізіологічної нейрональної збуджуваності і, особливо, в явища, які залучені до процесів запам'ятовування. Наприклад, було виявлено, що процес навчання пов'язаний зі зростанням у зв'язуванні АМРА зі своїм рецептором у гіпокампі, одній з ділянок мозку, головних для процесів запам'ятовування і пізнавання. Подібним чином, ноотропні агенти, такі як анірацетам, нещодавно були описані як позитивно модулюючі АМРА рецептори нейрональних клітин [Journal Neurochemistry, 1992, 58, 1199-1204]. В літературі, сполуки, як мають структуру бензаміду, були описані як такі, що володіють тим же механізмом дії і покращують процес запам'ятовування [Synapse, 1993, 15, 326-329]. Сполука В А 74, зокрема, являє собою найбільш активний з нових фармакологічних агентів. Нарешті, опис [патенту ЕР 692 484] розкриває похідне бензотіадіазину, яке володіє полегшувальною активністю відносно струму АМРА, і [патентна заявка WO 99/42456] описує серед інших конкретні похідні бензотіадіазину як модулятори АМРА рецепторів. Похідні бензотіазину і бензотіадіазину, до яких відноситься даний винахід, крім того, що вони є новими, несподівано виявляють фармакологічну активність відносно струму AMP А, що явно є більш переважним відносно активності сполук, які мають подібні структури, описані у попередньому рівні техніки. Вони є корисними як АМРА модулятори для лікування або запобігання 11 82182 розладам пам'яті і пізнавання, які пов'язані з віком, синдромами тривоги або депресії, прогресуючими нейродегенеративними захворюваннями, хворобою Альцгеймера, хворобою Піка, хореєю Хантінгтона, шизофренією, наслідками гострих нейродегенеративних захворювань, наслідками ішемії і наслідками епілепсії. Більш конкретно, даний винахід відноситься до сполук формули (І): (I) де: R1 являє собою атом водню, атом галогену або лінійну або розгалужену (С1-С6)алкільну групу, R1a являє собою атом водню або лінійну або розгалужену (С1-С6)алкільну групу, R2 являє собою атом водню, атом галогену або гідроксигрупу, А являє собою CR4R5 групу або NR4 групу, R3 являє собою атом водню, лінійну або розгалужену (С1-С6)алкільну групу або (С3С7)циклоалкільну групу, R4 являє собою атом водню або лінійну або розгалужену (С1-С6)алкільну групу, або А являє собою атом азоту і, разом з розташованою поряд –СHR3-групою, утворює кільце , де m являє собою 1,2 або 3, R5 являє собою атом водню або галогену, X являє собою NR6R7, S(O)nR8 або OR'8 групу або гетероциклічну групу, де: R6 являє собою атом водню, лінійну або розгалужену (С1-С6)алкільну групу, S(O)pR9, COR9 або P(O)OR9OR10, R7 являє собою атом водню або лінійну або розгалужену (С1-С6)алкільну групу, або R6 і R7, разом з атомом азоту, який містить їх, утворюють гетероциклічну групу, R8, R9 і R10, які можуть бути однаковими або різними, являють собою атом водню; лінійну або розгалужену (С1-С6)алкільну групу, необов'язково заміщену одним або більше атомами галогену; арил-(С1-С6)алкільну групу, в якій алкільна частина лінійна або розгалужена; або арильну групу, R'8 являє собою лінійну або розгалужену (С1С6)алкільну групу або лінійну або розгалужену (С1С6)ацильну групу, n і р, які можуть бути однаковими або різними, являють собою 1 або 2, до їх енантіомерів і діастереоізомерів, а також до їх адитивних солей з фармацевтично прийнятною кислотою або основою, повинно розумітись, що: - термін "гетероциклічна група" означає моноциклічну або біциклічну, ароматичну або неароматичну групу, яка містить від одного до чотирьох однакових або різних гетероатомів, вибраних з азоту, кисню і сірки, необов'язково 12 заміщену однією або більше однаковими або різними групами, вибраними з галогену, лінійного або розгалуженого (С1-С6)алкілу, лінійного або розгалуженого (С1-С6)алкокси, лінійного або розгалуженого (С1-С6)полігалоалкілу, лінійного або розгалуженого (С1-С6)алкоксикарбонілу, оксо, тіоксо, карбокси, лінійного або розгалуженого (СіСб)ацилу, лінійного або розгалуженого (С1С6)полігалоалкокси, гідрокси, ціано, нітро, аміно (необов'язково заміщеного однією або більше лінійними або розгалуженими (С1-С6)алкільними групами), аміносульфонілу (необов'язково заміщеного однією або більше лінійними або розгалуженими (С1-С6)алкільними групами) і (С1С6)алкілсульфоніламіно, - термін "арильна група", як повинно розумітись, означає моноциклічну ароматичну групу або біциклічну групу, в якій щонайменше одне з кілець є ароматичним, необов'язково заміщену однією або більше однаковими або різними групами, вибраними з галогену, лінійного або розгалуженого (С1-С6)алкілу (необов'язково заміщеного однією або більше гідроксигрупами), лінійного або розгалуженого (С1-С6)алкокси, лінійного або розгалуженого (С1-С6)полігалоалкілу, лінійного або розгалуженого (С1С6)алкоксикарбонілу, оксо, тіоксо, лінійного або розгалуженого (С1-С6)алкілтіо, карбокси, лінійного або розгалуженого (С1-С6)ацилу, лінійного або розгалуженого (С1-С6)полігалоалкокси, гідрокси, ціано, нітро, аміно (необов'язково заміщеного однією або більше лінійними або розгалуженими (С1-С6)алкільними або лінійними або розгалуженими (С1-С6)ацильними групами), амінокарбонілу (необов'язково заміщеного однією або більше лінійними або розгалуженими (С1С6)алкільними групами), аміносульфонілу (необов'язково заміщеного однією або більше лінійними або розгалуженими (С1-С6)алкільними групами), моноабо ді(трифторметилсульфоніл)аміно, PO(ORa)(ORb) (де Ra і Rb, які можуть бути однаковими або різними, являють собою атом водню або лінійну або розгалужену (С1-С6)алкільну групу), бензилокси і фенілу (необов'язково заміщених однією або більше однаковими або різними групами, вибраними з галогену, лінійного або розгалуженого (С1-С6)алкілу, лінійного або розгалуженого (С1-С6)пергалоалкілу, гідрокси або лінійного або розгалуженого (С1-С6)алкокси). Серед фармацевтично прийнятних кислот можуть бути згадані, без будь-якого обмеження, хлористоводнева кислота, бромистоводнева кислота, сірчана кислота, фосфорна кислота, оцтова кислота, трифтороцтова кислота, молочна кислота, піровиноградна кислота, малонова кислота, янтарна кислота, глутарова кислота, фумарова кислота, винна кислота, малеїнова кислота, лимонна кислота, аскорбінова кислота, метансульфонова кислота, камфорна кислота і т.д. Серед фармацевтично прийнятних основ можуть бути згадані, без будь-якого обмеження, гідроксид натрію, гідроксид калію, триетиламін, трет-бутиламін і т.д. 13 82182 Група переважно знаходиться у положенні b фенілу, який її містить. Перевага віддається R1a і R2 групам, які являють собою атоми водню. Група переважно знаходиться у мета- або пара-положенні структури фенокси кільця, яке її містить. X переважно являє собою NR6R7 або S(O)nR8 групу або гетероциклічну групу. Більш конкретно, група X переважно являє собою NR6R7 групу, де R6 являє собою атом водню або S(O)pR9 групу і R7 являє собою атом водню, такий як, наприклад, групи NHSO2Me, NHSO2iPr, NHSO2CF3, NH2. Переважні сполуки винаходу являють собою сполуки, де А являє собою атом азоту і, разом з розташованою поряд -CHR3 14 (IV) де R'1 і R'2 є такими, як визначено вище, яку потім циклізують у середовищі основи для одержання сполуки формули (V): (V) де R'1, R'2 і m є такими, як визначено вище, яку необов'язково піддають відновленню, у середовищі спирту або диметилформаміду, у присутності боргідриду натрію, для одержання сполуки формули (VI): (VI) групою, утворює кільце , де m являє собою 1, 2 або 3, переважно 1. Переважні сполуки винаходу являють собою: {3-[(5,5-діоксидо-2,3,3а,4-тетрагідро-1Нпіроло[2,1-с][1,2,4]бензотіадіазин-7іл)окси]феніл}метанамін, N-{3-[(5,5-діоксидо-2,3,3а,4-тетрагідро-1Hпіроло[2,1-с][1,2,4]бензотіадіазин-7-іл)окси]бензил}метансульфонамід, N-{4-[(5,5-діоксидо-2,3,3а,4-тетрагідро-1Нгароло[2,1-с][1,2,4]бензотіадіазин-7-іл)окси]бензил}метансульфонамід. Винахід також відноситься до способів приготування сполук формули (І). Спосіб приготування сполук формули (І), де А являє собою NR4 групу або А являє собою атом азоту і, разом з розташованою поряд CHR3 де R'1, R'2 і m є такими, як визначено вище, де сполуку формули (V) або (VI) піддають дії триброміду бору для одержання сполуки формули (VII): (VII) де R2 є таким, як визначено для формули (І), і m є таким, як визначено вище, (b) або циклізують: - у присутності амідину формули (VIII): (VIII) групою, утворює кільце , де m являє собою 1, 2 або 3, який відрізняється тим, що як вихідний матеріал використовують сполуку формули (II): де R3 є таким, як визначено для формули (І), для одержання сполуки формули (IX): (IX) (II) де R'1, R'2 і R3 є такими, як визначено вище, де: R'1 являє собою лінійну або розгалужену (С1С6)алкоксигрупу, R'2 являє собою атом водню, атом галогену або лінійну або розгалужену (C1С6)алкоксигрупу, яку: (а) або піддають реакції з кислотним хлоридом формули (III) у присутності основи, у середовищі тетрагідрофурану або ацетонітрилу: СІ-СН2-(СН2)m-СН2-СОСІ (III) де m є таким, як визначено для формули (І), для одержання сполуки формули (IV): яку: або відновлюють, використовуючи металевий гідрид, для одержання сполуки формули (X): (X) де R'1, R'2 і R3 є такими, як визначено вище, - або алкілують шляхом дії сильної основи у присутності алкілуючого агенту R'4X, де R'4 являє собою лінійну або розгалужену (С1-С6)алкільну 15 82182 групу і X являє собою атом галогену, і потім відновлюють для одержання сполуки формули (XI): (XI) де R'1, R'2, R3 і R'4 є такими, як визначено вище, - у присутності альдегіду формули (XII): (XII) де R3 є таким, як визначено для формули (І), для одержання сполуки формули (X), описаної вище, де сполуку формули (X) або (XI) групу R'1 і, коли група R'2 являє собою лінійну або розгалужену (С1-С6)алкоксигрупу, групу R'2 перетворюють у гідроксигрупи для одержання сполуки формули (XIII): 16 де сполуки формул (I/a1) і (І/а2): очищують, якщо необхідно, відповідно до звичайної техніки очищення, розділяють, якщо бажано, на їх ізомери відповідно до звичайної техніки розділення і перетворюють, якщо бажано, у їх адитивні солі з фармацевтично прийнятною кислотою або основою. Спосіб приготування сполук формули (І), де А являє собою CR4R5 групу, який відрізняється тим, що як вихідний матеріал використовують сполуку формули (XV): (XV) де: R'1 являє собою лінійну або розгалужену (С1С6)алкоксигрупу, R'2 являє собою атом водню, атом галогену або лінійну або розгалужену (С1-С6)алкоксигрупу, яку піддають дії хлорацетону у присутності диметилформаміду для одержання сполуки формули (XVI): (XIII) (XVI) де R2, R3 і R4 є такими, як визначено для формули (І), де сполуку формули (VII) або (ХIII) піддають реакції з бороновою кислотою сполуки формули (XIV): де R'1 і R'2 є такими, як визначено вище, яку піддають перегрупуванню у середовищі основи для одержання сполуки формули (XVII): (XIV) (XVII) де R"1 являє собою ціано групу або R1R1aXCгрупу як визначено для формули (І), для одержання (після необов'язкового перетворення групи R"1, коли остання являє собою ціано групу, у NR6R7 групу як визначено для формули (І)) сполуки формули (І/а1) або (І/а2), конкретних варіантів сполуки формули (І): де R'1 і R'2 є такими, як визначено вище, яку деацетилюють шляхом нагрівання зі зворотним холодильником у середовищі бензолу у присутності надлишку етиленгліколю і каталітичної кількості р-толуолсульфонової кислоти для одержання сполуки формули (XVIII): (XVIII) (I/a1) де R1, R1a, R2, R3, R4 і X є такими, як визначено для формули (І), де R'1 і R'2 є такими, як визначено вище, яку піддають гідролізу у середовищі кислоти для одержання сполуки формули (ХІХа): (XIXa) (I/a2) де R1, R1a, R2, m і X є такими, як визначено для формули (І), де R'1 і R'2 є такими, як визначено вище, атом азоту якої необов'язково, в залежності від природи групи R3, що є бажаною, захищають захисною групою і яку потім, після обробки сильною основою, обробляють сполукою формули R'3-P» 17 82182 де R'3 являє собою лінійну або розгалужену (С1-С6)алкільну групу або (С3-С7)циклоалкільну групу і Ρ являє собою відхідну групу, для одержання, після зняття захисту атома азоту, сполуки формули (ХІХ'а): 18 для одержання сполуки формули (XXIII): (XXIII) де R'1, R'2 і R'3 є такими, як визначено вище, де сполуку формули (ХІХа) або (ХІХ'а), представлену формулою (XIX): де R'1, R'2, R3 і R'4 є такими, як визначено вище, і R'5 являє собою атом галогену, де сполуки формул (XX) - (XXIII), групу R'1 і, коли група R'2 являє собою лінійну або розгалужену (С1-С6)алкоксигрупу, групу R'2 перетворюють у гідроксигрупи для одержання сполуки формули (XXIV): (XIX) (XXIV) де R'1 і R'2 є такими, як визначено вище, і R3 є таким, як визначено для формули (І): - або піддають каталітичному відновленню для одержання сполуки формули (XX): де R2, R3, R4 і R5 є такими, як визначено для формули (І), де сполуку формули (XXIV) піддають реакції з бороновою кислотою сполуки формули (XIV): (XX) (XIV) (XIX'a) де R'1 і R'2 є такими, як визначено вище, - або перетворюють дією гідриду у спирт, гідроксигрупу якої перетворюють в атом галогену дією відповідного реагенту для одержання сполуки формули (XXI): де R"1 являє собою ціано групу або R1R1aXCгрупу як визначено для формули (І), для одержання (після необов'язкового перетворення групи R"1, коли остання являє собою ціано групу, у NR6R7 групу як визначено для формули (І)) сполуки формули (I/b), конкретного варіанту сполук формули (І): (XXI) (I/b) де R'1, R'2 і R3 є такими, як визначено вище, і R'5 являє собою атом галогену, - або піддають дії магнійорганічної сполуки R'4MgBr, де R'4 являє собою лінійну або розгалужену (С1-С6)алкільну групу, для одержання сполуки формули (ХІХb): (XIXb) де R'1, R'2, R3 і R'4 є такими, як визначено вище, де сполуку формули (ХІХb) - або піддають каталітичному відновленню для одержання сполуки формули (XXII): (XXII) де R'1, R'2, R3 і R'4 є такими, як визначено вище, - або її гідроксигрупу перетворюють в атом галогену дією відповідного реагенту де R1, R1a, R2, R3, R4, R5 і X є такими, як визначено для формули (І), де сполуку формули (І/b) очищують, якщо необхідно, відповідно до звичайної техніки очищення, розділяють, якщо бажано, на її ізомери відповідно до звичайної техніки розділення і перетворюють, якщо бажано, у її адитивні солі з фармацевтично прийнятною кислотою або основою. Винахід також відноситься до фармацевтичних композицій, які містять, як активний інгредієнт, сполуку формули (І) з одним або більше відповідними, інертними, нетоксичними ексципієнтами. Серед фармацевтичних композицій відповідно до винаходу можуть бути згадані більш конкретно ті, які прийнятні для орального, парентерального (внутрішньовенного або підшкірного) або назального введення, таблетки або драже, під'язикові таблетки, желатинові капсули, коржики, супозиторії, креми, мазі, дермальні гелі, ін'єктовані препарати, питні суспензії і т.д. 19 82182 Прийнятне дозування може розрізнятись в залежності від природи і складності захворювання, шляху введення, віку і ваги пацієнта і знаходиться в діапазоні від 1 до 500мг на день за одне або більше введень. Наступні приклади демонструють даний винахід і жодним чином не обмежують його об'єму. Як вихідні матеріали використовують продукти, які відомі або виготовляються відповідно до відомих способів приготування. Структури сполук, описані у Прикладах, були визначені відповідно до звичайної спектрофотометричної техніки (інфрачервоне випромінювання, ЯМР, мас-спектрометрія,...). Приклад 1: {3-[(5,5-Діоксидо-2,3,3а,4тетрагідро-1H-піроло[2,1-с][1,2,4]-бензотіадіазин-7іл)окси]феніл} метанамін гідрохлорид Стадія А: 2,3-Дигідро-1H-піроло[2,1с][1,2,4]бензотіадіазин-7-ол 5,5-діоксид Розчин ВВr3 (68,75ммол) у 25мл метиленхлориду краплями додавали до розчину, охолодженого до 0°С, 27,5ммол 7-метокси-2,3дигідро-1Н-піроло[2,1-с]-[1,2,4]бензотіадіазин 5,5діоксиду у 350мл метиленхлориду. Перемішування здійснювали при температурі навколишнього середовища протягом 24 годин. Реакційну суміш виливали у суміш льоду і води, і суспензію перемішували протягом 30хв. Осад відфільтровували, промивали декілька разів водою, фільтрували всмоктуванням і висушували у вакуумі для одержання очікуваного продукту. Точка плавлення: >300°С Підраховано Знайдено С% 50,41 50,00 Н% 4,23 4,19 N% 11,76 11,28 S% 13,46 13,41 Стадія В: 3-[(5,5-Діоксидо-2,3-дигідро-1Нпіроло[2,1-с][1,2,4]бензотіадіазин-7-іл)окси] бензонітрил Суспензію, яка складається з 7,06ммол продукту, одержаного на Стадії вище, 3ціанофенілборонової кислоти (11,02ммол), ацетату міді(ІІ) (11,02ммол), піридину (22,0ммол) і близько 500мг 4А молекулярних сит у 200мл метиленхлориду перемішували протягом 24 годин. Реакційну суміш розріджували шляхом додавання ще 100мл метиленхлориду і суспензію фільтрували. Фільтрат концентрували і потім вміщували прямо на колонку силікагелю, яку елюювали системою метиленхлорид/метанол 95/5. Фракції, які містять очікуваний продукт, об'єднували і випаровували, і залишок додавали у невелику кількість етилового ефіру. Після відфільтровування твердий, очікуваний продукт відновлювали у формі білого порошку. Точка плавлення: 229-233°С Елементний мікроаналіз: Підраховано Знайдено С% 60,17 59,42 Н% 3,86 3,96 N% 12,38 12,29 S% 9,45 9,63 20 Стадія С: {3-[(5,5-Діоксидо-2,3,3а,4-тетрагідро1H-піроло[2,1-с][1,2,4]-бензотіадіазин-7іл)окси]феніл}метанамінгідрохлорид 112мг (2,95ммол) LiAIH4 додавали, невеликими порціями, до розчину 0,58ммол продукту, одержаного на Стадії вище, у 20мл безводного ТГФ і суміш перемішували при температурі навколишнього середовища протягом 1год. Надлишок гідриду гідролізували шляхом послідовного додавання краплями 1,5мл ізопропанолу і 1,5мл насиченого водного розчину NaCl. Солі алюмінію відфільтровували і фільтрат випаровували досуха. Залишок хроматографували на колонці силікагелю, елююючи сумішшю СН2Сl2/ЕtOН/водн. NH3 95/5/0,5. Після випаровування фракцій, які містять амін, додавали меренгу в ефірний НСl. Розчин випаровували досуха і залишок повторно розчиняли у мінімальній кількості ізопропанолу. Очікуваний продукт викристалізовували і відновлювали фільтруванням. Точка плавлення: 145°С Елементний мікроаналіз: Підраховано Знайдено С% 53,47 53,09 Н% 5,28 5,34 N% 11,00 10,65 S% 8,40 8,30 Сl% 9,28 9,30 Приклад 2: N-{3-[(5,5-Діоксидо-2,3,3а,4тетрагідро-1H-піроло[2,1-с][1,2,4]-бензотіадіазин-7іл)окси]бензил}метансульфонамід Метансульфоновий ангідрид (0,20ммол), розчинений у 2мл СН2СІ 2, додавали краплями до розчину, охолодженого на льодяній бані, сполуки, одержаної у Прикладі 1 (0,136ммол) у 10мл СН2СІ 2, що містить 0,34ммол Et3N. Реакційну суміш перемішували при температурі навколишнього середовища протягом З годин. Реакційний розчин промивали водою і потім насичували NaCl і сушили над MgSO4. Після випаровування у вакуумі, залишок робили більш твердим шляхом порошкування в етиловому ефірі для одержання вказаного у заголовку продукту після фільтрування. Точка плавлення: 183-190°С. Елементний мікроаналіз: Підраховано Знайдено С% 51,06 51,09 Н% 5,00 5,33 N% 9,92 9,58 S% 15,14 15,55 Наступні Приклади готували відповідно до методик, описаних у Прикладах 1 або 2, починаючи з відповідних вихідних матеріалів. Приклад 3: N-{3-[5,5-Діоксидо-2,3,3a,4тетрагідро-1H-піроло[2,1-с][1,2,4]-бензотіадіазин-7іл)окси]бензил}ацетамід Точка плавлення: 58°С. Елементний мікроаналіз: Підраховано Знайдено С% 58,90 58,51 Н% 5,46 5,73 N% 10,85 10,36 S% 8,28 7,82 21 82182 Приклад 4: N-(1-{3-[(5,5-Діоксидо-2,3,3а,4тетрагідро-1Н-піроло[2,1-с][1,2,4]бензотіадіазин-7іл)окси]феніл } етил)ацетамід Приклад 5: N-(1-{3-[(5,5-Діоксидо-2,3,3а,4тетрагідро-1H-піроло[2,1-с][1,2,4]бензотіадіазин-7іл)окси]феніл}-1-фторетил)ацетамід Приклад 6: 3-[(5,5-Діоксидо-2,3,3а,4тетрагідро-1Н-піроло[2,1-с][1,2,4]-бензотіадіазин-7іл)окси]бензил ізопропіл сульфон Приклад 7: 1-{3-[(5,5-Діоксидо-2,3,3а,4тетрагідро-1Н-піроло[2,1-с][1,2,4]-бензотіадіазин-7іл)окси]феніл}етил ізопропіл сульфон Приклад 8: 1-{3-[(5,5-Діоксидо-2,3,3а,4тетрагідро-1H-піроло[2,1-с][1,2,4]-бензотіадіазин-7іл)окси]феніл}-1-фторетилізопропілсульфон Приклад 9: N-{3-[(5,5-Діоксидо-2,3,3а,4тетрагідро-1Н-піроло[2,1-с][1,2,4]-бензотіадіазин-7іл)окси]бензил}(трифтор)метансульфонамід Точка плавлення: 104-113°С. Елементний мікроаналіз: Підраховано Знайдено С% 45,28 46,20 Н% 3,80 3,87 N% 8,80 8,58 S% 13,43 13,84 Приклад 10: N-(1-{3-[(5,5-Діоксидо-2,3,3а,4тетрагідро-1Н-піроло[2,1-с][1,2,4]бензотіадіазин-7іл)окси]феніл}етил)(трифтор)метансульфонамід Приклад 11: N-(1-{3-[(5,5-Діоксидо-2,3,3а,4тетрагідро-1Н-піроло[2,1-с][1,2,4]бензотіадіазин-7іл)окси]феніл}-1-фторетил)(трифтор)метансульфонамід Приклад 12: N-{3-[(5,5-Діоксидо-2,3,3а,4тетрагідро-1H-піроло[2,1-с][1,2,4]бензотіадіазин-7іл)окси]бензил}-N-метилбензамід Приклад 13: N-(1-{3-[(5,5-Діоксидо-2,3,3а,4тетрагідро-1Н-піроло[2,1-с][1,2,4]бензотіадіазин-7іл)окси]феніл}етил)-N-метилбензамід Приклад 14: N-(1-{3-[(5,5-Діоксидо-2,3,3а,4тетрагідро-1H-піроло[2,1-с][1,2,4]бензотіадіазин-7іл)окси]феніл}-1-фторетил)-N-метилбензамід Приклад 15: 7-{[3-(1H-Імідазол-4іл)метил]фенокси}-2,3,3а,4-тетрагідро-1Нпіроло[2,1-с][1,2,4]бензотіадіазин 5,5-діоксид Приклад 16: 7-{3-[1-(1H-Імідазол-4іл)етил]фенокси}-2,3,3а,4-тетрагідро-1Нпіроло[2,1-с][1,2,4]бензотіадіазин 5,5-діоксид Приклад 17: 7-{3-[1-Фтор-1-(1Н-імідазол-4іл)етил]фенокси}-2,3,3а,4-тетрагідро-1Нпіроло[2,1-с][1,2,4]бензотіадіазин 5,5-діоксид Приклад 18: N-{3-[(5,5-Діоксидо-2,3,3а,4тетрагідро-1H-піроло[2,1-с][1,2,4]бензотіадіазин-7іл)окси]бензил}пропан-2-сульфонамід Точка плавлення: 112-118°С. Елементний мікроаналіз: Теоретично % Емпірично % С 53,20 53,36 Н 5,58 5,80 N 9,31 9,24 S 14,20 14,52 Приклад 19: 7-[3-(1H-Пірол-1ілметил)фенокси]-2,3,3а,4-тетрагідро-1Hпіроло[2,1-c][1,2,4]бензотіадіазин 5,5-діоксид 200мг (0,58ммол) продукту, одержаного у Прикладі 1, у формі вільного аміну, і 105μл 22 (0,81ммол) 2,5-диметокситетрагідрофурану додавали до двофазної суміші 2,5мл води, 0,95мл АсОН і 2,85мл дихлор-1,2-етану. Суміш перемішували при 80°С протягом 2 годин, дозволяли охолонути до температури навколишнього середовища і екстрагували СН2Сl2. Органічну фазу промивали насиченим водним розчином NaCl і сушили над MgSO4. Очікуваний продукт очищували на колонці силікагелю (СН2Сl2/гептан 75/25). Точка плавлення: 150-152°С. Елементний мікроаналіз: Теоретично % Емпірично % С 63,78 63,65 Н 5,35 5,28 N 10,63 10,38 S 8,11 8,41 Приклад 20: 1-{4-[(5,5-Діоксидо-2,3,3а,4тетрагідро-1Н-піроло[2,1-с][1,2,4]-бензотіадіазин-7іл)окси]феніл}метанамінгідрохлорид Використовують ту ж методику, що і для Прикладу 1, заміщуючи 3-ціанофенілборонову кислоту на Стадії В ізомером 4ціанофенілборонової кислоти. Точка плавлення: 165-172°С. Теоретично % Емпірично % С Н N 53,47 5,28 11,00 54,08 5,16 10,46 S 8,40 8,25 Cl 9,28 9,42 Приклад 21: Ν-{4-[(5,5-Діоксидо-2,3,3а,4тетрагідро-1Н-піроло[2,1-с][1,2,4]-бензотіадіазин-7іл)окси]бензил}метансульфонамід Використовують ту ж методику, що і для Прикладу 2, починаючи зі сполуки, одержаної у Прикладі 20. Точка плавлення: 165-172°С. Елементний мікроаналіз: Теоретично % Емпірично % С 51,05 51,24 Н 5,00 5,45 N 9,92 9,17 S 15,14 14,94 Два енантіомери Прикладу 21 розділяли шляхом хіральної хроматографії на колонці Chiralpak AD®. Елюент: CH3CN/iPrOH/DEA 1000/2/1. Два енантіомери зазначені у Прикладах 22 і 23 в порядку, в якому їх елюювали згідно з вищезазначеними умовами. Приклад 22: N-{4-[(5,5-Діоксидо-2,3,3а,4тетрагідро-1H-піроло[2,1-с][1,2,4]-бензотіадіазин-7іл)окси]бензил}метансульфонамід, енантіомер 1 Елементний мікроаналіз: Теоретично % Емпірично % С 51,05 50,48 Н 5,00 5,08 N 9,92 9,63 S 15,14 15,53 Приклад 23: N-{4-[(5,5-Діоксидо-2,3,3а,4тетрагідро-1H-піроло[2,1-с][1,2,4]-бензотіадіазин-7іл)окси]бензил}метансульфонамід, енантіомер 2 Елементний мікроаналіз: С Н N S 23 Теоретично % Емпірично % 51,05 50,77 82182 5,00 5,06 9,92 9,70 15,14 15,47 Приклад 24: N-(4-[(5,5-Дюксидо-2,3,3а,4тетрапдро-1Н-піроло-[2,1-c][1,2,4]-бензотіадіазин7-іл)окси]бензил}ацетамід Використовують ту ж методику, що і для Прикладу 2, заміщуючи метансульфоновий ангідрид ацетилхлоридом і використовуючи як вихідний матеріал амін, одержаний у Прикладі 20. Точка плавлення: 158-161°С Елементний мікроаналіз: Теоретично % Емпірично % С 58,90 58,85 Н 5,46 5,69 N 10,85 10,65 S 8,28 8,51 Приклад 25: N-{4-[(5,5-Діоксидо-2,3,3а,4тетрагідро-1H-піроло[2,1-с][1,2,4]-бензотіадіазин-7іл)окси]бензил}-2,2,2-трифторацетамід Використовують ту ж методику, що і для Прикладу 2, заміщуючи метансульфоновий ангідрид трифтороцтовим ангідридом і використовуючи як вихідний матеріал амін, одержаний у Прикладі 20. Точка плавлення: 136-138°С Елементний мікроаналіз: Теоретично % Емпірично % С 51,70 51,84 Н 4,11 4,24 N 9,52 9,36 S 7,26 7,48 Приклад 26: N-{3-[(5,5-Діоксидо-2,3,3а,4тетрагідро-1H-піроло[2,1-с][1,2,.4]-бензотіадіазин7-іл)окси]бензил}-4-фторбензамід Використовують ту ж методику, що і для Прикладу 2, заміщуючи метансульфоновий ангідрид хлоридом 4-фторбензоїлу і використовуючи як вихідний матеріал амін, одержаний у Прикладі 20. Точка плавлення: 104-108°С Елементний мікроаналіз: Теоретично % Емпірично % С 61,66 61,41 Н 4,74 4,81 N 8,99 8,72 S 6,86 6,66 Приклад 27: 7-[4-(1Н-Тетразол-5ілметил)фенокси]-2,3,3а,4-тетрагідро-1Нпіроло[2,1-с][1,2,4]бензотіадіазин 5,5-діоксид Стадія А: {4-[(5,5-Діоксидо-2,3,3а,4-тетрагідро1H-піроло[2,1-с][1,2,4]-бензотіадіазин-7іл)окси]феніл}ацетонітрил Суспензію, яка містить 1,15г (4,77ммол) 2,3,3а,4-тетрагідро-1H-піроло[2,1-с][1,2,4]бензотіадіазин-7-олу 5,5-діоксид, 1,00г (6,21ммол) [4-(ціанометил)феніл]-боронової кислоти, 1,3г (7,15ммол) ацетату міді(ІІ), 1,16мл (14,31ммол) піридину і близько 500мг 4Å молекулярних сит у 200мл метиленхлориду, перемішували протягом ночі. Реакційну суміш розріджували додаванням ще 100мл метиленхлориду і суспензію фільтрували. Фільтрат концентрували і потім вміщували прямо 24 на колонку силікагелю, яку елюювали системою метиленхлорид/метанол 99/1. Фракції, які містять очікуваний продукт, об'єднували і випаровували, і залишок додавали у невелику кількість етилового ефіру. Після відфільтровування твердий, вказаний у заголовку продукт одержували у формі бежевого порошку. Точка плавлення: 156-158°С Стадія В: 7-[4-(1H-Тетразол-5ілметил)фенокси]-2,3,3а,4-тетрагідро-1Нпіроло[2,1-с][1,2,4]бензотіадіазин 5,5-діоксид Суспензію 300мг (0,844ммол) одержаного на Стадії А продукту, 164мг (2,53ммол) азиду натрію і 113мг (2,11ммол) NH4CI у 3мл DMF перемішували при 110°С протягом 24 годин. Реакційній суміші давали охолонути до температури навколишнього середовища і виливали її у 20мл 1N HCl. Проводили екстрагування (АсОЕt), сушіння (MgSO4) і випаровування досуха. Залишок порошкували у Et2O і осад відфільтровували для одержання вказаного у заголовку продукту. Точка плавлення: 209-212°С Елементний мікроаналіз: Теоретично % Емпірично % С 54,26 54,18 Н 4,55 4,44 N 21,09 20,67 S 8,05 8,05 Приклад 28: 3-{4-[(5,5-Діоксидо-2,3,3а,4тетрагідро-1Н-піроло[2,1-с][1,2,4]-бензотіадіазин-7іл)окси]бензил}-1,2,4-оксадіазол-5(4Н)-тіон Стадія А: 2- {4-[(5,5-Діоксидо-2,3-дигідро- 1Нпіроло[2,1-с][1,2,4]-бензотіадіазин-7-іл)окси]феніл}N'-гідроксіетанімідамід 2,51мл (18,0ммол) триетиламіну додавали до розчину 1,25г (18,0ммол) гідроксиламін гідрохлориду у 4мл DMSO і суспензію перемішували протягом 10хв. Осад відфільтровували і фільтрат концентрували. 992мг (3,00ммол) продукту Стадії А Прикладу 27 додавали до фільтрату і розчин перемішували при 75°С протягом 1 години 30хв. Розчину давали охолонути до температури навколишнього середовища, і осад реакційної суміші заміняли, використовуючи воду. Осад відфільтровували для одержання вказаного у заголовку продукту. Стадія В: 3-{4-[(5,5-Діоксидо-2,3-дигідро-1Нпіроло[2,1-с][1,2,4]-бензотіадіазин-7іл)окси]бензил}-1,2,4-оксадіазол-5(4Н)-тіон 348мг (1,95ммол) 1,1'-тіокарбонілдіімідазолу і потім 530μл (3,516ммол) ДБУ додавали до суспензії одержаного на Стадії А продукту (330мг, 0,85ммол) у 8мл CH3CN. Реакційний розчин перемішували при температурі навколишнього середовища протягом ночі. 20мл 1N HCl додавали; проводили екстрагування (СН2СІ 2), промивання (насиченим NaCl), сушіння (MgSO4) і випаровування досуха. Вказаний у заголовку продукт одержували у формі жовтого воску, який використовували у сирому вигляді на наступній Стадії. Стадія С: 3-{4-[(5,5-Діоксидо-2,3,3а,4тетрагідро-1Н-піроло[2,1-с][1,2,4]-бензотіадіазин-7іл)окси]бензил }-1,2,4-оксадіазол-5(4Н)-тіон 25 82182 Одержаний на Стадії В продукт (290мг, 0,68ммол) в етанолі (12мл) у присутності NaBH4 (77мг, 2,03ммол) перемішували при температурі навколишнього середовища протягом 1год. Додавали 10мл 1N HCl і проводили екстрагування (СН2Сl2). Вказаний у заголовку продукт очищували шляхом хроматографії на колонці силікагелю (СН2Сl2/МеOН 99/1). Точка плавлення: 124-126°С Елементний мікроаналіз: Теоретично % Емпірично % С 53,01 53,05 Н 4,21 4,37 N 13,01 12,32 S 14,90 15,20 Приклад 29: N-(1-{4-[(5,5-Діоксидо-2,3,3а,4тетрагідро-1H-піроло[2,1-с][1,2,4]бензотіадіазин-7іл)окси]феніл}етил)метансульфонамід Стадія А: 1-{4-[(5,5-Діоксидо-2,3,3а,4тетрагідро-1Н-піроло[2,1-с][1,2,4]-бензотіадіазин-7іл)окси]феніл}етанон Суспензію, яка містить 3,0г (12,48ммол) 2,3,3а,4-тетрагідро-1H-піроло[2,1-с][1,2,4]бензотіадіазин-7-олу 5,5-діоксид, 3,18г (18,73ммол) (4-ацетилфеніл)боронової кислоти, 3,42г (18,82ммол) ацетату міді(ll), 3,03мл (37,15ммол) піридину і близько 500мг 4Å молекулярних сит у 150мл метиленхлориду перемішували протягом ночі. Реакційну суміш розріджували додаванням ще 100мл метиленхлориду і суспензію фільтрували. Фільтрат концентрували і потім вміщували прямо на колонку силікагелю, яку елюювали системою СН2Сl2/ацетон 99/1. Фракції, які містять очікуваний продукт, об'єднували і випаровували, і залишок додавали в етиловий ефір. Після відфільтровування твердий, вказаний у заголовку продукт відновлювали у формі білого порошку. Точка плавлення: 152-154°С Стадія В: (1-{4-[(5,5-Діоксидо-2,3,3а,4тетрагідро-1Н-троло[2,1-с][1,2,4]-бензотіадіазин-7іл)окси]феніл}етил)амін 1,65мл (5,63ммол) ізопропоксиду титану(IV) додавали краплями до розчину 1,0г (2,80ммол) одержаного на Стадії А продукту у 5мл 7N аміачного метанолу. Перемішування проводили при температурі навколишнього середовища протягом ночі, додавали 424мг (11,20ммол) NaBH4 і перемішування продовжували ще протягом 2год. Осад реакційної суміші здійснювали шляхом додавання води (2-3мл); білий осад відфільтровували. Фільтрат відкладали. Сад суспендували у AcOEt, перемішування проводили протягом 30 хвилин і проводили фільтрування. Фільтрат об'єднували з першим фільтратом і продовжували виділення AcOEt. Органічні фази об'єднували, промивали (насиченим NaCl), сушили (MgSO4) і випаровували у вакуумі для одержання вказаного у заголовку продукту. Стадія С: N-(1-{4-[(5,5-Діоксидо-2,3,3а,4тетрагідро-1Н-піроло[2,1-с][1,2,4]-бензотіадіазин-7іл)окси]феніл}етил)метансульфонамід Використовують ту ж методику, що і для Прикладу 2, використовуючи як вихідний матеріал продукт зі стадії В вище. 26 Точка плавлення: 122-127°С Елементний мікроаналіз: Теоретично % Емпірично % С 52,16 51,93 Н 5,30 5,81 N 9,60 9,32 S 14,66 14,59 Приклад 30: N-(1-{3-[(5,5-Діоксидо-2,3,3а,4тетрагідро-1Н-піроло[2,1-с][1,2,4]бензотіадіазин-7іл)окси]феніл}етил)метансульфонамід Використовують ту ж методику, що і для Стадій А, В і С Прикладу 29, заміщуючи (4ацетилфеніл)боронову кислоту на Стадії А (3ацетилфеніл)бороновою кислотою. Точка плавлення: 83-84°С Елементний мікроаналіз: Теоретично % Емпірично % С 52,16 52,03 Н 5,30 5,28 N 9,60 9,20 S 14,66 14,81 Приклад 31: N-(4-[(5,5-Діоксидо-2,3,3а,4тетрагідро-1Н-піроло[2,1-с][1,2,4]-бензотіадіазин-7іл)окси]бензил}-N-метилметансульфонамід Суспензію, яка містить 5,74мг (3,37ммол) 2,3,3а,4-тетрагідро-1H-піроло[2,1с][1,2,4]бензотіадіазин-7-олу 5,5-діоксид, 926мг (4,04ммол) (4-{[метил(метилсульфоніл)аміно]метил}феніл)боронової кислоти, 920мг (5,06ммол) ацетату міді(ІІ), 817μл (10,10ммол) піридину і близько 4г 4Å молекулярних сит у 50мл СН2СІ 2 перемішували протягом ночі. Реакційну суміш фільтрували, промиваючи СН2СІ 2/МеOН (1/1). Фільтрат коцентрували і потім вміщували прямо на коронку силікагелю, яку елюювали системою СН2Сl2/МеOН 95/5. Фракції, які містять очікуваний продукт, об'єднували і випаровували, і залишок додавали в етиловий ефір. Після відфільтровування твердий, вказаний у заголовку продукт відновлювали у формі білого порошку. Точка плавлення: 142-144°С Елементний мікроаналіз: Теоретично % Емпірично % С 52,16 51,99 Н 5,30 5,55 N 9,60 9,43 S 14,66 14,66 Приклад 32: {3-[(5,5-Діоксидо-2,3,3а,4тетрагідро-1Н-піроло[2,1-с][1,2,4]-бензотіадіазин-7іл)окси]бензил} диметиламін Стадія А: Метил 3-[(5,5-Діоксидо-2,3-дигідро1Н-піроло[2,1-с][1,2,4]-бензотіадіазин-7іл)окси]бензоат Використовують ту ж методику, що і для Стадії В Прикладу 1, використовуючи як вихідні матеріали сполуку, одержану на Стадії А Прикладу 1, і [3-(метоксикарбоніл)феніл]боронову кислоту. Точка плавлення: 211-214°С Елементний мікроаналіз: Теоретично % Емпірично % С 58,06 57,70 Н 4,33 4,54 N 7,52 7,29 S 8,61 8,37 27 82182 Стадія В: 3-[3-(Аміносульфоніл)-4-(2оксопіролідин-1-іл)фенокси]бензойна кислота Суспензію одержаного на Стадії А продукту (1,1г, 2,55ммол) у 18мл 1N NaOH нагрівали при 95°С до одержання розчину. Розчину давали охолонути до температури навколишнього середовища, ацилювали з 1N HCl і екстрагували (СН2Сl2). Органічні фази об'єднували, промивали (насиченим NaCl), сушили (MgSO4) і випаровували. Залишок порошкувата у Et2O; вказаний у заголовку продукт випадав в осад, і його відновлювали фільтруванням. Стадія С: 3-[(2,3-Дигідро-5,5-діоксидо-1Нпіроло[2,1-с][1,2,4]бензотіадіазин-7іл)окси]бензойна кислота Суспензію одержаного на Стадії В продукту (850мг, 2,26ммол) у 25мл ТГФ у присутності 675μл (4,52ммол) ДБУ нагрівали із зворотним холодильником протягом 1год. Їй давали охолонути до температури навколишнього середовища і ацилювали з 1N HCl, і білий осад, відповідний вказаному у заголовку продукту, відфільтровували. Елементний мікроаналіз: Теоретично % Емпірично % С 56,98 57,15 Н 3,94 4,13 N 7,82 7,68 S 8,95 9,16 Стадія D: 3-[(5,5-Діоксидо-2,3-дигідро-1Нпіроло[2,1-с][1,2,4]бензотіадіазин-7-іл)окси]-N,Nдиметилбензамід До суспензії одержаного на Стадії С продукту (1,40г, 3,91ммол) у 20мл СН2Сl2 додавали 2 краплі DMF і потім, краплями, 684μл (7,81ммол) оксалілхлориду, розрідженого 2мл СН2Сl2. Перемішування проводили при температурі навколишнього середовища протягом 2год. 30хв.; проводили випаровування досуха; залишок додавали у 15мл СН2Сl2; додавали 1,1мл (7,81ммол) Et3N і потім 2,94мл (5,87ммол) 2М розчину диметиламіну у ТГФ. Перемішування проводили при температурі навколишнього середовища протягом 1год. Реакційну суміш ацилювали з 0,5N HCl і екстрагували (СН2Сl2). Органічні фази об'єднували, промивали (насиченим NaCl), сушили (MgSO4) і випаровували. Залишок порошкували у Еt2О; вказаний у заголовку продукт випадав в осад, і його відновлювали фільтруванням. Елементний мікроаналіз: Теоретично % Емпірично % С 59,21 59,23 Н 4,97 5,09 N 10,90 10,47 S 8,32 7,97 Стадія Е: {3-[(5,5-Діоксидо-2,3,3а,4-тетрагідро1H-піроло[2,1-с][1,2,4]-бензотіадіазин-7іл)окси]бензил}диметиламін 3,72мл (3,72ммол) 1М розчину LiAIH4 у ТГФ додавали краплями до суспензії 577мг (1,49ммол) одержаного на Стадії D продукту у 20мл ТГФ. Спостерігали, як реакційна суміш перетворюється в розчин, і перемішування проводили при 28 температурі навколишнього середовища протягом 3год. Надлишок гідриду гідролізували шляхом додавання краплями води доти, доки не припинялось виділення газу. Суспензію перемішували протягом 10хв., додавали 20мл води і проводили екстрагування AcOEt. Органічні фази об'єднували, промивали (насиченим NaCl), сушили (MgSO4) і випаровували, і залишок хроматографували на колонці силікагелю (СН2Сl2/МеОН 95/5) для одержання вказаного у заголовку продукту. Точка плавлення: 122°С Елементний мікроаналіз: Теоретично % Емпірично % С 61,10 61,32 Н 6,21 6,19 N 11,25 11,06 S 8,59 8,52 Фармакологічні дослідження продуктів за даним винаходом Дослідження збуджувальних токів, викликаних АМРА в ооцитах Xenopus а - Спосіб: мРНК одержували з кори головного мозку самців щурів Wistar способом гуанідин тіоціанат/фенол/хлороформ. Полі (А+) мРНК відділяли хроматографією на оліго-dT целюлозі та ін'єктували при рівні 50нг на ооцит. Ооцити інкубували протягом 2-3 днів при 18°С, щоб дозволити експресію рецепторів, і потім зберігали при 8-10°С. Проводили електрофізіологічну реєстрацію у камері Plexiglass® при 20-24°С у середовищі OR2 [J. Exp. Zool., 1973, 184, 321-334] способом "напруга-фіксація" з використанням двох електродів, з третім електродом, розміщеним у ванні, яка служить як зразок. Всі сполуки вводили через середовище інкубації і електричний струм вимірювали в кінці періоду введення. АМРА використовували у концентрації 10μΜ. Для кожної досліджуваної сполуки визначали концентрацію, яка подвоює (ЕС2Х) або збільшує у п'ять разів (ЕС5Х) силу струму, викликаного самим АМРА (від 5 до 50нА). b - Результати: Сполуки за даним винаходом підсилюють збуджувальні ефекти АМРА до дуже значних рівнів і їх активність є дуже переважною у порівнянні зі сполуками, на які є посилання. Сполука Прикладу 1, особливо, має значення ЕС2Х на рівні 3,5μΜ і значення ЕС5Х на рівні 9,2μΜ, сполука Прикладу 2 має значення ЕС2Х на рівні 0,35μΜ і значення ЕС5Х на рівні 2,6μΜ і сполука Прикладу 21 має значення ЕС2Х на рівні 0,1μΜ і значення ЕС5Х на рівні 0,56μΜ. Фармакологічна композиція: Формула для приготування 1000 таблеток, кожна з яких містить 100мг N{3-[(5,5-діоксидо-2,3,3а,4-тетрагідро-1Нпіроло[2,1-с][1,2,4]бензотіадіазин-7іл)окси]бензил}матенсульфонамід (Приклад 2) 100g гідроксипропілцелюлоза 2g пшеничний крохмаль 10g лактоза 100g 29 стеарат магнію тальк 82182 3g 3g. 30
ДивитисяДодаткова інформація
Назва патенту англійськоюDerivatives of benzothiazine and benzothiadiazine, process for preparation thereof and pharmaceutical composition containing thereof
Автори англійськоюDesos Patrice, Lestage Pierre
Назва патенту російськоюПроизводные бензотиазина и бензотиадиазина, способ их получения и фармацевтическая композиция, которая их содержит
Автори російськоюДезо Патрис, Лестаж Пьер
МПК / Мітки
МПК: A61K 31/542, C07D 279/00, A61K 31/5415, A61P 25/28, C07D 513/04, A61K 31/549, C07D 285/28
Мітки: фармацевтична, містить, яка, бензотіадіазину, похідні, бензотіазину, композиція, спосіб, одержання
Код посилання
<a href="https://ua.patents.su/15-82182-pokhidni-benzotiazinu-i-benzotiadiazinu-sposib-kh-oderzhannya-i-farmacevtichna-kompoziciya-yaka-kh-mistit.html" target="_blank" rel="follow" title="База патентів України">Похідні бензотіазину і бензотіадіазину, спосіб їх одержання і фармацевтична композиція, яка їх містить</a>
Попередній патент: Фарбовий набір, друкований виріб, спосіб друкування та застосування барвника
Наступний патент: Бункер для сипучих матеріалів
Випадковий патент: Аналоги камптотецину, спосіб їх отримання (варіанти) і фармацевтична композиція