Похідні бензотіазину і бензотіадіазину, спосіб їх одержання і фармацевтична композиція, що їх містить
Формула / Реферат
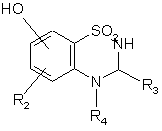
1. Сполука формули (І):
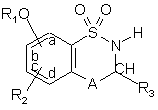 , (І)
, (І)
де:
R1 являє собою арил або гетероарильну групу,
R2 являє собою атом водню, атом галогену або гідроксигрупу,
А являє собою CR4R5 групу або NR4 групу,
R3 являє собою атом водню, лінійну або розгалужену (С1-С6)алкільну групу або (С3-С7)циклоалкільну групу,
R4 являє собою атом водню або лінійну або розгалужену (С1-С6)алкільну групу, або
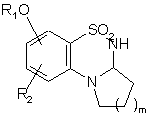
А являє собою атом азоту і, разом з розташованою поряд -СНR3-групою, утворює кільце 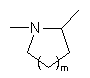 , де m являє собою 1, 2 або 3,
, де m являє собою 1, 2 або 3,
R5 являє собою атом водню або галогену,
її ізомери і її адитивні солі з фармацевтично прийнятною кислотою або основою,
- термін "арильна група", означає ароматичну моноциклічну групу або біциклічну групу, в якій щонайменше одне з кілець є ароматичним, необов'язково заміщену однією або більше однаковими або різними групами, вибраними з галогену, лінійного або розгалуженого (С1-С6)алкілу (необов'язково заміщеного однією або більше гідроксигрупами), лінійного або розгалуженого (С1-С6)алкокси, лінійного або розгалуженого (С1-С6)пергалоалкілу, лінійного або розгалуженого (С1-С6)алкоксикарбонілу, лінійного або розгалуженого (С1-С6)алкілтіо, карбокси, лінійного або розгалуженого (С1-С6)ацилу, лінійного або розгалуженого (С1-С6)пергалоалкокси, гідрокси, ціано, нітро, аміно (необов'язково заміщеного однією або більше лінійними або розгалуженими (С1-С6)алкільними або лінійними або розгалуженими (С1-С6)ацильними групами), амінокарбонілу (необов'язково заміщеного однією або більше лінійними або розгалуженими (С1-С6)алкільними групами), аміносульфонілу (необов'язково заміщеного однією або більше лінійними або розгалуженими (С1-С6)алкільними групами), моно- або ді-((С1-С6)алкілсульфоніл)аміно, моно- або ді-(трифторметилсульфоніл)аміно, PO(ORa)(ORb) (де Ra і Rb, які можуть бути однаковими або різними, являють собою атом водню або лінійну або розгалужену (С1-С6)алкільну групу), бензилокси і фенілу (необов'язково заміщених однією або більше однаковими або різними групами, вибраними з галогену, лінійного або розгалуженого (С1-С6)алкілу, лінійного або розгалуженого (С1-С6)пергалоалкілу, гідрокси або лінійного або розгалуженого (С1-С6)алкокси);
- термін "гетероарильна група" означає ароматичну моноциклічну або біциклічну групу, в якій щонайменше одне з кілець є ароматичним, що містить один, два або три однакових або різних гетероатоми, вибрані з азоту, кисню і сірки, необов'язково заміщену однією або більше однаковими або різними групами, вибраними з галогену, лінійного або розгалуженого (С1-С6)алкілу, лінійного або розгалуженого (С1-С6)алкокси, лінійного або розгалуженого (С1-С6)пергалоалкілу, лінійного або розгалуженого (С1-С6)алкоксикарбонілу, карбокси, лінійного або розгалуженого (С1-С6)ацилу, лінійного або розгалуженого (С1-С6)пергалоалкокси, гідрокси, ціано, нітро, аміно (необов'язково заміщеного однією або більше лінійними або розгалуженими (С1-С6)алкільними групами), аміносульфонілу (необов'язково заміщеного однією або більше лінійними або розгалуженими (С1-С6)алкільними групами) і (С1-С6)алкілсульфоніламіно.
2. Сполука формули (І) за п. 1, де R2 являє собою атом водню.
3. Сполука формули (І) за п. 1 або 2, де група R1 знаходиться у положенні b фенілу, який її містить.
4. Сполука формули (І) за п. 1, 2 або 3, де група R1 являє собою необов'язково заміщену фенільну групу.
5. Сполука формули (І) за будь-яким з пп. 1-4, де А являє собою атом азоту і, разом з розташованою поряд -СНR3-групою, утворює кільце  , де m являє собою 1, 2 або 3, переважно 1.
, де m являє собою 1, 2 або 3, переважно 1.
6. Сполука формули (І) за п. 1, яка являє собою 7-(3-метилфенокси)-2,3,3а,4-тетрагідро-1Н-піроло[2,1-с][1,2,4]-бензотіадіазин 5,5-діоксид, а також її ізомери.
7. Сполука формули (І) за п. 1, яка являє собою 3-[(5,5-діоксидо-2,3,3а,4-тетрагідро-1Н-піроло[2,1-с][1,2,4]бензотіадіазин-7-іл)окси]бензойну кислоту, а також її ізомери.
8. Сполука формули (І) за п. 1, яка являє собою 3-[(5,5-діоксидо-2,3,3а,4-тетрагідро-1Н-піроло[2,1-с][1,2,4]бензотіазин-7-іл)оксі]анілін, а також її ізомери.
9. Сполука формули (І) за п. 1, яка являє собою N-[3-(5,5-діоксидо-2,3,3а,4-тетрагідро-1Н-піридо[2,1-с][1,2,4]бензотіазин-7-іл)окси]феніл]метансульфонамід.
10. Сполука формули (І) за п. 1, яка являє собою етилводень 3-[(5,5-діоксидо-2,3,3а,4-тетрагідро-1Н-піроло[2,1-с][1,2,4]бензотіадіазин-7-іл)окси]фенілфосфонат, а також її ізомери.
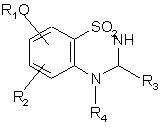
11. Спосіб одержання сполук формули (І), де А являє собою NR4 групу або А являє собою атом азоту і, разом з розташованою поряд СНR3 групою, утворює кільце  , де m являє собою 1, 2 або 3, який відрізняється тим, що як вихідний матеріал використовують сполуку формули (II):
, де m являє собою 1, 2 або 3, який відрізняється тим, що як вихідний матеріал використовують сполуку формули (II):
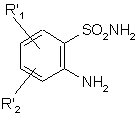 , (ІІ)
, (ІІ)
де:
R'1 являє собою лінійну або розгалужену (С1-С6)алкоксигрупу,
R'2 являє собою атом водню, атом галогену або лінійну чи розгалужену (С1-С6)алкоксигрупу,
яку:
(а) або піддають реакції з кислотним хлоридом формули (III) у присутності основи, у середовищі тетрагідрофурану або ацетонітрилу:
Сl-СН2-(СН2)m-СН2-СОСl, (ІІІ)
де m є таким, як визначено для формули (І), для одержання сполуки формули (IV):
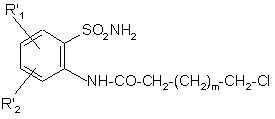 , (IV)
, (IV)
де R'1 i R'2 є такими, як визначено вище,
яку потім циклізують в основному середовищі для одержання сполуки формули (V):
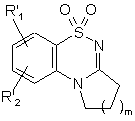 , (V)
, (V)
де R'1, R'2 і m є такими, як визначено вище,
яку піддають відновленню у середовищі спирту або диметилформаміду у присутності боргідриду натрію з одержанням сполуки формули (VI):
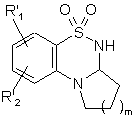 , (VI)
, (VI)
де R'1, R'2 і m є такими, як визначено вище,
де сполуку формули (V) або (VI) піддають дії триброміду бору
з одержанням сполуки формули (VII):
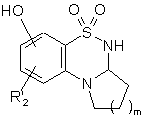 , (VII)
, (VII)
де R2 і m є таким, як визначено вище,
(b) або циклізують:
у присутності амідину формули (VIII):
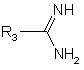 , (VIII)
, (VIII)
де R3 є таким, як визначено для формули (І), з одержанням сполуки формули (IX):
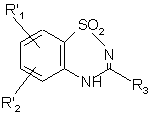 , (IX)
, (IX)
де R'1, R'2 і R3 є такими, як визначено вище, яку:
або відновлюють, використовуючи металевий гідрид, з одержанням сполуки формули (X):
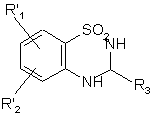 , (X)
, (X)
де R'1, R'2 і R3 є такими, як визначено вище,
або алкілують шляхом дії сильної основи у присутності алкілуючого агента R'4X, де R'4 являє собою лінійну або розгалужену (С1-С6)алкільну групу і Х являє собою атом галогену, і потім відновлюють
з одержанням сполуки формули (XI):
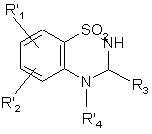 , (XI)
, (XI)
де R'1, R'2, R3 і R'4 є такими, як визначено вище,
у присутності альдегіду формули (XII):
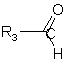 , (XII)
, (XII)
де R3 є таким, як визначено для формули (І),
з одержанням сполуки формули (X), описаної вище,
групу R'1 і групу R'2, коли вона являє собою лінійну або розгалужену (С1-С6)алкоксигрупу, сполуки формули (X) або (XI) перетворюють у гідроксигрупи для одержання сполуки формули (XIII):
 , (XIII)
, (XIII)
де R2, R3 і R4 є такими, як визначено для формули (І),
де сполуку формули (VII) або (XIII) піддають реакції з бороновою кислотою сполуки формули (XIV):
R1В(ОН)2, (XIV)
де R1 є таким, як визначено для формули (І),
з одержанням сполуки формули (І/a1) або (І/а2), конкретних варіантів сполук формули (І):
 , (I/a1)
, (I/a1)
де R1, R2, R3 і R4 є такими, як визначено для формули (І),
 , (I/a2)
, (I/a2)
де R1, R2 і m є такими, як визначено для формули (І),
де сполуки формул (І/а1) і (І/а2):
піддають, якщо необхідно, звичайним перетворенням відносно замісників групи R1,
якщо необхідно, очищують відповідно до звичайної техніки очищення, необов'язково розділяють, на їх ізомери відповідно до звичайної техніки розділення і перетворюють, якщо бажано, у їх адитивні солі з фармацевтично прийнятною кислотою або основою.
12. Спосіб одержання сполук формули (І), де А являє собою CR4R5 групу, який відрізняється тим, що як вихідний матеріал використовують сполуку формули (XV):
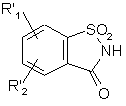 , (XV)
, (XV)
де:
R'1 являє собою лінійну або розгалужену (С1-С6)алкоксигрупу,
R'2 являє собою атом водню, атом галогену або лінійну або розгалужену (С1-С6)алкоксигрупу,
яку піддають дії хлорацетону у присутності диметилформаміду для одержання сполуки формули (XVI):
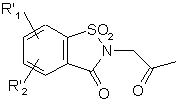 , (XVI)
, (XVI)
де R'1 і R'2 є такими, як визначено вище,
яку піддають перегрупуванню в основному середовищі з одержанням сполуки формули (XVII):
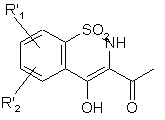 , (XVII)
, (XVII)
де R'1 і R'2 є такими, як визначено вище,
яку деацетилюють шляхом нагрівання у зворотному холодильнику у середовищі бензолу у присутності надлишку етиленгліколю і каталітичної кількості р-толуолсульфонової кислоти для одержання сполуки формули (XVIII):
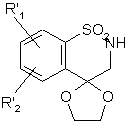 , (XVIII)
, (XVIII)
де R'1 і R'2 є такими, як визначено вище,
яку піддають гідролізу в кислотному середовищі з одержанням сполуки формули (ХІХа):
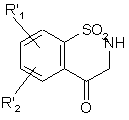 , (XIXa)
, (XIXa)
де R'1 i R'2 є такими, як визначено вище,
атом азоту якої необов'язково, в залежності від природи групи R3, що є бажаною, захищають захисною групою і яку потім, після обробки сильною основою, обробляють сполукою формули R'3-P,
де R'3 являє собою лінійну або розгалужену (С1-С6)алкільну групу або (С3-С7)циклоалкільну групу і Р являє собою відхідну групу,
з одержанням, після зняття захисту атома азоту, сполуки формули (ХІХ'а)
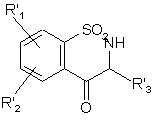 , (XIX'a)
, (XIX'a)
де R'1, R'2 і R'3 є такими, як визначено вище,
де сполуку формули (ХІХа) або (ХІХ'а), представлену формулою (XIX):
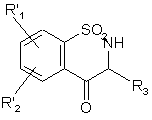 , (XIX)
, (XIX)
де R'1 і R'2 мають такі ж значення, і R3 є таким, як визначено для формули (І),
або піддають каталітичному відновленню з одержанням сполуки формули (XX):
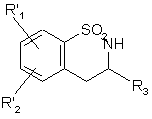 , (XX)
, (XX)
де R'1 і R'2 є такими, як визначено вище,
або перетворюють у спирт дією гідриду, гідроксигрупу якого перетворюють в атом галогену дією відповідного реагенту з одержанням сполуки формули (XXI):
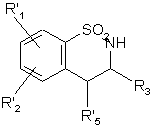 , (XXI)
, (XXI)
де R'1 i R'2 є такими, як визначено вище, і R'5 являє собою атом галогену,
або піддають дії магнійорганічної сполуки R'4MgBr, де R'4 являє собою лінійну або розгалужену (С1-С6)алкільну групу, з одержанням сполуки формули (ХІХb):
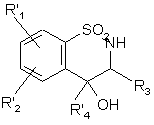 , (XIXb)
, (XIXb)
де R'1, R'2 і R'4 є такими, як визначено вище, де сполуку формули (ХІХb)
або піддають каталітичному відновленню з одержанням сполуки формули (XXII):
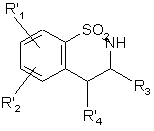 , (XXII)
, (XXII)
де R'1, R'2 і R'4 є такими, як визначено вище,
або її гідроксигрупу перетворюють в атом галогену дією відповідного реагенту
з одержанням сполуки формули (XXIII):
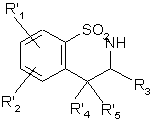 , (XXIII)
, (XXIII)
де R'1, R'2 і R'4 є такими, як визначено вище, і R'5 являє собою атом галогену,
групу R'1 і групу R'2, коли вона являє собою лінійну або розгалужену (С1-С6)алкоксигрупу, сполуки формул (XX)-(XXIII) перетворюють у гідроксигрупи
з одержанням сполуки формули (XXIV):
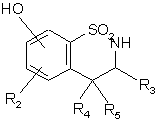 , (XXIV)
, (XXIV)
де R2, R4 і R5 є такими, як визначено для формули (І),
де сполуку формули (XXIV) піддають реакції з бороновою кислотою сполуки формули (XIV):
R1B(OH)2, (XIV)
де R1 є таким, як визначено для формули (І),
з одержанням сполуки формули (І/b), конкретного варіанта сполуки формули (І):
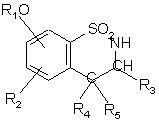 , (I/b)
, (I/b)
де R1, R2, R3, R4, R5 є такими, як визначено для формули (І),
де сполуку формули (І/b) піддають, якщо необхідно, звичайним перетворюванням відносно замісників групи R1,
очищують, якщо необхідно, відповідно до звичайної техніки очищення, необов'язково розділяють на її ізомери відповідно до звичайної техніки розділення і перетворюють, якщо бажано, у її адитивні солі з фармацевтично прийнятною кислотою або основою.
13. Фармацевтична композиції, яка містить як активний інгредієнт сполуку, вказану в будь-якому з пп. 1-10, у поєднанні з одним або більше фармацевтично прийнятними, інертними, нетоксичними ексципієнтами або носіями.
14. Фармацевтична композиції за п. 13, яка містить як активний інгредієнт сполуку, вказану в будь-якому з пп. 1-10, для застосування як лікарських засобів, таких як АМРА модулятори.
Текст
1. Сполука формули (І): O O R1O S H a N b c d CH A R3 R2 , (І) де: R1 являє собою арил або гетероарильну гр упу, R2 являє собою атом водню, атом галогену або гідроксигрупу, А являє собою CR4R5 гр уп у або NR4 гр упу, R3 являє собою атом водню, лінійну або розгалужену (С1-С6)алкільну групу або (С3С7)циклоалкільну гр упу, 2 (13) 1 3 77737 4 групами), амінокарбонілу (необов'язково заміщес][1,2,4]бензотіазин-7ного однією або більше лінійними або розгалужеіл)окси]феніл]метансульфонамід. ними (С1-С6)алкільними групами), аміносульфонілу 10. Сполука формули (І) за п. 1, яка являє собою (необов'язково заміщеного однією або більше ліетилводень 3-[(5,5-діоксидо-2,3,3а,4-тетрагідронійними або розгалуженими (С1-С6)алкільними 1Н-піроло[2,1-с][1,2,4]бензотіадіазин-7групами), моноабо ді-((С1іл)окси]фенілфосфонат, а також її ізомери. С6)алкілсульфоніл)аміно, моноабо ді11. Спосіб одержання сполук формули (І), де А (трифторметилсульфоніл)аміно, PO(ORa)(ORb) (де являє собою NR4 групу або А являє собою атом Ra і Rb, які можуть бути однаковими або різними, азоту і, разом з розташованою поряд СНR3 груявляють собою атом водню або лінійну або розгалужену (С1-С6)алкільну групу), бензилокси і фенілу N (необов'язково заміщених однією або більше однаковими або різними групами, вибраними з гало( )m пою, утворює кільце , де m являє согену, лінійного або розгалуженого (С1-С6)алкілу, бою 1, 2 або 3, який відрізняється тим, що як вилінійного або розгалуженого (С1-С6)пергалоалкілу, хідний матеріал використовують сполуку формули гідрокси або лінійного або розгалуженого (С1(II): С6)алкокси); R'1 - термін "гетероарильна група" означає ароматичSO 2NH 2 ну моноциклічну або біциклічну групу, в якій щонайменше одне з кілець є ароматичним, що містить один, два або три однакових або різних NH 2 гетероатоми, вибрані з азоту, кисню і сірки, необов'язково заміщену однією або більше однаковими R'2 , (ІІ) або різними групами, вибраними з галогену, лінійде: ного або розгалуженого (С1-С6)алкілу, лінійного R'1 являє собою лінійну або розгалужену (С1або розгалуженого (С1-С6)алкокси, лінійного або С6)алкоксигрупу, розгалуженого (С1-С6)пергалоалкілу, лінійного або R'2 являє собою атом водню, атом галогену або розгалуженого (С1-С6)алкоксикарбонілу, карбокси, лінійну чи розгалужену (С1-С6)алкоксигрупу, лінійного або розгалуженого (С1-С6)ацилу, лінійнояку: го або розгалуженого (С1-С6)пергалоалкокси, гід(а) або піддають реакції з кислотним хлоридом рокси, ціано, нітро, аміно (необов'язково заміщеноформули (III) у присутності основи, у середовищі го однією або більше лінійними або тетрагідрофурану або ацетонітрилу: розгалуженими (С1-С6)алкільними групами), аміноСl-СН2-(СН2)m-СН2-СОСl, (ІІІ) сульфонілу (необов'язково заміщеного однією або де m є таким, як визначено для формули (І), для більше лінійними або розгалуженими (С1одержання сполуки формули (IV): С6)алкільними групами) і (С1R'1 С6)алкілсульфоніламіно. SO 2NH 2 2. Сполука формули (І) за п. 1, де R2 являє собою атом водню. 3. Сполука формули (І) за п. 1 або 2, де група R 1 NH-CO-CH2-(CH2 )m-CH2-Cl знаходиться у положенні b фенілу, який її містить. 4. Сполука формули (І) за п. 1, 2 або 3, де група R 1 R'2 , (IV) являє собою необов'язково заміщену фенільну де R'1 i R'2 є такими, як визначено вище, груп у. яку потім циклізують в основному середовищі для 5. Сполука формули (І) за будь-яким з пп. 1-4, де А одержання сполуки формули (V): являє собою атом азоту і, разом з розташованою R'1 O O N S N ( )m поряд -СНR3-групою, утворює кільце , N де m являє собою 1, 2 або 3, переважно 1. R'2 ( )m 6. Сполука формули (І) за п. 1, яка являє собою 7, (V) (3-метилфенокси)-2,3,3а,4-тетрагідро-1Нде R'1, R' 2 і m є такими, як визначено вище, піроло[2,1-с][1,2,4]-бензотіадіазин 5,5-діоксид, а яку піддають відновленню у середовищі спирту також її ізомери. або диметилформаміду у присутності боргідриду 7. Сполука формули (І) за п. 1, яка являє собою 3натрію з одержанням сполуки формули (VI): [(5,5-діоксидо-2,3,3а,4-тетрагідро-1Н-піроло[2,1R'1 O O с][1,2,4]бензотіадіазин-7-іл)окси]бензойну кислоту, S а також її ізомери. NH 8. Сполука формули (І) за п. 1, яка являє собою 3[(5,5-діоксидо-2,3,3а,4-тетрагідро-1Н-піроло[2,1N с][1,2,4]бензотіазин-7-іл)оксі]анілін, а також її ізоR'2 мери. ( )m , (VI) 9. Сполука формули (І) за п. 1, яка являє собою Nде R'1, R' 2 і m є такими, як визначено вище, [3-(5,5-діоксидо-2,3,3а,4-тетрагідро-1Н-піридо[2,1 5 77737 де сполуку формули (V) або (VI) піддають дії триHO броміду бору з одержанням сполуки формули (VII): O O HO S NH R2 R' 2 N ( )m , (VII) де R2 і m є таким, як визначено вище, (b) або циклізують: у присутності амідину формули (VIII): NH R3 NH 2 , (VIII) де R3 є таким, як визначено для формули (І), з одержанням сполуки формули (IX): R'1 SO 2 N NH R'2 R3 , (IX) де R'1, R' 2 і R3 є такими, як визначено вище, яку: або відновлюють, використовуючи металевий гідрид, з одержанням сполуки формули (X): R'1 SO2 NH NH R'2 R3 , (X) де R'1, R' 2 і R3 є такими, як визначено вище, або алкілують шля хом дії сильної основи у присутності алкілуючого агента R'4X, де R'4 являє собою лінійну або розгалужену (С1-С6)алкільну груп у і Х являє собою атом галогену, і потім відновлюють з одержанням сполуки формули (XI): R'1 SO 2 NH N R'2 R3 R'4 , (XI) де R'1, R' 2, R3 і R'4 є такими, як визначено вище, у присутності альдегіду формули (XII): O R3 C H , (XII) де R3 є таким, як визначено для формули (І), з одержанням сполуки формули (X), описаної вище, груп у R'1 і групу R'2 , коли вона являє собою лінійну або розгалужену (С1-С6)алкоксигрупу, сполуки формули (X) або (XI) перетворюють у гідроксигрупи для одержання сполуки формули (XIII): 6 SO 2 NH N R3 R4 , (XIII) де R2, R3 і R4 є такими, як визначено для формули (І), де сполуку формули (VII) або (XIII) піддають реакції з бороновою кислотою сполуки формули (XIV): R1В(ОН)2, (XIV) де R1 є таким, як визначено для формули (І), з одержанням сполуки формули (І/a1) або (І/а2), конкретних варіантів сполук формули (І): R1O SO 2 NH N R2 R3 R4 , (I/a1) де R1, R2, R3 і R4 є такими, як визначено для формули (І), R1O SO 2 NH R2 N ( )m , (I/a2) де R1, R2 і m є такими, як визначено для формули (І), де сполуки формул (І/а1) і (І/а2): піддають, якщо необхідно, звичайним перетворенням відносно замісників групи R1, якщо необхідно, очищують відповідно до звичайної техніки очищення, необов'язково розділяють, на їх ізомери відповідно до звичайної техніки розділення і перетворюють, якщо бажано, у їх адитивні солі з фармацевтично прийнятною кислотою або основою. 12. Спосіб одержання сполук формули (І), де А являє собою CR4R5 групу, який відрізняється тим, що як вихідний матеріал використовують сполуку формули (XV): R'1 SO2 NH R' 2 O , (XV) де: R'1 являє собою лінійну або розгалужену (С1С6)алкоксигрупу, R'2 являє собою атом водню, атом галогену або лінійну або розгалужену (С1-С6)алкоксигрупу, яку піддають дії хлорацетону у присутності диметилформаміду для одержання сполуки формули (XVI): 7 77737 8 R'1 R'1 SO 2 NH SO 2 N R' 2 O O , (XVI) де R'1 і R'2 є такими, як визначено вище, яку піддають перегрупуванню в основному середовищі з одержанням сполуки формули (XVII): R'1 SO2 NH R'2 OH O O , (XIXa) де R'1 i R'2 є такими, як визначено вище, атом азоту якої необов'язково, в залежності від природи групи R3, що є бажаною, захищають захисною групою і яку потім, після обробки сильною основою, обробляють сполукою формули R'3-P, де R'3 являє собою лінійну або розгалужену (С1С6)алкільну груп у або (С3-С7)циклоалкільну гр упу і Р являє собою відхідну гр упу, з одержанням, після зняття захисту атома азоту, сполуки формули (ХІХ'а) R'1 SO 2 NH R'2 , (XIX) де R'1 і R'2 мають такі ж значення, і R 3 є таким, як визначено для формули (І), або піддають каталітичному відновленню з одержанням сполуки формули (XX): R'1 SO 2 NH R3 R'2 , (XX) де R'1 і R'2 є такими, як визначено вище, або перетворюють у спирт дією гідриду, гідроксигрупу якого перетворюють в атом галогену дією відповідного реагенту з одержанням сполуки формули (XXI): R'1 SO 2 NH O , (XVIII) де R'1 і R'2 є такими, як визначено вище, яку піддають гідролізу в кислотному середовищі з одержанням сполуки формули (ХІХа): R'1 SO 2 NH R'2 R3 O O , (XVII) де R'1 і R'2 є такими, як визначено вище, яку деацетилюють шляхом нагрівання у зворотному холодильнику у середовищі бензолу у присутності надлишку етиленгліколю і каталітичної кількості р-толуолсульфонової кислоти для одержання сполуки формули (XVIII): R'1 SO2 NH R'2 R'2 R'3 O , (XIX'a) де R'1, R' 2 і R'3 є такими, як визначено вище, де сполуку формули (ХІХа) або (ХІХ'а), представлену формулою (XIX): R'2 R3 R'5 , (XXI) де R'1 i R'2 є такими, як визначено вище, і R'5 являє собою атом галогену, або піддають дії магнійорганічної сполуки R'4MgBr, де R'4 являє собою лінійну або розгалужену (С1С6)алкільну групу, з одержанням сполуки формули (ХІХb): R'1 SO 2 NH R'2 R'4 OH R3 , (XIXb) де R'1, R'2 і R'4 є такими, як визначено вище, де сполуку формули (ХІХb) або піддають каталітичному відновленню з одержанням сполуки формули (XXII): R'1 SO 2 NH R'2 R3 R'4 , (XXII) де R'1, R' 2 і R'4 є такими, як визначено вище, або її гідроксигрупу перетворюють в атом галогену дією відповідного реагенту з одержанням сполуки формули (XXIII): 9 77737 10 R1O R'1 SO 2 NH SO 2 NH R'2 R3 R'4 R'5 , (XXIII) де R'1, R'2 і R'4 є такими, як визначено вище, і R'5 являє собою атом галогену, груп у R'1 і групу R'2 , коли вона являє собою лінійну або розгалужену (С1-С6)алкоксигрупу, сполуки формул (XX)-(XXIII) перетворюють у гідроксигрупи з одержанням сполуки формули (XXIV): HO SO 2 NH R2 R3 R4 R5 , (XXIV) де R2, R4 і R5 є такими, як визначено для формули (І), де сполуку формули (XXIV) піддають реакції з бороновою кислотою сполуки формули (XIV): R1B(OH)2, (XIV) де R1 є таким, як визначено для формули (І), з одержанням сполуки формули (І/b), конкретного варіанта сполуки формули (І): Даний винахід відноситься до нових похідних бензотіазину і бензотіадіазину, до способу їх приготування і фармацевтичних композицій, які їх містять. На сьогоднішній день відомо, що збуджувальні амінокислоти, особливо глутамат, відіграють ключову роль у фізіологічних процесах нейрональної пластичності і у механізмах, що лежать в основі навчання та запам'ятовування. Патофізіологічні дослідження чітко показали, що дефіцит у глутаматергічній нейротрансмісії тісно пов'язаний з розвитком хвороби Альцгеймера [Neuroscience і Biobehavioral reviews, 1992, 16, 13-24 ; Progress in Neurobiology, 1992, 39, 517-545]. Більше того, численні роботи за останні роки продемонстрували існування підтипів збуджувальних рецепторів амінокислот і їх функціональні взаємодії [Molecular Neuropharmacology, 1992, 2, 1531]. Серед таких рецепторів, АМРА (a-аміно-3гідроксид-метил-4-ізоксазол-пропіонова кислота) рецептор виявляється таким рецептором, який найбільше залучений в явище фізіологічної нейрональної збудженості і, особливо, в явища, які залучені до процесів запам'ятовування. Наприклад, було виявлено, що процес навчання пов'язаний зі зростанням у зв'язуванні АМРА зі своїм рецептором у гіпокампі, одній з ділянок мозку, головних для процесів запам'ятовування і пізнавання. Подібним чином, ноотропні агенти, такі як анірацетам, нещодавно були описані як позитивно модулюючі АМРА рецептори нейрональних клітин C R2 CH R3 R4 R5 , (I/b) де R1, R2, R3, R4, R5 є такими, як визначено для формули (І), де сполуку формули (І/b) піддають, якщо необхідно, звичайним перетворюванням відносно замісників групи R1, очищують, якщо необхідно, відповідно до звичайної техніки очищення, необов'язково розділяють на її ізомери відповідно до звичайної техніки розділення і перетворюють, якщо бажано, у її адитивні солі з фармацевтично прийнятною кислотою або основою. 13. Фармацевтична композиції, яка містить як активний інгредієнт сполуку, вказану в будь-якому з пп. 1-10, у поєднанні з одним або більше фармацевтично прийнятними, інертними, нетоксичними ексципієнтами або носіями. 14. Фармацевтична композиції за п. 13, яка містить як активний інгредієнт сполуку, вказану в будьякому з пп. 1-10, для застосування як лікарських засобів, таких як АМРА модулятори. [Journal Neurochemistry, 1992, 58, 1199-1204]. В літературі, сполуки, як мають структуру бензаміду, були описані як такі, що володіють тим же механізмом дії і покращують процес запам'ятовування [Synapse, 1993, 15, 326-329]. Сполука ВА 74, зокрема, являє собою найбільш активний з нових фармакологічних агентів. Нарешті, опис патенту ЕР 692484 розкриває похідне бензотіадіазину, яке володіє полегшувальною активністю відносно струму АМРА, і патентна заявка WO 99/42456 описує серед інших конкретні похідні бензотіадіазину як модулятори АМРА рецепторів. Похідні бензотіазину і бензотіадіазину, до яких відноситься даний винахід, крім того, що вони є новими, несподівано виявляють фармакологічну активність відносно струму АМРА, що явно є більш переважним відносно активності сполук, які мають подібні структури, описані у попередньому рівні техніки. Вони є корисними як АМРА модулятори для лікування або запобігання розладам пам'яті і пізнавання, які пов'язані з віком, синдромами тривоги або депресії, прогресуючими нейродегенеративними захворюваннями, хворобою Альцгеймера, хворобою Піка, хореєю Хантінгтона, шизофренією, наслідками гострих нейродегенеративних захворювань, наслідками ішемії і наслідками епілепсії. Більш конкретно, даний винахід відноситься до сполук формули (І): 11 77737 12 ного або розгалуженого (С1-Сб )алкілу, лінійного або розгалуженого (С1-Сб )алкокси, лінійного або розгалуженого (С1-Сб )пергалоалкілу, лінійного або розгалуженого (С1-Сб )алкоксикарбонілу, карбокси, лінійного або розгалуженого (С1-Сб )ацилу, лінійного або розгалуженого (С1-Сб )пергалоалкокси, гідде: рокси, ціано, нітро, аміно (необов'язково заміщеноR1 являє собою арил або гетероарильну гр упу, го однією або більше лінійними або R2 являє собою атом водню, атом галогену розгалуженими (С1-Сб )алкільними групами), аміноабо гідроксигрупу, сульфонілу (необов'язково заміщеного однією або А являє собою CR4R5 гр уп у або NR4 гр упу, більше лінійними або розгалуженими (С1R3 являє собою атом водню, лінійну або розСб )алкільними групами) або (С1галужену (С1-Сб )алкільну групу або (С3Сб )алкілсульфоніламіно. С7)циклоалкільну гр упу, Серед фармацевтично прийнятних кислот моR4 являє собою атом водню або лінійну або жуть бути згадані, без будь-якого обмеження, хлорозгалужену (С1-Сб )алкільну гр упу, або ристоводнева кислота, бромистоводнева кислота, А являє собою атом азоту і, разом з розташосірчана кислота,фосфорна кислота, оцтова кисваною поряд -СHR3-групою, утворює кільце лота, трифтороцтова кислота, молочна кислота, піровиноградна кислота, малонова кислота, янтарна кислота, глутарова кислота, фумарова кисло, де m являє собою 1, 2 або 3, та, винна кислота, малеїнова кислота, лимонна R5 являє собою атом водню або галогену, кислота, аскорбінова кислота, метансульфонова до їх ізомерів і їх адитивних солей з фармацекислота, камфорна кислота і т.д. втично прийнятною кислотою або основою, Серед фармацевтично прийнятних основ моповинно розумітись, що: жуть бути згадані, без будь-якого обмеження, гід- термін "арильна група", як повинно розуміроксид натрію, гідроксид калію, триетиламін, треттись, означає ароматичну моноциклічну групу або бутиламін і т.д. біциклічну груп у, в якій щонайменше одне з кілець Група R1O- переважно знаходиться у полоє ароматичним, необов'язково заміщену однією женні b фенілу, який її містить. або більше однаковими або різними групами, вибПереважна R1 група являє собою арильну грураними з галогену, лінійного або розгалуженого пу, особливо необов'язково заміщену фенільну. (С1-Сб )алкілу (необов'язково заміщеного однією Коли арильна група являє собою заміщену або більше гідроксигрупами), лінійного або розгафенільну групу, замісник переважно знаходиться у луженого (С1-Сб )алкокси, лінійного або розгалужемета положенні. ного (С1-С6)пергалоалкілу, лінійного або розгалуПереважною R2 групою є атом водню. женого (С1-С6)алкоксикарбонілу, лінійного або Переважні сполуки за даним винаходом являрозгалуженого (С1-Сб )алкілтіо, карбокси, лінійного ють собою сполуки, де А являє собою атом азоту і, або розгалуженого (С1-Сб )ацилу, лінійного або разом з розташованою поряд -СHR3-групою, утворозгалуженого (С1-Сб )пергалоалкокси, гідрокси, ціано, нітро, аміно (необов'язково заміщеного однією або більше лінійними або розгалуженими (С1рює кільце де m являє собою 1, 2 або 3, Сб )алкільними або лінійними або розгалуженими переважно 1. (С1-Сб )ацильними групами), амінокарбонілу (неПереважні сполуки за даним винаходом являобов'язково заміщеного однією або більше лінійють собою: ними або розгалуженими (С1-Сб )алкільними гру- 7-(3-метилфенокси)-2,3,За,4-тетрагідро-1Нпами), аміносульфонілу (необов'язково піроло[2,1-с][1,2,4]-бензотіадіазин 5,5-діоксид, заміщеного однією або більше лінійними або роз3-[(5,5-діоксидо-2,3,За,4-тетрагідро-1Нгалуженими (С1-Сб )алкільними групами), моно- або піроло[2,1-с][1,2,4]бензотіадіазин-7-іл)окси] бензоді-((С1-Сб )алкілсульфоніл)аміно, моно- або дійна кислота, (трифторметилсульфоніл)аміно, PO(ORa)(ORb) (де 3-(5,5-діоксидо-2,3,За,4-тетрагідро-1НRa і Rb, які можуть бути однаковими або різними, піроло[2,1-с][1,2,4]бензотіазин-7-іл)окси]анілін, являють собою атом водню або лінійну або розгаN-[3-(5,5-діоксидо-2,3,За,4-тетрагідро-1Нлужену (С1-Сб )алкільну груп у), бензилокси або піридо[2,1-с][1,2,4]бензотіазин-7фенілу (необов'язково заміщених однією або бііл)окси]феніл]метансульфонамід, льше однаковими або різними групами, вибраними етилводень 3-[(5,5-діоксидо-2,3,За,4з галогену, лінійного або розгалуженого (С1тетрагідро-1Н-піроло[2,1-с][1,2,4]бензотіадіазин-7Сб )алкілу, лінійного або розгалуженого (С1іл)окси]фенілфосфонат, і їх ізомери. Сб )пергалоалкілу, гідрокси або лінійного або розВинахід також відноситься до способу пригогалуженого (С1-Сб )алкокси), тування сполук формули (І). - термін "гетероарильна група" означає аромаСпосіб приготування сполук формули (І), де А тичну моноциклічну або біциклічну гр упу, в якій являє собою NR4 групу або А являє собою атом щонайменше одне з кілець є ароматичним, що азоту і, разом з розташованою поряд CHR3 грумістить один, два або три однакових або різних гетероатоми, вибрані з азоту, кисню і сірки, необов'язково заміщену однією або більше однаковими пою, утворює кільце , де m являє собою 1, або різними групами, вибраними з галогену, ліній2 або 3, який відрізняється тим, що як вихідний 13 матеріал використовують сполуку формули (II): 77737 14 де R3 є таким, як визначено для формули (І), для одержання сполуки формули (IX): де: R11 являє собою лінійну або розгалужену (С1Сб )алкоксигрупу, R'2 являє собою атом водню, атом галогену або лінійну або розгалужену (С1-Сб )алкоксигрупу, яку: (а) або піддають реакції з кислотним хлоридом формули (III) у присутності основи, у середовищі тетрагідрофурану або ацетонітрилу: де R'1, R'2 і R3 є такими, як визначено вище, яку: - або відновлюють, використовуючи металевий гідрид, для одержання сполуки формули (X): де m є таким, як визначено для формули (І), для одержання сполуки формули (IV): де R'1 і R'2 є такими, як визначено вище, яку потім циклізують в основному середовищі для одержання сполуки формули (V): де R'1, R' 2 і m є такими, як визначено вище, яку піддають відновленню, у середовищі спирту або диметилформаміду, у присутності боргідриду натрію, для одержання сполуки формули (VI): де R'1, R' 2 i m є такими, як визначено вище, де сполуку формули (V) або (VI) піддають дії триброміду бору для одержання сполуки формули (VII): де R2 і m є таким, як визначено вище, (b) або циклізують: - у присутності амідину формули (VIII): де R'1, R' 2 і R3 є такими, як визначено вище, - або алкілують шляхом дії сильної основи у присутності алкілуючого агенту R'4 X, де R'4 являє собою лінійну або розгалужену (С1-Сб )алкільну груп у і X являє собою атом галогену, і потім відновлюють для одержання сполуки формули (XI): де R'1, R'2, R3 і R'4 є такими, як визначено вище, - у присутності альдегіду формули (XII): де R3 є таким, як визначено для формули (І), для одержання сполуки формули (X), описаної вище, груп у R11 і групу R' 2, коли вона являє собою лінійну або розгалужену (С1-Сб )алкоксигрупу, сполуку яких формул (X) або (XI) перетворюють у гідроксигрупи для одержання сполуки формули (XIII): де R2, R3 і R4 є такими, як визначено для формули (І), де сполуку формули (VII) або (XIII) піддають реакції з бороновою кислотою сполуки формули (XIV): 15 77737 де R1, є таким, як визначено для формули (І), для одержання сполуки формули (І/а1) або (І/а2), конкретних варіантів сполук формули (І): де R1, R2, R3 і R4 є такими, як визначено для формули (І), де R1, R2, і m є такими, як визначено для формули (І), де сполуки формул (І/а1) і (І/а2): піддають, якщо необхідно, звичайним перетворенням відносно замісників групи R1, якщо необхідно, очищують відповідно до звичайної техніки очищення, необов'язково розділяють на їх ізомери відповідно до звичайної техніки розділення і перетворюють, якщо бажано, у їх адитивні солі з фармацевтично прийнятною кислотою або основою. Спосіб приготування сполук формули (І), де А являє собою CR4R5 групу, який відрізняється тим, що як вихідний матеріал використовують сполуку формули (XV): де: R'1 являє собою лінійну або розгалужену (С1Сб )алкоксигрупу, R'2 являє собою атом водню, атом галогену або лінійну або розгалужену (С1-Сб )алкоксигрупу, яку піддають дії хлорацетону у присутності диметилформаміду для одержання сполуки формули (XVI): 16 де R'1 і R'2 є такими, як визначено вище, яку деацетилюють шляхом нагрівання у зворотному холодильнику у середовищі бензолу у присутності надлишку етиленгліколю і каталітичної кількості р-толуолсульфонової кислоти для одержання сполуки формули (XVIII): де R'1 і R'2 є такими, як визначено вище, яку піддають гідролізу в кислотному середовищі для одержання сполуки формули (ХІХа): де R11 і R'2 є такими, як визначено вище, атом азоту якої необов'язково, в залежності від природи групи R3, що є бажаною, захищають захисною групою і яку потім, після обробки сильною основою, обробляють сполукою формули R'3P, де R'3 являє собою лінійну або розгалужену (С1-Сб )алкільну груп у або (С3-С7)циклоалкільну груп у і Ρ являє собою відхідну груп у, для одержання, після зняття захисту атома азоту, сполуки формули (ХІХ'а) де R11 і R'2 і R'3 є такими, як визначено вище, де сполуку формули (ХІХа) або (ХІХ'а), представлену формулою (XIX): де R'1 і R'2 є мають такі ж значення, і R3 є таким, як визначено для формули (І): - або піддають каталітичному відновленню для одержання сполуки формули (XX): де R'1 і R'2 є такими, як визначено вище, яку піддають перегрупуванню в основному середовищі для одержання сполуки формули (XVII): де R'1 і R'2 є такими, як визначено вище, або перетворюють у спирт дією гідриду, гідроксигрупу якого перетворюють в атом галогену дією відповідного реагенту для одержання сполуки формули (XXI): 17 77737 де R'1 і R'2 є такими, як визначено вище, і R'5 являє собою атом галогену, або піддають дії магнійорганічної сполуки R'4MgBr, де R'4 являє собою лінійну або розгалужену (С1-Сб )алкільну групу, для одержання сполуки формули (ХІХb): де R'1, R' 2 і R'4 є такими, як визначено вище, де сполуку формули (ХІХb) - або піддають каталітичному відновленню для одержання сполуки формули (XXII): де R'1, R' 2 i R'4 є такими, як визначено вище, - або її гідроксигрупу перетворюють в атом галогену дією відповідного реагенту для одержання сполуки формули (XXIII): де R'1, R' 2 і R' 4 є такими, як визначено вище, і R'5 являє собою атом галогену, груп у R'1 і гр уп у R'2 , коли вона являє собою лінійну або розгалужену (С1-Сб )алкоксигрупу, сполуки формул (XX)-(XXIII) яких перетворюють у гідроксигрупи для одержання сполуки формули (XXIV): де R2, R4 і R5 є такими, як визначено для формули (І), де сполуку формули (XXIV) піддають реакції з бороновою кислотою сполуки формули (XIV): де R1 є таким, як визначено для формули (І), для одержання сполуки формули (І/b), конкретного варіанту сполуки формули (І): 18 де R1, R2, R3, R4, R5 є такими, як визначено для формули (І), де сполуку формули (І/b) піддають, якщо необхідно, звичайним перетворюванням відносно замісників групи R1, очищують, якщо необхідно, відповідно до звичайної техніки очищення, необов'язково розділяють на її ізомери відповідно до звичайної техніки розділення і перетворюють, якщо бажано, в її адитивні солі з фармацевтично прийнятною кислотою або основою. Винахід також відноситься до фармацевтичних композицій, які містять, як активний інгредієнт, сполуку формули (І) з одним або більше відповідними інертними, нетоксичними ексципієнтами. Серед фармацевтичних композицій відповідно до даного винаходу можуть бути згадані більш конкретно ті, які прийнятні для орального, парентерального (внутрішньовенного або підшкірного) або назального введення, таблетки або драже, під'язикові таблетки, желатинові капсули, коржики, супозиторії, креми, мазі, дермальні гелі, ін'єктовані препарати, питні суспензії і т.д. Прийнятне дозування може розрізнятись в залежності від природи і складності захворювання, шляху введення, віку і ваги пацієнта. Дозування знаходиться в діапазоні від 1 до 500мг на день за одне або більше введень. Наступні приклади демонструють даний винахід і жодним чином не обмежують його об'єму. Як вихідні матеріали використовують продукти, які відомі або виготовляються відповідно до відомих способів приготування. Структури сполук, описані у Прикладах, були визначені відповідно до звичайної спектрофотометричної техніки (інфрачервоне випромінювання, ЯМР, мас-спектрометрія...). Приклад 1: 7-Фенокси-2,3,3а,4-тетрагідро-1Нпіроло[2,1-с][1,2,4]-бензотіадіазин 5,5-діоксид Стадія А: N-[2-(Аміносульфоніл)-4метоксифеніл-4-хлорбутанамід 144ммол триетиламіну і потім, краплями, розчин, який містить 135ммол 4-хлорбутанового кислотного хлориду в 30мл тетрагідрофурану (ТГФ), додають до розчину, який містить 96,4ммол 2аміно-5-метоксибензолсульфонаміду в 200мл ТГФ. Після перемішування протягом ночі при температурі навколишнього середовища ТГФ випаровують і залишок додають у воду. Органічну фазу промивають і висушують після екстрагуванню етилацетатом. Після випаровування очікуваний продукт одержують у формі олії. Стадія В: 5,5-Діоксо-7-метокси-2,3-дигідро-1Нпіроло[2,1-с][1,2,41-бензотіадіазин Продукт, одержаний на попередній Стадії, перемішують протягом ночі при температурі навколишнього середовища в 320мл водного 1N розчину гідроксиду натрію. Після додавання 50мл етилацетату і енергійного перемішування очікуваний продукт, який випав в осад, відфільтровують, 19 77737 20 промивають і висушують. Елементний мікроаналіз: Стадія С: 5,5-Діоксидо-7-метокси-2,3,3а,4С% Н% N% S% тетрагідро-1Н-піроло[2,1-с][1,2,4]бензотіадіазин Підраховано 60,74 5,10 8,85 10,14 106,5ммол боргідриду натрію додають до суЗнайдено 60,24 5,04 8,69 10,09 спензії, яка містить 35,5ммол продукту, одержаноСполуки наступних Прикладів одержували відго на попередній Стадії, в 40мл диметилформаміповідно до методики, описаної у Прикладі 1, викоду (ДМФ). Після перемішування протягом ночі при ристовуючи відповідні боронові кислоти на Стадії температурі навколишнього середовища реакційну Е. суміш охолоджують і потім 150мл замороженого Приклад 5: 4-[(5,5-Діоксидо-2,3,3а,4розчину 1N хлористоводневої кислоти додають до тетрагідро-1Н-піроло[2,1-с][1,2,4]-бензотіадіазин-7вищезазначеної суміші. Очікуваний продукт випаіл)окси]бензонітрил дає в осад і його відфільтровують. Точка плавлення: 242-245°С Точка плавлення: 193-198°С Елементний мікроаналіз: Стадія D: 5,5-Діоксидо-2,3,3а,4-тетрагідро-1НС% Н% N% S% піроло[2,1-с][1,2,4]-бензотіадіазин-7-ол Підраховано 59,81 4,43 12,31 9,39 79,3ммол триброміду бору додають краплями Знайдено 59,72 4,53 11,95 9,61 до суспензії, яка містить 26,7ммол продукту, одерПриклад 6: 3-[(5,5-Діоксидо-2,3,3а,4жаного на попередній Стадії, у 350мл дихлормететрагідро-1Н-піроло[2,1-с][1,2,4]-бензотіадіазин-7тану, який підтримують при -60°С під азотом. Теміл)окси]бензонітрил пературу підтримують протягом однієї години і Точка плавлення: 227-230°С потім все повертають до температури навколишЕлементний мікроаналіз: нього середовища і перемішують протягом ночі. С% Н% N% S% Після охолодження реакційної суміші на льодяній Підраховано 59,81 4,43 12,31 9,39 бані додають 100мл води і сформовану двофазну 3найдено 59,87 4,50 11,79 9,12 систему енергійно перемішують. С успензію, сфоПриклад 7: 7-(4-Метилфенокси)-2,3,3а,4рмовану таким чином, фільтрують. Одержану білу тетрагідро-1Н-піроло[2,1-с][1,2,4]бензотіадіазин тверду речовину промивають водою, ефіром, і 5,5-діоксид висушують, одержуючи очікуваний продукт. Точка плавлення: 222-226°С Точка плавлення: 237-242°С Елементний мікроаналіз: Стадія Е: 7-Фенокси-2,3,3а,4-тетрагідро-1НС% Н% N% S% піроло[2,1-с][1,2,4]-бензотіадіазин 5,5-діоксид Підраховано 61,80 5,49 8,48 9,70 Суспензію, яка містить 0,832ммол сполуки, 3найдено 61,77 5,54 8,29 9,38 одержаної на попередній Стадії, 1,66ммол фенілПриклад 8: 7-(3-Метилфенокси)-2,3,3а,4боронової кислоти, 1,25ммол ацетату міді, тетрагідро-1Н-піроло[2,1-с][1,2,4]бензотіадіазин 2,5ммол піридину і 100мг молекулярних сит пере5,5-діоксид мішують протягом 5 годин в 20мл метилен хлориТочка плавлення: 190-195°С ду (СН2СI2). Після додавання 20мл СН 2СI2, суспенЕлементний мікроаналіз: зію фільтрують. Після випаровування фільтрату, С% Н% N% S% залишок очищують на колонці силікагелю, викориПідраховано 61,80 5,49 8,48 9,70 стовуючи як елюент суміш метилен хло3найдено 62,16 5,55 8,22 9,56 рид/етилацетат (95/5), і одержують очікуваний Приклад 9: 7-(4-Метоксифенокси)-2,3,3а,4продукт. тетрагідро-1Н-піроло[2,1-с][1,2,4]бензотіадіазин Точка плавлення: 239-243°С 5,5-діоксид Елементний мікроаналіз: Точка плавлення: 188-191°С С% Н% N% S% Елементний мікроаналіз: Підраховано 60,74 5,10 8,85 10,13 С% Н% N% S% Знайдено 60,67 5,06 8,65 10,22 Підраховано 58,94 5,24 8,09 9,26 Приклад 2: 7-Фенокси-2,3,3а,4-тетрагідро-1Н3найдено 59,11 5,35 7,90 9,43 Приклад 10: 7-(3-Метоксифенокси)-2,3,3а,4піроло[2,1-с][1,2,4]-бензотіадіазин 5,5-діоксид, a тетрагідро-1Н-піроло[2,1-с][1,2,4]бензотіадіазин ізомер 5,5-діоксид Приклад 3: 7-Фенокси-2,3,3а,4-тетрагідро-1НТочка плавлення: 152-155°С піроло[2,1-с][1,2,4]-бензотіадіазин 5,5-діоксид, b Елементний мікроаналіз: ізомер С% Н% N% S% Сполуки Прикладів 2 і 3 одержують шля хом Підраховано 58,94 5,24 8,09 9,26 розділення ізомерів Прикладу 1 на хіральній коло3найдено 59,06 5,37 7,75 9,12 нці, Chiralcel ОСÒ , використовуючи, як елюючий Приклад 11: 7-(3-Метоксифенокси)-2,3,3а,4розчинник 1000/0,5 суміш ізопропанол/діетиламін. тетрагідро-1Н-піроло[2,1-с][1,2,4]бензотіадіазин Після розділення кожний ізомер очищають хрома5,5-діоксид, a ізомер тографією на колонці силікагелю, використовуючи Приклад 12: 7-(3-Метоксифенокси)-2,3,3а,4як елюент суміш ди хлорметан/етилацетат (20/10). тетрагідро-1Н-піроло[2,1-с][1,2,4]бензотіадіазин Приклад 4; 8-Фенокси-2,3,3а,4-тетрагідро-1Нпіроло[2,1-с][1,2,4]-бензотіадіазин 5,5-діоксид 5,5-діоксид, b ізомер Сполуки Прикладів 11 і 12 одержували роздіСполуку наступного Прикладу одержували ленням сполуки Прикладу 10 на хіральній колонці відповідно до методики, описаної у Прикладі 1, за тих же умов, що і описані для Прикладів 2 і 3. використовуючи відповідний вихідний матеріал. Приклад 13: 7-(2-Метоксифенокси)-2,3,3а,4Точка плавлення: 184-187°С 21 77737 22 тетрагідро-1Н-піроло[2,1-с][1,2,4]бензотіадіазин 2,3,3а,4-тетрагідро-1Н-піроло[2,15,5-діоксид с][1,2,4]бензотіадіазин 5,5-діоксид Точка плавлення: 175-176°С Точка плавлення: 175°С Елементний мікроаналіз: Елементний мікроаналіз: С% Н% Ν% S% С% Н% N% S% Підраховано 58,94 5,24 8,09 9,26 Підраховано 51,00 3,78 7,00 8,01 3найдено 58,91 5,34 7,93 9,26 Знайдено 51,10 3,82 6,93 8,10 Приклад 14: 7-(3-Трифторметилфенокси)Приклад 20: 7-(1-Нафтилокси)-2,3,3а,42,3,3а,4-тетрагідро-1Н-піроло-[2,1тетрагідро-1Н-піроло[2,1-с][1,2,4]бензотіадіазин с][1,2,4]бензотіадіазин 5,5-діоксид 5,5-діоксид Точка плавлення: 195-197°С Точка плавлення: 227-229°С Елементний мікроаналіз: Елементний мікроаналіз: С% Н% N% S% С% Н% №/о S% Підраховано 53,12 3,93 7,29 8,34 Підраховано 65,56 4,95 7,64 8,75 Знайдено 53,31 4,05 7,20 8,22 Знайдено 65,29 5,11 7,37 8,42 Сполуки Прикладів 14а і 14b одержували розПриклад 21: 7-(2-Нафтилокси)-2,3,3a,4діленням енантіомерів Прикладу 14 на хіральній тетрагідро-1Н-піроло[2,1-с][1,2,4]бензотіадіазин 5,5-діоксид колонці, Chiralcel ОСÒ , за тих же умов, що і описані Точка плавлення: 234-236°С для Прикладів 2 i 3. Елементний мікроаналіз: Приклад 14а: 7-(3-Трифторметилфенокси)С% Н% N% S% 2,3,3а,4-тетрагідро-1Н-піроло-[2,1Підраховано 65,56 4,95 7,64 8,75 с][1,2,4]бензотіадіазин 5,5-діоксид, a ізомер Знайдено 65,31 4,95 7,44 8,66 Елементний мікроаналіз: Приклад 22: 7-(3-Бензилоксифенокси)С% Н% Ν% S% 2,3,3а,4-тетрагідро-1Н-піроло-[2,1Підраховано 53,12 3,93 7,29 8,34 с][1,2,4]бензотіадіазин 5,5-діоксид. Знайдено 53,05 4,29 7,21 8,08 Точка плавлення: 179-182°С Приклад 14b: 7-(3-Трифторметилфенокси)Елементний мікроаналіз: 2,3,3а,4-тетрагідро-1Н-піроло[2,1С% Н% N% S% с][1,2,4]бензотіадіазин 5,5-діоксид, b ізомер Підраховано 65,38 5,25 6,63 7,59 Елементний мікроаналіз: Знайдено 65,55 5,24 6,52 7,25 С% Н% Ν% S% Приклад 23: 4-[(5,5-Діоксидо-2,3,3а,4Підраховано 53,12 3,93 7,29 8,34 тетрагідро-1Н-піроло[2,1-с][1,2,4]-бензотіадіазин-7Знайдено 53,24 4,19 7,28 8,12 іл)окси] фенол Приклад 15: 7-(3-Нітрофенокси)-2,3,3а,4Очікуваний продукт одержують, починаючи зі тетрагідро-1Н-піроло[2,1-с][1,2,4]бензотіадіазин сполуки, описаної в Прикладі 9. Розчин триброміду 5,5-діоксид бору (1М) у СН 2СI2 додають до нього, після розчиТочка плавлення: 201-204°С нення в метилен хлориді і охолодження на льодяЕлементний мікроаналіз: ній бані. Після повернення до температури навкоС% Н% N% S% лишнього середовища і перемішування протягом Підраховано 53,18 4,18 11,63 8,87 ночі, суміш охолоджують на льодяній бані. Після Знайдено 53,53 4,23 11,36 8,80 додавання води, екстрагування СН 2СI2, сушіння і Приклад 16: 7-[3,5випаровування, очікуваний продукт одержують Ди(Трифторметил)фенокси]-2,3,3а,4-тетрагідропісля відфільтровування залишку і додавання в 1Н-піроло[2,1-с][1,2,4]бензотіадіазин 5,5-діоксид ефір і фільтрування. Точка плавлення: 201-203°С Точка плавлення: 175-178°С Елементний мікроаналіз: Елементний мікроаналіз: С% Н% N% S% С% Н% N% S% Підраховано 47,79 3,12 6,19 7,09 Підраховано 57,82 4,85 8,43 9,65 Знайдено 47,90 3,24 6,10 7,07 Знайдено 57,66 4,83 8,18 9,63 Приклад 17: 7-(3-Хлорфенокси)-2,3,3а,4Приклад 24: 34(5,5-Діоксидо-2,3,3а,4тетрагідро-1Н-піроло[2,1-с][1,2,4]бензотіадіазин тетрагідро-1Н-піроло[2,1-с][1,2,4]-бензотіадіазин-75,5-діоксид іл)окси]фенол Точка плавлення: 194-198°С Очікуваний продукт одержують гідрогенізацією Елементний мікроаналіз: під атмосферним тиском при температурі навкоС% Н% N% S% Сl% лишнього середовища, протягом 5 годин, 100мг Підраховано 54,78 4,31 7,99 9,14 10,11 продукту Прикладу 22 у присутності 20мг палаЗнайдено 54,92 4,36 7,91 9,15 10,95 дію/С в 20мл етанолу і 10mл концентрованої хлоПриклад 18: 7-(3-Етоксифенокси)-2,3,3а,4ристоводневої кислоти. Після фільтрування і витетрагідро-1Н-піроло[2,1-с][1,2,4] бензотіад іазин паровування, залишок додають в ефір і 5,5-діоксид одержують очікуваний продукт після фільтруванТочка плавлення: 150°С ня. Елементний мікроаналіз: Точка плавлення: 205-208°С С% Н% N% S% Елементний мікроаналіз: Підраховано 59,98 5,59 7,77 8,90 С% Н% N% S% Знайдено 60,11 5,64 7,56 8,61 Підраховано 57,82 4,85 8,43 9,65 Приклад 19: 7-(3-Трифторметоксифенокси) 23 77737 24 Знайдено 57,80 4,89 8,27 9,31 бензотіадіазин-7-ол 1,1-діоксид Приклад 25: {3-[(5,5-Діоксидо-2,3,3а,479,3ммол триброміду бору додають краплями тетрагідро-1Н-піроло[2,1-с][1,2,4]-бензотіадіазин-7до суспензії, яка містить 2г продукту, одержаного іл)окси]феніл}етанон на попередній Стадії, у 200мл дихлорметану, який Точка плавлення: 170-172°С підтримують при -60°С під азотом. Температуру Елементний мікроаналіз: підтримують протягом однієї години і потім суміші С% Н% N% S% дають дійти до температури навколишнього сереПідраховано 60,32 5,06 7,82 8,95 довища і перемішують протягом ночі. Після охоЗнайдено 60,52 5,24 7,71 8,91 лодження реакційної суміші на льодяній бані доПриклад 26: Метил 3-[(5,5-Діоксидо-2,3,3а,4дають 100мл води і двофазну систему енергійно тетрагідро-1Н-піроло[2,1-с][1,2,4]бензотіадіазин-7перемішують. Суспензію, сформовану таким чиіл)окси]бензоат ном, фільтрують. Одержану тверду речовину проТочка плавлення: 223-227°С мивають водою, ефіром, і висушують, одержуючи Елементний мікроаналіз: очікуваний продукт. С% Н% N% S% Точка плавлення: 168-172°С Підраховано 57,74 4,85 7,48 8,56 Стадія Е: 4-Метил-7-фенокси-3,4-дигідро-2НЗнайдено 57,49 8,02 7,31 8,37 1,2,4-бензотіадіазин 1,1-діоксид Приклад 27: 3-[(5,5-Діоксидо-2,3,3а,4Очікуваний продукт одержують відповідно до тетрагідро-1Н-піроло[2,1-с][1,2,4]-бензотіадіазин-7методики, описаної на Стадії Ε Прикладу 1, почиіл)бензойна кислота наючи зі сполуки, описаної на попередній Стадії. 300мг продукту Прикладу 26 суспендують в Точка плавлення: 141-145°С 5мл 1N NaOH. Після перемішування у зворотному Елементний мікроаналіз: холодильнику протягом однієї години і ацилюванС% Н% Ν% S% ня з 1N хлористоводневою кислотою, очікуваний Підраховано 57,92 4,86 9,65 11,04 продукт одержують після фільтрування. Знайдено 57,97 4,95 9,45 11,36 Точка плавлення: 271-274°С Сполуки Прикладів 29-32 одержували відповіЕлементний мікроаналіз: дно до методики, описаної у Прикладі 28, викорисС% Н% N% S% товуючи відповідні вихідні матеріали. Підраховано 56,66 4,47 7,77 8,90 Приклад 29: 4-Етил-7-фенокси-3,4-дигідро-2НЗнайдено 56,58 4,68 7,70 8,84 1,2,4-бензотіадіазин 1,1-діоксид Приклад 28: 4-Метил-7-фенокси-3,4-дигідроТочка плавлення: 179-181°С 2Н-1,2,4-бензотіадіазин 1,1-діоксид Елементний мікроаналіз: Стадія А: 7-Ме токси-4Н-1,2,4-бензотіадіазин С% Н% N% S% 1,1-діоксид Підраховано 59,19 5,30 9,20 10,53 Суспензію 3,0г 2-аміно-5-метоксибензолЗнайдено 59,00 5,31 9,07 10,53 сульфонаміду перемішують протягом однієї ночі Приклад 30: 4-Пропіл-7-фенокси-3,4-дигідропри 80°С у присутності 1,31г формамідин гідро2Н-1,2,4-бензотіадіазин 1,1-діоксид хлориду і 2,27мл триетиламіну в 50мл толуолу. Точка плавлення: 143-145°С Толуол випаровують у вакуумі. Залишок додають Елементний мікроаналіз: у воду і осад відфільтровують. С% Н% N% S% Точка плавлення: 253-257°С Підраховано 60,36 5,70 8,80 10,07 Стадія В: 7-Метокеи-4-метил-4Н-1,2,4Знайдено 60,75 5,74 8,62 10,15 бензотіадіазин 1,1-діоксид Приклад 31: 3-[(4-Етил-1,1-діоксидо-3,42,88г продукту, одержаного на попередній дигідро-2Н-1,2,4-бензотіадіазин -7Стадії, додають порціями до суспензії 9мл ДМФ, іл)окси]бензонітрил яка містить 570мг 60% NaH в мінеральному маслі. Точка плавлення: 143-146°С Суміш перемішують протягом 30хв., поки не одерЕлементний мікроаналіз: С% Н% N% S% жують чорний розчин. 929mл йодометану потім Підраховано 58,34 4,59 12,76 9,74 додають краплями. Перемішування продовжують Знайдено 58,71 4,68 12,44 9,49 протягом 1год. і реакційну суміш осаджують за Приклад 32: 4-Етил-7-(3-метоксифенокси)-3,4допомогою додавання води. Осад відфільтровудигідро-2Н-1,2,4-бензотіадіазин 1,1-діоксид ють і промивають водою і потім ефіром, щоб одержати очікуваний продукт. Точка плавлення: 91-93°С Елементний мікроаналіз: Точка плавлення: 205-209°С С% Н% N% S% Стадія С: 7-Метокси-4-метил-3,4-дигідро-2НПідраховано 57,47 5,43 8,38 9,59 1,2,4-бензотіадіазин 1,1-діоксид Знайдено 57,17 5,40 8,01 9,41 1,19г боргідриду натрію додають до суспензії 2,37г продукту попередньої Стадії у 40мл етанолу. Приклад 33: 7-Фенокси-3,4-дигідро-2Н-1,2бензотіазин 1,1-діоксид Суміш поступово стає однорідною. Після реакції Стадія А: 6-Метокси-2-(2-оксопропіл)-1,2протягом 1год. при температурі навколишнього бензізотіазол-3(2Н)-он 1,1-діоксид середовища суміш охолоджують на льодяній бані і 360мг 6-метокси-1,1-діоксо-1,2-дигідронейтралізують додаванням IN HCl. Білий осад перемішують протягом 15хв. і вказаний у заголовку бензо[с1]ізотіазол-3-ону додають невеликими порціями до суспензії 72мг 60% NaH в мінеральному продукт відфільтровують. маслі у 1,6мл безводного диметилформаміду. ПісТочка плавлення: 126-128°С ля перемішування протягом 30хв. при температурі Стадія D: 4-Метил-3,4-дигідро-2Н-1,2,4 25 77737 26 навколишнього середовища реакційна суміш стає ного до -35°С. Суміші дають повернутись до температури навколишнього середовища. Після однорідною і до неї додають 162mл хлорацетону. Реакційну суміш нагрівають при 110°С протягом перемішування протягом 3год. при температурі навколишнього середовища реакційну суміш ви30хв. Їй дають охолонути до температури навколивають у воду при 5°С і екстрагування проводять лишнього середовища, і потім суміш осаджують з етилацетатом. Органічні фази об'єднують, прошляхом додавання води. Осад відфільтровують, мивають насиченим NaCl, висушують, фільтр ують промивають декілька разів водою, відфільтровують всмоктуванням і висушують у вакуумі. і випаровують. Одержують тверду речовину, яку додають у невеликій кількості до ізопропілового Точка плавлення: 185-191°С ефіру. Вказаний у заголовку продукт відфільтроСтадія В: 2-Ацетил-7-метокси-2Н-1,2вують. бензотіазин-4-ол 1,1-діоксид Точка плавлення: 173-177°С Розчин етанолату натрію в етанолі готують шляхом розчинення 1,08г натрію в 23мл етанолу у Стадія G: 7-Фенокси-3,4-дигідро-2Н-1,2бензотіазин 1,1-діоксид зворотному холодильнику. Температуру розчину Починаючи зі сполуки, описаної на попередній доводять до 40°С і 6,30г продукту Стадії А додаСтадії, очікуваний продукт одержують відповідно ють до нього з перемішуванням. Реакційна суміш до методики, описаної на Стадії Ε Прикладу 1. стає більш густою. 5мл етанолу додають для того, щоб зробити можливим перемішування, і провоТочка плавлення: 129-132°С Елементний мікроаналіз: дять нагрівання протягом додаткових 10хв. при 50С% Н% Ν% S% 55°С. Реакційну суміш потім охолоджують на льоПідраховано 61,07 4,76 5,09 11,65 дяній бані і ацилюють 3Ν НСl і сформований жовЗнайдено 61,40 4,85 5,11 11,40 тий осад відфільтровують. Точка плавлення: 162-166°С Сполуки Прикладів 34-38 одержували відповідно до методики, описаної у Прикладі 1, викорисСтадія С: 7-Метокси-2,3-дигідро-4Н-1,2товуючи відповідну арилборонову кислоту на Стабензотіазин-4,4-етилендіокси 1,1-діоксид дії Е. 5,35г продукту, одержаного на попередній Приклад 34: 7-(3-Метилсульфонілфенокси)Стадії, 200мг пара-толу олсульфонової кислоти і 5,6мл етиленгліколю перемішують у зворотному 2,3,3а,4-тетрагідро-1Н-піроло[2,1с][1,2,4]бензотіадіазин 5,5-діоксид холодильнику у 200мл бензолу в круглодонній коТочка плавлення: 160°С лбі, на якій встановлений апарат Діна-Старка. ПісЕлементний мікроаналіз: ля нагрівання у зворотному холодильнику протяС% Н% N% S% гом 72год., бензол випаровують у вакуумі. Залишок розчиняють в етилацетаті і органічну фаПідраховано 56,33 5,01 7,73 17,69 Знайдено 56,33 4,93 7,77 17,83 зу промивають водою і потім насиченим NaCl. Приклад 35: 7-(3-Етилфенокси)-2,3,3а,4Проводять сушіння, фільтрування і випаровування тетрагідро-1Н-піроло[2,1-с][1,2,4]бензотіадіазин і одержують олію, яку кристалізують з суміші ети5,5-діоксид ловий ефір/ізопропіловий ефір. Точка плавлення: 100-110°С Точка плавлення: 143-144°С Елементний мікроаналіз: Стадія D: 7-Метокси-2,3-дигідро-4Н-1,2С% Н% N% S% бензотіазин-4-он 1,1-діоксид Підраховано 62,77 5,85 8,13 9,31 Розчин 2,63г продукту з попередньої Стадії в Знайдено 62,69 5,88 8,1 9,26 суміші 50мл метанолу і 50мл 3N НСl перемішують у зворотному холодильнику протягом 15хв. Ме таПриклад 36: 7-(3-Ізопропілфенокси)-2,3,3а,4тетрагідро-1Н-піроло[2,1-с][1,2,4]бензотіадіазин нол випаровують у вакуумі і водну фазу екстрагу5,5-діоксид ють ефіром. Органічну фазу висушують і обробТочка плавлення: 171-172°С ляють паленою кісткою. Після фільтрування і Елементний мікроаналіз: випаровування, залишок додають в ізопропіловий ефір і тверду речовину відфільтровують. С% н% N% S% Підраховано 63,66 6,19 7,81 8,95 Точка плавлення: 124-127°С Знайдено 63,63 6,18 7,77 8,69 Стадія Е: 7-Метокси-3,4-дигідро-2Н-1,2Приклад 37: 7-(3-Фторфенокси)-2,3,3а,4бензотіазин 1,1-діоксид тетрагідро-1Н-піроло[2,1-с][1,2,4]бензотіадіазин 1,77г продукту з попередньої Стадії в 40мл оцтової кислоти гідрогенізують під тиском 5бар при 5,5-діоксид Точка плавлення: 201°С 70°С у присутності 1,75г 10% Pd/C. Суміші дають Елементний мікроаналіз: охолонути до температури навколишнього сереС% Н% N% S% довища і каталізатор відфільтровують. Фільтрат Підраховано 57,47 4,52 8,38 9,59 випаровують досуху і залишок хроматографують на силікагелі, використовуючи як елюент систему Знайдено 57,06 4,51 8,15 9,63 Приклад 38: 7-(3-Бромфенокси)-2,3,За,495/5 метилен хлорид/етилацетат, для одержання тетрагідро-1Н-піроло[2,1-с][1,2,4]бензотіадіазин очікуваного продукту. 5,5-діоксид Точка плавлення: 144-145°С Точка плавлення: 193-195°С Стадія F: 3,4-Дигідро-2Н-1,2-бензотіазин-7-ол 1,1-діоксид Елементний мікроаналіз: С% Н% N% S% Вr% 14,1мл 1М розчину ВВr3 у метилен хлориді доПідраховано 48,62 3,82 7,09 8,11 20,21 дають краплями до розчину 1г продукту з попереЗнайдено 48,95 3,82 7,03 8,13 20,02 дньої Стадії в 45мл метилен хлориду, охолодже 27 77737 28 Приклад 39: 3-[(5,5-Діоксидо-2,3,3а,40,90ммол триетиламіну, DMAP на кінчику шпатетрагідро-1Н-піроло[2,1-с][1,2,4]бензотіадіазин-7теля і потім, краплями, 0,90ммол метансульфоноіл)окси]бензамід вого ангідриду, розбавленого 8мл СН2СI2, додають Розчин 0,71ммол оксаліл хлориду, який роздо розчину 0,45ммол аміну Прикладу 42 у 30мл бавляють 1мл СН 2СI2, додають краплями до суСН2СI2. Після однієї ночі при температурі навколишнього середовища, реакційну суміш промиваспензії 5мл СН 2СI2 і 10ml ДМФ, який містить ють (IN HCI, насичений NaCl), висушують (MgSO4). 0,46ммол кислоти, одержаної у Прикладі 27. Все перемішують протягом 1год. 30 при температурі Очищення двох сформованих продуктів проводять шляхом хроматографії на силікагелі, елюючи навколишнього середовища і випаровують досуху. СН2СI2 100% СН2СI2/МеOН 95/5 градієнтом. ПерПаралельно, розчин 5млСН2СI2 насичують аміаший елюйований продукт відповідає диметилсуком, і тоді кислотний хлорид, одержаний вище, льфонілованому продукту, вказаному у заголовку. розчинений у 3 мл СН2С12, додають краплями до нього. Після перемішування протягом 2год. при Другий, моно-метилсульфонілована сполука відповідає продукту, описаному у наступному Притемпературі навколишнього середовища, реакційкладі. ну суміш розбавляють СН2СI2 і органічну фазу Точка плавлення: 214-215°С промивають підряд IN HCl, водою і насиченим Елементний мікроаналіз: NaCl. Після сушіння (MgSO4) і видалення розчинника екстрагуванням, залишок порошкують в суС% Н% N% S% Підраховано 44,34 4,34 8,62 19,73 міші ізопропілового ефіру і етилового е фіру. Білу Знайдено 44,72 4,55 8,55 19,84 тверду речовину відфільтровують для одержання Приклад 44: N-[3-(5,5-Діоксидо-2,3,3а,4очікуваного продукту. тетрагідро-1Н-піридо[2,1-с][1,2,4]бензотіазин-7Точка плавлення: 139-142°С Елементний мікроаналіз: іл)окси]феніл]метансульфонамід Як вказано у вищезазначеному Прикладі, вкаС% Н% N% S% заний у заголовку продукт відповідає другому проПідраховано 56,81 4,77 11,69 8,92 дукту, виділеному хроматографією за вказаними Знайдено 56,39 4,88 11,22 8,65 умовами. Приклад 40: 3-[(5,5-Діоксидо-2,3,За,4тетрагідро-1Н-піроло[2,1-с][1,2,4]-бензотіадіазин-7Точка плавлення: 117-120°С Елементний мікроаналіз: іл)окси]-N,N-диметилбензамід С% Н% N% S% Цю сполуку одержують відповідно до протокоПідраховано 49,86 4,68 10,26 15,66 лу Прикладу 39, замінюючи аміак диметиламіном у Знайдено 50,13 4,77 10,06 15,34 присутності піридину. Точка плавлення: 199-202°С Елементний мікроаналіз: Приклад 45: N-{3-[(5-Діоксидо-2,3,3а,4тетрагідро-1Н-піроло[2,1-с][1,2,4]бензотіадіазин-7С% Н% N% S% іл)окси]феніл}етансульфонамід Підраховано 58,9 5,46 10,85 8,28 Цю сполуку одержують відповідно до методиЗнайдено 58,97 5,54 10,66 7,86 ки Прикладу 43, використовуючи відповідний хлоПриклад 41: 3-[(5,5-Діоксидо-2,3,3а,4тетрагідро-1Н-піроло[2,1-с][1,2,4]-бензотіадіазин-7рсульфоніл. Точка плавлення: 169°С Елементний мікроаналіз: іл)окси]-N-метилбензамід С% Н% N% S% Цю сполуку одержують відповідно до протокоПідраховано 51,05 5,00 9,92 15,14 лу Прикладу 39, замінюючи амоній метиламіном у Знайдено 50,9 4,97 9,87 15,00 присутності піридину. Точка плавлення: 130-135°С Приклад 46: N-{3-[(5,5-Діоксидо-2,3,3а,4тетрагідро-1Н-піроло[2,1-с][1,2,4]бензотіадіазин-7Елементний мікроаналіз: іл)окси]феніл}пропан-2-сульфонамід С% Η% Ν% S% Цю сполуку одержують відповідно до методиПідраховано 57,88 5,13 11,25 8,59 ки Прикладу 43, використовуючи відповідний хлоЗнайдено 58,08 5,45 10,56 8,26 Приклад 42: 3-(5,5-Діоксидо-2,3,3а,4рсульфоніл. Точка плавлення: 179°С тетрагідро-1Н-піроло[2,1-с] [1,2,4]-бензотіазин-7Елементний мікроаналіз: іл)окси]анілін С% Н% N% S% Продукт Прикладу 15 (2,19ммол) розчиняють в Підраховано 52,16 5,30 9,60 14,66 суміші 100мл етилацетату і 50мл етанолу; 100мг 10% паладію на вугіллі додають і гідрогенізують Знайдено 51,88 5,33 9,87 14,71 Приклад 47: N-{3-[(5,5-Діоксидо-2,3,3а,4при атмосферному тиску протягом 1год. Каталізатетрагідро-1Н-піроло[2,1-с][1,2,4]бензотіадіазин-7тор відфільтровують, фільтрат випаровують досуіл)окси]феніл}бензолсульфонамід ху і залишок осаджують з ефіру для одержання Цю сполуку одержують відповідно до методиочікуваного продукту після фільтрування. Точка плавлення: 221-226°С ки Прикладу 43, використовуючи відповідний хлорсульфоніл. Елементний мікроаналіз: Точка плавлення: 142-145°С С% Н% N% S% Елементний мікроаналіз: Підраховано 57,99 5,17 12,68 9,68 С% Н% N% S% Знайдено 57,90 5,28 12,44 9,59 Приклад 43: N-(3-[(5,5-Діоксидо-2,3,3а,4Підраховано 56,04 4,49 8,91 13,60 Знайдено 56,33 4,62 8,60 13,67 тетрагідро-1Н-тетрагідро[2,1Приклад 48: N-{3-[(5,5-Діоксидо-2,3,3а,4с][1,2,4]бензотіадіазин-7-іл)окси]феніл}-Nтетрагідро-1Н-піроло[2,1-с][1,2,4]бензотіадіазин-7(метилсульфоніл)метансульфонамід 29 77737 30 іл)окси]феніл}ацетамід Цю сполуку одержують реакцією продукту Цю сполуку одержують відповідно до методиСтадії А Прикладу 49 з відповідним аміном. ки Прикладу 43, використовуючи оцтовий ангідрид. Точка плавлення: 151-155°С Точка плавлення: 251-253°С Елементний мікроаналіз: Елементний мікроаналіз: С% Н% N% S% С% Н% N% S% Підраховано 52,16 5,30 9,60 14,66 Підраховано 57,89 5,13 11,25 8,59 Знайдено 52,41 5,50 9,68 14,66 Знайдено 58,16 5,18 11,09 8,48 Приклад 52: Діетил 3-[(5,5-діоксидо-2,3,За,4Приклад 49: 3-[(5,5-Діоксидо-2,3,3а,4тетрагідро-1Н-піроло[2,1-с][1,2,4]бензотіадіазин-7тетрагідро-1Н-піроло[2,1-с][1,2,4]-бензотіадіазин-7іл)окси]фенілфосфонат іл)окси]бензолсульфонамід Суміш 5,40ммол бромзаміщеної сполуки ПриСтадія А: 3-[(5,5-Діоксидо-2,3,3а,4-тетрагідрокладу 38, 16,2ммол діетилфосфіту, 16,2ммол три1Н-піроло[2,1-c][1,2,4]-бензотіадіазин-7етиламіну, 1,62ммол Pd[P(Ph)3]4 перемішують проіл)окси]бензолсульфоніл хлорид тягом ночі в 110°С в 4мл ДМФ під струменем азоту. ДМФ випаровують, залишок додають в етиРозчин 2мл льодяної оцтової кислоти і 340mл лацетат і органічну фазу промивають розчином 1N води насичують SO2 шляхом барботування газом NaOH, водою, насиченим NaCl. Після сушіння і SO2 протягом 15хв. Паралельно, при 5°С готують розчин 1,51ммол аміну Прикладу 42 у суміші 1,3мл випаровування у вакуумі, одержують пінисту масу, яку кристалізують з ефіру для одержання очікувальодяної оцтової кислоти і 2,4мл концентрованої ного продукту. НСl. Розчин 1,7ммол нітриту натрію, розчиненого Точка плавлення: 148-152°С заздалегідь у 1мл води, додають краплями до цьоЕлементний мікроаналіз: го розчину, і реакційну суміш перемішують протягом 30хв. при 5°С. 0,6ммол СuСІ2.2Н2О додають С% Н% N% S% Підраховано 53,09 5,57 6,19 7,09 до розчину, який був насичений SO2, і одержану Знайдено 53,08 5,64 6,10 6,95 суспензію охолоджують до 5°С. Розчин діазонію, Приклад 53: Етилводень 3-[(5,5-діоксидоприготований вище, додають краплями до остан2,3,За,4-тетрагідро-1Н-піроло-[2,1нього. Суміш перемішують протягом 1год. при 5°С і потім протягом 1год. 30, даючи повернутись до с][1,2,4]бензотіадіазин-7-іл)окси]фенілфосфонат 0,66ммол продукту Прикладу 52 в 3мл В NaOH температури навколишнього середовища. Реакперемішують протягом 8год. при 70°С. Реакційний ційну суміш наливають на лід і осад відфільтровурозчин ацилюють IN HCI і білий осад відфільтроють і промивають водою. Після сушіння очікуваний вують для одержання очікуваного продукту. продукт одержують у формі бежевого порошку. Стадія В: 3-[(5,5-Діоксидо-2,3,3а,4-тетрагідроТочка плавлення: 177-182°С Елементний мікроаналіз: 1Н-піроло[2,1-с][1,2,4]-бензотіадіазин-7С% Н% N% S% іл)окси]бензолсульфонамід Підраховано 50,94 4,99 6,60 7,56 0,48ммол продукту з попередньої Стадії у суЗнайдено 50,85 5,02 6,59 7,65 міші 10мл 28% гідроксиду амонію, 2мл води і 1мл ацетону перемішують протягом ночі при темпераПриклад 54: 3-[(5,5-Діоксидо~2,3,За,4тетрагідро-1Н-шроло[2,1-c][1,2,4]-бензотіадіазин-7турі навколишнього середовища. Повільний переіл)окси]фенілфосфонова кислота хід до розчину спостерігають і, після однієї ночі, Ацетонітрил (20мл), 0,66ммол продукту Приодержують мутний оранжевий розчин. Розчин викладу 52 і 1,98ммол бромтриметилсилану переміливають у IN HCl, охолоджену заздалегідь на льодяній бані. Одержану в результату суспензію пешують у зворотному холодильнику протягом 1год. Розчинник і надлишок реагенту випаровують у ремішують протягом 10хв. і сирий продукт вакуумі і залишок додають у розчин у 10мл метавідновлюють фільтруванням. Очищення провонолу. Після перемішування протягом 30хв. розчин дять за допомогою хроматографії на силікагелі, випаровують досуху і залишок додають у IN HCl. використовуючи суміш 90/10 СН2Сl2/ацетон як елюент. Одержують камедь, яку кристалізують за допомогою додавання невеликої кількості СН 2Сl2. ОчікуТочка плавлення: 197-200°С ваний продукт відновлюють фільтруванням. Елементний мікроаналіз: Точка плавлення: 166-169°С С% Н% N% S% Елементний мікроаналіз: Підраховано 48,6 4,33 10,63 16,22 Знайдено 48,81 4,49 10,23 16,27 С% Н% N% S% Підраховано 48,49 4,32 7,07 8,09 Приклад 50: 3-[(5,5-Діоксидо-2,3,3а,4Знайдено 48,34 4,29 7,00 8,06 тетрагідро-1Н-піроло[2,1-с][1,2,4]-бензотіадіазин-7Приклад 55: 7-(3-Метилфенокси)-3,4-дигідроіл)окси]-N-пропілбензолсульфонамід 2Н-1,2-бензотіазин 1,1-діоксид Цю сполуку одержують реакцією продукту Стадії А Прикладу 49 з відповідним аміном. Приготовлений за допомогою зв'язування продукт, одержаний на Стадії F Прикладу 33, і 3Точка плавлення: 86-91°С метилфеніл-боронова кислота відповідно до меЕлементний мікроаналіз: тодики, описаної на Стадії Ε Прикладу 1. С% Н% N% S% Точка плавлення: 116-118°С Підраховано 52,16 5,30 9,60 14,66 Знайдено 52,96 5,30 9,33 14,41 Елементний мікроаналіз: С% Н% N% S% Приклад 51: 3-[(5,5-Діоксидо-2,3,3а,4Підраховано 62,26 5,23 4,84 11,08 тетрагідро-1Н-піроло[2,1-с][1,2,4]-бензотіадіазин-7Знайдено 62,69 5,17 4,94 10,90 іл)окси]-N-ізопропілбензолсульфонамід 31 77737 32 Сполуки Прикладів 56-61 одержували відповіЕлементний мікроаналіз: дно до методики, описаної для Прикладу 28, викоС% Н% N% S% ристовуючи етил йодид на Стадії В і відповідну Підраховано 42,57 3,57 9,31 14,21 арилборонову кислоту на Стадії Е. Знайдено 43,24 3,76 9,10 14,33 Приклад 56: 4-Етил-7-[(3Приклад 64: 1-{3-[(4-Етил-1,1-діоксидо-3,4метилсульфаніл)фенокси)-3,4-дигідро-2Ндигідро-2Н-1,2,4-бензотіадіазин-7[1,2,4]бензотіазин 1,1-діоксид іл)окси]феніл}етанол Точка плавлення: 127-130°С До 0,8мл безводного етанолу додають невеЕлементний мікроаналіз: ликими порціями 0,42ммол NaBH4, потім 0,21ммол С% Н% N% S% продукту Прикладу 59. Розчин перемішують протяПідраховано 54,83 5,18 7,99 18,30 гом 20хв. при температурі навколишнього середоЗнайдено 54,80 5,16 7,97 18,22 вища. Реакційну суміш охолоджують на льодяній Приклад 57: 4-Етил-7-(3-метилфенокси)-3,4бані і ацилюють додаванням краплями IN HCI. дигідро-2Н-[1,2,4]-бензотіадіазин 1,1-діоксид Реакційну суміш екстрагують етилацетатом і оргаТочка плавлення: 72-75°С нічну фазу промивають (вода, насичений NaCl), Елементний мікроаналіз: висушують (MgSO4) і випаровують для одержання С% н% N% S% очікуваного продукту. Підраховано 60,36 5,70 8,80 10,07 Точка плавлення: 60°С Знайдено 60,6 5,67 8,82 9,97 Елементний мікроаналіз: Приклад 58: N-{3-[(4-Етил-1,1-діоксидо-3,4С% Н% N% S% дигідро-2Н-1,2,4-бензотіадіазин-7Підраховано 58,60 5,79 8,04 9,20 іл)окси]феніл}метансульфонамід Знайдено 58,57 5,71 7,75 8,97 Точка плавлення: 165-168°С Приклад 65: 3-[(4-Етил-1,1-діоксидо-3,4Елементний мікроаналіз: дигідро-2Н-1,2,4-бензотіадіазин-7-іл)окси]бензойна С% Н% N% S% кислота Підраховано 48,35 4,82 10,57 16,13 Цю сполуку одержують відповідно до методиЗнайдено 48,74 5,02 10,39 16,22 ки, описаної у Прикладі 27. Приклад 59: 1-{3-[(4-Етил-1,1-діоксидо-3,4Точка плавлення: 228-230°С дигідро-2Н-1,2,4-бензотіадіазин-7Елементний мікроаналіз: іл)окси]феніл}етанон С% Н% N% S% Точка плавлення: 164-166°С Підраховано 55,16 4,63 8,04 9,20 Елементний мікроаналіз: Знайдено 54,89 4,69 7,89 9,32 С% Н% N% S% Приклад 66: 3-[(4-Етил-1,1-діоксидо-3,4Підраховано 58,94 5,24 8,09 9,26 дигідро-2Н-1,2,4-бензотіадіазин-7-іл)окси]бензамід Знайдено 59,06 5,24 7,81 8,88 Цю сполуку одержують амідуванням продукту Приклад 60: Етил-7-(3-тієнілокси)-3,4-дигідроПрикладу 65 відповідно до методики, описаної у 2Н-бензо[1,2,4]тіадіазин 1,1-діоксид Прикладі 39. Точка плавлення: 152-154°С Точка плавлення: 85-90°С Елементний мікроаналіз: Елементний мікроаналіз: С% Н% N% S% С% Н% N% S% Підраховано 50,30 4,55 9,03 20,66 Підраховано 55,32 4,93 12,10 9,23 Знайдено 50,26 4,42 80,92 20,97 Знайдено 55,21 5,13 11,52 8,85 Приклад 61: 7-(3,4-Диметилфенокси)-4-етилПриклад 67: 3-[(4-Етил-1,1-діоксидо-3,43,4-дигідро-2Н-1,2,4-бензотіадіазин 1,1-діоксид дигідро-2Н-1,2,4-бензотіадіазин-7-іл)окси]-N,NТочка плавлення: 109-111°С диметилбензамід Елементний мікроаналіз: Цю сполуку одержують амідуванням продукту С% Н% N% S% Прикладу 65 відповідно до методики, описаної у Підраховано 61,42 6,06 8,43 9,65 Прикладі 40. Точка плавлення: 65-70°С Знайдено 61,37 6,09 8,25 9,36 Елементний мікроаналіз: Приклад 62: 3-[(4-Етил-1Д-діоксидо-3,4С% Н% N% S% дигідро-2Н-1,2,4-бензотіадіазин-7-іл)окси]анілін Підраховано 57,58 5,64 11,19 8,54 Цю сполуку одержують відновленням нітро Знайдено 57,54 5,78 10,55 8,20 продукту Прикладу 15 відповідно до методики, Приклад 68: 3-Фенокси-6,6а,7,8,9,10описаної у Прикладі 42. гексагідропіридо[2,1-с][1,2,4]-бензотіадіазин 5,5Точка плавлення: 128-132°С діоксид Елементний мікроаналіз: Цю сполуку одержують відповідно до методиС% Н% Ν% S% ки, описаної у Прикладі 1, використовуючи 5Підраховано 56,41 5,37 13,16 10,04 хлорпропановий кислотний хлорид на Стадії А. Знайдено 56,84 5,53 12,89 10,17 Цю сполуку одержують амідуванням продукту Приклад 63: N-{3-[(4-Етил-1,1-діоксидо-3,4Прикладу 65 відповідно до методики, описаної у дигідро-2Н-1,2,4-бензотіадіазин-7-іл)окси]феніл}Прикладі 40. 1,1,1-трифторметансульфонамід Точка плавлення: 211-213°С Цю сполуку одержують реакцією аміну ПриЕлементний мікроаналіз: кладу 62 з трифторметансульфоновим ангідридом С% Н% N% S% в умовах, описаних для Прикладу 43. Підраховано 61,80 5,49 8,48 9,70 Точка плавлення: 136-138°С Знайдено 61,61 5,45 8,35 9,79 33 77737 34 Фармакологічні дослідження продуктів за дають концентрацію, яка подвоює (ЕС2Х) або збільним винаходом шує у п'ять разів (ЕС5Х) силу струму, викликаного Дослідження збуджувальних токів, викликаних самим АМРА (від 5 до 50нА). АМРА в ооцитах Xenopus b - Результати: а - Спосіб: Сполуки за даним винаходом підсилюють збумРНК одержують з кори головного мозку самджувальні ефекти АМРА до дуже значних рівнів і їх ців щурів Wistar способом гуанідин тіоціаактивність є дуже переважною у порівнянні зі спонат/фенол/хлороформ. Полі (А+) мРНК відділяли луками, на які є посилання. Сполука Прикладу 3, хроматографією на оліго-dT целюлозі та ін'єктуваособливо, має значення ЕС2Х на рівні 0,8μΜ і знали в кількості 50нг на ооцит. Ооцити залишають чення ЕС5Х на рівні 3,6μΜ. Що стосується сполуки інкубуватись протягом 2-3 днів при 18°С, щоб доПрикладу 29, то вона має значення ЕС2Х на рівні зволити вираження рецепторів, і потім зберігають 1,4μΜ і значення ЕС5Х на рівні 4,5μΜ. при 8-10°С. Фармакологічна композиція Проводять електрофізіологічну реєстрацію у Формула для приготування 1000 таблеток, кожна з яких містить 100мг камері PlexiglassÒ при 20-24°С у середовищі OR2 сполука Прикладу 1 100г [J. Exp. Zool., 1973, 184, 321-334] способом "напругідроксипропілцелюлоза 2г га-фіксація" з використанням двох електродів, з третім електродом, розміщеним у ванні, яка слупшеничний крохмаль 10г лактоза 100г жить як зразок. стеарат магнію 3г Всі сполуки вводять через середовище інкубатальк 3г ції і електричний струм вимірюють в кінці періоду введення. АМРА використовують у концентрації 10μΜ. Для кожної досліджуваної сполуки визнача Комп’ютерна в ерстка О. Гапоненко Підписне Тираж 26 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюBenzothiazine and benzothiadizine derivatives, a process for preparation thereof and pharmaceutical composition containing them
Автори англійськоюDesos Patrice, Lestage Pierre
Назва патенту російськоюПроизводные бензотиазина и бензотиадиазина, способ их получения и фармацевтическая композиция, содержащая их
Автори російськоюДезо Патрис, Лестаж Пьер
МПК / Мітки
МПК: A61P 25/22, C07D 285/24, C07D 513/04, A61P 43/00, A61P 25/00, A61P 25/14, A61P 25/18, C07D 417/12, A61K 31/549, A61P 25/28, A61K 31/662, A61P 25/08, C07D 279/00, A61P 25/24, A61P 9/10
Мітки: фармацевтична, бензотіадіазину, похідні, спосіб, композиція, бензотіазину, містить, одержання
Код посилання
<a href="https://ua.patents.su/17-77737-pokhidni-benzotiazinu-i-benzotiadiazinu-sposib-kh-oderzhannya-i-farmacevtichna-kompoziciya-shho-kh-mistit.html" target="_blank" rel="follow" title="База патентів України">Похідні бензотіазину і бензотіадіазину, спосіб їх одержання і фармацевтична композиція, що їх містить</a>
Попередній патент: Фармацевтична композиція на основі похідних азетидину
Наступний патент: Захисний елемент, захищений від підробки папір, цінний документ та перевідний матеріал
Випадковий патент: Збірно-монолітний залізобетонний каркас будівлі "житлобуд"












