Мікроорганізми для обробки ґрунту та спосіб їх одержання
Формула / Реферат
1. Препарати, прийнятні для обробки ґрунту та насіння рослин, що містять живі мікроорганізми або мікроорганізми, здатні до розмноження у ґрунтах різних типів у навколишньому середовищі рослини, які характеризуються тим, що містять у кількості 5 ´ 106 – 1011, переважно 107 – 1010 клітин/га, культуру Azotobacter vinelandii spp. M657 (NCAIM/P/B 001292) і, необов‘язково, один або більше наступних мікроорганізмів:
Azospirillum brasilense ssp. SW51 (NCAIM/P/B 001293),
Pseudomonas fluorescens var. SW11 (NCAIM/P/B 001296),
Bacillus polymyxa var. SW17 (NCAIM/P/B 001295),
Bacillus megaterium var. M326 (NCAIM/P/B 001291),
Micrococcus roseus ssp. (NCAIM/P/B 001294),
Bradyrhizobium japonicum var. PH25 (NCAIM/P/P 001302),
Streptomyces albus var. 0003 LP (NCAIM/P/B 001301),
згадані мікроорганізми, що також розмножуються при низькій температурі, переважно нижче 20 °С, а також у ґрунтах з низьким значенням рН, переважно нижче 5,0, задепоновані у Національній Колекції сільськогосподарських та промислових мікроорганізмів, разом з придатними сільськогосподарськими вологими або сухими носіями, придатними з сільськогосподарської точки зору, та такими, що є нетоксичними для мікроорганізмів.
2. Препарати згідно з пунктом 1, що містять воду та/або соєве борошно, та/або крохмаль, та/або целюлозу, та/або глюкозу, або їх похідні як носій.
3. Препарати згідно з пунктом 1 або 2, що містять як мікроорганізм:
Azotobacter vinelandii spp. M657 (NCAIM/P/B 001292),
Azospirillum brasilense ssp. SW51 (NCAIM/P/B 001293),
Pseudomonas fluorescens var. SW11 (NCAIM/P/B 001296),
Bacillus megaterium var. M326 (NCAIM/P/B 001291).
4. Спосіб приготування продуктів, прийнятних для обробки ґрунту та насіння рослин та/або препаратів, що містять живі мікроорганізми або мікроорганізми, здатні до розмноження на різноманітних типах ґрунтів у навколишньому середовищі рослин, які також розмножуються при низькій температурі, переважно нижче 20°С, а також у ґрунтах з низьким значенням рН, переважно нижче 5,0, який характеризується тим, що культивування здійснюють окремо або разом, на культуральному середовищі, яке містить джерела вуглецю та азоту та неорганічні солі Azotobacter vinelandii spp. M657 (NCAIM/P/B 001292) і, необов‘язково, один або більше наступних мікроорганізмів:
Azospirillum brasilense ssp. SW51 (NCAIM/P/B 001293),
Pseudomonas fluorescens var. SW11 (NCAIM/P/B 001296),
Bacillus polymyxa var. SW17 (NCAIM/P/B 001295),
Bacillus megaterium var. M326 (NCAIM/P/B 001291),
Micrococcus roseus ssp. (NCAIM/P/B 001294),
Bradyrhizobium japonicum var. PH25 (NCAIM/P/P 001302), і
Streptomyces albus var. 0003 LP (NCAIM/P/B 001301),
задепонованих у Національній Колекції сільськогосподарських та промислових мікроорганізмів, до досягнення кількості клітин на мілілітр від 5 ´ 107 до 5 ´ 109, при необов‘язковому змішуванні культури або культур у вказаних співвідношеннях, або при необов‘язковому осадженні культур(и) на носії, або при перемішуванні з ним, та при необов‘язковому висушуванні заморожуванням традиційним способом.
5. Спосіб згідно з пунктом 3, який відрізняється тим, що як джерело вуглецю використовують глюкозу та/або сахарозу, та/або мелясу, а як джерело азоту використовують хлорид амонію, та/або нітрат амонію, та/або сульфат амонію, та/або рідкий кукурудзяний крохмаль, та/або гідролізат казеїну, а як неорганічні солі використовують карбонат кальцію та солі, які дисоціюють на іони натрію, калію, магнію, кальцію, заліза, нітрату, хлориду, сульфату, карбонату, фосфату, а також мікроелементи.
6. Спосіб обробки ґрунту за допомогою препаратів згідно з пунктом 1 або 2, який відрізняється тим, що вносять мікроорганізми у кількості від 1010 до 1014, оптимально від 1011 до 1012 клітин на гектар, на поверхню ґрунту або у ґрунт у період, коли відсутнє промерзання ґрунту
7. Спосіб обробки насіння рослин за допомогою препаратів згідно з пунктом 1 або 2, який відрізняється тим, що проводять обробку насіння за допомогою рідкого продукту, що містить один з мікроорганізмів або їх суміш.
8. Спосіб згідно з пунктом 7, який відрізняється тим, що препарати, згідно з пунктом 1 або 2, містять Azotobacter vinelandii spp. M657 (NCAIM/P/B 001292) і Bradyrhizobium japonicum var. PH25 (NCAIM/P/В 001302).
9. Спосіб поліпшення та підтримання структури ґрунту, який відрізняється тим, що у ґрунт вносять полісахариди мікробіологічного походження, одержані переважно з мікроорганізмів, що біосинтезують сукциноглюкон.
10. Спосіб згідно з пунктом 9, який відрізняється тим, що застосовують мікроорганізми, здатні до біосинтезу полісахаридів, оптимально продукти, що містять штами Bacillus polymyxa var. SW17 (NCAIM/P/B 001295), Bacillus megaterium var. M326 (NCAIM/P/B 001292), Micrococcus roseus ssp. (NCAIM/P/B 001294), Bradyrhizobium japonicum var. PH25 (NCAIM/P/P 001302).
11. Спосіб згідно з пунктом 9 або 10, який відрізняється тим, що застосовують Bradyrhizobium japonicum var. PH25 (NCAIM/P/P 001302).
Текст
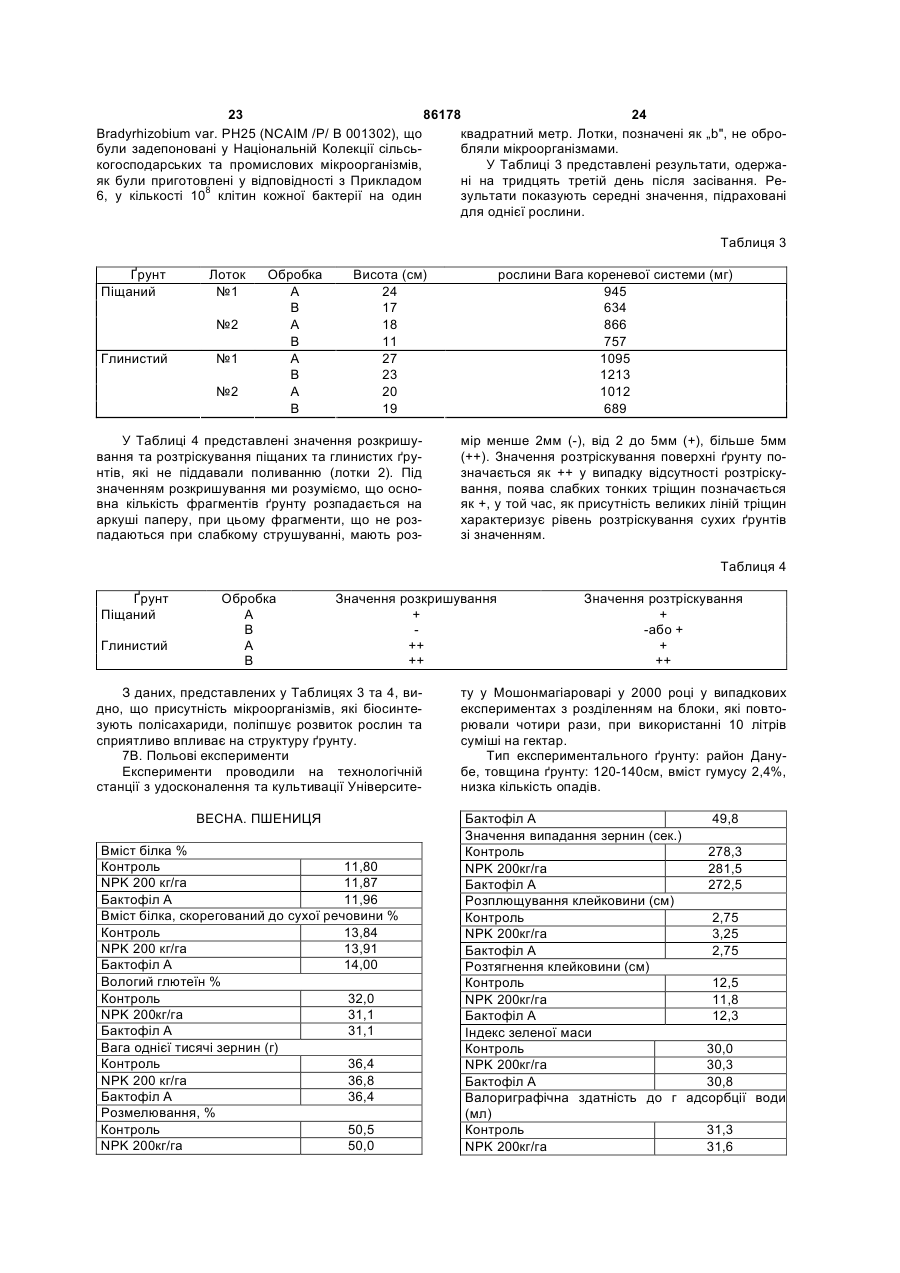
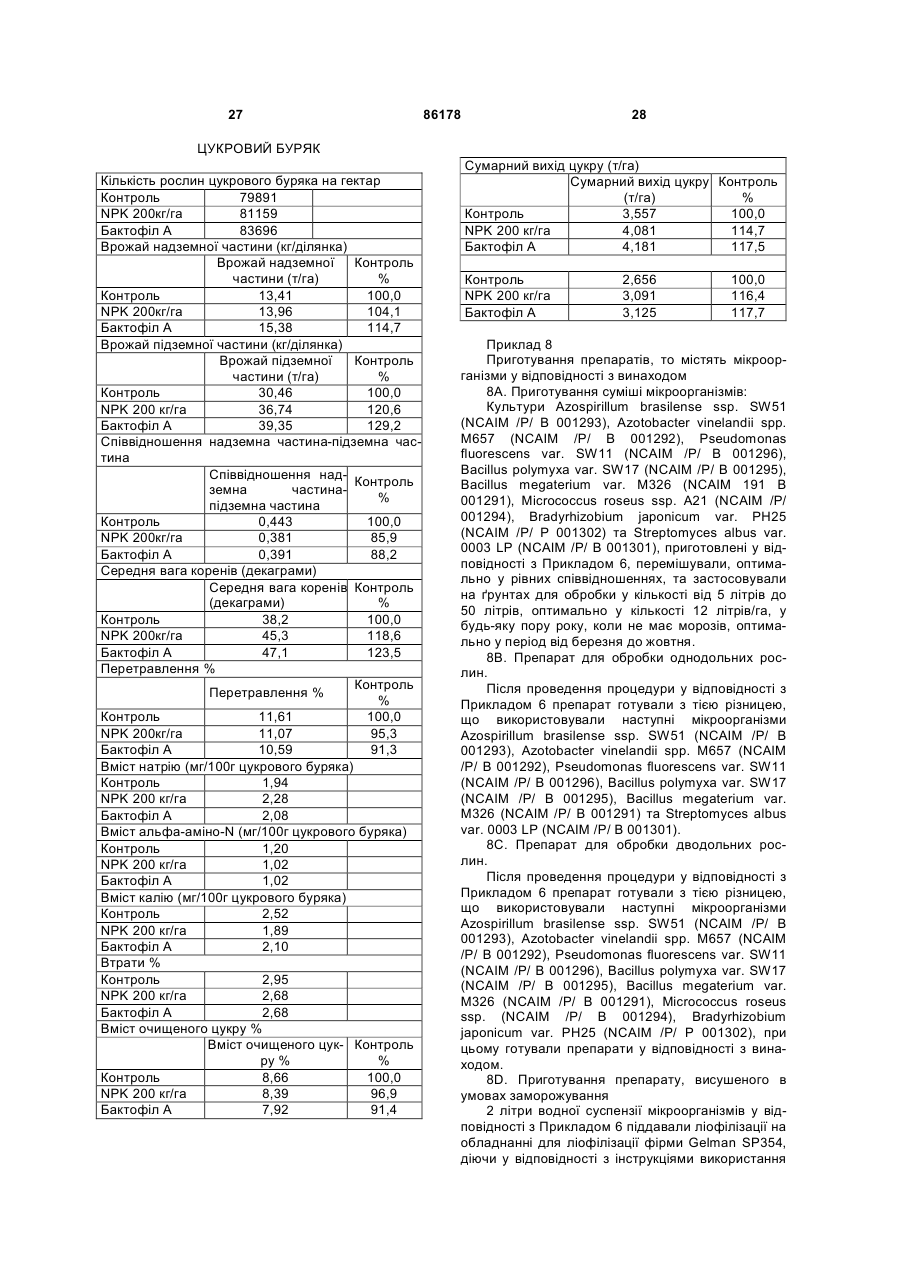
1. Препарати, прийнятні для обробки ґрунту та насіння рослин, що містять живі мікроорганізми або мікроорганізми, здатні до розмноження у ґрунтах різних типів у навколишньому середовищі рослини, які характеризуються тим, що містять у кількості 5 ´ 106 – 1011, переважно 107 – 1010 клітин/га, культуру Azotobacter vinelandii spp. M657 (NCAIM/P/B 001292) і, необов‘язково, один або більше наступних мікроорганізмів: Azospirillum brasilense ssp. SW51 (NCAIM/P/B 001293), Pseudomonas fluorescens var. SW11 (NCAIM/P/B 001296), Bacillus polymyxa var. SW17 (NCAIM/P/B 001295), Bacillus megaterium var. M326 (NCAIM/P/B 001291), Micrococcus roseus ssp. (NCAIM/P/B 001294), Bradyrhizobium japonicum var. PH25 (NCAIM/P/P 001302), 2 (19) 1 3 86178 4 довищі, яке містить джерела вуглецю та азоту та сульфату, карбонату, фосфату, а також мікроеленеорганічні солі Azotobacter vinelandii spp. M657 менти. (NCAIM/P/B 001292) і, необов‘язково, один або 6. Спосіб обробки ґрунту за допомогою препаратів більше наступних мікроорганізмів: згідно з пунктом 1 або 2, який відрізняється тим, Azospirillum brasilense ssp. SW51 (NCAIM/P/B що вносять мікроорганізми у кількості від 1010 до 001293), 1014, оптимально від 1011 до 1012 клітин на гектар, Pseudomonas fluorescens var. SW11 (NCAIM/P/B на поверхню ґрунту або у ґрунт у період, коли від001296), сутнє промерзання ґрунту Bacillus polymyxa var. SW17 (NCAIM/P/B 001295), 7. Спосіб обробки насіння рослин за допомогою Bacillus megaterium var. M326 (NCAIM/P/B 001291), препаратів згідно з пунктом 1 або 2, який відрізMicrococcus roseus ssp. (NCAIM/P/B 001294), няється тим, що проводять обробку насіння за Bradyrhizobium japonicum var. PH25 (NCAIM/P/P допомогою рідкого продукту, що містить один з 001302), і мікроорганізмів або їх суміш. Streptomyces albus var. 0003 LP (NCAIM/P/B 8. Спосіб згідно з пунктом 7, який відрізняється 001301), тим, що препарати, згідно з пунктом 1 або 2, місзадепонованих у Національній Колекції сільськоготять Azotobacter vinelandii spp. M657 (NCAIM/P/B сподарських та промислових мікроорганізмів, до 001292) і Bradyrhizobium japonicum var. PH25 (NCAIM/P/В 001302). досягнення кількості клітин на мілілітр від 5 ´ 107 9. Спосіб поліпшення та підтримання структури до 5 ´ 109, при необов‘язковому змішуванні кульґрунту, який відрізняється тим, що у ґрунт внотури або культур у вказаних співвідношеннях, або сять полісахариди мікробіологічного походження, при необов‘язковому осадженні культур(и) на носії, одержані переважно з мікроорганізмів, що біосинабо при перемішуванні з ним, та при неотезують сукциноглюкон. бов‘язковому висушуванні заморожуванням тра10. Спосіб згідно з пунктом 9, який відрізняється диційним способом. тим, що застосовують мікроорганізми, здатні до 5. Спосіб згідно з пунктом 3, який відрізняється біосинтезу полісахаридів, оптимально продукти, тим, що як джерело вуглецю використовують глющо містять штами Bacillus polymyxa var. SW17 козу та/або сахарозу, та/або мелясу, а як джерело (NCAIM/P/B 001295), Bacillus megaterium var. M326 азоту використовують хлорид амонію, та/або ніт(NCAIM/P/B 001292), Micrococcus roseus ssp. рат амонію, та/або сульфат амонію, та/або рідкий (NCAIM/P/B 001294), Bradyrhizobium japonicum var. кукурудзяний крохмаль, та/або гідролізат казеїну, PH25 (NCAIM/P/P 001302). а як неорганічні солі використовують карбонат 11. Спосіб згідно з пунктом 9 або 10, який відрізкальцію та солі, які дисоціюють на іони натрію, няється тим, що застосовують Bradyrhizobium калію, магнію, кальцію, заліза, нітрату, хлориду, japonicum var. PH25 (NCAIM/P/P 001302). Даний винахід відноситься до продукту(ів), що містить(ять) живий(і) мікроорганізм(и), прийнятний(і) для обробки грунту, до мікроорганізмів, які розмножуються при різноманітних кліматичних та природних умовах, а також до способу одержання таких продуктів і способу обробки ґрунту та рослин за допомогою цих продуктів. Більш докладно, винахід стосується способу одержання продуктів з будь-якого - мікроорганізму, вказаного нижче, а також з їх сумішей. Крім того, винахід відноситься до способу створення культур мікроорганізмів, що використовуються. Об'єкт даного винаходу також представляє собою мікроорганізми самі по собі. Більш докладно, винахід стосується способу для обробки ґрунту та рослин за допомогою продукту, що містить, принаймні, один з мікроорганізмів Azospirillum brasilense ssp. SW51 (NCAIM /Ρ/ В 001293), Azotobacter vinelandii spp. M657 (NCAIM /Ρ/ Β 001292), Pseudomonas fluorescens var. SW11 (NCAIM /Ρ/ Β 001296), Bacillus polymyxa var. SW17 (NCAIM /P/ В 001295), Bacillus megaterium var. M326 (NCAIM /Ρ/ Β 001291), Micrococcus roseus ssp. (NCAIM /P/ В 001294) Bradyrhizobium japonicum var. PH25 (NCAIM /Ρ/ Ρ 001302), Streptomyces albus var. 0003 LP (NCAIM /Ρ/ Β 001301), а також продуктів, які розмножуються та існують у навколишньому середовищі даних рослин, таких, що містять вказані мікроорганізми, та способу їх одержання. Природне середовище ґрунту представляє собою екосистему рослин та мікроорганізмів, що здатна до саморегуляції у природних умовах, існування такої моделі визначає усі інші параметри. Коли завдяки діяльності людини змінюється баланс, що розвинувся в процесі еволюції (глибока оранка, природні та штучні добрива, використання агентів для захисту рослин, тощо), в структурі та функціях цієї моделі можуть виникати непередбачувані зміни. Для розвитку популяцій мікроорганізмів, що необхідні для оптимального культивування даної вирощуваної культури, на різних ґрунтах та у різних кліматичних умовах та для селекції необхідний період часу, що триває багато років. Проте детермінантні мікроорганізми сприятливої популяції мікроорганізмів можуть бути введені у ґрунт, а умови, необхідні для оптимальної культивації можуть бути створені протягом одного-двох днів. Результатом цього ε більш високий врожай, якого досягають при відсутності шкідливого порушення природної екосистеми. Корисні та домінантні мікроорганізми, що існують у навколишньому середовищі даної рослини та є важливими з економічної точки зору, можуть бути визначені за допомогою 5 86178 6 лабораторних дослідів, після цього їх можна індинізми вносять у функцію ґрунту, мінеральний відуально розмножувати та одержувати за допосклад ґрунту стає задовільним, і при цьому не є могою промислових способів, при цьому вони це необхідним використання добрив, що містять фозабезпечує відновлення ґрунту у відношенні влассфат, або їх використання може бути значно зниних пропорцій. жене. В екосистемі ґрунту та мікроорганізмів можуть Для росту рослини потребують - особливо у бути відкриті важливі закономірності. У безпосеремомент дозрівання врожаю - значної кількості кадньому навколишньому середовищі кореневої силію. Хлібороби вносять калій у ґрунт шляхом пістеми живих рослин (ризосфері) та пророслого дживлення добривами, що містять калій. Таке добнасіння (сперматосфері) може бути визначена риво може бути доступним з калійної мінеральної різна кількість мікроорганізмів та можуть також сировини при використанні мікроорганізмів, що бути ідентифіковані різноманітні мікроорганізми. вивільняють іони калію. Розмноження бактерій в навколишньому середоСтосовно рослин можуть бути корисними міквищі коріння зазнає впливу багатьох факторів. Ці роорганізми, які підвищують біосинтез фізіологічно фактори залежать від району, якості ґрунту, склаактивних сполук у ґрунті, такими важливими споду популяції мікроорганізмів та від кліматичних луками, за винятком перерахованих вище, є фітоумов. гормони, ауксини (індол-3-оцтова кислота), етиДжерело вуглецю, що знаходиться у ґрунті, лен, гібереліни, кінетини, тощо. Деякі групи поступає у рослини, головним чином, та у переваPseudomonas у присутності заліза у незначній кіжній більшості рослин при використанні сонячної лькості здатні до утворення так званих сидерофоенергії та за допомогою фотосинтезу. рів, які можуть акумулювати залізо. Наслідком Цикл азоту ε більш складним, ніж такий для цього є те, що інші фітопатогенні бактерії та гриби, вуглецю. На процес перетворення азоту здійснюоскільки вони не можуть використовувати залізо з ють вплив біологічні та хімічні процеси. У природсидерофорів, зазнають інгібування з причини відних умовах газоподібний азот у так званій інертній сутності заліза, з іншого боку, ці сидерофори на формі є переважаючим, а так званий зв'язаний ґрунтах, де відсутнє залізо, значно стимулюють азот (нітрат, нітрит, амоній) присутній в обмеженій ріст рослин, оскільки, зв'язуючи залізо, вони безкількості. посередньо забезпечують ним рослину. За мінералізацію газоподібного азоту, перш за Для вирішення описаних вище проблем було все, відповідає біологічне зв'язування азоту. Оскірозроблено декілька технічних версій; при цьому льки кількість молекулярного азоту над одним гекдеякі мікроорганізми описані у спеціальній літературі більш детально. таром складає приблизно до 6-7´108 тонн, то це Угорські винахідники розкрили спосіб приготуозначає невичерпане джерело для зв'язування вання порошкоподібних нитрифікаційних культур азоту. Інтереси дослідників спрямовані на організ[угорський патент HU 143.391], культур Azobacter ми, що здатні до зв'язування азоту, тобто на оргаchroococcum та Rhizobium meliioti [угорський панізми, які можуть відновлювати молекулярний азот тент HU 188.434], культури водоростей [угорський до амонію, оскільки, поряд з іншими, знання стопатент HU 195.068] та культури Azotobacter совно цих мікроорганізмів та адекватне викорисchroococcum, а також препаратів культур мікроортання їх властивостей можуть забезпечити сприяганізмів Bacillus megaterium [угорський патент HU тливим для навколишнього середовища шляхом 207.751]. Azobacter chroococcum був задепоноваусунення голоду. ний під депозитним номером №00238, Bacillus Деякі бактерії, що зв'язують азот, здатні фіксуmegaterium - під серійним номером NCAIM /Р/ В вати азот при відсутності живих організмів, але 1140. Більш докладно, в угорських патентах HU значна кількість бактерій здатна до фіксації азоту 188.434 та HU 207.751 автори описують ферментільки у поєднанні з іншими організмами, вищими тативне виробництво вказаних вище задепоноварослинами. них мікроорганізмів. Згідно з угорським патентом Цикл фосфору, на противагу до азоту, є пракHU 213.163 автори доповнили культуру мікрооргатично закритим у природних умовах. Надходження нізмів за патентом HU 207.751 карбоксиметилцета вихід є однаковими, потік є незначним, повітря люлозою. Угорські винахідники в HU1671/96 опине є забруднене фосфором. Таким чином, цей сують культури мікроорганізмів, що' містять елемент акумулюється у воді, морях, та тільки Azospirillum lipoferum ssp., Azobacter vinelandii sp., незначна його кількість повертається назад на Pseudomonas fluorescens ssp. та Bacillus Землю (наприклад, у формі гуано). megaterium ssp. У живих клітинах, що містяться у ґрунті, фосЗастосування та ефект мікроорганізмів, що вифор акумулюється в органічних сполуках, їх мінекористовуються у згаданих вище процедурах, обралізація проходить при високій швидкості (3-8 межені тим фактом, що різні умови культивування, г/м2/рік). Розчинність фосфорних сполук, що виниґрунти різного складу, різні кліматичні умови, корокають, - і, таким чином, їх доступність для рослин ткий період виживання, умови навколишнього се, є різною, тільки 5% від середнього вмісту 400редовища та ризосфера різних рослин не завжди 1200мг фосфору, що визначається у кожному 1кг створюють оптимальні умови. ґрунту, є доступними. Період кругообігу деяких Основна мета винаходу полягає у приготуванфосфорних сполук складає 500-2000 років. ня препаратів таких культур фунтових мікроорганіШляхом введення груп мікроорганізмів, що розмів, які з огляду на вирощувані рослини та з екозкладають фосфорні сполуки у ґрунт, складні фономічної точки зору забезпечують сприятливий сфорні сполуки, які ε недоступними для рослини, ефект та які у той самий час можуть зберігати житможуть бути переведені у розчин. Якщо мікроорга 7 86178 8 тєздатність, розмножуватися та проявляти свій Azotobacter vinelandii spp. M657 (NCAIM /Ρ/ Β сприятливий вплив на різноманітних ґрунтах та 001292), Pseudomonas fluorescens var. SW11 стосовно різноманітних рослин, при різних кліма(NCAIM /Ρ/ Β 001296), Bacillus polymyxa var. SW17 тичних умовах та умовах культивації. (NCAIM /Ρ/ Β 001295), Bacillus megaterium var. Несподівано було виявлено, що розмноження M326 (NCAIM /P/ В 001291), Micrococcus roseus та збереження життєздатності мікроорганізмів, що ssp. A21 (NCAIM /P/ В 001294), Bradyrhizobium вирощуються у лабораторних умовах, та які сприjaponicum var. PH25 (NCAIM /Ρ/ Β 001302) та ятливо впливають на розвиток рослини, і при цьоStreptomyces albus var. 0003 LP (NCAIM /Ρ/ Β му фіксація азоту, мобілізація фосфату, стимулю001301), що можуть розмножуватися при низькій вання росту рослини, покращення структуру температурі у період сівби, та які забезпечують ґрунту варіюють в залежності від характеру ґрунту, рослини азотом, мобілізують фосфор, калій, біотемпературних умов та самої рослини у своєму синтезують ростові гормони та полісахариди, і безпосередньому оточенні. У ході експериментів таким чином, ми ізолювали такі мікроорганізми та було підтверджено, що, хоча це і є несподіваним, розробили їх спосіб вирощування. інші групи мікроорганізмів можуть розмножуватися З огляду на вказане вище у період з 1998 до у ризосфері різноманітних рослин або поблизу неї 1999 року ми ізолювали в Європі з ґрунту та серета виявляти тут свій вплив протягом тривалого довища, що оточує кореневу систему деяких росперіоду часу. лин, мікроорганізми, які тестували in vitro на їх Таким чином, були проведені експерименти здатність до фіксації азоту, розчинних фосфату та стосовно культивування рослин для ізоляції таких калію, полісахаридів, що беруть участь у створенні мікроорганізмів, які справляють сприятливий та біосинтезі рослинних гормонів, систематично ефект на навколишнє середовище даної рослини, ідентифікували вибрані мікроорганізми, приготущо є важливим з економічної точки зору. Крім того, вали такі варіанти шляхом мутаційної обробки, при були також виконані експерименти по ізоляції мікцьому такі мікроорганізми також інтенсивно розмроорганізмів, при цьому такі мікроорганізми моножуються при температурі нижче 20°С, для кульжуть мобілізувати іони калію. Такі мікроорганізми, тивування за допомогою цих розроблених технощо ізольовані з ґрунту та які піддавали лаборатологій вирощування з таких культур готували рним перетворенням шляхом мутаційних процепрепарати та перевіряли їх вплив на розвиток родур, можна розмножувати під час внесення у фунт, слин та на врожаї у теплицях та в умовах польовопри низькій температурі, при цьому вони виявляго експерименту. ють свій вплив на інші організми, хоча це звучить Ізолювали види та підвиди Azospirillum, несподівано для спеціаліста. Azotobacter, Bradyrhizobium, Pseudomonas, У ході експериментів ми встановили, що певні Bacillus, Streptomyces та Micrococcus. мікроорганізми, які продукують полісахариди, неВідомими видами Azospirillum є бактерії, що сподіваним чином змінюють структуру ґрунту мають Грам-негативне забарвлення в умовах ґрусприятливим з сількогосподарської точки зору чинту, при цьому ці види в мікро-аерофільних умовах ном, поліпшуючи стійкість до посухи. (у присутності 1-2% кисню) та при тісному контакті Підсумком та метою нашої експериментальної з кореневою системою рослин можуть відновлюроботи було ізолювати такі мікроорганізми, які вати азот повітря до амонію, а потім передавати передають азот, фосфор, калій рослинам, біосинйого рослинам. Деякі групи також синтезують ростезують рослинні ростові гормони, біосинтезують линні гормони. полісахариди, поліпшуючи структуру ґрунту, та які Групи Azospirillum були ізольовані з середоє здатними до розмноження у період сівби та у вища, що оточує корені кукурудзи, пшениці, ячмекраїнах з більш холодним кліматом, а також здатні ню, жита, що вирощуються на різноманітних орних до виявлення свого впливу на різноманітних грунземлях Європи, на різноманітних ґрунтах луків. тах та рослинах. Крім того, нашою метою було Бактеріальну суспензію із зразків ґрунту диспергустворення таких препаратів, в яких вміст мікроорвали у культуральному середовищі Nfb(ll) та ММ ганізмів у навколишньому середовищі рослини, у культуральному середовищі, що має склад наверизосфері, або безпосередньо серед рослинних дений нижче, а потім культивували в мікроклітин, шляхом фіксації та мобілізації життєво неаерофільних умовах. Через 72 години ідентифікуобхідних елементів, а також шляхом продукції ровали культури Azospirillum. Культури Azospirillum, слинних факторів росту та полісахаридів у навкощо відрізняються від інших дрібних бактеріальних лишньому середовищі даної рослини поліпшує та грибкових культур, досягали розміру приблизно розвиток даної рослини або родини рослин, вна3мм. слідок чого ми можемо уникати використання добКультури Azospirillum sp. під час фази експорива, і це забезпечує захист навколишнього серененціального росту на рідкому середовищі ММ та довища. м'якому агаризованому середовищі Nb(ll), що маОб'єктом даного винаходу є спосіб вирощують склад приведений нижче, продемонстрували вання приведених мікроорганізмів, -препарати, що морфологічні властивості, характерні для клітин їх містять, крім того, застосування препарату(ів), Azospirillum. що містить(ять) мікроорганізм(и), та конкретні мікКлітини мали віброїдну форму та S-подібну роорганізми. форму та розмір 1-2´2-4мкм. Для свого росту вони Даний винахід ґрунтується на визнанні того вимагали внесення біотину. На основі мікроскопічфакту, що для створення препаратів особливо них спостережень було виявлено, що вони мають прийнятними є наступні мікроорганізми Azospirilздатність швидко рухатися. їх рухливість може lum brasilense ssp. SW51 (NCAIM /Ρ/ B001293), бути приписана полярному джгутику. В своїх клі 9 86178 10 тинах вони можуть акумулювати полі-бетаізолювали групу Bradyrhizobium 13 липня з плангідроксибутиратні зерна та каротини. Червонуваті тації сої, що знаходиться у Шубаші, поблизу Сеплями зміни забарвлення можуть бути пояснені гед-Кішкундоросма. З вирощуваних рослин відбистарінням культури. Для свого росту вони можуть рали добре розвинуті рослини, потім використовувати органічні кислоти, такі, як яблучвідокремлювали добре розвинені бульбочки з кона кислота, молочна кислота, пірорацемічна кисренів. Ізолювали психрофільний варіант мікроорлота, а також бутандіоєва кислота. Фіксація азоту ганізма, як описано у представленому прикладі. з повітря має місце в мікро-аерофільних умовах. В Наші зразки ґрунту ми досліджували на мікрооргаекстремальних умовах, таких, як, наприклад, у нізми, що мобілізують фосфат, та ідентифікували випадку недостатності вологи, при низькому або відібрані мікроорганізми з систематичної точки високому значенні pH, при відсутності джерела зору. Частину мікроорганізмів визначали як такі, азоту або вуглецю, клітини можуть перетворюващо відносяться до Pseudomonas, іншу частину тися у цисти, в яких відсутній джгутик, але які місвизначали як такі, що відносяться до видів Bacillus. тять полі-бета-гідроксибутиратні зерна та оточені Pseudomonas представляє собою Грамкапсулярним полісахаридом. Спектр джерел вугнегативні аеробні клітини у формі тонких паличок, лецю, що можуть використовуватися мікроорганізвони виробляють у середовище основний забарвмами, змінюється в залежності від видів: А. Amaлювальний пігмент, при цьому вказані мікроорганіzonense: глюкоза + сахароза + інозитол+, A. зми представляють собою сапрофіти. Не спостеріBrasilense глюкоза + сахароза та інозитол -, A. гається ніякої продукції каротину, вони не ростуть Irakense використовує глюкозу (+) та сахарозу (+), при температурах, вищих 40°С. На желатинизоваале не використовує інозитол (-), a A. Lipoferum них агарах спостерігається їх зрідження. Нашою використовує тільки глюкозу. У середовищі, що не групою споживається глюкоза, але не споживаєтьмістить азоту, спектр використовуваних джерел ся крохмаль. Оскільки варіанти груп Pseudomonas, вуглецю відрізняється у більшій мірі, так, що вкащо виробляють забарвлювальний агент, системазані чотири види не можуть бути розрізнені. тично перебувають у тісному зв'язку, можна споСпектр використовуваних джерел вуглецю ізольостерігати певну систематичну гетерогенність між ваних нами мікроорганізмів частково відрізняється нашими мікроорганізмами та типовими групами: від такого для АТСС 29.731 А. Amazonense, A. наші мікроорганізми - що є характерним для Brasilense, A. Irakense неотипу [Holt, J.G. з співавPseudomonas - добре споживають глюкозу, галакторами. Керівництво Бергі з бактеріологічного витозу, оцтову кислоту, мальтозу, гліцерин та пірозначення, 9-е видання, 1994]. На противагу до тирацемічну кислоту. Вони не споживають фруктозу, пових груп вони прекрасно розмножуються у D-арабінозу, мальтозу, лактозу, крохмаль та інуприсутності 3,5% хлориду натрію, на м'якому агарі лін. На противагу до типових груп, проте, вони (це буде описано пізніше), їх мікроскопічна картина здатні рости на ксилозі, сахарозі та у деякій мірі на відрізняється у різні періоди культивування, їх сорбіті. Як єдине джерело вуглецю вони можуть продукування пігментів є більш інтенсивним, навикористовувати гліцин. приклад, на картопляному агарі. На основі вказаного вище, один з наших мікДеякі ізольовані Azospirillum є близькими до роорганізмів було ідентифіковано як такий, що видів А.lipoferum, A.amazonense, A.brasilense, а відноситься до виду Pseudomonas fluorescens, також до видів А.irakense, ми проводили подальші було також виявлено, що він схожий з варіантами, експерименти з ними при селекції однієї з груп що належать до групи Біовару III. Ми назвали цю Azospirillum brasilense. групу як Pseudomonas fluorescens ssp. З вказаних вище зразків ґрунту на Nfb(ll) м'яНа основі систематичних характеристик, відкому агарі були ізольовані мікроорганізми мінних від клітин виду Bacillus, які розчиняють неAzotobacter, їх піддавали селективному культивурозчинний фосфат, деякі були ідентифіковані як ванню, а потім на середовищі ММ та на середотакі, що відносяться до Bacillus polymyxa, а деякі вищі Федорова піддавали дисперсії та селекції як такі, що відносяться до Bacillus megaterium. Деодин з підвидів на основі здатності до фіксації азоякі групи були вибрані для подальших експеримету та зберігали для подальших експериментів. нтів. Клітини групи мали або плейоморфну або коковиЗ калієвих мінералів для ізолювання мікроордну форму. У присутності кисню вони можуть швиганізмів, здатних мобілізувати іони калію, з повердко рухатися. На середовищі, вільному від азоту, хні мінералів, що містять калій, польового шпату вони можуть виробляти забарвлювальний агент, та звичайної слюди, були ізольовані мікроорганізжовтувато-зелений пігмент, вони також добре ми, їх потім піддавали тестуванню так, як описано споживають рамнозу та мезо-інозитол. у наведених -прикладах, на твердому середовищі, Добре відомо, що Rhizobium утворює бульбочвільному від калію, для підтвердження мобілізацію ки на коренях бобових, при цьому, перебуваючи калію. При використанні процедури, що наведена серед рослинних клітин, вони безпосередньо пеу прикладах, шляхом мутаційних обробок, було редають фіксований азот рослині. З різними бобоодержано та задепоновано мікроорганізм, ідентивими у взаємозв'язок вступають різноманітні види фікований як Streptomyces psychrophilic. Rhizobium, з соєвими вступають у взаємозв'язок Ми також ізолювали такий мікроорганізм, який група Bradyrhizobium. Оскільки види останньої групісля систематичного та морфологічного тестів, а пи Rhizobium представляють собою єдину групу, також тестів на рибосомальну ДНК, був ідентифіяку вносять після збору врожаю, і вони не заликований як Micrococcus roseus та показав значний шаються у ґрунті у великій кількості, бажаним є сприятливий ефект у випадку експерименту на використовувати цю групу для обробки ґрунту. Ми рослинах. Одна з груп мікроорганізмів була заде 11 86178 12 понована, при цьому цю групу піддавали перетвосприятливим чином. Препарати у відповідності з ренням у лабораторних умовах. даним винаходом, їх одержання та застосування, Винахід також базується на тому факті, що міна відміну від відомих препаратів та способів прикроорганізми, які викликають сприятливий ефект, готування, що мають таке саме застосування та при внесенні у ґрунт можуть розмножуватися так призначені для тієї самої мети, ґрунтуються на швидко, на скільки це можливо на початкових етавикористанні мікроорганізмів, що справляють різпах розвитку проростків та рослин у кліматичних номанітні, відмінні між собою впливи, та які ізольоумовах осені та ранньої весни, а також у країнах з вані з різних ґрунтів, при цьому вони справляють більш холодним кліматом. Таким чином, мікроорспецифічний вплив на дану, економічно важливо ганізми піддають обробці, ізолюють та підтримурослину, яку піддають культивуванню, при цьому ють у відповідності з тим, як це описано у Прикладі вказані мікроорганізми можуть також розмножува4. Шляхом відомих способів були ізольовані мутатися при низьких температурах восени та ранньою нти та варіанти, що розмножуються при низьких весною у зонах з більш холодним кліматом. температурах, пізніше їх було задепоновано у НаМікроорганізми у відповідності з даним винаціональній Колекції сільськогосподарських та проходом можуть культивуватися на середовищі, що мислових мікроорганізмів. містить джерело вуглецю, наприклад, глюкозу, Винахід відноситься до таких препаратів та крохмаль, сахарозу або мелясу, як джерело азоту способів, при використанні яких збільшується вро- рідкий кукурудзяний екстракт, казеїн, дріжджовий жай рослинних культур. Спосіб виробництва суекстракт або солі амонію, а також інші неорганічні проводжується культивуванням мікроорганізмів, солі та солі, що дисоціюють на іони та мікроелеякі були ізольовані з різноманітних фунтів, навкоменти, але, як це є очевидним для спеціалістів, лишнього середовища різноманітних рослин, таможе використовуватися будь-яке засвоюване ких, що існують у навколишньому середовищі даджерело вуглецю та азоту та неорганічні солі, що ної рослинної родини протягом тривалого періоду сприяють розмноженню бактерій згідно з винахочасу, розмножуються при низьких температурах, дом. на різноманітних ґрунтах, винахід передбачає таКультура, що містить мікроорганізми згідно з кож внесення препаратів, що містять культури, під винаходом, може бути внесена безпосередньо у відповідні рослини, нанесення їх на насіння або їх ґрунт, який піддають обробці або під рослини у внесення в орні землі. Згідно з винаходом, препасередовищі, яке використовується для культивурати можуть використовуватися при обробці ґрунвання, при цьому також можуть бути приготовлені ту, рослин та рослинного насіння препаратами, що препарати, які підтримують біотичний потенціал містять, принаймні, один з наступних мікроорганімікроорганізмів, серед таких препаратів можна змів: Azospirillum brasilense ssp. SW51 (NCAIM /Ρ/ назвати такі препарати, що містять носій, який Β001293), Azotobacter vinelandii spp. M657 (NCAIM фіксує бактерії на насінні за допомогою адгезив/P/ В 001292), Pseudomonas fluorescens var. SW11 них сил. Кількість бактерій, що вноситься у ґрунт, (NCAIM /Ρ/ Β 001296), Bacillus polymyxa var. SW17 може варіювати від 5´1011 до 5´1015 клітин на гек(NCAIM /Ρ/ Β 001295), Bacillus megaterium var. тар, найбільш сприятлива кількість клітин складає M326 (NCAIM /P/ В 001291), Micrococcus roseus від 1012 до 1013. ssp. A21 (NCAIM /Ρ/ Β 001294), Bradyrhizobium Згідно з Будапештським договором ми задеjaponicum var. PH25 (NCAIM /Ρ/ Ρ 0012...) та понували ізольовані мікроорганізми, що були видіStreptomyces albus var. 0003 LP (NCAIM /Ρ/ Β лені з різноманітного навколишнього середовища 0012...). рослин та які також можуть розмножуватися при В результаті обробки буде прискорюватися нижчих температурах, у Національній Колекції розвиток рослин, вони стають більш стійкими до сільськогосподарських та промислових мікрооргапатогенів, покращується забезпечення їх водою та нізмів, при цьому вони були зареєстровані під наструктура ґрунту, поліпшується стан рослин, а таступними депозитними номерами: кож забезпечуються високі врожаї навіть при зниAzospirillum brasilense ssp. SW51 (NCAIM /Ρ/ женому використанні добрив або взагалі при відΒ001293) сутності використання добрив. Azotobacter vinelandii spp. M657 (NCAIM /Ρ/ Β Одна з найбільш важливих переваг способу 001292) згідно з даним винаходом полягає у його запроваPseudomonas fluorescens var. SW11 (NCAIM дженні при культивуванні рослин, при цьому прак/Ρ/ Β 001296) тично немає необхідності у застосуванні добрив на Bacillus polymyxa var. SW17 (NCAIM /Ρ/ Β основі азоту, фосфату та калію або таке застосу001295) вання може бути знижене в значній Мірі. Ефект Bacillus megaterium var. M326 (NCAIM /Ρ/ Β забруднення навколишнього середовища добри001291) вами є очевидним. Сполуки, що біосинтезуються у Micrococcus roseus ssp. A21 (NCAIM /Ρ/ Β клітинах мікроорганізмів, покращуючи рослинний 001294) розвиток, прискорюють розвиток оброблених росBradyrhizobium japonicum var. PH25 (NCAIM /Ρ/ лин, розвиток кореневої системи, а також у той Ρ 001302) та самий час поліпшується і забезпечення водою, Streptomyces albus var. 0003 LP (NCAIM /Ρ/ Β мікроорганізми, що використовуються для підкор001301). ми пригнічують розвиток фітопатогенних мікроорОб'єм даного винаходу також поширюється на ганізмів, а полісахариди, що біосинтезуються у задепоновані групи та на їх штучні та природні клітинах деяких з наших мікроорганізмів, поліпшумутанти, варіанти або також на лінії вказаних вище ють структуру ґрунту, водний баланс та особливо 13 86178 14 мікроорганізмів, що одержані будь-яким відомим 0,5% матеріалу, розчиненого у 0,2 Ν шляхом. ΚΟΗ) Приведене нижче призначене для ілюстрації Розчин 1,564% Fe-ЕДТА 4,0мл винаходу за допомогою прикладів, без обмеження Розчин вітамінів ** 1,0мл Агар 1,75г об'єму захисту. У прикладах проценти виражені у вагових Середовище доводили до значення pH 6,8 1Ν процентах, якщо інше не вказано. водним розчином КОН. "Композиція мікроелеменПриклад 1 тів була наступною: Ізолювання мікроорганізмів, що фіксують азот Сульфат заліза (II) ´7Η2Ο 200мг повітря, з різноманітних ґрунтів та навколишнього Хлорид заліза (III) ´6Η2Ο 10мг середовища різноманітних рослин та підтверСульфат магнію ´Η2Ο 1мг дження їх здатності до фіксації азоту Сульфат міді ´5Н2О 2мг Види Azospirillum представляли собою бактеNaMO4´2Н2О 1мг рії, що мають негативне забарвлення за Грамом, Хлорид кобальту ´ 6Н2О 2мг та які здатні до відновлення азоту повітря до амоСульфат цинку ´7Η2Ο 2мг нію в мікро-аерофільних умовах (у присутності 1Тетраборат натрію ´10Н2О 1мг 2% кисню), а також є здатними до того, щоб зроP2O5´24WO3´H2O 0,5мг бити його доступним для рослин. Нітрат вісмуту ´5Η2Ο 0,1мг Види Azospirillum були ізольовані з різних зраХлорид олова 0,01мг зків ґрунтів (гумусних ґрунтів, лесових, натрієвих, Хлорид селену 0,01мг коричневих та чорних ґрунтів, тощо), з частини Йодид калію 1мг ґрунту, що оточує кореневу систему різноманітних Лимонна кислота 100мг рослин (зернових культур, соняшника, кукурудзи, Дистильована вода до 1000мл трав'яних культур, тощо). Хімічні атрактанти, такі, "Композиція розчину вітамінів була наступною: як органічні кислоти та цукри, приваблюють групи Вітамін С 50мг Azospirillum шляхом хемотаксису. Допомагаючи Вітамін В1 5мг собі за допомогою джгутика, бактерії рухаються до Вітамін Ε 2мг коренів, та досягнувши їх, заселяють корені. Вітамін А 2мг Готували 10-, 100-, 1000- та 10000- кратні розБіотин 4мг ведення даних зразків ґрунту за допомогою стериДистильована вода 100мл льної дистильованої води, 100мкл суспензії поміБактерії, що вирощувалися на середовищі ММ щали у чашки Петрі, що містять м'який агар на на чашках, переносили в анаеробні термостати основі MM та Nfb(ll). Склад середовища MM був шляхом заміни повітряного прошарку термостату наступним: на азот, потім доводили до концентрації кисню К2НРО4 1,65г/л 1,6% за допомогою введення повітря задовільної MgSO4´7Н2О 0,29г/л якості. Чашки інкубували при температурі 32°С, СаСl2´2Н2О 0,07г/л після чого через 72 години ідентифікували органіNaMoO4´2Н2О 0,005г/л зми Azospirillum. У відповідності до серії розведенZnSO4´7Н2О 0,007г/л ня на чашках з десятикратним розведенням суCoSO4´7Н2О 0,00014г/л спензії розвивалося суцільне бактеріальне поле, у Глюкоза 5,0г/л той час, як при 10000-кратному розведенні суспенБактоагар 20,0г/л зії розвивалося тільки 30-50 культур. Культури КН2РО4 0,87г/л Azospirillum, що відрізняються від інших дрібних NaCI 0,18г/л культур бактерій та грибів, досягали розміру прибFeCI3´6Н2О 0,01г/л лизно 3мм. За межами цих культур деякі були MnSO4´Η2Ο 0,00014г/л морфологічно подібними до культур Azospirillum. CuSO4´5Η2Ο 0,000125г/л Деякі з них ми відбирали для подальшого досліН3ВО3 0,00003г/л дження. Сахароза 5,0г/л Культури, що вирощувалися на м'якому агарі Глюкозу стерилізували окремо від інших комNfb(ll), поміщали в аеробний термостат у вказанопонентів середовища MM шляхом автоклавування му вище середовищі та при вказаних вище умовах (121°С, 30 хвилин), потім перемішували з іншими культивування, перш за все розмножувалися компонентами після охолодження до температури Azospirillum, що мали характерну морфологію. 60°С. Стерильне середовище доводили до знаРізноманітні групи бактерій Azospirillum, одержані з чення pH 7,4, за допомогою стерильного 1N розсередовища ММ та Nfb(ll), вирощували у відповідчину NaOH. ності з мікробіологічною практикою, таким чином, Склад середовища Nfb(ll) був наступним: що первинна бактеріальна культура розмножуваL-малеїнова кислота 5,0г лася двічі в одній культурі на повному середовищі Гідрофосфат калію 0,5г ТАg. Групи бактерій Azospirillum очищали шляхом Сульфат магнію ´7Н2О 0,2г розмноження двічі в одній культурі на рідкому сеХлорид натрію 0,1г редовищі ТАg та зберігали у групі культур. БактеХлорид кальцію 0,02г ріальна суспензія, що зберігалася при температурі Розчин мікроелементів* 2,0мл -80°С, вважалася групою культур та усі експериБром-тимоловий блакитний (водний менти проводили з цією культурою. Склад середорозчин 2,0мл вища ТАg був наступним: 15 86178 16 Бактотриптон (Діфко) 1,0% Карбонат кальцію 0,5% Дріжджовий екстракт (Діфко) 0,1% Хлорид натрію 0,05% NaCI 0,5% Хлорид заліза (III) 0,02% Агар 2,5% Молібденат натрію 0,0002% Після стерилізації додавали водні розчини наМанітол 2,0% ступних сполук у приведених заключних концентБактоагар 2,0% раціях: Значення pH середовища перед стерилізацією доводили до 7,0 за допомогою 1N гідроксиду на0,1%0,1МСаСІ2´6Н2О трію. 0,1%0,1ММgСІ2´6Н2О На м'якому агарі на основі Nfb(ll) при селекти0,2% глюкоза (стерилізується окремо) вному культивуванні, а потім при селективному Після стерилізації pH розчину доводили до культивуванні на вільному від азоту середовищі значення 7,0-7,2. Колонізацію коренів мікроорганіММ та середовищі Федорова, мікроорганізми змами можна визначати шляхом простого експеAzotobacter ізолювали зі зразків орних земель. Ці рименту. На коренях рослин кукурудзи та пшениці, групи були визначені як такі, що відносяться до що оброблені бактеріями Azospirillum, та які вировиду Azotobacter vinelandii згідно з систематичнищувалися на стерильному перліті (горщики діамеми характеристиками та спектром джерел вуглетром 15см) визначали рівну кількість клітин (1´1010 цю, що можуть використовуватися, вони можуть клітин на горщик) на основі підрахунку під мікросфіксувати молекулярний азот повітря у великій копом, було встановлено, що вони характеризувакількості та були позначені, як М65-01-34, крім толися суттєво більшою колонізацією, ніж для контго, як описується нижче, нами були ізольовані варолів. Колонізація коренів мала місце на основі ріанти, що також розмножуються при низьких темспецифічних механізмів впізнання. У випадку копературах та біосинтезують полісахариди, один з лонізації клітини Azospirillum проходили у матрикс таких варіантів був задепонований. коренів і тут - шляхом активної фіксації азотуЗдатність груп Azospirillum та Azotobacter до могли покривати частину потреби в азоті основних фіксації азоту також визначали за допомогою мерослин (асоціативна фіксація азоту). Це підтвертоду відновлення ацетилену. Згідно з методом джувалося підвищеним ростом зеленої маси куку[Dilworth Μ.J., J.Biochem. Biophys. Acta, 27,285, рудзи та пшениці, інокульованої групами 1996] ацетилен вводять у культуру, що знаходитьAzospirillum у випадку лабораторних експерименся у закритих чашках, за допомогою пристрою для тів, результати яких викладені у деталях нижче. введення, потім після інкубації протягом 12 годин, Azospirillum продукує рослинні гормони та агенти, 0,25мл газової суміші вводять у колонку Propak N що також поліпшують ріст. Підвищення рівня прогазового хроматографа Перкін-Елмер. Концентрадукції цих агентів та їх сприятливий ефект на осції ацетилену та етилену газової суміші визначановні групи рослин може бути проілюстрований ють за допомогою детектора водню з іонізацією підвищеною здатністю до розмноження та більш полум'ям. З висоти піків ацетилену та етилену моінтенсивним ростом рослин у випадку експерименжна зробити чіткий висновок стосовно складної тів, які проводилися у лабораторних умовах. ферментативної активності нітрогенази. Наші груМорфологічні характеристики ізольованих випи Azospirillum та Azotobacter відновлювали протядів Azospirillum можуть бути знайдені у загальній гом 1 години ацетилен у кількості від 15 до 85 частині опису. нмоль до етилену. При селективному культивуванні на м'якому Група Bradyrhizobium була ізольована 13 липагарі на основі середовища Nfb(ll), a також на віня 2000 року від рослин сої, які вирощувалися у льному від азоту середовищі ММ при селективноШубаші поблизу Сегед-Кішкундоросма. З рослин, му культивуванні мікроорганізми Azospirillum були які вирощувалися на лесових ґрунтах, були відібізольовані зі зразків орних земель. Ці групи були рані розвинуті рослини, з їх коренів видаляли розідентифіковані як такі, що відносяться до виду винуті бульбочки. Бульбочки промивали дистильоAzospirillum brasilense згідно зі систематичними ваною водою, подрібнювали, а потім частинки характеристиками та спектром використання джесуспендували у розчині фізіологічної солі. З сурела вуглецю, згідно з більш високою здатністю до спензії у стерильних умовах готували серії розвефіксації молекулярного азоту повітря у відповіднодення та вносили у повне середовище. Здатність сті з оцінкою SW5-01-07, крім того, як описується до фіксації азоту культур, які вирощували після нижче, були ізольовані варіанти, що також розмінкубації протягом 48 годин у так званих умовах ножуються при низьких температурах та біосинтетестування рослин на симбіоз визначали як опизують полісахариди, один з таких варіантів був сано нижче: поверхню комерційного насіння люцезадепонований. рни (Medicago sativa) піддавали стерилізації за Для ізоляції груп Azospirillum у доповнення до допомогою теплової обробки шляхом витримуванвикористання середовища Nfb(ll) та MM композиня протягом 2 годин при температурі 72°С, а потім ції, що приведена вище, зразки ґрунту також кульобережно промивали за допомогою розчину Гіпо, тивували на середовищі Федорова, при цьому що Mat концентрацію 20%, потім пророщували у Azotobacter показав характерні морфологічні влассередовищі на основі дистильованої води, що містивості. Склад середовища Федорова був таким, тить1% агару. Проростки поміщали на 1,5% агарояк приведено нижче: ві косяки Гібсона (дивися нижче) та вирощували у Дигідрофосфат калію 0,03% теплиці протягом тижня. Кожну рослину віком один Гідрофосфат кальцію 0,02% тиждень піддавали інокуляції клітинами бактеріаСульфат калію 0,02% льної культури та знову вирощували у теплиці Сульфат магнію ´7Η2Ο 0,03% 17 86178 18 середній розмір, якого досягали кільця, складав протягом подальших восьми тижнів. З груп, які 34мм. належать трьом рослинам, що продемонстрували Кожна індивідуальна група Pseudomonas та значний оптимальний розвиток (суха маса частин деякі групи Bacillus були підтверджені як такі, що коріння складала 22-26мг на противагу до контроволодіють властивостями інтенсивної солюбілізальних рослин, для яких це значення складало 3ції фосфату. У розчині також добре визначалися 5мг), три з цих груп були відібрані на основі їх влагрупи, які містили обидва варіанти, що володіють стивостей, які є важливими з морфологічної та відмінною здатністю розчиняти неорганічний фоссистематичної точок зору. Ми визначили ці мікроофат, таким чином, їх можна визначити як такі, що рганізми як Bradyrhizobium japonicum var. PH-2-1-3. володіють відмінними властивостями до розчиПриклад 2 нення фосфату. Ізоляція мікроорганізмів, які солюбілізують На основі їх систематичних характеристик та фосфат та калій спектру джерел вуглецю, що можуть використовуЗразки ґрунту збирали у різних частинах земватися, з урахування дослідів, були відібрані чоної поверхні. Водні суспензії зразків вносили у сетирнадцять мікроорганізмів Pseudomonas та дваредовище ТАg (див. вище), а потім визначали дцять п'ять мікроорганізмів Bacillus, вони були морфологію клітин ізольованих матеріалів культур ідентифіковані як такі, що є Pseudomonas fluoresPseudomonas та Bacillus. cence, Bacillus polymyxa, а також Bacillus Різноманітні групи Pseudomonas та Bacillus megaterium, вказані варіанти позначали як SW1-1піддавали очистці у відповідності з мікробіологіч14, SW17-1-15 та М32-1-10, вони розмножуються ною практикою шляхом кількаразового засівання при низькій температурі, а також біосинтезують первинної бактеріальної культури на одиничній полісахариди у великій кількості, і ці групи були культурі на повному середовищі ТАg. Розмножуізольовані та задепоновані. вали одержані бактеріальні групи при засіванні Ізоляцію мікроорганізмів, що мобілізують іони рідкого та твердого середовища ТАg, та зберігали калію, проводять так, як описано вище, з тією різїх очищеними. ницею, що з середовища Піковської (HP), склад Властивість мікроорганізмів мобілізовувати якого наведений вище, виключається хлорид кафосфат перевіряли на середовищі поживного агалію та додається роздрібнений у тонкий порошок ру (Оксоїд), що містить 1% гідроксиапатиту, з мопольовий шпат та слюдовий сланець замість гіддифікацією Піковської (HP), що також доповнене роапатиту. 10% трикальцій фосфатом та глюкозою (0,2%). В оточуючому середовищі культур мікрооргаСклад середовища, що використовувався під нізмів, що несуть неорганічні солі, які повністю час експериментів, був наступним: нерозчинні у воді або лише частково розчиняютьМодифіковане середовище Піковської: ся у розчині, буде утворюватися прозора зона. Гідроксиапатит 1,0% Були відібрані деякі з цих мікроорганізмів, на (NH4)2SO4 0,05% основі систематичних, морфологічних характерисNaCI 0,02% тик та спектру джерел вуглецю, що може викорисKCI 0,02% товуватися, вони були ідентифіковані як такі, що MgSO4 ´ 7H2O 0,01% належать до родів Bacillus та Streptomyces, наші Дріжджовий екстракт 0,05% 15 груп були позначені як такі, що мають номер 1Агар 1,5% 015-0003, потім, як описано нижче, були ізольовані Глюкоза (стерилізується окремо) 1,0% варіанти, які розмножуються при низькій темпераРозчини наступних сполук додавали до серетурі, один з них було задепоновано. довища після стерилізації: Приклад 3 1% 20мг/100мл FeSO4 ´ 7Н2О Ізоляція мікроорганізмів, що продукують сиде1% 40мг/100мл MnSO4 ´ Н2О рофори та рослинні гормони Перед стерилізацією значення pH середовища Здатність до продукції сидерофору та гормонів доводили до 7,2. у груп, ізольованих так, як описано у Прикладах 1 Naoxg: поживний агар (Оксоїд), приготовлений та 2, була перевірена при використанні середовиу відповідності з інструкціями виробника + 0,2% ща Кінг В. Композиція була такою, як приведено глюкози. нижче: Під час визначення здатності до розчинення Пептон 2% фосфату груп, які були відібрані у ході попередніх Гліцерин 1% експериментів на середовищі Піковської (HP), куK2PO4 0,15% льтури, що вирощували протягом 3-4 днів при теMgSO4´7H2O 0,15% мпературі 30°С, давали на середовищі кільця розАгар 2% чинення - розміром 29 та 38мм. Клітинні суспензії Перед стерилізацією pH середовище доводиоднакових груп, одержаних з агарових косяків на ли до pH 7,2 за допомогою розчину гідроксиду наоснові середовища ТАg, з 1мл дистильованої води трію. занурювали у заглиблення, зроблені на пластинах Групи Pseudomonas, які продукують сидероNaoxg, що доповнений 10% трикальцій фосфатом фори, фіксували іони заліза, які вони передавали (0,1мл/заглиблення). При інкубації культур при рослинам у ґрунтах, збіднених на залізо. Крім того, температурі 30°С протягом 2-3 днів можна було вони, інгібують розмноження деяких фітопатогенспостерігати видимі кільця розчинення. їх розмір них мікроорганізмів, таких як Erwinia caratovora, складав 24мм при використанні груп Pseudomonas оскільки вони не можуть використовувати фіксовата 26мм, коли ми використовували групи Bacillus, не залізо. Ми тестували продукцію сидерофору 19 86178 20 Приклад 4 шляхом інгібування росту групи Escherichia coli Ізоляція мікроорганізмів, які продукують екстMC1061. Клітинні суспензії двох груп з агарової ра-целюлярний полісахарид культури готували при використанні дистильованої 4А. Відбір мікроорганізмів Bradyrhizobium води, а потім культивували протягом 48 годин при Групи Bradyrhizobium PH2-1-3 засівали на сетемпературі 28°С, вносячи у комірки планшета (30редовище, що містить 1% глюкози та 1% сахарози 50мкл), що містять середовище Кінг В, вільне від (див. Вище) та визначали кількість полісахариду заліза, та середовище, що містить залізо (1мкМ (слизький) навколо культур. Відбирали групи РН2FeCI3 ´ 7Н2О), та після цього, засіваючи планшет 1-1 та -2, що біосинтезують полісахариди. культурою мікроорганізмів E.coli MC106, що одер4B. Ізоляція Bacillus жана при культивуванні на ТАg агарі та подальшій Bacillus M32-1-10 та SW17-1-15 засівали на інкубації протягом додаткових 28 годин при темпесередовище, що містить 1% глюкози та 1% сахаратурі 28°С. Навкруги культур спостерігали різнорози (див. Вище) та визначали кількість полісахаманітні зони інгібування. Сумарні дані чотирьох риду (слизький) навколо культур. Відбирали групи експериментів представлені на Таблиці 1, при М32-1-6, 8, 10 та SW17-1-7, 11, 15, що біосинтезуцьому як негативний контроль використовували ють полісахариди. Ізольовані мікроорганізми були Bacillus megaterium, як позитивний контроль . підтверджені як такі, що відносяться до Pseudomonas fluorescent. Micrococcus roseus, вони біосинтезують на повному середовищі, що містить глюкозу та сахарозу Таблиця 1 велику кількість полісахариду, перетворюючи культуральне середовище у слизький матеріал. Зона інгібування Зона інгібування на МікропорВибрані групи згідно з нашими дослідами біона середовищі середовищі Кінг В ганізм синтезують розчинний полісахарид сукционоглюКінг В +1мкМ FeCI3 конового типу відомої структури. SW1-1-6 ++++ Приклад 5 SW1-1-12 ++ Ізоляція стійких до холоду мікроорганізмів P.fluores. + Мікроорганізми, відібрані у відповідності з B.megater. Прикладами 1-4, оброблювали за допомогою мутаційного агенту та радіації. Суспензії мікрооргані*Позначення інгібування: - відсутнє, + низький, змів, приготовлені на дистильованій воді, оброб++ та +++ високе та дуже високе лювали за допомогою 0,01, 0,1, 1,0, 10 та 100мкг/мл нітрозогуанідину протягом 1, 3, 5, 10 та У випадку тестування продукції сидерофору за 30 хвилин. Після обробки клітинні суспензії допомогою mob4 та групи позитивного контролю центрифугували, двічі промивали дистильованої спостерігали зону значного інгібування, якаусуваводою, а потім клітини висівали на культуральне лася у присутності іонів заліза. середовище ТАg. Повторювали обробку з клітинЯк вказується вище, деякі групи Pseudomonas ними суспензіями на основі дистильованої води, продукують рослинні гормони. Вибрані мікрооргащо містять 109 мікроорганізмів на мілілітр, витринізми тестували на здатність до біосинтезу гіберемуючи клітини протягом 1, 3, 5, 10 та 30 хвилин під лінової кислоти на ТАg середовищі складу, що ультрафіолетовою лампою на 15W, на відстані 10 приведений вище. Аналізи проводили при викорисм від неї. Клітинні суспензії висівали на культурастанні гіберелінової кислоти А стандарту (Sigma), льне середовище ТАg у серійних розведеннях. шляхом тонкошарової хроматографії на силікагелі ТАg культури інкубували при температурі 18°С (40мкг/мл) (Merck). Після екстракції культур етилапротягом 192 годин, після цього ізолювали найбіцетатом проводили екстракцію подвійним об'ємом льші культури на косяках ТАg агару та інкубували карбонату гідроксиду натрію, а потім у розчині з pH при температурі 18°С. Контролювали та підтриму2,5 знову за допомогою етилацетату. У залишку вали наступні ростові культури. екстракту, що одержаний за допомогою випарюКрім ізольованих, були відокремлені та задевання, були виявлені наступні групи плям, що мапоновані відібрані та стійкі до холоду мікроорганіли значення Rf, близькі до стандартних. зми: Azospirillum brasilense ssp. SW51 (NCAIM /Ρ/ Таблиця 2 Β001293), Azotobacter vinerandii spp. M657 (NCAIM /Ρ/ Β Розмір Група Rf 001292), плями (мм2) Pseudomonas fluorescens var. SW11 (NCAIM Стандарт 0,41 24 /Ρ/ Β 001296), SW1-1-6 0,46 17 Bacillus polymyxa var. SW17 (NCAIM /Ρ/ Β М32-1-9 0,42 27 001295), Pseudomonas fluorescens 0,49 14 Bacillus megaterium var. M326 (NCAIM /Ρ/ Β Bacillus megaterium 0,57 7 001291), Micrococcus roseus ssp. A21 (NCAIM /P/B Були відібрані групи, позначені, як SW1-1-6 та 001294), М32-1-9 (вони виробляли приблизно 3-15мкг горBradyrhizobium japonicum var. PH25 (NCAIM /Ρ/ мону на мілілітр). Β 001302), Описані групи були досліджені та ідентифікоStreptomyces albus var. 0003LP (NCAIM /Ρ/ Β вані з систематичної точки зору так, як описано у 001301). загальній частині. 21 86178 22 Для приготування культур більших об'ємів, 10 Приклад 6 літрів культур готували на культуральному сереКультивування мікроорганізмів довищі Та1і, що має склад, наведений вище, в 6А. Культивування на повному культуральноумовах ферментації, які приведені раніше, потім му середовищі: 100л стерилізованого середовища Та1і та 100 літГотували агарові косяки на основі культуральрів культурального середовища Ta1f інокулювали ного середовища ТАg, потім інкубували при темза допомогою 5-5 літрів кожне. Культивування пературі 30°С протягом 48 годин. Культури продовжували протягом 24 годин в приведених Azospirillum, Azotobacter, Bacillus, Bradyrhizobium, вище умовах ферментації, потім культуру, вироPseudomonas, Streptomyces або Micrococcus інощену на культуральному середовищі Ta1f у ґрунті, кулювали культуральне середовище, позначене як 50 літрів культури, вирощеної на культуральному Tali, що має наступний склад: середовищі Та1і, використовували для інокуляції Глюкоза (окремо стерилізується у ви1000 літрів стерилізованого середовища Ta1f. Кугляді 50%-ного водного розчину) 1,5% Меляса 1,5% льтивування здійснювали в умовах ферментації, Кукурудзяний екстракт (50% сухої рещо вказані вище, протягом 24 годин, потім після човини) 0,2% перевірки культура є готовою до використання. У Основний дріжджовий екстракт 0,2% випадку незвичайного інтенсивного піноутворення, Кислий казеїн 0,1% додавали 0,01% пропіленгліколю як антиспінюваСульфат амонію 0,1 льного агенту. Нітрат амонію 0,1% 6В. Культивування напівмінімального культуКарбонат кальцію 0,3% рального середовища: Дигідрофосфат калію 0,1% Метод, приведений у Прикладі 6, повторювали Хлорид натрію 0,1% з тією різницею, що замість культурального середовища Ta1f використовували культуральне сереСульфат магнію ´ 7Η2Ο 0,1% довище Ta2f наступного складу: Пальмова олія 0.2% Глюкоза (окремо стерилізується у виПорції 100-100мл культурального середовища гляді 50%-ного водного розчину) 1,5% вносили у колби Ерленмейєра на 500мл, потім Меляса 0,5% стерилізували при температурі 121°С протягом 30 Кислий казеїн 0,1% хвилин. Стерильне культуральне середовище іноСульфат амонію 0,7 кулювали за допомогою мікроорганізмів, вирощеНітрат амонію 0,5% них на агарових косяках та культивування провоКарбонат кальцію 0,3% дили при температурі 25°С на обертовій качалці Дигідрофосфат калію 0,3% при швидкості 260 обертів за хвилину протягом 36 Хлорид натрію 0,1% годин. За ростом спостерігали під мікроскопом, Сульфат магнію ´ 7Н2О потім використовували 5% інокулюму, який вноси0,2% ли в основне ферментаційне культуральне сереРозчин мікроелементів* 0,35% довище наступного складу: Пальмова олія 0,2% Глюкоза (окремо стерилізується у * Композиція мікроелементів у відповідності з вигляді 50%-ного водного розчину) 2,5% Прикладом 1. Рідкий кукурудзяний екстракт (50% Після завершення культивування культури мі1,5% сухої речовини) стили, в залежності від бактерії, 1-7´108 клітин на Основний дріжджовий екстракт 0,4% мілілітр. Кислий казеїн 0,4% Приклад 7 Сульфат амонію 0,2% Дослідженні по поліпшенню структури ґрунту Нітрат амонію 0,2% та культивуванню рослин Карбонат кальцію 0,3% 7А. Експерименти по поліпшенню структури Дигідрофосфат калію 0,2% ґрунту Хлорид натрію 0,1% Піщані ґрунти збирали у Данубе, поблизу ШоСульфат магнію ´ 7Н2О 0,2% мліосигету, глинисті ґрунти з Ештергому, їх поміРозчин мікроелементів* 0,45% щали у лотки розміром 90´90см з товщиною шару Пальмова олія 0,2% 25см. Піщані ґрунти оброблювали 10г нітрату амо*Композиція мікроелементів у відповідності з нію та 5г фосфату кальцію на лоток. Висівали куПрикладом 1. курудзу у лоток при нормі 104 насінини на лоток. Культуральне середовище у кількості 100мл у При оцінці не враховували дані стосовно п'яти колбах Ерленмейєра, у лабораторному ферментанайбільш розвинутих та п'яти найменш розвинутих торі загальним об'ємом 10л, та чистим з об'ємом рослин. Визначали масу коренів, промитих за до5л стерилізували за умов, що приведені вище. помогою дистильованої води та просушених проКультури, які були внесені у колби, культивутягом двох днів при температурі 45°С. Лоток №1 вали на ротаційній качалці, та у ферментаторах рясно поливали водою, лоток №2 рясно поливали звичайним чином, при об'ємній аерації та шляхом при засіванні, але не пізніше. Лотки, які позначали керування турбо змішувачем з подвійним входом, як „а", інокулювали мікроорганізмами, при цьому при режимі 360 обертів за хвилину протягом 24 як мікроорганізми, що біосинтезують полісахариди, годин, до тих, пір, поки кількість клітин на мілілітр використовували мікроорганізми групи Bacillus в залежності від виду бактерії - не досягала знаpolymyxa var. SW17 (NCAIM /Ρ/ Β 001295), Bacillus чень 4´108-1,3´109. megaterium var. M326 (NCAIM /P/ В 001292), Micrococcus roseus ssp. A21 (NCAIM /Ρ/ Β 001294) та 23 86178 24 Bradyrhizobium var. PH25 (NCAIM /Ρ/ Β 001302), що квадратний метр. Лотки, позначені як „b", не обробули задепоновані у Національній Колекції сільсьбляли мікроорганізмами. когосподарських та промислових мікроорганізмів, У Таблиці 3 представлені результати, одержаяк були приготовлені у відповідності з Прикладом ні на тридцять третій день після засівання. Ре6, у кількості 108 клітин кожної бактерії на один зультати показують середні значення, підраховані для однієї рослини. Таблиця 3 Ґрунт Піщаний Лоток №1 №2 Глинистий №1 №2 Обробка А В А В А В А В Висота (см) 24 17 18 11 27 23 20 19 У Таблиці 4 представлені значення розкришування та розтріскування піщаних та глинистих ґрунтів, які не піддавали поливанню (лотки 2). Під значенням розкришування ми розуміємо, що основна кількість фрагментів ґрунту розпадається на аркуші паперу, при цьому фрагменти, що не розпадаються при слабкому струшуванні, мають роз рослини Вага кореневої системи (мг) 945 634 866 757 1095 1213 1012 689 мір менше 2мм (-), від 2 до 5мм (+), більше 5мм (++). Значення розтріскування поверхні ґрунту позначається як ++ у випадку відсутності розтріскування, поява слабких тонких тріщин позначається як +, у той час, як присутність великих ліній тріщин характеризує рівень розтріскування сухих ґрунтів зі значенням. Таблиця 4 Ґрунт Піщаний Глинистий Обробка А В А В Значення розкришування + ++ ++ Значення розтріскування + -або + + ++ З даних, представлених у Таблицях 3 та 4, видно, що присутність мікроорганізмів, які біосинтезують полісахариди, поліпшує розвиток рослин та сприятливо впливає на структуру ґрунту. 7В. Польові експерименти Експерименти проводили на технологічній станції з удосконалення та культивації Університе ту у Мошонмагіароварі у 2000 році у випадкових експериментах з розділенням на блоки, які повторювали чотири рази, при використанні 10 літрів суміші на гектар. Тип експериментального ґрунту: район Данубе, товщина ґрунту: 120-140см, вміст гумусу 2,4%, низка кількість опадів. ВЕСНА. ПШЕНИЦЯ Бактофіл А 49,8 Значення випадання зернин (сек.) Контроль 278,3 NPK 200кг/га 281,5 Бактофіл А 272,5 Розплющування клейковини (см) Контроль 2,75 NPK 200кг/га 3,25 Бактофіл А 2,75 Розтягнення клейковини (см) Контроль 12,5 NPK 200кг/га 11,8 Бактофіл А 12,3 Індекс зеленої маси Контроль 30,0 NPK 200кг/га 30,3 Бактофіл А 30,8 Валориграфічна здатність до г адсорбції води (мл) Контроль 31,3 NPK 200кг/га 31,6 Вміст білка % Контроль 11,80 NPK 200 кг/га 11,87 Бактофіл А 11,96 Вміст білка, скорегований до сухої речовини % Контроль 13,84 NPK 200 кг/га 13,91 Бактофіл А 14,00 Вологий глютеїн % Контроль 32,0 NPK 200кг/га 31,1 Бактофіл А 31,1 Вага однієї тисячі зернин (г) Контроль 36,4 NPK 200 кг/га 36,8 Бактофіл А 36,4 Розмелювання, % Контроль 50,5 NPK 200кг/га 50,0 25 86178 26 Бактофіл А 31,4 Вміст вологи у кочанах, % Валориграфічне значення Контроль 26,1 Контроль 57,3 NPK 200кг/га 25,6 NPK 200кг/га 53,1 Бактофіл А 25,9 Бактофіл А 48,0 Вага кочанів, підрахована при 14%-ній вологості (кг/ділянка) Об’єм листової поверхні (см3) Вага кочанів (т/га) Контроль % Контроль 962,5 Контроль 2,416 100,0 NPK 200кг/га 977,5 NPK 200кг/га 2,740 113,4 Бактофіл А 1055,0 Бактофіл А 2,613 108,2 Морфологічні пропорції хліба Кількість стебел (тисячі/га) Контроль 2,38 Контроль 38,41 NPK 200кг/га 2,46 NPK 200кг/га 39,13 Бактофіл А 2,32 Бактофіл А 39,86 Вихід білка (кг/га) Кількість кочанів на стебло (шт./ділянка) Контроль 469,8 Контроль 1,04 NPK 200кг/га 498,6 NPK 200кг/га 1,10 Бактофіл А 510,3 Бактофіл А 1,05 Висота рослин (см) Кількість кочанів (тисячі/га) Контроль 56,3 Контроль 39,86 NPK 200кг/га 57,7 NPK 200кг/га 42,93 Бактофіл А 55,4 Бактофіл А 42,03 Рослинний врожай, підрахований при 13%-ній вологості (г/ділянка) Вага тисячі зерен невисушеного зерна (г) Врожай зерна (т/га) Контроль % Контроль 255,2 Контроль 3,398 100,0 NPK 200кг/га 259,2 NPK 200кг/га 3,584 105,5 Бактофіл А 263,3 Бактофіл А 3,646 107,3 Вага тисячі зернин при 14%-ній вологості (г) Вміст вологи у зібраному врожаї, % Контроль 245,6 Контроль 14,08 NPK 200кг/га 250,9 NPK 200кг/га 14,00 Бактофіл А 251,0 Бактофіл А 13,93 Сирова тестова вага (кг) Тестова вага (кг) Контроль 65,9 Контроль 69,8 NPK 200кг/га 65,1 NPK200 кг/га 70,4 Бактофіл А 64,6 Вага одного кочана при 14%-ній вологості (кг) КУКУРУДЗА Контроль 0,121 Сировий врожай у початках (кг/ділянка) NPK 200кг/га 0,136 Сировий врожай у Бактофіл А 0,131 Контроль % початках (т/га) Кількість зернин на кочан Контроль 5,496 100,0 Контроль 493,5 NPK 200кг/га 6,614 120,3 NPK 200кг/га 545,1 Бактофіл А 6,175 112,3 Бактофіл А 523,1 Врожай зерна, підрахований при 14%-ній вологоВміст вологи у кочані, % сті (кг/ділянка) Контроль 19,4 Врожай зерна (т/га) Контроль % NPK 200кг/га 20,7 Контроль 5,496 100,0 Бактофіл А 18,9 NPK 200кг/га 6,614 120,3 Вага кочана (г) Бактофіл А 6,175 112,3 Контроль 22,3 Вміст вологи у зерні % NPK 200 кг/га 22,3 Контроль 18,40 Бактофіл А 22,4 NPK 200кг/га 17,78 Індекс врожайності Бактофіл А 19,63 Контроль 44,1 Вага кочанів (кг/ділянка) NPK 200кг/га 41,5 Вага кочанів (т/га) Контроль % Бактофіл А 42,3 Контроль 2,672 100,0 NPK 200кг/га 3,016 112,9 Бактофіл А 2,886 108,0 27 86178 28 ЦУКРОВИЙ БУРЯК Кількість рослин цукрового буряка на гектар Контроль 79891 NPK 200кг/га 81159 Бактофіл А 83696 Врожай надземної частини (кг/ділянка) Врожай надземної Контроль частини (т/га) % Контроль 13,41 100,0 NPK 200кг/га 13,96 104,1 Бактофіл А 15,38 114,7 Врожай підземної частини (кг/ділянка) Врожай підземної Контроль частини (т/га) % Контроль 30,46 100,0 NPK 200 кг/га 36,74 120,6 Бактофіл А 39,35 129,2 Співвідношення надземна частина-підземна частина Співвідношення надКонтроль земна частина% підземна частина Контроль 0,443 100,0 NPK 200кг/га 0,381 85,9 Бактофіл А 0,391 88,2 Середня вага коренів (декаграми) Середня вага коренів Контроль (декаграми) % Контроль 38,2 100,0 NPK 200кг/га 45,3 118,6 Бактофіл А 47,1 123,5 Перетравлення % Контроль Перетравлення % % Контроль 11,61 100,0 NPK 200кг/га 11,07 95,3 Бактофіл А 10,59 91,3 Вміст натрію (мг/100г цукрового буряка) Контроль 1,94 NPK 200 кг/га 2,28 Бактофіл А 2,08 Вміст альфа-аміно-N (мг/100г цукрового буряка) Контроль 1,20 NPK 200 кг/га 1,02 Бактофіл А 1,02 Вміст калію (мг/100г цукрового буряка) Контроль 2,52 NPK 200 кг/га 1,89 Бактофіл А 2,10 Втрати % Контроль 2,95 NPK 200 кг/га 2,68 Бактофіл А 2,68 Вміст очищеного цукру % Вміст очищеного цук- Контроль ру % % Контроль 8,66 100,0 NPK 200 кг/га 8,39 96,9 Бактофіл А 7,92 91,4 Сумарний вихід цукру (т/га) Сумарний вихід цукру Контроль (т/га) % Контроль 3,557 100,0 NPK 200 кг/га 4,081 114,7 Бактофіл А 4,181 117,5 Контроль NPK 200 кг/га Бактофіл А 2,656 3,091 3,125 100,0 116,4 117,7 Приклад 8 Приготування препаратів, то містять мікроорганізми у відповідності з винаходом 8А. Приготування суміші мікроорганізмів: Культури Azospirillum brasilense ssp. SW51 (NCAIM /Ρ/ В 001293), Azotobacter vinelandii spp. M657 (NCAIM /P/ В 001292), Pseudomonas fluorescens var. SW11 (NCAIM /P/ В 001296), Bacillus polymyxa var. SW17 (NCAIM /Ρ/ Β 001295), Bacillus megaterium var. M326 (NCAIM 191 В 001291), Micrococcus roseus ssp. A21 (NCAIM /P/ 001294), Bradyrhizobium japonicum var. PH25 (NCAIM /Ρ/ Ρ 001302) та Streptomyces albus var. 0003 LP (NCAIM /Ρ/ Β 001301), приготовлені у відповідності з Прикладом 6, перемішували, оптимально у рівних співвідношеннях, та застосовували на ґрунтах для обробки у кількості від 5 літрів до 50 літрів, оптимально у кількості 12 літрів/га, у будь-яку пору року, коли не має морозів, оптимально у період від березня до жовтня. 8В. Препарат для обробки однодольних рослин. Після проведення процедури у відповідності з Прикладом 6 препарат готували з тією різницею, що використовували наступні мікроорганізми Azospirillum brasilense ssp. SW51 (NCAIM /Ρ/ В 001293), Azotobacter vinelandii spp. M657 (NCAIM /Ρ/ Β 001292), Pseudomonas fluorescens var. SW11 (NCAIM /P/ В 001296), Bacillus polymyxa var. SW17 (NCAIM /Ρ/ Β 001295), Bacillus megaterium var. M326 (NCAIM /Ρ/ Β 001291) та Streptomyces albus var. 0003 LP (NCAIM /Ρ/ Β 001301). 8C. Препарат для обробки дводольних рослин. Після проведення процедури у відповідності з Прикладом 6 препарат готували з тією різницею, що використовували наступні мікроорганізми Azospirillum brasilense ssp. SW51 (NCAIM /Ρ/ В 001293), Azotobacter vinelandii spp. M657 (NCAIM /Ρ/ Β 001292), Pseudomonas fluorescens var. SW11 (NCAIM /P/ В 001296), Bacillus polymyxa var. SW17 (NCAIM /Ρ/ Β 001295), Bacillus megaterium var. M326 (NCAIM /Ρ/ Β 001291), Micrococcus roseus ssp. (NCAIM /P/ В 001294), Bradyrhizobium japonicum var. PH25 (NCAIM /Ρ/ Ρ 001302), при цьому готували препарати у відповідності з винаходом. 8D. Приготування препарату, висушеного в умовах заморожування 2 літри водної суспензії мікроорганізмів у відповідності з Прикладом 6 піддавали ліофілізації на обладнанні для ліофілізації фірми Gelman SP354, діючи у відповідності з інструкціями використання 29 86178 30 обладнання, перемішували з карбонатом кальцію, ктів, матеріалів мікроорганізмів для зберігання, що крохмалем, глюкозою або целюлозою у співвіднослужать як основа для продуктів, які розмножушеннях від 1:1 до 1:100, зберігаючи препарати до ються при низькій температурі, біосинтезують повикористання при температурі від 4 до 10°С. лісахариди та способи для їх одержання. Клітини 8Е. Приготування препарату, що містить носій: одного з мікроорганізмів у відповідності з винахоОптимально рівні частини культур, приготовдом або їх композиція, може бути внесена у ґрунт лені на культуральному середовищі згідно з Прикабо нанесена на насіння рослин. ладом 6, перемішували з органічним добривом, За допомогою способу згідно з винаходом соєвим борошном (загальний розмір зерен 4 меш), продукт може бути внесений у ґрунт, при цьому метилцелюлозою або картопляним крохмалем так, продукт містить, принаймні, одну групу ґрунтових бактерій, що перетворюють азот повітря на сполущоб препарат містив 5´108-1010, оптимально 5´109 ки, доступні для рослин, розчиняють неорганічні клітин мікроорганізмів, потім вологий препарат або фосфатні та калійні сполуки та біосинтезують мапрепарат, висушений при температурі нижче 40°С, теріали, що поліпшують розвиток рослин, продуу кількості від 2 до 20, оптимально у кількості куючи при цьому полісахариди, які оптимально 5кг/га, вносили у ґрунт, який піддають обробці. впливають на структуру ґрунту, при цьому вказані Оптимально, принаймні, 1013 клітин мікроорганізмікроорганізми ізольовані з різноманітних ґрунтів мів на гектар вносили у ґрунт. та піддані змінам у лабораторних умовах, таким Резюме чином, досягають задовільного врожаю, практично Об'єкт даного винаходу представляє собою виключаючи застосування дорогих добрив. продукти та спосіб для обробки ґрунту за допомогою бактерій для поліпшення росту рослин та для збільшення врожаю, способи приготування проду Комп’ютерна верстка В. Мацело Підписне Тираж 28 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюMicroorganisms for cultivating soil and a method for obtaining thereof
Автори англійськоюKISS GYOERGY BOTOND, OTT ISTVAN
Назва патенту російськоюМикроорганизмы для обработки почвы и способ их получения
Автори російськоюКишш Дьйордь Ботонд, Отт Иштван
МПК / Мітки
МПК: C12R 1/07, A01C 1/00, C12R 1/47, C12R 1/065, C12R 1/11, C05F 11/08, C12N 1/00, C09K 17/14, C12R 1/265, C12R 1/12, A01N 63/00
Мітки: обробки, ґрунту, спосіб, мікроорганізми, одержання
Код посилання
<a href="https://ua.patents.su/15-86178-mikroorganizmi-dlya-obrobki-runtu-ta-sposib-kh-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">Мікроорганізми для обробки ґрунту та спосіб їх одержання</a>
Попередній патент: Пристрій для рекламування
Наступний патент: Спосіб лікування злоякісних пухлин із застосуванням ксеногенних рнк
Випадковий патент: Спосіб виконання реконструктивного етапу операції тотальної проктоколектомії