Людське моноклональне антитіло, що специфічно зв’язується з cd40, фармацевтична композиція, що його містить, та застосування антитіла для виробництва лікарського засобу для лікування cd40-негативної пухлини у людини
Номер патенту: 84539
Опубліковано: 10.11.2008
Автори: Бедіан Вахе, Глейдью Роналд П., Фенг Ксіао, Джіа Ксіао-Чі, Корвалан Хосе
Формула / Реферат
1. Людське моноклональне антитіло або його антигензв’язувальна частина, які специфічно зв’язуються з людським CD40, причому вказане антитіло або його антигензв’язувальна ділянка є агоністом CD40 і де антитіло містить важкий ланцюг і легкий ланцюг, і при цьому амінокислотні послідовності CDR1, CDR2 і CDR3 вказаного важкого ланцюга і CDR1, CDR2 і CDR3 вказаного легкого ланцюга вибрані з групи, яка складається з
(a) амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену важкого ланцюга з послідовністю SEQ ID NО:2 і амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену легкого ланцюга з послідовністю SEQ ID NО:4, відповідно;
(b) амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену важкого ланцюга з послідовністю SEQ ID NО:2 і амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену легкого ланцюга з послідовністю SEQ ID NО:94, відповідно;
(с) амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену важкого ланцюга з послідовністю SEQ ID NО:90 і амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену легкого ланцюга з послідовністю SEQ ID NО:4, відповідно;
(d) амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену важкого ланцюга з послідовністю з SEQ ID NО:90 і амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену легкого ланцюга з послідовністю SEQ ID NО:94, відповідно;
(е) амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену важкого ланцюга з послідовністю SEQ ID NО:92 і амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену легкого ланцюга з послідовністю SEQ ID NО:4, відповідно;
(f) амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену важкого ланцюга з послідовністю SEQ ID NО:92 і амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену легкого ланцюга з послідовністю SEQ ID NО:94, відповідно;
(g) амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену важкого ланцюга з послідовністю SEQ ID NО:10 і амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену легкого ланцюга з послідовністю SEQ ID NО:12, відповідно;
(h) амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену важкого ланцюга з послідовністю SEQ ID NО:18 і амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену легкого ланцюга з послідовністю SEQ ID NО:20, відповідно;
(i) амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену важкого ланцюга з послідовністю SEQ ID NО:26 і амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену легкого ланцюга з послідовністю SEQ ID NО:28, відповідно;
(j) амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену важкого ланцюга з послідовністю SEQ ID NО:34 і амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену легкого ланцюга з послідовністю SEQ ID NО:36, відповідно;
(k) амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену важкого ланцюга з послідовністю SEQ ID NО:42 і амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену легкого ланцюга з послідовністю SEQ ID NО:44, відповідно;
(l) амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену важкого ланцюга з послідовністю SEQ ID NО:50 і амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену легкого ланцюга з послідовністю SEQ ID NO:52, відповідно;
(m) амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену важкого ланцюга з послідовністю SEQ ID NО:96 і амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену легкого ланцюга з послідовністю SEQ ID NО:52, відповідно;
(n) амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену важкого ланцюга з послідовністю SEQ ID NО:58 і амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену легкого ланцюга з послідовністю SEQ ID NО:60, відповідно;
(о) амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену важкого ланцюга з послідовністю SEQ ID NО:66 і амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену легкого ланцюга з послідовністю SEQ ID NО:68, відповідно;
(р) амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену важкого ланцюга з послідовністю SEQ ID NО:66 і амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену легкого ланцюга з послідовністю SEQ ID NО:100, відповідно;
(q) амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену важкого ланцюга з послідовністю SEQ ID NО:98 і амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену легкого ланцюга з послідовністю SEQ ID NО:68, відповідно;
(r) амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену важкого ланцюга з послідовністю SEQ ID NО:98 і амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену легкого ланцюга з послідовністю SEQ ID NО:100, відповідно;
(s) амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену важкого ланцюга з послідовністю SEQ ID NО:74 і амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену легкого ланцюга з послідовністю SEQ ID NО:76, відповідно; і
(t) амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену важкого ланцюга з послідовністю SEQ ID NО:82 і амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену легкого ланцюга з послідовністю SEQ ID NО:84, відповідно.
2. Моноклональне антитіло або його антигензв’язувальна ділянка за п. 1, які мають щонайменше одну з наступних властивостей:
(а) не зв’язуються з мишачими, щурячими, собачими і/або кролячими В-клітинами;
(b) зв’язуються з В-клітинами людини, макак-резусів та мавп циномолгус;
(c) мають селективність відносно CD40, яка щонайменше в 100 разів вища, ніж їх селективність відносно рецепторного активатора ядерного фактора каппа-ланцюга В-клітин (RANK), 4-1ВВ (CD137), рецептора 1 фактора некрозу пухлини (TNFR-1) і рецептора 2 фактора некрозу пухлини (TNFR-2);
(d) зв’язуються з CD40 з KD 4×10-10 М або менше;
(e) мають показник для CD40 Koff, що складає 2×10-10 або менше;
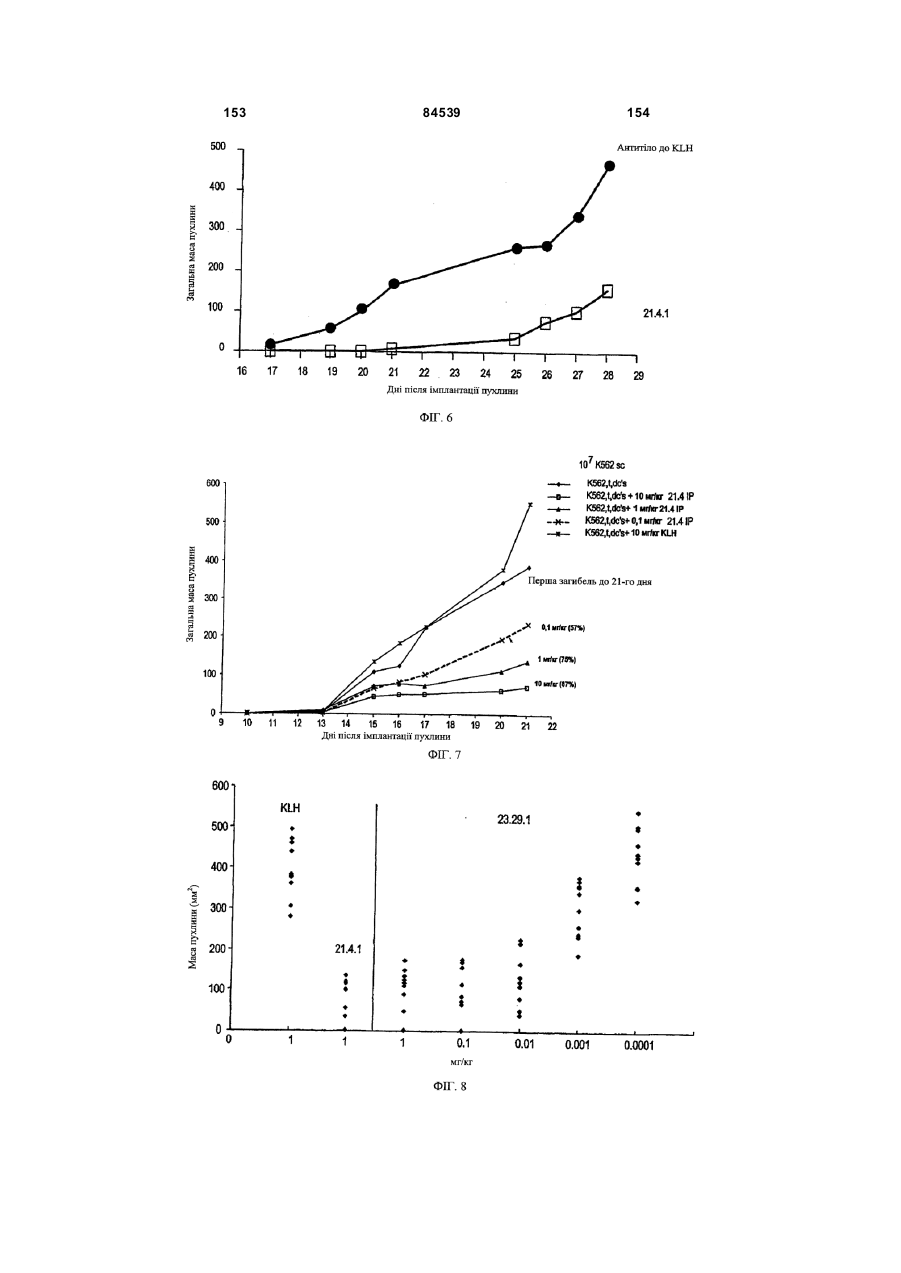
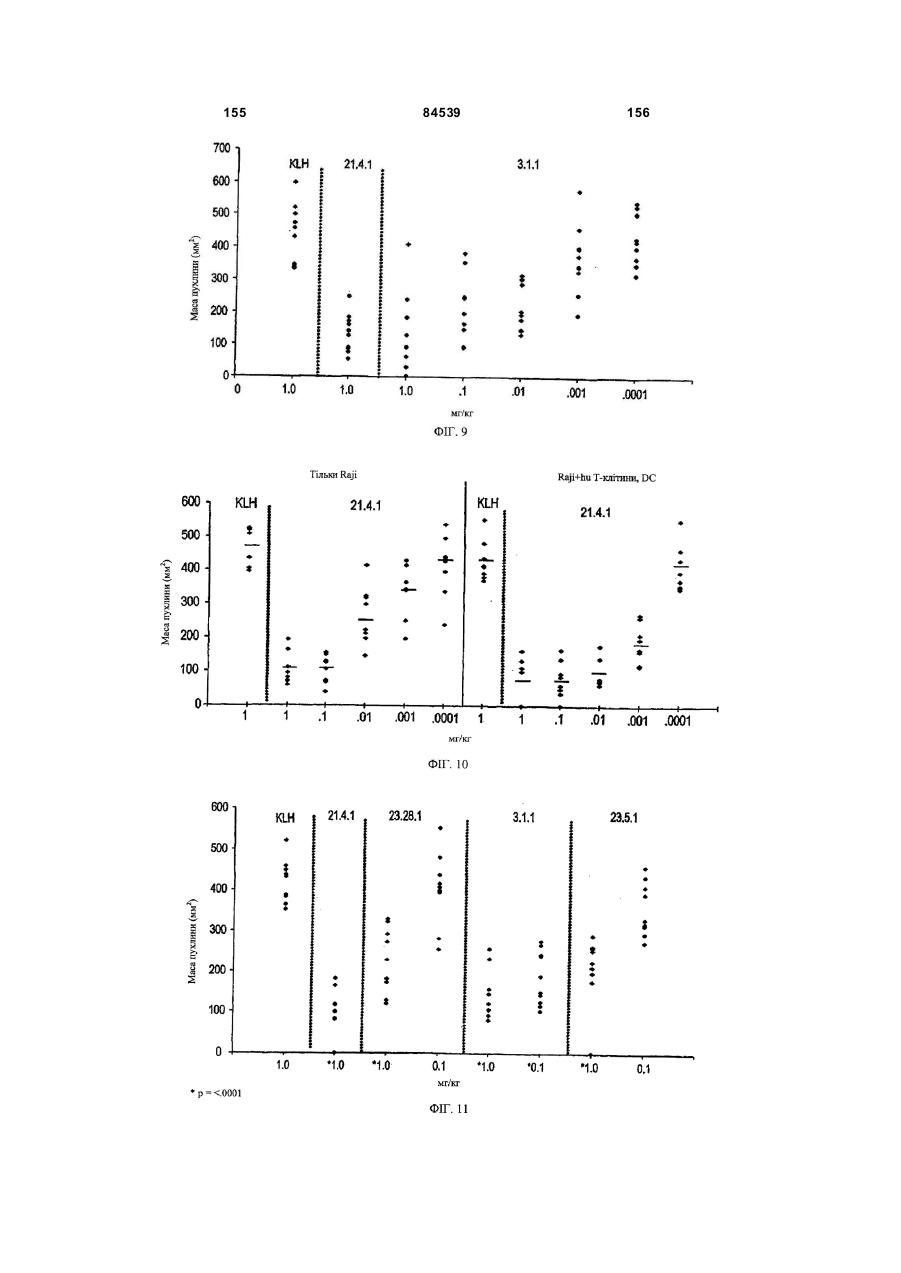
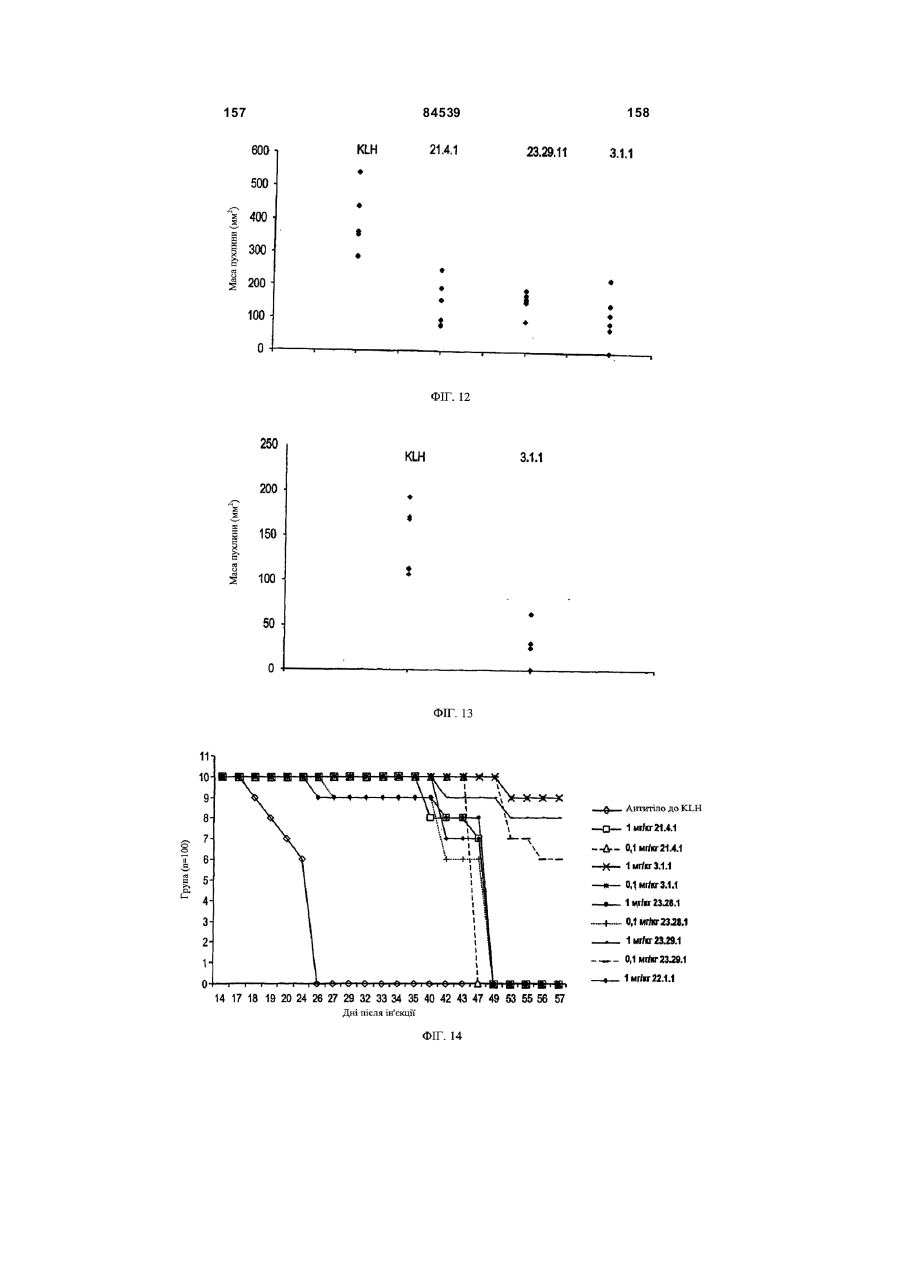
(f) інгібують ріст пухлини in vivo в присутності Т-клітин людини і/або дендритних клітин людини;
(g) інгібують ріст CD40-позитивних пухлин за відсутності імунних клітин людини;
(h) підвищують експресію ICAM, MHC-II, B7-2, CD71, CD23 і/або CD71 на поверхні В-клітин людини;
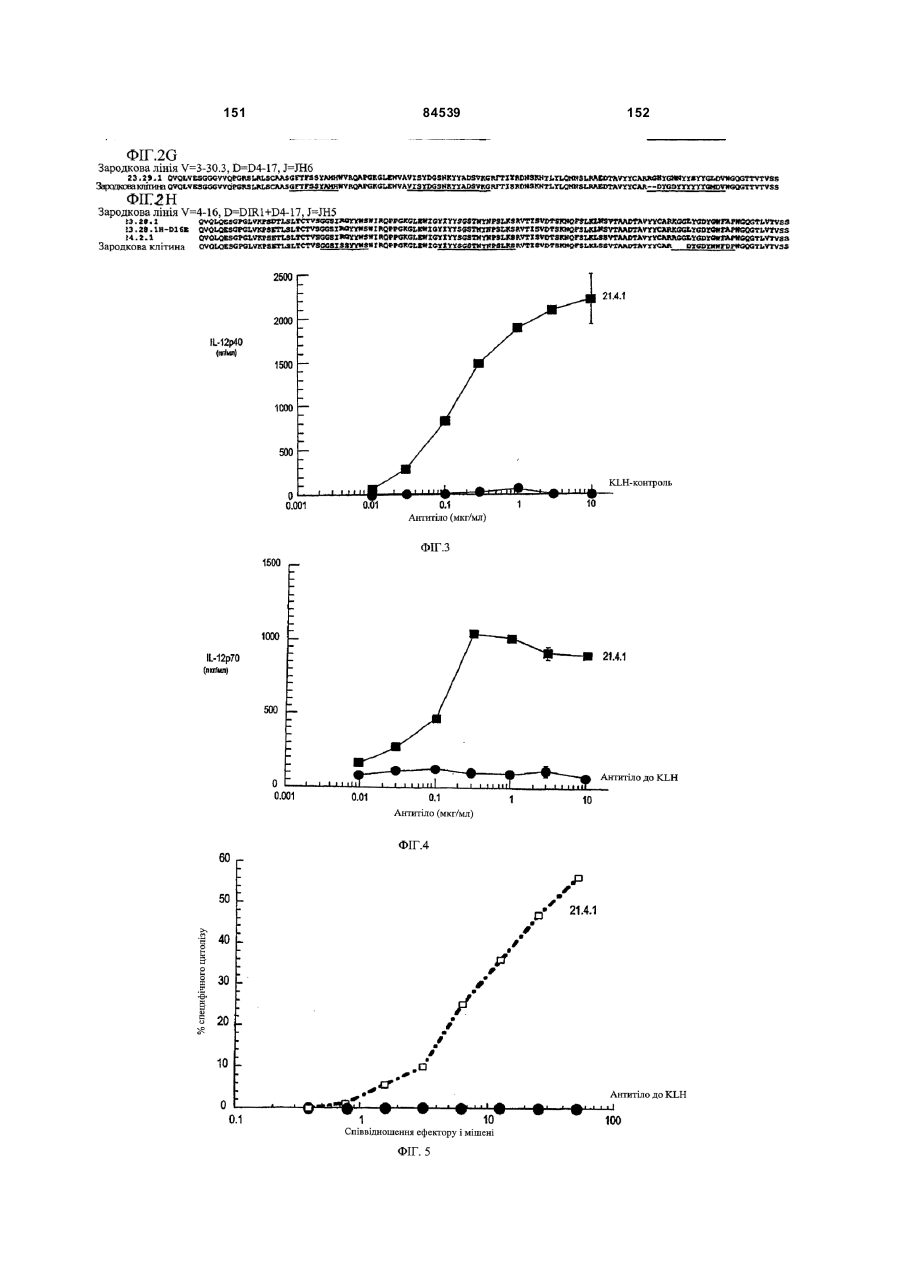
(i) збільшують секрецію IL-12p40, IL-12p70 і/або IL-8 дендритними клітинами людини;
(j) збільшують експресію ICAM, MHC-II, B7-2 і/або CD83 на поверхні дендритних клітин людини;
(k) підвищують експресію гамма-інтереферону Т-клітинами людини під час їх алогенної стимуляції;
(l) зв’язують людський CD40 у присутності людського CD40L;
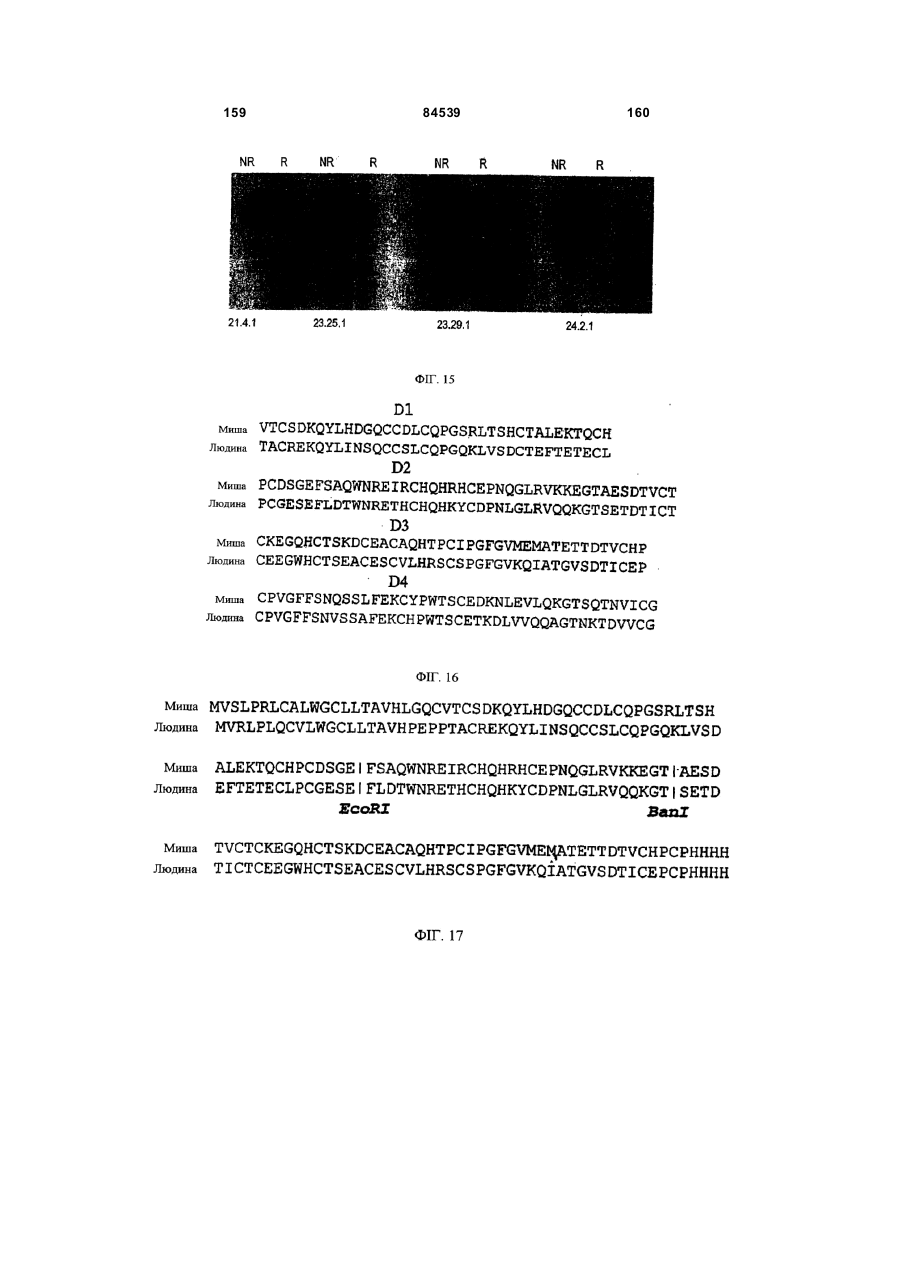
(m) зв’язуються з епітопом CD40 людини, який знаходиться в межах домену 1 або домену 2 позаклітинного домену CD40; і
(n) зв’язуються з епітопом CD40 людини, що знаходиться у межах домену 2 або домену 3 позаклітинного домену CD40.
3. Моноклональне антитіло за п. 1, в якому амінокислотні послідовності важкого ланцюга та легкого ланцюга вибрані з групи, яка складається з:
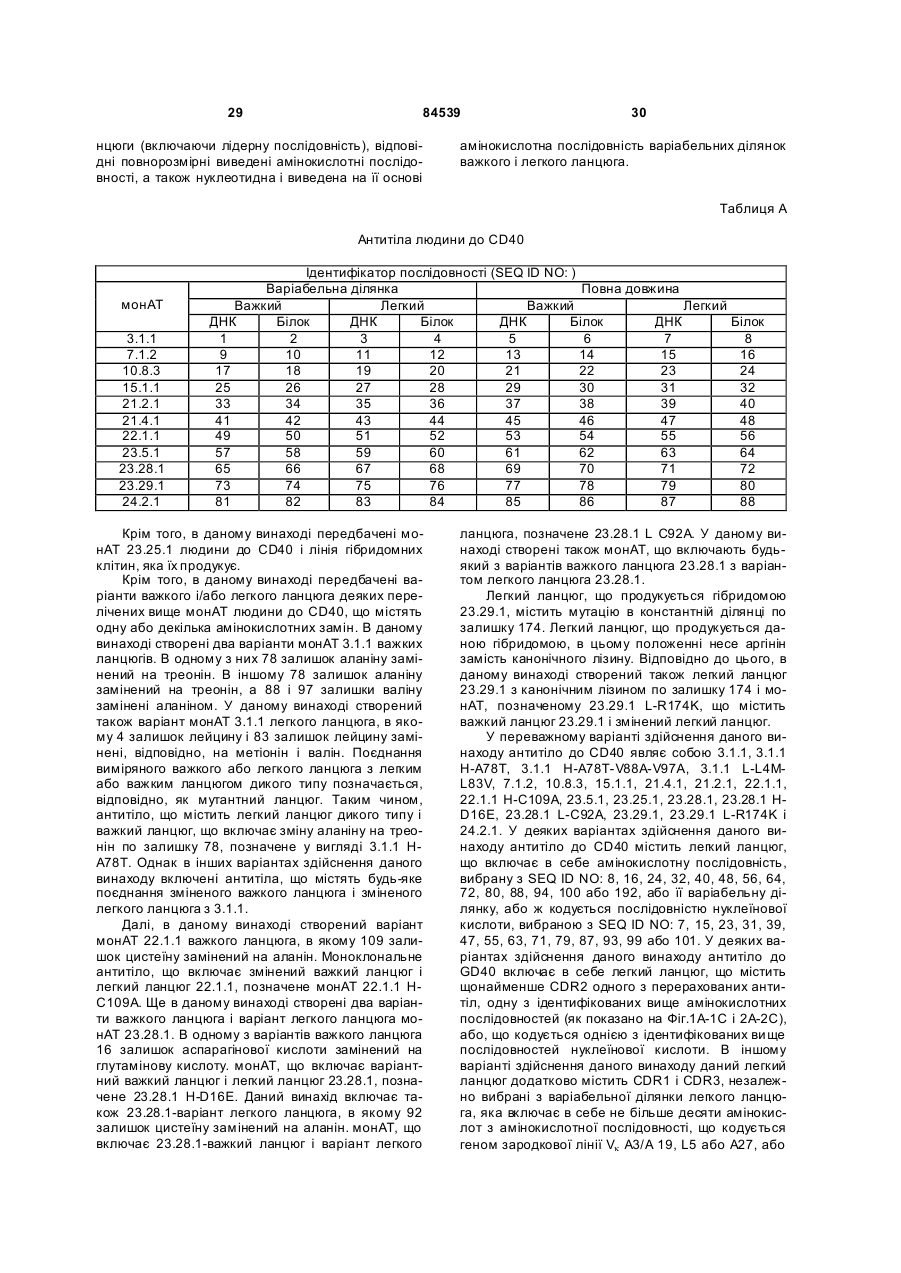
(a) амінокислотної послідовності важкого ланцюга і амінокислотної послідовності легкого ланцюга моноклонального антитіла 3.1.1, причому в обох вказаних амінокислотних послідовностях відсутня сигнальна послідовність;
(b) амінокислотної послідовності важкого ланцюга і амінокислотної послідовності легкого ланцюга моноклонального антитіла 7.1.2, причому в обох вказаних амінокислотних послідовностях відсутня сигнальна послідовність;
(с) амінокислотної послідовності важкого ланцюга і амінокислотної послідовності легкого ланцюга моноклонального антитіла 10.8.3, причому в обох вказаних амінокислотних послідовностях відсутня сигнальна послідовність;
(d) амінокислотної послідовності важкого ланцюга і амінокислотної послідовності легкого ланцюга моноклонального антитіла 15.1.1, причому в обох вказаних амінокислотних послідовностях відсутня сигнальна послідовність;
(е) амінокислотної послідовності важкого ланцюга і амінокислотної послідовності легкого ланцюга моноклонального антитіла 21.4.1, причому в обох вказаних амінокислотних послідовностях відсутня сигнальна послідовність;
(f) амінокислотної послідовності важкого ланцюга і амінокислотної послідовності легкого ланцюга моноклонального антитіла 21.2.1, причому в обох вказаних амінокислотних послідовностях відсутня сигнальна послідовність;
(g) амінокислотної послідовності важкого ланцюга і амінокислотної послідовності легкого ланцюга моноклонального антитіла 22.2.1, причому в обох вказаних амінокислотних послідовностях відсутня сигнальна послідовність;
(h) амінокислотної послідовності важкого ланцюга і амінокислотної послідовності легкого ланцюга моноклонального антитіла 22.2.1Н-С109А, причому в обох вказаних амінокислотних послідовностях відсутня сигнальна послідовність;
(i) амінокислотної послідовності важкого ланцюга і амінокислотної послідовності легкого ланцюга моноклонального антитіла 23.5.1, причому в обох вказаних амінокислотних послідовностях відсутня сигнальна послідовність;
(j) амінокислотної послідовності важкого ланцюга і амінокислотної послідовності легкого ланцюга моноклонального антитіла 23.25.1, причому в обох вказаних амінокислотних послідовностях відсутня сигнальна послідовність;
(k) амінокислотної послідовності важкого ланцюга і амінокислотної послідовності легкого ланцюга моноклонального антитіла 23.28.1, причому в обох вказаних амінокислотних послідовностях відсутня сигнальна послідовність;
(l) амінокислотної послідовності важкого ланцюга і амінокислотної послідовності легкого ланцюга моноклонального антитіла 23.28.1L-C92A, причому в обох вказаних амінокислотних послідовностях відсутня сигнальна послідовність;
(m) амінокислотної послідовності важкого ланцюга і амінокислотної послідовності легкого ланцюга моноклонального антитіла 23.28.1H-D16E, причому в обох вказаних амінокислотних послідовностях відсутня сигнальна послідовність;
(n) амінокислотної послідовності важкого ланцюга і амінокислотної послідовності легкого ланцюга моноклонального антитіла 23.29.1, причому в обох вказаних амінокислотних послідовностях відсутня сигнальна послідовність;
(о) амінокислотної послідовності важкого ланцюга і амінокислотної послідовності легкого ланцюга моноклонального антитіла 24.2.1, причому в обох вказаних амінокислотних послідовностях відсутня сигнальна послідовність;
(р) амінокислотної послідовності важкого ланцюга і амінокислотної послідовності легкого ланцюга моноклонального антитіла 3.1.1Н-А78Т, причому в обох вказаних амінокислотних послідовностях відсутня сигнальна послідовність;
(q) амінокислотної послідовності важкого ланцюга і амінокислотної послідовності легкого ланцюга моноклонального антитіла 3.1.1H-A78T-V88A-V97A, причому в обох вказаних амінокислотних послідовностях відсутня сигнальна послідовність;
(r) амінокислотної послідовності важкого ланцюга і амінокислотної послідовності легкого ланцюга моноклонального антитіла 3.1.1L-L4M-L83V, причому в обох вказаних амінокислотних послідовностях відсутня сигнальна послідовність;
(s) амінокислотної послідовності важкого ланцюга і амінокислотної послідовності легкого ланцюга моноклонального антитіла 3.1.1H-A78T-V88A-V97A/3.1.1L-L4M-L83V, причому в обох вказаних амінокислотних послідовностях відсутня сигнальна послідовність;
(t) амінокислотної послідовності важкого ланцюга і амінокислотної послідовності легкого ланцюга моноклонального антитіла 23.29.1L-R174K, причому в обох вказаних амінокислотних послідовностях відсутня сигнальна послідовність; і
(u) амінокислотної послідовності важкого ланцюга і амінокислотної послідовності легкого ланцюга моноклонального антитіла 23.28.1H-D16E/23.28.1L-C92A, причому в обох вказаних амінокислотних послідовностях відсутня сигнальна послідовність.
4. Моноклональне антитіло або його антигензв’язувальна ділянка за п. 1, в яких амінокислотні послідовності варіабельного домену вказаного важкого ланцюга та варіабельного домену вказаного легкого ланцюга вибрані з групи, яка складається з:
(a) амінокислотної послідовності SEQ ID NО:2 і амінокислотної послідовності SEQ ID NO:4, відповідно;
(b) амінокислотної послідовності SEQ ID NО:2 і амінокислотної послідовності SEQ ID NО:94, відповідно;
(c) амінокислотної послідовності SEQ ID NО:90 і амінокислотної послідовності SEQ ID NО:4, відповідно;
(d) амінокислотної послідовності SEQ ID NО:90 і амінокислотної послідовності SEQ ID NО:94, відповідно;
(е) амінокислотної послідовності SEQ ID NО:92 і амінокислотної послідовності SEQ ID NО:4, відповідно;
(f) амінокислотної послідовності SEQ ID NО:92 і амінокислотної послідовності SEQ ID NО:94, відповідно;
(g) амінокислотної послідовності SEQ ID NО:10 і амінокислотної послідовності SEQ ID NО:12, відповідно;
(h) амінокислотної послідовності SEQ ID NО:18 і амінокислотної послідовності SEQ ID NO:20, відповідно;
(i) амінокислотної послідовності SEQ ID NО:26 і амінокислотної послідовності SEQ ID NО:28, відповідно;
(j) амінокислотної послідовності SEQ ID NО:34 і амінокислотної послідовності SEQ ID NО:36, відповідно;
(k) амінокислотної послідовності SEQ ID NО:42 і амінокислотної послідовності SEQ ID NО:44, відповідно;
(l) амінокислотної послідовності SEQ ID NО:50 і амінокислотної послідовності SEQ ID NО:52, відповідно;
(m) амінокислотної послідовності SEQ ID NО:96 і амінокислотної послідовності SEQ ID NО:52, відповідно;
(n) амінокислотної послідовності SEQ ID NО:58 і амінокислотної послідовності SEQ ID NО:60, відповідно;
(о) амінокислотної послідовності SEQ ID NО:66 і амінокислотної послідовності SEQ ID NО:68, відповідно;
(р) амінокислотної послідовності SEQ ID NО:66 і амінокислотної послідовності SEQ ID NО:100, відповідно;
(q) амінокислотної послідовності SEQ ID NО:98 і амінокислотної послідовності SEQ ID NO:68, відповідно;
(r) амінокислотної послідовності SEQ ID NО:98 і амінокислотної послідовності SEQ ID NО:100, відповідно;
(s) амінокислотної послідовності SEQ ID NО:74 і амінокислотної послідовності SEQ ID NО:76, відповідно; i
(t) амінокислотної послідовності SEQ ID NО:82 і амінокислотної послідовності SEQ ID NО:84, відповідно.
5. Моноклональне антитіло за п. 1, в якому амінокислотні послідовності важкого ланцюга та легкого ланцюга вибрані з групи, яка складається з:
(a) амінокислотної послідовності SEQ ID NO:6 і амінокислотної послідовності SEQ ID NО:8, відповідно, причому в обох вказаних амінокислотних послідовностях відсутня сигнальна послідовність;
(b) амінокислотної послідовності SEQ ID NО:14 і амінокислотної послідовності SEQ ID NO:16, відповідно, причому в обох вказаних амінокислотних послідовностях відсутня сигнальна послідовність;
(с) амінокислотної послідовності SEQ ID NО:22 і амінокислотної послідовності SEQ ID NО:24, відповідно, причому в обох вказаних амінокислотних послідовностях відсутня сигнальна послідовність;
(d) амінокислотної послідовності SEQ ID NО:30 і амінокислотної послідовності SEQ ID NО:32, відповідно, причому в обох вказаних амінокислотних послідовностях відсутня сигнальна послідовність;
(е) амінокислотної послідовності SEQ ID NО:38 і амінокислотної послідовності SEQ ID NO:40, відповідно, причому в обох вказаних амінокислотних послідовностях відсутня сигнальна послідовність;
(f) амінокислотної послідовності SEQ ID NО:46 і амінокислотної послідовності SEQ ID NO:48, відповідно, причому в обох вказаних амінокислотних послідовностях відсутня сигнальна послідовність;
(g) амінокислотної послідовності SEQ ID NО:54 і амінокислотної послідовності SEQ ID NО:56, відповідно, причому в обох вказаних амінокислотних послідовностях відсутня сигнальна послідовність;
(h) амінокислотної послідовності SEQ ID NО:62 і амінокислотної послідовності SEQ ID NO:64, відповідно, причому в обох вказаних амінокислотних послідовностях відсутня сигнальна послідовність;
(i) амінокислотної послідовності SEQ ID NО:70 і амінокислотної послідовності SEQ ID NО:72, відповідно, причому в обох вказаних амінокислотних послідовностях відсутня сигнальна послідовність;
(j) амінокислотної послідовності SEQ ID NО:78 і амінокислотної послідовності SEQ ID NО:80, відповідно, причому в обох вказаних амінокислотних послідовностях відсутня сигнальна послідовність; i
(k) амінокислотної послідовності SEQ ID NО:86 і амінокислотної послідовності SEQ ID NО:88, відповідно, причому в обох вказаних амінокислотних послідовностях відсутня сигнальна послідовність.
6. Моноклональне антитіло за п. 5, яке містить:
(a) амінокислотну послідовність SEQ ID NО:6 без сигнальної послідовності, в якій залишок 78 зрілої послідовності змінений з аланіну на треонін, залишок 88 зрілої послідовності змінений з валіну на аланін і залишок 97 зрілої послідовності змінений з валіну на аланін, і
(b) амінокислотну послідовність SEQ ID NО:8 без сигнальної послідовності, в якій залишок 4 зрілої послідовності змінений з лейцину на метіонін, а залишок 83 зрілої послідовності змінений з лейцину на валін.
7. Моноклональне антитіло за п. 5, яке містить:
(а) амінокислотну послідовність SEQ ID NО:46 без сигнальної послідовності, і
(b) амінокислотну послідовність SEQ ID NО:48 без сигнальної послідовності.
8. Фармацевтична композиція, яка містить антитіло або його антигензв’язувальну ділянку за будь-яким з пп. 1-7 і фармацевтично прийнятний носій.
9. Застосування антитіла або антигензв’язувальної ділянки за будь-яким з пп. 1-7 для виробництва лікарського засобу для лікування злоякісної пухлини у людини.
10. Застосування антитіла або антигензв’язувальної ділянки за будь-яким з пп. 1-7 для виробництва лікарського засобу для посилення імунної відповіді у людини.
11. Виділена клітинна лінія, яка продукує антитіло або його антигензв’язувальну частину за будь-яким з пп. 1-7 або важкий ланцюг або легкий ланцюг вказаного антитіла або його антигензв’язувальну ділянку.
12. Виділена молекула нуклеїнової кислоти, яка містить нуклеотидну послідовність, що кодує важкий ланцюг або його антигензв’язувальну ділянку або легкий ланцюг або його антигензв’язувальну ділянку антитіла за будь-яким з пп. 1-7.
13. Виділена молекула нуклеїнової кислоти за п. 12, яка містить нуклеотидну послідовність, вибрану з групи, що складається з:
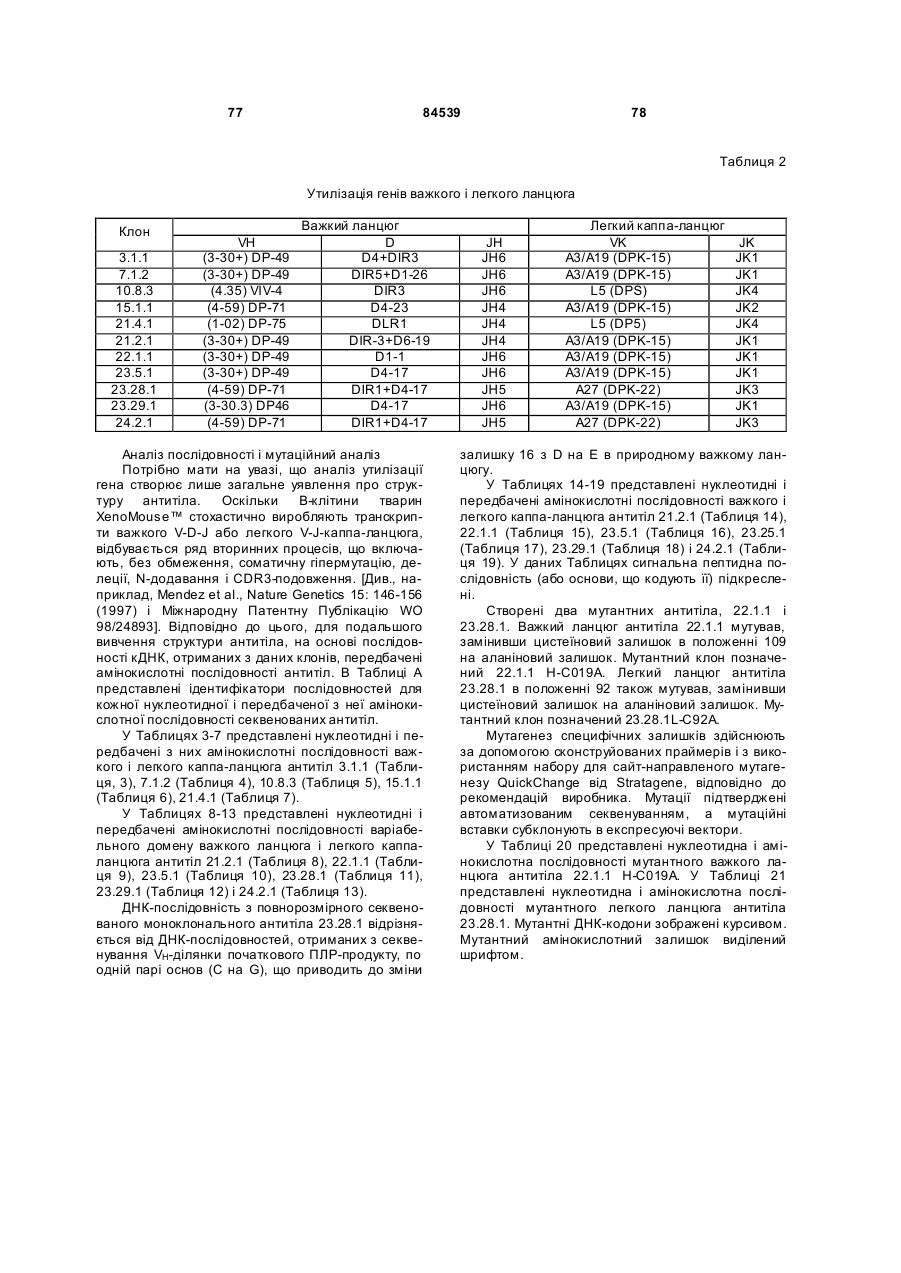
(а) нуклеотидної послідовності, що кодує амінокислотну послідовність важкого ланцюга антитіла або антигензв’язувальної ділянки антитіла, вибраного з групи, яка складається з 3.1.1, 3.1.1Н-А78Т, 3.1.1H-A78T-V88A-V97A, 3.1.1L-L4M-L83V, 3.1.1H-A78T-V88A-V97A/3.1.1L-L4M-L83M, 7.1.2, 10.8.3, 15.1.1, 21.4.1, 21.2.1, 22.1.1, 22.1.1H-C109A, 23.5.1, 23.25.1, 23.28.1, 23.28.1L-C92A, 23.28.1H-D16E, 23.28H-D16E/23.28.1L-C92A, 23.28.1L-C92A, 23.29.1, 23.29.1L-R174K і 24.2.1, або вказану амінокислотну послідовність, яка не містить сигнальну послідовність;
(b) нуклеотидної послідовності, яка кодує амінокислотну послідовність легкого ланцюга або його антигензв’язувальної ділянки антитіла, вибраного з групи, що складається з 3.1.1, 3.1.1Н-А78Т, 3.1.1H-A78T-V88A-V97A, 3.1.1L-L4M-L83V, 3.1.1H-A78T-V88A-V97A/3.1.1L-L4M-L83V, 7.1.2, 10.8.3, 15.1.1, 21.4.1, 21.2.1, 22.1.1, 22.1.1Н-С109А, 23.5.1, 23.25.1, 23.28.1, 23.28.1L-C92A, 23.28.1H-D16E, 23.28H-D16E/23.28.1L-C92A, 23.28.1L-C92A, 23.29.1, 23.29.1L-R174K і 24.2.1, або вказану амінокислотну послідовність, яка не містить сигнальну послідовність;
(с) нуклеотидної послідовності, яка кодує амінокислотну послідовність важкого ланцюга або його варіабельний домен, вибрані з групи, що складається з SEQ ID NО:2, 6, 10, 14, 18, 22, 26, 30, 34, 38, 42, 46, 50, 54, 58, 62, 66, 70, 74, 78, 82, 86, 90, 92, 96 і 98, або вказані амінокислотні послідовності, які не містять сигнальної послідовності, якщо вона присутня; і
d) нуклеотидної послідовності, що кодує важкий ланцюг або його варіабельний домен, причому вказана нуклеотидна послідовність вибрана з групи, яка складається з SEQ ID NО:1, 5, 9, 13, 17, 21, 25, 29, 33, 37, 41, 45, 49, 53, 57, 61, 65, 69, 73, 77, 81, 85, 89, 91, 95 і 97, або вказана послідовність не містить сигнальної послідовності, якщо вона присутня;
е) нуклеотидної послідовності, яка кодує амінокислотну послідовність легкого ланцюга або його варіабельний домен, вибрані з групи, що складається з SEQ ID NО:4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 94, 100 і 102, або вказану амінокислотну послідовність, яка не містить сигнальної послідовності, і
f) нуклеотидної послідовності, що кодує легкий ланцюг або його варіабельний домен, причому вказана нуклеотидна послідовність вибрана з групи, яка складається з SEQ ID NО:3, 7, 11, 15, 19, 23, 27, 31, 35, 39, 43, 47, 51, 55, 59, 63, 67, 71, 75, 79, 83, 87, 93, 99 і 101, або вказана послідовність не містить сигнальної послідовності, якщо вона присутня.
14. Вектор, що містить молекулу нуклеїнової кислоти за пп. 12 або 13, де вказаний вектор необов'язково містить послідовність, яка контролює експресію, оперативно зв'язану з молекулою нуклеїнової кислоти.
15. Клітина-хазяїн, яка містить вектор за п. 14 або молекулу нуклеїнової кислоти за п. 13.
16. Спосіб отримання анти-CD40-антитіла або його антигензв’язувальної ділянки, що передбачає культивування клітини-хазяїна за п. 15 або клітинної лінії за п. 11 у відповідних умовах і виділення вказаного антитіла або його антигензв’язувальної ділянки.
17. Застосування антитіла за п. 1 для виробництва лікарського засобу для лікування CD40-негативної пухлини у людини.
Текст
1. Людське моноклональне антитіло або його антигензв’язувальна частина, які специфічно зв’язуються з людським CD40, причому вказане антитіло або його антигензв’язувальна ділянка є агоністом CD40 і де антитіло містить важкий ланцюг і легкий ланцюг, і при цьому амінокислотні послідовності CDR1, CDR2 і CDR3 вказаного важкого ланцюга і CDR1, CDR2 і CDR3 вказаного легкого ланцюга вибрані з групи, яка складається з (a) амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену важкого ланцюга з послідовністю SEQ ID NО:2 і амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену легкого ланцюга з послідовністю SEQ ID NО:4, відповідно; (b) амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену важкого ланцюга з послідовністю SEQ ID NО:2 і амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену легкого ланцюга з послідовністю SEQ ID NО:94, відповідно; (с) амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену важкого ланцюга з послідовністю SEQ ID NО:90 і амінокислотних по UA (21) 20040604423 (22) 08.11.2002 (24) 10.11.2008 (86) PCT/US02/36107, 08.11.2002 (31) 60/348,980 (32) 09.11.2001 (33) US (46) 10.11.2008, Бюл.№ 21, 2008 р. (72) БЕДІАН ВАХЕ, ГЛЕЙДЬЮ РОНАЛД П., КОРВАЛАН ХОСЕ, ДЖІА КСІАО-ЧІ, ФЕНГ КСІАО (73) ПФАЙЗЕР ПРОДАКТС ІНК., ЕМДЖЕН ФРІМОНТ ІНК. (56) GROHMANN U ET AL: "CD40 ligation ablates the tolerogenic potential of lymphoid dendritic cells." JOURNAL OF IMMUNOLOGY (BALTIMORE, MD. : 1950) 1 JAN 2001, vol. 166, no. 1, 1 January 2001 (2001-01-01), pages 277-283, XP009076192 ISSN: 0022-1767. TURNER J G ET AL: "Anti-CD40 antibody induces antitumor and antimetastatic effects: the role of NK cells." JOURNAL OF IMMUNOLOGY (BALTIMORE, MD. : 1950) 1 JAN 2001, vol. 166, no. 1, 1 January 2001 (2001-01-01), pages 89-94, XP009076193 ISSN: 0022-1767. SZOCINSKI JAMIE L ET AL: "Acti vation-induced cell death of aggressive histology lymphomas by CD40 stimulation: Induction of bax" BLOOD, vol. 100, no. 1, 1 July 2002 (2002-07-01), pages 217-223, XP009076191 ISSN: 0006-4971. MIERLO VAN G J D ET AL: "CD40 STIMUL ATION LEADS TO EFFECTIVE THERAPY OF CD40TUMORS THROUGH INDUCTION OF STRONG SYSTEMIC CYTOTOXIC T LYMPHOC YTE IMMUNITY" PROCEEDINGS OF THE NATION AL AC ADEMY OF SCIENCES OF USA, N ATION AL AC ADEMY OF SCIENCE, WASHINGTON, DC, US, vol. 99, no. 8, 16 April 2002 (2002-04-16), pages 5561-5566, XP008046904 ISSN: 0027-8424. 2 (19) 1 3 слідовностей CDR1, CDR2 і CDR3 варіабельного домену легкого ланцюга з послідовністю SEQ ID NО:4, відповідно; (d) амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену важкого ланцюга з послідовністю з SEQ ID NО:90 і амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену легкого ланцюга з послідовністю SEQ ID NО:94, відповідно; (е) амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену важкого ланцюга з послідовністю SEQ ID NО:92 і амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену легкого ланцюга з послідовністю SEQ ID NО:4, відповідно; (f) амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену важкого ланцюга з послідовністю SEQ ID NО:92 і амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену легкого ланцюга з послідовністю SEQ ID NО:94, відповідно; (g) амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену важкого ланцюга з послідовністю SEQ ID NО:10 і амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену легкого ланцюга з послідовністю SEQ ID NО:12, відповідно; (h) амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену важкого ланцюга з послідовністю SEQ ID NО:18 і амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену легкого ланцюга з послідовністю SEQ ID NО:20, відповідно; (i) амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену важкого ланцюга з послідовністю SEQ ID NО:26 і амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену легкого ланцюга з послідовністю SEQ ID NО:28, відповідно; (j) амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену важкого ланцюга з послідовністю SEQ ID NО:34 і амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену легкого ланцюга з послідовністю SEQ ID NО:36, відповідно; (k) амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену важкого ланцюга з послідовністю SEQ ID NО:42 і амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену легкого ланцюга з послідовністю SEQ ID NО:44, відповідно; (l) амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену важкого ланцюга з послідовністю SEQ ID NО:50 і амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену легкого ланцюга з послідовністю SEQ ID NO:52, відповідно; (m) амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену важкого ланцюга з послідовністю SEQ ID NО:96 і амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену легкого ланцюга з послідовністю SEQ ID NО:52, відповідно; (n) амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену важкого ланцюга з 84539 4 послідовністю SEQ ID NО:58 і амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену легкого ланцюга з послідовністю SEQ ID NО:60, відповідно; (о) амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену важкого ланцюга з послідовністю SEQ ID NО:66 і амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену легкого ланцюга з послідовністю SEQ ID NО:68, відповідно; (р) амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену важкого ланцюга з послідовністю SEQ ID NО:66 і амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену легкого ланцюга з послідовністю SEQ ID NО:100, відповідно; (q) амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену важкого ланцюга з послідовністю SEQ ID NО:98 і амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену легкого ланцюга з послідовністю SEQ ID NО:68, відповідно; (r) амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену важкого ланцюга з послідовністю SEQ ID NО:98 і амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену легкого ланцюга з послідовністю SEQ ID NО:100, відповідно; (s) амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену важкого ланцюга з послідовністю SEQ ID NО:74 і амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену легкого ланцюга з послідовністю SEQ ID NО:76, відповідно; і (t) амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену важкого ланцюга з послідовністю SEQ ID NО:82 і амінокислотних послідовностей CDR1, CDR2 і CDR3 варіабельного домену легкого ланцюга з послідовністю SEQ ID NО:84, відповідно. 2. Моноклональне антитіло або його антигензв’язувальна ділянка за п.1, які мають щонайменше одну з наступних властивостей: (а) не зв’язуються з мишачими, щурячими, собачими і/або кролячими В-клітинами; (b) зв’язуються з В-клітинами людини, макакрезусів та мавп циномолгус; (c) мають селективність відносно CD40, яка щонайменше в 100 разів вища, ніж їх селективність відносно рецепторного активатора ядерного фактора каппа-ланцюга В-клітин (RANK), 4-1ВВ (CD137), рецептора 1 фактора некрозу пухлини (TNFR-1) і рецептора 2 фактора некрозу пухлини (TNFR-2); (d) зв’язуються з CD40 з KD 4×10-10 М або менше; (e) мають показник для CD40 Koff, що складає 2×10-10 або менше; (f) інгібують ріст пухлини in vivo в присутності Тклітин людини і/або дендритних клітин людини; (g) інгібують ріст CD40-позитивних пухлин за відсутності імунних клітин людини; (h) підвищують експресію ICAM, MHC-II, B7-2, CD71, CD23 і/або CD71 на поверхні В-клітин людини; (i) збільшують секрецію IL-12p40, IL-12p70 і/або IL 5 8 дендритними клітинами людини; (j) збільшують експресію ICAM, MHC-II, B7-2 і/або CD83 на поверхні дендритних клітин людини; (k) підвищують експресію гамма-інтереферону Тклітинами людини під час їх алогенної стимуляції; (l) зв’язують людський CD40 у присутності людського CD40L; (m) зв’язуються з епітопом CD40 людини, який знаходиться в межах домену 1 або домену 2 позаклітинного домену CD40; і (n) зв’язуються з епітопом CD40 людини, що знаходиться у межах домену 2 або домену 3 позаклітинного домену CD40. 3. Моноклональне антитіло за п.1, в якому амінокислотні послідовності важкого ланцюга та легкого ланцюга вибрані з групи, яка складається з: (a) амінокислотної послідовності важкого ланцюга і амінокислотної послідовності легкого ланцюга моноклонального антитіла 3.1.1, причому в обох вказаних амінокислотних послідовностях відсутня сигнальна послідовність; (b) амінокислотної послідовності важкого ланцюга і амінокислотної послідовності легкого ланцюга моноклонального антитіла 7.1.2, причому в обох вказаних амінокислотних послідовностях відсутня сигнальна послідовність; (с) амінокислотної послідовності важкого ланцюга і амінокислотної послідовності легкого ланцюга моноклонального антитіла 10.8.3, причому в обох вказаних амінокислотних послідовностях відсутня сигнальна послідовність; (d) амінокислотної послідовності важкого ланцюга і амінокислотної послідовності легкого ланцюга моноклонального антитіла 15.1.1, причому в обох вказаних амінокислотних послідовностях відсутня сигнальна послідовність; (е) амінокислотної послідовності важкого ланцюга і амінокислотної послідовності легкого ланцюга моноклонального антитіла 21.4.1, причому в обох вказаних амінокислотних послідовностях відсутня сигнальна послідовність; (f) амінокислотної послідовності важкого ланцюга і амінокислотної послідовності легкого ланцюга моноклонального антитіла 21.2.1, причому в обох вказаних амінокислотних послідовностях відсутня сигнальна послідовність; (g) амінокислотної послідовності важкого ланцюга і амінокислотної послідовності легкого ланцюга моноклонального антитіла 22.2.1, причому в обох вказаних амінокислотних послідовностях відсутня сигнальна послідовність; (h) амінокислотної послідовності важкого ланцюга і амінокислотної послідовності легкого ланцюга моноклонального антитіла 22.2.1Н-С109А, причому в обох вказаних амінокислотних послідовностях відсутня сигнальна послідовність; (i) амінокислотної послідовності важкого ланцюга і амінокислотної послідовності легкого ланцюга моноклонального антитіла 23.5.1, причому в обох вказаних амінокислотних послідовностях відсутня сигнальна послідовність; (j) амінокислотної послідовності важкого ланцюга і амінокислотної послідовності легкого ланцюга моноклонального антитіла 23.25.1, причому в обох вказаних амінокислотних послідовностях відсутня 84539 6 сигнальна послідовність; (k) амінокислотної послідовності важкого ланцюга і амінокислотної послідовності легкого ланцюга моноклонального антитіла 23.28.1, причому в обох вказаних амінокислотних послідовностях відсутня сигнальна послідовність; (l) амінокислотної послідовності важкого ланцюга і амінокислотної послідовності легкого ланцюга моноклонального антитіла 23.28.1L-C92A, причому в обох вказаних амінокислотних послідовностях відсутня сигнальна послідовність; (m) амінокислотної послідовності важкого ланцюга і амінокислотної послідовності легкого ланцюга моноклонального антитіла 23.28.1H-D16E, причому в обо х вказаних амінокислотних послідовностях відсутня сигнальна послідовність; (n) амінокислотної послідовності важкого ланцюга і амінокислотної послідовності легкого ланцюга моноклонального антитіла 23.29.1, причому в обох вказаних амінокислотних послідовностях відсутня сигнальна послідовність; (о) амінокислотної послідовності важкого ланцюга і амінокислотної послідовності легкого ланцюга моноклонального антитіла 24.2.1, причому в обох вказаних амінокислотних послідовностях відсутня сигнальна послідовність; (р) амінокислотної послідовності важкого ланцюга і амінокислотної послідовності легкого ланцюга моноклонального антитіла 3.1.1Н-А78Т, причому в обох вказаних амінокислотних послідовностях відсутня сигнальна послідовність; (q) амінокислотної послідовності важкого ланцюга і амінокислотної послідовності легкого ланцюга моноклонального антитіла 3.1.1H-A78T-V88A-V97A, причому в обох вказаних амінокислотних послідовностях відсутня сигнальна послідовність; (r) амінокислотної послідовності важкого ланцюга і амінокислотної послідовності легкого ланцюга моноклонального антитіла 3.1.1L-L4M-L83V, причому в обох вказаних амінокислотних послідовностях відсутня сигнальна послідовність; (s) амінокислотної послідовності важкого ланцюга і амінокислотної послідовності легкого ланцюга моноклонального антитіла 3.1.1H-A78T-V88AV97A/3.1.1L-L4M-L83V, причому в обох вказаних амінокислотних послідовностях відсутня сигнальна послідовність; (t) амінокислотної послідовності важкого ланцюга і амінокислотної послідовності легкого ланцюга моноклонального антитіла 23.29.1L-R174K, причому в обох вказаних амінокислотних послідовностях відсутня сигнальна послідовність; і (u) амінокислотної послідовності важкого ланцюга і амінокислотної послідовності легкого ланцюга моноклонального антитіла 23.28.1H-D16E/23.28.1LC92A, причому в обох вказаних амінокислотних послідовностях відсутня сигнальна послідовність. 4. Моноклональне антитіло або його антигензв’язувальна ділянка за п.1, в яких амінокислотні послідовності варіабельного домену вказаного важкого ланцюга та варіабельного домену вказаного легкого ланцюга вибрані з групи, яка складається з: (a) амінокислотної послідовності SEQ ID NО:2 і амінокислотної послідовності SEQ ID NO:4, відпо 7 відно; (b) амінокислотної послідовності SEQ ID NО:2 і амінокислотної послідовності SEQ ID NО:94, відповідно; (c) амінокислотної послідовності SEQ ID NО:90 і амінокислотної послідовності SEQ ID NО:4, відповідно; (d) амінокислотної послідовності SEQ ID NО:90 і амінокислотної послідовності SEQ ID NО:94, відповідно; (е) амінокислотної послідовності SEQ ID NО:92 і амінокислотної послідовності SEQ ID NО:4, відповідно; (f) амінокислотної послідовності SEQ ID NО:92 і амінокислотної послідовності SEQ ID NО:94, відповідно; (g) амінокислотної послідовності SEQ ID NО:10 і амінокислотної послідовності SEQ ID NО:12, відповідно; (h) амінокислотної послідовності SEQ ID NО:18 і амінокислотної послідовності SEQ ID NO:20, відповідно; (i) амінокислотної послідовності SEQ ID NО:26 і амінокислотної послідовності SEQ ID NО:28, відповідно; (j) амінокислотної послідовності SEQ ID NО:34 і амінокислотної послідовності SEQ ID NО:36, відповідно; (k) амінокислотної послідовності SEQ ID NО:42 і амінокислотної послідовності SEQ ID NО:44, відповідно; (l) амінокислотної послідовності SEQ ID NО:50 і амінокислотної послідовності SEQ ID NО:52, відповідно; (m) амінокислотної послідовності SEQ ID NО:96 і амінокислотної послідовності SEQ ID NО:52, відповідно; (n) амінокислотної послідовності SEQ ID NО:58 і амінокислотної послідовності SEQ ID NО:60, відповідно; (о) амінокислотної послідовності SEQ ID NО:66 і амінокислотної послідовності SEQ ID NО:68, відповідно; (р) амінокислотної послідовності SEQ ID NО:66 і амінокислотної послідовності SEQ ID NО:100, відповідно; (q) амінокислотної послідовності SEQ ID NО:98 і амінокислотної послідовності SEQ ID NO:68, відповідно; (r) амінокислотної послідовності SEQ ID NО:98 і амінокислотної послідовності SEQ ID NО:100, відповідно; (s) амінокислотної послідовності SEQ ID NО:74 і амінокислотної послідовності SEQ ID NО:76, відповідно; i (t) амінокислотної послідовності SEQ ID NО:82 і амінокислотної послідовності SEQ ID NО:84, відповідно. 5. Моноклональне антитіло за п.1, в якому амінокислотні послідовності важкого ланцюга та легкого ланцюга вибрані з групи, яка складається з: (a) амінокислотної послідовності SEQ ID NO:6 і амінокислотної послідовності SEQ ID NО:8, відповідно, причому в обох вказаних амінокислотних послідовностях відсутня сигнальна послідовність; 84539 8 (b) амінокислотної послідовності SEQ ID NО:14 і амінокислотної послідовності SEQ ID NO:16, відповідно, причому в обох вказаних амінокислотних послідовностях відсутня сигнальна послідовність; (с) амінокислотної послідовності SEQ ID NО:22 і амінокислотної послідовності SEQ ID NО:24, відповідно, причому в обох вказаних амінокислотних послідовностях відсутня сигнальна послідовність; (d) амінокислотної послідовності SEQ ID NО:30 і амінокислотної послідовності SEQ ID NО:32, відповідно, причому в обох вказаних амінокислотних послідовностях відсутня сигнальна послідовність; (е) амінокислотної послідовності SEQ ID NО:38 і амінокислотної послідовності SEQ ID NO:40, відповідно, причому в обох вказаних амінокислотних послідовностях відсутня сигнальна послідовність; (f) амінокислотної послідовності SEQ ID NО:46 і амінокислотної послідовності SEQ ID NO:48, відповідно, причому в обох вказаних амінокислотних послідовностях відсутня сигнальна послідовність; (g) амінокислотної послідовності SEQ ID NО:54 і амінокислотної послідовності SEQ ID NО:56, відповідно, причому в обох вказаних амінокислотних послідовностях відсутня сигнальна послідовність; (h) амінокислотної послідовності SEQ ID NО:62 і амінокислотної послідовності SEQ ID NO:64, відповідно, причому в обох вказаних амінокислотних послідовностях відсутня сигнальна послідовність; (i) амінокислотної послідовності SEQ ID NО:70 і амінокислотної послідовності SEQ ID NО:72, відповідно, причому в обох вказаних амінокислотних послідовностях відсутня сигнальна послідовність; (j) амінокислотної послідовності SEQ ID NО:78 і амінокислотної послідовності SEQ ID NО:80, відповідно, причому в обох вказаних амінокислотних послідовностях відсутня сигнальна послідовність; i (k) амінокислотної послідовності SEQ ID NО:86 і амінокислотної послідовності SEQ ID NО:88, відповідно, причому в обох вказаних амінокислотних послідовностях відсутня сигнальна послідовність. 6. Моноклональне антитіло за п.5, яке містить: (a) амінокислотну послідовність SEQ ID NО:6 без сигнальної послідовності, в якій залишок 78 зрілої послідовності змінений з аланіну на треонін, залишок 88 зрілої послідовності змінений з валіну на аланін і залишок 97 зрілої послідовності змінений з валіну на аланін, і (b) амінокислотну послідовність SEQ ID NО:8 без сигнальної послідовності, в якій залишок 4 зрілої послідовності змінений з лейцину на метіонін, а залишок 83 зрілої послідовності змінений з лейцину на валін. 7. Моноклональне антитіло за п.5, яке містить: (а) амінокислотну послідовність SEQ ID NО:46 без сигнальної послідовності, і (b) амінокислотну послідовність SEQ ID NО:48 без сигнальної послідовності. 8. Фармацевтична композиція, яка містить антитіло або його антигензв’язувальну ділянку за будьяким з пп.1-7 і фармацевтично прийнятний носій. 9. Застосування антитіла або антигензв’язувальної ділянки за будь-яким з пп.1-7 для виробництва лікарського засобу для лікування злоякісної пухлини у людини. 10. Застосування антитіла або анти 9 84539 10 гензв’язувальної ділянки за будь-яким з пп.1-7 для виробництва лікарського засобу для посилення імунної відповіді у людини. 11. Виділена клітинна лінія, яка продукує анти тіло або його антигензв’язувальну частину за будьяким з пп.1-7 або важкий ланцюг або легкий ланцюг вказаного антитіла або його антигензв’язувальну ділянку. 12. Виділена молекула нуклеїнової кислоти, яка містить нуклеотидн у послідовність, що кодує важкий ланцюг або його антигензв’язувальну ділянку або легкий ланцюг або його антигензв’язувальну ділянку антитіла за будь-яким з пп.1-7. 13. Виділена молекула нуклеїнової кислоти за п.12, яка містить нуклеотидну послідовність, вибрану з групи, щоскладається з: (а) нуклеотидної послідовності, що кодує амінокислотну послідовність важкого ланцюга антитіла або антигензв’язувальної ділянки антитіла, вибраного з групи, яка складається з 3.1.1, 3.1.1НА78Т, 3.1.1H-A78T-V88A-V97A, 3.1.1L-L4M-L83V, 3.1.1H-A78T-V88A-V97 A/3.1.1L-L4M-L83M, 7.1.2, 10.8.3, 15.1.1, 21.4.1, 21.2.1, 22.1.1, 22.1.1H-C109A, 23.5.1, 23.25.1, 23.28.1, 23.28.1L-C92A, 23.28.1HD16E, 23.28H-D16E/23.28.1L-C92A, 23.28.1L-C92A, 23.29.1, 23.29.1L-R174K і 24.2.1, або вказану амінокислотну послідовність, яка не містить сигнальну послідовність; (b) нуклеотидної послідовності, яка кодує амінокислотну послідовність легкого ланцюга або його антигензв’язувальної ділянки антитіла, вибраного з групи, що складається з 3.1.1, 3.1.1Н-А78Т, 3.1.1H-A78T-V88A-V97 A, 3.1.1L-L4M-L83V, 3.1.1HA78T-V88A-V97A/3.1.1L-L4M-L83V, 7.1.2, 10.8.3, 15.1.1, 21.4.1, 21.2.1, 22.1.1, 22.1.1Н-С109А, 23.5.1, 23.25.1, 23.28.1, 23.28.1L-C92A, 23.28.1H-D16E, 23.28H-D16E/23.28.1L-C92A, 23.28.1L-C92A, 23.29.1, 23.29.1L-R174K і 24.2.1, або вказану амінокислотну послідовність, яка не містить сигнальну послідовність; (с) нуклеотидної послідовності, яка кодує амінокислотну послідовність важкого ланцюга або його варіабельний домен, вибрані з групи, що складається з SEQ ID NО:2, 6, 10, 14, 18, 22, 26, 30, 34, 38, 42, 46, 50, 54, 58, 62, 66, 70, 74, 78, 82, 86, 90, 92, 96 і 98, або вказані амінокислотні послідовності, які не містять сигнальної послідовності, якщо вона присутня; і d) нуклеотидної послідовності, що кодує важкий ланцюг або його варіабельний домен, причому вказана нуклеотидна послідовність вибрана з групи, яка складається з SEQ ID NО:1, 5, 9, 13, 17, 21, 25, 29, 33, 37, 41, 45, 49, 53, 57, 61, 65, 69, 73, 77, 81, 85, 89, 91, 95 і 97, або вказана послідовність не містить сигнальної послідовності, якщо вона присутня; е) нуклеотидної послідовності, яка кодує амінокислотну послідовність легкого ланцюга або його варіабельний домен, вибрані з групи, що складається з SEQ ID NО:4, 8, 12, 16, 20, 24, 28, 32, 36, 40, 44, 48, 52, 56, 60, 64, 68, 72, 76, 80, 84, 88, 94, 100 і 102, або вказану амінокислотну послідовність, яка не містить сигнальної послідовності, і f) нуклеотидної послідовності, що кодує легкий ланцюг або його варіабельний домен, причому вказана нуклеотидна послідовність вибрана з групи, яка складається з SEQ ID NО:3, 7, 11, 15, 19, 23, 27, 31, 35, 39, 43, 47, 51, 55, 59, 63, 67, 71, 75, 79, 83, 87, 93, 99 і 101, або вказана послідовність не містить сигнальної послідовності, якщо вона присутня. 14. Вектор, що містить молекулу нуклеїнової кислоти за пп.12 або 13, де вказаний вектор необов'язково містить послідовність, яка контролює експресію, оперативно зв'язану з молекулою нуклеїнової кислоти. 15. Клітина-хазяїн, яка містить вектор за п.14 або молекулу н уклеїнової кислоти за п.13. 16. Спосіб отримання анти-CD40-антитіла або його антигензв’язувальної ділянки, що передбачає культивування клітини-хазяїна за п.15 або клітинної лінії за п.11 у відповідних умовах і виділення вказаного антитіла або його антигензв’язувальної ділянки. 17. Застосування антитіла за п.1 для виробництва лікарського засобу для лікування CD40-негативної пухлини у людини. Дана заявка має пріоритет відповідно до попередньої [заявки США №60/348980, поданої 9 листопада 2001р.]. Антиген CD40 являє собою 50кДа глікопротеїн клітинної поверхні, який відноситься до сімейства рецепторів фактора некрозу пухлин (TNF-R). [Stamenkovic et al., EMBO J. 8: 1403-10 (1989)]. CD40 експресується в багатьох типах нормальних і пухлинних клітин, включаючи В-лімфоцити, дендритні клітини, моноцити, макрофаги, епітелій вилочковой залози, ендотеліальні клітини, фібробласти, і клітини гладкої мускулатури. [Paulie S. et al., Cancer Immunol. Jmmun other. 20: 23-8 (1985); Banchereau J. et al., Adv. Exp. Med. & Biol. 378: 7983 (1995); Alderson M.R. et al., J. of Exp. Med. 178: 669-74 (1993); Ruggiero G. et al., J. of Immunol. 156: 3737-46 (1996); Hollenbaugh D. et al., J. of Exp. Med. 182: 33-40 (1995); Yellin M.J. et al., J. of Leukocyte Biol. 58: 209-16 (1995); і Lazaar A.L. et al., J. of Immunol. 161: 3120-7 (1998)]. CD40 експресується у всі х В-лімфомах і у 70% всіх солідних пухлин. Незважаючи на конститути вну експресію, CD40 добре регулюється в антигенпрезентуючих клітинах за допомогою сигналів дозрівання, таких як LPS, IL-Iβ, IFN-g і GM-CSF. Активація CD40 грає вирішальну роль в регуляції гуморальної і клітинної імунних відповідей. Антигенна презентація без активації CD40 може привести до толерантності, а СD40-сигналізація може обернути таку толерантність, посилити антигенну презентацію за допомогою всіх антигенпрезентуючих клітин (АПК), привести до секреції хел 11 84539 перних цитокінів і хемокінів, підвищити експресію ко-стимулюючих молекул і передачу сигналів, а також стимулювати цитолітичну активність імунних клітин. CD40 грає ключову роль в проліферації Вклітин, дозріванні і перемиканні класу імуноглобулінів. [Foy Т.М. et al., Ann. Rev. of Immunol. 14: 591617 (1996)). Порушення сигнального шляху CD40 веде до аномального розподілу ізотипів сироваткового імуноглобуліну, до відсутності СВ4+-Тклітинного примування і до дефектів вторинних гуморальних відповідей. Наприклад, Х-зчеплений синдром надмірного утворення IgM являє собою захворювання, пов'язане з мутацією у людини гена CD40L, яке характеризується нездатністю уражених індивідів виробляти антитіла, відмінні від IgMізотопу, і що свідчать про те, що для ефективної імунної відповіді необхідна продуктивна взаємодія між CD40 і CD40L. Захоплення CD40 за допомогою CD40L приводить до асоціації цитоплазматичного домена CD40 з TRAF (TNF-R-асоційовані фактори). [Lee H.H. et аl., Рrос. Natl. Acad. Sci. USA 96: 1421-6 (1999); Pullen S.S. et al., Biochemistry 37: 11836-45 (1998); Grammar А.С. et al., J. of Immunol. 161: 1183-93 (1998); Ishida ТАК ЯК et al., Рrос. Natl. Acad. Sci. USA 93: 9437-42 (1996); Pullen S.S. et al., J. of Biol. Chem. 274: 14246-54 (1999)]. Така взаємодія з TRAF може завершувати активацію обох шляхів - NFkB і Jun/APl. [Tsukamoto N. et al., Рrос. Natl. Acad. Sci. USA 96: 1234-9 (1999); Sutherland CL. et al., J. of Immunol. 162: 4720-30 (1999)]. В залежності від типу клітин, дана сигналізація приводить до посилення секреції цитокінів, таких як IL-6 [Jeppson J.D. et al., J. of Immunol. 161: 1738-42 (1998); Uejima Y. et al., Int. Arch, of Allergy & Immunol. 110: 225-32, (1996)], IL-8 [Gruss H.J. et al., Blood 84: 2305-14 (1994); von Leoprechting A. et al., Cancer Res. 59: 1287-94 (1999); Denfeld R.W. et al., Europ. J. of Immunol. 26: 2329-34 (1996)], IL-12 [Cella M. et al., J. of Exp. Med. 184: 747-52 (1996); Ferlin W.G. et al., Europ. J. of Immunol. 28: 525-31 (1998); Armant M. et al., Europ. J. of Immunol. 26: 1430-4 (1996); Koch F. et al., J. of Exp. Med. 184: 741-6 (1996); Seguin R. and L.H. Kasper, J. of Infect. Diseases 179: 467-74 (1999); Chaussabel D. et al., Infection & Immunity 67: 1929-34 (1999)], IL-15 [Kuniyoshi J.S. et al., Cellular Immunol. 193: 48-58 (1999)] і хемокінів [MIPIα, MIPIβ, R ANTES і інші) [McD yer J.F. et аl., J. of Iimunol. 162: 3711-7 (1999); Schaniel C. et al., J. of Exp. Wed. 188: 451-63 (1998); Altenburg A. et al., J. of Iimunol. 162: 4140-7 (1999); Deckers J.G. et al., J. of the Am. Society of Nephrology 9: 1187-93 (1998)], підвищує експресію MHC класу І і II (Santos-Argumedo L. et al., Cellular Immunol. 156: 272-85 (1994)], і підвищує експресію адгезивних молекул (наприклад, ICAM) [Lee Н.Н. et al., Рrос. Natl. Acad. Sci. USA 96: 1421-6 (1999); Grousson J. et al., Archi ves of Dermatol. Res. 290: 325-30 (1998); Katada Y. et al., Europ. J. of Immunol. 26: 192-200 (1996); Mayumi M. et al., J. of Allergy & Clin. Immunol. 96: 1136-44 (1995); Flores-Romo L. et al., Immunol. 79: 445-51 (1993)] і ко-стимулюючих молекул (наприклад, В7) [Roy M. et al., Europ. J. of Immunol. 25: 596-603 (1995); Jones K.W. and CJ. 12 Hackett, Cellular Immunol. 174: 42-53 (1996); Caux C. et al., Journal of Exp. Med. 180: 1263-72 (1994); Kiener P.A. et al, J. of Immunol. 155: 4917-25 (1995)]. Цитокини індукували внаслідок захоплення CD40, що підвищує виживаність і активацію Тклітин. Крім посилення клітинної і імунної функції, ефекти СD40-активації включають в себе рекрутинг клітин і їх диференціювання за допомогою хемокінів і цитокінів; активацію моноцитів, підвищення цитолітичної активності цитолітичних Тлімфоцитів (CTL) і природних кілерних (NK) клітин; індукцію апоптозу в СD40-позитивних злоякісних пухлинах; посилення імуногенності СD40позитивних злоякісних пухлин; і утворення антитіл, специфічних відносно злоякісних пухлин. Встановлена також роль СD40-активації в опосередкованих клітиною імунних відповідях, яка розглядається у Grewall et al., Ann. Rev. of Immunol. 16: 111-35 (1998); Mackey et al., J. of Leukocyte Biol. 63: 418-28 (1998); і Noelle R.J., Agents & Actions - Suppl. 49: 17-22 (1998)]. Дослідження з використанням модельної системи перехресного примування показують, що СD40-активація АПК може замінити потребу в хелперних T-клітинах, необхідних для утворення цитолітичних Т-лімфоцитів (CTL). [Bennett et al., Nature 393: 478-480 (1998)]. Дані, отримані на мишах з недостатньою кількістю CD40L, свідчать про явну потребу в СD40-сигналах для ініціації хелперних T-клітин. [Grewal I.S. et al., Science 273: 18647 (1996); Grewal LS. et al., Nature 378: 617-20 (1995)]. СD40-активація перетворює в іншому випадку толерогенні, антиген несучі В-клітини в компетентні АПК. [Buhlmann J.E. et al., Immunity 2: 64553 (1995)]. СD40-активація індукує дозрівання і диференціювання клітин-попередників пуповинної крові в дендритні клітини. [Flores-Romo L. et al., J. of Exp. Med. 185: 341-9 (1997); Mackey M.F. et al., J. of Iimunol. 161: 2094-8 (1998)]. СD40-активація індукує також диференціювання моноцитів в функціональні дендритні клітини. [Brossart P. et al., Blood 92: 4238-47 (1998)]. Крім того, CD40активація підвищує цитолітичну активність NKклітин за допомогою ATIK-CD40 індукованих цитокінів. [Carbone E. et al., J. of Exp. Med. 185: 2053-60 (1997); Martin-Fontecha A. et al., J. of Immunol. 162: 5910-6 (1999)]. Дані спостереження свідчать про те, що CD40 грає істотну роль в ініціації і посиленні імунних відповідей шляхом індукції дозрівання АПК, секреції хелперних цитокінів, поліпшеної регуляції костимулюючих молекул, а також в посиленні ефекторних функцій. Ключова роль СD40-сигналів в ініціація і розвитку гуморальної і цитотоксичної імунних відповідей робить дану систему ідеальною мішенню для імунного посилення. Таке посилення може бути особливо важливим для підтримки ефективних імунних відповідей на антигени злоякісних пухлин, які, як правило, представляються імунній системі через примування перехрестнореагуючим антигеном активованих АПК. [Huang A.Y. et al., Ciba Foundation Symp. 187: 229-44 (1994); Toes R.E.M. et al, Seminars in Immunol. 10: 443-8 (1998); Albert M.L. et al., Nature 392: 86-9 (1998); Bennett S.R. et 13 84539 al., J. of Exp. Med. 186: 65-70 (1997)]. Декілька груп дослідників продемонстрували ефективність СD40-активаци відносно протипухлинних відповідей in vitro і in vivo. [Toes R.E.M. et al., Seminars in Immunol. 10: 443-8 (1998)]. Дві групи дослідників, використовуючи модель легеневих метастазів нирковоклітинної карциноми і підшкірні пухлини, викликані за допомогою трансформованих вірусом клітин, незалежно показали, що активація CD40 може обернути толерантність до пухлиноспецифічних антигенів, викликаючи ефективну протипухлинну ініціацію Т-клітин. [Sotomayor Е.М. et al., Nature Medicine 5: 780-787 (1999); Diehl L. et al., Nature Medicine 5: 774-9 (1999)]. Про протипухлинну активність за відсутності імунних клітин повідомляється також для обробленої з допомогою CD40L і антитіла до CD40 модельної лінії злоякісних клітин молочної залози людини у SCID-мишей [Hirano A. et al., Blood 93: 2999-3007 (1999)]. На мишачих моделях недавно показана ліквідація лімфом CD40+ і CD40- внаслідок СD40-активації за допомогою антитіл до CD40. [French R.R. et al., Nature Medicine 5: 548-53 (1999)]. Більше того в попередніх дослідженнях Glennie і співавторів зроблений висновок про те, що сигнальна активність антитіл до CD40 більш ефективна для індукції клиренсу пухлини in vi vo ніж сигнальна активність інших антитіл до поверхневих маркерів, здатних викликати рекрутинг ефекторів. [Tutt A.L. et al., J. of Immunol. 161: 3176-85 (1998)]. Згідно з цими спостереженнями, при тестуванні антитіла до CD40 на активність проти CD40+-злоякісних клітин in vivo в більшості випадків, хоч і не завжди, туморицидна активність асоціюється швидше з СD40-сигналом ніж з ADCC. [Funakoshi S. et al., J. of Immunotherapy with Emphasis on Tumor Immunol. 19: 93-101 (1996)]. В іншому дослідженні дендритні клітини кісткового мозку обробляли ex vivo різними агентами, і тестували in vivo протипухлинну активність. Ці дослідження показали, що ДК, стимульовані CD40L, є найбільш зрілими і найбільш ефективними клітинами, що підвищують протипухлинну відповідь. Істотна роль CD40 в протипухлинному імунітеті показана також при порівнянні відповідей на протипухлинні вакцини у мишей дикого типу і у мишей CD40-/-. Ці дослідження показали, що миші CD40-/- не здатні реалізувати протипухлинний імунітет, властивий нормальним мишам. [Mackey M.F. et al., Cancer Research 57: 2569-74 (1997)]. В іншому дослідженні спленоцити мишей, носіїв пухлини, стимульовані пухлинними клітинами і оброблені активуючими ех vi vo антитілами до CD40, показали підвищену пухлиноспецифічну CTLактивність. [Donepudi M. et al., Cancer Iwnunol. Iwnunother. 48: 153-164 (1999)]. Ці дослідження показали, що CD40 займає ключову позицію в протипухлинному імунітеті, як в позитивних, так і в негативних по CD40 злоякісних пухлинах. Оскільки CD40 експресується в лімфомах, лейкозі, множинній мієломі, в більшості карцином носоглотки, сечового міхура, яєчника і печінки, а також в деяких карциномах молочної залози і прямої кишки, активація CD40 може мати широкий діапазон клінічного застосування. 14 Активація моноклональних антитіл до CD40 може сприяти ліквідації злоякісної пухлини за допомогою декількох важливих механізмів. Перший з них полягає в активації хазяйських дендритних клітин для посилення процесингу пухлинного антигена і його презентації, а також підвищення антигенної презентації або імуногенності самих пухлинних СD40-позитивних клітин, що приводить до активації пухлиноспецифічних CD4 +- і СВ8+лімфоцитів. Додаткова протипухлинна активність може бути опосередкована іншими посилюючими імунітет ефектами СD40-сигналів (вироблення хемокінів і цитокінів, набір і активування моноцитів, підвищення CTL- і NK-цитолітичної активності), а також прямим знищенням СD40+-пухлин внаслідок індукції апоптозу або шляхом стимуляції гуморальної відповіді, що приводить до ADCC. Клітини апоптозної і гинучої пухлини можуть також бути важливим джерелом пухлиноспецифічних антигенів, якими процесуються і презентуються АПК, активованими CD40. Відповідно до викладеного, існує гостра необхідність в терапевтичних, клінічно придатних антитілах проти CD40-агоністів. На Фіг.1A-1H представлені вирівнювання передбачених амінокислотних послідовностей для виділених варіабельних доменів легкого і важкого ланцюгів моноклонального антитіла до CD40 з амінокислотними послідовностями відповідних легкого і важкого ланцюгів генів зародкової лінії). Відмінності між клонами і відповідною послідовністю зародкової лінії відтінені. Послідовності зародкових ліній CDR1, CDR2 і CDR3 підкреслені. У вирівняних послідовностях важкого ланцюга поява інсерцій на СDR3-ділянці в послідовності зародкової лінії вказано знаком тире (-), а поява в послідовності даного клону делеції в CDR3-ділянці вказані знаком тире (-). Фіг.1A: передбачені амінокислотні послідовності варіабельної ділянки легкого каппа-ланцюга з монАТ 3.1.1 і 7.1.2 з Vk =A3/A19 і J=Jk 1 амінокислотні послідовності гена зародкової лінії. Фіг.1B: амінокислотні послідовності передбаченої варіабельної ділянки легкого каппа-ланцюга з клона 15.1.1 і амінокислотна послідовність (Vk=A3/A19 і J=J k2) клітин зародкової лінії; Фіг.1С: амінокислотні послідовності передбаченої варіабельної ділянки легкого каппа-ланцюга з монАТ 10.8.3 і 21.4.1 і амінокислотна послідовність (Vk =L5 (DP5) і J=Jk4) клітин зародкової лінії; Фіг.1D: амінокислотна послідовність передбаченої варіабельної ділянки важкого ланцюга з монАТ 3.1.1 і амінокислотна послідовність (VH=330+(DP-49), D=D4+DIR3 і J=JH6) клітин зародкової лінії; Фіг.1E: амінокислотна послідовність передбаченої варіабельної ділянки важкого ланцюга з монАТ 7.1.2 і амінокислотна послідовність (VH=330+(DP-49), D=DIR5+D1-26 і J=JH6) клітин зародкової лінії; Фіг.1F: амінокислотні послідовності передбаченої варіабельної ділянки важкого ланцюга з монАТ 10.8.3 і амінокислотна послідовність (VH=4.35 (VIV-4), D=DIR3 і J=JH6) клітин зародкової лінії; Фіг.1G: амінокислотні послідовності передба 15 84539 ченої варіабельної ділянки важкого ланцюга з монАТ 15.1.1 і амінокислотна послідовність (VH=4-59 (DP-71), D=D4-23 і J=JH4) клітин зародкової лінії; Фіг.1Н: амінокислотні послідовності передбаченої варіабельної ділянки важкого ланцюга з монАТ 21.4.1 і амінокислотна послідовність (VH=1-02 (DP-75), D=DLR1 і J=JH4) клітин зародкової лінії. На Фіг.2А-2Н представлено вирівнювання передбачених амінокислотних послідовностей виділених доменів легкого і важкого ланцюга моноклонального антитіла до CD40 і амінокислотних послідовностей відповідних легкому і важкому ланцюгу генів зародкової лінії. Відмінності між клонами і даною послідовністю зародкової лінії виділені жирним шрифтом. Послідовності клітин зародкової лінії CDR1, CDR2, і CDR3 підкреслені. При вирівнюванні послідовностей важкого ланцюга поява вставок на СDR3-ділянці зародкової лінії вказана знаком тире (-), а поява в послідовності даного клона делеції в СDR3-ділянці вказана знаком тире (-). Фіг.2А: передбачені амінокислотні послідовності легкого каппа-ланцюга з монАТ 22.1.1, 23.5.1, і 23.29.1 і амінокислотна послідовність (Vk=A3/A19 і J=Jk1) клітин зародкової лінії; Фіг.2В: передбачені амінокислотні послідовності легкого каппа-ланцюга з монАТ 21.2.1 і амінокислотна послідовність (Vk=A3/A19 і J=Jk3) клітин зародкової лінії; Фіг.2С: передбачені амінокислотні послідовності легкого каппа-ланцюга з монАТ 23.28.1, 23.28.1 L-C92A і 24.2.1 і амінокислотна послідовність (Vk=A27 і J=J k3) клітин зародкової лінії; Фіг.2В: передбачена амінокислотна послідовність важкого ланцюга з монАТ 21.2.1 і амінокислотна послідовність (VH=3-30+, D=DIR3+D6-19 і J=JH4) клітин зародкової лінії; Фіг.2Е: передбачена амінокислотна послідовність важкого ланцюга з монАТ 21.1.1, 22.1.1 НС109А і амінокислотна послідовність (VH=3-30+, D=D1-1 і J=JH6) клітин зародкової лінії; Фіг.2F: передбачений важкий ланцюг амінокислотної послідовності з монАТ 23.5.1 і амінокислотна послідовність (VH=3-30+, D=D4-17 і J=JH6) клітин зародкової лінії; Фіг.2G: передбачена амінокислотна послідовність важкого ланцюга з монАТ 23.29.1 і амінокислотна послідовність (VH=3-30.3, D=D4-17 і J=JH6) клітин зародкової лінії; Фіг.2Н: передбачені амінокислотні послідовності важкого ланцюга з монАТ 23.28.1, 23.28.1 HD16Е і 24.2.1 і амінокислотна послідовність клітин зародкової лінії (VH=4-59, D=DIR1+D4-17 i J=JH5). На Фіг.3 представлена крива залежності "дозаефект", яка ілюструє здатність антитіла проти CD40 згідно з винаходом (21.4.1) підвищува ти утворення IL-12p40 дендритними клітинами людини. На Фіг.4 представлена крива залежності "дозаефект", яка ілюструє здатність антитіла проти CD40 згідно з винаходом (21.4.1) підвищува ти утворення IL-12p70 дендритними клітинами людини. На Фіг.5 представлений графік, який ілюструє здатність антитіла проти CD40 згідно з винаходом 16 (21.4.1) підвищувати імуногенність стимулюючих клітин Jy і посилювати CTL-активність проти клітин-мішеней Jy. На Фіг.6 представлена крива інгібування росту злоякісної пухлини, яка ілюструє зниження росту позитивних по CD40 злоякісних пухлин Daudi у SCID-beige мишей, оброблених антитілом до CD40 (21.4.1) згідно з винаходом. На Фіг.7 представлена крива інгібування росту злоякісної пухлини, яка ілюструє зниження росту негативних по CD40 злоякісних пухлин К562 у мишей SCID-beige, оброблених антитілом до CD40 (21.4.1) згідно з винаходом і дендритними клітинами людини, а також Т-клітинами. На Фіг.8 показане інгібування росту негативни х по CD40 злоякісних пухлин К562 у SCID-мишей різними концентраціями агоністу монАТ 23.29.1 до CD40. На Фіг.9 показане інгібування росту негативни х по CD40 злоякісних пухлин К562 різними концентраціями агоністу монАТ 3.1.1 до CD40. На Фіг.10 показане інгібування росту позитивних по CD40 злоякісних пухлин Raj і в присутності або відсутність Т-клітин і дендритних клітин у SCID-мишей з допомогою агониста монАТ до CD40. На Фіг.11 показане інгібування росту позитивних по CD40 злоякісних пухлин Raji у SCID-мишей за допомогою агоністу антитіл до CD40. На Фіг.12 показане інгібування росту клітин BT 474 злоякісної пухлини молочної залози у мишей SCID-beige за допомогою агоністу антитіл до CD40. На Фіг.13 показане інгібування росту злоякісних пухлин РС-3 передміхурової залози у мишей SCID-beige за допомогою агоністу антитіл до CD40. На Фіг.14 представлена крива виживаності для мишей SCID-beige, ін'єктованих (iv) злоякісними клітинами Daudi і оброблених агоністом антитіл до CD40. На Фіг.15 представлений Вестерн-блот-аналіз до CD40-агоністу антитіл для редукованого (R) і нередукованого (NR) CD40 людини. На Фіг.16 представлені результати вирівнювання D1-D4-доменів CD40 миші і людини. На Фіг.17 представлені результати вирівнювання амінокислотних послідовностей CD40 миші і людини, що демонструють положення сайтів злиття в даних химерах. На Фіг.18 схематично представлена група діаграм для химерних CD40-конструкцій. У даному винаході представлено виділене антитіло, або його антигензв'язувальна частина, які зв'язують CD40 і діють як СD40-агоністи. У даному винаході представлена композиція, що містить антитіло до CD40 або його антигензв'язувальну частину, і фармацевтично прийнятний носій. Крім того, створена композиція може включати в себе другий компонент, такий як протипухлинний агент або візуалізуючий агент. У даному винаході розроблені також діагностичні і терапевтичні способи. У даному винаході представлена виділена клітинна лінія, така як гібридома, яка виробляє анти 17 84539 тіло до CD40 або його антигензв'язувальна частина. У даному винаході представлені також молекули нуклеїнових кислот, кодуючий важкий і/або легкий ланцюг антитіла до CD40 або його антигензв'язувальна частина. У даному винаході представлені вектори і хазяйські клітини, що містять молекули нуклеїнових кислот, а також способи рекомбінантного отримання поліпептидів, що кодуються молекулами нуклеїнових кислот. Передбачені також ті, що не належать людському роду трансгенні тварини, які експресують важкий і/або легкий ланцюг антитіла до CD40 або його антигензв'язувальну частину. У даному винаході розроблений також спосіб лікування пацієнта, потребуючого цього, ефективною кількістю молекул нуклеїнової кислоти, що кодує важкий і/або легкий ланцюг антитіла до CD40 або його антигензв'язувальну частину. Визначення і загальні методики За винятком особливо обумовлених випадків, наукові і технічні терміни, що використовуються в зв'язку з даним винаходом, мають на увазі їх звичайне розуміння рядовими фахівцями в даній галузі. Крім того, якщо не обумовлено в контексті, вживання термінів в однині має на увазі також і множинне тлумачення, і навпаки. Взагалі термінологія і методи, що використовується застосовно до культури клітин і культури тканин, до молекулярної біології, імунології, мікробіології, генетики, а також до білкової хімії і хімії нуклеїнових кислот і описаної тут гібридизації, являють собою добре відому термінологію і методи, що звичайно використовуються в даній галузі. Способи і методи даного винаходу, як правило, здійснюють відповідно до традиційних способів, добре відомих в даній галузі, а також описаних в різних загальних і більш конкретних посиланнях, які цитуються і обговорюються в даному описі, якщо не вказано інакше. [Див., наприклад, Sarabrook et al. Molecular Cloning: A Laboratory Manual, 2d ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N. Y. (1989) і Ausubel et al., Current Protocols in Molecular Biology, Greene Publishing Associates (1992), а також Harlow and Lane Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (1990)], які включені тут шля хом посилання. Ферментативні реакції і методи виділення очищенням здійснюють відповідно до інструкцій виробників, як звичайно прийнято в даній галузі або як описано тут. Термінологія, що використовується в зв'язку з цим, а також лабораторні операції і методи аналітичної хімії, синтетичної органічної хімії, а також медичної і фармацевтичної хімії, що описуються тут, відносяться до лабораторних операцій і методів, добре відомих і звичайно що використовується в даній галузі. Стандартні методи використовують для хімічного синтезу, хімічного аналізу, для отримання фармацевтичного препарату, в те хнології приготування лікарського засобу, а також для доставки і лікування пацієнтів. Якщо не вказано інакше, нижченаведені терміни мають наступні значення: 18 Термін "поліпептид" має на увазі природні або синтетичні білки, білкові фрагменти і поліпептидні аналоги білкової послідовності. Поліпептид може бути мономерним або полімерним. Термін "виділений білок", "виділений поліпептид" або "виділене антитіло" являє собою білок, поліпептид або антитіло, яке внаслідок свого походження або джерела отримання (1) не асоціюється з природно пов'язаними компонентами, які супроводжують його в своєму нативному стані, (2) вільне від інших білків з одних і тих же видів, (3) експресується клітинами різних видів або (4) не зустрічається в природі. Таким чином, поліпептид, який хімічно синтезований або синтезований в клітинній системі, відмінній від клітини, з якої він природним чином виник, повинен бути "виділеним" з своїх природно пов'язаних компонентів. Будьякий білок можна також практично звільнити від природно пов'язаних компонентів шляхом виділення, застосовуючи методи виділення очищення білка, добре відомі в даній галузі. Приклади виділених антитіл включають в себе антитіло до CD40, яке виділяють шляхом очищення по спорідненості з використанням CD40, антитіло до CD40, яке синтезують за допомогою гібридомної або іншої лінії клітин in vitro, і антитіло людини до CD40, що отримується з трансгенної миші. Білок або поліпептид є "практично чистим", "практично гомогенним", або "практично очищеним", якщо щонайменше близько 60-75% зразка представлено одним видом поліпептиду. Даний білок або поліпептид може бути мономерним або мультимерним. Практично чистий поліпептид або білок звичайно містить близько 50%, 60%, 70%, 80% або 90% мас/мас, білкового зразка, частіше близько 95%, і переважно понад 99% чистоти. Міру очи щення білка або міру гомогенності можна показати декількома способами, добре відомими в даній галузі, такими як електрофорез білкового зразка в поліакриламідном гелі з подальшою візуалізацією одиночної поліпептидної смуги після забарвлення гелю барвником, добре відомим в даній галузі. Для деяких цілей, що стосується виділення очищенням, високе розрізнення можна отримати шляхом використання ВЕРХ або іншими способами, добре відомими в даній галузі. Термін "поліпептидний фрагмент", що використовується тут, відноситься до поліпептиду, який має амінокінцеву і/або карбоксикінцеву делецію, а інша амінокислотна послідовність ідентична по відповідних положеннях послідовності, що зустрічається в природі. У деяких варіантах здійснення даного винаходу довжина фрагментів складає щонайменше 5, 6, 8 або 10 амінокислот. В інших варіантах здійснення даного винаходу довжина фрагментів складає щонайменше 14, щонайменше 20, щонайменше 50, або щонайменше 70, 80, 90, 100, 150 або 200 амінокислот. Термін "поліпептидний аналог", що використовується тут, відноситься до поліпептиду, який включає в себе сегмент, практично ідентичний частині амінокислотної послідовності і який володіє щонайменше наступними характеристиками: (1) специфічно зв'язується з CD40 у відповід 19 84539 них умовах зв'язування, (2) здатний активува ти CD40, (3) здатний добре регулювати експресію молекул на поверхні клітини, таких як ICAM, MHCII, В7-1, В7-2, CD71, CD23 і CD83, або (4) здатний підвищувати секрецію цитокінів, таких як IFN-β1, IL-2, IL-8, IL-12, IL-15, IL-18 і IL-23. Як правило, поліпептидні аналоги включають в себе консервативну амінокислотну заміну (або вставку або делецію) у послідовності, що з устрічається в природі. Як правило, аналоги містять в довжину щонайменше 20 або 25 амінокислот, переважно щонайменше 50, 60, 70, 80, 90, 100, 150 або 200 амінокислот або більше, і часто можуть володіти такою ж довжиною, як і повнорозмірний поліпептид, що зустрічається в природі. Переважними амінокислотними замінами є ті, які (1) зменшують чутливість до протеолізу, (2) зменшують чутливість до окислення, (3) змінюють спорідненість до зв'язування при утворенні білкових комплексів і (4) додають або модифікують інші фізико-хімічні або функціональні характеристики таких аналогів. Аналоги можуть містити різні зміни послідовності, відмінні від змін в пептидній послідовності, що з устрічається в природі. Наприклад, одиночну або множинні амінокислотні заміни (переважно консервативні амінокислотні заміни) можна створити в послідовності, що зустрічається в природі (переважно на ділянці поліпептиду, що знаходиться поза доменом(ами), що утворює міжмолекулярні контакти). Консервативна амінокислотна заміна не повинна істотно змінювати структурні характеристики батьківської послідовності (наприклад, заміна амінокислоти не повинна приводити до руйнування спіралі, яка існує в даній батьківській послідовності, або руйнувати інші види вторинної структури, яка характеризує дану батьківську послідовність). Приклади загальновідомих вторинних і третинних поліпептидних структур описані в [Proteins, Structures and Molecular Principles (Creighton, Ed., W.H.Freeman and Company, New York (1984)); Introduction to Protein Structure (C. Branden and J. Tooze, eds., Garland Publishing, New York, and Thornton et al., Nature 354: 105 (1991)], кожна з яких включена в даний опис шляхом посилання. Непептидні аналоги звичайно використовують в фармацевтичній промисловості у вигляді лікарських засобів з характеристиками, аналогічними характеристикам даного матриксного пептиду. Дані види непептидної фармацевтичної сполуки називають "пептидними міметиками" або "пептидоміметиками", [Fauchere, J. Adv. Drug Res. 15: 29 (1986); Veber and Freidinger, TINS p.392 (1985); і Evans et al., J. Med. Chem. 30: 1229 (1987)], включені тут шляхом посилання. Такі сполуки часто створюють за допомогою комп'ютерного молекулярного моделювання. Пептидні міметики, які структурно схожі з терапевтично придатними пептидами, можна використати для отримання еквівалентного терапевтичного або профілактичного ефекту. Взагалі пептидоміметики структурно схожі із зразковим поліпептидом (тобто поліпептидом, який володіє необхідною біохімічною властивістю або фармакологічною активністю), таким як антитіло людини, але володіє одним або декількома 20 пептидними зв'язками, необов'язково заміщеними зв'язком, вибраним з групи, що складається з CH2NH-, -CH2S-, CH2-CH2-, -CH=CH- (цис і транс), COCH2-, -CH(OH)CH2- і -CH2SO-, способами, добре відомими в даній галузі. Для отримання більш стабільних пептидів можна також використати системну заміну однієї або декількох амінокислот консенсусної послідовності D-амінокислотою такого ж типу (наприклад, D-лізин замість L-лізину). Крім того, пов'язані пептиди, що містять консенсусну послідовність або практично ідентичну варіацію консенсусної послідовності, можна отримати способами, добре відомими в даній галузі [Rizo and Gierasch, Ann. Rev. Biochem. 61: 387 (1992)], включені сюди у вигляді посилання); наприклад, шляхом додання внутрішніх цистеїнових залишків, здатних утворювати міжмолекулярні дисульфідні містки, які циклізують даний пептид. "Анти тіло" відноситься до повного антитіла або до його антигензв'язувальної ділянки, які конкурують з інтактним антитілом за специфічне зв'язування. Дивіться, головним чином, Fundamental Immunology, Ch. 7 [Paul, W., ed., 2n ed. Raven Press], (включену у всій повноті для всі х цілей). Антигензв'язувальні ділянки можна отримати за допомогою методів рекомбінантної ДНК або шляхом ферментативного або хімічного розщеплення інтактних антитіл. Антигензв'язувальні ділянки включають в себе, зокрема, Fab, Fab1, F(ab')2, Fd, Fv, dAb і фрагменти, що визначають ділянку комплементарності (CDR), одноланцюгові антитіла (scFv), химерні антитіла, діатільця і поліпептиди, які містять щонайменше ділянку антитіла, яка достатня для придання специфічності зв'язування антигену з даним поліпептидом. Від N-кінця до С-кінця варіабельні домени важкого і легкого ланцюга включають в себе ділянки FR1, CDR1, FR2, CDR2, FR3, CDR3 і FR4. Віднесення амінокислот до кожного з доменів здійснюють відповідно до визначень Kabat, Sequences of Proteins of Immunological Interest [National Institutes of Health, Bethesda, Md. (1987 and 1991)), або Chothia & Lesk, J. Моl. Biol. 196: 901-917 (1987); Chothia et al., Nature 342: 878-883 (1989)]. Тут антитіло, яке позначається числом, являє собою моноклональне антитіло, яке отримане з гібридоми з тим же числом. Наприклад, моноклональне антитіло 3.1.1 отримують з гібридоми 3.1.1. Тут Fd-фрагмент означає фрагмент антитіла, який складається з доменів VH і CH 1; Fv-фрагмент складається з доменів VL і VH одноплечевого антитіла; і dAb-фрагмент [Ward et al., Nature 341: 544546 (1989)], який складається з VH-домену. У деяких варіантах здійснення даного винаходу дане антитіло являє собою одноланцюгове антитіло (scFv), в якому домени VL і VH спарені за допомогою синтетичного лінкера з утворенням моновалентних молекул, що дозволяє їм утворювати одноланцюговий білок. [Bird et al., Science 242: 423-426 (1988) і Huston et al., Proc. Natl. Acad. Sci. USA 85: 5879-5883 (1988)]. В деяких варіантах здійснення даного винаходу дані антитіла являють собою діатільця, тобто являють собою бівалентні антитіла, в яких домени VH і VL експресуються в одному поліпептидному ланцюгу, але що викорис 21 84539 товують лінкер, який дуже короткий, щоб дозволити утворити пару між цими двома доменами в цьому ж ланцюгу, тим самим змушуючи ці домени утворювати пару з комплементарними доменами іншого ланцюга і створюючи два антигензв'язувальних сайти [див., наприклад, Holliger P. et аl., Рrос. Natl. Acad. Sd. USA 90: 6444-6448 (1993) і Poljak R.J. et al., Structure 2: 1121-1123 (1994)]. В деяких варіантах здійснення даного винаходу одне або декілька CDR антитіла згідно з винаходом можуть бути ковалентно або нековалентно включені в молекулу з перетворенням її в імуноадгезин, який специфічно зв'язується з CD40. У таких варіантах здійснення даного винаходу CDR може вбудовува тися як ділянка більшого поліпептидного ланцюга, може ковалентно приєднуватися до іншого поліпептидного ланцюга або може вбудовуватися нековалентно. У варіантах здійснення даного винаходу з одним або декількома зв'язуючими сайтами ці зв'язуючі сайти можуть бути ідентичні один одному, а можуть бути і різними. Як такий, що використовується тут, термін "антитіло людини" має на увазі будь-яке антитіло, в якому всі варіабельні і константні доменні послідовності являють собою послідовності людини. Дані антитіла можна отримати різноманітними способами, як описано нижче. Термін "химерне антитіло", що використовується тут, має на увазі антитіло, яке містить ділянки з двох або декількох різних антитіл. В одному з варіантів здійснення даного винаходу один або декілька CDR отримують з антитіла людини до CD40. В іншому варіанті здійснення даного винаходу всі вказані CDR отримують з антитіла людини до CD40. В іншому варіанті здійснення даного винаходу вказані CDR з більш ніж одного антитіла людини до CD40 об'єднують в химерне антитіло. Наприклад, химерне антитіло може включати в себе CDR1 легкого ланцюга першого антитіла людини до CD40, CDR2 легкого ланцюга другого антитіла людини до CD40, а також CDR3 і CDR3 легкого ланцюга третього антитіла людини до CD40, a CDR з важкого ланцюга можна отримати з одного або декількох інших антитіл до CD40. Крім того, каркасні ділянки можна отримати з одних і тих же антитіл до CD40 або з одного або декількох різних антитіл людини. "Активуюче антитіло" (що також тут іменується як "агоніст антитіла"), використання якого має на увазі антитіло, яке при доданні до клітини, тканини або організму, що експресують CD40, підвищує одну або декілька активностей CD40 щонайменше приблизно на 20%. У деяких варіантах здійснення даного винаходу дане антитіло активує СD40активність щонайменше на 40%, 50%, 60%, 70%, 80%, 85%. У деяких варіантах здійснення даного винаходу активуюче антитіло додають в присутності CD40L. У деяких варіантах здійснення даного винаходу активність активуючого антитіла вимірюють з використанням аналізу підвищуючої регуляції молекулярної поверхні клітин цільної крові. Див. Приклад VII. В іншому варіанті здійснення даного винаходу активність активуючого антитіла вимірюють з використанням аналізу дендритних 22 клітин для вимірювання вивільнення IL-12. Див. Приклад VIII. В іншому варіанті здійснення даного винаходу активність активуючого антитіла вимірюють з використанням in vivo-моделі злоякісної пухлини. Див. Приклад X. Фрагменти або аналоги антитіл або імуноглобулінових молекул можуть легко отримати рядові фа хівці в даній галузі, відповідно до вказівок даного опису. Переважні аміно- і карбоксикінцеві фрагменти або аналоги, що зустрічаються поблизу кордонів функціональних доменів. Структурні і функціональні домени можна ідентифікувати шляхом порівняння нуклеотидної і/або амінокислотної послідовності з послідовністю, опублікованою або зареєстрованою в базах даних. Для ідентифікації мотивів послідовності або передбаченої білкової конформації доменів, які зустрічаються в білках відомої структури і/або функції, переважно використовують методи комп'ютерного порівняння. Способи ідентифікації білкових послідовностей, які упаковані у відому трьохмірну структур у, відомі. [Див. Bowie et al., Science 253: 164 (1991)]. Термін "поверхневий плазмений резонанс", що використовується тут, відноситься до оптичного феномена, який дозволяє аналізувати в реальному часі біоспецифічні взаємодії шляхом детектування змін концентрації білка в біосенсорній матриці, наприклад, з використанням системи BIAcore (Pharmacia Biosensor AB, Uppsala, Sweden and Piscataway, N.J.). Подальший опис [див. Jonsson U. et al., Ann. Biol. Clin. 51: 19-26 (1993); Jonsson U. et al., Biotechniques 11: 620-627 (1991); Jonsson B. et al., J. MoI. Recognit. 8: 125-131 (1995); і Johnsson B. et al., Anal. Biochem. 198: 268-277 (1991)]. Термін "KD" відноситься до константи дисоціації конкретної взаємодії антиген-антитіло. Термін "епітоп" включає в себе будь-яку білкову детермінанту, здатну специфічно зв'язуватися з імуноглобуліном або Т-клітинним рецептором. Епітопні детермінанти звичайно складаються з хімічно активних згрупованих на поверхні молекул, таких як амінокислоти або цукрові бічні ланцюжки, і звичайно володіють специфічними тривимірними структурними характеристиками, а також певними значеннями заряду. Вважається, що антитіло специфічно зв'язує антиген при константі дисоціації
ДивитисяДодаткова інформація
Назва патенту англійськоюHuman monoclonal antibody that specifically binds to cd40, pharmaceutical composition containing thereof and use of antibody for production of medicinal agent for treatment of cd40- negative human tumor
Автори англійськоюBedian Vahe, Gladue Ronald P., Corvalan Jose, Jia Xiao-Chi, Feng Xiao
Назва патенту російськоюЧеловеческое моноклональное антитело, которое специфически связывается с cd40, фармацевтическая композиция, которая его содержит, и применение антитела для производства лекарственного средства для лечения cd 40-отрицательной опухоли у человека
Автори російськоюБедиан Вахе, Глейдью Роналд П., Корвалан Хосе, Джиа Ксиао-Чи, Фенг Ксиао
МПК / Мітки
МПК: C07K 16/28, C12N 15/63, C12N 15/13, A61K 39/395, C12N 5/20, A61P 35/00, A61P 37/00
Мітки: cd40-негативної, лікування, моноклональне, виробництва, лікарського, антитіла, засобу, антитіло, фармацевтична, застосування, містить, зв'язується, композиція, людини, cd40, людське, специфічно, пухлини
Код посилання
<a href="https://ua.patents.su/158-84539-lyudske-monoklonalne-antitilo-shho-specifichno-zvyazuehtsya-z-cd40-farmacevtichna-kompoziciya-shho-jjogo-mistit-ta-zastosuvannya-antitila-dlya-virobnictva-likarskogo-zasobu-dlya-li.html" target="_blank" rel="follow" title="База патентів України">Людське моноклональне антитіло, що специфічно зв’язується з cd40, фармацевтична композиція, що його містить, та застосування антитіла для виробництва лікарського засобу для лікування cd40-негативної пухлини у людини</a>
Попередній патент: Навігаційна система системи координат сухопутного транспортного засобу (варіанти)
Наступний патент: Новий цитокін zcytor17 ліганд
Випадковий патент: Спосіб одержання імпульсів струму пучка електронів пікосекундної тривалості