Синтез стирилпіридину, міченого радіоізотопом 18f, з тозилатного прекурсора та стабільна фармацевтична композиція на його основі
Номер патенту: 105914
Опубліковано: 10.07.2014
Автори: Чжан Вей, Гоулдінг Джефф, Лім Натаніель, Бенідем Тайлер
Формула / Реферат
1. Радіофармацевтична композиція для візуалізації нейродегенеративних захворювань мозку шляхом позитронно-емісійної томографії (ПЕТ), що включає:
ефективну кількість ((E)-4-(2-(6-(2-(2-(2-[18F]фтороетоксі)етоксі)етокси)піридин-3-іл)вініл)-N-метилбензенаміну);
10 % (за об'ємом) етилового спирту; та
0,5 % (маса/об'єм) аскорбату натрію
у 0,9 % (маса/об'єм) водному розчині хлориду натрію.
2. Радіофармацевтична композиція за п. 1, яка відрізняється тим, що нейродегенеративне захворювання включає ненормальну концентрацію нативного або патологічно зміненого білка, пептиду або олігонуклеотиду.
3. Радіофармацевтична композиція за п. 1 або 2, яка відрізняється тим, що нейродегенеративне захворювання включає β-амілоїд, α-синуклеїн, везикулярний транспортер моноамінів 2 (VMAT2) або їхні комбінації.
4. Радіофармацевтична композиція за будь-яким з пп. 1-3, яка відрізняється тим, що ((E)-4-(2-(6-(2-(2-(2-[18F]фтороетоксі)етоксі)етокси)піридин-3-іл)вініл)-N-метилбензенамін) виготовляється з тозилатного прекурсора.
5. Радіофармацевтична композиція за будь-яким з пп. 1-4, яка відрізняється тим, що має рН приблизно від 4,5 до 8,0.
6. Радіофармацевтична композиція за будь-яким з пп. 1-5, яка відрізняється тим, що включає приблизно 90 % або більше міченої радіоізотопом 18F сполуки при вимірюванні через щонайменше приблизно 4 години після кінця синтезу.
7. Радіофармацевтична композиція за п. 1 для використання у діагностиці нейродегенеративних захворювань, переважно таких як деменція, когнітивне порушення, хвороба Альцгеймера, хвороба Паркінсона, деменція з тільцями Леві та судинна деменція.
8. Радіофармацевтична композиція за будь-яким з пп. 1-7 для використання у методі діагностики нейродегенеративного захворювання пацієнта, що включає етапи: застосування радіофармацевтичної композиції; візуалізації принаймні частини мозку пацієнта та визначення патологічної мішені.
9. Радіофармацевтична композиція за будь-яким з пп. 1-7 для використання за п. 8, яка відрізняється тим, що етап візуалізації включає позитронно-емісійну томографію (ПЕТ), ПЕТ з одночасною комп'ютерною томографією (ПЕТ/КТ), ПЕТ з одночасною магнітно-резонансною томографією (ПЕТ/MPT) або їхніх комбінації.
10. Спосіб виготовлення радіофармацевтичної композиції за п. 1, який включає етапи:
підготовки сполуки вініланіліну з моно-Вос-захистом;
перетворення сполуки вініланіліну на похідне метил, t-бутилкарбамату;
проведення реакції 2-гало 5-йодопіридину з триетиленгліколем;
проведення реакції похідного метил, t-бутилкарбамату з продуктом реакції 2-гало 5-йодопіридину з триетиленгліколем для отримання (Е)-трет-бутилу 4-(2-(6-(2-(2-(2-гідроксіетоксі)етоксі)етокси)піридин-3-іл)вініл)феніл(метил)карбамату; та
проведення реакції (Е)-трет-бутилу 4-(2-(6-(2-(2-(2-гідроксіетоксі)етоксі)етокси)піридин-3-іл)вініл)феніл(метил)карбамату і тозилхлориду для утворення (E)-2-(2-(2-(5-(4-(трет-бутоксикарбоніл(метил)аміно)стирил)піридин-2-ілоксі)етоксі)етоксі)етилу 4-метилбензенсульфонату;
проведення реакції (Е)-2-(2-(2-(5-(4-(трет-бутоксикарбоніл(метил)аміно)стирил)піридин-2-ілоксі)етоксі)етоксі)етилу 4-метилбензенсульфонату з 18F-фторид-іоном у розчині диметилсульфоксиду (ДМСО) або апротонного розчинника з високою точкою кипіння для отримання ((E)-4-(2-(6-(2-(2-(2-[18F]фтороетоксі)етоксі)етоксі)піридин-3-іл)вініл)-N-метилбензенаміну);
виділення ((E)-4-(2-(6-(2-(2-(2-[18F]фтороетоксі)етоксі)етокси)піридин-3-іл)вініл)-N-метилбензенаміну);
очищення ((E)-4-(2-(6-(2-(2-(2-[18F]фтороетоксі)етоксі)етокси)піридин-3-іл)вініл)-N-метилбензенаміну);та
приготування ((E)-4-(2-(6-(2-(2-(2-[18F]фтороетоксі)етоксі)етокси)піридин-3-іл)вініл)-N-метилбензенаміну) у 0,9 % (маса/об'єм) водному розчині хлориду натрію та етилового спирту, що містить 10 % (за об'ємом) етилового спирту від загальної кількості композиції та
0,5 % (маса/об'єм) аскорбату натрію від загальної кількості композиції.
11. Сполука формули
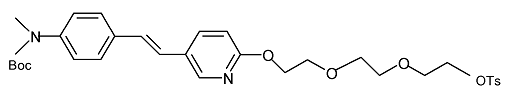 .
.
Текст
Реферат: 18 Цей винахід належить до методів синтезу міченого радіоізотопом F стирилпіридину та його 18 тозилатного прекурсора, зокрема ((E)-4-(2-(6-(2-(2-(2-[ F]фтороетоксі)етоксі)етокси)піридин-3іл)вініл)-N-метилбензенаміну). Цей винахід також належить до стабільних фармацевтичних 18 композицій, що містять мічений радіоізотопом F стирилпіридин та 10 % (за об'ємом) етилового спирту і 0,5 % (маса/об'єм) аскорбату натрію. UA 105914 C2 (12) UA 105914 C2 UA 105914 C2 5 10 15 20 25 30 35 40 45 50 55 Передумови створення винаходу [0001] Цим заявляється пріоритет згідно з п. 35 § 119(е) Кодексу Законів США стосовно попередньої заявки на патент № 61/141885, поданої 31 грудня 2008 p., текст якого включений в дану заявку в повному обсязі шляхом посилання. 1. Галузь винаходу [0002] Винахід загалом відноситься до методів синтезу препаратів для візуалізації головного 18 мозку, мічених радіоізотопом F, і, більш конкретно, до методів синтезу стирилпіридину, 18 міченого радіоізотопом F, і його тозилатного прекурсору та до стабільних фармацевтичних 18 композицій, що містять препарати для візуалізації головного мозку, мічені радіоізотопом F. 2. Опис відомого рівня техніки [0003] Хвороба Альцгеймера (XA) є прогресивним нейродегенеративним розладом, який характеризуються зниженням когнітивних здібностей, незворотною втратою пам'яті, дезорієнтацією і мовними порушеннями. XA уражає 10 % населення у віці понад 65 і не менше 50 % населення у віці понад 85 років. Повідомляється про наявність XA у пацієнтів віком 40-50 років, але оскільки наявність хвороби важко виявити без гістопатологічної експертизи мозкової тканини, момент початку хвороби у живих суб'єктів невідомий. [0004] Нині єдиним засобом переконливої діагностики XA є вивчення мозкової тканини, яке зазвичай виконується при посмертному розтині. Під час розтину медичні експерти оглядають мозкові тканини на наявність надлишкових нейритичних бляшок (НБ), що складаються з βамілоїдних пептидних відкладень і нейрофібрилярних клубків (НФК), сформованих з ниток високофосфорильованих тау-білків, оскільки ці особливості відрізняють патогенез XA. Амілоїдні відкладення утворюються шляхом агрегації амілоїдних пептидів з подальшим сполученням з іншими агрегатами та/або амілоїдними пептидами. Фібрилярні агрегати амілоїдних пептидів, Αβ1-40 і Αβ1-42, є основними пептидними метаболітами амілоїдного білка-прекурсору, що знаходяться в НБ та цереброваскулярних амілоїдних відкладеннях у пацієнтів з XA. [0005] Хвороба Паркінсона (ХП) є прогресивним нейродегенеративним захворюванням, яке характеризується треморами спокою, брадикінезією, м'язовою ригідністю і постуральною нестабільністю. ХП зазвичай розвивається після 60 років, хоча 15 % діагностованих пацієнтів мають вік до 50 років. Сімейний анамнез ХП є етіологічним чинником для 5-10 % пацієнтів, яким діагностовано цю хворобу, однак лише у 1 % випадків було підтверджено, що хвороба сімейно успадкована. За оцінкою, 1,5 мільйона американців в даний час живуть з ХП. [0006] Деменція з тільцями Леві (ДТЛ) є прогресуючим захворюванням мозку, яке має симптоми різного ступеня вираження. Ці симптоми включають в себе прогресивну деменцію, труднощі руху, характерні для ХП, галюцинації і підвищену чутливість до нейролептиків. Як і при XA, літній вік вважається найбільшим фактором ризику ДТЛ, причому зазвичай хвороба починається в середньому у віці 50-85 років. Крім того, 20 % всіх випадків деменції викликані ДТЛ, і у більше 50 % пацієнтів з ХП розвивається "деменція при хворобі Паркінсона" (ДХП), різновид ДТЛ. ДТЛ може розвиватися самостійно або в поєднанні з іншими аномаліями головного мозку, у тому числі тими, що характерні для XA і ХП, як згадувалося вище. В даний час остаточний діагноз ДТЛ можливий тільки після посмертного розтину. [0007] У ХП і ДТЛ спільна етіологія дефіциту допаміну, що корелює із загибеллю допамінергічних нейронів чорної субстанції. Причину загибелі допамінергічних нейронів при ХП не визначено, хоча є підстави вважати, що агрегати α-синуклеїну в мозку можуть бути пов'язані з втратою допамінергічних нейронів в смугастому тілі. Також визнається, що при ДТЛ ненормальні білкові відкладення, що містять а-синуклеїн та іменуються "тільцями Леві", є причиною загибелі допамінергічних нейронів. Тільця Леві трапляються переважно у чорній субстанції мозку і тих відділах стовбура мозку, які мають назву "блакитна пляма", а також у підкоркових і коркових відділах мозку. Через цю особливість локалізації в головному мозку, тільця Леві можуть втручатися у виробництво ацетилхоліну, спричиняючи порушення сприйняття та розумового процесу і впливаючи на поведінку. Тільця Леві вважаються типом нейритичних бляшок (НБ), оскільки вони складаються з агрегатів відкладень білка α-синуклеїну. [0008] Етіологія нейродегенерації може також включати суміш патологій, й зокрема компоненти мікросудинних, або перфузійних, дефіцитів у мозку. Наприклад, розлад, який зазвичай називають "змішаною деменцією", часто включає в себе як перфузійні дефіцити, так і патології амілоїдних бляшок. Термін "змішана деменція" має різні значення, але звичайно використовується для позначення співіснування XA і судинної деменції (СД), зокрема тоді, коли СД спричинена численними мікротромбами в судинній системі мозку. Хоча на даний момент мало відомо про справжню поширеність змішаної деменції, ця форма нейродегенерації клінічно важлива, тому що поєднання XA і СД може мати більший вплив на мозок, ніж будь-який стан 1 UA 105914 C2 5 10 15 20 25 30 35 40 45 50 55 60 окремо. Змішану деменцію звичайно дуже важко діагностувати. Симптоми схожі на АД або СД, або поєднання обох. [0009] Виникнення відкладень амілоїду в головному мозку може бути характерним для багатьох інших станів, включаючи, серед іншого, середземноморську лихоманку, синдром Макла - Уеллса, ідіопатичну мієлому, амілоїдну полінейропатію, амілоїдну кардіоміопатію, системний нейритичний амілоїдоз, спадковий крововилив у мозок з амілоїдозом, синдром Дауна, скрепі, хворобу Крейтцфельдта - Якоба, куру, синдром Герстмана - Штраусслера Шейнкера, медулярний рак щитовидної залози, ізольований амілоїдоз передсердя, амілоїд з 2мікроглобуліном у хворих, які знаходяться на діалізі, міозит з включеними тільцями, відкладення 2-амілоїду при м'язовій атрофії і інсуліному острівців Лангерганса при діабеті II типу. [0010] Через ту роль, яку відіграє наявність нейритичних бляшок (НБ) у діагностиці нейродегенеративних захворювань, спостерігається зацікавленість у розробці мічених лігандів, які зв'язуються з такими аномаліями і дозволяють робити їхню візуалізацію з використанням 11 11 існуючих методологій. Деякі звичайні радіопрепарати для візуалізації включають [ C]PIB, [ C] 18 123 4-N-метиламіно-4'-гідрокси-стильбен (SB-13), [ F]FDDNP та [ I]IMPY. 18 18 18 [0011] [ F]AV-45 (" F-AV-45"), ((E)-4-(2-(6-(2-(2-(2-[ F]фтороетокси)етокси)етокси) піридин-3іл)вініл)-N-метилбензенамін, є радіофармпрепаратом для позитронно-емісійної томографії (ПЕТ) амілоїдних агрегатів у мозку (див., наприклад, Choi, SR, et al., J Nucl Med, 50(11), 188718 1894, 2009). F-AV-45 містить радіоізотоп F-18, який, завдяки періоду напіврозпаду 110 хвилин, може бути виготовлений у централізованому місці і відправлений у межах тривалості доставки від 4 до 8 год. до діагностичних центрів, які виконують ПЕТ головного мозку. Така схема 18 виробництва і розподілу F-AV-45 та інших сполук для візуалізації амілоїду, мічених радіоізотопом F-18, вимагає, щоб радіофармпрепарат був зроблений у той же день, коли здійснюється ПЕТ, через радіоактивний розпад ізотопу F-18. Таким чином, виникає кілька вимог. 18 По-перше, радіоактивний препарат F-AV-45 повинен бути виготовлений протягом короткого періоду часу зі стабільної проміжної сполуки (іменованої "прекурсором"). По-друге, 18 радіофармпрепарат F-AV-45 повинен бути зроблений з розумною (наприклад, >10 %) часткою 18 радіохімічного виходу, починаючи з реакції прекурсору з фторид-іоном F-18. По-третє, F -AV45 має бути у розчинному середовищі, яке забезпечує адекватну розчинність як 19 радіофармпрепарату, так і його нерадіоактивної частини ( F-AV-45, який завжди присутній в дещо нижчій концентрації у виробничому середовищі за рахунок стабільного F-19), а також стабілізаційні властивості, щоб інгібувати радіолітичний розпад сполуки. [0012] Етанол, як правило, визнається як підходящий допоміжний засіб для солюбілізаціі ліпофільних препаратів, в тому числі радіофармацевтичних (див., наприклад, Lemaire C, et al., J Label Compd and Radiopharm, 42, 63-75, 1999). Аскорбінова кислота або солі-аскорбати були використані раніше як допоміжні засоби для інгібування радіолізу радіофармпрепаратів (див., наприклад, Tofe AJ, et al., J. Nucl Med, 17, 820-825, 1976; Knapp FF, et al., Anticancer Res 17, 1783-1795, 1997; Liu S, et al., Bioconj Chem, 14, 1052-1056, 2003), у тому числі радіо фармпрепаратів з F-18 (див., наприклад, Firnau G, et al., J Nucl Med, 25, 1228-1233, 1984). Однак використання солей-аскорбатів у водно-етанольному розчині в якості кращого середовища для 18 солюбілізаціі і стабілізації радіофармпрепаратів з F-18 для візуалізації мозку, таких як F-AV-45, є новітнім. [0013] Використання прекурсорів із вмістом тозилатної групи для реакції з фторидом F-18 у виробництві радіофармпрепаратів, що містять F-18, було описано раніше (див., наприклад, Zhang W, et al., Nucl Med Biol 34, 89-97, 2007). Проте ефективний процес синтезу для отримання більших (тобто, >10 г) кількостей тозилатного прекурсору (в цьому документі називається "AV105") не був описаний раніше. Кожна із згаданих тут публікацій наводиться як посилання в повному обсязі в тій мірі, в якій такі посилання не є несумісними з явними ідеями даної специфікації. Реферат винаходу [0014] Варіанти здійснення винаходу спрямовані на отримання радіофармацевтичної композиції для позитронно-емісійної томографії (ПЕТ) нейродегенеративних захворювань 18 мозку, яка включає ефективну кількість сполуки, міченої радіоізотопом F, від 1,0 % до 20 % (за об'ємом) етилового спирту, і принаймні близько 0,1 % (маса/об'єм) аскорбінової кислоти або її 18 солі. У різних варіантах сполука, мічена радіоізотопом F, здатна зв'язуватися з патологічною мішенню в мозку пацієнта. Патологічна мішень може містити ненормальну концентрацію нативного чи патологічно зміненого білка, пептиду чи олігонуклеотиду, β-амілоїд, α-синуклеїн або везикулярний моноаміновий транспортер 2 (VMAT2). 18 [0015] За деякими аспектами винаходу сполука, мічена радіоізотопом F, є похідним 18 стирилпіридину. У різних аспектах сполукою, міченою радіоізотопом F, є ((E)-4-(2-(6-(2-(2-(2 2 UA 105914 C2 18 5 10 15 20 25 30 35 40 45 50 55 60 18 [ F]фтороетокси)етокси)етокси) піридин-3-іл)вініл)-N-метилбензенамін ( F -AV-45). У деяких 18 варіантах F -AV-45 виробляється з тозилатного прекурсору. В інших аспектах сполукою, 18 міченою радіоізотопом F, в радіофармацевтичній композиції є (2R,3R,11bR)-9-(318 [ F]фторопропокси)-3-ізопропіл-10-метокси-11b-метил-2,3,4,6,7,11b-гексагідро-1Н-піридо[2,118 18 а]ізохінолін-2-ол (" F-AV-133"). А ще в деяких аспектах сполука, мічена радіоізотопом F, є похідним від дигідротетрабеназину (DTBZ). [0016] Радіофармацевтична композиція деяких варіантів здійснення винаходу включає в себе етиловий спирт у діапазоні концентрацій приблизно від 1,0 % до 15,0 % (за об'ємом). Інші варіанти включають в себе аскорбінову кислоту або її сіль в діапазоні концентрацій приблизно від 0,1 % до 1,0 % (маса/об'єм). рН радіофармацевтичної композиції може коливатися приблизно від 4,5 до 8,0. Перевага надається тим варіантам здійснення винаходу, в яких чистота радіофармацевтичної композиції більша або дорівнює близько 90 % при вимірюванні принаймні приблизно через 4 години після кінця синтезу (ПКС). [0017] Радіофармацевтична композиція може бути використана у діагностиці нейродегенеративних захворювань, таких як деменція, когнітивні порушення, хвороба Альцгеймера (XA), хвороба Паркінсона (ХП), деменція з тільцями Леві (ДТЛ), судинна деменція (CД) та їхні комбінації. [0018] Інші варіанти винаходу спрямовані на отримання радіофармацевтичної композиції для позигронно-емісійної томографії (ПЕТ) головного мозку, яка включає ефективну кількість 18 сполуки, міченої радіоізотопом F, принаймні близько 1,0 % (за об'ємом) етилового спирту і щонайменше близько 0,1 % (маса/об'єм) солі-аскорбату, причому сполука, мічена радіоізотопом 18 F, розпадається менш ніж приблизно на 10 % через 12 годин після кінця синтезу. [0019] В іншому аспекті винаходу описано метод для діагностики нейродегенеративних захворювань пацієнта, що включає в себе стадії: введення радіофармацевтичної композиції, здатної зв'язуватися з мішенню, пов'язаною з нейродегенеративним захворюванням пацієнта, в якій до складу згаданого радіофармпрепарату входить ефективна кількість сполуки, міченої 18 радіоізотопом F, принаймні близько 1,0 % (за об'ємом) етилового спирту і принаймні близько 0,1 % (маса/об'єм) аскорбату натрію; візуалізації принаймні частини мозку пацієнта, включаючи область, в якій, як очікується, повинна бути розташована мішень; і виявлення мішені. Стадія візуалізації може бути виконана з використанням позитронно-емісійної томографії (ПЕТ), ПЕТ з одночасною комп'ютерною томографією (ПЕТ/КТ), ПЕТ з одночасною магнітно-резонансною томографією (ПЕТ/MPT) або їхніх комбінацій. [0020] У ще одному варіанті винаходу описано метод для виробництва композиції, міченої 18 радіоізотопом F, здатної зв'язуватися з β-амілоїдом, в тому числі стадії: синтезу тозилатного 18 прекурсору; виконання нуклеофільного F-фторування тозилатного прекурсору у розчині 18 диметилсульфоксиду (ДМСО) для отримання F-радіофармпрепарату; а також технології 18 виготовлення F-радіофармпрепарату у розчині води та етилового спирту, що містить аскорбінову кислоту або її сіль, де етиловий спирт присутній у мінімальній концентрації близько 1,0 % (за об'ємом) і мінімальна концентрація аскорбінової кислоти або її солі становить близько 18 0,1 % (маса/об'єм) в кінцевій фармацевтичній композиції, міченій радіоізотопом F. [0021] Для іншого варіанта винаходу описано метод отримання тозилатного прекурсору для 18 F-AV-45, (E)-2-(2-(2-(5-(4-(трет-бутоксикарбоніл(метил)аміно)стирил)піридин-2ілокси)етокси)етокси)етил 4-метилбензенсульфонату ("AV-105"). Цей метод включає в себе стадії: (і) підготовки сполуки вініланіліну з моно-Вос-захистом; (іі) перетворення сполуки вініланіліну на похідне метил, t-бутилкарбамату; (ііі) взаємодії 2-гало 5-йодопіридину з триетиленгліколем; (iv) взаємодії похідного метил, t-бутилкарбамату стадії (іі) зі сполукою, отриманою в результаті стадії (ііі), для виробництва (Е)-трет-бутил 4-(2-(6-(2-(2-(2гідроксиетокси)етокси)етокси)піридин-3-іл)вініл)феніл(метил)карбамату і (ν) взаємодії (Е)-третбутил 4-(2-(6-(2-(2-(2-гідроксиетокси)етокси)етокси)піридин-3-іл)вініл)феніл(метил)карбамату з тозилхлоридом для утворення AV-105. [0022] У ще одному аспекті винаходу описано спосіб отримання радіофармацевтичної 18 композиції, в тому числі: взаємодію тозилатного прекурсору AV-105 з F-фторид-іоном в розчині диметилсульфоксиду (ДМСО) або іншому апротонному розчиннику з високою 18 температурою кипіння для виробництва ((E)-4-(2-(6-(2-(2-(2-[ F]фтороетокси)етокси)етокси) 18 18 18 піридин-3-іл)вініл)-N-метилбензенаміну) ( F-AV-45); ізоляції F-AV-45; очищення F-AV-45. Метод отримання радіофармацевтичної композиції може також включати в себе технологічний 18 етап виготовлення F-AV-45 в розчині, що містить від близько 1,0 % до близько 15 % (за об'ємом) етилового спирту і від близько 0,1 % до близько 1,0 % (маса/об'єм) солі-аскорбату. В окремих варіантах винаходу сіль-аскорбат - це аскорбат натрію, концентрація якого складає близько 0,5 % (маса/об'єм). 3 UA 105914 C2 5 10 15 20 25 30 35 40 45 50 55 [0023] Наведений вище реферат не призначений для опису кожного показаного варіанта або кожного впровадження цього винаходу. Короткий опис рисунків [0024] Для кращого розуміння суті винаходу слід зробити посилання на такі рисунки, в яких: [0025] на РИС.1 показана схема синтезу тозилатного прекурсору AV-105 і нерадіоактивного 19 F-AV-45 з р-толуолсульфонату відповідно до одного з варіантів винаходу; [0026] на РИС.2 показаний альтернативний метод синтезу тозилатного прекурсору AV-105 відповідно до іншого варіанта винаходу; [0027] на РИС.3 показаний метод радіохімічного синтезу одного з аспектів винаходу з 18 використанням тозилатного прекурсору для виробництва радіофармпрепарату F-AV-45, який зв'язує β-амілоїд. Пояснювальний опис варіантів здійснення винаходу [0028] Цей винахід не обмежується окремими описаними композиціями або методологіями, тому що вони можуть варіюватися. Крім того, термінологія, використана в описі, описує окремі версії або тільки варіанти винаходу і не призначена для обмеження його обсягу. Якщо не вказано інше, всі технічні і наукові терміни, що використовуються тут, мають ті ж значення, як їх розуміє звичайний фахівець у даній області. У випадку конфлікту опис винаходу, включаючи визначення, буде мати переважну силу. [0029] Використані тут форми однини включають в себе посилання на множину, якщо з контексту не очевидно інше. [0030] Використаний тут термін "близько" означає плюс або мінус 10 % від числової величини числа, якщо не вказано інше. [0031] Термін "введення" при використанні спільно з діагностичним препаратом, таким як, наприклад, радіофармпрепарат, означає введення безпосередньо в або на тканину-мішень або введення пацієнту радіофармпрепарату системно, щоб використовувати діагностичний препарат для візуалізації тканини або патології, пов'язаної з тканиною, для якої він призначений. "Введення" композиції може бути досягнуто шляхом ін'єкції, інфузії або будь-яким з цих методів у поєднанні з іншими відомими методами. [0032] Терміни "складатися", "містити", "мати" і "включати" і їхні однокореневі слова, використовувані тут, означають "включати, але не обов'язково обмежуватися". [0033] Терміни "ефективна кількість" або "терапевтично ефективна кількість", що використовуються тут, відносяться до кількості позитронно-випромінюючого радіофармпрепарату, що приводить до досить сильного сигналу гамма-випромінювання для адекватного зображення біологічної мішені, яка представляє інтерес, в мозку осіб з підозрою на нейродегенеративне захворювання. [0034] Термін "кінець синтезу" або "КС", що використовується тут, означає кінець радіохімічного синтезу. Це момент часу, на який процес радіохімічного синтезу, в тому числі будь-які стадії очищення, необхідні для ізоляції радіофармпрепарату, завершені. [0035] Термін "апротонний розчинник з високою температурою кипіння", що використовується тут, визначається як апротонний розчинник з температурою кипіння щонайменше близько 140 °C при одній (1) атм. [0036]Терміни "патологія" чи "патологічний", використовувані тут, відносяться до змінених біологічних процесів, які можуть бути, наприклад, пов'язані з аномальним виробництвом білків, пептидів, РНК та інших речовин, пов'язаних з механізмом захворювання. [0037] Використані тут терміни "пацієнт" і "суб'єкт" відносяться до будь-якого живого організму, в який вводяться описані тут сполуки і чию мозкову діяльність належить виміряти спільно з виконанням методів аналізу з цього винаходу. Пацієнти та/або суб'єкти можуть означати, серед іншого, будь-яких ссавців (які не є людиною), приматів та людину. Такі пацієнти та/або суб'єкти можуть виявляти або не виявляти ознаки, симптоми або патології одного або декількох конкретних хворобливих станів. [0038] Термін "мішень" при використанні спільно з діагностичним препаратом, таким як радіофармацевтичний препарат цього винаходу, відноситься до тканини або іншого матеріалу, які пов'язані з патологією та на яких бажана локалізація радіофармацевтичного або діагностичного препарату. Ці мішені можуть включати, серед іншого, хворі клітини, хвороботворні мікроорганізми, інших потенційних збудників інфекції або інший небажаний матеріал у пацієнта, такий як ненормальні білки, пептиди, PHK або ДНК або нормально експресовані рецептори, які змінилися через патологічний процес. [0039] Взагалі кажучи, використовуваний тут термін "тканина" відноситься до будь-якої агрегації клітин подібної спеціалізації, які об'єднані у виконанні певної функції. 4 UA 105914 C2 5 10 15 20 25 30 35 40 45 50 55 [0040] Різні варіанти винаходу передбачають спосіб синтезу препарату для візуалізації, 18 міченого радіоізотопом F, з тозилатного прекурсору, а також композиції стабільних фармацевтичних продуктів, яка містить такий препарат для візуалізації, мічений радіоізотопом 18 F. [0041] Деякі варіанти винаходу спрямовані на отримання радіофармацевтичної композиції, 18 18 що включає ефективну кількість сполуки, міченої радіоізотопом F, такої як мічений F 18 стирилпіридин або мічене F похідне дигідротетрабеназину (DTBZ), в розчині, що містить від близько 1,0 % до близько 30 % (маса/об'єм) етилового спирту і принаймні близько 0,1 % (маса/об'єм) аскорбату натрію. Інші варіанти винаходу спрямовані на отримання радіофармацевтичної композиції, що включає ефективну кількість сполуки, міченої 18 радіоізотопом F, в розчині для внутрішньовенного введення, що містить від близько 1,0 % до близько 20 % (за об'ємом) етилового спирту і принаймні близько 0,1 % (маса/об'єм) аскорбату натрію, з рН між приблизно 4,5 і 8,0. Ця радіофармацевтична композиція - прозорий розчин без нерозчинної речовини, який є стабільним принаймні 6 годин після виробництва і містить мічений F-18 радіофармпрепарат в концентраціях до 100 мКі/мл (від 37 до 3700 МБк/мл) або більше. [0042] Парентеральна радіофармацевтична композиція деяких варіантів винаходу може містити сполуки, мічені радіоізотопом F-18 та здатні зв'язуватися з патологічною мішенню у мозку пацієнта, такою як, наприклад, ненормальні концентрації нативного чи патологічно зміненого білка, пептиду або олігонуклеотиду, β-амілоїд, α-синуклеїн, або з нормально експресованою ендогенною мішенню, яка порушується за наявності деяких дегенеративних розладів, наприклад, з везикулярним моноаміновим транспортером (VMAT2) при хворобі Паркінсона (ХП), деменції з тільцями Леві (ДТЛ) або діабеті. [0043] Різні варіанти винаходу забезпечують радіофармацевтичні композиції, що мають характеристики, включаючи такі: високу спорідненість і вибірковість до мішені, низьку молекулярну масу (90 % протягом принаймні 4 годин після радіохімічного синтезу, а більш бажано - протягом періоду до 8 годин після радіохімічного синтезу. [0047] Радіофармацевтична композиція в деяких варіантах винаходу містить етиловий спирт у концентрації від близько 1,0 % до близько 15,0 % (за об'ємом) та сіль-аскорбат (наприклад, аскорбат натрію або іншу сіль аскорбінової кислоти) у діапазоні концентрацій від близько 0,1 % до близько 1,0 % (маса/об'єм). У деяких варіантах здійснення винаходу аскорбат натрію використовується в концентрації 0,5 % (маса/об'єм). рН композиції може коливатися від близько 4,5 до близько 8,0. У деяких варіантах чистота радіофармпрепарату становить принаймні 90 % при вимірюванні принаймні через 2 години після кінця синтезу (KC). Перевага надається тим 5 UA 105914 C2 5 10 15 20 25 30 35 40 45 50 55 60 варіантам, у яких чистота радіофармацевтичної композиції становить не менше 90 % при вимірюванні принаймні приблизно через 4 години після кінця синтезу. 18 [0048] У ще одному варіанті винаходу описано метод виробництва міченої радіоізотопом F композиції, здатної зв'язуватися з β-амілоїдом. Метод включає в тому числі: синтез тозилатного 18 прекурсору; нуклеофільне фторування F тозилатного прекурсору; технологію виготовлення 18 фторованого F тозилатного прекурсору у водному розчині; додавання етилового спирту для досягнення мінімальної концентрації близько 1,0 % (маса/об'єм) в кінцевій міченій радіоізотопом 18 F стирилпіридиновій композиції; а також додавання аскорбату натрію для досягнення 18 мінімальної концентрації близько 0,1 % (маса/об'єм) в кінцевій міченій радіоізотопом F стирилпіридиновій композиції. 18 [0049] В іншому варіанті описано спосіб отримання тозилатного прекурсору для F-AV-45, (Е)-2-(2-(2-(5-(4-(трет-бутоксикарбоніл(метил)аміно)стирил)піридин-2-ілокси)етокси)етокси)етил 4-метилбензенсульфонату ("AV-105"). Цей метод включає в себе стадії: (і) підготовки сполуки вініланіліну з моно-Вос-захистом; (іі) перетворення сполуки вініланіліну з (і) на похідне N-метил, t-бутилкарбамату (тобто, N-метил, N-Boc); (ііі) взаємодії 2-гало 5-йодопіридину (у деяких варіантах гало = хлоро або бромо) з триетиленгліколем; (iv) взаємодії похідного N-метил, N-Boc стадії (іі) з результуючою сполукою стадії (ііі) для виробництва (Е)-трет-бутил 4-(2-(6-(2-(2-(2гідроксиетокси)етокси)етокси)піридин-3-іл)вініл)феніл(метил)карбамату і (ν) взаємодії (Е)-третбутил 4-(2-(6-(2-(2-(2-гідроксиетокси)етокси)етокси)піридин-3-іл)вініл)феніл(метил)карбамату з тозилхлоридом для утворення AV-105. [0050] У ще одному аспекті винаходу описано спосіб отримання радіофармацевтичної 18 композиції, в тому числі: взаємодію тозилатного прекурсору AV-105 з F -фторид-іоном в розчині ДМСО або іншому апротонному розчиннику з високою температурою кипіння для 18 виробництва ((E)-4-(2-(6-(2-(2-(2-[ F]фтороетокси)етокси)етокси) піридин-3-іл)вініл)-N18 18 18 метилбензенамін) (" F-AV-45"); ізоляції F -AV-45; очищення F -AV-45. Спосіб отримання 18 радіофармацевтичної композиції може також включати технологічний етап виготовлення F-AV45 в розчині, що містить від близько 1,0 % до близько 15 % (за об'ємом) етилового спирту і від близько 0,1 % до близько 1,0 % або більше (маса/об'єм) аскорбату натрію або іншої соліаскорбату. В окремих варіантах винаходу концентрація аскорбату натрію складає 0,5 % (маса/об'єм). [0051] У ще одному варіанті здійснення винаходу передбачається отримання 18 радіофармацевтичної композиції, яка включає ефективну кількість міченої радіоізотопом F сполуки, принаймні близько 1,0 % (за об'ємом) етилового спирту і принаймні близько 0,1 % (маса/об'єм) аскорбату натрію, де швидкість розпаду радіофармацевтичної композиції, вимірювана in vitro, значною мірою відповідає таким показникам: (а) від близько 0,01 % до близько 5 % від загального розпаду приблизно через 2 години вимірювань; (b) від близько 0,01 % до близько 10 % від загального розпаду приблизно через 10 годин вимірювань; (с) від близько 0,01 % до близько 20 % від загального розпаду приблизно через 15 годин вимірювань та (d) не більше ніж близько 25 % від загального розпаду приблизно через 24 години вимірювань. [0052] У деяких варіантах винахід включає методи синтезу тозилатного прекурсору для 18 міченого радіоізотопом F стирилпіридину, AV-105 (показано на РИС.1). Метод синтезу AV-105 використовує первинний тозилат замість первинного мезилату як активну групу покидання. Використання тозилатного прекурсору для радіофторування вигідно принаймні з тієї причини, що тозилат, утворюваний при реакції радіофторування, легко видаляється за допомогою 18 хроматографічних засобів з міченого радіоізотопом F препарату для візуалізації. На РИС.1 представлено початковий синтез AV-105 і синтез холодного AV-45 в одному з варіантів винаходу. Використання p-толуолсульфонату (тозилату) в якості активної групи покидання усуває необхідність використання метансульфонату (мезилату), який не є кращим у зв'язку з генотоксичними властивостями метансульфокислоти - побічного продукту при використанні мезилату. Крім того, р-толуолсульфокислоту легше виявити, ніж метансульфокислоту і, отже, її легше очистити за допомогою рідинної хроматографії з УФ-детектуванням. Як далі показано на РИС.1, 4-диметиламінопіридин (ДМАП) задіяно на стадіях захисту за допомогою Вос (6-7) і стадії тозилації (8) для отримання AV-105. Залучення ДМАП на стадії тозилації приводить до скорочення часу, необхідного для повного перетворення вихідного матеріалу. Наявність ДМАП також інгібує розпад після тривалого часу реакції. З цього синтетичного матеріалу можна отримати малу (наприклад, грам) кількість AV-105, однак нелегко нарощувати масштаби виробництва до 50 г або більшої кількості AV-105. [0053] Альтернативний метод синтезу AV-105 представлений на РИС. 2.В цьому конвергентному методі синтезу використано р-толуолсульфонілхлорид замість типового 6 UA 105914 C2 5 10 15 20 25 30 35 40 45 50 55 60 метансульфонілхлориду для створення псевдо-галощу. Використання реакції Хека, як показано на РИС.2, збільшує конвергенцію синтезу, тим самим роблячи синтез більш ефективним і підвищуючи вихід продукту. Однак наведені на РИС.1 і 2 значення виходу продукту призначені тільки для ілюстрації і не відображають максимальні можливі значення. За можливою оцінкою фахівця в даній області, описані тут синтетичні методи отримання AV-105 можуть бути додатково оптимізовані шляхом використання методів очищення, застосовуваних для проміжних реагентів або самого AV-105. Такі методи можуть включати, наприклад, рекристалізацію, екстракцію розчинниками або хроматографічне розділення в колонці, здатні видаляти невеликі кількості домішок реагенту або побічні продукти реакції. Тим не менш, за допомогою описаних тут методів можливо виробляти AV-105 із загальним виходом 40 % або більше та з чистотою вище, ніж близько 95 %. [0054] Радіохімічний синтез в одному з варіантів винаходу з використанням первинного 18 алкілтозилату для вироблення радіофармпрепарату F-AV-45, здатного зв'язувати β-амілоїд, показано на РИС.3. Дотримуючись процесу введення радіоактивної мітки в аспектах винаходу, 18 F-AV-45 (позначений як Формула II на РИС.3) розроблений для сольового розчину. У деяких варіантах сольовий розчин містить, щонайменше, близько 1,0 % (за об'ємом) етилового спирту і щонайменше близько 0,1 % (маса/об'єм) аскорбату натрію і має рН від 4,5 до 8,0. В інших варіантах концентрація етилового спирту знаходиться в діапазоні від близько 1,0 % до близько 10,0 % (за об'ємом), а концентрація аскорбату натрію знаходиться в діапазоні від близько 0,1 % до близько 1,0 % (маса/об'єм). Не вдаючись у подробиці теорії, зазначимо, що присутність 18 аскорбату натрію мінімізує радіоліз під час очищення сировини F-AV-45 і в кінцевому розріджувачі для підвищення стабільності та терміну придатності. В одному з варіантів винаходу номінальна концентрація аскорбату натрію становить 0,5 % (маса/об'єм). [0055] В іншому аспекті винаходу описано метод виявлення нейродегенеративних захворювань у пацієнта, у тому числі введення пацієнту радіофармацевтичної композиції, здатної зв'язуватися з мішенню, пов'язаною з нейродегенеративним захворюванням. Згадана 18 композиція включає ефективну кількість міченої радіоізотопом F сполуки для візуалізації 18 амілоїду, такої як F-AV-45, або альтернативного міченого F-18 радіофармпрепарату, здатного зв'язуватися з амілоїдом, які містять приблизно від 1,0 % до 15 % (за об'ємом) етилового спирту і приблизно від 0,1 % до 1 % (маса/об'єм) аскорбату натрію; зображення частини організму пацієнта, де, як очікується, розташована мішень; виявлення мішені. Частина організму пацієнта може включати принаймні частину мозку. [0056] Радіофармацевтична композиція може бути використана у діагностиці нейродегенеративних захворювань, таких як, наприклад, деменція, когнітивні порушення, хвороба Альцгеймера (XA), хвороба Паркінсона (ХП), деменція з тільцями Леві (ДТЛ), судинна деменція (СД) та їхні комбінації. 18 [0057] Фармацевтична композиція, мічена радіоізотопом F, у варіантах здійснення винаходу може бути введена будь-яким методом, відомим в даній області. Наприклад, у конкретному аспекті радіофармацевтична композиція може вводитися за допомогою ін'єкцій. Методи введення можуть включати, серед іншого, внутрішньосудинні, внутрішньовенні, 18 внутрішньочеревні, підшкірні, внутрішньом'язові ін'єкції. Мічена радіоізотопом F радіофармацевтична композиція може також вводитися в дозованій лікарській формі, наприклад, як внутрішньовенне введення. У деяких варіантах радіофармацевтична композиція може бути підготовлена у шприці-тюбику, який містить відповідну кількість радіофармпрепарату. 18 [0058] Мічені F радіофармпрепарати у різних варіантах винаходу можуть бути відображені за допомогою будь-якого відповідного методу, відомого у даній області, в тому числі позитронно-емісійної томографії (ПЕТ), однофотонної емісійної комп'ютерної томографії (ОФЕКТ), ПЕТ з одночасною комп'ютерною томографією (ПЕТ/КТ), ПЕТ з одночасною магнітнорезонансною томографією (ПЕТ/MPT) або їхніх комбінацій. 18 [0059] Мічені F радіофармацевтичні композиції у варіантах винаходу мають як високу радіохімічну чистоту, так і високий вихід продукту радіохімічного синтезу. Терміни зберігання 18 мічених F радіофармпрепаратів можуть відрізнятися для різних варіантів і можуть залежати 18 від різних аспектів процедури. Звичайно термін зберігання міченого F радіофармпрепарату більше 8 годин після виробництва, якщо він вироблений за технологією, описаною в цьому 18 документі. Деякі варіанти винаходу також визначають технологію виготовлення F-міченої сполуки, яка є одночасно безпечною при введенні людині і стійкою до радіолізу або іншої хімічної деградації за час (наприклад, до 8-10 годин) відвантаження до лікарні або іншого 18 діагностичного центра. Наприклад, в одному з варіантів радіофармацевтична композиція FAV-45, що містить етиловий спирт і аскорбат натрію, зберігає стабільність (більше 90 %) до 20 годин після виробництва. 7 UA 105914 C2 5 10 15 20 25 30 35 40 45 50 55 60 Приклади [0060] Для того, щоб описаний тут винахід був більш зрозумілим, надаються такі приклади. Ці приклади тільки для ілюстрації і не повинні тлумачитися як ті, що обмежують винахід в будьякій формі. 18 Приклад 1.0. Синтез тозилатного прекурсору AV-105 для F-AV-45. [0061] Метод синтезу для розширення об'ємів виробництва тозилатного прекурсору (E)-2-(2(2-(5-(4-трет-бутоксикарбоніл(метил)аміно)стирил)піридин-2-ілокси)етокси)етокси)етил 418 метилбензенсульфонату ("AV-105") для ((E)-4-(2-(6-(2-(2-(2-[ F]фтороетокси)етокси)етокси) 18 піридин-3-іл)вініл)-N-метилбензенаміну) (" F-AV-45"), відповідно до одного з варіантів винаходу, показано на РИС.2. Захищений моно-Вос вініланілін 10 був підготовлений шляхом енергійного перемішування вініланіліну з ди-трет-бутилдикарбонатом у воді при кімнатній температурі протягом 2 годин. Захищений моно-Вос вініланілін 10 був осаджений і відфільтрований, щоб забезпечити вихід 98 %, та був використаний без додаткового очищення. Метилювання проміжного продукту за допомогою гідриду натрію та метилйодиду в диметилформаміді (ДМФ) дало сировину трет-бутил метил(4-вінілфеніл)карбамат 11 (88 % виходу), яка також була використана без додаткового очищення. 2-бром-5-йодопіридин був алкілований триетиленгліколем за допомогою трет-бутоксиду калію. Принаймні 4-разовий надлишок триетиленгліколю по відношенню до йодопіридину був використаний для забезпечення того, щоб моноалкілований продукт 2-(2-(2-(5-йодопіридин-2-ілокси)етокси)етокси)етанол 13 був основним продуктом. Моноалкілований продукт 13 (88 % виходу) не був очищений і був використаний безпосередньо на стадії (г) реакції. Реакція Хека між сировиною 11 і моноалкілованим продуктом 13 була проведена з використанням ацетату паладію, броміду тетрабутиламонію і карбонату калію в ДМФ, щоб створити стирилпіридин 14, який очищали з використанням технології флеш-хроматографії середнього тиску фірми Biotage (55 % виходу). Тозилацію стирилпіридину 14 проводили з використанням тозилхлориду, триетиламіну і ДМАП в DCM (дихлорметані?) для отримання AV-105, який очищали з використанням згаданої технології фірми Biotage. Загальний вихід, починаючи з 2-бром-5-йодопіридину, склав 40 % (3 стадії). Приклад 1.1. Трет-бутил 4-вінілфенілкарбамат. [0062] Вініланілін (3,75 г; 31,4 ммоль) і ди-трет-бутилдикарбонат (7,55 г; 34,6ммоль) енергійно перемішували у воді (23 мл) при кімнатній температурі протягом двох годин. Осад відфільтрували, і решту осаду на фільтрі повторно розчинили в етилацетаті (50 мл). Органічний шар промивали водою (50 мл) і сольовим розчином (50 мл), сушили над безводним сульфатом натрію, фільтрували і концентрували при зниженому тиску для отримання сировини вініланіліну, захищеного моно-Вос, 5 (6,75 г; 98 %) у вигляді рожевуватої твердої речовини, що може бути використана на наступній стадії без додаткового очищення. Приклад 1.2. Трет-бутил метил(4-вінілфеніл)карбамат. [0063] В атмосфері азоту додали гідрид натрію (1,11 г; 46,2 ммоль) до безводного ДМФ (80 мл), і суспензію охолодили до 0 °C за допомогою крижаної ванни. Вініланілін із моно-Восзахистом 10 (6,75 г; 30,8 ммоль), розчинений у безводному ДМФ (30 мл), додавався протягом 30 хвилин через краплинну воронку. Реакційна суміш самостійно нагрівалася до кімнатної температури, і метилйодид (8,75 г; 61,6 ммоль) додавався протягом 30 хвилин за допомогою шприца. Після перемішування при кімнатній температурі протягом ще 1,5 годин суміш вилили на лід (200 г) і екстрагували етилацетатом (200 мл). Органічний шар відокремили від водного шару, промили водою (100 мл) і сольовим розчином (50 мл), висушили над безводним сульфатом натрію, відфільтрували і сконцентрували при зниженому тиску, отримавши сировину 11 (6,3 г; 88 %) у вигляді червонуватої маслянистої рідини. Приклад 1.3. 2-(2-(2-(5-йодопіридин-2-ілокси)етокси)етокси)етанол. [0064] Трет-бутоксид калію (869 мг; 7,7 ммоль) додавався частинами до розчину 2-бром-5йодопіридину (2 г; 7,04 ммоль) і триетиленгліколю (4.23 г; 28,1 ммоль) у тетрагідрофурані (ТГФ) (40 мл). Потім реакційну суміш доводять до кипіння у пристрої зі зворотним холодильником протягом 20 год. Реакційну суміш сконцентрували при зниженому тиску для видалення розчинника ТГФ. Концентрат розбавили водою (100 мл) і екстрагували етилацетатом (50 мл ×2). Об'єднані органічні шари промили водою (50 мл), потім сольовим розчином (50 мл), висушили над безводним сульфатом натрію, відфільтрували і сконцентрували при зниженому тиску, отримавши моноалкілований продукт 2-(2-(2-(5-йодопіридин-2-ілокси)етокси)етокси)етанол 13 (2,2 г; 88 %) у вигляді світло-жовтуватої олії, яка затверділа після відстоювання протягом ночі при кімнатній температурі. Приклад 1.4. (Е)-трет-бутил 4-(2-(6-(2-(2-(2гідроксиетокси)етокси)етокси)піридин-3іл)вініл)феніл(метил)карбамат. 8 UA 105914 C2 5 10 15 20 25 30 35 40 45 50 55 60 [0065] Сполучні реагенти трет-бутил метил(4-вінілфеніл)карбамат 11 (1,29 г; 5,55 ммоль) і 2(2-(2-(5-йодопіридин-2-ілокси)етокси)етокси)етанол 13 (1,96 г; і 5,55 ммоль) разом з ацетатом паладію (62,3 мг; 0,278 ммоль), бромідом тетрабутиламонію (5,53 г; 16,65 ммоль) і карбонатом калію (3,83 г; 27,75 ммоль) було додано у безводний ДМФ (80 мл). Реакційну суміш дегазували у N2 протягом 5 хвилин і нагрівали при 100 °C протягом ночі. Об'єм реакційної суміші знизився на 50 % у вакуумі, і суміш розподілили між етилацетатом (200 мл) і водою (400 мл). Водний шар відокремили і проекстрагували додатковою кількістю етилацетату (150 мл). Органічні шари об'єднали, промили водою (100 мл) і сольовим розчином (100 мл), висушили над безводним сульфатом натрію і сконцентрували при зниженому тиску. Залишок очистили за технологією фірми Biotage (хроматографії у випарній колонці середнього тиску) (45 % етилацетату в гексанах, 65 % етилацетату в гексанах), отримавши (E)-трет-бутил 4-(2-(6-(2-(2-(2гідроксиетокси)етокси)етокси)піридин-3-іл)вініл)феніл(метил)карбамат 14 (1,4 г; 55 %). Приклад 1.5. (Е)-2-(2-(2-(5-(4-(трет-бутоксикарбоніл(метил)аміно)стирил)піридин-2ілокси)етокси)етокси)етил 4-метилбензенсульфонат (AV-105). [0066] (Е)-трет-бутил 4-(2-(6-(2-(2-(2-гідроксиетокси)етокси)етокси)піридин-3іл)вініл)феніл(метил)карбамат 14 (1,3 г; 2,83 ммоль) розчинили в DCM (50 мл) з наступним додаванням толуолсульфонілхлориду (1,08 г; 5,68 ммоль), триетиламіну (0,86 г; 8,49 ммоль) і ДМАП (24 мг; 0,2 ммоль). Суміш перемішували при кімнатній температурі протягом 6 годин. Додали води (50 мл). Органічний шар відокремили, промили сольовим розчином, висушили над безводним сульфатом натрію, сконцентрували при зниженому тиску і очистили за технологією фірми Biotage (хроматографії у випарній колонці середнього тиску) (почали з 30 % етилацетату в гексані і довели до 40 % етилацетату в гексані), отримавши сполуку AV-105 (1,5 г; 86 %) у вигляді прозорої, світло-жовтої олії, яка зрештою затверділа після декількох днів під вакуумом. 18 Приклад 2.0. Радіохімічний синтез F -AV-45 із AV-105. 18 [0067] Радіоактивний препарат [ F]-фториду був уловлений на картриджі аніонного обміну і елюйований (вимитий з адсорбенту) до реакційної посудини з використанням водного розчину К.2.2.2-К2СОз (карбонату калію і Kryptofix) і CH3CN. Елюйований радіоактивний препарат 18 висушили під вакуумом. [ F]-фторид далі був висушений шляхом додавання CH3CN до хімічного реактора, і азеотроп води з CH3CN було випаровано з підігрівом. AV-105 (1,5 мг в 2,0 мл ДМСО) було додано до хімічного реактора. Суміш у реакторі нагріли до 110-120 °C для 18 реакції введення радіоактивної мітки F. ЗМ розчин HCl було додано в посудину, і отриману суміш нагріли до 120 °C протягом 5 хвилин, щоб видалити N-Boc-групу. Після охолодження 1M розчин NaOH було додано для нейтралізації. Розчин було завантажено на картридж зворотної 18 фази. Ізольовану сировину F-AV-45 на картриджі промили приблизно 4 мл води для ін'єкцій з 18 5 % (маса/об'єм) аскорбату натрію. F-AV-45 далі був елюйований 1,5 мл CH3CN в резервуар, що містить 2 мл води для ін'єкцій з 5 % (маса/об'єм) аскорбату натрію і 1 мл розчинника для 18 високоефективної рідинної хроматографії (ВЕРХ). F-AV-45 далі був завантажений на 18 напівпрепаративну колонку для ВЕРХ і підданий очищенню. Фракція ВЕРХ з очищеним F-AV45 була зібрана в резервуар, що містить 20 мл води для ін'єкцій з 0,5 % (маса/об'єм) аскорбату 18 натрію. Розведений розчин пропустили через картридж SEP-PАК® C-18, і уловлений F-AV-45 18 промили 15 мл води для ін'єкцій з 0,5 % (маса/об'єм) аскорбату натрію. F-AV-45 елюювали з картриджа SEP-PАК® Light C-18 за допомогою розчину 1 мл етанолу (USP) в 9 мл 0,9 % хлориду натрію для ін'єкцій (стерильного, USP), що містить 0,5 % (маса/об'єм) аскорбату натрію (USP). Цей розчин потім перекачали через 0,22-мкм стерилізаційний фільтр в 10- або 30-мл 18 стерильний гофрований герметичний контейнер з перегородками. Фармацевтичний продукт FAV-45 може бути розведений хлоридом натрію для ін'єкцій (0,9 %, USP, стерильним), що містить не більше 10 % (за об'ємом) етанолу (USP) і 0,5 % (маса/об'єм) аскорбату натрію (USP). 19 18 Приклад 3.0. Технологія для солюбілізаціі F-AV-45 і стабілізації F-AV-45. 18 [0068] Радіофармацевтичну технологію та композицію F-AV-45 було оцінено с точки зору 19 розчинності нерадіоактивного F-AV-45, який також утворюється в кількості 1-5 мкг/мл під час 18 19 радіохімічного синтезу F-AV-45 через наявність невеликої кількості F-фториду з пробірок, клапанів та інших джерел в системі радіохімічного синтезу. При відсутності етанолу в композиції 19 через низьку розчинність F-AV-45 можуть спостерігатися тверді частинки. Тому додавши 10 % 19 етанолу до радіофармацевтичної композиції, визначали, чи достатня розчинність F-AV-45, щоб уникнути можливості утворення осаду. Межа розчинності AV-45 в композиції фармацевтичного продукту (10 % (за об'ємом) етанолу та 0,5 % (маса/об'єм) аскорбату натрію в 0,9 % водному розчині хлориду натрію) склала 17 мкг/мл при кімнатній температурі. Видимий осад був наявним в розчинах з концентрацією 22 мкг/мл. Зразки, приготовлені з концентраціями 20 мкг/мл, були оцінені методом ВЕРХ після центрифугування. Зразки з концентраціями 20 мкг/мл були також перевірені після зберігання протягом одного тижня при 9 UA 105914 C2 5 10 15 кімнатній температурі. Жодних змін у концентрації не відбулося після одного тижня зберігання при кімнатній температурі. 18 [0069] Радіофармацевтичні композиції F-AV-45 у варіантах здійснення винаходу незвичайно стійкі до радіолізу або хімічної деградації. Аскорбат натрію застосовується для 18 мінімізації радіолізу під час очищення F-AV-45 та в кінцевому розчині фармацевтичного продукту для підвищення стабільності та терміну придатності. Етанол в концентраціях 1-10 % 18 (за об'ємом) у водному розчині сприяє солюбілізаціі F-AV-45. Щоб продемонструвати 18 стабілізацію F-AV-45 в кінцевому фармацевтичному продукті, були виготовлені дослідні композиції з аскорбатом натрію та без нього. Композиції були проаналізовані в кінці синтезу (KC) методом зворотної ВЕРХ із застосуванням ультрафіолетового (УФ) та радіохімічного 18 детекторів. Радіохімічну чистоту F-AV-45 контролювали за допомогою ВЕРХ з радіометричним 19 детектуванням, а чистоту F-AV-45 контролювали за допомогою ВЕРХ з УФ-детектуванням у фармацевтичному продукті за методом нормалізації відсотка площі. Значення відсотка площі як для радіохімічного, так і для ультрафіолетового аналізу представлені в таблицях 1 і 2. 18 [0070] В KC радіохімічна чистота композиції F-AV-45, приготовленої без аскорбату натрію, становила 84 %, і композиція продовжувала розпадатися. Таким чином, через 2 години чистота 18 становила вже 80 %. Чистота композиції F-AV-45, виготовленої з аскорбатом натрію, була значно вище. В KC чистота склала 96 % з незначним розпадом через 2 години після KC (чистота 95 %). 20 Таблиця 1 Аналіз відсодка радіохімічної чистоти ін’єкції Радіоактивний компонент, що аналізується Час 18 % чистоти F AV-45 Невідомої (ВЧУ = 0,25) Невідомо 2 (ВЧУ = 0,31) Невідомо 3 (ВЧУ = 0,36) Невідомо 4 (ВЧУ = 0,40) 18 F-AV-45 після кінця синтезу (КС) AV4520080304 Виготовлено без аскорбату натрію (444 МБк/мл) через 2 години KC після KC 84 % 80 % HB HB 2% 4% HB HB 14 % 16 % АУ4520080603 Виготовлено з аскорбатом натрію (1036 МБк/мл) через 2 години KC після KC 96 % 95 % 2% 3% HB HB 2% 2% HB HB 19 [0071] Аскорбат натрію мав подібний стабілізуючий вплив на F-AV-45 і мінімізував утворення нерадіоактивних домішок, виявлених за допомогою УФ-випромінювання, як показано у Таблиці 2. 25 Таблиця 2 Аналіз УФ-чистоти 19 18 F-AV-45 у ін’єкції F-AV-45 за відсотком області після кінця синтезу (КС) та через 2 години після (КС)* Ультрафіолетовий компонент, що аналізується При 350 нм Час 19F-AV-45 (ВЧУ =1,00) Невідомо 1 (ВЧУ = 0,37) Невідомо 2 (ВЧУ = 0,36) Невідомо 3 (ВЧУ = 0,81) Невідомо 4 (ВЧУ = 0,92) Невідомо 5 (ВЧУ = 0,95) Невідомо 6 (ВЧУ =1,11) AV4520080304 Виготовлено без аскорбату натрію (444 МБк/мл) через 2 години KC після KC 83 % 76 % 6% 8% 1% 1% 4% 4% 1% 5% 5% HB 2% AV4520080603 Виготовлено з аскорбатом натрію (1036 МБк/мл) через 2 години KC після KC 100 % 100 % HB HB HB HB HB HB HB HB HB HB HB HB У таблицю включені лише домішки, які дорівнюють або перевищують 1 % 10 UA 105914 C2 18 [0072] У Таблиці 3 показано підвищену стабільність радіофармацевтичного препарату FAV-45 при додаванні приблизно 10 % (за об'ємом) етанолу у звичайний соляний розчин з вмістом 0,5 % (маса/об'єм) аскорбату натрію. Як зазначалося, радіохімічна чистота композиції, 18 міченої F, підтримується приблизно до 20 годин після виробництва. 5 Таблиця 3 18 Підвищена стабільність ін'єкції F-AV-45, яку виготовлено, і рецептуру якої розроблено з додаванням аскорбату натрію у концентрації 0,5 %. Номер партії AV4520071217J AV4520071220_1 AV4520080114_1 10 15 20 Умови зберігання Температура навколишнього середовища Температура навколишнього середовища Температура навколишнього eenerrnmmia %РХЧ KC %РХЧ (після KC) 99 % 99 % (21 година) 99 % 100 % (17 годин) 100 % 100 % (20 годин) [0073] Було проведено додаткове дослідження з метою визначення стабільності 18 радіофармацевтичного препарату F-AV-45 з додаванням 10 % (за об'ємом) етанолу у звичайний соляний розчин із вмістом 0,5 % (маса/об'єм) аскорбату натрію, при зберіганні у FLUROTEC®. Стабільність отриманого препарату оцінювалася на трьох окремих партіях 18 виробництва F-AV-45. Пробірки зберігалися вертикально та переверталися при температурі навколишнього середовища та температурі 40 °C, а також зберігалися вертикально при температурі 50 °C. Зразки отриманого препарату бралися через визначені інтервали впродовж 12 годин періоду тестування і оцінювалися на радіохімічну чистоту та стабільність. Постійна РХЧ протягом 12 годин і
ДивитисяДодаткова інформація
Назва патенту англійськоюSynthesis or 18f-radiolabeled styrylperidines from tosylate precursors and stable pharmaceutical compositions thereof
Автори російськоюBenedum, Tyler, Golding, Geoff, Lim, Nathaniel, Zhang, Wei
МПК / Мітки
МПК: C07D 213/16, A61K 51/04, A61M 36/00
Мітки: основі, міченого, тозилатного, радіоізотопом, синтез, прекурсора, стирилпіридину, стабільна, фармацевтична, композиція
Код посилання
<a href="https://ua.patents.su/16-105914-sintez-stirilpiridinu-michenogo-radioizotopom-18f-z-tozilatnogo-prekursora-ta-stabilna-farmacevtichna-kompoziciya-na-jjogo-osnovi.html" target="_blank" rel="follow" title="База патентів України">Синтез стирилпіридину, міченого радіоізотопом 18f, з тозилатного прекурсора та стабільна фармацевтична композиція на його основі</a>
Попередній патент: Мезилат 5-(2-{[6-(2,2-дифтор-2-фенілетокси)гексил]аміно}-1-гідроксіетил)-8-гідроксихінолін-2(1н)-ону як агоніст b2-адренергічного рецептора
Наступний патент: Спосіб і установка для одержання чавуну або рідких напівфабрикатів сталі
Випадковий патент: Натрієво-кальцієве зелене скло для харчової упаковки, що поглинає ультрафіолетове випромінювання та пропускає видиме світло












