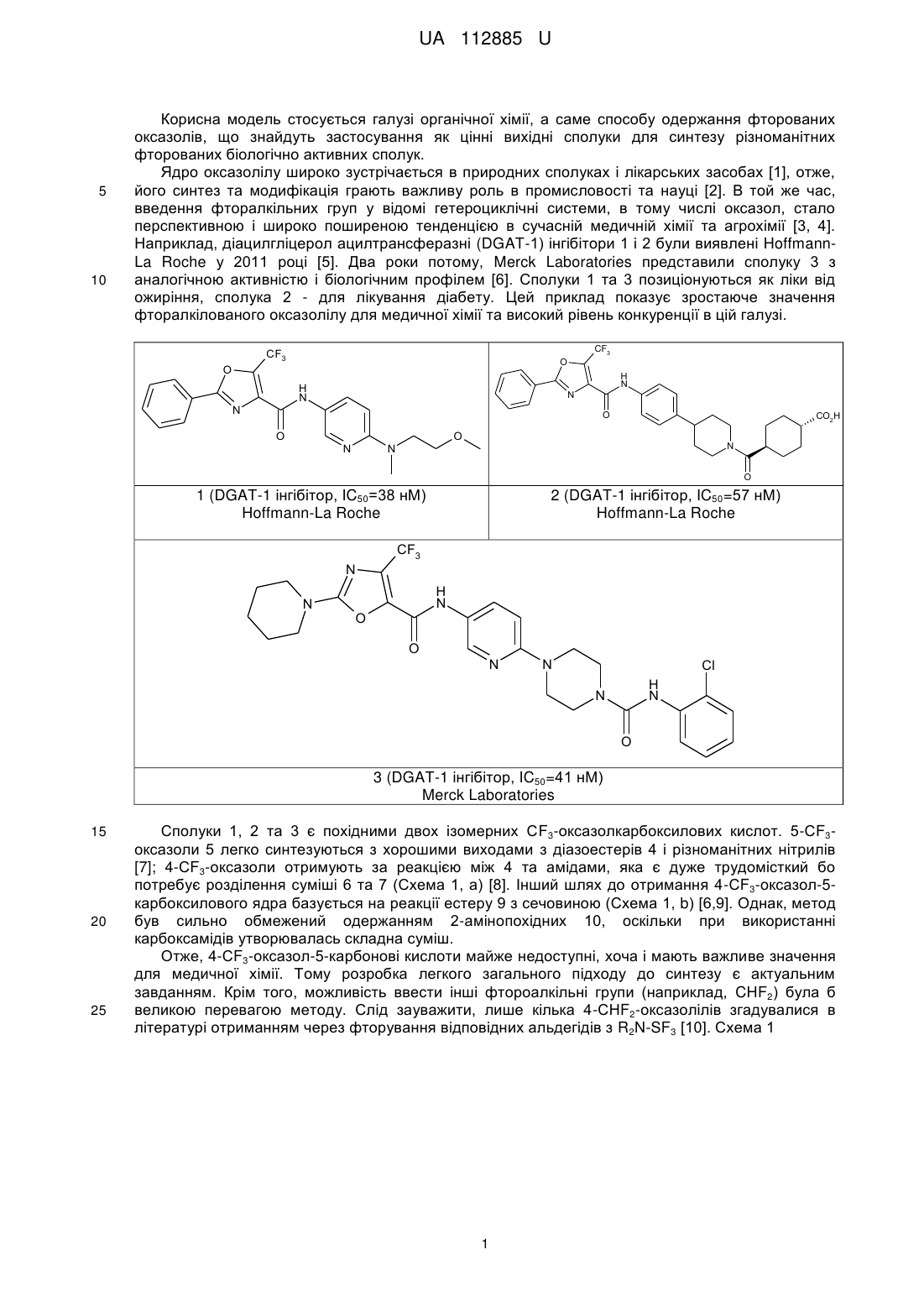
Спосіб одержання 4-фторалкілоксазол-5-карбонової кислоти
Формула / Реферат
1. Спосіб одержання 4-фторалкілоксазол-5-карбонової кислоти формули (І):
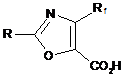 ,
,
де
Rf являє собою CF3 або CHF2;
R являє собою С1-С6алкіл, С3-С10циклоалкіл, С6-С10арил або С2-С9гетероарил, кожен з яких необов'язково заміщений одним або більшою кількість замісників, незалежно вибраних з С1-С6алкілу, С2-С6алкенілу, С2-С6алкінілу, С1-С6алкокси, С3-С10циклоалкілу, С6-С10арилу, С2-С9гетероарилу, галогену, -CN, NO2, -NHC1-С6алкілу, -N(C1-С6алкіл)2, -CONHC1-С6алкілу, -СОС1-С6алкілу, -СООС1-С6алкілу, -SC1-C6алкілу, -SOC1-С6алкілу або -SO2C1-C6алкілу, що включає наступні стадії:
а) обробку енаміну формули (II):
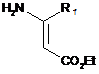
хлорангідридом кислоти RCOC1, де R має визначене вище значення, в присутності основи з одержанням N-ацильованого продукту формули (III):
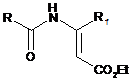 ,
,
б) обробку одержаного N-ацильованого продукту формули (III) діацетатом фенілйодонію (РhI(СН3СО2)2-PIDA), або бістрифторацетатом фенілйодонію (PhI(CF3CO2)2-PIFA), або дитрифлатом фенілйодонію (PhI(CF3SO2O)2 - PIDT) з одержанням естеру оксазолілу формули (IV):
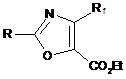 ,
,
в) гідроліз одержаного естеру оксазолілу формули (IV) з використанням основи з одержанням 4-фторалкілоксазол-5-карбонової кислоти формули (І).
2. Спосіб за п. 1, який відрізняється тим, що на стадії а) як основа може бути використана органічна основа, така як піридин.
3. Спосіб за п. 1, який відрізняється тим, що на стадії в) як основа може бути використана неорганічна основа, така як гідроксид літію.
Текст
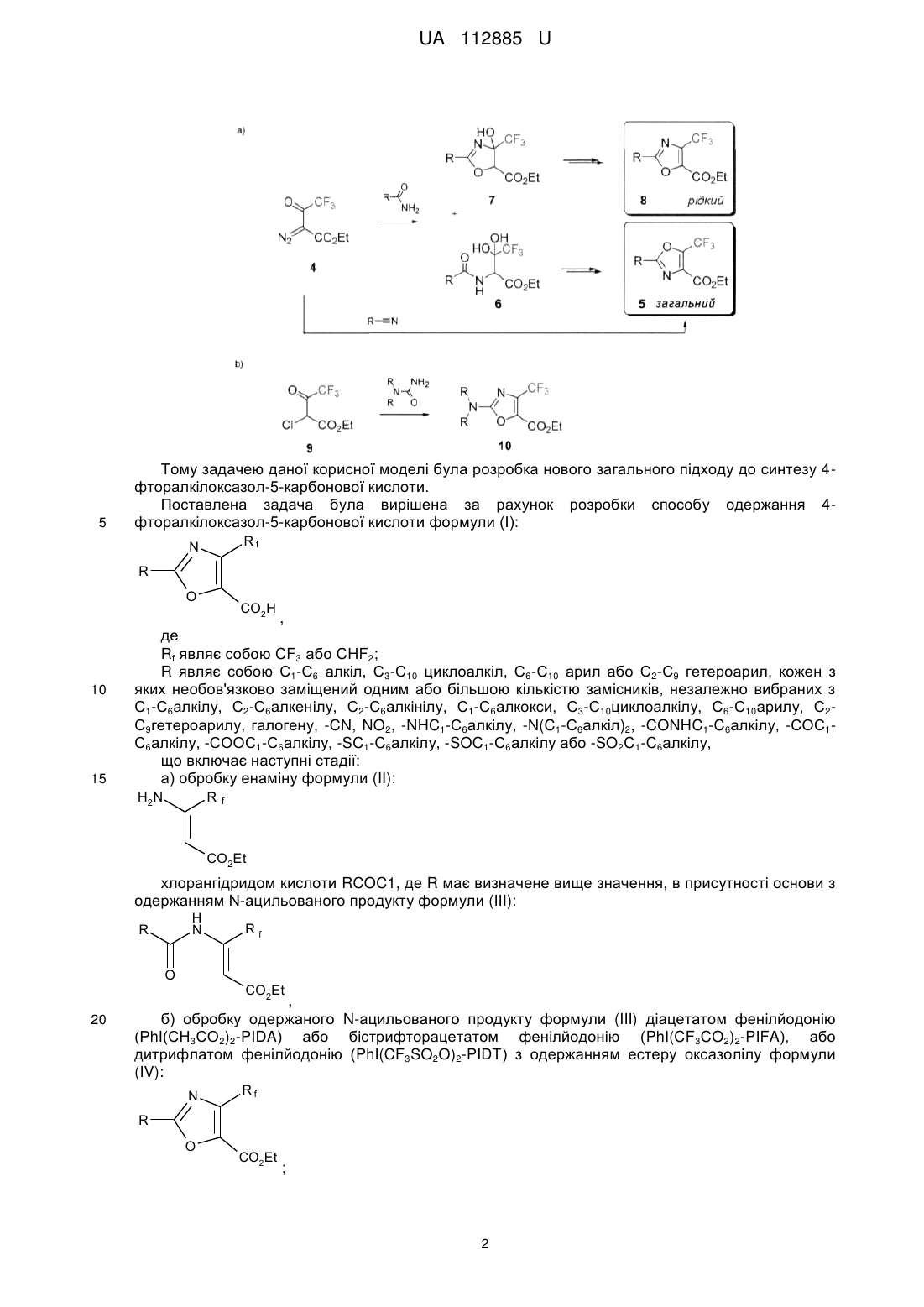
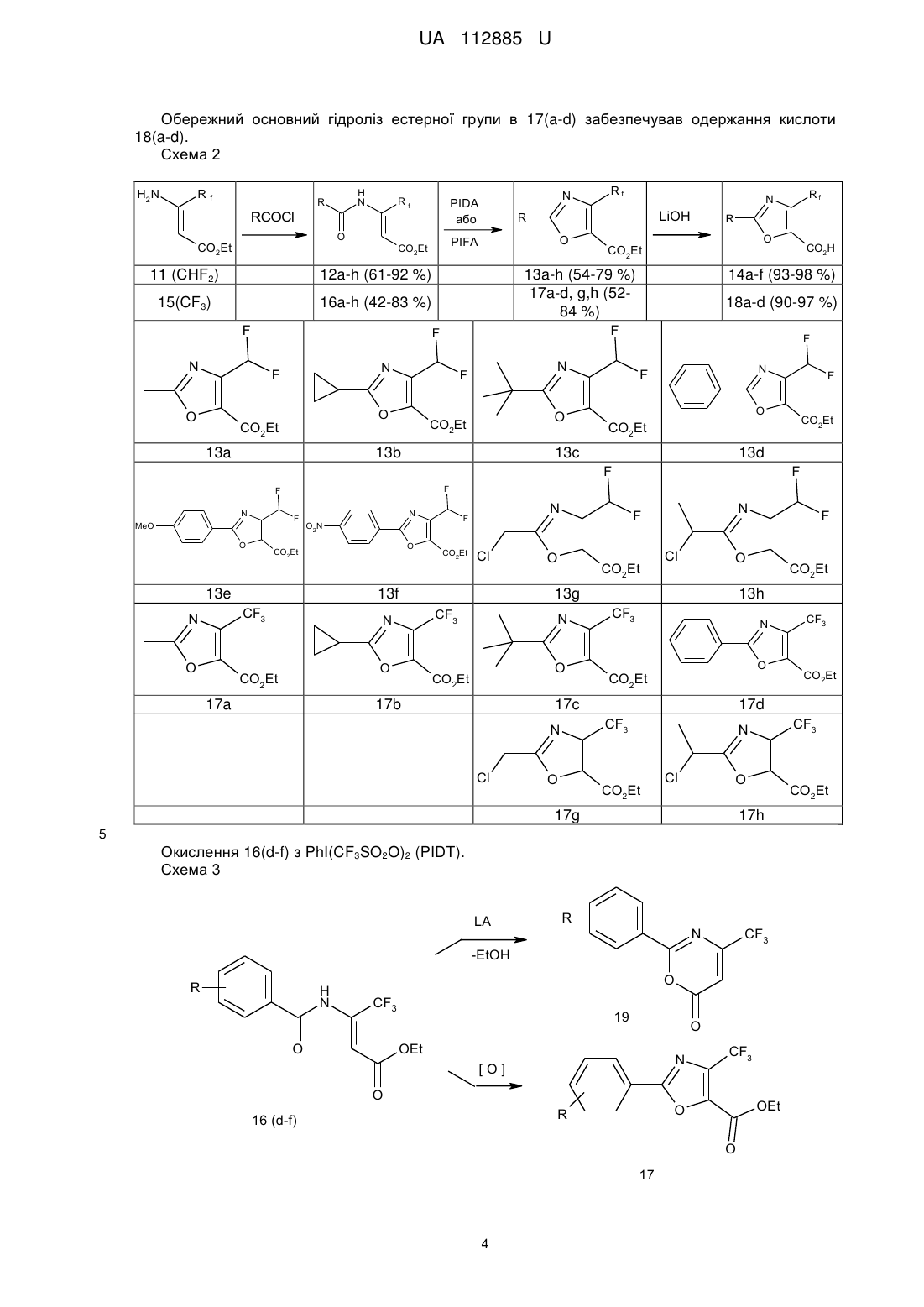
Реферат: Спосіб одержання 4-фторалкілоксазол-5-карбонової кислоти формули (І): Rf N R O CO2H включає наступні стадії: а) обробку енаміну формули (II): H2 N R f CO2Et хлорангідридом кислоти RCOCl, б) обробку одержаного N-ацильованого продукту формули (III) діацетатом фенілйодонію (РhI(СН3СО2)2-PIDA) або бістрифторацетатом фенілйодонію (PhI(CF3CO2)2-PIFA), або дитрифлатом фенілйодонію (PhI(CF3SO2O)2-PIDT) з одержанням естеру оксазолілу формули (IV): N Rf R O CO2Et , в) гідроліз одержаного естеру оксазолілу формули (IV) з використанням основи з одержанням 4-фторалкілоксазол-5-карбонової кислоти формули (І). UA 112885 U (54) СПОСІБ ОДЕРЖАННЯ 4-ФТОРАЛКІЛОКСАЗОЛ-5-КАРБОНОВОЇ КИСЛОТИ UA 112885 U UA 112885 U 5 10 Корисна модель стосується галузі органічної хімії, а саме способу одержання фторованих оксазолів, що знайдуть застосування як цінні вихідні сполуки для синтезу різноманітних фторованих біологічно активних сполук. Ядро оксазолілу широко зустрічається в природних сполуках і лікарських засобах [1], отже, його синтез та модифікація грають важливу роль в промисловості та науці [2]. В той же час, введення фторалкільних груп у відомі гетероциклічні системи, в тому числі оксазол, стало перспективною і широко поширеною тенденцією в сучасній медичній хімії та агрохімії [3, 4]. Наприклад, діацилгліцерол ацилтрансферазні (DGAT-1) інгібітори 1 і 2 були виявлені HoffmannLa Roche у 2011 році [5]. Два роки потому, Merck Laboratories представили сполуку 3 з аналогічною активністю і біологічним профілем [6]. Сполуки 1 та 3 позиціонуються як ліки від ожиріння, сполука 2 - для лікування діабету. Цей приклад показує зростаюче значення фторалкілованого оксазолілу для медичної хімії та високий рівень конкуренції в цій галузі. CF3 CF3 O O H N N H N N O O N CO2H O N N O 1 (DGAT-1 інгібітор, IC50=38 нМ) Hoffmann-La Roche 2 (DGAT-1 інгібітор, IC50=57 нМ) Hoffmann-La Roche CF3 N N H N O O N N Cl H N N O 3 (DGAT-1 інгібітор, IC50=41 нМ) Merck Laboratories 15 20 25 Сполуки 1, 2 та 3 є похідними двох ізомерних СF3-оксазолкарбоксилових кислот. 5-СF3оксазоли 5 легко синтезуються з хорошими виходами з діазоестерів 4 і різноманітних нітрилів [7]; 4-СF3-оксазоли отримують за реакцією між 4 та амідами, яка є дуже трудомісткий бо потребує розділення суміші 6 та 7 (Схема 1, а) [8]. Інший шлях до отримання 4-СF3-оксазол-5карбоксилового ядра базується на реакції естеру 9 з сечовиною (Схема 1, b) [6,9]. Однак, метод був сильно обмежений одержанням 2-амінопохідних 10, оскільки при використанні карбоксамідів утворювалась складна суміш. Отже, 4-СF3-оксазол-5-карбонові кислоти майже недоступні, хоча і мають важливе значення для медичної хімії. Тому розробка легкого загального підходу до синтезу є актуальним завданням. Крім того, можливість ввести інші фтороалкільні групи (наприклад, CHF2) була б великою перевагою методу. Слід зауважити, лише кілька 4-СНF2-оксазолілів згадувалися в літературі отриманням через фторування відповідних альдегідів з R2N-SF3 [10]. Схема 1 1 UA 112885 U 5 Тому задачею даної корисної моделі була розробка нового загального підходу до синтезу 4фторалкілоксазол-5-карбонової кислоти. Поставлена задача була вирішена за рахунок розробки способу одержання 4фторалкілоксазол-5-карбонової кислоти формули (І): Rf N R O 10 15 CO2H , де Rf являє собою CF3 або CHF2; R являє собою С1-С6 алкіл, С3-С10 циклоалкіл, С6-С10 арил або С2-С9 гетероарил, кожен з яких необов'язково заміщений одним або більшою кількістю замісників, незалежно вибраних з С1-С6алкілу, С2-С6алкенілу, С2-С6алкінілу, С1-С6алкокси, С3-С10циклоалкілу, С6-С10арилу, С2С9гетероарилу, галогену, -CN, NO2, -NHC1-С6алкілу, -N(C1-С6алкіл)2, -CONHC1-C6алкілу, -СОС1С6алкілу, -СООС1-С6алкілу, -SC1-C6алкілу, -SOC1-С6алкілу або -SO2C1-C6алкілу, що включає наступні стадії: а) обробку енаміну формули (II): H2 N R f CO2Et хлорангідридом кислоти RCOC1, де R має визначене вище значення, в присутності основи з одержанням N-ацильованого продукту формули (III): H N R O 20 Rf CO2Et , б) обробку одержаного N-ацильованого продукту формули (III) діацетатом фенілйодонію (РhI(СН3СО2)2-PIDA) або бістрифторацетатом фенілйодонію (PhI(CF3CO2)2-PIFA), або дитрифлатом фенілйодонію (PhI(CF3SO2O)2-PIDT) з одержанням естеру оксазолілу формули (IV): N Rf R O CO2Et ; 2 UA 112885 U 5 10 15 20 25 30 35 40 45 50 55 в) гідроліз одержаного естеру оксазолілу формули (IV) з використанням основи з одержанням 4-фторалкілоксазол-5-карбонової кислоти формули (І). На стадії а) як основа може бути використана органічна основа, така як піридин. На стадії в) як основа може бути використана неорганічна основа, така як гідроксид літію. Як зазначається вище, термін "галоген" означає хлор, бром, йод та фтор. Термін "С1-С6алкіл" стосується алкільного радикала, що має від одного до шести атомів вуглецю, і має нерозгалужену або розгалужену будову. Прикладами алкільних груп є, але не обмежується, метил, етил, пропіл, ізопропіл, бутил, ізобутил, втор-бутил, тpeт-бутил, пентил, 2пентил, 3-пентил, ізопентил, неопентил, (R)-2-метилбутил, (S)-2-метилбутил, 3-метилбутил, 2,3диметилпропіл, 2,3-диметилбутил, гексил і т.і. Термін "С1-С6алкокси", стосується алкокси радикалу, що має від одного до шести атомів вуглецю, що мають нерозгалужену або розгалужену будову. Алкокси групами є, але не обмежується, метокси, етокси, пропокси, ізопропокси, бутокси, гексилокси і т.і. Термін "С3-С10 циклоалкіл", як тут використовується, стосується моно, конденсованих або місткованих біциклічних або трициклічних карбоциклічних кілець, що містять, в деяких втіленнях, від трьох до десяти атомів вуглецю. Як тут використовується, циклоалкільні кільця можуть необов'язково містити один або два подвійні зв'язки. Термін "циклоалкіл" також включає спіроциклоалкільні групи, включаючи поліциклічні системи, зв'язані через один атом. Циклоалкільними групами є, але не обмежується, циклопропіл, циклобутил, циклопентил, циклогексил, циклогептил, циклопентеніл, циклогексеніл, біцикло[2,2,1]гептаніл, біцикло[3,2,1]октаніл, біцикло[5,2,0]нонаніл, адамантил і т.і. Термін "С6-С10арил", як тут використовується, стосується групи, що походить від ароматичного вуглеводню, що містить від шести до десяти атомів вуглецю. Прикладами таких груп є, але не обмежується, феніл і нафтил. Термін "арил" також включає конденсовані поліциклічні ароматичні системи, в яких ароматичне кільце є конденсованим з одним або більше кілець. Прикладами є, але не обмежується, 1-нафтил, 2-нафтил, 1-антрацил і 2антрацил. Також включеними в межі рамок терміну "арил", як тут використовується, є група, в якій ароматичне кільце є конденсованим з одним або більше неароматичних кілець, таким як інданіл, фенантридиніл або тетрагідронафтил, де радикал або точка приєднання знаходиться на ароматичному кільці. Термін "С2-С9 гетероарил, як тут використовується, стосується ароматичної моноциклічної або біциклічної гетероциклічної групи, що має загалом від 5 до 9 атомів в кільці, і що містить від 2 до 9 атомів вуглецю і від одного до чотирьох гетероатомів, що незалежно вибирають з азоту, кисню і сірки, за умови, що кільце згаданої групи не містить два сусідні атоми кисню або два сусідні атоми сірки. Гетероарильні групи є бензоконденсованими циклічними системами. Прикладами гетероарильних груп є, але не обмежується, піроліл, фурил, тієніл, імідазоліл, піразоліл, оксазоліл, ізоксазоліл, ізотіазоліл, триазоліл, оксадіазоліл, фуразаніл, тіадіазоліл, тіазоліл, тетразоліл, піридиніл, піразиніл, піримідил, піридазиніл, триазиніл, індоліл, ізоіндоліл, індолізиніл, бензофураніл, бензотіофеніл, індазоліл, бензімідазоліл, бензоксазоліл, фуро[3,26]піридиніл, бензотіазоліл, бензофуразаніл, пуриніл, хінолініл, ізохінолініл, хіназолініл, хіноксалініл, нафтиридиніл, цинолініл, фталазиніл, піридо[3,4-d]піримідил, птеридиніл і т.і. Синтез СНF2-похідних проводили першим. Обробка сполуки 11 хлорангідридами кислот / піридином забезпечила одержання N-ацилпродуктів 12a-f (Схема 2). Можливе С-ацилювання не спостерігалося, що повністю узгоджується з літературними даними. Обробка енамідів 12а-е діацетатом фенілйодонію (РhI(СН3СО2)2-PIDA) забезпечувало необхідний оксазоліл ІЗа-е з виходом 50-80 %. І, нарешті, проводили стандартний гідроліз естерної групи за допомогою LiOH з одержанням цільової кислоти 14a-f. Далі проводили синтез СFз-оксазолілу. Ацилювання енамінів 15 забезпечувало енамід 16a-h з помірними виходами. Всі спроби, проте, виконати окиснювальну циклізацію з 16а-h з використанням PIDA забезпечували низьке перетворення і побічні продукти. Після цього був застосований більш активний бістрифторацетат фенілйодоній (РhI(СF3СО2)2-PIFA). Його легко одержати т situ з PIDA, а також з трифтороцтової кислоти або її ангідриду. Насправді, реакція легко протікала з отриманням СF3-оксазолу 17(a-c, g,h) з 50-80 % виходом. Проте, ароматичні єнаміди 16d-16f ніяк не прореагували. Використання ще більш потужного окиснювача - дитрифлату фенілйодонію (PhI(CF3SO2O)2-PIDT) дозволило синтезувати оксазол 17d з виходом 52 %. У всіх випадках спостерігалося формування оксазинів 19. При синтезі 17d обидві реакції відбувалися паралельно, в той час як переважало формування єнамідів оксазинів 16e/16f. 3 UA 112885 U Обережний основний гідроліз естерної групи в 17(a-d) забезпечував одержання кислоти 18(a-d). Схема 2 H2 N R f H N R Rf RCOCl O CO2Et N PIDA або 11 (CHF2) 12a-h (61-92 %) 15(CF3) 16a-h (42-83 %) F 13a O CO2Et 13b 14a-f (93-98 %) 18a-d (90-97 %) N F O 13c F O N 13d O CO2Et CO2Et Cl 13f CF3 O F N F O2N 13e N CO2Et F F N F CO2Et F MeO CO2H F N F O CO2Et O CO2Et F N F R 13a-h (54-79 %) 17a-d, g,h (5284 %) F N O LiOH O Rf N R PIFA CO2Et Rf O CO2Et 17a O CO2Et Cl N O CO2Et 17b Cl N O CO2Et CO2Et Cl O 17g CO2Et 17h Окислення 16(d-f) з PhI(CF3SO2O)2 (PIDT). Схема 3 R N CF3 -EtOH R H N O CF3 O 19 O OEt N [O] O CF3 OEt O R 16 (d-f) O 17 4 CO2Et CF3 N 5 LA CF3 17d CF3 O CO2Et 13h CF3 17c N F O 13g CF3 N N F UA 112885 U 5 10 15 20 25 30 35 40 45 50 55 60 Дана корисна модель привела до розробки нового простого і зручного підходу до 4-CF3 і 4СНF2-оксазол-5-карбонових кислот. Синтез оснований на добре відомих і легкодоступних вихідних матеріалах і включає в себе послідовність 3-х стадій. Ключовими перетвореннями є замикання кільця окисненого оксазолу, індуковане реагентами йоду (III), в той час як дві інші стадії є звичайними і рутинними. Щодо обох (CF2H та CF3) серій були розроблені належні методи утворення цільових кислот з хорошими виходами у промисловому масштабуванні. Наявність отриманих будівельних блоків має високий потенціал для фармацевтичної хімії. Експериментальна частина Загальна інформація Енаміни 11 та 15 були підготовлені належним чином. Хлорангідриди також були доступними і синтезованими з відповідних кислот стандартними методами. Інші реагенти і розчинники були комерційно доступними. Точки плавлення визначали у відкритих капілярних трубках в апараті 1 13 19 Thiele і не корегували. Н, С, та F ЯМР спектри були отримані на Bruker Avance 500 (500 МГц 1 13 1 13 для Н, 125 МГц для С) та Mercury Varian 400 (400 МГц для Н, 100 МГц для С та 376 МГц 19 для F) спектрометрах в CDCl3 чи DMSO[D6] розчинах. Хімічні зсуви (5) подані в м.ч. на відміну 1 13 19 від внутрішніх Me4Si (для Н та С) чи CFCl2 (для F). Елементний аналіз проводили у відділі Інституту органічної хімії НАН, Київ, Україна. Чистота всіх приготованих сполук перевірялася на РХ-МС на інструменті Agilent 1100. Енаміди 12a-fma 16a-f. Основна методика. Хлорангідрид карбонової кислоти (66,7 ммоль) додавали однією порцією до розчину відповідного енаміну 11, 15 (60,6 ммоль) в 1,2-дихлоретані (200 мл) при кімнатній температурі. До нього ж також однією порцією додавали піридин (8,6 мл, 106 ммоль) і розчин перемішували при кип'ятінні зі зворотним холодильником протягом 16 год. Розчинник випарювали у вакуумі і залишок розподіляли між водою (200 мл) і етилацетатом (200 мл). Органічний шар відокремлювали і промивали послідовно водою (2 × 150 мл), насиченим водним розчином NaHCO3 (100 мл) і сольовим розчином (100 мл) і сушили (MgSO4). Після випарювання екстракту в вакуумі отримували очищені сполуки 12a-f, 16a-f у вигляді олій, які використовували на наступній стадії без додаткового очищення. Аналітичні зразки матеріалів очищали за допомогою колонкової хроматографії на силікагелі, як елюент використовували суміш етилацетат-гексан (1:3, об/об). Етил 3-ацетиламіно-4,4-дифторобут-2-еноат (12а) Жовтувата олія (11,4 г, 91 %). 1 Н ЯМР (CDCl3, 400 МГц): =1,23 (т, J=7,3 Гц, 3 Н, CH2CH3), 2,10 (с, 3 Н, Me), 4,15 (к, J=7,3 2 Гц, 2Н, СH2СН3), 5,57 (с, 1 Н, СН), 7,20 (т, JH-F=54,2 Гц, 1 Н, CHF2), 10,67 (ш с, 1 Н, NH) м.ч. 13 3 С ЯМР (CDCl3, 100 МГц): =14,0 (СН2СН3), 24,2 (Me), 60,9 (СН2СН3), 96,9 (т, JC-F=10,0 Гц, 1 2 СН), 108,5 (т, JC-F=242,0 Гц, CHF2), 146,7 (т, JC-F=23,5 Гц, C-CHF2), 168,3, 168,4 м.ч. 19 2 F ЯМР (CDCl3, 376 МГц, ): = - 122,84 (д, JH-F=54,0 Гц, CHF2) м.ч. + МС: m/z=208 [М + Н] . Елементний аналіз для C8H11F2NO3: С, 46,38; Н, 5,35; N, 6,76. Визначено: С, 46,44; Н, 5,30; N, 6,81. Етил 3-[(циклопропілкарбоніл)аміно]-4,4-дифторобут-2-еноат (12b) Жовтувата олія (13,8 г, 89 %). 1 Н ЯМР (CDCl3, 400 МГц): =0,89-0,94 (м, 2 H, СН2), 1,04-1,08 (м, 2 Н, СН2), 1,31 (т, J=7,0 Гц, 2 3 Н, СН2СH3), 1,57-1,63 (м, 1 Н, СН), 4,23 (к, J=7,0 Гц, 2 Н, СH2СН3), 5,64 (с, 1 Н, СН), 7,27 (т, JHF=54,0 Гц, 1 Н, CHF2), 10,99 (ш с, 1 Н, NH) м.ч. 13 С ЯМР (CDCl3, 100 МГц): =9,1 (2СН2), 14,0 (СН2СН3), 15,8 (СН), 60,9 (СН2СН3), 96,3 (т, 3 1 2 JC-F- = 9,5 Гц, СН), 108,5 (т, JC-F=242,0 Гц, CHF2), 146,9 (т, JC-F=23,5 Гц, C-CHF2), 168,6 (CO2Et), 172,1 (СО) м.ч. 19 2 F ЯМР (CDCl3, 376 МГц, ): = - 122,51 (д, JH-F=54,0 Гц, CHF2) м.ч. + МС: m/z=234 [М + Н] . Елементний аналіз для C10H13F2NO3: С, 51,50; Н, 5,62; N, 6,01. Визначено: С, 51,41; Н, 5,59; N, 5,89. Етил 3-[(2,2-диметилпропаноїл)аміно]-4,4-дифторобут-2-еноат (12с) Жовтувата олія (11,1 г, 75 %). 1 Н ЯМР (CDCl3, 400 МГц): -1,27 (с, 9 Н, С(СН3)3), 1,30 (т, J=7,0 Гц, 3Н, СН2СH3), 4,22 (к, 2 J=7,0 Гц, 2 Н, СH2СН3), 5,66 (с, 1Н, СН), 7,29 (т, JH-F=54,2 Гц, 1 Н, CHF2), 11,07(ш с, 1 H, NH) m.h. 13 С ЯМР (CDCl3, 100 МГц): 6=14,0 (СН2СН3), 27,2 (С(СН3)5), 40,0 (С(СН3)3), 60,9 (СН2СН3), 1 2 97,0 (т, C-F=9,5 Гц, СН), 108,7 (т, JC-F=241,4 Гц, CHF2), 147,3 (т, JC-F=23,5 Гц, C-CHF2), 168,7 (CO2Et), 177,2 (СО) мл. 5 UA 112885 U F ЯМР (CDCl3, 376 МГц, ): = - 122,74 (д, JH-F=54,0 Гц, CHF2) м.ч. + MC:w/z=250[M+H] . Елементний аналіз для C11H17F2NO3: С, 53,01; Н, 6,87; N, 5,62. Визначено: С, 52,93; Н, 6,92; N, 5,69. Етил 3-бензоїламіно-4,4-дифторобут-2-еноат (12d) Біла тверда речовина (13,5 г, 82 %) Тпл. 65 °C. 1 Н ЯМР (CDCl3, 400 МГц): =1,36 (т, J=6,8 Гц, 3Н, СН2СH3), 4,30 (к, = 6,8 Гц, 2 Н, СH2СН3), 2 5,82 (с, 1Н, СН), 7,51 (т, JH-F=53,7 Гц, 1 Н, CHF2), 7,53 (т, J=7,8 Гц, 2 Н, 2HPh), 7,61 (т, J=7,8 Гц, 1 Н, HPh), 7,99 (д, J=7,8 Гц, 2 Н, 2HPh), 11,83 (ш с, 1 Н, NH) м.ч. 13 3 С ЯМР (CDCl3, 100 МГц): =14,1 (СН2СН3), 61,1 (СН2СН3), 97,7 (т, JC-F-10,3 Гц, СН), 108,8 1 2 (т, JC-F=242,1 Гц, CHF2), 127,8 (2CHPh), 129,0 (2CHPh), 132,5 (СPh), 133,0 (СНPh), 147,3 (т, JCF=23,5 Гц, C-CHF2), 164,7, 169,0 м.ч. 19 2 F ЯМР (CDCl3, 376 МГц, ): = - 122,39 (д, JH-F=54,0 Гц, CHF2) м.ч. + MC:w/z=270[M+H] . Елементний аналіз для C13H13F2NO3: С, 57,99; Н, 4,87; N, 5,20. Визначено: С, 58,04; Н, 4,91; N, 5,18. Етил 4,4-дифторо-3-[(4-метоксибензоїл)аміно]бут-2-еноат (12е) Біла тверда речовина (12,1 г, 67 %) Тпл. 63 °C. 1 Н ЯМР (CDCl3, 400 МГц): =1,36 (т, J=7,0 Гц, 3 Н, СН2СH3), 3,89 (с, 3 Н, ОМе), 4,29 (к, J=7,0 2 Гц, 2 Н, СH2СН3), 5,78 (с, 1 Н, СН), 7,00 (д, J=8,8 Гц, 2 Н, 2НАr), 7,51 (т, JH-F=54,2 Гц, 1 Н, CHF2), 7,96 (д, J=8,8 Гц, 2 Н, 2НАr), 11,76 (ш с, 1 Н, NH) м.ч. 13 3 С ЯМР (CDCl3, 100 МГц): =14,2 (СН2СН3), 55,5 (ОМе), 61,0 (СН2СН3), 97,0 (т, JC-F=9,5 Гц, 1 2 СН), 108,8 (т, JC-F=242,1 Гц, CHF2), 114,2 (2СНАг), 124,8 (СAr), 129,9 (2СНAr), 147,6 (т, JC-F=23,5 Гц, C-CHF2), 163,4, 164,2, 169,1 м.ч. 19 2 F ЯМР (CDCl3, 376 МГц, ): = - 122,31 (д, JH-F=54,0 Гц, CHF2) м.ч. + МС: m/z=300 [М + Н] . Елементний аналіз для C14H15F2NO4: С, 56,19; Н, 5,05; N, 4,68. Визначено: С, 56,09; Н, 4,97; N, 4,75. Етил 4,4-дифторо-3-[(4-нітробензоїл)аміно]бут-2-еноат (12/) Жовта тверда речовина (11,6 г, 61 %) Тпл. 78 °C. 1 Н ЯМР (DMSO[D6], 500 МГц): =1,23 (т, J=7,1 Гц, 3 Н, СН2СH5), 4,20 (к, J=7,1 Гц, 2 Н, 2 СH2СН3), 5,88 (с, 1 Н, СН), 7,29 (т, JH-F=54,1 Гц, 1 Н, CHF2), 8,13 (д, J=8,8 Гц, 2 Н, 2HAr), 8,41 (д, J-8,8 Гц, 2 Н, 2НAr), 11,34 (с, 1 Н, NH) м.ч. 13 3 С ЯМР (DMSO[D6], 125 МГц): =14,0 (СН2СН3), 61,0 (СН2СН3), 103,0 (т, JC-F=9,0 Гц, СН), 1 2 109,8 (т, JC-F=240,8 Гц, CHF2), 124,2 (2CHAr), 129,2 (2CHAr), 138,0 (CAr), 144,2 (t, JC-F=23,4 Гц, C-CHF2), 150,0 (C-NO2), 162,9, 166,8 м.ч. 19 2 F ЯМР (DMSO[D6], 376 МГц, ): = - 121,22 (д, JH-F=53,5 Гц, CHF2) м.ч. + MC:w/z=315[M+H] . Елементний аналіз для C13Hi2F2N2C»5: С, 49,69; Н, 3,85; N, 8,91. Визначено: С, 49,78; Н, 3,77; N, 9,02. Етил 3-ацетиламіно-4,4,4-трифторобут-2-еноат (16а) Жовтувата олія (11,3 г, 83 %). 1 Н ЯМР (CDCl3, 400 МГц): =1,26 (т, J=7,3 Гц, 3 Н, СН2СH5), 2,13 (с, 3 Н, Me), 4,19 (к, 7=7,3 Гц, 2 Н, СH2СН3), 5,77 (с, 1 Н, СН), 10,17 (ш с, 1 Н, NH) м.ч. 13 3 С ЯМР (CDCl3, 100 МГц): =13,8 (СН2СН3), 24,1 (Me), 61,3 (СН2СН3), 103.5 (к, JC-F=5,9 Гц, 1 2 СН), 119,7 (к, JC-F=275,1 Гц, CF3), 139,4 (к, JC-F=35,9 Гц, C-CF3), 166,6, 167,0 мл. 19 F ЯМР (CDCl3, 376 МГц, ): = - 66,32 (с, CF3) м.ч. + MC:m/z=226[M+H] . Елементний аналіз для C8H10F3NO3: С, 42,67; Н, 4,48; N, 6,22. Визначено: С, 42,74; Н, 4,39; N, 6,11. Етил 3-[(циклопропілкарбоніл)аміно]-4,4,4-трифторобут-2-еноат (16b) Жовтувата олія (11,7 г, 77 %). 1 Н ЯМР (CDC13, 500 МГц): =0,87-0,89 (ш м, 2 Н, СН2), 1,05 (ш с, 2 Н, СН2), 1,29 (т, J=7,0 Гц, 3 Н, СН2СH3), 1,58-1,60 (ш м, 1 Н, СН), 4,22 (ш к, J=7,0 Гц, 2 Н, СH2СН3), 5,74 (с, 1 Н, СН), 10,61 (ш с, 1 Н, NH) м.ч. 13 С ЯМР (CDCl3, 125 МГц): =9,2 (2СН2), 14,1 (СН2СН3), 16,0 (СН), 61,5 (СН2СН3), 101,8 (к, 3 1 2 JC-F=6,0 Гц, СН), 119,8 (к, JC-F=275,3 Гц, CF3), 140,4 (к, JC-F=35,9 Гц, C-CF3), 167,7, 170,5 м.ч. 19 F ЯМР (CDCl3, 376 МГц, ): = - 65,66 (с, CF3) м.ч. + MC:m/z=252[M+H] . 19 5 10 15 20 25 30 35 40 45 50 55 2 6 UA 112885 U 5 10 15 20 25 30 35 40 45 50 55 Елементний аналіз для C10H12F3NO3: С, 47,81; Н, 4,81; N, 5,58. Визначено: С, 47,93; Н, 4,89; N, 5,65. Етил 3-[(2,2-диметилпропаноїл)аміно]-4,4,4-трифторобут-2-еноат (16с) Жовтувата олія (9,5 г, 59 %). 1 Н ЯМР (CDCl3, 500 МГц): =1,27-1,30 (м, 12 Н, С(СН3)3 + СН2СН3), 4,23 (к, J=7,1 Гц, 2 Н, СH2СН3), 5,76 (с, 1 Н, СН), 10,72 (ш с, 1 Н, NH) м.ч. 13 С ЯМР (CDCl3, 125 МГц): =14,1 (СН2СН3), 27,3 (C(CH3)3), 40,3 (С(СН3)3), 61,5 (СН2СН3), 3 1 2 102,0 (к, JC-F=6,0 Гц, СН), 119,9 (к, JC-F=274,8 Гц, CF3), 141,6 (к, JC-F=35,4 Гц, C-CF3), 167,9, 175,5 м.ч. 19 F ЯМР (CDCl3, 376 МГц, ): = - 65,34 (с, CF3) м.ч. + МС: m/z=268 [М + Н] . Елементний аналіз для C11H16F3NO3: С, 49,44; Н, 6,03; N, 5,24. Визначено: С, 49,54; Н, 5,97; N, 5,29. Етил 3-бензоїламіно-4,4,4-трифторобут-2-еноат (16d) Біла тверда речовина (11,6 г, 58 %) Тпл. 89 °C. 1 Н ЯМР (CDCl3, 400 МГц): =1,36 (т, J=7,0 Гц, 3 Н, СН2CH3), 4,31 (к, J=7,0 Гц, 2 Н, СH2СН3), 5,92 (с, 1 Н, СН), 7,53 (т, J=7,5 Гц, 2 Н, 2HPh), 7,61 (т, J=7,5 Гц, 1 Н, HPh), 8,01 (д, J=7,5 Гц, 2 Н, 2HPh), 11,53 (ш с, 1 Н, NH) м.ч. 13 3 С ЯМР (CDCl3, 100 МГц): =14,1 (СН2СН3), 61,6 (СН2СН3), 102,2 (к, JC-F=5,9 Гц, СН), 119,8 3 2 (к, JC-F=275,1 Гц, CF3), 127,9 (2CHPh), 129,0 (2CHPh), 132,7 (CPh), 132,9 (CHPh), 141,5 (к, JCF=35,9 Гц, C-CF3), 163,0, 168,1 м.ч. 19 F ЯМР (CDCI3, 376 МГц, ): = - 64,96 (с, CF3) м.ч. + MC:m/z=288 [M+H] . Елементний аналіз для C13H12F3NO3: С, 54,36; H, 4,21; N, 4,88. Визначено: С, 54,42; Н, 4,17; N, 4,91. Етил 4,4,4-трифторо-3-[(4-метоксибензоїл)аміно]бут-2-еноат (16е) Біла тверда речовина (9,4 г, 49 %) Тпл. 84 °C. 1 Н ЯМР (CDCl3, 400 МГц): =1,31 (т, J=7,3 Гц, 3 Н, СН2СH3), 3,84 (с, З Н, ОМе), 4,25 (к, J=7,3 Гц, 2 Н, СH2СН3), 5,83 (с, 1 Н, СН), 6,96 (д, J=8,8 Гц, 2 Н, 2НAr), 7,93 (д, J=8,8 Гц, 2 Н, 2НAr), П, 45 (ш с, 1 Н, NH) м.ч. 13 3 С ЯМР (CDCl3, 100 МГц): =14,1 (СН2СН3), 55,5 (ОМе), 61,5 (СН2СН3), 101,4 (к, JC-F=6,6 Гц, 2 2 СН), 114,2 (2CHAr), 119,8 (к, JC-F=275,1 Гц, CF3), 125,0 (CAr), 130,0 (2CHAr), 141,8 (к, JC-F=35,9 Гц, C-CF3), 162,5, 163,4, 168,3 мл. 19 F ЯМР (CDCl3, 376 МГц, ): = - 64,84 (с, CF3) мл. + MC:w/r=318[M+H] . Елементний аналіз для C14H14F3NO4: С, 53,00; Н, 4,45; N, 4,41. Визначено: С, 52,94; Н, 4,41; N, 4,36. Етил 4,4,4-трифторо-3-[(4-нітробензоїл)аміно]бут-2-еноат (16f) Жовта тверда речовина (8,5 г, 42 %) Тпл. 93 °C. 1 Н ЯМР (DMSO[D6], 400 МГц): =1,33 (т, J=7,0 Гц, 3 Н, СН2СЯ3), 4,28 (к, J=7,0 Гц, 2 Н, СЯ2СН3), 5,94 (с, 1 Н, СН), 8,13 (д, J=8,5 Гц, 2 Н, 2НАr), 8,33 (д, J=8,5 Гц, 2 Н, 2НАr), 11,70 (ш с, 1 Н, NH) м.ч. 13 3 С ЯМР (DMSO[D6], 100 МГц): =14,0 (СН2СН3), 62,0 (СН2СН3), 103,4 (к, JC-F=5,9 Гц, СН), 1 2 119,6 (к, JC-F=275,1 Гц, CF3), 124,2 (2CHAr), 129,1 (2CHAr), 138,1 (CAr), 140,9 (к, JC-f=36,7 Гц, CCF3), 150,3 (C-NO2), 161,0, 168,2 м.ч. 19 F ЯМР (CDCl3, 376 МГц, ): = - 65,21 (c, CF3) м.ч. + MC:m/z=333[M+H] . Елементний аналіз для C13H11F3N2O5: С, 47,00; H, 3,34; N, 8,43. Визначено: С, 47,08; Н, 3,36; N, 8,40. Енаміди 12 g, h та 16 g, h. Основна методика. Хлорацетил або 2-хлорпропіонілхлорид (106 ммоль) додавали одну порцію до розчину відповідного енаміну 11, 15 (60,6 ммоль) в безводному діоксані (100 мл) при кімнатній температурі; одержану суміш перемішували при температурі кипіння зі зворотним холодильником протягом 24 годин. Розчинник випарювали у вакуумі, і залишок розподіляли між водою (150 мл) і етилацетатом (150 мл). Органічний шар відокремлювали і промивали послідовно водою (100 мл), насиченим водним розчином NaHCO3 (2 100 мл) і сольовим розчином (100 мл) і сушили (MgSO4). Випаровування екстракту в вакуумі забезпечувало одержання неочищеної сполуки 12g, h, 16g, h у вигляді олії, яку використовували на наступній стадії без додаткового очищення. Аналітичні зразки матеріалів очищали за допомогою 7 UA 112885 U 5 10 15 20 25 30 35 40 45 50 55 колонкової хроматографії на силікагелі, як елюент використовували суміш етилацетат - гексан (1:3, об./об.). Етил 3-[(хлорацетил)аміно]-4,4-дифторобут-2-еноат (12g) Жовтувата олія (14,1 г, 92 %). 1 Н ЯМР (CDCl3, 500 МГц): =1,25 (т, J=7,1 Гц, 3 Н, СН2СH3), 4,09 (с, 2 Н, СН2Сl), 4,19 (к, J=7,1 2 Гц, 2 Н, СЯ2СН3), 5,70 (с, 1 Н, СН), 7,18 (т, JH-F=54,1 Гц, 1 Н, CHF2), 11,52 (ш с, 1 Н, NH) м.ч. 13 3 С ЯМР (CDCl3, 125 МГц): =13,5 (СН2СН3), 42,0 (СН2Сl), 60,8 (СН2СН3), 99,1 (т, JC-F=9,5 Гц, 1 2 СН), 108,0 (т, JC-F=241,8 Гц, CHF2), 144,9 (т, JC-F=23,4 Гц, C-CHF2), 164,4, 167,4 мл. 19 2 F ЯМР (CDCl3, 376 МГц, ): = - 122,90 (д, .W=53,5 Гц, CHF2) м.ч. + MC:m/z=242[M+H] . Елементний аналіз для C8H10ClF2NO3: С, 39,77; Н, 4,17; N, 5,80. Визначено: С, 39,88; Н, 4,25; N, 5,76. Етил 3-[(2-хлоропропаноїл)аміно]-4,4-дифторобут-2-еноат (12h) Жовтувата олія (14,2 г, 92 %). 1 Н ЯМР (CDCl3, 400 МГц): 3=1.29 (т, J=7,0 Гц, 3 Н, СН2СН3), 1,73 (д, J=7,0 Гц, 3 Н, СН(СH3)Сl), 4,23 (к, J=7,1 Гц, 2 Н, СH2СН3), 4,45 (к, J=7,0 Гц, 1 Н, СH(СН3)Сl), 5,74 (с, 1 Н, СН), 2 7,22 (т, JH-F-54,2 Гц, 1 Н, CHF2), 11,53 (ш с, 1 Н, NH) м.ч. 13 С ЯМР (CDCl3, 100 МГц): -14,0 (СН2СН3), 21,9 (СН(СН3)Сl), 54,9 (СН(СН3)Сl), 61.1 3 1 2 (СН2СН3), 99,4 (т, JC-F=9,5 Гц, СН), 108,4 (т, JC-F=242,1 Гц, CHF2), 145,6 (т, JC-f=24.2 Гц, CCHF2), 167,9, 168,2 м.ч. 19 2 2 F ЯМР (CDCl3, 376 МГц, ): =- 122,91 і - 122,46 (2д, JH-F=53,5 Гц і JH-F-54,0 Гц, CHF2) м.ч. + МС: m/z=256 [М + Н] . Елементний аналіз для C9H12ClF2NO3: С, 42,28; Н, 4,73; N, 5,48. Визначено: С, 42,14; Н, 4,79; N, 5,39. Етил 3-[(хлороацетил)аміно]-4,4,4-трифторобут-2-еноат (16g) Жовтувата олія (12,2 г, 78 %). 1 Н ЯМР (CDCl3, 400 МГц): =1,35 (т, J=7,3 Гц, 3 Н, СН2СH5), 4,18 (с, 2 Н, СН2Сl), 4,30 (к, 7=7,3 Гц, 2Н, СH;СН3), 5,95 (с, 1 Н, СН), 11,19 (ш с, 1 H, NH)m.4. 13 3 С ЯМР (CDCl3, 100 МГц): =14,0 (СН2СН3), 42,7 (СН2Сl), 61,7 (СН2СН3), 105,0 (к, JC-f-5,9 Гц, 1 СН), 119,6 (к, JC-F=275,1 Гц, CF3), 139,0 (к, 2JC-f=35,9 Гц, C-CF3), 162,9, 168,8 м.ч. 19 F ЯМР (CDCl3, 376 МГц, ): = - 65,65 (с, CF3) м.ч. + МС: m/z=260 [М + Н] . Елементний аналіз для C8H9ClF3NO3: С, 37,01; Н, 3,49; N, 5,40. Визначено: С, 37,10; Н, 3,46; N, 5,37. Етил 3-[(2-хлоропропаноїл)аміно]-4,4,4-трифторобут-2-еноат (16h) Жовтувата олія (12,1 г, 73 %). 1 Н ЯМР (CDCl3, 400 МГц): =1,32 (т, J=7,3 Гц, 3 Н, СН2СH5), 1,77 (д, J=6,8 Гц, 3 Н, СН(СH3)СІ), 4,28 (к, J=7,3 Гц, 2 Н, ОДСН3), 4,49 (к, J=6,8 Гц, 1 Н, СЯ(СН3)С1), 5,92 (с, 1 Н, СН), 11,09 (ш с, 1 Н, NH) м.ч. 13 С ЯМР (CDCl3, 100 МГц): =14,0 (СН2СН3), 22,0 (СН(СН3)Сl), 55,1 (СН(СН3)Сl), 61,6 3 1 2 (СН2СН3), 104,8 (к, JC-f=5,9 Гц, СН), 119,6 (к, JC-f=275,1 Гц, CF3), 139,3 (к, JC-f=35,9 Гц, C-CF3), 166,4, 166,8 м.ч. 19 F ЯМР (CDCl3, 376 МГц, ): = - 65,72 (с, CF3) м.ч. + MC:m/z=274[M+H] . Елементний аналіз для C9H11ClF3NO3: С, 39,50; Н, 4,05; N, 5,12. Визначено: С, 39,59; Н, 3,99; N, 5,11. Етил 4-дифторометилоксазол-5-карбоксилати 13а-h. Основна методика. PIDA (10.2 г, 56 ммоль) обережно додавали невеликими порціями до перемішуваного розчину відповідного енаміду 12a-h (40 ммоль) і комплексу Et2O-BF3 (16,8 мл, 80 ммоль) в 1,2дихлоретані (200 мл). Додавання займає ~ 30 хв. Після того як стадія була завершена отриману суміш перемішували при температурі кипіння зі зворотним холодильником протягом ночі. Після охолодження розчинник видаляли у вакуумі і залишок розподіляли між водою (300 мл) і етилацетатом (200 мл). Органічний шар відокремлювали і промивали послідовно водою (200 мл), насиченим водним розчином NaHCO3 (200 мл) і сольовим розчином (200 мл) і сушили (MgSO4). Розчинник випарювали у вакуумі, а залишок очищали за допомогою хроматографії на колонці з силікагелем, використовуючи як елюент суміш етилацетат-гексан (3:10, об./об.) з отриманням сполук 13а-h у формі олій, деякі з яких тверднуть при стоянні. Етил 4-дифторометил-2-метилоксазол-5-карбоксилат (13а) Жовтувата олія (6,4 г, 79 %). 8 UA 112885 U Н ЯМР (CDCl3, 400 МГц): =1,35 (т, J=7,0 Гц, 3 Н, СН2СН3), 2,53 (с, 3 Н, Me), 4,37 (к, J=7,0 2 Гц, 2 Н, СH2СН3), 7,04 (т, JH-F=53,5 Гц, 1 Н, CHF2) м.ч. 13 1 С ЯМР (CDCl3, 100 МГц): =14,1 (Me), 14,2 (Me), 62,3 (СН2СН3), 107,6 (т, JC-f=235,5 Гц, 2 3 CHF2), 139,7 (т, JC-f=25,7 Гц, C-CHF2), 140,1 (т, JС-F=8,1 Гц, C-CO2Et), 156,8, 164,5 м.ч. 19 2 F ЯМР (CDCl3, 376 МГц, ): =-118,00 (д, JH-F=53,5 Гц, CHF2) м.ч. + МС: m/z=206 [М + Н] . Елементний аналіз для C8H9F2NO3: С, 46,83; Н, 4,42; N, 6,83. Визначено: С, 46,91; Н, 4,45; N, 6,80. Етил 2-циклопропіл-4-(дифторометил)оксазол-5-карбоксилат (13b) Жовтувата олія (6,3 г, 68 %). 1 Н ЯМР (CDCl3, 400 МГц): =1,13-1,22 (м, 4 Н, 2СН2), 1,37 (т, J=7,3 Гц, 3 Н, СН2СH3), 2,102 2,17 (м, 1 Н, СН), 4,38 (к, J=7,3 Гц, 2 Н, СH2СН3), 7,04 (т, JH-F=53,5 Гц, 1 Н, CHF2) м.ч. ІЗ 1 С ЯМР (CDCl3, 100 МГц): =9,2 (СН), 9,7 (2СН2), 14,1 (СН2СН3), 62,1 (СН2СН3), 107,7 (т, JC3 2 F-236,2 Гц, CHF2), 139,2 (т, JC-F=8,1 Гц, C-CO2Et), 140,0 (т, JC-F=26,4 Гц, C-CHF2), 156,8, 169,5 м.ч. 19 2 F ЯМР (CDCl3, 376 МГц, ): = - 118,06 (д, JH-F=53,0 Гц, CHF2) м.ч. + MC:m/z=232[M+H] . Елементний аналіз для C10H11F2NO3: С, 51,95; Н, 4,80; N, 6,06. Визначено: С, 52,04; Н, 4,85; N, 5,99. Етил 2-(терт-бутил)-4-(дифторометил)оксазол-5-карбоксилат (13с) Жовтувата олія (6,2 г, 63 %). 1 Н ЯМР (CDCl3, 400 МГц): =1,39-1,44 (м, 12 Н, СН2СH3 + С(СН3)3), 4,42 (к, J=7,1 Гц, 2 Н, 2 СH2СН3), 7,10 (т, JH-F=53,5 Гц, 1 Н, CHF2) м.ч. 13 С ЯМР (CDCl3, 100 МГц): =14,2 (CH2CH3), 28,4 (C(CH3)3), 34,4 (С(СН3)3), 62,2 (СН2СН3), 1 2 2 107,9 (т, JC-F-236,2 Гц, CHF2), 139,7 (т, JC-F=25,7 Гц, C-CHF2), 139,2 (т, JC-F=8,1 Гц, C-CO2Et), 157,1, 174,2 м.ч. 19 2 F ЯМР (CDC13, 376 МГц, ): = - 117,67 (д, JH-F=53,5 Гц, CHF2) м.ч. + MC:m/z=248[M+H] . Елементний аналіз для C11H15F2NO3: С, 53,44; Н, 6,12; N, 5,67. Визначено: С, 53,49; Н, 6,07; N, 5,70. Етил 4-дифторометил-2-фенілоксазол-5-карбоксилат (13d) Біла тверда речовина (7,8 г, 73 %) Тпл. 81 °C. 1 Н ЯМР (CDCl3, 400 МГц): =1,47 (т, J=7,0 Гц, 3 Н, СН2СH3), 4,50 (к, J=7,0 Гц. 2 Н, СH2СН3), 2 7,22 (т, JH-F=53,2 Гц, 1 Н, CHF2), 7,50-7,60 (м, 3 Н, 3HPh), 8,20 (д, J=7,0 Гц, 2 Н, 2HPh) м.ч. 13 1 С ЯМР (CDCl3, 100 МГц): =14,2 (СН2СН3), 62,3 (СH2СН3), 107,9 (т, JC-F=236,2 Гц, CHF2), 3 125,6 (CPh), 127,6 (2CHPh), 129,0 (2CHPh), 132,3 (CHPh), 139,8 (т, JC-F=8,1 Гц, C-CO2Et), 144,0 (t, 2 JC-F=25,7 Гц, C-CHF2), 157,0, 163,7 м.ч. 19 2 F ЯМР (CDCl3, 376 МГц, ): = - 118,01 (д, JH-F=53,5 Гц, CHF2) м.ч. + MC: m/z-268 [M+H] . Елементний аналіз для C13H11F2NO3: С, 58,43; Н, 4,15; N, 5,24. Визначено: С, 58,38; Н, 4,11; N, 5,31. Етил 4-дифторометил-2-(4-метоксифеніл)оксазол-5-карбоксилат (13е) Біла тверда речовина (7,9 г, 67 %) Тпл. 85 °C. 1 Н ЯМР (CDCl3, 400 МГц): =1,44 (т, J=7,0 Гц, 3 Н, CH2CH3), 3,87 (с, 3 Н, ОМе), 4,46 (к, J=7,0 2 Гц, 2 Н, СH2СН3), 6,98 (д, J=9,0 Гц, 2 Н, 2НАr), 7,18 (т, JH-F=53,2 Гц, 1 Н, CHF2), 8,10 (д, J=9,0 Гц, 2 Н, 2НAr) м.ч. 13 1 С ЯМР (CDCl3, 100 МГц): =14,2 (СН2СН3), 55,4 (ОМе), 62,2 (СН2СН3), 107,9 (т, JC-F=235,5 3 Гц, CHF2), 114,4 (2CHAr), 118,1 (Сд, ), 129,5 (2CHAr), 139,3 (т, JC-F=8,1 Гц, C-CO2Et), 141,0 (т, 2 JC-F=25,7 Гц, C-CHF2), 157,1 (C-OMe), 162,8, 163,9 м.ч. 19 2 F ЯМР (CDCI3, 376 МГц, ): = - 118,07 (д, JH-F=53,5 Гц, CHF2) м.ч. + MC: т/г = 298 [М + Н] . Елементний аналіз для C14H13F2NO4: С, 56,57; Н, 4,41; N, 4,71. Визначено: С, 56,64; Н, 4,38; N, 4,66. Етил 4-дифторометил-2-(4-нітрофеніл)оксазол-5-карбоксилат (13f) Жовта тверда речовина (7,0 г, 54 %) Тпл. 89 °C. 1 Н ЯМР (CDCl3, 500 МГц): =1,46 (т, J=7,1 Гц, 3 Н, СН2СH5), 4,50 (к, J=7,1 Гц, 2 Н, СH2СН3), 2 7,20 (т, JH-F=53,2 Гц, 1 Н, CHF2), 8,37 (с, 4 Н, 4НАr) м.ч. 1 5 10 15 20 25 30 35 40 45 50 55 9 UA 112885 U С ЯМР (CDCl3, 125 МГц): =14,3 (СН2СН3), 62,9 (СН2СН3), 107,7 (т, JC-F=236,9 Гц, CHF2), 3 2 124,2 (2СНАr), 128,6 (2СНАr), 131,0 (САr), 141,0 (т, JC-F=7,5 Гц, C-CO2Et), 141,3 (т, JC-F=25,9 Гц, C-CHF2), 150,0 (C-NO2), 156,7, 161,4 м.ч. 19 2 F ЯМР (CDCl3, 376 МГц, ): = - 118,04 (д, JH-F=53,5 Гц, CHF2) м.ч. + MC:m/z=3/3 [М + Н] . Елементний аналіз для C13H10F2N2O5: С, 50,01; Н, 3,23; N, 8,97. Визначено: С, 49,91; Н, 3,16; N, 9,02. Етил 2-хлорометил-4-(дифторометил)оксазол-5-карбоксилат (13g) Жовтувата олія (6,6 г, 69 %). 1 Н ЯМР (CDCl3, 400 МГц): =1,34 (т, J=7,3 Гц, 3 Н, CH2CH3), 4,37 (к, J=7,3 Гц, 2 Н, СH2СН3), 2 4,61 (с, 2 Н, СН2Сl), 7,03 (т, JH-F-53,0 Гц, 1 Н, CHF2) м.ч. 13 1 С ЯМР (CDCl3, 100 МГц): =14,0 (СН2СН3), 35,0 (СН2Сl), 62,7 (СН2СН3), 107,4 (т, JC-F=236,2 2 3 Гц, CHF2), 139,7 (т, JC-F=25,7 Гц, C-CHF2), 141,2 (т, JC-F=7,3 Гц, C-CO2Et), 156,3, 161,4 м.ч. 19 2 F ЯМР (CDCl3, 376 МГц, ): = - 118,13 (д, JH-F=53,0 Гц, CHF2) м.ч. + MC: m/z=240 [М + Н] . Елементний аналіз для C8H8ClF2NO3: С, 40,10; Н, 3,37; N, 5,85. Визначено: С, 40,04; Н, 3,41; N, 5,92. Етил 2-(1-хлороетил)-4-(дифторометил)оксазол-5-карбоксилат (13h) Жовтувата олія (7,5 г, 74 %). 1 Н ЯМР (CDCl3, 400 МГц): =1,33 (т, J=7,0 Гц, 3 Н, СН2СH3), 1,88 (д, J=7,0 Гц, 3 Н, 2 СН(СH3)СІ), 4,36 (к, J=7,0 Гц, 2 Н, СH2СН3), 5,08 (к, J=7,0 Гц, 1 Н, СH(СН3)Сl), 7,03 (т, Jh-F=53,0 Гц, 1 Н, CHF2) м.ч. 13 С ЯМР (CDCl3, 100 МГц): -14,0 (СН2СН3), 22,0 (СН(СН3)Сl), 47,4 (СН(СН3)Сl), 62,6 1 2 3 (СН2СН3), 107,5 (т, JC-F=236,2 Гц, CHF2), 139,5 (т, JC-F=25,7 Гц, C-CHF2), 140,7 (т, JC-F=73 Гц, CCO2Et), 156,4, 164,7 м.ч. 19 2 2 F ЯМР (CDCl3, 376 МГц, ): =- 118,14 і - 118,15 (2д, JH-F=53,5 Гц і JH-F=53,0 Гц, CHF2) м.ч. + MC:m/z=254[M+H] . Елементний аналіз для C9H10ClF2NO3: С, 42,62; Н, 3,97; N, 5,52. Визначено: С, 42,69; Н, 4,02; N, 5,55. Етил 4-трифторометилоксазол-5-карбоксилати 17a-c, g,h. Основна методика. PIFA (12,8 г, 56 ммоль) обережно додавали малими порціями до перемішуваного розчину відповідного енаміду 16a-c, g,h (40 ммоль) та Et2O-BF3 комплексу (16,8 мл, 80 ммоль) в 1,2дихлоретані (200 мл). Додавання зайняло ~ 30 хв. Після того, як стадія була завершена, отриману суміш перемішували при температурі кипіння зі зворотним холодильником протягом ночі. Після охолодження розчинник видаляли у вакуумі і залишок розподіляли між водою (300 мл) і етилацетатом (200 мл). Органічний шар відокремлювали і промивали послідовно водою (200 мл), насиченим водним розчином NаНСО3 (200 мл) і сольовим розчином (200 мл) і сушили (MgSO4). Розчинник випарювали у вакуумі, а залишок очищали за допомогою хроматографії на колонці з силікагелем, користуючись як елюентом сумішшю етилацетат-гексан (3:10, об/об) з отриманням сполук 17a-c, g,h у формі олій. Етил 2-метил-4-(трифторометил)оксазол-5-карбоксилат (17а) Жовтувата олія (7,5 г, 84 %). 1 Н ЯМР (DMSO[D6], 500 МГц): =1,30 (т, J=7,1 Гц, 3 Н, СН2СH3), 2,57 (с, 3 Н, Me), 4,35 (к, J=7,1 Гц, 2 Н, СH2СН3) м.ч. 13 1 С ЯМР (DMSO[D6], 125 МГц): =13,6 (Me), 13,7 (Me), 62,1 (СН2СН3), 119,8 (к, JC-F=268,8 Гц, 2 3 CF3), 134,3 (к, JC-F=40,4 Гц, C-CF3), 139,9 (к, JC-F-3,0 Гц, C-CO2Et), 155,3 (С-Ме), 164,2 (CO2Et) м.ч. I9 F ЯМР (DMSO[D6], 376 МГц, ): = - 61,65 (с, CF3) м.ч. + МС: m/z-224 [М + Н] . Елементний аналіз для C8H8F3NO3: С, 43,06; Н, 3,61; N, 6,28. Визначено: С, 43,12; Н, 3,60; N, 6,24. Етил 2-циклопропіл-4-(трифторометил)оксазол-5-карбоксилат (17b) Жовтувата олія (6,6 г, 67 %). 1 Н ЯМР (CDCl3, 400 МГц): =1,15-1,25 (м, 4 Н, 2СН2), 1,37 (т, J=7,0 Гц, 3 Н, СН2СH3), 2,122,19 (м, 1 Н, СН), 4,39 (к, J=7,0 Гц, 2 Н, СH2СН3) м.ч. 13 С ЯМР (CDCl3, 100 МГц): =9,0 (СН), 9,7 (2СН2), 13,9 (СН2СН3), 62,2 (СН2СН3), 119,7 (к, 1 2 3 JH-F=270,0 Гц, CF3), 135,6 (к, JC-F=41,0 Гц, C-CF3), 139,3 (к, JC-F=2,9 Гц, C-CO2Et), 155,9, 168,4 (CO2Et) м.ч. 19 F ЯМР (CDCl3, 376 МГц, ): = - 62,51 (с, CF3) м.ч. 13 5 10 15 20 25 30 35 40 45 50 55 1 10 UA 112885 U + 5 10 15 20 25 30 35 40 45 50 55 MC:m/z=250[M+H] . Елементний аналіз для C10H10F3NO3: С, 48,20; Н, 4,04; N, 5,62. Визначено: С, 48,12; Н, 4,01; N, 5,55. Етил 2-(трет-бутил)-4-(трифторометил)оксазол-5-карбоксилат (17с) Жовтувата олія (5,8 г, 55 %). 1 Н ЯМР (DMSO[D6], 500 МГц): =1,30 (т, J=7,0 Гц, 3 Н, СН2СH3), 1,37 (с, 9 Н, С(СН3)3), 4,37 (к, J=7,0 Гц, 2 Н, СH2СН3) м.ч. 13 С ЯМР (DMSO[D6], 100 МГц): =14,2 (СН2СН3), 28,3 (С(СН3)3), 34,4 (С(СН3)3), 62,6 (СН2СН3), 1 2 3 120,3 (к, JC-f=269,2 Гц, CF3), 133,9 (к, JC-F=38,9 Гц, C-CF3), 140,3 (к, JC-F=3,7 Гц, C-CO2Et), 155,9 (C-tBu), 173,2 (CO2Et) м.ч. 19 F ЯМР (DMSO[D6], 376 МГц, ): = - 61,07 (с, CF3) м.ч. + MC: m/z=266 [М + Н] . Елементний аналіз для C11H14F3NO3: С, 49,81; Н, 5,32; N, 5,28. Визначено: С, 49,90; Н, 5,26; N, 5,26. Етил 2-хлорометил-4-(трифторометил)оксазол-5-карбоксилат (17g) Жовтувата олія (7,6 г, 74 %). 1 Н ЯМР (CDCl3, 400 МГц): =1,35 (т, J=7,0 Гц, 3 Н, СН2CH3), 4,40 (к, J=7,0 Гц, 2 Н, CH2CH3), 4,62 (с, 2 Н, СН2Сl) м.ч. 13 1 С ЯМР (CDCl3, 100 МГц): =13,8 (СН2СН3), 34,8 (СН2Сl), 62,8 (СН2СН3), 119,3 (к, JC-F=270,0 2 3 Гц, CF3), 135,5 (к, JC-F=41,8 Гц, C-CF3), 141,5 (к, JC-F=2,9 Гц, C-CO2Et), 155,4 (С-СН2Сl), 160,5 (CO2Et) м.ч. 19 F ЯМР (CDCI3, 376 МГц, ): = - 62,43 (с, CF3) м.ч. + MC: m/z=258 [М + Н] . Елементний аналіз для C8H7ClF3NO3:С, 37,30; Н, 2,74; N, 5,44. Визначено: С, 37,23; Н, 2,76; N, 5,35. Етил 2-(1-хлороетил)-4-(трифторометил)оксазол-5-карбоксилат (17h) Жовтувата олія (7,4 г, 68 %). 1 Н ЯМР (CDCl3, 400 МГц): =1,36 (т, J=7,0 Гц, 3 Н, CH2CH3), 1,93 (д, J=6,8 Гц, 3 Н, СН(СH5)Сl), 4,40 (к, J=7,0 Гц, 2 Н, СH2СН3), 5,10 (к, J=6,8 Гц, 1 Н, СH(СН3)Сl) м.ч. 13 С ЯМР (CDCl3, 100 МГц): -13,8 (СН2СН3), 22,1 (СН(СН3)Сl), 47,1 (СН(СН3)Сl), 62,8 1 2 3 (СН2СН3), 119,4 (к, JC-F=270,0 Гц, CF3), 135,3 (к, JC-F=41,1 Гц, C-CF3), 140,9 (к, JC-F=2,9 Гц, CCO2Et), 155,5 (С-СН(СН3)Сl), 163,8 (CO2Et) м.ч. 19 F ЯМР (CDCl3, 376 МГц, ): = - 62,35 (с, CF3) м.ч. + MC:m/z=272[M+H] . Елементний аналіз для C9H9ClF3NO3: С, 39,80; Н, 3,34; N, 5,16. Визначено: С, 39,89; Н, 3,24; N, 5,07. Етил 2-Феніл-4-(трифторометил)оксазол-5-карбоксилат (17d) PIDA (10,2 г, 56 моль) обережно додавали невеликими порціями до перемішуваного та прокип'яченого розчину сполуки 16d (11,5 г, 40 ммоль) і Me3SiOSO2CF3 (10,2 мл, 80 ммоль) в 1,2-дихлоретані (200 мл). Додавання займає ~ 30 хв. Після того, як стадія була завершена, отриману суміш перемішували при кип'ятінні протягом ночі. Після охолодження розчинник видаляли у вакуумі і залишок розподіляли між водою (300 мл) і етилацетатом (200 мл). Органічний шар відокремлювали і промивали послідовно водою (200 мл), насиченим водним розчином NaHCO3 (200 мл) і сольовим розчином (200 мл) і сушили (MgSO4). Розчинник випарювали у вакуумі, а залишок очищали за допомогою хроматографії на колонці з силікагелем, використовуючи як елюент суміш етилацетат-гексан (1:5, об/об) з отриманням сполуки 23d у вигляді білої твердої речовини (5,9 г, 52 %) т.пл. 90 °C. 1 Н ЯМР (CDCl3, 400 МГц): =1,46 (т, J=7,0 Гц, 3 Н, СН2СH3), 4,49 (к, J=7,0 Гц, 2 Н, СH2СН3), 7,52-7,61 (м, 3 Н, 3HPh), 8,18 (д, J=7,0 Гц, 2 Н, 2HPh) м.ч. 13 1 С ЯМР (CDCl3, 100 МГц): =14,0 (СН2СН3), 62,5 (СН2СН3), 119,8 (к, JC-F=268,5 Гц, CF3), 2 123,8 (CPh), 127,5 (2CHPh), 129,1 (2CHPh), 132,4 (CHPh), 136,6 (к, JC-F=41,1 Гц, C-CF3), 139,9 (к, 1 JC-F=2,9 Гц, C-CO2Et), 156,1 (C-Ph), 162,7 (CO2Et) м.ч. 19 F ЯМР (CDCl3, 376 МГц, ): = - 62,31 (с, CF3) м.ч. + MC:m/z=286[M+H] . Елементний аналіз для C13H10F3NO3: С, 54,74; Н, 3,53; N, 4,91. Визначено: С, 54,69; Н, 3,49; N, 4,96. Оксазол-5-карбонові кислоти 14a-f, 18a-d. Основна методика. LiOH•H2O (2,0 г, 48 ммоль) додавали однією порцією до розчину відповідного естеру 13a-f, 23a-d (20 ммоль) в THF - вода (100 мл, 10: 1 об/об), і утворену суміш перемішували при 11 UA 112885 U 5 10 15 20 25 30 35 40 45 50 55 кімнатній температурі протягом 2-х днів. Розчинник видаляли у вакуумі, а залишок розчинили у воді (100 мл). Водний розчин промивали етилацетатом (100 мл), потім підкисляли соляною кислотою до рН 4 і екстрагували етилацетатом (2 50 мл). Екстракт сушили (MgSO4) і випарювали у вакуумі, отримуючи чисті кислоти 14a-f, 18a-d у вигляді твердих речовин. Аналітичні зразки додатково перекристалізували з відповідного розчинника. 4-дифторометил-2-метилоксазол-5-карбонова кислота (14а) Білий порошок (3,4 г, 96 %); Тпл. 178 °C. 1 2 Н ЯМР (DMSO[D6], 400 МГц): =2,52 (с, 3 Н, Me), 7,23 (т, JH-F=53,0 Гц, 1 Н, CHF2), 14,37 (ш с, 1 Н, СО2Н) м.ч. 13 1 2 С ЯМР (DMSO[D6], 100 МГц): =14,3 (Me), 108,7 (т, JC-F=234,0 Гц, CHF2), 138,6 (т, JC-F=24,9 3 Гц, C-CHF2), 141,4 (т, JC-F=8,8 Гц, С-СО2Н), 158,2, 164,8 м.ч. 19 2 F ЯМР (DMSO[D6], 376 МГц, ): = - 116,74 (д, JH-F=53,0 Гц, CHF2) м.ч. + MC:m/z=178[M+H] . Елементний аналіз для C6H5F2NO3: С, 40,69; Н, 2,85; N, 7,91. Визначено: С, 40,76; Н, 2,80; N, 7,84. 2-циклопротл-4-(дифторометил)оксазол-5-карбонова кислота (14b) Білий порошок (3,9 г, 97 %); Тпл. 163 °C. 1 2 Н ЯМР (DMSO[D6], 500 МГц): =1,03-1,15 (м, 4 Н, 2СН2), 2,19-2,24 (м, 1 Н, СН), 7,18 (т, JHF=53,2 Гц, 1 Н, CHF2), 13,84 (ш с, 1 Н, СО2Н) м.ч. 13 1 С ЯМР (DMSO[D6], 125 МГц): =8,6 (СН), 9,1 (2СН2), 108,2 (т, JC-F=233,4 Гц, CHF2), 138,3 2 3 (т, JC-F=24.9 Гц, C-CHF2), 140,3 (т, JC-F-8,0 Гц, С-СО2Н), 157,7, 168,5 м.ч. 19 2 F ЯМР (DMSO[D6], 376 МГц, ): = - 117,09 (д, JH-F=53,5 Гц, CHF2) м.ч. + МС: m/z=204 [М + Н] . Елементний аналіз для C8H7F2NO3: С, 47,30; Н, 3,47; N, 6,89. Визначено: С, 47,39; Н, 3,51; N, 6,82. 2-(трет-бутил)-4-(дифторометил)оксазол-5-карбонова кислота (14с) Жовтувата олія (4,1 г, 95 %). 1 2 Н ЯМР (DMSO[D6], 500 МГц): =1,35 (с, 9 Н, С(СН3)3), 7,23 (т, JН-F=53,2 Гц, 1 Н, CHF2) M.4. 13 1 С ЯМР (DMSO[D6], 125 МГц): =27,9 (С(СН3)3), 34,0 (С(СН3)3), 108,3 (т, JC-F=233,4 Гц, 2 3 CHF2), 137,8 (т, JC-F=25,4 Гц, C-CHF2), 140,9 (т, JC-F=7,5 Гц, С-СО2Н), 157,9, 173,0 м.ч. 19 2 F ЯМР (DMSO[D6], 376 МГц, ): = - 116,70 (д, JH-F=53,5 Гц, CHF2) м.ч. + МС: m/z=220 [М + Н] . Елементний аналіз для C9H11F2NO3: С, 49,32; Н, 5,06; N, 6,39. Визначено: С, 49,41; Н, 5,15; N, 6,37. 4-дифторометил-2-фенілоксазол-5-карбонова кислота (14d) Білий порошок (4,7 г, 98 %); Тпл. 175 °C. 1 2 Н ЯМР (DMSO[D6], 500 МГц): =7,35 (т, JH-F=53,0 Гц, 1 Н, CHF2), 7,57-7,65 (м, 3 Н, 3HPh), 8,05 (д, J=7,1 Гц, 2 Н, 2HPh), 14,43 (ш с, 1 Н, СО2Н) м.ч. 13 1 С ЯМР (DMSO[D6], 125 МГц): =108,4 (т, JC-F=233,9 Гц, CHF2), 125,3 (CPh), 127,0 (2CHPh), 2 3 129,5 (2CHPh), 132,4 (CHPh), 139,3 (т, JC-F=24,9 Гц, C-CHF2), 141,2 (т, JC-F=8,0 Гц, С-СО2Н), 157,9, 162,4 м.ч. 19 2 F ЯМР (DMSO[D6], 376 МГц, ): = - 116,98 (д, JH-F=53,0 Гц, CHF2) м.ч. + МС: m/z=240 [М + Н] . Елементний аналіз для С11Н7F2NО3: С, 55,24; Н, 2,95; N, 5,86. Визначено: С, 55,26; Н, 3,01; N, 5,90. 4-дифторометил-2-(4-метоксифеніл)оксазол-5-карбонова кислота (14е) Білий порошок (5,0 г, 94 %); Тпл. 158 °C. 1 2 Н ЯМР (DMSO[D6], 500 МГц): =3,83 (с, 3 Н, ОМе), 7,10 (д, J-8,8 Гц, 2 Н, 2НAr), 7,32 (т, JHF=52,7 Гц, 1 Н, CHF2), 7,97 (д, J=8,8 Гц, 2 Н, 2НАr), 14,16 (ш с, 1 Н, СО2Н) м.ч. 13 1 С ЯМР (DMSO[D6], 125 МГц): =55,6 (ОМе), 108,4 (т, JC-F=233,9 Гц, CHF2), 114,9 (2СНАr), 2 3 П7,7 (СAr), 129,0 (2СНАr), 139,3 (т, JC-F=24,5 Гц, C-CHF2), 140,6 (т, JC-F=9,0 Гц, С-СО2Н), 158,0 (С-ОМе), 162,5, 162,6 м.ч. 19 2 F ЯМР (DMSO[D6], 376 МГц, ): = - 116,99 (д, JH-F=53,5 Гц, CHF2) м.ч. + МС: m/z-270 [М + Н] . Елементний аналіз для C12H9F2NO4: С, 53,54; Н, 3,37; N, 5,20. Визначено: С, 53,49; H, 3,31; N, 5,23. 4-дифторометил-2-(4-нітрофеніл) оксазол-5'-карбонова кислота (14f) Білий порошок (5,3 г, 93 %); Тпл. 165 °C. 12 UA 112885 U Н ЯМР (DMSO[D6], 500 МГц): =7,35 (т, JH-F=53,0 Гц, 1 Н, CHF2), 8,27 (д, J=8,5 Гц, 2 Н, 2НAr), 8,37 (д, J=8,5 Гц, 2 Н, 2НAr) м.ч. 13 1 С ЯМР (DMSO[D6], 125 МГц): =108,2 (т, JC-F=234,4 Гц, CHF2), 124,6 (2СНAr), 128,4 2 3 (2СНАr), 130,7 (САr), 139,4 (т, JC-F-24,9 Гц, C-CHF2), 142,2 (т, JC-F=8,5 Гц, С-СО2Н), 149,3 (CNO2), 157,7, 160,4 м.ч. 19 2 F ЯМР (DMSO[D6], 376 МГц, ): = - 117,05 (д, JH-F=53,0 Гц, CHF2) м.ч. + MC:m/z=285[M+H] . Елементний аналіз для C11H6F2N2O5: С, 46,49; Н, 2,13; N, 9,86. Визначено: С, 46,58; Н, 2,21; N, 9,90. 2-метил-4-(трифторометил)оксазол-5-карбонова кислота (18а) Білий порошок (3,8 г, 97 %); Тпл. 198 °C. 1 Н ЯМР (DMSO[D6], 500 МГц): =2,54 (с, 3 Н, Me) м.ч. 13 1 2 С ЯМР (DMSO[D6], 125 МГц): =13,8 (Me), 120,0 (к, JC-F=268,8 Гц, CF3), 133,3 (к, JC-F=39,4 3 Гц, C-CF3), 141,2 (к, JC-F=3,0 Гц, С-СО2Н), 156,8 (С-Ме), 163,8 (СО2Н) м.ч. 19 F ЯМР (DMSO[D6], 376 МГц, ): = - 60,96 (с, CF3) м.ч. + MC:m/z-196[M+H] . Елементний аналіз для C6H4F3NO3:С, 36,94; Н, 2,07; N, 7,18. Визначено: С, 37,02; Н, 2,11; N, 7,22. 2-Циклопропіл-4-(трифторометил)оксазол-5-карбонова кислота (18b) Білий порошок (4,1 г, 93 %): Тпл. 182 °C. 1 Н ЯМР (DMSO[D6], 400 МГц): =1,04-1,18 (м, 4 Н, 2СН2), 2,21-2,28 (ш м, 1 Н, СН)м.ч. 13 1 С ЯМР (DMSO[D6], 100 МГц): =8,9 (СН), 9,7 (2СН2), 120,3 (к, JC-F=268,5 Гц, CF3), 133,9 (к, 2 3 JC-F=40,3 Гц, C-CF3), 140,8 (к, JC-F=2,9 Гц, С-СО2Н), 157,1, 168,2 (СО2Н) м.ч. 19 F ЯМР (DMSO[D6], 376 МГц, ): = - 61,10 (с, CF3) м.ч. + МС: m/z=222 [М + Н] . Елементний аналіз для C8H6F3NO3: С, 43,45; Н, 2,73; N, 6,33. Визначено: С, 43,40; Н, 2,80; N, 6,28. 2-(трет-бутил)-4-(трифторометил)оксазол-5-карбонова кислота (18с) Білий порошок (4,2 г, 90 %); Тпл. 107 °C. 1 Н ЯМР (DMSO[D6], 400 МГц): =1,35 (с, 9 Н, С(СН3)3) мл. 13 1 С ЯМР (DMSO[D6], 100 МГц): =28,3 (С(СН3)з), 34,3 (С(СН3)3), 120,4 (к, JC-F=267,8 Гц, CF3), 2 3 133,3 (к, JC-F=40,3 Гц, C-CF3), 141,5 (к, JC-F=2,9 Гц, С-СО2Н), 157,3 (С-tВu), 172,7 (СО2Н)м.ч. 19 F ЯМР (DMSO[D6], 376 МГц, ): = - 60,82 (с, CF3) м.ч. + МС: m/z=238 [М + Н] . Елементний аналіз для C9H10F3NO3: С, 45,58; Н, 4,25; N, 5,91. Визначено: С, 45,66; Н, 4,19; N, 5,87. 2-феніл-4-(трифторометил)оксазол-5-карбонова кислота (18d) Білий порошок (4,9 г, 95 %); Тпл. 183 °C. 1 Н ЯМР (DMSO[D6], 500 МГц): =7,56-7,65 (м, 3 Н, 3HPh), 8,02 (д, J=7,8 Гц, 2 Н, 2HPh) м.ч. 13 x С ЯМР (DMSO[D6], 125 МГц): =120,0 (к, JC-f=268,8 Гц, CF3), 124,9 (CPh), 127,0 (2CHPh), 2 3 129,5 (2CHPh), 132,6 (CHPh), 134,5 (к, JC-F=39,9 Гц, C-CF3), 141,3 (к, JC-F=2,9 Гц, С-СО2Н), 156,9 (C-Ph), 161,6 (CO2H) м.ч. I9 F ЯМР (DMSO[D6], 376 МГц, ): = - 61,07 (с, CF3) м.ч. + МС: m/z=258 [М + Н] . Елементний аналіз для C11H6F3NO3: С, 51,37; Н, 2,35; N, 5,45. Визначено: С, 51,29; Н, 2,39; N, 5,48. Посилання [1] М. Inoue, Mini-Rev. Org. Chem. 5 (2008) 77-84; [2] D. С. Palmer, E. С Taylor, Oxazoles: Synthesis, Reactions and Spectroscopy, Parts A & B, Chemistry of Heterocyclic Compounds; John Wiley & Sons: New York, vol. 60 (2004); [3] K. Muller, С Faeh, F. Diederich, Science 317 (2007) 1881-1886; [4] J. Wang, M. Sanchez-Rosello, J. L. Acena, С del Pozo, A. E. Sorochinsky, S. Fustero, V. A. Soloshonok, H. Liu, Chem. Rev. 114 (2014) 2432-2506; [5] W. Yun, M. Ahmad, Y. Chen, P. Gillespie, K. Conde-Knape, S. Kazmer, S. Li, Y. Qian, R. Taub, S. J. Wertheimer, T. Whittard, D. Bolin, Bioorg. Med. Chem. Lett. 21 (2011) 7205-7209; [6] Н. М. Kim, M. D. Smith, J.-H. Kim, M. A. Caplen, Т. Y. Chan, B. A. McKittrick, J. A. Cook, M. van Heek, J. Lachowicz, Bioorg. Med. Chem. Lett. 23 (2013) 6410-6414; [7] Y. Wang, S. Zhu, J. Fluorine Chem. 103 (2000) 139-144; [8] M. A. Honey, R. Pasceri, W. Lewis, С J. Moody, J. Org. Chem. 77 (2012) 1396-1405; 1 5 10 15 20 25 30 35 40 45 50 55 2 13 UA 112885 U [9] P. Ting, R. G. Aslaninan, M. A. Caplen, J. Cao, D. W-S. Kim, H. Kim, R. Kuang, J. F. Lee, J. H. Schwerdt, H. Wu, G. Zhou, N. Zorn, PCT Int. Appl. WO 2010059606 (2010); [10] M. A. Brodney, С R. Butler, E. M. Beck, J. E. Davoren, E. A. LaChapelle, В. Т. O'Neill, US Patent, 228356 (2014). 5 ФОРМУЛА КОРИСНОЇ МОДЕЛІ 1. Спосіб одержання 4-фторалкілоксазол-5-карбонової кислоти формули (І): Rf N R O 10 15 CO2H , де Rf являє собою CF3 або CHF2; R являє собою С1-С6алкіл, С3-С10циклоалкіл, С6-С10арил або С2-С9гетероарил, кожен з яких необов'язково заміщений одним або більшою кількість замісників, незалежно вибраних з С 1С6алкілу, С2-С6алкенілу, С2-С6алкінілу, С1-С6алкокси, С3-С10циклоалкілу, С6-С10арилу, С2С9гетероарилу, галогену, -CN, NO2, -NHC1-С6алкілу, -N(C1-С6алкіл)2, -CONHC1-С6алкілу, -СОС1С6алкілу, -СООС1-С6алкілу, -SC1-C6алкілу, -SOC1-С6алкілу або -SO2C1-C6алкілу, що включає наступні стадії: а) обробку енаміну формули (II): H2 N R f CO2Et 20 хлорангідридом кислоти RCOCl, де R має визначене вище значення, в присутності основи з одержанням N-ацильованого продукту формули (III): H N R O 25 Rf CO2Et , б) обробку одержаного N-ацильованого продукту формули (III) діацетатом фенілйодонію (РhI(СН3СО2)2-PIDA), або бістрифторацетатом фенілйодонію (PhI(CF3CO2)2-PIFA), або дитрифлатом фенілйодонію (PhI(CF3SO2O)2-PIDT) з одержанням естеру оксазолілу формули (IV): N Rf R O 30 CO2Et , в) гідроліз одержаного естеру оксазолілу формули (IV) з використанням основи з одержанням 4фторалкілоксазол-5-карбонової кислоти формули (І). 2. Спосіб за п. 1, який відрізняється тим, що на стадії а) як основа може бути використана органічна основа, така як піридин. 3. Спосіб за п. 1, який відрізняється тим, що на стадії в) як основа може бути використана неорганічна основа, така як гідроксид літію. Комп’ютерна верстка А. Крижанівський Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 14
ДивитисяДодаткова інформація
МПК / Мітки
МПК: C07C 51/00
Мітки: кислоти, 4-фторалкілоксазол-5-карбонової, спосіб, одержання
Код посилання
<a href="https://ua.patents.su/16-112885-sposib-oderzhannya-4-ftoralkiloksazol-5-karbonovo-kisloti.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання 4-фторалкілоксазол-5-карбонової кислоти</a>
Попередній патент: Протикумулятивний екран для бойової і транспортної техніки
Наступний патент: Спосіб одержання cf3cнf-заміщених піразолів
Випадковий патент: Мембранний компенсатор пульсації тиску